Zovirax 200mg, 400mg, 800mg Acyclovir Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Zovirax 800mg on ja miten sitä käytetään?
Zovirax on reseptilääke, jota käytetään huuliherpesen (Herpes Labialis) ja genitaaliherpeksen oireiden hoitoon. Zovirax 800 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Zovirax 400mg kuuluu lääkeryhmään nimeltä Antivirals, Topical.
Ei tiedetä, onko Zovirax 200mg turvallinen ja tehokas alle 12-vuotiaille lapsille.
Mitkä ovat Zovirax 800mg:n mahdolliset sivuvaikutukset?
Zovirax 200mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- helppo mustelma tai verenvuoto,
- violetit tai punaiset pisteet ihon alla,
- vähän tai ei ollenkaan virtsaamista,
- kivulias tai vaikea virtsaaminen,
- turvotus jaloissasi tai nilkoissasi,
- väsynyt olo ja
- hengenahdistus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zoviraxin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ripuli,
- yleinen huono olo,
- päänsärkyä ja
- suukipu, kun käytät asykloviiri-bukkaalista tablettia
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Zoviraxin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
TUOTTEEN YHTEENVETOTIEDOT
Huumausaine
Oikea nimi: asykloviiri
Kemiallinen nimi: 9-[(2-hydroksietoksi)metyyli]guaniini
Muu nimi: asykloguanosiini
Molekyylikaava: C8H11N503
Molekyylimassa: 225.2 Rakennekaava:
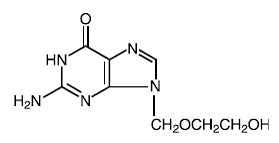
Fysikaalis-kemialliset ominaisuudet: Acyclovir on valkoinen, kiteinen jauhe, jonka suurin liukoisuus veteen on 1,3 mg/ml 25 °C:ssa.
INDIKAATIOT
Käyttöaiheet ja kliininen käyttö
ZOVIRAX® (asikloviiri) on tarkoitettu seuraaviin tiloihin:
- Herpes genitaliksen alkuvaiheiden hoito.
- Epätavallisen toistuvien genitaliksen uusiutumisen estäminen (6 tai enemmän jaksoa vuodessa).
- Herpes zosterin (vyöruusu) ja vesirokon (vesirokon) akuutti hoito.
Kliinisten tutkimusten tulokset viittaavat siihen, että jotkut potilaat, joilla on uusiutuva genitaaliherpes, voivat saada kliinistä hyötyä suun kautta otettavasta ZOVIRAX®-valmisteesta, jos se otetaan uhkaavan episodin ensimmäisten merkkien yhteydessä. Todennäköisimmin hyötyvät potilaat, joilla on vakavia, pitkittyneitä uusiutumista; Tällainen ajoittainen hoito voi olla tarkoituksenmukaisempaa kuin estävä hoito, kun nämä uusiutumiset ovat harvinaisia.
Akuutin herpes zosterin (vyöruusu) varhainen hoito immunokompetenteilla yksilöillä oraalisella ZOVIRAX®-hoidolla johti viruksen leviämisen vähenemiseen; lyhentynyt aika paranemiseen; vähemmän leviämistä; ja akuutin kivun lievitykseen.
Vesirokon (vesirokon) hoito immunokompetenteilla potilailla oraalisella ZOVIRAX®-hoidolla vähensi leesioiden kokonaismäärää, nopeuttai leesioiden etenemistä kuorittuneisiin ja parantuneisiin vaiheisiin ja vähensi jäljellä olevien hypopigmentoituneiden leesioiden määrää. Lisäksi ZOVIRAX® alensi kuumetta ja vesirokkoon liittyviä perustuslaillisia oireita.
Asykloviirin profylaktista käyttöä vesirokon hoidossa ei ole osoitettu.
Geriatria (≥ 65 vuotta): Käyttö iäkkäässä väestössä saattaa liittyä turvallisuuseroihin, jotka johtuvat ikään liittyvistä munuaisten toiminnan muutoksista, ja lyhyt keskustelu löytyy asianmukaisista osioista (ks. VAROITUKSET JA VAROTOIMET ).
Pediatria ( Tietoja ei ole saatavilla.
ANNOSTELU JA HALLINNOINTI
Annostelua koskevia huomioita
- ZOVIRAX®-annosta (asikloviiri) tulee pienentää potilailla, joilla on munuaisten vajaatoiminta.
- Hoito tulee aloittaa mahdollisimman pian vesirokon tai herpes zoster -diagnoosin jälkeen tai ensimmäisten sukuelinten herpes-epidemian oireiden ilmetessä.
- Suositeltu annos ja käytön kesto riippuvat käyttöaiheesta.
Suositeltu annos ja annoksen säätö
Herpes Genitalis -infektion hoito: 200 mg (yksi 200 mg:n tabletti tai yksi teelusikallinen suspensiota [5 ml]) 4 tunnin välein, 5 kertaa päivässä, yhteensä 1 g päivässä 10 päivän ajan. Hoito tulee aloittaa mahdollisimman aikaisin oireiden ilmaantumisen jälkeen.
Toistuvan genitaliksen estävä hoito
Suositeltu aloitusannos on 200 mg (yksi 200 mg:n tabletti tai yksi teelusikallinen suspensiota [5 ml]) kolme kertaa päivässä. Tätä voidaan lisätä, jos läpimurto tapahtuu, ja se on enintään yksi 200 mg:n tabletti tai yksi teelusikallinen [5 ml] suspensiota viisi kertaa päivässä. Tarvittaessa voidaan harkita 400 mg:n annosta (kaksi 200 mg:n tablettia tai kaksi teelusikallista suspensiota [10 ml]) kahdesti vuorokaudessa. Hoidon tarpeen säännöllistä uudelleenarviointia suositellaan.
ZOVIRAX®-injektio jaksoittaiseen hoitoon on 200 mg (yksi 200 mg:n tabletti tai yksi teelusikallinen [5 ml] suspensiota) 4 tunnin välein 5 kertaa päivässä 5 päivän ajan. Hoito tulee aloittaa, kun uusiutumisen aikaisin merkki tai oire (prodromi) ilmenee.
Herpes zosterin hoito
800 mg suun kautta otettavaa ZOVIRAX®:ia 4 tunnin välein, 5 kertaa päivässä 7-10 päivän ajan. Hoito tulee aloittaa 72 tunnin kuluessa leesioiden alkamisesta. Kliinisissä tutkimuksissa suurin hyöty saavutettiin, kun hoito aloitettiin 48 tunnin sisällä leesioiden alkamisesta.
Vesirokon hoito
20 mg/kg (ei yli 800 mg) suun kautta, 4 kertaa päivässä 5 päivän ajan. Hoito tulee aloittaa 24 tunnin kuluessa ihottuman ilmaantumisesta.
Potilaat, joilla on akuutti tai krooninen munuaisten vajaatoiminta
Varovaisuutta tulee noudattaa annettaessa asykloviiria potilaille, joilla on munuaisten vajaatoiminta. Riittävä nesteytys on säilytettävä.
Kattavat farmakokineettiset tutkimukset on saatu päätökseen suonensisäisten asykloviiri-infuusioiden jälkeen potilailla, joilla on munuaisten vajaatoiminta.
Näiden tutkimusten perusteella taulukossa 5 suositellaan annoksen muuttamista sukupuolielinten herpes- ja herpes zoster -indikaatioiden osalta.
Hemodialyysi
Hemodialyysiä tarvitsevien potilaiden asikloviirin keskimääräinen puoliintumisaika plasmassa on hemodialyysin aikana noin 5 tuntia. Tämä johtaa 60 %:n laskuun plasman pitoisuuksissa kuuden tunnin dialyysijakson jälkeen. Siksi potilaan annostusaikataulua tulee muuttaa siten, että lisäannos annetaan jokaisen dialyysin jälkeen.
Peritoneaalidialyysi
Lisäannosta ei näytä tarvittavan annosvälin säätämisen jälkeen.
Unohtunut annos
Jos ZOVIRAX®-annos unohtuu, potilasta tulee neuvoa ottamaan se heti kun hän muistaa ja jatkamaan seuraavalla annoksella oikeaan aikaväliin.
MITEN TOIMITETAAN
Varastointi ja vakaus
ZOVIRAX®-tabletit tulee säilyttää valvotussa huoneenlämmössä (15-25°C) kuivassa paikassa valolta suojattuna.
ZOVIRAX®-suspensio tulee säilyttää valvotussa huoneenlämpötilassa (15-25 °C).
Annostusmuodot, koostumus ja pakkaus
Jousitus: Jokainen teelusikallinen (5 ml) ZOVIRAX®-suspensiota sisältää 200 mg asykloviiria ja ei-lääkeaineita, banaaniaromia, selluloosaa, glyseriiniä, metyyliparabeenia, propyyliparabeenia, sorbitolia, vanilliinia ja vettä.
Jokainen ZOVIRAX® 200 -tabletti sisältää 200 mg asykloviiria ja ei-lääkeaineita, selluloosaa, indigotiinia, laktoosia, magnesiumstearaattia, povidonia ja natriumtärkkelysglykolaattia.
ZOVIRAX® Suspensio on saatavana 125 ml* ja 475 ml pulloissa. Jokainen teelusikallinen (5 ml) luonnonvalkoista, banaaninmakuista suspensiota sisältää 200 mg asykloviiria.
*125 ml:n pullo ei ole saatavilla Kanadassa
ZOVIRAX® 200 tabletteja on saatavana 100 tabletin pulloissa. Jokainen sininen, kilven muotoinen, viistoreunainen, puristettu tabletti sisältää 200 mg asykloviiria, ja sen toiselle puolelle on painettu ”ZOVIRAX” ja toiselle puolelle kolmio.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Tarkistettu: 10. marraskuuta 2014
SIVUVAIKUTUKSET
Yleiskatsaus lääkkeiden haittavaikutuksiin
Yleisimmät ZOVIRAX® (asikloviiri) käyttöön liittyvät haittavaikutukset ovat päänsärky ja pahoinvointi.
Myös neurologisia sivuvaikutuksia on raportoitu harvoissa tapauksissa. Iäkkäillä potilailla ja potilailla, joilla on aiemmin ollut munuaisten vajaatoimintaa, on lisääntynyt näiden vaikutusten riski. Raportoiduissa tapauksissa nämä reaktiot korjautuivat yleensä hoidon lopettamisen jälkeen (ks VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET , Markkinoiden jälkeiset huumeiden haittavaikutukset ).
Kliinisen tutkimuksen haittavaikutukset
Koska kliiniset tutkimukset suoritetaan hyvin erityisissä olosuhteissa, kliinisissä tutkimuksissa havaitut haittavaikutukset eivät välttämättä heijasta käytännössä havaittuja nopeuksia, eikä niitä tule verrata muiden lääkkeiden kliinisissä tutkimuksissa havaittuihin nopeuksiin. Kliinisistä tutkimuksista saadut tiedot haittavaikutuksista ovat hyödyllisiä lääkkeisiin liittyvien haittatapahtumien tunnistamisessa ja niiden esiintymistiheyden arvioinnissa.
Herpes simplexin hoito
Lyhytaikainen anto (5-10 päivää): Taulukossa 1 on lueteltu yleisimmät haittavaikutukset, jotka on raportoitu kliinisissä tutkimuksissa genitaaliherpeksen hoidosta suun kautta otettavalla ZOVIRAX®-valmisteella 298 potilaalla.
Herpes simplexin tukahduttaminen
Pitkäaikainen anto: Taulukossa 2 on lueteltu yleisimmät haittatapahtumat, jotka on raportoitu kliinisessä tutkimuksessa uusiutumisen ehkäisemiseksi jatkuvalla 400 mg:n (kaksi 200 mg:n kapselia) 2 kertaa päivässä antamisella.
Kliinisistä tutkimuksista tähän mennessä saadut todisteet viittaavat siihen, että haittatapahtumien vakavuus ja esiintymistiheys eivät todennäköisesti edellytä hoidon lopettamista.
Herpes zoster
Taulukossa 3 on lueteltu yleisimmät haittavaikutukset, jotka on raportoitu kolmessa kliinisessä tutkimuksessa herpes zosterin (vyöruusu) hoidosta 800 mg:lla suun kautta otettavaa ZOVIRAX®ia 5 kertaa päivässä 7 tai 10 päivän ajan tai lumelääkettä.
Vesirokko
Yleisimmät haittatapahtumat, jotka on raportoitu kolmessa kliinisessä tutkimuksessa vesirokon hoidosta suun kautta otettavalla ZOVIRAX®-valmisteella tai lumelääkkeellä, on lueteltu taulukossa 4.
Harvemmat kliinisissä tutkimuksissa havaitut haittavaikutukset (
Muita haittavaikutuksia, joita raportoitiin alle 1 %:lla ZOVIRAX®ia saaneista potilaista missä tahansa kliinisessä tutkimuksessa, olivat: vatsakipu, ruokahaluttomuus, ummetus, huimaus, turvotus, väsymys, ilmavaivat, nivusen adenopatia, unettomuus, jalkakipu, lääkkeen maku, ihottuma, arkuus kurkku, puuskittaiset käden liikkeet ja urtikaria.
Epänormaalit hematologiset ja kliinisen kemian löydökset
Kliinisissä tutkimuksissa vesirokon ja zosterin hoidossa sekä genitaaliherpeksen hoidossa ja estämisessä ZOVIRAX®:lla ei ole havaittu kliinisesti merkittäviä muutoksia laboratorioarvoissa.
Markkinoiden jälkeiset huumeiden haittavaikutukset
Seuraavia tapahtumia on raportoitu vapaaehtoisesti ZOVIRAX®-valmisteen markkinoille saattamisen jälkeisen käytön aikana kliinisessä käytännössä. Nämä tapahtumat on valittu sisällytettäviksi joko niiden vakavuuden, ilmoitustiheyden, mahdollisen syy-yhteyden ZOVIRAX®iin tai näiden tekijöiden yhdistelmän vuoksi. Markkinoille saattamisen jälkeiset haittatapahtumat ilmoitetaan spontaanisti tuntemattoman kokoiselta populaatiolta, joten niiden esiintymistiheyttä ei voida arvioida.
Yleistä: Kuume, päänsärky, kipu ja perifeerinen turvotus.
Hermostunut: Huimausta, parestesiaa, kiihtyneisyyttä, sekavuutta, vapinaa, ataksiaa, dysartriaa, hallusinaatioita, psykoottisia oireita, kouristuksia, uneliaisuutta, enkefalopatiaa ja koomaa on raportoitu. Nämä tapahtumat ovat yleensä palautuvia, ja niitä on yleensä raportoitu potilailla, joilla on munuaisten vajaatoiminta tai muita altistavia tekijöitä (ks. VAROITUKSET JA VAROTOIMET ). Nämä oireet voivat olla merkittäviä erityisesti vanhemmilla aikuisilla.
Ruoansulatus: Ripuli, maha-suolikanavan vaiva ja pahoinvointi.
Hematologiset ja lymfaattiset: Anemia, leukopenia, lymfadenopatia ja trombosytopenia.
Yliherkkyys ja iho: Hiustenlähtö, erythema multiforme, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, ihottumat mukaan lukien valoherkkyys, kutina, nokkosihottuma, hengenahdistus, angioödeema ja anafylaksia.
Maksa ja sappitie ja haima: Raportit palautuvasta hyperbilirubinemiasta ja kohonneista maksaan liittyvistä entsyymeistä. Hepatiitti ja keltaisuus.
Tuki- ja liikuntaelimistö: Myalgia.
Erityiset aistit: Näköhäiriöt.
Urogenitaaliset: Kohonnut veren kreatiniini- ja veren ureatyppipitoisuus (BUN). Akuuttia munuaisten vajaatoimintaa, munuaiskipua ja hematuriaa on raportoitu. Munuaiskipu voi liittyä munuaisten vajaatoimintaan (ks VAROITUKSET JA VAROTOIMET ).
HUUMEIDEN VUOROVAIKUTUKSET
Huumeiden väliset vuorovaikutukset
Kliinisesti merkittäviä yhteisvaikutuksia ei ole tunnistettu.
Asikloviiri eliminoituu pääasiassa muuttumattomana virtsaan aktiivisen munuaistiehyeterityksen kautta. Kaikki samanaikaisesti annetut lääkkeet, jotka kilpailevat tämän mekanismin kanssa, voivat lisätä asykloviiripitoisuutta plasmassa. Probenesidi ja simetidiini lisäävät asykloviirin käyrän alla olevaa pinta-alaa (AUC) tällä mekanismilla ja vähentävät asyklovirin munuaispuhdistumaa. Samoin asykloviirin ja mykofenolaattimofetiilin inaktiivisen metaboliitin, elinsiirtopotilailla käytettävän immunosuppressiivisen aineen, AUC-arvon nousu plasmassa on osoitettu, kun lääkkeitä annetaan samanaikaisesti. Annostusta ei kuitenkaan tarvitse muuttaa asykloviirin laajan terapeuttisen indeksin vuoksi.
Lääkkeiden ja ruoan vuorovaikutukset
Yhteisvaikutuksia ruoan kanssa ei tiedetä (ks Toiminta ja kliininen farmakologia , Farmakokinetiikka ).
Huumeiden ja yrttien vuorovaikutukset
Vuorovaikutuksia kasviperäisten tuotteiden kanssa ei ole osoitettu.
Lääkkeiden ja laboratoriotestien vuorovaikutukset
Yhteisvaikutuksia laboratoriokokeiden kanssa ei ole osoitettu.
VAROITUKSET
ZOVIRAX (asykloviiri) kapselit, tabletit ja suspensio on tarkoitettu vain suun kautta nautittavaksi. Munuaisten vajaatoimintaa, joka joissakin tapauksissa on johtanut kuolemaan, on havaittu asikloviirihoidon yhteydessä (ks HAITTAVAIKUTUKSET: Havaittu kliinisen käytännön ja yliannostuksen aikana ). Tromboottinen trombosytopeeninen purppura/hemolyyttinen ureeminen oireyhtymä (TTP/HUS), joka on johtanut kuolemaan, on esiintynyt asykloviirihoitoa saavilla immuunipuutteellisilla potilailla.
VAROTOIMENPITEET
Annoksen muuttamista suositellaan, kun ZOVIRAXia (asikloviiria) annetaan potilaille, joilla on munuaisten vajaatoiminta (ks. ANNOSTELU JA HALLINNOINTI ). Varovaisuutta tulee noudattaa myös annettaessa ZOVIRAXia (asikloviiria) potilaille, jotka saavat mahdollisesti nefrotoksisia aineita, koska tämä voi lisätä munuaisten vajaatoiminnan riskiä ja/tai palautuvien keskushermosto-oireiden riskiä, kuten sellaisia, joita on raportoitu laskimonsisäisellä asykloviirilla hoidetuilla potilailla. . Riittävä nesteytys on säilytettävä.
Herpes zoster: Ei ole tietoja hoidosta, joka on aloitettu yli 72 tuntia vyöruusuttuman alkamisen jälkeen. Potilaita tulee neuvoa aloittamaan hoito mahdollisimman pian herpes zoster -diagnoosin jälkeen.
Sukuelinten herpes-infektiot: Potilaille tulee kertoa, että ZOVIRAX (asikloviiri) ei paranna sukupuolielinten herpestä. Ei ole tietoja sen arvioimiseksi, estääkö ZOVIRAX (asikloviiri) infektion siirtymisen muille. Koska genitaaliherpes on sukupuoliteitse tarttuva tauti, potilaiden tulee välttää kosketusta leesioihin tai yhdyntää leesioiden ja/tai oireiden esiintyessä välttääkseen kumppanien tartunnan. Genitaaliherpes voi tarttua myös ilman oireita oireettoman viruksen leviämisen kautta. Jos genitaaliherpesen uusiutumisen lääketieteellinen hoito on aiheellista, potilaita tulee neuvoa aloittamaan hoito episodin ensimmäisten merkkien tai oireiden ilmetessä.
Vesirokko: Muutoin terveiden lasten vesirokko on yleensä itsestään rajoittuva sairaus, jonka vaikeusaste on lievä tai kohtalainen. Nuorilla ja aikuisilla on yleensä vakavampi sairaus. Kontrolloiduissa tutkimuksissa hoito aloitettiin 24 tunnin sisällä tyypillisestä vesirokkoihottumasta, eikä myöhemmin sairauden aikana aloitetun hoidon vaikutuksista ole tietoa.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Alla esitetyt tiedot sisältävät viittauksia plasman asykloviirin vakaan tilan huippupitoisuuksiin, joita havaittiin ihmisillä, joita hoidettiin 800 mg:lla suun kautta 5 kertaa päivässä (herpes zosterin hoitoon sopiva annos) tai 200 mg:lla suun kautta 5 kertaa päivässä (hoitoon sopiva annostus). sukupuolielinten herpes). Plasman lääkepitoisuudet eläinkokeissa ilmaistaan moninkertaisina ihmisen altistuksen asikloviirille korkeammalla ja pienemmällä annosteluohjelmalla (ks. KLIININEN FARMAKOLOGIA: Farmakokinetiikka ).
Asikloviiria testattiin elinikäisissä biomäärityksissä rotilla ja hiirillä kerta-annoksilla 450 mg/kg asti annettaessa letkuletkulla. Käsiteltyjen ja kontrollieläinten välillä ei ollut tilastollisesti merkitsevää eroa kasvainten ilmaantuvuudessa, eikä asykloviiri lyhentänyt kasvainten latenssia. Plasman huippupitoisuudet olivat 3–6 kertaa ihmisen tasot hiiren biotestissä ja 1–2 kertaa ihmisen pitoisuudet rotan biomäärityksessä.
Asykloviiri testattiin 16:ssa in vitro ja in vivo geneettisessä toksisuusmäärityksessä. Asykloviiri oli positiivinen viidessä kokeessa.
Asykloviiri ei heikentänyt hedelmällisyyttä tai lisääntymistä hiirillä (450 mg/kg/vrk, po) tai rotilla (25 mg/kg/vrk, sc). Hiiritutkimuksessa plasman pitoisuudet olivat 9-18 kertaa ihmisen tasot, kun taas rottatutkimuksessa ne olivat 8-15 kertaa ihmisen tasot. Suuremmilla annoksilla (50 mg/kg/vrk, sc) rotilla ja kaniineilla (11-22 ja 16-31 kertaa ihmisen tasot vastaavasti) implantaation tehokkuus, mutta ei pentueen koko, heikkeni. Rotilla tehdyssä peri- ja postnataalisessa tutkimuksessa annoksella 50 mg/kg/vrk, ihonalaisesti, havaittiin tilastollisesti merkitsevä lasku keltarauhasten, implantaatiokohtien ja elävien sikiöiden lukumäärässä ryhmässä.
Kivesten poikkeavuuksia ei havaittu koirilla, joille annettiin 50 mg/kg/vrk, laskimonsisäisesti 1 kuukauden ajan (21-41 kertaa ihmisen tasot) tai koirilla, joille annettiin 60 mg/kg/vrk suun kautta 1 vuoden ajan (6-12 kertaa ihmisen tasot). Kivesatrofiaa ja aspermatogeneesiä havaittiin rotilla ja koirilla suuremmilla annoksilla.
Raskaus
Teratogeeniset vaikutukset: Raskausluokka B. Organogeneesin aikana annettu asykloviiri ei ollut teratogeeninen hiirellä (450 mg/kg/vrk, po), kaniinilla (50 mg/kg/vrk, sc ja IV) eikä rotalla (50 mg/kg/vrk, sc). Nämä altistukset johtivat 9- ja 18-, 16- ja 106- ja 11- ja 22-kertaisiin plasmapitoisuuksiin verrattuna ihmisellä.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Prospektiivinen epidemiologinen rekisteri asykloviirin käytöstä raskauden aikana perustettiin vuonna 1984 ja valmistui huhtikuussa 1999. Naisilla, jotka olivat altistuneet systeemiselle asykloviirille ensimmäisen raskauskolmanneksen aikana, seurattiin 749 raskautta, mikä johti 756 tulokseen. Synnynnäisten epämuodostumien esiintymistiheys on suunnilleen sama kuin yleisessä väestössä. Rekisterin pieni koko ei kuitenkaan riitä arvioimaan vähemmän yleisten vikojen riskiä tai mahdollistamaan luotettavien tai lopullisten johtopäätösten tekeminen asykloviirin turvallisuudesta raskaana oleville naisille ja heidän kehittyville sikiöilleen. Acyclovir-valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle.
Imettävät äidit
Asikloviiripitoisuudet on dokumentoitu rintamaidossa kahdella naisella ZOVIRAXin (asikloviiri) suun kautta antamisen jälkeen, ja ne vaihtelivat 0,6-4,1 kertaa vastaavat plasmapitoisuudet. Nämä pitoisuudet saattavat altistaa imetettävän lapsen asykloviiriannokselle, joka on enintään 0,3 mg/kg/vrk. ZOVIRAX (asikloviiri) tulee antaa imettävälle äidille varoen ja vain tarvittaessa.
Käyttö lapsille
Asykloviirin oraalisten formulaatioiden turvallisuutta ja tehokkuutta alle 2-vuotiailla lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Niistä 376 potilaasta, jotka saivat ZOVIRAXia (asikloviiria) kliinisessä tutkimuksessa herpes zoster -hoidosta ¡Ý50-vuotiailla immuunikyvyttömällä henkilöllä, 244 oli 65-vuotiaita ja sitä vanhempia ja 111 oli 75-vuotiaita tai vanhempia. Vanhojen ja nuorempien aikuisten välillä ei raportoitu yleisiä eroja tehokkuudessa uuden leesion muodostumisen lakkaamiseen tai paranemiseen kuluvaan aikaan. Kivun kesto paranemisen jälkeen oli pidempi 65-vuotiailla ja sitä vanhemmilla potilailla. Pahoinvointia, oksentelua ja huimausta raportoitiin useammin iäkkäillä henkilöillä. Iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta ja he tarvitsevat annoksen pienentämistä. Iäkkäillä potilailla on myös todennäköisemmin munuaisten tai keskushermoston haittavaikutuksia. Kliinisen käytännön aikana havaittujen keskushermoston haittavaikutusten osalta uneliaisuutta, hallusinaatioita, sekavuutta ja koomaa raportoitiin useammin iäkkäillä potilailla (ks. KLIININEN FARMAKOLOGIA, HAITTAVAIKUTUKSET: Havaittu kliinisen käytännön aikana, ja ANNOSTELU JA HALLINNOINTI ).
YLIANNOSTUS
Ota yhteyttä alueelliseen myrkytystietokeskukseen epäillyn huumeyliannostuksen hoitamiseksi.
Aktiivihiiltä voidaan antaa auttamaan imeytymättömän lääkkeen poistamisessa. Yleisiä tukitoimenpiteitä suositellaan.
Asykloviiri imeytyy vain osittain maha-suolikanavassa. Potilaat ovat nauttineet jopa 20 g asykloviiria yhdellä kertaa ilman odottamattomia haittavaikutuksia. Kliinisissä tutkimuksissa korkein yhdellä potilaalla havaittu plasmapitoisuus näillä annoksilla oli 10,0 μg/ml. Useiden päivien ajan tapahtuneet vahingossa tapahtuneet toistuvat oraalisen asykloviirin yliannostukset on yhdistetty ruoansulatuskanavaan (kuten pahoinvointiin ja oksenteluun) ja neurologisiin vaikutuksiin (päänsärky ja sekavuus).
Ihmisille suonensisäisesti annetut annokset ovat olleet jopa 1 200 mg/m² (28 mg/kg) 3 kertaa päivässä 2 viikon ajan. Plasman huippupitoisuudet ovat saavuttaneet 80 μg/ml. Suonensisäisen asykloviirin yliannostus on johtanut seerumin kreatiniini- ja veren ureatypen nousuun ja sitä seuraavaan munuaisten vajaatoimintaan. Suonensisäisen yliannostuksen yhteydessä on kuvattu neurologisia vaikutuksia, kuten sekavuutta, hallusinaatioita, kiihtyneisyyttä, kouristuksia ja koomaa.
Potilaita tulee tarkkailla tarkasti toksisuuden merkkien varalta. Hemodialyysi tehostaa merkittävästi asykloviirin poistumista verestä, ja siksi sitä voidaan pitää hoitovaihtoehtona oireisen yliannostuksen yhteydessä. Asykloviirin saostumista munuaistiehyissä voi tapahtua, jos liukoisuus (2,5 mg/ml) intratubulaariseen nesteeseen ylittyy. Munuaisten vajaatoiminnan ja anurian sattuessa potilas voi hyötyä hemodialyysistä, kunnes munuaisten toiminta palautuu (ks. ANNOSTELU JA HALLINNOINTI ).
VASTA-AIHEET
ZOVIRAX® (asikloviiri) on vasta-aiheinen potilaille, joille kehittyy yliherkkyys tai jotka ovat yliherkkiä asykloviirille, valasykloviirille tai muille ZOVIRAX®-valmisteiden komponenteille. Katso täydellinen luettelo Annostusmuodot , Koostumus ja pakkaus tuotemonografian osio .
KLIININEN FARMAKOLOGIA
Toiminta ja kliininen farmakologia
Toimintamekanismi
ZOVIRAX® (asykloviiri), synteettinen asyklinen puriininukleosidianalogi, on substraatti, jolla on korkea spesifisyys herpes simplexille ja varicella zoster -spesifiselle tymidiinikinaasille. Asykloviiri on huono substraatti isäntäsoluspesifiselle tymidiinikinaasille. Herpes simplexin ja varicella zosterin spesifioima tymidiinikinaasi muuttaa asykloviirin monofosfaatiksi, joka sitten muuttuu useiden soluentsyymien toimesta asykloviiridifosfaatiksi ja asykloviiritrifosfaatiksi. Asikloviiritrifosfaatti on sekä herpesvirukselle määritellyn DNA-polymeraasin estäjä että substraatti. Vaikka asykloviiritrifosfaatti voi myös estää solun a-DNA-polymeraasia infektoituneissa soluissa, tämä tapahtuu vain asikloviiritrifosfaatin pitoisuuksilla, jotka ovat korkeampia kuin ne, jotka estävät herpesviruksen spesifismää DNA-polymeraasia. Asikloviiri muuttuu selektiivisesti aktiiviseksi muotoonsa herpesviruksen infektoimissa soluissa ja siten ensisijaisesti nämä solut ottavat sen vastaan. Asykloviiri on osoittanut hyvin paljon pienemmän toksisen potentiaalin in vitro normaaleille infektoimattomille soluille, koska: 1) vähemmän imeytyy; 2) vähemmän muunnetaan aktiiviseen muotoon; ja 3) sellulaarisella a-DNA-polymeraasilla on pienempi herkkyys lääkkeen aktiivisen muodon vaikutukselle. Tymidiinikinaasispesifisyyden, DNA-polymeraasin eston ja DNA-synteesin ennenaikaisen lopettamisen yhdistelmä johtaa herpesviruksen replikaation estämiseen. Vaikutusta piilevään ei-replikoituvaan virukseen ei ole osoitettu. Viruksen esto lyhentää viruksen leviämisaikaa, rajoittaa leviämisastetta ja patologian tasoa ja siten helpottaa paranemista. Suppression aikana ei ole näyttöä siitä, että asykloviiri estäisi viruksen hermoston kulkeutumista. Se keskeyttää toistuvan herpesjakson, koska se estää viruksen replikaation uudelleenaktivoitumisen jälkeen.
Farmakokinetiikka
Asykloviirin farmakokinetiikkaa suun kautta annetun annon jälkeen on arvioitu kuudessa kliinisessä tutkimuksessa, joihin osallistui 110 aikuista potilasta.
Imeytyminen
Yhdessä tutkimuksessa, johon osallistui 35 immuunipuutteista potilasta, joilla oli herpes simplex- tai varicella-zoster-infektio, joille annettiin ZOVIRAX®-kapseleita 200-1000 mg:n annoksina 4 tunnin välein 6 kertaa päivässä 5 päivän ajan, biologisen hyötyosuuden arvioitiin olevan 15-20 %. Tässä tutkimuksessa vakaan tilan plasmapitoisuudet saavutettiin toisena annostuspäivänä. Keskimääräiset vakaan tilan huippupitoisuudet viimeisen 200 mg:n annoksen jälkeen olivat 0,49 μg/ml (0,47 - 0,54 μg/ml) ja 0,31 μg/ml (0,18 - 0,41 μg/ml) ja viimeisen annoksen jälkeen 800 mg. 2,8 μg/ml (2,3 - 3,1 μg/ml) ja 1,8 μg/ml (1,3 - 2,5 μg/ml). Toisessa tutkimuksessa 20 immunokompetensille potilaalle, joilla oli uusiutuvia genitaaliherpes simplex -infektioita, annettiin ZOVIRAX®-kapseleita 800 mg:n annoksena 6 tunnin välein 4 kertaa päivässä 5 päivän ajan. Keskimääräiset vakaan tilan huippu- ja alin pitoisuudet olivat 1,4 μg/ml (0,66 - 1,8 μg/ml) ja 0,55 μg/ml (0,14 - 1,1 μg/ml).
Moniannostutkimuksessa, jossa 23 vapaaehtoista sai ZOVIRAX®-valmistetta yhtenä 200 mg:n kapselina, yhtenä 400 mg:n tablettina ja yhtenä 800 mg:n tablettina 6 kertaa päivässä, imeytyminen väheni annoksen kasvaessa ja asykloviirin arvioitu biologinen hyötyosuus oli 20, 15 ja 10 %. , vastaavasti. Biologisen hyötyosuuden vähenemisen uskotaan olevan annoksen eikä annosmuodon funktio. Osoitettiin, että asykloviiri ei ole suhteessa annokseen annosalueella 200-800 mg. Tässä tutkimuksessa asykloviirin vakaan tilan huippu- ja alin pitoisuudet olivat 0,83 ja 0,46 μg/ml, 1,21 ja 0,63 μg/ml ja 1,61 ja 0,83 μg/ml 200, 400 ja 800 mg:n annostusohjelmilla.
Toisessa tutkimuksessa, johon osallistui 6 vapaaehtoista, ruoan vaikutus asykloviirin imeytymiseen ei ollut ilmeinen.
Oraalisen kerta-annoksen biologista hyötyosuutta koskeva tutkimus 23 normaalilla vapaaehtoisella osoitti, että ZOVIRAX® 200 mg kapselit ovat bioekvivalentteja 200 mg:n asykloviirin kanssa vesiliuoksessa. Erillisessä tutkimuksessa 20 vapaaehtoisella osoitettiin, että ZOVIRAX®-suspensio on biologisesti samanarvoinen ZOVIRAX®-kapseleiden kanssa. Toisessa kerta-annoksen biologista hyötyosuutta/bioekvivalenssia koskevassa tutkimuksessa, johon osallistui 24 vapaaehtoista, yksi ZOVIRAX® 800 mg tabletti osoitettiin biologisesti samanarvoiseksi neljän ZOVIRAX® 200 mg kapselin kanssa.
Jakelu
Sitoutuminen plasman proteiineihin on suhteellisen vähäistä (9-33 %), eikä lääkeinteraktioita, joihin liittyy sitoutumiskohdan siirtymistä, ole odotettavissa.
Eliminointi
Oraalisen annon jälkeen asykloviirin keskimääräinen puoliintumisaika plasmassa vaihteli vapaaehtoisilla ja potilailla, joiden munuaistoiminta oli normaali, 2,5–3,3 tuntia. Keskimääräinen munuaisten kautta erittynyt lääkeaine on 14,4 % (8,6-19,8 %) suun kautta annetusta annoksesta. Ainoa virtsan metaboliitti (tunnistettu korkean erotuskyvyn nestekromatografialla) on 9-[(karboksimetoksi)metyyli]guaniini.
Erityiset väestöt ja olosuhteet
Pediatria
Yleensä asikloviirin farmakokinetiikka lapsilla on samanlainen kuin aikuisilla. Keskimääräinen puoliintumisaika oraalisten annosten 300 ja 600 mg/m2 jälkeen oli 7 kuukauden - 7 vuoden ikäisillä lapsilla 2,6 tuntia (vaihteluväli 1,59 - 3,74 tuntia).
Suun kautta annettua asykloviiriä alle 2-vuotiaille lapsille ei ole vielä täysin tutkittu.
Geriatria
Vanhuksilla kokonaispuhdistuma laskee iän myötä, mikä liittyy kreatiniinipuhdistuman laskuun, vaikka terminaalinen puoliintumisaika plasmassa ei muutu juurikaan. Annoksen pienentäminen saattaa olla tarpeen iäkkäillä potilailla, joiden munuaisten toiminta on heikentynyt (ks ANNOSTELU JA HALLINNOINTI ).
Munuaisten vajaatoiminta
Asikloviirin puoliintumisaika ja kokonaispuhdistuma riippuvat munuaisten toiminnasta.
Annoksen muuttamista suositellaan potilaille, joiden munuaisten toiminta on heikentynyt (ks ANNOSTELU JA HALLINNOINTI ).
Kliiniset tutkimukset
Alkuperäinen genitaaliherpes
Lumekontrolloidut kaksoissokkotutkimukset ovat osoittaneet, että suun kautta annettu ZOVIRAX® lyhensi merkittävästi akuutin infektion kestoa ja vaurion paranemisen kestoa. Kivun ja uusien vaurioiden muodostumisen kesto lyheni joissakin potilasryhmissä.
Toistuva sukupuolielinten herpes
Tutkimuksessa potilailla, jotka saivat ZOVIRAX® 400 mg kahdesti vuorokaudessa 3 vuoden ajan, 45 %:lla potilaista, 52 %:lla ja 63 %:lla potilaista ei esiintynyt uusiutumista ensimmäisenä, toisena ja kolmantena vuonna. Potilaiden kolmen kuukauden uusiutumistiheyden sarjaanalyysit osoittivat, että 71–87 % oli uusiutumattomia kullakin vuosineljänneksellä.
Herpes zoster -infektiot
Kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa immunokompetenteilla potilailla, joilla oli paikallinen ihon vyöruusutulehdus, ZOVIRAX® (800 mg 5 kertaa päivässä 10 päivän ajan) lyhensi aikaa leesion rupistumiseen, paranemiseen ja kivun täydelliseen loppumiseen sekä lyhensi viruksen kestoa. irtoaminen ja uuden vaurion muodostumisen kesto.
Samankaltaisessa kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa ZOVIRAX® (800 mg 5 kertaa päivässä 7 päivän ajan) lyhensi vaurion rupeutumisen, parantumisen ja kivun lakkaamisen kestoa sekä lyhensi uuden leesion muodostumisen kestoa.
Hoito aloitettiin 72 tunnin kuluessa ihottuman alkamisesta, ja se oli tehokkainta, jos se aloitettiin ensimmäisten 48 tunnin aikana. Yli 50-vuotiailla aikuisilla oli suurempi hyöty.
Vesirokko
Kolme satunnaistettua, kaksoissokkoutettua, lumekontrolloitua tutkimusta suoritettiin 993 vesirokkopotilaalla iältään 2–18-vuotiailla lapsipotilailla. Kaikki potilaat hoidettiin 24 tunnin kuluessa ihottuman alkamisesta. Kahdessa tutkimuksessa ZOVIRAX®-valmistetta annettiin 20 mg/kg neljä kertaa päivässä (jopa 3 200 mg päivässä) 5 päivän ajan. Kolmannessa tutkimuksessa annokset 10, 15 tai 20 mg/kg annettiin neljä kertaa päivässä 5-7 päivän ajan. ZOVIRAX®-hoito lyhensi parantumisaikaa 50 %:iin, vähensi leesioiden enimmäismäärää, vähensi rakkuloiden mediaanimäärää, vähensi jäljellä olevien leesioiden mediaanimäärää päivänä 28 ja vähensi niiden potilaiden osuutta, joilla oli kuumetta, ruokahaluttomuutta ja letargiaa. päivään 2 mennessä. ZOVIRAX®-hoito ei vaikuttanut varicella zoster -virukselle spesifisiin humoraalisiin tai sellulaarisiin immuunivasteisiin 1 kuukauden tai 1 vuoden kuluttua hoidosta.
Yksityiskohtainen farmakologia
Katso Toiminta ja kliininen farmakologia.
Virologia
Herpes simplex -viruksen (HSV) ja varicella zoster -virusten (VZV) asykloviiriherkkyyden ja kliinisen hoitovasteen välillä ei ole kvantitatiivista suhdetta ihmisellä, eikä virusherkkyystestausta ole standardoitu. Herkkyystestien tulokset, ilmaistuna lääkeaineen pitoisuutena, joka vaaditaan estämään 50 % viruksen kasvua soluviljelmässä (ID50), vaihtelevat suuresti riippuen käytetystä tietystä määrityksestä, käytetystä solutyypistä ja testin suorittavasta laboratoriosta. Asykloviirin ID50 HSV-1-isolaatteja vastaan voi vaihdella välillä 0,02 μg/ml (plakin väheneminen Vero-soluissa) arvoon 5,9-13,5 μg/ml (plakin väheneminen vihreiden apinan munuaisten [GMK]-soluissa). ID50 HSV-2:ta vastaan vaihtelee välillä 0,01 - 9,9 μg/ml (plakin väheneminen Vero- ja GMK-soluissa, vastaavasti).
Käyttämällä Vero-solujen värinottomenetelmää, joka antaa ID50-arvot noin 5-10 kertaa korkeammat kuin plakin vähentämismäärityksissä, tutkittiin 1 417 HSV-isolaattia (553 HSV-1 ja 864 HSV-2) noin 500 potilaalta 5-vuotiaana. vuoden ajanjakso. Näissä määrityksissä havaittiin, että 90 % HSV-1-isolaateista oli herkkiä ≤ 0,9 µg/ml asykloviirille ja 50 % kaikista isolaateista oli herkkiä ≤ 0,2 µg/ml asykloviirille. HSV-2-isolaateista 90 % oli herkkiä ≤ 2,2 μg/ml:lle ja 50 % kaikista isolaateista oli herkkiä ≤ 0,7 μg/ml asykloviirille. Isolaatteja, joiden herkkyys oli merkittävästi heikentynyt, löydettiin 44 potilaalta. On korostettava, että potilaita tai isolaatteja ei valittu satunnaisesti, eivätkä ne siksi edusta yleistä populaatiota. Useimmat vähemmän herkistä kliinisistä HSV-isolaateista ovat olleet suhteellisen puutteellisia viruksen tymidiinikinaasissa (TK). Myös kantoja, joissa on muutoksia viruksen TK:ssa tai viruksen DNA-polymeraasissa, on raportoitu.
ID50 VZV:tä vastaan vaihtelee välillä 0,17-1,53 μg/ml (sadon väheneminen, ihmisen esinahan fibroblastit) 1,85-3,98 μg/ml:iin (pesäkkeiden väheneminen, ihmisalkion fibroblastit [HEF]). 1,5 μg/ml asykloviiri estää EBV-genomin lisääntymisen 50 % superinfektoiduissa Raji-soluissa tai P3HR-1-lymfoblastoidisoluissa. Sytomegalovirus (CMV) on suhteellisen resistentti asykloviirille, ja sen ID50-arvot vaihtelevat välillä 2,3-17,6 μg/ml (plakin väheneminen, HEF-solut) 1,82-56,8 μg/ml:iin (DNA-hybridisaatio, HEF-solut). Minkään ihmisen herpesviruksen genomin piilevän tilan ei tiedetä olevan herkkä asykloviirille.
Resistanssi
Pitkäaikainen HSV:n altistuminen asykloviirin pitoisuuksille (0,1 μg/ml) soluviljelmässä on johtanut useiden asykloviiriresistenttien kantojen syntymiseen. Resistenttien kantojen syntymisen uskotaan tapahtuvan "valimalla" luonnossa esiintyviä viruksia, joilla on suhteellisen alhainen herkkyys asykloviirille. Tällaisia kantoja on raportoitu useista kliinisistä tutkimuksista tehdyissä hoitoa edeltävissä isolaateissa.
Kaksi resistenssimekanismia, joihin liittyy viruksen tymidiinikinaasi (tarvitaan asykloviirin aktivoimiseksi), on kuvattu. Näitä ovat: (a) sellaisten tymidiinikinaasipuutteisten mutanttien valinta, jotka indusoivat vain vähän tai ei ollenkaan entsyymiaktiivisuutta infektion jälkeen, ja (b) sellaisten mutanttien valinta, joilla on muuttuneen substraattispesifisyyden omaava tymidiinikinaasi, joka pystyy fosforyloimaan luonnollisen tymidiinin nukleosidin, mutta ei. asykloviiri. Suurin osa in vitro syntyvistä vähemmän herkistä viruksista on tymidiinikinaasipuutteisia, joilla on vähentynyt tarttuvuus ja patogeenisyys ja pienempi todennäköisyys aiheuttaa latenssia eläimissä.
Kuitenkin asikloviiriresistentin HSV-infektion immunosuppressoituneella luuydinsiirteen vastaanottajalla, joka sai pidennettyä asykloviirihoitoa, havaittiin johtuvan kliinisestä isolaatista, jossa oli normaali tymidiinikinaasi mutta muuttunut DNA-polymeraasi. Tämä kolmas herpes simplex -viruksen DNA-polymeraasiin liittyvä resistenssin mekanismi johtuu mutanttien valinnasta, jotka koodaavat muuttunutta entsyymiä, joka on resistentti asykloviiritrifosfaatin inaktivaatiolle.
VZV näyttää osoittavan vastustuskykyä asykloviirille samankaltaisten mekanismien kautta kuin HSV:ssä.
Rajoitettu kliininen tutkimus ei kuitenkaan ole paljastanut mitään todisteita merkittävästä muutoksesta in vitro VZV-herkkyydessä asykloviirihoidolla, vaikka tämän viruksen resistenttejä mutantteja voidaan eristää in vitro HSV:n kanssa analogisella tavalla. Analyysi pienestä määrästä kliinisiä isolaatteja potilailta, jotka ovat saaneet oraalista asykloviiria tai lumelääkettä akuuttiin herpes zosteriin, viittaavat siihen, että in vivo -resistentin VZV:n ilmaantuminen saattaa esiintyä harvoin. Pitkäaikainen asykloviirihoito erittäin immuunipuutteisilla potilailla, joilla on hankinnainen immuunikato-oireyhtymä ja vaikea VZV, voi johtaa resistentin viruksen ilmaantumiseen.
Ristiresistenssi muille viruslääkkeille esiintyy in vitro asikloviiriresistenteissä mutanteissa. HSV-mutantit, jotka ovat resistenttejä asykloviirille virustymidiinikinaasin puuttumisen vuoksi, ovat ristiresistenttejä muille herpesviruksen tymidiinikinaasin fosforyloimille aineille, kuten bromovinyylideoksiuridiinille, gansikloviirille ja 2'-fluoripyrimidiininukleosideille, kuten 2'-fluorille. -5-jodiarabinosyylisytosiini (FIAC).
Kliininen vaste asikloviirihoidolle on yleensä ollut hyvä potilailla, joilla on normaali immuniteetti ja joista HSV, jolla on vähentynyt asykloviiriherkkyys, on toipunut joko ennen hoitoa, sen aikana tai sen jälkeen. Tietyt potilasryhmät, kuten vakavasti heikentyneet immuunivasteet (erityisesti luuydinsiirron saajat) ja kroonista suppressiohoitoa saavat, on kuitenkin havaittu liittyvän useimmiten resistenttien herpes simplex -kantojen ilmaantuvuuteen, mikä saattaa liittyä huonoon vasteeseen tai ei. lääkkeelle. Tällaisia potilaita hoidettaessa on tunnustettava vähemmän herkkien virusten ilmaantumisen mahdollisuus, ja näiden potilaiden kliinisten isolaattien herkkyyden seurantaa tulee rohkaista.
Yhteenvetona voidaan todeta, että kvantitatiivista suhdetta HSV:n ja VZV:n in vitro -herkkyyden asykloviirille ja kliinisen hoitovasteen välillä ei ole selkeästi osoitettu ihmisellä. Standardoituja virusherkkyystestausmenetelmiä tarvitaan, jotta in vitro -virusherkkyyden ja asykloviirihoidon kliinisen vasteen välillä saadaan tarkempia korrelaatioita.
Toksikologia
Akuutin toksisuuden tutkimukset
Aikuiset hiiret ja rotat : Suun kautta otettavan asykloviirin akuutti toksisuus määritettiin taulukon 6 mukaisesti.
Vastasyntyneet, epäkypsät ja aikuiset rotat
10 uros- ja 10 naarasrotan Charles River CD (Sprague-Dawley) ryhmille annettiin yksittäisiä suuria annoksia (5 eri annostasoa) asykloviiriliuosta (pH 11,0) ihonalaisena injektiona, kun ne olivat 3, 10, 28 ja 71 päivää. iästä. Niitä tarkkailtiin 14 päivän ajan hoidon jälkeen ja LD50-arvot laskettiin Litchfieldin ja Wilcoxonin menetelmällä (katso taulukko 7 alla). Tämä tutkimus tehtiin sen määrittämiseksi, vaikuttaako ikä altistuessa asykloviirin akuuttiin toksisuuteen; ei ollut näyttöä siitä, että nuoret rotat olisivat herkempiä kuin vanhemmat rotat asykloviirin akuuteille toksisille vaikutuksille.
Hoidon jälkeisen eloonjäämisajan ja hoidon iän välillä ei ollut selvää yhteyttä. 3 ja 10 päivän iässä hoidettujen rottien kliinisiä oireita olivat punaiset ja purppuraiset ihorakkulat, siniset alueet, rupia, arvet, nekroottinen ja hilseilevä iho, avoimet haavat, kehon vapina ja hiustenlähtö. Vähentynyttä aktiivisuutta, kyynelnestettä, sulkeutuneita silmäluomet, punaruskeaa tai ruskeaa materiaalia silmien, nenän ja suun ympärillä, ataksiaa, uupumusta, kehon vapinaa, virtsan tahroja vatsan tai sukuelinten alueella, rupia tai nekroottisia alueita ja hiustenlähtöä havaittiin rotilla, joita hoidettiin klo. 28 ja 71 päivän iässä.
Subkrooninen suun toksisuustutkimus
Hiiret
Neljälle ryhmälle, joista kukin koostui 28 uros- ja 28 naaraspuolisesta Charles River CD-1 (ICR) -hiirestä, annosteltiin suun kautta mahaletkua 33 päivän ajan asykloviirisuspensioilla. Päivittäiset annostasot olivat 0, 50, 150 ja 450 mg/kg. Hematologiset ja kliinisen kemian mittaukset tehtiin vielä 8 uros- ja 8 naarashiirelle ryhmää kohden (annosteltiin samalla tavalla) ensimmäisen ja neljännen annosteluviikon jälkeen ja 3. annoksen jälkeisen viikon aikana.
Plasman lääkepitoisuudet mitattiin yhdistetyistä näytteistä 4 uros- ja 4 naarashiirestä ryhmää kohden annospäivinä 1, 15 ja 30.
Rotilla ja hiirillä tehtyjen alustavien kokeiden perusteella valittiin suuri annos 450 mg/kg tuottamaan korkeimmat lääkeainepitoisuudet plasmassa, jotka jyrsijälajilla voidaan saavuttaa käytännöllisesti suun kautta. Keskimääräiset lääkeainepitoisuudet plasmassa vaihtelivat noin 3,4:stä (pienellä annoksella) 11,0:een (suurella annoksella) μg/ml plasmaa tunnin kuluttua oraalisen annostelun jälkeen.

Terveydessä, kasvunopeudessa, hematologisissa ja kliinisen kemian mittauksissa ei tapahtunut muutoksia, jotka voisivat varmasti johtua asykloviiriannoksesta. Suuren annoksen saaneiden ja kontrolliryhmien 16 uros- ja 16 naarasrotan kokonais- ja histopatologiset tutkimukset annostelujakson lopussa eivät paljastaneet mitään merkittävää.
Kroonisen toksisuuden tutkimukset
Elinikäinen suun toksisuustutkimus rotilla, joille annettiin asykloviiriä mahaintubaatiolla
Charles River CD (Sprague-Dawley) -rotille annettiin asykloviirisuspensioita letkulla. Kullakin seuraavista annostasoista oli 50 uros- ja 50 naarasrottaa: 0, 50, 150 ja 450 mg/kg. 30 ja 52 viikon hoidon jälkeen 10 uros- ja 10 naarasrotalle kustakin ryhmästä tehtiin ruumiinavaus. Jäljelle jääville rotille annosteltiin joka päivä, kunnes luonnollinen kuolleisuus pienensi ryhmän kokoa noin 20 %:iin sitä sukupuolta olevien eläinten lukumäärästä, jotka olivat läsnä testiryhmissä tutkimuksen alkaessa. Kaikki jäljellä olevat rotat tapettiin ja niille tehtiin ruumiinavaus, kun 20 %:n raja-arvo saavutettiin. Tämä tapahtui viikolla 110 urosrotilla ja viikolla 122 naarasrotilla. Kontrollirottien ja suuren annoksen ryhmän kudokset arvioitiin valomikroskopialla. Pienen ja keskiannoksen ryhmien rottien kudoksia, joissa oli massoja, kyhmyjä tai epätavallisia vaurioita, tutkittiin myös valomikroskopialla. Kiinteät kudokset rotista, jotka löydettiin kuolleina tutkimuksen ensimmäisen 52 viikon aikana, arvioitiin myös valomikroskopialla.
Toksikoosin merkkejä ei havaittu. Plasmanäytteet kerättiin 1,5 tuntia annostuksen jälkeen päivinä 7, 90, 209, 369, 771 (vain miehet) ja 852 (vain naiset). Keskimääräiset plasmapitoisuudet, jotka todettiin suuriannoksilla miehillä (450 mg/kg/vrk) edellä mainittuina aikoina, olivat seuraavat: 1,54, 1,63, 1,39, 1,60 ja 1,70 μg/ml (6,84, 7,26, 6,17, 7,10 ja 7,5 μM) . Vastaavat keskimääräiset plasmapitoisuudet suuria annoksia saaneilla naisilla vastaavina ajanjaksoina olivat 1,76, 2,38, 2,12, 1,71 ja 1,81 µg/ml (7,82, 10,58, 9,44, 7,62 ja 8,03 µM). Sekä miesten että naisten plasmatasot kaikilla annostasoilla yhden vuoden hoidon jälkeen olivat yleensä verrattavissa aikaisemmissa näytteissä saatuihin plasmapitoisuuksiin. Laboratoriokokeiden, mukaan lukien hematologia, kliininen kemia ja oftalmoskopia, arvot olivat kaikki normaalin alueen sisällä. Ei ollut lääkkeiden aiheuttamia karkeita tai mikroskooppisia vaurioita, eikä ollut näyttöä siitä, että asykloviiri vaikuttaisi eloonjäämiseen.
Elinikäinen suun karsinogeenisuustutkimus rotilla
Charles River CD (Sprague-Dawley) -rotilla (100 rottaa/sukupuoli/annosryhmä), joille annettiin asykloviiria suun kautta 50, 150 ja 450 mg/kg, ei havaittu toksikoosin merkkejä elinikäisessä suun karsinogeenisuustutkimuksessa. Keskimääräiset plasmapitoisuudet, jotka mitattiin suuriannoksisilla miehillä 1,5 tunnin kuluttua annostelusta eri näytteenottoaikoina tutkimuksen aikana, olivat seuraavat: 1,54, 1,63, 1,39, 1,60 ja 1,70 μg/ml (6,84, 7,26, 6,17, 7,10 μg ja 7,M) vuorokaudessa. 7, 90, 209, 369 ja 771, vastaavasti. Vastaavat keskiarvot suuria annoksia saaneille naisille olivat 1,76, 2,38, 2,12, 1,71 ja 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 ja 8,03 μM) päivinä 7, 90 ja 8,03 μM, vastaavasti päivinä 7, 90, 6,20
Arvot kliinisissä laboratoriotutkimuksissa, mukaan lukien hematologia, kliininen kemia, virtsaanalyysi, ruumiinpaino, ruuankulutus ja oftalmoskopia, olivat kaikki normaaleissa rajoissa. Ei ollut lääkkeiden aiheuttamia karkeita tai mikroskooppisia leesioita, eikä ollut näyttöä siitä, että asykloviiri vaikuttaisi eloonjäämiseen, kasvainten esiintyvyyden ajallisiin malleihin tai hyvänlaatuisten tai pahanlaatuisten kasvainten määrään.
Suurin osa suhteellisen harvoista rotista, jotka löydettiin kuolleina tai kuolleina tämän tutkimuksen ensimmäisten 52 viikon aikana, kärsivät annostusonnettomuuksista, mistä on osoituksena kuoleman jälkeiset löydökset ruokatorven perforaatiosta, joka aiheutti keuhkopussin effuusiota, keuhkokuumetta tai mediastiniittia.
Elinikäinen suun karsinogeenisuustutkimus hiirillä
Charles River CD-1 (ICR) -hiirillä (115 hiirtä/sukupuoli/annosryhmä), joille annettiin asykloviiria suun kautta 50, 150 ja 450 mg/kg/vrk, ei havaittu merkkejä toksikoosista elinikäisessä suun karsinogeenisuustutkimuksessa. Keskimääräiset plasmapitoisuudet, jotka mitattiin suuria annoksia saaneilla miehillä 1,5 tunnin kuluttua annostelusta eri näytteenottoaikoina tutkimuksen aikana, olivat seuraavat: 2,83, 3,17 ja 1,82 μg/ml (12,59, 14,10 ja 8,10 μM) päivinä 90, 365 ja 541, vastaavasti. Vastaavat keskiarvot suuria annoksia saaneilla naisilla olivat 9,81, 5,85 ja 4,0 μg/ml (43,60, 26,0 ja 17,79 μM).
Kliinisten laboratoriotutkimusten arvot, mukaan lukien hematologia, ruumiinpaino ja ruoankulutus, olivat kaikki normaaleissa rajoissa. Lääkkeiden aiheuttamia karkeita tai mikroskooppisia vaurioita ei ollut. Naarashiiret, joille annettiin 150 ja 450 mg/kg asykloviiria, selvisivät merkittävästi kauemmin kuin kontrollinaarashiiret; hoidettujen miesten eloonjääminen oli verrattavissa kontrolliurosten eloonjäämiseen. Asikloviirihoito ei vaikuttanut hyvänlaatuisten tai pahanlaatuisten kasvainten kasvainten esiintyvyyteen ja kasvainten määrään.
Krooninen 12 kuukauden suun toksisuustutkimus koirilla
Puhdasrotuisille beagle-koirille annettiin 0, 15, 45 tai 150 mg/kg/päivä asykloviiria joka päivä kahden ensimmäisen viikon ajan vuoden kestäneessä tutkimuksessa. Jokaisessa testiryhmässä oli 9 uros- ja 9 naaraskoiraa. Koirille annettiin gelatiinikapseleita, jotka sisälsivät sopivan annoksen. Niitä käsiteltiin kolme kertaa vuorokaudessa, joten annokset, jotka annettiin kussakin kolmesta tasavälisestä annosjaksosta, olivat 0, 5, 15 ja 50 mg/kg. Annokset 45 ja 150 mg/kg aiheuttivat ripulia, oksentelua, vähentynyttä ruuankulutusta ja painon laskua sekä uros- että naaraskoirilla tutkimuksen kahden ensimmäisen viikon aikana. Tästä syystä tutkimuksen kolmannella viikolla päätettiin laskea keski- ja korkeaannosten tasot 30 ja 60 mg/kg/vrk (10 ja 20 mg/kg tid). Pieni annos 15 mg/kg/vrk (5 mg/kg tid) pysyi ennallaan. Koirat, joille annettiin 60 mg/kg/vrk, oksentelivat ajoittain ja heillä oli toisinaan ripulia, mutta menestyivät hyvin testin ajan, ja painonnousun ja ruuan kulutuksen arvot olivat verrattavissa kontrolliarvoihin.
Suurempien asikloviiriannosten aiheuttaman toksikoosin aikana lääkkeen plasmapitoisuudet olivat todennäköisesti erittäin korkeat (kuten alkuarvot 24,0 μg/ml (106,6 μM) suuriannoksisilla miehillä ja 17,4 μg/ml (77,2 μM) osoittavat. suuriannoksisille naisille, kun se määritettiin 1 tunti kolmannen annoksen jälkeen tutkimuksen ensimmäisenä päivänä). Päivänä 15 mitattuna asykloviirin plasmapitoisuudet suuriannoksisilla koirilla (150 mg/kg/vrk) olivat edelleen erittäin korkeat, mutta ne laskivat myöhemmin, kun annoksia pienennettiin. Plasman pitoisuudet 12 kuukauden hoidon jälkeen olivat yleensä verrattavissa arvoihin, jotka kirjattiin 1, 3 ja 6 kuukauden hoidon jälkeen. Siten ei ollut viitteitä asykloviirin parantuneesta metaboliasta kroonisen hoidon seurauksena.
Viikon 13 aikana joillakin uros- ja naaraskoirilla oli sekä keski- että korkea-annosteluilla seuraavia oireita: etukäpälöiden arkuus, jalkatyynyjen eroosio sekä kynsien murtuminen ja löystyminen. Kadonneiden kynsien uusiutuminen alkoi muutamaa viikkoa myöhemmin. Kynnet regeneroituivat 6 kuukaudessa (kun 3 urosta ja 3 naarasta kustakin ryhmästä tapettiin väliaikaista uhrausta varten) ja tutkimuksen loppuun mennessä olivat yleensä hyvälaatuisia. Pienen annoksen ryhmässä (15 mg/kg/vrk) koirilla ei koskaan havaittu merkkejä vaikutuksesta tassuihin tai kynsiin.
On hyväksyttyä, että kynnen keratiinia tuottavan sydänepiteelin vaurio voi johtaa keratiinin tuotannon pysähtymiseen ja epänormaalin keratiinin tuotantoon. Tutkimuksen kahden ensimmäisen viikon aikana annettujen suurten asykloviiriannosten (45 ja 150 mg/kg/vrk) aiheuttama ohimenevä toksikoosi on saattanut vaikuttaa sydänepiteeliin. Jos sydämen epiteeliin oli ohimenevää vaikutusta (jolloin liittyy suoriin vaikutuksiin tai sekundaarinen lääkkeiden aiheuttamaan sairauteen tutkimuksen kahden ensimmäisen viikon aikana), kynnen myöhempi menetys voi olla seurausta. Mitään havaittavia vaikutuksia muihin keratiinia tuottaviin tai keratiinia sisältäviin kudoksiin ei havaittu. On korostettava, että muutokset kynsissä näyttivät liittyvän ohimenevään toksikoosiin, jonka aiheuttivat tutkimuksen kahden ensimmäisen viikon aikana testatut annostasot 50 ja 150 mg/kg/vrk, eivät 30 ja 60 mg/kg. /vrk annostasot testataan myöhemmin.
Tämän tutkimuksen aikana sopivin väliajoin suoritetuissa seerumin biokemiallisissa kokeissa, virtsa- ja elektrokardiografisissa testeissä ei havaittu merkittäviä lääkkeiden aiheuttamia muutoksia. Seerumin albumiinin ja kokonaisproteiinin arvot laskivat hieman koirilla, joita hoidettiin 30 ja 60 mg/kg/vrk 6 ja 12 kuukauden ajan. Kaikki näiden parametrien arvot pysyivät kuitenkin normaaleina hyväksytyissä rajoissa.
Lukuun ottamatta jäännösmuutoksia vanhassa keratiinissa kynsien päissä, missään valomikroskoopilla tutkitussa kudoksessa ei havaittu merkkejä hoitoon liittyvistä vaikutuksista. Ruumiinavauksessa punnittujen elinten arvoissa ei myöskään ollut merkittäviä muutoksia. Siten annostasot 60 mg/kg/vrk asti olivat hyvin siedettyjä yhden vuoden ajan. Asykloviirin "annosvaikutuston" annostaso oli 15 mg/kg/vrk (5 mg/kg tid); kuitenkin ainoat haittavaikutukset annoksilla 30 tai 60 mg/kg/vrk olivat muutokset kynsissä ja jalkatyynyissä (30 ja 60 mg/kg/vrk) ja lieviä maha-suolikanavan oireita (60 mg/kg/vrk).
Lisääntymistutkimukset
Teratologia – Rotat
Asykloviiria annettiin raskaana oleville ARS Sprague-Dawley -naarasrotille subkutaanisena injektiona organogeneesin aikana (tiineyspäivä 6 - 15) annostasoilla 0,0, 6,0, 12,5 ja 25,0 mg/kg ruumiinpainoa kahdesti vuorokaudessa.
Yhdistetyn vaikutuksen arviointiperusteita olivat äidin ruumiinpainot, painonnousut, ulkonäkö ja käyttäytyminen, eloonjäämisluvut, silmämuutokset, raskausluvut ja lisääntymistiedot. Myös jälkeläisten elinkelpoisuus ja kehitys arvioitiin.
Yllä olevien mittausten lisäksi määrätyt eläimet lopetettiin 1 tunti ensimmäisen annoksen jälkeen päivänä 15 näytteiden keräämiseksi äidin verestä, lapsivedestä ja sikiöistä lääkeainepitoisuuden mittaamista varten. Näiden näytteiden keskiarvot on lueteltu taulukossa 8.
Plasmalle saadut arvot edustaisivat noin 30 % alkuperäisestä plasman tasosta jyrsijöillä plasman puoliintumisajan perusteella arvioituna.
Äidin ruumiinpainoarvoja, ulkonäköä ja käyttäytymistä, eloonjäämislukuja, raskauslukuja tai implantoinnin tehokkuutta verrattaessa ei havaittu asykloviirin antamisesta johtuvia vaikutuksia. Lisäksi sikiön koon, sukupuolen ja kehityksen arvioinnissa ei havaittu yhdisteisiin liittyviä eroja.
Vaikka resorption ja sikiön elinkelpoisuuden ilmaantuvuus oli normaalin vaihteluvälin sisällä kaikissa ryhmissä, havaittiin hieman suurempia resorptioiden esiintymistiheyksiä suuriannoksilla saaneilla eläimillä, jotka lopetettiin tiineyspäivinä 15 ja 19; Selviä annokseen liittyviä suuntauksia ei kuitenkaan syntynyt.
Siksi asykloviiria ei pidetty teratogeenisena tai alkiotoksisena, kun sitä annettiin rotille pitoisuuksina 50,0 mg/kg/vrk organogeneesin aikana.
Teratologia – Kanit
Teratologinen tutkimus tehtiin New Zealand White -kaneilla käyttäen olennaisesti samaa koesuunnitelmaa kuin rotalla, paitsi että annostelu oli 6. päivästä 18. tiineyspäivään. Myös sikiöiden, lapsivesien ja äidin verinäytteiden kerääminen tapahtui 18. päivänä eikä 15. päivänä.
Mitään merkkejä äidin toksisuudesta ei havaittu millään annoksella, mutta suuren annoksen ryhmässä implantaatiotehokkuus oli tilastollisesti merkitsevä (p
Asykloviiripitoisuuksia havaittiin plasma- ja lapsivesinäytteistä sekä sikiön kudoshomogenaateista. Kaikki näytteet otettiin yksi tunti ensimmäisen annoksen jälkeen 18. raskauspäivänä. Lapsiveden lääkepitoisuudet olivat huomattavasti korkeammat kuin plasmassa (katso taulukko 9).
Lisääntyminen – Hedelmällisyys
Kahden sukupolven hedelmällisyystutkimuksessa asykloviirin ei osoitettu heikentävän hedelmällisyyttä tai lisääntymistä 15 uros- ja 30 naarashiiren ryhmissä. Tämän tutkimuksen hiirille annettiin asykloviiria mahaintubaatiolla annostasoilla 50, 150 ja 450 mg/kg/vrk. Uroksille annosteltiin 64 peräkkäistä päivää ennen parittelua ja naaraille 21 päivää ennen parittelua.
Rotilla tehdyssä hedelmällisyystutkimuksessa, jossa 20 uros- ja 20 naarasrotan ryhmille annettiin 0, 12,5, 25,0 ja 50,0 mg/kg/vrk ihonalaisena injektiona, asykloviirilla ei osoitettu olevan vaikutusta paritteluun tai hedelmällisyyteen. Uroksille annettiin annostusta 60 päivää ennen parittelua ja kunnes heidän paritteluaikataulunsa oli suoritettu. Naarasrotille annosteltiin 14 päivää ennen parittelua ja tiineyspäivään 7 asti. Annoksella 50 mg/kg/vrk ihon alle havaittiin tilastollisesti merkitsevä lisäys istutuksen jälkeisessä katoamisessa, mutta ei samanaikaista pienenemistä pentueen koosta.
25 naaraskaniinilla, joita hoidettiin ihonalaisesti 50 mg/kg/vrk asykloviirilla tiineyspäivinä 6-18, implantaatiotehokkuus väheni tilastollisesti merkitsevästi, mutta ei samanaikaista pienenemistä pentueen koosta. Myös niiden sikiöiden määrässä, joilla oli ylimääräiset kylkiluut, oli annoksesta riippuvainen kasvu kaikissa lääkehoidetuissa ryhmissä. Tämä lisäys ei ollut annoksesta riippuvainen, kun tarkasteltiin ylimääräisten kylkiluiden esiintymistä pentueessa.
15 naaraskaniinilla, joita hoidettiin suonensisäisesti 50 mg/kg/vrk asykloviirilla tiineyspäivinä 6-18, ei ollut vaikutusta istutuksen tehokkuuteen eikä pentueen kokoon.
Peri- ja postnataalisessa tutkimuksessa (20 naarasrottaa ryhmää kohden) asykloviiria annettiin ihonalaisesti 0, 12,5, 25 ja 50 mg/kg/vrk 17. tiineyden päivästä 21. päivään synnytyksen jälkeen. Annoksella 50 mg/kg/vrk ihon alle havaittiin tilastollisesti merkitsevä lasku keltasolujen, kokonaisistutuskohtien ja elävien sikiöiden lukumäärässä F1-sukupolvessa. Vaikka ei tilastollisesti merkitsevästi, myös annoksesta riippuvainen lasku elävien sikiöiden ja implantaatiokohtien keskimääräisessä ryhmässä laski annoksella 12,5 mg/kg/vrk ja 25 mg/kg/vrk sc.
Viidellä naaraspuolisella kaniinilla tehdyssä annosvälitutkimuksessa asykloviirin suonensisäinen antaminen annoksella 100 mg/kg/vrk 6–8 raskauspäivänä. Annos, jonka tiedettiin aiheuttavan obstruktiivista nefropatiaa, lisäsi merkittävästi sikiön resorptiota ja vastaava pieneneminen pentueen koon. Suurimmalla siedetyllä suonensisäisellä annoksella 50 mg/kg/vrk kaneilla ei havaittu lääkkeeseen liittyviä lisääntymisvaikutuksia.
Subkroonisessa toksisuustutkimuksessa, jossa 20 uros- ja 20 naarasrotan ryhmille annettiin vatsaontelonsisäisiä asikloviiriannoksia 0, 20, 80 tai 320 mg/kg/vrk yhden kuukauden ajan ja sitä seurattiin kuukauden ajan annoksen ottamisen jälkeen. surkastuminen. Jotkut histologiset todisteet siittiöiden tuotannon palautumisesta olivat ilmeisiä 30 päivää annoksen ottamisen jälkeen, mutta tämä aika ei riittänyt osoittamaan täydellistä palautuvuutta.
25 uros- ja 25 naarasrotan ryhmille annettiin vatsaontelonsisäisiä asykloviiriannoksia 0, 5, 20 tai 80 mg/kg/vrk 6 kuukauden ajan. Kymmenen uros- ja 10 naarasrottaa kussakin ryhmässä jatkettiin annostelematta 13 viikon ajan. Kivesten surkastuminen rajoittui suuriannoksisille rotille, joille annettiin 80 mg/kg/vrk 6 kuukauden ajan. Elinten painotiedot ja valomikroskopia määrittelivät kivesten surkastumisen täysin palautuvan annoksen jälkeisen toipumisjakson loppuun mennessä.
31 päivää kestäneessä koiratutkimuksessa (16 urosta ja 16 naarasta ryhmää kohden), jossa asykloviiria annettiin laskimoon 50, 100 ja 200 mg/kg/vrk, kivekset olivat normaaleja koirilla annoksella 50 mg/kg. Annokset 100 tai 200 mg/kg/vrk aiheuttivat joidenkin koirien kuoleman sytostaattisten vaikutusten vuoksi (luuydin ja maha-suolikanavan epiteeli) ja aspermiset kivekset tai kivekset, joissa oli hajallaan olevia aspermiset tubuluksia. Ei voida sulkea pois mahdollisuutta, että kivesten muutos on voinut olla ensisijainen, mutta samanlaisia muutoksia voidaan havaita sekundaarisesti kuolevilla koirilla vakavan stressin seurauksena.
Kehitystoksisuustutkimukset
Vastasyntyneet rotat - Subkrooninen tutkimus
Acyclovir liuotettuna 0,4 % steriiliin suolaliuokseen annettiin ihonalaisella injektiolla Charles River CD (Sprague-Dawley) vastasyntyneille rotille 19 peräkkäisenä päivänä, alkaen 3. synnytyksen jälkeisestä päivästä. Testatut annostasot olivat 0, 5, 20 ja 80 mg/kg ruumiinpainoa. Jokaisella annostasolla oli 12 pentuetta (joissa kussakin oli 5 uros- ja 5 naaraspuolista vastasyntynyttä, jotka imettävät luonnollista emä). Patoja ei käsitelty. Vastasyntyneet poistettiin kustakin ryhmästä ruumiinavausta ja useiden kudosten mikroskooppista arviointia varten, mukaan lukien silmät ja useat aivoosat, sen jälkeen, kun heitä oli hoidettu 5, 12 tai 19 päivää ja 3 viikon lääkkeettömän annoksen jälkeen ( jolloin he olivat 45 päivän ikäisiä). Hematologiset (hemoglobiini, pakattu solutilavuus, punasolujen, valkosolujen ja erilaisten solujen lukumäärät) ja kliinisen kemian (BUN) testit tehtiin 16 päivän hoidon jälkeen ja toistettiin 18 päivää viimeisen (19.) annoksen jälkeen.
Joiltakin vastasyntyneiltä kerättiin verta 30 minuuttia hoidon jälkeen päivänä 1, päivänä 9 ja annosjakson lopussa asykloviiripitoisuuksien määrittämiseksi plasmassa. Suurin asykloviiripitoisuus plasmassa oli 99,1 μg/ml (440,5 μM), joka löydettiin yhdistetyssä plasmassa, joka oli kerätty 6 naaraspuolisesta vastasyntyneestä, joilla oli suuri annos (80 mg/kg) 30 minuuttia ensimmäisen annoksen antamisen jälkeen. Asykloviirihoito ei lisännyt kuolleisuutta vastasyntyneiden aikana.
Pienen annoksen ryhmän rotat lihoivat yhtä paljon ruumiinpainoa kuin vastaavat kontrollirotat. Merkittäviä (p
Silmätutkimukset ja valomikroskopia eivät paljastaneet haitallisia vaikutuksia silmän kehitykseen. On korostettava, että ei ollut morfologisia tai toiminnallisia todisteita haitallisista vaikutuksista aivojen tai muiden keskushermoston osien kehittymiseen. Siten asykloviiri on selvästi erilainen kuin sytosiiniarabinosidi, jonka on raportoitu aiheuttavan näkyvää pikkuaivojen ja verkkokalvon dysplasiaa vastasyntyneillä rotilla.
Mutageenisuus ja muut lyhytaikaiset tutkimukset
Asykloviirin mutageenisuus on testattu useissa in vitro ja in vivo -järjestelmissä: 10. marraskuuta 2014 Sivu 27/38
Mikrobi
Asykloviiri testattiin mutageenisen aktiivisuuden suhteen Ames Salmonella -levymäärityksessä; Ames-määrityksen esi-inkubaatiomodifikaatiossa; Rosenkrantz E. coli polA+/polA- DNA-korjausmäärityksessä; ja eukaryootissa S. cerevisiae, D-4. Kaikki tutkimukset suoritettiin sekä eksogeenisen nisäkkään metabolisen aktivaation läsnä ollessa että ilman sitä. Acyclovir ei antanut positiivisia vasteita missään näistä systeemeistä.
Aiemmat salmonellatutkimukset laajennettiin erittäin korkeisiin pitoisuuksiin myrkyllisyyden saavuttamiseksi. Positiivisia vaikutuksia ei havaittu eksogeenisen nisäkkään metabolisen aktivaation läsnäollessa tai poissa ollessa asykloviiripitoisuuksilla 300 mg/malja tai 80 mg/ml asti.
Nisäkäsjärjestelmät
Asikloviirin mutageeninen aktiivisuus testattiin viljellyissä L5178Y-hiiren lymfoomasoluissa, jotka ovat heterotsygoottisia tymidiinikinaasi (TK) -lokuksessa, mittaamalla eteenpäin suuntautuva mutaationopeus TK-puutokselle (TK+/- → TK-/-; lisätutkimuksia suoritettiin HGPRT:ssä lokuksessa ja Ouabain-resistenssimarkkerissa näissä samoissa soluissa. Kaikki tutkimukset suoritettiin eksogeenisen nisäkkään metabolisen aktivaation läsnä ollessa ja ilman sitä. Testiyhdiste oli mutageeninen TK-lokuksessa korkeilla pitoisuuksilla (400 -2 400 μg/ml) (Vertailuksi, asykloviirin huippupitoisuuksien yläraja plasmassa oraalisen annoksen 200 mg q4h jälkeen on 0,9 μg/ml.) Se oli negatiivinen HGPRT-lokuksessa ja Ouabain-resistenssimarkkerissa. Samat tulokset saatiin metabolisen aktivaation kanssa ja ilman sitä.
Epävarmoja tuloksia ilman ilmeistä annokseen liittyvää vastetta saatiin, kun asykloviirin mutageenisuutta tutkittiin kussakin kolmessa lokuksessa (APRT, HGPRT ja Ouabain-resistenssi) kiinanhamsterin munasarjasoluissa (CHO) sekä eksogeenisen metabolisen aktivaation läsnä ollessa että ilman sitä.
Asyklovirin, jonka pitoisuus on 50 μg/ml (222 μM) 72 tunnin altistuksessa, on osoitettu lisäävän tilastollisesti merkitsevästi morfologisesti muuntuneiden pesäkkeiden ilmaantuvuutta, jotka johtuvat BALB/C-3T3-solujen käsittelystä in vitro eksogeenisen metabolisen aktivaation puuttuminen. Morfologisesti transformoituneiden pesäkkeiden on osoitettu kasvavan kasvaimina immunosuppressoituihin, syngeenisiin, vieroittaviin hiiriin siirron jälkeen. Kasvainkudokset diagnosoitiin joko erilaistumattomiksi sarkoomiksi tai lymfosarkoomiksi.
Asykloviiri pitoisuuksina 8-64 µg/ml 18 tunnin altistuksen aikana ei aiheuttanut morfologisesti muuttuneita pesäkkeitä C3H/10T ½ -soluissa, joita käsiteltiin in vitro ilman eksogeenistä metabolista aktivaatiota.
Asykloviiri pitoisuuksina 62,5 ja 125 μg/ml 48 tunnin altistuksen aikana ei aiheuttanut kromosomipoikkeavuuksia viljellyissä ihmisen lymfosyyteissä ilman eksogeenistä metabolista aktivaatiota. Korkeammilla pitoisuuksilla, 250 ja 500 μg/ml 48 tunnin altistuksen aikana, asykloviiri aiheutti merkittävän lisäyksen kromosomien rikkoutumisen ilmaantuvuudessa. Mitoottisessa indeksissä oli myös merkittävä annoksesta riippuvainen lasku asikloviirialtistuksen yhteydessä.
Asykloviiri, annoksina 25 ja 50 mg/kg/vrk ip 5 peräkkäisenä päivänä, ei tuottanut hallitsevaa tappavaa vaikutusta BKA (CPLP)-uroshiirillä. Lisäksi ei ollut näyttöä hallitsevasta tappavasta vaikutuksesta Charles River CD-1 (ICR) -uros- ja -naarashiiriin, joita hoidettiin suun kautta annostasoilla 50, 150 ja 450 mg/kg/vrk, kuten yhteenveto kahden sukupolven lisääntymis-/hedelmällisyystutkimuksesta. .
Asykloviiri 25, 50 ja 100 mg/kg vatsaontelonsisäisinä kerta-annoksina ei onnistunut indusoimaan kromosomipoikkeavuuksia kiinanhamsterin luuydinsoluissa, kun sitä tutkittiin 24 tuntia annostuksen jälkeen. Suuremmilla nefrotoksisilla annoksilla (500 ja 1 000 mg/kg) havaittiin blastogeeninen vaikutus. (Intraperitoneaalinen annos 500 mg/kg tuottaa kiinalaisille hamstereille keskimääräiset huippupitoisuudet plasmassa 611 μg/ml (2,72 mM), mikä on 680 kertaa korkeampi kuin ihmisen plasman huippupitoisuuksien yläraja, kun suun kautta annosteltiin 200 mg q4h).
Asykloviiri ei kerta-annoksilla 25, 50 ja 100 mg/kg suonensisäisinä annoksina indusoinut kromosomipoikkeavuuksia uros- ja naarasrottien luuydinsoluissa, kun sitä tutkittiin 6, 24 ja 48 tuntia hoidon jälkeen.
Siten kaikki nämä tutkimukset osoittivat, että asykloviiri ei aiheuta yhden geenin mutaatioita, mutta pystyy rikkomaan kromosomeja.
Immunotoksikologiset tutkimukset
Asykloviirille tehtiin useita in vitro ja in vivo immunologisia testejä.
Kahdessa in vivo -testissä, lymfosyyttivälitteisessä sytotoksisuudessa ja neutrofiilien kemotaksisessa, asykloviiri ei osoittanut estäviä vaikutuksia niinkin korkeilla pitoisuuksilla kuin 135 µg/ml (600 µM). Yhdiste esti ruusukkeiden muodostumista noin 50 % pitoisuudella 0,9 μg/ml (4 μM).
Neljässä hiirillä tehdyssä in vivo -testissä, joissa mitattiin soluvälitteistä immuniteettia (komplementista riippuvainen solujen sytotoksisuus, komplementista riippumaton solusytotoksisuus, viivästynyt yliherkkyys ja siirrännäinen vs. isäntä -reaktio), asykloviiri ei osoittanut estäviä vaikutuksia kerta-annoksilla 200 mg/kg asti. päivänä 2 antigeenisen stimulaation jälkeen.
Neljällä päivittäisellä annoksella 100 mg/kg/vrk ei ollut merkittävää vaikutusta Jernen hemolysiiniplakkeihin tai kiertäviin vasta-aineisiin päivänä 7 antigeenisen stimulaation jälkeen. Kun Jernen hemolysiiniplakit ja vasta-ainetiitterit tutkittiin neljä päivää antigeenialtistuksen jälkeen ja yksi päivä viimeisen lääkeannoksen jälkeen, 100 mg/kg osoitti vain lievää suppressoivaa vaikutusta. Kuitenkin 200 mg/kg tuotti jonkin verran painonpudotusta (-2,2 g), kohtalaisen Jernen hemolysiiniplakkien määrän vähenemisen (PFC/perna väheni 33 %:iin kontrollista, PFC/107 WBC 46,5 %:iin kontrollista). Kuitenkin verenkierrossa oleva hemagglutiniinitiitteri (8,3:sta 6,5:een) ja verenkierrossa oleva hemolysiinitiitteri (9,5:stä 8,3:een) laski vain vähän annoksella 200 mg/kg.
Hiirillä tehdyissä kokeissa, joiden tarkoituksena oli testata, voisiko asykloviiri tehostaa atsatiopriinin immunosuppressiivista vaikutusta vasta-aineiden muodostukseen, havaittiin, että näiden kahden lääkkeen vaikutukset olivat vain additiivisia. Vain asykloviiriannos 200 mg/kg osoitti lisääntynyttä vasta-ainevasteen suppressiota, kun sitä annettiin yhdessä atsatiopriinin kanssa yli 25 mg/kg annoksilla.
Suoritettiin tutkimuksia asykloviirin vaikutuksen arvioimiseksi in vitro ihmisen lymfosyyttien toimintaan. Blastogeneesiä estäviä vaikutuksia havaittiin vain määrityksissä, joissa tutkittiin tehokkaiden mitogeenien, fytohemagglutiniinin (PHA) ja konkanavaliini A:n (Con A) huippupitoisuuksia, ja vain yli 50 µg/ml (222 µM) lääkeainepitoisuuksilla, ja monilialla ja monilialla oli paljon pienempiä vaikutuksia. tetanustoksoidiantigeenit, joissa blastogeeninen vaste on tyypillisesti vähemmän voimakas. Vaikutus sytotoksisuuteen tai LIF-tuotantoon oli hyvin vähäinen paitsi pitoisuuksilla 200 μg/ml (890 μM), joissa on jo osoitettu olevan suora sytotoksinen vaikutus. Nämä inhiboivat pitoisuudet ovat paljon suuremmat kuin kliiniseen käyttöön valituilla annoksilla odotetut tasot ja yli 1 000 kertaa korkeammat kuin pitoisuus, joka vaaditaan herpesviruksen lisääntymisen estämiseen in vitro.
Asykloviirin vaikutus ihmissoluihin mitattiin. Konsentraatio 11,2 - 22,5 μg/ml (50-100 μM) estää fibroblastien jakautumista vaihtelevassa määrin, riippuen koesuunnitelmasta ja yksikerroksen konfluenssista. Tämän vaikutuksen suuruus oli pienempi kuin adeniiniarabinosidin tai ihmisen leukosyyttiinterferonin aiheuttama, kun näitä kolmea viruslääkettä verrattiin kliinisesti merkittävillä pitoisuuksilla. Asykloviiri esti myös PHA:n tai kolmen erilaisen herpesvirusantigeenin stimuloimien perifeerisen veren mononukleaarisolujen tymidiinin liittymistä. Näillä soluilla havaittiin lineaarinen annos-vastekäyrä, ja 22,5 µg/ml (100 µM) asykloviiri esti niiden lisääntymistä 50 %. T-solujen proliferaatiota estettiin ilman ilmeistä vaikutusta lymfokiinien vapautumiseen tai monosyyttien toimintaan.
On myös mainittava, että tässä yhteenvedossa aiemmin käsitellyissä yksityiskohtaisissa subkroonisissa ja kroonisissa eläinkokeissa ei ollut todisteita haitallisista vaikutuksista immuunijärjestelmään paitsi liian suurilla annoksilla (50-100 mg/kg bid) koirilla, joilla oli huomattavaa lymfoidista hypoplasiaa. tapahtui.
VIITTEET
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et ai. Vesirokon asykloviirihoito muuten terveillä lapsilla. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et ai. Vesirokon asykloviirihoito muuten terveillä nuorilla. Yhteistyöryhmä Acyclovir Varicella Study Group. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Viruslääkkeet: asykloviiri, kliinisen farmakologian viimeaikaisissa edistysaskeleissa. Turner P, Shand DG (toim.) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Virusresistenssi kliinisessä käytännössä: yhteenveto viiden vuoden kokemuksesta asykloviirista. Farmakologiset ja kliiniset lähestymistavat herpesviruksiin ja viruskemoterapiaan, Aiso, Japani, 10.-13. syyskuuta 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Virusresistenssi, kliininen kokemus. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Virusresistenssi kliinisessä käytännössä: yhteenveto viiden vuoden kokemuksesta asykloviirista. Proceedings of the International Symposium on Pharmacological and Clinical Approches to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Asykloviirin vaikutus yhdessä muiden antiherpeettisten aineiden kanssa varicella zoster -virukseen in vitro. Am J Med 1982; 73(1A):54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Laskimonsisäisen asykloviirin usean annoksen farmakokinetiikka potilailla, jotka saavat jatkuvaa ambulatorista peritoneaalidialyysihoitoa. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et ai. Genitaaliherpes simplex -virusinfektion ensimmäisten jaksojen hoito suun kautta otettavalla asykloviirilla. Satunnaistettu kaksoissokkoutettu kontrolloitu tutkimus normaaleilla koehenkilöillä. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C et ai. Resistentin Herpes simplex -viruksen eristäminen ja karakterisointi asykloviirihoidon jälkeen. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Asikloviiriresistenttien ja -herkkien kliinisten herpes simplex -virusisolaattien karakterisointi immuunipuutteisesta potilaasta. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Varicella-Zoster-virus ei muutu resistentiksi asykloviirille hoidon aikana. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. Uuden antiviraalisen aineen, 9-(2-hydroksietoksimetyyli)guaniinin (asykloguanosiinin) aktiivisuus in vitro herpesvirusta vastaan. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Herpes simplex -virusisolaattien herkkyyden seuranta asykloviiria saavilta potilailta. J Antimicrob Chemother 1986; 18 Liite B:103-112.
15. Collins P. Viruksen herkkyys asykloviirin käyttöönoton jälkeen. Am J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Herpes simplex -viruksen DNA-polymeraasimutantin karakterisointi vakavasti immuunipuutteisesta potilaasta, joka saa asykloviiria. J Gen Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Ihmisen infektioista eristettyjen herpesvirusten kasvun esto asykloguanosiinilla. Antimicrob Agents Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistenssi herpes simplex -viruksen antiviraalisille lääkkeille, jotka on eristetty asykloviirilla hoidetusta potilaasta. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Herpes simplex -viruksen nukleosidianalogin estäjille vastustuskyvyn mekanismit. 6th Int Congr Virol 1984; (Abstract #W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF et ai. Herpes-lääkkeiden vertaileva tehokkuus herpes simplex -viruksen eri kantoja vastaan. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Herpeslääkkeiden vertaileva tehokkuus eri solulinjoissa. Antimicrob Agents Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Virusresistenssi kliinisessä käytännössä. J Antimicrob Chemother 1983; 12 Liite B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et ai. Kaksoissokkoutettu, lumekontrolloitu tutkimus kroonisesti annetun oraalisen asykloviirin vaikutuksesta siittiöiden tuotantoon miehillä, joilla on usein toistuva sukupuolielinten herpes. J Infect Dis 1988 maaliskuu; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et ai. Kaksoissokkotutkimus suun kautta otettavasta asykloviiristä sukuelinten herpes simplex -virusinfektion uusiutumisen estämiseksi. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et ai. Kontrolloitu asykloviiritutkimus vesirokkoa varten normaaleille lapsille. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S etal. HSV-2-kliinisen isolaatin karakterisointi, joka sisältää ACV-resistentin mutantin, joka tuottaa tymidiinikinaasia, jolla on muuttunut substraattispesifisyys. Ninth Int Herpesvirus Workshop, Seattle, Washington, 24.-29. elokuuta 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et ai. Herpes simplex -viruksen tyypin 2 kliininen isolaatti, joka indusoi tymidiinikinaasia, jonka substraattispesifisyys on muuttunut. Antimicrob Agents Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex -virus, joka on resistentti asykloviirille. Tutkimus korkea-asteen hoitokeskuksessa. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et ai. Foskarnet-hoito vakavien asykloviiriresistenttien herpes simplex -viruksen tyypin 2 infektioiden hoitoon potilailla, joilla on hankinnainen immuunikato-oireyhtymä (AIDS). Hallitsematon oikeudenkäynti. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et ai. Asikloviiriresistentti herpes simplex -virusinfektiot potilailla, joilla on hankittu immuunikato-oireyhtymä. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Herpes simplex -viruksen asykloviiriresistenttien mutanttien eristäminen ja karakterisointi. J Gen Virol 1980; 49(1):115-124.
32. Kenttä HJ. Huumeiden aiheuttaman virusresistenssin ongelma julkaisussa Antiviral Therapy ongelmat. Stuart-Harris CH, Oxford J (toim.) Academic Press, Lontoo 1983.
33. Fyfe K. Genitaaliherpesen uusiutumismallit yli 5 vuotta kestäneen kroonisen asykloviirisuppression lopettamisen jälkeen. VIII Int Conf AIDS/III Std Wrld Cong 1992; (B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et ai. Herpes zoster -hoito suun kautta otettavalla asykloviirilla. Am J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et ai. Asikloviiriresistentti varicella zoster -virusinfektio kroonisen oraalisen asykloviirihoidon jälkeen potilailla, joilla on hankinnainen immuunikato-oireyhtymä (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et ai. Pitkäaikainen jatkuva asykloviirihoito normaaleille aikuisille, joilla on usein toistuva genitaaliherpes simplex -virusinfektio. Acyclovir-tutkimusryhmä. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Hemodialyysin vaikutus asykloviirin farmakokinetiikkaan potilailla, joilla on krooninen munuaisten vajaatoiminta. Am J Med 1982; 73(1A):202-204.
38. Kurtz T. Usein toistuvan genitaaliherpesen pitkäaikaisen suppressiivisen sykloviirihoidon turvallisuus ja tehokkuus: vuoden 5 tulokset. 30th Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et ai. Munuaisten vajaatoiminnan vaikutus asykloviirin farmakokinetiikkaan. Am J Med 1982; 73(1A):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Odottamaton asykloviirin kertyminen äidinmaitoon, kun arvioidaan imeväisten altistumista. Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Toistuva sukupuolielinten herpes ja estävä oraalinen asykloviirihoito. Kliinisen lopputuloksen ja in vitro -lääkeherkkyyden välinen suhde. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. HSV-sukupuolielinten herkkyys oraalisen asykloviirin jälkeen. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10.10.1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A et ai. Kaksoissokkoutettu, lumekontrolloitu tutkimus, jossa verrataan pitkäaikaista suppressiivisuutta lyhytaikaiseen oraaliseen asykloviirihoitoon toistuvan genitaaliherpesen hoidossa. Am J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack CD, Barry DW. Herpes simplex -viruksen kliinisten isolaattien asykloviirin herkkyysspektri. Am J Med 1982; 73(1A):376-379.
45. McLaren C, Ellis MN, Hunter GA. Kolorimetrinen määritys herpes simplex -virusten herkkyyden mittaamiseksi antiviraalisille aineille. Antiviral Res 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In vitro -herkkyys asykloviirille asykloviirihoitoa saaneiden potilaiden genitaaliherpes simplex -viruksissa. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et ai. Kaksoissokkoutettu lumekontrolloitu koe suun kautta otettavasta asykloviiristä ensimmäisen jakson genitaaliherpes simplex -virusinfektiossa. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et ai. Usein toistuvan genitaaliherpes simplex -virusinfektion pitkäaikainen asykloviiri-suppressio. Monikeskuskaksoissokkotutkimus. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et ai. Pitkäaikainen jatkuva vs. ajoittainen oraalinen asykloviirihoito normaaleille aikuisille, joilla on usein toistuva genitaaliherpes simplex -virusinfektio. Am J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Acyclovir ihmisen rintamaidossa. Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et ai. Ennaltaehkäisevä oraalinen asykloviiri toistuvassa genitaaliherpeksessä. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Suun kautta otettava asykloviiri herpes zosterin hoidossa yleisessä käytännössä. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Sukuelinten herpesvirusinfektion sytohistopatologian suhde kohdunkaulan anaplasiaan. Cancer Res 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et ai. Suun kautta otettavan asykloviirin tehokkuus alkuperäisen ja toistuvan sukupuolielinten herpesen hoidossa. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. Herpesviruksen in vitro asykloviiriherkkyys, jonka potilaat saavat suppressiivista oraalista hoitoa. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8. - 10. lokakuuta 1984; (Abstract #1015).
56. O'Brien JJ, Campoli-Richards DM. Acyclovir. Päivitetty katsaus sen antiviraalisesta vaikutuksesta, farmakokineettisistä ominaisuuksista ja terapeuttisesta tehosta. Drugs 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N et ai. Jatkuva varicella-zoster-infektio, joka liittyy asykloviiriresistenssiin lapsella, jolla on AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Acyclovir-resistentti herpes simplex -virusinfektio, joka johtuu muuttuneesta DNA-polymeraasista. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Kliinisissä isolaateissa on Herpes simplex -viruksen variantteja, jotka rajoittuvat korkeisiin asykloviiripitoisuuksiin. Antimicrob Agents Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Varicella-zoster-viruksen rokotekantojen herkkyys antiviraalisille yhdisteille. Antimicrob Agents Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et ai. Toistuvien genitaaliherpes simplex -infektioiden hoito suun kautta otettavalla asykloviirilla. Kontrolloitu koe. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Asykloviirin farmakokinetiikka potilaalla, joka saa jatkuvaa ambulatorista peritoneaalidialyysihoitoa. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et ai. Asikloviiriresistentin herpes simplex -viruksen tyypin 1 patogeenisyys immuunipuutteisesta lapsesta. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Suun kautta otettava asykloviiri estämään toistuvia herpes simplex -virusinfektioita immuunipuutospotilailla. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et ai. Usein toistuvan genitaaliherpeksen estäminen. Plasebokontrolloitu kaksoissokkotutkimus suun kautta otettavasta asykloviiristä. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et ai. Usein toistuvan genitaaliherpeksen asykloviiri-suppressio. Teho ja vähenevä tarve peräkkäisten hoitovuosien aikana. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Krooninen herpeettinen infektio immuunipuutteellisella potilaalla: raportti tapauksesta. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Laskimonsisäinen asykloviiri limakalvon herpes simplex -virusinfektion hoitoon luuytimensiirron jälkeen: kaksoissokkotutkimus. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Asykloviiriresistenttien herpes simplex -viruksen esiintyvyys ja merkitys, jotka on eristetty luuytimensiirtopotilaista, jotka saavat useita asykloviirihoitokuureja. J Infect Dis 1983; 148(6):1077-1082.
POTILASTIEDOT
Potilaita neuvotaan neuvottelemaan lääkärinsä kanssa, jos heillä on vakavia tai vaikeita haittavaikutuksia, he tulevat raskaaksi tai aikovat tulla raskaaksi, he aikovat imettää ottaessaan suun kautta annettavaa ZOVIRAXia (asikloviiri) tai heillä on muita kysymyksiä.
Potilaita tulee neuvoa ylläpitämään riittävää nesteytystä.
