Sustiva 200mg, 600mg Efavirenz Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Sustiva 600mg on ja miten sitä käytetään?
Sustiva on reseptilääke, jota käytetään HIV-infektion oireiden hoitoon. Sustivaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Sustiva kuuluu lääkeryhmään nimeltä HIV, NNRTI:t.
Ei tiedetä, onko Sustiva turvallinen ja tehokas alle 3 kuukauden ikäisille lapsille.
Mitkä ovat Sustivan mahdolliset sivuvaikutukset?
Sustiva voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- kuume,
- kipeä kurkku,
- palavat silmät,
- ihokipu,
- punainen tai violetti ihottuma, johon liittyy rakkuloita ja hilseilyä,
- kohtaus,
- hallusinaatiot,
- keskittymisvaikeuksia,
- puhe- tai liikkumisvaikeudet (voi ilmaantua kuukausia tai vuosia lääkkeen aloittamisen jälkeen),
- huimaus,
- uneliaisuus,
- hämmennystä,
- keskittymisvaikeuksia,
- outoja unia,
- unettomuus,
- ongelmia puheen kanssa,
- vaikeuksia tasapainossa tai lihasten liikkeessä,
- ahdistus,
- vainoharhaisuus,
- epätavallinen käytös,
- surullinen tai toivoton olo,
- itsemurha-ajatuksia,
- pahoinvointi,
- vatsakipu,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- yöhikoilut,
- turvonneet rauhaset,
- huuliherpes,
- yskä,
- hengityksen vinkuminen,
- ripuli,
- painonpudotus,
- nielemisvaikeudet,
- ongelmia tasapainossa tai silmien liikkeessä,
- heikkous,
- piikikäs tunne,
- turvotus niskassa tai kurkussa (kilpirauhasen suureneminen),
- kuukautiskierron muutokset ja
- impotenssi
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Sustivan yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- oksentelua,
- huimaus,
- uneliaisuus,
- keskittymisvaikeuksia,
- ihottuma,
- päänsärky,
- väsymys,
- unihäiriöt (unettomuus),
- outoja unia ja
- kehon rasvan muodon tai sijainnin muutokset (erityisesti käsivarsissa, jaloissa, kasvoissa, kaulassa, rinnoissa ja vyötäröllä)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Sustivan mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
SUSTIVA® (efavirentsi) on HIV-1-spesifinen, ei-nukleosidinen käänteiskopioijaentsyymin estäjä (NNRTI). Efavirentsi kuvataan kemiallisesti nimellä (S)-6-kloori-4-(syklopropyylietynyyli)-1,4-dihydro4-(trifluorimetyyli)-2H-3,1-bentsoksatsin-2-oni. Sen empiirinen kaava on C14H9ClF3NO2 ja sen rakennekaava on:
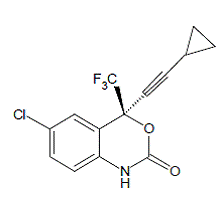
Efavirentsi on valkoinen tai hieman vaaleanpunainen kiteinen jauhe, jonka molekyylimassa on 315,68. Se on käytännössä veteen liukenematon (
Kapselit
SUSTIVAa on saatavana suun kautta annettavina kapseleina, jotka sisältävät joko 50 mg tai 200 mg efavirentsia ja seuraavia inaktiivisia aineosia: laktoosimonohydraatti, magnesiumstearaatti, natriumlauryylisulfaatti ja natriumtärkkelysglykolaatti. Kapselin kuori sisältää seuraavia inaktiivisia aineosia ja väriaineita: gelatiini, natriumlauryylisulfaatti, titaanidioksidi ja/tai keltainen rautaoksidi. Kapselin kuoret voivat sisältää myös piidioksidia. Kapselit on painettu musteella, joka sisältää karmiininsinistä 40, FD&C Blue No. 2:ta ja titaanidioksidia.
Tabletit
SUSTIVA 600 mg on saatavana kalvopäällysteisinä tabletteina suun kautta annettavina tabletteina, jotka sisältävät 600 mg efavirentsia ja seuraavia inaktiivisia aineita: kroskarmelloosinatrium, hydroksipropyyliselluloosa, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa ja natriumlauryylisulfaatti. Kalvopinnoite sisältää Opadry Yellow ja Opadry Clear. Tabletit on kiillotettu karnaubavahalla ja painettu violetilla musteella, Opacode WB.
INDIKAATIOT
SUSTIVA® (efavirentsi) yhdessä muiden antiretroviraalisten aineiden kanssa on tarkoitettu ihmisen immuunikatoviruksen tyypin 1 (HIV-1) infektion hoitoon aikuisilla ja lapsipotilailla, jotka ovat vähintään 3 kuukauden ikäisiä ja painavat vähintään 3,5 kg.
ANNOSTELU JA HALLINNOINTI
Maksan toiminta
Seuraa maksan toimintaa ennen SUSTIVA-hoidon aloittamista ja sen aikana [ks VAROITUKSET JA VAROTOIMET ]. SUSTIVA 600 mg:aa ei suositella potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta (Child Pugh B tai C) [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Aikuiset
SUSTIVAn (efavirentsin) suositeltu annos on 600 mg suun kautta kerran vuorokaudessa yhdessä proteaasi-inhibiittorin ja/tai nukleosidianalogien käänteiskopioijaentsyymin estäjien (NRTI) kanssa. On suositeltavaa, että SUSTIVA otetaan tyhjään mahaan, mieluiten nukkumaan mennessä. Suuremmat efavirentsipitoisuudet, joita havaitaan SUSTIVA 600 mg:n annon jälkeen ruoan kanssa, voivat lisätä haittavaikutusten esiintymistiheyttä [ks. KLIININEN FARMAKOLOGIA ]. Annostelu nukkumaan mennessä voi parantaa hermoston oireiden siedettävyyttä [katso VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET , ja POTILASTIEDOT ]. SUSTIVA-kapselit tai tabletit tulee niellä koskemattomina nesteen kanssa. Potilaille, jotka eivät voi niellä kapseleita tai tabletteja, suositellaan kapselin sprinkle-antotapaa [katso Kapselin sprinkle Antotapa ].
Samanaikainen antiretroviraalinen hoito
SUSTIVA on annettava yhdessä muiden antiretroviraalisten lääkkeiden kanssa [katso INDIKAATIOT , VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
Annoksen säätö
Jos SUSTIVA 200 mg annetaan samanaikaisesti vorikonatsolin kanssa, vorikonatsolin ylläpitoannos tulee suurentaa 400 mg:aan 12 tunnin välein ja SUSTIVA 200 mg:n annos pienentää 300 mg:aan kerran vuorokaudessa käyttämällä kapselimuotoa (yksi 200 mg ja kaksi 50 mg:n kapselia tai kuusi 50 mg:n kapselia). mg kapselit). SUSTIVA 600 mg tabletteja ei saa rikkoa. [katso HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA .]
Jos SUSTIVAa annetaan samanaikaisesti rifampiinin kanssa potilaille, jotka painavat 50 kg tai enemmän, SUSTIVA-annoksen nostamista 200 mg:aan 800 mg:aan kerran vuorokaudessa suositellaan [ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Pediatriset potilaat
On suositeltavaa, että SUSTIVA 600 mg otetaan tyhjään mahaan, mieluiten nukkumaan mennessä. Taulukossa 1 kuvataan suositeltu SUSTIVA-annos vähintään 3 kuukauden ikäisille ja 3,5–40 kg painaville lapsipotilaille [ks. KLIININEN FARMAKOLOGIA ]. Suositeltu SUSTIVA-annos lapsipotilaille, jotka painavat 40 kg tai enemmän, on 600 mg kerran vuorokaudessa. Lapsipotilaille, jotka eivät voi niellä kapseleita, kapselin sisältö voidaan antaa pienen ruoan tai äidinmaidonkorvikkeen kanssa käyttämällä kapselin sprinkle-antotapaa [ks. Kapselin sprinkle Antotapa ].
Kapselin sprinkle Antotapa
Vähintään 3 kuukauden ikäisille ja vähintään 3,5 kg painaville lapsipotilaille sekä aikuisille, jotka eivät pysty nielemään kapseleita tai tabletteja, kapselin sisältö voidaan antaa pienen määrän (1-2 teelusikallista) ruoan kanssa. Äidinmaidonkorvikkeen käyttöä sekoittamiseen tulisi harkita vain niille nuorille imeväisille, jotka eivät voi luotettavasti kuluttaa kiinteää ruokaa. Potilaita ja hoitajia tulee neuvoa avaamaan kapseli varovasti, jotta kapselin sisältö ei roisku tai leviä ilmaan. Kapseli tulee pitää vaakasuorassa pienen astian päällä ja kiertämällä sitä varovasti avataksesi. Potilaille, jotka sietävät kiinteitä ruokia, koko kapselin sisältö tulee sekoittaa varovasti pienessä astiassa ikään sopivan pehmeän ruoan, kuten omenasoseen, viinirypälehyytelön tai jogurtin, kanssa. Nuorille imeväisille, jotka saavat kapselin ja äidinmaidonkorvikkeen seosta, koko kapselin sisältö sekoitetaan varovasti pienessä astiassa 2 teelusikalliseen huoneenlämpöistä äidinmaidonkorviketta sekoittaen varovasti pienellä lusikalla ja sekoitetaan sitten seos 10 litraan. ml:n oraalinen annosruisku antoa varten. SUSTIVA-ruoka- tai kaavaseoksen antamisen jälkeen tyhjään sekoitusastiaan on lisättävä pieni lisämäärä (noin 2 teelusikallista) ruokaa tai korviketta, sekoitettava jäljellä olevien SUSTIVA-jäämien hajottamiseksi ja annettava potilaalle. SUSTIVA-ruoka- tai kaavaseos tulee antaa 30 minuutin kuluessa sekoittamisesta. Ylimääräistä ruokaa ei saa syödä 2 tuntiin SUSTIVAn annon jälkeen.
Lisää potilasohjeita kapselin sprinkle-antomenetelmästä on FDA:n hyväksymässä potilasmerkinnässä (ks. POTILASTIEDOT ja KÄYTTÖOHJEET ).
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Kapselit
200 mg:n kapselit ovat kullanvärisiä, joiden kääntöpuolelle on painettu ”SUSTIVA” runkoon ja merkintä ”200 mg” kanteen.
50 mg:n kapselit ovat kullanvärisiä ja valkoisia, kullanväriseen kanteen on painettu ”SUSTIVA” ja valkoiseen runkoon on painettu ”50 mg”.
Tabletit
600 mg tabletit ovat keltaisia, kapselin muotoisia, kalvopäällysteisiä tabletteja, joiden molemmille puolille on painettu ”SUSTIVA”.
Varastointi ja käsittely
Kapselit
SUSTIVA® (efavirentsi) -kapselit ovat saatavilla seuraavasti:
200 mg:n kapselit ovat kullanvärisiä, joiden kääntöpuolelle on painettu ”SUSTIVA” runkoon ja merkintä ”200 mg” kanteen.
Pullot 90 - NDC 0056-0474-92
50 mg:n kapselit ovat kullanvärisiä ja valkoisia, kullanväriseen kanteen on painettu ”SUSTIVA” ja valkoiseen runkoon on painettu ”50 mg”.
Pullot 30 - NDC 0056-0470-30
Tabletit
SUSTIVA® (efavirentsi) -tabletit ovat saatavilla seuraavasti:
600 mg:n tabletit ovat keltaisia, kapselinmuotoisia, kalvopäällysteisiä tabletteja, joiden molemmille puolille on painettu ”SUSTIVA”.
Pullot 30 - NDC 0056-0510-30
Varastointi
SUSTIVA 600 mg:n kapselit ja SUSTIVA-tabletit tulee säilyttää 25 °C:ssa (77 °F); retket sallitaan 15°C-30°C (59°F-86°F) [katso USP Controlled Room Temperature].
Jakelija: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Tarkistettu: lokakuuta 2020
SIVUVAIKUTUKSET
Merkittävimmät SUSTIVAlla hoidetuilla potilailla havaitut haittavaikutukset ovat:
- psykiatriset oireet [katso VAROITUKSET JA VAROTOIMET ],
- hermoston oireet [katso VAROITUKSET JA VAROTOIMET ],
- ihottuma [katso VAROITUKSET JA VAROTOIMET ].
- maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, raportoituja haittavaikutusten määrää ei voida suoraan verrata muiden kliinisten tutkimusten osuuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
Haittavaikutukset aikuisilla
Yleisimmät (> 5 % kummassakin efavirentsihoitoryhmässä) vähintään kohtalaisen vakavia haittavaikutuksia tutkimuksessa 006 SUSTIVA 200 mg yhdistelmänä tsidovudiinin/lamivudiinin tai indinaviirin kanssa saaneilla potilailla olivat ihottuma, huimaus, pahoinvointi, päänsärky, väsymys, unettomuus, ja oksentelua.
Valitut keskivaikeat tai vaikeat kliiniset haittavaikutukset, joita havaittiin ≥ 2 %:lla SUSTIVAlla hoidetuista potilaista kahdessa kontrolloidussa kliinisessä tutkimuksessa, on esitetty taulukossa 2.
Haimatulehdusta on raportoitu, vaikka syy-yhteyttä efavirentsiin ei ole osoitettu. Oireetonta seerumin amylaasipitoisuuden nousua havaittiin merkittävästi suuremmalla määrällä potilaita, jotka saivat 600 mg efavirentsia kuin kontrollipotilailla (ks. Laboratoriohäiriöt ).
Hermoston oireet
Taulukossa 3 on lueteltu 1008 potilaalle, joita hoidettiin SUSTIVAa sisältävillä hoito-ohjelmilla, ja 635 potilaasta, joita hoidettiin kontrolli-ohjelmalla kontrolloiduissa tutkimuksissa, eri vaikeusasteisten oireiden esiintymistiheydet ja hoidon keskeytystiheydet yhden tai useamman seuraavista hermosto-oireista: huimaus, unettomuus, keskittymiskyvyn heikkeneminen, uneliaisuus, epänormaalit unet, euforia, sekavuus, kiihtyneisyys, muistinmenetys, hallusinaatiot, stupor, epänormaali ajattelu ja depersonalisaatio [ks. VAROITUKSET JA VAROTOIMET ]. Spesifisten keskus- ja ääreishermoston oireiden esiintymistiheydet on esitetty taulukossa 2.
Psykiatriset oireet
SUSTIVAlla hoidetuilla potilailla on raportoitu vakavia psyykkisiä haittavaikutuksia. Kontrolloiduissa tutkimuksissa psykiatriset oireet, joita havaittiin yli 2 %:lla potilaista, joita hoidettiin SUSTIVA 600 mg:lla tai vertailuhoidolla, olivat masennus (19 %, 16 %), ahdistuneisuus (13 %, 9 %) ja hermostuneisuus (7 %). , 2 %).
Ihottuma
Kontrolloiduissa kliinisissä tutkimuksissa ihottuman esiintymistiheys (kaikki asteet, syy-yhteydestä riippumatta) oli 26 % 1008 aikuisesta, joita hoidettiin 200 mg SUSTIVAa sisältävillä hoito-ohjelmilla, ja 17 % 635 aikuisella, joita hoidettiin kontrolli-ohjelmalla. Useimmat ilmoitukset ihottumasta olivat lieviä tai kohtalaisia. Asteen 3 ihottuman esiintymistiheys oli 0,8 % SUSTIVAlla hoidetuilla potilailla ja 0,3 % kontrolliryhmillä, ja asteen 4 ihottuman esiintymistiheys oli 0,1 % SUSTIVAlla ja 0 kontrolliryhmillä. Ihottuman vuoksi hoidon keskeyttämisprosentti oli 1,7 % SUSTIVA-hoitoa saaneilla potilailla ja 0,3 % kontrolliryhmillä [ks. VAROITUKSET JA VAROTOIMET ].
Kokemukset SUSTIVAsta potilailla, jotka lopettivat muiden NNRTI-luokan antiretroviraalisten aineiden käytön, ovat rajallisia. SUSTIVAlla on hoidettu yhdeksäntoista potilasta, jotka lopettivat nevirapiinihoidon ihottuman vuoksi. Yhdeksälle näistä potilaista kehittyi lievä tai keskivaikea ihottuma SUSTIVA-hoidon aikana, ja kaksi näistä potilaista keskeytti hoidon ihottuman vuoksi.
Laboratoriohäiriöt
Valitut asteen 3–4 laboratorioarvojen poikkeavuudet, joita raportoitiin ≥ 2 %:lla SUSTIVAlla hoidetuista potilaista kahdessa kliinisessä tutkimuksessa, on esitetty taulukossa 4.
B- tai C-hepatiittitartunnan saaneet potilaat
Maksan toimintakokeita tulee seurata potilailla, joilla on ollut hepatiitti B ja/tai C. Pitkän aikavälin tutkimusaineistossa tutkimuksesta 006 137 potilasta sai SUSTIVAa sisältäviä hoito-ohjelmia (hoidon mediaanikesto 68 viikkoa) ja 84 potilasta. kontrolli-ohjelmalla (mediaanikesto, 56 viikkoa) olivat seropositiivisia hepatiitti B:n (pinta-antigeenipositiivinen) ja/tai C:n (hepatiitti C-vasta-ainepositiivinen) seulonnassa. Näistä koinfektoituneista potilaista ASAT-arvon nousu yli viisinkertaiseksi ULN-arvoon kehittyi 13 %:lla SUSTIVA-haarojen potilaista ja 7 %:lla kontrolliryhmän potilaista, ja ALAT-arvon nousu yli viisinkertaiseksi ULN-arvoon kehittyi 20 %:lla potilaista. SUSTIVA-haaroissa ja 7 %:lla vertailuryhmän potilaista. Samanaikaisesti tartunnan saaneista potilaista 3 % SUSTIVAa sisältävillä hoito-ohjelmilla hoidetuista ja 2 % kontrolliryhmästä keskeytti tutkimuksen maksan tai sappijärjestelmän häiriöiden vuoksi [ks. VAROITUKSET JA VAROTOIMET ].
Lipidit
Kokonaiskolesterolin 10-20 % nousua lähtötilanteesta on havaittu joillakin SUSTIVAa saavilla ei-tartunnan saaneilla vapaaehtoisilla. Potilailla, joita hoidettiin SUSTIVAlla + tsidovudiinilla + lamivudiinilla, havaittiin noin 20 %:n ja HDL-kolesterolin nousu lähtötasosta noin 20 % ja HDL 25 %. Potilailla, joita hoidettiin SUSTIVAlla + indinaviiriga, havaittiin noin 40 % ja HDL:n nousu lähtötasosta noin 40 % ja HDL 35 %. Kokonaiskolesterolitasot paaston aikana olivat ≥ 240 mg/dl ja ≥ 300 mg/dl 34 %:lla ja 9 %:lla potilaista, joita hoidettiin SUSTIVAlla + tsidovudiinilla + lamivudiinilla; 54 % ja 20 % potilaista, joita hoidettiin SUSTIVAlla + indinaviiriga; ja 28 % ja 4 % potilaista, joita hoidettiin indinaviiri + tsidovudiini + lamivudiini. SUSTIVA 600 mg:n vaikutuksia triglyserideihin ja LDL:ään tässä tutkimuksessa ei kuvattu hyvin, koska näytteet otettiin ei-paastoneilta potilailta. Näiden löydösten kliinistä merkitystä ei tunneta [katso VAROITUKSET JA VAROTOIMET ].
Haittavaikutukset lapsipotilailla
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, raportoituja haittavaikutusten määrää ei voida suoraan verrata muiden kliinisten tutkimusten osuuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
Haittavaikutusten arviointi perustuu kolmeen kliiniseen tutkimukseen 182 HIV-1-tartunnan saaneella lapsipotilaalla (3 kk - 21-vuotiaat), jotka saivat SUSTIVAa 200 mg yhdessä muiden antiretroviraalisten aineiden kanssa keskimäärin 123 viikon ajan. Kolmessa tutkimuksessa havaitut haittavaikutukset olivat samankaltaisia kuin aikuisilla tehdyissä kliinisissä tutkimuksissa havaitut, paitsi että ihottuma oli yleisempää lapsipotilailla (32 % kaikista asteista syy-yhteydestä riippumatta) ja useammin korkealaatuisempia (eli vakavampia). Kahdella (1,1 %) lapsipotilaalla oli asteen 3 ihottumaa (yhtenäinen ihottuma kuumeen kanssa, yleistynyt ihottuma) ja neljällä (2,2 %) lapsipotilaalla oli asteen 4 ihottumaa (kaikki erythema multiforme). Viisi lapsipotilasta (2,7 %) keskeytti tutkimuksen ihottuman vuoksi [katso VAROITUKSET JA VAROTOIMET ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu SUSTIVAn hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti tuntemattoman kokoiselta populaatiolta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkealtistukseen.
Keho kokonaisuutena: allergiset reaktiot, voimattomuus, kehon rasvan uudelleenjakautuminen/kertyminen [katso VAROITUKSET JA VAROTOIMET ]
Keskus- ja ääreishermosto: epänormaali koordinaatio, ataksia, enkefalopatia, pikkuaivojen koordinaatio- ja tasapainohäiriöt, kouristukset, hypoestesia, parestesia, neuropatia, vapina, huimaus
Endokriiniset: gynekomastia
Ruoansulatuskanava: ummetus, imeytymishäiriö
Sydän: punoitus, sydämentykytys
Maksa ja sappijärjestelmä: maksaentsyymiarvojen nousu, maksan vajaatoiminta, hepatiitti.
Aineenvaihdunta ja ravitsemus: hyperkolesterolemia, hypertriglyseridemia
Tuki- ja liikuntaelimistö: nivelkipu, myalgia, myopatia
Psykiatrinen: aggressiiviset reaktiot, kiihtyneisyys, harhaluulot, emotionaalinen labilisuus, mania, neuroosi, vainoharhaisuus, psykoosi, itsemurha, katatonia
Hengitys: hengenahdistus
Iho ja lisäkkeet: erythema multiforme, fotoallerginen dermatiitti, Stevens-Johnsonin oireyhtymä
Erityiset aistit: epänormaali näkö, tinnitus
HUUMEIDEN VUOROVAIKUTUKSET
SUSTIVA voi vaikuttaa muihin lääkkeisiin
Efavirentsin on osoitettu in vivo indusoivan CYP3A:ta ja CYP2B6:ta. Muiden CYP3A:n tai CYP2B6:n substraatteja sisältävien yhdisteiden plasmapitoisuudet voivat laskea, kun niitä annetaan samanaikaisesti SUSTIVAn kanssa.
Muiden lääkkeiden mahdollisuus vaikuttaa SUSTIVAan
CYP3A-aktiivisuutta indusoivien lääkkeiden (esim. fenobarbitaali, rifampiini, rifabutiini) odotetaan lisäävän efavirentsin puhdistumaa, mikä johtaa plasman pitoisuuksien alenemiseen [ks. ANNOSTELU JA HALLINNOINTI ].
QT-aikaa pidentävät lääkkeet
SUSTIVA 600 mg:n ja QTc-aikaa pidentävien lääkkeiden mahdollisista farmakodynaamisista yhteisvaikutuksista on saatavilla vain vähän tietoa. QTc-ajan pidentymistä on havaittu efavirentsin käytön yhteydessä [ks KLIININEN FARMAKOLOGIA ]. Harkitse vaihtoehtoja SUSTIVA 600 mg:lle, kun sitä annetaan yhdessä sellaisen lääkkeen kanssa, jolla on tunnettu Torsade de Pointes -riski.
Vakiintuneet ja muut potentiaalisesti merkittävät huumeiden yhteisvaikutukset
Lääkeinteraktiot SUSTIVAn kanssa on esitetty yhteenvetona taulukossa 5. Farmakokineettiset tiedot, [ks. KLIININEN FARMAKOLOGIA ] Taulukot 7 ja 8. Tämä taulukko sisältää mahdollisesti merkittäviä vuorovaikutuksia, mutta se ei kata kaikkea.
Lääkkeet, joilla ei ole kliinisesti merkittäviä yhteisvaikutuksia SUSTIVAn kanssa
Annoksen muuttamista ei suositella, kun SUSTIVA 600 mg:aa annetaan seuraavien aineiden kanssa: alumiini/magnesiumhydroksidi-antasidit, atsitromysiini, setiritsiini, famotidiini, flukonatsoli, loratsepaami, nelfinaviiri, nukleosidikäänteiskopioijakopioijaentsyymin estäjät (abakaviiri, emtrisiinivuudrabiini, tenofovuudrabiini, tenofovuraksiini ), paroksetiini ja raltegraviiri.
Kannabinoiditestin vuorovaikutus
Efavirentsi ei sitoudu kannabinoidireseptoreihin. Vääriä positiivisia virtsan kannabinoiditestituloksia on raportoitu joissakin seulontamäärityksissä tartunnan saamattomilla ja HIV-tartunnan saaneilla henkilöillä, jotka saavat efavirentsia. Positiivisten kannabinoidien seulontatestien vahvistamista suositellaan erityisemmällä menetelmällä.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Huumeiden vuorovaikutukset
CYP3A:n substraatit, estäjät tai indusoijat voivat muuttaa efavirentsin pitoisuuksia plasmassa. Samoin efavirentsi voi muuttaa CYP3A:n tai CYP2B6:n kautta metaboloituvien lääkkeiden pitoisuuksia plasmassa. Efavirentsin merkittävin vaikutus vakaassa tilassa on CYP3A:n ja CYP2B6:n induktio [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
QTc-ajan pidentyminen
QTc-ajan pidentymistä on havaittu efavirentsin käytön yhteydessä [ks HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ]. Harkitse vaihtoehtoja SUSTIVA 600 mg:lle, kun sitä annetaan yhdessä sellaisen lääkkeen kanssa, jolla on tiedossa oleva Torsade de Pointes -riski, tai kun sitä annetaan potilaille, joilla on suurempi Torsade de Pointes -riski.
Resistanssi
SUSTIVA 200 mg:aa ei saa käyttää yksinään HIV-1-infektion hoitoon eikä sitä saa käyttää ainoana lääkkeenä epäonnistuneeseen hoito-ohjelmaan. Resistentti virus ilmaantuu nopeasti, kun efavirentsia annetaan monoterapiana. Uusien antiretroviraalisten aineiden valinnassa, joita käytetään yhdessä efavirentsin kanssa, tulee ottaa huomioon viruksen ristiresistenssin mahdollisuus.
Yhteishallinto vastaavien tuotteiden kanssa
SUSTIVAn ja ATRIPLAn (efavirentsi 600 mg/emtrisitabiini 200 mg/tenofoviiridisoproksiilifumaraatti 300 mg) samanaikaista antamista ei suositella, ellei annoksen muuttamista tarvita (esim. rifampiinin kanssa), koska efavirentsi on yksi sen vaikuttavista aineista.
Psykiatriset oireet
SUSTIVAlla hoidetuilla potilailla on raportoitu vakavia psyykkisiä haittavaikutuksia. Kontrolloiduissa tutkimuksissa, joihin osallistui 1008 potilasta, joita hoidettiin SUSTIVAa 600 mg sisältävillä hoito-ohjelmilla keskimäärin 2,1 vuoden ajan ja 635 potilaalla, joita hoidettiin kontrolli-ohjelmilla keskimäärin 1,5 vuoden ajan, tiettyjen vakavien psykiatristen tapahtumien esiintymistiheys (syy-yhteydestä riippumatta) potilailla, jotka saivat SUSTIVAa tai kontrolli-ohjelmat olivat vastaavasti vakava masennus (2,4 %, 0,9 %), itsemurha-ajatukset (0,7 %, 0,3 %), ei-kuolettavat itsemurhayritykset (0,5 %, 0), aggressiivinen käyttäytyminen (0,4 %, 0,5 %), vainoharhaiset reaktiot (0,4 %, 0,3 %) ja maaniset reaktiot (0,2 %, 0,3 %). Kun yllämainittujen kaltaisia psykiatrisia oireita yhdistettiin ja arvioitiin ryhmänä tutkimuksen 006 tietojen monitekijäanalyysissä, efavirentsihoitoon liittyi näiden valittujen psykiatristen oireiden esiintymisen lisääntyminen. Muita tekijöitä, jotka liittyivät näiden psykiatristen oireiden esiintymisen lisääntymiseen, olivat injektiohuumeiden käyttöhistoria, psykiatrinen historia ja psykiatristen lääkkeiden saaminen tutkimukseen tullessa; samanlaisia assosiaatioita havaittiin sekä SUSTIVA- että kontrolliryhmässä. Tutkimuksessa 006 uusia vakavia psykiatrisia oireita ilmaantui koko tutkimuksen ajan sekä SUSTIVA-hoitoa saaneilla että kontrollipotilailla. Yksi prosentti SUSTIVAlla hoidetuista potilaista keskeytti tai keskeytti hoidon yhden tai useamman näistä valituista psykiatrisista oireista johtuen. Markkinoille tulon jälkeen on myös satunnaisia raportteja itsemurhakuolemista, harhaluuloista ja psykoosin kaltaisesta käyttäytymisestä, vaikka näiden raporttien perusteella ei voida määrittää syy-yhteyttä SUSTIVAn käyttöön. Markkinoille tulon jälkeen on myös raportoitu katatoniatapauksia, jotka voivat liittyä lisääntyneeseen efavirentsialtistukseen. Potilaiden, joilla on vakavia psyykkisiä haittavaikutuksia, tulee hakeutua välittömästi lääkärinarviointiin arvioidakseen mahdollisuutta, että oireet voivat liittyä SUSTIVA-valmisteen käyttöön, ja jos näin on, onko hoidon jatkamisen riskit suurempia kuin hyödyt. [katso HAITTAVAIKUTUKSET .]
Hermoston oireet
Viisikymmentäkolme prosenttia (531/1008) potilaista, jotka saivat SUSTIVAa 600 mg kontrolloiduissa tutkimuksissa, ilmoitti keskushermosto-oireista (mitä tahansa astetta, syy-yhteydestä riippumatta) verrattuna 25 prosenttiin (156/635) kontrollihoitoa saaneista potilaista [ks. HAITTAVAIKUTUKSET ]. Näitä oireita olivat muun muassa huimaus (28,1 % 1008 potilaasta), unettomuus (16,3 %), keskittymiskyvyn heikkeneminen (8,3 %), uneliaisuus (7,0 %), epänormaalit unet (6,2 %) ja hallusinaatiot (1,2 %). %). Nämä oireet olivat vakavia 2,0 %:lla potilaista; ja 2,1 % potilaista keskeytti hoidon tämän seurauksena. Nämä oireet alkavat yleensä ensimmäisen tai toisen hoitopäivän aikana ja häviävät yleensä 2-4 ensimmäisen hoitoviikon jälkeen. Neljän viikon hoidon jälkeen hermostooireiden, joiden vakavuus oli vähintään kohtalainen, esiintyvyys vaihteli 5–9 %:lla potilailla, joita hoidettiin SUSTIVAa sisältävillä hoito-ohjelmilla, ja 3–5 %:lla kontrollihoitoa saaneilla potilailla. Potilaille tulee kertoa, että nämä yleiset oireet todennäköisesti paranevat hoidon jatkuessa eivätkä ne ennakoineet harvempien psykiatristen oireiden myöhempää ilmaantumista [ks. Psykiatriset oireet ]. Annostus nukkumaan mennessä voi parantaa näiden hermoston oireiden siedettävyyttä [katso ANNOSTELU JA HALLINNOINTI ].
Tutkimuksen 006 pitkän aikavälin tietojen analyysi (mediaaniseuranta 180 viikkoa, 102 viikkoa ja 76 viikkoa potilailla, joita hoidettiin SUSTIVAlla + tsidovudiini + lamivudiini, SUSTIVA + indinaviiri ja vastaavasti indinaviiri + tsidovudiini + lamivudiini) osoitti, että sen jälkeen. 24 viikon hoidon aikana uusien hermosto-oireiden ilmaantuvuus SUSTIVA-hoitoa saaneilla potilailla oli yleensä samanlainen kuin indinaviiria sisältävässä kontrolliryhmässä.
Myöhään alkavaa neurotoksisuutta, mukaan lukien ataksia ja enkefalopatia (tajunnan heikkeneminen, sekavuus, psykomotorinen hidastuminen, psykoosi, delirium), voi esiintyä kuukausia tai vuosia efavirentsihoidon aloittamisen jälkeen. Joitakin myöhään alkavia hermotoksisuustapahtumia on esiintynyt potilailla, joilla on CYP2B6:n geneettisiä polymorfismeja, jotka liittyvät kohonneisiin efavirentsipitoisuuksiin SUSTIVAn tavanomaisesta annoksesta huolimatta. Potilaat, joilla on vakavien neurologisten haittavaikutusten merkkejä ja oireita, tulee arvioida viipymättä, jotta voidaan arvioida mahdollisuus, että nämä tapahtumat voivat liittyä efavirentsin käyttöön ja onko SUSTIVA 600 mg -hoidon lopettaminen aiheellista.
SUSTIVA 600 mg:aa saavia potilaita tulee varoittaa mahdollisista additiivisista keskushermostovaikutuksista, kun SUSTIVA 200 mg:aa käytetään samanaikaisesti alkoholin tai psykoaktiivisten lääkkeiden kanssa.
Potilaiden, joilla on keskushermosto-oireita, kuten huimausta, keskittymiskyvyn heikkenemistä ja/tai uneliaisuutta, tulee välttää mahdollisesti vaarallisia tehtäviä, kuten autolla ajoa tai koneiden käyttöä.
Alkion ja sikiön myrkyllisyys
Efavirentsi voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle ensimmäisen raskauskolmanneksen aikana. Neuvo lisääntymiskykyisiä naisia, jotka saavat SUSTIVA 600 mg, välttämään raskautta. [katso Käyttö tietyissä populaatioissa .]
Ihottuma
Kontrolloiduissa kliinisissä tutkimuksissa 26 %:lla (266/1008) aikuispotilaista, joita hoidettiin 600 mg:lla SUSTIVAa, ilmeni uutta ihottumaa verrattuna 17 %:iin (111/635) kontrolliryhmissä [ks. HAITTAVAIKUTUKSET ]. Rakkuloitumiseen, kosteaan hilseilyyn tai haavaumiin liittyvää ihottumaa esiintyi 0,9 %:lla (9/1008) SUSTIVAlla hoidetuista potilaista. Asteen 4 ihottuman (esim. erythema multiforme, Stevens-Johnsonin oireyhtymä) ilmaantuvuus SUSTIVAlla hoidetuilla aikuispotilailla oli kaikissa tutkimuksissa ja laajennetussa tutkimuksessa 0,1 %. Ihottumat ovat yleensä lieviä tai keskivaikeita makulopapulaarisia ihottumia, joita esiintyy kahden ensimmäisen viikon aikana efavirentsihoidon aloittamisesta (mediaaniaika ihottuman ilmaantumiseen aikuisilla oli 11 päivää), ja useimmilla potilailla, jotka jatkavat efavirentsihoitoa, ihottuma häviää 1 kuluessa. kuukausi (mediaanikesto, 16 päivää). Aikuisten kliinisissä tutkimuksissa ihottuman keskeyttämisprosentti oli 1,7 % (17/1008).
Ihottuma raportoitiin 59:llä 182:sta SUSTIVA-hoitoa saaneesta lapsipotilaasta (32 %) [ks. HAITTAVAIKUTUKSET ]. Kahdella lapsipotilaalla esiintyi asteen 3 ihottumaa (yhtenäinen ihottuma kuumeen kanssa, yleistynyt ihottuma) ja neljällä potilaalla oli asteen 4 ihottumaa (erythema multiforme). Mediaani aika ihottuman ilmaantumiseen lapsipotilailla oli 28 päivää (vaihteluväli 3-1642 päivää). Lapsipotilaiden ennaltaehkäisyä asianmukaisilla antihistamiineilla tulee harkita ennen SUSTIVA-hoidon aloittamista.
SUSTIVA 600 mg -hoito voidaan yleensä aloittaa uudelleen potilailla, jotka keskeyttävät hoidon ihottuman vuoksi. SUSTIVA 200 mg -hoito tulee lopettaa, jos potilaalle kehittyy vaikea ihottuma, johon liittyy rakkuloita, hilseilyä, limakalvovaurioita tai kuumetta. Asianmukaiset antihistamiinit ja/tai kortikosteroidit voivat parantaa ihottuman siedettävyyttä ja nopeuttaa ihottuman häviämistä. Potilaille, joilla on ollut henkeä uhkaava ihoreaktio (esim. Stevens-Johnsonin oireyhtymä), tulee harkita vaihtoehtoista hoitoa [ks. VASTA-AIHEET ].
Maksatoksisuus
Markkinoille tulon jälkeen SUSTIVAlla hoidetuilla potilailla on raportoitu hepatiittitapauksia, mukaan lukien fulminantti hepatiitti, joka etenee maksan vajaatoiminnaksi, joka vaatii siirtoa tai joka on johtanut kuolemaan. Raporteissa on ollut potilaita, joilla on taustalla oleva maksasairaus, mukaan lukien B- tai C-hepatiittitartunta, sekä potilaita, joilla ei ole aiempaa maksasairautta tai muita tunnistettavissa olevia riskitekijöitä.
SUSTIVA 600 mg:aa ei suositella potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta. Huolellista seurantaa suositellaan potilaille, joilla on lievä maksan vajaatoiminta ja jotka saavat SUSTIVAa. [katso HAITTAVAIKUTUKSET ja Käyttö tietyissä populaatioissa ].
Maksaentsyymien seurantaa ennen hoitoa ja sen aikana suositellaan kaikille potilaille [katso ANNOSTELU JA HALLINNOINTI ].
Harkitse SUSTIVA 600 mg -hoidon lopettamista potilailla, joilla seerumin transaminaasiarvot ovat jatkuvasti kohonneet yli viisinkertaiseksi normaalin ylärajaan verrattuna.Lopeta SUSTIVA 200 mg -hoito, jos seerumin transaminaasiarvojen nousuun liittyy hepatiitin tai maksan vajaatoiminnan kliinisiä merkkejä tai oireita.
Kouristukset
Kouristuksia on havaittu efavirentsia saavilla aikuis- ja lapsipotilailla, yleensä niillä, joilla on tunnetusti kouristuksia [ks. Ei-kliininen toksikologia ]. Varovaisuutta tulee noudattaa potilailla, joilla on ollut kouristuskohtauksia. Potilaat, jotka saavat samanaikaisesti kouristuksia estäviä lääkkeitä, jotka metaboloituvat pääasiassa maksassa, kuten fenytoiinia ja fenobarbitaalia, saattavat tarvita säännöllistä plasmapitoisuuden seurantaa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Lipidien nousu
SUSTIVA-hoito on johtanut kokonaiskolesterolin ja triglyseridien pitoisuuden nousuun [katso HAITTAVAIKUTUKSET ]. Kolesteroli- ja triglyseridimittaukset tulee tehdä ennen SUSTIVA 200 mg -hoidon aloittamista ja säännöllisin väliajoin hoidon aikana.
Immuunijärjestelmän palautumisoireyhtymä
Immuunireaktion oireyhtymää on raportoitu potilailla, joita on hoidettu antiretroviraalisella yhdistelmähoidolla, mukaan lukien SUSTIVA. Antiretroviraalisen yhdistelmähoidon alkuvaiheessa potilaat, joiden immuunijärjestelmä reagoi, voivat kehittää tulehdusreaktion indolenteille tai jäljellä oleville opportunistisille infektioille (kuten Mycobacterium avium -infektio, sytomegalovirus, Pneumocystis jiroveci -keuhkokuume [PCP] tai tuberkuloosi), mikä saattaa edellyttää lisäarviointia. ja hoitoon.
Autoimmuunisairauksia (kuten Gravesin tauti, polymyosiitti, Guillain-Barrén oireyhtymä ja autoimmuunihepatiitti) on myös raportoitu esiintyvän immuunijärjestelmän palautumisen yhteydessä; aika sen alkamiseen on kuitenkin vaihtelevampi ja voi tapahtua useita kuukausia hoidon aloittamisen jälkeen.
Rasvan uudelleenjako
Kehon rasvan uudelleenjakautumista/kerääntymistä mukaan lukien keskuslihavuus, kohdunkaulan rasvan suureneminen (puhvelin kyhmy), perifeerinen kuihtuminen, kasvojen kuihtuminen, rintojen suureneminen ja "cushingoidin ulkonäkö" on havaittu potilailla, jotka saavat antiretroviraalista hoitoa. Näiden tapahtumien mekanismia ja pitkän aikavälin seurauksia ei tällä hetkellä tunneta. Syy-yhteyttä ei ole vahvistettu.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ja Käyttöohjeet ).
Huumeiden vuorovaikutukset
Potilaille ja terveydenhuollon tarjoajille tarkoitettu lausunto sisältyy tuotteen pullon etikettiin: VAROITUS: Ota selvää lääkkeistä, joita EI pidä ottaa SUSTIVAn kanssa.
SUSTIVAlla voi olla yhteisvaikutuksia joidenkin lääkkeiden kanssa; siksi kehota potilaita ilmoittamaan lääkärilleen muiden reseptilääkkeiden tai reseptivapaiden lääkkeiden käytöstä.
Yleistä tietoa potilaille
Kerro potilaille, että SUSTIVA 200 mg ei paranna HIV-1-infektiota ja potilaat voivat edelleen kokea HIV-1-infektioon liittyviä sairauksia, mukaan lukien opportunistiset infektiot. Potilaiden tulee pysyä lääkärin valvonnassa SUSTIVA-hoidon aikana.
Neuvo potilaita välttämään asioita, jotka voivat levittää HIV-1-tartuntaa muille.
- Älä jaa tai käytä uudelleen neuloja tai muita injektiovälineitä.
- Älä jaa henkilökohtaisia esineitä, joissa voi olla verta tai kehon nesteitä, kuten hammasharjoja ja partakoneen teriä.
- Älä harrasta minkäänlaista seksiä ilman suojaa. Harjoittele aina turvaseksiä käyttämällä lateksi- tai polyuretaanikondomia vähentääksesi mahdollisuutta joutua seksuaaliseen kontaktiin siemennesteen, emättimen eritteiden tai veren kanssa.
- Älä imetä. Äitien, joilla on HIV-1, ei tule imettää, koska HIV-1 voi tarttua vauvaan äidinmaidon mukana.
Annosteluohjeet
Neuvo potilaita ottamaan SUSTIVAa joka päivä ohjeiden mukaan. Jos potilas unohtaa ottaa SUSTIVAa, kehota potilasta ottamaan unohtunut annos heti, ellei ole melkein seuraavan annoksen aika. Neuvo potilasta olemaan ottamatta 2 annosta kerralla ja ottamaan seuraavan annoksen säännöllisen aikataulun mukaisesti. Neuvo potilasta kysymään terveydenhuollon tarjoajalta, tarvitseeko hän apua suunniteltaessa parhaita aikoja lääkkeensä ottamiseen.
SUSTIVA 200 mg on aina käytettävä yhdessä muiden antiretroviraalisten lääkkeiden kanssa. Neuvo potilaita ottamaan SUSTIVA 600 mg tyhjään mahaan, mieluiten nukkumaan mennessä. SUSTIVAn ottaminen ruoan kanssa lisää efavirentsipitoisuuksia ja saattaa lisätä haittavaikutusten esiintymistiheyttä. Annostelu nukkumaan mennessä voi parantaa hermoston oireiden siedettävyyttä [katso ANNOSTELU JA HALLINNOINTI ja HAITTAVAIKUTUKSET ]. Terveydenhuollon tarjoajien tulee auttaa vanhempia tai hoitajia määrittämään paras SUSTIVA-annostusohjelma imeväisille ja pikkulapsille.
Aikuisille ja lapsipotilaille, jotka eivät voi niellä kapseleita tai tabletteja, potilaita tai heidän hoitajiaan tulee neuvoa lukemaan ja noudattamaan huolellisesti ohjeet kapselin sisällön antamisesta pienessä määrässä ruokaa tai äidinmaidonkorviketta [ks. ANNOSTELU JA HALLINNOINTI ja FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ja KÄYTTÖOHJEET )]. Potilaiden tulee soittaa terveydenhuollon tarjoajalleen tai apteekkiin, jos heillä on kysyttävää.
Hermoston oireet
Kerro potilaille, että keskushermosto-oireita (NSS), mukaan lukien huimaus, unettomuus, keskittymiskyvyn heikkeneminen, uneliaisuus ja epänormaalit unet, raportoidaan yleisesti SUSTIVA-hoidon ensimmäisten viikkojen aikana [ks. VAROITUKSET JA VAROTOIMET ]. Annostelu ennen nukkumaanmenoa voi parantaa näiden oireiden siedettävyyttä, jotka todennäköisesti paranevat hoidon jatkuessa. Varoita potilaita mahdollisista additiivisista vaikutuksista, kun SUSTIVAa käytetään samanaikaisesti alkoholin tai psykoaktiivisten lääkkeiden kanssa. Neuvo potilaita, että jos he kokevat NSS:n, heidän tulee välttää mahdollisesti vaarallisia tehtäviä, kuten ajamista tai koneiden käyttöä.
Kerro potilaille, että on olemassa riski myöhään alkavasta neurotoksisuudesta, mukaan lukien ataksia ja enkefalopatia, joita voi esiintyä kuukausia tai vuosia SUSTIVA-hoidon aloittamisen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Psykiatriset oireet
Kerro potilaille, että SUSTIVAa saavilla potilailla on raportoitu vakavia psyykkisiä oireita, mukaan lukien vaikea masennus, itsemurhayritykset, aggressiivinen käyttäytyminen, harhaluulot, vainoharhaisuus, psykoosin kaltaiset oireet ja katonia [ks. VAROITUKSET JA VAROTOIMET ]. Jos he kokevat vakavia psykiatrisia haitallisia kokemuksia, heidän tulee hakeutua välittömästi lääkärinarviointiin. Neuvo potilaita ilmoittamaan lääkärilleen kaikista mielenterveysongelmista tai päihteiden väärinkäytöstä.
Ihottuma
Kerro potilaille, että yleinen sivuvaikutus on ihottuma [katso VAROITUKSET JA VAROTOIMET ]. Ihottuma häviää yleensä ilman muutoksia hoitoon. Koska ihottuma voi kuitenkin olla vakava, kehota potilaita ottamaan välittömästi yhteyttä lääkäriin, jos ihottumaa ilmenee.
Maksatoksisuus
Kerro potilaille, että he tarkkailevat maksatulehduksen tai maksan vajaatoiminnan varhaisia varoitusmerkkejä, kuten väsymystä, heikkoutta, ruokahaluttomuutta, pahoinvointia ja oksentelua, sekä myöhempiä oireita, kuten keltaisuutta, sekavuutta, vatsan turvotusta ja värjäytyneitä ulosteita, ja neuvottelemaan heidän kanssaan terveydenhuollon ammattilainen viipymättä, jos tällaisia oireita ilmenee [katso VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Lisääntymispotentiaalin naiset
Kehota lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä ja estemenetelmää SUSTIVA 600 mg -hoidon aikana ja 12 viikon ajan SUSTIVA-hoidon lopettamisen jälkeen. Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaansa, jos he suunnittelevat raskautta, tulevat raskaaksi tai jos epäillään raskautta SUSTIVA-hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Raskausaltistusrekisteri
Kerro potilaille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet SUSTIVAlle raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Rasvan uudelleenjako
Kerro potilaille, että kehon rasvan uudelleen jakautumista tai kertymistä voi tapahtua antiretroviraalista hoitoa saavilla potilailla ja että näiden tilojen syytä ja pitkäaikaisia terveysvaikutuksia ei tunneta [ks. VAROITUKSET JA VAROTOIMET ].
SUSTIVA on Bristol-Myers Squibb Pharma Companyn rekisteröity tavaramerkki. ATRIPLA on Bristol-Myers Squibb & Gilead Sciences, LLC:n tavaramerkki.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Efavirentsillä suoritettiin pitkäaikaisia karsinogeenisuustutkimuksia hiirillä ja rotilla. Hiirille annettiin 0, 25, 75, 150 tai 300 mg/kg/päivä 2 vuoden ajan. Naisilla hepatosellulaaristen adenoomien ja karsinoomien sekä keuhkoalveolaaristen/bronkiolaaristen adenoomien ilmaantuvuus lisääntyi taustan yläpuolelle. Miehillä ei havaittu kasvainten esiintyvyyden lisääntymistä taustan yläpuolella. Tätä tutkimusta varten naisilla ei todettu NOAEL-arvoa, koska kasvainlöydöksiä esiintyi kaikilla annoksilla. AUC NOAEL-arvolla (150 mg/kg) miehillä oli noin 0,9 kertaa suurempi kuin ihmisillä suositellulla kliinisellä annoksella. Rottatutkimuksessa kasvainten ilmaantuvuuden lisääntymistä ei havaittu annoksilla 100 mg/kg/vrk asti, jolloin AUC-arvot olivat 0,1 (urokset) tai 0,2 (naaraat) kertaa suuremmat kuin ihmisillä suositellulla kliinisellä annoksella.
Mutageneesi
Efavirentsi oli negatiivinen useissa in vitro ja in vivo genotoksisuusmäärityksissä. Näihin sisältyivät bakteerimutaatiomääritykset S. typhimuriumissa ja E. colissa, nisäkäsmutaatiomääritykset kiinanhamsterin munasarjasoluissa, kromosomipoikkeamamääritykset ihmisen perifeerisen veren lymfosyyteissä tai kiinanhamsterin munasarjasoluissa ja in vivo hiiren luuytimen mikrotumamääritys.
Hedelmällisyyden heikkeneminen
Efavirentsi ei heikentänyt uros- tai naarasrottien parittelua tai hedelmällisyyttä, eikä se vaikuttanut käsiteltyjen urosrottien siittiöön. Efavirentsiä saaneiden naarasrottien jälkeläisten lisääntymiskyky ei muuttunut. AUC-arvot NOAEL-arvoilla urosrotilla (200 mg/kg) ja naarasrotilla (100 mg/kg) olivat noin ≤ 0,15 kertaa suuremmat kuin ihmisillä suositellulla kliinisellä annoksella.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet SUSTIVA 600 mg:lle raskauden aikana. Lääkäreitä kehotetaan rekisteröimään potilaat soittamalla Antiretroviraaliseen raskausrekisteriin numeroon 1-800-258-4263.
Riskien yhteenveto
On olemassa retrospektiivisiä tapausraportteja hermoputken vaurioista imeväisillä, joiden äidit olivat altistuneet efavirentsia sisältäville hoito-ohjelmille raskauden ensimmäisen kolmanneksen aikana. Antiretroviraalisen raskausrekisterin tulevasta raskaudesta saadut tiedot eivät riitä arvioimaan tätä riskiä riittävästi. Antiretroviraalisen raskausrekisterin saatavilla olevat tiedot eivät osoita eroa vakavien synnynnäisten epämuodostumien riskissä verrattuna vakavien synnynnäisten epämuodostumien taustaosuuteen, joka on 2,7 % Yhdysvaltain Metropolitan Atlanta Congenital Defects -ohjelman (MACDP) vertailuväestössä. Vaikka syy-yhteyttä ei ole osoitettu ensimmäisen raskauskolmanneksen efavirentsille altistumisen ja hermoputkivaurioiden välillä, samanlaisia epämuodostumia on havaittu apinoilla tehdyissä tutkimuksissa ihmisannoksia vastaavilla annoksilla. Lisäksi sikiö- ja alkiotoksisuutta esiintyi rotilla annoksella, joka oli kymmenen kertaa pienempi kuin ihmisen altistus suositellulla kliinisellä annoksella. Hermoputkivaurioiden mahdollisen riskin vuoksi efavirentsia ei tule käyttää raskauden ensimmäisen kolmanneksen aikana. Kerro raskaana oleville naisille mahdollisista riskeistä sikiölle.
Data
Ihmistiedot
Markkinoille tulon jälkeen on saatu retrospektiivisiä raportteja löydöksistä, jotka ovat yhdenmukaisia hermoputken vaurioiden kanssa, mukaan lukien meningomyelocele, kaikki imeväisillä, joiden äidit ovat altistuneet efavirentsia sisältäville hoito-ohjelmille ensimmäisen raskauskolmanneksen aikana.
Antiretroviraalisen raskausrekisterin (APR) tulevien raporttien perusteella noin 1 000 elävänä syntyneestä efavirentsia sisältävien hoito-ohjelmien jälkeen (mukaan lukien yli 800 ensimmäisen raskauskolmanneksen aikana altistunutta elävänä syntynyttä lasta), efavirentsin ja yleisten synnynnäisten epämuodostumien välillä ei ollut eroa verrattuna taustasyntyneiden epämuodostumien määrä on 2,7 % Metropolitan Atlanta Congenital Defects -ohjelman Yhdysvaltojen vertailuväestössä. Joulukuussa 2014 julkaistun APR-väliraportin mukaan synnynnäisten epämuodostumien esiintyvyys ensimmäisen raskauskolmanneksen altistumisen jälkeen oli 2,3 % (95 % CI: 1,4-3,6 %). Yksi näistä prospektiivisesti raportoiduista vioista ensimmäisen raskauskolmanneksen altistuksen yhteydessä oli hermoputken vika. Prospektiivisesti on raportoitu myös yksi anoftalmiatapaus ensimmäisen raskauskolmanneksen altistumisesta efavirentsille. Tämä tapaus sisälsi myös vakavia vinoja kasvojen halkeamia ja lapsivesinauhaa, joilla on tunnettu yhteys anoftalmiaan.
Eläinten tiedot
Efavirentsin vaikutuksia alkion ja sikiön kehitykseen on tutkittu kolmella ei-kliinisellä lajilla (cynomolgus-apinat, rotat ja kanit). Apinoilla efavirentsia annettiin 60 mg/kg/vrk raskaana oleville naaraille koko raskauden ajan (tiineyspäivät 20-150). Äidin systeeminen lääkealtistus (AUC) oli 1,3 kertaa suurempi kuin ihmisten altistus suositellulla kliinisellä annoksella (600 mg/vrk), ja sikiön napalaskimon lääkepitoisuudet olivat noin 0,7 kertaa äidin arvot. Kolmella 20 sikiöstä/lapsesta oli yksi tai useampi epämuodostuma; lumelääkettä saaneista äideistä ei ollut epämuodostuneita sikiöitä tai vauvoja. Näissä kolmessa apinan sikiössä ilmenneet epämuodostumat sisälsivät anenkefaliaa ja yksipuolista anoftalmiaa yhdellä sikiöllä, mikroftalmiaa toisessa ja suulakihalkeamaa kolmannessa. Tälle tutkimukselle ei määritetty NOAEL-tasoa (ei havaittavissa olevaa haittavaikutustasoa), koska arvioitiin vain yksi annos. Rotille efavirentsia annettiin joko organogeneesin aikana (raskauspäivät 7–18) tai 7. tiineyspäivästä 21. imetyspäivään 50, 100 tai 200 mg/kg/vrk. Annoksen 200 mg/kg/vrk antaminen rotille liittyi varhaisten resorptioiden lisääntymiseen; ja annokset 100 mg/kg/vrk tai suuremmat liittyivät varhaiseen vastasyntyneiden kuolleisuuteen. AUC NOAEL-arvolla (50 mg/kg/vrk) tässä rottatutkimuksessa oli 0,1 kertaa suurempi kuin ihmisillä suositellulla kliinisellä annoksella. Lääkepitoisuudet maidossa imetyspäivänä 10 olivat noin 8 kertaa suuremmat kuin äidin plasmassa. Tiineillä kaniineilla efavirentsi ei ollut alkiolle tappava eikä teratogeeninen, kun sitä annettiin annoksilla 25, 50 ja 75 mg/kg/vrk organogeneesin aikana (tiineyspäivät 6-18). AUC arvolla NOAEL (75 mg/kg/vrk) kaneilla oli 0,4 kertaa suurempi kuin ihmisillä suositellulla kliinisellä annoksella.
Imetys
Riskien yhteenveto
Tautien torjunta- ja ehkäisykeskukset suosittelevat, että HIV-tartunnan saaneet äidit eivät imetä lapsiaan, jotta he eivät riskeeraa HIV-tartunnan jälkeistä riskiä. Koska HIV-tartunta on mahdollista imetettäville vauvoille, kehota naisia olemaan imettämättä.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Mahdollisten teratogeenisten vaikutusten vuoksi SUSTIVAa saavien naisten tulee välttää raskautta. [katso Raskaus .]
Raskaustestaus
Lisääntymiskykyisille naisille tulee tehdä raskaustesti ennen SUSTIVA-hoidon aloittamista.
Ehkäisy
Lisääntymiskykyisten naisten tulee käyttää tehokasta ehkäisyä SUSTIVA 200 mg -hoidon aikana ja 12 viikon ajan SUSTIVA 200 mg -hoidon lopettamisen jälkeen efavirentsin pitkän puoliintumisajan vuoksi. Esteehkäisyä tulee aina käyttää yhdessä muiden ehkäisymenetelmien kanssa. Hormonaaliset menetelmät, jotka sisältävät progesteronia, voivat heikentää tehokkuutta [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Käyttö lapsille
SUSTIVA 600 mg:n turvallisuutta, farmakokineettistä profiilia sekä virologisia ja immunologisia vasteita arvioitiin kolmessa avoimessa kliinisessä tutkimuksessa, jotka olivat aiemmin saaneet antiretroviraalista lääkettä ja - kokeneita HIV-1-tartunnan saaneita lapsipotilaita iältään 3 kuukaudesta 21 vuoteen [ks. HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA , ja Kliiniset tutkimukset ]. Haittavaikutusten tyyppi ja esiintymistiheys näissä tutkimuksissa olivat yleensä samankaltaisia kuin aikuisilla potilailla, paitsi että ihottumaa esiintyi useammin, mukaan lukien asteen 3 tai 4 ihottuma, lapsipotilailla aikuisiin verrattuna [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
SUSTIVAn käyttöä alle 3 kuukauden ikäisille TAI alle 3,5 kg:n painoisille potilaille ei suositella, koska SUSTIVA 600 mg:n turvallisuutta, farmakokinetiikkaa ja antiviraalista aktiivisuutta ei ole arvioitu tässä ikäryhmässä ja HIV-resistenssin kehittymisen riski on olemassa. jos SUSTIVA on aliannostettu. katso ANNOSTELU JA HALLINNOINTI annossuosituksia lapsipotilaille.
Geriatrinen käyttö
SUSTIVA 200 mg:n kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Yleensä iäkkäille potilaille annosvalinnan tulee olla varovaista, koska maksan, munuaisten tai sydämen toiminta on heikentynyt sekä samanaikainen sairaus tai muu hoito.
Maksan vajaatoiminta
SUSTIVAa ei suositella potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta, koska tiedot eivät ole riittäviä sen määrittämiseksi, onko annoksen muuttaminen tarpeen. Potilaita, joilla on lievä maksan vajaatoiminta, voidaan hoitaa efavirentsilla ilman, että annosta muutetaan. Koska efavirentsin sytokromi P450-välitteinen metabolia on laaja ja kliininen kokemus maksan vajaatoimintaa sairastavista potilaista on rajallista, SUSTIVAa tulee noudattaa varovaisuutta annettaessa näille potilaille [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Jotkut potilaat, jotka ovat vahingossa ottaneet 600 mg kahdesti vuorokaudessa, ovat raportoineet lisääntyneistä hermosto-oireista. Yksi potilas koki tahattomia lihassupistuksia.
SUSTIVA 200 mg:n yliannostuksen hoidon tulee sisältää yleisiä tukitoimenpiteitä, mukaan lukien elintoimintojen seuranta ja potilaan kliinisen tilan tarkkailu. Aktiivihiilen antamista voidaan käyttää auttamaan imeytymättömän lääkkeen poistamisessa. SUSTIVAn yliannostukseen ei ole spesifistä vastalääkettä. Koska efavirentsi sitoutuu voimakkaasti proteiineihin, dialyysi ei todennäköisesti poista lääkettä merkittävästi verestä.
VASTA-AIHEET
- SUSTIVA on vasta-aiheinen potilailla, joilla on aiemmin osoitettu kliinisesti merkittävää yliherkkyyttä (esim. Stevens-Johnsonin oireyhtymä, erythema multiforme tai toksinen ihottuma) jollekin tämän tuotteen aineosista.
- Efavirentsin samanaikainen anto elbasvirin ja grazopreviirin kanssa on vasta-aiheista [katso VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Efavirentsi on viruslääke [katso Mikrobiologia ].
Farmakodynamiikka
Sydämen elektrofysiologia
SUSTIVA 600 mg:n vaikutusta QTc-väliin arvioitiin avoimessa, positiivisessa ja lumelääkekontrolloidussa, kiinteässä yhden sekvenssin 3-jaksoisessa 3 hoidon risteävässä QT-tutkimuksessa 58 terveellä koehenkilöllä, jotka oli rikastettu CYP2B6-polymorfismien suhteen. Efavirentsin keskimääräinen Cmax koehenkilöillä, joiden genotyyppi oli CYP2B6 *6/*6, sen jälkeen, kun 600 mg:n vuorokausiannos oli annettu 14 päivän ajan, oli 2,25-kertainen verrattuna CYP2B6 *1/*1 -genotyyppiä omaavien henkilöiden keskimääräiseen Cmax-arvoon. Positiivinen suhde efavirentsipitoisuuden ja QTc-ajan pidentymisen välillä havaittiin. Konsentraatio-QTc-suhteen perusteella QTc-ajan keskimääräinen pidentyminen ja sen yläraja 90 %:n luottamusväli ovat 8,7 ms ja 11,3 ms koehenkilöillä, joilla on genotyyppi CYP2B6*6/*6, kun 600 mg:n päiväannos on annettu 14 päivän ajan [ks. VAROITUKSET JA VAROTOIMET ].
Farmakokinetiikka
Imeytyminen
Efavirentsin huippupitoisuudet plasmassa, 1,6–9,1 µM, saavutettiin 5 tunnin kuluttua 100–1600 mg:n kerta-annosten oraalisesta oraalisesta annoksesta terveille vapaaehtoisille. Annoksesta riippuvaisia Cmax- ja AUC-arvojen nousuja havaittiin aina 1600 mg:n annoksilla; lisääntyminen oli suhteellista vähemmän, mikä viittaa heikentyneeseen imeytymiseen suuremmilla annoksilla.
Vakaassa tilassa HIV-1-infektoituneilla potilailla keskimääräinen Cmax, keskimääräinen Cmin ja keskimääräinen AUC olivat suhteessa annokseen 200 mg, 400 mg ja 600 mg vuorokausiannoksilla. Aika huippupitoisuuksiin plasmassa oli noin 3-5 tuntia ja vakaan tilan plasmapitoisuudet saavutettiin 6-10 päivässä. 35 potilaalla, jotka saivat SUSTIVAa 600 mg kerran päivässä, vakaan tilan Cmax oli 12,9 ± 3,7 µM (keskiarvo ± SD), vakaan tilan Cmin oli 5,6 ± 3,2 µM ja AUC oli 184 ± 73 µM•h.
Ruoan vaikutus suun kautta imeytymiseen:
Kapselit
Kerta-annos 600 mg efavirentsikapseleita runsasrasvaisen/paljokalorisen aterian (894 kcal, 54 g rasvaa, 54 % kaloreita rasvasta) tai vähärasvaisen/normaalikalorisen aterian (440 kcal, 2 g) kanssa. rasvaa, 4 % kaloreita rasvasta) liittyi efavirentsin AUC∞:n keskimääräiseen nousuun 22 % ja 17 %:iin ja efavirentsin Cmax:n keskimääräiseen nousuun 39 % ja 51 % verrattuna paasto-olosuhteissa saavutettuun altistukseen. . [katso ANNOSTELU JA HALLINNOINTI ja POTILASTIEDOT .]
Tabletit

Yhden 600 mg:n efavirentsitabletin antaminen runsasrasvaisen/paljonkalorisen aterian yhteydessä (noin 1000 kcal, 500-600 kcal rasvasta) liittyi efavirentsin keskimääräisen AUC∞-arvon nousuun 28 % ja keskiarvon nousuun 79 %. Efavirentsin Cmax suhteessa paasto-olosuhteissa saavutettuun altistukseen. [katso ANNOSTELU JA HALLINNOINTI ja POTILASTIEDOT .]
Kapselin sisällön biologinen hyötyosuus sekoitettuna elintarvikeajoneuvoihin
Terveillä aikuisilla efavirentsin AUC, kun se annettiin kolmen 200 mg:n kapselin sisältönä sekoitettuna 2 teelusikalliseen tiettyjä elintarvikkeita (omenasose, viinirypälehyytelö tai jogurtti tai äidinmaidonkorvike) täytti bioekvivalenssikriteerit annetun ehjän kapselin AUC:lle. paaston olosuhteissa.
Jakelu
Efavirentsi sitoutuu voimakkaasti (noin 99,5-99,75 %) ihmisen plasman proteiineihin, pääasiassa albumiiniin. HIV-1-tartunnan saaneilla potilailla (n=9), jotka saivat SUSTIVAa 200–600 mg kerran vuorokaudessa vähintään kuukauden ajan, aivo-selkäydinnesteen pitoisuudet vaihtelivat välillä 0,26–1,19 % (keskiarvo 0,69 %) vastaavasta plasmapitoisuudesta. Tämä osuus on noin 3 kertaa suurempi kuin efavirentsin proteiiniin sitoutumaton (vapaa) fraktio plasmassa.
Aineenvaihdunta
Ihmisillä tehdyt tutkimukset ja in vitro -tutkimukset, joissa käytettiin ihmisen maksan mikrosomeja, ovat osoittaneet, että efavirentsi metaboloituu pääasiassa sytokromi P450 -järjestelmässä hydroksyloiduiksi metaboliiteiksi, minkä jälkeen nämä hydroksyloidut metaboliitit glukuronidoituvat. Nämä metaboliitit ovat olennaisesti inaktiivisia HIV-1:tä vastaan. In vitro -tutkimukset viittaavat siihen, että CYP3A ja CYP2B6 ovat tärkeimmät efavirentsin metaboliasta vastaavat isoentsyymit.
Efavirentsin on osoitettu indusoivan CYP-entsyymejä, mikä johtaa sen oman metabolian indusoitumiseen. Useat 200–400 mg:n annokset vuorokaudessa 10 päivän ajan johtivat ennustettua pienempään kertymiseen (22–42 % pienempi) ja lyhyempään terminaaliin puoliintumisaikaan 40–55 tuntia (kerta-annoksen puoliintumisaika 52–76 tuntia ).
Eliminointi
Efavirentsin terminaalinen puoliintumisaika on 52-76 tuntia kerta-annoksen jälkeen ja 40-55 tuntia toistuvien annosten jälkeen. Kuukauden mittainen massatasapaino/eritystutkimus suoritettiin käyttämällä 400 mg:aa päivässä C-merkittyllä annoksella, joka annettiin päivänä 8. Noin 14-34 % radioaktiivisesta leimasta löytyi virtsasta ja 16-61 % ulosteesta. . Lähes kaikki radioaktiivisesti leimatun lääkkeen virtsaan erittyminen oli metaboliittien muodossa. Efavirentsin osuus ulosteen kokonaisradioaktiivisuudesta oli suurin.
Erikoispopulaatiot
Pediatriset
Efavirentsin farmakokineettiset parametrit vakaassa tilassa lapsipotilailla ennustettiin populaatiofarmakokineettisella mallilla, ja ne on yhteenveto taulukossa 6 painoalueittain, jotka vastaavat suositeltuja annoksia.
Sukupuoli Ja rotu
Efavirentsin farmakokinetiikka potilailla näyttää olevan samanlainen miesten ja naisten välillä sekä tutkituissa roturyhmissä.
Munuaisten vajaatoiminta
Efavirentsin farmakokinetiikkaa ei ole tutkittu potilailla, joilla on munuaisten vajaatoiminta. Kuitenkin alle 1 % efavirentsista erittyy muuttumattomana virtsaan, joten munuaisten vajaatoiminnan vaikutuksen efavirentsin eliminaatioon tulee olla minimaalinen.
Maksan vajaatoiminta
Useita annoksia koskeva tutkimus ei osoittanut merkittävää vaikutusta efavirentsin farmakokinetiikkaan potilailla, joilla oli lievä maksan vajaatoiminta (Child-Pugh-luokka A) verrokkeihin verrattuna. Tietoja ei ollut riittävästi sen määrittämiseksi, vaikuttaako kohtalainen tai vaikea maksan vajaatoiminta (Child-Pugh-luokka B tai C) efavirentsin farmakokinetiikkaan.
Huumeiden vuorovaikutustutkimukset
Efavirentsin on osoitettu in vivo aiheuttavan maksaentsyymien induktiota, mikä lisää joidenkin CYP3A:n ja CYP2B6:n kautta metaboloituvien lääkkeiden biotransformaatiota. In vitro -tutkimukset ovat osoittaneet, että efavirentsi esti CYP-isotsyymejä 2C9 ja 2C19 Ki-arvoilla (8,5-17 μM) havaittujen efavirentsipitoisuuksien alueella plasmassa. In vitro -tutkimuksissa efavirentsi ei estänyt CYP2E1:tä ja esti CYP2D6:ta ja CYP1A2:ta (Ki-arvot 82-160 µM) vain kliinisesti saavutettuja pitoisuuksia korkeammilla pitoisuuksilla. Efavirentsin samanaikainen anto pääasiassa CYP2C9-, CYP2C19-, CYP3A- tai CYP2B6-isotsyymien kautta metaboloituvien lääkkeiden kanssa voi muuttaa samanaikaisesti annetun lääkkeen pitoisuutta plasmassa. Lääkkeiden, jotka indusoivat CYP3A- ja CYP2B6-aktiivisuutta, odotetaan lisäävän efavirentsin puhdistumaa, mikä pienentää plasman pitoisuuksia.
Lääkkeiden yhteisvaikutustutkimuksia suoritettiin efavirentsillä ja muilla lääkkeillä, joita todennäköisesti annetaan samanaikaisesti, tai lääkkeillä, joita käytetään yleisesti farmakokineettisten yhteisvaikutusten koettimina. Efavirentsin samanaikaisen käytön vaikutukset Cmax-, AUC- ja Cmin-arvoihin on esitetty yhteenvetona taulukossa 7 (efavirentsin vaikutus muihin lääkkeisiin) ja taulukossa 8 (muiden lääkkeiden vaikutus efavirentsiin). Lisätietoja kliinisistä suosituksista, katso HUUMEIDEN VUOROVAIKUTUKSET .
Mikrobiologia
Toimintamekanismi
Efavirentsi on HIV-1:n NNRTI. Efavirentsin aktiivisuus välittyy pääasiassa HIV-1:n käänteiskopioijaentsyymin ei-kilpailevan eston kautta. Efavirentsi ei estä HIV-2-käänteiskopioijaentsyymiä ja ihmisen solujen DNA-polymeraaseja α, β, γ ja δ.
Antiviraalinen aktiivisuus soluviljelmässä
Villityypin laboratorioon sovitettujen kantojen ja kliinisten isolaattien replikaatiota soluviljelmässä 90-95 % (EC90-95) estävän efavirentsin pitoisuus vaihteli välillä 1,7-25 nM lymfoblastoidisolulinjoissa, perifeerisen veren mononukleaarisissa soluissa (PBMC) ja makrofageissa. /monosyyttiviljelmät. Efavirentsi osoitti antiviraalista aktiivisuutta kladi B:tä ja useimpia ei-kladi B-isolaatteja (alatyypit A, AE, AG, C, D, F, G, J, N) vastaan, mutta sillä oli vähentynyt antiviraalinen aktiivisuus ryhmän O viruksia vastaan. Efavirentsi osoitti additiivista antiviraalista aktiivisuutta ilman sytotoksisuutta HIV-1:tä vastaan soluviljelmässä, kun sitä yhdistettiin NNRTI-lääkkeiden, delavirdiinin ja nevirapiinin, NRTI-lääkkeiden (abakaviiri, didanosiini, emtrisitabiini, lamivudiini, stavudiini, tenofoviiri, tsalsitabiini, tsidofoviiri, tsidovudiini, virpiinavudiini, nelfinaviiri, ritonaviiri, sakinaviiri) ja fuusionestäjä enfuvirtidi. Efavirentsi osoitti additiivisen antagonistisen antiviraalisen vaikutuksen soluviljelmässä atatsanaviirin kanssa. Efavirentsi ei ollut antagonistinen hepatiitti B -virusinfektion hoitoon käytettävän adefoviirin tai ribaviriinin kanssa, jota käytettiin yhdessä interferonin kanssa hepatiitti C -virusinfektion hoitoon.
Resistanssi
Soluviljelmässä
Soluviljelmässä HIV-1-isolaatteja, joiden herkkyys efavirentsille oli vähentynyt (EC90-arvon yli 380-kertainen nousu), syntyi nopeasti lääkkeen läsnä ollessa. Näiden virusten genotyyppinen karakterisointi tunnisti käänteiskopioijaentsyymistä yksittäiset aminohapposubstituutiot L100I tai V179D, kaksoissubstituutiot L100I/V108I ja kolmoissubstituutiot L100I/V179D/Y181C.
Kliiniset tutkimukset
On saatu kliinisiä isolaatteja, joiden soluviljelmässä herkkyys efavirentsille on vähentynyt. Yksi tai useampi substituutio aminohappoasemissa 98, 100, 101, 103, 106, 108, 188, 190, 225 ja 227 käänteiskopioijaentsyymissä havaittiin potilailla, jotka eivät saaneet hoitoa efavirentsin ja indinaviirin yhdistelmällä tai tsidovudiini plus lamivudiinilla. K103N-substituutio havaittiin useimmin. Pitkäaikaisessa resistenssin seurannassa (keskiarvo 52 viikkoa, vaihteluväli 4-106 viikkoa) analysoitiin 28 vastaavaa lähtötilannetta ja virologista epäonnistumista. 61 prosentilla (17/28) näistä epäonnistuneista isolaateista oli vähentynyt efavirentsiherkkyys soluviljelmässä ja efavirentsiherkkyyden mediaanimuutos (EC50-arvo) oli 88-kertainen vertailuarvoon verrattuna. Näissä potilas-isolaateissa yleisin NNRTI-substituutio oli K103N (54 %). Muita kehitettyjä NNRTI-substituutioita olivat L100I (7 %), K101E/Q/R (14 %), V108I (11 %), G190S/T/A (7 %), P225H (18 %) ja M230I/L (11 %). %).
Ristivastus
NNRTI-lääkkeiden välillä on havaittu ristiresistenssiä. Aiemmin efavirentsille resistentiksi luonnehditut kliiniset isolaatit olivat myös fenotyyppisesti resistenttejä soluviljelmässä delavirdiinille ja nevirapiinille verrattuna lähtötilanteeseen. Delavirdiini- ja/tai nevirapiiniresistentit kliiniset virusisolaatit, joissa on NNRTI-resistenssiin liittyviä substituutioita (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, M227L) tai heikentynyt herkkyys227L, soluviljelmässä. Yli 90 % soluviljelmässä testatuista NRTI-resistenteistä kliinisistä isolaateista säilytti herkkyyden efavirentsille.
Eläinten toksikologia
Jatkumattomia kouristuksia havaittiin 6:lla 20 apinasta, jotka saivat efavirentsia annoksilla, jotka tuottivat plasman AUC-arvot 4–13 kertaa suuremmat kuin suositellulla annoksella saaneilla ihmisillä [ks. VAROITUKSET JA VAROTOIMET ].
Kliiniset tutkimukset
Aikuiset
Tutkimus 006 satunnaistettu, avoin tutkimus, jossa verrattiin SUSTIVAa (600 mg kerran päivässä) + tsidovudiinia (ZDV, 300 mg q12h) + lamivudiinia (LAM, 150 mg q12h) tai SUSTIVAa (600 mg kerran päivässä) + indinaviiria (IDV, 1000 mg) q8h) indinaviirin (800 mg q8h) + tsidovudiinin (300 mg q12h) + lamivudiinin (150 mg q12h) kanssa. Mukaan otettiin kaksitoistasataakuusikymmentäkuusi potilasta (keski-ikä 36,5 vuotta [vaihteluväli 18-81], 60 % valkoihoisia, 83 % miehiä). Kaikki potilaat eivät olleet aiemmin saaneet efavirentsia, lamivudiinia, NNRTI:tä ja proteaasinestäjiä tutkimukseen osallistuessaan. Keskimääräinen lähtötason CD4+-solumäärä oli 320 solua/mm3 ja mediaani lähtötason HIV-1 RNA -taso oli 4,8 log kopiota/ml. Hoitotulokset standardimäärityksellä (määrityksen raja 400 kopiota/ml) viikkoon 48 ja 168 on esitetty taulukossa 9. Plasman HIV-RNA-tasot kvantifioitiin standardilla (määrityksen raja 400 kopiota/ml) ja ultraherkällä (määrityksen raja 50 kopiota/ml) AMPLICOR HIV-1 MONITOR -määrityksen versiot. Tutkimuksen aikana Euroopassa otettiin käyttöön määrityksen versio 1.5, joka tehostaa ei-klade B -viruksen havaitsemista.
Potilailla, joita hoidettiin yhdistelmällä SUSTIVA + tsidovudiini + lamivudiini, SUSTIVA + indinaviiri tai indinaviiri + tsidovudiini + lamivudiini, vasteen saaneiden HIV-1 RNA:n
ACTG 364 on satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, 48 viikkoa kestänyt tutkimus potilailla, jotka olivat aiemmin saaneet NRTI-hoitoa ja jotka olivat suorittaneet kaksi aikaisempaa ACTG-tutkimusta. Sata yhdeksänkymmentäkuusi potilasta (keski-ikä 41 vuotta [vaihteluväli 18-76], 74 % valkoihoisia, 88 % miehiä) sai NRTI-lääkkeitä yhdessä SUSTIVAn (600 mg kerran vuorokaudessa) tai nelfinaviirin (NFV, 750 mg kolmesti vuorokaudessa) kanssa. ) tai SUSTIVA (600 mg kerran vuorokaudessa) + nelfinaviiri satunnaistetulla, kaksoissokkoutetulla tavalla. Keskimääräinen lähtötason CD4+-solumäärä oli 389 solua/mm3 ja keskimääräinen lähtötason HIV-1 RNA -taso oli 8130 kopiota/ml. Tutkimukseen osallistumisen jälkeen kaikille potilaille määrättiin uusi avoin NRTI-hoito, joka oli riippuvainen heidän aiemmasta NRTI-hoitokokemuksestaan. Keskimääräisessä CD4+-solumäärässä ei ollut merkitsevää eroa hoitoryhmien välillä; keskimääräinen kokonaislisäys oli noin 100 solua viikolla 48 potilailla, jotka jatkoivat tutkimusohjelmia. Hoitotulokset on esitetty taulukossa 10. Plasman HIV-RNA-tasot kvantifioitiin AMPLICOR HIV-1 MONITOR -määrityksellä käyttäen kvantifioinnin alarajaa 500 kopiota/ml.
Kaplan-Meier-analyysi hoidon epäonnistumiseen kuluneesta ajasta 72 viikon aikana osoittaa pidempään virologisen suppression keston (HIV RNA
Pediatriset potilaat
Tutkimus AI266922 on avoin tutkimus, jossa arvioidaan SUSTIVA 200 mg:n farmakokinetiikkaa, turvallisuutta, siedettävyyttä ja antiviraalista aktiivisuutta yhdessä didanosiinin ja emtrisitabiinin kanssa antiretroviruslääkettä aiemmin käyttämättömillä ja kokeneilla lapsipotilailla. SUSTIVAlla hoidettiin 37 potilasta, joiden ikä oli 3 kuukaudesta 6 vuoteen (mediaani 0,7 vuotta). Lähtötilanteessa plasman HIV-1-RNA:n mediaani oli 5,88 log kopiota/ml, CD4+-solujen mediaanimäärä oli 1144 solua/mm3 ja CD4+-prosenttiosuuden mediaani oli 25 %. Tutkimushoidon mediaaniaika oli 60 viikkoa; 27 % potilaista keskeytti hoidon ennen viikkoa 48. ITT-analyysin perusteella HIV-RNA:ta
Tutkimus PACTG 1021 oli avoin tutkimus, jossa arvioitiin SUSTIVA 200 mg:n farmakokinetiikkaa, turvallisuutta, siedettävyyttä ja antiviraalista aktiivisuutta yhdessä didanosiinin ja emtrisitabiinin kanssa lapsipotilailla, jotka eivät olleet aiemmin saaneet antiretroviraalista hoitoa. 43 potilasta, joiden ikä oli 3 kuukaudesta 21 vuoteen (mediaani 9,6 vuotta), sai SUSTIVAa. Lähtötilanteessa plasman HIV-1-RNA:n mediaani oli 4,8 log kopiota/ml, CD4+-solumäärän mediaani oli 367 solua/mm3 ja mediaani CD4+-prosentti oli 18 %. Tutkimushoidon mediaaniaika oli 181 viikkoa; 16 % potilaista keskeytti hoidon ennen viikkoa 48. ITT-analyysin perusteella HIV-RNA:ta
Tutkimus PACTG 382 oli avoin tutkimus, jossa arvioitiin SUSTIVAn farmakokinetiikkaa, turvallisuutta, siedettävyyttä ja antiviraalista aktiivisuutta yhdessä nelfinaviirin ja NRTI:n kanssa aiemmin antiretroviraalista lääkitystä saaneilla ja NRTI-hoitoa aiemmin saaneilla lapsipotilailla. SUSTIVAlla hoidettiin sataa kahta potilasta, joiden ikä oli 3 kuukaudesta 16 vuoteen (mediaani 5,7 vuotta). 87 prosenttia potilaista oli saanut aikaisempaa antiretroviraalista hoitoa. Lähtötilanteessa plasman HIV-1-RNA:n mediaani oli 4,57 log kopiota/ml, CD4+-solujen mediaanimäärä oli 755 solua/mm3 ja CD4+-prosenttiosuuden mediaani oli 30 %. Tutkimushoidon mediaaniaika oli 118 viikkoa; 25 % potilaista keskeytti hoidon ennen viikkoa 48. ITT-analyysin perusteella HIV-RNA:ta
POTILASTIEDOT
SUSTIVA® (sus-TEE-vah) (efavirentsi) kapselit
SUSTIVA® (sus-TEE-vah) (efavirentsi) tabletit
Tärkeää: Kysy lääkäriltäsi tai apteekista lääkkeistä, joita ei tule ottaa SUSTIVAn kanssa. Katso lisätietoja osiosta "Mitä minun pitäisi kertoa lääkärilleni ennen SUSTIVAn ottamista?"
Lue nämä potilastiedot ennen kuin aloitat SUSTIVAn käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi.
Mikä on SUSTIVA?
SUSTIVA 600mg on reseptilääke HIV-1 (ihmisen immuunikatoviruksen tyyppi 1) kanssa, jota käytetään muiden antiretroviraalisten lääkkeiden kanssa HIV-1-infektion hoitoon aikuisilla ja vähintään 3 kuukauden ikäisillä lapsilla, jotka painavat vähintään 7 paunaa 12 unssia (3,5) kg). HIV on virus, joka aiheuttaa AIDSin (hankitun immuunikato-oireyhtymän).
Ei tiedetä, onko SUSTIVA turvallinen ja tehokas alle 3 kuukauden ikäisille lapsille tai alle 3,5 kg painaville lapsille.
Käytettäessä muiden antiretroviraalisten lääkkeiden kanssa HIV-1-infektion hoitoon, SUSTIVA 600 mg voi auttaa:
- vähentää HIV-1:n määrää veressäsi. Tätä kutsutaan viruskuormitukseksi.
- lisää CD4+ (T) -solujen määrää veressäsi, mikä auttaa torjumaan muita infektioita.
HIV-1:n määrän vähentäminen ja CD4+ (T) -solujen määrän lisääminen veressäsi voivat auttaa parantamaan immuunijärjestelmääsi. Tämä voi vähentää riskiäsi kuolla tai saada infektioita, joita voi tapahtua, kun immuunijärjestelmäsi on heikko (opportunistiset infektiot).
SUSTIVA 600mg ei paranna HIV-1-infektiota tai AIDSia. Sinun tulee jatkaa HIV-1-lääkkeiden käyttöä HIV-1-infektion hallitsemiseksi ja HIV-sairauksien vähentämiseksi.
Vältä tekemästä asioita, jotka voivat levittää HIV-1-tartuntaa muille:
- Älä jaa tai käytä uudelleen neuloja tai muita injektiovälineitä.
- Älä jaa henkilökohtaisia esineitä, joissa voi olla verta tai kehon nesteitä, kuten hammasharjoja ja partakoneen teriä.
- Älä harrasta minkäänlaista seksiä ilman suojaa. Harjoittele aina turvaseksiä käyttämällä lateksi- tai polyuretaanikondomia vähentääksesi mahdollisuutta joutua seksuaaliseen kontaktiin kehon nesteiden, kuten siemennesteen, emättimen eritteiden tai veren kanssa.
Kysy lääkäriltäsi, jos sinulla on kysyttävää HIV-tartunnan estämisestä muille ihmisille.
Kuka ei saa ottaa SUSTIVA 600mg -valmistetta?
Älä ota SUSTIVAa, jos olet allerginen efavirentsille tai jollekin SUSTIVA-valmisteen aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo SUSTIVAn ainesosista.
Älä ota SUSTIVAa, jos käytät parhaillaan elbasviiria ja grazopreviiria (ZEPATIER®).
Mitä minun tulee kertoa lääkärilleni ennen SUSTIVA 200 mg:n ottamista?
Ennen kuin otat SUSTIVAa, kerro lääkärillesi, jos sinulla on jokin sairaus ja erityisesti jos:
- on sydänsairaus
- on koskaan ollut mielenterveysongelmia
- ole koskaan käyttänyt katuhuumeita tai suuria määriä alkoholia
- sinulla on maksaongelmia, mukaan lukien B- tai C-hepatiittivirusinfektio
- sinulla on ollut kohtauksia
- olet raskaana tai suunnittelet raskautta. SUSTIVA 600 mg voi vahingoittaa sikiötäsi. Jos voit tulla raskaaksi, terveydenhuollon tarjoajan tulee tehdä raskaustesti ennen SUSTIVA-hoidon aloittamista. Älä tule raskaaksi SUSTIVA-hoidon aikana ja 12 viikkoon SUSTIVA-hoidon lopettamisen jälkeen. Naisten, jotka voivat tulla raskaaksi, tulee käyttää kahta tehokasta ehkäisymenetelmää hoidon aikana ja 12 viikon ajan SUSTIVA-hoidon lopettamisen jälkeen. Estemuotoista ehkäisyä tulee aina käyttää yhdessä muun tyyppisen ehkäisyn kanssa.
- Ehkäisyvälineitä voivat olla lateksi- tai polyuretaanikondomi, ehkäisysieni, spermisidillä varustettu pallea ja kohdunkaulan korkki.
- Hormonaaliset ehkäisymenetelmät, kuten ehkäisypillerit, injektiot, emätinrenkaat tai implantit, eivät välttämättä toimi SUSTIVA-hoidon aikana.
- Keskustele lääkärisi kanssa ehkäisymuodoista, joita voidaan käyttää SUSTIVA-hoidon aikana.
- Raskausrekisteri. On olemassa raskausrekisteri naisille, jotka käyttävät antiretroviraalisia lääkkeitä raskauden aikana. Tämän rekisterin tarkoituksena on kerätä tietoja sinun ja vauvasi terveydestä. Keskustele lääkärisi kanssa siitä, kuinka voit osallistua tähän rekisteriin.
- Älä imetä, jos käytät SUSTIVAa.
- Älä imetä, jos sinulla on HIV, koska sinulla on riski siirtää HIV lapsellesi.
Kerro lääkärillesi ja apteekkiin kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
SUSTIVA 600 mg voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa SUSTIVA 600 mg:n tehoon, ja voi aiheuttaa vakavia sivuvaikutuksia. Jos käytät tiettyjä lääkkeitä SUSTIVAn kanssa, SUSTIVA 600 mg:n määrä elimistössäsi saattaa olla liian alhainen eikä se ehkä auta hillitsemään HIV-infektiotasi. Kehossasi oleva HIV-virus voi muuttua resistentiksi SUSTIVAlle tai muille HIV-lääkkeille, jotka ovat sen kaltaisia.
Älä ota SUSTIVA 600 mg:aa, jos käytät ATRIPLAa (efavirentsi, emtrisitabiini, tenofoviiridisoproksiilifumaraatti), ellei lääkärisi niin määrää.
Kerro lääkärillesi ja apteekkiin kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Joillakin lääkkeillä on yhteisvaikutuksia SUSTIVAn kanssa.
Pidä luetteloa lääkkeistäsi näytettäväksi lääkärillesi ja apteekkiin.
- Voit pyytää lääkäriltäsi tai apteekista luettelon lääkkeistä, joilla on yhteisvaikutuksia SUSTIVAn kanssa.
- Älä aloita uuden lääkkeen ottamista kertomatta lääkärillesi. Lääkärisi voi kertoa sinulle, onko SUSTIVAa turvallista ottaa muiden lääkkeiden kanssa.
Miten minun pitäisi ottaa SUSTIVAa?
- Ota SUSTIVA 600 mg juuri sen verran kuin lääkärisi on määrännyt.
- Älä muuta annostasi tai lopeta SUSTIVA-valmisteen käyttöä, ellei lääkärisi kehota sinua tekemään niin.
- Pysy lääkärisi valvonnassa SUSTIVA-hoidon aikana.
- SUSTIVAa on käytettävä muiden antiretroviraalisten lääkkeiden kanssa.
- Ota SUSTIVA 1 kerran päivässä.
- SUSTIVA toimitetaan tabletteina tai kapseleina.
- SUSTIVA-tabletteja ei saa rikkoa.
- Niele SUSTIVA-tabletit tai kapselit kokonaisina nesteen kanssa.
Miten ja milloin SUSTIVA otetaan.
- Ota SUSTIVA 600 mg tyhjään mahaan nukkumaan mennessä. SUSTIVA 200 mg:n ottaminen ruoan kanssa lisää lääkkeen määrää kehossasi. Jotkut haittavaikutukset saattavat häiritä sinua vähemmän, jos otat SUSTIVA 600 mg -tabletteja tyhjään mahaan ja nukkumaan mennessä.
- Lapsesi lääkäri määrää oikean annoksen SUSTIVA 200 mg lapsesi painon perusteella.
- Jos sinulla on vaikeuksia niellä tabletteja tai kapseleita, kerro siitä lääkärillesi. Lääkärisi saattaa suositella SUSTIVA-kapselin avaamista ja sisällön sekoittamista ruokaan tai äidinmaidonkorvikkeeseen. Katso yksityiskohtaiset "Käyttöohjeet" tämän potilastietojen lopusta saadaksesi tietoa oikean tavan ottaa SUSTIVA 600 mg kapselin sprinklemenetelmällä.
- Aikuisten ja lasten, jotka ottavat SUSTIVA 600 mg kapselin ruiskutusmenetelmällä, ei tule syödä 2 tuntiin SUSTIVA-annoksen ottamisen jälkeen.
- Vauvoille ei saa antaa äidinmaidonkorviketta 2 tuntiin sen jälkeen, kun SUSTIVA-annos on otettu kapselin sprinklemenetelmällä.
- Älä missaa annosta SUSTIVAa. Jos unohdat ottaa SUSTIVAa, ota unohtunut annos heti, ellei ole melkein seuraavan annoksen aika. Älä ota 2 annosta kerralla. Ota vain seuraava annos säännöllisesti sovittuna aikana. Jos tarvitset apua parhaiden lääkkeiden ottavien aikojen suunnittelussa, kysy lääkäriltäsi tai apteekista.
- Jos otat liikaa SUSTIVAa, soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
- Kun SUSTIVA 600 mg -annoksesi alkaa olla vähissä, hanki lisää lääkäriltäsi tai apteekista. On tärkeää, että SUSTIVA ei lopu kesken. HIV-1:n määrä veressäsi voi nousta, jos lääke lopetetaan edes lyhyeksi ajaksi. Virus voi muuttua resistentiksi SUSTIVA 600 mg:lle ja sitä on vaikeampi hoitaa.
Mitkä ovat SUSTIVAn mahdolliset sivuvaikutukset?
SUSTIVA 600 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Jos sinulla on huimausta, keskittymisvaikeuksia tai uneliaisuutta, älä aja autoa, käytä koneita tai tee mitään, mikä vaatii sinulta valppautta.
Jotkut hermosto-oireet (esim. sekavuus, hitaat ajatukset ja fyysiset liikkeet ja harhaluulot [väärät uskomukset] tai hallusinaatiot [näkee tai kuulee asioita, joita muut eivät näe tai kuule]) voivat ilmaantua kuukausia tai vuosia SUSTIVA 600 mg -hoidon aloittamisen jälkeen. Ota välittömästi yhteyttä terveydenhuollon tarjoajaan, jos jokin näistä oireista ilmenee.
Kerro heti lääkärillesi, jos saat jonkin seuraavista oireista:
- Vakavia mielenterveysongelmia voi tapahtua ihmisillä, jotka käyttävät SUSTIVAa. Kerro heti lääkärillesi, jos sinulla on jokin seuraavista oireista:
- ole surullinen tai toivoton älä luota muihin ihmisiin
- tuntea ahdistusta tai levottomuutta kuulla tai nähdä asioita, jotka eivät ole todellisia
- olet ajatellut satuttaa itseäsi (itsemurha) tai olet yrittänyt satuttaa itseäsi tai muita
- eivät pysty liikkumaan tai puhumaan normaalisti
- eivät pysty erottamaan, mikä on totta tai totta ja mikä on väärää tai epätodellista
- Hermoston oireet ovat yleisiä ihmisillä, jotka käyttävät SUSTIVA 200 mg:aa ja voivat olla vakavia. Nämä oireet alkavat yleensä SUSTIVA 200 mg -hoidon ensimmäisen tai toisen päivän aikana ja häviävät yleensä 2–4 viikon hoidon jälkeen. Jotkut oireet voivat ilmaantua kuukausia tai vuosia SUSTIVA-hoidon aloittamisen jälkeen. Nämä oireet voivat pahentua, jos juot alkoholia, käytät lääkettä mielenterveysongelmiin tai käytät tiettyjä katulääkkeitä SUSTIVA-hoidon aikana. Oireita voivat olla:
- huimaus
- keskittymisvaikeuksia
- nukahtamisvaikeuksia
- uneliaisuus
- epätavallisia unia
- koordinaation puute tai tasapainovaikeudet
- Ihottuma on yleinen SUSTIVA 600 mg:n kanssa, mutta voi joskus olla vakava. Ihottuma häviää yleensä ilman muutoksia hoitoon. Jos sinulle ilmaantuu ihottuma, johon liittyy jokin seuraavista oireista, kerro siitä heti lääkärillesi:
- ihottuma kutinalla tai ilman
- ihon kuorinta
- kuume
- suun haavaumat
- kasvosi turvotus
- punaiset tai tulehtuneet silmät, kuten "vaaleanpunainen silmä" (sidekalvotulehdus)
- rakkuloita tai ihovaurioita
- Maksaongelmat, mukaan lukien maksan vajaatoiminta ja kuolema voi tapahtua ihmisillä, jotka käyttävät SUSTIVAa. Maksaongelmia voi esiintyä ihmisillä, joilla ei ole aiemmin ollut maksaongelmia. Lääkärisi tekee verikokeita maksan tarkistamiseksi ennen SUSTIVA 200 mg -hoidon aloittamista ja hoidon aikana.
- ihosi tai silmiesi valkoinen osa muuttuu keltaisiksi (keltatauti)
- et halua syödä ruokaa useaan päivään tai pidempään
- virtsasi tummuu
- tunnet pahoinvointia vatsassasi
- uloste muuttuvat vaaleaksi
- sinulla on alavatsan alueen (vatsan) kipua
- Kohtaukset voi tapahtua ihmisillä, jotka käyttävät SUSTIVAa. Kouristuskohtaukset ovat todennäköisemmin, jos sinulla on ollut kohtauksia aiemmin. Kerro lääkärillesi, jos sinulla on ollut kouristuskohtaus tai jos käytät lääkkeitä kouristuskohtausten ehkäisemiseksi.
- Muutokset immuunijärjestelmässäsi (immuunireaktion oireyhtymä) voi tapahtua, kun aloitat HIV-1-lääkkeiden käytön. Immuunijärjestelmäsi voi vahvistua ja alkaa taistella infektioita vastaan, jotka ovat olleet piilossa kehossasi pitkään. Kerro lääkärillesi, jos sinulle ilmaantuu uusia oireita HIV-1-lääkityksen aloittamisen jälkeen.
- Muutokset kehon rasvassa voi tapahtua ihmisillä, jotka käyttävät HIV-1-lääkettä. Näihin muutoksiin voi sisältyä rasvan lisääntyminen yläselässä ja niskassa ("puhvelin kyssä"), rinnassa ja kehon pääosassa (runko). Myös jaloista, käsivarsista ja kasvoista voi laskea rasvaa. Näiden sairauksien syytä ja pitkäaikaisia terveysvaikutuksia ei tunneta.
SUSTIVA 600mg:n yleisimmät sivuvaikutukset ovat:
- ihottuma
- epänormaalit unet
- huimaus
- väsymys
- pahoinvointi
- nukahtamisvaikeuksia
- päänsärky
- oksentelua
- keskittymisvaikeuksia
Joillakin SUSTIVAa käyttävillä potilailla on kohonnut veren lipidiarvot (kolesteroli ja triglyseridit). Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikki SUSTIVAn mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää SUSTIVA?
- Säilytä SUSTIVA-kapselit ja -tabletit huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
Pidä SUSTIVA ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa SUSTIVAsta
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä SUSTIVA 600 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna SUSTIVA 600 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltä tietoja SUSTIVAsta, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja saat osoitteesta www.sustiva.com tai soittamalla numeroon 1-800-321-1335.
Mitä ainesosia SUSTIVA sisältää?
Aktiivinen ainesosa: efavirentsi
Inaktiiviset ainesosat:
SUSTIVA 600mg kapselit: laktoosimonohydraatti, magnesiumstearaatti, natriumlauryylisulfaatti ja natriumtärkkelysglykolaatti. Kapselin kuori sisältää gelatiinia, natriumlauryylisulfaattia, titaanidioksidia ja/tai keltaista rautaoksidia. Kapselin kuori voi sisältää myös piidioksidia. Kapselit on painettu musteella, joka sisältää karmiininsinistä 40, FD&C Blue No. 2:ta ja titaanidioksidia.
SUSTIVA tabletit: kroskarmelloosinatrium, hydroksipropyyliselluloosa, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa ja natriumlauryylisulfaatti. Tabletin kalvopäällyste sisältää Opadry Yellowia ja Opadry Clearia. Tabletit on kiillotettu karnaubavahalla ja painettu violetilla musteella, Opacode WB.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
Käyttöohjeet
SUSTIVA® (sus-TEE-vah) (efavirentsi) kapselit
SUSTIVA 600mg annoksen valmistaminen kapselin sprinklemenetelmällä
Lue nämä käyttöohjeet ennen kuin valmistat ensimmäisen SUSTIVA-annoksen ruokaan tai äidinmaidonkorvikkeeseen sekoitettuna kapselin ruiskutusmenetelmällä, aina kun saat täyttöä ja tarpeen mukaan. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että puhut lääkärillesi terveydentilastasi tai hoidostasi. Kysy lääkäriltäsi tai apteekista, jos sinulla on kysyttävää SUSTIVA 200 mg -annoksen sekoittamisesta tai annostelusta kapseliruiskutusmenetelmällä.
Tärkeää tietoa:
- Lisätietoja SUSTIVA 600 mg kapseleista on potilastiedotteessa.
- Kapselin sirotusmenetelmää SUSTIVA-kapseleiden sisällön sekoittamiseen pehmeän ruoan tai äidinmaidonkorvikkeen kanssa voidaan käyttää aikuisille tai lapsille, jotka eivät voi niellä kapseleita tai tabletteja.
- Ota SUSTIVA 600 mg tyhjään mahaan nukkumaan mennessä.
- Älä syö 2 tuntiin sen jälkeen, kun olet ottanut SUSTIVAn ruokaan sekoitettuna.
- Vauvoille, jotka ovat tarpeeksi vanhoja nielemään ruokaa, tulee antaa SUSTIVAa kapselin ruoan kanssa sekoitettuna äidinmaidonkorvikkeen sijaan.
- Keskustele lääkärisi kanssa auttaaksesi päättämään parhaan aikataulun antaa vauvallesi SUSTIVA sekoitettuna äidinmaidonkorvikkeeseen kapseliruiskutusmenetelmällä.
SUSTIVA 600mg annoksen valmistaminen ruokaan sekoitettuna kapselin sprinkle-menetelmällä.
Ennen kuin valmistat annoksen SUSTIVA 200 mg ruokaa sekoitettuna kapselin sprinklemenetelmällä, kerää seuraavat tarvikkeet:
- paperipyyhkeitä
- teelusikallinen mittaamiseen
- pieni lusikka sekoittamista ja ruokintaa varten
- pieni puhdas astia (esim pieni kuppi tai kulho)
- pehmeitä ruokia, kuten omenasosetta, rypälehyytelöä tai jogurttia
Vaihe 1. Valitse puhdas, tasainen työtaso. Aseta puhdas paperipyyhe työtasolle. Aseta sitten muut tarvikkeet paperipyyhkeelle.
Vaihe 2. Pese ja kuivaa kätesi hyvin.
Vaihe 3. Laita pieneen astiaan 1–2 teelusikallista pehmeää ruokaa, kuten omenasosetta, viinirypälehyytelöä tai jogurttia (katso Kuva A ). Ruoan väri ja paksuus voivat muuttua, kun se sekoitetaan lääkkeen kanssa.
Kuva A
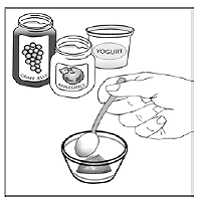
Vaihe 4. SUSTIVA 200 mg kapselissa on 2 osaa. Katso SUSTIVA-kapselista, mikä kapselin osa menee päällekkäin toisen osan kanssa (katso Kuva B ).
Kuva B
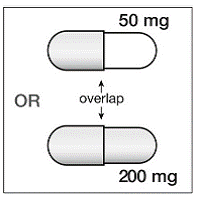
Vaihe 5. Pidä SUSTIVA-kapselia sivuttain (vaaka-asennossa) suoraan ruoka-astian päällä. Pidä SUSTIVA-kapselin päitä peukaloiden ja etusormiesi välissä (katso Kuva C ).
Kuva C
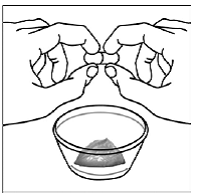
Vaihe 6. Purista peukalolla ja etusormella SUSTIVA 600 mg kapselin päällekkäisen osan päätä (katso Kuva D ).
Kuva D
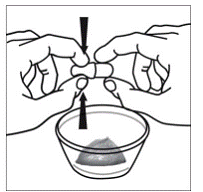
Kierrä sitten varovasti SUSTIVA 600 mg kapselin molempia päitä vastakkaisiin suuntiin avataksesi sen (katso Kuva E ). Varo läikyttämästä kapselin sisältöä tai levittämästä sitä ilmaan.
Kuva E

Vaihe 7. Ripottele SUSTIVA-kapselin sisältö ruoan päälle (katso Kuva F ).
- Tarkista kapselin kuoret varmistaaksesi, että ne ovat tyhjiä.
- Heitä pois tyhjät kapselin kuoret.
Kuva F

Jos määrätty kokonaisannos on enemmän kuin 1 kapseli, noudata vaiheita 4–7 kunkin kapselin kohdalla. Älä lisää ruokaa.
Vaiheet 8–11 on suoritettava 30 minuutin sisällä lääkkeen sekoittamisesta (ks Kuva G ).
Kuva G

Vaihe 8. Sekoita kapselin sisältö ja ruoka varovasti pienellä lusikalla (katso Kuva H ). Sprinkit eivät liukene. Seos näyttää rakeiselta, mutta ei saa olla kokkareinen.
Kuva H
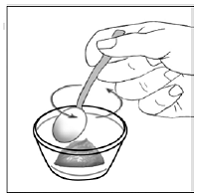
Vaihe 9. Käytä pientä lusikkaa ruoan ja kapselin sisällön antamiseen tai ottamiseen. Varmista, että kaikki seos on nielty.
Vaihe 10. Lisää noin 2 teelusikallista enemmän ruokaa tyhjään astiaan ja sekoita kevyesti pienellä lusikalla, jotta se sekoittuu astiassa mahdollisesti vielä olevan kapselin sisältöön.
Vaihe 11. Käytä pientä lusikkaa ruoan ja kapselin sisällön antamiseen tai ottamiseen. Varmista, että kaikki seos on nielty.
Vaihe 12. Pese astia ja lusikat. Heitä talouspaperi pois ja puhdista työtaso. Pese kätesi.
SUSTIVA 600 mg annoksen valmistaminen äidinmaidonkorvikkeeseen sekoitettuna kapselin sprinklemenetelmällä
Älä anna SUSTIVA-kapselin sisältöä vauvallesi pullossa varmistaaksesi, että vauva saa kaiken lääkkeen.
Ennen kuin valmistat annoksen äidinmaidonkorvikkeeseen sekoitettua SUSTIVAa kapseliruiskutusmenetelmällä, kerää seuraavat tarvikkeet:
- paperipyyhkeitä
- teelusikallinen sekoittamiseen ja mittaamiseen
- pieni puhdas astia (esim pieni kuppi tai kulho) (katso Kuva I ).
- 10 ml:n annosruisku (kysy tätä apteekista) (ks Kuva I ).
- äidinmaidonkorvike huoneenlämmössä.
Kuva I
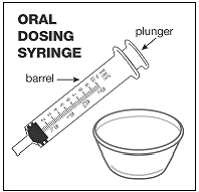
Vaihe 1. Valmista äidinmaidonkorvike äidinmaidonkorvikkeen pakkauksessa olevien ohjeiden mukaan. Käytät noin 1 unssia kaavaa lääkkeen antamiseen. Jäljellä olevaa korviketta ei saa antaa lapselle 2 tuntiin.
Vaihe 2. Valitse puhdas, tasainen työtaso. Aseta puhdas paperipyyhe työtasolle. Aseta tarvitsemasi tarvikkeet paperipyyhkeelle.
Vaihe 3. Pese ja kuivaa kätesi hyvin.
Vaihe 4. Kaada astiaan 2 tl huoneenlämpöistä äidinmaidonkorviketta (katso Kuva J ).
Kuva J
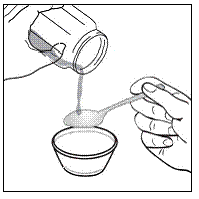
Vaihe 5. SUSTIVA-kapselissa on 2 osaa. Katso SUSTIVA-kapselista, mikä kapselin osa menee päällekkäin toisen osan kanssa (katso Kuva K ).
Kuva K
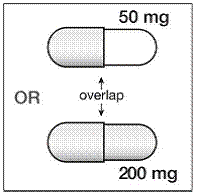
Vaihe 6. Pidä SUSTIVA-kapselia sivuttain (vaaka-asennossa) suoraan äidinmaidonkorvikkeen säiliön päällä. Pidä SUSTIVA 600 mg kapselin kumpaakin päätä peukaloiden ja etusormiesi välissä (ks. Kuva L ).
Kuva L
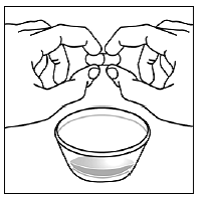
Vaihe 7. Purista peukalolla ja etusormella SUSTIVA-kapselin päällekkäisen osan päätä (katso Kuva M ).
Kuva M
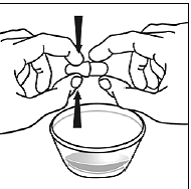
Kierrä sitten varovasti SUSTIVA-kapselin molempia päitä vastakkaisiin suuntiin avataksesi sen (katso Kuva N ). Varo läikyttämästä kapselin sisältöä tai levittämästä sitä ilmaan.
Kuva N
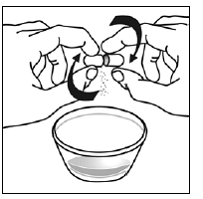
Vaihe 8. Ripottele SUSTIVA 600 mg kapselin sisältö äidinmaidonkorvikkeen päälle (katso Kuva O ).
- Tarkista kapselin kuoret varmistaaksesi, että ne ovat tyhjiä.
- Heitä pois tyhjät kapselin kuoret.
Kuva O
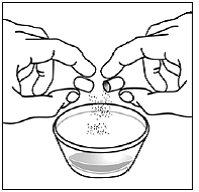
Jos määrätty kokonaisannos on enemmän kuin 1 kapseli, noudata vaiheita 5–8 kunkin kapselin kohdalla. Älä lisää äidinmaidonkorviketta.
Vaiheet 9–12 on suoritettava 30 minuutin sisällä lääkkeen sekoittamisesta (ks Kuva P ).
Kuva P

Vaihe 9. Pidä säiliöstä kiinni yhdellä kädellä. Sekoita toisella kädellä teelusikalla varovasti kapselin sisältö ja äidinmaidonkorvike (katso Kuva Q ). Sprinkit eivät liukene. Seos näyttää rakeiselta, mutta ei saa olla kokkareinen.
Kuva Q
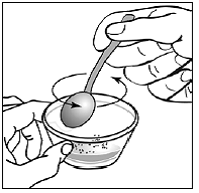
Vaihe 10. Koko seoksen vetäminen oraaliseen annosruiskuun:
Kuva R
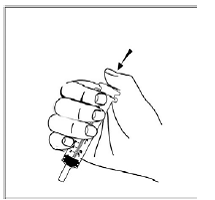
Kuva S
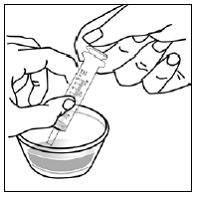
Kuva T
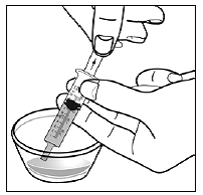
- Tarkista, että mäntä on työnnetty kokonaan ruiskun piippuun (katso Kuva R ).
- Aseta ruiskun kärki astiassa olevaan seokseen (katso Kuva S ).
- Vedä mäntää hitaasti taaksepäin ja vedä koko seos (katso Kuva T ).
Vaihe 11. Aseta ruiskun kärki vauvan suuhun sisäposkea pitkin (katso Kuva U ). Paina mäntää hitaasti antaaksesi vauvallesi koko seos.
Kuva U
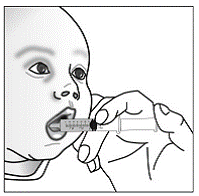
Vaihe 12. Varmista, että kaikki lääkkeet annetaan vauvallesi:
- Toista yllä oleva vaihe 4.
- Sekoita teelusikalla.
- Toista sitten Vaiheet 10 ja 11 yllä (katso Kuva V ).
Kuva V
Vaihe 13. Irrota mäntä annosruiskusta. Pese säiliö, teelusikka ja annosruisku. Anna männän ja ruiskun säiliön kuivua ennen kuin asetat ne takaisin yhteen.
Vaihe 14. Heitä talouspaperi pois ja puhdista työtaso. Pese kätesi.
Miten SUSTIVA 600 mg kapseleita säilytetään?
- Säilytä SUSTIVA-kapselit huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
Pidä SUSTIVA 600 mg:n kapselit ja kaikki lääkkeet poissa lasten ulottuvilta.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä käyttöohjeet.
