Copegus 100mg Ribavirin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Copegus 100mg on ja miten sitä käytetään?
Copegus 100mg on reseptilääke, jota käytetään kroonisen hepatiitti C:n oireiden hoitoon. Copegus 100mg -valmistetta voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Copegus kuuluu lääkeluokkaan, jota kutsutaan hepatiitti B:n/hepatiitti C:n aiheuttajiksi; RSV-agentit.
Mitkä ovat Copegusin mahdolliset sivuvaikutukset?
Copegus voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- ongelmia näkösi kanssa,
- voimakas kipu ylävatsassa, joka leviää selkään,
- pahoinvointi,
- oksentelua,
- ripuli,
- uusi tai paheneva yskä,
- kuume,
- pistävä rintakipu,
- hengityksen vinkuminen,
- hengenahdistus,
- vakava masennus,
- ajatukset itsensä vahingoittamisesta tai jonkun muun vahingoittamisesta,
- vaalea tai kellastunut iho,
- tumma virtsa,
- hämmennystä,
- heikkous,
- vilunväristykset,
- flunssan kaltaiset oireet,
- turvonneet ikenet,
- suun haavaumat,
- ihohaavat,
- helppo mustelma,
- epätavallinen verenvuoto ja
- huimaus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Copegusin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ruokahalun menetys,
- kuume,
- vilunväristykset tai vapina,
- alhainen verisolujen määrä,
- anemia,
- heikkous,
- väsymys,
- päänsärky,
- lihaskipu,
- mielialan muutoksia,
- ahdistus ja
- ärtyneisyys
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Copegusin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VAKAVIEN HÄIRIÖIDEN JA RIBAVIRIINIIN LIITTYVIEN VAIKUTUSTEN RISKI
COPEGUS (ribaviriini) -monoterapia ei ole tehokas kroonisen hepatiitti C -virusinfektion hoidossa, eikä sitä tule käyttää yksinään tähän käyttöaiheeseen.
Ribaviriinin ensisijainen kliininen toksisuus on hemolyyttinen anemia. Ribaviriinihoitoon liittyvä anemia voi johtaa sydänsairauksien pahenemiseen ja johtaa kuolemaan johtaviin ja ei-fataalisiin sydäninfarkteihin. Potilaita, joilla on ollut merkittävä tai epästabiili sydänsairaus, ei tule hoitaa COPEGUS-valmisteella [katso VAROITUKSET JA VAROTOIMET, HAITTAVAIKUTUKSET sekä ANNOSTUS JA ANTO].
Merkittäviä teratogeenisiä ja/tai alkioita tappavia vaikutuksia on osoitettu kaikilla ribaviriinille altistuneilla eläinlajilla. Lisäksi ribaviriinin toistuvan annoksen puoliintumisaika on 12 päivää, ja se voi säilyä muissa kuin plasma-osastoissa jopa 6 kuukautta. Siksi ribaviriini, mukaan lukien COPEGUS 100 mg, on vasta-aiheinen raskaana oleville naisille ja raskaana olevien naisten miespuolisille puolisoille. Äärimmäistä varovaisuutta on noudatettava raskauden välttämiseksi hoidon aikana ja 6 kuukauden ajan hoidon päättymisen jälkeen sekä naispotilailla että ribaviriinihoitoa saavien miespotilaiden naispuolisilla kumppaneilla. Hoidon aikana ja 6 kuukauden hoidon jälkeisen seurantajakson aikana on käytettävä vähintään kahta luotettavaa tehokasta ehkäisyä [katso VASTA-AIHEET, VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä ryhmissä].
KUVAUS
COPEGUS 100 mg, ribaviriini, on nukleosidianalogi, jolla on antiviraalista vaikutusta. Ribaviriinin kemiallinen nimi on 1-β-dribofuranosyyli-1H-1,2,4-triatsoli-3-karboksamidi ja sillä on seuraava rakennekaava:
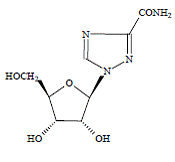
Ribaviriinin empiirinen kaava on C8H12N4O5 ja molekyylipaino on 244,2. Ribaviriini on valkoinen tai luonnonvalkoinen jauhe. Se liukenee vapaasti veteen ja liukenee hieman vedettömään alkoholiin.
COPEGUS (ribaviriini) on saatavana vaaleanpunaisena tai vaaleanpunaisena, litteänä, soikeana, kalvopäällysteisenä tablettina suun kautta annettavaksi. Jokainen tabletti sisältää 200 mg ribaviriinia ja seuraavia inaktiivisia aineosia: esigelatinoitu tärkkelys, mikrokiteinen selluloosa, natriumtärkkelysglykolaatti, maissitärkkelys ja magnesiumstearaatti. Tabletin pinnoite sisältää Chromatone-P:tä tai Opadry Pinkia (valmistettu käyttämällä hydroksipropyylimetyyliselluloosaa, talkkia, titaanidioksidia, synteettistä keltaista rautaoksidia ja synteettistä punaista rautaoksidia), etyyliselluloosaa (ECD-30) ja triasetiinia.
INDIKAATIOT
COPEGUS 100 mg yhdessä PEGASYSin (peginterferoni alfa-2a) kanssa on tarkoitettu 5-vuotiaille ja sitä vanhemmille potilaille, joilla on krooninen hepatiitti C (CHC) -virusinfektio ja joilla on kompensoitunut maksasairaus ja joita ei ole aiemmin hoidettu interferoni alfalla.
Seuraavat seikat tulee ottaa huomioon aloitettaessa COPEGUS 100 mg -yhdistelmähoitoa PEGASYSin kanssa:
- Tämä käyttöaihe perustuu yhdistelmähoitoa koskeviin kliinisiin tutkimuksiin potilailla, joilla on CHC ja kompensoitu maksasairaus, joista joillakin oli histologisia todisteita kirroosista (Child-Pugh-luokka A), ja aikuispotilailla, joilla on kliinisesti stabiili HIV-sairaus ja CD4-luku yli 100 soluja/mm³.
- Tämä käyttöaihe perustuu havaitsemattoman HCV-RNA:n saavuttamiseen 24 tai 48 viikon hoidon jälkeen HCV-genotyypin perusteella ja jatkuvan virologisen vasteen (SVR) ylläpitämiseen 24 viikkoa viimeisen annoksen jälkeen.
- Turvallisuutta ja tehoa koskevia tietoja ei ole saatavilla yli 48 viikkoa kestävästä hoidosta.
- COPEGUS 100 mg:n ja PEGASYS-hoidon turvallisuutta ja tehoa ei ole osoitettu maksan tai muun elinsiirron saajilla, potilailla, joilla on dekompensoitunut maksasairaus tai jotka eivät ole aiemmin saaneet vastetta interferonihoitoon.
- COPEGUS-hoidon turvallisuutta ja tehoa adenovirus-, RSV-, parainfluenssa- tai influenssainfektioiden hoidossa ei ole osoitettu. COPEGUS-valmistetta ei tule käyttää näihin käyttöaiheisiin. Inhaloitavaksi tarkoitettu ribaviriinilla on erillinen pakkausseloste, johon tulee tutustua, jos harkitaan ribaviriinin inhalaatiohoitoa.
ANNOSTELU JA HALLINNOINTI
COPEGUS 100 mg tulee ottaa ruoan kanssa. COPEGUS tulee antaa yhdessä PEGASYSin kanssa; On tärkeää huomata, että COPEGUS 100 mg -valmistetta ei koskaan tule antaa monoterapiana. Katso PEGASYS Pakkausseloste sisältää kaikki PEGASYSin annostelua ja antoa koskevat ohjeet.
Krooninen hepatiitti C -monoinfektio
Aikuiset potilaat
Suositeltu COPEGUS 100 mg -tablettien annos on esitetty taulukossa 1. Suositeltu hoidon kesto potilailla, joita ei ole aiemmin hoidettu ribaviriinilla ja interferonilla, on 24-48 viikkoa.
COPEGUS 100 mg:n vuorokausiannos on 800-1200 mg suun kautta jaettuna kahteen annokseen. Annos on yksilöitävä potilaalle riippuen sairauden lähtötilanteen ominaisuuksista (esim. genotyyppi), hoitovasteesta ja hoito-ohjelman siedettävyydestä (ks. ).
Pediatriset potilaat
PEGASYSia annetaan 180 mikrog/1,73 m² x BSA kerran viikossa ihon alle, maksimiannokseen 180 mikrogrammaa, ja se tulee antaa yhdessä ribaviriinin kanssa. Suositeltu hoidon kesto potilailla, joilla on genotyyppi 2 tai 3, on 24 viikkoa ja muille genotyypeille 48 viikkoa.
COPEGUS tulee antaa yhdessä PEGASYSin kanssa. COPEGUS 100 mg on saatavana vain 200 mg:n tabletteina, ja siksi terveydenhuollon tarjoajan tulee selvittää, voiko lapsipotilas niellä tämän kokoisen tabletin. COPEGUS-valmisteen suositellut annokset on esitetty taulukossa 2. Potilaiden, jotka aloittavat hoidon ennen 18-vuotissyntymäpäiväänsä, tulee säilyttää lasten annostus hoidon loppuun asti.
Krooninen C-hepatiitti ja HIV-yhteisinfektio
Aikuiset potilaat
Suositeltu annos kroonisen C-hepatiitti C:n hoitoon potilailla, joilla on samanaikaisesti HIV-infektio, on PEGASYS 180 mikrog ihon alle kerran viikossa ja COPEGUS 800 mg suun kautta vuorokaudessa yhteensä 48 viikon ajan riippumatta HCV:n genotyypistä.
Annoksen muutokset
Aikuiset ja lapsipotilaat
Jos COPEGUS/PEGASYS-yhdistelmähoidon aikana ilmaantuu vakavia haittavaikutuksia tai laboratorioarvojen poikkeavuuksia, annosta on muutettava tai hoito lopetettava tarvittaessa, kunnes haittavaikutukset häviävät tai vaikeutuvat. Jos intoleranssi jatkuu annoksen muuttamisen jälkeen, COPEGUS/PEGASYS-hoito on lopetettava. Taulukossa 3 on potilaan hemoglobiinipitoisuuden ja sydämen tilan perusteella ohjeet annoksen muuttamisesta ja hoidon lopettamisesta.
COPEGUS 100 mg -valmistetta tulee antaa varoen potilaille, joilla on ennestään sydänsairaus. Potilaat tulee arvioida ennen hoidon aloittamista, ja heitä tulee seurata asianmukaisesti hoidon aikana. Jos kardiovaskulaarinen tila heikkenee, hoito on lopetettava [katso VAROITUKSET JA VAROTOIMET ].
Tässä taulukossa esitetyt ohjeet COPEGUS 100 mg -annoksen muuttamisesta koskevat myös laboratorioarvojen poikkeavuuksia tai muita haittavaikutuksia kuin hemoglobiiniarvojen laskua.
Aikuiset potilaat
Kun COPEGUS 100 mg:n antaminen on keskeytetty joko laboratoriopoikkeaman tai kliinisen haittavaikutuksen vuoksi, COPEGUS 100 mg -hoito voidaan yrittää aloittaa uudelleen annoksella 600 mg vuorokaudessa ja nostaa annosta edelleen 800 mg:aan vuorokaudessa. COPEGUS-annoksen suurentamista alkuperäiseen määrättyyn annokseen (1000–1200 mg) ei kuitenkaan suositella.
Pediatriset potilaat
Laboratorioarvojen poikkeavuuden tai kliinisen haittavaikutuksen korjaantumisen jälkeen voidaan yrittää nostaa COPEGUS 100 mg -annosta alkuperäiseen annokseen lääkärin harkinnan mukaan. Jos COPEGUS-hoito on keskeytetty laboratoriopoikkeaman tai kliinisen haittavaikutuksen vuoksi, COPEGUS 100 mg -hoito voidaan yrittää aloittaa uudelleen puolella täydestä annoksesta.
Munuaisten vajaatoiminta
COPEGUS-valmisteen päivittäistä kokonaisannosta tulee pienentää potilailla, joiden kreatiniinipuhdistuma on pienempi tai yhtä suuri kuin 50 ml/min. ja PEGASYSin viikkoannosta tulee pienentää, jos kreatiniinipuhdistuma on alle 30 ml/min, kuten taulukossa 4 [ks. Käyttö tietyissä populaatioissa , Farmakokinetiikka , ja PEGASYS Pakkausseloste ].
COPEGUS 100 mg:n annosta ei saa muuttaa enempää potilailla, joilla on munuaisten vajaatoiminta. Jos vakavia haittavaikutuksia tai laboratorioarvojen poikkeavuuksia kehittyy, COPEGUS-hoito on tarvittaessa keskeytettävä, kunnes haittavaikutukset ovat hävinneet tai vaikeutuneet. Jos intoleranssi jatkuu COPEGUS 100 mg -annoksen uudelleen aloittamisen jälkeen, COPEGUS/PEGASYS-hoito on lopetettava.
Tietoja ei ole saatavilla lapsista, joilla on munuaisten vajaatoiminta.
Annostelun lopettaminen
PEGASYS/COPEGUS 100 mg -hoidon lopettamista tulee harkita, jos potilaan HCV RNA:n määrä ei ole laskenut vähintään 2 log10 lähtötasosta 12 viikon hoidon aikana tai jos HCV RNA:ta ei ole havaittavissa 24 viikon hoidon jälkeen.
PEGASYS/COPEGUS 100 mg -hoito tulee lopettaa potilailla, joille kehittyy maksan vajaatoiminta hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
COPEGUS (ribaviriini) on saatavana vaaleanpunaisena tai vaaleanpunaisena, litteänä, soikeana, kalvopäällysteisenä tablettina suun kautta annettavaksi. Yksi tabletti sisältää 200 mg ribaviriinia.
COPEGUS® (ribaviriini) on saatavana tabletteina suun kautta annettavaksi. Jokainen tabletti sisältää 200 mg ribaviriinia ja on väriltään vaaleanpunaisesta vaaleanpunaiseen, litteä, soikea, kalvopäällysteinen, ja sen toisella puolella on kaiverrus RIB 200 ja toisella puolella ROCHE. Ne on pakattu 168 tabletin pulloon ( NDC 0004-0086-94).
Varastointi ja käsittely
Säilytä COPEGUS®-tablettipulloa 25 °C:ssa (77 °F); retket ovat sallittuja 15 °C - 30 °C (59 °F - 86 °F) [katso USP-ohjattu huonelämpötila ]. Pidä pullo tiiviisti suljettuna.
Valmistaja: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Roche Groupin jäsen, 1 DNA Way, South San Francisco, CA 94080-4990. Tarkistettu: elokuu 2015
SIVUVAIKUTUKSET
PEGASYS yhdessä COPEGUSin kanssa aiheuttaa monenlaisia vakavia haittavaikutuksia [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]. Yleisimpiä COPEGUS/PEGASYSin aiheuttamia tai pahentamia vakavia tai henkeä uhkaavia haittavaikutuksia ovat masennus, itsemurha, huumeiden väärinkäytön/yliannostuksen uusiutuminen ja bakteeri-infektiot, joita esiintyy alle 1 %:lla. Maksan vajaatoimintaa esiintyi 2 %:lla (10/574) CHC/HIV-potilaista [ks. VAROITUKSET JA VAROTOIMET ].
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Aikuiset potilaat
Keskeisissä rekisteröintitutkimuksissa NV15801 ja NV15942 886 potilasta sai COPEGUS-valmistetta 48 viikon ajan annoksina 1000/1200 mg painon perusteella. Näissä tutkimuksissa yksi tai useampi vakava haittavaikutus ilmeni 10 %:lla CHC-monoinfektoituneista potilaista ja 19 %:lla CHC/HIV-potilaista, jotka saivat PEGASYSia yksinään tai yhdessä COPEGUSin kanssa. Yleisin vakava haittatapahtuma (3 % CHC:ssä ja 5 % CHC/HIV:ssä) oli bakteeri-infektio (esim. sepsis, osteomyeliitti, endokardiitti, pyelonefriitti, keuhkokuume).
Muita vakavia haittavaikutuksia esiintyi alle 1 %:lla ja niitä olivat: itsemurha, itsemurha-ajatukset, psykoosi, aggressio, ahdistus, huumeiden väärinkäyttö ja huumeiden yliannostus, angina pectoris, maksan toimintahäiriö, rasvamaksa, kolangiitti, rytmihäiriöt, diabetes mellitus, autoimmuuniilmiöt (esim. kilpirauhasen liikatoiminta, kilpirauhasen vajaatoiminta, sarkoidoosi, systeeminen lupus erythematosus, nivelreuma), perifeerinen neuropatia, aplastinen anemia, peptinen haava, maha-suolikanavan verenvuoto, haimatulehdus, paksusuolitulehdus, sarveiskalvon haavauma, keuhkoembolia, keuhkoveritulppa, kooma, myosiitti, aivojen verenpurkaus psykoottinen häiriö ja hallusinaatiot.
Kliinisissä tutkimuksissa 98 %:lla potilaista oli yksi tai useampi haittavaikutus. Yleisimmin raportoidut haittavaikutukset olivat psykiatriset reaktiot, mukaan lukien masennus, unettomuus, ärtyneisyys, ahdistuneisuus ja flunssan kaltaiset oireet, kuten väsymys, kuume, lihaskipu, päänsärky ja jäykkyys. Muita yleisiä reaktioita olivat anoreksia, pahoinvointi ja oksentelu, ripuli, nivelkivut, pistoskohdan reaktiot, hiustenlähtö ja kutina.
osoittaa haittatapahtumien määrät, joita esiintyi vähintään 5 %:lla potilaista, jotka saivat pegyloitua interferonin ja ribaviriinin yhdistelmähoitoa CHC Clinical Trial, NV15801 -tutkimuksessa.
Kymmenen prosenttia CHC-monoinfektiopotilaista, jotka saivat 48 viikon PEGASYS-hoitoa yhdessä COPEGUS 100 mg:n annoksen kanssa, keskeytti hoidon; 16 % CHC/HIV-yhteisinfektion saaneista potilaista keskeytti hoidon. Yleisimmät syyt hoidon keskeyttämiseen olivat psykiatriset, flunssan kaltaiset oireyhtymät (esim. letargia, väsymys, päänsärky), iho- ja maha-suolikanavan häiriöt sekä laboratorioarvojen poikkeavuudet (trombosytopenia, neutropenia ja anemia).
Kaiken kaikkiaan 39 % CHC- tai CHC/HIV-potilaista tarvitsi PEGASYS- ja/tai COPEGUS-hoidon muuttamista. Yleisin syy PEGASYS-annoksen muuttamiseen CHC- ja CHC/HIV-potilailla olivat laboratorioarvojen poikkeavuudet; neutropeniaa (20 % ja 27 %) ja trombosytopeniaa (4 % ja 6 %, vastaavasti). Yleisin syy COPEGUS-annoksen muuttamiseen CHC- ja CHC/HIV-potilailla oli anemia (22 % ja 16 %, vastaavasti).
PEGASYS-annosta pienennettiin 12 %:lla potilaista, jotka saivat 1000 mg:sta 1200 mg:aan COPEGUS 100 mg:aa 48 viikon ajan ja 7 %:lla potilaista, jotka saivat 800 mg COPEGUS-valmistetta 24 viikon ajan. COPEGUS-annosta pienennettiin 21 %:lla potilaista, jotka saivat 1000 mg COPEGUS 100 mg:aa 1200 mg:aan 48 viikon ajan, ja 12 %:lla potilaista, jotka saivat 800 mg COPEGUS 100 mg 24 viikon ajan.
Kroonisilla C-hepatiitti-monoinfektoituneilla potilailla, joita hoidettiin 24 viikkoa PEGASYSillä ja 800 mg COPEGUS 100 mg:lla, vakavien haittavaikutusten ilmaantuvuuden havaittiin olevan pienempi (3 % vs. 10 %) ja hemoglobiini oli alle 10 g/dl (3 % vs. 15 %). , PEGASYSin (30 % vs. 36 %) ja COPEGUSin (19 % vs. 38 %) annoksen muuttaminen ja hoidosta lopettaminen (5 % vs. 15 %) verrattuna potilaisiin, joita hoidettiin 48 viikkoa PEGASYSillä ja 1000 mg tai 1200 mg COPEGUS. Toisaalta haittatapahtumien yleinen ilmaantuvuus näytti olevan samanlainen kahdessa hoitoryhmässä.
Pediatriset potilaat
Kliinisessä tutkimuksessa, jossa 114 lapsipotilasta (5–17-vuotiaita), joita hoidettiin PEGASYSillä yksinään tai yhdessä COPEGUS 100 mg:n kanssa, annosmuutoksia vaadittiin noin kolmanneksella koehenkilöistä, yleisimmin neutropenian ja anemian vuoksi. Yleisesti ottaen lapsipotilailla havaittu turvallisuusprofiili oli samanlainen kuin aikuisilla. Pediatrisessa tutkimuksessa yleisimmät haittatapahtumat potilailla, joita hoidettiin yhdistelmähoidolla PEGASYS ja COPEGUS 100 mg enintään 48 viikon ajan, olivat influenssan kaltainen sairaus (91 %), ylempien hengitysteiden infektio (60 %), päänsärky (64 %), maha-suolikanavan häiriö (56 %), ihosairaus (47 %) ja pistoskohdan reaktio (45 %). Seitsemän potilasta, jotka saivat PEGASYS- ja COPEGUS-yhdistelmähoitoa 48 viikon ajan, keskeyttivät hoidon turvallisuussyistä (masennus, psykiatrisen arvioinnin poikkeavuus, ohimenevä sokeus, verkkokalvon eritteet, hyperglykemia, tyypin 1 diabetes ja anemia). Vakavia haittavaikutuksia raportoitiin kahdella henkilöllä PEGASYS ja COPEGUS 100 mg yhdistelmähoitoryhmässä (hyperglykemia ja kolekystektomia).
Yhdistelmähoitoon satunnaistetuilla lapsipotilailla useimpien haittavaikutusten ilmaantuvuus oli samanlainen koko hoitojakson ajan (jopa 48 viikkoa plus 24 viikkoa seurantaa) verrattuna ensimmäisiin 24 viikkoon ja lisääntyi vain hieman päänsäryn ja ruoansulatuskanavan häiriön osalta. , ärtyneisyys ja ihottuma. Suurin osa haittavaikutuksista ilmeni ensimmäisten 24 hoitoviikon aikana.
Kasvun esto lapsipotilailla
[katso VAROITUKSET JA VAROTOIMET ].
PEGASYSin ja ribaviriinin yhdistelmähoidolla hoidetuilla lapsilla painon ja pituuden nousu viivästyi jopa 48 viikon hoidon aikana verrattuna lähtötilanteeseen. Sekä iän paino että pituus iän z-pisteet sekä normatiivisen populaation prosenttipisteet koehenkilön painon ja pituuden osalta laskivat hoidon aikana. Hoidon jälkeisen 2 vuoden seurannan lopussa useimmat koehenkilöt olivat palanneet lähtötason normatiivisen käyrän prosenttipisteisiin painon (64. keskimääräinen prosenttipiste lähtötilanteessa, 60. keskimääräinen prosenttipiste 2 vuotta hoidon jälkeen) ja pituuden (54. keskimääräinen prosenttipiste lähtötilanteessa, 56. keskimääräinen prosenttipiste 2 vuotta hoidon jälkeen). Hoidon lopussa 43 %:lla (23/53) koehenkilöistä painon prosenttipisteen lasku yli 15 prosenttiyksikköä ja 25 %:lla (13 53:sta) pituuden prosenttipisteen lasku yli 15 prosenttipisteellä normatiivisilla kasvukäyrillä. 2 vuotta hoidon jälkeen 16 % (6/38) koehenkilöistä oli yli 15 prosenttiyksikköä lähtöviivan painokäyrän alapuolella ja 11 % (4 38:sta) oli yli 15 prosenttiyksikköä peruspituuskäyrän alapuolella.
Kolmekymmentäkahdeksan 114 henkilöstä osallistui pitkäaikaiseen seurantatutkimukseen, joka ulottui jopa 6 vuoteen hoidon jälkeen. Useimmilla koehenkilöillä hoidon jälkeinen kasvun palautuminen 2 vuotta hoidon jälkeen säilyi 6 vuoteen hoidon jälkeen.
Yleiset haittavaikutukset CHC:ssä ja HIV-infektio (aikuiset)
PEGASYS/COPEGUS-hoitoa saaneiden potilaiden haittatapahtumaprofiili tutkimuksessa NR15961 oli yleensä samanlainen kuin yksiinfektiopotilailla tutkimuksessa NV15801 (taulukko 5). Tapauksia, joita esiintyi useammin samanaikaisilla potilailla, olivat neutropenia (40 %), anemia (14 %), trombosytopenia (8 %), painon lasku (16 %) ja mielialan muutokset (9 %).
Laboratoriokokeiden poikkeavuudet
Aikuiset potilaat
Hemolyysistä johtuva anemia on ribaviriinihoidon merkittävin toksisuus. Anemiaa (hemoglobiini alle 10 g/dl) havaittiin kliinisissä tutkimuksissa 13 %:lla kaikista COPEGUS- ja PEGASYS-yhdistelmähoitoa saaneista potilaista. Suurin hemoglobiinin lasku tapahtui ribaviriinihoidon aloittamisen ensimmäisten 8 viikon aikana [katso ANNOSTELU JA HALLINNOINTI ].
Pediatriset potilaat
Hemoglobiinin, neutrofiilien ja verihiutaleiden väheneminen saattaa edellyttää annoksen pienentämistä tai hoidon pysyvää lopettamista [ks. ANNOSTELU JA HALLINNOINTI ]. Useimmat kliinisen tutkimuksen aikana havaitut laboratorioarvojen poikkeavuudet palasivat lähtötasolle pian hoidon lopettamisen jälkeen.
Yhdistelmähoitoon satunnaistetuilla potilailla poikkeavuuksien ilmaantuvuus koko hoitovaiheen aikana (enintään 48 viikkoa plus 24 viikon seuranta) verrattuna ensimmäiseen 24 viikkoon lisääntyi hieman neutrofiilien osalta välillä 500-1000 solua/mm³ ja hemoglobiiniarvot välillä 8,5 ja 10 g/dl. Suurin osa hematologisista poikkeavuuksista ilmeni ensimmäisen 24 hoitoviikon aikana.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu ja raportoitu PEGASYS/COPEGUS 100 mg yhdistelmähoidon hyväksymisen jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imukudosjärjestelmän häiriöt
Puhdas punasoluaplasia
Korva- ja labyrinttihäiriöt
Kuulon heikkeneminen, kuulon heikkeneminen
Silmäsairaudet
Seroottinen verkkokalvon irtauma
Immuunihäiriöt
Maksa- ja munuaissiirteen hylkiminen
Aineenvaihdunta- ja ravitsemushäiriöt
Kuivuminen
Ihon ja ihonalaisten kudosten häiriöt
Stevens-Johnsonin oireyhtymä (SJS)
Toksinen epidermaalinen nekrolyysi (TEN)
HUUMEIDEN VUOROVAIKUTUKSET
Farmakokineettisen alatutkimuksen tulokset eivät osoittaneet farmakokineettistä yhteisvaikutusta PEGASYSin (peginterferoni alfa-2a) ja ribaviriinin välillä.
Nukleosidikäänteiskopioijaentsyymin estäjät (NRTI:t)
In vitro -tiedot osoittavat, että ribaviriini vähentää lamivudiinin, stavudiinin ja tsidovudiinin fosforylaatiota. Farmakokineettisiä (esim. plasmapitoisuudet tai solunsisäiset trifosforyloitujen aktiivisten metaboliittien pitoisuudet) tai farmakodynaamisia (esim. HIV/HCV:n virologisen suppression häviäminen) yhteisvaikutuksia ei havaittu, kun ribaviriini ja lamivudiini (n=18), stavudiini (n=10) tai tsidovudiinia (n=6) annettiin samanaikaisesti osana usean lääkkeen hoitoa potilaille, joilla oli HCV/HIV-infektio.
Tutkimuksessa NR15961 CHC/HIV-infektoituneiden kirroosipotilaiden joukossa, jotka saivat NRTI-lääkkeitä, havaittiin maksan vajaatoimintaa (joissakin tapauksissa kuolemaan johtavia) [ks. VAROITUKSET JA VAROTOIMET ].
Potilaita, jotka saavat PEGASYS/COPEGUS 100 mg ja NRTI-lääkkeitä, tulee seurata tarkasti hoitoon liittyvien toksisuuksien varalta. Lääkäreiden tulee tutustua vastaavien NRTI-lääkkeiden määräämistietoihin saadakseen ohjeita toksisuuden hallintaan. Lisäksi PEGASYSin, COPEGUS 100 mg:n tai molempien annoksen pienentämistä tai lopettamista tulee myös harkita, jos havaitaan pahenevia toksisia vaikutuksia, mukaan lukien maksan vajaatoiminta (esim. Child-Pugh suurempi tai yhtä suuri kuin 6) [ks. VAROITUKSET JA VAROTOIMET ja ANNOSTELU JA HALLINNOINTI ].
Didanosiini
COPEGUS-valmisteen ja didanosiinin samanaikainen käyttö on vasta-aiheista. Didanosiinin tai sen aktiivisen metaboliitin (dideoksiadenosiini-5'-trifosfaatti) pitoisuudet suurenevat, kun didanosiinia annetaan samanaikaisesti ribaviriinin kanssa, mikä voi aiheuttaa tai pahentaa kliinisiä toksisuuksia. Kliinisissä tutkimuksissa on raportoitu kohtalokkaasta maksan vajaatoiminnasta sekä perifeerisesta neuropatiasta, haimatulehduksesta ja oireellisesta hyperlaktatemiasta/maitohappoasidoosista [ks. VASTA-AIHEET ].
Zidovudiini
Tutkimuksessa NR15961 potilaille, joille annettiin tsidovudiinia yhdessä PEGASYS/COPEGUSin kanssa, kehittyi vaikeaa neutropeniaa (ANC alle 500) ja vaikeaa anemiaa (hemoglobiini alle 8 g/dl) useammin kuin vastaavilla potilailla, jotka eivät saaneet tsidovudiinia (neutropenia 15 % vs. 9 %) (anemia 5 % vs. 1 %). Tsidovudiinihoidon lopettamista tulee harkita lääketieteellisesti tarkoituksenmukaisena.
Sytokromi P450:n metaboloimat lääkkeet
In vitro -tutkimukset osoittavat, että ribaviriini ei estä CYP 2C9-, CYP 2C19-, CYP 2D6- tai CYP 3A4:ää.
Atsatiopriini
Ribaviriinin käytön kroonisen hepatiitti C:n hoitoon atsatiopriinia saavilla potilailla on raportoitu aiheuttavan vaikeaa pansytopeniaa ja saattaa lisätä atsatiopriiniin liittyvän myelotoksisuuden riskiä. Inosiinimonofosfaattidehydrogenaasia (IMDH) tarvitaan yhdelle atsatiopriinin metaboliareiteistä. Ribaviriinin tiedetään estävän IMDH:ta, mikä johtaa atsatiopriinimetaboliitin, 6-metyylitioinosiinimonofosfaatin (6-MTITP) kertymiseen, mikä liittyy myelotoksisuuteen (neutropenia, trombosytopenia ja anemia). Atsatiopriinia ribaviriinin kanssa saavien potilaiden täydellinen verenkuva, mukaan lukien verihiutaleiden määrä, tulee seurata viikoittain ensimmäisen kuukauden ajan, kahdesti kuukaudessa toisen ja kolmannen hoitokuukauden ajan, sitten kuukausittain tai useammin, jos annostusta tai muita hoitomuutoksia tarvitaan [ks. VAROITUKSET JA VAROTOIMET ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
COPEGUS/PEGASYS-yhdistelmähoitoon liittyviä merkittäviä haittavaikutuksia ovat vakava masennus ja itsemurha-ajatukset, hemolyyttinen anemia, luuytimen toiminnan heikkeneminen, autoimmuuni- ja infektiosairaudet, oftalmologiset häiriöt, aivoverenkiertohäiriöt, keuhkojen toimintahäiriöt, paksusuolitulehdus, haimatulehdus ja diabetes.
PEGASYS-pakkausseloste tulee tarkistaa kokonaisuudessaan lisäturvallisuustietojen saamiseksi ennen yhdistelmähoidon aloittamista.
Raskaus
COPEGUS 100 mg voi aiheuttaa synnynnäisiä epämuodostumia ja/tai altistuneen sikiön kuoleman. Ribaviriinilla on havaittu merkittäviä teratogeenisiä ja/tai alkioita tappavia vaikutuksia kaikissa eläinlajeissa, joilla on suoritettu riittävät tutkimukset. Nämä vaikutukset ilmenivät niinkin pienillä annoksilla kuin yksi kahdeskymmenesosa ihmisille suositellusta ribaviriiniannoksesta.
COPEGUS-hoitoa ei saa aloittaa, ellei heti ennen suunniteltua hoidon aloittamista ole saatu negatiivista raskaustestiä. Naispotilaiden ja miespotilaiden naispuolisten kumppanien raskauden välttämiseksi on oltava erittäin varovainen. Potilaita tulee neuvoa käyttämään vähintään kahta tehokasta ehkäisyä hoidon aikana ja 6 kuukauden ajan hoidon lopettamisen jälkeen. Raskaustesti tulee tehdä kuukausittain COPEGUS 100 mg -hoidon aikana ja 6 kuukauden ajan hoidon lopettamisen jälkeen [ks. LAATIKKO VAROITUS , VASTA-AIHEET , Käyttö tietyissä populaatioissa , ja POTILASTIEDOT ].
Anemia
Ribaviriinin ensisijainen toksisuus on hemolyyttinen anemia, jota havaittiin kliinisissä tutkimuksissa noin 13 %:lla kaikista COPEGUS/PEGASYS-hoitoa saaneista potilaista. COPEGUS 100 mg -annokseen liittyvä anemia ilmenee 1-2 viikon kuluessa hoidon aloittamisesta. Koska hemoglobiinin alkupudotus voi olla merkittävä, hemoglobiini tai hematokriitti on suositeltavaa mitata ennen hoitoa ja hoidon viikolla 2 ja 4 tai useammin, jos se on kliinisesti aiheellista. Potilaita tulee sitten seurata kliinisesti tarkoituksenmukaisella tavalla. Varovaisuutta on noudatettava aloitettaessa hoitoa kaikilla potilailla, joilla on vakavan anemian riski (esim. sferosytoosi, gastrointestinaalinen verenvuoto) [ks. ANNOSTELU JA HALLINNOINTI ].
Kuolemaan johtaneita ja ei-fataalisia sydäninfarkteja on raportoitu potilailla, joilla on COPEGUSin aiheuttama anemia. Ennen ribaviriinihoidon aloittamista potilailla on arvioitava sydänsairaus. Potilaille, joilla on aiempi sydänsairaus, tulee ottaa EKG-kuvaus ennen hoitoa, ja heitä on seurattava asianmukaisesti hoidon aikana. Jos kardiovaskulaarinen tila heikkenee, hoito on keskeytettävä tai lopetettava [ks. ANNOSTELU JA HALLINNOINTI ]. Koska lääkkeiden aiheuttama anemia voi pahentaa sydänsairautta, potilaiden, joilla on ollut merkittävä tai epästabiili sydänsairaus, ei tule käyttää COPEGUS-valmistetta [ks. LAATIKKO VAROITUS ja ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Kroonista C-hepatiittia (CHC) sairastavilla potilailla, joilla on kirroosi, saattaa olla maksan vajaatoiminnan ja kuoleman riski, kun niitä hoidetaan alfainterferoneilla, mukaan lukien PEGASYS. Kirroosipotilailla, joilla on samanaikaisesti HIV-infektio ja jotka saavat erittäin aktiivista antiretroviraalista hoitoa (HAART) ja interferoni alfa-2a:ta ribaviriinin kanssa tai ilman sitä, näyttää olevan suurempi riski maksan vajaatoiminnan kehittymiselle verrattuna potilaisiin, jotka eivät saa HAART-hoitoa. Tutkimuksessa NR15961 [katso Kliiniset tutkimukset ], 129 HAART-hoitoa saaneesta CHC/HIV-kirroosipotilaasta 14:lle (11 %) näistä potilaista kaikissa hoitoryhmissä kehittyi maksan vajaatoiminta, joka johti 6 kuolemaan. Kaikki 14 potilasta käyttivät NRTI-lääkkeitä, mukaan lukien stavudiini, didanosiini, abakaviiri, tsidovudiini ja lamivudiini. Nämä pienet potilasmäärät eivät salli tiettyjen NRTI-lääkkeiden tai niihin liittyvien riskien välistä eroa. Hoidon aikana potilaan kliinistä tilaa ja maksan toimintaa on seurattava tarkasti maksan vajaatoiminnan merkkien ja oireiden varalta. PEGASYS/COPEGUS 100 mg -hoito tulee lopettaa välittömästi potilailla, joilla on maksan vajaatoiminta (ks. VASTA-AIHEET ].
Yliherkkyys
Alfa-interferoni- ja ribaviriinihoidon aikana on havaittu vaikeita akuutteja yliherkkyysreaktioita (esim. nokkosihottuma, angioödeema, keuhkoputkien supistuminen ja anafylaksia). Jos tällainen reaktio ilmenee, PEGASYS- ja COPEGUS 100 mg -hoito on lopetettava välittömästi ja aloitettava asianmukainen lääkehoito. Vakavia ihoreaktioita, mukaan lukien vesiculobulloosia eruptiot, Stevens-Johnsonin oireyhtymän (erythema multiforme major) eriasteisia reaktioita, joihin liittyy eriasteisia iho- ja limakalvovaurioita, sekä eksfoliatiivista ihotulehdusta (erytroderma) on raportoitu potilailla, jotka ovat saaneet PEGASYSia ribaviriinin kanssa tai ilman. Potilaiden, joille kehittyy vakavien ihoreaktioiden merkkejä tai oireita, on lopetettava hoito [katso HAITTAVAIKUTUKSET ].
Keuhkosairaudet
Hengenahdistusta, keuhkoinfiltraatteja, keuhkotulehdusta, keuhkoverenpainetautia ja keuhkokuumetta on raportoitu ribaviriini- ja interferonihoidon aikana. Ajoittain kuolemaan johtaneita keuhkokuumeita on esiintynyt. Lisäksi sarkoidoosia tai sarkoidoosin pahenemista on raportoitu. Jos on näyttöä keuhkoinfiltraateista tai keuhkojen toiminnan heikkenemisestä, potilaita on seurattava tarkasti ja tarvittaessa COPEGUS/PEGASYS-yhdistelmähoito on lopetettava.
Luuytimen suppressio
Pansytopeniaa (huomattava punasolujen, neutrofiilien ja verihiutaleiden väheneminen) ja luuytimen suppressiota on kirjallisuudessa raportoitu esiintyvän 3–7 viikon kuluessa pegyloidun interferonin/ribaviriinin ja atsatiopriinin samanaikaisesta annosta. Tällä rajoitetulla potilaiden määrällä (n=8) myelotoksisuus korjaantui 4–6 viikossa, kun sekä HCV:n antiviraalinen hoito että samanaikainen atsatiopriinihoito lopetettiin, eikä se uusiutunut, kun kumpikaan hoito aloitettiin uudelleen yksinään. PEGASYSin, COPEGUS 100 mg:n ja atsatiopriinin käyttö tulee lopettaa pansytopenian vuoksi, eikä pegyloitua interferonia/ribaviriinia tule ottaa uudelleen käyttöön samanaikaisen atsatiopriinin kanssa (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Haimatulehdus
COPEGUS- ja PEGASYS-hoito tulee keskeyttää potilailla, joilla on haimatulehduksen merkkejä ja oireita, ja lopettaa potilaiden, joilla on todettu haimatulehdus.
Vaikutus lapsipotilaiden kasvuun
5–17-vuotiailla lapsilla havaittiin kasvun estymistä 48 viikon yhdistelmähoidon aikana PEGASYSin ja ribaviriinin kanssa. Painon laskua iän z-pisteissä ja pituuden laskua iän z-pisteissä 48 hoitoviikkoon asti havaittiin lähtötasoon verrattuna. 2 vuotta hoidon jälkeen 16 % lapsipotilaista oli yli 15 prosenttiyksikköä lähtöviivan painokäyrän alapuolella ja 11 % oli yli 15 prosenttiyksikköä perusviivan pituuskäyrän alapuolella.
Saatavilla olevat pidemmän aikavälin tiedot koehenkilöistä, joita seurattiin 6 vuotta hoidon jälkeen, ovat liian rajallisia määrittämään aikuisen pituuden laskun riskiä joillakin potilailla [ks. Kokemus kliinisistä tutkimuksista ].
Laboratoriotestit
Ennen PEGASYS/COPEGUS-yhdistelmähoidon aloittamista kaikille potilaille suositellaan tavallisia hematologisia ja biokemiallisia laboratoriotestejä. Hedelmällisessä iässä oleville naisille on tehtävä raskausseulonta. Potilaille, joilla on sydämen poikkeavuuksia, tulee ottaa EKG-kuvaus ennen PEGASYS/COPEGUS-hoitoa.
Hoidon aloittamisen jälkeen hematologiset testit tulee tehdä 2 ja 4 viikon kuluttua ja biokemialliset testit 4 viikon kuluttua. Lisätestejä tulee tehdä säännöllisesti hoidon aikana. Aikuisten kliinisissä tutkimuksissa CBC (mukaan lukien hemoglobiinitaso sekä valkosolujen ja verihiutaleiden määrä) ja kemiat (mukaan lukien maksan toimintakokeet ja virtsahappo) mitattiin 1, 2, 4, 6 ja 8 viikon välein ja sen jälkeen joka 4. 6 viikkoa tai useammin, jos havaitaan poikkeavuuksia. Lasten kliinisessä tutkimuksessa hematologiset ja kemialliset arvioinnit tehtiin 1, 3, 5 ja 8 viikon välein ja sen jälkeen 4 viikon välein. Kilpirauhasta stimuloiva hormoni (TSH) mitattiin 12 viikon välein. Raskaustesti tulee tehdä kuukausittain yhdistelmähoidon aikana ja 6 kuukauden ajan hoidon lopettamisen jälkeen.
COPEGUS 100mg:n ja PEGASYSin kliinisissä tutkimuksissa käytettyjä sisääntulokriteereitä voidaan pitää ohjeena hyväksyttäville perusarvoille hoidon aloittamisessa:
- Verihiutaleiden määrä on suurempi tai yhtä suuri kuin 90 000 solua/mm³ (niinkin alhainen kuin 75 000 solua/mm³ HCV-potilailla, joilla on kirroosi tai 70 000 solua/mm³ potilailla, joilla on CHC ja HIV)
- Absoluuttinen neutrofiilien määrä (ANC) on suurempi tai yhtä suuri kuin 1500 solua/mm³
- TSH ja T4 normaaleissa rajoissa tai riittävästi hallittu kilpirauhasen toiminta
- CD4+-solujen määrä suurempi tai yhtä suuri kuin 200 solua/mm³ tai CD4+-solujen määrä suurempi tai yhtä suuri kuin 100 solua/mm³, mutta vähemmän kuin 200 solua/mm³ ja HIV-1-RNA alle 5 000 kopiota/ml potilailla, joilla on samanaikaisesti HIV-infektio
- Hemoglobiini suurempi tai yhtä suuri kuin 12 g/dl naisilla ja suurempi tai yhtä suuri kuin 13 g/dl miehillä CHC-monoinfektiopotilailla
- Hemoglobiini suurempi tai yhtä suuri kuin 11 g/dl naisilla ja suurempi tai yhtä suuri kuin 12 g/dl miehillä potilailla, joilla on CHC ja HIV
Potilasneuvontatiedot
- Katso FDA:n hyväksymä potilasmerkintä (lääkeopas)
Raskaus
Potilaille on kerrottava, että ribaviriini voi aiheuttaa synnynnäisiä epämuodostumia ja/tai altistuneen sikiön kuoleman. COPEGUS 100 mg -hoitoa eivät saa käyttää raskaana olevat naiset tai miehet, joiden naispuoliset kumppanit ovat raskaana. Äärimmäistä varovaisuutta on noudatettava raskauden välttämiseksi naispotilailla ja COPEGUS-hoitoa saavien miespotilaiden naispuolisoilla ja 6 kuukauden ajan hoidon jälkeen. Potilaiden tulee käyttää kahta luotettavaa ehkäisymenetelmää COPEGUS-hoidon aikana ja 6 kuukauden ajan hoidon jälkeen. COPEGUS-hoitoa ei saa aloittaa ennen kuin on saatu raportti negatiivisesta raskaustestistä välittömästi ennen hoidon aloittamista. Potilaiden on tehtävä raskaustesti kuukausittain hoidon aikana ja 6 kuukauden ajan hoidon jälkeen.
Hedelmällisessä iässä oleville naispotilaille ja miespotilaille, joilla on hedelmällisessä iässä olevia naispuolisia kumppaneita, on kerrottava teratogeenisistä/sikiövaurioista ja heitä on opastettava käyttämään tehokasta ehkäisyä COPEGUS-hoidon aikana ja 6 kuukauden ajan hoidon jälkeen. Potilaita tulee neuvoa ilmoittamaan välittömästi terveydenhuollon tarjoajalle raskauden sattuessa [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Anemia
Yleisin ribaviriiniin liittyvä haittatapahtuma on anemia, joka voi olla vakava [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ]. Potilaita tulee kertoa, että laboratoriotutkimuksia tarvitaan ennen COPEGUS-hoidon aloittamista ja määräajoin sen jälkeen [ks. VAROITUKSET JA VAROTOIMET ]. On suositeltavaa, että potilaat ovat hyvin nesteytettyinä, erityisesti hoidon alkuvaiheessa.
Potilaita, joille kehittyy huimausta, sekavuutta, uneliaisuutta ja väsymystä, tulee varoittaa ajamasta autoa tai käyttämästä koneita.
Potilaita tulee neuvoa ottamaan COPEGUS 100 mg ruoan kanssa.
Potilailta tulee kysyä aiemmasta huumeiden väärinkäytöstä ennen COPEGUS/PEGASYS-hoidon aloittamista, sillä interferoneilla hoidetuilla potilailla on raportoitu huumeriippuvuuden uusiutumista ja huumeiden yliannostuksia.
Potilaita tulee neuvoa olemaan juomatta alkoholia, sillä alkoholi voi pahentaa kroonista hepatiitti C -infektiota.
Potilaille tulee kertoa, mitä tehdä, jos he unohtavat ottaa COPEGUS-annoksen. Unohtuneet annokset tulee ottaa mahdollisimman pian saman päivän aikana. Potilaat eivät saa kaksinkertaistaa seuraavaa annosta. Potilaita tulee neuvoa soittamaan terveydenhuollon tarjoajalleen, jos heillä on kysyttävää.
Potilaille tulee kertoa, että PEGASYS/COPEGUS-hoidon vaikutusta hepatiitti C -infektion leviämiseen ei tunneta, ja että asianmukaisia varotoimia on ryhdyttävä hepatiitti C -viruksen leviämisen estämiseksi hoidon aikana tai hoidon epäonnistuessa.
Potilaille tulee kertoa COPEGUS-valmisteen käyttöön liittyvistä mahdollisista eduista ja riskeistä. Asianmukaista käyttöä koskevat ohjeet tulee antaa, mukaan lukien pakkauksen sisällön tarkastelu LÄÄKKEEN OPAS , joka ei ole kaikkien tai mahdollisten haittavaikutusten paljastaminen.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Hiirillä tehdyssä p53-karsinogeenisuustutkimuksessa (+/-) ribaviriini ei ollut onkogeeninen. Ribaviriini ei myöskään ollut onkogeeninen rotalla tehdyssä 2 vuoden karsinogeenisuustutkimuksessa annoksilla, jotka olivat korkeintaan siedettyä 60 mg/kg/vrk. Kehon pinta-alan perusteella nämä annokset ovat noin 0,5-kertaisia ja 0,6-kertaisia ihmisen suurinta suositeltua ribaviriinin vuorokausiannosta.
Mutageneesi
Ribaviriini osoitti mutageenista aktiivisuutta hiiren lymfoomatestissä in vitro. Klastogeenistä aktiivisuutta ei havaittu hiiren in vivo mikrotumatestissä annoksilla 2000 mg/kg asti. Kirjallisuudessa julkaistujen tutkimusten tulokset osoittavat kuitenkin klastogeenistä aktiivisuutta hiiren in vivo mikrotumatestissä oraalisilla annoksilla aina 2000 mg/kg asti. Hallitseva tappava määritys rotilla oli negatiivinen, mikä osoitti, että jos rotissa tapahtui mutaatioita, ne eivät välittyneet urospuolisten sukusolujen kautta.
Hedelmällisyyden heikkeneminen
Rotilla tehdyssä hedelmällisyystutkimuksessa ribaviriini vähensi siittiöiden määrää marginaalisesti annoksella 100 mg/kg/vrk ilman vaikutusta hedelmällisyyteen. Hoidon lopettamisen jälkeen täydellinen toipuminen tapahtui 1 spermatogeneesisyklin jälkeen. Siittiöissä havaittiin poikkeavuuksia hiirillä tehdyissä tutkimuksissa, joiden tarkoituksena oli arvioida ribaviriinin aiheuttaman kivesten rappeuman ajan kulumista ja palautuvuutta annoksilla 15-150 mg/kg/vrk (noin 0,1-0,8 kertaa ihmisen suurin suositeltu ribaviriinin päivittäinen annos). 3-6 kuukauden ajan. Kun hoito lopetettiin, ribaviriinin aiheuttamasta kivestoksisuudesta toipuminen oli ilmeistä 1 tai 2 spermatogeenisen syklin kuluessa.
Hedelmällisessä iässä olevat naispotilaat ja miespotilaat, joilla on hedelmällisessä iässä oleva naiskumppani, eivät saa saada COPEGUS-valmistetta, elleivät potilas ja hänen kumppaninsa käytä tehokasta ehkäisyä (kaksi luotettavaa muotoa). Koska ribaviriinin usean annoksen puoliintumisaika (t½) on 12 päivää, tehokasta ehkäisyä on käytettävä 6 kuukauden ajan hoidon jälkeen (eli ribaviriinin puhdistuman puoliintumisaika on 15).
Lisääntymistoksikologisia tutkimuksia ei ole tehty käyttämällä PEGASYSia yhdessä COPEGUSin kanssa. Kuitenkin peginterferoni alfa-2a:lla ja ribaviriinilla on erikseen annettuna haitallisia vaikutuksia lisääntymiseen. On oletettava, että jommankumman aineen tuottamat vaikutukset yksin johtuisivat myös näiden kahden aineen yhdistelmästä.
Käyttö tietyissä populaatioissa
Raskaus
Luokka X [katso VASTA-AIHEET ]. Ribaviriini aiheutti merkittäviä alkioita tappavia ja/tai teratogeenisiä vaikutuksia kaikissa eläinlajeissa, joilla on suoritettu riittävät tutkimukset. Kallon, kitalaen, silmän, leuan, raajojen, luuston ja maha-suolikanavan epämuodostumia havaittiin. Teratogeenisten vaikutusten ilmaantuvuus ja vakavuus lisääntyivät lääkeannoksen noustessa. Sikiöiden ja jälkeläisten eloonjääminen väheni [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Perinteisissä sikiötoksisuus/teratogeenisuustutkimuksissa rotilla ja kaniineilla havaitut vaikutuksettomat annostasot olivat selvästi alle ehdotetun kliinisen käytön tasot (0,3 mg/kg/vrk sekä rotalla että kaniinilla; noin 0,06 kertaa ihmisen suositeltu ribaviriinin päivittäinen annos). . Peri/postnataalisessa toksisuustutkimuksessa rotilla ei havaittu emolle toksisuutta tai vaikutuksia jälkeläisiin suun kautta enintään 1 mg/kg/vrk (noin 0,01 kertaa ihmisen suurin suositeltu ribaviriinin vuorokausiannos).
Hoito ja jälkihoito: mahdollinen riski sikiölle
Ribaviriinin tiedetään kerääntyvän solunsisäisiin komponentteihin, joista se poistuu hyvin hitaasti. Ei tiedetä, sisältyykö ribaviriinia siittiöön, ja jos on, sillä on mahdollinen teratogeeninen vaikutus munasolujen hedelmöityksessä. Ribaviriinin mahdollisten ihmisiin kohdistuvien teratogeenisten vaikutusten vuoksi miespotilaita tulee kuitenkin neuvoa ryhtymään kaikkiin varotoimiin naispuolisten kumppanien raskauden riskin välttämiseksi.
COPEGUS-valmistetta eivät saa käyttää raskaana olevat naiset tai miehet, joiden naispuoliset kumppanit ovat raskaana. Hedelmällisessä iässä olevat naispotilaat ja miespotilaat, joilla on hedelmällisessä iässä olevia naispuoliskoja, eivät saa saada COPEGUS-valmistetta, elleivät potilas ja hänen kumppaninsa käytä tehokasta ehkäisyä (kaksi luotettavaa muotoa) hoidon aikana ja 6 kuukauden ajan hoidon jälkeen [ks. VASTA-AIHEET ].
Ribavirinin raskausrekisteri
Ribaviriinin raskausrekisteri on perustettu seuraamaan ribaviriinille altistuneiden naispotilaiden ja miespotilaiden naispuolisten raskauksien äidin ja sikiön tuloksia hoidon aikana ja 6 kuukauden ajan hoidon lopettamisen jälkeen. Terveydenhuollon tarjoajia ja potilaita kehotetaan ilmoittamaan tällaisista tapauksista soittamalla numeroon 1-800-593-2214.
Imettävät äidit
Ei tiedetä, erittyykö ribaviriini äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon ja jotta vältetään ribaviriinin aiheuttamien vakavien haittavaikutusten mahdollisuus imettäville imeväisille, tulee päättää joko imetyksen tai COPEGUS 100 mg -hoidon keskeyttämisestä hoidon merkityksen äidille perusteella.
Käyttö lapsille
Lapsipotilaiden farmakokineettisiä arviointeja ei ole tehty.
COPEGUS-valmisteen turvallisuutta ja tehokkuutta ei ole osoitettu alle 5-vuotiailla potilailla.
Geriatrinen käyttö
COPEGUS 100 mg:n ja PEGASYSin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita tai vanhempia, jotta voitaisiin määrittää, reagoivatko he eri tavalla kuin nuoremmat. Ribaviriinille ei ole tehty erityisiä farmakokineettisiä arviointeja vanhuksilla. Tämän lääkkeen aiheuttamien toksisten reaktioiden riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. COPEGUS 100 mg:n annosta tulee pienentää potilailla, joiden kreatiniinipuhdistuma on enintään 50 ml/min. ja PEGASYS-annosta tulee pienentää potilailla, joiden kreatiniinipuhdistuma on alle 30 ml/min [ks. ANNOSTELU JA HALLINNOINTI ; Käyttö tietyissä populaatioissa ].
Rotu
42 potilaalla tehty farmakokineettinen tutkimus osoitti, että ribaviriinin farmakokinetiikassa ei ole kliinisesti merkitsevää eroa mustien (n=14), latinalaisamerikkalaisten (n=13) ja valkoihoisten (n=15) välillä.
Munuaisten vajaatoiminta
Munuaisten toiminta on arvioitava kaikilla potilailla ennen COPEGUS-hoidon aloittamista arvioimalla potilaan kreatiniinipuhdistuma.
Kliinisessä tutkimuksessa arvioitiin COPEGUS- ja PEGASYS-hoitoa 50 CHC-potilaalla, joilla oli kohtalainen (kreatiniinipuhdistuma 30–50 ml/min) tai vaikea (kreatiniinipuhdistuma alle 30 ml/min) munuaisten vajaatoiminta tai loppuvaiheen munuaissairaus (ESRD), joka vaati kroonista hemodialyysiä. (HD). 18 potilaalle, joilla oli krooninen HD-sairaus, COPEGUS annettiin 200 mg:n vuorokaudessa ilman havaittavissa olevaa eroa haittavaikutusprofiilissa verrattuna potilaisiin, joiden munuaistoiminta oli normaali. Annoksen pienennystä ja COPEGUS-hoidon tilapäisiä keskeytyksiä (johtuen COPEGUS-valmisteeseen liittyvistä haittavaikutuksista, pääasiassa anemiasta) havaittiin jopa kolmanneksella ESRD/HD-potilaista hoidon aikana; ja vain kolmasosa näistä koehenkilöistä sai COPEGUS-hoitoa 48 viikon ajan. Plasman ribaviriinialtistukset olivat noin 20 % pienemmät HD-potilailla, joilla oli loppuvaiheen munuaisten vajaatoiminta, verrattuna potilaisiin, joiden munuaistoiminta oli normaali ja jotka saivat normaalia 1000/1200 mg COPEGUS-vuorokausiannosta.
Kohtalainen (n=17) tai vaikea (n=14) munuaisten vajaatoiminta ei sietänyt 600 mg:n tai 400 mg:n vuorokausiannoksia COPEGUS-valmistetta COPEGUS-valmisteeseen liittyvien haittavaikutusten, pääasiassa anemian, vuoksi, ja potilailla oli 20–30 %. suurempi ribaviriinialtistus plasmassa (huolimatta toistuvista annoksen muutoksista) verrattuna potilaisiin, joiden munuaisten toiminta on normaali (kreatiniinipuhdistuma yli 80 ml/min), jotka saivat COPEGUS-standardin annoksen. Hoidon keskeyttämisprosentit olivat korkeampia potilailla, joilla oli vaikea munuaisten vajaatoiminta, kuin potilailla, joilla oli kohtalainen munuaisten vajaatoiminta tai normaali munuaisten toiminta. Farmakokineettinen mallinnus ja simulointi osoittavat, että 200 mg:n vuorokausiannos potilailla, joilla on vaikea munuaisten vajaatoiminta, ja 200 mg:n vuorokausiannos vuorotellen 400 mg:n kanssa seuraavana päivänä potilailla, joilla on kohtalainen munuaisten vajaatoiminta, antaa plasman ribaviriinialtistuksen, joka on samanlainen kuin potilailla, joilla on normaali munuaisten toiminta. saavat hyväksytyn COPEGUS-ohjelman. Näitä annoksia ei ole tutkittu potilailla [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Tämän tutkimuksen farmakokineettisten ja turvallisuustulosten perusteella potilaiden, joiden kreatiniinipuhdistuma on pienempi tai yhtä suuri kuin 50 ml/min, tulee saada pienempi COPEGUS-annos. ja potilaiden, joiden kreatiniinipuhdistuma on alle 30 ml/min, tulee saada pienempi PEGASYS-annos. COPEGUS 100 mg:aa saavien potilaiden kliinistä ja hematologista tilaa, joiden kreatiniinipuhdistuma on enintään 50 ml/min, tulee seurata huolellisesti. Potilaiden, joilla on kliinisesti merkittäviä laboratorioarvojen poikkeavuuksia tai haittavaikutuksia, jotka ovat jatkuvasti vakavia tai pahenevia, hoito tulee keskeyttää [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA , ja PEGASYS Pakkausseloste ].
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta ribaviriinin farmakokinetiikkaan COPEGUS-valmisteen annon jälkeen ei ole arvioitu. COPEGUS 100 mg:n kliiniset tutkimukset rajoittuivat potilaisiin, joilla oli Child-Pugh-luokan A tauti.
Sukupuoli
Mitään kliinisesti merkitseviä eroja ribaviriinin farmakokinetiikassa ei havaittu miesten ja naisten välillä.
Ribaviriinin farmakokinetiikka painoon korjattuna on samanlainen mies- ja naispotilailla.
Elinsiirtojen vastaanottajat
PEGASYS- ja COPEGUS 100 mg -hoidon turvallisuutta ja tehoa ei ole osoitettu potilailla, joille on tehty maksansiirto tai muu maksansiirto. Kuten muidenkin alfa-interferonien kohdalla, PEGASYS-valmisteella on raportoitu maksa- ja munuaissiirteen hylkimisreaktioita joko yksinään tai yhdessä COPEGUS-valmisteen kanssa [ks. HAITTAVAIKUTUKSET ].
YLIANNOSTUS
Kliinisissä tutkimuksissa ei ole raportoitu COPEGUSin yliannostustapauksia. Hypokalsemiaa ja hypomagnesemiaa on havaittu henkilöillä, jotka ovat saaneet suositeltua ribaviriiniannosta suurempia annoksia. Useimmissa näistä tapauksista ribaviriinia annettiin suonensisäisesti annoksina, jotka olivat jopa nelinkertaisia suositeltuun enimmäisvuorokausiannokseen nähden ja joissakin tapauksissa ylittivät.
VASTA-AIHEET
COPEGUS (ribaviriini) on vasta-aiheinen:
- Raskaana olevat naiset. COPEGUS voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. COPEGUS on vasta-aiheinen naisille, jotka ovat tai voivat tulla raskaaksi. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle [ks. VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa , ja POTILASTIEDOT ].
- Miehet, joiden naispuoliset kumppanit ovat raskaana.
- Potilaat, joilla on hemoglobinopatia (esim. suuri talassemia tai sirppisoluanemia).
- Yhdessä didanosiinin kanssa. Kliinisissä tutkimuksissa on raportoitu kuolemaan johtaneesta maksan vajaatoiminnasta sekä perifeerisesta neuropatiasta, haimatulehduksesta ja oireellisesta hyperlaktatemiasta/maitohappoasidoosista [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
COPEGUS- ja PEGASYS-yhdistelmähoito on vasta-aiheinen potilailla, joilla on:
- Autoimmuuni hepatiitti.
- Maksan vajaatoiminta (Child-Pugh-pistemäärä yli 6; luokka B ja C) kirroottisilla CHC-monoinfektiopotilailla ennen hoitoa [ks. VAROITUKSET JA VAROTOIMET ].
- Maksan vajaatoiminta (Child-Pugh-pistemäärä suurempi tai yhtä suuri kuin 6) CHC-kirroosipotilailla, joilla on samanaikaisesti HIV-infektio ennen hoitoa [ks. VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Ribaviriini on viruslääke [katso Mikrobiologia ].
Farmakokinetiikka
Ribaviriinin usean annoksen farmakokineettisiä tietoja on saatavilla HCV-potilaista, jotka saivat ribaviriinia yhdessä peginterferoni alfa-2a:n kanssa. Kun annoksella 1200 mg/vrk annettiin ruoan kanssa 12 viikon ajan keskiarvo ± SD (n=39; ruumiinpaino yli 75 kg), AUC0-12h oli 25 361 ± 7110 ng·h/ml ja Cmax oli 2748 ± 818 ng/ml. Keskimääräinen aika Cmax:n saavuttamiseen oli 2 tuntia. Ribaviriinin pienimmät pitoisuudet plasmassa 12 viikon ruokailun jälkeen olivat 1662±545 ng/ml HCV-tartunnan saaneilla potilailla, jotka saivat 800 mg/vrk (n=89), ja 2112±810 ng/ml potilailla, jotka saivat 1200 mg/vrk. n = 75; ruumiinpaino yli 75 kg).
Ribaviriinin terminaalinen puoliintumisaika suun kautta otetun COPEGUS-kerta-annoksen jälkeen on noin 120-170 tuntia. Näennäinen kokonaispuhdistuma COPEGUS 100 mg:n kerta-annoksen oraalisen annon jälkeen on noin 26 l/h. Ribaviriinia kertyy laajasti toistuvien annosten jälkeen (kahdesti vuorokaudessa), joten vakaan tilan Cmax oli neljä kertaa suurempi kuin kerta-annoksella.
Ruoan vaikutus ribaviriinin imeytymiseen
Ribaviriinin suun kautta otetun kerta-annoksen biologinen hyötyosuus lisääntyi, kun annettiin samanaikaisesti runsasrasvaisen aterian kanssa. Imeytyminen hidastui (Tmax kaksinkertaistui) ja AUC0-192h nousi 42 % ja Cmax 66 %, kun COPEGUS otettiin runsasrasvaisen aterian yhteydessä verrattuna paastoolosuhteisiin [ks. ANNOSTELU JA HALLINNOINTI ja POTILASTIEDOT ].
Eliminaatio ja aineenvaihdunta
Munuaisten ja maksan vaikutusta ribaviriinin eliminaatioon COPEGUS 100 mg:n annon jälkeen ei tunneta. In vitro -tutkimukset osoittavat, että ribaviriini ei ole CYP450-entsyymien substraatti.
Munuaisten vajaatoiminta
Kliinisessä tutkimuksessa arvioitiin 50 CHC-potilasta, joilla oli joko kohtalainen (kreatiniinipuhdistuma 30–50 ml/min) tai vaikea (kreatiniinipuhdistuma alle 30 ml/min) munuaisten vajaatoiminta tai loppuvaiheen munuaissairaus (ESRD), joka vaati kroonista hemodialyysiä (HD). Ribaviriinin näennäinen puhdistuma pieneni henkilöillä, joiden kreatiniinipuhdistuma oli alle tai yhtä suuri kuin 50 ml/min, mukaan lukien tutkimushenkilöt, joilla oli HD:n ESRD, ja se oli noin 30 % arvosta, joka havaittiin potilailla, joiden munuaisten toiminta on normaali. Farmakokineettinen mallinnus ja simulointi osoittavat, että 200 mg:n vuorokausiannos potilailla, joilla on vaikea munuaisten vajaatoiminta, ja 200 mg:n päivittäinen annos vuorotellen 400 mg:n kanssa seuraavana päivänä potilailla, joilla on kohtalainen munuaisten vajaatoiminta, antavat plasman ribaviriinialtistuksen, joka on samanlainen kuin potilailla, joilla on normaali munuaisten toiminta saa normaalin 1000/1200 mg COPEGUS-vuorokausiannoksen. Näitä annoksia ei ole tutkittu potilailla.
COPEGUS-hoitoa annettiin 200 mg:n vuorokaudessa 18 potilaalle, joilla oli krooninen HDD. Plasman ribaviriinialtistus näillä koehenkilöillä oli noin 20 % pienempi verrattuna potilaisiin, joilla oli normaali munuaisten toiminta ja jotka saivat normaalia 1000/1200 mg COPEGUS-vuorokausiannosta [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Plasman ribaviriini poistetaan hemodialyysillä, jonka uuttosuhde on noin 50 %; Ribaviriinin suuren jakautumistilavuuden vuoksi plasma-altistuksen ei kuitenkaan odoteta muuttuvan hemodialyysin myötä.
Mikrobiologia
Toimintamekanismi
Mekanismia, jolla ribaviriini edistää sen antiviraalista tehoa klinikalla, ei ole täysin ymmärretty. Ribaviriinilla on suora antiviraalinen vaikutus kudosviljelmässä monia RNA-viruksia vastaan. Ribaviriini lisää mutaatiotaajuutta useiden RNA-virusten genomissa ja ribaviriinitrifosfaatti estää HCV-polymeraasia biokemiallisessa reaktiossa.
Antiviraalinen aktiivisuus soluviljelmässä
Stabiilissa HCV-soluviljelymallijärjestelmässä (HCV-replikoni) ribaviriini esti autonomisen HCV-RNA-replikaation 50 %:n tehokkaalla konsentraation (EC50) arvolla 11-21 mcM. Samassa mallissa PEG-IFN a-2a esti myös HCV RNA:n replikaatiota EC50-arvolla 0,1-3 ng/ml. PEG-IFN a-2a:n ja ribaviriinin yhdistelmä oli tehokkaampi HCV-RNA:n replikaation estämisessä kuin kumpikaan aine yksinään.
Resistanssi
Eri HCV-genotyypeillä on huomattavaa kliinistä vaihtelua vasteessa PEG-IFN-α- ja ribaviriinihoitoon. Muuttuvaan vasteeseen liittyviä viruksen geneettisiä determinantteja ei ole lopullisesti tunnistettu.
Ristivastus
Ristiresistenssiä IFN α:n ja ribaviriinin välillä ei ole havaittu.
Eläinten toksikologia
Rotilla tehdyssä tutkimuksessa pääteltiin, että ribaviriini ei aiheuttanut hallitsevaa kuolleisuutta 200 mg/kg:n annoksilla 5 päivän ajan (jopa 1,7 kertaa suurempi kuin ihmiselle suositeltu ribaviriinin enimmäisannos).
Pitkäaikaiset tutkimukset hiirellä ja rotalla (18 - 24 kuukautta; annos 20 - 75 ja 10 - 40 mg/kg/vrk, vastaavasti, noin 0,1 - 0,4 kertaa ihmisen enimmäisvuorokausiannos ribaviriinia) ovat osoittaneet suhteen krooninen ribaviriinialtistus ja lisääntynyt verisuonivaurioiden (mikroskooppisten verenvuotojen) ilmaantuvuus hiirillä. Rotilla verkkokalvon rappeutumista esiintyi kontrolleilla, mutta ilmaantuvuus lisääntyi ribaviriinilla hoidetuilla rotilla.
Kliiniset tutkimukset
Krooninen hepatiitti C -potilaat
Aikuiset potilaat
PEGASYSin turvallisuutta ja tehoa yhdessä COPEGUSin kanssa hepatiitti C -virusinfektion hoidossa arvioitiin kahdessa satunnaistetussa kontrolloidussa kliinisessä tutkimuksessa. Kaikki potilaat olivat aikuisia, heillä oli kompensoitunut maksasairaus, havaittavissa oleva hepatiitti C -virus, krooninen hepatiitti maksan biopsiadiagnoosi, ja heitä ei ollut aiemmin hoidettu interferonilla. Noin 20 %:lla potilaista molemmissa tutkimuksissa oli kompensoitunut kirroosi (Child-Pugh-luokka A). Potilaat, joilla oli samanaikaisesti HIV-infektio, suljettiin pois näistä tutkimuksista.
Tutkimuksessa NV15801 potilaat satunnaistettiin saamaan joko PEGASYSia 180 mikrogrammaa ihonalaisesti kerran viikossa oraalisen lumelääkkeen kanssa, PEGASYS 180 mikrog kerran viikossa ja COPEGUS 1000 mg suun kautta (paino alle 75 kg) tai 1200 mg enemmän kuin suun kautta (paino suurempi). tai 75 kg) tai interferoni alfa-2b:tä 3 MIU ihon alle kolme kertaa viikossa plus ribaviriinia 1000 mg tai 1200 mg suun kautta. Kaikki potilaat saivat 48 viikkoa hoitoa, jota seurasi 24 viikon hoitoton seuranta. COPEGUS- tai lumelääkehoitotehtävä sokeutui. Jatkuva virologinen vaste määriteltiin havaitsemattomaksi (alle 50 IU/ml) HCV-RNA:ksi tutkimusviikolla 68 tai sen jälkeen. PEGASYS yhdessä COPEGUS 100 mg:n kanssa johti korkeampaan SVR:ään verrattuna pelkkään PEGASYSiin tai interferoni alfa-2b:hen ja ribaviriiniin (taulukko 9). . Kaikissa hoitoryhmissä potilailla, joilla oli virusgenotyyppi 1, oli viruskuormasta riippumatta pienempi vaste PEGASYS:lle yhdessä COPEGUS 100 mg:n kanssa verrattuna potilaisiin, joilla oli muita virusgenotyyppejä.
Ero kokonaishoitovasteessa (PEGASYS/COPEGUS – Interferoni alfa-2b/ribaviriini) oli 9 % (95 % CI 2,3, 15,3).
Tutkimuksessa NV15942 kaikki potilaat saivat PEGASYSia 180 mikrogrammaa ihon alle kerran viikossa ja ne satunnaistettiin joko 24 tai 48 viikon hoitoon ja joko 800 mg tai 1000 mg/1200 mg COPEGUS-annokseen (paino alle 75 kg/ylempi kuin tai 75 kg). Jakaminen neljään hoitohaaraan ositettiin viruksen genotyypin ja HCV-virustiitterin perustason perusteella. Potilaat, joilla oli genotyyppi 1 ja korkea virustiitteri (määritelty yli 2 x 106 HCV RNA-kopiota/ml seerumia), määrättiin ensisijaisesti 48 viikon hoitoon.
Jatkuva virologinen vaste (SVR) ja HCV-genotyyppi
HCV 1 ja 4 — Virustiitterin lähtötasosta riippumatta 48 viikon PEGASYS-hoito ja 1000 mg tai 1200 mg COPEGUS-hoito johti korkeampaan SVR:ään (määritelty HCV-RNA:ksi, jota ei voida havaita 24 viikon hoitovapaan seurantajakson lopussa) verrattuna lyhyempään hoitoon. (24 viikkoa) ja/tai 800 mg COPEGUS.
HCV 2 ja 3 — Virustiitterin lähtötasosta riippumatta 24 viikon PEGASYS-hoito ja 800 mg COPEGUS-hoito johti samanlaiseen SVR:ään verrattuna pidempään hoitoon (48 viikkoa) ja/tai 1000 mg tai 1200 mg COPEGUS-hoitoon (katso taulukko 10).
Genotyypin 5 ja 6 potilaiden määrä oli liian pieni mielekkään arvioinnin mahdollistamiseksi.
Pediatriset potilaat
Aikaisemmin hoitamattomia 5–17-vuotiaita lapsipotilaita (55 % alle 12-vuotiaita), joilla oli krooninen hepatiitti C, kompensoitunut maksasairaus ja havaittava HCV-RNA, hoidettiin COPEGUS 100 mg:lla noin 15 mg/kg/vrk plus PEGASYS 180 mikrogrammaa/1,73 m² x kehon pinta-ala kerran viikossa 48 viikon ajan. Kaikkia koehenkilöitä seurattiin 24 viikon ajan hoidon jälkeen. Jatkuva virologinen vaste (SVR) määriteltiin havaitsemattomaksi (alle 50 IU/ml) HCV-RNA:ksi tutkimusviikolla 68 tai sen jälkeen. Yhteensä 114 henkilöä satunnaistettiin saamaan joko COPEGUS- ja PEGASYS-yhdistelmähoitoa tai PEGASYS-monoterapiaa; potilaat, jotka eivät saa PEGASYS-monoterapiaa 24 viikon tai myöhemmin, voivat saada avoimen COPEGUS- ja PEGASYS-valmisteen. Alkuperäiset satunnaistetut haarat tasapainotettiin demografisten tekijöiden mukaan; 55 henkilöä sai alkuvaiheessa yhdistelmähoitoa COPEGUS 100 mg plus PEGASYS ja 59 sai PEGASYS plus lumelääkettä; Hoitoaikeiden kokonaispopulaatiosta 45 % oli naisia, 80 % valkoihoisia ja 81 % oli HCV:n genotyypin 1 infektoituneita. SVR-tulokset on yhteenveto taulukossa 11.
Muut hoitovasteen ennustajat
Hoitovaste on alhaisempi potilailla, joilla on huonot prognostiset tekijät ja jotka saavat pegyloitua alfa-interferonihoitoa. Tutkimuksissa NV15801 ja NV15942 hoitovaste oli alhaisempi yli 40-vuotiailla potilailla (50 % vs. 66 %), kirroosipotilailla (47 % vs. 59 %) ja yli 85 kg painavilla potilailla (49 % vs. 60 %) ja genotyypin 1 potilailla korkea vs. alhainen viruskuorma (43 % vs. 56 %). Afroamerikkalaisten potilaiden vasteprosentti oli pienempi kuin valkoihoisilla.
Tutkimuksissa NV15801 ja NV15942 varhaisen virologisen vasteen puute 12 viikon kuluttua (määriteltynä HCV RNA:ta ei havaittu tai yli 2 log10 alempi kuin lähtötaso) oli syy hoidon lopettamiselle. Potilaista, joilla ei ollut varhaista virusvastetta 12 viikkoon mennessä ja jotka suorittivat suositellun hoitojakson huolimatta protokollan määritellystä vaihtoehdosta lopettaa hoito, 5/39 (13 %) saavutti SVR:n. Potilaista, joilla ei ollut varhaista virusvastetta 24 viikkoon mennessä, 19 suoritti täyden hoitojakson eikä yksikään saavuttanut SVR:ää.
Krooninen hepatiitti C/HIV-tartunnan saaneet potilaat
Tutkimuksessa NR15961 CHC/HIV-potilaat satunnaistettiin saamaan joko PEGASYSia 180 mikrogrammaa ihonalaisesti kerran viikossa plus suun kautta plaseboa, PEGASYSia 180 mikrog kerran viikossa sekä COPEGUSia 800 mg suun kautta päivittäin tai interferoni alfa-2a:ta, 3 MIU ihonalaisesti kolme kertaa viikossa. plus COPEGUS 800 mg suun kautta päivittäin. Kaikki potilaat saivat 48 viikon hoitoa ja jatkuva virologinen vaste (SVR) arvioitiin 24 viikon hoitottoman seurannan jälkeen. COPEGUS 100 mg:n tai lumelääkehoidon tehtävä sokkoutettiin PEGASYS-hoitoryhmissä. Kaikki potilaat olivat aikuisia, heillä oli kompensoitunut maksasairaus, havaittavissa oleva hepatiitti C -virus, krooninen hepatiitti C -biopsiadiagnoosi, ja heitä ei ollut aiemmin hoidettu interferonilla. Potilaiden CD4+-solumäärä oli myös suurempi tai yhtä suuri kuin 200 solua/mm³ tai CD4+-solumäärä suurempi tai yhtä suuri kuin 100 solua/mm³, mutta vähemmän kuin 200 solua/mm³ ja HIV-1-RNA alle 5000 kopiota/ml, ja heidän tilansa oli vakaa. HIV:stä. Noin 15 %:lla tutkimukseen osallistuneista potilaista oli kirroosi. Tulokset on esitetty taulukossa 12.
Hoitovaste oli alhaisempi CHC/HIV-potilailla, joilla oli huonot prognostiset tekijät (mukaan lukien HCV genotyyppi 1, HCV RNA yli 800 000 IU/ml ja kirroosi), jotka saivat pegyloitua interferoni alfa -hoitoa.
Potilaista, joilla ei havaittu havaitsematonta HCV-RNA:ta tai vähintään 2 log10:n laskua lähtötasosta 12 viikon PEGASYS- ja COPEGUS-yhdistelmähoidon aikana, 2 % (2/85) saavutti SVR:n.
CHC-potilailla, joilla on HIV-yhteisinfektio ja jotka saivat 48 viikon ajan PEGASYS-hoitoa yksinään tai yhdessä 100 mg COPEGUS-hoidon kanssa, HIV-RNA-tiitterien keskiarvo ja mediaani eivät nousseet lähtötason yläpuolelle hoidon aikana tai 24 viikkoa hoidon jälkeen.
POTILASTIEDOT
COPEGUS® (Co-PEG-UHS) (ribaviriini) Tabletit
Lue tämä lääkitysopas huolellisesti ennen kuin aloitat COPEGUS 100 mg -valmisteen käytön ja lue lääkitysopas aina, kun saat lisää COPEGUS-valmistetta. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Lue myös PEGASYSin (peginterferoni alfa-2a) lääkitysopas.
Mikä on tärkein tieto, joka minun pitäisi tietää COPEGUSista?
- Naisilla on tehtävä raskaustesti ennen COPEGUS-hoidon aloittamista, joka kuukausi COPEGUS 100 mg -hoidon aikana ja joka kuukausi 6 kuukauden ajan COPEGUS-hoidon jälkeen.
- Jos sinä tai seksikumppanisi tulee raskaaksi kun otat COPEGUS 100 mg -valmistetta tai 6 kuukauden kuluessa COPEGUS-hoidon lopettamisesta, kerro siitä välittömästi terveydenhuollon tarjoajallesi. Sinun tai terveydenhuollon tarjoajasi tulee ottaa yhteyttä Ribavirinin raskausrekisteri soittamalla numeroon 1-800-593-2214. Ribavirin Pregnancy Registry kerää tietoa siitä, mitä äideille ja heidän vauvoilleen tapahtuu, jos äiti ottaa COPEGUS-valmistetta raskaana ollessaan.
Mikä on COPEGUS 100mg?
COPEGUS 100mg on reseptilääke, jota käytetään yhdessä toisen PEGASYS-nimisen lääkkeen (peginterferoni alfa-2a) kanssa kroonisen (pitkäaikaisen) hepatiitti C -infektion hoitoon 5-vuotiailla ja sitä vanhemmilla ihmisillä, joiden maksa toimii edelleen normaalisti ja joita ei ole aiemmin hoidettu lääke, jota kutsutaan interferoni alfaksi. Ei tiedetä, onko COPEGUS turvallinen ja toimiiko se alle 5-vuotiaille lapsille.
Kuka ei saa ottaa COPEGUS 100 mg -valmistetta?
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää COPEGUS 100mg:sta?"
Älä ota COPEGUS-valmistetta, jos:
- sinulla on tietyntyyppinen hepatiitti johtuu siitä, että immuunijärjestelmäsi hyökkää maksaasi (autoimmuunihepatiitti)
- sinulla on tiettyjä verisairauksia, kuten talassemia major tai sirppisoluanemia (hemoglobinopatiat)
- ota didanosiinia (Videx tai Videx EC)
Keskustele terveydenhuollon tarjoajan kanssa ennen kuin aloitat COPEGUS 100 mg -hoidon, jos sinulla on jokin näistä sairauksista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen COPEGUS 100 mg:n ottamista?
Ennen kuin otat COPEGUS-valmistetta, kerro terveydenhuollon tarjoajallesi, jos sinulla on tai on ollut:
- C-hepatiitin hoitoon, joka ei tehonnut sinulle
- vakavat allergiset reaktiot COPEGUS-valmisteesta tai jollekin COPEGUS-valmisteen aineosalle. Katso tämän lääkitysoppaan lopusta luettelo ainesosista.
- hengitysongelmia. COPEGUS 100 mg voi aiheuttaa tai pahentaa hengitysvaikeuksia, joita sinulla on jo.
- näköongelmia. COPEGUS voi aiheuttaa silmäongelmia tai pahentaa jo olemassa olevia silmäongelmia. Sinun tulee käydä silmätutkimuksessa ennen COPEGUS-hoidon aloittamista.
- tietyt verisairaudet, kuten anemia
- korkea verenpaine, sydänongelmia tai sinulla on ollut sydänkohtaus. Terveydenhuollon tarjoajasi tulee testata veresi ja sydämesi ennen kuin aloitat COPEGUS-hoidon.
- kilpirauhasen ongelmia
- diabetes. COPEGUS 100 mg:n ja PEGASYSin yhdistelmähoito voi pahentaa diabetestasi tai vaikeuttaa sen hoitoa.
- maksaongelmia muu kuin hepatiitti C -virusinfektio
- ihmisen immuunikatovirus (HIV) tai muut immuniteettiongelmat
- mielenterveysongelmia, mukaan lukien masennus tai itsemurha-ajatukset
- munuaisongelmia
- elinsiirto
- huumeriippuvuus tai väärinkäyttö
- hepatiitti B -viruksen aiheuttama infektio
- mikä tahansa muu sairaus
- imettävät. Ei tiedetä, erittyykö COPEGUS 100 mg rintamaitoon. Sinun ja terveydenhuollon tarjoajasi tulee päättää, otatko COPEGUS-valmistetta vai imetätkö.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Jotkut lääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, jos niitä otetaan samalla, kun käytät COPEGUS-valmistetta. Jotkut lääkkeet voivat vaikuttaa COPEGUS 100 mg:n tehoon tai COPEGUS 100 mg voi vaikuttaa muiden lääkkeiden tehoon.
Kerro erityisesti terveydenhuollon tarjoajallesi, jos käytät lääkkeitä HIV:n hoitoon, mukaan lukien didanosiini (Videx tai Videx EC), tai jos käytät atsatiopriinia (Imuran tai Azasan).
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle tai apteekkihenkilökunnalle, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa COPEGUS 100 mg?
- Ota COPEGUS juuri sen verran kuin terveydenhuollon tarjoajasi on neuvonut. Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon COPEGUS-valmistetta sinun tulee ottaa ja milloin se tulee ottaa. 5-vuotiaille ja sitä vanhemmille lapsille terveydenhuollon tarjoaja määrää COPEGUS 100 mg -annoksen painon perusteella.
- Ota COPEGUS ruoan kanssa.
- Jos unohdat ottaa COPEGUS 100 mg -annoksen, ota unohtunut annos mahdollisimman pian saman päivän aikana. Älä kaksinkertaista seuraavaa annosta. Jos sinulla on kysyttävää siitä, mitä tehdä, soita terveydenhuollon tarjoajallesi.
- Jos otat liikaa COPEGUS 100 mg -valmistetta, soita välittömästi terveydenhuollon tarjoajallesi tai paikalliseen myrkytystietokeskukseen tai mene välittömästi lähimmän sairaalan ensiapuun.
- Terveydenhuollon tarjoajasi tulee tehdä verikokeita ennen COPEGUS-hoidon aloittamista, hoitoviikkojen 2 ja 4 kohdalla ja sitten tarvittaessa nähdäkseen, kuinka hyvin siedät hoitoa, ja tarkistaakseen sivuvaikutukset. Terveydenhuollon tarjoaja voi muuttaa COPEGUS 100 mg -annostasi verikoetulosten tai mahdollisten sivuvaikutusten perusteella.
- Jos sinulla on sydänongelmia, terveydenhuollon tarjoajan tulee tarkistaa sydämesi tekemällä elektrokardiogrammi ennen COPEGUS-hoidon aloittamista ja tarvittaessa hoidon aikana.
Mitä minun pitäisi välttää COPEGUS-hoidon aikana?
COPEGUS 100mg voi saada sinut tuntemaan olosi väsyneeksi, huimaukseksi tai hämmentyneeksi. Älä aja autoa tai käytä koneita, jos sinulla on jokin näistä oireista.
Älä juo alkoholia, mukaan lukien olut, viini ja viina. Tämä voi pahentaa maksasairauttasi.
Mitkä ovat COPEGUSin mahdolliset sivuvaikutukset?
COPEGUS 100mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää COPEGUS 100mg:sta?"
- Haiman turvotus ja ärsytys (haimatulehdus). Sinulla voi olla vatsakipua, pahoinvointia, oksentelua tai ripulia.
- Vaikeat allergiset reaktiot. Oireita voivat olla nokkosihottuma, hengityksen vinkuminen, hengitysvaikeudet, rintakipu, suun, kielen tai huulten turvotus tai vaikea ihottuma.
- Vakavia hengitysvaikeuksia. Hengitysvaikeudet voivat olla merkki vakavasta keuhkotulehduksesta (keuhkokuume), joka voi johtaa kuolemaan.
- Vakavia silmäongelmia joka voi johtaa näön menetykseen tai sokeuteen.
- Maksaongelmat. Joidenkin ihmisten maksan toiminta voi huonontua. Kerro heti terveydenhuollon tarjoajalle, jos sinulla on jokin näistä oireista: vatsan turvotus, sekavuus, ruskea virtsa ja keltaiset silmät.
- Vakava masennus
- Itsemurha-ajatuksia ja -yrityksiä
- Vaikutus lasten kasvuun. Lasten painonnousu ja pituuden nousu voi viivästyä PEGASYS- ja COPEGUS-hoidon aikana. Kasvu nopeutuu hoidon lopettamisen jälkeen, mutta jotkut lapset eivät välttämättä saavuta pituutta, jota heidän odotettiin saavuttavan ennen hoitoa. Keskustele terveydenhuollon tarjoajan kanssa, jos olet huolissasi lapsesi kasvusta PEGASYS- ja COPEGUS-hoidon aikana.
Soita terveydenhuollon tarjoajallesi tai hakeudu heti lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista. Nämä voivat olla merkkejä COPEGUS 100 mg -hoidon vakavasta sivuvaikutuksesta.
PEGASYSin kanssa otetun COPEGUSin yleisiä sivuvaikutuksia ovat:
- flunssan kaltaiset oireet - väsymys, päänsärky, vapina ja korkea kuume sekä lihas- tai nivelkivut
- mielialan muutokset, ärtyneisyys, ahdistuneisuus ja univaikeudet
- ruokahaluttomuus, pahoinvointi, oksentelu ja ripuli
- hiustenlähtö
- kutina
Kerro terveydenhuollon tarjoajallesi kaikista sivuvaikutuksista, jotka häiritsevät sinua tai jotka eivät katoa.
Nämä eivät ole kaikkia COPEGUS-hoidon mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Voit myös ilmoittaa sivuvaikutuksista Genentechille numerossa 1-888-835-2555.
Kuinka minun pitäisi säilyttää COPEGUS 100mg?
- Säilytä COPEGUS-tabletteja 15–30 °C:ssa (59–86 °F).
- Pidä pullo tiiviisti suljettuna.
Pidä COPEGUS 100mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa COPEGUSin turvallisesta ja tehokkaasta käytöstä
Ei tiedetä, estääkö COPEGUS 100 mg -hoito yhdessä PEGASYSin kanssa tartunnan saaneita henkilöitä levittämästä hepatiitti C -virusta toiselle henkilölle hoidon aikana.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä COPEGUS 100 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna COPEGUS-valmistetta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä COPEGUS-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajalta tai apteekista terveydenhuollon ammattilaisille kirjoitettuja COPEGUS-tietoja.
Mitä ainesosia COPEGUS 100mg sisältää?
Vaikuttava aine: ribaviriini
Inaktiiviset ainesosat: Tabletin ydin sisältää esigelatinoitua tärkkelystä, mikrokiteistä selluloosaa, natriumtärkkelysglykolaattia, maissitärkkelystä ja magnesiumstearaattia. Tabletin pinnoite sisältää Chromatone-P:tä tai Opadry Pinkia (valmistettu käyttämällä hydroksipropyylimetyyliselluloosaa, talkkia, titaanidioksidia, synteettistä keltaista rautaoksidia ja synteettistä punaista rautaoksidia), etyyliselluloosaa (ECD-30) ja triasetiinia.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
