Famvir 250mg, 500mg Famciclovir Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Famvir on ja miten sitä käytetään?
Famvir on reseptilääke, jota käytetään akuutin herpes zosterin (vyöruusu), Herpes Labialliksen ja sukupuolielinten herpesin oireiden hoitoon. Famvir 250 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Famvir 250mg kuuluu luokkaan antiviraalit, muut.
Ei tiedetä, onko Famvir turvallinen ja tehokas alle 18-vuotiaille lapsille.
Mitkä ovat Famvir 250mg:n mahdolliset sivuvaikutukset?
Famvir 250 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hämmennystä,
- vähän tai ei ollenkaan virtsaamista,
- turvotus jaloissasi tai nilkoissasi,
- väsymys ja
- hengenahdistus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Famvir 500mg:n yleisimmät sivuvaikutukset ovat:
- päänsärkyä ja
- pahoinvointi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Famvirin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
FAMVIR 500 mg tablettien vaikuttava aine on famsikloviiri, joka on pensikloviirin oraalisesti annettava aihiolääke. Kemiallisesti famsikloviiri tunnetaan nimellä 2-[2-(2-amino-9H-purin-9-yyli)etyyli]-1,3-propaanidiolidiasetaatti. Sen molekyylikaava on C14H19N5O4; sen molekyylipaino on 321,3. Se on synteettinen asyklinen guaniinijohdannainen ja sillä on seuraava rakenne
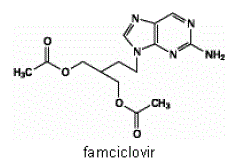
Famsikloviiri on valkoisesta vaaleankeltaiseen kiinteään aineeseen. Se liukenee vapaasti asetoniin ja metanoliin ja niukkaliukoinen etanoliin ja isopropanoliin. 25 °C:ssa famsikloviiri liukenee aluksi vapaasti (>25 % w/v) veteen, mutta saostuu nopeasti niukkaliukoisena (2-3 % w/v) monohydraattina. Famsikloviiri ei ole hygroskooppinen alle 85 %:n suhteellisessa kosteudessa. Jakaantumiskertoimet ovat: oktanoli/vesi (pH 4,8) P=1,09 ja oktanoli/fosfaattipuskuri (pH 7,4) P=2,08.
FAMVIR 250 mg tabletit sisältävät 125 mg, 250 mg tai 500 mg famsikloviiria yhdessä seuraavien inaktiivisten aineosien kanssa: hydroksipropyyliselluloosa, hydroksipropyylimetyyliselluloosa, laktoosi, magnesiumstearaatti, polyetyleeniglykolit, natriumtärkkelysglykolaatti ja natriumtärkkelysglykolaatti.
INDIKAATIOT
Immunokompetentit aikuispotilaat
Herpes Labialis (huuliherpes)
FAMVIR on tarkoitettu toistuvan herpes labialisin hoitoon.
Sukupuoliherpes
Toistuvat jaksot:
FAMVIR on tarkoitettu toistuvien genitaaliherpesepisodien hoitoon. FAMVIR:n tehoa, kun se aloitetaan yli 6 tunnin kuluttua oireiden tai leesioiden alkamisesta, ei ole osoitettu.
Suppressiivinen terapia:
FAMVIR 250mg on tarkoitettu toistuvien genitaaliherpesepisodien krooniseen suppressiiviseen hoitoon. FAMVIRin tehoa ja turvallisuutta toistuvan sukupuolielinten herpeksen estämisessä yli vuoden ajan ei ole osoitettu.
Herpes zoster (vyöruusu)
FAMVIR 500mg on tarkoitettu herpes zosterin hoitoon. FAMVIR-hoidon tehoa, kun se aloitetaan yli 72 tunnin kuluttua ihottuman alkamisesta, ei ole osoitettu.
HIV-tartunnan saaneet aikuispotilaat
Toistuva suun tai sukupuolielinten herpes
FAMVIR on tarkoitettu HIV-tartunnan saaneiden aikuisten toistuvien suu- ja sukupuoliherpesepisodien hoitoon. FAMVIR:n tehoa, kun se aloitetaan yli 48 tunnin kuluttua oireiden tai leesioiden alkamisesta, ei ole osoitettu.
Käytön rajoitus
FAMVIRin tehoa ja turvallisuutta ei ole varmistettu:
- Potilaat alle 18-vuotiaat
- Potilaat, joilla on ensimmäinen genitaaliherpesjakso
- Potilaat, joilla on oftalminen zoster
- potilaat, joiden immuunivaste on heikentynyt muuhun kuin toistuvan suun labiaalisen tai sukupuolielinten herpesin hoitoon HIV-tartunnan saaneilla potilailla
- Mustat ja afroamerikkalaiset potilaat, joilla on toistuva sukupuolielinten herpes
ANNOSTELU JA HALLINNOINTI
FAMVIR 500 mg voidaan ottaa ruoan kanssa tai ilman.
Annostussuositus immuunipuutteisille aikuispotilaille
Herpes Labialis (huuliherpes)
FAMVIR 500 mg:n suositeltu annos toistuvan herpes labialisin hoitoon on 1500 mg kerta-annoksena. Hoito tulee aloittaa herpes labialisin ensimmäisten merkkien tai oireiden (esim. pistely, kutina, kirvely, kipu tai vaurio) ilmetessä.
Sukupuoliherpes
Toistuvat jaksot
FAMVIRin suositeltu annostus toistuvien genitaaliherpesepisodien hoitoon on 1000 mg kahdesti vuorokaudessa 1 päivän ajan. Hoito tulee aloittaa toistuvan episodin ensimmäisten merkkien tai oireiden ilmetessä (esim. pistely, kutina, kirvely, kipu tai vaurio).
Tukahduttava terapia
FAMVIR 500 mg:n suositusannos toistuvien genitaaliherpesepisodien krooniseen suppressiiviseen hoitoon on 250 mg kahdesti vuorokaudessa.
Herpes zoster (vyöruusu)
FAMVIR 250 mg:n suositusannos herpes zosterin hoitoon on 500 mg 8 tunnin välein 7 päivän ajan. Hoito tulee aloittaa heti, kun herpes zoster on diagnosoitu.
Annostussuositus HIV-tartunnan saaneille aikuispotilaille
Toistuva suun tai sukupuolielinten herpes
Suositeltu FAMVIR-annos HIV-tartunnan saaneiden potilaiden toistuvan suun labiaalisen tai genitaaliherpeksen hoitoon on 500 mg kahdesti vuorokaudessa 7 päivän ajan. Hoito tulee aloittaa toistuvan episodin ensimmäisten merkkien tai oireiden ilmetessä (esim. pistely, kutina, kirvely, kipu tai vaurio).
Annostussuositus potilaille, joilla on munuaisten vajaatoiminta
Annostussuositukset aikuisille potilaille, joilla on munuaisten vajaatoiminta, on esitetty taulukossa 1 [katso Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
FAMVIR-tabletteja on saatavana 3 vahvuutena:
- 125 mg: Valkoinen, pyöreä kalvopäällysteinen, kaksoiskupera, viistoreunainen, toisella puolella kaiverrus ”FAMVIR” ja toisella puolella ”125”
- 250 mg: Valkoinen, pyöreä kalvopäällysteinen, kaksoiskupera, viistoreunainen, toisella puolella merkintä ”FAMVIR” ja toisella ”250”
- 500 mg: valkoinen, soikea kalvopäällysteinen, kaksoiskupera, toisella puolella merkintä ”FAMVIR” ja toisella ”500”
Varastointi ja käsittely
FAMVIR tabletit toimitetaan kalvopäällysteisinä tabletteina seuraavasti: 125 mg 30 tabletin pulloissa; 250 mg 30:n pulloissa; 500 mg 30 kappaleen pulloissa ja 50 kappaleen yksittäispakkauksissa (tarkoitettu vain laitoskäyttöön).
- FAMVIR 125 mg tabletti: Valkoinen, pyöreä kalvopäällysteinen, kaksoiskupera, viistoreunainen tabletti, jonka toisella puolella on merkintä ”FAMVIR” ja toisella ”125”. 125 mg 30s NDC 0078-0366-15
- FAMVIR 250 mg tabletti : Valkoinen, pyöreä kalvopäällysteinen, kaksoiskupera, viistetyt reunat, joissa toisella puolella "FAMVIR" ja toisella "250". 250 mg 30s NDC 0078-0367-15
- FAMVIR 500 mg tabletti : Valkoinen, soikea kalvopäällysteinen, kaksoiskupera, toisella puolella merkintä ”FAMVIR” ja toisella ”500”. 500 mg 30s NDC 0078-0368-15 500 mg SUP 50:t NDC 0078-0368-64
Säilytä 25°C (77°F); retket sallitaan 15-30 °C:seen (59-86 °F) [katso USP Controlled Room Temperature].
Jakelija: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Tarkistettu: syyskuu 2016
SIVUVAIKUTUKSET
Akuuttia munuaisten vajaatoimintaa käsitellään yksityiskohtaisemmin etiketin muissa osissa [katso VAROITUKSET JA VAROTOIMET ].
Yleisimmät haittatapahtumat, jotka yli 10 %:lla FAMVIR 250 mg:lla hoidetuista aikuispotilaista raportoi vähintään yhdessä käyttöaiheessa, ovat päänsärky ja pahoinvointi.
Kokemus kliinisistä kokeista aikuispotilailla
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Immunokompetentit potilaat
FAMVIR 250 mg:n turvallisuutta on arvioitu aktiivisilla ja lumekontrolloiduilla kliinisillä tutkimuksilla, joihin osallistui 816 FAMVIR-hoitoa sairastavaa herpes zoster -potilasta (FAMVIR, 250 mg kolmesti päivässä - 750 mg kolmesti päivässä); 163 FAMVIR-hoitoa sairastavaa potilasta, joilla on uusiutuva genitaaliherpes (FAMVIR, 1000 mg kahdesti päivässä); 1 197 potilasta, joilla oli uusiutuva genitaaliherpes, hoidettiin FAMVIR:llä 250 mg estävänä hoitona (125 mg kerran vuorokaudessa - 250 mg kolmesti päivässä), joista 570 potilasta sai FAMVIR:ää (avoin ja/tai kaksoissokkoutettu) vähintään 10 kuukauden ajan; ja 447 FAMVIR-hoitoa sairastavaa potilasta, joilla on herpes labialis (FAMVIR 500 mg, 1500 mg kerran päivässä tai 750 mg kahdesti vuorokaudessa). Taulukossa 2 luetellaan valitut haittatapahtumat.
Taulukossa 3 luetellaan valitut laboratoriopoikkeavuudet genitaaliherpessuppressiokokeissa.
HIV-tartunnan saaneet potilaat
HIV-tartunnan saaneilla potilailla FAMVIR:n (500 mg kahdesti vuorokaudessa; n=150) ja asykloviirin (400 mg, 5x/vrk; n=143) yleisimmin raportoidut haittatapahtumat olivat päänsärky (17 % vs. 15 %). ), pahoinvointi (11 % vs. 13 %), ripuli (7 % vs. 11 %), oksentelu (5 % vs. 4 %), väsymys (4 % vs. 2 %) ja vatsakipu (3 % vs. 6 %).
Markkinoinnin jälkeinen kokemus
Alla luetellut haittatapahtumat on raportoitu FAMVIR:n hyväksymisen jälkeisen käytön aikana. Koska nämä tapahtumat on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
Veren ja imunestejärjestelmän häiriöt : Trombosytopenia
Maksan ja sappien häiriöt : Epänormaalit maksan toimintakokeet, kolestaattinen keltaisuus
Immuunijärjestelmän häiriöt : Anafylaktinen sokki, anafylaktinen reaktio
Hermoston häiriöt : Huimaus, uneliaisuus, kohtaukset
Psyykkiset häiriöt sekavuus (mukaan lukien delirium, sekavuus ja sekavuustila, jota esiintyy pääasiassa vanhuksilla), hallusinaatiot
Ihon ja ihonalaisen kudoksen häiriöt : Nokkosihottuma, erythema multiforme, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, angioödeema (esim. kasvojen, silmäluomien, periorbitaalinen ja nielun turvotus), yliherkkyysvaskuliitti
Sydämen häiriöt : Sydämentykytys
HUUMEIDEN VUOROVAIKUTUKSET
FAMVIR 250mg voi vaikuttaa muihin lääkkeisiin
Digoksiinin vakaan tilan farmakokinetiikka ei muuttunut, kun samanaikaisesti annettiin useita famsikloviiriannoksia (500 mg kolmesti vuorokaudessa). Mitään kliinisesti merkitsevää vaikutusta tsidovudiinin, sen metaboliitin tsidovudiiniglukuronidin tai emtrisitabiinin farmakokinetiikkaan ei havaittu, kun famsikloviiria annettiin suun kautta 500 mg:n kerta-annoksena yhdessä tsidovudiinin tai emtrisitabiinin kanssa.
Ihmisen maksan mikrosomeilla tehty in vitro -tutkimus viittaa siihen, että famsikloviiri ei ole CYP3A4-entsyymien estäjä.
Muiden lääkkeiden mahdollisuus vaikuttaa pensikloviiriin
Kliinisesti merkittäviä muutoksia pensikloviirin farmakokinetiikassa ei havaittu 500 mg:n famsikloviirin kerta-annoksen antamisen jälkeen, kun niitä oli esikäsittelyssä useilla allopurinoli-, simetidiini-, teofylliini-, tsidovudiini-, prometatsiini-annoksilla, kun ne annettiin pian antasidin (magnesium- ja alumiinihydroksidin kanssa) antamisen jälkeen. emtrisitabiini. Kliinisesti merkitsevää vaikutusta pensikloviirin farmakokinetiikkaan ei havaittu, kun famsikloviiria (500 mg) annettiin toistuvasti (3 kertaa vuorokaudessa) toistuvien digoksiiniannosten kanssa.
Samanaikainen käyttö probenesidin tai muiden lääkkeiden kanssa, jotka eliminoituvat merkittävästi aktiivisen munuaisten tubuluserityksen kautta, voi lisätä pensikloviiripitoisuuksia plasmassa.
Aldehydioksidaasi katalysoi 6-deoksipensikloviirin muuttumista pensikloviiriksi. Yhteisvaikutuksia muiden tämän entsyymin metaboloimien ja/tai tätä entsyymiä inhiboivien lääkkeiden kanssa saattaa esiintyä. Famsikloviirin ja simetidiinin ja prometatsiinin, aldehydioksidaasin in vitro estäjien, kliiniset yhteisvaikutustutkimukset eivät osoittaneet merkittäviä vaikutuksia pensikloviirin muodostumiseen. Raloksifeeni, voimakas aldehydioksidaasin estäjä in vitro, saattaa vähentää pensikloviirin muodostumista. Kliinistä lääkeaineiden yhteisvaikutustutkimusta pensikloviirin ja raloksifeenin välisen yhteisvaikutuksen suuruuden määrittämiseksi ei kuitenkaan ole tehty.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Akuutti munuaisten vajaatoiminta
Akuuttia munuaisten vajaatoimintaa on raportoitu potilailla, joilla on taustalla oleva munuaissairaus ja jotka ovat saaneet munuaisten toimintatasonsa vuoksi sopimattomia FAMVIR-annoksia. Annoksen pienentämistä suositellaan, kun FAMVIRia annetaan potilaille, joilla on munuaisten vajaatoiminta [katso ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä (potilastiedot).
Ei ole näyttöä siitä, että FAMVIR vaikuttaisi potilaan kykyyn ajaa autoa tai käyttää koneita. Potilaiden, jotka kokevat huimausta, uneliaisuutta, sekavuutta tai muita keskushermostohäiriöitä FAMVIR 500 mg -valmisteen käytön aikana, tulee kuitenkin pidättäytyä ajamasta autoa tai käyttämättä koneita.
Koska FAMVIR sisältää laktoosia (FAMVIR 125 mg, 250 mg ja 500 mg tabletit sisältävät laktoosia 26,9 mg, 53,7 mg ja 107,4 mg, vastaavasti), potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, vaikea laktaasin puutos tai glukoosi-galaktio neuvoa keskustelemaan terveydenhuollon tarjoajansa kanssa ennen FAMVIRin ottamista.
Herpes Labialis (huuliherpes)
Potilaita tulee neuvoa aloittamaan hoito heti, kun yskänherpesen uusiutumisen merkki tai oire ilmenee (esim. pistely, kutina, polttava, kipu tai vaurio). Potilaita tulee neuvoa, että huuliherpeshoito ei saa ylittää yhtä annosta. Potilaille tulee kertoa, että FAMVIR ei paranna yskänrokkoa.
Sukupuoliherpes
Potilaille tulee kertoa, että FAMVIR ei paranna sukupuolielinten herpestä. Ei ole olemassa tietoja sen arvioimiseksi, estääkö FAMVIR tartunnan siirtymisen muille. Koska genitaaliherpes on sukupuoliteitse tarttuva tauti, potilaiden tulee välttää kosketusta leesioihin tai yhdyntää leesioiden ja/tai oireiden esiintyessä välttääkseen kumppanien tartunnan. Genitaaliherpes tarttuu usein ilman oireita oireettoman viruksen leviämisen kautta. Siksi potilaita tulee neuvoa käyttämään turvallisempia seksikäytäntöjä.
Jos toistuvan genitaaliherpesen jaksollinen hoito on aiheellista, potilaita tulee neuvoa aloittamaan hoito episodin ensimmäisten merkkien tai oireiden ilmetessä.
Yli 1 vuoden kestävän kroonisen suppressiivisen hoidon turvallisuudesta tai tehokkuudesta ei ole tietoa.
Herpes zoster (vyöruusu)
Ei ole tietoja hoidosta, joka aloitettiin yli 72 tuntia vyöruusu-ihottuman alkamisen jälkeen. Potilaita tulee neuvoa aloittamaan hoito mahdollisimman pian herpes zoster -diagnoosin jälkeen.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Famsikloviirilla tehtiin kaksivuotisia karsinogeenisuustutkimuksia ruokavaliosta rotilla ja hiirillä. Maitorauhasen adenokarsinooman (yleinen kasvain tämän kannan eläimillä) esiintyvyyden lisääntyminen havaittiin naarasrotilla, jotka saivat suuren annoksen 600 mg/kg/vrk (1,1-4,5 kertaa ihmisen systeeminen altistus suositellulla päiväannoksella suun kautta). vaihtelevat välillä 500 mg - 2000 mg, perustuen pensikloviirin plasmakonsentraatiokäyrän alla olevaan pinta-alaan [24 tunnin AUC]). Kasvainten ilmaantuvuuden lisääntymistä ei raportoitu urosrotilla, joita hoidettiin annoksilla 240 mg/kg/vrk (0,7-2,7 kertaa ihmisen AUC) eikä uros- ja naarashiirillä annoksilla 600 mg/kg/vrk (0,3- 1,2 kertaa ihmisen AUC).
Mutageneesi
Famsikloviiri ja pensikloviiri (famsikloviirin aktiivinen metaboliitti) testattiin genotoksisuuden suhteen useissa in vitro ja in vivo -määrityksissä. Famsikloviiri ja pensikloviiri olivat negatiivisia in vitro -testeissä bakteerien geenimutaatioiden (S. typhimurium ja E. coli) ja suunnittelemattoman DNA-synteesin varalta nisäkkään HeLa 83 -soluissa (annoksilla 10 000 ja 5 000 mikrogrammaa/levy vastaavasti). Famsikloviiri oli myös negatiivinen L5178Y-hiiren lymfoomamäärityksessä (5000 mcg/ml), hiiren mikrotumatestissä in vivo (4800 mg/kg) ja rotan dominanttiletaalitutkimuksessa (5000 mg/kg). Famsikloviiri aiheutti polyploidian lisääntymistä ihmisen lymfosyyteissä in vitro ilman kromosomivaurioita (1200 mcg/ml). Pensikloviiri oli positiivinen L5178Y-hiiren lymfoomamäärityksessä geenimutaatioiden/kromosomipoikkeavuuksien toteamiseksi sekä metabolisen aktivaation kanssa että ilman (1000 mcg/ml). Ihmisen lymfosyyteissä pensikloviiri aiheutti kromosomipoikkeavuuksia ilman metabolista aktivaatiota (250 mcg/ml). Pensikloviiri lisäsi mikrotumien ilmaantuvuutta hiiren luuytimessä in vivo, kun sitä annettiin suonensisäisesti luuytimelle erittäin toksisina annoksina (500 mg/kg), mutta ei suun kautta annettuna.
Hedelmällisyyden heikkeneminen
Kivestoksisuutta havaittiin rotilla, hiirillä ja koirilla famsikloviirin tai pensikloviirin toistuvan annon jälkeen. Kivesmuutoksia olivat siementiehyiden surkastuminen, siittiöiden määrän väheneminen ja/tai lisääntynyt siittiöiden esiintyvyys, joilla on epänormaali morfologia tai vähentynyt liikkuvuus. Miesten lisääntymiseen kohdistuvan toksisuuden aste liittyi annokseen ja altistuksen kestoon. Urosrotilla havaittiin heikentynyttä hedelmällisyyttä 10 viikon annoksella 500 mg/kg/vrk (1,4-5,7 kertaa ihmisen AUC). Siittiö- ja kivestoksisuustaso, jossa ei havaittu vaikutusta rotilla kroonisen annon (26 viikkoa) jälkeen, oli 50 mg/kg/vrk (0,15-0,6 kertaa ihmisen systeeminen altistus AUC-vertailujen perusteella). Kivestoksisuutta havaittiin, kun hiirille (104 viikkoa) ja koirille (26 viikkoa) annettiin kroonista annoksilla 600 mg/kg/vrk (0,3-1,2 kertaa ihmisen AUC) ja 150 mg/kg/vrk (1,3-5,1 x ihmisen AUC), vastaavasti.
Famsikloviiri ei vaikuttanut yleiseen lisääntymiskykyyn tai hedelmällisyyteen naarasrotilla annoksilla 1000 mg/kg/vrk asti (2,7-10,8 kertaa ihmisen AUC).
Kahdessa lumekontrolloidussa tutkimuksessa yhteensä 130 muuten terveellä miehellä, joilla oli normaali siittiöprofiili 8 viikon lähtötilanteen aikana ja toistuva genitaaliherpes, jotka saivat suun kautta FAMVIR:ää (250 mg kahdesti vuorokaudessa) (n=66) tai lumelääkettä (n=64) 18 viikon hoidon aikana ei havaittu merkittäviä vaikutuksia siittiöiden määrään, liikkuvuuteen tai morfologiaan hoidon aikana tai 8 viikon seurannan aikana.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka B
Oraalisen annon jälkeen famsikloviiri (aihiolääke) muuttuu pensikloviiriksi (aktiivinen lääke). Famsikloviirin tai pensikloviirin käytöstä raskaana oleville naisille ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Haitallisia vaikutuksia alkion ja sikiön kehitykseen ei havaittu lisääntymistutkimuksissa eläimillä, joissa käytettiin famsikloviiria ja pensikloviiria annoksilla, jotka olivat suurempia kuin suurin suositeltu ihmisannos (MRHD) ja ihmisen altistus. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, famsikloviiria tulee käyttää raskauden aikana vain tarvittaessa.
Lisääntymistutkimuksissa eläimillä raskaana olevat rotat ja kaniinit saivat suun kautta famsikloviiria annoksina (jopa 1000 mg/kg/vrk), jotka olivat 2,7-10,8-kertaiset (rotilla) ja 1,4-5,4-kertaiset (kaniinit) ihmisen systeemiseen altistukseen verrattuna AUC:n perusteella. Alkion ja sikiön kehitykseen ei havaittu haitallisia vaikutuksia. Muissa tutkimuksissa raskaana olevat rotat ja kanit saivat suonensisäisesti famsikloviiria annoksina (360 mg/kg/vrk) 1,5-6 kertaa (rotat) ja (120 mg/kg/vrk) 1,1-4,5 kertaa (kanit) tai pensikloviiria annoksina (80 mg/kg/vrk) 0,3-1,3 kertaa (rotat) ja (60 mg/kg/vrk) 0,5-2,1 kertaa (kanit) MRHD:tä kehon pinta-alavertailujen perusteella. Alkion ja sikiön kehitykseen ei havaittu haitallisia vaikutuksia.
Raskausaltistuksen raportointi
Novartis Pharmaceuticals Corporation ylläpitää FAMVIR-raskausraportointijärjestelmää seuratakseen FAMVIR 500 mg:lle altistuneiden raskaana olevien naisten äidin ja sikiön tuloksia. Lääkäreitä kehotetaan ilmoittamaan potilaistaan soittamalla numeroon 1-888-NOW-NOVA (669-6682).
Imettävät äidit
Ei tiedetä, erittyykö famsikloviiri (aihiolääke) vai pensikloviiri (aktiivinen lääke) äidinmaitoon. Kun famsikloviiria annettiin suun kautta imettäville rotille, pensikloviiri erittyi rintamaitoon plasmassa havaittuja pitoisuuksia suurempina pitoisuuksina. FAMVIR 250 mg:n turvallisuudesta imeväisille ei ole tietoa. FAMVIR 500 mg -valmistetta ei tule käyttää imettäville äideille, ellei mahdollisten hyötyjen katsota ylittävän hoitoon liittyviä mahdollisia riskejä.
Käyttö lapsille
FAMVIR 250 mg:n tehoa ei ole osoitettu lapsipotilailla. Famsikloviirin (kokeelliset rakeet sekoitettuna OraSweet®:iin tai tabletteihin) farmakokineettistä profiilia ja turvallisuutta tutkittiin kolmessa avoimessa tutkimuksessa.
Tutkimus 1 oli kerta-annoksen farmakokineettinen ja turvallisuustutkimus 1 kuukauden–
Tutkimus 2 oli avoin, kerta-annoksen farmakokineettinen, usean annoksen turvallisuustutkimus famsikloviirin kokeellisilla rakeilla sekoitettuna OraSweetiin 1–
Yhteensä 100 potilasta otettiin mukaan tutkimuksen usean annoksen turvallisuusosaan; 47 henkilöä, joilla oli aktiivinen tai piilevä HSV-infektio, ja 53 henkilöä, joilla oli vesirokko. Potilaat, joilla oli aktiivinen tai piilevä HSV-infektio, saivat famsikloviiria kahdesti päivässä 7 päivän ajan. Famsikloviirin vuorokausiannos vaihteli 150–500 mg kahdesti vuorokaudessa potilaan painon mukaan. Vesirokkopotilaat saivat famsikloviiria kolme kertaa päivässä 7 päivän ajan. Famsikloviirin vuorokausiannos vaihteli 150–500 mg kolme kertaa vuorokaudessa potilaan painon mukaan. Tässä tutkimuksessa havaitut kliiniset haittatapahtumat ja laboratoriotestien poikkeavuudet olivat samanlaisia kuin aikuisilla. Käytettävissä olevat tiedot eivät riitä tukemaan famsikloviirin käyttöä vesirokon tai HSV:n aiheuttamien infektioiden hoitoon 1–
Vesirokko
Famsikloviirin tehoa vesirokon hoidossa ei ole osoitettu lapsi- tai aikuispotilailla. Famsikloviiri on hyväksytty herpes zosterin hoitoon aikuisilla potilailla. Herpes zoster -tautia sairastavien aikuisten tehokkuustietojen ekstrapolointi vesirokkoa sairastaviin lapsiin ei kuitenkaan ole asianmukaista. Vaikka vesirokko ja herpes zoster ovat saman viruksen aiheuttamia, sairaudet ovat erilaisia.
Sukupuoliherpes
Kliinistä tietoa sukupuolielinten herpesestä lapsilla on rajoitetusti. Siksi aikuisilta saatuja tehokkuustietoja ei voida ekstrapoloida tähän populaatioon. Lisäksi famsikloviiria ei ole tutkittu 1–
Herpes Labialis
Ei ole olemassa farmakokineettisiä ja turvallisuustietoja 1–
Tutkimus 3 oli avoin, yksihaarainen tutkimus, jossa arvioitiin 1500 mg:n kerta-annoksen (kolme 500 mg:n tablettia) famsikloviirin farmakokinetiikkaa, turvallisuutta ja antiviraalista aktiivisuutta 12–
Vaiheen 3 tutkimuksessa aikuisilla, jossa potilaat saivat 1 500 mg:n kerta-annoksen famsikloviiria tai lumelääkettä, parantumisajan mediaani potilailla, joilla oli abortoimattomia vaurioita, oli 4,4 päivää famsikloviiria 1500 mg kerta-annosryhmässä ja 6,2 päivää. lumeryhmä. On huomattava, että aikuistutkimuksessa potilaat aloittivat hoidon 1 tunnin sisällä oireiden alkamisesta [katso Kliiniset tutkimukset ]. Tutkimuksen 3 tehokkuustulosten perusteella famsikloviiria ei suositella 12–
Geriatrinen käyttö
Kliinisissä tutkimuksissa 816 herpes zoster -potilaasta, joita hoidettiin FAMVIR:llä, 248 (30,4 %) oli 65-vuotiaita ja 103 (13 %) ≥75-vuotiaita. Yleisiä eroja ei havaittu nuorempien ja vanhempien potilaiden haittatapahtumien ilmaantuvuuden tai tyypin välillä. Kliinisissä tutkimuksissa 610 potilaasta, joilla oli uusiutuva herpes simplex (tyyppi 1 tai tyyppi 2), joita hoidettiin FAMVIR 500 mg:lla, 26 (4,3 %) oli yli 65-vuotiaita ja 7 (1,1 %) yli 75-vuotiaita. FAMVIR 500 mg:n kliinisissä tutkimuksissa potilailla, joilla oli uusiutuva genitaaliherpes, ei ollut riittävästi 65-vuotiaita ja sitä vanhempia, jotta voitaisiin määrittää, reagoivatko he eri tavalla kuin nuoremmat.
Famsikloviiriannoksen muuttamista iän perusteella ei suositella, ellei munuaisten toiminta ole heikentynyt [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ]. Yleensä on noudatettava asianmukaista varovaisuutta annettaessa ja seurattaessa FAMVIR 250 mg iäkkäille potilaille, koska munuaisten toiminta heikkenee ja muita lääkkeitä käytetään useammin.
Potilaat, joilla on munuaisten vajaatoiminta
Pensikloviirin näennäinen plasmapuhdistuma, munuaispuhdistuma ja plasman eliminaationopeusvakio pienenivät lineaarisesti munuaisten toiminnan heikkenemisen myötä. Kun kerta-annos 500 mg famsikloviiria annettiin suun kautta (n=27) terveille vapaaehtoisille ja vapaaehtoisille, joilla oli eriasteinen munuaisten vajaatoiminta (CLCR vaihteli välillä 6,4-138,8 ml/min), saatiin seuraavat tulokset (taulukko 4):
Famsikloviiria koskevassa usean annoksen tutkimuksessa, joka suoritettiin eriasteisesta munuaisten vajaatoiminnasta kärsivillä (n=18), pensikloviirin farmakokinetiikka oli verrattavissa kerta-annosten jälkeiseen farmakokinetiikkaan.
Annoksen muuttamista suositellaan potilaille, joilla on munuaisten vajaatoiminta [ks ANNOSTELU JA HALLINNOINTI ].
Potilaat, joilla on maksan vajaatoiminta
Lievä tai kohtalainen maksan vajaatoiminta (krooninen hepatiitti [n=6], krooninen etanolin väärinkäyttö [n=8] tai primaarinen sappikirroosi [n=1]) ei vaikuttanut pensikloviirin saatavuuden määrään (AUC) kerta-annoksen jälkeen 500 mg famsikloviiria. Pensikloviirin keskimääräinen plasman huippupitoisuus (Cmax) pieneni kuitenkin 44 % ja maksimipitoisuuden saavuttamiseen kuluva aika (tmax) piteni 0,75 tuntia potilailla, joilla oli maksan vajaatoiminta normaaliin vapaaehtoiseen verrattuna. Annoksen muuttamista ei suositella potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. Pensikloviirin farmakokinetiikkaa ei ole arvioitu potilailla, joilla on vaikea maksan vajaatoiminta. Famsikloviirin muuntuminen aktiiviseksi metaboliitiksi pensikloviiriks voi heikentyä näillä potilailla, mikä johtaa alhaisempiin pensikloviiripitoisuuksiin plasmassa ja siten mahdollisesti famsikloviirin tehon heikkenemiseen [ks. KLIININEN FARMAKOLOGIA ].
Mustat ja afroamerikkalaiset potilaat
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 304 immunokompetenttia mustaa ja afroamerikkalaista aikuista, joilla oli uusiutuva genitaaliherpes, ei havaittu eroa FAMVIR- tai lumelääkettä saaneiden potilaiden parantumiseen kuluvassa mediaaniajassa. Yleensä haittavaikutusprofiili oli samanlainen kuin muissa aikuispotilailla tehdyissä kliinisissä FAMVIR-tutkimuksissa havaittu [katso HAITTAVAIKUTUKSET ]. Näiden tutkimustulosten merkitystä muihin indikaatioihin mustilla ja afroamerikkalaispotilailla ei tunneta [katso Kliiniset tutkimukset ].
YLIANNOSTUS
Asianmukaista oireenmukaista ja tukevaa hoitoa tulee antaa. Pensikloviiri poistetaan hemodialyysillä.
VASTA-AIHEET
FAMVIR 250mg on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä tuotteelle, sen aineosille tai Denavir®:lle (pensikloviirivoide).
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Famsikloviiri on oraalisesti annettava antiviraalisen aineen pensikloviiri aihiolääke [ks. Mikrobiologia ].
Farmakokinetiikka
Famsikloviiri on aktiivisen antiviraalisen yhdisteen pensikloviirin diasetyyli-6-deoksianalogi. Oraalisen annon jälkeen famsikloviiri metaboloituu nopeasti ja laajasti pensikloviiriksi, ja plasmassa tai virtsassa todetaan vain vähän tai ei ollenkaan famsikloviiria. Pensikloviiri eliminoituu pääasiassa muuttumattomana munuaisten kautta. Siksi FAMVIR 500 mg annosta on säädettävä potilailla, joilla on eriasteinen munuaisten vajaatoiminta [ks. ANNOSTELU JA HALLINNOINTI ].
Farmakokinetiikka aikuisilla
Imeytyminen ja biologinen hyötyosuus:
Pensikloviirin absoluuttinen biologinen hyötyosuus on 77 ± 8 % määritettynä 500 mg:n famsikloviiriannoksen oraalisen ja 400 mg:n pensikloviirin suonensisäisen annon jälkeen 12 terveelle mieshenkilölle.
Pensikloviiripitoisuudet kasvoivat suhteessa annokseen kerta-annoksena annetulla famsikloviiriannosalueella 125–1000 mg. Taulukko 5 esittää pensikloviirin keskimääräiset farmakokineettiset parametrit FAMVIR:n kerta-annoksen jälkeen terveille miespuolisille vapaaehtoisille.
Kun 7 potilaalle, joilla oli herpes zoster, annettiin kerta-annos 500 mg famsikloviiria suun kautta, AUC (keskiarvo ± SD), Cmax ja tmax olivat 12,1 ± 1,7 mcg h/ml, 4,0 ± 0,7 mcg/ml ja 0,7 ± 0,2 tuntia. , vastaavasti. Pensikloviirin AUC oli noin 35 % suurempi herpes zoster -potilailla verrattuna terveisiin vapaaehtoisiin. Osa tästä erosta voi johtua munuaisten toiminnan eroista näiden kahden ryhmän välillä.
Pensikloviiria ei kerry, kun 500 mg famsikloviiria on annettu kolme kertaa vuorokaudessa 7 päivän ajan.
Pensikloviirin Cmax pieneni noin 50 % ja tmax viivästyi 1,5 tuntia, kun famsikloviirikapselimuoto annettiin ruoan kanssa (ravintosisältö oli noin 910 Kcal ja 26 % rasvaa). Pensikloviirin saatavuuden määrään (AUC) ei ollut vaikutusta. Kun famsikloviiri annettiin 2 tuntia aterian jälkeen, Cmax pieneni 18 % ja tmax viivästyi noin 1 tunnilla verrattuna siihen, että se annettiin 2 tuntia ennen ateriaa. Koska pensikloviirin systeemiseen saatavuuteen ei ollut vaikutusta, FAMVIR 250 mg voidaan ottaa aterioista riippumatta.
Jakelu:
Jakautumistilavuus (Vdβ) oli 1,08 ± 0,17 l/kg 12 terveellä miespuolisella koehenkilöllä sen jälkeen, kun 400 mg:n pensikloviiria annettiin kerta-annoksena laskimoon 1 tunnin suonensisäisenä infuusiona. Pensikloviiri sitoutuu alle 20 % plasman proteiineihin pitoisuuksilla 0,1-20 mcg/ml. Pensikloviirin veri/plasma-suhde on noin 1.
Aineenvaihdunta:
Oraalisen annon jälkeen famsikloviiri deasetyloidaan ja hapetetaan pensikloviiriksi. Inaktiivisia aineenvaihduntatuotteita ovat 6-deoksipensikloviiri, monoasetyloitu pensikloviiri ja 6-deoksimonoasetyloitu pensikloviiri (5 %, HUUMEIDEN VUOROVAIKUTUKSET ].
Eliminaatio:
Noin 94 % annetusta radioaktiivisuudesta erittyi virtsaan 24 tunnin aikana (83 % annoksesta erittyi ensimmäisten 6 tunnin aikana) sen jälkeen, kun 5 mg/kg radioaktiivisesti leimattua pensikloviiria annettiin 1 tunnin infuusiona 3 terveelle miespuoliselle vapaaehtoiselle. Pensikloviiri vastasi 91 % virtsaan erittyneestä radioaktiivisuudesta.
Kun kolmelle terveelle miespuoliselle vapaaehtoiselle annettiin suun kautta yksi 500 mg:n annos radioaktiivisesti leimattua famsikloviiria, 73 % ja 27 % annetusta radioaktiivisuudesta erittyi virtsaan ja ulosteeseen 72 tunnin aikana. Pensikloviirin osuus virtsaan erittyneestä radioaktiivisuudesta oli 82 % ja 6-deoksipensikloviirin osuus 7 %. Noin 60 % annetusta radioleimatusta annoksesta kerättiin virtsaan ensimmäisten 6 tunnin aikana.
Kun pensikloviiria annettiin suonensisäisesti 48 terveelle miespuoliselle vapaaehtoiselle, pensikloviirin plasman kokonaispuhdistuma oli keskimäärin ± SD 36,6 ± 6,3 l/h (0,48 ± 0,09 l/h/kg). Pensikloviirin munuaispuhdistuma oli 74,5±8,8 % plasman kokonaispuhdistumasta.
Pensikloviirin munuaispuhdistuma oli 27,7 ± 7,6 l/tunti sen jälkeen, kun 109 terveelle miespuoliselle vapaaehtoiselle annettiin 500 mg:n kerta-annos famsikloviiria. Aktiivinen tubuluseritys edistää pensikloviirin eliminaatiota munuaisten kautta.
Pensikloviirin eliminaation puoliintumisaika plasmassa oli 2,0 ± 0,3 tuntia pensikloviirin laskimonsisäisen annon jälkeen 48 terveelle miespuoliselle vapaaehtoiselle ja 2,3 ± 0,4 tuntia oraalisen 500 mg:n famsikloviirin antamisen jälkeen 124 terveelle miespuoliselle vapaaehtoiselle. Puoliintumisaika 17 herpes zoster -potilaalla oli 2,8 ± 1,0 tuntia kerta-annoksen ja 2,7 ± 1,0 tuntia toistuvan annoksen jälkeen.
Erikoispopulaatiot
Geriatriset potilaat
Ristiintutkimusten vertailun perusteella pensikloviirin AUC oli 40 % suurempi ja pensikloviirin munuaispuhdistuma 22 % pienempi iäkkäillä koehenkilöillä (n=18, ikä 65-79 vuotta) verrattuna nuorempiin koehenkilöihin. Osa tästä erosta voi johtua munuaisten toiminnan eroista näiden kahden ryhmän välillä. Famsikloviiriannoksen muuttamista iän perusteella ei suositella, ellei munuaisten toiminta ole heikentynyt [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ]
Potilaat, joilla on munuaisten vajaatoiminta
Koehenkilöillä, joilla oli eriasteinen munuaisten vajaatoiminta, pensikloviirin näennäinen plasmapuhdistuma, munuaispuhdistuma ja plasman eliminaationopeusvakio laskivat lineaarisesti munuaisten toiminnan heikkenemisen myötä sekä kerta- että toistuvan annostelun jälkeen [ks. Käyttö tietyissä populaatioissa ]. Annoksen muuttamista suositellaan potilaille, joilla on munuaisten vajaatoiminta [ks ANNOSTELU JA HALLINNOINTI ].
Potilaat, joilla on maksan vajaatoiminta
Lievä tai kohtalainen maksan vajaatoiminta ei vaikuttanut pensikloviirin saatavuuden määrään (AUC) [ks. Käyttö tietyissä populaatioissa ]. Annoksen muuttamista ei suositella potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. Vaikean maksan vajaatoiminnan vaikutusta pensikloviirin farmakokinetiikkaan ei ole arvioitu.
HIV-tartunnan saaneet potilaat
Kun 500 mg:n kerta-annos famsikloviiria annettiin suun kautta HIV-positiivisille potilaille, pensikloviirin farmakokineettiset parametrit olivat verrattavissa terveillä koehenkilöillä havaittuihin parametreihin.
Sukupuoli
Pensikloviirin farmakokinetiikkaa arvioitiin 18 terveellä mies- ja 18 terveellä naispuolisella vapaaehtoisella 500 mg:n famsikloviirin oraalisen kerta-annoksen jälkeen. Pensikloviirin AUC oli 9,3 ± 1,9 mcg h/ml miehillä ja 11,1 ± 2,1 mcg h/ml naisilla. Pensikloviirin munuaispuhdistuma oli 28,5±8,9 l/h ja 21,8±4,3 l/h. Nämä erot johtuivat munuaisten toiminnan eroista näiden kahden ryhmän välillä. Famsikloviiriannoksen muuttamista sukupuolen perusteella ei suositella.
Rotu
Suoritettiin retrospektiivinen arviointi, jossa verrattiin farmakokineettisiä parametreja, jotka saatiin mustaihoisilla ja valkoihoisilla koehenkilöillä 500 mg:n famsikloviirin kerta- ja toistuvan kerran päivässä, kahdesti vuorokaudessa tai kolmesti vuorokaudessa antamisen jälkeen. Terveillä vapaaehtoisilla (kerta-annos) tehdystä tutkimuksesta, eriasteisesta munuaisten vajaatoiminnasta kärsivillä koehenkilöillä tehdystä tutkimuksesta (kerta-annos ja toistuva annos) ja maksan vajaatoimintaa sairastavilla koehenkilöillä tehdystä tutkimuksesta (kerta-annos) saadut tiedot eivät osoittaneet merkittäviä eroja lääkeaineen farmakokinetiikassa. pensikloviiria mustien ja valkoihoisten koehenkilöiden välillä.
Mikrobiologia
Toimintamekanismi
Famsikloviiri on pensikloviirin aihiolääke, joka on osoittanut estävää vaikutusta herpes simplex -viruksen tyyppejä 1 (HSV-1) ja 2 (HSV-2) ja varicella zoster -virusta (VZV) vastaan. HSV-1:llä, HSV-2:lla tai VZV:llä infektoiduissa soluissa viruksen tymidiinikinaasi fosforyloi pensikloviirin monofosfaattimuotoon, jonka solukinaasit puolestaan muuttavat aktiiviseksi pensikloviiritrifosfaatiksi. Biokemialliset tutkimukset osoittavat, että pensikloviiritrifosfaatti estää HSV-2-DNA-polymeraasia kilpailukykyisesti deoksiguanosiinitrifosfaatin kanssa. Tämän seurauksena herpesviruksen DNA-synteesi ja siten replikaatio estyvät selektiivisesti. Pensikloviiritrifosfaatin solunsisäinen puoliintumisaika on 10 tuntia HSV-1-, 20 tuntia HSV-2- ja 7 tuntia VZV-infektoiduissa viljelmässä kasvatetuissa soluissa. Solunsisäisen puoliintumisajan kliinistä merkitystä ei kuitenkaan tunneta.
Antiviraalinen toiminta
Soluviljelytutkimuksissa pensikloviiri estää seuraavia herpesviruksia: HSV-1, HSV-2 ja VZV. Pensikloviirin antiviraalinen aktiivisuus ihmisen esinahan fibroblasteissa kasvatettuja villityypin kantoja vastaan arvioitiin plakin vähentämismäärityksellä ja värjäyksellä kristallivioletilla 3 päivää HSV-infektion ja 10 päivää VZV-infektion jälkeen. Pensikloviirin EC50-arvojen mediaanit HSV-1-, HSV-2- ja VZV-laboratorio- ja kliinisiä isolaatteja vastaan olivat 2 μM (vaihteluväli 1,2 - 2,4 μM, n = 7), 2,6 μM (vaihteluväli 1,6 - 11 μM, n = 6) , ja 34 μM (alue 6,7 - 71 μM, n = 6).
Resistanssi
Pensikloviiriresistentit HSV- ja VZV-mutantit voivat johtua mutaatioista viruksen tymidiinikinaasi- (TK) ja DNA-polymeraasigeeneissä. Mutaatiot viruksen TK-geenissä voivat johtaa TK-aktiivisuuden täydelliseen menettämiseen (TK-negatiivinen), TK-aktiivisuuden alentumiseen (TK osittainen) tai muutokseen viruksen TK:n kyvyssä fosforyloida lääkettä ilman vastaavanlaista fosforylaatiokyvyn menetystä. tymidiini (TK muutettu). Mediaanit EC50-arvot, jotka havaittiin plakin vähentämismäärityksessä pensikloviiriresistenttien HSV-1:n, HSV-2:n ja VZV:n kanssa, olivat 69 µM (väli 14-115 µM, n=6), 46 µM (väli 4->395 µM, n= 9) ja 92 μM (alue 51 - 148 μM, n = 4). Viruksen pensikloviiriresistenssin mahdollisuus tulee ottaa huomioon potilailla, jotka eivät reagoi hoitoon tai joilla virus erittyy toistuvasti hoidon aikana.
Ristivastus
Ristiresistenssi on havaittu HSV-DNA-polymeraasin estäjien keskuudessa. Yleisimmin havaitut asykloviiriresistentit mutantit, jotka ovat TK-negatiivisia, ovat myös resistenttejä pensikloviirille.
Kliiniset tutkimukset
Herpes Labialis (huuliherpes)
Satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus suoritettiin 701 immuunikompetenssilla aikuisella, joilla oli toistuva herpes labialis. Potilaat aloittivat hoidon 1 tunnin sisällä toistuvan herpes labialis -episodin ensimmäisten merkkien tai oireiden ilmaantumisesta käyttämällä FAMVIR 1500 mg kerta-annoksena (n=227), FAMVIR 750 mg kahdesti vuorokaudessa (n=220) tai lumelääke (n= 254) 1 päiväksi. Keskimääräinen paranemisaika potilailla, joilla oli abortoimattomia vaurioita (etenevät näppylävaiheen jälkeen), oli 4,4 päivää FAMVIR 1500 mg kerta-annosryhmässä (n = 152) verrattuna 6,2 päivään lumeryhmässä (n = 168). . Keskimääräinen ero paranemisajassa lumelääkettä ja FAMVIR 1500 mg:lla hoidettujen ryhmien välillä oli 1,3 päivää (95 % luottamusväli: 0,6–2,0). Ei havaittu eroja niiden potilaiden osuudessa, joilla oli keskeytynyt vaurio (jotka eivät edenneet papulointivaihetta pidemmälle) FAMVIR 250 mg:n tai lumelääkettä saaneiden potilaiden välillä: 33 % FAMVIR 1500 mg kerta-annoksella ja 34 % lumelääkettä saaneiden potilaiden välillä. Keskimääräinen aika kivun ja arkuuden häviämiseen oli 1,7 päivää FAMVIR 1500 mg:n kerta-annoksella hoidetuilla potilailla ja 2,9 päivää lumelääkettä saaneilla potilailla.
Sukupuoliherpes
Toistuvat jaksot
Satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus suoritettiin 329 immunokompetentilla aikuisella, joilla oli toistuva sukupuolielinten herpes. Potilaat aloittivat hoidon itse 6 tunnin kuluessa toistuvan genitaaliherpesepisodin ensimmäisistä merkeistä tai oireista joko FAMVIR 1000 mg kahdesti vuorokaudessa (n=163) tai lumelääke (n=166) 1 päivän ajan. Keskimääräinen paranemisaika potilailla, joilla oli abortoimattomia vaurioita (etenevät näppylävaiheen jälkeen), oli 4,3 päivää FAMVIR-hoidetuilla potilailla (n = 125) verrattuna 6,1 päivään lumelääkettä saaneilla potilailla (n = 145). Mediaani ero parantumiseen plasebo- ja FAMVIR-hoitoa saaneiden ryhmien välillä oli 1,2 päivää (95 % luottamusväli: 0,5 - 2,0). 23 prosentilla FAMVIR-hoitoa saaneista potilaista oli keskeytettyjä leesioita (ei vaurion kehittymistä eryteeman lisäksi) ja 13 prosentilla lumelääkettä saaneista potilaista. Mediaaniaika kaikkien oireiden (esim. pistely, kutina, polttaminen, kipu tai arkuus) häviämiseen oli 3,3 päivää FAMVIR-hoitoa saaneilla potilailla ja 5,4 päivää lumelääkettä saaneilla potilailla.
Satunnaistettu (2:1), kaksoissokkoutettu, lumekontrolloitu tutkimus suoritettiin 304 immunokompetenttia mustaa ja afroamerikkalaista aikuista, joilla oli toistuva sukupuolielinten herpes. Potilaat aloittivat hoidon itse 6 tunnin kuluessa toistuvan genitaaliherpesepisodin ensimmäisistä merkeistä tai oireista joko FAMVIR 1000 mg kahdesti vuorokaudessa (n=206) tai lumelääke (n=98) 1 päivän ajan. Paranemisajan mediaani potilailla, joilla oli abortoimattomia vaurioita, oli 5,4 päivää FAMVIR-hoidetuilla potilailla (n = 152) verrattuna 4,8 päivään lumelääkettä saaneilla potilailla (n = 78). Mediaani ero parantumiseen plasebo- ja FAMVIR-hoitoa saaneiden ryhmien välillä oli -0,26 päivää (95 % CI: -0,98 - 0,40).
Tukahduttava terapia
Kaksi satunnaistettua, kaksoissokkoutettua, plasebokontrolloitua, 12 kuukauden mittaista tutkimusta suoritettiin 934 immuunikyvyttömällä aikuisella, joilla on ollut vähintään kuusi sukupuolielinten herpesepisodia vuodessa. Vertailut sisälsivät FAMVIR 125 mg kolme kertaa vuorokaudessa, 250 mg kahdesti vuorokaudessa, 250 mg kolme kertaa vuorokaudessa ja lumelääke. 12 kuukauden kohdalla 60–65 % potilaista sai edelleen FAMVIR-hoitoa ja 25 % lumelääkehoitoa. Taulukossa 6 on esitetty uusiutumistiheys 6 ja 12 kuukauden kohdalla potilailla, joita hoidettiin annoksella 250 mg kahdesti vuorokaudessa.
FAMVIR-hoitoa saaneilla potilailla oli noin 1/5 uusiutumisten mediaanimäärästä lumelääkettä saaneisiin potilaisiin verrattuna. Suurempiin FAMVIR 250 mg -annoksiin ei liittynyt tehon lisääntymistä.
Toistuva suun tai sukupuolielinten herpes HIV-tartunnan saaneilla potilailla
Satunnaistetussa kaksoissokkotutkimuksessa verrattiin famsikloviiria 500 mg kahdesti vuorokaudessa 7 päivän ajan (n = 150) oraaliseen asykloviiriin 400 mg 5 kertaa päivässä 7 päivän ajan (n = 143) HIV-tartunnan saaneilla potilailla, joilla oli toistuva suun labiaalinen tai genitaaliherpes ja joita hoidettiin 48 tuntia leesion alkamisesta. Noin 40 %:lla potilaista CD4+-määrä oli alle 200 solua/mm3, 54 %:lla potilaista oli anogenitaalisia vaurioita ja 35 %:lla orabiaalisia leesioita. Famsikloviirihoito oli verrattavissa oraaliseen asykloviiriin uusien leesioiden muodostumisen vähentämisessä ja täydelliseen paranemiseen kuluneessa ajassa.
Herpes zoster (vyöruusu)
Kaksi satunnaistettua kaksoissokkotutkimusta, 1 lumekontrolloitu ja 1 aktiivikontrolloitu, suoritettiin 964 immunokompetentilla aikuisella, joilla oli komplisoitumaton herpes zoster. Hoito aloitettiin 72 tunnin sisällä leesion ensimmäisestä ilmaantumisesta ja sitä jatkettiin 7 päivää.
Lumekontrolloidussa tutkimuksessa 419 potilasta sai joko FAMVIR 500 mg kolmesti päivässä (n = 138), FAMVIR 750 mg kolme kertaa vuorokaudessa (n = 135) tai lumelääke (n = 146). Mediaani aika täyteen kuoriutumiseen oli 5 päivää FAMVIR 500 mg:lla hoidetuilla potilailla verrattuna 7 päivään lumelääkettä saaneilla potilailla. Ajat täyteen kuoriutumiseen, rakkuloiden häviämiseen, haavaumien häviämiseen ja kuorien häviämiseen olivat lyhyempiä FAMVIR 500 mg:lla hoidetuilla potilailla kuin lumelääkettä saaneilla potilailla koko tutkimuspopulaatiossa. FAMVIR 500 mg:n vaikutukset olivat suuremmat, kun hoito aloitettiin 48 tunnin sisällä ihottuman alkamisesta; se oli myös syvällisempää 50-vuotiailla tai sitä vanhemmilla potilailla. Niistä 65,2 %:sta potilaista, joilla oli vähintään yksi positiivinen virusviljelmä, FAMVIR-hoidetuilla potilailla viruksen leviämisen mediaaniaika oli lyhyempi kuin lumelääkettä saaneilla potilailla (1 päivä ja 2 päivää, vastaavasti).
FAMVIR- ja lumelääkettä saaneiden ryhmien välillä ei ollut yleisiä eroja kivun kestossa ennen ihottuman paranemista. Lisäksi hoitoryhmien välillä ei ollut eroa ihottuman paranemisen jälkeisen kivun (postherpeettisen neuralgian) ilmaantuvuudessa. Niillä 186 potilaalla (44,4 % koko tutkimusväestöstä), joille kehittyi postherpeettinen neuralgia, postherpeettisen neuralgian mediaanikesto oli lyhyempi potilailla, joita hoidettiin 500 mg FAMVIR:llä kuin lumelääkettä saaneilla (63 päivää ja 119 päivää). Suuremmalla FAMVIR-annoksella ei osoitettu lisätehoa.
Aktiivikontrolloidussa tutkimuksessa 545 potilasta hoidettiin yhdellä kolmesta FAMVIR-annoksesta kolme kertaa päivässä tai asykloviirilla 800 mg viisi kertaa päivässä. Ajat täyteen leesion kuoriutumiseen ja ajat akuutin kivun häviämiseen olivat vertailukelpoisia kaikissa ryhmissä, eikä postherpeettisen neuralgian häviämiseen kuluvassa ajassa ollut tilastollisesti merkitseviä eroja FAMVIR- ja asykloviirilla hoidettujen ryhmien välillä.
POTILASTIEDOT
FAMVIR® (Fam'-veer) (famsikloviiri) Tabletit
Lue nämä potilastiedot ennen kuin aloitat FAMVIR-hoidon ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on FAMVIR?
Famvir on reseptillä määrätty viruslääke, jota käytetään:
- hoitaa huuliherpesepidemia (kuumerakkuloita) terveillä aikuisilla
- hoitaa sukupuolielinten herpesepidemia terveillä aikuisilla
- vähentää sukupuolielinten herpesepidemiaa terveillä aikuisilla
- hoitaa herpes simplex -leesioiden puhkeamista suussa, sukupuolielimissä ja peräaukon alueella HIV-tartunnan saaneilla ihmisillä
- vyöruusun (herpes zoster) hoitoon aikuisilla, joilla on normaali immuunijärjestelmä
Ei tiedetä, onko FAMVIR 500mg turvallinen ja tehokas alle 18-vuotiaille lapsille.
FAMVIR 250mg ei paranna herpestä. Ei tiedetä, voiko FAMVIR estää herpesin leviämisen muihin. Jos olet seksuaalisesti aktiivinen, voit siirtää herpesin kumppanillesi, vaikka käytät FAMVIRia. Herpes voi tarttua, vaikka sinulla ei olisi aktiivisia oireita. Sinun tulee jatkaa turvallisemman seksin harjoittamista vähentääksesi mahdollisuuksia levittää sukupuolielinten herpestä muille. Älä pidä seksuaalista yhteyttä kumppaniisi sukupuolielinten herpesepidemian aikana tai jos sinulla on sukupuolielinten herpesoireita. Käytä lateksista tai polyuretaanista valmistettua kondomia, kun olet seksuaalisessa kanssakäymisessä. Kysy terveydenhuollon tarjoajalta lisätietoja turvallisemmista seksikäytännöistä.
Kuka ei saa ottaa FAMVIRiä?
Älä ota FAMVIR 250 mg -valmistetta, jos olet allerginen jollekin sen aineosalle tai Denavir®-valmisteelle (pensikloviirivoide). Katso tämän potilastiedotteen lopusta täydellinen luettelo FAMVIRin ainesosista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen FAMVIR 500 mg:n ottamista?
Ennen kuin aloitat FAMVIR 500 mg:n käytön, kerro terveydenhuollon tarjoajallesi, jos:
- sinulla on munuais- tai maksaongelmia
- sinulla on harvinainen geneettinen ongelma, johon liittyy galaktoosi-intoleranssi, vakava laktaasinpuutos tai et imeydy glukoosi-galaktoosiin (imeytymishäiriö)
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako FAMVIR 250 mg sikiötäsi
- Raskausaltistusraportointi: Novartis Pharmaceuticals Corporation kerää raskausraportteja, jotka raportoidaan vapaaehtoisesti. Jos olet raskaana, keskustele terveydenhuollon tarjoajan kanssa raskauden ilmoittamisesta
- imetät tai aiot imettää
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- muut lääkkeet ja tuotteet, joita käytät herpesepidemioiden hoitoon
- probenesidi (probalaani)
Tunne käyttämäsi lääkkeet. Pidä luettelo niistä mukanasi, jotta voit näyttää terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle aina, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa FAMVIR?
- Ota FAMVIR juuri niin kuin on määrätty
- Terveydenhuollon tarjoaja kertoo sinulle, kuinka monta FAMVIR-valmistetta sinun tulee ottaa ja milloin ne tulee ottaa. FAMVIR 250 mg -annoksesi ja sen käyttötiheys voivat vaihdella tilasi mukaan
- FAMVIR voidaan ottaa ruoan kanssa tai ilman
- On tärkeää, että otat kaikki lääkkeet loppuun ohjeiden mukaan, vaikka olosi alkaisikin paremmin
- Oireesi voivat jatkua, vaikka olet lopettanut kaiken FAMVIR-hoidon. Tämä ei tarkoita, että tarvitset lisää lääkettä, koska olet jo suorittanut täyden FAMVIR 500 mg -kuurin ja se jatkaa vaikutusta kehossasi. Keskustele terveydenhuollon tarjoajasi kanssa, jos sinulla on kysyttävää tilastasi ja hoidostasi
Mitkä ovat FAMVIR 250mg:n mahdolliset sivuvaikutukset?
FAMVIR 500mg:n yleisimmät sivuvaikutukset ovat:
- päänsärky
- pahoinvointi
Keskustele terveydenhuollon tarjoajan kanssa, jos sinulla on sivuvaikutuksia, jotka häiritsevät sinua tai jotka eivät katoa.
Nämä eivät ole kaikki FAMVIRin mahdollisia sivuvaikutuksia. Kysy lisätietoja terveydenhuollon tarjoajaltasi tai apteekista.
Soita terveydenhuollon tarjoajallesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA1088.
Kuinka minun pitäisi säilyttää FAMVIR 500mg?
- Säilytä FAMVIR huoneenlämmössä 59 °F - 86 °F (15 °C - 30 °C).
Pidä FAMVIR ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa FAMVIRistä
Lääkkeitä määrätään joskus muihin kuin potilasohjeissa lueteltuihin tarkoituksiin. Älä käytä FAMVIRia sellaiseen sairauteen, johon sitä ei ole määrätty. Älä anna FAMVIR 500 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tässä esitteessä on yhteenveto tärkeimmistä FAMVIR-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Terveydenhuollon tarjoaja tai apteekki voi antaa sinulle tietoa FAMVIR 500mg:stä, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja saat osoitteesta www.FAMVIR.com tai soittamalla numeroon 1-888-669-6682.
Mitä ainesosia FAMVIR sisältää?
Aktiivinen ainesosa: famsikloviiri
Inaktiiviset ainesosat: hydroksipropyyliselluloosa, hydroksipropyylimetyyliselluloosa, laktoosi, magnesiumstearaatti, polyetyleeniglykolit, natriumtärkkelysglykolaatti ja titaanidioksidi
