Symbicort 160/4.5mcg Budesonide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä on Symbicort 4.5mcg ja miten sitä käytetään?
Symbicort 4,5 mcg on reseptilääke, jota käytetään astman ja kroonisen obstruktiivisen keuhkosairauden oireiden hoitoon. Symbicortia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Symbicort kuuluu lääkeryhmään nimeltä Respiratory Inhalant Combos.
Ei tiedetä, onko Symbicort 4,5 mcg turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Symbicort 4.5mcg:n mahdolliset sivuvaikutukset?
Symbicort voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- pahenevat hengitysvaikeudet,
- haavaumia tai valkoisia läiskiä suussa tai kurkussa,
- kipua nieltäessä,
- vapina,
- hermostuneisuus,
- rintakipu,
- nopeat tai jyskyttävät sydämenlyönnit,
- yskä liman kanssa,
- hengenahdistuksen tunne,
- hengityksen vinkuminen,
- tukehtuminen,
- muut hengitysvaikeudet,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai punoitus,
- nähdä haloja valojen ympärillä,
- kuume,
- vilunväristykset,
- kehon kivut,
- epätavallinen väsymys,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- jalkakrampit,
- ummetus,
- epäsäännölliset sydämenlyönnit,
- lepattaa rinnassasi,
- tunnottomuus tai pistely,
- lihas heikkous,
- veltto tunne,
- väsymys,
- heikkous,
- huimaus,
- pahoinvointi ja
- oksentelua
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Symbicortin yleisimmät sivuvaikutukset ovat:
- kurkun kipu tai ärsytys,
- valkoisia läiskiä suussa tai kurkussa,
- vatsakipu,
- oksentelua,
- selkäkipu,
- päänsärky,
- flunssan oireet ja
- vilustumisoireet (tukkoinen tai vuotava nenä, aivastelu, poskiontelokipu tai kurkkukipu)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Symbicortin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
SYMBICORT 80/4.5 ja SYMBICORT 160/4.5 sisältävät kumpikin mikronisoitua budesonidia ja mikronisoitua formoterolifumaraattidihydraattia vain oraaliseen inhalaatioon.
Jokainen SYMBICORT 80/4.5- ja SYMBICORT 160/4.5 -kapseli on formuloitu hydrofluorialkaaniksi (HFA 227; 1,1,1,2,3,3,3-heptafluoripropaani) käytettäväksi paineistetuksi annosinhalaattoriksi, joka sisältää joko 60 tai [120 toimenpidettä Annostusmuodot ja vahvuudet ja MITEN TOIMITETAAN / Varastointi ja käsittely ]. Esikäsittelyn jälkeen jokainen toimilaite mittaa joko 91/5,1 mcg tai 181/5,1 mcg venttiilistä ja toimittaa joko 80/4,5 mcg tai 160/4,5 mcg (mikronisoitu budesonidi/mikronoitu formoterolifumaraattidihydraatti) toimilaitteesta. Todellinen keuhkoihin toimitetun lääkkeen määrä voi riippua potilaan tekijöistä, kuten laitteen käytön ja annostelujärjestelmän kautta tapahtuvan sisäänhengityksen välisestä koordinaatiosta. SYMBICORT 160mg sisältää myös povidonia K25 USP suspendointiaineena ja polyetyleeniglykolia 1000 NF voiteluaineena.
SYMBICORT 160mg tulee pohjustaa ennen ensimmäistä käyttöä päästämällä kaksi testisuihketta ilmaan pois kasvoilta ja ravistamalla hyvin 5 sekuntia ennen jokaista ruiskutusta. Jos inhalaattoria ei ole käytetty yli 7 päivään tai kun se on pudonnut, esittele inhalaattori uudelleen ravistamalla hyvin 5 sekuntia ennen jokaista suihketta ja päästämällä kaksi testisuihketta ilmaan pois kasvoilta.
Yksi SYMBICORT 4,5 mikrogramman aktiivinen komponentti on budesonidi, kortikosteroidi, joka on kemiallisesti nimetty (RS)11β, 16α, 17,21-tetrahydroksipregna-1,4-dieeni-3,20-dioni sykliseksi 16,17-asetaaliksi butyraldehydillä. Budesonidia tarjotaan kahden epimeerin (22R ja 22S) seoksena. Budesonidin empiirinen kaava on C25H34O6 ja sen molekyylipaino on 430,5. Sen rakennekaava on:
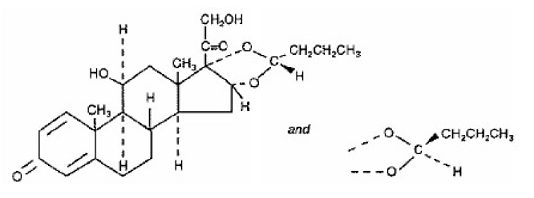
Budesonidi on valkoinen tai luonnonvalkoinen, mauton, hajuton jauhe, joka on käytännössä liukenematon veteen ja heptaaniin, liukenee niukasti etanoliin ja liukenee vapaasti kloroformiin. Sen jakaantumiskerroin oktanolin ja veden välillä pH:ssa 7,4 on 1,6 x 103.
Toinen SYMBICORT 160 mg:n aktiivinen ainesosa on formoterolifumaraattidihydraatti, selektiivinen beeta2-agonisti, joka on kemiallisesti nimetty (R*,R*)-(±)-N-[2-hydroksi-5-[1-hydroksi-2-[[ 2-(4-metoksifenyyli)-1 metyylietyyli]amino]etyyli]fenyyli]formamidi, (E)-2-butendioaatti (2:1), dihydraatti. Formoterolin empiirinen kaava on C42H56N4O14 ja sen molekyylipaino on 840,9. Sen rakennekaava on:
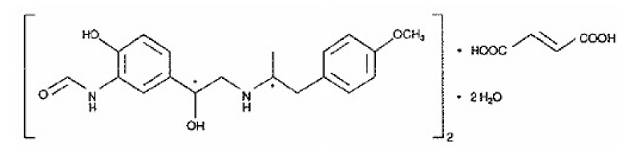
Formoterolifumaraattidihydraatti on jauhe, joka liukenee heikosti veteen. Sen oktanoli-vesi-jakaantumiskerroin pH:ssa 7,4 on 2,6. Formoterolifumaraattidihydraatin pKa 25 °C:ssa on 7,9 fenoliryhmälle ja 9,2 aminoryhmälle.
INDIKAATIOT
Astman hoito
SYMBICORT 4,5 mcg on tarkoitettu astman hoitoon 6-vuotiaille ja sitä vanhemmille potilaille.
SYMBICORTia tulee käyttää potilailla, jotka eivät pysy riittävästi hallinnassa pitkäaikaisella astman hallintalääkkeellä, kuten inhaloitavalla kortikosteroidilla (ICS), tai joiden sairaus edellyttää hoidon aloittamista sekä inhaloitavalla kortikosteroidilla että pitkävaikutteisella beeta2-adrenergisella agonistilla (LABA).
Tärkeitä käytön rajoituksia
- SYMBICORTia EI ole tarkoitettu akuutin bronkospasmin lievitykseen.
Kroonisen obstruktiivisen keuhkosairauden ylläpitohoito
SYMBICORT 160/4.5 on tarkoitettu ilmanvirtaustukoksen ylläpitohoitoon potilailla, joilla on krooninen keuhkoahtaumatauti (COPD), mukaan lukien krooninen keuhkoputkentulehdus ja/tai emfyseema. SYMBICORT 160/4.5 on myös tarkoitettu vähentämään keuhkoahtaumatautien pahenemista. SYMBICORT 160/4.5 on ainoa vahvuus, joka on tarkoitettu COPD:n hoitoon.
Tärkeitä käytön rajoituksia
- SYMBICORT 4,5 mcg EI ole tarkoitettu akuutin bronkospasmin lievitykseen.
ANNOSTELU JA HALLINNOINTI
Hallintotiedot
SYMBICORT 160 mg tulee antaa 2 inhalaationa kahdesti vuorokaudessa (aamulla ja illalla, noin 12 tunnin välein), joka päivä vain suun kautta hengitettynä. Inhalaation jälkeen potilaan tulee huuhdella suu vedellä nielemättä.
Pohjusta SYMBICORT 4,5 mcg ennen ensimmäistä käyttöä suihtamalla kaksi testisuihketta ilmaan pois kasvoilta ja ravistamalla hyvin 5 sekuntia ennen jokaista suihketta. Jos inhalaattoria ei ole käytetty yli 7 päivään tai kun se on pudonnut, esittele inhalaattori uudelleen ravistamalla hyvin ennen jokaista suihketta ja päästämällä kaksi testisuihketta ilmaan pois kasvoilta.
Määrätyn vahvuuden SYMBICORTin useampaa antamista tai useampaa inhalaatiomäärää (yli 2 inhalaatiota kahdesti vuorokaudessa) ei suositella, koska joillakin potilailla on todennäköisemmin haittavaikutuksia suuremmilla formoteroliannoksilla. SYMBICORTia käyttävien potilaiden ei tule käyttää ylimääräistä LABA:ta mistään syystä [katso VAROITUKSET JA VAROTOIMET ].
Astma
Jos astmaoireita ilmaantuu annosten välisenä aikana, inhaloitavaa lyhytvaikutteista beeta2-agonistia tulee ottaa välittömän helpotuksen saamiseksi.
Aikuiset ja 12-vuotiaat ja sitä vanhemmat potilaat
12-vuotiaille ja sitä vanhemmille potilaille annos on 2 inhalaatiota SYMBICORT 80/4,5 tai SYMBICORT 160/4,5 kahdesti päivässä.
SYMBICORTin suositellut aloitusannokset 12-vuotiaille ja sitä vanhemmille potilaille perustuvat potilaan astman vaikeusasteeseen tai astman oireiden hallintaan sekä nykyisten inhaloitavien kortikosteroidien pahenemisriskiin.
Suurin suositeltu annos aikuisille ja 12-vuotiaille ja sitä vanhemmille nuorille on SYMBICORT 160/4,5, kaksi inhalaatiota kahdesti vuorokaudessa.
Astmahallinnan paraneminen SYMBICORT-inhalaation jälkeen voi tapahtua 15 minuutin kuluessa hoidon aloittamisesta, vaikka suurinta hyötyä ei ehkä saavuteta 2 viikon tai pidempään hoidon aloittamisen jälkeen. Yksittäiset potilaat kokevat vaihtelevan ajan ilmaantumiseen ja oireiden lievittymiseen.
Potilaille, jotka eivät reagoi riittävästi aloitusannokseen 1-2 viikon SYMBICORT 80/4.5 -hoidon jälkeen, korvaaminen SYMBICORT 160/4.5 -valmisteella voi parantaa astman hallintaa.
Jos aiempi tehokas SYMBICORT 4,5 mikrog:n annostusohjelma ei pysty varmistamaan astman riittävää hallintaa, hoito-ohjelma tulee arvioida uudelleen ja muita hoitovaihtoehtoja (esim. korvata pienempi vahvuus SYMBICORT 4,5 mikrogrammaa suuremmalla vahvuudella, lisäämällä inhaloitavaa lääkettä). kortikosteroidien tai oraalisten kortikosteroidien käytön aloittamista) tulee harkita.
Pediatriset potilaat, joiden ikä on 6–12 vuotta
6 - alle 12-vuotiaille potilaille annos on 2 inhalaatiota SYMBICORT 80/4,5 kahdesti päivässä.
Krooninen keuhkoahtaumatauti
Keuhkoahtaumatautipotilaille suositeltu annos on SYMBICORT 160/4,5, kaksi inhalaatiota kahdesti vuorokaudessa.
Jos hengenahdistusta ilmenee annosten välillä, tulee ottaa inhaloitava lyhytvaikutteinen beeta2-agonisti välittömän helpotuksen saamiseksi.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
SYMBICORT on saatavana mittariannosinhalaattorina, joka sisältää budesonidin (80 tai 160 mikrog) ja formoterolin (4,5 mikrog) yhdistelmän inhalaatioaerosolina kahdessa vahvuudessa: 80/4,5 ja 160/4,5. Jokainen annosvahvuus sisältää 60 tai 120 painallusta säiliötä kohden. Jokaisen vahvuuden SYMBICORT 160mg mukana toimitetaan punainen muovinen toimilaite, jossa on harmaa pölysuojus.
Varastointi ja käsittely
SYMBICORTia on saatavana kahdessa vahvuudessa ja se toimitetaan seuraavissa pakkauskokoissa:
Annostusmuodot ja vahvuudet
Jokainen vahvuus toimitetaan paineistetussa alumiinikapselissa, johon on kiinnitetty laskentalaite, punainen muovinen toimilaitteen runko, jossa on valkoinen suukappale ja kiinnitetty harmaa pölysuojus. Jokaisen 120 inhalaatiokapselin nettäyttöpaino on 10,2 grammaa ja jokaisen 60 inhalaatiokapselin nettäyttöpaino on 6,9 grammaa (SYMBICORT 80/4,5) tai 6 grammaa (SYMBICORT 160/4,5). Jokainen kanisteri on pakattu kalvopäällyspussiin, jossa on kuivausainepussi ja sijoitettu pahvilaatikkoon. Jokainen laatikko sisältää yhden säiliön ja potilasohjeen.
SYMBICORT 4,5 mcg:n kanisteria tulee käyttää vain SYMBICORT 4,5 mcg:n toimilaitteen kanssa, eikä SYMBICORT-toimilaitetta saa käyttää minkään muun inhaloitavan lääkevalmisteen kanssa.
Oikeaa lääkemäärää jokaisessa inhalaatiossa ei voida varmistaa sen jälkeen, kun merkitty määrä inhalaatioita säiliöstä on käytetty, vaikka inhalaattori ei ehkä tunnu täysin tyhjältä ja saattaa jatkaa toimintaansa. Inhalaattori tulee hävittää, kun merkitty määrä inhalaatioita on käytetty tai 3 kuukauden kuluessa kalvopussista poistamisesta. Älä koskaan upota säiliötä veteen sen jäljellä olevan määrän määrittämiseksi ("kelluvatesti").
Säilytä kontrolloidussa huoneenlämmössä 20 °C - 25 °C (68 °F - 77 °F) [katso USP]. Säilytä inhalaattoria suukappale alaspäin.
Parhaan tuloksen saavuttamiseksi kanisterin tulee olla huoneenlämpöinen ennen käyttöä. Ravista hyvin 5 sekuntia ennen käyttöä.
Pidä poissa lasten ulottuvilta. Vältä roiskumista silmiin.
SISÄLTÖ PAINEEN ALAINEN.
Älä puhkaise tai polta. Älä säilytä lämmön tai avotulen lähellä. Altistuminen yli 120 °F:n lämpötiloille voi aiheuttaa halkeamia. Älä koskaan heitä astiaa tuleen tai polttouuniin.
Valmistettu: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 Tekijä: AstraZeneca Dunkerque Production, Dunkerque, Ranska. Tarkistettu: joulukuuta 2017
SIVUVAIKUTUKSET
LABA:n käyttö voi johtaa seuraaviin:
- Vakavat astmaan liittyvät tapahtumat – sairaalahoidot, intubaatiot, kuolema [ks VAROITUKSET JA VAROTOIMET ].
- Kardiovaskulaariset ja keskushermostovaikutukset [katso VAROITUKSET JA VAROTOIMET ].
Systeeminen ja hengitettyjen kortikosteroidien käyttö voi johtaa seuraaviin:
- Candida albicans -infektio [katso VAROITUKSET JA VAROTOIMET ]
- Keuhkokuume tai alempien hengitysteiden infektiot keuhkoahtaumatautia sairastavilla potilailla [katso VAROITUKSET JA VAROTOIMET ]
- Immunosuppressio [katso VAROITUKSET JA VAROTOIMET ]
- Hyperkortisismi ja lisämunuaisten vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ]
- Kasvuvaikutukset lapsipotilailla [katso VAROITUKSET JA VAROTOIMET ]
- Glaukooma ja kaihi [katso VAROITUKSET JA VAROTOIMET ]
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kokemus astman kliinisistä kokeista
Aikuiset ja 12-vuotiaat ja sitä vanhemmat potilaat
Yleiset turvallisuustiedot aikuisilla ja nuorilla perustuvat 10 aktiivi- ja lumekontrolloituun kliiniseen tutkimukseen, joissa 3393 12-vuotiasta ja sitä vanhempaa potilasta (2052 naista ja 1341 miestä), joilla oli vaikeusasteltaan vaihteleva astma, hoidettiin SYMBICORT 80/4,5 tai 160 -hoidolla. /4,5 otettu 2 inhalaatiota kerran tai kahdesti päivässä 12-52 viikon ajan. Näissä tutkimuksissa SYMBICORT-hoitoa saaneiden potilaiden keski-ikä oli 38 vuotta, ja he olivat pääosin valkoihoisia (82 %).
Yleisten haittatapahtumien ilmaantuvuus alla olevassa taulukossa 2 perustuu yhdistettyihin tietoihin kolmesta 12 viikkoa kestäneestä kaksoissokkoutetusta, lumekontrolloidusta kliinisestä tutkimuksesta, joissa 401 aikuista ja nuorta potilasta (148 miestä ja 253 naista) oli vähintään 12-vuotias. hoidettiin kahdella inhalaatiolla SYMBICORT 80/4,5 tai SYMBICORT 160/4,5 kahdesti päivässä. SYMBICORT-ryhmä koostui enimmäkseen valkoihoisista (84 %) potilaista, joiden keski-ikä oli 38 vuotta, ja ennustetun FEV1:n keskimääräinen prosenttiosuus lähtötilanteessa oli 76 ja 68 hoitoryhmissä 80/4,5 mikrogrammaa ja 160/4,5 mikrogrammaa. Vertailun vertailuhaaroihin sisältyi 2 inhalaatiota budesonidi HFA:n mittariannosinhalaattoria (MDI) 80 tai 160 mikrogrammaa, formoterolikuivajauheinhalaattoria (DPI) 4,5 mcg tai lumelääkettä (MDI ja DPI) kahdesti päivässä. Taulukko 2 sisältää kaikki haittatapahtumat, joiden ilmaantuvuus oli >3 % missä tahansa SYMBICORT-ryhmässä ja yleisemmin kuin lumeryhmässä kahdesti vuorokaudessa annettaessa. Näitä tietoja tarkasteltaessa tulee ottaa huomioon SYMBICORT-potilaiden potilaiden keskimääräinen altistuksen kesto, koska ilmaantuvuutta ei ole mukautettu hoidon keston epätasapainoon.
Pitkäaikainen turvallisuus - Astman kliiniset tutkimukset 12-vuotiailla ja sitä vanhemmilla potilailla
Pitkäaikaiset turvallisuustutkimukset 12-vuotiailla ja sitä vanhemmilla nuorilla ja aikuisilla potilailla, joita hoidettiin enintään 1 vuoden ajan annoksilla 1280/36 mcg/vrk (640/18 mcg kahdesti vuorokaudessa), eivät paljastaneet kliinisesti merkittäviä muutoksia ilmaantuvuuden suhteen. eikä uudentyyppisiä haittatapahtumia ilmaantuu pidemmän hoitojakson jälkeen. Samoin merkittäviä tai odottamattomia poikkeavuuksia ei havaittu 1 vuoteen turvallisuustoimenpiteissä, mukaan lukien kemian, hematologian, EKG:n, Holter-monitorin ja HPA-akselin arvioinnit.
Lapsipotilaat 6 - alle 12 vuoden ikäiset
Turvallisuustiedot 6-vuotiaista alle 12-vuotiaista lapsipotilaista perustuvat yhteen tutkimukseen, joka kesti 12 viikkoa. Potilaat (79 naista ja 105 miestä), jotka saivat inhaloitavaa kortikosteroidia tutkimukseen osallistuessaan, satunnaistettiin saamaan SYMBICORT 80/4,5 (n = 92) tai budesonidi pMDI 80 mikrogrammaa (n = 92), 2 inhalaatiota kahdesti päivässä. Näiden potilaiden yleinen turvallisuusprofiili oli samanlainen kuin 12-vuotiailla ja sitä vanhemmilla potilailla, jotka saivat SYMBICORT 80/4,5 kahdesti päivässä samankaltaisissa tutkimuksissa. Yleisiä haittavaikutuksia, joita esiintyi potilailla, joita hoidettiin SYMBICORT 80/4,5:llä ja joiden esiintymistiheys oli ≥3 % ja useammin kuin potilailla, joita hoidettiin vain budesonidi pMDI 80 mikrogrammalla, olivat ylempien hengitysteiden infektio, nielutulehdus, päänsärky ja nuha.
Kroonisen obstruktiivisen keuhkosairauden kliinisistä kokeista saatu kokemus
Alla kuvatut turvallisuustiedot kuvaavat 1783 potilaan altistumista SYMBICORT 160/4,5 -valmisteelle. SYMBICORT 160/4,5:tä tutkittiin kahdessa lumekontrolloidussa keuhkojen toimintatutkimuksessa (kesto 6 ja 12 kuukautta) ja kahdessa aktiivisella kontrolloidussa pahenemistutkimuksessa (kesto 6 ja 12 kuukautta) keuhkoahtaumatautipotilailla.
Yleisten haittatapahtumien ilmaantuvuus alla olevassa taulukossa 3 perustuu yhdistettyihin tietoihin kahdesta kaksoissokkoutetusta, lumekontrolloidusta keuhkotoimintatutkimuksesta (kesto 6 ja 12 kuukautta), joissa 771 aikuista COPD-potilasta (496 miestä ja 275 naista) 40 vuotiaille ja sitä vanhemmille hoidettiin SYMBICORT 160/4,5, kaksi inhalaatiota kahdesti päivässä. Näistä potilaista 651 sai hoitoa 6 kuukauden ajan ja 366 12 kuukauden ajan. SYMBICORT-ryhmä koostui enimmäkseen valkoihoisista (93 %) potilaista, joiden keski-ikä oli 63 vuotta, ja ennustetun FEV1:n keskimääräinen prosenttiosuus lähtötilanteessa oli 33 %. Vertailuhaaroihin sisältyi kaksi inhalaatiota budesonidi HFA:ta (MDI) 160 mikrogrammaa, formoterolia (DPI) 4,5 mikrogrammaa tai lumelääkettä (MDI ja DPI) kahdesti päivässä. Taulukko 3 sisältää kaikki haittatapahtumat, joiden ilmaantuvuus oli ≥3 % SYMBICORT-ryhmässä ja yleisemmin kuin lumeryhmässä. Näitä tietoja tarkasteltaessa tulee ottaa huomioon potilaan pidempi keskimääräinen altistuminen SYMBICORT 4,5 mikrog:lle, koska ilmaantuvuutta ei ole mukautettu hoidon keston epätasapainoon.
Muita keuhkoinfektioita kuin keuhkokuume (enimmäkseen keuhkoputkentulehdus) esiintyi suuremmalla prosenttiosuudella SYMBICORT 160/4,5 -hoitoa saaneista kuin lumelääkettä saaneista (7,9 % vs. 5,1 %). Kliinisesti merkittäviä tai odottamattomia poikkeavuuksia ei havaittu korkeintaan 1 vuoteen kemian, hematologian, EKG:n, EKG:n (Holter) seurannan, HPA-akselin, luun mineraalitiheyden ja oftalmologian arvioinneissa.
Turvallisuushavainnot kahdesta kaksoissokkoutetusta, aktiivisesti kontrolloidusta pahenemistutkimuksesta (kesto 6 ja 12 kuukautta), joissa 1012 aikuista keuhkoahtaumatautipotilasta (616 miestä ja 396 naista), jotka olivat vähintään 40-vuotiaita, saivat SYMBICORT 160/4,5 -hoitoa, kaksi inhalaatiota kahdesti vuorokaudessa oli yhdenmukainen keuhkojen toimintatutkimusten kanssa.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu SYMBICORTin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Joitakin näistä haittavaikutuksista on voitu havaita myös SYMBICORTin kliinisissä tutkimuksissa.
Sydämen häiriöt: angina pectoris, takykardia, eteis- ja kammiotakyarytmiat, eteisvärinä, ekstrasystolat, sydämentykytys
Endokriiniset häiriöt: hyperkortisismi, kasvunopeuden hidastuminen lapsipotilailla
Silmäsairaudet: kaihi, glaukooma, kohonnut silmänpaine
Ruoansulatuskanavan häiriöt: suun ja nielun kandidiaasi, pahoinvointi
Immuunijärjestelmän häiriöt: välittömät ja viivästyneet yliherkkyysreaktiot, kuten anafylaktinen reaktio, angioödeema, bronkospasmi, nokkosihottuma, eksanteema, ihotulehdus, kutina
Aineenvaihdunta- ja ravitsemushäiriöt: hyperglykemia, hypokalemia
Tuki- ja liikuntaelimistön, sidekudoksen ja luuston häiriöt: lihaskrampit
Hermoston häiriöt: vapina, huimaus
Psyykkiset häiriöt: käyttäytymishäiriöt, unihäiriöt, hermostuneisuus, kiihtyneisyys, masennus, levottomuus
Hengityselimet, rintakehä ja välikarsina: dysfonia, yskä, kurkun ärsytys
Ihon ja ihonalaisen kudoksen häiriöt: ihon mustelmia
Verisuonihäiriöt: hypotensio, verenpainetauti
HUUMEIDEN VUOROVAIKUTUKSET
Kliinisissä tutkimuksissa SYMBICORTin ja muiden lääkkeiden, kuten lyhytvaikutteisten beeta2-agonistien, intranasaalisten kortikosteroidien ja antihistamiinien/dekongestanttien samanaikainen käyttö ei ole lisännyt haittavaikutuksia. SYMBICORTilla ei ole suoritettu virallisia yhteisvaikutustutkimuksia.
Sytokromi P4503A4:n estäjät
Kortikosteroidien, mukaan lukien budesonidin, joka on SYMBICORTin komponentti, pääasiallinen metaboliareitti on sytokromi P450 (CYP) isoentsyymi 3A4 (CYP3A4). Ketokonatsolin, voimakkaan CYP3A4:n estäjän, oraalisen annon jälkeen suun kautta annetun budesonidin keskimääräinen plasmapitoisuus nousi. CYP3A4:n samanaikainen anto voi estää budesonidin metaboliaa ja lisätä systeemistä altistusta budesonidille. Varovaisuutta tulee noudattaa harkittaessa SYMBICORT 4,5 mikrogramman samanaikaista käyttöä pitkäaikaisen ketokonatsolin ja muiden tunnettujen vahvojen CYP3A4-estäjien (esim. ritonaviiri, atatsanaviiri, klaritromysiini, indinaviiri, itrakonatsoli, nefatsodoni, nelfinaviiri, sakinaviiri) kanssa [katso telitromysinviiri VAROITUKSET JA VAROTOIMET ].
Monoamiinioksidaasin estäjät ja trisykliset masennuslääkkeet
SYMBICORTia tulee antaa varoen potilaille, joita hoidetaan monoamiinioksidaasin estäjillä tai trisyklisillä masennuslääkkeillä, tai 2 viikon kuluessa tällaisten lääkkeiden käytön lopettamisesta, koska nämä aineet voivat voimistaa SYMBICORT 160 mg:n komponentin, formoterolin vaikutusta verisuonijärjestelmään. . Kliinisissä SYMBICORT-tutkimuksissa rajoitettu määrä COPD- ja astmapotilaita sai trisyklisiä masennuslääkkeitä, joten kliinisesti merkityksellisiä johtopäätöksiä haittavaikutuksista ei voida tehdä.
Beeta-adrenergisiä reseptoreja salpaavat aineet
Beetasalpaajat (mukaan lukien silmätipat) eivät ainoastaan estä beeta-agonistien, kuten formoterolin, joka on SYMBICORT-valmisteen komponentti, vaikutusta keuhkoihin, vaan ne voivat myös aiheuttaa vaikeaa bronkospasmia astmapotilaille. Siksi astmapotilaita ei normaalisti tule hoitaa beetasalpaajilla. Tietyissä olosuhteissa ei kuitenkaan ehkä ole hyväksyttäviä vaihtoehtoja beetasalpaajien käytölle astmapotilailla. Tässä tilanteessa kardioselektiivisiä beetasalpaajia voidaan harkita, vaikka niitä tuleekin antaa varoen.
Diureetit
Beeta-agonistit voivat pahentaa akuutisti EKG-muutoksia ja/tai hypokalemiaa, jotka voivat johtua kaliumia säästämättömien diureettien (kuten loop- tai tiatsididiureettien) antamisesta, etenkin jos beeta-agonistin suositeltu annos ylittyy. Vaikka näiden vaikutusten kliinistä merkitystä ei tunneta, varovaisuutta tulee noudattaa käytettäessä SYMBICORTia samanaikaisesti ei-kaliumia säästävien diureettien kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Vakavat astmaan liittyvät tapahtumat – sairaalahoidot, intubaatiot ja kuolema
LABA:n käyttö monoterapiana (ilman ICS:ää) astmaan liittyy lisääntyneeseen astmaan liittyvän kuoleman riskiin [katso Salmeterol Multicenter Asthma Research Trial (SMART)]. Saatavilla olevat tiedot kontrolloiduista kliinisistä tutkimuksista viittaavat myös siihen, että LABA:n käyttö monoterapiana lisää astmaan liittyvän sairaalahoidon riskiä lapsi- ja nuorilla potilailla. Näitä löydöksiä pidetään LABA:n luokkavaikutuksena. Kun LABA:ta käytetään kiinteän annoksen yhdistelmänä ICS:n kanssa, suurista kliinisistä tutkimuksista saadut tiedot eivät osoita merkittävää lisäystä vakavien astmaan liittyvien tapahtumien (sairaalahoidot, intubaatiot, kuolema) riskissä verrattuna pelkkään ICS:ään (ks. Vakavat astmaan liittyvät tapahtumat ICS/LABA:n kanssa).
Vakavat astmaan liittyvät tapahtumat ICS/LABA:n kanssa
Neljä suurta, 26 viikkoa kestänyt, satunnaistettua, sokkoutettua, aktiivisesti kontrolloitua kliinistä turvallisuustutkimusta suoritettiin arvioimaan vakavien astmaan liittyvien tapahtumien riskiä, kun LABA:ta käytettiin kiinteän annoksen yhdistelmänä ICS:n kanssa verrattuna pelkkään ICS:ään astmapotilailla. Kolmeen tutkimukseen osallistui aikuisia ja yli 12-vuotiaita nuoria: yhdessä tutkimuksessa budesonidia/formoterolia (SYMBICORT) verrattiin budesonidiin [ks. Kliiniset tutkimukset ]; yhdessä tutkimuksessa verrattiin flutikasonipropionaatti/salmeteroli-inhalaatiojauhetta flutikasonipropionaatti-inhalaatiojauheeseen; ja yhdessä tutkimuksessa verrattiin mometasonifuroaattia/formoterolia mometasonifuroaattiin. Neljänteen tutkimukseen osallistui 4–11-vuotiaita lapsipotilaita, ja flutikasonipropionaatti/salmeteroli-inhalaatiojauhetta verrattiin flutikasonipropionaatti-inhalaatiojauheeseen. Ensisijainen turvallisuuspäätetapahtuma kaikissa neljässä tutkimuksessa oli vakavat astmaan liittyvät tapahtumat (sairaalahoito, intubaatiot ja kuolema). Sokkoutettu tuomiokomitea määritti, liittyivätkö tapahtumat astmaan.
Kolme aikuisten ja nuorten koetta suunniteltiin sulkemaan pois riskimarginaali 2,0 ja lapsitutkimuksen tarkoituksena oli sulkea pois riski 2,7. Jokainen yksittäinen tutkimus saavutti ennalta määritellyn tavoitteensa ja osoitti, että ICS/LABA ei ollut huonompi kuin pelkkä ICS. Kolmen aikuisten ja nuorten kokeen meta-analyysi ei osoittanut vakavan astmaan liittyvän tapahtuman riskin merkittävää lisääntymistä kiinteän ICS/LABA-annosyhdistelmän kanssa verrattuna pelkkään ICS:ään (taulukko 1). Näitä tutkimuksia ei suunniteltu sulkemaan pois vakavien astmaan liittyvien tapahtumien riskiä ICS/LABA:lla verrattuna ICS:ään.
Lasten turvallisuustutkimukseen osallistui 6 208 4–11-vuotiasta lapsipotilasta, jotka saivat ICS/LABA-hoitoa (flutikasonipropionaatti/salmeteroli-inhalaatiojauhe) tai ICS (flutikasonipropionaatti-inhalaatiojauhe). Tässä tutkimuksessa 27/3107 (0,9 %) potilasta, jotka satunnaistettiin ICS/LABA:han ja 21/3101 (0,7 %) potilasta, jotka satunnaistettiin ICS:ään, koki vakavan astmaan liittyvän tapahtuman. Ei ollut astmaan liittyviä kuolemantapauksia tai intubaatioita. ICS/LABA ei osoittanut merkittävästi suurentunutta vakavan astmaan liittyvän tapahtuman riskiä ICS:ään verrattuna ennalta määritettyyn riskimarginaaliin (2,7) perustuen, ja arvioitu riskisuhde aika ensimmäiseen tapahtumaan oli 1,29 (95 % CI: 0,73). , 2,27).
Salmeterol Multicenter Asthma Research Trial (SMART)
28 viikkoa kestänyt, lumekontrolloitu yhdysvaltalainen tutkimus, jossa verrattiin salmeterolin turvallisuutta plaseboon, joista kumpikin lisättiin tavalliseen astmahoitoon, osoitti astmaan liittyvien kuolemien lisääntyneen salmeterolia saaneilla potilailla (13/13 176 salmeterolilla hoidetuilla potilailla vs. 3). /13 179 lumelääkettä saaneilla potilailla; suhteellinen riski: 4,37 [95 % CI 1,25, 15,34]). Tausta-ICS:n käyttöä ei vaadittu SMARTissa. Suurentunutta astmaan liittyvää kuolemanriskiä pidetään LABA-monoterapian luokkavaikutuksena.
Formoterolimonoterapiatutkimukset
Kliiniset tutkimukset, joissa formoterolia käytettiin monoterapiana, viittaavat vakavan astman pahenemisen esiintyvyyden olevan korkeampi formoterolia saaneilla potilailla kuin lumelääkettä saaneilla. Näiden tutkimusten koot eivät riittäneet mittaamaan tarkasti eroa vakavien astman pahenemisvaiheiden välillä hoitoryhmien välillä.
Taudin paheneminen ja akuutit jaksot
SYMBICORT 4,5 mikrog -hoitoa ei pidä aloittaa potilailla, joilla astma tai keuhkoahtaumatauti pahenee nopeasti tai mahdollisesti hengenvaarallisesti. SYMBICORTia ei ole tutkittu potilailla, joilla on akuutisti paheneva astma tai keuhkoahtaumatauti. SYMBICORT 4,5 mcg:n aloittaminen tässä asetuksessa ei ole sopivaa.
Inhaloitavien lyhytvaikutteisten beeta2-agonistien lisääntyvä käyttö on merkki astman pahenemisesta. Tässä tilanteessa potilas vaatii välitöntä uudelleenarviointia ja hoito-ohjelman uudelleenarviointia kiinnittäen erityistä huomiota mahdolliseen tarpeeseen korvata SYMBICORTin nykyinen vahvuus suuremmalla vahvuudella, lisätä inhaloitavaa kortikosteroidia tai aloittaa systeemisten kortikosteroidien käyttö. Potilaat eivät saa käyttää SYMBICORTia enempää kuin 2 inhalaatiota kahdesti päivässä (aamulla ja illalla).
SYMBICORT 160 mg:aa ei tule käyttää akuuttien oireiden lievittämiseen, ts. pelastushoitona akuuttien bronkospasmijaksojen hoitoon. Inhaloitavaa lyhytvaikutteista beeta2-agonistia, ei SYMBICORTia, tulee käyttää akuuttien oireiden, kuten hengenahdistuksen, lievittämiseen.
Kun aloitetaan hoito SYMBICORT 4,5 mikrogrammalla, potilaita, jotka ovat käyttäneet suun kautta tai inhaloitavia lyhytvaikutteisia beeta2-agonisteja säännöllisesti (esim. 4 kertaa päivässä), tulee neuvoa lopettamaan näiden lääkkeiden säännöllinen käyttö.
SYMBICORT 4,5 mcg:n liiallinen käyttö ja käyttö muiden pitkävaikutteisten beeta2-agonistien kanssa
Kuten muitakin beeta2-adrenergisiä aineita sisältäviä inhaloitavia lääkkeitä, SYMBICORT 4,5 mikrogrammaa ei tule käyttää suositeltua useammin, suositeltua suurempina annoksina tai yhdessä muiden LABA:ta sisältävien lääkkeiden kanssa, koska seurauksena voi olla yliannostus. Inhaloitavien sympatomimeettisten lääkkeiden liiallisen käytön yhteydessä on raportoitu kliinisesti merkittäviä kardiovaskulaarisia vaikutuksia ja kuolemantapauksia. SYMBICORTia käyttävät potilaat eivät saa käyttää ylimääräistä LABA:ta (esim. salmeterolia, formoterolifumaraattia, arformoterolitartraattia) mistään syystä, mukaan lukien rasituksen aiheuttaman bronkospasmin (EIB) ehkäisy tai astman tai keuhkoahtaumataudin hoito.
Paikalliset tehosteet
Kliinisissä tutkimuksissa SYMBICORT-hoitoa saaneilla potilailla on esiintynyt Candida albicansin aiheuttamia paikallisia suun ja nielun infektioita. Kun tällainen infektio kehittyy, sitä tulee hoitaa sopivalla paikallisella tai systeemisellä (eli suun kautta otettavalla sienilääkkeellä) hoidolla samalla, kun SYMBICORT 160 mg -hoitoa jatketaan, mutta toisinaan SYMBICORT 4,5 mikrog:n hoito saattaa olla tarpeen keskeyttää. Kehota potilasta huuhtelemaan suunsa vedellä nielemättä hengityksen jälkeen, mikä auttaa vähentämään suunnielun kandidiaasin riskiä.
Keuhkokuume ja muut alempien hengitysteiden infektiot
Lääkäreiden tulee pysyä valppaina keuhkokuumeen mahdollisen kehittymisen varalta keuhkoahtaumatautipotilailla, koska keuhkokuumeen ja pahenemisvaiheiden kliiniset piirteet menevät usein päällekkäin. Alempien hengitysteiden infektioita, mukaan lukien keuhkokuume, on raportoitu inhaloitavien kortikosteroidien antamisen jälkeen.
Kuusi kuukautta kestäneessä keuhkojen toimintatutkimuksessa 1704 keuhkoahtaumatautipotilaalla havaittiin muita keuhkotulehdusten kuin keuhkokuumeen (esim. keuhkoputkentulehdus, virusperäiset alahengitystieinfektiot jne.) suurempi ilmaantuvuus SYMBICORT 160/4,5 (7,6 %) potilailla. kuin niillä, jotka saivat SYMBICORT 80/4,5 (3,2 %), formoterolia 4,5 mikrog (4,6 %) tai lumelääkettä (3,3 %). Keuhkokuumetta ei esiintynyt useammin SYMBICORT 160/4,5 -ryhmässä (1,1 %) verrattuna lumelääkkeeseen (1,3 %). 12 kuukauden keuhkojen toimintatutkimuksessa, johon osallistui 1964 keuhkoahtaumatautia sairastavaa potilasta, myös muiden keuhkoinfektioiden kuin keuhkokuumeen ilmaantuvuus oli suurempi SYMBICORT 160/4,5 (8,1 %) kuin SYMBICORT 80/4,5 (6,9 %) potilailla. formoteroli 4,5 mikrog (7,1 %) tai lumelääke (6,2 %). Kuten 6 kuukautta kestäneessä tutkimuksessa, keuhkokuumetta ei esiintynyt useammin SYMBICORT 160/4,5 -ryhmässä (4,0 %) verrattuna lumelääkkeeseen (5,0 %).
Immunosuppressio
Potilaat, jotka käyttävät immuunijärjestelmää heikentäviä lääkkeitä, ovat alttiimpia infektioille kuin terveet henkilöt. Esimerkiksi vesirokko ja tuhkarokko voivat olla vakavampia tai jopa kuolemaan johtavia kortikosteroideja käyttävillä herkillä lapsilla tai aikuisilla. Tällaisilla lapsilla tai aikuisilla, joilla ei ole ollut näitä sairauksia tai jotka eivät ole asianmukaisesti rokotettuja, tulee olla erityisen varovaisia altistumisen välttämiseksi. Ei tiedetä, miten kortikosteroidien annos, reitti ja kesto vaikuttavat leviävän infektion kehittymisriskiin. Perussairauden ja/tai aiemman kortikosteroidihoidon osuutta riskiin ei myöskään tunneta. Jos altistuminen altistuu, hoito varicella zoster -immunoglobuliinilla (VZIG) tai yhdistetyllä suonensisäisellä immunoglobuliinilla (IVIG) voi olla tarpeen. Jos altistut tuhkarokkolle, profylaksi yhdistetyllä lihaksensisäisellä immunoglobuliinilla (IG) voi olla aiheellista (katso VZIG:n ja IG:n täydelliset reseptitiedot vastaavista pakkausselosteista). Jos vesirokko kehittyy, hoitoa viruslääkkeillä voidaan harkita. Immuunivastetta vesirokkorokotteelle arvioitiin 12 kuukauden–8 vuoden ikäisillä astmaa sairastavilla lapsipotilailla budesonidin inhalaatiosuspensiolla.
Avoimessa, ei-satunnaistetussa kliinisessä tutkimuksessa tarkasteltiin immuunivastetta vesirokkorokotteelle 243 astmapotilaalla, jotka olivat iältään 12 kuukauden ja 8 vuoden ikäisiä ja joita hoidettiin budesonidin inhalaatiosuspensiolla 0,25–1 mg päivässä (n=151) tai ei-kortikosteroidihoidolla (n). =92) (eli beeta2-agonistit, leukotrieenireseptoriantagonistit, kromonit). Niiden potilaiden prosenttiosuus, joille kehittyi seroprotektiivinen vasta-ainetiitteri >5,0 (gpELISA-arvo) vasteena rokotukseen, oli samanlainen potilailla, joita hoidettiin budesonidin inhalaatiosuspensiolla (85 %), verrattuna potilaisiin, joita hoidettiin ei-kortikosteroidisella astmahoidolla (90 %). Yhdellekään budesonidin inhalaatiosuspensiolla hoidetulle potilaalle ei kehittynyt vesirokkoa rokotuksen seurauksena.
Inhaloitavia kortikosteroideja tulee käyttää varoen, jos ollenkaan, potilailla, joilla on aktiivinen tai lepotilassa oleva hengitysteiden tuberkuloosiinfektio. hoitamattomat systeemiset sieni-, bakteeri-, virus- tai loisinfektiot; tai silmän herpes simplex.
Potilaiden siirtäminen systeemisestä kortikosteroidihoidosta
Erityistä varovaisuutta tarvitaan potilailla, jotka on siirretty systeemisesti aktiivisista kortikosteroideista inhaloitaviin kortikosteroideihin, koska lisämunuaisten vajaatoiminnasta johtuvia kuolemantapauksia on esiintynyt astmapotilailla systeemisistä kortikosteroideista vähemmän saatavilla oleviin inhaloitaviin kortikosteroideihin siirtymisen aikana ja sen jälkeen. Systeemisten kortikosteroidien käytön lopettamisen jälkeen tarvitaan useita kuukausia hypotalamus-aivolisäke-lisämunuaisen (HPA) toiminnan palautumiseen.
Potilaat, jotka ovat saaneet aiemmin 20 mg:aa tai enemmän prednisonia (tai vastaavaa) päivässä, voivat olla herkimpiä, etenkin kun heidän systeemiset kortikosteroidinsa on lopetettu lähes kokonaan. Tänä HPA-suppression aikana potilailla saattaa ilmetä lisämunuaisten vajaatoiminnan merkkejä ja oireita, kun he joutuvat alttiiksi traumalle, leikkaukselle tai infektiolle (erityisesti gastroenteriitille) tai muille tiloille, jotka liittyvät vakavaan elektrolyyttihäviöön. Vaikka SYMBICORT voi hallita astman oireita näiden jaksojen aikana, se antaa suositeltuina annoksina normaalia pienempiä fysiologisia määriä systeemisesti glukokortikoidia, eikä se tarjoa mineralokortikoidiaktiivisuutta, joka on välttämätön näiden hätätilanteiden selvittämiseksi.
Stressin, vaikean astmakohtauksen tai vakavan keuhkoahtaumatautien pahenemisen aikana potilaita, joille on lopetettu systeemisten kortikosteroidien käyttö, tulee neuvoa jatkamaan suun kautta otettavia kortikosteroideja (suurina annoksina) välittömästi ja ottamaan yhteyttä lääkäriinsä lisäohjeita varten. Näitä potilaita tulee myös neuvoa kantamaan mukanaan varoituskortti, joka osoittaa, että he saattavat tarvita täydentäviä systeemisiä kortikosteroideja stressijaksojen, vaikean astmakohtauksen tai vakavan keuhkoahtaumatautien pahenemisen aikana.
Potilaat, jotka tarvitsevat suun kautta otettavia kortikosteroideja, tulee vieroittaa hitaasti systeemisten kortikosteroidien käytöstä SYMBICORT-hoitoon siirtymisen jälkeen. Prednisonin vähentäminen voidaan saavuttaa pienentämällä päivittäistä prednisonin annosta 2,5 mg:lla viikoittain SYMBICORT-hoidon aikana. Keuhkojen toimintaa (keskimääräinen pakotettu uloshengitystilavuus 1 sekunnissa [FEV1] tai aamuinen uloshengityksen huippuvirtaus [PEF]), beeta-agonistien käyttöä ja astman tai keuhkoahtaumatautioireita tulee tarkkailla huolellisesti suun kautta otettavien kortikosteroidien käytön lopettamisen aikana. Lisäksi potilaita tulee tarkkailla lisämunuaisten vajaatoiminnan merkkien ja oireiden varalta, kuten väsymys, väsymys, heikkous, pahoinvointi ja oksentelu sekä hypotensio.
Potilaiden siirtyminen systeemisestä kortikosteroidihoidosta inhaloitaviin kortikosteroideihin tai SYMBICORTIIN voi paljastaa sairauksia, jotka systeeminen kortikosteroidihoito on aiemmin tukahduttanut (esim. nuha, sidekalvotulehdus, ekseema, niveltulehdus, eosinofiiliset tilat). Joillakin potilailla saattaa esiintyä systeemisesti aktiivisten kortikosteroidien vieroitusoireita (esim. nivel- ja/tai lihaskipua, väsymystä, masennusta) hengitystoiminnan ylläpitämisestä tai jopa paranemisesta huolimatta.
Hyperkortisismi ja lisämunuaisten vajaatoiminta
Budesonidi, SYMBICORT-valmisteen komponentti, auttaa usein hallitsemaan astman ja keuhkoahtaumataudin oireita vähentämällä HPA:n toimintaa kuin terapeuttisesti vastaavat oraaliset prednisoniaannokset. Koska budesonidi imeytyy verenkiertoon ja voi olla systeemisesti aktiivinen suuremmilla annoksilla, SYMBICORTin suotuisat vaikutukset HPA:n toimintahäiriön minimoimisessa voidaan odottaa vain, jos suositeltuja annoksia ei ylitetä ja yksittäisille potilaille titrataan pienin tehokas annos.
Koska inhaloitavien kortikosteroidien systeeminen imeytyminen on mahdollista, SYMBICORT 160 mg:lla hoidettuja potilaita tulee tarkkailla huolellisesti systeemisten kortikosteroidivaikutusten varalta. Erityistä varovaisuutta tulee noudattaa potilaiden tarkkailussa leikkauksen jälkeen tai stressijaksojen aikana lisämunuaisen riittämättömän vasteen varalta.
On mahdollista, että systeemisiä kortikosteroidivaikutuksia, kuten hyperkortismia ja lisämunuaisten vajaatoimintaa (mukaan lukien lisämunuaisen kriisi), saattaa ilmetä pienellä määrällä potilaita, erityisesti kun budesonidia annetaan suositeltua suurempina annoksina pitkiä aikoja. Jos tällaisia vaikutuksia ilmenee, SYMBICORT-annosta tulee pienentää hitaasti noudattaen hyväksyttyjä menetelmiä systeemisten kortikosteroidien vähentämiseksi ja astman oireiden hoitamiseksi.
Lääkevuorovaikutukset vahvojen sytokromi P450 3A4 -estäjien kanssa
Varovaisuutta on noudatettava harkittaessa SYMBICORT 4,5 mikrog:n samanaikaista käyttöä ketokonatsolin ja muiden tunnettujen vahvojen CYP3A4-estäjien (esim. ritonaviiri, atatsanaviiri, klaritromysiini, indinaviiri, itrakonatsoli, nefatsodoni, nelfinaviiri, sakinaviiri) kanssa, koska systeemiset haitalliset vaikutukset liittyvät lisääntyneeseen telitromiaan. budesonidia saattaa esiintyä [ks HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Paradoksaalinen bronkospasmi ja ylempien hengitysteiden oireet
Kuten muutkin inhaloitavat lääkkeet, SYMBICORT 160 mg voi aiheuttaa paradoksaalisen bronkospasmin, joka voi olla hengenvaarallinen. Jos paradoksaalinen bronkospasmi ilmaantuu SYMBICORT 160 mg:n annostelun jälkeen, se tulee hoitaa välittömästi inhaloitavalla lyhytvaikutteisella bronkodilataattorilla, SYMBICORT-hoito on lopetettava välittömästi ja aloitettava vaihtoehtoinen hoito.
Välittömät yliherkkyysreaktiot
Välittömiä yliherkkyysreaktioita saattaa ilmetä SYMBICORT 160 mg:n annon jälkeen, mikä on osoituksena urtikariasta, angioedeemasta, ihottumasta ja bronkospasmista.
Sydän- ja keskushermoston vaikutukset
Liialliseen beeta-adrenergiseen stimulaatioon on liittynyt kohtauksia, angina pectoris-kipua, kohonnutta verenpainetta tai hypotensiota, takykardiaa jopa 200 lyöntiä minuutissa, rytmihäiriöitä, hermostuneisuutta, päänsärkyä, vapinaa, sydämentykytys, pahoinvointia, huimausta, väsymystä, huonovointisuutta ja unettomuutta [ks. YLIANNOSTUS ]. Siksi SYMBICORT 160 mg:aa, kuten kaikkia sympatomimeettisiä amiineja sisältäviä tuotteita, tulee käyttää varoen potilailla, joilla on sydän- ja verisuonisairauksia, erityisesti sepelvaltimon vajaatoimintaa, sydämen rytmihäiriöitä ja verenpainetautia.
Formoteroli, SYMBICORTin komponentti, voi aiheuttaa kliinisesti merkittävän kardiovaskulaarisen vaikutuksen joillakin potilailla pulssin, verenpaineen ja/tai oireiden perusteella mitattuna. Vaikka tällaiset vaikutukset ovat harvinaisia, jos formoterolia on annettu suositelluilla annoksilla, lääkkeen käyttö saattaa olla tarpeen lopettaa, jos niitä ilmenee. Lisäksi beeta-agonistien on raportoitu aiheuttavan EKG-muutoksia, kuten T-aallon tasoittumista, QTc-ajan pidentymistä ja ST-segmentin laskua. Näiden löydösten kliinistä merkitystä ei tunneta. Inhaloitavien sympatomimeettisten lääkkeiden liiallisen käytön yhteydessä on raportoitu kuolemantapauksia.
Luun mineraalitiheyden vähentäminen
Luun mineraalitiheyden (BMD) laskua on havaittu käytettäessä inhaloitavia kortikosteroideja sisältäviä valmisteita pitkään. BMD:n pienten muutosten kliinistä merkitystä pitkäaikaisten seurausten, kuten murtumien, kannalta ei tunneta. Potilaat, joilla on merkittäviä riskitekijöitä luun mineraalipitoisuuden laskulle, kuten pitkittynyt immobilisaatio, suvussa esiintynyt osteoporoosi, postmenopausaalinen tila, tupakan käyttö, korkea ikä, huono ravitsemus tai krooninen luumassaa vähentävien lääkkeiden (esim. epilepsialääkkeet, suun kautta otettavat kortikosteroidit) käyttö ) tulee seurata ja hoitaa vakiintuneiden hoitostandardien mukaisesti. Koska keuhkoahtaumatautipotilailla on usein useita riskitekijöitä alentuneelle luun mineraalitiheydelle, luun mineraalitiheyden arviointia suositellaan ennen SYMBICORT 160 mg -hoidon aloittamista ja ajoittain sen jälkeen. Jos luun mineraalitiheys vähenee merkittävästi ja SYMBICORTia pidetään edelleen lääketieteellisesti tärkeänä potilaan keuhkoahtaumatautihoidossa, lääkkeiden käyttöä osteoporoosin hoitoon tai ehkäisyyn tulee harkita voimakkaasti.
SYMBICORT 160/4,5-, SYMBICORT 80/4,5-, formoteroli 4,5 mikrogrammaa tai lumelääkehoidon vaikutuksia luun mineraalitiheyteen arvioitiin 326 potilaan alaryhmässä (naiset ja miehet 41-88-vuotiaat), joilla oli keuhkoahtaumatauti 12 kuukauden keuhkotoiminnassa. opiskella. Lonkka- ja lannerangan alueiden BMD-arvioinnit suoritettiin lähtötilanteessa ja 52 viikon kuluttua käyttämällä kaksoisenergiaröntgenabsorptiometria (DEXA) -skannauksia. BMD:n keskimääräiset muutokset lähtötilanteesta hoidon loppuun olivat pieniä (keskimääräiset muutokset vaihtelivat välillä -0,01 -0,01 g/cm²). ANCOVA-tulokset koko selkärangan ja lonkan kokonaisluun BMD:stä, jotka perustuvat hoidon päättymisajankohtaan, osoittivat, että kaikki geometriset LS-keskiarvot parittaisten hoitoryhmien vertailuissa olivat lähellä 1:tä, mikä osoittaa, että lonkan kokonais- ja selkärangan kokonaisalueen BMD-arvot yhteensä 12:lla. -kuukauden aikapisteet olivat vakaat koko hoitojakson ajan.
Vaikutus kasvuun
Oraalisesti inhaloitavat kortikosteroidit voivat hidastaa kasvunopeutta, kun niitä annetaan lapsipotilaille. Seuraa SYMBICORTia saavien lapsipotilaiden kasvua rutiininomaisesti (esim. stadiometrisesti). Suun kautta hengitettävien kortikosteroidien, mukaan lukien SYMBICORTin, systeemisten vaikutusten minimoimiseksi kunkin potilaan annos titrataan pienimpään annokseen, joka hallitsee hänen oireitaan tehokkaasti [ks. ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Glaukooma ja kaihi
Glaukoomaa, kohonnutta silmänpainetta ja kaihia on raportoitu astmaa ja keuhkoahtaumatautia sairastavilla potilailla pitkäaikaisen inhaloitavien kortikosteroidien, mukaan lukien budesonidin, SYMBICORT-valmisteen komponentin, käytön jälkeen. Siksi tarkka seuranta on aiheellista potilailla, joiden näkö on muuttunut tai joilla on aiemmin ollut kohonnut silmänpaine, glaukooma ja/tai kaihi.
SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoteroli 4,5 mikrog tai lumelääke hoidon vaikutuksia kaihien tai glaukooman kehittymiseen arvioitiin 461 keuhkoahtaumatautipotilaan alaryhmässä 12 kuukauden keuhkojen toimintatutkimuksessa. Oftalmiset tutkimukset suoritettiin lähtötilanteessa, 24 viikon ja 52 viikon kuluttua. Satunnaistetun hoitojakson aikana 26 koehenkilöllä (6 %) posteriorinen subkapsulaarinen pistemäärä nousi lähtötasosta maksimiarvoon (> 0,7). Muutoksia posteriorisissa subkapsulaarisissa arvoissa >0,7 lähtötasosta hoidon maksimiarvoon esiintyi 11 potilaalla (9,0 %) SYMBICORT 160/4,5 -ryhmässä, 4 potilaalla (3,8 %) SYMBICORT 80/4,5 -ryhmässä ja 5 potilaalla (4,2 %) formoteroliryhmässä ja 6 potilasta (5,2 %) lumeryhmässä.
Eosinofiiliset sairaudet ja Churg-Straussin oireyhtymä
Harvinaisissa tapauksissa inhaloitavia kortikosteroideja käyttävillä potilailla voi esiintyä systeemisiä eosinofiilisiä tiloja. Joillakin näistä potilaista on vaskuliitin kliinisiä piirteitä, jotka vastaavat Churg-Straussin oireyhtymää, sairautta, jota usein hoidetaan systeemisellä kortikosteroidihoidolla. Nämä tapahtumat ovat yleensä, mutta eivät aina, liittyneet oraalisen kortikosteroidihoidon vähentämiseen ja/tai lopettamiseen inhaloitavien kortikosteroidien käyttöönoton jälkeen. Lääkäreiden tulee olla varuillaan potilailla esiintyvien eosinofilian, vaskuliittisten ihottumien, pahenevien keuhkooireiden, sydänkomplikaatioiden ja/tai neuropatian suhteen. Budesonidin ja näiden taustalla olevien sairauksien välillä ei ole osoitettu syy-yhteyttä.
Rinnakkaiset olosuhteet
SYMBICORT 4,5 mikrogrammaa, kuten kaikkia sympatomimeettisiä amiineja sisältäviä lääkkeitä, tulee käyttää varoen potilailla, joilla on kouristuksia tai tyreotoksikoosia sekä potilaille, jotka reagoivat epätavallisen sympatomimeettisille amiineille. Suonensisäisen beeta2-adrenoseptoriagonistin albuterolin annosten on raportoitu pahentavan jo olemassa olevaa diabetes mellitusta ja ketoasidoosia, kun ne annetaan suonensisäisesti.
Hypokalemia ja hyperglykemia
Beeta-adrenergiset agonistilääkkeet voivat aiheuttaa joillakin potilailla merkittävää hypokalemiaa, mahdollisesti solunsisäisen shuntingin kautta, mikä voi aiheuttaa haitallisia kardiovaskulaarisia vaikutuksia [ks. KLIININEN FARMAKOLOGIA ]. Seerumin kaliumpitoisuuden lasku on yleensä ohimenevää, eikä se vaadi lisäravinteita. Kliinisesti merkittäviä muutoksia veren glukoosissa ja/tai seerumin kaliumissa havaittiin harvoin kliinisissä tutkimuksissa, joissa SYMBICORTia käytettiin suositelluilla annoksilla.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ja käyttöohjeet ).
Vakavat astmaan liittyvät tapahtumat
Kerro astmapotilaille, että LABA yksinään käytettynä lisää astmaan liittyvän sairaalahoidon tai astmaan liittyvän kuoleman riskiä. Saatavilla olevat tiedot osoittavat, että käytettäessä ICS:ää ja LABA:ta yhdessä, kuten SYMBICORTin kanssa, näiden tapahtumien riski ei kasva merkittävästi.
Ei akuutteihin oireisiin
Kerro potilaille, että SYMBICORT 160 mg ei ole tarkoitettu astman tai keuhkoahtaumataudin akuuttien oireiden lievittämiseen, eikä ylimääräisiä annoksia saa käyttää tähän tarkoitukseen. Neuvo potilaita hoitamaan akuutteja oireita inhaloitavalla, lyhytvaikutteisella beeta2-agonistilla, kuten albuterolilla. Tarjoa potilaille tällaista lääkitystä ja opasta potilasta, kuinka sitä tulee käyttää.
Neuvo potilaita hakeutumaan välittömästi lääkärin hoitoon, jos heillä on jokin seuraavista:
- Inhaloitavien lyhytvaikutteisten beeta2-agonistien tehon heikkeneminen
- Inhaloitavien lyhytvaikutteisten beeta2-agonistien inhalaatioiden tarve tavallista enemmän
- Lääkärin ohjeiden mukaan merkittävä keuhkojen toiminnan heikkeneminen
Kerro potilaille, etteivät he saa lopettaa SYMBICORT-hoitoa ilman lääkärin/hoitajan ohjeita, koska oireet voivat uusiutua hoidon lopettamisen jälkeen.
Älä käytä muita pitkävaikutteisia beeta2-agonisteja
Neuvo potilaita olemaan käyttämättä muita LABA:ta astmaan ja keuhkoahtaumatautiin.
Paikalliset tehosteet
Kerro potilaille, että joillakin potilailla on esiintynyt paikallisia Candida albicans -infektioita suussa ja nielussa. Jos suun ja nielun kandidiaasi kehittyy, sitä tulee hoitaa asianmukaisella paikallisella tai systeemisellä (eli suun kautta otettavalla) sienilääkityksellä samalla, kun SYMBICORT 4,5 mikrog -hoitoa jatketaan, mutta toisinaan SYMBICORT-hoito saattaa olla tarpeen väliaikaisesti keskeyttää tarkassa lääkärin valvonnassa. Suun huuhtelua vedellä nielemättä hengityksen jälkeen suositellaan sammasriskin vähentämiseksi.
Keuhkokuume
Keuhkoahtaumatautipotilailla on suurempi riski saada keuhkokuume; neuvoa heitä ottamaan yhteyttä terveydenhuollon tarjoajaan, jos he saavat keuhkokuumeen oireita.
Immunosuppressio
Varoita potilaita, jotka saavat immuunivastetta heikentäviä kortikosteroidiannoksia, välttämään altistumista vesirokolle tai tuhkarokkolle, ja jos he altistuvat, ottamaan yhteyttä lääkäriin viipymättä. Kerro potilaille olemassa olevan tuberkuloosin, sieni-, bakteeri-, virus- tai loisinfektion tai silmän herpes simplexin mahdollisesta pahenemisesta.
Hyperkortisismi ja lisämunuaisten vajaatoiminta
Kerro potilaille, että SYMBICORT voi aiheuttaa systeemisiä kortikosteroidivaikutuksia, kuten hyperkortismia ja lisämunuaisten vajaatoimintaa. Kerro myös potilaille, että lisämunuaisten vajaatoiminnasta johtuvia kuolemia on esiintynyt systeemisistä kortikosteroideista siirron aikana ja sen jälkeen. Potilaiden tulee vähentää hitaasti systeemisten kortikosteroidien käyttöä siirtyessään SYMBICORTIIN.
Luun mineraalitiheyden vähentäminen
Kerro potilaille, joilla on suurentunut riski alentua luun mineraalitiheydestä, että kortikosteroidien käyttö voi aiheuttaa lisäriskin.
Alennettu kasvunopeus
Kerro potilaille, että suun kautta hengitetyt kortikosteroidit, jotka ovat SYMBICORTin komponentti, voivat hidastaa kasvunopeutta, kun niitä annetaan lapsipotilaille. Lääkäreiden tulee seurata tarkasti lasten ja nuorten kasvua, jotka käyttävät kortikosteroideja millä tahansa reitillä.
Silmävaikutukset
Inhaloitavien kortikosteroidien pitkäaikainen käyttö voi lisätä joidenkin silmäongelmien (kaihi tai glaukooma) riskiä; harkitse säännöllisiä näöntarkastuksia.
Beta-agonistihoitoon liittyvät riskit
Kerro potilaille beeta2-agonistien haittavaikutuksista, kuten sydämentykytys, rintakipu, nopea syke, vapina tai hermostuneisuus.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Budesonidi
Budesonidin karsinogeenisuuden arvioimiseksi tehtiin pitkäaikaisia tutkimuksia rotilla ja hiirillä suun kautta.
Sprague-Dawley-rotilla tehdyssä kaksivuotisessa tutkimuksessa budesonidi lisäsi tilastollisesti merkitsevää glioomien ilmaantuvuutta urosrotilla oraalisella annoksella 50 mcg/kg (vastaa suunnilleen MRHDID:tä aikuisilla ja lapsilla mcg/m²). perusta). Tuumorigeenisyyttä ei havaittu uros- ja naarasrotilla vastaavilla suun kautta annetuilla annoksilla 25 ja 50 mcg/kg asti (vastaa suunnilleen MRHDID:tä aikuisilla ja lapsilla mikrog/m²:n perusteella). Kahdessa 2-vuotisessa lisätutkimuksessa Fischer- ja Sprague-Dawley-urosrotilla budesonidi ei aiheuttanut glioomia suun kautta annetulla annoksella 50 mikrogrammaa/kg (suunnilleen sama kuin MRHDID aikuisilla ja lapsilla mikrog/m²:n perusteella). Urospuolisilla Sprague-Dawley-rotilla budesonidi kuitenkin lisäsi tilastollisesti merkitsevää maksasolukasvainten ilmaantuvuutta oraalisella annoksella 50 mcg/kg (vastaa suunnilleen MRHDID:tä aikuisilla ja lapsilla mcg/m²:n perusteella). Samanaikaiset vertailukortikosteroidit (prednisoloni ja triamsinoloniasetonidi) näissä kahdessa tutkimuksessa osoittivat samanlaisia tuloksia.
91 viikkoa kestäneessä hiirillä tehdyssä tutkimuksessa budesonidi ei aiheuttanut hoitoon liittyvää karsinogeenisuutta suun kautta otetuilla annoksilla aina 200 mikrog/kg asti (noin 2 kertaa suurempi kuin MRHDID aikuisilla ja lapsilla mikrog/m²:n perusteella).
Budesonidi ei ollut mutageeninen tai klastogeeninen kuudessa eri testijärjestelmässä: Amesin salmonella/mikrosomilevytesti, hiiren mikrotumatesti, hiiren lymfoomatesti, kromosomipoikkeamatesti ihmisen lymfosyyteillä, sukupuoleen liittyvä resessiivinen letaalitesti Drosophila melanogasterissa ja DNA-korjausanalyysi rotalla. hepatosyyttiviljelmä.
Rotilla ei ollut vaikutusta hedelmällisyyteen ja lisääntymiskykyyn ihonalaisilla annoksilla 80 mcg/kg asti (suunnilleen yhtä suuri kuin MRHDID mikrogrammaa/m²:n perusteella). Se kuitenkin heikensi pentujen syntymää edeltävää elinkelpoisuutta ja elinkelpoisuutta syntyessään ja imetyksen aikana sekä vähensi äidin painonnousua ihonalaisilla annoksilla 20 mcg/kg tai enemmän (vähemmän kuin MRHDID mikrogrammaa/m² perusteella). ). Tällaisia vaikutuksia ei havaittu annoksella 5 mikrog/kg (vähemmän kuin MRHDID mikrogrammaa/m²).
Formoteroli
Formoterolifumaraatin karsinogeenisuuden arvioimiseksi tehtiin pitkäaikaisia tutkimuksia hiirillä, joissa annettiin suun kautta, ja rotilla inhalaatiolla.
24 kuukautta kestäneessä CD-1-hiirillä tehdyssä karsinogeenisuustutkimuksessa formoteroli oraalisilla annoksilla 100 mcg/kg tai enemmän (noin 30 ja 15 kertaa MRHDID aikuisilla ja lapsilla, mikrog/m² perusteella) aiheutti annoksen kohdun leiomyoomien ilmaantuvuuden lisääntyminen.
Sprague-Dawley-rotilla tehdyssä 24 kuukautta kestäneessä karsinogeenisuustutkimuksessa havaittiin mesovariaalisen leiomyooman ja kohdun leiomyosarkooman lisääntynyt esiintyvyys inhaloitavalla annoksella 130 mikrogrammaa/kg (noin 70 ja 35 kertaa MRHDID aikuisilla ja lapsilla, vastaavasti). mcg/m² perusteella). Kasvaimia ei havaittu annoksella 22 mcg/kg (noin 12 ja 6 kertaa MRHDID aikuisilla ja lapsilla, mikrog/m² perusteella).
Muut beeta-agonistilääkkeet ovat samalla tavoin osoittaneet lisääntynyttä sukupuolielinten leiomyoomia naarasjyrsijöillä. Näiden löydösten merkitystä ihmisten käyttöön ei tunneta.
Formoteroli ei ollut mutageeninen tai klastogeeninen Amesin salmonella/mikrosomilevytestissä, hiiren lymfoomatestissä, kromosomipoikkeavuustestissä ihmisen lymfosyyteillä ja rotan mikrotumatestissä.
Hedelmällisyyden ja/tai lisääntymiskyvyn heikkeneminen havaittiin urosrotilla, joita hoidettiin formoterolin oraalisella annoksella 15 000 mcg/kg (noin 2200 kertaa MRHDID AUC:n perusteella). Tällaista vaikutusta ei havaittu annoksella 3 000 mikrogrammaa/kg (noin 1 600 kertaa MRHDID mikrogrammaa/m²). Erillisessä tutkimuksessa urosrotilla, joita hoidettiin suun kautta annoksella 15 000 mcg/kg (noin 8000 kertaa MRHDID mikrogrammaa/m²:n perusteella), havaittiin kivesten tubulusatrofiaa ja siittiöjäämiä kiveksissä ja oligospermiaa lisäkiveksissä. Naarasrotilla ei havaittu vaikutusta hedelmällisyyteen annoksilla 15 000 mikrog/kg asti (noin 1100 kertaa MRHDID AUC:n perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia SYMBICORT 160 mg:sta tai yhdestä sen yksittäisestä ainesosasta, formoterolifumaraatista, raskaana olevilla naisilla. toisesta komponentista budesonidia on kuitenkin saatavilla tutkimuksia. Eläinten lisääntymistutkimuksissa SYMBICORT 4,5 mikrogrammaa inhalaatioreittinä annettuna oli teratogeeninen, alkioita tappava ja alensi sikiön painoa rotilla pienemmällä suositellulla ihmisen päivittäisellä inhalaatioannoksella (MRHDID) mcg/m²:n perusteella. Budesonidi yksinään ihonalaisesti annettuna oli teratogeenistä, alkioita tappavaa ja alensi sikiön painoa rotilla ja kaniineilla alle MRHDID:n, mutta näitä vaikutuksia ei havaittu rotilla, jotka saivat inhaloitavia annoksia, jotka olivat jopa 4 kertaa MRHDID:tä suuremmat. Raskaana olevilla naisilla tehdyt tutkimukset eivät ole osoittaneet, että inhaloitava budesonidi yksinään lisää poikkeavuuksien riskiä, kun sitä annetaan raskauden aikana. Oraalisista kortikosteroideista saadut kokemukset viittaavat siihen, että jyrsijät ovat alttiimpia kortikosteroidialtistuksen teratogeenisille vaikutuksille kuin ihmiset. Pelkästään suun kautta annettuna formoterolifumaraatti oli teratogeeninen rotilla ja kaneissa 1600 ja 65 000 kertaa MRHDID. Formoterolifumaraatti oli myös alkioita tappava, lisäsi pentujen menetystä syntymän ja imetyksen aikana ja pienensi rottien pentujen painoa 110-kertaisella MRHDID:llä. Nämä haittavaikutukset ilmenivät yleensä MRHDID:n suurilla kerrannaisilla, kun formoterolifumaraattia annettiin suun kautta korkean systeemisen altistuksen saavuttamiseksi. Rotilla, jotka saivat inhalaatioannoksia, jotka olivat jopa 375-kertaisia MRHDID:iin verrattuna, ei havaittu teratogeenisia, alkioita tappavia tai kehitysvaikutuksia.
Ilmoitettujen populaatioiden vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Naisilla, joilla on huonosti tai kohtalaisesti hallinnassa oleva astma, on lisääntynyt riski saada useita perinataalisia haittavaikutuksia, kuten preeklampsia äidillä ja ennenaikaisuus, alhainen syntymäpaino ja pieni raskausikään nähden vastasyntyneellä. Raskaana olevia naisia, joilla on astma, tulee seurata tarkasti ja lääkitystä säädettävä tarpeen mukaan optimaalisen astman hallinnan ylläpitämiseksi.
Työ tai toimitus
Ei ole olemassa hyvin kontrolloituja ihmistutkimuksia, jotka olisivat tutkineet SYMBICORT 4,5 mikrogramman vaikutuksia synnytyksen ja synnytyksen aikana. Koska beeta-agonisti saattaa vaikuttaa kohdun supistumiskykyyn, SYMBICORT 4,5 mikrogramman käyttö synnytyksen aikana tulee rajoittaa potilaisiin, joilla hyödyt ovat selvästi suuremmat kuin riskit.
Data
Ihmistiedot
Raskaana olevilla naisilla tehdyt tutkimukset eivät ole osoittaneet, että inhaloitava budesonidi lisää poikkeavuuksien riskiä, kun sitä annetaan raskauden aikana. Tulokset laajasta väestöpohjaisesta prospektiivisestä kohorttiepidemiologisesta tutkimuksesta, jossa tarkasteltiin tietoja kolmesta ruotsalaisesta rekisteristä, jotka kattavat noin 99 % raskauksista vuosina 1995-1997 (eli Ruotsin lääketieteellinen syntymärekisteri; synnynnäisten epämuodostumien rekisteri; lasten kardiologian rekisteri), eivät osoita lisääntynyttä riskiä inhaloitavan budesonidin käytöstä raskauden alkuvaiheessa aiheutuneiden synnynnäisten epämuodostumien hoitoon. Synnynnäisiä epämuodostumia tutkittiin vuonna 2014 syntyneillä vauvoilla, joiden äidit ilmoittivat käyttäneensä inhaloitavaa budesonidia astman hoitoon raskauden alkuvaiheessa (yleensä 10-12 viikkoa viimeisten kuukautisten jälkeen), jolloin esiintyy useimmat merkittävät elinten epämuodostumat. Rekisteröityjen synnynnäisten epämuodostumien määrä oli samanlainen verrattuna väestön yleiseen määrään (3,8 % vs. 3,5 %). Lisäksi inhaloitavalle budesonidille altistumisen jälkeen suu- ja kasvohalkeamilla syntyneiden imeväisten määrä oli sama kuin normaalissa populaatiossa (4 lasta vs. 3,3).
Näitä samoja tietoja käytettiin toisessa tutkimuksessa, jossa oli yhteensä 2534 vauvaa, joiden äidit altistuivat inhaloitavalle budesonidille. Tässä tutkimuksessa synnynnäisten epämuodostumien määrä pikkulapsilla, joiden äidit olivat altistuneet inhaloitavalle budesonidille raskauden alkuvaiheessa, ei eronnut kaikkien vastasyntyneiden määrästä samana ajanjaksona (3,6 %).
Eläinten tiedot
SYMBICORT
Alkion ja sikiön kehitystutkimuksessa tiineillä rotilla, joille annosteltiin organogeneesin aikana tiineyspäivistä 6-16, SYMBICORT 160 mg aiheutti napatyrä sikiöille annoksilla, jotka olivat pienempiä kuin MRHDID (mcg/m², kun emon inhaloitavat annokset olivat 12/ 0,66 mcg/kg/vrk ja enemmän). Sikiön paino laski noin 5-kertaisella ja 3-kertaisella MRHDID:llä (AUC:n perusteella äidin inhaloidulla annoksella 80/4,4 mcg/kg (budesonidi/formoteroli)). Teratogeenisia tai alkioita tappavia vaikutuksia ei havaittu annoksilla, jotka olivat pienempiä kuin MRHDID (mcg/m², kun äidin inhaloitava annos oli 2,5/0,14 mcg/kg/vrk).
Budesonidi
Hedelmällisyys- ja lisääntymistutkimuksessa urosrotille annosteltiin ihon alle 9 viikon ajan ja naaraille 2 viikon ajan ennen pariutumista ja koko parittelujakson ajan. Naaraille annosteltiin jälkeläisten vieroitukseen asti. Budesonidi heikensi pentujen syntymää edeltävää elinkykyä ja elinkykyä syntyessään ja laktaation aikana sekä vähensi äidin painonnousua annoksilla, jotka olivat pienempiä kuin MRHDID (mcg/m², kun emon ihonalainen annos oli 20 mcg/ kg/päivä ja enemmän). Tällaisia vaikutuksia ei havaittu MRHDID:tä pienemmällä annoksella (mcg/m² äidin ihonalaisella annoksella 5 mcg/kg/vrk).
Alkion ja sikiön kehitystutkimuksessa tiineillä kaniineilla, joita annosteltiin organogeneesin aikana tiineyspäivistä 6–18, budesonidi aiheutti sikiön menetystä, sikiön painon laskua ja luuston poikkeavuuksia annoksilla, jotka olivat pienempiä kuin MRHDID (mcg/m²:n perusteella). äidin ihonalainen annos 25 mikrog/kg/vrk). Alkion ja sikiön kehitystutkimuksessa tiineillä rotilla, joille annosteltiin organogeneesin aikana tiineyspäivistä 6–15, budesonidi aiheutti samanlaisia haitallisia sikiövaikutuksia annoksilla, jotka olivat noin 8-kertaisia MRHDID:iin verrattuna (mcg/m², kun emon ihonalainen annos oli 500 mcg/kg/päivä). Toisessa tiineillä rotilla tehdyssä alkion ja sikiön kehitystutkimuksessa ei havaittu teratogeenisia tai alkioita tappavia vaikutuksia annoksilla, jotka olivat enintään 4 kertaa MRHDID:tä suuremmilla annoksilla (mcg/m²:n perusteella emon inhalaatioannoksilla 250 mikrog/kg/vrk asti).
Peri- ja postnataalisessa kehitystutkimuksessa rotille, joille annosteltiin tiineyspäivästä 15. synnytyksen jälkeiseen päivään 21, budesonidilla ei ollut vaikutusta synnytykseen, mutta sillä oli vaikutusta jälkeläisten kasvuun ja kehitykseen. Jälkeläisten eloonjäämisaika väheni, ja eloonjääneiden jälkeläisten keskimääräinen ruumiinpaino pieneni syntyessään ja imetyksen aikana annoksilla, jotka olivat pienempiä kuin MRHDID tai suurempia (mcg/m²:n perusteella emon ihonalaisilla annoksilla 20 mcg/kg/vrk tai enemmän). Nämä löydökset tapahtuivat emolle toksisuuden ollessa läsnä.
Formoteroli
Hedelmällisyys- ja lisääntymistutkimuksessa urosrotille annettiin annos suun kautta 9 viikon ajan ja naaraille 2 viikon ajan ennen pariutumista ja koko parittelujakson ajan. Naaraille annosteltiin joko tiineyspäivään 19 asti tai jälkeläisten vieroitukseen asti. Miehille annosteltiin 25 viikkoon asti. Rotan sikiöillä havaittiin napatyrä 1 600-kertaisilla ja suurempilla annoksilla kuin MRHDID (mcg/m²-perusteella äidin suun kautta annetuilla annoksilla 3000 mcg/kg/vrk tai enemmän). Brachygnathiaa havaittiin rotan sikiöillä annoksella, joka oli 8 000 kertaa MRHDID (mcg/m², kun äidin oraalinen annos oli 15 000 mikrog/kg/vrk). Raskaus pitkittyi annoksella, joka oli 8 000-kertainen MRHDID:iin verrattuna (mcg/m², kun äidin oraalinen annos oli 15 000 mikrog/kg/vrk). Sikiö- ja poikaskuolemia esiintyi tiineyden aikana annoksilla, jotka olivat noin 1 600-kertaisia MRHDID:iin verrattuna ja suuremmilla annoksilla (mcg/m²:n perusteella suun kautta otetuilla annoksilla 3 000 mikrogrammaa/kg/vrk ja enemmän).
Alkion ja sikiön kehitystutkimuksessa tiineillä rotilla, joille annosteltiin organogeneesin aikana tiineyspäivistä 6-15, ei havaittu teratogeenisia, alkioita tappavia tai kehitysvaikutuksia annoksilla, jotka olivat enintään 375 kertaa MRHDID:tä suuremmilla annoksilla (mcg/m² emon inhalaatiolla). 690 mikrogrammaa/kg/vrk asti).
Alkion ja sikiön kehitystutkimuksessa tiineillä kaniineilla, joita annosteltiin organogeneesin aikana tiineyspäivistä 6-18, sikiöissä havaittiin subkapsulaarisia kystoja maksassa annoksella, joka oli 65 000 kertaa MRHDID (mcg/m² emolla). oraalinen annos 60 000 mcg/kg/vrk). Teratogeenisia vaikutuksia ei havaittu annoksilla, jotka olivat enintään 3800-kertaisia MRHDID-annoksilla (mcg/m²:n perusteella äidin suun kautta annetuilla annoksilla 3500 mikrog/kg/vrk asti).
Pre- ja postnataalisessa kehitystutkimuksessa raskaana olevat naarasrotat saivat formoterolia suun kautta annoksina 0, 210, 840 ja 3400 mikrogrammaa/kg/vrk raskauspäivästä 6 imetysjaksoon asti. Pentujen eloonjäämisaika pieneni syntymästä synnytyksen jälkeiseen päivään 26 annoksilla, jotka olivat 110 kertaa MRHDID ja suuremmat (mcg/m² perusteella emon suun kautta annetuilla annoksilla 210 mcg/kg/vrk tai enemmän), vaikkakaan ei ollut näyttöä annosvasteesta. suhdetta. Hoitoon liittyviä vaikutuksia ei havaittu rotanpentujen fyysiseen, toiminnalliseen tai käyttäytymiseen.
Imetys
Riskien yhteenveto
Ei ole saatavilla tietoja SYMBICORT 4,5 mikrogramman, budesonidin tai formoterolifumaraatin vaikutuksista imetettävään lapseen tai maidontuotantoon. Budesonidia, kuten muitakin inhaloitavia kortikosteroideja, on äidinmaidossa [katso Data ]. Formoterolifumaraatin erittymisestä äidinmaitoon ei ole saatavilla tietoja. Formoterolifumaraattia on rotan maidossa [katso Data ]. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin SYMBICORT 4,5 mikrog:n kliininen tarve ja SYMBICORT 160 mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Data
Ihmisillä saadut tiedot budesonidin kuivajauheinhalaattorilla annostelusta osoittavat, että rintamaidossa imeväiselle saatavilla oleva budesonidin päivittäinen kokonaisannos on noin 0,3–1 % äidin hengittämästä annoksesta [ks. KLIININEN FARMAKOLOGIA ]. SYMBICORT 4,5 mikrogrammaa käytettäessä vauvalle äidinmaitoon erittyvän budesonidin annoksen oletetaan olevan samanlainen prosentteina äidin annoksesta.
Rotilla tehdyssä hedelmällisyys- ja lisääntymistutkimuksessa formoterolin plasmapitoisuudet mitattiin pennuilla 15. syntymän jälkeisenä päivänä [ks. Käyttö tietyissä populaatioissa ]. Arvioiden mukaan suurin plasmapitoisuus, jonka pennut saivat emoeläimeltä suurimmalla annoksella 15 mg/kg imetyksen jälkeen, oli 4,4 % (0,24 nmol/l pentueella vs. 5,5 nmol/l emolla). .
Käyttö lapsille
SYMBICORTin turvallisuus ja tehokkuus 12-vuotiailla ja sitä vanhemmilla astmapotilailla on osoitettu 12 kuukautta kestäneissä tutkimuksissa. Kahdessa 12 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa avaintutkimuksessa USA:ssa 25 potilasta, jotka olivat iältään 12-17 vuotta, hoidettiin SYMBICORTilla kahdesti päivässä [ks. Kliiniset tutkimukset ]. Tehokkuustulokset tässä ikäryhmässä olivat samanlaiset kuin 18-vuotiailla ja sitä vanhemmilla potilailla. Tässä ikäryhmässä raportoitujen haittatapahtumien tyypissä tai esiintymistiheydessä ei ollut selviä eroja 18-vuotiaisiin ja sitä vanhempiin potilaisiin verrattuna.
SYMBICORT 80/4,5:n turvallisuus ja tehokkuus 6–12-vuotiailla astmapotilailla on osoitettu enintään 12 viikkoa kestäneissä tutkimuksissa [ks. Kliiniset tutkimukset ]. Turvallisuusprofiili näillä potilailla oli yhdenmukainen 12-vuotiailla ja sitä vanhemmilla potilailla, jotka saivat myös SYMBICORTia [ks. HAITTAVAIKUTUKSET ].
SYMBICORT 160 mg:n turvallisuutta ja tehoa alle 6-vuotiailla astmapotilailla ei ole varmistettu.
Kontrolloidut kliiniset tutkimukset ovat osoittaneet, että suun kautta hengitettävät kortikosteroidit, mukaan lukien budesonidi, joka on SYMBICORTin ainesosa, voivat hidastaa kasvunopeutta lapsipotilailla. Tämä vaikutus on havaittu ilman laboratoriotutkimuksia HPA-akselin suppressiosta, mikä viittaa siihen, että kasvunopeus on herkempi indikaattori systeemiselle kortikosteroidialtistukselle lapsipotilailla kuin jotkut yleisesti käytetyt HPA-akselin toiminnan testit. Tämän suun kautta hengitettäviin kortikosteroideihin liittyvän kasvunopeuden hidastumisen pitkäaikaisvaikutuksia, mukaan lukien vaikutusta lopulliseen pituuteen, ei tunneta. Suun kautta hengitettävien kortikosteroidien hoidon lopettamisen jälkeistä "kiihtymiskasvun" mahdollisuutta ei ole tutkittu riittävästi.
5–12-vuotiailla astmaa sairastavilla lapsilla tehdyssä tutkimuksessa budesonidi-DPI:llä 200 mikrogrammaa kahdesti vuorokaudessa (n=311) hoidettujen kasvu hidastui 1,1 senttimetriä lumelääkettä saaneisiin (n=418) vuoden lopussa. ; näiden kahden hoitoryhmän välinen ero ei kasvanut enempää kolmen vuoden lisähoidon aikana. Neljän vuoden lopussa budesonidi-DPI:llä hoidettujen lasten ja lumelääkettä saaneiden lasten kasvunopeus oli samanlainen. Tästä tutkimuksesta tehtyjä johtopäätöksiä saattaa hämmentää kortikosteroidien epätasainen käyttö hoitoryhmissä ja tutkimusten aikana murrosiän saavuttaneiden potilaiden tietojen sisällyttäminen.
Suun kautta inhaloitavia kortikosteroideja, mukaan lukien SYMBICORTia, saavien lapsipotilaiden kasvua on seurattava. Jos jotakin kortikosteroidia käyttävällä lapsella tai nuorella näyttää olevan kasvun hidastumista, hänen mahdollisuuttaan olla erityisen herkkä tälle vaikutukselle tulee harkita. Pitkäaikaisen hoidon mahdollisia kasvuvaikutuksia tulee punnita saavutettuihin kliinisiin hyötyihin nähden. Suun kautta hengitettävien kortikosteroidien, mukaan lukien SYMBICORTin, systeemisten vaikutusten minimoimiseksi jokainen potilas tulee titrata alhaisimpaan vahvuuteen, joka hallitsee hänen astmaansa tehokkaasti [ks. ANNOSTELU JA HALLINNOINTI ].
Geriatrinen käyttö
Kaikista astmapotilaista, joita hoidettiin SYMBICORTilla 160 mg kahdesti vuorokaudessa kahdessa 12 viikkoa kestäneessä tutkimuksessa ja 26 viikkoa kestäneessä markkinoille tulon jälkeisessä tutkimuksessa, 791 oli 65-vuotiaita tai vanhempia, joista 141 oli 75-vuotiaita tai vanhempia.
6–12 kuukautta kestäneissä keuhkoahtaumatautitutkimuksissa 810 potilasta, joita hoidettiin SYMBICORT 160/4,5:llä, kaksi inhalaatiota kahdesti päivässä, olivat vähintään 65-vuotiaita, ja näistä 177 potilasta oli vähintään 75-vuotiaita. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa.
Kuten muidenkin beeta2-agonisteja sisältävien valmisteiden kohdalla, erityistä varovaisuutta on noudatettava käytettäessä SYMBICORTia iäkkäille potilaille, joilla on samanaikainen sydän- ja verisuonisairaus, johon beeta2-agonistit voivat vaikuttaa haitallisesti.
SYMBICORTista tai sen vaikuttavista aineista saatavilla olevien tietojen perusteella SYMBICORT 4,5 mikrog:n annosta ei ole perusteltua muuttaa iäkkäillä potilailla.
Maksan vajaatoiminta
Virallisia farmakokineettisiä tutkimuksia SYMBICORTilla ei ole tehty potilailla, joilla on maksan vajaatoiminta. Koska sekä budesonidi että formoterolifumaraatti kuitenkin poistuvat pääasiassa maksametaboliassa, maksan toiminnan heikkeneminen voi johtaa budesonidin ja formoterolifumaraatin kertymiseen plasmaan. Siksi potilaita, joilla on maksasairaus, tulee seurata tarkasti.
Munuaisten vajaatoiminta
Virallisia farmakokineettisiä tutkimuksia SYMBICORTilla ei ole tehty potilailla, joilla on munuaisten vajaatoiminta.
YLIANNOSTUS
SYMBICORT
SYMBICORT sisältää sekä budesonidia että formoterolia; siksi alla kuvattujen yksittäisten komponenttien yliannostukseen liittyvät riskit koskevat SYMBICORTia. Farmakokineettisissa tutkimuksissa keuhkoahtaumatautia sairastaville potilaille annettiin kerta-annoksia 960/54 mikrogrammaa (12 SYMBICORT 80/4,5:tä) ja 1280/36 mikrogrammaa (8 160/4,5). Yhteensä 1920/54 mikrogrammaa (12 SYMBICORT 160/4,5:n painallusta) annettiin kerta-annoksena sekä terveille koehenkilöille että astmapotilaille. Pitkäaikaisessa aktiivikontrolloidussa turvallisuustutkimuksessa 12-vuotiaille ja sitä vanhemmille nuorille ja aikuisille astmapotilaille SYMBICORT 160/4,5 annettiin enintään 12 kuukauden ajan annoksina, jotka olivat enintään kaksi kertaa suurin suositeltu päiväannos. Missään näistä tutkimuksista ei havaittu kliinisesti merkittäviä haittavaikutuksia.
Budesonidi
Budesonidin yliannostuksen aiheuttamien akuuttien toksisten vaikutusten mahdollisuus on pieni. Jos sitä käytetään liiallisina annoksina pitkiä aikoja, voi esiintyä systeemisiä kortikosteroidivaikutuksia, kuten hyperkortismia [ks. VAROITUKSET JA VAROTOIMET ]. Budesonidi viisi kertaa suurin suositeltu annos (3200 mikrog päivässä) ihmisille annettuna kuuden viikon ajan vähensi merkittävästi (27 %) plasman kortisolivastetta 6 tunnin ACTH-infuusiossa lumelääkkeeseen verrattuna (+1 %). Vastaava vaikutus 10 mg prednisonia päivässä oli 35 %:n lasku plasman kortisolivasteessa ACTH:lle.
Formoteroli
Formoterolin yliannostus johtaisi todennäköisesti beeta2-agonisteille tyypillisten vaikutusten liiallisuuksiin: kohtaukset, angina pectoris, kohonnut verenpaine, hypotensio, takykardia, eteis- ja kammiotakyarytmiat, hermostuneisuus, päänsärky, vapina, sydämentykytys, lihaskrampit, pahoinvointi, huimaus, unihäiriöt , metabolinen asidoosi, hyperglykemia, hypokalemia. Kuten kaikki sympatomimeettiset lääkkeet, sydämenpysähdys ja jopa kuolema voivat liittyä formoterolin väärinkäyttöön. Kliinisesti merkittäviä haittavaikutuksia ei havaittu, kun formoterolia annettiin aikuisille potilaille, joilla oli akuutti keuhkoputkien supistuminen annoksella 90 mikrog/vrk 3 tunnin ajan tai stabiileille astmaatikoille 3 kertaa päivässä kokonaisannoksella 54 mikrog/vrk 3 päivän ajan.
Formoterolin yliannostuksen hoito koostuu lääkkeen käytön keskeyttämisestä sekä asianmukaisen oireenmukaisen ja/tai tukihoidon aloittamisesta. Kardioselektiivisen beetasalpaajan harkittua käyttöä voidaan harkita pitäen mielessä, että tällainen lääkitys voi aiheuttaa bronkospasmia. Ei ole riittävästi näyttöä sen määrittämiseksi, onko dialyysistä hyötyä formoterolin yliannostuksesta. Yliannostustapauksissa suositellaan sydämen seurantaa.
VASTA-AIHEET
SYMBICORTin käyttö on vasta-aiheista seuraavissa olosuhteissa:
- Status astmaattisen tai muiden akuuttien astman tai keuhkoahtaumatautien ensisijainen hoito, kun tarvitaan intensiivisiä toimenpiteitä.
- Yliherkkyys jollekin SYMBICORTin aineosalle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
SYMBICORT
SYMBICORT sisältää sekä budesonidia että formoterolia; siksi alla kuvatut yksittäisten komponenttien vaikutusmekanismit koskevat SYMBICORTia. Nämä lääkkeet edustavat kahta lääkeluokkaa (synteettinen kortikosteroidi ja pitkävaikutteinen selektiivinen beeta2-adrenoseptoriagonisti), joilla on erilaisia vaikutuksia keuhkoahtaumatautien ja astman kliinisiin, fysiologisiin ja tulehdusindekseihin.
Budesonidi
Budesonidi on anti-inflammatorinen kortikosteroidi, jolla on voimakas glukokortikoidiaktiivisuus ja heikko mineralokortikoidiaktiivisuus. Tavallisissa in vitro ja eläinmalleissa budesonidilla on noin 200 kertaa suurempi affiniteetti glukokortikoidireseptoriin ja 1000 kertaa suurempi paikallisesti käytettävä tulehdusta estävä teho kuin kortisolilla (rotan krotoniöljykorvan turvotusmääritys). Systeemisen aktiivisuuden mittana budesonidi on 40 kertaa tehokkaampi kuin kortisoli ihonalaisesti annettuna ja 25 kertaa tehokkaampi oraalisesti annettuna rotan kateenkorvan involuutiotestissä.
Glukokortikoidireseptoriaffiniteettitutkimuksissa budesonidin 22R-muoto oli kaksi kertaa niin aktiivinen kuin 22S-epimeeri. In vitro -tutkimukset osoittivat, että budesonidin kaksi muotoa eivät muutu keskenään.
Tulehdus on tärkeä osa COPD:n ja astman patogeneesiä. Kortikosteroideilla on laaja valikoima estäviä vaikutuksia useita solutyyppejä (esim. syöttösoluja, eosinofiilejä, neutrofiilejä, makrofageja ja lymfosyytit) ja välittäjiä (esim. histamiinia, eikosanoideja, leukotrieeniä ja sytokiineja) vastaan, jotka ovat osallisia allergisissa ja ei-allergisissa välitteissä. tulehdus. Nämä kortikosteroidien anti-inflammatoriset vaikutukset voivat myötävaikuttaa niiden tehoon COPD:ssä ja astmassa.
Astmapotilailla tehdyt tutkimukset ovat osoittaneet suotuisan suhteen paikallisen anti-inflammatorisen vaikutuksen ja systeemisten kortikosteroidivaikutusten välillä useilla budesonidin annoksilla. Tämä selittyy suhteellisen korkean paikallisen anti-inflammatorisen vaikutuksen, suun kautta imeytyneen lääkkeen laajan ensikierron maksan hajoamisen (85–95 %) ja muodostuneiden metaboliittien alhaisen tehon yhdistelmällä.
Formoteroli
Formoterolifumaraatti on pitkävaikutteinen selektiivinen beeta2-adrenerginen agonisti (beeta2-agonisti), jonka vaikutus alkaa nopeasti. Hengitetty formoterolifumaraatti toimii paikallisesti keuhkoissa keuhkoputkia laajentavana aineena. In vitro -tutkimukset ovat osoittaneet, että formoterolilla on yli 200 kertaa suurempi agonistivaikutus beeta2-reseptoreihin kuin beeta1-reseptoreihin. In vitro -sitoutumisselektiivisyys beeta2-beeta1-adrenoseptoreihin on korkeampi formoterolin kuin albuterolin (5 kertaa), kun taas salmeterolilla on korkeampi (3 kertaa) beeta2-selektiivisyyssuhde kuin formoterolin.
Vaikka beeta2-reseptorit ovat vallitsevia adrenergisiä reseptoreita keuhkoputkien sileässä lihaksessa ja beeta1-reseptorit ovat vallitsevia reseptoreita sydämessä, on myös ihmisen sydämessä beeta2-reseptoreita, jotka muodostavat 10–50 % kaikista beeta-adrenergisista reseptoreista. Näiden reseptorien tarkkaa toimintaa ei ole varmistettu, mutta ne lisäävät mahdollisuuden, että jopa erittäin selektiivisillä beeta2-agonisteilla voi olla sydänvaikutuksia.
Beeta2-adrenoseptoriagonistilääkkeiden, mukaan lukien formoterolin, farmakologiset vaikutukset johtuvat ainakin osittain solunsisäisen adenyylisyklaasin, entsyymin, joka katalysoi adenosiinitrifosfaatin (ATP) muuttumista sykliseksi 3',5'-adenosiinimonofosfaatiksi, stimulaatiosta. syklinen AMP). Lisääntyneet sykliset AMP-tasot aiheuttavat keuhkoputkien sileän lihaksen rentoutumista ja välittömän yliherkkyyden välittäjien vapautumisen estoa soluista, erityisesti syöttösoluista.
In vitro -testit osoittavat, että formoteroli estää syöttösoluvälittäjien, kuten histamiinin ja leukotrieenien, vapautumisen ihmisen keuhkoista. Formoteroli estää myös histamiinin aiheuttamaa plasman albumiinin ekstravasaatiota nukutetuissa marsuissa ja estää allergeenin aiheuttamaa eosinofiilien sisäänvirtausta koirilla, joilla on hengitysteiden yliherkkyys. Näiden in vitro ja eläinlöydösten merkitystä ihmisille ei tunneta.
Farmakodynamiikka
Astma
Sydän- ja verisuonivaikutukset
Kerta-annostutkimuksessa, johon osallistui 201 jatkuvaa astmaa sairastavaa potilasta, kerta-annoshoitoja 4,5, 9 ja 18 mikrogrammaa formoterolia yhdistettynä SYMBICORTin kautta annettuun 320 mikrogrammaan budesonidia verrattiin pelkkään budesonidiannokseen 320 mikrogrammaa. FEV1:ssä havaittiin annoksen mukaisia parannuksia verrattuna budesonidiin. EKG:t ja verinäytteet glukoosille ja kaliumille otettiin annostuksen jälkeen. SYMBICORT 4,5 mikrog:n kohdalla havaittiin pieniä keskimääräisiä seerumin glukoosipitoisuuksien nousuja ja seerumin kaliumpitoisuuksien laskuja (+0,44 mmol/L ja -0,18 mmol/L suurimmalla annoksella) formoteroliannoksilla budesonidiin verrattuna. EKG:ssä SYMBICORT sai aikaan pienen annoksesta riippuvan sydämen sykkeen (noin 3 lyöntiä minuutissa suurimmalla annoksella) ja QTc-ajan (3-6 ms) nousun pelkkään budesonidiin verrattuna. Yhdelläkään koehenkilöllä ei ollut QT- tai QTc-arvoa ≥500 ms.
Yhdysvalloissa viidessä 12 viikon aktiivi- ja lumekontrolloidussa tutkimuksessa ja yhdessä 6 kuukauden aktiivisella kontrolloidussa tutkimuksessa arvioitiin 2976 vähintään 6-vuotiasta astmapotilasta. Formoterolin systeemiset farmakodynaamiset vaikutukset (syke/pulssi, verenpaine, QTc-aika, kalium ja glukoosi) olivat samankaltaisia SYMBICORTilla hoidetuilla potilailla verrattuna potilaisiin, joita hoidettiin formoterolin kuivalla inhalaatiojauheella 4,5 mikrogrammaa, 2 inhalaatiota kahdesti päivässä. Yhdelläkään potilaalla QT- tai QTc-arvo ei ollut ≥500 ms hoidon aikana.
Kolmessa lumekontrolloidussa tutkimuksessa astmaa sairastavilla 12-vuotiailla ja sitä vanhemmilla nuorilla ja aikuisilla yhteensä 1232 potilaalla (553 potilasta SYMBICORT 160 mg:n ryhmässä) oli arvioitava jatkuva 24 tunnin elektrokardiografinen seuranta. Kaiken kaikkiaan kammio- tai supraventrikulaarisen ektopian esiintyvyydessä ei ollut merkittäviä eroja eikä näyttöä kliinisesti merkittävän rytmihäiriön lisääntyneestä riskistä SYMBICORT 160 mg -ryhmässä lumelääkkeeseen verrattuna.
HPA-akseliefektit
Kaiken kaikkiaan mitään kliinisesti merkittäviä vaikutuksia HPA-akseliin, mitattuna 24 tunnin virtsan kortisolilla, ei havaittu SYMBICORT-hoidetuilla aikuisilla tai nuorilla potilailla annoksilla 640/18 mikrog/vrk verrattuna budesonidiin.
Krooninen keuhkoahtaumatauti
Sydän- ja verisuonivaikutukset
Kahdessa keuhkoahtaumatautitutkimuksessa, jotka kestivät 6 kuukautta ja 12 kuukautta, mukaan lukien 3 668 COPD-potilasta, ei havaittu kliinisesti merkittäviä eroja pulssissa, verenpaineessa, kaliumissa ja glukoosissa SYMBICORTin, SYMBICORT 160 mg:n yksittäisten komponenttien ja lumelääkkeen välillä [ks. Kliiniset tutkimukset ].
EKG:t, jotka rekisteröitiin useilla klinikkakäynneillä hoidon aikana kummassakaan tutkimuksessa, eivät osoittaneet kliinisesti merkittäviä eroja sykkeen, PR-välin, QRS-keston, sykkeen, sydämen iskemian tai rytmihäiriöiden osalta SYMBICORT 160/4.5 -monotuotteiden ja lumelääkkeen välillä, jotka kaikki annettiin kahtena inhalaationa. kahdesti päivässä. EKG:n perusteella 6 potilaalla, joita hoidettiin SYMBICORT 160/4,5:llä, 6 potilaalla, joita hoidettiin formoterolia 4,5 mikrogrammaa, ja 6 potilasta lumeryhmässä koki eteisvärinää tai lepatusta, jota ei ollut lähtötilanteessa. SYMBICORT 160/4,5, formoteroli 4,5 mikrogrammaa tai lumelääkeryhmässä ei esiintynyt tapauksia jatkuvasta kammiotakykardiasta.
12 kuukautta kestäneessä tutkimuksessa 520 potilaalla oli arvioitava jatkuva 24 tunnin EKG (Holter) -seuranta ennen ensimmäistä annosta ja noin 1 ja 4 kuukauden hoidon jälkeen. Kliinisesti merkittäviä eroja kammio- tai supraventrikulaarisissa rytmihäiriöissä, kammio- tai supraventrikulaarisissa kohdunulkoisissa lyönneissä tai sydämen sykkeessä ei havaittu ryhmissä, joita hoidettiin SYMBICORT 160/4,5:llä, formoterolilla tai lumelääkettä 2 inhalaatiolla kahdesti vuorokaudessa. EKG (Holter) -seurannan perusteella yksi potilas sai SYMBICORT 160/4,5, yksikään potilas sai 4,5 mikrog formoterolia ja kolme potilasta lumeryhmässä koki eteisvärinää tai lepatusta, jota ei ollut lähtötilanteessa.
HPA-akselin tehosteet
24 tunnin virtsan kortisolimittaukset kerättiin yhdistetystä alajoukosta (n = 616) potilaista kahdesta keuhkoahtaumatautitutkimuksesta. Tiedot osoittivat, että SYMBICORTin pitkäaikaisen (> 6 kuukautta) annon jälkeen 24 tunnin virtsan vapaan kortisolin keskiarvo oli noin 30 % pienempi kuin lumelääke. SYMBICORT 4,5 mikrogrammaa kortisolisuppressiota näytti olevan verrattavissa pelkkään budesonidin 160 mikrogrammaan tai budesonidin 160 mikrogramman ja formoterolin 4,5 mikrogramman yhteiskäyttöön. Potilailla, joita hoidettiin SYMBICORTilla 160 mg tai lumelääkettä enintään 12 kuukauden ajan, niiden potilaiden prosenttiosuus, jotka siirtyivät normaalista alhaiseen tämän mittauksen vuoksi, olivat yleensä vertailukelpoisia.
Muut Budesonide-tuotteet
Sen vahvistamiseksi, että systeeminen imeytyminen ei ole merkittävä tekijä inhaloitavan budesonidin kliinisen tehon kannalta, tehtiin astmapotilailla kliininen tutkimus, jossa verrattiin 400 mikrogrammaa budesonidia, joka annettiin paineistetulla annosinhalaattorilla, jossa on letkun välikappale. . Tutkimus osoitti inhaloitavan budesonidin tehokkuuden, mutta ei suun kautta nautitun budesonidin tehoa vertailukelpoisista systeemisistä tasoista huolimatta. Näin ollen suun kautta inhaloitavan budesonidin tavanomaisten annosten terapeuttinen vaikutus selittyy suurelta osin sen suoralla vaikutuksella hengitysteihin.
Inhaloitavan budesonidin on osoitettu vähentävän hengitysteiden reaktiivisuutta erilaisiin altistusmalleihin, mukaan lukien histamiini, metakoliini, natriummetabisulfiitti ja adenosiinimonofosfaatti potilailla, joilla on hyperreaktiiviset hengitystiet. Näiden mallien kliininen merkitys ei ole varma.
Esikäsittely inhaloitavalla budesonidilla, 1 600 mikrogrammaa päivässä (800 mikrogrammaa kahdesti päivässä) 2 viikon ajan vähensi akuuttia (varhaisen vaiheen reaktio) ja viivästyneen (myöhäisen vaiheen reaktio) FEV1:n laskua inhaloitavan allergeenialtistuksen jälkeen.
Inhaloitavien kortikosteroidien systeemiset vaikutukset liittyvät systeemiseen altistumiseen tällaisille lääkkeille. Farmakokineettiset tutkimukset ovat osoittaneet, että sekä astmaa sairastavilla aikuisilla että lapsilla systeeminen altistuminen budesonidille on pienempi SYMBICORT 160 mg:n annoksella verrattuna inhaloitavaan budesonidiin, joka annetaan samalla annosteluannoksella kuivajauheinhalaattorin kautta [ks. KLIININEN FARMAKOLOGIA ]. Siksi SYMBICORTista toimitetun budesonidin systeemisten vaikutusten (HPA-akseli ja kasvu) ei odoteta olevan suurempia kuin inhaloitavan budesonidin raportoitu, kun sitä annetaan vertailukelpoisina annoksina kuivajauheinhalaattorin kautta [ks. Käyttö tietyissä populaatioissa ].
HPA-akseliefektit
Kuivajauheinhalaattorilla annetun inhaloitavan budesonidin vaikutuksia HPA-akseliin tutkittiin 905 aikuisella ja 404 astmapotilaalla. Useimmilla potilailla kyky lisätä kortisolin tuotantoa vasteena stressiin, joka arvioitiin kosyntropiinin (ACTH) stimulaatiotestillä, säilyi ennallaan budesonidihoidolla suositelluilla annoksilla. Aikuispotilaista, joita hoidettiin 100, 200, 400 tai 800 mikrogrammaa kahdesti vuorokaudessa 12 viikon ajan, 4 %:lla, 2 %:lla 6 %:lla ja 13 %:lla 13 %:lla oli epänormaali stimuloitu kortisolivaste (kortisolin huippuarvo
Muut Formoterol-tuotteet
Vaikka farmakodynaaminen vaikutus johtuu beeta-adrenergisten reseptoreiden stimulaatiosta, näiden reseptorien liiallinen aktivoituminen johtaa yleensä luustolihasten vapinaan ja kouristukseen, unettomuuteen, takykardiaan, plasman kaliumpitoisuuden laskuun ja plasman glukoosipitoisuuden nousuun. Inhaloitava formoteroli, kuten muutkin beeta2-adrenergiset agonistilääkkeet, voi aiheuttaa annoksesta riippuvaisia kardiovaskulaarisia vaikutuksia ja vaikutuksia veren glukoosiin ja/tai seerumin kaliumiin [ks. VAROITUKSET JA VAROTOIMET ]. SYMBICORT 160 mg:n osalta nämä vaikutukset on kuvattu tarkemmin kohdassa Kliininen farmakologia, Farmakodynamiikka, SYMBICORT (12.2).
LABA-lääkkeiden käyttö voi johtaa keuhkoputkia suojaavien ja keuhkoputkia laajentavien vaikutusten sietokykyyn.
Kroonisen pitkävaikutteisen beetaagonistihoidon lopettamisen jälkeen ei ole havaittu rebound-keuhkoputkien yliherkkyyttä.
Farmakokinetiikka
SYMBICORT
Imeytyminen
Budesonidi
Terveet aiheet
Suun kautta inhaloitu budesonidi imeytyy nopeasti keuhkoihin ja huippupitoisuus saavutetaan tyypillisesti 20 minuutissa. Suun kautta annetun budesonidin huippupitoisuus plasmassa saavutettiin noin 1–2 tunnissa, ja absoluuttinen systeeminen hyötyosuus oli 6–13 % laajan ensikierron metabolian vuoksi. Sitä vastoin suurin osa keuhkoihin kuljetetusta budesonidista imeytyi systeemisesti. Terveillä koehenkilöillä 34 % mitatusta annoksesta kerääntyi keuhkoihin (määritettynä plasman pitoisuusmenetelmällä ja käyttämällä budesonidia sisältävää kuivajauheinhalaattoria), ja absoluuttinen systeeminen saatavuus oli 39 % mitatusta annoksesta.
Kun terveille koehenkilöille annettiin SYMBICORT 160/4,5, kaksi tai neljä inhalaatiota kahdesti päivässä 5 päivän ajan, plasman budesonidipitoisuus nousi yleensä suhteessa annokseen. Budesonidin kumulaatioindeksi ryhmässä, joka sai 2 inhalaatiota kahdesti päivässä, oli 1,32.
Astmapotilaat
Kerta-annostutkimuksessa potilaille, joilla oli keskivaikea astma, annettiin suositeltua suurempia annoksia SYMBICORTia (12 inhalaatiota SYMBICORT 160/4,5). Budesonidin huippupitoisuus plasmassa, 4,5 nmol/l, saavutettiin 20 minuuttia annostelun jälkeen. Tämä tutkimus osoitti, että SYMBICORT 4,5 mikrogramman systeeminen kokonaisaltistus budesonidille oli noin 30 % pienempi kuin inhaloitavalla budesonidilla kuivajauheinhalaattorin (DPI) kautta samalla annosteluannoksella. SYMBICORTin annon jälkeen budesonidikomponentin puoliintumisaika oli 4,7 tuntia.
Toistuvaannostutkimuksessa suurin suositeltu SYMBICORT-annos (160/4,5, kaksi inhalaatiota kahdesti vuorokaudessa) annettiin keskivaikeaa astmaa sairastaville potilaille ja terveille henkilöille viikon ajan. Budesonidin huippupitoisuus plasmassa 1,2 nmol/l saavutettiin astmapotilailla 21 minuutin kohdalla. Budesonidin huippupitoisuus plasmassa oli 27 % pienempi astmapotilailla verrattuna terveisiin koehenkilöihin. Budesonidin systeeminen kokonaisaltistus oli kuitenkin verrattavissa astmapotilaiden systeemiseen altistukseen.
DPI:llä annetun budesonidin vakaan tilan huippupitoisuudet plasmassa astmaa sairastavilla aikuisilla olivat keskimäärin 0,6 ja 1,6 nmol/l annoksilla 180 mikrogrammaa ja 360 mikrogrammaa kahdesti vuorokaudessa. Astmapotilailla budesonidin AUC- ja Cmax-arvot nousivat lineaarisesti annoksen noustessa sekä kerta- että toistuvan inhaloitavan budesonidin annon jälkeen.
COPD-potilaat
Kerta-annostutkimuksessa 12 inhalaatiota SYMBICORT 80/4,5:tä (kokonaisannos 960/54 mikrog) annettiin keuhkoahtaumatautipotilaille. Budesonidin keskimääräinen huippupitoisuus plasmassa 3,3 nmol/l saavutettiin 30 minuutin kuluttua annostelusta. Budesonidin systeeminen altistuminen oli verrattavissa SYMBICORT pMDI:n ja budesonidin samanaikaisen antamisen välillä mittariannosinhalaattorin ja formoterolin kanssa kuivajauheinhalaattorin kautta (budesonidi 960 mikrogrammaa ja formoterolia 54 mikrogrammaa). Samassa tutkimuksessa avoin ryhmä kohtalaista astmapotilaita sai myös saman suuremman annoksen SYMBICORTia. Budesonidipotilailla COPD-potilailla oli 12 % suurempi AUC ja 10 % pienempi Cmax verrattuna astmapotilaisiin.
Kuusi kuukautta kestäneessä avainasemassa keuhkojen toimintaa koskevassa kliinisessä tutkimuksessa budesonidin vakaan tilan farmakokineettiset tiedot saatiin keuhkoahtaumatautipotilaiden alaryhmässä, jonka hoitohaaroissa oli SYMBICORT 4,5 mikrogrammaa pMDI 160/4,5, SYMBICORT 160 mg pMDI mDI mDI 80/4,6 budesonide5, budesonide5. 160 mikrogrammaa ja formoterolia 4,5 mikrogrammaa yhdessä annettuna, kaikki 2 inhalaationa kahdesti päivässä. Budesonidin systeeminen altistus (AUC ja Cmax) lisääntyi suhteessa annoksilla 80 mikrogrammasta 160 mikrogrammaan ja oli yleensä samanlainen kolmen hoitoryhmän välillä, jotka saivat saman budesonidiaannoksen (SYMBICORT 4,5 mikrogrammaa pMDI 160/4,5, budesonidi 160 mikrogrammaa, budesonidi 160 mcg ja 160 mcg) formoteroli 4,5 mikrog yhdessä annettuna).
Formoteroli
Hengitetty formoteroli imeytyy nopeasti; plasman huippupitoisuudet saavutetaan tyypillisesti ensimmäisellä plasmanäytteenottokerralla, 5-10 minuutin kuluessa annostelusta. Kuten monien suun kautta annettavien lääkevalmisteiden kohdalla, on todennäköistä, että suurin osa sisäänhengitetystä formoterolista niellään ja sitten imeytyy maha-suolikanavasta.
Terveet aiheet
Kun SYMBICORTia annettiin (160/4,5, kaksi tai neljä inhalaatiota kahdesti päivässä) 5 päivän ajan terveille koehenkilöille, plasman formoterolin pitoisuus nousi yleensä suhteessa annokseen. Ryhmän, joka sai 2 inhalaatiota kahdesti päivässä, kertymisindeksi oli 1,77 formoterolin osalta.
Astmapotilaat
Kerta-annostutkimuksessa potilaille, joilla oli keskivaikea astma, annettiin suositeltua suurempia annoksia SYMBICORTia (12 inhalaatiota SYMBICORT 160/4,5). Formoterolin huippupitoisuus plasmassa, 136 pmol, saavutettiin 10 minuutin kuluttua annostelusta. Noin 8 % annetusta formoteroliannoksesta erittyi virtsaan muuttumattomana lääkkeenä.
Toistuvaannostutkimuksessa suurin suositeltu SYMBICORT-annos (160/4,5, kaksi inhalaatiota kahdesti vuorokaudessa) annettiin keskivaikeaa astmaa sairastaville potilaille ja terveille henkilöille viikon ajan. Plasman formoterolin huippupitoisuus, 28 pmol/l, saavutettiin 10 minuutin kohdalla astmapotilailla. Plasman formoterolin huippupitoisuus oli noin 42 % pienempi astmapotilailla verrattuna terveisiin koehenkilöihin. Formoterolin systeeminen kokonaisaltistus oli kuitenkin verrattavissa astmapotilaiden systeemiseen altistukseen.
COPD-potilaat
SYMBICORT 80/4,5:n 12 inhalaation kerta-annoksen jälkeen formoterolin keskimääräinen huippupitoisuus plasmassa 167 pmol/l saavutettiin nopeasti 15 minuutin kuluttua annostelusta. Formoterolialtistus oli hieman suurempi (n. 16-18 %) SYMBICORT 160 mg pMDI:stä verrattuna budesonidin samanaikaiseen antoon mittariannosinhalaattorin kautta ja formoterolin samanaikaiseen antamiseen kuivajauheinhalaattorin kautta (budesonidin kokonaisannos 960 mikrogrammaa ja formoterolia 54 mikrogrammaa). Samassa tutkimuksessa avoin ryhmä kohtalaista astmapotilaita sai saman annoksen SYMBICORTia. Keuhkoahtaumapotilailla oli 12-15 % suurempi formoterolin AUC ja Cmax astmapotilaisiin verrattuna.
Kuusi kuukautta kestäneessä avainasemassa keuhkojen toimintaa koskevassa kliinisessä tutkimuksessa formoterolin vakaan tilan farmakokineettiset tiedot saatiin keuhkoahtaumatautipotilaiden alaryhmästä, joiden hoitohaaroissa oli SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,40 mg 160 5 mDI. mikrogrammaa ja formoterolia 4,5 mikrogrammaa yhdessä annettuna, kaikki 2 inhalaationa kahdesti päivässä. Systeeminen formoterolin altistuminen AUC:n mukaan oli noin 30 % ja 16 % suurempi SYMBICORT pMDI:stä verrattuna pelkkään formoterolihoitoon ja budesonidin ja formoterolihoitoryhmän yksittäisten komponenttien yhteisantoon verrattuna.
Jakelu
Budesonidi
Budesonidin jakautumistilavuus oli noin 3 l/kg. Se sitoutui plasman proteiineihin 85–90 %. Proteiinisitoutuminen oli vakio pitoisuusalueella (1-100 nmol/L), joka saavutettiin suositelluilla inhaloitavilla annoksilla ja ylitti ne. Budesonidi sitoutui vain vähän tai ei lainkaan kortikosteroideja sitovaan globuliiniin. Budesonidi tasapainottui nopeasti punasolujen kanssa pitoisuudesta riippumattomalla tavalla veriplasmasuhteen ollessa noin 0,8.
Formoteroli
Konsentraatioalueella 10-500 nmol/l plasman proteiineihin sitoutuminen formoterolin RR- ja SS-enantiomeeriin oli 46 % ja 58 %. Plasman proteiineihin sitoutumisen arvioimiseen käytetyt formoterolin pitoisuudet olivat korkeampia kuin plasmassa saavutetut pitoisuudet kerta-annoksen 54 mikrogramman inhalaation jälkeen.
Aineenvaihdunta
Budesonidi
Ihmisen maksahomogenaateilla tehdyt in vitro -tutkimukset ovat osoittaneet, että budesonidi metaboloitui nopeasti ja laajasti. Kaksi tärkeintä metaboliittia, jotka muodostuvat sytokromi P450:n (CYP) isoentsyymi 3A4:n (CYP3A4) katalysoiman biotransformaation kautta, on eristetty ja tunnistettu 16α-hydroksiprednisoloniksi ja 6ß-hydroksibudesonidiksi. Kummankin näiden kahden metaboliitin kortikosteroidiaktiivisuus oli alle 1 % alkuperäisen yhdisteen aktiivisuudesta. In vitro ja in vivo -metaboliakuvioiden välillä ei havaittu laadullisia eroja. Ihmisen keuhko- ja seerumivalmisteissa havaittiin vähäistä metabolista inaktivaatiota.
Formoteroli
Formoterolin ensisijainen metabolia tapahtuu suoralla glukuronidaatiolla ja O-demetylaatiolla, jota seuraa konjugaatio inaktiivisiksi metaboliiteiksi. Toissijaisia metabolisia reittejä ovat deformylaatio ja sulfaattikonjugaatio. CYP2D6:n ja CYP2C:n on todettu olevan ensisijaisesti vastuussa odemetylaatiosta.
Eliminointi
Budesonidi
Budesonidi erittyi virtsaan ja ulosteisiin metaboliittien muodossa. Noin 60 % suonensisäisestä radioleimatusta annoksesta havaittiin virtsassa.
Virtsassa ei havaittu muuttumatonta budesonidia. Budesonidin 22R-muoto poistui ensisijaisesti maksasta systeemisellä puhdistumalla 1,4 l/min vs. 1,0 l/min 22S-muodolla. Terminaalinen puoliintumisaika, 2–3 tuntia, oli sama molemmilla epimeereillä ja riippumaton annoksesta.
Formoteroli
Formoterolin erittymistä tutkittiin neljällä terveellä koehenkilöllä sen jälkeen, kun radioaktiivisesti merkittyä formoterolia annettiin samanaikaisesti suun kautta ja laskimoon. Tuossa tutkimuksessa 62 % radioaktiivisesti leimatusta formoterolista erittyi virtsaan ja 24 % ulosteiden mukana.
Erikoispopulaatiot
Geriatric
SYMBICORT 4,5 mikrogramman farmakokinetiikkaa iäkkäillä potilailla ei ole erityisesti tutkittu.
Pediatriset
Budesonidin plasmapitoisuudet mitattiin neljän SYMBICORT 160/4,5 -inhalaation jälkeen kerta-annostutkimuksessa astmaa sairastavilla lapsipotilailla, joiden ikä on 6–12 vuotta. Budesonidin huippupitoisuudet 1,4 nmol/l saavutettiin 20 minuuttia annoksen jälkeen. Tämä tutkimus osoitti myös, että SYMBICORT 4,5 mikrogramman systeeminen kokonaisaltistus budesonidille oli noin 30 % pienempi kuin inhaloitavalla budesonidilla kuivajauheinhalaattorilla, joka myös arvioitiin samalla annostelulla. Budesonidin annoksen mukaan normalisoitu Cmax ja AUC0-inf kerta-annoksen inhalaation jälkeen 6–alle 12-vuotiailla lapsilla olivat numeerisesti pienempiä kuin aikuisilla.
Kahden SYMBICORT 160/4,5 -inhalaation jälkeen kahdesti vuorokaudessa formoterolin Cmax ja AUC0-6 vakaassa tilassa 6–alle 12-vuotiailla lapsilla olivat verrattavissa aikuisilla havaittuihin.
Sukupuoli/rotu
Erityisiä tutkimuksia sukupuolen ja rodun vaikutuksista SYMBICORTin farmakokinetiikkaan ei ole tehty. SYMBICORT 4,5 mikrog -tietojen populaatio-PK-analyysi osoittaa, että sukupuoli ei vaikuta budesonidin ja formoterolin farmakokinetiikkaan. Rodun vaikutuksesta ei voida tehdä johtopäätöksiä, koska PK:n suhteen on arvioitu vain vähän ei-valkoihoisia.
Imettävät äidit
Budesonidin jakautumista annettaessa hengitettynä kuivajauheinhalaattorista annoksina 200 tai 400 mikrogrammaa kahdesti päivässä vähintään 3 kuukauden ajan tutkittiin kahdeksalla imettävällä naisella, joilla oli astma 1-6 kuukautta synnytyksen jälkeen. Näiden naisten systeeminen altistuminen budesonidille näyttää olevan verrattavissa muiden tutkimusten mukaan astmaa sairastaviin naisiin, jotka eivät imetä. Kahdeksan tunnin aikana annoksen jälkeen saatu rintamaito osoitti, että budesonidin maksimipitoisuus 400 ja 800 mikrogramman päivittäisillä kokonaisannoksilla oli 0,39 ja 0,78 nmol/l, ja se ilmaantui 45 minuutin sisällä annostelusta. Arvioitu budesonidin oraalinen päivittäinen annos äidinmaidosta lapselle on noin 0,007 ja 0,014 mikrog/kg/vrk kahdella tässä tutkimuksessa käytetyllä annostusohjelmalla, mikä on noin 0,3–1 % äidin hengittämästä annoksesta. Budesonidipitoisuudet plasmanäytteissä, jotka otettiin viideltä lapselta noin 90 minuuttia imetyksen jälkeen (ja noin 140 minuuttia lääkkeen antamisen jälkeen äidille), olivat kvantitatiivisen tason alapuolella ( Käyttö tietyissä populaatioissa ].
Munuaisten tai maksan vajaatoiminta
Ei ole olemassa tietoja SYMBICORTin erityisestä käytöstä potilailla, joilla on maksan tai munuaisten vajaatoiminta. Maksan vajaatoiminta voi vaikuttaa kortikosteroidien eliminaatioon. Budesonidin farmakokinetiikkaan vaikutti maksan toiminnan heikkeneminen, mistä on osoituksena kaksinkertainen systeeminen saatavuus suun kautta otetun. Laskimonsisäisen budesonidin farmakokinetiikka oli kuitenkin samanlainen kirroosipotilailla ja terveillä koehenkilöillä. Formoterolin käytöstä ei ole saatavilla erityisiä tietoja, mutta koska formoteroli eliminoituu ensisijaisesti maksametabolian kautta, altistus voi olla lisääntynyt potilailla, joilla on vaikea maksan vajaatoiminta.
Huumeiden väliset vuorovaikutukset
Yhden annoksen risteytystutkimus tehtiin seuraavien kahdeksan inhalaation farmakokinetiikkaa vertailemaan: budesonidi, formoteroli ja budesonidi plus formoteroli annettuna samanaikaisesti. Tutkimuksen tulokset osoittivat, että SYMBICORTin kahden komponentin välillä ei ollut näyttöä farmakokineettisestä yhteisvaikutuksesta.
Sytokromi P450 -entsyymien estäjät
Ketokonatsoli
Ketokonatsoli, joka on kortikosteroidien pääasiallisen metabolisen entsyymin sytokromi P450 (CYP) isoentsyymin 3A4 (CYP3A4) vahva estäjä, nosti suun kautta nautitun budesonidin pitoisuutta plasmassa.
Simetidiini
Suositelluilla annoksilla simetidiinillä, joka on CYP-entsyymien epäspesifinen estäjä, oli lievä mutta kliinisesti merkityksetön vaikutus suun kautta otettavan budesonidin farmakokinetiikkaan.
Spesifisiä lääkkeiden yhteisvaikutustutkimuksia formoterolin kanssa ei ole tehty.
Eläinten toksikologia ja/tai farmakologia
Prekliininen
Laboratorio-eläimillä (minisiat, jyrsijät ja koirat) tehdyt tutkimukset ovat osoittaneet sydämen rytmihäiriöiden ja äkillisen kuoleman (jossa on histologisia todisteita sydänlihaksen nekroosista) esiintymistä, kun beeta-agonisteja ja metyyliksantiineja on annettu samanaikaisesti. Näiden löydösten kliinistä merkitystä ei tunneta.
Kliiniset tutkimukset
Astma
12-vuotiaat ja sitä vanhemmat astmapotilaat
Kahdessa kliinisessä tutkimuksessa, joissa verrattiin SYMBICORT 4,5 mikrogrammaa yksittäisiin komponentteihin, parannukset useimmissa tehon päätepisteissä olivat suurempia SYMBICORTilla kuin pelkällä budesonidia tai formoterolia käytettäessä. Lisäksi yksi kliininen tutkimus osoitti samanlaisia tuloksia SYMBICORTin ja budesonidin ja formoterolin samanaikaisen käytön vastaavilla annoksilla eri inhalaattoreista.
SYMBICORT 160 mg:n turvallisuus ja teho osoitettiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä Yhdysvalloissa tehdyssä kliinisessä tutkimuksessa, joihin osallistui 1076 vähintään 12-vuotiasta potilasta. Kiinteitä SYMBICORT-annoksia 160/9 mcg ja 320/9 mcg kahdesti vuorokaudessa (kukin annos annettiin kahtena inhalaationa vahvuuksilla 80/4,5 ja 160/4,5 mikrogrammaa) verrattiin monokomponentteihin (budesonidi ja placebo-formoteroli) antaa tietoa sopivasta annostuksesta kattamaan astman vaikeusaste.
Tutkimus 1: Kliininen tutkimus SYMBICORTilla 160/4.5
Tässä 12 viikkoa kestäneessä tutkimuksessa arvioitiin 596 vähintään 12-vuotiasta potilasta vertaamalla SYMBICORT 160/4,5, budesonidin 160 mikrogrammaa plus formoterolia 4,5 mikrogrammaa erillisissä inhalaattoreissa, budesonidia 160 mikrogrammaa, formoterolia 4,5 mcg ja placeboa; kumpikin annetaan 2 inhalaationa kahdesti päivässä. Tutkimukseen sisältyi 2 viikon sisäänajojakso, jossa budesonidia 80 mikrogrammaa, 2 inhalaatiota kahdesti päivässä. Useimmilla potilailla oli kohtalainen tai vaikea astma, ja he käyttivät kohtalaisia tai suuria annoksia inhaloitavia kortikosteroideja ennen tutkimukseen osallistumista. Satunnaistaminen kerrottiin aiemman inhaloitavan kortikosteroidihoidon perusteella (71,6 % keskivaikealla ja 28,4 % suuriannoksisella inhaloitavalla kortikosteroidihoidolla). Keskimääräinen ennustettu FEV1-prosentti oli lähtötilanteessa 68,1 % ja se oli samanlainen kaikissa hoitoryhmissä. Ensisijaiset tehokkuuden päätepisteet olivat 12 tunnin keskiarvo annoksen jälkeen viikolla 2 ja annosta edeltävä FEV1 keskiarvo tutkimuksen aikana. Tutkimus edellytti myös potilaiden, jotka täyttivät ennalta määritellyn astman pahenemiskriteerin, poistamista. Ennalta määritellyt astman pahenemiskriteerit olivat FEV1:n tai PEF:n kliinisesti merkittävä lasku, pelastusalbuterolin käytön lisääntyminen, astman aiheuttama yöherääminen, astman aiheuttama hätähoito tai sairaalahoito tai astmalääkityksen tarve, jota protokolla ei salli. Astman aiheuttaman yöllisen heräämisen kriteerin osalta potilaiden annettiin jäädä tutkimukseen tutkijan harkinnan mukaan, jos mikään muu astmaa pahentava kriteeri ei täyttynyt. Taulukossa 4 on esitetty niiden potilaiden prosenttiosuus, jotka lopettavat astman pahenemisen vuoksi tai täyttävät ennalta määritellyt kriteerit.
FEV1:n keskimääräinen prosentuaalinen muutos lähtötasosta mitattuna välittömästi ennen annosta (ennen annosta) 12 viikon aikana on esitetty kuvassa 1. Koska tässä tutkimuksessa käytettiin ennalta määritettyjä vieroituskriteerejä astman pahenemiseen, mikä aiheutti erilaisen vieroitustiheyden hoitoryhmissä, annoksen FEV1-tulokset viimeisellä saatavilla olevalla tutkimuskäynnillä (hoidon loppu, EOT) toimitetaan myös. SYMBICORT 160/4,5 -hoitoa saaneiden potilaiden FEV1:n keskiarvo parani huomattavasti enemmän lähtötasosta hoidon lopussa (0,19 l, 9,4 %) verrattuna budesonidin 160 mikrogrammaan (0,10 l, 4,9 %) ja formoterolin 4,5 mikrogrammaan (-0,12 %). L, -4,8 %) ja lumelääke (-0,17 L, -6,9 %).
Kuva 1: Keskimääräinen prosentuaalinen muutos lähtötilanteesta ennen annosta FEV1:ssä 12 viikon aikana (tutkimus 1)
POTILASTIEDOT
SYMBICORT (SIM-bi-kort) (budesonidi 80 mcg ja formoterolifumaraattidihydraatti 4,5 mcg) Inhalaatioaerosoli
SYMBICORT (SIM-bi-kort) (budesonidi 160 mcg ja formoterolifumaraattidihydraatti 4,5 mcg) Inhalaatioaerosoli
Mikä on SYMBICORT?
SYMBICORT yhdistää inhaloitavan kortikosteroidilääkkeen (ICS), budesonidin ja pitkävaikutteisen beeta2-adrenergisen agonistin (LABA) lääkkeen, formoterolin.
- Inhaloitavat kortikosteroidit auttavat vähentämään tulehdusta keuhkoissa. Keuhkotulehdus voi aiheuttaa hengitysvaikeuksia.
- LABA-lääkkeitä käytetään ihmisillä, joilla on krooninen obstruktiivinen keuhkosairaus (COPD) ja astma. LABA-lääkkeet auttavat keuhkojesi hengitysteiden ympärillä olevia lihaksia pysymään rentoina ja ehkäisemään oireita, kuten hengityksen vinkumista, yskää, puristavaa tunnetta rinnassa ja hengenahdistusta. Nämä oireet voivat ilmetä, kun hengitysteiden ympärillä olevat lihakset kiristyvät. Tämä vaikeuttaa hengittämistä. Vakavissa tapauksissa hengityksen vinkuminen voi pysäyttää hengityksesi ja johtaa kuolemaan, jos sitä ei hoideta välittömästi.
SYMBICORT 4,5 mikrogrammaa ei käytetä äkillisten hengitysongelmien lievittämiseen, eikä se korvaa pelastusinhalaattoria. SYMBICORTia käytetään astmaan ja keuhkoahtaumatautiin seuraavasti:
- Astma: SYMBICORTia käytetään astman oireiden hallintaan ja oireiden, kuten hengityksen vinkumisen, ehkäisyyn aikuisilla ja 6-vuotiailla ja sitä vanhemmilla lapsilla. SYMBICORT 4,5 mcg sisältää formoterolia. LABA-lääkkeet, kuten formoteroli, yksinään käytettyinä lisäävät astmaongelmien aiheuttamaa kuoleman- ja sairaalahoidon riskiä. SYMBICORT sisältää ICS:n ja LABA:n. Kun ICS:ää ja LABA:ta käytetään yhdessä, ei ole merkittävää lisääntynyttä riskiä sairaalahoidoissa ja astmaongelmista johtuvassa kuolemassa. SYMBICORT 160mg ei ole tarkoitettu astmaa sairastaville aikuisille ja lapsille, jotka ovat hyvin hallinnassa astman hallintalääkkeellä, kuten pienellä tai keskisuurella annoksella ICS-lääkettä. SYMBICORT 160mg on tarkoitettu astmaa sairastaville aikuisille ja lapsille, jotka tarvitsevat sekä ICS- että LABA-lääkettä. Ei tiedetä, onko SYMBICORT turvallinen ja tehokas alle 6-vuotiaille astmaa sairastaville lapsille.
- COPD: COPD on pitkäaikainen (krooninen) keuhkosairaus, joka sisältää kroonisen keuhkoputkentulehduksen, emfyseeman tai molemmat. SYMBICORT 160/4,5 mikrogrammaa käytetään pitkäaikaisesti, 2 inhalaationa 2 kertaa päivässä, parantamaan keuhkoahtaumataudin oireita ja parantamaan hengitystä ja vähentämään pahenemisvaiheiden määrää (COPD-oireiden paheneminen useiden päivien ajan).
Älä käytä SYMBICORTia:
- astman tai COPD:n äkillisten vaikeiden oireiden hoitoon.
- jos olet allerginen jollekin SYMBICORTin aineosalle. Katso tämän pakkausselosteen lopusta luettelo SYMBICORTin aineosista.
Ennen kuin käytät SYMBICORTia, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- on sydänongelmia.
- on korkea verenpaine.
- saada kohtauksia.
- sinulla on kilpirauhasen ongelmia.
- on diabetes.
- sinulla on maksaongelmia.
- on osteoporoosi.
- sinulla on immuunijärjestelmäongelma.
- sinulla on silmäongelmia, kuten kohonnut silmänpaine, glaukooma tai kaihi.
- ovat allergisia jollekin lääkkeelle.
- sinulla on minkä tahansa virus-, bakteeri-, sieni- tai loisinfektio.
- ovat alttiina vesirokolle tai tuhkarokolle.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, voiko SYMBICORT 4,5 mcg vahingoittaa sikiötäsi.
- imettävät. Budesonidi, yksi SYMBICORTin vaikuttavista aineista, erittyy äidinmaitoon. Sinun ja terveydenhuollon tarjoajasi tulee päättää, otatko SYMBICORT 160 mg -valmistetta imetyksen aikana.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. SYMBICORT ja tietyt muut lääkkeet voivat olla yhteisvaikutuksia keskenään. Tämä voi aiheuttaa vakavia sivuvaikutuksia. Kerro erityisesti terveydenhuollon tarjoajallesi, jos käytät sieni- tai HIV-lääkkeitä.
Tiedä kaikki käyttämäsi lääkkeet. Pidä luetteloa ja näytä se terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle aina, kun saat uuden lääkkeen.
Kuinka minun pitäisi käyttää SYMBICORTia?
Katso vaiheittaiset ohjeet SYMBICORTin käytöstä tämän potilastietolehtisen lopusta. Älä käytä SYMBICORT 4,5 mikrogrammaa, ellei terveydenhuollon tarjoajasi ole opettanut sinulle ja ymmärrät kaikkea. Kysy terveydenhuollon tarjoajalta tai apteekista, jos sinulla on kysyttävää.
- Käytä SYMBICORTia täsmälleen ohjeiden mukaisesti. Älä käytä SYMBICORT 160 mg:aa useammin kuin on määrätty. SYMBICORTissa on kaksi vahvuutta. Terveydenhuollon tarjoaja on määrännyt sinulle parhaiten sopivan vahvuuden. Huomaa erot SYMBICORTin ja muiden inhaloitavien lääkkeiden välillä, mukaan lukien erot määrätyssä käytössä ja fyysisessä ulkonäössä.
- Lasten tulee käyttää SYMBICORTia aikuisen avustuksella lapsen terveydenhuollon tarjoajan ohjeiden mukaisesti.
- SYMBICORT 160 mg tulee ottaa joka päivä 2 hengityksenä aamulla ja 2 hengityksenä illalla noin 12 tunnin välein.
- Jos unohdat ottaa SYMBICORT 160 mg -annoksen, ota seuraava annos samaan aikaan kuin tavallisesti.
- Huuhtele suusi vedellä ja sylje vesi ulos jokaisen SYMBICORT-annoksen (2 suihke) jälkeen. Älä niele vettä. Tämä auttaa vähentämään mahdollisuutta saada sieni-infektio (sammas) suussa ja kurkussa.
- Jos otat liikaa SYMBICORTia, soita välittömästi terveydenhuollon tarjoajalle tai mene lähimmän sairaalan ensiapuun, jos sinulla on epätavallisia oireita, kuten pahenevaa hengenahdistusta, rintakipua, kohonnutta sykettä tai vapinaa.
- Älä suihkuta SYMBICORT 4,5 mikrogrammaa silmiisi. Jos joudut vahingossa SYMBICORT 160 mg:aa silmiisi, huuhtele silmäsi vedellä ja jos punoitus tai ärsytys jatkuu, ota yhteys terveydenhuollon tarjoajaan.
- Älä muuta tai lopeta lääkkeitä, joita käytetään hengitysvaikeuksiesi hallintaan tai hoitoon. Terveydenhuollon tarjoaja vaihtaa lääkkeitäsi tarpeen mukaan.
- Kun käytät SYMBICORTia 2 kertaa päivässä, älä mistään syystä käytä muita LABA:ta sisältäviä lääkkeitä. Kysy terveydenhuollon tarjoajalta tai apteekista, ovatko muut lääkkeesi LABA-lääkkeitä.
- SYMBICORT 4,5 mcg ei lievitä äkillisiä oireita. Pidä aina mukanasi pelastusinhalaattorilääke äkillisten oireiden hoitoon. Jos sinulla ei ole pelastusinhalaattoria, soita terveydenhuollon tarjoajalle, jotta hän määrää sellaisen sinulle.
- Soita terveydenhuollon tarjoajallesi tai hakeudu lääkärin hoitoon välittömästi, jos:
- hengitysvaikeutesi pahenevat SYMBICORTin käytön yhteydessä.
- sinun on käytettävä pelastusinhalaattoriasi tavallista useammin.
- pelastusinhalaattorilääke ei tehoa yhtä hyvin oireiden lievittämiseen.
- huippuvirtausmittarin tulokset laskevat. Terveydenhuollon tarjoaja kertoo sinulle sopivat numerot.
- oireesi eivät parane, kun käytät SYMBICORT 160 mg -valmistetta säännöllisesti viikon ajan.
Mitkä ovat SYMBICORTin mahdolliset sivuvaikutukset?
SYMBICORT 4,5 mcg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Liian suuren LABA-lääkkeen käyttö voi aiheuttaa:
- rintakipu
- kohonnut verenpaine
- nopea ja epäsäännöllinen syke
- päänsärky
- vapina
- hermostuneisuus
- Sieni-infektio suussa tai kurkussa (sammas). Huuhtele suusi vedellä nielemättä SYMBICORT 4,5 mcg:n käytön jälkeen vähentääksesi sammasriskiäsi.
- Keuhkokuume ja muut alempien hengitysteiden infektiot. Keuhkoahtaumatautia sairastavilla ihmisillä on suurempi mahdollisuus saada keuhkokuume ja muita keuhkoinfektioita. Inhaloitavat kortikosteroidit voivat lisätä keuhkokuumeen riskiä. Soita terveydenhuollon tarjoajallesi, jos huomaat jonkin näistä oireista:
- liman (ysköksen) tuotannon lisääntyminen
- liman värin muutos
- kuume
- vilunväristykset
- lisääntynyt yskä
- lisääntyneet hengitysongelmat
- Immuunijärjestelmän vaikutukset ja suurempi mahdollisuus saada infektioita. Kerro terveydenhuollon tarjoajallesi kaikista infektion merkeistä, kuten:
- kuume
- kipu
- kehon särkyjä
- vilunväristykset
- väsynyt olo
- pahoinvointi
- oksentelua
- Lisämunuaisen vajaatoiminta. Lisämunuaisten vajaatoiminta on tila, jossa lisämunuaiset eivät tuota tarpeeksi steroidihormoneja. Tämä voi tapahtua, kun lopetat oraalisten kortikosteroidilääkkeiden käytön ja aloitat inhaloitavan kortikosteroidilääkityksen.
- Lisääntynyt hengityksen vinkuminen heti SYMBICORTin ottamisen jälkeen. Pidä aina mukanasi pelastusinhalaattori äkillisen hengityksen vinkumisen hoitoon.
- Vakavat allergiset reaktiot, mukaan lukien ihottuma, nokkosihottuma, kasvojen, suun ja kielen turvotus ja hengitysvaikeudet. Soita terveydenhuollon tarjoajallesi tai hakeudu ensiapuun, jos saat vakavan allergisen reaktion oireita.
- Alempi luun mineraalitiheys. Tämä voi tapahtua ihmisillä, joilla on suuri mahdollisuus alhaiseen luun mineraalitiheyteen (osteoporoosi). Terveydenhuollon tarjoajan tulee tarkistaa tämä SYMBICORT-hoidon aikana.
- Hidastunut kasvu lapsilla. Lapsen kasvua tulee tarkkailla säännöllisesti SYMBICORTia käytettäessä.
- Silmäongelmat, mukaan lukien glaukooma ja kaihi. Sinun tulee käydä säännöllisesti silmätutkimuksissa käyttäessäsi SYMBICORTia.
- Verisuonten turvotus. Tämä voi tapahtua astmaa sairastavilla ihmisillä. Kerro heti terveydenhuollon tarjoajallesi, jos sinulla on:
- pistelyn tunne tai
- flunssan kaltaiset oireet käsien tai jalkojen puutuminen
- poskionteloiden kipu ja turvotus
- ihottuma
- Veren kaliumpitoisuuden lasku (hypokalemia).
- Verensokeritason nousu (hyperglykemia).
SYMBICORTin yleisimpiä sivuvaikutuksia ovat:
Ihmiset, joilla on astma:
- kurkun ärsytystä
- päänsärky
- ylähengitysteiden infektio
- kurkkukipu
- poskionteloiden limakalvojen tulehdus
- flunssa (sinusiitti)
- nenän tukkoisuus
- selkäkipu
- oksentelua
- vatsakipu
- sammas suussa ja kurkussa. Huuhtele suusi vedellä nielemättä sitä käytön jälkeen, jotta vältyt sammalta
Ihmiset, joilla on COPD:
- kurkun ärsytystä.
- sammas suussa ja kurkussa. Huuhtele suusi vedellä nielemättä sitä käytön jälkeen, jotta vältyt sammalta.
- keuhkoputkien limakalvojen infektio ja tulehdus (keuhkoputkentulehdus).
- poskionteloiden limakalvojen tulehdus (sinusiitti).
- ylähengitysteiden infektio.
Kerro terveydenhuollon tarjoajallesi kaikista sivuvaikutuksista, jotka häiritsevät sinua tai jotka eivät katoa.
Nämä eivät ole kaikkia SYMBICORTin mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Voit myös ilmoittaa sivuvaikutuksista AstraZenecalle numerossa 1-800-236-9933.
Kuinka minun pitäisi säilyttää SYMBICORT?
- Säilytä SYMBICORTia huoneenlämmössä 20 - 25 °C (68–77 °F).
- Säilytä SYMBICORT suukappale alaspäin.
- SYMBICORT-säiliösi sisältö on paineen alaisena. Älä puhkaise tai heitä säiliötä tuleen tai polttouuniin. Älä käytä tai säilytä sitä lämmön tai avotulen lähellä. Säilytys yli 120 °F:n lämpötilassa voi aiheuttaa kapselin räjähtämisen.
- Hävitä SYMBICORT 160mg, kun laskuri saavuttaa nollan ("0") tai 3 kuukautta sen jälkeen, kun olet ottanut SYMBICORTin foliopussistaan sen mukaan, kumpi tulee ensin.
- Pidä SYMBICORT 4,5 mcg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa SYMBICORTin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä SYMBICORT 4,5 mikrogrammaa sairauteen, johon sitä ei ole määrätty. Älä anna SYMBICORTia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista tietoja SYMBICORT 4,5 mcg:stä, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia SYMBICORT 4.5mcg sisältää?
Vaikuttavat aineet: mikronisoitu budesonidi ja mikronisoitu formoterolifumaraattidihydraatti
Ei-aktiiviset aineet: hydrofluroalkaani (HFA 227), povidoni K25 USP ja polyetyleeniglykoli 1000 NF
Käyttöohjeet
SYMBICORT (SIM-bi-kort) (budesonidi 80 mcg ja formoterolifumaraattidihydraatti 4,5 mcg) Inhalaatioaerosoli
SYMBICORT (SIM-bi-kort) (budesonidi 160 mcg ja formoterolifumaraattidihydraatti 4,5 mcg) Inhalaatioaerosoli
Kuvio 1  Pystyasennossa
Pystyasennossa
Kuinka käyttää SYMBICORTia
Noudata alla olevia ohjeita käyttääksesi SYMBICORTia. Hengität sisään (hengität) lääkkeen. Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
SYMBICORT-inhalaattorin valmistelu käyttöä varten
Kuva 2 
5. Täytä SYMBICORT-inhalaattorisi
Ennen kuin käytät SYMBICORTia ensimmäistä kertaa, sinun on esivalmistettava se. Täytä SYMBICORT 160mg pitämällä sitä pystyasennossa. Katso kuva 1. Ravista SYMBICORT 4,5 mikrogramman inhalaattoria hyvin 5 sekunnin ajan. Pidä SYMBICORT 160 mg -inhalaattoria itsestäsi poispäin ja paina lujasti ja kokonaan SYMBICORT 160 mg -inhalaattorin tiskin yläosaa, jolloin testisuihke vapautuu. Ravista sitten uudelleen 5 sekuntia ja vapauta toinen testisuihku. SYMBICORT 160 mg inhalaattorisi on nyt valmis ja käyttövalmis. Kun olet täyttänyt SYMBICORT-inhalaattorin ensimmäisen kerran, laskuri näyttää joko 120 tai 60 sen mukaan, mikä koko sinulle toimitettiin.
Jos et käytä SYMBICORT-inhalaattoria yli 7 päivään tai jos pudotat sen, sinun on täytettävä uudelleen.
Kuinka pitää SYMBICORT 160 mg inhalaattoria käyttöä varten
Kuva 3 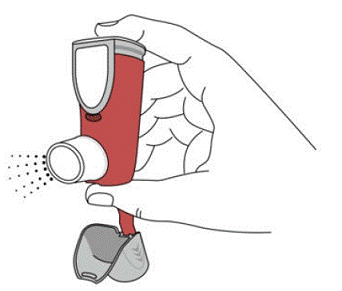
TAI
Kuva 4 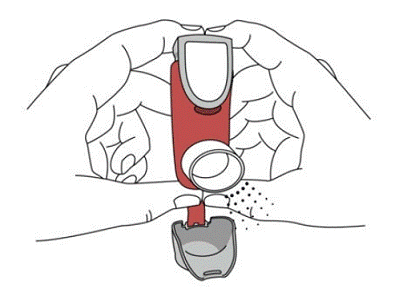
SYMBICORT-inhalaattorin käyttäminen
6. Ravista SYMBICORT 160 mg inhalaattoria hyvin 5 sekunnin ajan. Irrota suukappaleen suojus. Tarkista, ettei suukappaleessa ole vieraita esineitä.
7. Hengitä ulos kokonaan (hengitä ulos). Pidä SYMBICORT-inhalaattoria suutasi vasten. Aseta valkoinen suukappale kokonaan suuhusi ja sulje huulet sen ympärille. Varmista, että SYMBICORT 4,5 mikrogramman inhalaattori on pystyasennossa ja että suukappaleen aukko osoittaa kurkkusi takaosaan (katso kuva 5).
Kuva 5 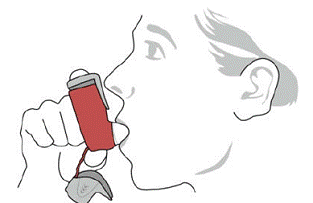
8. Hengitä sisään (hengitä) syvään ja hitaasti suun kautta. Paina lujasti ja kokonaan SYMBICORT-inhalaattorin tiskin yläosaa vapauttaaksesi lääke (ks. kuvat 3 ja 4).
9. Jatka sisäänhengittämistä (hengitä) ja pidätä hengitystäsi noin 10 sekuntia tai niin kauan kuin tuntuu mukavalta. Ennen kuin hengität ulos (hengitä ulos), vapauta sormesi tiskin yläosasta. Pidä SYMBICORT-inhalaattori pystyasennossa ja poista se suustasi.
10. Ravista SYMBICORT-inhalaattoria uudelleen 5 sekunnin ajan ja toista vaiheet 7–9.
SYMBICORT-inhalaattorin käytön jälkeen
11. Sulje käytön jälkeen suukappaleen kansi painamalla, kunnes se napsahtaa paikalleen.
12. Kun olet lopettanut SYMBICORT-valmisteen ottamisen (2 hengittämistä), huuhtele suusi vedellä. Sylje vesi ulos. Älä niele sitä.
Laskurin lukeminen
- SYMBICORT-inhalaattorin yläosassa oleva tiskin nuoli osoittaa inhalaattorissasi jäljellä olevien inhalaatioiden määrää.
LASKURI 
- Laskuri laskee alas joka kerta, kun vapautat lääkehuipun (joko SYMBICORT-inhalaattorin esivalmistelussa tai lääkkeen ottamisen yhteydessä).
- Kun tiskin nuoli lähestyy arvoa 20, huomaat alkavan keltaisen alueen, joka ilmoittaa, että on aika soittaa terveydenhuollon tarjoajalle täyttöä varten.
LASKURI 
- On tärkeää, että kiinnität huomiota SYMBICORT 160 mg -inhalaattoriin jäljellä olevien inhalaatioiden (suihkujen) määrään lukemalla laskurin. Hävitä SYMBICORT, kun laskuri näyttää nollaa ("0") tai 3 kuukautta sen jälkeen, kun olet ottanut SYMBICORT 160 mg -inhalaattorin foliopussista sen mukaan, kumpi tulee ensin. SYMBICORT-inhalaattorisi ei ehkä tunnu tyhjältä ja se saattaa jatkaa toimintaansa, mutta et saa oikeaa lääkemäärää, jos jatkat sen käyttöä. Käytä uutta SYMBICORT-inhalaattoria ja noudata esikäsittelyohjeita (katso ohje 5 yllä).
Kuinka puhdistaa SYMBICORT-inhalaattorisi
Puhdista SYMBICORT 4,5 mikrogramman inhalaattorisi valkoinen suukappale 7 päivän välein. Suukappaleen puhdistaminen:
- Irrota harmaa suukappaleen kansi
- Pyyhi valkoisen suukappaleen aukon sisä- ja ulkopuoli puhtaalla, kuivalla liinalla
- Aseta suukappaleen suojus takaisin paikalleen
- Älä laita SYMBICORT-inhalaattoria veteen
- Älä yritä purkaa omaasi SYMBICORT inhalaattori
Nämä potilastiedot ja käyttöohjeet ovat Yhdysvaltain elintarvike- ja lääkeviraston hyväksymiä.
