Pulmicort 100mcg, 200mcg Budesonide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Pulmicort 100mcg Turbuhaler on ja miten sitä käytetään?
Pulmicort 100mcg Turbuhaler on reseptilääke, jota käytetään astman oireiden hoitoon. Pulmicort 100mcg Turbuhaleria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Pulmicort Turbuhaler kuuluu lääkeryhmään nimeltä kortikosteroidit, inhalantit.
Ei tiedetä, onko Pulmicort Turbuhaler turvallinen ja tehokas alle 1-vuotiaille lapsille.
Mitkä ovat Pulmicort 200mcg Turbuhalerin mahdolliset sivuvaikutukset?
Pulmicort 100mcg Turbuhaler voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- epätavallinen väsymys,
- näköongelmia,
- helppo mustelma tai verenvuoto,
- turvonneet kasvot,
- epätavallinen hiusten kasvu,
- mielialan muutoksia,
- masennus,
- mielialan vaihtelut,
- agitaatio,
- lihasheikkous tai kipu,
- ihon oheneminen,
- hidas haavan paraneminen ja
- lisääntynyt jano tai virtsaaminen
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Pulmicort 100mcg Turbuhalerin yleisimmät sivuvaikutukset ovat:
- kuiva, ärtynyt tai kipeä kurkku,
- käheys,
- ääni muuttuu,
- paha maku suussa,
- vuotava tai tukkoinen nenä ja
- nenäverenvuoto
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Pulmicort Turbuhalerin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Vain suun kautta hengitettynä.
KUVAUS
Budesonidi, PULMICORT TURBUHALERin (budesonidi) 200 mikrogramman aktiivinen komponentti, on kortikosteroidi, joka on kemiallisesti nimetty (RS)-11β, 16α, 17,21-tetrahydroksipregna-1,4-dieeni-3,20-dioni sykliseksi 16,17- asetaali butyraldehydin kanssa. Budesonidia tarjotaan kahden epimeerin (22R ja 22S) seoksena. Budesonidin empiirinen kaava on C25H34O6 ja sen molekyylipaino on 430,5. Sen rakennekaava on:
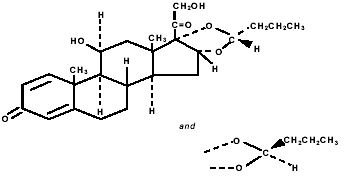
Budesonidi on valkoinen tai luonnonvalkoinen, mauton, hajuton jauhe, joka on käytännössä liukenematon veteen ja heptaaniin, liukenee niukasti etanoliin ja liukenee vapaasti kloroformiin. Sen jakaantumiskerroin oktanolin ja veden välillä pH:ssa 7,4 on 1,6 x 103.
PULMICORT 100mcg TURBUHALER (budesonidi) on inhalaatiokäyttöinen usean annoksen kuivajauheinhalaattori, joka sisältää vain mikronisoitua budesonidia. Jokainen PULMICORT 100 mikrogramman TURBUHALERin painallus antaa 200 mikrogrammaa budesonidia mitattua annosta kohti, mikä vapauttaa noin 160 mikrogrammaa budesonidia suukappaleesta (perustuu in vitro -testiin 60 l/min 2 sekunnin ajan).
In vitro -testit ovat osoittaneet, että PULMICORT 100 mikrogramman TURBUHALER (budesonidi) annostelu riippuu olennaisesti laitteen läpi kulkevasta ilmavirrasta. Potilastekijät, kuten sisäänhengityksen virtausnopeudet, vaikuttavat myös potilaiden keuhkoihin kuljetettavaan annokseen todellisessa käytössä (ks. Potilaan käyttöohjeet ). Aikuisilla astmapotilailla (keskimääräinen FEV1 2,9 l [0,8 - 5,1 l]) keskimääräinen huippuinspiratorinen virtaus (PIF) PULMICORT TURBUHALERin (budesonidi) läpi oli 78 (40-111) l/min. Samanlaisia tuloksia (keskimääräinen PIF 82 [43-125] l/min) saatiin astmaa sairastavilla lapsilla (6-15 vuotta, keskimääräinen FEV1 2,1 l [0,9 - 5,4 l]). Potilaita tulee neuvoa huolellisesti tämän lääkevalmisteen käytöstä optimaalisen annostelun varmistamiseksi.
INDIKAATIOT
PULMICORT TURBUHALER (budesonidi) on tarkoitettu astman ylläpitohoitoon profylaktisena hoitona vähintään kuuden vuoden ikäisille aikuis- ja lapsipotilaille. Se on tarkoitettu myös potilaille, jotka tarvitsevat oraalista kortikosteroidihoitoa astmaan. Monet näistä potilaista voivat ajan myötä pystyä vähentämään tai poistamaan oraalisten kortikosteroidien tarvetta.
PULMICORT 100mcg TURBUHALER (budesonidi) EI ole tarkoitettu akuutin bronkospasmin lievitykseen.
ANNOSTELU JA HALLINNOINTI
PULMICORT 200 mcg TURBUHALER (budesonidi) tulee antaa suun kautta hengitettynä 6-vuotiaille ja sitä vanhemmille astmapotilaille. Yksittäiset potilaat kokevat vaihtelevan alkamisen ja oireiden helpotuksen. Yleensä PULMICORT TURBUHALERilla (budesonidi) on suhteellisen nopea vaikutus inhaloitavan kortikosteroidin suhteen. Astman hallinnan paraneminen PULMICORT 200 mikrogramman TURBUHALERin (budesonidi) inhaloinnin jälkeen voi tapahtua 24 tunnin kuluessa hoidon aloittamisesta, vaikka suurinta hyötyä ei ehkä saavuteta 1-2 viikon tai pidempään. PULMICORT TURBUHALERin (budesonidi) turvallisuutta ja tehoa suositeltuja annoksia suurempina annettaessa ei ole varmistettu.
PULMICORT TURBUHALERin (budesonidi) suositeltu aloitusannos ja suurin suositeltu annos, joka perustuu aikaisempaan astmahoitoon, on lueteltu seuraavassa taulukossa.
*Potilailla, joilla on lievä tai kohtalainen astma ja jotka ovat hyvin hallinnassa inhaloitavilla kortikosteroideilla, voidaan harkita PULMICORT 100 mikrogramman TURBUHALER (budesonidi) 200 mikrogrammaa tai 400 mikrogrammaa kerran vuorokaudessa antamista. PULMICORT 200mcg TURBUHALER (budesonidi) voidaan antaa kerran päivässä joko aamulla tai illalla.
Jos kerran vuorokaudessa annettava PULMICORT 200 mikrogramman TURBUHALER (budesonidi) -hoito ei takaa astman oireiden riittävää hallintaa, vuorokausiannosta tulee suurentaa ja/tai annostella jaettuna.
Potilaat, jotka saavat kroonista oraalista kortikosteroidia
Aluksi PULMICORT TURBUHALER (budesonidi) tulee käyttää samanaikaisesti potilaan tavanomaisen systeemisen kortikosteroidin ylläpitoannoksen kanssa. Noin viikon kuluttua systeemisen kortikosteroidin asteittainen lopettaminen aloitetaan vähentämällä päivittäistä tai vaihtoehtoista vuorokausiannosta. Seuraava vähennys tehdään yhden tai kahden viikon kuluttua potilaan vasteesta riippuen. Yleensä nämä vähennykset eivät saa ylittää 2,5 mg prednisonia tai sitä vastaavaa. Hidas vetäytymisnopeus on erittäin suositeltavaa. Suun kautta otettavien kortikosteroidien vähentämisen aikana potilaita tulee tarkkailla huolellisesti astman epävakauden varalta, mukaan lukien objektiiviset hengitysteiden toiminnan mittaukset, sekä lisämunuaisten vajaatoiminnan varalta (ks. VAROITUKSET ). Vieroituksen aikana joillakin potilailla saattaa esiintyä systeemisen kortikosteroidivieroitusoireita, kuten nivel- ja/tai lihaskipua, väsymystä ja masennusta huolimatta keuhkojen toiminnan ylläpidosta tai jopa paranemisesta. Tällaisia potilaita tulee rohkaista jatkamaan PULMICORT TURBUHALERin (budesonidi) käyttöä, mutta heitä on seurattava lisämunuaisten vajaatoiminnan objektiivisten merkkien varalta. Jos lisämunuaisten vajaatoimintaa ilmenee, systeemisiä kortikosteroidiannoksia on suurennettava tilapäisesti ja sen jälkeen lopettamista on jatkettava hitaammin. Stressin tai vakavan astmakohtauksen aikana siirtopotilaat saattavat tarvita lisähoitoa systeemisillä kortikosteroideilla.
MERKINTÄ: Kaikilla potilailla on toivottavaa titrata pienin tehokas annos, kun astma on vakaa.
Käyttöohjeet
Kuvitetut potilasohjeet käytettäväksi jokaisen PULMICORT 200mcg TURBUHALER (budesonidi) -pakkauksen mukana.
Potilaita tulee neuvoa esittelemään PULMICORT TURBUHALER (budesonidi) ennen sen ensimmäistä käyttöä ja opastamaan hengittämään syvään ja voimakkaasti joka kerta, kun yksikköä käytetään. Suun huuhtelua suositellaan myös inhalaation jälkeen.
MITEN TOIMITETAAN
PULMICORT TURBUHALER (budesonidi) koostuu useista kootuista muoviosista, joista pääosat ovat annostelumekanismi, lääkeaineen säilytysyksikkö ja suukappale. Inhalaattoria suojaa valkoinen putkimainen ulkokansi, joka on ruuvattu inhalaattoriin. Inhalaattorin runko on valkoinen ja kääntökahva ruskea. Kädensijaan on painettu seuraava teksti korotetuin kirjaimin "Pulmicort™ 200 mcg". TURBUHALER-inhalaattoria ei voi täyttää uudelleen, ja se tulee hävittää tyhjänä.
PULMICORT TURBUHALER (budesonidi) on saatavana 200 mikrog/annos, 200 annosta (NDC 0186-0915-42) ja sen täyttöpaino on 104 mg.
Kun PULMICORT 200mcg TURBUHALER (budesonidi) -valmisteessa on jäljellä 20 annosta, ilmaisinikkunaan tulee punainen merkki. Jos yksikköä käytetään kauemmin kuin punainen merkki ilmestyy ikkunan alareunaan, oikeaa lääkemäärää ei ehkä saada. Laite tulee hävittää.
Säilytä kansi kiristettynä kuivassa paikassa valvotussa huoneenlämpötilassa 20-25 °C (68-77 °F) [katso USP]. Pidä poissa lasten ulottuvilta.
Kaikki tavaramerkit ovat AstraZeneca-konsernin omaisuutta. ©AstraZeneca 2001, 2006. Valmistettu: AstraZeneca LP, Wilmington, DE 19850 Tekijä: AstraZeneca AB, Sodertalje, Ruotsi 33020-00. Rev. 10/06. FDA Rev date: 20/8/2007
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia raportoitiin potilailla, joita hoidettiin PULMICORT 100 mcg TURBUHALERilla (budesonidi).
Yleisten haittavaikutusten ilmaantuvuus perustuu kaksoissokkoutettuihin, lumekontrolloituihin kliinisiin Yhdysvalloissa tehtyihin tutkimuksiin, joissa 1116 aikuista ja 6–70-vuotiasta lapsipotilasta (472 naista ja 644 miestä) hoidettiin PULMICORT TURBUHALERilla (budesonidi) (200–800). mikrogrammaa kahdesti päivässä 12-20 viikon ajan) tai lumelääkettä.
Seuraavassa taulukossa on esitetty haittavaikutusten ilmaantuvuus potilailla, jotka ovat aiemmin saaneet keuhkoputkia laajentavia lääkkeitä ja/tai inhaloitavia kortikosteroideja Yhdysvalloissa kontrolloiduissa kliinisissä tutkimuksissa. Tähän populaatioon kuului 232 mies- ja 62 naispuolista lapsipotilasta (ikä 6–17 vuotta) ja 332 mies- ja 331 naispuolista aikuispotilasta (18-vuotiaat ja sitä vanhemmat).
PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi) käyttävien potilaiden raportoimat haittatapahtumat, joiden ilmaantuvuus on ≥ 3 %
Yllä oleva taulukko sisältää kaikki tapahtumat (riippumatta siitä, katsoivatko tutkijat lääkkeeseen liittyviksi tai ei-lääkkeeksi), joita esiintyi ≥3 % missä tahansa PULMICORT TURBUHALER (budesonidi) -ryhmässä ja jotka olivat yleisempiä kuin lumeryhmässä. Näitä tietoja tarkasteltaessa on otettava huomioon PULMICORT 200 mikrogrammaa TURBUHALER (budesonidi) -potilaiden keskimääräinen altistuksen kesto.
Seuraavia muita haittavaikutuksia esiintyi näissä kliinisissä tutkimuksissa, joissa käytettiin PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi), ilmaantuvuus 1–3 %, ja ne olivat yleisempiä PULMICORT 200 mikrogrammaa TURBUHALER (budesonidi) saaneessa kuin lumelääkkeessä.
Keho kokonaisuutena: Niskakipu
Sydän: pyörtymä
Ruoansulatus: vatsakipu, suun kuivuminen, oksentelu
Aineenvaihdunta ja ravitsemus: painonnousu
Tuki- ja liikuntaelimistö: murtuma, myalgia
Hermostunut: hypertonia, migreeni
Verihiutaleet, verenvuoto ja hyytyminen: mustelma
Psykiatrinen: unettomuus
Vastusmekanismit: infektio
Erityiset aistit: makuperversio
20 viikkoa kestäneessä tutkimuksessa aikuisilla astmaatikoilla, jotka tarvitsivat aiemmin suun kautta otettavia kortikosteroideja, PULMICORT TURBUHALER (budesonidi) 400 mikrogrammaa kahdesti vuorokaudessa (N=53) ja 800 mikrogrammaa kahdesti vuorokaudessa (N=53) vaikutuksia verrattiin lumelääkkeeseen (N=53). ) ilmoitettujen haittatapahtumien esiintymistiheydestä. Haittatapahtumat, jotka ovat raportoitu yli viidellä potilaalla PULMICORT 200 mcg TURBUHALER (budesonidi) -ryhmässä, olivatpa tutkijoiden mielestä lääkkeisiin liittyviä tai ei-liittyviä ja joita esiintyi useammin PULMICORT TURBUHALER (budesonidi) kuin lumelääkettä käytettäessä, on esitetty alla. % PULMICORT TURBUHALER (budesonidi) ja % lumelääke). Näitä tietoja tarkasteltaessa on otettava huomioon PULMICORT 200 mikrogramman TURBUHALER (budesonidi) potilaiden keskimääräinen altistuksen kesto (78 päivää PULMICORT TURBUHALER (budesonidi) vs. 41 päivää lumelääkkeellä).
Potilaat, jotka saavat PULMICORT TURBUHALER (budesonidia) kerran päivässä
Haittavaikutusten profiilia annettaessa PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi) 200 mikrog ja 400 mikrogrammaa kerran vuorokaudessa sekä lumelääkettä arvioitiin 309 aikuisella astmapotilaalla 18 viikkoa kestäneessä tutkimuksessa. Tutkimuspopulaatiossa oli sekä potilaita, joita oli aiemmin hoidettu inhaloitavilla kortikosteroideilla, että potilaita, jotka eivät olleet aiemmin saaneet kortikosteroidihoitoa. Haittavaikutusten rakenteessa ei ollut kliinisesti merkittävää eroa PULMICORT 200 mikrogramman TURBUHALERin (budesonidi) kerran vuorokaudessa antamisen jälkeen verrattuna kahdesti vuorokaudessa tapahtuvaan annokseen.
Pediatriset tutkimukset: 12 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa, johon osallistui 404 6-18-vuotiasta lapsipotilasta, jotka saivat aiemmin inhaloitavia kortikosteroideja, haittatapahtumien esiintymistiheys kussakin ikäluokassa (6-12-vuotiaat, 13-18-vuotiaat) oli vertailukelpoinen PULMICORT TURBUHALERin kanssa. (budesonidi) (100, 200 ja 400 mikrogrammaa kahdesti päivässä) ja lumelääkettä. Lapsilla ei havaittu kliinisesti merkittäviä eroja haittavaikutusten rakenteessa tai vakavuudessa aikuisilla raportoituihin verrattuna.
Haittatapahtumaraportit muista lähteistä: Harvinaisia haittatapahtumia, joita on raportoitu julkaistussa kirjallisuudessa tai maailmanlaajuisesta markkinointikokemuksesta minkä tahansa inhaloitavan budesonidin formulaatiolla, ovat: välittömät ja viivästyneet yliherkkyysreaktiot, mukaan lukien ihottuma, kosketusihottuma, nokkosihottuma, angioedeema ja bronkospasmi; hypokortismin ja hyperkortismin oireet; glaukooma, kaihi; psykiatriset oireet mukaan lukien masennus, aggressiiviset reaktiot, ärtyneisyys, ahdistuneisuus ja psykoosi.
HUUMEIDEN VUOROVAIKUTUKSET
Kliinisissä tutkimuksissa budesonidin ja muiden astman hoidossa yleisesti käytettyjen lääkkeiden samanaikainen käyttö ei ole johtanut haittavaikutusten esiintymistiheyden lisääntymiseen. Budesonidin, samoin kuin muiden kortikosteroidien, pääasiallinen metabolia on sytokromi P450 (CYP) isoentsyymi 3A4 (CYP3A4) kautta. Ketokonatsolin, voimakkaan CYP3A4:n estäjän, oraalisen annon jälkeen suun kautta annetun budesonidin keskimääräinen plasmapitoisuus nousi. Muiden tunnettujen CYP3A4:n estäjien (esim. itrakonatsoli, klaritromysiini, erytromysiini jne.) samanaikainen anto saattaa estää budesonidin metaboliaa ja lisätä systeemistä altistusta budesonidialle. Varovaisuutta tulee noudattaa, kun budesonidia annetaan yhdessä pitkäaikaisen ketokonatsolin ja muiden tunnettujen CYP3A4-estäjien kanssa.
VAROITUKSET
Erityistä varovaisuutta tarvitaan potilailla, jotka siirtyvät systeemisesti aktiivisista kortikosteroideista PULMICORT 200mcg TURBUHALERiin (budesonidi), koska astmapotilailla on esiintynyt lisämunuaisten vajaatoiminnasta johtuvia kuolemia systeemisistä kortikosteroideista vähemmän systeemisesti saatavilla oleviin inhaloitaviin kortikosteroideihin siirtymisen aikana. Systeemisten kortikosteroidien käytön lopettamisen jälkeen tarvitaan useita kuukausia hypotalamus-aivolisäke-lisämunuaisen (HPA) toiminnan palautumiseen.
Potilaat, jotka ovat saaneet aiemmin 20 mg:aa tai enemmän prednisonia (tai vastaavaa) päivässä, voivat olla herkimpiä, etenkin kun heidän systeemiset kortikosteroidinsa on lopetettu lähes kokonaan. Tänä HPA-suppression aikana potilailla saattaa ilmetä lisämunuaisten vajaatoiminnan merkkejä ja oireita, kun he joutuvat alttiiksi traumalle, leikkaukselle tai infektiolle (erityisesti gastroenteriitille) tai muille tiloille, jotka liittyvät vakavaan elektrolyyttihäviöön. Vaikka PULMICORT TURBUHALER (budesonidi) saattaa hallita astman oireita näiden jaksojen aikana, se antaa suositeltuina annoksina normaalia pienempiä fysiologisia määriä glukokortikoidia systeemisesti eikä tarjoa mineralokortikoidiaktiivisuutta, joka on tarpeen näiden hätätilanteiden selvittämiseksi.
Stressin tai vakavan astmakohtauksen aikana potilaita, joilta on lopetettu systeemisten kortikosteroidien käyttö, tulee neuvoa jatkamaan suun kautta otettavia kortikosteroideja (suurina annoksina) välittömästi ja ottamaan yhteyttä lääkäriinsä lisäohjeita varten. Näitä potilaita tulee myös neuvoa kantamaan mukanaan lääketieteellistä henkilökorttia, joka osoittaa, että he saattavat tarvita täydentäviä systeemisiä kortikosteroideja stressijaksojen tai vakavan astmakohtauksen aikana.
Potilaat, jotka tarvitsevat suun kautta otettavia kortikosteroideja, tulee vieroittaa hitaasti systeemisestä kortikosteroidien käytöstä siirryttyään PULMICORT 100 mcg TURBUHALERiin (budesonidi). Keuhkojen toimintaa (FEV1 tai AM PEF), beeta-agonistien käyttöä ja astmaoireita tulee seurata huolellisesti suun kautta otettavien kortikosteroidien käytön lopettamisen aikana. Astman merkkien ja oireiden seurannan lisäksi potilaita tulee tarkkailla lisämunuaisten vajaatoiminnan merkkien ja oireiden varalta, kuten väsymys, väsymys, heikkous, pahoinvointi ja oksentelu sekä hypotensio.
Potilaiden siirtyminen systeemisestä kortikosteroidihoidosta PULMICORT 200 mcg TURBUHALERiin (budesonidi) voi paljastaa allergisia tiloja, jotka systeeminen kortikosteroidihoito on aiemmin tukahduttanut, esim. nuha, sidekalvotulehdus, niveltulehdus, eosinofiiliset tilat ja ekseema (ks. ANNOSTELU JA HALLINNOINTI ).
Potilaat, jotka käyttävät immuunijärjestelmää heikentäviä lääkkeitä, ovat alttiimpia infektioille kuin terveet henkilöt. Esimerkiksi vesirokko ja tuhkarokko voivat edetä vakavammin tai jopa kuolemaan herkillä lapsipotilailla tai aikuisilla, jotka saavat immunosuppressiivisia kortikosteroidiannoksia. Lapsi- tai aikuispotilailla, joilla ei ole ollut näitä sairauksia, on oltava erityisen varovainen altistumisen välttämiseksi. Ei tiedetä, miten kortikosteroidien annos, reitti ja kesto vaikuttavat leviävän infektion kehittymisriskiin. Perussairauden ja/tai aiemman kortikosteroidihoidon osuutta riskiin ei myöskään tunneta. Jos altistuminen altistuu, hoito varicella zoster -immunoglobuliinilla (VZIG) tai yhdistetyllä suonensisäisellä immunoglobuliinilla (IVIG) voi olla tarpeen. Jos altistuminen tuhkarokkolle, ehkäisy yhdistetyn intramuskulaarisen immunoglobuliinin (IG) avulla voi olla aiheellista. (Katso VZIG:n ja IG:n täydelliset reseptitiedot vastaavista pakkausselosteista.) Jos vesirokko kehittyy, hoitoa viruslääkkeillä voidaan harkita.
PULMICORT 200mcg TURBUHALER (budesonidi) ei ole keuhkoputkia laajentava aine, eikä sitä ole tarkoitettu bronkospasmin tai muiden akuuttien astmakohtausten nopeaan lievitykseen.
Kuten muitakin inhaloitavia astmalääkkeitä käytettäessä, bronkospasmia, johon liittyy välitöntä hengityksen vinkumista, voi esiintyä annostelun jälkeen. Jos bronkospasmi ilmenee PULMICORT TURBUHALER (budesonidi) -annoksen jälkeen, se tulee hoitaa välittömästi nopeasti vaikuttavalla inhaloitavalla keuhkoputkia laajentavalla lääkkeellä. PULMICORT TURBUHALER (budesonidi) -hoito on lopetettava ja aloitettava vaihtoehtoinen hoito.
Potilaita tulee neuvoa ottamaan yhteyttä lääkäriin välittömästi, kun PULMICORT TURBUHALER (budesonidi) -hoidon aikana ilmenee astmakohtauksia, jotka eivät reagoi heidän tavanomaisiin keuhkoputkia laajentaviin annoksiin. Tällaisten jaksojen aikana potilaat saattavat tarvita oraalista kortikosteroidihoitoa.
VAROTOIMENPITEET
Kenraali
Suun kautta otettavien kortikosteroidien käytön lopettamisen aikana joillakin potilailla saattaa esiintyä systeemisesti aktiivisten kortikosteroidien vieroitusoireita, kuten nivel- ja/tai lihaskipua, väsymystä ja masennusta huolimatta hengitystoiminnan ylläpitämisestä tai jopa paranemisesta (ks. ANNOSTELU JA HALLINNOINTI ).
Responsiivisilla potilailla PULMICORT TURBUHALER (budesonidi) voi mahdollistaa astmaoireiden hallinnan vähentämällä HPA-akselin toimintaa vähemmän kuin terapeuttisesti vastaavat oraaliset prednisoniaannokset. Koska budesonidi imeytyy verenkiertoon ja voi olla systeemisesti aktiivista, PULMICORT 100mcg TURBUHALERin (budesonidin) suotuisat vaikutukset HPA:n toimintahäiriön minimoimisessa voidaan odottaa vain silloin, kun suositeltuja annoksia ei ylitetä ja yksittäiset potilaat titrataan pienimpään tehokkaaseen annokseen. Koska yksilöllinen herkkyys vaikutuksille kortisolin tuotantoon on olemassa, lääkäreiden tulee ottaa nämä tiedot huomioon määrätessään PULMICORT 100mcg TURBUHALER (budesonidi).
Koska inhaloitavien kortikosteroidien systeeminen imeytyminen on mahdollista, potilaita, joita hoidetaan PULMICORT 200 mikrogrammaa TURBUHALERilla (budesonidi), tulee tarkkailla huolellisesti mahdollisten systeemisten kortikosteroidivaikutusten varalta. Erityistä varovaisuutta tulee noudattaa potilaiden tarkkailussa leikkauksen jälkeen tai stressijaksojen aikana lisämunuaisen riittämättömän vasteen varalta.
On mahdollista, että systeemisiä kortikosteroidivaikutuksia, kuten hyperkortisismi, alentunut luun mineraalitiheys ja lisämunuaisten vajaatoiminta, voi ilmaantua pienelle määrälle potilaita, erityisesti suurempia annoksia käytettäessä. Jos tällaisia muutoksia ilmenee, PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi) annosta tulee vähentää hitaasti astman oireiden hallintaan ja systeemisten steroidien vähentämiseen liittyvien hyväksyttyjen menetelmien mukaisesti.
Suun kautta inhaloitavat kortikosteroidit, mukaan lukien budesonidi, voivat hidastaa kasvunopeutta, kun niitä annetaan lapsipotilaille. Kasvunopeuden hidastuminen voi johtua astman riittämättömästä hallinnasta tai kortikosteroidien käytöstä hoidossa. Pitkäaikaisen hoidon mahdollisia vaikutuksia kasvunopeuteen tulee punnita suhteessa saavutettuihin kliinisiin hyötyihin ja vaihtoehtoisiin hoitoihin liittyviin riskeihin. Suun kautta hengitettävien kortikosteroidien systeemisten vaikutusten minimoimiseksi, mukaan lukien PULMICORT 200 mcg TURBUHALER (budesonidi), jokainen potilas tulee titrata hänen pienimpään tehokkaaseen annokseensa (ks. VAROTOIMET, Lastenkäyttö ).
Vaikka kliinisissä tutkimuksissa osallistuvat potilaat ovat saaneet PULMICORT TURBUHALER (budesonidi) jatkuvasti 1–2 vuoden ajan, PULMICORT 200 mikrogramman TURBUHALERin (budesonidi) pitkäaikaisia paikallisia ja systeemisiä vaikutuksia ihmisillä ei tunneta täysin. Erityisesti PULMICORT TURBUHALERin (budesonidin) pitkäaikaisen käytön vaikutuksia kehitys- tai immunologisiin prosesseihin suussa, nielussa, henkitorvessa ja keuhkoissa ei tunneta.
PULMICORT TURBUHALERilla (budesonidi) tehdyissä kliinisissä tutkimuksissa joillakin potilailla esiintyi paikallisia Candida albicans -infektioita suussa ja nielussa. Nämä infektiot voivat vaatia hoitoa asianmukaisella sienilääkkeellä ja/tai PULMICORT TURBUHALER (budesonidi) -hoidon lopettamista.
Inhaloitavia kortikosteroideja tulee käyttää varoen, jos ollenkaan, potilailla, joilla on aktiivinen tai lepotilassa oleva hengitysteiden tuberkuloosiinfektio, hoitamaton systeeminen sieni-, bakteeri-, virus- tai loisinfektio tai silmän herpes simplex.
Harvinaisia tapauksia glaukoomasta, kohonneesta silmänsisäisestä paineesta ja kaihista on raportoitu kortikosteroidien inhaloitavan annon jälkeen.
Tietoa potilaille
PULMICORT TURBUHALERilla (budesonidi) hoidettavien potilaiden tulee saada seuraavat tiedot ja ohjeet. Näiden tietojen tarkoituksena on auttaa potilasta lääkkeen turvallisessa ja tehokkaassa käytössä. Se ei ole kaikkien mahdollisten haitallisten tai suunniteltujen vaikutusten paljastaminen. Jotta PULMICORT 200mcg TURBUHALER (budesonidi) voidaan käyttää oikein ja saavuttaa maksimaalinen parannus, potilaan tulee lukea ja noudattaa mukana toimitettuja ohjeita. Potilaan ohjeet varovaiseen käyttöön.
- Potilaiden tulee käyttää PULMICORT 200mcg TURBUHALER (budesonidia) säännöllisin väliajoin ohjeiden mukaisesti, koska sen teho riippuu säännöllisestä käytöstä. Potilas ei saa muuttaa hänelle määrättyä annosta, ellei lääkäri kehota tekemään niin.
- Potilaita tulee kertoa, että PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi) ei ole keuhkoputkia laajentava lääke eikä sitä ole tarkoitettu akuuttien tai hengenvaarallisten astmakohtausten hoitoon.
- Potilaita tulee kertoa, että PULMICORT 100mcg TURBUHALER (budesonidi) teho riippuu laitteen asianmukaisesta käytöstä ja inhalaatio-antotekniikasta:
- 1. PULMICORT TURBUHALER (budesonidi) on oltava pystyasennossa (suukappale päällä) lataamisen aikana oikean annoksen saamiseksi.
- 2. PULMICORT 100mcg TURBUHALER (budesonidi) on esikäsiteltävä, kun yksikköä käytetään ensimmäistä kertaa. Yksikön esikäsittelyä varten sitä on pidettävä pystyasennossa ja ruskea kahva käännetty kokonaan oikealle ja sitten kokonaan vasemmalle, kunnes se napsahtaa. Toistaa.
- 3. Ensimmäisen annoksen lataamiseksi kahvaa on käännettävä kokonaan oikealle ja kokonaan vasemmalle, kunnes se napsahtaa.
- 4. Ensimmäisen annoksen jälkeen yksikköä ei tarvitse esitellä. Se on kuitenkin ladattava pystyasentoon välittömästi ennen käyttöä edellä kuvatulla tavalla.
- 5. Potilaita tulee neuvoa olemaan ravistamatta inhalaattoria.
- Potilaiden tulee asettaa suukappale huulten väliin ja hengittää voimakkaasti ja syvään. Tämän jälkeen jauhe toimitetaan keuhkoihin.
- Potilaat eivät saa hengittää ulos PULMICORT TURBUHALERin (budesonidi) kautta.
- Jauheen pienestä tilavuudesta johtuen potilas ei ehkä maista tai tunne keuhkoihin joutuvan lääkkeen läsnäoloa hengittäessään TURBUHALER-inhalaattorista. Tämä tuntemattomuus ei osoita, että potilas ei saa hyötyä PULMICORT TURBUHALER (budesonidi) -hoidosta.
- Potilaita tulee kertoa, että suun huuhteleminen vedellä ilman nielemistä jokaisen annoksen jälkeen voi vähentää suun kandidiaasin kehittymisen riskiä.
- Potilaita tulee neuvoa, että he saavat uuden PULMICORT TURBUHALER (budesonidi) -yksikön joka kerta, kun he täyttävät reseptinsä. Potilaita tulee neuvoa hävittämään koko laite, kun merkitty määrä inhalaatioita on käytetty. Kun PULMICORT TURBUHALERissa (budesonidi) on jäljellä 20 annosta, ilmaisinikkunaan tulee punainen merkki.
- PULMICORT TURBUHALER (budesonidi) ei saa käyttää välikappaleen kanssa.
- Suukappaletta ei saa purra tai pureskella.
- Kansi on asetettava tiukasti takaisin jokaisen avaamisen jälkeen.
- Potilaiden tulee pitää PULMICORT TURBUHALER (budesonidi) aina puhtaana ja kuivana.
- Potilaita tulee kertoa, että astman hallinnan paraneminen PULMICORT TURBUHALERin (budesonidi) inhalaation jälkeen voi tapahtua 24 tunnin kuluessa hoidon aloittamisesta, vaikka suurinta hyötyä ei ehkä saavuteta 1-2 viikon tai pidempään. Jos oireet eivät parane tässä ajassa tai jos tila pahenee, potilasta tulee neuvoa olemaan lisäämättä annosta vaan ottamaan yhteyttä lääkäriin.
- Potilaita, joiden systeemisiä kortikosteroideja on vähennetty tai lopetettu, tulee neuvoa pitämään mukanaan varoituskortti, jossa ilmoitetaan, että he saattavat tarvita täydentäviä systeemisiä kortikosteroideja stressijaksojen tai astmakohtauksen aikana, joka ei tehoa keuhkoputkia laajentaviin lääkkeisiin.
- Potilaita tulee neuvoa olemaan lopettamatta PULMICORT TURBUHALERin (budesonidi) käyttöä äkillisesti.
- Potilaita tulee varoittaa välttämään altistumista vesirokolle tai tuhkarokkolle, ja jos he altistuvat, ottamaan yhteyttä lääkäriin viipymättä.
- Inhaloitavien kortikosteroidien, mukaan lukien budesonidin, pitkäaikainen käyttö voi lisätä joidenkin silmäongelmien (kaihi tai glaukooma) riskiä. Säännöllisiä näöntarkastuksia tulee harkita.
- Naisten, jotka harkitsevat PULMICORT TURBUHALERin (budesonidi) käyttöä, tulee neuvotella lääkärinsä kanssa, jos he ovat raskaana tai aikovat tulla raskaaksi tai jos he imettävät vauvaa.
- Potilaiden, jotka harkitsevat PULMICORT TURBUHALERin (budesonidi) käyttöä, tulee neuvotella lääkärinsä kanssa, jos he ovat allergisia budesonidille tai jollekin muulle suun kautta hengitetylle kortikosteroidille.
- Potilaiden tulee kertoa lääkärilleen muista käyttämistään lääkkeistä, koska PULMICORT 100 mcg TURBUHALER (budesonidi) ei välttämättä sovellu joissain olosuhteissa ja lääkäri saattaa haluta käyttää toista lääkettä.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Budesonidin karsinogeenisuuden arvioimiseksi tehtiin pitkäaikaisia tutkimuksia rotilla ja hiirillä suun kautta.
Sprague-Dawley-rotilla tehdyssä 104 viikkoa kestäneessä suun kautta otetussa tutkimuksessa glioomien esiintyvyyden tilastollisesti merkitsevä lisääntyminen urosrotilla, jotka saivat suun kautta annoksen 50 mikrogrammaa/kg/vrk (pienempi kuin suurin suositeltu päivittäinen inhalaatioannos aikuisille ja lapset mcg/m2 perusteella). Tuumorigeenisyyttä ei havaittu uros- ja naarasrotilla vastaavilla suun kautta annetuilla annoksilla 25 ja 50 mikrog/kg asti (pienempi kuin suurin suositeltu päivittäinen inhalaatioannos aikuisille ja lapsille mikrog/m2:n perusteella). Kahdessa kaksivuotisessa lisätutkimuksessa Fischer- ja Sprague-Dawley-urosrotilla budesonidi ei aiheuttanut glioomia suun kautta annetulla annoksella 50 mikrogrammaa/kg (pienempi kuin suurin suositeltu päivittäinen inhalaatioannos aikuisille ja lapsille mikrog/m2:n perusteella). Sprague-Dawley-urosrotilla budesonidi kuitenkin lisäsi tilastollisesti merkitsevää maksasolukasvainten ilmaantuvuutta oraalisella annoksella 50 mcg/kg (pienempi kuin suurin suositeltu päivittäinen inhalaatioannos aikuisille ja lapsille mikrog/m2-pohjalta ). Samanaikaiset vertailukortikosteroidit (prednisoni ja triamsinoloniasetonidi) näissä kahdessa tutkimuksessa osoittivat samanlaisia tuloksia.
Ei ollut todisteita karsinogeenisesta vaikutuksesta, kun budesonidia annettiin suun kautta 91 viikon ajan hiirille annoksina 200 mcg/kg/vrk (pienempi kuin suurin suositeltu päivittäinen inhalaatioannos aikuisille ja lapsille mikrog/m2-pohjaisesti laskettuna).
Budesonidi ei ollut mutageeninen tai klastogeeninen kuudessa eri testijärjestelmässä: Amesin salmonella/mikrosomilevytesti, hiiren mikrotumatesti, hiiren lymfoomatesti, kromosomipoikkeamatesti ihmisen lymfosyyteillä, sukupuoleen liittyvä resessiivinen letaalitesti Drosophila melanogasterissa ja DNA-korjausanalyysi rotalla. hepatosyyttiviljelmä.
Rotilla budesonidilla ei ollut vaikutusta hedelmällisyyteen ihonalaisilla annoksilla 80 mikrog/kg asti (vähemmän kuin ihmisen suurin suositeltu päivittäinen inhalaatioannos mikrog/m2:n perusteella).
Annoksella 20 mikrog/kg/vrk (vähemmän kuin ihmisen suurin suositeltu päivittäinen inhalaatioannos mikrog/m2:n perusteella) havaittiin äidin painonnousun, synnytystä edeltävän elinkelpoisuuden ja poikien elinkelpoisuuden laskua syntymän ja imetyksen aikana. Tällaisia vaikutuksia ei havaittu annoksella 5 mikrog/kg (vähemmän kuin ihmisen suurin suositeltu päivittäinen inhalaatioannos aikuisille mikrog/m2:n perusteella).
Raskaus: Teratogeeniset vaikutukset
Raskausluokka B: Kuten muutkin glukokortikoidit, budesonidi aiheutti sikiön menetystä, alensi poikasten painoa ja luuston poikkeavuuksia kaneille ihonalaisilla annoksilla 25 mcg/kg/vrk (vähemmän kuin ihmisen suurin suositeltu päivittäinen inhalaatioannos mikrog/m2:n perusteella). ja 500 mikrogrammaa/kg/vrk rotilla (noin 3 kertaa ihmisen suurin suositeltu päivittäinen inhalaatioannos mikrog/m2:n perusteella).
Rotilla ei havaittu teratogeenisia tai alkioita tappavia vaikutuksia, kun budesonidia annettiin inhalaatiolla annoksina 250 mikrog/kg/vrk (vastaa suurinta suositeltua ihmisen päivittäistä inhalaatioannosta mikrog/m2:n perusteella).
Oraalisista kortikosteroideista saadut kokemukset niiden käyttöönoton jälkeen farmakologisissa annoksissa fysiologisten annosten sijaan viittaavat siihen, että jyrsijät ovat alttiimpia kortikosteroidien teratogeenisille vaikutuksille kuin ihmiset.
Raskaana olevilla naisilla tehdyt tutkimukset eivät kuitenkaan ole osoittaneet, että PULMICORT TURBUHALER (budesonidi) lisää poikkeavuuksien riskiä, kun sitä annetaan raskauden aikana. Tulokset laajasta väestöpohjaisesta prospektiivisestä kohorttiepidemiologisesta tutkimuksesta, jossa tarkasteltiin tietoja kolmesta ruotsalaisesta rekisteristä, jotka kattavat noin 99 % raskauksista vuosina 1995-1997 (eli Ruotsin lääketieteellinen syntymärekisteri; synnynnäisten epämuodostumien rekisteri; lasten kardiologian rekisteri), eivät osoita lisääntynyttä riskiä inhaloitavan budesonidin käytöstä raskauden alkuvaiheessa aiheutuneiden synnynnäisten epämuodostumien hoitoon. Synnynnäisiä epämuodostumia tutkittiin 2 014 lapsella, joiden äidit ilmoittivat käyttäneensä inhaloitavaa budesonidia astman hoitoon raskauden alkuvaiheessa (yleensä 10–12 viikkoa viimeisten kuukautisten jälkeen), jolloin useimmat merkittävät elinten epämuodostumat esiintyvät. Rekisteröityjen synnynnäisten epämuodostumien määrä oli samanlainen verrattuna väestön yleiseen määrään (3,8 % vs. 3,5 %). Lisäksi inhaloitavalle budesonidille altistumisen jälkeen suu- ja kasvohalkeamilla syntyneiden imeväisten määrä oli sama kuin normaalissa populaatiossa (4 lasta vs. 3,3).
Näitä samoja tietoja käytettiin toisessa tutkimuksessa, jossa kokonaismäärä nousi 2 534 vauvaan, joiden äidit altistuivat inhaloitavalle budesonidille. Tässä tutkimuksessa synnynnäisten epämuodostumien määrä pikkulapsilla, joiden äidit olivat altistuneet inhaloitavalle budesonidille raskauden alkuvaiheessa, ei eronnut kaikkien vastasyntyneiden määrästä samana ajanjaksona (3,6 %).
Eläinlöydöistä huolimatta näyttää siltä, että sikiövaurioiden mahdollisuus on vähäinen, jos lääkettä käytetään raskauden aikana. Koska ihmisillä tehdyt tutkimukset eivät kuitenkaan voi sulkea pois haittojen mahdollisuutta, PULMICORT TURBUHALER (budesonidi) tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.

Ei-teratogeeniset vaikutukset
Hypoadrenalismia voi esiintyä imeväisillä, joiden äidit ovat saaneet kortikosteroideja raskauden aikana. Tällaisia lapsia tulee tarkkailla huolellisesti.
Imettävät äidit
Kortikosteroidit erittyvät äidinmaitoon. Koska mikä tahansa kortikosteroidi voi aiheuttaa haittavaikutuksia imetettäville imeväisille, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkehoito, ottaen huomioon lääkkeen merkitys äidille. Budesonidista puuttuu todellisia tietoja.
Käyttö lapsille
PULMICORT 100 mikrogramman TURBUHALER (budesonidi) turvallisuutta ja tehokkuutta alle 6-vuotiailla lapsipotilailla ei ole varmistettu.
Lasten astmapotilailla PULMICORT 100 mcg TURBUHALER (budesonidi) havaittujen haittatapahtumien esiintyvyys oli samanlainen 6–12-vuotiaiden ikäryhmässä (N=172) verrattuna 13–17-vuotiaiden ikäryhmään (N=124). .
Kontrolloidut kliiniset tutkimukset ovat osoittaneet, että suun kautta hengitetyt kortikosteroidit voivat hidastaa kasvunopeutta lapsipotilailla. Tämä vaikutus on havaittu hypotalamus-aivolisäke-lisämunuaisen (HPA) akselin suppressiosta puuttuessa, mikä viittaa siihen, että kasvunopeus on herkempi indikaattori systeemiselle kortikosteroidialtistukselle lapsipotilailla kuin jotkut yleisesti käytetyt HPA-akselin toiminnan testit. Tämän suun kautta hengitettäviin kortikosteroideihin liittyvän kasvunopeuden hidastumisen pitkän aikavälin vaikutuksia, mukaan lukien vaikutusta aikuisen lopulliseen pituuteen, ei tunneta. Suun kautta hengitettävien kortikosteroidien hoidon lopettamisen jälkeistä kasvun "kiinni kiinni" mahdollisuutta ei ole tutkittu riittävästi.
5–12-vuotiailla astmaa sairastavilla lapsilla tehdyssä tutkimuksessa PULMICORT 200 mikrogrammaa TURBUHALER (budesonidi) 200 mikrogrammaa kahdesti vuorokaudessa (n = 311) saaneiden lasten kasvu hidastui 1,1 senttimetriä lumelääkettä saaneisiin (n = 418) yhden vuoden lopussa; näiden kahden hoitoryhmän välinen ero ei kasvanut enempää kolmen vuoden lisähoidon aikana. Neljän vuoden loppuun mennessä PULMICORT TURBUHALERilla (budesonidi) hoidetuilla lapsilla ja lumelääkettä saavilla lapsilla oli samanlainen kasvunopeus. Tästä tutkimuksesta tehtyjä johtopäätöksiä saattaa hämmentää kortikosteroidien epätasainen käyttö hoitoryhmissä ja tutkimusten aikana murrosiän saavuttaneiden potilaiden tietojen sisällyttäminen.
Suun kautta inhaloitavia kortikosteroideja, mukaan lukien PULMICORT TURBUHALER (budesonidi) saavien lapsipotilaiden kasvua on seurattava rutiininomaisesti (esim. stadiometrisesti). Pitkäaikaisen hoidon mahdollisia kasvuvaikutuksia tulee punnita saavutettuihin kliinisiin hyötyihin ja vaihtoehtoisiin hoitoihin liittyviin riskeihin ja hyötyihin nähden. Inhaloitavien kortikosteroidien systeemisten vaikutusten minimoimiseksi, mukaan lukien PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi), jokainen potilas tulee titrata hänen pienimpään tehokkaaseen annokseensa.
Geriatrinen käyttö
Sata 65-vuotiasta tai sitä vanhempaa potilasta oli mukana Yhdysvalloissa ja ei-yhdysvaltalaisissa kontrolloiduissa PULMICORT 100 mcg TURBUHALERin (budesonidi) kliinisissä tutkimuksissa. Lääkkeen turvallisuudessa ja tehossa ei ollut eroja nuoremmilla potilailla havaittuihin verrattuna.
Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
YLIANNOSTUS
Akuuttien toksisten vaikutusten mahdollisuus PULMICORT 100 mikrogramman TURBUHALERin (budesonidi) yliannostuksen jälkeen on pieni. Jos sitä käytetään suuria annoksia pitkiä aikoja, voi esiintyä systeemisiä kortikosteroidivaikutuksia, kuten hyperkortismia (ks. VAROTOIMENPITEET ). PULMICORT TURBUHALER kaksinkertainen suositusannos (3200 mikrog päivässä) 6 viikon ajan alensi merkittävästi (27 %) plasman kortisolivastetta 6 tunnin ACTH-infuusion aikana lumelääkkeeseen verrattuna (+1 %). Vastaava vaikutus 10 mg prednisonia päivässä oli 35 %:n lasku plasman kortisolivasteessa ACTH:lle.
Pienin tappava inhalaatioannos hiirillä oli 100 mg/kg (noin 320 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisilla ja noin 380 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille mikrogrammaa/m2). Rotille annettiin 68 mg/kg:n inhalaatioannos (noin 430 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisilla ja noin 510 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille mikrog/m2:n perusteella). Pienin suun kautta tappava annos oli 200 mg/kg hiirillä (noin 630 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisilla ja noin 750 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille mikrogrammaa/m2) ja alle 100 mg/kg. rotilla (noin 630 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisilla ja noin 750 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille laskettuna mikrogrammaa/m2).
Markkinoille tulon jälkeinen kokemus osoitti, että potilaat, jotka saivat akuutin inhaloitavan budesonidin yliannostuksen, pysyivät yleensä oireettomina. Liiallisten annosten (jopa 6400 mikrogrammaa päivässä) käyttö pitkiä aikoja osoitti systeemisiä kortikosteroidivaikutuksia, kuten hyperkortismia.
VASTA-AIHEET
PULMICORT TURBUHALER (budesonidi) on vasta-aiheinen astmaatikon tai muiden akuuttien astmakohtausten ensisijaisessa hoidossa, kun tarvitaan intensiivisiä toimenpiteitä.
Yliherkkyys budesonidille on vasta-aiheinen PULMICORT TURBUHALERin (budesonidi) käytölle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Budesonidi on anti-inflammatorinen kortikosteroidi, jolla on voimakas glukokortikoidiaktiivisuus ja heikko mineralokortikoidiaktiivisuus. Tavallisissa in vitro ja eläinmalleissa budesonidilla on noin 200 kertaa suurempi affiniteetti glukokortikoidireseptoriin ja 1000 kertaa suurempi paikallisesti käytettävä tulehdusta ehkäisevä teho kuin kortisolilla (rotan krotoniöljykorvan ödeemamääritys). Systeemisen aktiivisuuden mittana budesonidi on 40 kertaa tehokkaampi kuin kortisoli ihonalaisesti annettuna ja 25 kertaa tehokkaampi oraalisesti annettuna rotan kateenkorvan involuutiotestissä.
PULMICORT 100 mcg TURBUHALERin vaikutus johtuu alkuperäisestä lääkkeestä, budesonidista. Glukokortikoidireseptorin affiniteettitutkimuksissa 22R-muoto oli kaksi kertaa niin aktiivinen kuin 22S-epimeeri. In vitro -tutkimukset osoittivat, että budesonidin kaksi muotoa eivät muutu keskenään.
Kortikosteroidien tarkkaa mekanismia tulehdukseen astmassa ei tunneta. Tulehdus on tärkeä tekijä astman patogeneesissä. Kortikosteroideilla on osoitettu olevan laaja valikoima estäviä vaikutuksia useisiin solutyyppeihin (esim. syöttösolut, eosinofiilit, neutrofiilit, makrofagit ja lymfosyytit) ja välittäjiin (esim. histamiini, eikosanoidit, leukotrieenit ja sytokiinit), jotka liittyvät allergisiin ja ei-soluihin. -allerginen tulehdus. Nämä kortikosteroidien anti-inflammatoriset vaikutukset voivat edistää niiden tehoa astmassa.
Astmapotilailla tehdyt tutkimukset ovat osoittaneet suotuisan suhteen paikallisen anti-inflammatorisen vaikutuksen ja systeemisten kortikosteroidivaikutusten välillä PULMICORT 200 mcg TURBUHALERin (budesonidi) laajalla annosalueella. Tämä selittyy suhteellisen korkean paikallisen anti-inflammatorisen vaikutuksen, suun kautta imeytyneen lääkkeen laajan ensikierron maksassa tapahtuvan hajoamisen (85-95 %) ja muodostuneiden metaboliittien alhaisen tehokkuuden yhdistelmällä (katso alla).
Farmakokinetiikka
Imeytyminen:
Budesonidin oraalisen annon jälkeen huippupitoisuus plasmassa saavutettiin noin 1-2 tunnissa ja absoluuttinen systeeminen hyötyosuus oli 6-13 %. Sitä vastoin suurin osa keuhkoihin kulkeutuneesta budesonidista imeytyy systeemisesti. Terveillä koehenkilöillä 34 % mitatusta annoksesta kertyi keuhkoihin (arvioitu plasman pitoisuusmenetelmällä), ja absoluuttinen systeeminen saatavuus oli 39 % mitatusta annoksesta. Budesonidin farmakokinetiikka ei eroa merkittävästi terveillä vapaaehtoisilla ja astmapotilailla. Budesonidin huippupitoisuus plasmassa saavutettiin 30 minuutin sisällä PULMICORT 200 mikrogramman TURBUHALER-inhalaation jälkeen.Astmapotilailla budesonidin AUC- ja Cmax-arvot nousivat lineaarisesti annoksen noustessa sekä kerta-annoksen että toistuvan PULMICORT 200 mikrogramman TURBUHALER-annoksen (budesonidi) jälkeen.
Jakelu:
Budesonidin jakautumistilavuus oli noin 3 l/kg. Se sitoutui 85-90 % plasman proteiineihin. Proteiineihin sitoutuminen oli vakio pitoisuusalueella (1-100 nmol/L), joka saavutettiin PULMICORT TURBUHALERin suositusannoksilla ja ylitti ne. Budesonidi sitoutui vain vähän tai ei lainkaan kortikosteroideja sitovaan globuliiniin. Budesonidi tasapainottui nopeasti punasolujen kanssa pitoisuudesta riippumattomalla tavalla veri/plasma-suhteen ollessa noin 0,8.Aineenvaihdunta:
Ihmisen maksahomogenaateilla tehdyt in vitro -tutkimukset ovat osoittaneet, että budesonidi metaboloituu nopeasti ja laajasti. Kaksi tärkeintä metaboliittia, jotka muodostuvat sytokromi P450:n (CYP) isoentsyymi 3A4:n (CYP3A4) katalysoiman biotransformaation kautta, on eristetty ja tunnistettu 16α-hydroksiprednisoloniksi ja 6β-hydroksibudesonidiksi. Kummankin näiden kahden metaboliitin kortikosteroidiaktiivisuus on alle 1 % alkuperäisen yhdisteen aktiivisuudesta. Kvalitatiivisia eroja ei ole havaittu in vitro ja in vivo aineenvaihduntakuvioiden välillä. Ihmisen keuhko- ja seerumivalmisteissa havaittiin vähäistä metabolista inaktivaatiota.Erittyminen/eliminaatio:
Budesonidin 22R-muoto poistui ensisijaisesti maksasta systeemisellä puhdistumalla 1,4 l/min vs. 1,0 l/min 22S-muodolla. Terminaalinen puoliintumisaika, 2–3 tuntia, oli sama molemmilla epimeereillä ja riippumaton annoksesta. Budesonidi erittyi virtsaan ja ulosteisiin metaboliittien muodossa. Noin 60 % suonensisäisestä radioleimatusta annoksesta havaittiin virtsassa. Virtsassa ei havaittu muuttumatonta budesonidia.Erikoispopulaatiot:
Rotuun, sukupuoleen tai ikääntymiseen liittyviä farmakokineettisiä eroja ei ole havaittu.Pediatriset:
Laskimonsisäisen annostelun jälkeen 10–14-vuotiaille lapsipotilaille puoliintumisaika plasmassa oli lyhyempi kuin aikuisilla (1,5 tuntia vs. 2,0 tuntia aikuisilla). Samassa populaatiossa sen jälkeen, kun budesonidia inhaloitiin paineistetun annosinhalaattorin kautta, absoluuttinen systeeminen saatavuus oli samanlainen kuin aikuisilla.Maksan vajaatoiminta:
Maksan vajaatoiminta voi vaikuttaa kortikosteroidien eliminaatioon. Budesonidin farmakokinetiikkaan vaikutti maksan toiminnan heikkeneminen, mikä on osoituksena systeemisen saatavuuden kaksinkertaistumisesta oraalisen nauttimisen jälkeen. Budesonidin suonensisäinen farmakokinetiikka oli kuitenkin samanlainen kirroosipotilailla ja terveillä koehenkilöillä.Lääkkeiden väliset vuorovaikutukset:
Ketokonatsoli, sytokromi P450:n (CYP) isoentsyymin 3A4 (CYP3A4), voimakas estäjä, joka on kortikosteroidien pääasiallinen metabolinen entsyymi, nosti suun kautta nautitun budesonidin pitoisuutta plasmassa. Suositelluilla annoksilla simetidiinillä oli lievä mutta kliinisesti merkityksetön vaikutus suun kautta otettavan budesonidin farmakokinetiikkaan.Farmakodynamiikka
Sen vahvistamiseksi, että systeeminen imeytyminen ei ole merkittävä tekijä inhaloitavan budesonidin kliinisen tehon kannalta, tehtiin astmapotilailla kliininen tutkimus, jossa verrattiin 400 mikrogrammaa budesonidia, joka annettiin paineistetulla mitta-annosinhalaattorilla, jossa on letkun välikappale. plasebo. Tutkimus osoitti inhaloitavan budesonidin tehokkuuden, mutta ei suun kautta nautitun budesonidin tehoa vertailukelpoisista systeemisistä tasoista huolimatta. Näin ollen suun kautta inhaloitavan budesonidin tavanomaisten annosten terapeuttinen vaikutus selittyy suurelta osin sen suoralla vaikutuksella hengitysteihin.
Yleensä PULMICORT TURBUHALERilla (budesonidi) on suhteellisen nopea vaikutus inhaloitavan kortikosteroidin suhteen. Astman hallinnan paraneminen PULMICORT TURBUHALERin (budesonidi) inhalaation jälkeen voi tapahtua 24 tunnin kuluessa hoidon aloittamisesta, vaikka suurinta hyötyä ei ehkä saavuteta 1-2 viikon tai pidempään.
PULMICORT TURBUHALERin (budesonidin) on osoitettu vähentävän hengitysteiden reaktiivisuutta erilaisissa altistusmalleissa, mukaan lukien histamiini, metakoliini, natriummetabisulfiitti ja adenosiinimonofosfaatti potilailla, joilla on hyperreaktiiviset hengitystiet. Näiden mallien kliininen merkitys ei ole varma.
Esikäsittely PULMICORT 200 mcg TURBUHALER (budesonidi) 1600 mcg päivässä (800 mcg kahdesti vuorokaudessa) 2 viikon ajan vähensi akuuttia (varhaisen vaiheen reaktio) ja viivästyneen (myöhäisen vaiheen reaktio) FEV1:n laskua inhaloidun allergeenialtistuksen jälkeen.
PULMICORT 200 mikrogramman TURBUHALERin (budesonidi) vaikutuksia hypotalamus-aivolisäke-lisämunuainen (HPA) -akseliin tutkittiin 905 aikuisella ja 404 astmapotilaalla. Useimmilla potilailla kyky lisätä kortisolin tuotantoa vasteena stressiin, kuten kosyntropiinin (ACTH) stimulaatiotestillä arvioitiin, säilyi ennallaan PULMICORT TURBUHALER (budesonidi) -hoidolla suositelluilla annoksilla. Aikuispotilaista, joita hoidettiin 100, 200, 400 tai 800 mikrogrammaa kahdesti vuorokaudessa 12 viikon ajan, 4 %:lla, 2 %:lla 6 %:lla ja 13 %:lla 13 %:lla oli epänormaali stimuloitu kortisolivaste (kortisolin huippuarvo
Budesonidin anto PULMICORT 200 mcg TURBUHALERin (budesonidi) kautta annoksina enintään 800 mcg/vrk (keskimääräinen vuorokausiannos 445 mcg/vrk) tai paineistetun annossumuttimen kautta annoksina 1200 mcg/vrk (keskimääräinen vuorokausiannos 620 mcg) /vrk) 216:lle lapsipotilaalle (3-11-vuotiaat) 2-6 vuoden ajan, ei vaikuttanut merkittävästi kasvuun verrattuna ei-kortikosteroidihoitoon 62 vastaavalla kontrollipotilaalla. PULMICORT TURBUHALERin (budesonidin) pitkäaikaista vaikutusta kasvuun ei kuitenkaan tunneta täysin.
Kliiniset polut
PULMICORT 100 mikrogramman TURBUHALERin (budesonidi) terapeuttista tehoa on arvioitu kontrolloiduissa kliinisissä tutkimuksissa, joihin osallistui yli 1 300 potilasta (6-vuotiaat ja sitä vanhemmat), joilla oli astma, jonka sairauden kesto (20 vuotta) ja vaikeusaste vaihtelevat.
Kaksoissokkoutuneet, rinnakkaiset, lumekontrolloidut kliiniset tutkimukset, jotka kestivät vähintään 12 viikkoa, ovat osoittaneet, että verrattuna lumelääkkeeseen PULMICORT TURBUHALER (budesonidi) paransi merkittävästi keuhkojen toimintaa (mitattu PEF:llä ja FEV1:llä) ja vähensi merkittävästi astman aamu- ja iltaoireita. ja vähensi merkittävästi tarpeen mukaan inhaloitavien β2-agonistien käyttöä annoksilla 400 mcg - 1600 mcg päivässä (200 mcg - 800 mcg kahdesti vuorokaudessa) ja 400 mcg - 800 mcg päivässä (200 mcg - 400 mcg) kahdesti päivässä) vähintään 6-vuotiailla lapsipotilailla.
Keuhkojen toiminnan paranemista (aamu-PEF) havaittiin 24 tunnin kuluessa hoidon aloittamisesta sekä aikuisilla että 6-vuotiailla ja sitä vanhemmilla lapsipotilailla, vaikka suurinta hyötyä ei saavutettu 1-2 viikon tai pidempään hoidon aloittamisen jälkeen. Parempi keuhkojen toiminta säilyi koko 12 viikon ajan kaksoissokkoutetussa tutkimuksessa.
Potilaat, jotka eivät saa kortikosteroidihoitoa
12 viikkoa kestäneessä kliinisessä tutkimuksessa 273 potilaalla, joilla oli lievä tai keskivaikea astma (keskimääräinen FEV1 2,27 l), jotka eivät olleet hyvin hallinnassa pelkillä keuhkoputkia laajentavilla lääkkeillä, PULMICORT 200 mikrogrammaa TURBUHALER (budesonidia) arvioitiin annoksilla 200 mikrogrammaa mcg kahdesti vuorokaudessa ja 400 mikrogrammaa kahdesti vuorokaudessa. päivittäin vs. lumelääke. Tämän kokeen FEV1-tulokset on esitetty alla olevassa kuvassa. Keuhkojen toiminta parani merkittävästi molemmilla PULMICORT 100 mikrogramman TURBUHALER (budesonidi) annoksilla verrattuna lumelääkkeeseen.
12 viikon tutkimus potilailla, jotka eivät saa kortikosteroidihoitoa ennen tutkimukseen tuloa

12 kuukauden kontrolloidussa tutkimuksessa, johon osallistui 75 potilasta, jotka eivät aiemmin saaneet kortikosteroideja, PULMICORT TURBUHALER (budesonidi) annoksella 200 mikrogrammaa kahdesti vuorokaudessa johti keuhkojen toiminnan paranemiseen (PEF:llä mitattuna) ja keuhkoputkien hyperreaktiivisuuden vähenemiseen verrattuna lumelääkkeeseen.
Potilaat, jotka ovat aiemmin saaneet inhaloitavia kortikosteroideja
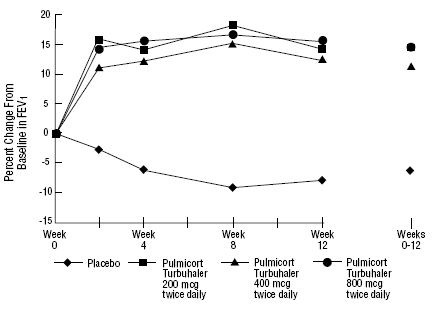
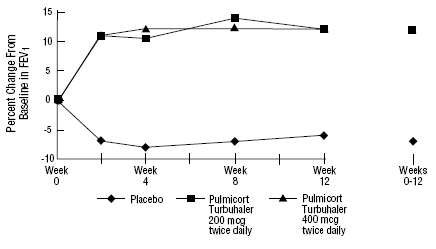
PULMICORT 200 mcg TURBUHALERin (budesonidi) turvallisuutta ja tehoa arvioitiin myös aikuisilla ja lapsipotilailla (6-18-vuotiaat), jotka ovat saaneet aiemmin inhaloitavia kortikosteroideja (aikuiset: N = 473, keskimääräinen lähtötason FEV1 2,04 L, dipropionaatti-1-asoni2-dipropionaatti-asoniannokset). -1008 mcg/vrk; pediatria: N=404, keskimääräinen lähtötason FEV1 2,09 L, beklometasonidipropionaatin lähtötason annokset 126-672 mcg/vrk tai triamsinoloniasetonidin 300-1800 mcg/vrk). FEV1-tulokset näistä kahdesta, molemmat 12 viikkoa kestäneistä kokeista, on esitetty seuraavissa kuvissa. Keuhkojen toiminta parani merkittävästi kaikilla PULMICORT TURBUHALERin (budesonidi) annoksilla verrattuna lumelääkkeeseen molemmissa tutkimuksissa.
Aikuiset potilaat, jotka ovat aiemmin saaneet inhaloitavia kortikosteroideja
6–18-vuotiaat lapsipotilaat, jotka ovat aiemmin saaneet inhaloitavia kortikosteroideja
Potilaat, jotka saavat PULMICORT TURBUHALER (budesonidia) kerran päivässä
PULMICORT 100 mikrogrammaa TURBUHALER (budesonidi) 200 mikrog ja 400 mikrogrammaa sekä lumelääkettä kerran vuorokaudessa annon tehoa ja turvallisuutta arvioitiin myös 309 aikuisella astmapotilaalla (keskimääräinen FEV1 2,7 L) 18 viikkoa kestäneessä tutkimuksessa. Plaseboon verrattuna potilaat, jotka saivat Pulmicortia 200 tai 400 mikrogrammaa kerran vuorokaudessa, osoittivat merkittävästi parempaa astman stabiilisuutta PEF:n ja FEV1:n perusteella 6 viikon alkuhoitojakson aikana, jota ylläpidettiin 200 mikrogramman vuorokausiannoksella seuraavien 12 viikon ajan. Vaikka tutkimuspopulaatiossa oli sekä potilaita, joita oli aiemmin hoidettu inhaloitavilla kortikosteroideilla, että potilaita, jotka eivät aiemmin olleet saaneet kortikosteroidihoitoa, tulokset osoittivat, että kerran vuorokaudessa annostelu oli selkeimmin tehokkaita potilailla, jotka olivat aiemmin saaneet oraalisesti inhaloitavia kortikosteroideja (ks. ANNOSTELU JA HALLINNOINTI ).
Potilaat, jotka ovat aiemmin saaneet suun kautta otettavia kortikosteroideja
Kliinisessä tutkimuksessa 159 vakavalla astmapotilaalla, jotka tarvitsivat kroonista oraalista prednisonihoitoa (keskimääräinen lähtötason prednisoniannos 19,3 mg/vrk) PULMICORT TURBUHALER (budesonidi) annoksilla 400 mikrogrammaa kahdesti vuorokaudessa ja 800 mikrogrammaa kahdesti vuorokaudessa verrattiin lumelääkkeeseen 20 viikon ajan. ajanjaksoa. Noin kaksi kolmasosaa (68 % annoksella 400 mikrogrammaa kahdesti vuorokaudessa ja 64 % 800 mikrogrammaa kahdesti vuorokaudessa) PULMICORT TURBUHALERilla (budesonidi) hoidetuista potilaista pystyi saavuttamaan jatkuvan (vähintään 2 viikkoa) suun kautta otetun kortikosteroidihoidon lopettamisen (verrattuna 8 %:iin potilaista). lumelääkettä saaneet potilaat) ja astman hallinta parani. Keskimääräinen oraalinen kortikosteroidiannos pieneni 83 % 400 mikrog kahdesti vuorokaudessa ja 79 % 800 mikrog kahdesti vuorokaudessa PULMICORT TURBUHALER (budesonidi) saaneilla potilailla verrattuna 27 % lumelääkettä saaneisiin potilaisiin. Lisäksi 58 potilaasta 64 potilaasta (91 %), jotka eliminoivat kokonaan oraaliset kortikosteroidit tutkimuksen kaksoissokkovaiheen aikana, ei saanut oraalisia kortikosteroideja vielä 12 kuukauden ajan, kun he saivat PULMICORT 200 mikrogrammaa TURBUHALER (budesonidia).
POTILASTIEDOT
Potilaan käyttöohjeet
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen. Se tarjoaa yhteenvedon lääkkeesi tiedoista. Näiden ohjeiden noudattaminen auttaa varmistamaan, että hengität lääkkeen oikein.
KYSY LISÄTIETOJA LÄÄKÄRILTÄ TAI APTEAKSESTA.
MITÄ SINUN TULEE TIETÄÄ PULMICORT TURBUHALERISTA (budesonidi)
Lääkärisi on määrännyt PULMICORT TURBUHALER 200 mikrog. Se sisältää budesonidia, joka on synteettinen kortikosteroidi. Kortikosteroidit ovat elimistön luonnollisia aineita, jotka auttavat torjumaan tulehdusta. Niitä käytetään astman hoitoon, koska ne vähentävät keuhkojen pienten ilmakanavien seinämien turvotusta ja ärsytystä ja helpottavat hengitysvaikeuksia. Säännöllisesti hengitettynä kortikosteroidit auttavat myös ehkäisemään astmakohtauksia.
PULMICORT TURBUHALER (budesonidi) hoitaa tulehdusta - astman "hiljaista osaa", jota et kuule, näe tai tunne. Kun tulehdus jätetään hoitamatta, astmaoireesi ja kohtaukset voivat lisääntyä. PULMICORT 200mcg TURBUHALER (budesonidi) ehkäisee ja vähentää astman oireita ja kohtauksia.
TÄRKEITÄ MUISTETTAJA PULMICORT TURBUHALERISTA (budesonidi)
VARMISTA, että tämä lääke sopii sinulle (ks. ”ENNEN KÄYTTÖÄ PULMICORT TURBUHALERIN (budesonidi)”).
On tärkeää, että hengität jokaisen annoksen lääkärisi ohjeiden mukaisesti.
Käytä Turbuhaleria lääkärisi ohjeiden mukaan. ÄLÄ LOPETA HOITOA TAI VÄHENTÄ AnnostaSI, VAIKKA TUNTIT PAREMPI, ellei lääkärisi kehota tekemään niin.
ÄLÄ hengitä enemmän annoksia tai käytä Turbuhaleria useammin kuin lääkärisi on määrännyt.
Tämä lääke on EI tarkoitettu helpottamaan hengitysvaikeuksia nopeasti astmakohtauksen aikana. Se on otettava säännöllisin väliajoin lääkärisi ohjeiden mukaan, ei hätätoimenpiteenä.
Lääkärisi voi määrätä lisälääkkeitä (kuten keuhkoputkia laajentavia lääkkeitä) hätäapua varten, jos vaiva on akuutti
Jos käytät myös toista lääkettä hengitettynä, kysy lääkäriltäsi ohjeita siitä, milloin sitä tulee käyttää PULMICORT 100mcg TURBUHALERin (budesonidi) käytön yhteydessä.
ENNEN PULMICORT TURBUHALERIN KÄYTTÖÄ (budesonidi)
KERRO LÄÄKÄRILLE ENNEN TÄMÄN LÄÄKKEEN OTtamisen aloittamista, JOS:
- olet raskaana (tai aiot tulla raskaaksi),
- imetät vauvaa,
- olet allerginen budesonidille tai jollekin muulle suun kautta hengitettävälle kortikosteroidille,
- sinulla on infektioita,
- sinulla on tai on ollut tuberkuloosi,
- sinulla on osteoporoosi,
- ovat äskettäin olleet lähellä ketään, jolla on vesirokko tai tuhkarokko,
- suunnittelet leikkausta,
- olet käyttänyt oraalista kortikosteroidilääkettä, kuten prednisonia. Saatat joutua noudattamaan erityisiä ohjeita välttääksesi tämäntyyppisten lääkkeiden käytön lopettamiseen liittyvät terveysriskit.
Joissain tapauksissa tämä lääke ei ehkä sovi, ja lääkärisi saattaa haluta määrätä sinulle toisen lääkkeen. Varmista, että lääkärisi tietää, mitä muita lääkkeitä käytät, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, sekä kaikki vitamiinit tai ravintolisät ja yrttilisät.
MITÄ OVAT PULMICORT TURBUHALERIN (budesonidin) MAHDOLLISET HAITTAVAIKUTUKSET?
Kuten kaikkien inhaloitavien kortikosteroidien kohdalla, sinun tulee olla tietoinen seuraavista sivuvaikutuksista:
- Lisääntynyt hengityksen vinkuminen heti PULMICORT 100 mcg TURBUHALER (budesonidi) ottamisen jälkeen. Pidä aina mukanasi lyhytvaikutteista keuhkoputkia laajentavaa lääkettä äkillisen hengityksen vinkumisen hoitoon. Lyhytvaikutteiset keuhkoputkia laajentavat lääkkeet auttavat rentoutumaan keuhkojesi hengitysteiden ympärillä olevia lihaksia. Vinkumista tapahtuu, kun hengitysteiden ympärillä olevat lihakset kiristyvät. Tämä vaikeuttaa hengittämistä. Vakavissa tapauksissa hengityksen vinkuminen voi pysäyttää hengityksesi ja aiheuttaa kuoleman, jos sitä ei hoideta välittömästi.
- Immuunijärjestelmän vaikutukset ja suurempi mahdollisuus saada infektioita.
- Silmäongelmat, mukaan lukien glaukooma ja kaihi. Silmätutkimusta tulee harkita käytettäessä PULMICORT TURBUHALER (budesonidi).
- Lapsen kasvua tulee tarkkailla säännöllisesti PULMICOR TURBUHALERin käytön aikana, koska kasvu saattaa hidastua.
Kliinisten tutkimusten perusteella PULMICORT 100mcg TURBUHALER (budesonidi) käyttävien potilaiden yleisimmät sivuvaikutukset ovat:
- hengitystien tulehdus
- päänsärky
- flunssan oireita
- kipeä kurkku
- sinuiitti
Nämä eivät ole kaikki PULMICORT TURBUHALERin (budesonidi) mahdollisista sivuvaikutuksista. Lisätietoja saat lääkäriltäsi, terveydenhuollon ammattilaiselta tai apteekista.
PULMICORT TURBUHALERIN KÄYTTÖ (budesonidi)
- Noudata kohdassa "PULMICORT 200 mcg TURBUHALERIN KÄYTTÖOHJEET" annettuja ohjeita. Jos sinulla on ongelmia, kerro niistä lääkärillesi tai apteekkiin.
- On tärkeää, että hengität jokaisen annoksen lääkärisi ohjeiden mukaan. Apteekin etiketissä kerrotaan yleensä, mikä annos sinun tulee ottaa ja kuinka usein. Jos ei, tai et ole varma, kysy lääkäriltäsi tai apteekista.
ANNOSTUS
- Käytä lääkärisi ohjeiden mukaan.
- se on HYVIN TÄRKEÄ että noudatat lääkärisi ohjeita siitä, kuinka monta inhalaatiota sinun tulee ottaa ja kuinka usein PULMICORT TURBUHALER (budesonidi) tulee käyttää.
- ÄLÄ hengitä enemmän annoksia tai käytä PULMICORT TURBUHALER (budesonidia) useammin kuin lääkärisi neuvoo.
- Saattaa kestää 1–2 viikkoa tai kauemmin, ennen kuin tunnet maksimaalisen parannuksen ON ERITTÄIN TÄRKEÄÄ, ETTÄ KÄYTÄT PULMICORT 100mcg TURBUHALERIA (budesonidia) SÄÄNNÖLLISESTI. ÄLÄ LOPETA HOITOA TAI VÄHENTÄ AnnostaSI, VAIKKA OLET TUNNIN PARANEMINEN, ellei lääkärisi kehota tekemään niin.
- Jos unohdat ottaa annoksen, ota vain säännöllisesti suunniteltu seuraava annos, kun se on määrä. ÄLÄ TULOSTA annosta.
MITEN KÄYTETÄÄN PULMICORT TURBUHALERIA (budesonidi)
Lue täydelliset ohjeet huolellisesti ja käytä vain ohjeiden mukaan.
POISTAMISOHJEET:
Ennen kuin käytät uutta PULMICORT 200mcg TURBUHALER (budesonidia) ensimmäistä kertaa, se tulee esitellä. Tätä varten käännä kansi ja nosta se pois. Pidä PULMICORT TURBUHALER (budesonidi) pystyasennossa (suukappale ylöspäin) ja kierrä sitten ruskea kahva kokonaan oikealle ja takaisin vasemmalle. Toistaa. Nyt olet valmis ottamaan ensimmäisen annoksesi (katso ohjeet "ANNOKSEN OTTO"). Sinun ei tarvitse pohjustaa sitä muulloin tämän jälkeen, vaikka jättäisit sen syrjään pidemmäksi aikaa.
ANNOKSEN OTTO:
ANNOKSEN LATAAMINEN
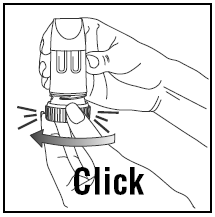
- Kierrä kansi ja nosta pois.
- Jotta saat oikean annoksen, PULMICORT TURBUHALER (budesonidi) on pidettävä pystyasennossa (suukappale ylhäällä) aina, kun lääkeannosta ladataan.
- Kierrä ruskea kahva kokonaan oikealle niin pitkälle kuin se menee. Kierrä se takaisin kokonaan vasemmalle.
- Kuulet napsahduksen.
ANNOKSEN HENGITYS
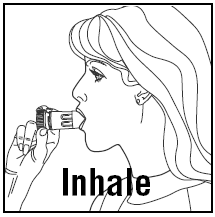
- Kun hengität, PULMICORT 200 mcg TURBUHALER (budesonidi) on pidettävä pystyasennossa (suukappale ylhäällä) tai vaaka-asennossa.
- Käännä pää poispäin inhalaattorista ja hengitä ulos. Älä ravista inhalaattoria lataamisen jälkeen.
- Aseta suukappale huultesi väliin ja hengitä syvään ja voimakkaasti. Et ehkä maistu tai tunne lääkettä.
- Älä pureskele tai pure suukappaletta.
- Ota inhalaattori suustasi ja hengitä ulos. Älä puhalla tai hengitä ulos suukappaleeseen.
- Jos tarvitaan useampi kuin yksi annos, toista yllä olevat vaiheet.
- Kun olet valmis, aseta kansi takaisin inhalaattoriin ja kierrä se kiinni. Huuhtele suusi vedellä. Älä niele.
- Pidä PULMICORT TURBUHALER (budesonidi) aina puhtaana ja kuivana.
- Älä käytä PULMICORT TURBUHALER (budesonidia), jos se on vaurioitunut tai jos suukappale on irronnut.
PULMICORT TURBUHALERIN SÄILYTTÄMINEN (budesonidi)
- Aseta valkoinen kansi takaisin jokaisen käyttökerran jälkeen ja kierrä se tiukasti paikalleen.
- Säilytä PULMICORT TURBUHALER (budesonidi) kuivassa paikassa valvotussa huoneenlämpötilassa, 68-77 °F (20-25 °C).
- Säilytä PULMICORT TURBUHALER (budesonidi) turvallisessa paikassa poissa pienten lasten ulottuville.
- ÄLÄ käytä Turbuhalerin runkoon merkityn päivämäärän jälkeen.
MITEN TIEDÄT, KUN PULMICORT TURBUHALERIN (budesonidi) ON TYHJÄ
Pakkauksessa tai kannessa oleva etiketti kertoo, kuinka monta annosta PULMICORT TURBUHALERissa on. PULMICORT TURBUHALERissa (budesonidi) on kätevä annosilmaisinikkuna aivan suukappaleen alapuolella.
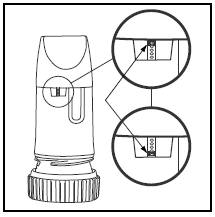
- Kun punainen merkki ilmestyy ikkunan yläosaan, lääkeannosta on jäljellä 20 annosta. Nyt on aika hankkia seuraava PULMICORT 100mcg TURBUHALER (budesonidi).
- Kun punainen merkki saavuttaa ikkunan alaosan, inhalaattorisi tulee hävittää, koska se ei ehkä enää anna oikeaa lääkemäärää. (Saat silti kuulla äänen, jos ravistat sitä – tämä ääni ei ole lääke. Tämän äänen tuottaa Turbuhalerin sisällä oleva kuivausaine.)
- Muista, että saat uuden inhalaattorin joka kerta, kun täytät reseptisi.
- Älä upota sitä veteen nähdäksesi, onko se tyhjä. Tarkista vain annosilmaisinikkuna.
LISÄTIETOJA PULMICORT TURBUHALERISTA (budesonidi)
- PULMICORT 200mcg TURBUHALER (budesonidi) toimittaa lääkkeesi erittäin hienona jauheena. Tämän vuoksi et ehkä maistaa, tuoksua tai tuntea kaikki lääkkeet, jotka pääsevät keuhkoihin hengitettäessä PULMICORT TURBUHALER (budesonidi) Tämä ei tarkoita, että et saa lääkitystäsi.
- PULMICORT 100 mcg TURBUHALER (budesonidia) ei saa käyttää välikappaleen kanssa.
- PULMICORT 100mcg TURBUHALER sisältää vain budesonidia eikä sisällä inaktiivisia aineita.
- PULMICORT TURBUHALER (budesonidi) on erityisesti suunniteltu antamaan vain yksi annos kerrallaan riippumatta siitä, kuinka usein napsautat ruskeaa kahvaa. Jos puhallat vahingossa inhalaattoriin annoksen lataamisen jälkeen, seuraa vain uuden annoksen lataamisohjeita.
Tämä pakkausseloste ei sisällä kaikkia tietoja lääkkeestäsi. Jos sinulla on kysyttävää tai olet epävarma jostakin, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Haluat ehkä lukea tämän pakkausselosteen uudelleen. ÄLÄ HEITÄ SITÄ PÄÄSTÄ ennen kuin olet lopettanut lääkkeesi.
MUISTA: Lääkärisi on määrännyt sinulle tämän lääkkeen. ÄLÄ anna tätä lääkettä kenellekään muulle.
KÄYTÄ TÄTÄ TUOTETTA OHJEIDEN MUKAISESTI, ELLEI LÄÄKÄRISI OHJEET TOIMIA TOIMIIN.
Jos sinulla on lisäkysymyksiä PULMICORT 100mcg TURBUHALERin (budesonidi) käytöstä, soita: 1-800-236-9933.
