Singulair 10mg, 4mg, 5mg Montelukast Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Singulair on ja miten sitä käytetään?
Singulair 5mg on reseptilääke, jota käytetään astman, rasituksen aiheuttaman bronkospasmin ja allergisen tai ympärivuotisen (ympärivuotisen) nuhan oireiden hoitoon. Singulairia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Singulair kuuluu lääkeryhmään, jota kutsutaan leukotrieenireseptorin antagonisteiksi.
- Ei tiedetä, onko Singulair turvallinen ja tehokas alle 1-vuotiaille lapsille.
Mitkä ovat Singulairin mahdolliset sivuvaikutukset?
Singulair voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- epätavalliset muutokset mielialassa tai käyttäytymisessä,
- ihottuma,
- mustelmat,
- voimakas pistely,
- tunnottomuus,
- kipu,
- lihas heikkous,
- korva kipu,
- turvotus,
- lämpö,
- kuume,
- kipeä kurkku,
- turvotus kasvoissasi tai kielessäsi,
- polttaa silmissäsi ja
- ihokipu, jota seuraa punainen tai violetti ihottuma, joka leviää ylävartaloon ja aiheuttaa rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Singulairin yleisimpiä sivuvaikutuksia ovat:
- vatsakipu,
- ripuli,
- kuume,
- flunssan oireet,
- vilustumisoireet (nenän tukkoisuus, poskiontelokipu, yskä, kurkkukipu),
- päänsärkyä ja
- vuoteeseen kastelu tai virtsarakon hallinnan menetys lapsilla
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Singulairin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Montelukastinatrium, SINGULAIR 4mg:n vaikuttava aine, on selektiivinen ja oraalisesti aktiivinen leukotrieenireseptorin salpaaja, joka estää kysteinyylileukotrieeni CysLT1-reseptoria.
Montelukastinatrium kuvataan kemiallisesti nimellä [R-(E)]-1-[[[1-[3-[2-(7-kloori-2-kinolinyyli)etenyyli]fenyyli]-3-[2-(1-hydroksi) -1-metyylietyyli)fenyyli]propyyli]tio]metyyli]syklopropaanietikkahappo, mononatriumsuola.
Empiirinen kaava on C35H35ClNNaO3S ja sen molekyylipaino on 608,18. Rakennekaava on:
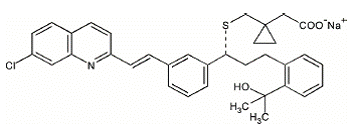
Montelukastinatrium on hygroskooppinen, optisesti aktiivinen, valkoinen tai luonnonvalkoinen jauhe. Montelukastinatrium liukenee vapaasti etanoliin, metanoliin ja veteen ja käytännössä liukenematon asetonitriiliin.
Jokainen 10 mg:n kalvopäällysteinen SINGULAIR-tabletti sisältää 10,4 mg montelukastinatriumia, mikä vastaa 10 mg:aa montelukastia, ja seuraavia inaktiivisia aineita: mikrokiteinen selluloosa, laktoosimonohydraatti, kroskarmelloosinatrium, hydroksipropyyliselluloosa ja magnesiumstearaatti. Kalvopinnoite koostuu hydroksipropyylimetyyliselluloosasta, hydroksipropyyliselluloosasta, titaanidioksidista, punaisesta rautaoksidista, keltaisesta rautaoksidista ja karnaubavahasta.
Jokainen 4 mg:n ja 5 mg:n pureskeltava SINGULAIR-tabletti sisältää 4,2 mg ja 5,2 mg montelukastinatriumia, mikä vastaa 4 ja 5 mg:aa montelukastia. Molemmat purutabletit sisältävät seuraavia inaktiivisia aineosia: mannitolia, mikrokiteistä selluloosaa, hydroksipropyyliselluloosaa, punaista rautaoksidia, kroskarmelloosinatriumia, kirsikkaaromia, aspartaamia ja magnesiumstearaattia.
Jokainen SINGULAIR 4 mg:n oraalisten rakeiden pakkaus sisältää 4,2 mg montelukastinatriumia, mikä vastaa 4 mg:aa montelukastia. Suun kautta otettava raeformulaatio sisältää seuraavat inaktiiviset aineosat: mannitoli, hydroksipropyyliselluloosa ja magnesiumstearaatti.
INDIKAATIOT
Astma
SINGULAIR® on tarkoitettu astman ennaltaehkäisyyn ja krooniseen hoitoon aikuisilla ja vähintään 12 kuukauden ikäisillä lapsipotilailla.
Harjoituksen aiheuttama keuhkoputken supistus (EIB)
SINGULAIR on tarkoitettu rasituksen aiheuttaman bronkokonstriktion (EIB) ehkäisyyn 6-vuotiailla ja sitä vanhemmilla potilailla.
Allerginen nuha
SINGULAIR 10mg on tarkoitettu kausiluonteisen allergisen nuhan oireiden lievittämiseen vähintään 2-vuotiailla potilailla ja ympärivuotisen allergisen nuhan oireiden lievittämiseen yli 6 kuukauden ikäisillä potilailla. Koska SINGULAIR 4 mg:n hyödyt eivät välttämättä ole suurempia kuin neuropsykiatristen oireiden riski potilailla, joilla on allerginen nuha [ks. VAROITUKSET JA VAROTOIMET ], varata käyttö potilaille, joiden vaste vaihtoehtoisiin hoitomuotoihin on riittämätön tai jotka eivät siedä niitä.
Käyttörajoitukset
SINGULAIR ei ole tarkoitettu akuutin astmakohtauksen hoitoon.
ANNOSTELU JA HALLINNOINTI
Astma
Astman hoitoon SINGULAIR annetaan suun kautta kerran vuorokaudessa illalla, ruoan kanssa tai ilman. Astmapotilailla ei ole tehty kliinisiä tutkimuksia, joissa olisi arvioitu aamu- ja ilta-annoksen suhteellista tehoa.
Seuraavia annoksia suositellaan:
Potilaiden, jotka unohtavat ottaa annoksen, tulee ottaa seuraava annos tavanomaiseen aikaan, eivätkä ne saa ottaa kahta annosta samanaikaisesti.
Harjoituksen aiheuttama keuhkoputken supistus (EIB)
EIB:n ehkäisemiseksi anna kerta-annos SINGULAIR 10 mg suun kautta vähintään 2 tuntia ennen harjoittelua. Seuraavia annoksia suositellaan:
Ylimääräistä SINGULAIR-annosta ei saa ottaa 24 tunnin sisällä edellisestä annoksesta. Potilaiden, jotka jo käyttävät SINGULAIRia päivittäin johonkin muuhun käyttöaiheeseen (mukaan lukien krooniseen astmaan), ei tule ottaa lisäannosta estääkseen EIB:n. Kaikilla potilailla tulee olla käytettävissä lyhytvaikutteinen β-agonisti.
SINGULAIRin päivittäistä antoa astman krooniseen hoitoon ei ole osoitettu estävän akuutteja EIB-jaksoja.
Allerginen nuha
Allergisen nuhan hoitoon, anna SINGULAIR 5 mg suun kautta kerran vuorokaudessa ruoan nauttimisajasta riippumatta. Antoaika allergisesta nuhasta kärsiville potilaille voidaan räätälöidä potilaan tarpeiden mukaan.
Seuraavia annoksia suositellaan kausiluonteisen allergisen nuhan oireiden hoitoon:
Taulukko 3: Suositeltu annostus kausiluonteisessa allergisessa nuhassa
Potilaiden, jotka unohtavat ottaa annoksen, tulee ottaa seuraava annos tavanomaiseen aikaan, eivätkä ne saa ottaa kahta annosta samanaikaisesti.
Astma ja allerginen nuha
Potilaille, joilla on sekä astma että allerginen nuha, annetaan vain yksi SINGULAIR-annos suun kautta kerran päivässä illalla.
Potilaiden, jotka unohtavat ottaa annoksen, tulee ottaa seuraava annos tavanomaiseen aikaan, eivätkä ne saa ottaa kahta annosta samanaikaisesti.
Suun kautta otettavien rakeiden anto-ohjeet
SINGULAIR 4 mg oraaliset rakeet voidaan antaa joko suoraan suuhun, liuotettuna 1 teelusikalliseen (5 ml) kylmää tai huoneenlämpöistä äidinmaidonkorviketta tai rintamaitoa tai sekoitettuna lusikalliseen kylmiä tai huoneenlämpöisiä pehmeitä ruokia; stabiilisuustutkimusten perusteella vain omenasosetta, porkkanoita, riisiä tai jäätelöä tulisi käyttää. Pakkausta ei saa avata ennen kuin se on valmis käytettäväksi. Pakkauksen avaamisen jälkeen koko annos (sekoitettuna äidinmaidonkorvikkeen, äidinmaidon tai ruoan kanssa tai ilman) on annettava 15 minuutin kuluessa. Jos SINGULAIR 4 mg:n rakeita sekoitetaan äidinmaidonkorvikkeen, äidinmaidon tai ruoan kanssa, sitä ei saa säilyttää tulevaa käyttöä varten. Hävitä käyttämättä jäänyt osa. SINGULAIR-oraalisia rakeita ei ole tarkoitettu liuotettavaksi mihinkään muuhun nesteeseen kuin äidinmaidonkorvikkeeseen tai rintamaitoon antoa varten. Nesteitä voidaan kuitenkin ottaa annon jälkeen. SINGULAIR-rakeet voidaan antaa ruokailuajasta riippumatta.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit
10 mg, beige, pyöristetty, neliön muotoinen, kalvopäällysteinen tabletti, jonka toisella puolella on koodi MSD 117 ja toisella puolella SINGULAIR 4 mg.
Purutabletit
5 mg, vaaleanpunainen, pyöreä, kaksoiskuperan muotoinen, koodi MSD 275 toisella puolella ja SINGULAIR toisella.
Purutabletit
4 mg, vaaleanpunainen, soikea, kaksoiskuperan muotoinen, koodi MSD 711 toisella puolella ja SINGULAIR toisella.
Suun kautta otettavat rakeet
4 mg, valkoisia rakeita, nettopaino 500 mg, pakattu lapsiturvalliseen foliopakkaukseen.
Varastointi ja käsittely
SINGULAIR 4 mg suun kautta otettavat rakeet : valkoiset rakeet, nettopaino 500 mg, pakattu lapsiturvalliseen foliopakkaukseen.
NDC 0006-3841-30 käyttöyksikköpakkaus, jossa 30 pakettia.
SINGULAIR 4 mg tabletit : vaaleanpunainen, soikea, kaksoiskuperan muotoinen purutabletti, jonka toisella puolella on koodi MSD 711 ja toisella puolella SINGULAIR 10 mg.
NDC 0006-1711-31 käyttöyksikköä korkeatiheyksistä polyeteenistä (HDPE) 30 pullot, joissa on polypropeenista valmistettu lapsiturvallinen korkki, alumiinifolion induktiotiiviste ja silikageelikuivausaine.
SINGULAIR 5 mg tabletit vaaleanpunainen, pyöreä, kaksoiskupera purutabletti, jonka toisella puolella on koodi MSD 275 ja toisella puolella SINGULAIR.
NDC 0006-9275-31 käyttöyksikköä korkeatiheyspolyeteenistä (HDPE) valmistettuja 30 pullon pulloja, joissa on polypropeenista valmistettu lapsiturvallinen korkki, alumiinifolion induktiotiiviste ja silikageelikuivausaine.
SINGULAIR 10 mg tabletit : beige, pyöreä, neliön muotoinen, kalvopäällysteinen tabletti, jonka toisella puolella on koodi MSD 117 ja toisella puolella SINGULAIR 4 mg.
NDC 0006-9117-31 käyttöyksikköä korkeatiheyksistä polyeteenistä (HDPE) 30 pullot, joissa on polypropeenista valmistettu lapsiturvallinen korkki, alumiinifolion induktiotiiviste ja silikageelikuivausaine
NDC 0006-9117-54 käyttöyksikköä korkeatiheyspolyeteeniä (HDPE) 90 pullot, joissa on polypropeenista valmistettu lapsiturvallinen korkki, alumiinifolion induktiotiiviste ja silikageelikuivausaine.
Varastointi
Säilytä SINGULAIR 4 mg:n suun kautta otettavat rakeet, 4 mg:n purutabletit, 5 mg:n purutabletit ja 10 mg:n kalvopäällysteiset tabletit 20 °C - 25 °C:ssa (68 °F - 77 °F). C - 30 °C (59 °F - 86 °F) [katso USP Controlled Room Temperature]. Suojaa kosteudelta ja valolta. Säilytä alkuperäispakkauksessa.
Jakelija: Merck Sharp & Dohme Corp., MERCK & CO., INC.:n tytäryhtiö, Whitehouse Station, USA. Tarkistettu: helmikuuta 2021
SIVUVAIKUTUKSET
Seuraavat kliinisesti merkittävät haittavaikutukset on kuvattu muualla merkinnöissä:
- Neuropsykiatriset tapahtumat [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia. Seuraavassa kliinisistä tutkimuksista saatujen kokemusten kuvauksessa haittavaikutukset on lueteltu syy-yhteyden arvioinnista riippumatta.
Yleisimmät haittavaikutukset (esiintyvyys ≥ 5 % ja suurempi kuin lumelääke; lueteltu esiintyvyyden alenevassa järjestyksessä) kontrolloiduissa kliinisissä tutkimuksissa olivat: ylempien hengitysteiden infektio, kuume, päänsärky, nielutulehdus, yskä, vatsakipu, ripuli, välikorvatulehdus, influenssa, rinorrea, poskiontelotulehdus, korvatulehdus.
Aikuiset ja 15-vuotiaat ja sitä vanhemmat nuoret, joilla on astma
SINGULAIR 10 mg:n turvallisuutta on arvioitu kliinisissä tutkimuksissa noin 2950 aikuisella ja 15-vuotiaalla ja sitä vanhemmalla nuorella. Plasebokontrolloiduissa kliinisissä tutkimuksissa seuraavia SINGULAIR 4 mg:n käytön yhteydessä raportoituja haittavaikutuksia esiintyi vähintään 1 %:lla potilaista ja ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla potilailla:
Harvempien haittavaikutusten esiintymistiheys oli vertailukelpoinen SINGULAIRin ja lumelääkkeen välillä.
SINGULAIR 10 mg:n turvallisuusprofiili, kun sitä annettiin kerta-annoksena EIB:n ehkäisyyn aikuisille ja 15-vuotiaille ja sitä vanhemmille nuorille, vastasi SINGULAIRille aiemmin kuvattua turvallisuusprofiilia.
Kliinisissä tutkimuksissa 569 potilasta hoidettiin SINGULAIR 10 mg:lla vähintään kuuden kuukauden ajan, 480 yhden vuoden ajan ja 49 potilasta kahden vuoden ajan. Pitkän hoidon aikana haittavaikutusprofiili ei muuttunut merkittävästi.
6–14-vuotiaat lapsipotilaat, joilla on astma
SINGULAIR 10 mg:n turvallisuutta on arvioitu 476:lla 6–14-vuotiaalla lapsipotilaalla. Kliinisissä tutkimuksissa 289 lapsipotilasta hoidettiin SINGULAIR 10 mg:lla vähintään 6 kuukauden ajan ja 241 potilasta yhden vuoden tai pidempään. SINGULAIRin turvallisuusprofiili 8 viikkoa kestäneessä kaksoissokkoutetussa pediatrisessa tehokkuustutkimuksessa oli yleensä samanlainen kuin aikuisten turvallisuusprofiili. 6–14-vuotiailla lapsipotilailla, jotka saivat SINGULAIR 5 mg:aa, seuraavia reaktioita esiintyi ≥ 2 %:lla ja useammin kuin lumelääkettä saaneilla lapsipotilailla: nielutulehdus, influenssa, kuume, sinuiitti, pahoinvointi, ripuli, dyspepsia, otitis, virusinfektio ja kurkunpäätulehdus. Harvempien haittavaikutusten esiintyvyys oli verrattavissa SINGULAIR 4 mg:n ja lumelääkkeen välillä. Pitkän hoidon aikana haittavaikutusprofiili ei muuttunut merkittävästi.
SINGULAIR 4 mg:n turvallisuusprofiili, kun sitä annettiin kerta-annoksena EIB:n ehkäisyyn 6-vuotiaille ja sitä vanhemmille lapsipotilaille, vastasi SINGULAIRille aiemmin kuvattua turvallisuusprofiilia.
Kasvunopeutta arvioivissa tutkimuksissa näiden lapsipotilaiden turvallisuusprofiili vastasi SINGULAIRille aiemmin kuvattua turvallisuusprofiilia. 56 viikkoa kestäneessä kaksoissokkotutkimuksessa, jossa arvioitiin SINGULAIR-hoitoa saaneiden 6–8-vuotiaiden lapsipotilaiden kasvunopeutta, seuraavat reaktiot, joita ei aiemmin havaittu SINGULAIRin käytön yhteydessä tässä ikäryhmässä, esiintyivät ≥ 2 %:n esiintymistiheydellä ja useammin kuin lumelääkettä saaneilla lapsipotilailla: päänsärky, nuha (tarttuva), vesirokko, gastroenteriitti, atooppinen dermatiitti, akuutti keuhkoputkentulehdus, hammastulehdus, ihotulehdus ja likinäköisyys.
2–5-vuotiaat lapsipotilaat, joilla on astma
SINGULAIRin turvallisuutta on arvioitu 573:lla 2–5-vuotiaalla lapsipotilaalla kerta- ja toistuvia annoksia koskevissa tutkimuksissa. Kliinisissä tutkimuksissa yhteensä 426 2–5-vuotiasta lapsipotilasta sai SINGULAIR 10 mg:lla vähintään 3 kuukautta, 230 6 kuukauden ajan tai pidempään ja 63 potilasta yhden vuoden tai pidempään. SINGULAIRia saaneilla 2–5-vuotiailla lapsipotilailla seuraavia reaktioita esiintyi ≥ 2 %:lla ja useammin kuin lumelääkettä saaneilla lapsipotilailla: kuume, yskä, vatsakipu, ripuli, päänsärky, rinorrea, poskiontelotulehdus, otitis, influenssa, ihottuma, korvakipu, gastroenteriitti, ekseema, nokkosihottuma, vesirokko, keuhkokuume, ihotulehdus ja sidekalvotulehdus.
6–23 kuukauden ikäiset lapsipotilaat, joilla on astma
Turvallisuutta ja tehoa alle 12 kuukauden ikäisillä astmaa sairastavilla lapsipotilailla ei ole varmistettu.
SINGULAIR 4 mg:n turvallisuutta on arvioitu 175:llä 6–23 kuukauden ikäisellä lapsipotilaalla. SINGULAIRin turvallisuusprofiili 6 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa oli yleensä samanlainen kuin turvallisuusprofiili aikuisilla ja 2–14-vuotiailla lapsipotilailla. 6–23 kuukauden ikäisillä lapsipotilailla, jotka saivat SINGULAIR 5 mg:aa, seuraavia reaktioita esiintyi ≥ 2 %:lla ja useammin kuin lumelääkettä saaneilla lapsipotilailla: ylempien hengitysteiden infektio, hengityksen vinkuminen; välikorvatulehdus; nielutulehdus, tonsilliitti, yskä; ja nuha. Harvempien haittavaikutusten esiintymistiheys oli vertailukelpoinen SINGULAIRin ja lumelääkkeen välillä.
Aikuiset ja 15-vuotiaat ja sitä vanhemmat nuoret, joilla on kausiluonteinen allerginen nuha
SINGULAIRin turvallisuutta on arvioitu kliinisissä tutkimuksissa 2199 aikuisella ja 15-vuotiaalla ja sitä vanhemmalla nuorella. Kerran vuorokaudessa aamulla tai illalla annetun SINGULAIR 10 mg:n turvallisuusprofiili oli samanlainen kuin lumelääkkeellä. Plasebokontrolloiduissa kliinisissä tutkimuksissa SINGULAIR 5 mg:lla ilmoitettiin seuraavan reaktion esiintymistiheydellä ≥ 1 % ja esiintymistiheydellä enemmän kuin lumelääkettä: ylempien hengitysteiden infektio, 1,9 % potilaista, jotka saivat SINGULAIR 4 mg vs. 1,5 % potilaista, jotka saivat lumelääkettä. 4 viikkoa kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa turvallisuusprofiili vastasi 2 viikkoa kestäneissä tutkimuksissa havaittua. Uneliaisuuden ilmaantuvuus oli kaikissa tutkimuksissa samanlainen kuin lumelääkkeellä.
2–14-vuotiaat lapsipotilaat, joilla on kausiluonteinen allerginen nuha
SINGULAIR 5 mg:aa on arvioitu 280:lla 2–14-vuotiaalla lapsipotilaalla 2 viikkoa kestäneessä, kaksoissokkoutetussa, lumekontrolloidussa, rinnakkaisryhmissä tehdyssä monikeskustutkimuksessa. Kerran vuorokaudessa iltaisin annetulla SINGULAIRilla oli samanlainen turvallisuusprofiili kuin lumelääkkeellä. Tässä tutkimuksessa seuraavia reaktioita esiintyi esiintymistiheydellä ≥ 2 % ja esiintymistiheydellä enemmän kuin lumelääkettä: päänsärky, välikorvatulehdus, nielutulehdus ja ylempien hengitysteiden tulehdus.
Aikuiset ja 15-vuotiaat ja sitä vanhemmat nuoret, joilla on monivuotinen allerginen nuha
SINGULAIRin turvallisuutta on arvioitu 3 357 aikuisella ja 15-vuotiaalla ja sitä vanhemmalla potilaalla, joilla on jatkuva allerginen nuha, joista 1 632 sai SINGULAIRia kahdessa 6 viikkoa kestäneessä kliinisessä tutkimuksessa. Kerran vuorokaudessa annetun SINGULAIR 10 mg:n turvallisuusprofiili vastasi kausiluonteista allergista nuhaa sairastavilla potilailla havaittua turvallisuusprofiilia ja samanlainen kuin lumelääkkeellä. Näissä kahdessa tutkimuksessa SINGULAIRilla ilmoitettiin seuraavat reaktiot, joiden esiintymistiheys oli ≥ 1 % ja ilmaantuvuus suurempi kuin lumelääke: sinuiitti, ylempien hengitysteiden infektio, poskiontelopäänsärky, yskä, nenäverenvuoto ja kohonnut ALAT. Uneliaisuuden ilmaantuvuus oli samanlainen kuin lumelääkkeellä.
6 kuukauden - 14 vuoden ikäiset lapsipotilaat, joilla on monivuotinen allerginen nuha
Turvallisuutta 2–14-vuotiailla potilailla, joilla on ympärivuotinen allerginen nuha, tukee turvallisuus 2–14-vuotiailla potilailla, joilla on kausiluonteista allergista nuhaa. Turvallisuutta 6–23 kuukauden ikäisillä potilailla tukevat tiedot, jotka on saatu farmakokineettisistä ja turvallisuutta ja tehoa koskevista tutkimuksista astman hoidossa tässä lapsiväestössä sekä aikuisten farmakokineettisistä tutkimuksista.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu SINGULAIRin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veren ja imunestejärjestelmän häiriöt lisääntynyt verenvuototaipumus, trombosytopenia
Immuunijärjestelmän häiriöt yliherkkyysreaktiot mukaan lukien anafylaksia, maksan eosinofiilinen infiltraatio
Psyykkiset häiriöt mukaan lukien, mutta ei rajoittuen, kiihtyneisyys, aggressiivinen käyttäytyminen tai vihamielisyys, ahdistuneisuus, masennus, sekavuus, huomiohäiriöt, unen poikkeavuudet, dysfemia (änkytys), hallusinaatiot, unettomuus, ärtyneisyys, muistin heikkeneminen, pakko-oireiset oireet, levottomuus, uneliaisuus, itsemurha-ajattelu ja -käyttäytyminen (mukaan lukien itsemurha), tic ja vapina [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ]
Hermoston häiriöt uneliaisuus, parestesia/hypoestesia, kohtaukset
Sydämen häiriöt sydämentykytys
Hengityselimet, rintakehä ja välikarsina nenäverenvuoto, keuhkojen eosinofilia
Ruoansulatuskanavan häiriöt ripuli, dyspepsia, pahoinvointi, haimatulehdus, oksentelu
Maksan ja sappien häiriöt SINGULAIRilla hoidetuilla potilailla on raportoitu kolestaattista hepatiittia, hepatosellulaarista maksavauriota ja sekamuotoista maksavauriota. Useimmat näistä ilmenivät yhdessä muiden häiritsevien tekijöiden, kuten muiden lääkkeiden käytön, kanssa tai kun SINGULAIRia annettiin potilaille, joilla oli mahdollista maksasairaus, kuten alkoholin käyttö tai muu hepatiitti.
Ihon ja ihonalaisen kudoksen häiriöt angioödeema, mustelmat, erythema multiforme, erythema nodosum, kutina, Stevens-Johnsonin oireyhtymä/toksinen epidermaalinen nekrolyysi, urtikaria
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt nivelsärky, myalgia mukaan lukien lihaskrampit
Munuaisten ja virtsateiden häiriöt enureesi lapsilla
Yleiset häiriöt ja antopaikan haitat turvotus
SINGULAIR-hoitoa saavilla astmapotilailla voi esiintyä systeemistä eosinofiliaa, jossa voi joskus esiintyä vaskuliitin kliinisiä piirteitä, jotka vastaavat Churg-Straussin oireyhtymää, tila, jota usein hoidetaan systeemisellä kortikosteroidihoidolla. Näitä reaktioita on joskus liitetty oraalisen kortikosteroidihoidon vähentämiseen. Lääkäreiden tulee olla varuillaan potilailla esiintyvien eosinofilian, vaskuliittisten ihottumien, pahenevien keuhkooireiden, sydänkomplikaatioiden ja/tai neuropatian suhteen [ks. VAROITUKSET JA VAROTOIMET ].
HUUMEIDEN VUOROVAIKUTUKSET
Annosta ei tarvitse muuttaa, kun SINGULAIR 5 mg annetaan samanaikaisesti teofylliinin, prednisonin, prednisolonin, oraalisten ehkäisyvalmisteiden, feksofenadiinin, digoksiinin, varfariinin, gemfibrotsiilin, itrakonatsolin, kilpirauhashormonien, rauhoittavien unilääkkeiden, ei-steroidisten tulehduskipulääkkeiden, bentsodiatsepiinien kanssa. ja sytokromi P450 (CYP) -entsyymi-indusoijat [katso KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Neuropsykiatriset tapahtumat
Vakavia neuropsykiatrisia (NP) tapahtumia on raportoitu SINGULAIRin käytön yhteydessä. Nämä markkinoille tulon jälkeiset raportit ovat olleet hyvin vaihtelevia ja sisältävät, mutta eivät rajoittuneet, kiihtyneisyyttä, aggressiivista käyttäytymistä tai vihamielisyyttä, ahdistuneisuutta, masennusta, desorientaatiota, huomiohäiriöitä, unen poikkeavuuksia, dysfemiaa (änkytystä), hallusinaatioita, unettomuutta, ärtyneisyyttä, muistin heikkenemistä, pakko-oireiset oireet, levottomuus, somnambulismi, itsemurha-ajatukset ja -käyttäytyminen (mukaan lukien itsemurha), tic ja vapina. NP-tapahtumia on raportoitu aikuisilla, nuorilla ja lapsipotilailla, joilla on tai ei ole aiemmin ollut psykiatrista häiriötä. NP-tapahtumia on raportoitu enimmäkseen SINGULAIR 10 mg -hoidon aikana, mutta joitakin niistä on raportoitu SINGULAIR 5 mg -hoidon lopettamisen jälkeen. Eläintutkimukset osoittivat, että montelukasti jakautuu rottien aivoihin [katso KLIININEN FARMAKOLOGIA ]; SINGULAIRiin liittyvien NP-tapahtumien taustalla olevia mekanismeja ei kuitenkaan tällä hetkellä ymmärretä hyvin. Saatavilla olevien tietojen perusteella on vaikea tunnistaa NP-tapahtumien riskitekijöitä tai määrittää niiden riskiä SINGULAIR 10 mg:n käytön yhteydessä.
NP-tapahtumien riskin vuoksi SINGULAIRin hyödyt eivät ehkä ole riskejä suuremmat joillakin potilailla, varsinkin kun sairauden oireet voivat olla lieviä ja niitä on hoidettu riittävästi vaihtoehtoisilla hoidoilla. Varaa SINGULAIR 4 mg:n käyttö potilaille, joilla on allerginen nuha ja joilla on riittämätön vaste tai intoleranssi vaihtoehtoisiin hoitoihin [ks. INDIKAATIOT ]. Potilaille, joilla on astma tai rasituksen aiheuttama bronkokonstriktio, harkitse hyödyt ja riskit ennen SINGULAIRin määräämistä.
Keskustele SINGULAIR 10 mg:n käytön hyödyistä ja riskeistä potilaiden ja hoitajien kanssa, kun määräät SINGULAIRia. Neuvo potilaita ja/tai hoitajia olemaan valppaana käyttäytymismuutosten tai uusien NP-oireiden varalta SINGULAIR-hoidon aikana. Jos havaitset muutoksia käyttäytymisessä tai jos ilmaantuu uusia NP-oireita tai itsemurha-ajatuksia ja/tai -käyttäytymistä, kehota potilaita lopettamaan SINGULAIR 10mg -valmisteen käyttö ja ottamaan välittömästi yhteyttä terveydenhuollon tarjoajaan. Monissa tapauksissa oireet hävisivät SINGULAIR-hoidon lopettamisen jälkeen; Joissakin tapauksissa oireet kuitenkin jatkuivat SINGULAIR-hoidon lopettamisen jälkeen. Siksi jatka seurantaa ja tukihoidon antamista, kunnes oireet häviävät. Arvioi uudelleen SINGULAIR 10 mg -hoidon uudelleen aloittamisen hyödyt ja riskit, jos tällaisia tapahtumia ilmenee.
Akuutti astma
SINGULAIR ei ole tarkoitettu käytettäväksi bronkospasmin poistamiseen akuuteissa astmakohtauksissa, mukaan lukien status astmaattinen kohtaus. Potilaita tulee neuvoa, että heillä on saatavilla tarvittavat pelastuslääkkeet. SINGULAIR 4 mg -hoitoa voidaan jatkaa astman akuuttien pahenemisvaiheiden aikana. Potilailla, joilla on astman pahenemisvaihe harjoituksen jälkeen, tulee olla saatavilla lyhytvaikutteinen inhaloitava beeta-agonisti.
Samanaikainen kortikosteroidien käyttö
Vaikka inhaloitavan kortikosteroidin annosta voidaan pienentää asteittain lääkärin valvonnassa, SINGULAIRia ei tule äkillisesti korvata inhaloitavilla tai suun kautta otetuilla kortikosteroideilla.
Aspiriinin herkkyys
Potilaiden, joiden tiedetään olevan herkkiä aspiriinille, tulee edelleen välttää aspiriinia tai ei-steroidisia tulehduskipulääkkeitä SINGULAIR-hoidon aikana. Vaikka SINGULAIR parantaa tehokkaasti hengitysteiden toimintaa astmaatikoilla, joilla on dokumentoitu aspiriiniherkkyys, sen ei ole osoitettu katkaisevan bronkokonstriktorivastetta aspiriinille ja muille ei-steroidisille tulehduskipulääkkeille aspiriinille herkillä astmapotilailla [ks. Kliiniset tutkimukset ].
Eosinofiiliset tilat
SINGULAIR-hoitoa saavilla astmapotilailla voi esiintyä systeemistä eosinofiliaa, jossa voi joskus esiintyä vaskuliitin kliinisiä piirteitä, jotka vastaavat Churg-Straussin oireyhtymää, tila, jota usein hoidetaan systeemisellä kortikosteroidihoidolla. Nämä tapahtumat on joskus liitetty suun kautta otettavan kortikosteroidihoidon vähentämiseen. Lääkäreiden tulee olla varuillaan potilailla esiintyvien eosinofilian, vaskuliittisten ihottumien, pahenevien keuhkooireiden, sydänkomplikaatioiden ja/tai neuropatian suhteen. SINGULAIR 10 mg:n ja näiden taustalla olevien sairauksien välillä ei ole osoitettu syy-yhteyttä [ks. HAITTAVAIKUTUKSET ].
Riski potilailla, joilla on fenyyliketonuria
SINGULAIR 4mg sisältää aspartaamia, fenyylialaniinin lähdettä. Fenyylialaniini voi olla haitallista potilaille, joilla on fenyyliketonuria (PKU). Jokainen 4 mg:n ja 5 mg:n purutabletti sisältää 0,674 mg ja 0,842 mg fenyylialaniinia. Ennen kuin määräät SINGULAIRia potilaalle, jolla on PKU, harkitse fenyylialaniinin yhdistettyä päivittäistä määrää kaikista lähteistä, mukaan lukien SINGULAIR.
Potilasneuvontatiedot
Neuvo potilasta ja/tai hoitajaa lukemaan tablettien ja purutablettien osalta FDA:n hyväksymät potilasmerkinnät ( Lääkitysopas ).
Suun kautta otettavien rakeiden osalta neuvo potilasta ja/tai hoitajaa lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ja käyttöohjeet ).
- Neuvo potilaita vakavien neuropsykiatristen oireiden ja käyttäytymismuutosten mahdollisesta riskistä SINGULAIRin käytön yhteydessä [ks. VAROITUKSET JA VAROTOIMET ].
- Keskustele SINGULAIRin hyödyistä ja riskeistä potilaiden kanssa, kun määräät tai jatkat SINGULAIR-hoitoa [ks. VAROITUKSET JA VAROTOIMET ].
- Neuvo potilaita seuraamaan käyttäytymisen tai neuropsykiatristen oireiden muutoksia potilailla, jotka käyttävät SINGULAIRia [katso VAROITUKSET JA VAROTOIMET ].
- Neuvo potilaita lopettamaan SINGULAIR-hoito ja ottamaan välittömästi yhteyttä terveydenhuollon tarjoajaan, jos käyttäytymisessä tai ajattelussa tapahtuu muutoksia, jotka eivät ole tyypillisiä potilaalle tai jos potilaalle kehittyy itsemurha-ajatuksia tai itsemurhakäyttäytyminen [ks. VAROITUKSET JA VAROTOIMET ].
- Neuvo potilaita ottamaan SINGULAIRia päivittäin ohjeiden mukaan, vaikka he olisivat oireettomia, sekä astman pahenemisjaksojen aikana, ja ottamaan yhteyttä lääkäriin, jos heidän astmansa ei ole hyvin hallinnassa.
- Kerro potilaille, että suun kautta otettava SINGULAIR ei ole tarkoitettu akuuttien astmakohtausten hoitoon. Heillä tulee olla saatavilla sopiva lyhytvaikutteinen inhaloitava β-agonistilääkitys astman pahenemisvaiheiden hoitoon. Potilaita, joilla on astman pahenemisvaihe harjoituksen jälkeen, tulee neuvoa, että heillä on oltava lyhytvaikutteinen inhaloitava beeta-agonisti. SINGULAIRin päivittäistä antamista astman krooniseen hoitoon ei ole osoitettu estämään EIB:n akuutteja jaksoja [ks. VAROITUKSET JA VAROTOIMET ].
- Neuvo potilaita hakeutumaan lääkärin hoitoon, jos lyhytvaikutteisia inhaloitavia keuhkoputkia laajentavia lääkkeitä tarvitaan tavallista useammin tai jos tarvitaan enemmän kuin 24 tunnin ajaksi määrätty lyhytvaikutteisen bronkodilataattorihoidon enimmäismäärä.
- Neuvo potilaita jatkamaan muita astmalääkkeitä kuten on määrätty, ellei lääkäri ole niin kehottanut.
- Neuvo potilaita, joiden tiedetään olevan herkkiä aspiriinille, jatkamaan aspiriinin tai ei-steroidisten tulehduskipulääkkeiden välttämistä SINGULAIR-hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ].
- Kerro fenyyliketonuriapotilaille, että 4 mg:n ja 5 mg:n purutabletit sisältävät fenyylialaniinia (aspartaamin lähde) [ks. VAROITUKSET JA VAROTOIMET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Tuumorigeenisyydestä ei havaittu todisteita karsinogeenisuustutkimuksissa, jotka kestivät 2 vuotta Sprague-Dawley-rotilla tai 92 viikkoa hiirillä, kun annos oli 200 mg/kg/vrk tai 100 mg/kg/vrk. Arvioitu altistuminen rotilla oli noin 120 ja 75 kertaa AUC aikuisilla ja 75 kertaa suurempi kuin lasten AUC suurin suositellulla vuorokausiannoksella suun kautta. Arvioitu altistuminen hiirillä oli noin 45 ja 25 kertaa AUC aikuisilla ja 25 kertaa suurempi kuin lasten AUC suurin suositellulla vuorokausiannoksella suun kautta.
Montelukastilla ei havaittu näyttöä mutageenisesta tai klastogeenisesta aktiivisuudesta seuraavissa määrityksissä: mikrobien mutageneesimääritys, V-79-nisäkässolujen mutageneesimääritys, alkalinen eluutiomääritys rotan maksasoluissa, kromosomipoikkeavuusmääritys kiinanhamsterin munasarjasoluissa ja vivo hiiren luuytimen kromosomipoikkeavuusmääritys.
Naarasrotilla tehdyissä hedelmällisyystutkimuksissa montelukasti aiheutti hedelmällisyyden ja hedelmällisyyden indeksien laskua suun kautta annetulla annoksella 200 mg/kg (arvioitu altistus oli noin 70 kertaa suurempi kuin aikuisten AUC suurin suositellulla vuorokausiannoksella). Mitään vaikutuksia naisten hedelmällisyyteen tai hedelmällisyyteen ei havaittu oraalisella annoksella 100 mg/kg (arvioitu altistus oli noin 20 kertaa suurempi kuin aikuisten AUC suurin suositellulla vuorokausiannoksella). Montelukastilla ei ollut vaikutusta urosrottien hedelmällisyyteen oraalisilla annoksilla aina 800 mg/kg asti (arvioitu altistus oli noin 160 kertaa suurempi kuin aikuisten AUC suurin suositellulla vuorokausiannoksella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot julkaistuista prospektiivisistä ja retrospektiivisistä kohorttitutkimuksista vuosikymmeniä montelukastin käytöstä raskaana oleville naisille eivät ole osoittaneet lääkkeisiin liittyvää vakavien synnynnäisten epämuodostumien riskiä [ks. Data ]. Eläinten lisääntymistutkimuksissa ei havaittu haitallisia kehitysvaikutuksia, kun montelukastia annettiin suun kautta tiineille rotille ja kaneille organogeneesin aikana annoksilla, jotka olivat vastaavasti noin 100-kertaisia ja 110-kertaisia annoksilla, jotka olivat vastaavasti suurinta suositeltua ihmisen suun kautta otettavaa päivittäistä annostusta (MRHDOD) AUC-arvojen perusteella [ks. Data ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Vuonna
USA:n väestön arvioitu taustariski vakaville synnynnäisille epämuodostumille ja keskenmenolle kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Heikosti tai kohtalaisesti hallittu astma raskauden aikana lisää äidin riskiä synnyttää perinataalisia haittavaikutuksia, kuten preeklampsiaa ja vauvan ennenaikaisuutta, alhaista syntymäpainoa ja raskausikään nähden pientä.
Data
Ihmistiedot
Prospektiivisista ja retrospektiivisistä kohorttitutkimuksista julkaistut tiedot eivät ole havainneet yhteyttä SINGULAIRin käyttöön raskauden ja vakavien synnynnäisten epämuodostumien kanssa. Saatavilla olevilla tutkimuksilla on metodologisia rajoituksia, kuten pieni otoskoko, joissakin tapauksissa retrospektiivinen tiedonkeruu ja epäjohdonmukaiset vertailuryhmät.
Eläinten tiedot
Alkion ja sikiön kehitystutkimuksissa tiineillä rotilla ja kaniineilla organogeneesin aikana (raskauspäivät 6-17 rotilla ja 6-18 kaneilla) annettu montelukasti ei aiheuttanut haitallisia kehitysvaikutuksia emon suun kautta annetuilla annoksilla 400 ja 300 mg/kg asti. /vrk rotilla ja kaniineilla (noin 100 ja 110 kertaa AUC ihmisillä MRHDOD:ssa).
Imetys
Riskien yhteenveto
Julkaistu kliininen imetystutkimus raportoi montelukastin esiintyvän äidinmaidossa. Saatavilla olevat tiedot lääkkeen vaikutuksista imeväisiin joko suoraan [katso Käyttö lapsille tai rintamaidon kautta, eivät viittaa merkittävään SINGULAIR-altistuksen haittavaikutusten riskiin. Lääkkeen vaikutuksia maidontuotantoon ei tunneta. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen SINGULAIR 5 mg:n tarve ja SINGULAIR 10 mg:n mahdolliset haittavaikutukset imetettävälle lapselle tai äidin taustalla oleva tila.
Käyttö lapsille
SINGULAIRin turvallisuus ja tehokkuus astman hoidossa on osoitettu 6–14-vuotiailla lapsipotilailla. SINGULAIR 4 mg:n käyttöä tähän käyttöaiheeseen tukee hyvin kontrolloiduista tutkimuksista saatu näyttö. Turvallisuus- ja tehotiedot tässä ikäryhmässä ovat samanlaisia kuin aikuisilla [katso HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA , Tietyt populaatiot , ja Kliiniset tutkimukset ].
SINGULAIRin tehokkuus kausiluonteisen allergisen nuhan hoidossa 2–14-vuotiailla lapsipotilailla ja ympärivuotisen allergisen nuhan hoidossa 6 kuukauden–14-vuotiailla lapsipotilailla on osoitettu, ja sitä tukee osoitetun tehokkuuden ekstrapolointi. 15-vuotiailla ja sitä vanhemmilla potilailla, joilla on allerginen nuha, sekä olettamus, että taudin kulku, patofysiologia ja lääkkeen vaikutus ovat oleellisesti samanlaisia näissä populaatioissa.
SINGULAIR 4 mg purutablettien turvallisuus 2–5-vuotiailla astmaa sairastavilla lapsipotilailla on osoitettu riittävillä ja hyvin kontrolloiduilla tiedoilla [ks. HAITTAVAIKUTUKSET ]. SINGULAIR 5 mg:n tehokkuus tässä ikäryhmässä on ekstrapoloitu 6-vuotiailla ja sitä vanhemmilla astmapotilailla osoitetusta tehokkuudesta, ja se perustuu samanlaisiin farmakokineettisiin tietoihin sekä olettamukseen, että taudin kulku, patofysiologia ja lääkkeen vaikutus ovat olennaisesti samanlaisia. näiden populaatioiden joukossa. Tehokkuutta tässä ikäryhmässä tukevat 2–5-vuotiailla potilailla tehdyt laajan, hyvin kontrolloidun turvallisuustutkimuksen tutkivat tehonarvioinnit.
SINGULAIR 4 mg:n oraalisten rakeiden turvallisuus 12–23 kuukauden ikäisillä astmaa sairastavilla lapsipotilailla on osoitettu analyysissä, johon osallistui 172 lapsipotilasta, joista 124:ää hoidettiin SINGULAIRilla, 6 viikon kaksoissokkoutetussa lumelääketutkimuksessa. -kontrolloitu tutkimus [katso HAITTAVAIKUTUKSET ]. SINGULAIRin tehokkuus tässä ikäryhmässä on ekstrapoloitu 6-vuotiailla ja sitä vanhemmilla astmapotilailla osoitetusta tehokkuudesta, joka perustuu samanlaiseen keskimääräiseen systeemiseen altistukseen (AUC) ja että taudin kulku, patofysiologia ja lääkkeen vaikutus ovat olennaisesti samanlaisia näissä populaatioissa. , jota tukevat tehokkuustiedot turvallisuustutkimuksesta, jossa teho oli tutkiva arviointi.
SINGULAIR 4 mg:n ja 5 mg:n purutablettien turvallisuutta allergista nuhaa sairastavilla 2–14-vuotiailla lapsipotilailla tukevat 2–14-vuotiailla astmaa sairastavilla lapsipotilailla tehdyistä tutkimuksista saadut tiedot. Turvallisuustutkimus 2–14-vuotiailla lapsipotilailla, joilla oli kausiluonteista allergista nuhaa, osoitti samanlaisen turvallisuusprofiilin [ks. HAITTAVAIKUTUKSET ]. SINGULAIR 4 mg oraalisten rakeiden turvallisuutta alle 6 kuukauden ikäisillä lapsipotilailla, joilla on ympärivuotinen allerginen nuha, tukee ekstrapolointi turvallisuustiedoista, jotka on saatu 6 kuukauden–23 kuukauden ikäisillä astmapotilailla tehdyistä tutkimuksista ja farmakokineettisistä tiedoista. vertaamalla systeemisiä altistuksia 6 kuukauden - 23 kuukauden ikäisillä potilailla aikuisten systeemisiin altistuksiin.
Turvallisuutta ja tehokkuutta alle 12 kuukauden ikäisillä lapsipotilailla, joilla on astma, 6 kuukauden ikäisillä ympärivuotisella allergisella nuhalla ja 6 vuoden ikäisillä, joilla on rasituksen aiheuttama bronkokonstriktio, ei ole osoitettu.
Kasvunopeus lapsipotilailla
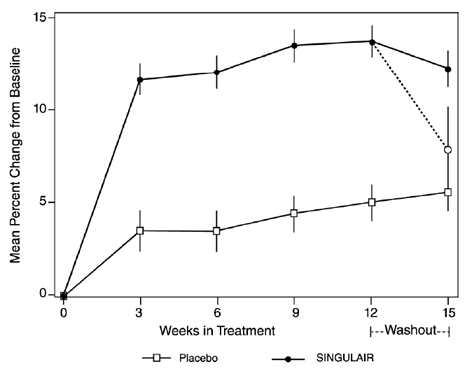
56 viikkoa kestänyt, monikeskus, kaksoissokkoutettu, satunnaistettu, aktiivi- ja lumekontrolloitu rinnakkaisryhmätutkimus suoritettiin arvioimaan SINGULAIR 4 mg:n vaikutusta kasvunopeuteen 360 potilaalla, joilla oli lievä astma, iältään 6–8 vuotta. Hoitoryhmiin kuuluivat SINGULAIR 5 mg kerran vuorokaudessa, lumelääke ja beklometasonidipropionaatti 168 mikrogrammaa kahdesti vuorokaudessa välikappaleen kanssa. Jokaiselle koehenkilölle kasvunopeus määriteltiin pituusmittauksiin sopivan lineaarisen regressioviivan kaltevuudeksi 56 viikon aikana. Ensisijainen vertailu oli kasvunopeuksien ero SINGULAIR- ja lumeryhmien välillä. Kasvunopeudet, ilmaistuna pienimmän neliösumman (LS) keskiarvona (95 % CI) cm/vuosi, SINGULAIR-, lume- ja beklometasonihoitoryhmissä olivat 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) ja 4,86 ( 4,64 ja 5,08). Erot kasvunopeuksissa, ilmaistuna pienimmän neliösumman (LS) keskiarvona (95 % CI) cm/vuosi, SINGULAIR 5 mg miinus lumelääke, beklometasoni miinus lumelääke ja SINGULAIR 5 mg miinus beklometasoni hoitoryhmissä olivat 0,03 (-0,26, 0,31). , -0,78 (-1,06, -0,49); ja 0,81 (0,53, 1,09), vastaavasti. Kasvunopeus (ilmaistuna keskimääräisenä pituuden muutoksena ajan kuluessa) kussakin hoitoryhmässä on esitetty KUVASSA 1.
Kuva 1: Muutos korkeudessa (cm) satunnaiskäynnistä aikataulun mukaan (hoitoryhmän keskiarvo ± keskiarvon standardivirhe*)
Geriatrinen käyttö
Montelukastin kliinisissä tutkimuksissa koehenkilöiden kokonaismäärästä 3,5 % oli vähintään 65-vuotiaita ja 0,4 % 75-vuotiaita tai vanhempia. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois. Suun kautta otettavan 10 mg:n montelukastin kerta-annoksen farmakokineettinen profiili ja biologinen hyötyosuus ovat samanlaiset vanhuksilla ja nuoremmilla aikuisilla. Montelukastin puoliintumisaika plasmassa on hieman pidempi vanhuksilla. Annosta ei tarvitse muuttaa vanhuksilla.
Maksan vajaatoiminta
Annoksen muuttamista ei suositella potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta [ks. KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Annoksen muuttamista ei suositella potilaille, joilla on munuaisten vajaatoiminta [katso KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
SINGULAIR-yliannostuksen hoidosta ei ole saatavilla erityistä tietoa. Yliannostustapauksessa on järkevää käyttää tavanomaisia tukitoimenpiteitä; esim. poista imeytymätön aines ruoansulatuskanavasta, käytä kliinistä seurantaa ja aloita tarvittaessa tukihoito. Ei tiedetä, poistetaanko montelukasti peritoneaalidialyysillä vai hemodialyysillä.
VASTA-AIHEET
SINGULAIR on vasta-aiheinen potilaille, jotka ovat yliherkkiä jollekin sen aineosalle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Kysteinyylileukotrieenit (LTC4, LTD4, LTE4) ovat arakidonihapon aineenvaihdunnan tuotteita ja vapautuvat eri soluista, mukaan lukien syöttösolut ja eosinofiilit. Nämä eikosanoidit sitoutuvat kysteinyylileukotrieeni (CysLT) -reseptoreihin. CysLT-tyypin 1 (CysLT1) -reseptoria löytyy ihmisen hengitysteistä (mukaan lukien hengitysteiden sileät lihassolut ja hengitysteiden makrofagit) ja muista tulehdusta edistävistä soluista (mukaan lukien eosinofiilit ja tietyt myelooiset kantasolut). CysLT:t on korreloitu astman ja allergisen nuhan patofysiologian kanssa. Astmassa leukotrieenivälitteisiä vaikutuksia ovat hengitysteiden turvotus, sileän lihaksen supistuminen ja tulehdusprosessiin liittyvä muuttunut soluaktiivisuus. Allergisessa nuhassa CysLT:t vapautuvat nenän limakalvosta allergeenialtistuksen jälkeen sekä varhaisen että myöhäisen vaiheen reaktioiden aikana ja niihin liittyy allergisen nuhan oireita.
Montelukast on oraalisesti aktiivinen yhdiste, joka sitoutuu suurella affiniteetilla ja selektiivisyydellä CysLT1-reseptoriin (ensisijaisesti muihin farmakologisesti tärkeisiin hengitysteiden reseptoreihin, kuten prostanoidi-, kolinergiseen tai β-adrenergiseen reseptoriin). Montelukasti estää LTD4:n fysiologisia vaikutuksia CysLT1-reseptoriin ilman agonistiaktiivisuutta.
Farmakodynamiikka
Montelukasti estää hengitysteiden kysteinyylileukotrieenireseptoreja, minkä osoittaa kyky estää astmaatikoilla inhaloidun LTD4:n aiheuttamaa bronkokonstriktiota. Jo 5 mg:n annokset estävät LTD4:n aiheuttaman bronkokonstriktion merkittävästi. Plasebokontrolloidussa jakotutkimuksessa (n = 12) SINGULAIR 4 mg esti antigeenialtistuksen aiheuttamaa varhaisen ja myöhäisen vaiheen bronkokonstriktiota 75 % ja 57 %.
SINGULAIR 5 mg:n vaikutusta perifeerisen veren eosinofiileihin tutkittiin kliinisissä tutkimuksissa. 2-vuotiailla ja sitä vanhemmilla astmapotilailla, jotka saivat SINGULAIR 10 mg:aa, havaittiin keskimääräisen perifeerisen veren eosinofiilimäärän lasku 9–15 % lumelääkkeeseen verrattuna kaksoissokkoutettujen hoitojaksojen aikana. Yli 15-vuotiailla kausiluonteista allergista nuhaa sairastavilla potilailla, jotka saivat SINGULAIR 4 mg:aa, havaittiin perifeerisen veren eosinofiilimäärän keskimääräinen nousu 0,2 % verrattuna kaksoissokkohoitoon verrattuna keskimäärin 12,5 % lumelääkettä saaneilla potilailla. jaksot; tämä kuvastaa keskimääräistä 12,3 %:n eroa SINGULAIRin hyväksi. Näiden havaintojen ja kliinisissä tutkimuksissa havaittujen montelukastin kliinisten hyötyjen välistä yhteyttä ei tunneta [ks. Kliiniset tutkimukset ].
Farmakokinetiikka
Imeytyminen
Montelukasti imeytyy nopeasti oraalisen annon jälkeen. Kun 10 mg:n kalvopäällysteinen tabletti on annettu paastolle aikuisille, montelukastin keskimääräinen huippupitoisuus plasmassa (Cmax) saavutetaan 3–4 tunnissa (Tmax). Keskimääräinen oraalinen hyötyosuus on 64 %. Normaali aamu-ateria ei vaikuta oraaliseen hyötyosuuteen ja Cmax:iin.
5 mg:n purutabletin keskimääräinen Cmax saavutetaan 2–2,5 tunnissa sen jälkeen, kun se on annettu aikuisille paastotilassa. Keskimääräinen oraalinen hyötyosuus on 73 % paastotilassa verrattuna 63 %:iin, kun lääke otetaan tavallisen aterian yhteydessä aamulla.
4 mg:n purutabletin keskimääräinen Cmax saavutetaan 2 tunnin kuluttua annon jälkeen 2–5-vuotiailla lapsipotilailla paastotilassa.
mg:n oraalinen raeformulaatio on bioekvivalentti 4 mg:n purutabletin kanssa, kun se annetaan aikuisille paastotilassa. Suun kautta otettavan raeformulaation ja omenasoseen yhteiskäytöllä ei ollut kliinisesti merkittävää vaikutusta montelukastin farmakokinetiikkaan. Runsasrasvainen ateria aamulla ei vaikuttanut oraalisten montelukastirakeiden AUC-arvoon; ateria kuitenkin pienensi Cmax-arvoa 35 % ja pidensi Tmax-arvoa 2,3 ± 1,0 tunnista 6,4 ± 2,9 tuntiin.
SINGULAIRin turvallisuus ja tehokkuus astmapotilailla osoitettiin kliinisissä tutkimuksissa, joissa 10 mg:n kalvopäällysteiset tabletit ja 5 mg:n purutabletit annettiin iltaisin riippumatta ruuan nauttimisajasta. SINGULAIR 4 mg:n turvallisuus astmapotilailla osoitettiin myös kliinisissä tutkimuksissa, joissa 4 mg:n purutabletti ja 4 mg:n suun kautta otettavat rakeet annettiin illalla ruoan nauttimisajasta riippumatta. SINGULAIR-valmisteen turvallisuus ja tehokkuus kausiluonteista allergista nuhaa sairastavilla potilailla osoitettiin kliinisissä tutkimuksissa, joissa 10 mg:n kalvopäällysteinen tabletti annettiin aamulla tai illalla ruoan nauttimisajasta riippumatta.
Montelukastin vertailevaa farmakokinetiikkaa annettaessa kaksi 5 mg:n purutablettia verrattuna yhteen 10 mg:n kalvopäällysteiseen tablettiin ei ole arvioitu.
Jakelu
Montelukasti sitoutuu yli 99 % plasman proteiineihin. Montelukastin vakaan tilan jakautumistilavuus on keskimäärin 8-11 litraa. Suun kautta annettu montelukasti jakautuu rotilla aivoihin.
Eliminointi
Montelukastin plasmapuhdistuma on keskimäärin 45 ml/min terveillä aikuisilla. Radioaktiivisesti leimatun montelukastin oraalisen annoksen jälkeen 86 % radioaktiivisuudesta havaittiin 5 päivän ulostekeräyksissä ja
Useissa tutkimuksissa montelukastin keskimääräinen puoliintumisaika plasmassa oli 2,7–5,5 tuntia terveillä nuorilla aikuisilla. Montelukastin farmakokinetiikka on lähes lineaarinen oraalisilla annoksilla 50 mg:aan asti. Käytettäessä 10 mg:n montelukastia kerran vuorokaudessa emolääkkeen kertyminen plasmaan on vähäistä (14 %).
Aineenvaihdunta
Montelukasti metaboloituu laajalti. Terapeuttisilla annoksilla tehdyissä tutkimuksissa montelukastin metaboliittien plasmapitoisuuksia ei pystytty havaitsemaan vakaassa tilassa aikuisilla ja lapsipotilailla.
Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittavat, että CYP3A4, 2C8 ja 2C9 osallistuvat montelukastin metaboliaan. Kliinisesti merkittävinä pitoisuuksina 2C8:lla näyttää olevan tärkeä rooli montelukastin metaboliassa.
Tietyt populaatiot
Potilaat, joilla on maksan vajaatoiminta
Potilailla, joilla oli lievä tai keskivaikea maksan vajaatoiminta ja kliinisiä merkkejä kirroosista, havaittiin merkkejä montelukastin heikentyneestä metaboliasta, mikä johti 41 % (90 % CI = 7 %, 85 %) korkeampaan montelukastin keskimääräiseen AUC-arvoon 10 mg:n kerta-annoksen jälkeen. Montelukastin eliminaatio oli hieman pitempi kuin terveillä koehenkilöillä (keskimääräinen puoliintumisaika, 7,4 tuntia). Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai keskivaikea maksan vajaatoiminta. SINGULAIRin farmakokinetiikkaa potilailla, joilla on vaikeampi maksan vajaatoiminta tai hepatiitti, ei ole arvioitu.
Potilaat, joilla on munuaisten vajaatoiminta
Koska montelukasti ja sen metaboliitit eivät erity virtsaan, montelukastin farmakokinetiikkaa ei ole arvioitu munuaisten vajaatoimintaa sairastavilla potilailla. Annoksen muuttamista ei suositella näille potilaille.
Mies- ja naispotilaat
Montelukastin farmakokinetiikka on samanlainen miehillä ja naisilla.
Roturyhmät
Rotuun johtuvia farmakokineettisiä eroja ei ole tutkittu.
Nuoret ja lapsipotilaat
Farmakokineettisissä tutkimuksissa arvioitiin systeeminen altistus 4 mg:n oraaliselle rakemuodolle 6–23 kuukauden ikäisillä lapsipotilailla, 4 mg:n purutableteilla 2–5-vuotiailla lapsipotilailla ja 5 mg:n purutableteilla lapsipotilailla 6 14-vuotiaille ja 10 mg:n kalvopäällysteisiä tabletteja nuorille aikuisille ja ≥15-vuotiaille nuorille.
Montelukastin plasmapitoisuusprofiili 10 mg:n kalvopäällysteisen tabletin annon jälkeen on samanlainen ≥15-vuotiailla nuorilla ja nuorilla aikuisilla. 10 mg:n kalvopäällysteistä tablettia suositellaan käytettäväksi ≥15-vuotiaille potilaille.
Keskimääräinen systeeminen altistus 4 mg:n purutabletille 2–5-vuotiailla lapsipotilailla ja 5 mg:n purutableteilla 6–14-vuotiailla lapsipotilailla on samanlainen kuin 10 mg:n kalvon keskimääräinen systeeminen altistus. päällystetty tabletti aikuisille. 5 mg:n purutablettia tulee käyttää 6–14-vuotiaille lapsipotilaille ja 4 mg:n purutablettia 2–5-vuotiaille lapsipotilaille.
6–11 kuukauden ikäisillä lapsilla systeeminen altistuminen montelukastille ja montelukastipitoisuuksien vaihtelu plasmassa olivat suurempia kuin aikuisilla. Populaatioanalyysien perusteella keskimääräinen AUC (4296 ng•hr/ml [vaihteluväli 1200-7153]) oli 60 % suurempi ja keskimääräinen Cmax (667 ng/ml [vaihteluväli 201-1058]) 89 % korkeampi kuin aikuiset (keskimääräinen AUC 2689 ng•hr/ml [alue 1521-4595]) ja keskimääräinen Cmax (353 ng/ml [vaihteluväli 180-548]). Systeeminen altistuminen 12–23 kuukauden ikäisillä lapsilla oli vähemmän vaihtelevaa, mutta silti korkeampi kuin aikuisilla. Keskimääräinen AUC (3574 ng•hr/ml [alue 2229-5408]) oli 33 % korkeampi ja keskimääräinen Cmax (562 ng/ml [vaihteluväli 296-814]) oli 60 % korkeampi kuin aikuisilla havaitut. Montelukastin turvallisuus ja siedettävyys kerta-annoksen farmakokineettisessä tutkimuksessa 26 lapsella 6–23 kuukauden ikäisillä olivat samanlaiset kuin 2-vuotiailla ja sitä vanhemmilla potilailla [ks. HAITTAVAIKUTUKSET ]. 4 mg:n oraalista rakemuotoilua tulee käyttää 12–23 kuukauden ikäisille lapsipotilaille astman hoitoon tai 6–23 kuukauden ikäisille lapsipotilaille ympärivuotisen allergisen nuhan hoitoon. Koska 4 mg:n oraalinen raeformulaatio on bioekvivalentti 4 mg:n purutabletin kanssa, sitä voidaan käyttää myös vaihtoehtona 4 mg:n purutabletille 2–5-vuotiailla lapsipotilailla.
Huumeiden vuorovaikutustutkimukset
Teofylliini, prednisoni ja prednisoloni
SINGULAIRia on annettu muiden astman ennaltaehkäisyssä ja kroonisessa hoidossa rutiininomaisesti käytettyjen hoitojen kanssa ilman, että haittavaikutukset ovat lisääntyneet. Lääkkeiden yhteisvaikutustutkimuksissa suositellulla kliinisellä montelukastin annoksella ei ollut kliinisesti merkittäviä vaikutuksia seuraavien lääkkeiden farmakokinetiikkaan: teofylliini, prednisoni ja prednisoloni.
Montelukasti 10 mg kerran vuorokaudessa annosteltuna farmakokineettiseen vakaaseen tilaan ei aiheuttanut kliinisesti merkittäviä muutoksia teofylliinin [pääasiassa sytokromi P450 (CYP) 1A2-substraatti] laskimonsisäisen kerta-annoksen kinetiikassa. Montelukasti ≥ 100 mg:n vuorokausiannoksilla, kun se annosteltiin farmakokineettiseen vakaaseen tilaan, ei aiheuttanut kliinisesti merkitseviä muutoksia prednisonin tai prednisolonin plasmaprofiileissa joko oraalisen prednisonin tai suonensisäisen prednisolonin antamisen jälkeen.
Suun kautta otettavat ehkäisyvalmisteet, feksofenadiini, digoksiini ja varfariini
Lääkkeiden yhteisvaikutustutkimuksissa suositellulla kliinisellä montelukastin annoksella ei ollut kliinisesti merkittäviä vaikutuksia seuraavien lääkkeiden farmakokinetiikkaan: suun kautta otettavat ehkäisyvalmisteet (noretindroni 1 mg/etinyyliestradioli 35 mikrogrammaa), digoksiini ja varfariini. Montelukasti ≥ 100 mg:n vuorokausiannoksilla farmakokineettisen vakaan tilan saavuttamiseen ei muuttanut merkitsevästi noretindronia 1 mg/etinyyliestradiolia 35 mikrog sisältävän oraalisen ehkäisyvalmisteen kummankaan osan pitoisuuksia plasmassa. Montelukasti 10 mg kerran vuorokaudessa annosteltuna farmakokineettiseen vakaaseen tilaan ei muuttanut feksofenadiinin plasmapitoisuusprofiilia, ei muuttanut immunoreaktiivisen digoksiinin farmakokineettistä profiilia tai erittymistä virtsaan. ei muuttanut varfariinin (ensisijaisesti CYP2C9:n, 3A4:n ja 1A2:n substraatti) farmakokineettistä profiilia eikä vaikuttanut varfariinin yksittäisen 30 mg:n oraalisen annoksen vaikutukseen protrombiiniaikaan tai kansainväliseen normalisoituun suhteeseen (INR).
Kilpirauhashormonit, rauhoittavat unilääkkeet, ei-steroidiset tulehduskipulääkkeet, bentsodiatsepiinit ja dekongestantit
Vaikka muita erityisiä yhteisvaikutustutkimuksia ei tehty, SINGULAIRia käytettiin samanaikaisesti useiden yleisesti määrättyjen lääkkeiden kanssa kliinisissä tutkimuksissa ilman näyttöä kliinisistä haittavaikutuksista. Näitä lääkkeitä olivat kilpirauhashormonit, rauhoittavat unilääkkeet, ei-steroidiset tulehduskipulääkkeet, bentsodiatsepiinit ja dekongestantit.
Sytokromi P450 (CYP) -entsyymien indusoijat
Maksametaboliaa indusoiva fenobarbitaali pienensi montelukastin plasmapitoisuuskäyrän alla olevaa pinta-alaa (AUC) noin 40 % montelukastin 10 mg:n kerta-annoksen jälkeen. SINGULAIRin annostusta ei suositella. On järkevää käyttää asianmukaista kliinistä seurantaa, kun voimakkaita CYP-entsyymi-induktoreita, kuten fenobarbitaalia tai rifampiinia, annetaan samanaikaisesti SINGULAIRin kanssa.
Montelukastin vaikutus sytokromi P450 (CYP) -entsyymeihin
Montelukasti on voimakas CYP2C8:n estäjä in vitro. Tiedot kliinisestä lääkkeiden yhteisvaikutustutkimuksesta, johon osallistui montelukasti ja rosiglitatsoni (koetinsubstraatti, joka edustaa pääasiassa CYP2C8:n kautta metaboloituvia lääkkeitä) 12 terveellä yksilöllä osoittivat kuitenkin, että rosiglitatsonin farmakokinetiikka ei muutu, kun lääkkeitä annetaan samanaikaisesti, mikä viittaa siihen, että montelukasti eivät estä CYP2C8:aa in vivo. Siksi montelukastin ei odoteta muuttavan tämän entsyymin metaboloimien lääkkeiden (esim. paklitakselin, rosiglitatsonin ja repaglinidin) metaboliaa. Ihmisen maksan mikrosomeista saatujen muiden in vitro -tulosten perusteella montelukastin terapeuttiset plasmapitoisuudet eivät estä CYP 3A4-, 2C9-, 1A2-, 2A6-, 2C19- tai 2D6-entsyymejä.
Sytokromi P450 (CYP) -entsyymin estäjät
In vitro -tutkimukset ovat osoittaneet, että montelukasti on CYP 2C8-, 2C9- ja 3A4-substraatti. Montelukastin samanaikainen anto itrakonatsolin kanssa, joka on vahva CYP 3A4:n estäjä, ei lisännyt merkittävästi systeemistä montelukastialtistusta. Tiedot kliinisestä lääkeinteraktiotutkimuksesta, johon osallistui montelukasti ja gemfibrotsiili (sekä CYP 2C8:n että 2C9:n estäjä), osoittivat, että gemfibrotsiili lisäsi terapeuttisella annoksella montelukastin systeemistä altistusta 4,4-kertaiseksi. Itrakonatsolin, gemfibrotsiilin ja montelukastin samanaikainen anto ei lisännyt montelukastin systeemistä altistusta. Saatavilla olevan kliinisen kokemuksen perusteella montelukastin annosta ei tarvitse muuttaa, kun sitä annetaan yhdessä gemfibrotsiilin kanssa (ks. YLIANNOSTUS ].
Kliiniset tutkimukset
Astma
Aikuiset ja 15-vuotiaat ja sitä vanhemmat nuoret, joilla on astma
Aikuisilla ja 15-vuotiailla ja sitä vanhemmilla nuorilla tehdyt kliiniset tutkimukset osoittivat, että yli 10 mg kerran vuorokaudessa annoksilla ei ole kliinistä lisähyötyä.
SINGULAIR-valmisteen teho astman kroonisessa hoidossa aikuisilla ja 15-vuotiailla ja sitä vanhemmilla nuorilla osoitettiin kahdessa (USA ja monikansallisessa) samalla tavalla suunnitellussa, satunnaistetussa, 12 viikkoa kestäneessä kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa 1576 potilaalla ( 795 hoidettiin SINGULAIRilla, 530 sai lumelääkettä ja 251 hoidettiin aktiivisella kontrollilla). Mediaani-ikä oli 33 vuotta (vaihteluväli 15-85); 56,8 % oli naisia ja 43,2 % miehiä. Etninen/rotujakauma näissä tutkimuksissa oli 71,6 % valkoihoisia, 17,7 % latinalaisamerikkalaisia, 7,2 % muuta alkuperää ja 3,5 % mustia. Potilailla oli lievä tai keskivaikea astma, ja he olivat tupakoimattomia, jotka tarvitsivat noin 5 hengitettyä β-agonistia päivässä "tarpeen mukaan". Potilaiden keskimääräinen lähtötilanteen prosenttiosuus ennustetusta pakotetusta uloshengityksen tilavuudesta 1 sekunnissa (FEV1) oli 66 % (likimääräinen vaihteluväli 40–90 %). Näissä tutkimuksissa ensisijaiset päätetapahtumat olivat FEV1 ja päiväsaikaan astmaoireet. Molemmissa tutkimuksissa 12 viikon jälkeen satunnainen osaryhmä SINGULAIR 5 mg:aa saaneita potilaita vaihdettiin lumelääkkeeseen vielä 3 viikon kaksoissokkohoidon ajaksi mahdollisten rebound-vaikutusten arvioimiseksi.
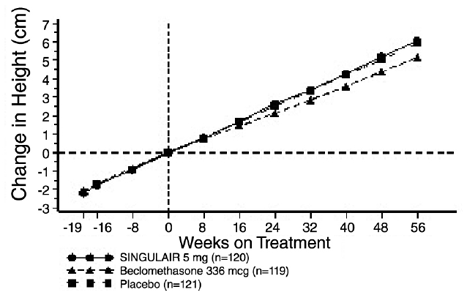
US-tutkimuksen tulokset ensisijaisesta päätetapahtumasta, aamun FEV1:stä, ilmaistuna keskimääräisenä prosentuaalisena muutoksena lähtötasosta 12 viikon hoitojakson keskiarvona, on esitetty KUVASSA 2. Plaseboon verrattuna hoito yhdellä SINGULAIR 10 mg:n tabletilla päivittäin ilta johti tilastollisesti merkitsevään nousuun FEV1 prosentin muutoksessa lähtötasosta (13,0 % muutos SINGULAIR 4 mg:lla hoidetussa ryhmässä vs. 4,2 % muutos lumeryhmässä, p
Kuva 2: FEV1:n keskimääräinen prosenttimuutos lähtötilanteesta (US-koe: SINGULAIR 5 mg N = 406; lumelääke N = 270) (ANOVA-malli)
SINGULAIR 5 mg:n vaikutus muihin primaarisiin ja toissijaisiin päätepisteisiin, joita monikansallinen tutkimus edustaa, on esitetty taulukossa 6. Tulokset näistä päätepisteistä olivat samankaltaisia Yhdysvalloissa tehdyssä tutkimuksessa.
Molemmissa tutkimuksissa arvioitiin SINGULAIR 4 mg:n vaikutusta toissijaisiin tuloksiin, mukaan lukien astmakohtaus (terveydenhuollon resurssien käyttö, kuten suunnittelematon käynti lääkärin vastaanotolla, ensiapupoliklinikalla tai sairaalassa; tai hoito suun kautta, suonensisäisesti tai lihaksensisäinen kortikosteroidi) ja oraalisten kortikosteroidien käyttö astman hoitoon. Monikansallisessa tutkimuksessa SINGULAIRia saaneilla potilailla merkittävästi harvemmilla potilailla (15,6 % potilaista) oli astmakohtauksia verrattuna lumelääkettä saaneisiin potilaisiin (27,3 %, p
Toiminnan alkaminen ja vaikutusten ylläpito
Jokaisessa lumekontrolloidussa aikuisilla tehdyssä tutkimuksessa SINGULAIR 4 mg:n hoitovaikutus mitattuna päivittäisillä päiväkirjakorttiparametreilla, mukaan lukien oirepisteet, "tarpeen mukaan" β-agonistien käyttö ja PEFR-mittaukset, saavutettiin ensimmäisen annoksen jälkeen, ja se säilyi. koko annosteluvälin (24 tuntia). Ei-plasebokontrolloiduissa jatkotutkimuksissa ei havaittu merkittävää muutosta hoidon vaikutuksessa jatkuvan kerran vuorokaudessa iltaisin annettaessa. SINGULAIR 4 mg:n lopettaminen astmapotilailla 12 viikon jatkuvan käytön jälkeen ei aiheuttanut astman pahenemista.
6–14-vuotiaat lapsipotilaat, joilla on astma
SINGULAIR 5 mg:n teho 6–14-vuotiailla lapsipotilailla osoitettiin yhdessä 8 viikon kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 336 potilaalla (201 hoidettiin SINGULAIRilla ja 135 lumelääkettä) käyttäen inhaloitavaa beeta-agonistia. "tarpeen mukaan". Potilaiden keskimääräinen lähtötilanteen ennustettu FEV1-prosentti oli 72 % (likimääräinen vaihteluväli 45–90 %) ja keskimääräinen päivittäinen inhaloitavan β-agonistin tarve oli 3,4 albuterolia. Noin 36 % potilaista käytti inhaloitavia kortikosteroideja. Mediaani-ikä oli 11 vuotta (vaihteluväli 6-15); 35,4 % oli naisia ja 64,6 % miehiä. Etninen/rotujakauma tässä tutkimuksessa oli 80,1 % valkoihoisia, 12,8 % mustia, 4,5 % latinalaisamerikkalaisia ja 2,7 % muuta alkuperää.
Plaseboon verrattuna hoito yhdellä 5 mg:n SINGULAIR 4 mg:n purutabletilla päivittäin paransi merkittävästi keskimääräistä aamun FEV1 prosentin muutosta lähtötasosta (8,7 % SINGULAIR 4 mg:lla hoidetussa ryhmässä vs. 4,2 % muutos lähtötasosta lumeryhmässä, p
Kuten aikuistutkimuksissa, ei havaittu merkittävää muutosta hoidon vaikutuksessa jatkuvan kerran vuorokaudessa annettaessa yhdessä avoimessa jatkotutkimuksessa ilman samanaikaista lumelääkeryhmää enintään 6 kuukauden ajan.
2–5-vuotiaat lapsipotilaat, joilla on astma
SINGULAIRin tehoa astman kroonisessa hoidossa 2–5-vuotiailla lapsipotilailla tutkittiin 12 viikkoa kestäneessä lumekontrolloidussa turvallisuus- ja siedettävyystutkimuksessa 689 potilaalla, joista 461 sai SINGULAIR-hoitoa. Mediaani-ikä oli 4 vuotta (vaihteluväli 2-6); 41,5 % oli naisia ja 58,5 % miehiä. Etninen/rotujakauma tässä tutkimuksessa oli 56,5 % valkoihoisia, 20,9 % latinalaisamerikkalaisia, 14,4 % muita alkuperää olevia ja 8,3 % mustia.
Vaikka ensisijaisena tavoitteena oli määrittää SINGULAIR 10 mg:n turvallisuus ja siedettävyys tässä ikäryhmässä, tutkimukseen sisältyi tutkivia tehokkuuden arviointeja, mukaan lukien päivä- ja yön aikana esiintyvät astman oireet, β-agonistien käyttö, oraalinen kortikosteroidihoito ja lääkärin kokonaisarviointi. Näiden tutkivien tehokkuusarviointien tulokset sekä farmakokinetiikka ja iäkkäiden potilaiden tehokkuustietojen ekstrapolointi tukevat yleistä päätelmää, että SINGULAIR on tehokas astman ylläpitohoidossa 2–5-vuotiailla potilailla.
Vaikutukset potilailla samanaikaisiin inhaloitaviin kortikosteroideihin
Erillisissä aikuisilla tehdyissä tutkimuksissa arvioitiin SINGULAIR 10 mg:n kykyä lisätä inhaloitavien kortikosteroidien kliinistä vaikutusta ja mahdollistaa inhaloitavien kortikosteroidien pieneneminen, kun sitä käytetään samanaikaisesti.
Yhteen satunnaistettuun, lumekontrolloituun, rinnakkaisryhmätutkimukseen (n=226) otettiin stabiilia astmaa sairastavia aikuisia, joiden keskimääräinen FEV1 oli noin 84 % ennustetuista ja jotka olivat aiemmin saaneet erilaisia inhaloitavia kortikosteroideja (annostelulla aerosoli- tai kuivajauheinhalaattorit). ). Mediaani-ikä oli 41,5 vuotta (vaihteluväli 16-70); 52,2 % oli naisia ja 47,8 % miehiä. Etninen/rotujakauma tässä tutkimuksessa oli 92,0 % valkoihoisia, 3,5 % mustia, 2,2 % latinalaisamerikkalaisia ja 2,2 % aasialaisia. Inhaloitavien kortikosteroidien tyyppejä ja niiden keskimääräisiä perustarpeita olivat beklometasonidipropionaatti (keskimääräinen annos, 1203 mcg/vrk), triamsinoloniasetonidi (keskimääräinen annos, 2004 mcg/vrk), flunisolidi (keskimääräinen annos, 1971 mcg/vrk), flutikasonipropionaatti annos, 1083 mcg/vrk) tai budesonidi (keskimääräinen annos, 1192 mcg/vrk). Jotkut näistä inhaloitavista kortikosteroideista eivät olleet USA:n hyväksymiä formulaatioita, ja ilmaistut annokset eivät välttämättä ole ex-actuator. Tutkimusta edeltävä inhaloitavien kortikosteroidien tarve pieneni noin 37 % 5–7 viikon lumelääkejakson aikana, jonka tarkoituksena oli titrata potilaat kohti alhaisinta tehokasta inhaloitavaa kortikosteroidiannosta. Hoito SINGULAIR 4 mg:lla pienensi edelleen 47 % keskimääräistä inhaloitavaa kortikosteroidiannosta verrattuna 30 %:iin lumelääkeryhmässä 12 viikon aktiivisen hoitojakson aikana (p≤0,05). Ei tiedetä, voidaanko tämän tutkimuksen tuloksia yleistää astmapotilaille, jotka tarvitsevat suurempia annoksia inhaloitavia kortikosteroideja tai systeemisiä kortikosteroideja.
Toisessa satunnaistetussa, lumekontrolloidussa, rinnakkaisryhmätutkimuksessa (n=642) samanlaisessa aikuispotilaspopulaatiossa, jotka olivat aiemmin saaneet hengitettävillä kortikosteroideilla (beklometasoni 336 mikrog/vrk), mutta eivät olleet riittävästi hallinnassa, johti SINGULAIRin lisäämiseen beklometasoniin. tilastollisesti merkitsevässä FEV1:n parannuksessa verrattuna potilaisiin, jotka jatkoivat beklometasonin käyttöä yksinään, tai potilaisiin, jotka lopettivat beklometasonin käytön ja joita hoidettiin pelkällä montelukastilla tai lumelääkehoidolla 16 viikon pituisen sokkohoitojakson viimeisen 10 viikon aikana. Potilailla, jotka oli satunnaistettu beklometasonia sisältäviin hoitoryhmiin, astman hallinta oli tilastollisesti merkitsevästi parempi kuin niillä potilailla, jotka satunnaistettiin saamaan pelkkä SINGULAIR tai lumelääke FEV1:n, päiväaikaisten astmaoireiden, PEFR:n, astman aiheuttamien yöllisten heräämisen ja "tarpeen mukaan" β- mukaan. agonistivaatimukset.
Aikuisilla astmapotilailla, joilla oli dokumentoitua aspiriiniherkkyyttä ja joista lähes kaikki saivat samanaikaisesti inhaloitavia ja/tai oraalisia kortikosteroideja, 4 viikkoa kestänyt, satunnaistettu rinnakkaisryhmätutkimus (n=80) osoitti, että SINGULAIR 10 mg verrattuna lumelääkkeeseen astman hallinnan parametrien merkittävässä paranemisessa. SINGULAIR 4 mg:n vaikutuksen suuruus aspiriinille herkillä potilailla oli samanlainen kuin yleisellä tutkituilla astmapotilailla havaittu vaikutus. SINGULAIRin vaikutusta keuhkoputkien supistavaan vasteeseen aspiriinille tai muille ei-steroidisille tulehduskipulääkkeille aspiriinille herkillä astmapotilailla ei ole arvioitu [ks. VAROITUKSET JA VAROTOIMET ].
Harjoituksen aiheuttama keuhkoputken supistus (EIB)
Liikunnan aiheuttama keuhkoputken supistuminen (aikuiset, nuoret ja 6-vuotiaat ja sitä vanhemmat lapsipotilaat)
SINGULAIR 5 mg:n, 10 mg:n tehoa, kun se annettiin kerta-annoksena 2 tuntia ennen harjoittelua EIB:n ehkäisyyn, tutkittiin kolmessa (yhdysvaltalaisessa ja monikansallisessa), satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa ristikkäistutkimuksessa, jotka sisälsivät yhteensä 160 aikuista ja yli 15-vuotiasta EIB-potilasta. Harjoitushaastetesti suoritettiin 2 tunnin, 8,5 tai 12 tunnin ja 24 tunnin kuluttua tutkimuslääkkeen (SINGULAIR 10 mg tai lumelääke) kerta-annoksen annon jälkeen. Ensisijainen päätetapahtuma oli FEV1:n keskimääräinen prosentuaalinen lasku 2 tunnin kuluttua annoksen ottamisesta rasituksen jälkeen kaikissa kolmessa tutkimuksessa (tutkimus A, tutkimus B ja tutkimus C). Tutkimuksessa A kerta-annos SINGULAIRia 10 mg osoitti tilastollisesti merkitsevän suojaavan hyödyn EIB:tä vastaan, kun se otettiin 2 tuntia ennen harjoittelua. Jotkut potilaat olivat suojassa EIB:ltä 8,5 ja 24 tunnin kuluttua annosta; jotkut potilaat eivät kuitenkaan olleet. Tulokset keskimääräiselle maksimiprosentin laskulle kussakin ajankohdassa tutkimuksessa A on esitetty taulukossa 7, ja ne edustavat kahden muun tutkimuksen tuloksia.
SINGULAIR 5 mg purutablettien tehoa, kun niitä annettiin kerta-annoksena 2 tuntia ennen harjoittelua EIB:n ehkäisyyn, tutkittiin yhdessä monikansallisessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa ristikkäistutkimuksessa, johon kuului yhteensä 64 lapsipotilasta. 6–14-vuotiaat EIB-potilaat. Harjoitushaastetesti suoritettiin 2 tuntia ja 24 tuntia yhden annoksen tutkimuslääkettä (SINGULAIR 5 mg tai lumelääke) annon jälkeen. Ensisijainen päätetapahtuma oli FEV1:n keskimääräinen enimmäisprosentin lasku 2 tuntia annoksen jälkeisen rasituksen jälkeen. SINGULAIR 5 mg:n kerta-annos osoitti tilastollisesti merkitsevää suojaavaa hyötyä EIB:tä vastaan, kun se otettiin 2 tuntia ennen harjoittelua (TAULUKKO 8). Samanlaiset tulokset osoitettiin 24 tuntia annoksen jälkeen (toissijainen päätetapahtuma). Jotkut potilaat olivat suojassa EIB:ltä 24 tunnin kuluttua annosta; jotkut potilaat eivät kuitenkaan olleet. Aikapisteitä ei arvioitu 2–24 tunnin välillä annoksen ottamisen jälkeen.
SINGULAIR 5 mg:n tehoa EIB:n ehkäisyyn alle 6-vuotiailla potilailla ei ole osoitettu.
SINGULAIR 4 mg:n päivittäistä antoa astman krooniseen hoitoon ei ole osoitettu estävän akuutteja EIB-jaksoja.
12 viikkoa kestäneessä satunnaistetussa kaksoissokkoutetussa rinnakkaisryhmätutkimuksessa, johon osallistui 110 aikuista ja 15-vuotiasta ja sitä vanhempaa astmaatikota, keskimääräinen lähtötason FEV1-prosentti ennustetusta 83 %:sta ja dokumentoitu rasituksen aiheuttama astman paheneminen, hoito SINGULAIR, 10 mg, kerran vuorokaudessa iltaisin, johti tilastollisesti merkitsevästi alenemaan FEV1:n ja keskimääräisen palautumisajan keskimääräisessä maksimiprosentissa 5 %:iin verrattuna harjoitusta edeltävään FEV1:een. Harjoitusaltistus suoritettiin annosteluvälin lopussa (eli 20-24 tuntia edellisen annoksen jälkeen). Tämä vaikutus säilyi koko 12 viikon hoitojakson ajan, mikä osoittaa, että toleranssia ei esiintynyt. SINGULAIR 4 mg ei kuitenkaan estänyt kliinisesti merkittävää FEV1:n maksimaalisen prosentuaalisen laskun heikkenemistä harjoituksen jälkeen (eli ≥ 20 %:n lasku ennen harjoitusta lähtötasosta) 52 %:lla tutkituista potilaista. Erillisessä aikuisilla tehdyssä ristikkäistutkimuksessa samanlainen vaikutus havaittiin kahden kerran vuorokaudessa annetun 10 mg:n SINGULAIR-annoksen jälkeen.
6–14-vuotiailla lapsipotilailla, jotka käyttivät 5 mg:n purutabletteja, 2 päivän risteytystutkimus osoitti samanlaisia vaikutuksia kuin aikuisilla, kun rasitus suoritettiin annosvälin lopussa (eli 20–24). tuntia edellisen annoksen jälkeen).
Allerginen nuha (kausiluonteinen ja monivuotinen)
Kausiluonteinen allerginen nuha
SINGULAIR-tablettien tehoa kausiluonteisen allergisen nuhan hoidossa tutkittiin viidessä samalla tavalla suunnitellussa, satunnaistetussa, kaksoissokkoutetussa, rinnakkaisryhmissä, lumelääke- ja aktiivikontrolloidussa (loratadiini) tutkimuksessa, jotka suoritettiin Pohjois-Amerikassa. Viiteen tutkimukseen osallistui yhteensä 5029 potilasta, joista 1799 sai SINGULAIR-tabletteja. Potilaat olivat 15–82-vuotiaita, joilla oli kausiluonteinen allerginen nuha, positiivinen ihotesti vähintään yhdelle relevantille kausiluonteiselle allergeenille ja aktiivisia kausiluonteisen allergisen nuhan oireita tutkimukseen osallistuessa.
Satunnaistetun hoidon kesto oli 2 viikkoa 4 tutkimuksessa ja 4 viikkoa yhdessä tutkimuksessa. Ensisijainen tulosmuuttuja oli keskimääräinen muutos lähtötilanteesta päiväaikaisten nenäoireiden pistemäärissä (nenän tukkoisuuden, nuhan, nenän kutina, aivastelu yksittäisten pisteiden keskiarvo), jonka potilaat arvioivat kategorisella asteikolla 0-3.
Neljä viidestä tutkimuksesta osoitti, että päiväsaikojen nenäoireiden pisteet vähenivät merkittävästi SINGULAIR 10 mg -tableteilla verrattuna lumelääkkeeseen. Yhden kokeen tulokset on esitetty alla. Mediaani-ikä tässä tutkimuksessa oli 35,0 vuotta (vaihteluväli 15-81); 65,4 % oli naisia ja 34,6 % miehiä. Etninen/rotujakauma tässä tutkimuksessa oli 83,1 % valkoihoisia, 6,4 % muita alkuperää olevia, 5,8 % mustia ja 4,8 % latinalaisamerikkalaisia. Keskimääräiset muutokset lähtötasosta päiväsaikojen nenäoireiden pisteytyksissä hoitoryhmissä, jotka saivat SINGULAIR 4 mg tabletteja, loratadiinia ja lumelääkettä, on esitetty taulukossa 9. Loput kolme tutkimusta, jotka osoittivat tehon, osoittivat samanlaisia tuloksia. Teho kausiluonteiseen allergiseen nuhaan osoitettiin, kun montelukasti annettiin aamulla tai illalla.
Monivuotinen allerginen nuha
SINGULAIR 5 mg -tablettien tehoa ympärivuotisen allergisen nuhan hoidossa tutkittiin kahdessa satunnaistetussa, kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa Pohjois-Amerikassa ja Euroopassa. Kahteen tutkimukseen osallistui yhteensä 3357 potilasta, joista 1632 sai SINGULAIR 10 mg tabletteja. 15–82-vuotiaat potilaat, joilla on monivuotinen allerginen nuha, joka on vahvistettu historiassa ja positiivinen ihotesti vähintään yhdelle relevantille monivuotiselle allergeenille (pölypunkit, eläinten hilse ja/tai homeitiöt), joilla oli aktiivisia oireita tutkimuksen aikana sisääntulo, olivat ilmoittautuneet.
Tutkimuksessa, jossa teho osoitettiin, mediaani-ikä oli 35 vuotta (vaihteluväli 15-81); 64,1 % oli naisia ja 35,9 % miehiä. Etninen/rotujakauma tässä tutkimuksessa oli 83,2 % valkoihoisia, 8,1 % mustia, 5,4 % latinalaisamerikkalaisia, 2,3 % aasialaisia ja 1,0 % muuta alkuperää. SINGULAIR 10 mg tablettien kerran vuorokaudessa on osoitettu vähentävän merkittävästi ympärivuotisen allergisen nuhan oireita 6 viikon hoitojakson aikana (TAULUKKO 10); tässä tutkimuksessa ensisijainen tulosmuuttuja oli keskimääräinen muutos lähtötasosta päiväaikaisten nenäoireiden pistemäärissä (nenän tukkoisuuden, nenän ja aivastelun yksittäisten pisteiden keskiarvo).
Toisessa 6 viikkoa kestäneessä tutkimuksessa arvioitiin SINGULAIR 10 mg (n = 626), lumelääke (n = 609) ja aktiivinen kontrolli (setiritsiini 10 mg; n = 120). Ensisijaisessa analyysissä verrattiin SINGULAIRin päiväsaikaan nenäoireiden pisteytyksen keskimääräistä muutosta lähtötilanteeseen verrattuna lumelääkkeeseen 4 ensimmäisen hoitoviikon aikana; tutkimusta ei suunniteltu SINGULAIRin ja aktiivisen kontrollin tilastolliseen vertailuun. Ensisijainen tulosmuuttuja sisälsi nenän kutinaa nenän tukkoisuuden, rinorrean ja aivastelun lisäksi. Arvioitu ero SINGULAIRin ja lumelääkkeen välillä oli -0,04 ja 95 %:n luottamusväli (-0,09, 0,01). Arvioitu ero aktiivisen kontrollin ja lumelääkkeen välillä oli -0,10 ja 95 %:n luottamusväli (-0,19, -0,01).
POTILASTIEDOT
SINGULAIR® (SING-u-lair) (montelukastinatrium) purutabletit
Mikä on tärkein tieto, joka minun pitäisi tietää SINGULAIR 4mg:sta?SINGULAIRia käyttävillä ihmisillä on esiintynyt vakavia mielenterveysongelmia tai jopa hoidon lopettamisen jälkeen.
Tämä voi tapahtua ihmisillä, joilla on tai ei ole ollut mielenterveysongelmia. Lopeta SINGULAIRin käyttö ja kerro heti terveydenhuollon tarjoajalle, jos sinulla tai lapsellasi on epätavallisia muutoksia käyttäytymisessä tai ajattelussa, mukaan lukien jokin seuraavista oireista:
- kiihtyneisyys, mukaan lukien aggressiivinen käyttäytyminen tai vihamielisyys
- huomion ongelmia
- huonoja tai kirkkaita unia
- masennus
- desorientaatio (hämmennys)
- ahdistuneena
- ärtyneisyys
- hallusinaatiot (näkee tai kuulee asioita, joita ei todellisuudessa ole olemassa)
- muistiongelmia
- pakko-oireiset oireet
- levottomuus
- unissakävely
- änkyttävä
- itsetuhoiset ajatukset ja teot (mukaan lukien itsemurha)
- vapina
- nukahtamisvaikeuksia
- hallitsemattomat lihasliikkeet
Mikä on SINGULAIR 10mg?
SINGULAIR 4mg on reseptilääke, joka estää leukotrieenit elimistön aineet. Tämä voi auttaa parantamaan astman oireita ja nenän limakalvon tulehduksia (allerginen nuha). SINGULAIR ei sisällä steroideja. SINGULAIRia käytetään:
- ulkona esiintyvät allergiat, joita esiintyy osan vuotta (kausiluonteinen allerginen nuha) aikuisilla ja yli 2-vuotiailla lapsilla, ja
- sisäallergiat, joita esiintyy ympäri vuoden (ylivuotinen allerginen nuha) aikuisilla ja yli 6 kuukauden ikäisillä lapsilla.
Älä ota SINGULAIR, jos olet allerginen jollekin sen aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo SINGULAIRin ainesosista.
Ennen kuin otat SINGULAIR 4 mg -valmistetta, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- ovat allergisia aspiriinille.
- sinulla on fenyyliketonuria. SINGULAIR-purutabletit sisältävät aspartaamia, joka on fenyylialaniinin lähde.
- sinulla on tai on ollut mielenterveysongelmia.
- olet raskaana tai suunnittelet raskautta. Keskustele terveydenhuollon tarjoajan kanssa, jos olet raskaana tai suunnittelet raskautta, sillä SINGULAIR 4 mg ei ehkä sovi sinulle.
- imetät tai aiot imettää. Ei tiedetä, erittyykö SINGULAIR äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi SINGULAIR-hoidon aikana.
Kerro terveydenhuollon tarjoajalle kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja reseptilääkkeet, vitamiinit ja yrttilisät. Jotkut lääkkeet voivat vaikuttaa SINGULAIRin tehoon, tai SINGULAIR 4 mg voi vaikuttaa muiden lääkkeiden tehoon.
Miten minun pitäisi ottaa SINGULAIR 10 mg?
varten kuka tahansa kuka ottaa SINGULAIR:
- Lue yksityiskohtainen Käyttöohjeet joka tulee SINGULAIR oraalisten rakeiden mukana.
- Ota SINGULAIR 4 mg juuri sen verran kuin lääkärisi on määrännyt. Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon SINGULAIRia sinun tulee ottaa ja milloin ottaa.
- Lopeta SINGULAIR 5 mg:n käyttö ja kerro heti terveydenhuollon tarjoajallesi, jos sinulla tai lapsellasi on epätavallisia muutoksia käyttäytymisessä tai ajattelussa.
- Voit ottaa SINGULAIR 5 mg:n ruoan kanssa tai ilman ruokaa. Katso kohta "Kuinka voin antaa SINGULAIR-rakeita lapselleni?" in Käyttöohjeet saadaksesi tietoa siitä, mitä ruokia ja nesteitä voidaan ottaa SINGULAIR 10mg oraalisten rakeiden kanssa.
- Jos sinä tai lapsesi unohdat ottaa SINGULAIR-annoksen, ota seuraava annos normaaliin aikaan. Älä ota 2 annosta samanaikaisesti.
- Jos otat liikaa SINGULAIRia, soita heti terveydenhuollon tarjoajallesi.
Aikuisille ja 12 kuukauden ikäisille ja sitä vanhemmille lapsille, joilla on astma:
- Ota SINGULAIR 1 kerran päivässä, illalla. Jatka SINGULAIR 5 mg:n ottamista joka päivä niin kauan kuin terveydenhuollon tarjoajasi on määrännyt, vaikka sinulla ei olisi astman oireita.
- Kerro heti terveydenhuollon tarjoajallesi, jos astmaoireesi pahenevat tai jos sinun on käytettävä pelastusinhalaattoria useammin astmakohtausten hoitoon.
- Pidä aina mukanasi pelastusinhalaattorisi astmakohtauksia varten.
- Jatka muiden astmalääkkeiden ottamista ohjeiden mukaan, ellei terveydenhuollon tarjoaja kehota sinua muuttamaan näiden lääkkeiden käyttötapaa.
6-vuotiaille ja sitä vanhemmille rasituksen aiheuttaman astman ehkäisyyn:
- Ota SINGULAIR vähintään 2 tuntia ennen harjoittelua.
- Pidä aina mukanasi pelastusinhalaattorisi astmakohtauksia varten.
- Jos otat SINGULAIR 10 mg joka päivä krooniseen astmaan tai allergiseen nuhaan, Älä ota toinen annos rasituksen aiheuttaman astman estämiseksi. Keskustele terveydenhuollon tarjoajan kanssa harjoituksen aiheuttaman astman hoidosta.
- Älä ota kahta annosta SINGULAIR 5 mg 24 tunnin (1 vuorokauden) aikana.
Kaikille 2-vuotiaille ja sitä vanhemmille, joilla on kausiluonteinen allerginen nuha, tai yli 6 kuukauden ikäisille, joilla on jatkuva allerginen nuha:
- Ota SINGULAIR kerran päivässä, suunnilleen samaan aikaan joka päivä.
Mitä minun pitäisi välttää SINGULAIR 10 mg:n käytön aikana?
Jos sinulla on astma ja aspiriini pahentaa astman oireita, vältä edelleen aspiriinin tai muiden ei-steroidisiksi tulehduskipulääkkeiksi (NSAID) kutsuttujen lääkkeiden käyttöä SINGULAIR-hoidon aikana.
Mitkä ovat SINGULAIRin mahdolliset sivuvaikutukset?
SINGULAIR voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää SINGULAIR 4mg:sta?"
- Tiettyjen valkosolujen (eosinofiilien) lisääntyminen ja mahdolliset tulehtuneet verisuonet koko kehossa (systeeminen vaskuliitti). Tämä voi harvoin tapahtua astmaa sairastavilla henkilöillä, jotka käyttävät SINGULAIRia. Näin tapahtuu joskus ihmisillä, jotka ottavat myös suun kautta steroidilääkettä, joka lopetetaan tai annosta pienennetään.
Kerro heti terveydenhuollon tarjoajallesi, jos saat yhden tai useamman seuraavista oireista:
- pistelyn tunne tai käsien tai jalkojen puutuminen
- flunssan kaltainen sairaus
- ihottuma
- vakava tulehdus (kipu ja turvotus) poskionteloissa (sinusiitti)
SINGULAIRin yleisimpiä sivuvaikutuksia ovat:
- ylähengitystieinfektio
- kuume
- päänsärky
- kipeä kurkku
- yskä
- vatsakipu
- ripuli
- korvakipu tai korvatulehdus
- flunssa
- vuotava nenä
- poskiontelon tulehdus
Nämä eivät ole kaikkia SINGULAIRin mahdollisia sivuvaikutuksia. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää SINGULAIR?
- Säilytä SINGULAIR 10 mg huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
- Säilytä SINGULAIR 4mg pakkauksessaan.
- Säilytä SINGULAIR 4mg kuivassa paikassa ja valolta suojassa.
- Pidä SINGULAIR ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa SINGULAIRin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä SINGULAIRia sairauteen, johon sitä ei ole määrätty. Älä anna SINGULAIRia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja SINGULAIR 10mg -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia SINGULAIR sisältää?
Aktiivinen ainesosa: montelukastinatrium
Inaktiiviset ainesosat:
- 4 mg oraaliset rakeet: mannitoli, hydroksipropyyliselluloosa ja magnesiumstearaatti.
- 4 mg:n ja 5 mg:n purutabletit: mannitoli, mikrokiteinen selluloosa, hydroksipropyyliselluloosa, punainen rautaoksidi, kroskarmelloosinatrium, kirsikkaaromi, aspartaami ja magnesiumstearaatti.
- Ihmiset, joilla on fenyyliketonuria: SINGULAIR 4 mg purutabletit sisältävät 0,674 mg fenyylialaniinia ja SINGULAIR 5 mg purutabletit sisältää 0,842 mg fenyylialaniinia.
- 10 mg tabletti: mikrokiteinen selluloosa, laktoosimonohydraatti, kroskarmelloosinatrium, hydroksipropyyliselluloosa ja magnesiumstearaatti. Kalvopinnoite sisältää: hydroksipropyylimetyyliselluloosaa, hydroksipropyyliselluloosaa, titaanidioksidia, punaista rautaoksidia, keltaista rautaoksidia ja karnaubavahaa.
Käyttöohjeet
SINGULAIR® (SING-u-lair) (montelukastinatrium) oraaliset rakeet
Tämä käyttöohje sisältää tietoa SINGULAIR 10 mg oraalisten rakeiden käytöstä.
Tärkeää tietoa:
- Ennen kuin annat annoksen SINGULAIR-rakeita, lue nämä käyttöohjeet varmistaaksesi, että valmistat ja annat suun kautta otettavat rakeet oikein.
- Anna SINGULAIR-rakeet lapsellesi täsmälleen terveydenhuollon tarjoajan ohjeiden mukaisesti.
- Lopeta SINGULAIR 5 mg:n antaminen ja kerro heti terveydenhuollon tarjoajallesi, jos lapsesi käyttäytymisessä tai ajattelussa on epätavallisia muutoksia.
- Jatka astmalääkkeiden antamista lapsellesi ohjeiden mukaan, ellei terveydenhuollon tarjoaja kehota sinua muuttamaan näiden lääkkeiden antamistapaa.
- Voit antaa SINGULAIR 5 mg oraalisia rakeita ruoan kanssa tai ilman ruokaa.
Kuinka voin antaa SINGULAIR 4mg oraalisia rakeita lapselleni?
- Älä avaa pakkaus, kunnes olet valmis käyttämään.
- Voit antaa SINGULAIR 4 mg oraalisia rakeita eri tavoilla. Sinun tulee valita lapsellesi paras tapa:
- suoraan suuhun
- liuotettuna 1 teelusikalliseen (5 ml) kylmää tai huoneenlämpöistä äidinmaidonkorviketta tai rintamaitoa
- sekoitettuna 1 lusikalliseen jotakin seuraavista pehmeistä ruoista kylmässä tai huoneenlämmössä: omenasose, porkkanamuusi, riisi tai jäätelö.
- Anna lapselle kaikki seos 15 minuutin kuluessa.
- Älä säilytä ylimääräistä SINGULAIR-seosta (ruoan, äidinmaidonkorvikkeen tai äidinmaidon kanssa sekoitettuja suullisia rakeita) myöhempää käyttöä varten. Heitä käyttämättä jäänyt osa pois.
- Älä sekoita SINGULAIR-rakeita muihin nestemäisiin juomiin kuin äidinmaidonkorvikkeeseen tai rintamaitoon. Lapsesi voi juoda muita nesteitä nieltyään seoksen.
Miten SINGULAIR 5mg pitäisi säilyttää?
- Säilytä SINGULAIR 4 mg huoneenlämmössä 20 °C - 25 °C (68–77 °F).
- Säilytä SINGULAIR pakkauksessaan.
- Säilytä SINGULAIR 5 mg kuivassa paikassa ja valolta suojassa.
- Pidä SINGULAIR ja kaikki lääkkeet poissa lasten ulottuvilta.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä käyttöohjeet
