Proair Inhaler 100mcg Salbutamol Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä ProAir on ja miten sitä käytetään?
ProAir on reseptilääke, jota käytetään akuutin, vaikean tai rasituksen aiheuttaman astman (bronkospasmin) oireiden hoitoon. ProAiria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
ProAir kuuluu lääkeluokkaan, jota kutsutaan PAH-, PDE-5-estäjät- ja fosfodiesteraasi-5-entsyymi-inhibiittorit.
Ei tiedetä, onko ProAir turvallinen ja tehokas alle 4-vuotiaille lapsille.
Mitkä ovat ProAirin mahdolliset sivuvaikutukset?
ProAir voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hengityksen vinkuminen,
- tukehtuminen,
- muut hengitysvaikeudet,
- rintakipu,
- nopea syke,
- hakkaavia sydämenlyöntejä tai lepatusta rinnassasi,
- kova päänsärky,
- hakkaa niskassasi tai korvissasi,
- kipua tai polttamista virtsatessa,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- jalkakrampit,
- ummetus,
- epäsäännölliset sydämenlyönnit,
- lisääntynyt jano tai virtsaaminen,
- puutuminen tai pistely ja
- lihasheikkous tai veltto tunne
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
ProAirin yleisimpiä sivuvaikutuksia ovat:
- rintakipu,
- nopeat tai jyskyttävät sydämenlyönnit,
- huimaus,
- vapiseva tai hermostunut olo,
- päänsärky,
- selkäkipu,
- kehon kivut,
- ärtynyt vatsa,
- kipeä kurkku,
- poskiontelokipu ja
- vuotava tai tukkoinen nenä
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia ProAirin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
ProAir HFA (albuterolisulfaatti) -inhalaatioaerosolin vaikuttava ainesosa on albuterolisulfaatti, albuterolin raseeminen suola. Albuterolisulfaatin kemiallinen nimi on α-[(tert-butyyliamino)metyyli]-4-hydroksi-m-ksyleeni-α,α'-diolisulfaatti (2:1) (suola), ja sillä on seuraava kemiallinen rakenne:
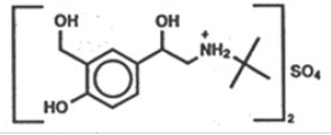
Albuterolisulfaatin molekyylipaino on 576,7 ja empiirinen kaava on (C13H21NO3)2 •H2SO4. Albuterolisulfaatti on valkoinen tai luonnonvalkoinen kiteinen jauhe. Se liukenee veteen ja liukenee hieman etanoliin. Albuterolisulfaatti on virallinen yleisnimi Yhdysvalloissa, ja salbutamolisulfaatti on Maailman terveysjärjestön suosittelema yleisnimi. ProAir HFA -inhalaatioaerosoli on paineistettu mitattu annosaerosoliyksikkö, jossa on annoslaskuri. ProAir HFA on tarkoitettu vain oraaliseen inhalaatioon. Se sisältää albuterolisulfaatin mikrokiteisen suspension ponneaineessa HFA-134a (1, 1, 1, 2-tetrafluorietaani) ja etanolissa.
Valmistele inhalaattori ennen ensimmäistä käyttökertaa ja tapauksissa, joissa inhalaattoria ei ole käytetty yli 2 viikkoon, suihkaise kolme suihketta ilmaan, pois kasvoilta. Esikäsittelyn jälkeen jokainen käyttö antaa 108 mikrogrammaa albuterolisulfaattia toimilaitteen suukappaleesta (vastaa 90 mikrogrammaa albuteroliemästä). Jokaisessa kanisterissa on 200 käyttökertaa (inhalaatiota).
Tämä tuote ei sisällä kloorifluorihiilivetyjä (CFC) ponneaineena.
INDIKAATIOT
Bronkospasmi
PROAIR HFA -inhalaatioaerosoli on tarkoitettu bronkospasmin hoitoon tai ehkäisyyn yli 4-vuotiailla potilailla, joilla on palautuva obstruktiivinen hengitystiesairaus.
Harjoituksen aiheuttama bronkospasmi
PROAIR HFA -inhalaatioaerosoli on tarkoitettu rasituksen aiheuttaman bronkospasmin ehkäisyyn 4-vuotiaille ja sitä vanhemmille potilaille.
ANNOSTELU JA HALLINNOINTI
Bronkospasmi
Akuuttien bronkospasmin hoitoon tai bronkospasmiin liittyvien oireiden ehkäisyyn tavanomainen annos aikuisille ja 4-vuotiaille ja sitä vanhemmille lapsille on kaksi inhalaatiota 4–6 tunnin välein. Useampaa antoa tai useampaa inhalaatiomäärää ei suositella. Joillekin potilaille voi riittää yksi inhalaatio 4 tunnin välein.
Harjoituksen aiheuttama bronkospasmi
Tavallinen annos aikuisille ja 4-vuotiaille tai sitä vanhemmille lapsille on kaksi inhalaatiota 15-30 minuuttia ennen harjoitusta.
Hallintotiedot
Anna PROAIR HFA vain suun kautta hengitettynä. Ravista hyvin ennen jokaista ruiskutusta. Tämän tuotteen oikean käytön ylläpitämiseksi ja lääkkeiden kertymisen ja tukkeutumisen estämiseksi on tärkeää noudattaa puhdistusohjeita huolellisesti.
Pohjustus
Valmistele inhalaattori ennen ensimmäistä käyttökertaa ja tapauksissa, joissa inhalaattoria ei ole käytetty yli 2 viikkoon, suihkaise kolme suihketta ilmaan, pois kasvoilta.
Puhdistus
Kuten kaikkien HFA:ta sisältävien albuteroliinhalaattoreiden kohdalla, tämän tuotteen oikean käytön ylläpitämiseksi ja lääkkeiden kertymisen ja tukkeutumisen estämiseksi on tärkeää puhdistaa muovisuukappale säännöllisesti. Inhalaattori voi lopettaa lääkkeen annostelun, jos muovista toimilaitteen suukappaletta ei puhdisteta ja kuivata kunnolla. Puhdistus: Pese muovinen suukappale lämpimällä juoksevalla vedellä 30 sekunnin ajan, ravista ylimääräinen vesi pois ja kuivaa ilmassa perusteellisesti vähintään kerran viikossa. Jos potilaalla on useampi kuin yksi PROAIR HFA -inhalaattori, potilaan tulee pestä jokainen niistä erikseen, jotta väärä säiliö ei kiinnity väärään muoviseen toimilaitteeseen. Näin potilas voi olla varma, että hän tietää aina oikean määrän jäljellä olevia annoksia. Älä koskaan kiinnitä minkään muun inhalaattorin lääkesäiliötä PROAIR HFA -toimilaitteeseen äläkä koskaan kiinnitä PROAIR HFA -säiliötä minkään muun inhalaattorin toimilaitteeseen. Jos suukappale tukkeutuu, suukappaleen pesu poistaa tukos. Jos inhalaattoria on käytettävä ennen kuin se on täysin kuiva, ravista ylimääräinen vesi pois, vaihda kanisteri, suihkuta kahdesti ilmaan poispäin kasvoilta ja ota määrätty annos. Tällaisen käytön jälkeen suukappale tulee pestä uudelleen ja antaa kuivua kunnolla. [katso FDA:n hyväksymä potilasmerkintä ].
Annoslaskuri
PROAIR HFA:ssa on annoslaskuri kiinnitettynä toimilaitteeseen. Kun potilas saa inhalaattorin, näyttöikkunaan ilmestyy musta piste, kunnes se on esitäytetty 3 kertaa, jolloin näyttöön tulee numero 200. Annoslaskuri laskee alaspäin aina, kun suihke vapautetaan. Kun annoslaskuri saavuttaa arvon 20, numeroiden väri muuttuu punaiseksi muistuttamaan potilasta ottamaan yhteyttä apteekkiin lääkkeen täyttöä varten tai kääntymään lääkärin puoleen reseptin täyttöä varten.
Kun annoslaskuri saavuttaa nollan, tausta muuttuu tasaisen punaiseksi. PROAIR HFA -inhalaattori tulee hävittää, kun annoslaskuri näyttää nollaa tai tuotteen viimeisen käyttöpäivän jälkeen sen mukaan, kumpi tulee ensin.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
PROAIR HFA on inhaloitava aerosoli. PROAIR HFA toimitetaan 8,5 g/200 iskua paineistetussa alumiinikapselissa, jossa on punainen muovinen toimilaite, jossa on annoslaskuri ja valkoinen pölykorkki, kukin yhden laatikoissa. Jokainen käyttö antaa 120 mikrogrammaa albuterolisulfaattia säiliön venttiilistä ja 108 mikrogrammaa albuterolisulfaattia toimilaitteen suukappaleesta (vastaa 90 mikrogrammaa albuteroliemästä).
Varastointi ja käsittely
PROAIR HFA (albuterolisulfaatti) Hengitysaerosoli toimitetaan paineistetussa alumiinikapselissa, jossa on punainen muovinen toimilaite, jossa on annoslaskuri ja valkoinen pölykorkki, kukin yhden laatikoissa. Jokainen säiliö sisältää 8,5 g formulaatiota ja tarjoaa 200 käyttökertaa ( NDC 59310-579-22). Jokainen käyttö antaa 120 mikrogrammaa albuterolisulfaattia säiliön venttiilistä ja 108 mikrogrammaa albuterolisulfaattia toimilaitteen suukappaleesta (vastaa 90 mikrogrammaa albuteroliemästä).
RAVISTA HYVIN ENNEN KÄYTTÖÄ. Säilytä 15–25 °C (59–77 °F). Sisältö paineen alla. Älä puhkaise tai polta. Suojaa jäätymiseltä ja pitkäaikaiselta suoralta auringonvalolta. Altistuminen yli 120 °F:n lämpötiloille voi aiheuttaa halkeamia. Parhaan tuloksen saavuttamiseksi kanisterin tulee olla huoneenlämpöinen ennen käyttöä. Vältä roiskumista silmiin. Pitää poissa lasten ulottuvilta.
Katso FDA:n hyväksymä potilasmerkintä pohjustus- ja puhdistusohjeita varten.
PROAIR HFA -inhalaatioaerosolin mukana toimitettua punaista toimilaitetta ei saa käyttää muiden inhalaatioaerosolituotteiden säiliön kanssa. PROAIR HFA -inhalaatioaerosolisäiliötä ei saa käyttää muiden inhalaatioaerosolituotteiden toimilaitteen kanssa.
PROAIR HFA -inhalaattorissa on annoslaskuri kiinnitettynä toimilaitteeseen. Potilaiden ei tule koskaan yrittää muuttaa annoslaskurin numeroita tai peukaloida toimilaitteen sisällä olevaa tappimekanismia. Hävitä PROAIR HFA -sumutin, kun laskuri näyttää 0:a tai tuotteen viimeisen käyttöpäivämäärän jälkeen sen mukaan, kumpi tulee ensin. Jokaisella painalluksella merkittyä lääkemäärää ei voida taata sen jälkeen, kun laskuri näyttää nollaa, vaikka säiliö ei ole täysin tyhjä ja jatkaa toimintaansa. Älä koskaan upota säiliötä veteen sen täytön määrittämiseksi ("kelluvatesti").
PROAIR HFA -hengitysaerosoli ei sisällä kloorifluorihiilivetyjä (CFC) ponneaineena.
Valmistaja: Teva Respiratory, LLC, Frazer, PA 19355. Valmistaja: IVAX Pharmaceuticals Ireland Waterford, Irlanti. Tarkistettu: helmikuuta 2019
SIVUVAIKUTUKSET
PROAIR HFA:n käyttö voi liittyä seuraaviin:
- Paradoksaalinen bronkospasmi [katso VAROITUKSET JA VAROTOIMET ]
- Sydän- ja verisuonivaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Välittömät yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
- Hypokalemia [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Maailmanlaajuisen kliinisen kehitysohjelman aikana yhteensä 1090 henkilöä hoidettiin PROAIR HFA -inhalaatioaerosolilla tai samalla albuteroliformulaatiolla kuin PROAIR HFA -inhalaatioaerosolissa.
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset ja 12-vuotiaat ja sitä vanhemmat nuoret
Alla olevassa taulukossa esitetyt PROAIR HFA -inhalaatioaerosolia koskevat haittavaikutustiedot ovat peräisin 6 viikkoa kestäneestä sokkotutkimuksesta, jossa verrattiin PROAIR HFA -inhalaatioaerosolia (180 mikrogrammaa neljä kertaa päivässä) kaksoissokkoutettuun lumelääkkeeseen HFA-inhalaatioaerosoliin ja arvioija-sokkoutettu markkinoitu aktiivinen vertailuvalmiste HFA-134a albuteroliinhalaattori 172 astmapotilaalle 12–76-vuotiaille. Taulukossa luetellaan kaikkien tämän tutkimuksen haittatapahtumien ilmaantuvuus (riippumatta siitä, onko tutkija katsonut lääkkeeseen liittyvän tai lääkkeeseen liittymättömän), joita esiintyi vähintään 3 % PROAIR HFA -inhalaatioaerosolihoitoryhmässä ja useammin PROAIR HFA:ssa. Inhalaatioaerosolihoitoryhmä kuin vastaavassa lumeryhmässä. Kaiken kaikkiaan PROAIR HFA -inhalaatioaerosolin ja markkinoitavan aktiivisen vertailuaineen HFA-134a albuteroliinhalaattorin raportoitujen haittatapahtumien esiintyvyys ja luonne olivat vertailukelpoisia.
Haitallisten kokemusten ilmaantuvuus (% potilaista) kuuden viikon kliinisessä tutkimuksessa*
Alle 3 %:lla PROAIR HFA:n inhalaatioaerosolia saaneista potilaista raportoituja haittavaikutuksia, mutta suuremmalla osalla PROAIR HFA:n inhalaatioaerosolipotilaista kuin vastaavia lumelääkepotilaita, jotka voivat liittyä PROAIR HFA:n inhalaatioaerosoliin, olivat rintakipu, infektio, ripuli, glossiitti, tapaturmavamma (hermosto), ahdistuneisuus, hengenahdistus, korvahäiriöt, korvakipu ja virtsatietulehdus.
Pienillä kumulatiivisilla annoksilla tehdyissä tutkimuksissa vapina, hermostuneisuus ja päänsärky olivat yleisimpiä haittavaikutuksia.
4–11-vuotiaat lapsipotilaat
Haittatapahtumat, jotka raportoitiin 3 viikkoa kestäneessä lasten kliinisessä tutkimuksessa, jossa verrattiin samaa albuterolin formulaatiota kuin PROAIR HFA -inhalaatioaerosolissa (180 mikrogrammaa albuterolia neljä kertaa päivässä) vastaavaan lumelääkkeeseen HFA-inhalaatioaerosoliin, ilmaantuvuus oli alhainen (enintään 2 %). aktiivisessa hoitoryhmässä) ja olivat samanlaisia kuin aikuisilla ja nuorilla tehdyissä tutkimuksissa.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu PROAIR HFA:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Raportit ovat sisältäneet harvinaisia tapauksia pahentuneesta bronkospasmista, tehon puutteesta, astman pahenemisesta (raportoitu kuolemaan johtaneen yhdessä tapauksessa), lihaskrampit ja erilaisia suunnielun sivuvaikutuksia, kuten kurkun ärsytystä, makuaistin muutoksia, kielentulehdusta, kielen haavaumia ja hengästymistä.
Seuraavia haittavaikutuksia on havaittu inhaloitavan albuterolin käytön jälkeen: nokkosihottuma, angioedeema, ihottuma, bronkospasmi, käheys, suunielun turvotus ja rytmihäiriöt (mukaan lukien eteisvärinä, supraventrikulaarinen takykardia, ekstrasystolat). Lisäksi albuteroli, kuten muut sympatomimeettiset aineet, voi aiheuttaa haittavaikutuksia, kuten: angina pectoris, kohonnut verenpaine tai hypotensio, sydämentykytys, keskushermoston stimulaatio, unettomuus, päänsärky, hermostuneisuus, vapina, lihaskrampit, suunielun kuivuminen tai ärsytys, hypokalemia, hyperglykemia ja metabolinen asidoosi.
HUUMEIDEN VUOROVAIKUTUKSET
Muita lyhytvaikutteisia sympatomimeettisiä aerosolikeuhkoputkia laajentavia aineita ei tule käyttää samanaikaisesti PROAIR HFA -inhalaatioaerosolin kanssa. Jos muita adrenergisiä lääkkeitä annetaan jollakin tavalla, niitä tulee käyttää varoen, jotta vältetään haitalliset sydän- ja verisuonivaikutukset.
Beetasalpaajat
Beeta-adrenergisiä reseptoreja salpaavat aineet eivät ainoastaan estä beeta-agonistien, kuten PROAIR HFA -inhalaatioaerosolin, vaikutusta keuhkoihin, vaan ne voivat aiheuttaa vakavia bronkospasmia astmapotilailla. Siksi astmapotilaita ei normaalisti tule hoitaa beetasalpaajilla. Tietyissä olosuhteissa, esim. sydäninfarktin jälkeisenä ehkäisynä, beetasalpaajien käytölle astmapotilailla ei kuitenkaan ehkä ole hyväksyttäviä vaihtoehtoja. Harkitse tässä tilanteessa kardioselektiivisiä beetasalpaajia, vaikka niitä tuleekin antaa varoen.
Diureetit
Beeta-agonistit voivat pahentaa äkillisesti EKG-muutoksia ja/tai hypokalemiaa, jotka voivat johtua kaliumia säästämättömien diureettien (kuten loop- tai tiatsididiureettien) antamisesta, erityisesti jos beeta-agonistin suositeltu annos ylittyy. Vaikka näiden vaikutusten kliinistä merkitystä ei tunneta, varovaisuutta tulee noudattaa annettaessa beeta-agonisteja samanaikaisesti kaliumia säästämättömien diureettien kanssa. Harkitse kaliumtasojen seurantaa.
Digoksiini
Seerumin digoksiinipitoisuudet laskivat keskimäärin 16 % ja 22 %, kun albuterolia annettiin kerta-annoksena suonensisäisesti ja suun kautta normaaleille vapaaehtoisille, jotka olivat saaneet digoksiinia 10 päivän ajan. Näiden löydösten kliininen merkitys obstruktiivista hengitystiesairautta sairastaville potilaille, jotka saavat albuterolia ja digoksiinia kroonisesti, on epäselvä. Olisi kuitenkin järkevää arvioida huolellisesti seerumin digoksiinipitoisuudet potilailla, jotka saavat parhaillaan digoksiinia ja PROAIR HFA -inhalaatioaerosolia.
Monoamiinioksidaasin estäjät tai trisykliset masennuslääkkeet
PROAIR HFA -inhalaatioaerosolia tulee antaa äärimmäisen varovaisesti potilaille, joita hoidetaan monoamiinioksidaasin estäjillä tai trisyklisillä masennuslääkkeillä, tai 2 viikon sisällä tällaisten lääkkeiden käytön lopettamisesta, koska albuterolin vaikutus sydän- ja verisuonijärjestelmään saattaa voimistua. Harkitse vaihtoehtoista hoitoa potilaille, jotka käyttävät MAO-estäjiä tai trisyklisiä masennuslääkkeitä.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Paradoksaalinen Bronkospasmi
PROAIR HFA -hengitysaerosoli voi aiheuttaa paradoksaalisen bronkospasmin, joka voi olla hengenvaarallinen. Jos paradoksaalista bronkospasmia ilmenee, PROAIR HFA -inhalaatioaerosoli on lopetettava välittömästi ja aloitettava vaihtoehtoinen hoito. On huomattava, että paradoksaalista bronkospasmia, kun se liittyy inhaloitaviin formulaatioihin, esiintyy usein uuden kapselin ensimmäisen käytön yhteydessä.
Astman paheneminen
Astma voi pahentua akuutisti muutaman tunnin aikana tai kroonisesti useiden päivien tai pidempään. Jos potilas tarvitsee tavallista suurempia annoksia PROAIR HFA -inhalaatioaerosolia, tämä voi olla merkki astman epävakaudesta ja edellyttää potilaan ja hoito-ohjelman uudelleenarviointia kiinnittäen erityistä huomiota mahdolliseen anti-inflammatoriseen hoitoon, esim. kortikosteroidit.
Anti-inflammatoristen aineiden käyttö
Beeta-adrenergisten agonistien keuhkoputkia laajentavien lääkkeiden käyttö ei välttämättä riitä astman hallintaan monilla potilailla. Tulehduskipulääkkeiden, esim. kortikosteroidien, lisäämistä hoito-ohjelmaan tulee harkita ajoissa.
Sydän- ja verisuonivaikutukset
PROAIR HFA -inhalaatioaerosoli, kuten muutkin beeta-adrenergiset agonistit, voi aiheuttaa kliinisesti merkittäviä kardiovaskulaarisia vaikutuksia joillakin potilailla pulssin nopeudella, verenpaineella ja/tai oireilla mitattuna. Vaikka tällaiset vaikutukset ovat harvinaisia, kun PROAIR HFA -inhalaatioaerosolia on annettu suositelluilla annoksilla, lääkkeen käyttö saattaa olla tarpeen lopettaa, jos niitä ilmenee. Lisäksi beeta-agonistien on raportoitu aiheuttavan EKG-muutoksia, kuten T-aallon tasoittumista, QTc-ajan pidentymistä ja ST-segmentin laskua. Näiden löydösten kliinistä merkitystä ei tunneta. Siksi PROAIR HFA -inhalaatioaerosolia, kuten kaikkia sympatomimeettisiä amiineja, tulee käyttää varoen potilailla, joilla on sydän- ja verisuonisairauksia, erityisesti sepelvaltimon vajaatoimintaa, sydämen rytmihäiriöitä ja verenpainetautia.
Älä ylitä suositeltua annosta
Inhaloitavien sympatomimeettisten lääkkeiden liiallisen käytön yhteydessä on raportoitu kuolemantapauksia astmapotilailla. Tarkkaa kuolinsyytä ei tunneta, mutta sydämenpysähdystä epäillään odottamattoman vakavan akuutin astmaattisen kriisin ja sitä seuranneen hypoksian seurauksena.
Välittömät yliherkkyysreaktiot
Välittömiä yliherkkyysreaktioita saattaa ilmetä albuterolisulfaatin annon jälkeen, mikä on osoitettu harvinaisina urtikaria, angioedeeman, ihottuman, bronkospasmin, anafylaksia ja suunnielun turvotuksen tapauksina. Yliherkkyyden mahdollisuus on otettava huomioon kliinisessä arvioinnissa potilaista, jotka saavat välittömiä yliherkkyysreaktioita PROAIR HFA -inhalaatioaerosolia saaessaan.
Rinnakkaiset olosuhteet
PROAIR HFA -inhalaatioaerosolia, kuten kaikkia sympatomimeettisiä amiineja, tulee käyttää varoen potilailla, joilla on sydän- ja verisuonisairauksia, erityisesti sepelvaltimon vajaatoimintaa, sydämen rytmihäiriöitä ja verenpainetautia. potilailla, joilla on kouristuksia, kilpirauhasen liikatoimintaa tai diabetes mellitus; ja potilailla, jotka ovat epätavallisen herkkiä sympatomimeettisille amiineille. Kliinisesti merkittäviä muutoksia systolisessa ja diastolisessa verenpaineessa on havaittu yksittäisillä potilailla, ja niiden on odotettavissa tapahtuvan joillakin potilailla minkä tahansa beeta-adrenergisen bronkodilataattorin käytön jälkeen. Suonensisäisen albuterolin suurten annosten on raportoitu pahentavan jo olemassa olevaa diabetes mellitusta ja ketoasidoosia.
Hypokalemia
Kuten muutkin beeta-agonistit, PROAIR HFA -inhalaatioaerosoli voi aiheuttaa joillakin potilailla merkittävää hypokalemiaa, mahdollisesti solunsisäisen shuntingin kautta, mikä voi aiheuttaa haitallisia kardiovaskulaarisia vaikutuksia. Väheneminen on yleensä ohimenevää, ei vaadi lisäravinteita.
Potilasneuvontatiedot
Katso FDA:n hyväksymä potilasmerkintä
Potilaille tulee antaa seuraavat tiedot:
Käyttötiheys
PROAIR HFA -inhalaatioaerosolin vaikutuksen tulisi kestää 4–6 tuntia. Älä käytä PROAIR HFA -inhalaatioaerosolia suositeltua useammin. Pyydä potilaita olemaan suurentamatta PROAIR HFA -inhalaatioaerosolin annosta tai annosten tiheyttä neuvottelematta lääkärin kanssa. Jos potilaat huomaavat, että PROAIR HFA -inhalaatioaerosolihoito heikkenee oireiden lievittämisessä, oireet pahenevat ja/tai heidän on käytettävä tuotetta tavallista useammin, heidän on hakeuduttava välittömästi lääkärin hoitoon.
Pohjustus ja puhdistus
Pohjustus
Pohjustus on välttämätöntä, jotta varmistetaan sopiva albuterolipitoisuus jokaisessa painalluksessa. Neuvo potilaita esittelemään inhalaattori ennen ensimmäistä käyttökertaa ja tapauksissa, joissa inhalaattoria ei ole käytetty yli 2 viikkoon, päästämällä kolme suihketta ilmaan, pois kasvoilta.
Puhdistus
Oikean annostelun varmistamiseksi ja toimilaitteen aukon tukkeutumisen estämiseksi neuvo potilaita pesemään punainen muovinen toimilaitteen suukappale ja kuivaamaan perusteellisesti vähintään kerran viikossa. Neuvo potilaita, että jos heillä on useampi kuin yksi PROAIR HFA -inhalaattori, heidän tulee pestä jokainen eri aikoina, jotta väärä säiliö ei kiinnity väärään muoviseen toimilaitteeseen. Tällä tavalla he voivat olla varmoja, että he tietävät aina oikean määrän jäljellä olevia annoksia. Potilaita tulee neuvoa, etteivät he koskaan kiinnitä minkään muun inhalaattorin lääkesäiliötä PROAIR HFA -toimilaitteeseen eivätkä koskaan kiinnitä PROAIR HFA -säiliötä minkään muun inhalaattorin toimilaitteeseen. Potilaat eivät saa irrottaa säiliötä toimilaitteesta paitsi puhdistuksen aikana, koska uudelleen kiinnittäminen voi vapauttaa annoksen ilmaan ja annoslaskuri laskee alas joka kerta, kun suihke vapautuu. Yksityiskohtaiset puhdistusohjeet sisältyvät kuvalliseen potilaslehteen tietoihin.
Annoslaskuri
Potilaille tulee kertoa, että PROAIR HFA:ssa on annoslaskuri kiinnitettynä toimilaitteeseen. Kun potilas saa inhalaattorin, näyttöikkunaan ilmestyy musta piste, kunnes se on esitäytetty 3 kertaa, jolloin näyttöön tulee numero 200. Annoslaskuri laskee alaspäin aina, kun suihke vapautetaan. Annoslaskurin ikkuna näyttää inhalaattorissa jäljellä olevien suihkeiden määrän kahden yksiköissä (esim. 200, 198, 196 jne.). Kun laskuri näyttää 20, numeroiden väri muuttuu punaiseksi muistuttamaan potilasta ottamaan yhteyttä apteekkiin lääkkeen täyttöä varten tai kääntymään lääkärin puoleen reseptin täyttöä varten. Kun annoslaskuri saavuttaa nollan, tausta muuttuu tasaisen punaiseksi. Potilaita tulee neuvoa hävittämään PROAIR HFA -inhalaattori, kun annoslaskuri näyttää nollaa tai tuotteen viimeisen käyttöpäivämäärän jälkeen sen mukaan, kumpi tulee ensin.
Paradoksaalinen Bronkospasmi
Kerro potilaille, että PROAIR HFA -inhalaatioaerosoli voi aiheuttaa paradoksaalisen bronkospasmin. Neuvo potilaita lopettamaan PROAIR HFA -inhalaatioaerosoli, jos paradoksaalista bronkospasmia ilmenee.
Samanaikainen huumeiden käyttö
Kun potilaat käyttävät PROAIR HFA -inhalaatioaerosolia, muita inhaloitavia lääkkeitä ja astmalääkkeitä tulee ottaa vain lääkärin ohjeiden mukaan.
Yleiset haittatapahtumat
Inhaloitavan albuterolin hoidon yleisiä haittavaikutuksia ovat sydämentykytys, rintakipu, nopea syke, vapina tai hermostuneisuus.
Raskaus
Raskaana olevien tai imettävien potilaiden tulee ottaa yhteyttä lääkäriin PROAIR HFA -inhalaatioaerosolin käytöstä.
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet astmalääkkeille raskauden aikana [katso Käyttö tietyissä populaatioissa ].
Yleisiä tietoja käytöstä
PROAIR HFA -inhalaatioaerosolin tehokkaaseen ja turvalliseen käyttöön sisältyy ymmärrys tavasta, jolla se tulee antaa.
Ravista hyvin ennen jokaista ruiskutusta.
Käytä PROAIR HFA -inhalaatioaerosolia vain tuotteen mukana toimitetun toimilaitteen kanssa. Hävitä PROAIR HFA -inhalaattori, kun annoslaskuri näyttää nollaa tai tuotteen viimeinen käyttöpäivämäärä sen mukaan, kumpi tulee ensin. Älä koskaan upota säiliötä veteen sen täytön määrittämiseksi ("kelluvatesti").
Yleisesti ottaen PROAIR HFA -inhalaatioaerosolin antotapa lapsille on samanlainen kuin aikuisille. Lasten tulee käyttää PROAIR HFA -inhalaatioaerosolia aikuisen valvonnassa potilaan lääkärin ohjeiden mukaisesti.
FDA:n hyväksymä potilasmerkintä
Katso kuvassa repäisy Tietoa potilaalle esite.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Sprague-Dawley-rotilla tehdyssä 2-vuotisessa tutkimuksessa albuterolisulfaatti aiheutti annoksesta riippuvan mesovariumin hyvänlaatuisten leiomyoomien esiintyvyyden lisääntymisen vähintään 2 mg/kg:n ravinnon annoksilla (noin 15 kertaa ja 6 kertaa ihmiselle suositeltuun enimmäisannokseen verrattuna). päivittäinen inhalaatioannos (MRHDID) aikuisille ja lapsille, vastaavasti, mg/m² perusteella). Toisessa tutkimuksessa tämä vaikutus estettiin antamalla samanaikaisesti propranololia, joka on ei-selektiivinen beeta-adrenerginen antagonisti. 18 kuukautta kestäneessä CD-1-hiirillä tehdyssä tutkimuksessa albuterolisulfaatti ei osoittanut tuumorigeenisyyttä ravinnon annoksilla, jotka olivat enintään 500 mg/kg (noin 1 900 kertaa ja 740 kertaa MRHDID aikuisilla ja 740 kertaa lapsilla mg/m² perusta). 22 kuukautta kestäneessä Golden Hamsters -tutkimuksessa albuterolisulfaatti ei osoittanut tuumorigeenisyyttä ravinnon annoksilla, jotka olivat korkeintaan 50 mg/kg (noin 250-kertainen ja 100-kertainen MRHDID aikuisille ja 100-kertaisesti aikuisille ja lapsille, mg/m²-pohjalta laskettuna). .
Albuterolisulfaatti ei ollut mutageeninen Ames-testissä tai hiivan mutaatiotestissä. Albuterolisulfaatti ei ollut klastogeeninen ihmisen perifeeristen lymfosyyttien määrityksessä tai AH1-kannan hiiren mikrotumamäärityksessä.
Rotilla tehdyt lisääntymistutkimukset eivät osoittaneet hedelmällisyyden heikkenemistä suun kautta annetuilla annoksilla 50 mg/kg asti (noin 380 kertaa aikuisten MRHDID mg/m²:n perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet astmalääkkeille raskauden aikana. Lisätietoja saat ottamalla yhteyttä Teratology Information Specialists -järjestön suorittamaan Mothers To Baby Pregnancy Studies -tutkimukseen numerosta 1-877-311-8972 tai käymällä osoitteessa http://mothertobaby.org/pregnancystudies/.
Riskien yhteenveto
Albuterolin käytöstä raskauden aikana ei ole satunnaistettuja kliinisiä tutkimuksia. Saatavilla olevat tiedot julkaistuista epidemiologisista tutkimuksista ja markkinoille tulon jälkeisistä tapausraporteista inhaloidun albuterolin käytön aiheuttamista raskauden tuloksista eivät johdonmukaisesti osoita vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Albuterolin käytöllä raskaana olevilla naisilla on kliinisiä näkökohtia [katso Kliiniset näkökohdat ]. Eläinten lisääntymistutkimuksissa, kun albuterolisulfaattia annettiin ihonalaisesti tiineille hiirille, havaittiin suulakihalkeama alle ja jopa 9 kertaa ihmisen suurin suositeltu päivittäinen inhalaatioannos (MRHDID) [ks. Data ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu riski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Naisilla, joilla on huonosti tai kohtalaisesti hallinnassa oleva astma, on lisääntynyt preeklampsian riski äidillä ja keskosilla, alhainen syntymäpaino ja pieni raskausikään nähden vastasyntyneellä. Raskaana olevia naisia tulee seurata tarkasti ja lääkitystä säädettävä tarpeen mukaan optimaalisen hallinnan ylläpitämiseksi.
Työ tai toimitus
Koska beeta-agonisti saattaa vaikuttaa kohdun supistumiskykyyn, PROAIR HFA -inhalaatioaerosolin käyttö keuhkoputkien kouristuksen lievittämiseen synnytyksen aikana tulee rajoittaa potilaisiin, joiden hyödyt ovat selvästi suuremmat kuin riskit. PROAIR HFA -inhalaatioaerosolia ei ole hyväksytty ennenaikaisen synnytyksen hoitoon. Vakavia haittavaikutuksia, mukaan lukien keuhkopöhö, on raportoitu ennenaikaisen synnytyksen beeta2-agonisteilla, mukaan lukien albuterolilla, hoidon aikana tai sen jälkeen.
Data
Eläinten tiedot
Hiirillä tehdyssä lisääntymistutkimuksessa ihonalaisesti annettu albuterolisulfaatti aiheutti suulakihalkeamaa 5:ssä 111:stä (4,5 %) sikiöstä altistumalla yhdeksän kymmenesosaa MRHDID:stä aikuisille (mg/m², kun äidin annos oli 0,25 mg/kg ) ja 10:llä 108:sta (9,3 %) sikiöstä noin 9-kertaisella MRHDID:llä (mg/m²:n perusteella äidin annoksella 2,5 mg/kg). Samanlaisia vaikutuksia ei havaittu noin yhdestätoista MRHDID:ssä aikuisilla (mg/m², kun äidin annos oli 0,025 mg/kg). Suulakihalkeama esiintyi myös 22:lla 72:sta (30,5 %) naaraiden sikiöstä, joita hoidettiin ihonalaisesti isoproterenolilla (positiivinen kontrolli).
Kanin lisääntymistutkimuksessa oraalisesti annettu albuterolisulfaatti aiheutti kranioskoosia 7:ssä 19 sikiöstä (37 %) noin 750-kertaisella MRHDID:llä (mg/m² emon annoksella 50 mg/kg).
Rotan lisääntymistutkimuksessa inhalaationa annettu albuterolisulfaatti/HFA-134a-formulaatio ei aiheuttanut teratogeenisiä vaikutuksia altistuksilla, jotka olivat noin 80 kertaa MRHDID:tä suuremmat (mg/m², kun emon annos oli 10,5 mg/kg).
Tutkimus, jossa raskaana oleville rotille annettiin radioaktiivisesti leimattua albuterolisulfaattia, osoitti, että lääkkeeseen liittyvää materiaalia siirtyy äidin verenkierrosta sikiöön.
Imetys
Riskien yhteenveto
Tietoja albuterolin esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon ei ole saatavilla. Albuterolin plasmatasot inhaloitujen terapeuttisten annosten jälkeen ovat kuitenkin alhaisia ihmisillä, ja jos albuterolia on rintamaidossa, albuterolin oraalinen hyötyosuus on alhainen [ks. KLIININEN FARMAKOLOGIA ].
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen albuterolin tarve ja albuterolin tai äidin taustalla olevan sairauden mahdolliset haitalliset vaikutukset imetettävään lapseen.
Käyttö lapsille
PROAIR HFA -inhalaatioaerosolin turvallisuus ja tehokkuus bronkospasmin hoitoon tai ehkäisyyn 12-vuotiailla ja sitä vanhemmilla lapsilla, joilla on palautuva obstruktiivinen hengitystiesairaus, perustuu yhteen 6 viikkoa kestäneeseen kliiniseen tutkimukseen 116:lla vähintään 12-vuotiaalla astmapotilaalla. 180 mikrogramman annokset neljä kertaa vuorokaudessa lumelääkettä käytettäessä, ja yksi kerta-annostutkimus, jossa verrattiin 90, 180 ja 270 mikrogramman annoksia lumelääkkeeseen 58 potilaalla [ks. Kliiniset tutkimukset ]. PROAIR HFA -inhalaatioaerosolin turvallisuus ja tehokkuus rasituksen aiheuttaman bronkospasmin hoidossa 12-vuotiailla ja sitä vanhemmilla lapsilla perustuu yhteen kerta-annostutkimukseen, johon osallistui 24 aikuista ja nuorta, joilla on rasituksen aiheuttama bronkospasmi, jossa verrattiin 180 mikrogramman annoksia lumelääkkeeseen. [katso Kliiniset tutkimukset ].
PROAIR HFA -inhalaatioaerosolin turvallisuus 4–11-vuotiailla lapsilla perustuu yhteen 3 viikkoa kestäneeseen kliiniseen tutkimukseen, johon osallistui 50 potilasta 4-11-vuotiailla astmapotilailla, jotka käyttivät samaa albuteroliformulaatiota kuin PROAIR HFA -inhalaatioaerosolissa, jossa verrattiin 180 mikrogrammaa neljä kertaa päivässä lumelääkkeen kanssa. PROAIR HFA -inhalaatioaerosolin tehokkuus 4–11-vuotiailla lapsilla on ekstrapoloitu kliinisistä tutkimuksista 12-vuotiailla ja sitä vanhemmilla astmaa ja rasituksen aiheuttamaa bronkospasmia sairastavilla potilailla, jotka perustuvat kerta-annostutkimuksen tietoihin, joissa verrattiin keuhkoputkia laajentavaa vaikutusta. PROAIR HFA 90 mikrogrammaa ja 180 mikrogrammaa lumelääkkeen kanssa 55 astmapotilaalla ja 3 viikon kliininen tutkimus, jossa käytettiin samaa albuteroliformulaatiota kuin PROAIR HFA -inhalaatioaerosolissa 95 astmaa sairastavalla 4–11-vuotiaalla lapsella verrattaessa 180 mikrogramman albuteroliannosta. neljä kertaa päivässä lumelääkkeen kanssa [katso Kliiniset tutkimukset ].
PROAIR HFA -inhalaatioaerosolin turvallisuutta ja tehokkuutta alle 4-vuotiailla lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
PROAIR HFA -inhalaatioaerosolin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia potilaita sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkäälle potilaalle annoksen valinnassa tulee olla varovaista, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä [ks. VAROITUKSET JA VAROTOIMET ].
Kaikkien beeta2-adrenergisten agonistien, mukaan lukien albuterolin, tiedetään erittyvän olennaisesti munuaisten kautta, ja toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä.
YLIANNOSTUS
Odotettavissa olevat oireet yliannostuksen yhteydessä ovat liiallinen beeta-adrenerginen stimulaatio ja/tai minkä tahansa HAITTAVAIKUTUKSET-kohdassa lueteltujen oireiden esiintyminen tai voimistuminen, esim. kohtaukset, angina pectoris, verenpainetauti tai hypotensio, takykardia jopa 200 lyöntiä minuutissa, rytmihäiriöt, hermostuneisuus , päänsärky, vapina, suun kuivuminen, sydämentykytys, pahoinvointi, huimaus, väsymys, huonovointisuus ja unettomuus.
Hypokalemiaa voi myös esiintyä. Kuten kaikki sympatomimeettiset lääkkeet, sydämenpysähdys ja jopa kuolema voivat liittyä PROAIR HFA -inhalaatioaerosolin väärinkäyttöön.
Hoito koostuu PROAIR HFA -inhalaatioaerosolin käytön lopettamisesta ja asianmukaisesta oireenmukaisesta hoidosta. Kardioselektiivisen beetasalpaajan harkittua käyttöä voidaan harkita pitäen mielessä, että tällainen lääkitys voi aiheuttaa bronkospasmia. Ei ole riittävästi näyttöä sen määrittämiseksi, onko dialyysistä hyötyä PROAIR HFA -inhalaatioaerosolin yliannostuksesta.
Albuterolisulfaatin tappava suun kautta otettava annos hiirillä on suurempi kuin 2 000 mg/kg (noin 6 800 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisille mg/m²:n perusteella ja noin 3 200 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille mg /m² perusteella). Aikuisilla rotilla albuterolisulfaatin subkutaaninen tappava annos on noin 450 mg/kg (noin 3 000 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisille mg/m²:n perusteella ja noin 1 400 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille. mg/m² perusteella). Nuorilla rotilla subkutaaninen mediaani tappava annos on noin 2 000 mg/kg (noin 14 000 kertaa suurin suositeltu päivittäinen inhalaatioannos aikuisille mg/m²:n perusteella laskettuna ja noin 6 400 kertaa suurin suositeltu päivittäinen inhalaatioannos lapsille mg/m² perusta). Hengitettyä tappavaa annosta ei ole määritetty eläimillä.
VASTA-AIHEET
PROAIR HFA -inhalaatioaerosoli on vasta-aiheinen potilaille, joilla on aiemmin ollut yliherkkyys albuterolille ja muille PROAIR HFA -inhalaatioaerosolin aineosille. Harvinaisia yliherkkyysreaktioita, mukaan lukien nokkosihottuma, angioödeema ja ihottuma, on raportoitu albuterolisulfaatin käytön jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Albuterolisulfaatti on beeta-2-adrenerginen agonisti. Albuterolisulfaatin farmakologiset vaikutukset johtuvat beeta-2-adrenergisten reseptorien aktivoinnista hengitysteiden sileissä lihaksissa. Beeta2-adrenergisten reseptorien aktivoituminen johtaa adenyylisyklaasin aktivoitumiseen ja syklisen 3', 5'-adenosiinimonofosfaatin (syklisen AMP) solunsisäisen pitoisuuden kasvuun. Tämä syklisen AMP:n lisääntyminen liittyy proteiinikinaasi A:n aktivoitumiseen, mikä puolestaan estää myosiinin fosforylaatiota ja alentaa solunsisäistä ionista kalsiumpitoisuutta, mikä johtaa lihasten rentoutumiseen. Albuteroli rentouttaa kaikkien hengitysteiden sileitä lihaksia henkitorvesta terminaalisiin keuhkoputkiin. Albuteroli toimii toiminnallisena antagonistina, joka rentouttaa hengitysteitä asiaan liittyvästä kouristusta aiheuttavasta aineesta riippumatta, mikä suojaa kaikilta keuhkoputkia supistavilta haasteilta. Lisääntyneet sykliset AMP-pitoisuudet liittyvät myös välittäjäaineiden vapautumisen estämiseen syöttösoluista hengitysteissä. Vaikka tiedetään, että beeta2-adrenergiset reseptorit ovat keuhkoputkien sileän lihaksen hallitsevia reseptoreita, tiedot osoittavat, että ihmisen sydämessä on beeta-reseptoreita, joista 10–50 % on sydämen beeta2-adrenergisiä reseptoreita. Näiden reseptorien tarkkaa toimintaa ei ole vahvistettu [katso VAROITUKSET JA VAROTOIMET ].
Useimmissa kontrolloiduissa kliinisissä tutkimuksissa albuterolin on osoitettu vaikuttavan enemmän hengitysteihin keuhkoputkien sileän lihaksen rentoutumisen muodossa kuin isoproterenolilla vertailukelpoisina annoksina samalla, kun sillä on vähemmän kardiovaskulaarisia vaikutuksia. Inhaloitava albuteroli, kuten muutkin beeta-adrenergiset agonistilääkkeet, voi kuitenkin aiheuttaa joillakin potilailla merkittävän kardiovaskulaarisen vaikutuksen, mitattuna pulssilla, verenpaineella, oireilla ja/tai elektrokardiografisilla muutoksilla [ks. VAROITUKSET JA VAROTOIMET ].
Farmakokinetiikka
Albuterolin systeemiset tasot ovat alhaiset suositeltujen annosten hengittämisen jälkeen. Terveillä vapaaehtoisilla miehillä ja naispuolisilla vapaaehtoisilla tehdyssä ristikkäistutkimuksessa suuret kumulatiiviset PROAIR HFA -inhalaatioaerosoliannokset (1 080 mikrogrammaa albuteroliemästä annettuna tunnin aikana) tuottivat keskimääräiset huippupitoisuudet plasmassa (Cmax) ja systeeminen altistus (AUCinf) noin 4 100 pg/ ml ja 28 426 pg/ml*tunti, vastaavasti verrattuna noin 3 900 pg/ml ja 28 395 pg/ml*h, vastaavasti saman annoksen jälkeen aktiivista HFA-134a albuteroli-inhalaattoria. PROAIR HFA -inhalaatioaerosolilla toimitetun albuterolin terminaalinen puoliintumisaika plasmassa oli noin 6 tuntia. Farmakokineettisten parametrien vertailu ei osoittanut eroja tuotteiden välillä.
PROAIR HFA -inhalaatioaerosolin farmakokineettistä profiilia arvioitiin kaksisuuntaisessa ristikkäistutkimuksessa, johon osallistui 11 tervettä, 4–11-vuotiasta vapaaehtoista lasta. PROAIR HFA -inhalaatioaerosolin (180 mikrogrammaa albuteroliemästä) kerta-annos tuotti pienimmän neliösumman (SE) Cmax:n ja AUC0-∞:n 1100 (1,18) pg/ml ja 5120 (1,15) pg/ml*tuntia. PROAIR HFA -inhalaatioaerosolilla toimitetun albuterolin terminaalinen puoliintumisaika plasmassa pienimmän neliösumman (SE) oli 166 (7,8) minuuttia.
Aineenvaihdunta ja eliminaatio
Julkaistussa kirjallisuudessa saatavilla olevat tiedot viittaavat siihen, että ensisijainen entsyymi, joka vastaa albuterolin metaboliosta ihmisillä, on SULTIA3 (sulfotransferaasi). Kun raseemista albuterolia annettiin joko suonensisäisesti tai inhalaationa hiilen oraalisen annon jälkeen, pitoisuus-aikakäyrien alla oli 3-4-kertainen ero (R)- ja (S)albuterolin enantiomeerien välillä (S) )-albuterolipitoisuudet ovat jatkuvasti korkeammat. Kuitenkin ilman esikäsittelyä puuhiilellä joko oraalisen tai inhalaation jälkeen erot olivat 8-24-kertaiset, mikä viittaa siihen, että (R)-albuteroli metaboloituu ensisijaisesti maha-suolikanavassa, oletettavasti SULTIA3:n vaikutuksesta.
Albuterolin pääasiallinen eliminaatioreitti on joko lähtöaineen tai ensisijaisen metaboliitin erittyminen munuaisten kautta (80–100 %). Alle 20 % lääkkeestä havaitaan ulosteissa. Raseemisen albuterolin suonensisäisen annon jälkeen 25–46 % annoksen (R)-albuterolifraktiosta erittyi muuttumattomana (R)-albuterolina virtsaan.
Vanhempi, lasten, maksan/munuaisten vajaatoiminta
PROAIR HFA -inhalaatioaerosolilla ei ole tehty farmakokineettisiä tutkimuksia vastasyntyneillä tai vanhuksilla.
Maksan vajaatoiminnan vaikutusta PROAIR HFA -inhalaatioaerosolin farmakokinetiikkaan ei ole arvioitu.
Munuaisten vajaatoiminnan vaikutus albuterolin farmakokinetiikkaan arvioitiin viidellä koehenkilöllä, joiden kreatiniinipuhdistuma oli 7-53 ml/min, ja tuloksia verrattiin terveiden vapaaehtoisten tuloksiin. Munuaissairaudella ei ollut vaikutusta puoliintumisaikaan, mutta albuterolin puhdistuma väheni 67 %. Varovaisuutta tulee noudattaa annettaessa suuria annoksia PROAIR HFA -inhalaatioaerosolia potilaille, joilla on munuaisten vajaatoiminta [ks. Käyttö tietyissä populaatioissa ].
Eläinten toksikologia ja/tai farmakologia
Prekliininen
Suonensisäiset tutkimukset rotilla albuterolisulfaatilla ovat osoittaneet, että albuteroli läpäisee veri-aivoesteen ja saavuttaa aivopitoisuudet, jotka ovat noin 5 % plasman pitoisuuksista. Veri-aivoesteen ulkopuolisissa rakenteissa (käpy- ja aivolisäke) albuterolipitoisuuksien havaittiin olevan 100-kertaisia koko aivoihin verrattuna.
Laboratorio-eläimillä (minisiat, jyrsijät ja koirat) tehdyt tutkimukset ovat osoittaneet sydämen rytmihäiriöiden ja äkillisen kuoleman (jossa on histologisia todisteita sydänlihaksen nekroosista) esiintymistä, kun β-agonisteja ja metyyliksantiineja annettiin samanaikaisesti. Näiden löydösten kliinistä merkitystä ei tunneta.
Ponneaine HFA-134a:lla ei ole farmakologista aktiivisuutta lukuun ottamatta erittäin suuria annoksia eläimissä (380–1300 kertaa ihmisen enimmäisaltistus AUC-arvojen vertailun perusteella), mikä aiheuttaa ensisijaisesti ataksiaa, vapinaa, hengenahdistusta tai syljeneritystä. Nämä ovat samanlaisia kuin rakenteellisesti samankaltaisten kloorifluorihiilivetyjen (CFC:t) tuottamat vaikutukset, joita on käytetty laajalti annossumuttimissa.
Ponneaineen HFA-134a havaittiin imeytyvän ja eliminoituvan nopeasti eläimillä ja ihmisillä, ja eliminaation puoliintumisaika oli eläimillä 3-27 minuuttia ja ihmisillä 5-7 minuuttia. Aika plasman huippupitoisuuteen (Tmax) ja keskimääräinen viipymäaika ovat molemmat äärimmäisen lyhyitä, mikä johtaa ohimenevään HFA-134a:n esiintymiseen veressä ilman merkkejä kertymisestä.
Kliiniset tutkimukset
Astmaan liittyvä bronkospasmi
Aikuiset ja 12-vuotiaat ja sitä vanhemmat potilaat
Kuuden viikon satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa PROAIR HFA -inhalaatioaerosolia (58 potilasta) verrattiin vastaavaan lumelääkkeeseen HFA-inhalaatioaerosoliin (58 potilasta) 12–76-vuotiailla astmapotilailla annoksella. 180 mikrogrammaa albuterolia neljä kertaa päivässä. Mukaan otettiin arvioija-sokkomarkkinoitu aktiivinen vertailuvalmiste HFA-134a albuteroliinhalaattori (56 potilasta).
FEV1-sarjamittaukset, jotka on esitetty alla prosentuaalisena muutoksena testipäivän lähtötasosta päivänä 1 ja päivänä 43, osoittivat, että kaksi PROAIR HFA -inhalaatioaerosolin inhalaatiota paransi huomattavasti FEV1:tä hoitoa edeltävään arvoon verrattuna vastaavaan lumelääkkeeseen. verrattavissa oleva keuhkoputkia laajentava vaikutus markkinoituun aktiiviseen vertailuvalmisteeseen HFA-134a albuteroliinhalaattoriin.
FEV1 keskimääräisenä prosentuaalisena muutoksena testipäivän ennen annosta 6 viikon kliinisen tutkimuksen päivä 1
POTILASTIEDOT
PROAIR® HFA (pro' ar) (albuterolisulfaatti) Hengitys Aerosoli
Lue nämä potilastiedot ennen kuin aloitat PROAIR HFA:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi.
Mikä on PROAIR HFA?
PROAIR HFA on reseptilääke, jota käytetään 4-vuotiaille ja sitä vanhemmille:
- hoitaa tai ehkäistä bronkospasmia ihmisillä, joilla on palautuva obstruktiivinen hengitystiesairaus
- estää harjoituksen aiheuttamaa bronkospasmia
Ei tiedetä, onko PROAIR HFA turvallinen ja tehokas alle 4-vuotiaille lapsille.
Kuka ei saa käyttää PROAIR HFA:ta?
Älä käytä PROAIR HFA:ta, jos olet allerginen albuterolisulfaatille tai jollekin PROAIR HFA:n aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo PROAIR HFA:n ainesosista.
Mitä minun pitäisi kertoa lääkärilleni ennen kuin käytän PROAIR HFA:ta?
Ennen kuin käytät PROAIR HFA:ta, kerro lääkärillesi, jos:
- on sydänongelmia
- sinulla on korkea verenpaine (hypertensio)
- sinulla on kouristuksia (kouristuskohtauksia)
- sinulla on kilpirauhasen ongelmia
- on diabetes
- sinulla on alhainen kaliumtaso veressäsi
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako PROAIR HFA sikiötäsi. Keskustele lääkärisi kanssa, jos olet raskaana tai suunnittelet raskautta.
- imetät tai aiot imettää. Ei tiedetä, erittyykö PROAIR HFA äidinmaitoon. Keskustele lääkärisi kanssa parhaasta tavasta ruokkia vauvasi, jos käytät PROAIR HFA:ta.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät.
PROAIR HFA ja muut lääkkeet voivat vaikuttaa toisiinsa ja aiheuttaa sivuvaikutuksia. PROAIR HFA voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa PROAIR HFA:n toimintaan.
Kerro lääkärillesi erityisesti, jos otat:
- muita inhaloitavia lääkkeitä tai astmalääkkeitä
- beetasalpaajia
- diureetteja
- digoksiini
- monoamiinioksidaasin estäjät
- trisykliset masennuslääkkeet
Pyydä lääkäriltäsi tai apteekista luettelo näistä lääkkeistä, jos et ole varma.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi lääkärillesi ja apteekkiin, kun saat uuden lääkkeen.
Kuinka minun pitäisi käyttää PROAIR HFA:ta?
- Katso tarkemmat ohjeet "Käyttöohjeet" tämän potilastietojen lopussa.
- Käytä PROAIR HFA:ta juuri sen verran kuin lääkärisi on määrännyt.
- Jos lapsesi tarvitsee PROAIR HFA:ta, tarkkaile lastasi tarkasti varmistaaksesi, että lapsesi käyttää inhalaattoria oikein. Lääkärisi näyttää sinulle, kuinka lapsesi tulee käyttää PROAIR HFA:ta.
- Jokaisen PROAIR HFA -annoksen tulee kestää 4–6 tuntia.
- Älä nosta annostasi tai ota ylimääräisiä PROAIR HFA -annoksia keskustelematta ensin lääkärin kanssa.
- Hae heti lääkärin apua, jos PROAIR HFA ei enää auta oireitasi.
- Hakeudu välittömästi lääkärin hoitoon, jos oireesi pahenevat tai jos sinun on käytettävä inhalaattoria useammin.
- Kun käytät PROAIR HFA:ta, älä käytä muita inhaloitavia pelastuslääkkeitä tai astmalääkkeitä, ellei lääkärisi kehota sinua tekemään niin.
- Soita lääkärillesi, jos astmaoireesi, kuten hengityksen vinkuminen ja hengitysvaikeudet, pahenevat muutaman tunnin tai päivän kuluessa. Lääkärisi saattaa joutua antamaan sinulle toista lääkettä (esimerkiksi kortikosteroideja) oireidesi hoitoon.
Mitkä ovat PROAIR HFA:n mahdolliset sivuvaikutukset?
PROAIR HFA voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- pahenevat hengitysvaikeudet, yskä ja hengityksen vinkuminen (paradoksaalinen bronkospasmi). Jos näin tapahtuu, lopeta PROAIR HFA:n käyttö ja soita lääkärillesi tai hakeudu välittömästi hätäapuun. Paradoksaalinen bronkospasmi esiintyy todennäköisemmin, kun käytät ensimmäistä kertaa uutta lääkesäiliötä.
- sydänongelmia, mukaan lukien nopeampi syke ja korkea verenpaine
- mahdollinen kuolema astmapotilailla, jotka käyttävät liikaa PROAIR HFA:ta
- allergiset reaktiot. Soita lääkärillesi välittömästi, jos sinulla on seuraavat allergisen reaktion oireet:
- kutiava iho
- turvotusta ihon alla tai kurkussa
- ihottuma
- pahenevat hengitysvaikeudet
- alhainen kaliumpitoisuus veressäsi
- muiden lääketieteellisten ongelmien paheneminen ihmisillä, jotka käyttävät myös PROAIR HFA:ta, mukaan lukien verensokerin nousu
PROAIR HFA:n yleisimmät sivuvaikutukset ovat:
- sydämesi tuntuu hakkaavan tai jyskyttävän (tykytystykytys)
- rintakipu
- nopea syke
- vapina
- hermostuneisuus
- päänsärky
- huimaus
- kipeä kurkku
- vuotava nenä
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia PROAIR HFA:n mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka PROAIR HFA tulee säilyttää?
- Säilytä PROAIR HFA:ta huoneenlämmössä 59–77 °F (15–25 °C).
- Vältä altistumista äärimmäiselle kuumuudelle ja kylmälle.
- Ravista PROAIR HFA -säiliötä hyvin ennen käyttöä.
- Älä puhkaise PROAIR HFA -säiliö.
- Älä säilytä PROAIR HFA -säiliötä lähellä kuumuutta tai liekkejä. Yli 120 °F:n lämpötilat voivat aiheuttaa kapselin räjähtämisen.
- Älä heitä PROAIR HFA -kanisteri tuleen tai polttouuniin.
- Vältä PROAIR HFA:n suihkuttamista silmiin.
Pidä PROAIR HFA ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa PROAIR HFA:n turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä PROAIR HFA:ta sairauteen, johon sitä ei ole määrätty. Älä anna PROAIR HFA:ta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Nämä potilastiedot sisältävät yhteenvedon tärkeimmistä PROAIR HFA -tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltä tietoa PROAIR HFA:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta www.ProAirHFA.com tai soittamalla numeroon 1-888-482-9522.
Mitä ainesosia PROAIR HFA sisältää?
Vaikuttava aine: albuterolisulfaatti
Ei-aktiiviset aineet: ponneaine HFA-134a ja etanoli.
Käyttöohjeet
PROAIR® HFA (pro' ar) (albuterolisulfaatti) Hengitys Aerosoli
Lue nämä käyttöohjeet ennen kuin aloitat PROAIR HFA:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi.
PROAIR HFA -inhalaattorisi osat:
PROAIR HFA -inhalaattorissasi on kaksi pääosaa, mukaan lukien:
- punainen muovinen toimilaite, joka suihkuttaa lääkettä säiliöstä. Katso kuva A.
- suojaava pölysuojus, joka peittää toimilaitteen suukappaleen. Katso kuva A.
Siellä on myös metallisäiliö, jossa lääke säilytetään. Katso kuva A.
Toimilaitteen takaosaan on kiinnitetty myös annoslaskuri, jonka katseluikkuna näyttää, kuinka monta lääkesuihketta sinulla on jäljellä. Katso kuva B.
Näet mustan pisteen toimilaitteen katseluikkunassa, kunnes laite on esikäsitelty 3 kertaa. Katso kuva B ja "PROAIR HFA -laitteen esikäsittely" alla.
Kuva A ja kuva B 
- Älä käytä PROAIR HFA -toimilaitetta minkä tahansa muun inhalaattorin lääkesäiliön kanssa.
- Älä käytä PROAIR HFA -säiliötä minkä tahansa muun inhalaattorin toimilaitteen kanssa, mukaan lukien toinen PROAIR HFA -inhalaattori.
PROAIR HFA -laitteen esitäyttö:
PROAIR-laitteesi on esivalmistettava ennen kuin käytät sitä ensimmäistä kertaa tai jos laitettasi ei ole käytetty yli 14 päivään peräkkäin. Älä täytä PROAIR HFA -laitteesi joka päivä.
- Poista PROAIR HFA -laitteesi pakkauksestaan.
- Irrota pölysuojus suukappaleesta.
- Ravista inhalaattoria hyvin ja suihkuta sitä ilmaan pois kasvoiltasi. Katso kuva C.
Kuva C 
- Ravista ja suihkuta inhalaattoria näin vielä 2 kertaa, jotta se on valmis. Toimilaitteen annoslaskurin tulee näyttää numero 200, kun toimilaite on esitäytetty ensimmäisen kerran. Katso kuva D.
Kuva D 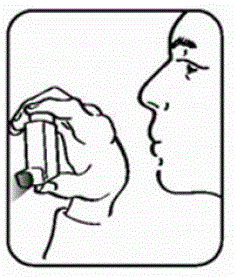
Aina kun käytät PROAIR HFA -laitettasi:
- Varmista, että säiliö sopii tiukasti muoviseen toimilaitteeseen.
- Katso suukappaleen sisään varmistaaksesi, ettei siinä ole vieraita esineitä, varsinkin jos korkkia ei ole käytetty suukappaleen peittämiseen.
PROAIR HFA -toimilaitteen annoslaskurin lukeminen
- Annoslaskuri laskee alaspäin aina, kun suihke vapautetaan. Annoslaskuriikkuna näyttää inhalaattorissasi jäljellä olevien suihkeiden määrän 2 suihkeen yksiköissä. Esimerkiksi jäljellä on 190 ruiskutusta, jos nuoli on täsmälleen vastapäätä numeroa 190, tai 189 ruiskutusta jäljellä, jos nuoli osoittaa välillä 190 ja 188. Katso kuva D.
- Kun annoslaskuri saavuttaa 0:n, se näyttää edelleen nollaa ja sinun tulee vaihtaa PROAIR HFA -laite.
- Annoslaskuria ei voi nollata, ja se on kiinnitetty pysyvästi toimilaitteeseen. Älä koskaan muuta annoslaskurin numeroita tai kosketa toimilaitteen sisällä olevaa tappia.
- Älä poista säiliö muovisesta toimilaitteesta paitsi puhdistuksen ajaksi. Kapselin kiinnittäminen takaisin toimilaitteeseen voi vahingossa päästää annoksen PROAIR HFA:ta ilmaan. Annoslaskuri laskee alaspäin aina, kun suihke vapautetaan.
PROAIR HFA -laitteen käyttäminen:
Vaihe 1. Ravista inhalaattoria hyvin ennen jokaista ruiskutusta. Ota korkki pois toimilaitteen suukappaleesta.
Vaihe 2. Pidä inhalaattoria suukappale alaspäin. Katso kuva E.
Kuva E 
Vaihe 3. Hengitä ulos suun kautta ja työnnä niin paljon ilmaa keuhkoistasi kuin pystyt. Laita suukappale suuhusi ja sulje huulet sen ympärille. Katso kuva F.
Vaihe 4. Työnnä säiliön yläosa kokonaan alas samalla kun hengität syvään ja hitaasti suun kautta. Katso kuva F.
Kuva F 
Vaihe 5. Heti kun suihke on tullut ulos, ota sormesi pois säiliöstä. Kun olet hengittänyt kokonaan sisään, ota inhalaattori ulos suustasi ja sulje suusi.
Vaihe 6. Pidätä hengitystäsi niin kauan kuin voit, 10 sekuntiin asti ja hengitä sitten normaalisti.
Jos lääkärisi on käskenyt sinua käyttämään enemmän suihkeita, odota 1 minuutti ja ravista inhalaattoria uudelleen. Toista vaiheet 2–6.
Vaihe 7. Aseta korkki takaisin suukappaleeseen jokaisen inhalaattorin käytön jälkeen. Varmista, että korkki napsahtaa tiukasti paikalleen.
PROAIR HFA -laitteen puhdistaminen:
On erittäin tärkeää pitää muovinen toimilaite puhtaana, jotta lääke ei keräänny ja estä suihketta. Katso kuva G ja kuva H.
Kuva G ja kuva H 
- Älä yritä puhdistaa metallisäiliötä tai anna sen kastua. Inhalaattori voi lopettaa ruiskutuksen, jos sitä ei puhdisteta oikein.
- Jos sinulla on enemmän kuin 1 PROAIR HFA -inhalaattori, pese jokainen laite eri aikoina, jotta vältetään väärän säiliön ja väärän muovisen toimilaitteen yhdistäminen. Näin voit olla varma, että tiedät aina oikean määrän jäljellä olevia PROAIR HFA -annoksia.
- Pese toimilaite vähintään 1 kerran viikossa seuraavasti:
- Ota säiliö pois toimilaitteesta ja poista suukappaleen korkki.
- Pidä toimilaitetta hanan alla ja juokse lämmintä vettä sen läpi noin 30 sekunnin ajan. Katso kuva I.
Kuva I 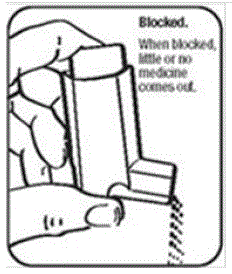
- Käännä toimilaite ylösalaisin ja valuta lämmintä vettä suukappaleen läpi noin 30 sekunnin ajan. Katso kuva J.
Kuva J 
- Ravista toimilaitteesta niin paljon vettä kuin mahdollista. Katso suukappaleeseen varmistaaksesi, että lääkkeen kerääntyminen on pesty kokonaan pois. Jos siinä on kerääntymiä, toista pesuohjeet.
- Anna toimilaitteen ilmakuivua kokonaan, esimerkiksi yön yli. Katso kuva K.
Kuva K 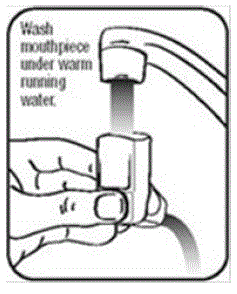
- Kun toimilaite on kuiva, laita kanisteri toimilaitteeseen ja varmista, että se sopii tiukasti. Ravista inhalaattoria hyvin ja suihkuta sitä kahdesti ilmaan pois kasvoiltasi. Laita korkki takaisin suukappaleeseen.
Jos sinun on käytettävä inhalaattoria ennen kuin toimilaite on täysin kuiva:
- Ravista toimilaitteesta niin paljon vettä kuin pystyt.
- Aseta kanisteri toimilaitteeseen ja varmista, että se sopii tiukasti.
- Ravista inhalaattoria hyvin ja suihkuta sitä kahdesti ilmaan pois kasvoiltasi.
- Ota PROAIR HFA -annos ohjeiden mukaan.
- Noudata yllä olevia puhdistusohjeita.
PROAIR HFA -laitteen vaihtaminen
- Kun toimilaitteen annoslaskuri näyttää numeron 20, numeroiden väri muuttuu punaiseksi. Punaiset numerot muistuttavat sinua täyttämään reseptisi tai pyytämään lääkäriltäsi toista PROAIR HFA -reseptiä. Kun annoslaskuri saavuttaa nollan, taustaväri muuttuu tasaiseksi punaiseksi.
- Heitä PROAIR HFA -inhalaattori pois heti, kun annoslaskuri ilmoittaa 0 tai PROAIR HFA -pakkauksen viimeisen käyttöpäivän jälkeen, sen mukaan, kumpi tulee ensin. Älä jatka inhalaattorin käyttöä 200 suihkeen jälkeen, vaikka säiliö ei ehkä ole täysin tyhjä. Et voi olla varma, että saat lääkkeitä 200 suihkeen käytön jälkeen.
- Älä käytä inhalaattoria PROAIR HFA -pakkauksessa olevan viimeisen käyttöpäivämäärän jälkeen.
Nämä potilastiedot ja käyttöohjeet ovat Yhdysvaltain elintarvike- ja lääkeviraston hyväksymiä.
