Spiriva 9mcg Tiotropium Bromide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Spiriva 9mcg HandiHaler on ja miten sitä käytetään?
Spiriva HandiHaler (tiotropiumbromidi) -inhalaatiojauhe on antikolinerginen lääke, jota käytetään estämään bronkospasmia (keuhkojen hengitysteiden supistuminen) ihmisillä, joilla on keuhkoputkentulehdus, emfyseema tai COPD (krooninen obstruktiivinen keuhkosairaus).
Mitä sivuvaikutuksia Spiriva 9mcg HandiHalerilla on?
Spiriva 9mcg HandiHalerin yleisiä sivuvaikutuksia ovat:
- kuiva suu,
- ummetus,
- ärtynyt vatsa,
- oksentelua,
- vilustumisoireet (nenän tukkoisuus, aivastelu, kurkkukipu),
- nenäverenvuoto tai
- lihaskipu.
Kerro lääkärillesi, jos sinulla on vakavia Spiriva 9mcg HandiHalerin sivuvaikutuksia, mukaan lukien:
- vaikea tai kivulias virtsaaminen tai
- nopea sydämenlyönti.
KUVAUS
SPIRIVA 9mcg HANDIHALER koostuu SPIRIVA-kapseleista ja HANDIHALER-laitteesta. Jokainen vaaleanvihreä, kova gelatiini SPIRIVA 9 mikrog -kapseli sisältää kuivajauhetta, joka koostuu 18 mikrogrammasta tiotropiumia (vastaa 22,5 mikrogrammaa tiotropiumbromidimonohydraattia) sekoitettuna laktoosimonohydraattiin (joka saattaa sisältää maitoproteiineja).
SPIRIVA-kapseleiden sisältö on tarkoitettu vain oraaliseen inhalaatioon, ja se on tarkoitettu annettavaksi vain HANDIHALER-laitteen kanssa.
SPIRIVA HANDIHALERin vaikuttava ainesosa on tiotropium. Lääkeaine, tiotropiumbromidimonohydraatti, on antikolinerginen aine, joka on spesifinen muskariinireseptoreille. Sitä kuvataan kemiallisesti nimellä (1α, 2β, 4β, 5α, 7β)-7-[(hydroksidi-2-tienyyliasetyyli)oksi]-9,9-dimetyyli-3-oksa-9-atsoniatrisyklo[3.3.1.02,4] nonaanibromidi monohydraatti. Se on synteettinen, ei-kiraalinen kvaternäärinen ammoniumyhdiste. Tiotropiumbromidi on valkoinen tai kellertävän valkoinen jauhe. Se liukenee niukasti veteen ja liukenee metanoliin.
Rakennekaava on:
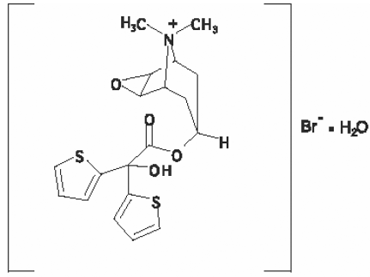
Tiotropiumbromidin (monohydraatin) molekyylimassa on 490,4 ja molekyylikaava C19H22NO4S2Br • H2O.
HANDIHALER-laite on inhalaatiolaite, jota käytetään SPIRIVA 9mcg -kapselin sisältämän kuivajauheen hengittämiseen. Kuivajauhe toimitetaan HANDIHALER-laitteesta niinkin alhaisilla virtausnopeuksilla kuin 20 l/min. Standardoidussa in vitro -testauksessa HANDIHALER-laite tuottaa keskimäärin 10,4 mikrogrammaa tiotropiumia testattaessa virtausnopeudella 39 l/min 3,1 sekunnin ajan (yhteensä 2 litraa). Tutkimuksessa 26 aikuispotilaalla, joilla oli keuhkoahtaumatauti ja vakavasti heikentynyt keuhkotoiminta [keskimääräinen FEV1 1,02 L (vaihteluväli 0,45 - 2,24 l); 37,6 % ennustetusta (vaihteluväli 16 % - 65 %)], sisäänhengityksen huippuvirtauksen (PIF) mediaani HANDIHALER-laitteen läpi oli 30,0 l/min (vaihteluväli 20,4 - 45,6 l/min). Keuhkoihin toimitettavan lääkkeen määrä vaihtelee potilaan tekijöiden mukaan, kuten sisäänhengityksen virtaus ja sisäänhengityksen huippuvirtaus HANDIHALER-laitteen läpi, mikä voi vaihdella potilaasta toiseen ja voi vaihdella läpipainopakkauksen ulkopuolella olevan SPIRIVA 9mcg -kapselin altistusajan mukaan. pakkaus.
INDIKAATIOT
SPIRIVA HANDIHALER (tiotropiumbromidi-inhalaatiojauhe) on tarkoitettu krooniseen obstruktiiviseen keuhkosairauteen (COPD), mukaan lukien krooninen keuhkoputkentulehdus ja emfyseema, liittyvän bronkospasmin pitkäaikaiseen, kerran päivässä annettavaan ylläpitohoitoon. SPIRIVA 9mcg HANDIHALER on tarkoitettu vähentämään COPD-potilaiden pahenemisvaiheita.
ANNOSTELU JA HALLINNOINTI
Vain suun kautta hengitettäväksi. Älä niele SPIRIVA 9mcg -kapseleita, sillä suunniteltuja vaikutuksia keuhkoihin ei saavuteta. SPIRIVA-kapseleiden sisältöä tulee käyttää vain HANDIHALER-laitteen kanssa [katso YLIANNOSTUS ].
Suositeltu SPIRIVA HANDIHALER -annos on kaksi inhalaatiota yhden SPIRIVA-kapselin jauhesisällöstä kerran päivässä HANDIHALER-laitteella [ks. POTILASTIEDOT ]. Älä ota useampaa kuin yhtä annosta 24 tunnin aikana.
SPIRIVA HANDIHALERin antamista varten SPIRIVA 9 mikrogramman kapseli asetetaan HANDIHALER-laitteen keskikammioon. SPIRIVA 9mcg kapseli lävistetään painamalla ja vapauttamalla HANDIHALER-laitteen sivulla oleva vihreä lävistyspainike. Tiotropiumformulaatio dispergoituu ilmavirtaan, kun potilas hengittää sisään suukappaleen kautta [katso POTILASTIEDOT ].
Annosta ei tarvitse muuttaa iäkkäille, maksan tai munuaisten vajaatoimintaa sairastaville potilaille. Potilaita, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta ja jotka saavat SPIRIVA 9 mcg HANDIHALERia, on kuitenkin seurattava tarkasti antikolinergisten vaikutusten varalta [ks. VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa , ja KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Hengitysjauhe
SPIRIVA 9mcg HANDIHALER koostuu SPIRIVA-kapseleista, jotka sisältävät tiotropiumjauhetta oraalista inhalaatiota varten, ja HANDIHALER-laitteen. SPIRIVA 9mcg kapselit sisältävät 18 mikrog tiotropiumia vaaleanvihreässä, kovassa liivatekapselissa, jonka toisella puolella on painettu TI 01 ja toisella puolella Boehringer Ingelheim -yhtiön logo. HANDIHALER-laite on tarkoitettu käytettäväksi vain SPIRIVA-kapseleiden kanssa.
Varastointi ja käsittely
SPIRIVA HANDIHALER koostuu SPIRIVA 9mcg kapseleista ja HANDIHALER laitteesta. SPIRIVA 9mcg kapselit sisältävät 18 mcg tiotropiumia ja ovat vaaleanvihreitä, ja SPIRIVA-kapselin korkissa on Boehringer Ingelheim -yhtiön logo ja SPIRIVA-kapselin rungossa TI 01 tai päinvastoin.
HANDIHALER-laite on harmaa ja siinä on vihreä lävistyspainike. Siihen on painettu SPIRIVA HANDIHALER (tiotropiumbromidi-inhalaatiojauhe), Boehringer Ingelheim -yhtiön logo. Se on myös painettu osoittamaan, että SPIRIVA-kapseleita ei saa säilyttää HANDIHALER-laitteessa ja että HANDIHALER-laitetta saa käyttää vain SPIRIVA 9mcg -kapseleiden kanssa.
SPIRIVA 9mcg -kapselit on pakattu alumiini/alumiiniläpipainopakkaukseen ja liitetty toisiinsa rei'itettyä leikkauslinjaa pitkin. SPIRIVA 9mcg -kapselit tulee aina säilyttää läpipainopakkauksessa ja poistaa vain välittömästi ennen käyttöä. Lääke tulee käyttää välittömästi yksittäisen SPIRIVA-kapselin pakkauksen avaamisen jälkeen.
Seuraavat paketit ovat saatavilla:
- laatikko, jossa on 5 SPIRIVA 9 mikrog kapselia (1 yksikköannos läpipainopakkaus) ja 1 HANDIHALER-inhalaatiolaite ( NDC 0597-0075-75) (laitospaketti)
- laatikko, joka sisältää 30 SPIRIVA 9 mikrog kapselia (3 yksikköannoksen läpipainopakkausta) ja 1 HANDIHALER-inhalaatiolaite ( NDC 0597-0075-41)
- pahvipakkaus, joka sisältää 90 SPIRIVA-kapselia (9 kerta-annoksen läpipainopakkausta) ja 1 HANDIHALER-inhalaatiolaitteen ( NDC 0597-0075-47)
Pitää poissa lasten ulottuvilta. Älä päästä jauhetta silmiin.
Varastointi
Säilytä 25°C (77°F); 15° - 30°C (59° - 86°F) sallitut retket [katso USP Controlled Room Temperature].
SPIRIVA-kapseleita ei saa altistaa äärimmäisille lämpötiloille tai kosteudelle. Älä säilytä SPIRIVA 9mcg -kapseleita HANDIHALER-laitteessa.
Jakelija: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Tarkistettu: helmikuuta 2018
SIVUVAIKUTUKSET
Seuraavat haittavaikutukset on kuvattu tai kuvattu yksityiskohtaisemmin muissa osissa:
- Välittömät yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
- Paradoksaalinen bronkospasmi [katso VAROITUKSET JA VAROTOIMET ]
- Ahdaskulmaglaukooman paheneminen [katso VAROITUKSET JA VAROTOIMET ]
- Virtsan kertymisen paheneminen [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin erilaisissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittujen haittavaikutusten ilmaantuvuutta ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa esiintyviin ilmaantuvuuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja ilmaantuvuutta.
Kokeilut 6 kuukaudesta 1 vuoteen
Alla kuvatut tiedot heijastavat altistumista SPIRIVA 9mcg HANDIHALERille 2663 potilaalla. SPIRIVA 9mcg HANDIHALERia tutkittiin kahdessa yhden vuoden lumekontrolloidussa tutkimuksessa, kahdessa 1 vuoden aktiivisessa kontrolloidussa tutkimuksessa ja kahdessa 6 kuukauden lumekontrolloidussa tutkimuksessa keuhkoahtaumatautipotilailla. Näissä tutkimuksissa 1308 potilasta hoidettiin SPIRIVA HANDIHALERilla suositellulla annoksella 18 mikrog kerran vuorokaudessa. Väestön ikä vaihteli 39-87-vuotiaista, 65-85 % miehistä, 95 % valkoihoisia, ja keuhkoahtaumatauti, jonka keskimääräinen pre-keuhkoputkia laajentava pakotettu uloshengitystilavuus sekunnissa (FEV1) prosentin ennustettiin olevan 39-43 %. Potilaat, joilla oli ahdaskulmaglaukooma tai oireinen eturauhasen liikakasvu tai virtsarakon ulostulotukos, suljettiin pois näistä tutkimuksista. Tähän turvallisuustietokantaan ei sisälly 6 kuukauden lisätutkimusta, joka suoritettiin Veteran's Affairs -ympäristössä, koska vain vakavat haittatapahtumat kerättiin.
Yleisin raportoitu haittavaikutus oli suun kuivuminen. Suun kuivuminen oli yleensä lievää ja hävisi usein hoidon jatkuessa. Muita yksittäisillä potilailla raportoituja ja mahdollisten antikolinergisten vaikutusten mukaisia reaktioita olivat ummetus, takykardia, näön hämärtyminen, glaukooma (alku tai paheneminen), dysuria ja virtsan kertymä.
Neljässä monikeskustutkimuksessa, yhden vuoden, lumekontrolloidussa ja aktiivisella kontrolloidussa tutkimuksessa arvioitiin SPIRIVA HANDIHALER -hoitoa keuhkoahtaumatautipotilailla. Taulukossa 1 on esitetty kaikki haittavaikutukset, joiden esiintymistiheys oli ≥3 % SPIRIVA 9mcg HANDIHALER -ryhmässä yhden vuoden lumekontrolloiduissa tutkimuksissa, joissa SPIRIVA HANDIHALER -ryhmässä esiintymistiheys ylitti lumelääkkeen ≥ 1 %:lla. Vastaavien reaktioiden esiintymistiheys ipratropiumkontrolloiduissa tutkimuksissa on sisällytetty vertailun vuoksi.
Niveltulehdusta, yskää ja influenssan kaltaisia oireita esiintyi ≥ 3 % SPIRIVA 9 mikrogrammaa HANDIHALER-hoitoryhmässä, mutta ne olivat
Muita reaktioita, joita esiintyi SPIRIVA HANDIHALER -ryhmässä 1–3 %:n esiintymistiheydellä lumekontrolloiduissa tutkimuksissa, joissa esiintymistiheys oli suurempi kuin lumeryhmässä, ovat:
Keho kokonaisuutena: allerginen reaktio, jalkakipu;
Keskus- ja ääreishermosto: dysfonia, parestesia;
Ruoansulatuskanavan häiriöt: maha-suolikanavan häiriö, jota ei ole erikseen määritelty (NOS), gastroesofageaalinen refluksi, stomatiitti (mukaan lukien haavainen stomatiitti);
Aineenvaihdunta- ja ravitsemushäiriöt: hyperkolesterolemia, hyperglykemia;
Tuki- ja liikuntaelimistön häiriöt: luuston kipu;
Sydäntapahtumat: angina pectoris (mukaan lukien pahentunut angina pectoris);
Psykiatrinen häiriö: masennus; Infektiot: herpes zoster;
Hengityselinten häiriö (ylempi): kurkunpään tulehdus;
Näköhäiriö: kaihi.
Lisäksi kliinisissä tutkimuksissa havaittuja haittavaikutuksia, joiden ilmaantuvuus oli alle 1 %, olivat eteisvärinä, supraventrikulaarinen takykardia, angioedeema ja virtsanpidätys.
Yhden vuoden tutkimuksissa suun kuivumisen, ummetuksen ja virtsatietulehduksen ilmaantuvuus lisääntyi iän myötä [ks. Käyttö tietyissä populaatioissa ].
Kahdessa monikeskustutkimuksessa, 6 kuukautta kestäneessä kontrolloidussa tutkimuksessa arvioitiin SPIRIVA 9 mikrogrammaa HANDIHALER keuhkoahtaumatautipotilailla. Haittavaikutukset ja ilmaantuvuus olivat samanlaiset kuin vuoden kestäneissä kontrolloiduissa tutkimuksissa.
4 vuoden kokeilu
Alla kuvatut tiedot heijastavat altistumista SPIRIVA 9 mcg HANDIHALERille 5992 keuhkoahtaumatautipotilaalla 4 vuotta kestäneessä lumekontrolloidussa tutkimuksessa. Tässä tutkimuksessa 2986 potilasta hoidettiin SPIRIVA 9 mikrog HANDIHALERilla suositellulla annoksella 18 mikrog kerran päivässä. Väestön ikähaarukka oli 40–88 vuotta, 75 % miehiä, 90 % valkoihoisia ja keuhkoahtaumatautia, jonka keskimääräisen keuhkoputkia laajentavan FEV1 prosentin ennustettiin olevan 40 %. Potilaat, joilla oli ahdaskulmaglaukooma tai oireinen eturauhasen liikakasvu tai virtsarakon ulostulotukos, suljettiin pois näistä tutkimuksista. Kun haittavaikutuksia analysoitiin ≥3 %:n esiintymistiheydellä SPIRIVA 9mcg HANDIHALER -ryhmässä, jossa SPIRIVA 9mcg HANDIHALER -ryhmässä esiintymistiheys ylitti lumelääkettä ≥1 %:lla, haittavaikutukset sisälsivät (SPIRIVA 9mcg HANDIHALER, lumelääke): nielutulehdus (12.5 %). , 10,8 %), poskiontelotulehdus (6,5 %, 5,3 %), päänsärky (5,7 %, 4,5 %), ummetus (5,1 %, 3,7 %), suun kuivuminen (5,1 %, 2,7 %), masennus (4,4 %, 3,3 %) , unettomuus (4,4 %, 3,0 %) ja nivelkipu (4,2 %, 3,1 %).
Muut haittavaikutukset
Muita haittavaikutuksia, joita ei ole aiemmin mainittu ja joita ilmoitettiin useammin keuhkoahtaumatautipotilailla, joita hoidettiin SPIRIVA 9mcg HANDIHALERilla kuin lumelääkettä, ovat: nestehukka, ihohaava, stomatiitti, ientulehdus, suunnielun kandidiaasi, ihon kuivuminen, ihotulehdus ja nivelten turvotus.
Markkinoinnin jälkeinen kokemus
Spiriva HANDIHALERin maailmanlaajuisen hyväksynnän jälkeisen käytön aikana on havaittu haittavaikutuksia. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Nämä haittavaikutukset ovat: antokohdan ärsytys (glossiitti, suun haavaumat ja nielun kipu), huimaus, nielemishäiriö, käheys, suolen tukkeuma mukaan lukien halvaussulku, silmänsisäisen paineen nousu, suun kandidiaasi, sydämentykytys, kutina, takykardia, kurkun irritaria.
HUUMEIDEN VUOROVAIKUTUKSET
Sympatomimeetit, metyyliksantiinit, steroidit
SPIRIVA 9mcg HANDIHALERia on käytetty samanaikaisesti lyhytvaikutteisten ja pitkävaikutteisten sympatomimeettisten (beeta-agonistien) keuhkoputkia laajentavien lääkkeiden, metyyliksantiinien sekä oraalisten ja inhaloitavien steroidien kanssa ilman, että haittavaikutukset lisääntyvät.
Antikolinergiset aineet
Samanaikaisesti käytettyjen antikolinergisten lääkkeiden kanssa on mahdollista additiivinen yhteisvaikutus. Vältä siksi SPIRIVA 9mcg HANDIHALERin samanaikaista antamista muiden antikolinergisiä lääkkeitä sisältävien lääkkeiden kanssa, koska tämä voi johtaa antikolinergisten haittavaikutusten lisääntymiseen [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Ei akuuttiin käyttöön
SPIRIVA 9mcg HANDIHALER on tarkoitettu kerran päivässä annettavaksi keuhkoahtaumatautien ylläpitohoidoksi, eikä sitä tule käyttää akuuttien oireiden lievittämiseen eli pelastushoitona akuuttien bronkospasmijaksojen hoidossa.
Välittömät yliherkkyysreaktiot
Välittömiä yliherkkyysreaktioita, mukaan lukien nokkosihottuma, angioödeema (mukaan lukien huulten, kielen tai kurkun turvotus), ihottuma, bronkospasmi, anafylaksia tai kutina, voi ilmaantua SPIRIVA 9mcg HANDIHALERin annon jälkeen. Jos tällainen reaktio ilmenee, SPIRIVA 9mcg HANDIHALER -hoito tulee lopettaa välittömästi ja vaihtoehtoisia hoitoja harkita. Koska atropiinilla on samankaltainen rakennekaava kuin tiotropiumilla, potilaita, joilla on aiemmin esiintynyt yliherkkyysreaktioita atropiinille tai sen johdannaisille, tulee seurata tarkasti samanlaisten SPIRIVA HANDIHALERin aiheuttamien yliherkkyysreaktioiden varalta. Lisäksi SPIRIVA HANDIHALER -valmistetta tulee käyttää varoen potilailla, joilla on vaikea yliherkkyys maidon proteiineille.
Paradoksaalinen Bronkospasmi
Inhaloitavat lääkkeet, mukaan lukien SPIRIVA HANDIHALER, voivat aiheuttaa paradoksaalisen bronkospasmin. Jos näin tapahtuu, se tulee hoitaa välittömästi inhaloitavalla lyhytvaikutteisella beeta2-agonistilla, kuten albuterolilla. SPIRIVA HANDIHALER -hoito tulee lopettaa ja muita hoitoja harkita.
Kapeakulmaglaukooman paheneminen
SPIRIVA 9mcg HANDIHALERia tulee käyttää varoen potilailla, joilla on ahdaskulmaglaukooma. Lääkkeen määrääjien ja potilaiden tulee olla varuillaan akuutin ahdaskulmaglaukooman merkeissä ja oireissa (esim. silmäkipu tai -epämukavuus, näön hämärtyminen, näkösädekehät tai värilliset kuvat, jotka liittyvät sidekalvon tukkoisuudesta ja sarveiskalvon turvotuksesta johtuvaan punaisiin silmiin). Neuvo potilaita ottamaan yhteyttä lääkäriin välittömästi, jos jokin näistä merkeistä tai oireista kehittyy.
Virtsanpidätyksen paheneminen
SPIRIVA HANDIHALER -valmistetta tulee käyttää varoen potilailla, joilla on virtsanpidätys. Lääkäreiden ja potilaiden tulee olla varuillaan virtsanpidätyksen merkeissä ja oireissa (esim. virtsaamisvaikeudet, kivulias virtsaaminen), erityisesti potilailla, joilla on eturauhasen liikakasvu tai virtsarakon kaulan tukos. Neuvo potilaita ottamaan yhteyttä lääkäriin välittömästi, jos jokin näistä merkeistä tai oireista kehittyy.
Munuaisten vajaatoiminta
Koska lääke erittyy pääasiassa munuaisten kautta, potilaita, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma KLIININEN FARMAKOLOGIA ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ja käyttöohjeet ).
Ei akuuttiin käyttöön
Kerro potilaille, että SPIRIVA HANDIHALER on kerran päivässä annettava ylläpitokeuhkoputkia laajentava lääke, eikä sitä tule käyttää hengitysvaikeuksien välittömään lievitykseen (eli pelastuslääkkeenä).
Välittömät yliherkkyysreaktiot
Kerro potilaille, että anafylaksia, angioödeema (mukaan lukien huulten, kielen tai kurkun turvotus), nokkosihottuma, ihottuma, bronkospasmi tai kutina voivat ilmaantua SPIRIVA 9mcg HANDIHALERin antamisen jälkeen. Neuvo potilasta välittömästi lopettamaan hoito ja kääntymään lääkärin puoleen, jos jokin näistä merkeistä tai oireista kehittyy.
Paradoksaalinen Bronkospasmi
Kerro potilaille, että SPIRIVA HANDIHALER voi aiheuttaa paradoksaalisen bronkospasmin. Neuvo potilaita, että jos paradoksaalista bronkospasmia ilmenee, potilaiden tulee lopettaa SPIRIVA HANDIHALER -hoito.
Kapeakulmaglaukooman paheneminen
Neuvo potilaita varomaan ahdaskulmaglaukooman merkkejä ja oireita (esim. silmäkipu tai -epämukavuus, näön hämärtyminen, näköhalot tai värilliset kuvat yhdessä sidekalvon tukkoisuudesta ja sarveiskalvon turvotuksesta johtuvan punaisten silmien kanssa). Neuvo potilaita ottamaan välittömästi yhteyttä lääkäriin, jos jokin näistä merkeistä ja oireista kehittyy.
Kerro potilaille, että on varottava jauhetta joutumasta silmiin, koska tämä voi aiheuttaa näön hämärtymistä ja pupillien laajentumista.
Koska SPIRIVA HANDIHALER -valmistetta käytettäessä voi esiintyä huimausta ja näön hämärtymistä, varo potilaita ryhtymästä toimiin, kuten ajoneuvon ajamiseen tai koneiden tai koneiden käyttämiseen.
Virtsanpidätyksen paheneminen
Neuvo potilaita olemaan valppaana virtsanpidätyksen merkeissä ja oireissa (esim. virtsaamisvaikeudet, kivulias virtsaaminen). Neuvo potilaita ottamaan yhteyttä lääkäriin välittömästi, jos jokin näistä merkeistä tai oireista kehittyy.
Spiriva HANDIHALERin anto-ohjeet
Opeta potilaita, kuinka SPIRIVA 9mcg -kapselit annetaan oikein HANDIHALER-laitteella [ks. POTILASTIEDOT ]. Kerro potilaille, että SPIRIVA 9 mikrogramman kapseleita tulee antaa vain HANDIHALER-laitteen kautta ja että HANDIHALER-laitetta ei saa käyttää muiden lääkkeiden antamiseen. Muistuta potilaita, että SPIRIVA 9mcg -kapseleiden sisältö on tarkoitettu vain oraaliseen inhalaatioon, eikä sitä saa niellä.
Neuvo potilaita aina säilyttämään SPIRIVA 9mcg -kapselit suljetuissa läpipainopakkauksissa ja poistamaan vain yksi SPIRIVA-kapseli juuri ennen käyttöä, muuten sen teho voi heikentyä. Neuvo potilaita hävittämään käyttämättömät ylimääräiset SPIRIVA-kapselit, jotka ovat alttiina ilmalle (eli joita ei ole tarkoitettu välittömään käyttöön).
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Tuumorigeenisyydestä ei havaittu näyttöä 104 viikkoa kestäneessä inhalaatiotutkimuksessa rotilla tiotropiumin annoksilla 59 mikrog/kg/vrk asti, 83 viikkoa kestäneessä inhalaatiotutkimuksessa naarashiirillä annoksilla 145 mikrog/kg/vrk, ja 101 viikon inhalaatiotutkimus uroshiirillä annoksilla 2 mikrog/kg/vrk. Nämä annokset vastaavat vastaavasti noin 30, 40 ja 0,5 kertaa suositeltua ihmisen päivittäistä inhalaatioannosta (MRHDID) mikrog/m2:n perusteella.
Tiotropiumbromidi ei osoittanut näyttöä mutageenisuudesta tai klastogeenisuudesta seuraavissa määrityksissä: bakteerigeenimutaatiomääritys, V79 kiinanhamsterin solumutageneesimääritys, kromosomipoikkeamamääritykset ihmisen lymfosyyteissä in vitro ja hiiren mikrotuman muodostuminen in vivo, ja suunnittelematon DNA-synteesi primaarinen rotan hepatosyyttien in vitro -määritys.
Rotilla havaittiin keltasolujen määrän ja implanttien prosenttiosuuden vähenemistä inhaloitavilla tiotropiumannoksilla, jotka olivat 78 mcg/kg/vrk tai suurempia (noin 40 kertaa MRHDID mikrogrammaa/m2-pohjaisesti laskettuna). Tällaisia vaikutuksia ei havaittu annoksella 9 mikrogrammaa/kg/päivä (noin 5 kertaa MRHDID mikrogrammaa/m2:n perusteella). Hedelmällisyysindeksiin ei kuitenkaan vaikuttanut inhalaatioannoksilla 1 689 mikrogrammaa/kg/vrk asti (noin 910 kertaa MRHDID mikrogrammaa/m2:n perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Rajalliset tiedot ihmisistä SPIRIVA 9mcg HANDIHALERin käytöstä raskauden aikana eivät riitä osoittamaan lääkkeeseen liittyvää riskiä raskauteen liittyvistä haitallisista seurauksista. Eläimillä tehtyjen lisääntymistutkimusten perusteella rakenteellisia poikkeavuuksia ei havaittu, kun tiotropiumia annettiin inhalaatiolla tiineille rotille ja kaneille organogeneesin aikana annoksina 790 ja 8 kertaa ihmisen suurin suositeltu päivittäinen inhalaatioannos (MRHDID). Lisääntynyt implantaation jälkeinen menetys havaittiin rotilla ja kaneissa, joille annettiin tiotropiumia emolle toksisilla annoksilla, jotka olivat 430-kertaisia ja 40-kertaisia MRHDID-annoksia [ks. Data ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Data
Eläinten tiedot
Kahdessa erillisessä alkion ja sikiön kehitystutkimuksessa raskaana olevat rotat ja kanit saivat tiotropiumia organogeneesin aikana annoksina, jotka olivat enintään noin 790 ja 8 kertaa MRHDID (mcg/m2:n perusteella inhalaatioannoksilla 1471 ja 7 mcg/kg). /vrk rotilla ja kaniineilla). Rotilla tai kaniineilla ei havaittu näyttöä rakenteellisista poikkeavuuksista. Rotilla tiotropium aiheutti kuitenkin sikiön resorptiota, pentueen katoamista, elävien pentujen lukumäärän pienenemistä syntymähetkellä ja pentujen keskimääräisen painon vähenemistä sekä pentujen seksuaalisen kypsymisen viivästymistä tiotropiumannoksilla, jotka olivat noin 40-kertaisia MRHDID-annoksilla (mcg/m2 äidin inhalaatioannoksella 78 mcg/kg/vrk). Kaneissa tiotropium lisäsi istutuksen jälkeistä menetystä tiotropiumannoksella, joka oli noin 430-kertainen MRHDID:ään verrattuna (mcg/m2:n perusteella emon inhalaatioannoksella 400 mcg/kg/vrk). Tällaisia vaikutuksia ei havaittu noin 5-kertaisella ja 95-kertaisella MRHDID:llä (mcg/m2:n perusteella inhalaatioannoksilla 9 ja 88 mcg/kg/vrk rotilla ja kaniineilla).
Imetys
Riskien yhteenveto
Ei ole tietoa tiotropiumin esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon. Tiotropiumia on imettävien rottien maidossa; laktaatiofysiologian lajikohtaisista eroista johtuen näiden tietojen kliininen merkitys ei kuitenkaan ole selvä [ks. Data ]. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen SPIRIVA 9mcg HANDIHALER -tarve ja SPIRIVA HANDIHALERin mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Data
Tiotropiumbromidin jakautumista maitoon tutkittiin sen jälkeen, kun imettäville rotille annettiin kerta-annos 10 mg/kg. Tiotropiumia ja/tai sen metaboliitteja on imettävien rottien maidossa pitoisuuksina, jotka ovat suurempia kuin plasmassa.
Käyttö lapsille
SPIRIVA HANDIHALER ei ole tarkoitettu käytettäväksi lapsille. SPIRIVA 9mcg HANDIHALERin turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
Saatavilla olevien tietojen perusteella SPIRIVA HANDIHALER -annoksen muuttaminen iäkkäillä potilailla ei ole perusteltua [ks. KLIININEN FARMAKOLOGIA ].
Kaikista potilaista, jotka saivat SPIRIVA 9 mikrogrammaa HANDIHALERia vuoden kestäneissä kliinisissä tutkimuksissa, 426 oli alle 65-vuotiaita, 375 oli 65-74-vuotiaita ja 105 oli 75-vuotiaita. Kussakin ikäryhmässä ei havaittu eroja haittavaikutuksia saaneiden potilaiden osuudessa SPIRIVA 9 mikrogrammaa HANDIHALER -hoidon ja vertailuryhmien välillä useimpien tapahtumien osalta. Suun kuivuminen lisääntyi iän myötä SPIRIVA 9 mikrogrammaa HANDIHALER -ryhmässä (erot lumelääkkeeseen olivat 9,0 %, 17,1 % ja 16,2 % edellä mainituissa ikäryhmissä). Spiriva HANDIHALER -ryhmässä lumekontrolloiduissa tutkimuksissa havaittiin ummetuksen ja virtsatieinfektioiden yleisempää iän myötä. Ummetuksen erot lumelääkkeeseen olivat 0 %, 1,8 % ja 7,8 % kussakin ikäryhmässä. Erot plaseboon virtsatieinfektioissa olivat –0,6 %, 4,6 % ja 4,5 %. Näiden ryhmien välillä ei havaittu yleisiä eroja tehokkuudessa.
Munuaisten vajaatoiminta
Potilaita, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutuksia tiotropiumin farmakokinetiikkaan ei ole tutkittu.
YLIANNOSTUS
Suuret tiotropiumannokset voivat aiheuttaa antikolinergisiä merkkejä ja oireita. Kuudella terveellä vapaaehtoisella ei kuitenkaan havaittu systeemisiä antikolinergisiä haittavaikutuksia enintään 282 mikrogramman tiotropiumin kerta-annoksen jälkeen. Tutkimuksessa, johon osallistui 12 tervettä vapaaehtoista, havaittiin molemminpuolinen sidekalvotulehdus ja suun kuivuminen, kun 141 mikrogrammaa tiotropiumia hengitettiin toistuvasti kerran päivässä.
Yliannostuksen hoito koostuu SPIRIVA HANDIHALER -hoidon keskeyttämisestä sekä asianmukaisen oireenmukaisen ja/tai tukihoidon aloittamisesta.
Vahingossa nieleminen
Spiriva-kapseleiden tahattomasta oraalisesta nauttimisesta aiheutuva akuutti myrkytys on epätodennäköistä, koska se ei imeydy hyvin systeemisesti.
Yliannostustapauksia on raportoitu markkinoille tulon jälkeen. Naispotilaan kerrottiin hengittäneen 30 kapselia 2,5 päivän aikana, ja hänelle kehittyi muuttunut henkinen tila, vapina, vatsakipu ja vaikea ummetus. Potilas vietiin sairaalaan, SPIRIVA HANDIHALER lopetettiin ja ummetusta hoidettiin peräruiskeella. Potilas toipui ja kotiutettiin samana päivänä.
VASTA-AIHEET
SPIRIVA 9mcg HANDIHALER on vasta-aiheinen potilailla, jotka ovat yliherkkiä tiotropiumille, ipratropiumille tai jollekin tämän tuotteen aineosalle [ks. VAROITUKSET JA VAROTOIMET ]. Spiriva 9mcg HANDIHALERin kliinisissä tutkimuksissa ja markkinoille tulon jälkeen on raportoitu välittömiä yliherkkyysreaktioita, mukaan lukien angioedeemaa (mukaan lukien huulten, kielen tai kurkun turvotus), kutinaa tai ihottumaa [ks. VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Tiotropium on pitkävaikutteinen antimuskariininen aine, jota kutsutaan usein antikolinergiseksi aineeksi. Sillä on samanlainen affiniteetti muskariinireseptorien alatyyppeihin M1-M5. Hengitysteissä sillä on farmakologisia vaikutuksia estämällä M3-reseptoreita sileässä lihaksessa, mikä johtaa keuhkoputkien laajenemiseen. Antagonismin kilpaileva ja palautuva luonne osoitettiin ihmis- ja eläinperäisten reseptoreiden ja eristettyjen elinvalmisteiden avulla. Prekliinisissä in vitro- ja in vivo -tutkimuksissa metakoliinin aiheuttamien bronkokonstriktiovaikutusten ehkäisy oli annoksesta riippuvaista ja kesti yli 24 tuntia. Tiotropiumin inhalaation jälkeinen bronkodilataatio on pääasiassa paikkaspesifinen vaikutus.
Farmakodynamiikka
Sydämen elektrofysiologia
Monikeskustutkimuksessa, satunnaistetussa kaksoissokkotutkimuksessa, jossa käytettiin tiotropiumkuivajauhetta inhaloitavaksi, johon otettiin mukaan 198 keuhkoahtaumatautipotilasta, potilaiden määrä, joiden lähtötilanteen mukaan korjattu QT-aika vaihteli 30–60 ms, oli suurempi SPIRIVA 9 mcg HANDIHALER -ryhmässä verrattuna. lumelääkkeen kanssa. Tämä ero oli ilmeinen käyttämällä sekä Bazettin (QTcB) [20 (20 %) potilasta vs. 12 (12 %) potilasta] että Fredericia (QTcF) [16 (16 %) potilasta vs. 1 (1 %) potilasta] korjauksia. QT sykkeelle. Yhdelläkään potilaalla kummassakaan ryhmässä QTcB tai QTcF ei ollut >500 ms. Muut kliiniset SPIRIVA HANDIHALER -tutkimukset eivät havainneet lääkkeen vaikutusta QTc-aikaan.
Inhaloitavan tiotropiumkuivajauheen vaikutusta QT-aikaan arvioitiin myös satunnaistetussa, lumelääke- ja positiivisesti kontrolloidussa risteytystutkimuksessa, johon osallistui 53 tervettä vapaaehtoista. Koehenkilöt saivat tiotropiumkuivajauhetta inhalaatioon 18 mikrogrammaa, 54 mikrogrammaa (3 kertaa suositeltu annos) tai lumelääkettä 12 päivän ajan. EKG-arvioinnit suoritettiin lähtötilanteessa ja koko annosteluvälin ajan tutkimuksen ensimmäisen ja viimeisen annoksen jälkeen. Suhteessa lumelääkkeeseen tutkimuskohtaisen QTc-ajan suurin keskimääräinen muutos lähtötilanteesta oli 3,2 ms ja 0,8 ms tiotropiumkuivajauheella inhaloitavassa 18 mikrogrammassa ja 54 mikrogrammassa 54 ms. Yhdelläkään tutkittavalla ei havaittu uutta QTc:n alkamista > 500 ms tai QTc:n muutoksia ≥ 60 ms:n lähtötasosta.
Farmakokinetiikka
Tiotropiumia annetaan kuivajauheinhalaatiolla. Jotkut alla kuvatuista farmakokineettisistä tiedoista saatiin hoitoon suositeltua suurempia annoksia käytettäessä. Erityisessä farmakokineettisessä tutkimuksessa keuhkoahtaumatautia sairastavilla potilailla arvioitiin RESPIMAT-inhalaattorista (5 mikrogrammaa) ja HANDIHALER-laitteesta inhalaatiojauheena (18 mikrogrammaa) annettua tiotropiumia kerran päivässä, mikä johti samanlaiseen systeemiseen altistumiseen näiden kahden tuotteen välillä.
Imeytyminen
Kun nuoret terveet vapaaehtoiset ovat inhaloineet kuivajauhetta, 19,5 %:n absoluuttinen hyötyosuus viittaa siihen, että keuhkoihin saapuva fraktio on erittäin biologisesti hyödynnettävissä. Tiotropiumin oraaliliuosten absoluuttinen hyötyosuus on 2-3 %. Ruoan ei odoteta vaikuttavan tiotropiumin imeytymiseen. Tiotropiumin huippupitoisuudet plasmassa havaittiin 7 minuuttia inhalaation jälkeen.
Jakelu
Tiotropium sitoutuu 72 % plasman proteiineihin ja sen jakautumistilavuus oli 32 l/kg suonensisäisen annostelun jälkeen nuorille terveille vapaaehtoisille. Paikallisia pitoisuuksia keuhkoissa ei tunneta, mutta antotapa viittaa olennaisesti suurempiin pitoisuuksiin keuhkoissa. Rotilla tehdyt tutkimukset ovat osoittaneet, että tiotropium ei tunkeudu helposti veri-aivoesteeseen.
Eliminointi
Tiotropiumin terminaalinen puoliintumisaika keuhkoahtaumatautipotilailla 5 mikrog tiotropiumin kerran päivässä inhalaation jälkeen oli noin 25 tuntia. Kokonaispuhdistuma oli 880 ml/min suonensisäisen annon jälkeen nuorilla terveillä vapaaehtoisilla. Sen jälkeen, kun keuhkoahtaumatautipotilaat olivat inhaloineet kuivajauhetta kerran päivässä, farmakokineettinen vakaa tila saavutettiin 7. päivään mennessä, eikä sen jälkeen kerrytty.
Aineenvaihdunta
Aineenvaihdunta on pieni. Tämä käy ilmi siitä, että 74 % muuttumattomana ainetta erittyy virtsaan suonensisäisen annoksen jälkeen nuorille terveille vapaaehtoisille. Tiotropium, esteri, pilkkoutuu ei-entsymaattisesti alkoholiksi N-metyyliskopiiniksi ja ditienyyliglykolihapoksi, joista kumpikaan ei sitoudu muskariinireseptoreihin.
Ihmisen maksan mikrosomeilla ja ihmisen hepatosyyteillä tehdyt in vitro -kokeet viittaavat siihen, että osa annetusta annoksesta (74 % suonensisäisestä annoksesta erittyy muuttumattomana virtsaan, jolloin 25 % jää metaboliaan) metaboloituu sytokromi P450:stä riippuvaisen hapettumisen ja sitä seuranneen glutationin konjugaation kautta. useisiin faasin II metaboliitteihin. CYP450 2D6- ja 3A4-estäjät, kuten kinidiini, ketokonatsoli ja gestodeeni, voivat estää tämän entsymaattisen reitin. Siten CYP450 2D6 ja 3A4 ovat mukana aineenvaihduntareitissä, joka vastaa pienen osan annetusta annoksesta eliminaatiosta. In vitro -tutkimukset, joissa käytettiin ihmisen maksan mikrosomeja, osoittivat, että tiotropium ei terapeuttista suurempina pitoisuuksina estänyt CYP450:tä 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 tai 3A4.
Erittyminen
Suonensisäisesti annettu tiotropiumbromidi erittyy pääasiassa muuttumattomana virtsaan (74 %). Kuivajauheinhalaation jälkeen keuhkoahtaumatautipotilaille vakaassa tilassa virtsaan erittyi 7 % (1,3 mikrog) muuttumattomasta annoksesta 24 tunnin aikana. Tiotropiumin munuaispuhdistuma ylittää kreatiniinipuhdistuman, mikä viittaa virtsaan erittymiseen.
Tietyt populaatiot
Geriatriset potilaat
Kuten odotettiin kaikkien pääosin munuaisten kautta erittyvien lääkkeiden kohdalla, iän ikääntyminen liittyi tiotropiumin munuaispuhdistuman laskuun (365 ml/min keuhkoahtaumatautipotilailla
Munuaisten vajaatoiminta
viikon SPIRIVA 9 mcg HANDIHALER tai SPIRIVA 9 mcg RESPIMAT kerran vuorokaudessa antamisen jälkeen keuhkoahtaumatautia sairastaville potilaille lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma 60-
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutuksia tiotropiumin farmakokinetiikkaan ei ole tutkittu.
Huumeiden vuorovaikutukset
Yhteisvaikutustutkimus tehtiin tiotropiumilla (14,4 mikrog suonensisäinen infuusio 15 minuutin aikana) ja simetidiinillä 400 mg kolmesti vuorokaudessa tai ranitidiinilla 300 mg kerran vuorokaudessa. Simetidiinin ja tiotropiumin samanaikainen anto johti 20 %:n nousuun AUC0-4h:ssa, 28 %:n laskuun tiotropiumin munuaispuhdistumassa eikä merkitsevää muutosta Cmax-arvossa ja virtsaan erittyvässä määrässä 96 tunnin aikana. Tiotropiumin ja ranitidiinin samanaikainen anto ei vaikuttanut tiotropiumin farmakokinetiikkaan.
Keuhkoahtaumatautipotilaiden yhteisten samanaikaisten lääkkeiden (pitkävaikutteisten beeta2-adrenergisten agonistien (LABA), inhaloitavien kortikosteroidien (ICS)) ei havaittu muuttavan tiotropiumaltistusta.
Kliiniset tutkimukset
SPIRIVA 9mcg HANDIHALER (tiotropiumbromidi-inhalaatiojauhe) kliininen kehitysohjelma koostui kuudesta vaiheen 3 tutkimuksesta 2663 keuhkoahtaumatautipotilaalla (1308 sai SPIRIVA 9mcg HANDIHALER): kaksi yhden vuoden lumekontrolloitua tutkimusta, kaksi 6 kuukauden lumelääkekontrolloitua tutkimusta. tutkimukset ja kaksi yhden vuoden ipratropiumkontrolloitua tutkimusta. Näihin tutkimuksiin otettiin potilaita, joilla oli kliininen keuhkoahtaumatautidiagnoosi, jotka olivat vähintään 40-vuotiaita, tupakoineet yli 10 pakkausvuotta ja joiden pakotettu uloshengitystilavuus sekunnissa (FEV1) oli alle tai yhtä suuri kuin 60 %. tai 65 % ennustetusta, ja FEV1/FVC-suhde on pienempi tai yhtä suuri kuin 0,7.
Näissä tutkimuksissa SPIRIVA HANDIHALER, joka annettiin kerran päivässä aamulla, paransi keuhkojen toimintaa (FEV1), ja huippuvaikutus saavutettiin 3 tunnin kuluessa ensimmäisestä annoksesta.
Kahdessa lisätutkimuksessa arvioitiin pahenemisvaiheita: 6 kuukauden, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskuskliininen tutkimus 1829 keuhkoahtaumatautipotilaalla US Veterans Affairs -ympäristössä ja 4 vuotta kestänyt, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskus, kliininen tutkimus 5992 COPD-potilaalla. Pitkäaikaiset vaikutukset keuhkojen toimintaan ja muihin tuloksiin arvioitiin myös 4 vuotta kestäneessä monikeskustutkimuksessa.
Kuuden kuukauden - 1 vuoden vaikutukset keuhkojen toimintaan
Vuoden kestäneissä lumekontrolloiduissa tutkimuksissa FEV1:n keskimääräinen parannus 30 minuutin kohdalla oli 0,13 litraa (13 %) ja huippuparannukset 0,24 litraa (24 %) verrattuna lähtötilanteeseen ensimmäisen annoksen jälkeen (päivä 1). FEV1:n ja pakotetun vitaalikapasiteetin (FVC) parannuksia havaittiin, kun farmakodynaaminen vakaa tila saavutettiin 8. päivään mennessä kerran vuorokaudessa annetulla hoidolla. Keskimääräinen huippuparannukset FEV1:ssä verrattuna lähtötilanteeseen oli 0,28–0,31 litraa (28–31 %) viikon (8. päivä) kerran päivässä annetun hoidon jälkeen. Keuhkojen toiminnan paraneminen säilyi 24 tunnin ajan kerta-annoksen jälkeen ja jatkui johdonmukaisesti yhden vuoden hoitojakson ajan ilman näyttöä sietokyvystä.
Kahdessa 6 kuukauden lumekontrolloidussa tutkimuksessa sarja spirometrisiä arviointeja suoritettiin koko päivän ajan kokeessa A (12 tuntia) ja rajoitettiin 3 tuntiin kokeessa B. FEV1-sarjaarvot 12 tunnin ajalta (koe A) näytetään Kuva 1. Nämä kokeet tukevat edelleen keuhkojen toiminnan (FEV1) paranemista SPIRIVA 9 mcg HANDIHALER -valmisteella, mikä jatkui spirometrisen havainnointijakson ajan. Teho säilyi 24 tunnin ajan antamisen jälkeen 6 kuukauden hoitojakson aikana.
Kuva 1: Keskimääräinen FEV1 ajan kuluessa (ennen tutkimuslääkkeen antamista ja sen jälkeen) päivinä 1 ja 169 kokeessa A (kuuden kuukauden lumekontrolloitu tutkimus)* 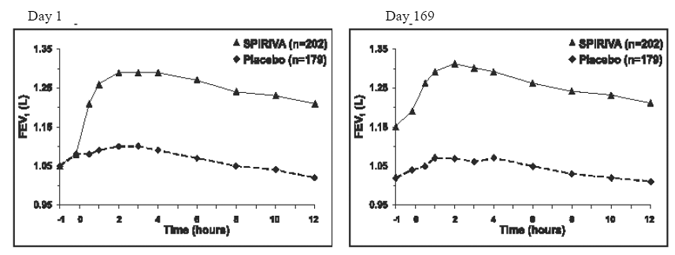
*Keinot mukautettu keskustaan, hoitoon ja lähtötilanteeseen. Päivänä 169 yhteensä 183 potilasta SPIRIVA HANDIHALER ja 149 potilasta lumeryhmässä suoritti tutkimuksen päätökseen. Muiden potilaiden tiedot laskettiin käyttämällä viimeistä havaintoa tai epäedullisimpia havaintoja.
Jokaisen vuoden kestäneen ipratropiumkontrolloidun tutkimuksen tulokset olivat samankaltaisia kuin yhden vuoden lumekontrolloitujen tutkimusten tulokset. Yhden näistä kokeista saadut tulokset on esitetty kuvassa 2.
Kuva 2: Keskimääräinen FEV1 ajan kuluessa (0-6 tuntia annoksen jälkeen) päivinä 1 ja 92, vastaavasti toisessa kahdesta ipratropiumkontrolloidusta tutkimuksesta* 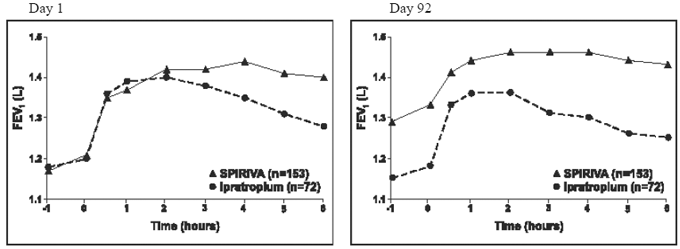
*Keinot mukautettu keskustaan, hoitoon ja lähtötilanteeseen. Päivänä 92 (ensisijainen päätetapahtuma) kaikkiaan 151 potilasta SPIRIVA HANDIHALER ja 69 potilasta ipratropiumryhmässä suoriutui kolmen kuukauden havainnoinnin aikana. Muiden potilaiden tiedot laskettiin käyttämällä viimeistä havaintoa tai epäedullisimpia havaintoja.
Satunnaistettu, lumekontrolloitu kliininen tutkimus 105 keuhkoahtaumatautipotilaalla osoitti, että keuhkoputkien laajeneminen säilyi koko 24 tunnin annosvälin ajan lumelääkkeeseen verrattuna riippumatta siitä, annettiinko SPIRIVA 9 mcg HANDIHALER aamulla vai illalla.
Kahden lumekontrolloidun tutkimuksen yhden vuoden hoitojakson jokaisen viikon aikana SPIRIVA 9 mikrogrammaa HANDIHALERia saaneiden potilaiden tarve käyttää lyhytvaikutteisia beeta2-agonisteja oli vähentynyt. Toisessa kahdesta 6 kuukauden tutkimuksesta osoitettiin, että lyhytvaikutteisten beeta2-agonistien käyttö väheni lumelääkkeeseen verrattuna.
4 vuoden vaikutukset keuhkojen toimintaan
Neljä vuotta kestänyt, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskuskliininen tutkimus, johon osallistui 5992 keuhkoahtaumatautipotilasta, suoritettiin arvioimaan SPIRIVA HANDIHALERin pitkän aikavälin vaikutuksia taudin etenemiseen (FEV1:n laskunopeus). Potilaat saivat käyttää kaikkia hengityslääkkeitä (mukaan lukien lyhyt- ja pitkävaikutteiset beeta-agonistit, inhaloitavat ja systeemiset steroidit ja teofylliinit) muita kuin inhaloitavia antikolinergisia lääkkeitä. Potilaat olivat iältään 40–88-vuotiaita, 75 % miehiä ja 90 % valkoihoisia, ja heillä oli keuhkoahtaumatautidiagnoosi ja keskimääräinen keuhkoputkia laajentava FEV1 oli 39 % (vaihteluväli = 9 % - 76 %) tutkimukseen tullessa. Ryhmien välillä ei ollut eroa kummassakaan ensisijaisessa tehokkuuden päätepisteessä, vuosittaisessa heikkenemisnopeudessa ennen ja jälkeen keuhkoputkia laajentavassa FEV1:ssä, mikä osoitti samankaltaiset FEV1:n laskun kulmat ajan myötä (kuva 3).
SPIRIVA HANDIHALER säilytti parannuksia alimmassa (ennen annosta) FEV1:ssä (mukautettu keskiarvo ajan kuluessa: 87-103 ml) koko tutkimuksen neljän vuoden ajan (kuva 3).
Kuva 3: Alimmat (ennen annosta) FEV1-keskiarvot kullakin aikapisteellä 
Toistettua mittaa ANOVAa käytettiin keskiarvojen arvioimiseen. Keskiarvot on säädetty perusmittauksia varten. Lähtötason alin FEV1 (havaittu keskiarvo) = 1,12. Potilaat, joilla oli ≥3 hyväksyttävää keuhkojen toimintakoetta 30. päivän jälkeen ja joiden lähtötaso ei puuttunut, otettiin mukaan analyysiin.
Pahenemisvaiheet
SPIRIVA 9mcg HANDIHALERin vaikutusta keuhkoahtaumatautien pahenemiseen arvioitiin kahdessa kliinisessä tutkimuksessa: yllä kuvatussa 4 vuotta kestäneessä kliinisessä tutkimuksessa ja 6 kuukauden kliinisessä tutkimuksessa, johon osallistui 1829 COPD-potilasta Veterans Affairs -ympäristössä. Kuusi kuukautta kestäneessä tutkimuksessa keuhkoahtaumatautien pahenemisvaiheet määriteltiin hengitystieoireiden kokonaisuudeksi (lisääntyminen tai uusiutuminen), jossa oli useampi kuin yksi seuraavista: yskä, yskös, hengityksen vinkuminen, hengenahdistus tai puristava tunne rinnassa, joka kestää vähintään 3 päivää. jotka vaativat hoitoa antibiooteilla, systeemisillä steroideilla tai sairaalahoitoa. Väestön ikä vaihteli välillä 40-90 vuotta, 99 % miehiä, 91 % valkoihoisia, ja keuhkoahtaumatautia, jonka keskimääräinen prebronchodilator FEV1-prosentti oli ennustettu 36 % (vaihteluväli = 8 % - 93 %). Potilaat saivat käyttää hengityslääkkeitä (mukaan lukien lyhyt- ja pitkävaikutteiset beeta-agonistit, inhaloitavat ja systeemiset steroidit sekä teofylliinit) kuin inhaloitavia antikolinergisia lääkkeitä. Kuusi kuukautta kestäneessä tutkimuksessa ensisijaiset päätetapahtumat olivat COPD:n pahenemista sairastavien potilaiden osuus ja keuhkoahtaumatautien pahenemisen vuoksi sairaalahoidossa olevien potilaiden osuus. SPIRIVA 9 mcg HANDIHALER vähensi merkitsevästi pahenevien keuhkoahtaumatautipotilaiden osuutta lumelääkettä saaneisiin verrattuna (27,9 % vs. 32,3 %; Odds Ratio (OR) (tiotropium/plasebo) = 0,81; 95 % CI = 0,66, 0,090; 3 p7 = 0,090; ). Keuhkoahtaumatautien pahenemisen vuoksi sairaalahoitoon joutuneiden potilaiden osuus SPIRIVA 9 mcg HANDIHALERia käyttäneistä potilaista lumelääkkeeseen verrattuna oli 7,0 % vs. 9,5 %; TAI = 0,72; 95 % CI = 0,51, 1,01; p = 0,056.
Pahenemisvaiheet arvioitiin toissijaisena tuloksena 4 vuotta kestäneessä monikeskustutkimuksessa. Tässä tutkimuksessa keuhkoahtaumatautien pahenemisvaiheet määriteltiin useamman kuin yhden seuraavista hengitystieoireista (yskä, yskös, ysköksen märkivä, hengityksen vinkuminen, hengenahdistus) lisääntymisenä tai uudeksi ilmaantumiseksi, jotka kestivät vähintään kolme päivää ja vaativat antibiootti- ja/tai hoitoa. systeemiset (oraaliset, lihaksensisäiset tai suonensisäiset) steroidit. SPIRIVA HANDIHALER vähensi merkittävästi pahenemisriskiä 14 % (riskisuhde (HR) = 0,86; 95 % CI = 0,81, 0,91; p
Kaikkisyykuolleisuus
Edellä kuvatussa 4-vuotisessa lumekontrolloidussa keuhkojen toimintatutkimuksessa kaikista syistä johtuva kuolleisuus arvioitiin lumelääkkeeseen verrattuna. Spiriva 9mcg HANDIHALERin ja lumelääkkeen välillä ei ollut merkittäviä eroja kaikista syistä johtuvassa kuolleisuusluvussa.
SPIRIVA HANDIHALERin kaikista syistä johtuvaa kuolleisuutta verrattiin myös 5 mikrog:n tiotropiuminhalaatiosuihkeeseen (SPIRIVA RESPIMAT 5 mikrog) ylimääräisessä pitkäaikaisessa, satunnaistetussa, kaksoissokkoutetussa, aktiivikontrolloidussa kaksoisnukketutkimuksessa, jonka tarkkailujakso oli enintään 3 vuotta. Kaikesta syystä kuolleisuus oli samanlainen SPIRIVA 9mcg HANDIHALERin ja SPIRIVA RESPIMATin välillä.
POTILASTIEDOT
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (tiotropiumbromidi) Inhalaatiojauhe, oraaliseen inhalaatiokäyttöön
ÄLÄ niele SPIRIVA-kapseleita.
Tärkeää tietoa: Älä niele SPIRIVA-kapseleita. SPIRIVA 9mcg -kapseleita tulee käyttää vain HANDIHALER-laitteen kanssa ja hengittää suun kautta (suun kautta).
Lue SPIRIVA HANDIHALERin mukana tulevat tiedot ennen kuin aloitat sen käytön ja aina, kun täytät reseptiäsi. Saattaa tulla uutta tietoa. Tämä pakkausseloste ei korvaa sitä, että keskustelet lääkärisi kanssa sairaudesta tai hoidostasi.
Mikä on SPIRIVA HANDIHALER?
- SPIRIVA HANDIHALER on reseptilääke, jota käytetään päivittäin (ylläpitolääke) kroonisen obstruktiivisen keuhkosairauden (COPD) oireiden hallintaan, mukaan lukien krooninen keuhkoputkentulehdus ja emfyseema.
- SPIRIVA HANDIHALER auttaa saamaan keuhkojesi toimimaan paremmin 24 tunnin ajan. SPIRIVA 9mcg HANDIHALER rentouttaa hengitysteitäsi ja auttaa pitämään ne auki. Saatat alkaa tuntea, että on helpompi hengittää ensimmäisenä päivänä, mutta saattaa kestää kauemmin, ennen kuin tunnet lääkkeen täyden vaikutuksen. SPIRIVA HANDIHALER toimii parhaiten ja saattaa helpottaa hengittämistä, kun käytät sitä joka päivä.
- SPIRIVA 9mcg HANDIHALER vähentää keuhkoahtaumatautien (COPD) oireiden pahenemisen ja pahenemisen todennäköisyyttä. COPD:n paheneminen määritellään useamman kuin yhden keuhkoahtaumatautioireen, kuten yskän, liman, hengenahdistuksen ja hengityksen, lisääntymisenä tai uudeksi ilmaantumiseksi, joka vaatii lääkitystäsi muuta kuin pelastuslääkettäsi.
SPIRIVA 9mcg HANDIHALER ei ole pelastuslääke, eikä sitä tule käyttää äkillisten hengitysvaikeuksien hoitoon. Lääkärisi voi antaa sinulle muita lääkkeitä käytettäväksi äkillisiin hengitysvaikeuksiin.
Ei tiedetä, onko SPIRIVA 9mcg HANDIHALER turvallinen ja tehokas lapsille.
Kuka ei saa ottaa SPIRIVA 9mcg HANDIHALERia?
Älä käytä SPIRIVA 9mcg HANDIHALERia, jos:
- olet allerginen tiotropiumille, ipratropiumille (Atrovent®) tai jollekin SPIRIVA 9mcg HANDIHALERin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo SPIRIVA 9mcg HANDIHALERin ainesosista.
Spiriva 9mcg HANDIHALERin vakavan allergisen reaktion oireita voivat olla:
- kohonneet punaiset läiskit ihollasi (nokkosihottuma)
- kutina
- ihottuma
- kasvojen, huulten, kielen ja kurkun turvotus, joka voi aiheuttaa hengitys- tai nielemisvaikeuksia
Jos sinulla on näitä allergisen reaktion oireita, lopeta SPIRIVA HANDIHALERin käyttö ja soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
Mitä minun tulee kertoa lääkärilleni ennen SPIRIVA HANDIHALERin käyttöä?
Ennen kuin otat SPIRIVA HANDIHALERin, kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- on munuaisongelmia.
- on glaukooma. SPIRIVA HANDIHALER voi pahentaa glaukoomaasi.
- sinulla on suurentunut eturauhanen, virtsaamisvaikeudet tai virtsarakon tukos. SPIRIVA 9mcg HANDIHALER voi pahentaa näitä ongelmia.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, voiko SPIRIVA HANDIHALER vahingoittaa sikiötäsi.
- imetät tai aiot imettää. Ei tiedetä, erittyykö SPIRIVA HANDIHALER äidinmaitoon. Sinä ja lääkärisi päätät, sopiiko SPIRIVA 9mcg HANDIHALER sinulle, kun imetät.
- sinulla on vakava allergia maidon proteiineille. Kysy lääkäriltäsi, jos et ole varma.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet ja silmätipat, vitamiinit ja yrttilisät. Jotkut muut lääkkeesi tai lisäravinteet voivat vaikuttaa SPIRIVA HANDIHALERin tehoon. SPIRIVA 9mcg HANDIHALER on antikolinerginen lääke. Älä käytä muita antikolinergisiä lääkkeitä, kun käytät SPIRIVA 9mcg HANDIHALERia, mukaan lukien ipratropiumia. Kysy lääkäriltäsi tai apteekista, jos et ole varma, onko jokin lääkkeistäsi antikolinerginen.
Tunne käyttämäsi lääkkeet. Pidä mukanasi luettelo lääkkeistäsi näyttääksesi lääkärillesi ja apteekkiin, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa SPIRIVA 9mcg HANDIHALER?
- Käytä SPIRIVA 9mcg HANDIHALER täsmälleen ohjeiden mukaisesti. Käytä SPIRIVA HANDIHALER kerran päivässä.
- Lue "Käyttöohjeet" tämän pakkausselosteen lopusta ennen kuin käytät SPIRIVA HANDIHALERia. Keskustele lääkärisi kanssa, jos et ymmärrä ohjeita.
- Älä niele SPIRIVA 9 mikrogramman kapseleita.
- Käytä vain SPIRIVA 9mcg kapseleita HANDIHALER-laitteen kanssa.
- Älä käytä HANDIHALER-laitetta muiden lääkkeiden ottamiseen.
- SPIRIVA 9mcg HANDIHALER toimitetaan jauheena SPIRIVA 9mcg kapselissa, joka sopii HANDIHALER-laitteeseen. Jokainen SPIRIVA-kapseli, joka sisältää vain pienen määrän SPIRIVA-jauhetta, on yksi täysi annos lääkettä.
- Irrota yksi läpipainopakkaus pakkauksesta. Ota sitten yksi SPIRIVA 9mcg kapseleista läpipainopakkauksesta juuri ennen kuin käytät sitä.
- Kun kapseli on lävistetty, ota koko annos SPIRIVA HANDIHALER -valmistetta hengittämällä jauhetta sisään suun kautta kaksi kertaa HANDIHALER-laitteella (ota 2 inhalaatiota yhdestä SPIRIVA-kapselista). Katso "Käyttöohjeet" tämän esitteen lopussa.
- Heitä pois kaikki käyttämättömät SPIRIVA-kapselit heti, kun se on otettu läpipainopakkauksesta. Älä jätä SPIRIVA-kapseleita auki ilmaan. ne eivät välttämättä toimi yhtä hyvin.
- Jos unohdat ottaa annoksen, ota se heti kun muistat. Älä käytä SPIRIVA HANDIHALERia useammin kuin kerran 24 tunnin välein. ? Jos käytät määräämääsi enemmän SPIRIVA HANDIHALERia, ota yhteys lääkäriin tai myrkytystietokeskukseen.
Mitä minun tulisi välttää SPIRIVA 9mcg HANDIHALERin käytön aikana?
- Älä anna SPIRIVA-kapselin jauheen joutua silmiisi. Näkösi voi hämärtyä ja silmäsi pupilli voi suurentua (laajentua). Jos näin tapahtuu, soita lääkärillesi.
- SPIRIVA 9mcg HANDIHALER voi aiheuttaa huimausta ja näön hämärtymistä. Jos koet näitä oireita, sinun tulee olla varovainen ajaessasi autoa tai käyttäessäsi koneita tai muita koneita.
Mitkä ovat SPIRIVA HANDIHALERin mahdolliset sivuvaikutukset?
SPIRIVA 9mcg HANDIHALER voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien: Allerginen reaktio. Oireita voivat olla:
- kohonneet punaiset läiskit ihollasi (nokkosihottuma)
- kutina
- ihottuma
- huulten, kielen tai kurkun turvotus, joka voi aiheuttaa hengitys- tai nielemisvaikeuksia
Jos sinulla on näitä allergisen reaktion oireita, lopeta SPIRIVA HANDIHALERin käyttö ja soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
- Keuhkoihin menevien hengitysteiden äkillinen kapeneminen ja tukkeutuminen (bronkospasmi) . Hengityksenne pahenee yhtäkkiä.
Jos sinulla on näitä bronkospasmin oireita, lopeta SPIRIVA 9mcg HANDIHALERin käyttö ja soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
- Uusi tai pahentunut kohonnut silmänpaine (akuutti ahdaskulmaglaukooma). Akuutin ahdaskulmaglaukooman oireita voivat olla:
- silmän kipu
- näön hämärtyminen
- halojen (visuaalisten halojen) tai värillisten kuvien näkeminen punaisten silmien kanssa
Pelkkä silmätippojen käyttö näiden oireiden hoitoon ei välttämättä toimi. Jos sinulla on näitä oireita, lopeta SPIRIVA HANDIHALERin käyttö ja ota heti yhteys lääkäriin.
- Uusi tai pahentunut virtsanpidätys. Virtsarakon tukkeutumisen ja/tai laajentuneen eturauhasen oireita voivat olla: virtsaamisvaikeudet, kivulias virtsaaminen.
Jos sinulla on näitä virtsanpidätysoireita, lopeta SPIRIVA HANDIHALERin käyttö ja ota heti yhteys lääkäriin.
Muita SPIRIVA 9mcg HANDIHALERin sivuvaikutuksia ovat:
- ylähengitysteiden infektio
- kuiva suu
- poskiontelon tulehdus
- kipeä kurkku
- epäspesifinen rintakipu
- virtsatieinfektio
- ruoansulatushäiriöt
- vuotava nenä
- ummetus
- lisääntynyt syke
- näön hämärtyminen
Nämä eivät ole kaikkia SPIRIVA HANDIHALERin mahdollisia sivuvaikutuksia. Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka säilytän SPIRIVA HANDIHALERin?
- Älä säilytä SPIRIVA-kapseleita HANDIHALER-laitteessa.
- Säilytä SPIRIVA-kapselit suljetussa läpipainopakkauksessa huoneenlämmössä 68 °F - 77 °F (20 °C - 25 °C).
- Pidä SPIRIVA-kapselit poissa lämmöltä ja kylmältä (älä jäädytä).
- Säilytä SPIRIVA 9mcg kapselit kuivassa paikassa. Heitä pois kaikki käyttämättömät SPIRIVA 9mcg -kapselit, jotka ovat olleet ilmaan.
Kysy lääkäriltäsi tai apteekista, jos sinulla on kysyttävää SPIRIVA 9mcg -kapseleiden säilyttämisestä.
Pidä SPIRIVA HANDIHALER, SPIRIVA 9mcg kapselit ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa SPIRIVA HANDIHALERista
Lääkkeitä määrätään joskus muihin kuin potilasohjeissa lueteltuihin tarkoituksiin. Älä käytä SPIRIVA 9mcg HANDIHALERia tarkoitukseen, johon sitä ei ole määrätty. Älä anna SPIRIVA HANDIHALERia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Lisätietoja SPIRIVA HANDIHALERista saat lääkäriltäsi. Voit kysyä lääkäriltäsi tai apteekista tietoja SPIRIVA 9mcg HANDIHALER -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja SPIRIVA 9mcg HANDIHALERista saat osoitteesta www.SPIRIVA.com tai skannaa alla oleva koodi tai soita Boehringer Ingelheim Pharmaceuticals, Inc:lle numeroon 1-800-542-6257 tai (TTY) 1-800-459-9906.
Mitä ainesosia SPIRIVA 9mcg HANDIHALER sisältää?
Aktiivinen ainesosa: tiotropiumia
Ei-aktiivinen ainesosa: laktoosimonohydraatti
Mikä on COPD (krooninen obstruktiivinen keuhkosairaus)?
COPD on vakava keuhkosairaus, joka sisältää kroonisen keuhkoputkentulehduksen, emfyseeman tai molemmat. Suurin osa COPD:stä johtuu tupakoinnista. Kun sinulla on COPD, hengitystiesi kapenevat. Joten ilma liikkuu ulos keuhkoistasi hitaammin. Tämä vaikeuttaa hengittämistä.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
KÄYTTÖOHJEETSPIRIVA® (speh REE vah) HANDIHALER® (tiotropiumbromidi) inhalaatiojauhe, oraaliseen inhalaatiokäyttöön
Älä niele SPIRIVA-kapseleita.
Tärkeää tietoa SPIRIVA HANDIHALERin käytöstä
- Älä niele SPIRIVA 9 mikrogramman kapseleita.
- SPIRIVA-kapseleita tulee käyttää vain HANDIHALER-laitteen kanssa ja hengittää suun kautta (suun kautta).
- Älä käytä HANDIHALER-laitettasi minkään muun lääkkeen ottamiseen.
Lue ensin potilastiedot ja sitten nämä käyttöohjeet ennen kuin aloitat SPIRIVA HANDIHALERin käytön ja aina, kun täytät reseptiäsi. Saattaa tulla uutta tietoa.
HANDIHALER-laitteeseesi ja SPIRIVA-kapseleihin tutustuminen:
SPIRIVA HANDIHALER -laitteen mukana toimitetaan SPIRIVA 9mcg -kapselit läpipainopakkauksissa ja HANDIHALER-laite. Käytä lääkkeesi mukana toimitettua uutta HANDIHALER-laitetta.
HANDIHALER-laitteesi osia ovat:
(Katso kuva A)
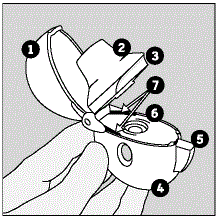
Kuva A
Jokainen SPIRIVA 9mcg kapseli on pakattu läpipainopakkaukseen. (Katso kuva B)
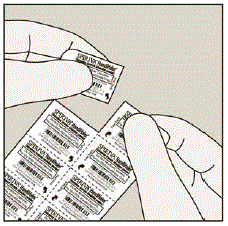
Kuva B
- Jokainen SPIRIVA-kapseli sisältää vain pienen määrän jauhetta. (Katso kuva C) Tämä on 1 täysi annos.
- Älä avaa SPIRIVA 9 mikrogramman kapselia tai se ei ehkä toimi.

Kuva C
Täyden päivittäisen lääkeannoksesi ottaminen vaatii 4 päävaihetta.
Vaihe 1. HANDIHALER-laitteen avaaminen:
Kun olet poistanut HANDIHALER-laitteesi pussista:
- Avaa pölysuojus (kansi) painamalla vihreää lävistyspainiketta. (Katso kuva D)
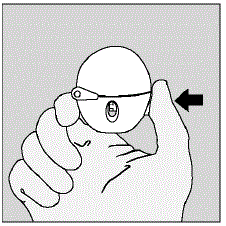
Kuva D
- Vedä pölysuojusta (kansi) ylöspäin irti alustasta paljastaaksesi suukappaleen. (Katso kuva E)
Kuva E
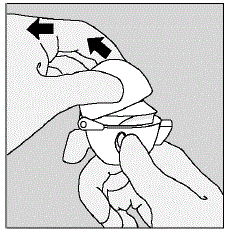
- Avaa suukappale vetämällä suukappaleen harjaa ylös ja poispäin pohjasta niin, että keskikammio tulee näkyviin. (Katso kuva F)

Kuva F
Vaihe 2. SPIRIVA 9mcg -kapselin asettaminen HANDIHALER-laitteeseen:
Erota joka päivä vain yksi rakkula läpipainopakkauskortista revimällä rei'itettyä viivaa pitkin. (Katso kuva G)
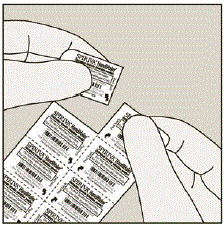
Kuva G
Poista SPIRIVA-kapseli läpipainopakkauksesta:
- Älä leikkaa folio tai käytä teräviä välineitä SPIRIVA-kapselin poistamiseksi läpipainopakkauksesta.
- Taivuta 1 läpipainopakkauksen kulmat nuolella ja erota alumiinifoliokerrokset.
- Irrota painettu folio, kunnes näet koko SPIRIVA-kapselin. (Katso kuva H)
- Jos olet avannut useamman kuin yhden läpipainopakkauksen ilmaan, ylimääräistä SPIRIVA 9 mikrogramman kapselia ei tule käyttää, vaan se on hävitettävä.
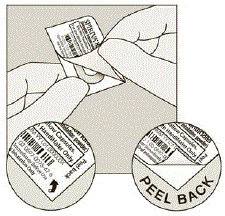
Kuva H
Aseta SPIRIVA 9mcg kapseli HANDIHALER-laitteesi keskikammioon. (Katso kuva I)
Kuva I
Sulje suukappale tiukasti harmaata pohjaa vasten, kunnes kuulet napsahduksen. Jätä pölysuojus (kansi) auki. (Katso kuva J)
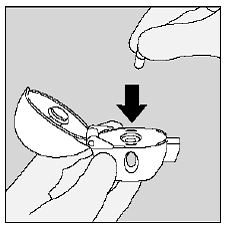
Kuva J
Vaihe 3. SPIRIVA 9mcg -kapselin lävistys:
- Pidä HANDIHALER-laitetta suukappale ylöspäin. (Katso kuva K)
- Paina vihreää lävistyspainiketta kerran, kunnes se on tasaisesti (tasapainossa) alustaa vasten, ja vapauta sitten. Näin teet reikiä SPIRIVA-kapseliin, jotta saat lääkkeesi sisään hengittäessäsi.
- Älä paina vihreää painiketta useammin kuin kerran.
- Älä ravista HANDIHALER-laitettasi.
- SPIRIVA 9mcg kapselin lävistys voi tuottaa pieniä gelatiinin paloja. Jotkut näistä pienistä paloista voivat kulkeutua HANDIHALER-laitteesi näytön läpi suuhusi tai kurkkuun, kun hengität lääkettäsi. Tämä on normaalia. Pienet gelatiinipalat eivät saa vahingoittaa sinua.
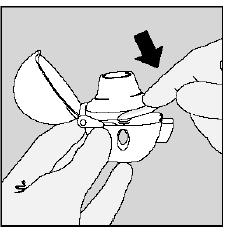
Kuva K
Vaihe 4. Koko päiväannoksesi ottaminen (2 inhalaatiota samasta SPIRIVA 9mcg -kapselista):
Hengitä kokonaan ulos yhdellä hengityksellä, tyhjentää keuhkot kaikesta ilmasta. (Katso kuva L)
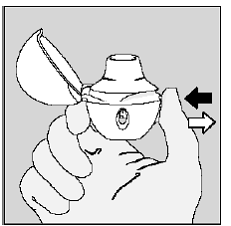
Kuva L
Tärkeää: Älä hengitä HANDIHALER-laitteeseen.
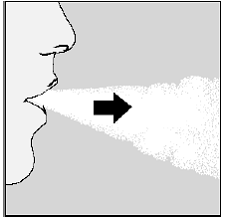
Ota lääkkeesi seuraavalla hengitykselläsi:
- Pidä päätäsi pystyasennossa, kun katsot suoraan eteenpäin. (Katso kuva M)
- Nosta HANDIHALER-laite suullesi vaaka-asennossa. Älä tukkia ilmanottoaukot.
- Sulje huulet tiukasti suukappaleen ympärille.
- Hengitä syvään sisään kunnes keuhkot ovat täynnä. Sinun pitäisi kuulet tai tunnet SPIRIVA-kapselin värisevän (helistin). (Katso kuva M)
- Pidätä hengitystäsi muutaman sekunnin ajan ja ota samalla HANDIHALER-laite suustasi.
- Hengitä taas normaalisti.
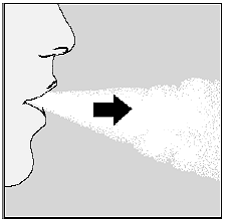
Kuva M
Helinä kertoo, että hengität oikein. Jos et kuule tai tunne helistystä, katso kohta "Jos et kuule tai tunne SPIRIVA-kapselin kolinaa hengittäessäsi lääkettäsi".
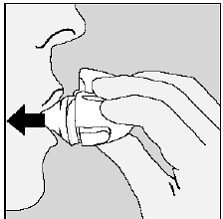
Kuva N
Saadaksesi täyden päiväannoksesi, sinun on hengitettävä uudelleen kokonaan ulos (katso kuva N) ja toisen kerran sisään (katso kuva O) samasta SPIRIVA-kapselista.
Tärkeää: Älä paina vihreää lävistyspainiketta uudelleen.
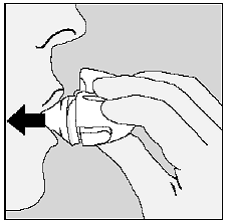
Kuva O
Muistaa: Saadaksesi täyden lääkeannoksesi joka päivä, sinun on hengitettävä sisään 2 kertaa samasta SPIRIVA 9mcg -kapselista. Varmista, että hengität kokonaan ulos joka kerta ennen kuin hengität sisään HANDIHALER-laitteesta.
SPIRIVA HANDIHALERin hoito ja säilytys:
Kuva P
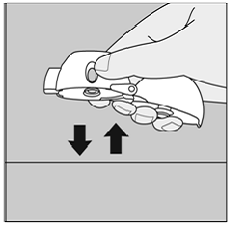
- Kun olet ottanut päiväannoksesi, avaa suukappale ja kaada käytetty SPIRIVA 9mcg -kapseli roskakoriin koskematta siihen.
- Poista kaikki SPIRIVA 9mcg kapselin palaset tai SPIRIVA 9mcg jauhekertymät kääntämällä HANDIHALER-laite ylösalaisin ja kevyesti, mutta lujasti, napauttamalla sitä. (Katso kuva P) Sulje sitten suukappale ja pölysuojus säilytystä varten.
- Älä Säilytä HANDIHALER-laitettasi ja SPIRIVA 9mcg -kapseleita (läpipainopakkauksia) kosteassa, kosteassa paikassa. Säilytä SPIRIVA-kapselit aina suljetuissa läpipainopakkauksissa.
Jos et kuule tai tunne SPIRIVA 9mcg kapselin helistystä hengittäessäsi lääkettäsi:
Kuva Q
Älä paina vihreää lävistyspainiketta uudelleen.
Pidä HANDIHALER-laitetta suukappale ylöspäin ja napauta HANDIHALER-laitetta kevyesti pöytää vasten. (Katso kuva Q)
Tarkista, että suukappale on täysin kiinni. Hengitä kokonaan ulos ennen kuin hengität uudelleen syvään suukappale suussasi. (Katso kuva O)
Jos et edelleenkään kuule tai tunne SPIRIVA-kapselin kolinaa yllä olevien vaiheiden toistamisen jälkeen:
- Heitä SPIRIVA-kapseli pois.
- Avaa pohja nostamalla vihreää lävistyspainiketta ja tarkista, onko keskikammiossa SPIRIVA 9mcg -kapselin palasia. SPIRIVA 9mcg kapselipalat keskikammiossa voivat estää SPIRIVA 9mcg kapselin helisemisen.
- Käännä HANDIHALER-laitteesi ylösalaisin ja napauta kevyesti, mutta lujasti poistaaksesi SPIRIVA-kapselin palaset. Soita lääkärillesi ohjeiden saamiseksi.
HANDIHALER-laitteen puhdistaminen:
Puhdista HANDIHALER-laitteesi tarvittaessa. (Katso kuva R)
- HANDIHALER-laitteesi ilmakuivaus kestää 24 tuntia puhdistuksen jälkeen.
- Älä käytä puhdistusaineita tai pesuaineita.
- Älä laita HANDIHALER-laitteesi astianpesukoneeseen puhdistusta varten.
Puhdistusvaiheet:
- Avaa pölysuojus ja suukappale.
- Avaa pohja nostamalla vihreää lävistyspainiketta.
- Etsi keskikammiosta SPIRIVA 9 mcg:n kapselin palasia tai jauhekertymiä. Jos näet, napauta ulos.
- Huuhtele HANDIHALER-laitteesi lämpimällä vedellä painamalla vihreää lävistyspainiketta muutaman kerran, jotta keskikammio ja lävistysneula ovat juoksevan veden alla. Tarkista, että jauheen kertymä tai SPIRIVA-kapselin palaset on poistettu.
- Kuivaa HANDIHALER-laitteesi hyvin kaatamalla ylimääräinen vesi talouspaperin päälle. Kuivaa sen jälkeen ilmassa, jätä pölysuojus, suukappale ja pohja auki levittämällä se kokonaan ulos, jotta se kuivuu kokonaan.
- Älä kuivaa HANDIHALER-laitteesi hiustenkuivaajalla.
- Älä käytä HANDIHALER-laitetta, kun se on märkä. Tarvittaessa voit puhdistaa suukappaleen ulkopinnan puhtaalla kostealla liinalla.
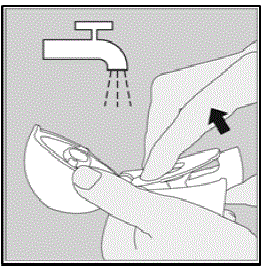
Kuva R
Hyödyllisiä vinkkejä, jotka auttavat varmistamaan, että otat oikean SPIRIVA 9mcg HANDIHALER -päiväannoksesi:
- Lehdistö vihreä lävistyspainike kerran; Hengitä sisään 2 kertaa; Hengitä ulos kokonaan ennen jokaista 2 inhalaatiota.
- Käytä aina lääkkeesi mukana toimitettua uutta HANDIHALER-laitetta.
- Pidä HANDIHALER-laitetta suukappale ylöspäin, kun painat vihreää lävistyspainiketta.
- Paina vihreää lävistyspainiketta 1 kerran lävistääksesi SPIRIVA-kapselin.
- Älä hengitä ulos HANDIHALER-laitteeseen.
- Pidä HANDIHALER-laitettasi vaakasuorassa asennossa ja pidä pää pystyasennossa katsoen suoraan eteenpäin hengittäessäsi.
- Tarkista HANDIHALER-laitteesi keskikammiosta SPIRIVA 9mcg:n kapselin palasten tai jauheen kertymien varalta. Jos näet paloja tai jauhetta, koputa ennen käyttöä.
- Puhdista HANDIHALER tarpeen mukaan ja kuivaa huolellisesti.
Lisätietoja saat lääkäriltäsi tai apteekista tai käy osoitteessa www.spiriva.com, skannaa alla oleva koodi tai soita numeroon 1-800-542-6257 tai (TTY) 1-800-459-9906.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä käyttöohjeet.
