Psykoosin hoito: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Strattera 40mg on ja miten sitä käytetään?
Strattera on reseptilääke, jota käytetään tarkkaavaisuus-/hyperaktiivisuushäiriön (ADHD) oireiden hoitoon. Strattera 18mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Strattera 10mg on selektiivinen norepinefriinin takaisinoton estäjä.
Ei tiedetä, onko Strattera turvallinen ja tehokas alle 2-vuotiaille lapsille.
Mitkä ovat Stratteran mahdolliset sivuvaikutukset?
Strattera 25 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintakipu,
- vaikeuksia hengittää,
- huimaus,
- hallusinaatiot,
- uusia käyttäytymisongelmia,
- aggressio,
- vihamielisyys,
- vainoharhaisuus,
- vatsakipu,
- kutina,
- flunssan kaltaiset oireet,
- tumma virtsa,
- keltaisuus (ihon tai silmien keltaisuus),
- kivulias tai vaikea virtsaaminen ja
- erektio, joka on kivulias tai kestää yli 4 tuntia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Strattera 40mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- oksentelua,
- ärtynyt vatsa,
- ummetus,
- kuiva suu,
- ruokahalun menetys,
- mielialan muutoksia,
- väsynyt olo,
- huimaus,
- virtsaamisongelmat ja
- impotenssi, erektio-ongelmat,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Stratteran mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
LASTEN JA NUURIN ITTUURPA-AJAUKSET
STRATTERA (atomoksetiini) lisäsi itsemurha-ajatusten riskiä lyhytaikaisissa tutkimuksissa lapsilla tai nuorilla, joilla oli tarkkaavaisuus-/hyperaktiivisuushäiriö (ADHD). Jokaisen, joka harkitsee STRATTERA 18 mg:n käyttöä lapselle tai nuorelle, on tasapainotettava tämä riski kliinisen tarpeen kanssa. ADHD:n yhteydessä esiintyviin samanaikaisiin sairauksiin saattaa liittyä itsemurha-ajatusten ja/tai -käyttäytymisen riskin lisääntyminen. Potilaita, joille aloitetaan hoito, tulee seurata tarkasti itsemurha-ajattelun (itsemurha-ajattelun ja -käyttäytymisen), kliinisen pahenemisen tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa, että heitä on tarkkailtava tarkasti ja kommunikoida lääkärin kanssa. STRATTERA 10 mg on hyväksytty ADHD:n hoitoon lapsi- ja aikuispotilailla. STRATTERA 40 mg ei ole hyväksytty vakavaan masennukseen. Lyhytaikaisten (6–18 viikkoa) lumekontrolloitujen STRATTERA 10 mg:n lasten ja nuorten tutkimusten yhdistetyt analyysit (yhteensä 12 tutkimusta, joihin osallistui yli 2200 potilasta, mukaan lukien 11 ADHD-tutkimusta ja 1 enureesikoe) ovat paljastaneet suuremman riskin. itsemurha-ajatuksia varhaisessa vaiheessa STRATTERAa saaneilla verrattuna lumelääkkeeseen. Keskimääräinen itsemurha-ajatusten riski potilailla, jotka saivat STRATTERAa 25 mg, oli 0,4 % (5/1357 potilasta), kun taas lumelääkettä saaneiden potilaiden ei yhtään (851 potilasta). Näissä kokeissa ei tapahtunut itsemurhia [katso VAROITUKSET JA VAROTOIMET ].
KUVAUS
STRATTERA® (atomoksetiini) on selektiivinen norepinefriinin takaisinoton estäjä. Atomoksetiini-HCl on R(-)-isomeeri määritettynä röntgendiffraktiolla. Kemiallinen nimitys on (-)-N-metyyli-3-fenyyli-3-(o-tolyylioksi)propyyliamiinihydrokloridi. Molekyylikaava on C17H21NO•HCl, joka vastaa molekyylipainoa 291,82. Kemiallinen rakenne on:
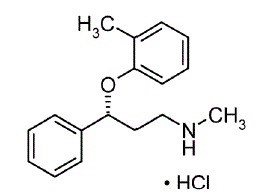
Atomoksetiini HCl on valkoinen tai käytännöllisesti katsoen valkoinen kiinteä aine, jonka liukoisuus veteen on 27,8 mg/ml.
STRATTERA-kapselit on tarkoitettu annettavaksi vain suun kautta.
Jokainen kapseli sisältää atomoksetiinihydrokloridia, joka vastaa 10, 18, 25, 40, 60, 80 tai 100 mg atomoksetiinia. Kapselit sisältävät myös esigelatinoitua tärkkelystä ja dimetikonia. Kapselin kuoret sisältävät gelatiinia, natriumlauryylisulfaattia ja muita inaktiivisia aineosia. Kapselin kuoret sisältävät myös yhden tai useamman seuraavista:
FD&C Blue No. 2, synteettinen keltainen rautaoksidi, titaanidioksidi, punainen rautaoksidi. Kapseleihin on painettu syötävällä mustalla musteella.
INDIKAATIOT
Huomio-/hyperaktiivisuushäiriö (ADHD)
STRATTERA 25 mg on tarkoitettu tarkkaavaisuus-/hyperaktiivisuushäiriön (ADHD) hoitoon.
STRATTERA-kapseleiden teho vahvistettiin seitsemässä kliinisessä tutkimuksessa ADHD-potilailla: neljä 6-9 viikkoa kestäneessä tutkimuksessa lapsipotilailla (6-18-vuotiaat), kahdessa 10 viikon tutkimuksessa aikuisilla ja yhdessä ylläpitotutkimuksessa lapsipotilailla (6-vuotiaat). 15) [katso Kliiniset tutkimukset ].
Diagnostisia huomioita
ADHD (DSM-IV) -diagnoosi viittaa hyperaktiivis-impulsiivisten tai tarkkaavaisten oireiden esiintymiseen, jotka aiheuttavat vajaatoimintaa ja jotka olivat esiintyneet ennen 7 vuoden ikää. Oireiden on oltava pysyviä, vakavampia kuin vastaavalla kehitystasolla olevilla yksilöillä tyypillisesti havaitaan, niiden on aiheutettava kliinisesti merkittävää vajaatoimintaa, esim. sosiaalisissa, akateemisissa tai ammatillisissa toiminnassa, ja niitä on oltava kahdessa tai useammassa ympäristössä, esim. koulussa (tai töissä) ja kotona. Oireita ei saa paremmin selittää toisella mielenterveyshäiriöllä.
ADHD:n spesifistä etiologiaa ei tunneta, eikä ole olemassa yhtä diagnostista testiä. Riittävä diagnoosi edellyttää paitsi lääketieteellisten, myös erityisten psykologisten, koulutuksellisten ja sosiaalisten resurssien käyttöä. Oppiminen voi olla heikentynyt tai ei. Diagnoosi tulee perustua potilaan täydelliseen historiaan ja arviointiin, ei pelkästään vaaditun määrän DSM-IV-ominaisuuksien olemassaoloon.
Tarkkailemattomalla tyypillä vähintään 6 seuraavista oireista on täytynyt jatkua vähintään 6 kuukautta: huomion puute yksityiskohtiin/huolimattomat virheet, jatkuvan huomion puute, huono kuuntelija, tehtävien suorittamatta jättäminen, huono organisointi, tehtävien välttäminen vaatii jatkuvaa henkistä ponnistelua, menettää asioita, helposti hajamielinen, unohteleva. Hyperaktiiv-impulsiivisella tyypillä vähintään 6 seuraavista oireista on täytynyt jatkua vähintään 6 kuukautta: heiluminen/kiipeily, poistuminen istuimesta, sopimaton juoksu/kiipeily, vaikeudet tehdä hiljaisia toimintoja, "liikkeellä", liiallinen puhuminen, röyhkeily vastauksia, ei malta odottaa vuoroa, häiritsevä. Yhdistelmätyypin diagnoosin on täytettävä sekä tarkkaavaisuus että hyperaktiivisuus-impulsiiviset kriteerit.
Tarvitsee kattavan hoitoohjelman
STRATTERA 18mg on tarkoitettu kiinteäksi osaksi ADHD:n kokonaishoito-ohjelmaa, joka voi sisältää muita toimenpiteitä (psykologisia, kasvatuksellisia, sosiaalisia) tätä oireyhtymää sairastaville potilaille. Lääkehoitoa ei välttämättä ole tarkoitettu kaikille potilaille, joilla on tämä oireyhtymä. Lääkehoitoa ei ole tarkoitettu käytettäväksi potilaalle, jolla on ympäristötekijöiden ja/tai muiden primaaristen psykiatristen häiriöiden, mukaan lukien psykoosin, aiheuttamia oireita. Asianmukainen koulutuspaikka on välttämätön lapsille ja nuorille, joilla on tämä diagnoosi, ja psykososiaalinen interventio on usein hyödyllistä. Kun korjaavat toimenpiteet eivät yksinään riitä, päätös lääkehoidon määräämisestä riippuu lääkärin arviosta potilaan oireiden kroonisuudesta ja vaikeudesta.
ANNOSTELU JA HALLINNOINTI
Akuutti hoito
Annostus lapsille ja nuorille, jotka painavat enintään 70 kg
STRATTERA 40 mg tulee aloittaa kokonaisvuorokausiannoksella noin 0,5 mg/kg, ja sitä nostetaan vähintään 3 päivän kuluttua tavoitepäivän kokonaisannokseen, joka on noin 1,2 mg/kg joko yhtenä vuorokausiannoksena aamulla tai jaettuna tasaisesti. annokset aamulla ja myöhään iltapäivällä/aikaisin illalla. Yli 1,2 mg/kg/vrk annoksilla ei ole osoitettu lisähyötyä [katso Kliiniset tutkimukset ].
Lasten ja nuorten vuorokausiannos ei saa ylittää 1,4 mg/kg tai 100 mg sen mukaan, kumpi on pienempi.
Yli 70 kg painavien lasten ja nuorten annostelu ja aikuiset
STRATTERA 18 mg -hoito tulee aloittaa 40 mg:n vuorokausiannoksella ja sitä nostetaan vähintään 3 päivän kuluttua tavoitepäivän kokonaisannokseen, joka on noin 80 mg joko yhtenä vuorokausiannoksena aamulla tai jaettuna tasaisesti aamulla. myöhään iltapäivällä / alkuillalla. 2–4 lisäviikon kuluttua annosta voidaan suurentaa enintään 100 mg:aan potilailla, jotka eivät ole saavuttaneet optimaalista vastetta. Ei ole tietoa, joka tukisi tehokkuuden lisääntymistä suuremmilla annoksilla [katso Kliiniset tutkimukset ].
Suurin suositeltu vuorokausiannos yli 70 kg painaville lapsille ja nuorille sekä aikuisille on 100 mg.
Huolto/pidennetty hoito
Yleisesti ollaan yhtä mieltä siitä, että ADHD:n lääkehoitoa voidaan tarvita pitkiä aikoja. Kontrolloidussa tutkimuksessa osoitettiin, että ADHD-potilaiden (6-15-vuotiaat) ylläpitäminen STRATTERA-annoksella 18 mg saavutettiin vasteen jälkeen annosalueella 1,2-1,8 mg/kg/vrk. Ylläpitovaiheessa STRATTERAan määrätyt potilaat saivat yleensä saman annoksen, jolla saavutettiin vaste avoimessa vaiheessa. Lääkärin, joka päättää käyttää STRATTERAa pitkiä aikoja, tulee säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle [ks. Kliiniset tutkimukset ].
Yleiset annostelutiedot
STRATTERA voidaan ottaa ruoan kanssa tai ilman.
STRATTERA 40mg voidaan lopettaa ilman kapenemista.
STRATTERA-kapseleita ei ole tarkoitettu avattavaksi, ne tulee ottaa kokonaisina [katso POTILASTIEDOT ].
Yli 120 mg:n kerta-annosten ja yli 150 mg:n päivittäisten kokonaisannosten turvallisuutta ei ole arvioitu systemaattisesti.
Annostelu tietyissä populaatioissa
Annoksen säätö maksan vajaatoimintapotilaille
Niille ADHD-potilaille, joilla on maksan vajaatoiminta (HI), annoksen muuttamista suositellaan seuraavasti: Potilaille, joilla on kohtalainen HI (Child-Pugh-luokka B), aloitus- ja tavoiteannokset tulee pienentää 50 %:iin normaaliannoksesta (potilaille, joilla ei ole HEI). Potilaille, joilla on vaikea HI (Child-Pugh-luokka C), aloitusannos ja tavoiteannokset tulee pienentää 25 prosenttiin normaalista [ks. Käyttö tietyissä populaatioissa ].
Annoksen säätö käytettäväksi vahvan CYP2D6-estäjän kanssa tai potilailla, joiden tiedetään olevan CYP2D6 PM:itä
Enintään 70 kg painaville lapsille ja nuorille, joille annetaan vahvoja CYP2D6:n estäjiä, kuten paroksetiinia, fluoksetiinia ja kinidiiniä, tai potilaille, joiden tiedetään olevan CYP2D6 PM:itä, STRATTERA-hoito tulee aloittaa annoksella 0,5 mg/kg/vrk ja nostaa vain tasolle tavallinen tavoiteannos 1,2 mg/kg/vrk, jos oireet eivät parane 4 viikon jälkeen ja aloitusannos on hyvin siedetty.
Yli 70 kg painaville lapsille ja nuorille sekä aikuisille, joille on annettu vahvoja CYP2D6-estäjiä, kuten paroksetiinia, fluoksetiinia ja kinidiiniä, STRATTERA-hoito tulee aloittaa annoksella 40 mg/vrk ja nostaa tavanomaiseen tavoiteannokseen 80 mg/vrk vain, jos oireet eivät häviä. paranemaan 4 viikon kuluttua ja aloitusannos on hyvin siedetty.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Jokainen kapseli sisältää atomoksetiini HCl:a, joka vastaa 10 mg (läpinäkymätön valkoinen, läpinäkymätön valkoinen), 18 mg (kulta, läpinäkymätön valkoinen), 25 mg (läpinäkymätön sininen, läpinäkymätön valkoinen), 40 mg (läpinäkymätön sininen, läpinäkymätön sininen), 60 mg (läpinäkymätön sininen). Sininen, kulta), 80 mg (Opaque Brown, Opaque White) tai 100 mg (Opaque Brown, Opaque Brown) atomoksetiinia.
Varastointi ja käsittely
Säilytä 25°C (77°F); 15° - 30°C (59° - 86°F) sallitut retket [katso USP Controlled Room Temperature].
Markkinoija: Lilly USA, LLC Indianapolis, IN 46285, USA. Tarkistettu: toukokuuta 2017.
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
STRATTERA 10 mg annettiin kliinisissä tutkimuksissa 5 382 lapselle tai nuorelle potilaalle, joilla oli ADHD ja 1 007 aikuiselle, joilla oli ADHD. Kliinisissä ADHD-tutkimuksissa 1625 lasta ja nuorta potilasta hoidettiin yli vuoden ajan ja 2529 lasta ja nuorta potilasta yli 6 kuukauden ajan.
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kliiniset tutkimukset lapsille ja nuorille
Syyt hoidon keskeyttämiseen lasten ja nuorten kliinisissä tutkimuksissa havaittujen haittavaikutusten vuoksi
Akuuteissa lapsilla ja nuorilla tehdyissä lumekontrolloiduissa tutkimuksissa 3,0 % (48/1613) atomoksetiinipotilaista ja 1,4 % (13/945) lumelääkepotilaista keskeytti hoidon haittavaikutusten vuoksi. Kaikissa tutkimuksissa (mukaan lukien avoimet ja pitkäaikaiset tutkimukset) 6,3 % nopean metaboloijan (EM) potilaista ja 11,2 % heikosti metaboloivista (PM) potilaista keskeytti hoidon haittavaikutuksen vuoksi. STRATTERA-hoitoa saaneista potilaista ärtyneisyys (0,3 %, N = 5); uneliaisuus (0,3 %, N = 5); aggressio (0,2 %, N = 4); pahoinvointi (0,2 %, N = 4); oksentelu (0,2 %, N = 4); vatsakipu (0,2 %, N=4); ummetus (0,1 %, N = 2); väsymys (0,1 %, N = 2); epänormaali olo (0,1 %, N=2); ja päänsärky (0,1 %, N = 2) olivat syitä lopettamiseen, joita ilmoitti useampi kuin yksi potilas.
Kohtaukset
STRATTERAa ei ole arvioitu systemaattisesti lapsipotilailla, joilla on kohtaushäiriö, koska nämä potilaat suljettiin pois kliinisistä tutkimuksista tuotteen markkinoille saattamista edeltävän testauksen aikana. Kliinisessä kehitysohjelmassa kohtauksia raportoitiin 0,2 %:lla (12/5073) lapsista, joiden keski-ikä oli 10 vuotta (vaihteluväli 6-16 vuotta). Näissä kliinisissä tutkimuksissa kohtausten riski hitailla metaboloijilla oli 0,3 % (1/293) verrattuna 0,2 %:iin (11/4741) nopeilla metaboloijilla.
Yleisesti havaitut haittavaikutukset akuuteissa lapsilla ja nuorilla, lumekontrolloiduissa kokeissa
Taulukossa 2 on lueteltu STRATTERAn käyttöön liittyvät yleisesti havaitut haittavaikutukset (esiintyvyys 2 % tai suurempi) ja joita ei havaittu vastaavalla ilmaantuvuusasteella lumelääkettä saaneiden potilaiden keskuudessa (STRATTERA 40 mg:n ilmaantuvuus suurempi kuin lumelääkettä saaneiden potilaiden keskuudessa). Tulokset olivat samankaltaisia BID:ssä ja QD-kokeessa, paitsi taulukossa 3 esitetyllä tavalla, joka näyttää sekä BID- että QD-tulokset valituille haittavaikutuksille tilastollisesti merkittävien Breslow-Dayn testien perusteella. Yleisimmin havaitut haittavaikutukset STRATTERA-hoitoa saaneilla potilailla (ilmaantuvuus vähintään 5 % ja vähintään kaksinkertainen esiintyvyys lumelääkepotilailla, joko kahdesti kahdesti tai neljä kertaa päivässä) olivat: pahoinvointi, oksentelu, väsymys, ruokahalun heikkeneminen, vatsakipu ja uneliaisuus (katso taulukot 2 ja 3).
Lisätiedot ADHD-kliinisistä tutkimuksista (kontrolloiduista ja kontrolloimattomista) ovat osoittaneet, että noin 5–10 % lapsipotilaista koki kliinisesti merkittäviä muutoksia sydämen sykkeessä (≥20 lyöntiä minuutissa) tai verenpaineessa (≥15–20 mm Hg) [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Seuraavia haittavaikutuksia esiintyi vähintään 2 %:lla lapsista ja nuorista CYP2D6-PM-potilaista, ja ne olivat tilastollisesti merkitsevästi yleisempiä PM-potilailla kuin CYP2D6-EM-potilailla: unettomuus (11 % PM-potilaista, 6 % EM-potilaista); paino laski (7 % PM:istä, 4 % EM:istä); ummetus (7 % PM:istä, 4 % EM:istä); masennus1 (7 % PM:istä, 4 % EM:istä); vapina (5 % PM:istä, 1 % EM:istä); excoriation (4 % PM:istä, 2 % EM:istä); keskivaikea unettomuus (3 % PM:istä, 1 % EM:istä); sidekalvotulehdus (3 % PM:istä, 1 % EM:istä); pyörtyminen (3 % PM:istä, 1 % EM:istä); aikainen aamuherääminen (2 % PM:istä, 1 % EM:istä); mydriaasi (2 % PM:istä, 1 % EM:istä); sedaatio (4 % PM:istä, 2 % EM:istä).
1 Masennus sisältää seuraavat termit: masennus, vakava masennus, masennusoireet, masentunut mieliala, dysforia.
Aikuisten kliiniset tutkimukset
Syyt hoidon keskeyttämiseen haittavaikutusten vuoksi akuuteissa aikuisten lumekontrolloiduissa tutkimuksissa
Akuuteissa aikuisten lumekontrolloiduissa tutkimuksissa 11,3 % (61/541) atomoksetiinipotilaista ja 3,0 % (12/405) lumelääkepotilaista keskeytti hoidon haittavaikutusten vuoksi. STRATTERA-hoitoa saaneista potilaista unettomuus (0,9 %, N = 5); pahoinvointi (0,9 %, N = 5); rintakipu (0,6 %, N=3); väsymys (0,6 %, N = 3); ahdistus (0,4 %, N = 2); erektiohäiriö (0,4 %, N = 2); mielialan vaihtelut (0,4 %, N = 2); hermostuneisuus (0,4 %, N = 2); sydämentykytys (0,4 %, N = 2); ja virtsanpidätys (0,4 %, N = 2) olivat syitä lopettamiseen, joista useampi kuin yksi potilas ilmoitti.
Kohtaukset
STRATTERAa ei ole arvioitu systemaattisesti aikuispotilailla, joilla on kohtaushäiriö, koska nämä potilaat suljettiin pois kliinisistä tutkimuksista tuotteen markkinoille saattamista edeltävän testauksen aikana. Kliinisessä kehitysohjelmassa kouristuskohtauksia raportoitiin 0,1 %:lla (1/748) aikuispotilaista. Näissä kliinisissä tutkimuksissa yksikään heikko metaboloija (0/43) ei raportoinut kohtauksia verrattuna 0,1 %:iin (1/705) nopeilla metaboloijilla.
Yleisesti havaitut haittavaikutukset akuuteissa aikuisten lumekontrolloiduissa kokeissa
Taulukossa 4 on lueteltu STRATTERAn käyttöön liittyvät yleisesti havaitut haittavaikutukset (esiintyvyys 2 % tai suurempi) ja joita ei ole havaittu vastaavalla ilmaantuvuusasteella lumelääkettä saaneiden potilaiden keskuudessa (STRATTERA 25 mg:n ilmaantuvuus suurempi kuin lumelääkettä saaneiden potilaiden keskuudessa). Yleisimmin havaitut haittavaikutukset STRATTERA-hoitoa saaneilla potilailla (esiintyvyys vähintään 5 % ja vähintään kaksinkertainen lumelääkepotilailla) olivat: ummetus, suun kuivuminen, pahoinvointi, ruokahalun heikkeneminen, huimaus, erektiohäiriöt ja virtsan epäröinti (ks. taulukko 4). Lisätiedot ADHD-kliinisistä tutkimuksista (kontrolloiduista ja kontrolloimattomista) ovat osoittaneet, että noin 5–10 % aikuispotilaista koki kliinisesti merkittäviä muutoksia sydämen sykkeessä (≥20 lyöntiä minuutissa) tai verenpaineessa (≥15–20 mm Hg) [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Seuraavia haittatapahtumia esiintyi vähintään 2 %:lla aikuisista CYP2D6:n hitaasti metaboloivista (PM) potilaista, ja ne olivat tilastollisesti merkitsevästi yleisempiä PM-potilailla verrattuna CYP2D6:n nopeaan metaboloijaan (EM): näön hämärtyminen (4 % PM:istä, 1 % EM-potilaista ); suun kuivuminen (35 % PM:istä, 17 % EM:istä); ummetus (11 % PM:istä, 7 % EM:istä); hermostuneisuus (5 % PM:istä, 2 % EM:istä); vähentynyt ruokahalu (23 % PM:istä, 15 % EM:istä); vapina (5 % PM:istä, 1 % EM:istä); unettomuus (19 % PM:istä, 11 % EM:istä); unihäiriö (7 % PM:istä, 3 % EM:istä); keskivaikea unettomuus (5 % PM:istä, 3 % EM:istä); terminaalinen unettomuus (3 % PM:istä, 1 % EM:istä); virtsanpidätys (6 % PM:istä, 1 % EM:istä); erektiohäiriöt (21 % PM:istä, 9 % EM:istä); siemensyöksyhäiriö (6 % PM:istä, 2 % EM:istä); liikahikoilu (15 % PM:istä, 7 % EM:istä); perifeerinen kylmyys (3 % PM:stä, 1 % EM:stä).
Miesten ja naisten seksuaalinen toimintahäiriö
Atomoksetiini näyttää heikentävän seksuaalista toimintaa joillakin potilailla. Muutoksia seksuaalisessa halussa, seksuaalisessa suorituskyvyssä ja seksuaalisessa tyytyväisyydessä ei arvioida hyvin useimmissa kliinisissä tutkimuksissa, koska ne vaativat erityistä huomiota ja koska potilaat ja lääkärit voivat olla haluttomia keskustelemaan niistä. Näin ollen tuotemerkinnöissä mainitut arviot epäsuotuisten seksuaalisten kokemusten esiintyvyydestä ja suorituskyvystä aliarvioivat todellisen esiintyvyyden. Yllä olevassa taulukossa 4 on esitetty seksuaalisten sivuvaikutusten ilmaantuvuus, jonka raportoi vähintään 2 % STRATTERAa saaneista aikuispotilaista lumekontrolloiduissa tutkimuksissa.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia seksuaalisen toimintahäiriön tutkimisesta STRATTERA 40 mg -hoidolla. Vaikka STRATTERA 40 mg:n käyttöön liittyvän seksuaalisen toimintahäiriön tarkkaa riskiä on vaikea tietää, lääkäreiden tulee rutiininomaisesti tiedustella tällaisia mahdollisia sivuvaikutuksia.
Markkinoinnin jälkeiset spontaanit raportit
Seuraavat haittavaikutukset on tunnistettu STRATTERAn hyväksynnän jälkeisen käytön aikana. Ellei toisin mainita, näitä haittavaikutuksia on esiintynyt aikuisilla ja lapsilla ja nuorilla. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Sydän- ja verisuonijärjestelmä - QT-ajan pidentyminen, pyörtyminen.
Perifeeriset verisuonivaikutukset - Raynaudin ilmiö.
Yleiset häiriöt ja antopaikan haitat - Letargia.
Tuki- ja liikuntaelimistö - Rabdomyolyysi.
Hermoston häiriöt - Hypoestesia; parestesia lapsilla ja nuorilla; aistihäiriöt; tics.
Psyykkiset häiriöt - Masennus ja masentunut mieliala; ahdistuneisuus, libido muutokset.
Kohtaukset Markkinoille tulon jälkeisellä kaudella on raportoitu kohtauksia. Markkinoille tulon jälkeisiin kohtaustapauksiin kuuluvat potilaat, joilla on aiempaa kohtaushäiriötä, ja potilaita, joilla on tunnistettu kohtausten riskitekijöitä, sekä potilaita, joilla ei ole aiemmin esiintynyt tai joilla ei ole havaittu kohtausten riskitekijöitä. STRATTERA 40 mg:n ja kohtausten välistä tarkkaa suhdetta on vaikea arvioida, koska ADHD-potilaiden kohtausten taustariskistä ei ole varmuutta.
Ihon ja ihonalaisen kudoksen häiriöt - Hiustenlähtö, liikahikoilu.
Urogenitaalinen järjestelmä - Miesten lantion kipu; virtsan epäröinti lapsilla ja nuorilla; virtsanpidätys lapsilla ja nuorilla.
HUUMEIDEN VUOROVAIKUTUKSET
Monoamiinioksidaasin estäjät
Muiden aivojen monoamiinipitoisuuksiin vaikuttavien lääkkeiden yhteydessä on raportoitu vakavia, joskus kuolemaan johtavia reaktioita (mukaan lukien hypertermia, jäykkyys, myoklonus, autonominen epävakaus ja mahdolliset elintoimintojen nopeat vaihtelut ja mielentilan muutoksia, joihin kuuluu äärimmäistä kiihtyneisyyttä, joka etenee deliriumiin ja koomaan ), kun sitä käytetään yhdessä MAO:n estäjän kanssa. Joissakin tapauksissa esiintyi pahanlaatuista neuroleptisyndroomaa muistuttavia piirteitä. Tällaisia reaktioita voi esiintyä, kun näitä lääkkeitä annetaan samanaikaisesti tai niiden välittömässä läheisyydessä [katso VASTA-AIHEET ].
CYP2D6-estäjien vaikutus atomoksetiiniin
Nopeilla metaboloijilla (EM:t) CYP2D6:n estäjät (esim. paroksetiini, fluoksetiini ja kinidiini) lisäävät atomoksetiinin vakaan tilan plasmapitoisuuksia samanlaisiin altistuksiin kuin hitailla metaboloijilla (PM:t). Paroksetiinilla tai fluoksetiinilla hoidetuilla EM-potilailla atomoksetiinin AUC on noin 6–8-kertainen ja Css, max noin 3–4 kertaa suurempi kuin atomoksetiinin yksinään.
In vitro -tutkimukset viittaavat siihen, että sytokromi P450:n estäjien samanaikainen antaminen PM:ille ei lisää atomoksetiinin plasmapitoisuuksia.
Verenpainetta alentavat lääkkeet ja painostavat aineet
Mahdollisten verenpainevaikutusten vuoksi STRATTERAa tulee käyttää varoen verenpainetta alentavien lääkkeiden ja painetta aiheuttavien aineiden (esim. dopamiinin, dobutamiinin) tai muiden verenpainetta kohottavien lääkkeiden kanssa.
Albuteroli
STRATTERAa tulee antaa varoen potilaille, joita hoidetaan systeemisesti (suun kautta tai laskimoon) annettavalla albuterolilla (tai muilla beeta2-agonisteilla), koska albuterolin vaikutus sydän- ja verisuonijärjestelmään voi voimistua, mikä voi johtaa sydämen sykkeen ja verenpaineen nousuun. Albuteroli (600 mikrogrammaa iv 2 tunnin aikana) nosti sykettä ja verenpainetta. Näitä vaikutuksia voimisti atomoksetiini (60 mg kahdesti vuorokaudessa 5 päivän ajan), ja ne olivat voimakkaimpia albuterolin ja atomoksetiinin ensimmäisen samanaikaisen annon jälkeen. Näitä vaikutuksia sykeen ja verenpaineeseen ei kuitenkaan havaittu toisessa tutkimuksessa sen jälkeen, kun albuterolia (200-800 mikrogrammaa) ja atomoksetiinia (80 mg QD 5 päivän ajan) annettiin samanaikaisesti inhaloitavan annoksen kanssa 21 terveellä aasialaisella koehenkilöllä, jotka jätettiin pois huonosta sairaudesta. metaboloijan tila.
Atomoksetiinin vaikutus P450-entsyymeihin
Atomoksetiini ei aiheuttanut kliinisesti merkittävää sytokromi P450 -entsyymien, mukaan lukien CYP1A2, CYP3A, CYP2D6 ja CYP2C9, estoa tai induktiota.
CYP3A-substraatti (esim. midatsolaami)
STRATTERAn (60 mg kahdesti vuorokaudessa 12 päivän ajan) samanaikainen antaminen midatsolaamin kanssa, joka on CYP3A4:n metaboloituvien lääkkeiden malliyhdiste (5 mg:n kerta-annos), johti 15 %:n nousuun midatsolaamin AUC:ssa. Annoksen muuttamista ei suositella CYP3A:n kautta metaboloituville lääkkeille.
CYP2D6-substraatti (esim. desipramiini)
STRATTERA-valmisteen (40 tai 60 mg kahdesti vuorokaudessa 13 päivän ajan) samanaikainen anto CYP2D6:n metaboloituvien lääkkeiden malliyhdisteen desipramiinin kanssa (50 mg:n kerta-annos) ei muuttanut desipramiinin farmakokinetiikkaa. Annoksen muuttamista ei suositella CYP2D6:n kautta metaboloituville lääkkeille.
Alkoholi
Etanolin käyttö STRATTERA 18mg:n kanssa ei muuttanut etanolin päihdyttäviä vaikutuksia.
Metyylifenidaatti
Metyylifenidaatin samanaikainen anto STRATTERA 18 mg:n kanssa ei lisännyt kardiovaskulaarisia vaikutuksia enemmän kuin pelkällä metyylifenidaatilla.
Lääkkeet, jotka sitoutuvat voimakkaasti plasman proteiineihin
In vitro lääkeaineen syrjäytystutkimuksia tehtiin atomoksetiinilla ja muilla voimakkaasti sitoutuneilla lääkkeillä terapeuttisilla pitoisuuksilla. Atomoksetiini ei vaikuttanut varfariinin, asetyylisalisyylihapon, fenytoiinin tai diatsepaamin sitoutumiseen ihmisen albumiiniin. Samalla tavalla nämä yhdisteet eivät vaikuttaneet atomoksetiinin sitoutumiseen ihmisen albumiiniin.
Lääkkeet, jotka vaikuttavat mahalaukun pH:hon
Mahalaukun pH:ta nostavilla lääkkeillä (magnesiumhydroksidi/alumiinihydroksidi, omepratsoli) ei ollut vaikutusta STRATTERAn biologiseen hyötyosuuteen.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
STRATTERA ei ole valvottu aine.
Väärinkäyttö
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, väärinkäytön mahdollisuutta aiheuttavassa aikuisilla tehdyssä tutkimuksessa, jossa verrattiin STRATTERAn ja lumelääkkeen vaikutuksia, STRATTERA ei liittynyt vastemalliin, joka viittaisi stimulantteihin tai euforiaan vaikuttaviin ominaisuuksiin.
Riippuvuus
Yli 2000 ADHD-lapsella, nuorella ja aikuisella ja yli 1200 masennusta sairastavalla aikuisella tehdyt kliiniset tutkimustiedot osoittivat vain yksittäisiä STRATTERAan liittyviä lääkkeiden väärinkäytön tai sopimattoman itseannostelun tapauksia. Ei ollut näyttöä oireiden palautumisesta tai haittavaikutuksista, jotka viittaisivat lääkkeen käytön lopettamiseen tai vieroitusoireyhtymään.
Eläinkokemus
Huumeiden erottelututkimukset rotilla ja apinoilla osoittivat epäjohdonmukaista ärsykkeiden yleistymistä atomoksetiinin ja kokaiinin välillä.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Itsemurha-ajattelu
STRATTERA lisäsi itsemurha-ajatusten riskiä lyhytaikaisissa tutkimuksissa lapsilla ja nuorilla, joilla oli tarkkaavaisuus-/hyperaktiivisuushäiriö (ADHD). Lyhytaikaisten (6–18 viikkoa) lumekontrolloitujen STRATTERA-tutkimusten yhdistetyt analyysit lapsilla ja nuorilla ovat osoittaneet, että STRATTERA-hoitoa saavilla potilailla on suurempi itsemurha-ajatusten riski hoidon alkuvaiheessa. Tutkimuksia oli yhteensä 12 (11 ADHD:ssa ja 1 enureesissa), joihin osallistui yli 2 200 potilasta (joista 1 357 potilasta sai STRATTERAa ja 851 lumelääkettä). Keskimääräinen itsemurha-ajatusten riski STRATTERA-hoitoa saaneilla potilailla oli 0,4 % (5/1357 potilasta), kun taas lumelääkettä saaneiden potilaiden riski ei ollut yhtään. Näistä noin 2 200 potilaasta tehtiin yksi itsemurhayritys, joka tapahtui STRATTERA-hoitoa saaneella potilaalla. Näissä kokeissa ei tapahtunut itsemurhia. Kaikki reaktiot esiintyivät 12-vuotiailla tai sitä nuoremmilla lapsilla. Kaikki reaktiot ilmenivät ensimmäisen hoitokuukauden aikana. Ei tiedetä, ulottuuko itsemurha-ajatusten riski lapsipotilailla pitkäaikaiseen käyttöön. Samanlainen analyysi aikuispotilailla, joita hoidettiin STRATTERAlla joko ADHD:n tai vakavan masennushäiriön (MDD) vuoksi, ei paljastanut lisääntynyttä itsemurha-ajatusten tai -käyttäytymisen riskiä STRATTERAn käytön yhteydessä.
Kaikkia STRATTERA-hoitoa saavia lapsipotilaita on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muuttaessa, joko suurentaa tai pienentää. .
Seuraavia oireita on raportoitu STRATTERAn käytön yhteydessä: ahdistuneisuus, kiihtyneisyys, paniikkikohtaukset, unettomuus, ärtyneisyys, vihamielisyys, aggressiivisuus, impulsiivisuus, akatisia (psykomotorinen levottomuus), hypomania ja mania. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on olemassa huoli siitä, että tällaiset oireet voivat olla esiasteita kehittyvälle itsemurhalle. Siksi STRATTERA 40 mg:lla hoidettavia potilaita tulee tarkkailla tällaisten oireiden ilmaantumisen varalta.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, jotka kokevat syntyvää itsemurhaa tai oireita, jotka saattavat olla uuden itsemurha-ajatuksen esiaste, varsinkin jos nämä oireet ovat vakavia tai alkaneet äkillisesti tai eivät olleet osa hoitoa. potilaan oireet.
STRATTERA 10 mg:lla hoidettujen lapsipotilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden sekä itsemurha-ajattelun ilmaantumisen varalta. Ilmoita tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu.
Vakava maksavaurio
Markkinoille tulon jälkeiset raportit osoittavat, että STRATTERA voi aiheuttaa vakavan maksavaurion. Vaikka kliinisissä tutkimuksissa, joihin osallistui noin 6 000 potilasta, ei havaittu mitään näyttöä maksavauriosta, kliinisesti merkittäviä maksavaurioita on esiintynyt harvoissa tapauksissa, joiden katsottiin todennäköisesti tai mahdollisesti liittyvän STRATTERA 40 mg:n käyttöön markkinoille tulon jälkeen. Harvinaisia maksan vajaatoimintatapauksia on myös raportoitu, mukaan lukien tapaus, joka johti maksansiirtoon. Todennäköisen aliraportoinnin vuoksi on mahdotonta antaa tarkkaa arviota näiden reaktioiden todellisesta esiintyvyydestä. Raportoidut maksavauriotapaukset ilmenivät 120 päivän sisällä atomoksetiinihoidon aloittamisesta, ja joillakin potilailla oli huomattavasti kohonneita maksaentsyymiarvoja [>20 X normaalin yläraja (ULN)] ja keltaisuutta, johon liittyi merkittävästi kohonneita bilirubiinitasoja (>2). X ULN), jota seuraa toipuminen atomoksetiinihoidon lopettamisen jälkeen. Yhdellä potilaalla maksavaurio, joka ilmeni kohonneina maksaentsyymiarvoina jopa 40 X ULN ja keltatauti, jossa bilirubiini oli jopa 12 X ULN, uusiutui, kun lääke otettiin uudelleen käyttöön, ja sitä seurasi toipuminen lääkkeen käytön lopettamisen jälkeen, mikä osoitti, että STRATTERA todennäköisesti aiheutti maksavaurion. Tällaisia reaktioita voi esiintyä useita kuukausia hoidon aloittamisen jälkeen, mutta laboratorioarvojen poikkeavuudet voivat jatkua useiden viikkojen ajan lääkkeen lopettamisen jälkeen. Edellä kuvattu potilas toipui maksavauriostaan eikä tarvinnut maksansiirtoa.
STRATTERA-hoito tulee lopettaa potilailla, joilla on keltaisuus tai laboratoriotutkimuksia maksavauriosta, eikä sitä saa aloittaa uudelleen. Laboratoriokokeet maksaentsyymitasojen määrittämiseksi tulee tehdä heti, kun ilmenee maksan toimintahäiriön ensimmäinen oire tai merkki (esim. kutina, tumma virtsa, keltaisuus, oikean yläkvadrantin arkuus tai selittämättömät "flunssan kaltaiset" oireet) [ks. Laboratoriotestit , POTILASTIEDOT ].
Vakavat sydän- ja verisuonitapahtumat
Äkillinen kuolema ja olemassa olevat sydämen rakenteelliset poikkeavuudet tai muut vakavat sydänongelmat
Lapset ja nuoret
Äkillistä kuolemaa on raportoitu tavallisilla annoksilla käytettyjen atomoksetiinihoidon yhteydessä lapsilla ja nuorilla, joilla on rakenteellisia sydämen poikkeavuuksia tai muita vakavia sydänongelmia. Vaikka jotkin vakavat sydänongelmat yksinään lisäävät äkillisen kuoleman riskiä, atomoksetiinia ei yleensä tule käyttää lapsille tai nuorille, joilla on tunnettuja vakavia sydämen rakenteellisia poikkeavuuksia, kardiomyopatiaa, vakavia sydämen rytmihäiriöitä tai muita vakavia sydänongelmia, jotka saattavat lisätä heidät haavoittuvaan atomoksetiinin noradrenergisiin vaikutuksiin.
Aikuiset
Äkillisiä kuolemantapauksia, aivohalvauksia ja sydäninfarkteja on raportoitu aikuisilla, jotka ovat käyttäneet atomoksetiinia tavallisilla annoksilla ADHD:n hoitoon. Vaikka atomoksetiinin roolia näissä aikuisten tapauksissa ei myöskään tunneta, aikuisilla on suurempi todennäköisyys saada vakavia rakenteellisia sydämen poikkeavuuksia, kardiomyopatiaa, vakavia sydämen rytmihäiriöitä, sepelvaltimotautia tai muita vakavia sydänongelmia. On harkittava, ettei aikuisia, joilla on kliinisesti merkittäviä sydämen poikkeavuuksia, hoideta.
Atomoksetiinihoitoa saavien potilaiden kardiovaskulaarisen tilan arviointi
Lapsilla, nuorilla tai aikuisilla, joille harkitaan atomoksetiinihoitoa, tulee olla huolellinen historia (mukaan lukien sukuhistorian äkillinen kuolema tai kammiorytmihäiriö) ja fyysinen tutkimus sydänsairauden toteamiseksi, ja heidän tulee saada lisää sydäntutkimuksia. arviointi, jos löydökset viittaavat tällaiseen sairauteen (esim. EKG ja kaiku). Potilaille, joille ilmaantuu atomoksetiinihoidon aikana oireita, kuten rasituksen aiheuttamaa rintakipua, selittämätöntä pyörtymistä tai muita sydänsairauteen viittaavia oireita, tulee suorittaa nopea sydänarviointi.
Vaikutukset verenpaineeseen ja sykeen
STRATTERA-valmistetta tulee käyttää varoen potilailla, joiden perussairaus voi pahentua verenpaineen tai sydämen sykkeen nousun vuoksi, kuten tietyillä potilailla, joilla on verenpainetauti, takykardia tai sydän- tai aivoverisuonisairaus. Sitä ei tule käyttää potilailla, joilla on vakavia sydän- tai verisuonisairauksia, joiden tilan odotetaan heikkenevän, jos heillä olisi kliinisesti merkittävää verenpaineen tai sykkeen nousua [ks. VASTA-AIHEET ]. Pulssi ja verenpaine tulee mitata lähtötilanteessa, STRATTERA-annoksen suurentamisen jälkeen ja ajoittain hoidon aikana mahdollisten kliinisesti merkittävien nousujen havaitsemiseksi.
Seuraavassa taulukossa on lyhytaikaisia, lumekontrolloituja kliinisiä tutkimuksia koskevia tietoja niiden potilaiden osuuksista, joilla on kohonnut diastolinen verenpaine ≥15 mm Hg; systolinen verenpaine ≥20 mm Hg; syke on suurempi tai yhtä suuri kuin 20 lyöntiä minuutissa sekä lapsi- että aikuisväestössä (katso taulukko 1).
Lapsipotilailla tehdyissä lumekontrolloiduissa rekisteröintitutkimuksissa takykardia havaittiin haittatapahtumaksi 0,3 %:lla (5/1597) näistä STRATTERA 10 mg:n potilaista verrattuna 0 %:iin (0/934) lumelääkepotilaista. Keskimääräinen sykkeen nousu kiihkeästi metaboloijapotilailla (EM) oli 5,0 lyöntiä/minuutti ja heikosti metaboloijapotilailla (PM) 9,4 lyöntiä minuutissa.
Aikuisten kliinisissä tutkimuksissa, joissa EM/PM-status oli saatavilla, keskimääräinen sykkeen nousu PM-potilailla oli merkittävästi korkeampi kuin EM-potilailla (11 lyöntiä/min vs. 7,5 lyöntiä/min). Sykevaikutukset voivat olla kliinisesti tärkeitä joillakin PM-potilailla.
Lumekontrolloiduissa rekisteröintitutkimuksissa aikuispotilailla takykardia havaittiin haittatapahtumaksi 1,5 %:lla (8/540) STRATTERA 25 mg:n potilaista verrattuna 0,5 %:iin (2/402) lumelääkepotilaista.
Aikuisten kliinisissä tutkimuksissa, joissa EM/PM-status oli saatavilla, diastolisen verenpaineen keskimääräinen muutos lähtötasosta PM-potilailla oli suurempi kuin EM-potilailla (4,21 vs. 2,13 mmHg), samoin kuin systolisen verenpaineen (PM) keskimääräinen muutos lähtötasosta. 2,75 vs. EM: 2,40 mm Hg). Verenpainevaikutukset voivat olla kliinisesti tärkeitä joillakin PM-potilailla.
Ortostaattista hypotensiota ja pyörtymistä on raportoitu STRATTERAa käyttävillä potilailla. Lapsia ja nuoria koskevissa rekisteröintitutkimuksissa 0,2 % (12/5596) STRATTERA-hoitoa saaneista potilaista koki ortostaattista hypotensiota ja 0,8 % (46/5596) pyörtymistä. Lyhytaikaisissa lapsilla ja nuorilla tehdyissä rekisteröintitutkimuksissa 1,8 % (6/340) STRATTERA-hoitoa saaneista potilaista koki ortostaattista hypotensiota verrattuna 0,5 %:iin (1/207) lumelääkettä saaneista potilaista. Pyörtymistä ei raportoitu lyhytaikaisissa lasten ja nuorten lumekontrolloiduissa ADHD-rekisteröintitutkimuksissa. STRATTERA 10 mg:aa tulee käyttää varoen kaikissa tiloissa, jotka voivat altistaa potilaat hypotensiolle tai tiloihin, jotka liittyvät äkillisiin syke- tai verenpaineen muutoksiin.
Uusien psykoottisten tai maanisten oireiden ilmaantuminen
Hoidossa ilmenevät psykoottiset tai maaniset oireet, kuten hallusinaatiot, harhaluuloinen ajattelu tai mania lapsilla ja nuorilla, joilla ei ole aiempaa psykoottista sairautta tai maniaa, voivat johtua tavallisina annoksina käytetty atomoksetiini. Jos tällaisia oireita ilmenee, atomoksetiinin mahdollinen syy-seuraus on otettava huomioon ja hoidon lopettamista tulee harkita. Useiden lyhytaikaisten lumekontrolloitujen tutkimusten yhdistetyssä analyysissä tällaisia oireita esiintyi noin 0,2 %:lla (4 potilasta 1939:stä, joilla oli reaktioita atomoksetiinille useiden viikkojen ajan tavallisilla annoksilla) atomoksetiinilla hoidetuista potilaista verrattuna 0 potilaaseen 1056 lumelääkettä saanutta potilasta.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Yleisesti ottaen ADHD:n hoidossa tulee noudattaa erityistä varovaisuutta potilailla, joilla on samanaikainen kaksisuuntainen mielialahäiriö. Ei tiedetä, edustaako mikään yllä kuvatuista oireista tällaista muutosta. Kuitenkin ennen STRATTERA 40 mg -hoidon aloittamista potilaita, joilla on samanaikaisia masennusoireita, tulee seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski. Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia.
Aggressiivinen käytös tai vihamielisyys
Potilaita, jotka aloittavat ADHD-hoidon, tulee seurata aggressiivisen käyttäytymisen tai vihamielisyyden ilmaantumisen tai pahenemisen varalta. Aggressiivista käyttäytymistä tai vihamielisyyttä havaitaan usein lapsilla ja nuorilla, joilla on ADHD. Lasten lyhytaikaisissa kontrolloiduissa kliinisissä tutkimuksissa 21/1308 (1,6 %) atomoksetiinipotilaista ja 9/806 (1,1 %) lumelääkettä saaneista potilaista ilmoitti spontaanisti hoidosta aiheutuvia vihamielisyyteen liittyviä haittatapahtumia (kokonaisriskisuhde 1,33 [95 % CI 0,67-2,64 – ei tilastollisesti merkitsevä]). Aikuisten lumelääkekontrolloiduissa kliinisissä tutkimuksissa 6/1697 (0,35 %) atomoksetiinipotilaista ja 4/1 560 (0,26 %) lumelääkettä saaneista potilaista ilmoitti spontaanisti hoitoon liittyvistä vihamielisyydestä johtuvista haittatapahtumista (kokonaisriskisuhde 1,38 [95 % CI 0,39-4,88 – ei tilastollisesti merkitsevä]). Vaikka tämä ei ole vakuuttava todiste siitä, että STRATTERA 10 mg aiheuttaa aggressiivista käyttäytymistä tai vihamielisyyttä, näitä käyttäytymistä havaittiin useammin kliinisissä tutkimuksissa STRATTERA-hoitoa saaneilla lapsilla, nuorilla ja aikuisilla kuin lumelääkettä saaneilla.
Allergiset tapahtumat
STRATTERAa käyttävillä potilailla on raportoitu allergisia reaktioita, mukaan lukien anafylaktiset reaktiot, angioneuroottinen turvotus, nokkosihottuma ja ihottuma, vaikka ne ovat harvinaisia.
Vaikutukset virtsan ulosvirtaukseen virtsarakosta
Aikuisten ADHD-kontrolloiduissa tutkimuksissa virtsaretentio (1,7 %, 9/540) ja virtsan epäröinti (5,6 %, 30/540) lisääntyivät atomoksetiinipotilailla verrattuna lumelääkettä saaneisiin (0 %, 0/402; 0,5 %). 2/402). Kontrolloiduista kliinisistä tutkimuksista kaksi aikuista atomoksetiinipotilasta ja yksikään lumelääkettä keskeytti virtsan pidättymisen vuoksi. Valituksen virtsan kertymisestä tai virtsan epäröimisestä tulee katsoa mahdollisesti liittyvän atomoksetiiniin.
Priapismi
STRATTERAlla hoidetuilla lapsi- ja aikuispotilailla on raportoitu harvinaisia markkinoille tulon jälkeisiä priapismitapauksia, jotka määritellään kivuliaaksi ja kivuttomaksi peniksen erektioksi, joka kestää yli 4 tuntia. Erektiot paranivat tapauksissa, joissa seurantatietoja oli saatavilla, joista osa STRATTERA-hoidon lopettamisen jälkeen. Priapismia epäiltäessä tarvitaan nopeaa lääkärinhoitoa.
Vaikutukset kasvuun
Tiedot STRATTERA 25 mg:n pitkäaikaisista kasvuvaikutuksista ovat peräisin avoimista tutkimuksista, ja painon ja pituuden muutoksia verrataan normatiivisiin väestötietoihin. Yleisesti ottaen STRATTERA-hoitoa saaneiden lapsipotilaiden painon ja pituuden nousu on jäljessä normaalipopulaatiotietojen ennusteesta noin ensimmäisten 9-12 hoitokuukauden aikana. Myöhemmin painonnousu palautuu, ja noin 3 vuoden hoidon aikana STRATTERA-hoitoa saaneet potilaat ovat lihoneet keskimäärin 17,9 kg, 0,5 kg enemmän kuin heidän lähtötilanteensa perusteella ennustettiin. Noin 12 kuukauden kuluttua pituuden nousu tasaantuu, ja 3 vuoden kohdalla STRATTERA 40 mg:lla hoidetut potilaat ovat nousseet keskimäärin 19,4 cm, mikä on 0,4 cm vähemmän kuin heidän lähtötilanteensa perusteella ennustettiin (katso kuva 1 alla).
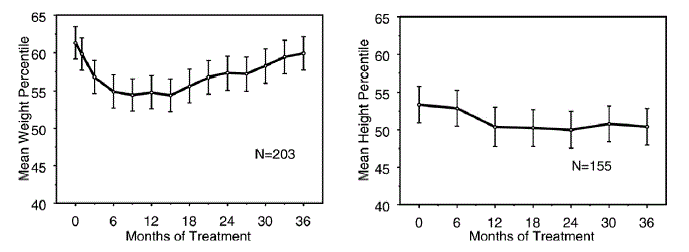
Kuva 1: Keskimääräiset paino- ja pituusprosentiilit ajan mittaan potilailla, jotka ovat saaneet kolme vuotta STRATTERA 40 mg -hoitoa
Tämä kasvukuvio oli yleensä samanlainen riippumatta murrosiästä hoidon aloitushetkellä. Potilaat, jotka olivat hoidon alussa esimurrosiässä (tytöt ≤ 8 vuotta vanhat, pojat ≤ 9 vuotta vanhat), lihoivat keskimäärin 2,1 kg ja 1,2 cm vähemmän kuin ennustettiin kolmen vuoden jälkeen. Potilaiden, jotka olivat murrosiässä (tytöt > 8 - ≤ 13 vuotta vanhat, pojat > 9 - ≤ 14 vuotta vanhat) tai myöhään murrosiässä (tytöt > 13 vuotta vanhat, pojat > 14 vuotta vanhat), keskimääräinen painon ja pituuden nousu oli lähellä tai ylitti ennustetut kolmen vuoden hoidon jälkeen.
Kasvu noudatti samanlaista mallia sekä laajoissa että huonoissa metaboloijissa (EM:t, PM:t). Vähintään kaksi vuotta hoidetut PM:t lihoivat keskimäärin 2,4 kg ja 1,1 cm vähemmän kuin ennustettiin, kun taas EM-potilaat lihoivat keskimäärin 0,2 kg ja 0,4 cm vähemmän kuin ennustettiin.

Lyhytaikaisissa kontrolloiduissa tutkimuksissa (enintään 9 viikkoa) STRATTERA-hoitoa saaneet potilaat laihtivat keskimäärin 0,4 kg ja lihoivat keskimäärin 0,9 cm, kun lumelääkettä saaneiden potilaiden paino nousi 1,5 kg ja 1,1 cm. Kiinteän annoksen kontrolloidussa tutkimuksessa 1,3 %, 7,1 %, 19,3 % ja 29,1 % potilaista menetti vähintään 3,5 % painostaan lumelääke-, 0,5, 1,2 ja 1,8 mg/kg/vrk annosryhmissä.
Kasvua tulee seurata STRATTERA-hoidon aikana.
Laboratoriotestit
Rutiinilaboratoriotutkimuksia ei vaadita.
CYP2D6-aineenvaihdunta
CYP2D6:n heikoilla metaboloijilla (PM:t) on 10 kertaa suurempi AUC ja 5 kertaa korkeampi huippupitoisuus tietyllä STRATTERA 25 mg:n annoksella verrattuna nopeisiin metaboloijeihin (EM). Noin 7 % valkoihoisista on PM:itä. Laboratoriokokeita on saatavilla CYP2D6-PM:iden tunnistamiseksi. Veritasot PM:issä ovat samankaltaisia kuin ne, jotka saavutetaan ottamalla vahvoja CYP2D6:n estäjiä. Korkeammat veren tasot PM:issä johtavat korkeampiin STRATTERAn haittavaikutuksiin [katso HAITTAVAIKUTUKSET ].
Voimakkaiden CYP2D6:n estäjien samanaikainen käyttö tai käyttö potilailla, joiden tiedetään olevan CYP2D6 PM:ää
Atomoksetiini metaboloituu ensisijaisesti CYP2D6-reitin kautta 4-hydroksiatomoksetiiniksi. STRATTERA-annoksen muuttaminen voi olla tarpeen, kun sitä annetaan samanaikaisesti voimakkaiden CYP2D6:n estäjien (esim. paroksetiini, fluoksetiini ja kinidiini) kanssa tai kun sitä annetaan CYP2D6 PM:ille. [Katso ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
Potilasneuvontatiedot
Katso FDA:n hyväksymä POTILASTIEDOT .
Yleistä tietoa
Lääkäreiden tulee neuvoa potilaitaan lukemaan lääkitysopas ennen STRATTERA-hoidon aloittamista ja lukemaan se uudelleen aina, kun resepti uusitaan.
Lääkäreiden tai muiden terveydenhuollon ammattilaisten tulee kertoa potilaille, heidän perheilleen ja heidän hoitajilleen STRATTERA-hoidon eduista ja riskeistä ja neuvoa heitä sen asianmukaisessa käytössä. Lääkkeen määrääjän tai terveydenhuollon ammattilaisen tulee neuvoa potilaita, heidän perheitään ja hoitajiaan lukemaan lääkitysopas ja auttaa heitä ymmärtämään sen sisältö. Potilaille tulee antaa mahdollisuus keskustella lääkitysoppaan sisällöstä ja saada vastauksia mahdollisiin kysymyksiinsä.
Potilaita tulee kertoa seuraavista ongelmista ja pyytää heitä varoittamaan lääkäriään, jos niitä ilmenee STRATTERA-hoidon aikana.
Itsemurhariski
Potilaita, heidän perheitään ja heidän omaisiaan tulee kannustaa olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyneisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. masennusta ja itsemurha-ajatuksia, erityisesti STRATTERA-hoidon alkuvaiheessa ja annosta muuttaessa. Potilaiden perheitä ja hoitajia tulee neuvoa tarkkailemaan tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät olleet osa potilaan oireita. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne voivat viitata erittäin tiiviin seurannan tarpeeseen ja mahdollisesti lääkityksen muutoksiin.
Vakava maksavaurio
Potilaita, jotka aloittavat STRATTERA-hoidon, tulee varoittaa siitä, että saattaa kehittyä vakava maksavaurio. Potilaita tulee neuvoa ottamaan välittömästi yhteyttä lääkäriin, jos heille ilmaantuu kutinaa, tummaa virtsaa, keltaisuutta, oikean yläkvadrantin arkuutta tai selittämättömiä "flunssan kaltaisia" oireita [ks. VAROITUKSET JA VAROTOIMET ].
Aggressio tai vihamielisyys
Potilaita tulee neuvoa soittamaan lääkärilleen mahdollisimman pian, jos he huomaavat lisääntyvän aggressiivisuuden tai vihamielisyyden.
Priapismi
STRATTERAlla hoidetuilla lapsi- ja aikuispotilailla on raportoitu harvinaisia markkinoille tulon jälkeisiä priapismitapauksia, jotka määritellään kivuliaaksi ja kivuttomaksi peniksen erektioksi, joka kestää yli 4 tuntia. STRATTERA 25 mg -valmistetta käyttävien lapsipotilaiden ja STRATTERAa käyttävien aikuispotilaiden vanhemmille tai huoltajille tulee kertoa, että priapismi vaatii välitöntä lääkärinhoitoa.
Silmiä Ärsyttävä
STRATTERA on silmiä ärsyttävä aine. STRATTERA-kapseleita ei ole tarkoitettu avattavaksi. Jos kapselin sisältö joutuu kosketuksiin silmien kanssa, sairastunut silmä on huuhdeltava välittömästi vedellä ja hakeuduttava lääkärin hoitoon. Kädet ja mahdollisesti saastuneet pinnat tulee pestä mahdollisimman pian.
Huumeiden välinen vuorovaikutus
Potilaita tulee neuvoa ottamaan yhteyttä lääkäriin, jos he käyttävät tai aikovat ottaa resepti- tai käsikauppalääkkeitä, ravintolisiä tai rohdosvalmisteita.
Raskaus
Potilaita tulee neuvoa ottamaan yhteyttä lääkäriin, jos he imettävät, ovat raskaana tai aikovat tulla raskaaksi STRATTERA-hoidon aikana.
Ruokaa
Potilaat voivat ottaa STRATTERA 25 mg aterian kanssa tai ilman.
Unohtunut annos
Jos potilas unohtaa ottaa annoksen, heitä tulee neuvoa ottamaan se mahdollisimman pian, mutta he eivät saa ottaa enempää kuin määrätty STRATTERAn päivittäinen kokonaismäärä minkään 24 tunnin aikana.
Psykomotorisen suorituskyvyn häiriöt
Potilaita tulee neuvoa olemaan varovaisia ajaessaan autoa tai käyttäessään vaarallisia koneita, kunnes he ovat kohtuullisen varmoja siitä, että atomoksetiini ei vaikuta heidän suorituskykyyn.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Atomoksetiinihydrokloridi ei ollut syöpää aiheuttava rotilla ja hiirillä, kun sitä annettiin ruokavalion yhteydessä 2 vuoden ajan aikapainotetuilla keskiannoksilla 47 ja 458 mg/kg/vrk. Suurin rotilla käytetty annos on noin 8 ja 5 kertaa suurempi kuin suurin annos ihmisille lapsille ja aikuisille, vastaavasti mg/m2-pohjaisesti. Atomoksetiinin plasmapitoisuuksien (AUC) tällä annoksella rotilla arvioidaan olevan 1,8-kertaiset (nopeat metaboloijat) tai 0,2-kertaiset (huonosti metaboloijat) verrattuna ihmisiin, jotka saavat suurimman ihmisannoksen. Suurin hiirillä käytetty annos on noin 39 ja 26 kertaa suurempi kuin suurin annos ihmisille lapsille ja aikuisille, vastaavasti mg/m2:n perusteella.
Mutageneesi
Atomoksetiini HCl oli negatiivinen useissa genotoksisuustutkimuksissa, joihin sisältyi käänteispistemutaatiomääritys (Ames-testi), in vitro hiiren lymfoomatesti, kromosomipoikkeamatesti kiinanhamsterin munasarjasoluilla, suunnittelematon DNA-synteesitesti rotan maksasoluilla ja in vivo mikrotumatesti hiirillä. Diplokromosomeja sisältävien kiinanhamsterin munasarjasolujen prosenttiosuus kuitenkin kasvoi hieman, mikä viittaa endoreduplikaatioon (numeerinen poikkeama).
Metaboliitti N-desmetyyliatomoksetiini HCl oli negatiivinen Ames-testissä, hiiren lymfoomatestissä ja suunnittelemattomassa DNA-synteesitestissä.
Hedelmällisyyden heikkeneminen
Atomoksetiinihydrokloridi ei heikentänyt rottien hedelmällisyyttä, kun sitä annettiin ruokavaliossa enintään 57 mg/kg/vrk annoksilla, mikä on noin 6 kertaa ihmisen enimmäisannos mg/m2:n perusteella laskettuna.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
Raskaana olevia kaneja käsiteltiin jopa 100 mg/kg/päivä atomoksetiinilla letkuruokinnalla koko organogeneesin ajan. Tällä annoksella havaittiin yhdessä kolmesta tutkimuksesta elävien sikiöiden määrän väheneminen ja varhaisten resorptioiden lisääntyminen. Kaulavaltimon epätyypillisen alkuperän ja poissaolevan subclavian valtimon esiintyvyyden havaittiin lisääntyneen hieman. Nämä löydökset havaittiin annoksilla, jotka aiheuttivat lievää emolle toksisuutta. Näihin löydöksiin vaikuttamaton annos oli 30 mg/kg/vrk. 100 mg/kg annos on noin 23 kertaa ihmisen enimmäisannos mg/m2:n perusteella laskettuna; Atomoksetiinin plasmapitoisuuksien (AUC) tällä annoksella kaneilla arvioidaan olevan 3,3-kertaiset (laajuiset metaboloijat) tai 0,4-kertaiset (huonosti metaboloijat) verrattuna ihmisiin, jotka saavat suurimman ihmisannoksen.
Rotille annettiin noin 50 mg/kg/vrk atomoksetiinia (noin 6 kertaa ihmisen enimmäisannos mg/m2:n perusteella laskettuna) 2 viikon (naaraat) tai 10 viikon (urokset) jälkeen ennen parittelua. organogeneesin ja imetyksen jaksot. Yhdessä kahdesta tutkimuksesta havaittiin poikasten painon ja eloonjäämisen laskua. Pentujen eloonjäämisen väheneminen havaittiin myös annoksella 25 mg/kg (mutta ei annoksella 13 mg/kg). Tutkimuksessa, jossa rottia hoidettiin atomoksetiinilla ruokavaliossa 2 viikkoa (naaraat) tai 10 viikkoa (urokset) ennen parittelua koko organogeneesin ajan, sikiön painon lasku (ainoastaan naaraat) ja lisääntynyt ilmaantuvuus sikiöillä havaittiin nikamakaaren epätäydellistä luutumista annoksella 40 mg/kg/vrk (noin 5 kertaa ihmisen enimmäisannos mg/m2:n perusteella laskettuna), mutta ei annoksella 20 mg/kg/vrk.
Mitään haitallisia sikiövaikutuksia ei havaittu, kun tiineitä rottia hoidettiin jopa 150 mg/kg/vrk (noin 17 kertaa ihmisen enimmäisannos mg/m2:n perusteella) letkuruokinnalla koko organogeneesin ajan. Raskaana olevilla naisilla ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. STRATTERA 18 mg:aa ei tule käyttää raskauden aikana, ellei mahdollinen hyöty ole suurempi kuin mahdollinen riski sikiölle.
Työ ja toimitus
Atomoksetiini ei vaikuttanut rottien synnytykseen. STRATTERAn vaikutusta synnytykseen ja synnytykseen ihmisillä ei tunneta.
Imettävät äidit
Atomoksetiini ja/tai sen metaboliitit erittyivät rottien maitoon. Ei tiedetä, erittyykö atomoksetiini äidinmaitoon. Varovaisuutta on noudatettava, jos STRATTERAa annetaan imettävälle naiselle.
Käyttö lapsille
Jokaisen, joka harkitsee STRATTERAn käyttöä lapsella tai nuorella, on tasapainotettava mahdolliset riskit kliinisen tarpeen kanssa [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]. Atomoksetiinin farmakokinetiikka lapsilla ja nuorilla on samanlainen kuin aikuisilla. STRATTERAn turvallisuutta, tehoa ja farmakokinetiikkaa alle 6-vuotiailla lapsipotilailla ei ole arvioitu.
Nuorilla rotilla suoritettiin tutkimus atomoksetiinin vaikutusten arvioimiseksi kasvuun sekä hermokäyttäytymiseen ja seksuaaliseen kehitykseen. Rotille annettiin 1, 10 tai 50 mg/kg/vrk (noin 0,2, 2 ja 8 kertaa ihmisen maksimiannos mg/m2:n perusteella laskettuna) atomoksetiinia, joka annettiin letkulla varhaisesta synnytyksen jälkeisestä ajanjaksosta (päivä). 10-vuotiaana) aikuisikään asti. Pieniä viiveitä emättimen aukeamisessa (kaikki annokset) ja esinahan irtoamisessa (10 ja 50 mg/kg), lisäkiveksen painon ja siittiöiden lukumäärän lievää laskua (10 ja 50 mg/kg) ja keltasolujen lievää laskua (50 mg) /kg) havaittiin, mutta niillä ei ollut vaikutuksia hedelmällisyyteen tai lisääntymiskykyyn. Pieni viive etuhampaiden puhkeamisessa havaittiin annoksella 50 mg/kg. Motorisen aktiivisuuden lievää lisääntymistä havaittiin päivänä 15 (urokset 10 ja 50 mg/kg ja naiset 50 mg/kg) ja päivänä 30 (naaraat 50 mg/kg), mutta ei 60. päivänä. Ei ollut vaikutusta oppimiseen ja muistitesteihin. Näiden löydösten merkitystä ihmisille ei tunneta.
Geriatrinen käyttö
STRATTERA 10 mg:n turvallisuutta, tehoa ja farmakokinetiikkaa iäkkäillä potilailla ei ole arvioitu.
Maksan vajaatoiminta
Atomoksetiinialtistus (AUC) on tavallista suurempi EM-potilailla, joilla on kohtalainen (Child-Pugh-luokka B) (2-kertainen) ja vaikea (Child-Pugh-luokka C) (4-kertainen) maksan vajaatoiminta. Annoksen muuttamista suositellaan potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta [ks ANNOSTELU JA HALLINNOINTI ].
Munuaisten vajaatoiminta
EM-potilailla, joilla oli loppuvaiheen munuaissairaus, systeeminen altistus atomoksetiinille oli suurempi kuin terveillä henkilöillä (noin 65 %:n lisäys), mutta eroa ei ollut, kun altistus korjattiin mg/kg annoksella. STRATTERA 25 mg voidaan siksi antaa ADHD-potilaille, joilla on loppuvaiheen munuaissairaus tai vähäisempi munuaisten vajaatoiminta, käyttämällä normaalia annostelua.
Sukupuoli
Sukupuoli ei vaikuttanut atomoksetiinin jakautumiseen.
Etninen alkuperä
Etninen alkuperä ei vaikuttanut atomoksetiinin jakautumiseen (paitsi että PM:t ovat yleisempiä valkoihoisilla).
Potilaat, joilla on samanaikainen sairaus
Tikit potilailla, joilla on ADHD ja samanaikainen Touretten häiriö
Atomoksetiinia, jota annettiin joustavalla annosalueella 0,5–1,5 mg/kg/vrk (keskimääräinen annos 1,3 mg/kg/vrk) ja lumelääkettä verrattiin 148 satunnaistetulla lapsipotilaalla (ikä 717 vuotta), joilla oli DSM-IV-diagnoosi ADHD ja komorbidinen tic-häiriö 18 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa, jossa suurin osa (80 %) osallistui tähän tutkimukseen, jolla oli Touretten häiriö (Touretten häiriö: 116 henkilöä; krooninen motorinen tikihäiriö: 29 henkilöä). Non-inferiority-analyysi paljasti, että STRATTERA 10 mg ei pahentanut tics-oireita näillä potilailla Yalen Global Tic Severity Scale Total Score (YGTSS) -pistemäärän mukaan. 148 potilaasta, jotka siirtyivät akuuttiin hoitovaiheeseen, 103 (69,6 %) potilasta keskeytti tutkimuksen. Ensisijaisena syynä hoidon lopettamiseen sekä atomoksetiini- (38 potilaasta 76 potilaasta, 50,0 %) että lumelääkeryhmässä (45 72 potilaasta, 62,5 %) havaittiin tehon puutteeksi, koska useimmat potilaista keskeyttivät hoidon viikolla 12. Tämä oli ensimmäinen käynti, jossa potilaat, joilla on CGI-S≥4, saattoivat myös täyttää "kliinisen vasteettoman" kriteerit (CGI-S pysyi samana tai kasvoi tutkimuksen lähtötasosta) ja he voivat osallistua avoimeen jatkotutkimukseen atomoksetiinilla. Markkinoille tulon jälkeen on raportoitu ticistä [katso HAITTAVAIKUTUKSET ].
Ahdistuneisuus potilailla, joilla on ADHD ja samanaikainen ahdistuneisuushäiriö
Kahdessa markkinoille tulon jälkeisessä kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa on osoitettu, että ADHD-potilaiden ja samanaikaisten ahdistuneisuushäiriöiden hoito STRATTERA 10 mg:lla ei pahenna heidän ahdistuneisuuttaan.
12 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 176 potilasta, iältään 8–17, jotka täyttivät ADHD:n DSM-IV-kriteerit ja vähintään yhden ahdistuneisuushäiriön, kuten eroahdistushäiriön, yleistyneen ahdistuneisuushäiriön tai sosiaalisen fobian, tutkittiin. satunnaistettu. 2 viikon kaksoissokkoutetun lumelääkehoidon jälkeen STRATTERA 25 mg aloitettiin annoksella 0,8 mg/kg/vrk ja nostettiin tavoiteannokseen 1,2 mg/kg/vrk (mediaaniannos 1,30 mg/kg/vrk +/-0,29 mg/kg/vrk). STRATTERA ei pahentanut ahdistusta näillä potilailla lasten ahdistuneisuusluokitusasteikon (PARS) mukaan. Niistä 158 potilaasta, jotka suorittivat kaksoissokkoutetun lumelääketutkimuksen, 26 (16 %) potilasta keskeytti tutkimuksen.
Erillisessä 16 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa satunnaistettiin 442 18–65-vuotiasta potilasta, jotka täyttivät aikuisten ADHD:n ja sosiaalisen ahdistuneisuushäiriön DSM-IV-kriteerit (joista 23 %:lla oli myös yleistynyt ahdistuneisuushäiriö). 2 viikon kaksoissokkoutetun lumelääkehoidon jälkeen STRATTERA 10 mg aloitettiin annoksella 40 mg/vrk maksimiannokseen 100 mg/vrk (keskimääräinen vuorokausiannos 83 mg/vrk +/-19,5 mg/vrk). STRATTERA 18 mg ei pahentanut ahdistusta näillä potilailla Liebowitzin sosiaalisen ahdistuneisuusasteikon (LSAS) mukaan. Niistä 413 potilaasta, jotka suorittivat kaksoissokkoutetun lumelääketutkimuksen, 149 (36,1 %) potilasta keskeytti tutkimuksen. Markkinoille tulon jälkeen on raportoitu ahdistusta [katso HAITTAVAIKUTUKSET ] .
YLIANNOSTUS
Inhimillinen kokemus
Kliinisistä tutkimuksista STRATTERAn yliannostuksesta on vain vähän kokemusta. Markkinoille tulon jälkeisenä aikana on raportoitu kuolemantapauksia, jotka liittyivät STRATTERA 10 mg:n ja vähintään yhden muun lääkkeen seka-annostukseen. Pelkän STRATTERAn yliannostukseen liittyviä kuolemantapauksia ei ole raportoitu, mukaan lukien tahalliset yliannostukset enintään 1400 mg:n annoksilla. Joissakin STRATTERAn yliannostustapauksissa on raportoitu kohtauksia. Yleisimmin raportoidut oireet, jotka liittyvät STRATTERAn akuuttiin ja krooniseen yliannostukseen, olivat maha-suolikanavan oireet, uneliaisuus, huimaus, vapina ja epänormaali käyttäytyminen. Myös yliaktiivisuutta ja kiihtyneisyyttä on raportoitu. Myös lievää tai kohtalaista sympaattisen hermoston aktivoitumiseen liittyviä merkkejä ja oireita (esim. takykardia, kohonnut verenpaine, mydriaasi, suun kuivuminen) on havaittu. Useimmat tapahtumat olivat lieviä tai kohtalaisia. Harvemmin on raportoitu QT-ajan pidentymistä ja henkisiä muutoksia, mukaan lukien desorientaatio ja hallusinaatiot [ks. KLIININEN FARMAKOLOGIA ].
Yliannostuksen hallinta
Ota yhteyttä sertifioituun myrkytystietokeskukseen saadaksesi ajantasaisia ohjeita ja neuvoja. Koska atomoksetiini sitoutuu voimakkaasti proteiineihin, dialyysistä ei todennäköisesti ole hyötyä yliannostuksen hoidossa.
VASTA-AIHEET
Yliherkkyys
STRATTERA on vasta-aiheinen potilailla, joiden tiedetään olevan yliherkkiä atomoksetiinille tai muille tuotteen aineosille [ks. VAROITUKSET JA VAROTOIMET ].
Monoamiinioksidaasin estäjät (MAOI)
STRATTERAa ei tule ottaa MAO:n estäjän kanssa tai 2 viikon kuluessa MAO:n estäjähoidon lopettamisesta. MAOI-hoitoa ei pidä aloittaa 2 viikon kuluessa STRATTERA-hoidon lopettamisesta. Muiden aivojen monoamiinipitoisuuksiin vaikuttavien lääkkeiden yhteydessä on raportoitu vakavia, joskus kuolemaan johtavia reaktioita (mukaan lukien hypertermia, jäykkyys, myoklonus, autonominen epävakaus ja mahdolliset elintoimintojen nopeat vaihtelut sekä mielentilan muutoksia, joihin kuuluu äärimmäinen kiihtymys, joka etenee deliriumiksi ja kooma), kun niitä käytetään yhdessä MAO:n estäjän kanssa. Joissakin tapauksissa esiintyi pahanlaatuista neuroleptisyndroomaa muistuttavia piirteitä. Tällaisia reaktioita voi esiintyä, kun näitä lääkkeitä annetaan samanaikaisesti tai niiden välittömässä läheisyydessä [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Kapeakulmaglaukooma
Kliinisissä tutkimuksissa STRATTERAn käyttöön liittyi lisääntynyt mydriaasin riski, joten sen käyttöä ei suositella potilaille, joilla on kapeakulmaglaukooma.
Feokromosytooma
Vakavia reaktioita, mukaan lukien kohonnut verenpaine ja takyarytmia, on raportoitu STRATTERAa saaneilla potilailla, joilla on feokromosytooma tai joilla on aiemmin ollut feokromosytooma. Siksi STRATTERA 18 mg -valmistetta ei tule käyttää potilaiden, joilla on feokromosytooma tai joilla on aiemmin ollut feokromosytooma.
Vakavat sydän- ja verisuonihäiriöt
STRATTERA 40 mg:aa ei pidä käyttää potilailla, joilla on vakavia sydän- tai verisuonisairauksia, joiden tilan odotetaan heikkenevän, jos heillä on kliinisesti merkittävää verenpaineen tai sykkeen nousua (esimerkiksi 15-20 mmHg verenpaine tai 20 lyöntiä minuutissa sykkeessä). [Katso VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Tarkkaa mekanismia, jolla atomoksetiini tuottaa terapeuttisia vaikutuksiaan tarkkaavaisuus-/hyperaktiivisuushäiriössä (ADHD), ei tunneta, mutta sen uskotaan liittyvän presynaptisen norepinefriinin kuljettajan selektiiviseen estoon, kuten on määritetty ex vivo -otto- ja välittäjäaineiden ehtymistä koskevissa tutkimuksissa. .
Farmakodynamiikka
Atomoksetiiniannoksia (0,5, 1,2 tai 1,8 mg/kg/vrk) tai lumelääkettä käsittävä altistus-vaste-analyysi osoitti, että atomoksetiinialtistus korreloi tehon kanssa mitattuna tarkkaavaisuus-/hyperaktiivisuushäiriöiden arviointiasteikolla-IV-Vanhemman versiolla. teki maalin. Altistuksen ja tehon välinen suhde oli samanlainen kuin annoksen ja tehon välillä havaittu suhde, jossa mediaanialtistus kahdella suurimmalla annoksella johti lähes maksimaalisiin muutoksiin lähtötasosta [ks. Kliiniset tutkimukset ].
Sydämen elektrofysiologia
STRATTERAn vaikutusta QTc-ajan pidentymiseen arvioitiin satunnaistetussa, kaksoissokkoutetussa, positiivisessa (moksifloksasiini 400 mg) ja lumekontrolloidussa ristikkäistutkimuksessa terveillä miespuolisilla CYP2D6:n heikoilla metaboloijilla. Yhteensä 120 terveelle henkilölle annettiin STRATTERAa (20 mg ja 60 mg) kahdesti päivässä 7 päivän ajan. Tutkimuksessa ei havaittu suuria muutoksia QTc-välissä (eli nousua > 60 ms lähtötasosta, absoluuttinen QTc > 480 ms). Pieniä QTc-ajan muutoksia ei kuitenkaan voida sulkea pois nykyisestä tutkimuksesta, koska tutkimus ei osoittanut määrityksen herkkyyttä. QTc-aika piteni hieman atomoksetiinipitoisuuden lisääntyessä.
Farmakokinetiikka
Atomoksetiini imeytyy hyvin suun kautta annetun annon jälkeen, ja ruoka vaikuttaa siihen hyvin vähän. Se eliminoituu ensisijaisesti oksidatiivisen aineenvaihdunnan kautta sytokromi P450 2D6 (CYP2D6) -entsymaattisen reitin ja sitä seuraavan glukuronidaation kautta. Atomoksetiinin puoliintumisaika on noin 5 tuntia. Osa väestöstä (noin 7 % valkoihoisista ja 2 % afroamerikkalaisista) on CYP2D6:n metaboloituvien lääkkeiden heikkoja metaboloijia (PM). Näillä henkilöillä on heikentynyt aktiivisuus tällä reitillä, mikä johtaa 10 kertaa korkeampiin AUC-arvoihin, 5 kertaa korkeampiin huippupitoisuuksiin plasmassa ja hitaampiin atomoksetiinin eliminaatioon (puoliintumisaika plasmassa noin 24 tuntia) verrattuna ihmisiin, joilla on normaali aktiivisuus [laajuiset metaboloijat (EM:t) )]. CYP2D6:ta estävät lääkkeet, kuten fluoksetiini, paroksetiini ja kinidiini, lisäävät samanlaista altistumista.
Atomoksetiinin farmakokinetiikkaa on arvioitu yli 400 lapsella ja nuorella valikoiduissa kliinisissä tutkimuksissa, joissa on käytetty pääasiassa populaatiofarmakokineettisiä tutkimuksia. Yksittäisiä kerta-annos- ja vakaan tilan farmakokineettisiä tietoja saatiin myös lapsista, nuorista ja aikuisista. Kun annokset normalisoitiin arvoon mg/kg, samanlaiset puoliintumisajat, Cmax- ja AUC-arvot havaittiin lapsilla, nuorilla ja aikuisilla. Myös puhdistuma ja jakautumistilavuus ruumiinpainon mukauttamisen jälkeen olivat samanlaiset.
Imeytyminen ja jakautuminen
Atomoksetiini imeytyy nopeasti oraalisen annon jälkeen, ja absoluuttinen hyötyosuus on noin 63 % EM:issä ja 94 % PM:issä. Plasman huippupitoisuudet (Cmax) saavutetaan noin 1-2 tunnin kuluttua annostelusta.
STRATTERA 18 mg voidaan ottaa ruoan kanssa tai ilman. STRATTERAn anto tavallisen runsasrasvaisen aterian kanssa ei vaikuttanut atomoksetiinin oraalisen imeytymisen laajuuteen (AUC), mutta hidasti imeytymisnopeutta, mikä johti 37 % pienempään Cmax:iin ja viivästytti Tmax-arvoa 3 tunnilla. Lapsilla ja nuorilla tehdyissä kliinisissä tutkimuksissa STRATTERAn anto ruoan kanssa johti 9 % pienempään Cmax:iin.
Vakaan tilan jakautumistilavuus laskimonsisäisen annon jälkeen on 0,85 l/kg, mikä osoittaa, että atomoksetiini jakautuu ensisijaisesti koko kehon veteen. Jakaantumistilavuus on samanlainen potilaan painoalueella, kun paino on normalisoitunut.
Terapeuttisilla pitoisuuksilla 98 % plasman atomoksetiinista sitoutuu proteiineihin, pääasiassa albumiiniin.
Aineenvaihdunta ja eliminaatio
Atomoksetiini metaboloituu ensisijaisesti CYP2D6-entsymaattisen reitin kautta. Ihmisillä, joilla on vähentynyt aktiivisuus tällä reitillä (PM), on korkeammat plasman atomoksetiinipitoisuudet verrattuna ihmisiin, joilla on normaali aktiivisuus (EM). PM:illä atomoksetiinin AUC on noin 10-kertainen ja Css, max noin 5 kertaa suurempi kuin EM:ien. Laboratoriokokeita on saatavilla CYP2D6-PM:iden tunnistamiseksi. STRATTERA:n samanaikainen anto voimakkaiden CYP2D6:n estäjien, kuten fluoksetiinin, paroksetiinin tai kinidiinin kanssa, lisää merkittävästi plasman atomoksetiinialtistusta, ja annostuksen muuttaminen saattaa olla tarpeen [ks. VAROITUKSET JA VAROTOIMET ]. Atomoksetiini ei estänyt tai indusoinut CYP2D6-reittiä.
Pääasiallinen muodostunut oksidatiivinen metaboliitti CYP2D6-statuksesta riippumatta on 4-hydroksiatomoksetiini, joka on glukuronidoitunut. 4-Hydroksiatomoksetiini on ekvipotentti atomoksetiinin kanssa norepinefriinin kuljettajan inhibiittorina, mutta kiertää plasmassa paljon pienemmillä pitoisuuksilla (1 % atomoksetiinipitoisuudesta EM:issä ja 0,1 % atomoksetiinipitoisuudesta PM:issä). 4-hydroksiatomoksetiinia muodostaa ensisijaisesti CYP2D6, mutta PM:issä useat muut sytokromi P450 -entsyymit muodostavat 4-hydroksiatomoksetiinia hitaammin. N-desmetyyliatomoksetiinia muodostavat CYP2C19 ja muut sytokromi P450 -entsyymit, mutta sillä on huomattavasti vähemmän farmakologista aktiivisuutta verrattuna atomoksetiiniin ja se kiertää plasmassa pienemmillä pitoisuuksilla (5 % atomoksetiinipitoisuudesta EM:issä ja 45 % atomoksetiinipitoisuudesta PM:issä).
Atomoksetiinin keskimääräinen näennäinen plasmapuhdistuma suun kautta annon jälkeen aikuisilla EM-potilailla on 0,35 l/h/kg ja keskimääräinen puoliintumisaika on 5,2 tuntia. Kun atomoksetiinia on annettu suun kautta PM:ille, keskimääräinen näennäinen plasmapuhdistuma on 0,03 l/h/kg ja keskimääräinen puoliintumisaika on 21,6 tuntia. PM:illä atomoksetiinin AUC on noin 10-kertainen ja Css, max noin 5 kertaa suurempi kuin EM:ien. 4-hydroksiatomoksetiinin eliminaation puoliintumisaika on samanlainen kuin N-desmetyyliatomoksetiinin (6-8 tuntia) EM-potilailla, kun taas N-desmetyyliatomoksetiinin puoliintumisaika on paljon pidempi PM-potilailla (34-40 tuntia).
Atomoksetiini erittyy pääasiassa 4-hydroksiatomoksetiini-O-glukuronidina, pääasiassa virtsaan (yli 80 % annoksesta) ja vähemmässä määrin ulosteeseen (alle 17 % annoksesta). Vain pieni osa STRATTERA 40 mg:n annoksesta erittyy muuttumattomana atomoksetiinina (alle 3 % annoksesta), mikä viittaa laajaan biotransformaatioon.
[Katso Käyttö tietyissä populaatioissa ].
Kliiniset tutkimukset
ADHD-tutkimukset lapsilla ja nuorilla
Akuutit tutkimukset
STRATTERA 40 mg:n teho ADHD:n hoidossa vahvistettiin neljässä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa lapsipotilailla (ikä 6–18). Noin kolmasosa potilaista täytti DSM-IV:n kriteerit huomaamattomalle alatyypille ja kaksi kolmasosaa täytti sekä tarkkaavaisuuden että hyperaktiivisen/impulsiivisen alatyypin kriteerit.
ADHD:n merkit ja oireet arvioitiin vertaamalla keskimääräistä muutosta lähtötilanteesta päätepisteeseen STRATTERA- ja lumelääkettä saaneilla potilailla käyttämällä ensisijaisen tulosmitan hoitoaikeusanalyysiä, jonka tutkija antoi ja pisteytti ADHD-arviointiasteikon IV. Parent Version (ADHDRS) kokonaispistemäärä, mukaan lukien hyperaktiivinen/impulsiivinen ja tarkkaavaisuus ala-asteikot. Jokainen ADHDRS:n kohde liittyy suoraan yhteen ADHD:n oirekriteeriin DSM-IV:ssä.
Tutkimuksessa 1, 8 viikkoa kestäneessä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, annosvasteellisessa akuutissa hoitotutkimuksessa 8–18-vuotiailla lapsilla ja nuorilla (N=297), potilaat saivat joko kiinteän annoksen STRATTERAa (0,5, 1,2 tai 1,8 mg/kg/vrk) tai lumelääkettä. STRATTERA 10 mg annettiin jaettuna annoksena aikaisin aamulla ja myöhään iltapäivällä/varhain illalla. Kahdella suuremmalla annoksella ADHD-oireiden paraneminen oli tilastollisesti merkitsevästi parempi STRATTERA-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin ADHDRS-asteikolla mitattuna. STRATTERA 25 mg:n annos 1,8 mg/kg/vrk ei tuonut lisähyötyä verrattuna annoksella 1,2 mg/kg/vrk. STRATTERA-annos 0,5 mg/kg/vrk ei ollut lumelääkettä parempi.
Tutkimuksessa 2, 6 viikkoa kestäneessä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, akuutissa hoitotutkimuksessa 6–16-vuotiailla lapsilla ja nuorilla (N=171), potilaat saivat joko 40 mg STRATTERAa tai lumelääkettä. STRATTERA annettiin kerta-annoksena aikaisin aamulla ja titrattiin painon mukaan kliinisen vasteen mukaan enimmäisannokseen 1,5 mg/kg/vrk. STRATTERA 10 mg:n keskimääräinen lopullinen annos oli noin 1,3 mg/kg/vrk. ADHD-oireet paranivat tilastollisesti merkitsevästi STRATTERA-ryhmässä lumelääkkeeseen verrattuna ADHDRS-asteikolla mitattuna. Tämä tutkimus osoittaa, että STRATTERA on tehokas, kun sitä annetaan kerran päivässä aamulla.
Kahdessa identtisessä, 9 viikkoa kestäneessä, akuutissa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 7–13-vuotiailla lapsilla (tutkimus 3, N = 147; tutkimus 4, N = 144), STRATTERAa 40 mg ja metyylifenidaattia verrattiin lumelääkkeeseen. . STRATTERA 18 mg annettiin jaettuna annoksena aikaisin aamulla ja myöhään iltapäivällä (koulun jälkeen) ja titrattiin painon mukaan mukautettuna kliinisen vasteen mukaan. Suurin suositeltu STRATTERA-annos oli 2,0 mg/kg/vrk. Keskimääräinen lopullinen STRATTERA-annos 18 mg molemmissa tutkimuksissa oli noin 1,6 mg/kg/vrk. Molemmissa tutkimuksissa ADHD-oireet paranivat tilastollisesti merkitsevästi enemmän STRATTERA 10 mg:lla kuin lumelääkkeellä ADHDRS-asteikolla mitattuna.
Sukupuolen ja iän (
Kunnossapitotutkimus
STRATTERA 18 mg:n tehokkuus ADHD:n ylläpitohoidossa vahvistettiin avohoitotutkimuksessa lapsilla ja nuorilla (6-15-vuotiaat). Potilaat, jotka täyttivät ADHD:n DSM-IV-kriteerit ja jotka osoittivat jatkuvaa vastetta noin 4 viikon ajan ensimmäisessä 10 viikon avoimessa STRATTERA-hoitovaiheessa (1,2–1,8 mg/kg/vrk), satunnaistettiin jatkamaan nykyistä STRATTERA-annostaan (N). = 292) tai lumelääkettä (N = 124) kaksoissokkohoidon aikana uusiutumisen havainnointiin. Avoimen vaiheen vaste määriteltiin CGI-ADHD-S-pisteiksi ≤2 ja vähintään 25 %:n alenemiseksi lähtötasosta ADHDRS-IV-Parent:Inv-kokonaispisteissä. Potilaat, joille määrättiin STRATTERA ja jotka osoittivat jatkuvaa vastetta noin 8 kuukauden ajan ensimmäisen kaksoissokkohoitovaiheen aikana, satunnaistettiin jälleen jatkamaan nykyistä STRATTERA-annosta (N = 81) tai lumelääkettä (N = 82) kaksoissokkoutettuna. hoitoon uusiutumisen havainnointiin. Relapsi kaksoissokkovaiheen aikana määriteltiin CGI-ADHD-S-pisteiden lisäykseksi vähintään 2:lla avoimen vaiheen lopusta ja ADHDRS-IV-Parent:Inv-kokonaispisteet palasivat ≥ 90 %:iin tutkimuksen tulopisteistä 2:lla. peräkkäisiä käyntejä. Molemmissa kaksoissokkoutetuissa vaiheissa STRATTERA-hoitoa jatkaneet potilaat kokivat merkittävästi pidempään relapsivaiheessa kuin lumelääkettä saaneilla potilailla.
ADHD-tutkimukset aikuisilla
STRATTERAn tehokkuus ADHD:n hoidossa vahvistettiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa aikuispotilailla, vähintään 18-vuotiaat ja jotka täyttivät ADHD:n DSM-IV-kriteerit.
ADHD:n merkit ja oireet arvioitiin käyttämällä tutkijan antamaa Conners Adult ADHD Rating Scale Screening Version (CAARS) -skaalaa, joka on 30 pisteen asteikko. Ensisijainen tehokkuuden mitta oli 18 kohdan ADHD-oireiden kokonaispistemäärä (CAARS:n tarkkaamattomuuden ja hyperaktiivisuuden/impulsiivisuuden ala-asteikkojen summa), joka arvioitiin vertaamalla keskimääräistä muutosta lähtötilanteesta päätepisteeseen käyttämällä intent-to-treat -analyysiä.
Kahdessa identtisessä, 10 viikon, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa akuutin hoitotutkimuksessa (tutkimus 5, N = 280; tutkimus 6, N = 256), potilaat saivat joko 25 mg STRATTERAa tai lumelääkettä. STRATTERA annettiin jaettuna annoksena aikaisin aamulla ja myöhään iltapäivällä/varhain illalla ja titrattiin kliinisen vasteen mukaan välillä 60–120 mg/vrk. Keskimääräinen lopullinen STRATTERA-annos 40 mg molemmissa tutkimuksissa oli noin 95 mg/vrk. Molemmissa tutkimuksissa ADHD-oireet paranivat tilastollisesti merkitsevästi STRATTERA-tutkimuksessa, mitattuna ADHD-oirepisteellä CAARS-asteikosta.
Populaatioalaryhmien sukupuolen ja iän (
POTILASTIEDOT
STRATTERA® (Stra-TAIR-a) (atomoksetiini) Kapselit
Lue STRATTERAn® mukana tuleva lääkitysopas ennen kuin sinä tai lapsesi aloitat sen ottamisen ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa sitä, että keskustelet lääkärisi kanssa hoidostasi tai lapsesi STRATTERA-hoidosta.
Mikä on tärkein tieto, joka minun pitäisi tietää STRATTERA 18mg:sta?
Seuraavia on raportoitu STRATTERAn käytön yhteydessä:
Lapset ja teini-ikäiset ajattelevat joskus itsemurhaa, ja monet kertovat yrittäneensä tappaa itsensä. Tulokset STRATTERAn kliinisistä tutkimuksista yli 2200 lapsen tai teini-ikäisen ADHD-potilaan kanssa viittaavat siihen, että joillakin lapsilla ja teini-ikäisillä voi olla suurempi mahdollisuus saada itsetuhoisia ajatuksia tai toimia. Vaikka näissä tutkimuksissa ei tapahtunut itsemurhia, neljälle 1000 potilaasta kehittyi itsemurha-ajatuksia. Kerro lapsesi tai teini-ikäisen lääkärille, jos lapsesi tai teini-ikäinen (tai suvussasi on:
- sinulla on kaksisuuntainen mielialahäiriö (maanis-depressiivinen sairaus)
- oli itsemurha-ajatuksia tai -toimia ennen STRATTERAn aloittamista
Itsemurha-ajatusten ja -toimien mahdollisuus voi olla suurempi:
- varhain STRATTERA 10 mg -hoidon aikana
- annoksen säätämisen aikana
Estä itsemurha-ajatukset ja -toimet lapsessasi tai teini-ikäisessä:
- kiinnitä erityistä huomiota lapsesi tai teini-ikäisen mielialaan, käyttäytymiseen, ajatuksiin ja tunteisiin STRATTERA 25 mg -hoidon aikana
- pitää kaikki seurantakäynnit lapsesi tai teini-ikäisen lääkärin kanssa aikataulun mukaisesti
Tarkkaile seuraavia merkkejä lapsessasi tai teini-ikäisessä STRATTERA 25 mg -hoidon aikana:
- ahdistusta
- agitaatiota
- paniikkikohtaukset
- nukahtamisvaikeuksia
- ärtyneisyys
- vihamielisyys
- aggressiivisuus
- impulsiivisuus
- levottomuus
- mania
- masennus
- itsemurha-ajatuksia
Soita lapsesi tai teini-ikäisen lääkärille välittömästi, jos heillä on jokin yllä olevista merkeistä, varsinkin jos ne ovat uusia, äkillisiä tai vakavia. Lapsesi tai teini-ikäinen voi joutua tarkkailemaan tarkasti itsemurha-ajatusten ja -tekojen varalta tai tarvitsemaan lääketieteellisen muutoksen.
STRATTERA voi aiheuttaa maksavaurion joillekin potilaille. Soita lääkärillesi välittömästi, jos sinulla on lapsellasi seuraavia maksaongelmia:
- kutina
- oikean ylävatsan kipu
- tumma virtsa
- keltainen iho tai silmät
- selittämättömiä flunssan kaltaisia oireita
- äkillinen kuolema potilailla, joilla on sydänongelmia tai sydänvikoja
- aivohalvaus ja sydänkohtaus aikuisilla
- kohonnut verenpaine ja syke
Kerro lääkärillesi, jos sinulla tai lapsellasi on sydänongelmia, sydänvikoja, korkea verenpaine tai suvussa on esiintynyt näitä ongelmia. Lääkärisi tulee tarkistaa sinun tai lapsesi huolellisesti sydänongelmien varalta ennen STRATTERAn aloittamista.
Lääkärisi tulee tarkistaa verenpaineesi tai lapsesi verenpaine ja syke säännöllisesti STRATTERA-hoidon aikana.
Soita lääkärillesi välittömästi, jos sinulla tai lapsellasi on merkkejä sydänongelmista, kuten rintakipu, hengenahdistus tai pyörtyminen STRATTERA-hoidon aikana.
- uudet psykoottiset oireet (kuten äänien kuuleminen, epätodeksi uskominen, epäilykset) tai uudet maaniset oireet
Soita lapsesi tai teini-ikäisen lääkärille välittömästi uusista mielenterveysoireista koska STRATTERA 40 mg -hoidon säätämistä tai lopettamista saattaa olla tarpeen harkita.
Mikä on STRATTERA 18mg?
STRATTERA on selektiivinen norepinefriinin takaisinoton estäjä. Sitä käytetään tarkkaavaisuuden ja hyperaktiivisuushäiriön (ADHD) hoitoon. STRATTERA voi auttaa lisäämään huomiota ja vähentämään impulsiivisuutta ja yliaktiivisuutta potilailla, joilla on ADHD.
STRATTERA 10 mg tulee käyttää osana ADHD:n kokonaishoitoa, joka voi sisältää neuvontaa tai muita hoitoja.
STRATTERAa ei ole tutkittu alle 6-vuotiailla lapsilla.
Kuka ei saa ottaa STRATTERAa?
STRATTERAa ei tule ottaa, jos sinä tai lapsesi:
- käytät tai olet käyttänyt viimeisten 14 päivän aikana masennuslääkettä, jota kutsutaan monoamiinioksidaasin estäjäksi tai MAOI:ksi. Jotkut MAOI-lääkkeiden nimet ovat Nardil® (feneltsiinisulfaatti), Parnate® (tranyylisypromiinisulfaatti) ja Emsam® (selegiliini transdermaalinen järjestelmä).
- sinulla on silmäongelma, jota kutsutaan kapeakulmaglaukoomaksi
- ovat allergisia jollekin STRATTERA-aineesta. Katso tämän lääkitysoppaan lopusta täydellinen luettelo ainesosista.
- sinulla on tai on ollut harvinainen kasvain nimeltä feokromosytooma.
STRATTERA ei ehkä ole oikea sinulle tai lapsellesi. Ennen kuin aloitat STRATTERA-hoidon, kerro lääkärillesi tai lapsesi lääkärille kaikista terveystiloista (tai suvussa esiintyvistä sairauksista), mukaan lukien:
- sinulla on tai on ollut itsemurha-ajatuksia tai -toimia
- sydänvaivoja, sydänvikoja, epäsäännöllistä sydämen sykettä, korkeaa verenpainetta tai matalaa verenpainetta
- mielenterveysongelmia, psykoosia, maniaa, kaksisuuntaista mielialahäiriötä tai masennusta
- maksaongelmat Kerro lääkärillesi, jos sinä tai lapsesi olet raskaana, suunnittelet raskautta tai imetät.
Voidaanko STRATTERAa ottaa muiden lääkkeiden kanssa?
Kerro lääkärillesi kaikista lääkkeistä, joita sinä tai lapsesi käytät, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. STRATTERA ja jotkut lääkkeet voivat olla vuorovaikutuksessa keskenään ja aiheuttaa vakavia sivuvaikutuksia. Lääkärisi päättää, voidaanko STRATTERAa ottaa muiden lääkkeiden kanssa.
Kerro lääkärillesi erityisesti, jos sinä tai lapsesi otat:
- astmalääkkeet
- masennuslääkkeet, mukaan lukien MAO-estäjät
- verenpainelääkkeet
- nuha- tai allergialääkkeet, jotka sisältävät dekongestantteja
Tunne lääkkeet, joita sinä tai lapsesi käytät. Pidä mukanasi luettelo lääkkeistäsi näytettäväksi lääkärillesi ja apteekkiin.
Älä aloita mitään uutta lääkettä STRATTERA-hoidon aikana keskustelematta ensin lääkärin kanssa.
Miten STRATTERA tulee ottaa?
- Ota STRATTERA 40 mg juuri niin kuin on määrätty. STRATTERA 18mg on saatavana eri annosvahvuuksina kapseleina. Lääkärisi voi muuttaa annosta, kunnes se sopii sinulle tai lapsellesi.
- Älä pureskele, murskaa tai avaa kapseleita. Niele STRATTERA-kapselit kokonaisina veden tai muiden nesteiden kanssa. Kerro lääkärillesi, jos sinä tai lapsesi ei pysty nielemään STRATTERA 10 mg -valmistetta kokonaisena. Saatat joutua määräämään toisen lääkkeen.
- Vältä koskemasta rikkoutuneeseen STRATTERA 18 mg kapseliin. Pese kädet ja pinnat, jotka koskettivat avointa STRATTERA 10 mg kapselia. Jos jauheesta joutuu silmiisi tai lapsesi silmiin, huuhtele ne heti vedellä ja ota yhteys lääkäriin.
- STRATTERA voidaan ottaa ruoan kanssa tai ilman.
- STRATTERA 10 mg otetaan yleensä kerran tai kahdesti päivässä. Ota STRATTERA 25 mg samaan aikaan joka päivä auttaaksesi sinua muistamaan. Jos unohdat ottaa STRATTERA-annoksen, ota se heti kun muistat kyseisen päivän. Jos unohdat ottaa STRATTERA 10 mg -annoksen, älä kaksinkertaista annosta seuraavana päivänä. Ohita vain päivä, jolloin unohdat.
- Ajoittain lääkärisi voi keskeyttää STRATTERA 25 mg -hoidon joksikin aikaa tarkistaakseen ADHD-oireet.
- Lääkärisi voi tarkistaa säännöllisesti veren, sydämen ja verenpaineen STRATTERA-hoidon aikana. Lasten pituus ja paino tulee tarkistaa usein STRATTERA-hoidon aikana. STRATTERA-hoito voidaan lopettaa, jos näiden tarkastusten aikana havaitaan ongelma.
- Jos sinä tai lapsesi otat liikaa STRATTERAa tai yliannostuksen, soita heti lääkärillesi tai myrkytystietokeskukseen tai hakeudu ensiapuun.
Mitkä ovat STRATTERAn mahdolliset sivuvaikutukset?
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää STRATTERA 10mg:sta?" tietoa raportoiduista itsemurha-ajatuksista ja -toimista, muista mielenterveysongelmista, vakavista maksavaurioista ja sydänongelmista.
Muita vakavia sivuvaikutuksia ovat:
- vakavat allergiset reaktiot (soita lääkärillesi, jos sinulla on hengitysvaikeuksia, näet turvotusta tai nokkosihottumaa tai koet muita allergisia reaktioita)
- kasvun hidastuminen (pituus ja paino) lapsilla
- virtsaamisongelmat mukaan lukien
- ongelmia virtsavirran käynnistämisessä tai pitämisessä
- ei pysty tyhjentämään rakkoa kokonaan
Yleisiä sivuvaikutuksia lapsilla ja nuorilla ovat:
- ärtynyt vatsa
- vähentynyt ruokahalu
- pahoinvointia tai oksentelua
- huimaus
- väsymys
- mielialan vaihtelut
Yleisiä sivuvaikutuksia aikuisilla ovat:
- ummetus
- kuiva suu
- pahoinvointi
- vähentynyt ruokahalu
- huimaus
- seksuaalisia sivuvaikutuksia
- virtsaamisongelmat
Muita tietoja lapsille, nuorille ja aikuisille:
- Erektiota, joka ei häviä (priapismi), on esiintynyt harvoin STRATTERA-hoidon aikana. Jos sinulla on yli 4 tuntia kestävä erektio, hakeudu välittömästi lääkärin hoitoon. Koska priapismi voi aiheuttaa pysyviä vaurioita, mukaan lukien mahdollinen erektiokyvyttömyys, lääkärin on arvioitava priapismi välittömästi.
- STRATTERA 10 mg voi vaikuttaa kykyysi tai lapsesi kykyyn ajaa autoa tai käyttää raskaita koneita. Ole varovainen, kunnes tiedät, kuinka STRATTERA 25 mg vaikuttaa sinuun tai lapseesi.
- Keskustele lääkärisi kanssa, jos sinulla tai lapsellasi on haittavaikutuksia, jotka ovat häiritseviä tai eivät häviä.
Tämä ei ole täydellinen luettelo mahdollisista sivuvaikutuksista. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää STRATTERA?
- Säilytä STRATTERAa turvallisessa paikassa huoneenlämmössä, 59 - 86 °F (15 - 30 °C).
- Pidä STRATTERA 40 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä STRATTERAsta
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä STRATTERA 25 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna STRATTERAa muille ihmisille, vaikka heillä olisi sama sairaus. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä STRATTERA-tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä lääkäriltäsi tai apteekista lisätietoja STRATTERAsta, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja STRATTERAsta saat soittamalla numeroon 1-800-Lilly-Rx (1-800-545-5979) tai käymällä osoitteessa www.strattera.com.
Mitä ainesosia STRATTERA 40mg sisältää?
Aktiivinen ainesosa: atomoksetiinihydrokloridi.
Inaktiiviset ainesosat: esigelatinoitu tärkkelys, dimetikoni, gelatiini, natriumlauryylisulfaatti, FD&CBlue No. 2, synteettinen keltainen rautaoksidi, titaanidioksidi, punainen rautaoksidi ja syötävä musta muste.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
