Clozaril 25mg, 50mg, 100mg Clozapine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Clozaril on ja miten sitä käytetään?
Clozaril 100mg on reseptilääke, jota käytetään skitsofrenian oireiden hoitoon. Clozaril 50 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Clozaril 100 mg kuuluu lääkeryhmään nimeltä 2. sukupolven psykoosilääkkeet.
Ei tiedetä, onko Clozaril 25 mg turvallinen ja tehokas lapsille.
Mitkä ovat Clozarilin mahdolliset sivuvaikutukset?
Clozaril voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- heikkous,
- kuume,
- turvonneet ikenet,
- kipeä kurkku,
- tuskalliset suun haavaumat,
- kipua nieltäessä,
- ihohaavat,
- vilustumisen tai flunssan oireet,
- yskä,
- vaikeuksia hengittää,
- huulten, kielen, silmien, kasvojen, käsivarsien tai jalkojen hallitsemattomat lihasliikkeet,
- päänsärky, johon liittyy rintakipua ja voimakasta huimausta,
- sykkivät sydämenlyönnit,
- lepattaa rinnassasi,
- huimaus,
- äkillinen yskä,
- nopea hengitys,
- yskii verta,
- kireä tunne niskassa tai leuassa,
- nykiminen tai hallitsemattomat lihasliikkeet,
- kohtaus (tummuus tai kouristukset),
- vähän tai ei ollenkaan virtsaamista,
- turvotus jaloissasi tai nilkoissasi,
- väsymys,
- hengenahdistus,
- pahoinvointi,
- ylävatsakipu,
- ruokahalun menetys,
- epätavallinen verenvuoto,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- erittäin jäykät (jäykät) lihakset,
- korkea kuume,
- hikoilu,
- hämmennystä,
- nopeat tai epätasaiset sydämenlyönnit,
- vapina,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- nälkä,
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- uneliaisuus,
- kuiva iho,
- näön hämärtyminen,
- painonpudotus,
- helppo mustelma tai verenvuoto,
- vaikea pistely tai puutuminen,
- lihas heikkous,
- ylävatsakipu,
- rintakipu,
- uusi tai paheneva yskä ja
- vaikeuksia hengittää
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Clozarilin yleisimpiä sivuvaikutuksia ovat:
- painonnousu,
- vapina,
- huimaus,
- pyörivä tunne,
- päänsärky,
- uneliaisuus,
- pahoinvointi,
- ummetus,
- kuiva suu,
- lisääntynyt syljeneritys,
- näön hämärtyminen,
- nopea syke ja
- lisääntynyt hikoilu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Clozarilin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VAKAVA NEUTROPENIA; ORTOSTAATTINEN HYPOTENSIO, BRADYCARDIA JA SYNKOOPPI; TAVARAKKO; Sydänlihastulehdus ja kardiomyopatia; DEMENTIAAN LIITTYVÄÄ psykoosia sairastavien iäkkäiden potilaiden lisääntynyt kuolleisuus
Vaikea neutropenia
CLOZARIL-hoito on aiheuttanut vaikeaa neutropeniaa, joka määritellään absoluuttiseksi neutrofiilimääräksi (ANC) alle 500/μl. Vaikea neutropenia voi johtaa vakavaan infektioon ja kuolemaan. Ennen CLOZARIL-hoidon aloittamista ANC:n lähtötason on oltava vähintään 1500/μl väestössä; ja sen on oltava vähintään 1000/μl potilailla, joilla on dokumentoitu hyvänlaatuinen etninen neutropenia (BEN). Hoidon aikana potilaita on seurattava säännöllisesti ANC:n kanssa. Neuvo potilaita ilmoittamaan välittömästi oireista, jotka liittyvät vakavaan neutropeniaan tai infektioon (esim. kuume, heikkous, letargia tai kurkkukipu) [katso ANNOSTUS JA ANNOSTUS sekä VAROITUKSET JA VAROTOIMET].
Vaikean neutropenian riskin vuoksi CLOZARIL on saatavilla vain rajoitetun ohjelman kautta, joka kuuluu riskinarviointistrategiaan (REMS), nimeltään Clozapine REMS -ohjelma. [katso VAROITUKSET JA VAROTOIMET].
Ortostaattinen hypotensio, bradykardia, pyörtyminen
CLOZARIL-hoidon yhteydessä on esiintynyt ortostaattista hypotensiota, bradykardiaa, pyörtymistä ja sydämenpysähdystä. Riski on suurin alkutitrausjakson aikana, erityisesti kun annosta nostetaan nopeasti. Nämä reaktiot voivat ilmaantua ensimmäisellä annoksella, niinkin pienillä annoksilla kuin 12,5 mg vuorokaudessa. Aloita hoito annoksella 12,5 mg kerran tai kahdesti päivässä; titraa hitaasti; ja käytä jaettuja annoksia. Käytä CLOZARIL-valmistetta varoen potilailla, joilla on sydän- tai aivoverenkiertosairaus tai hypotensiolle altistavia tiloja (esim. nestehukka, verenpainelääkkeiden käyttö) [ks.
Kohtaukset
Kohtauksia on esiintynyt CLOZARIL 25 mg -hoidon aikana. Riski on annoksesta riippuvainen. Aloita hoito annoksella 12,5 mg, titraa asteittain ja käytä jaettua annostusta. Noudata varovaisuutta, kun annat CLOZARIL 50 mg -valmistetta potilaille, joilla on ollut kouristuskohtauksia tai muita kohtauksille altistavia riskitekijöitä (keskushermoston patologia, kohtauskynnystä alentavat lääkkeet, alkoholin väärinkäyttö). Varo potilaita ryhtymästä sellaiseen toimintaan, jossa äkillinen tajunnan menetys voi aiheuttaa vakavan riskin itselleen tai muille [katso ANNOSTUS JA ANTO, VAROITUKSET JA VAROTOIMET].
Sydänlihastulehdus ja kardiomyopatia
CLOZARIL-hoidon yhteydessä on esiintynyt kuolemaan johtanutta sydänlihastulehdusta ja kardiomyopatiaa. Lopeta CLOZARIL 25 mg:n käyttö ja suorita sydänarviointi, jos epäilet näitä reaktioita. Yleensä klozariiliin liittyvää sydänlihastulehdusta tai kardiomyopatiaa sairastaville potilaille ei saa antaa uudelleen CLOZARIL-hoitoa. Harkitse sydänlihastulehduksen tai kardiomyopatian mahdollisuutta, jos rintakipua, takykardiaa, sydämentykytys, hengenahdistusta, kuumetta, flunssan kaltaisia oireita, hypotensiota tai EKG-muutoksia esiintyy [katso VAROITUKSET JA VAROTOIMET].
Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. CLOZARIL-valmistetta ei ole hyväksytty käytettäväksi potilailla, joilla on dementiaan liittyvä psykoosi (ks. VAROITUKSET JA VAROTOIMET).
KUVAUS
CLOZARIL® (klotsapiini), epätyypillinen psykoosilääke, on trisyklinen dibentsodiatsepiinijohdannainen, 8-kloori-11-(4-metyyli-1-piperatsinyyli)-5H-dibentso[b,e] [1,4]-diatsepiini. Rakennekaava on
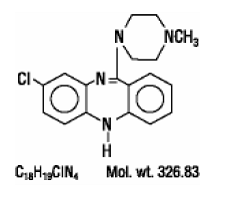
CLOZARIL on saatavana vaaleankeltaisina 25 mg:n ja 100 mg:n tabletteina suun kautta annettavaksi.
Aktiivinen ainesosa: klotsapiini
Inaktiiviset ainesosat ovat kolloidinen piidioksidi, laktoosi, magnesiumstearaatti, povidoni, tärkkelys (maissi) ja talkki.
INDIKAATIOT
Hoitoa kestävä skitsofrenia
CLOZARIL 50 mg on tarkoitettu sellaisten vaikeasti sairaiden skitsofreniapotilaiden hoitoon, jotka eivät reagoi riittävästi tavanomaiseen antipsykoottiseen hoitoon. Vaikean neutropenian ja sen käyttöön liittyvien kohtausten riskin vuoksi CLOZARILIA tulee käyttää vain potilaille, jotka eivät ole reagoineet riittävästi tavanomaiseen antipsykoottiseen hoitoon (ks. VAROITUKSET JA VAROTOIMET ].
CLOZARILin tehokkuus hoitoresistentissä skitsofrenian hoidossa osoitettiin 6 viikkoa kestäneessä, satunnaistetussa kaksoissokkoutetussa, aktiivisesti kontrolloidussa tutkimuksessa, jossa verrattiin CLOZARILIA ja klooripromatsiinia potilailla, joille muut psykoosilääkkeet eivät olleet tehonneet [ks. Kliiniset tutkimukset ].
Toistuvan itsemurhakäyttäytymisen riskin vähentäminen skitsofreniassa tai skitsoaffektiivisessa häiriössä
CLOZARIL on tarkoitettu vähentämään toistuvan itsemurhakäyttäytymisen riskiä skitsofreniaa tai skitsoaffektiivista häiriötä sairastavilla potilailla, joilla katsotaan olevan krooninen riski itsemurhakäyttäytymisestä uudelleen historian ja viimeaikaisen kliinisen tilan perusteella. Itsemurhakäyttäytyminen tarkoittaa potilaan toimintaa, joka saattaa hänet kuolemaan.
CLOZARILin tehokkuus toistuvan itsemurhakäyttäytymisen riskin vähentämisessä osoitettiin kahden vuoden hoitojakson aikana InterSePT™-tutkimuksessa [ks. Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Pakollinen laboratoriotutkimus ennen hoidon aloittamista ja hoidon aikana
Ennen CLOZARIL-hoidon aloittamista on saatava ANC-lähtöarvo. Lähtötason ANC:n on oltava vähintään 1500/μl yleisväestöllä ja vähintään 1000/μl potilailla, joilla on dokumentoitu hyvänlaatuinen etninen neutropenia (BEN). Hoidon jatkamiseksi ANC-arvoa on seurattava säännöllisesti [katso VAROITUKSET JA VAROTOIMET ].
Annostelutiedot
Aloitusannos on 12,5 mg kerran vuorokaudessa tai kahdesti vuorokaudessa. Vuorokauden kokonaisannosta voidaan suurentaa 25 mg:lla 50 mg:aan vuorokaudessa, jos se on hyvin siedetty, jotta saavutetaan tavoiteannos 300–450 mg vuorokaudessa (annoksina jaettuina) 2 viikon loppuun mennessä. Sen jälkeen annosta voidaan suurentaa kerran viikossa tai kahdesti viikossa enintään 100 mg:n lisäyksin. Suurin annos on 900 mg päivässä. Ortostaattisen hypotension, bradykardian ja pyörtymisen riskin minimoimiseksi on välttämätöntä käyttää tätä pientä aloitusannosta, asteittaista titrausaikataulua ja jaettuja annoksia [ks. VAROITUKSET JA VAROTOIMET ].
CLOZARIL voidaan ottaa ruoan kanssa tai ilman ruokaa [ks Farmakokinetiikka ].
Ylläpitohoito
Yleensä potilaiden, jotka reagoivat CLOZARIL-hoitoon, tulee jatkaa ylläpitohoitoa tehokkaalla annoksellaan akuutin jakson jälkeen.
Hoidon keskeyttäminen
Hoidon lopettamismenetelmä vaihtelee potilaan viimeisimmän ANC:n mukaan:
- Katso taulukoista 2 tai 3 asianmukaista neutropeniatasoon perustuvaa ANC-seurantaa, jos hoidon äkillinen lopettaminen on tarpeen keskivaikean tai vaikean neutropenian vuoksi.
- Pienennä annosta asteittain 1-2 viikon aikana, jos CLOZARIL 50 mg -hoidon lopettamista suunnitellaan eikä keskivaikeasta tai vaikeasta neutropeniasta ole näyttöä.
- Jos klotsapiinihoito lopetetaan äkillisesti syystä, joka ei liity neutropeniaan, nykyisen ANC-seurannan jatkamista suositellaan yleispopulaatiopotilaille, kunnes ANC on ≥1500/μl ja BEN-potilaiden ANC on ≥1000/μL tai suurempi kuin lähtötaso.
- Ylimääräinen ANC-seuranta on tarpeen, jos potilas ilmoittaa kuumeen alkamisesta (lämpötila 38,5 °C tai 101,3 °F tai korkeampi) kahden viikon aikana hoidon lopettamisen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
- Seuraa kaikkia potilaita huolellisesti psykoottisten oireiden ja kolinergiseen reboundiin liittyvien oireiden, kuten runsaan hikoilun, päänsäryn, pahoinvoinnin, oksentelun ja ripulin toistumisen varalta.
Hoidon uudelleen aloittaminen
Kun CLOZARIL-hoito aloitetaan uudelleen potilailla, jotka ovat lopettaneet CLOZARIL-hoidon (eli 2 päivää tai enemmän viimeisestä annoksesta), aloita uudelleen annoksella 12,5 mg kerran vuorokaudessa tai kahdesti vuorokaudessa. Tämä on tarpeen hypotension, bradykardian ja pyörtymisen riskin minimoimiseksi [katso VAROITUKSET JA VAROTOIMET ]. Jos tämä annos on hyvin siedetty, annosta voidaan suurentaa aiemmin terapeuttiseen annokseen nopeammin kuin aloitushoitoon suositellaan.
Annoksen muuttaminen CYP1A2-, CYP2D6-, CYP3A4-estäjien tai CYP1A2-, CYP3A4-induktorien samanaikaisen käytön yhteydessä
Annoksen muuttaminen saattaa olla tarpeen potilailla, jotka käyttävät samanaikaisesti: vahvoja CYP1A2-estäjiä (esim. fluvoksamiinia, siprofloksasiinia tai enoksasiinia); kohtalaiset tai heikot CYP1A2-estäjät (esim. suun kautta otettavat ehkäisyvalmisteet tai kofeiini); CYP2D6- tai CYP3A4-estäjät (esim. simetidiini, essitalopraami, erytromysiini, paroksetiini, bupropioni, fluoksetiini, kinidiini, duloksetiini, terbinafiini tai sertraliini); CYP3A4:n indusoijat (esim. fenytoiini, karbamatsepiini, mäkikuisma ja rifampiini); tai CYP1A2-indusoijat (esim. tupakointi) (taulukko 1) [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Munuaisten tai maksan vajaatoiminta tai CYP2D6:n huonot metaboloijat
Saattaa olla tarpeen pienentää CLOZARIL 50 mg annosta potilailla, joilla on merkittävä munuaisten tai maksan vajaatoiminta tai CYP2D6-entsyymin heikentyneet metaboloijat [ks. Käyttö tietyissä populaatioissa ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
CLOZARIL (klotsapiini) on saatavana 25 mg, 50 mg ja 100 mg pyöreinä, vaaleankeltaisina, päällystämättöminä tabletteina, joiden toisella puolella on helpotettu jakouurre. Clozaril (klotsapiini) 200 mg tabletit ovat kapselin muotoisia, vaaleankeltaisia, päällystämättömiä tabletteja, joiden toisella puolella on helpotettu jakouurre.
CLOZARIL® (klotsapiini) -tabletit
25 mg
Pyöreä, vaaleankeltainen, päällystämätön tabletti. Toisella puolella on merkintä ”CLOZARIL” kerran. Kaiverrettu helpotettu pistemäärä ja "25" kerran toisella puolella. Pullo 100 .............. NDC 69809-0126-05
50 mg
Pyöreä, vaaleankeltainen, päällystämätön tabletti. Toisella puolella on merkintä ”CLOZARIL” kerran. Toisella puolella kaiverrus "50", helpotettu pistemäärä ja "mg". Pullo 100 .............. NDC 69809-0130-05
100 mg
Pyöreä, vaaleankeltainen, päällystämätön tabletti. Toisella puolella on merkintä ”CLOZARIL” kerran. Kaiverrettu helpotettu pistemäärä ja "100" kerran toisella puolella. Pullo 100 .............. NDC 69809-0127-05
200 mg
Kapselin muotoinen, vaaleankeltainen, päällystämätön tabletti. Toiselle puolelle on kaiverrettu "CLOZARIL". Toisella puolella on kaiverrus "200", helpotettu pistemäärä ja "mg". Pullo 100 .............. NDC 69809-0135-05
Varastointi ja käsittely
Säilytyslämpötila ei saa ylittää 30 °C (86 °F).
Pitää poissa lasten ulottuvilta.
Jakelija: HLS Therapeutics (USA), Inc., Rosemont, PA 19010, (844) 457-8721. Tarkistettu: helmikuuta 2021
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Vaikea neutropenia [katso VAROITUKSET JA VAROTOIMET ]
- Ortostaattinen hypotensio, bradykardia ja pyörtyminen [katso VAROITUKSET JA VAROTOIMET ]
- Falls [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaukset [katso VAROITUKSET JA VAROTOIMET ]
- Sydänlihastulehdus, kardiomyopatia ja mitraaliläpän epäpätevyys [katso VAROITUKSET JA VAROTOIMET ]
- Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi [ks. VAROITUKSET JA VAROTOIMET ]
- Ruoansulatuskanavan hypomotiliteetti, johon liittyy vakavia komplikaatioita [katso VAROITUKSET JA VAROTOIMET ]
- Eosinofilia [katso VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen [katso VAROITUKSET JA VAROTOIMET ]
- Aineenvaihduntamuutokset (hyperglykemia ja diabetes mellitus, dyslipidemia ja painonnousu) [katso VAROITUKSET JA VAROTOIMET ]
- Pahanlaatuinen neuroleptinen oireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Kuume [katso VAROITUKSET JA VAROTOIMET ]
- Keuhkoembolia [katso VAROITUKSET JA VAROTOIMET ]
- Antikolinerginen toksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Häiriö kognitiiviseen ja motoriseen suorituskykyyn [katso VAROITUKSET JA VAROTOIMET ]
- Tardiivi dyskinesia [katso VAROITUKSET JA VAROTOIMET ]
- Aivoverenkierron haittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Psykoosin ja kolinergisen reboundin uusiutuminen äkillisen lopettamisen jälkeen [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Kliinisissä CLOZARIL-tutkimuksissa yleisimmin raportoidut haittavaikutukset (≥5 %) olivat: keskushermostoreaktiot, mukaan lukien sedaatio, huimaus/huimaus, päänsärky ja vapina; sydän- ja verisuonireaktiot, mukaan lukien takykardia, hypotensio ja pyörtyminen; autonomisen hermoston reaktiot, mukaan lukien liiallinen syljeneritys, hikoilu, suun kuivuminen ja näköhäiriöt; maha-suolikanavan reaktiot, mukaan lukien ummetus ja pahoinvointi; ja kuumetta. Taulukossa 9 on yhteenveto yleisimmin raportoiduista haittavaikutuksista (≥ 5 %) CLOZARILilla hoidetuilla potilailla (verrattuna klooripromatsiinihoitoa saaneisiin potilaisiin) keskeisessä, 6 viikkoa kestäneessä, kontrolloidussa tutkimuksessa hoidolle resistentissä skitsofreniassa.
Taulukossa 10 on yhteenveto haittavaikutuksista, jotka raportoitiin CLOZARILilla hoidetuilla potilailla vähintään 2 %:n esiintymistiheydellä kaikissa CLOZARIL-tutkimuksissa (lukuun ottamatta 2 vuoden InterSePT™-tutkimusta). Näitä korkoja ei ole mukautettu altistuksen kestoon.
Taulukossa 11 on yhteenveto InterSePT™-tutkimuksessa yleisimmin raportoiduista haittavaikutuksista (>10 % CLOZARIL- tai olantsapiiniryhmästä). Tämä oli riittävä ja hyvin kontrolloitu kaksivuotinen tutkimus, jossa arvioitiin CLOZARILin tehoa suhteessa olantsapiiniin itsetuhoisen käyttäytymisen riskin vähentämisessä skitsofreniaa tai skitsoaffektiivista häiriötä sairastavilla potilailla. Hinnat eivät ole mukautettuja altistuksen kestoon.
Dystonia
Luokkaefekti
Dystonian oireita, pitkittyneitä lihasryhmien epänormaaleja supistuksia, voi esiintyä herkillä henkilöillä muutaman ensimmäisen hoitopäivän aikana. Dystonisia oireita ovat: niskalihasten kouristukset, jotka joskus etenevät kurkun kireyteen, nielemisvaikeudet, hengitysvaikeudet ja/tai kielen ulkoneminen. Vaikka nämä oireet voivat ilmaantua pienillä annoksilla, niitä esiintyy useammin ja voimakkaammin suuren tehon ja suuremmilla ensimmäisen sukupolven psykoosilääkkeiden annoksilla. Miehillä ja nuoremmilla ikäryhmillä havaitaan kohonnut akuutin dystonian riski.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu klotsapiinin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keskushermosto
Delirium, epänormaali EEG, myoklonus, parestesia, mahdollinen katapleksia, status epilepticus, pakko-oireiset oireet, levottomat jalat -oireyhtymä ja hoidon lopettamisen jälkeiset kolinergiset rebound-haittavaikutukset.
Sydän- ja verisuonijärjestelmä
Eteis- tai kammiovärinä, kammiotakykardia, sydämentykytys, QT-ajan pidentyminen, Torsades de Pointes, mitraaliläpän epäkompetenssi, joka liittyy klotsapiiniin liittyvään kardiomyopatiaan, sydäninfarkti, sydämenpysähdys, sydänlihastulehdus ja periorbitaalinen turvotus.
Endokriininen järjestelmä
Pseudofeokromosytooma
Ruoansulatuskanavajärjestelmä
Akuutti haimatulehdus, dysfagia, sylkirauhasten turvotus, paksusuolentulehdus, megakoolon, suolen iskemia tai infarkti.
Maksa-sappijärjestelmä
Kolestaasi, hepatiitti, keltaisuus, maksatoksisuus, maksan steatoosi, maksanekroosi, maksafibroosi, maksakirroosi, maksavaurio (maksa-, kolestaattinen ja sekamuotoinen) ja maksan vajaatoiminta.
Immuunijärjestelmän häiriöt
Angioedeema, leukosytoklastinen vaskuliitti.
Urogenitaalinen järjestelmä
Akuutti interstitiaalinen nefriitti, yöllinen enureesi, priapismi, munuaisten vajaatoiminta ja retrogradinen siemensyöksy.
Ihon ja ihonalaisten kudosten häiriöt
Yliherkkyysreaktiot: valoherkkyys, vaskuliitti, erythema multiforme, ihon pigmentaatiohäiriö ja Stevens-Johnsonin oireyhtymä.
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt
Myasteeninen oireyhtymä, rabdomyolyysi ja systeeminen lupus erythematosus.
Hengitysjärjestelmä
Aspiraatio, pleuraeffuusio, keuhkokuume, alempien hengitysteiden infektio, uniapnea.
Hemic ja lymfaattinen järjestelmä
Lievä, keskivaikea tai vaikea leukopenia, agranulosytoosi, granulosytopenia, valkosolujen väheneminen, syvä laskimotukos, kohonnut hemoglobiini/hematokriitti, lisääntynyt punasolujen sedimentaationopeus (ESR), sepsis, trombosytoosi ja trombosytopenia.
Näköhäiriöt
Kapeakulmaglaukooma.
Sekalaista
Kreatiinifosfokinaasitason nousu, hyperurikemia, hyponatremia, polyserosiitti ja laihtuminen.
HUUMEIDEN VUOROVAIKUTUKSET
Muiden lääkkeiden mahdollisuus vaikuttaa CLOZARILiin
Klotsapiini on substraatti monille sytokromi P450 isotsyymeille, erityisesti CYP1A2:lle, CYP3A4:lle ja CYP2D6:lle. Noudata varovaisuutta, kun annat CLOZARIL 100 mg samanaikaisesti lääkkeiden kanssa, jotka indusoivat tai inhiboivat näitä entsyymejä.
CYP1A2:n estäjät
CLOZARIL-inhibiittoreiden ja CYP1A2-estäjien samanaikainen käyttö voi lisätä klotsapiinin pitoisuutta plasmassa, mikä saattaa johtaa haittavaikutuksiin. Pienennä CLOZARIL-annosta kolmasosaan alkuperäisestä annoksesta, kun CLOZARILia annetaan samanaikaisesti vahvojen CYP1A2-estäjien (esim. fluvoksamiini, siprofloksasiini tai enoksasiini) kanssa. CLOZARIL-annosta tulee suurentaa alkuperäiseen annokseen, kun vahvojen CYP1A2-estäjien samanaikainen käyttö lopetetaan [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
Kohtalaisia tai heikkoja CYP1A2-estäjiä ovat suun kautta otettavat ehkäisyvalmisteet ja kofeiini. Seuraa potilaita tarkasti, kun CLOZARIL-valmistetta annetaan samanaikaisesti näiden estäjien kanssa. Harkitse CLOZARIL 25 mg -annoksen pienentämistä tarvittaessa [ks ANNOSTELU JA HALLINNOINTI ].
CYP2D6 ja CYP3A4 estäjät
Samanaikainen CLOZARIL-hoito ja CYP2D6- tai CYP3A4-estäjät (esim. simetidiini, essitalopraami, erytromysiini, paroksetiini, bupropioni, fluoksetiini, kinidiini, duloksetiini, terbinafiini tai sertraliini) voivat lisätä klotsapiinipitoisuuksia ja johtaa haittavaikutuksiin [ks. KLIININEN FARMAKOLOGIA ]. Ole varovainen ja seuraa potilaita tarkasti käyttäessäsi tällaisia estäjiä. Harkitse CLOZARIL 100 mg -annoksen pienentämistä [katso ANNOSTELU JA HALLINNOINTI ].
CYP1A2 ja CYP3A4 indusoijat
Samanaikainen hoito CYP1A2:ta tai CYP3A4:ää indusoivilla lääkkeillä voi alentaa plasman klotsapiinin pitoisuutta, mikä johtaa CLOZARILin tehon heikkenemiseen. Tupakansavu on kohtalainen CYP1A2:n indusoija. Vahvoja CYP3A4-indusoijia ovat karbamatsepiini, fenytoiini, mäkikuisma ja rifampiini. Saattaa olla tarpeen suurentaa CLOZARIL 50 mg annosta, jos sitä käytetään samanaikaisesti näiden entsyymien indusoijien kanssa. CLOZARILin ja vahvojen CYP3A4-induktorien samanaikaista käyttöä ei kuitenkaan suositella [katso ANNOSTELU JA HALLINNOINTI ].
Harkitse CLOZARIL 50 mg:n annoksen pienentämistä, kun lopetat samanaikaisesti annettavien entsyymi-induktorien käytön. koska induktorien lopettaminen voi johtaa plasman klotsapiinipitoisuuden nousuun ja lisääntyneeseen haittavaikutusten riskiin [ks. ANNOSTELU JA HALLINNOINTI ].
Antikolinergiset lääkkeet
Samanaikainen hoito klotsapiinilla ja muilla antikolinergisesti vaikuttavilla lääkkeillä (esim. bentstropiini, syklobentsapriini, difenhydramiini) voi lisätä antikolinergisen toksisuuden ja vakavien maha-suolikanavan hypomotiliteettiin liittyvien haittavaikutusten riskiä. Vältä CLOZARILin samanaikaista käyttöä antikolinergisten lääkkeiden kanssa, jos mahdollista [katso VAROITUKSET JA VAROTOIMET ].
QT-ajan pidentymistä aiheuttavat lääkkeet
Ole varovainen, kun käytät samanaikaisesti QT-aikaa pidentäviä tai klotsapiinin metaboliaa estäviä lääkkeitä. QT-ajan pidentymistä aiheuttavia lääkkeitä ovat: spesifiset psykoosilääkkeet (esim. tsiprasidoni, iloperidoni, klooripromatsiini, tioridatsiini, mesoridatsiini, droperidoli ja pimotsidi), spesifiset antibiootit (esim. erytromysiini, gatifloksasiini, moksifloksasiini, sparfloksasiini), luokka 1, quimicsdiini prokainamidi) tai luokan III rytmihäiriölääkkeet (esim. amiodaroni, sotaloli) ja muut (esim. pentamidiini, levometadyyliasetaatti, metadoni, halofantriini, meflokiini, dolasetronimesylaatti, probukoli tai takrolimuusi) [ks. VAROITUKSET JA VAROTOIMET ].
CLOZARILilla on mahdollisuus vaikuttaa muihin lääkkeisiin
CLOZARIL 25 mg:n samanaikainen käyttö muiden CYP2D6:n kautta metaboloituvien lääkkeiden kanssa voi lisätä näiden CYP2D6-substraattien pitoisuuksia. Noudata varovaisuutta, kun käytät CLOZARIL 50 mg:aa samanaikaisesti muiden CYP2D6:n kautta metaboloituvien lääkkeiden kanssa. Saattaa olla tarpeen käyttää pienempiä annoksia tällaisia lääkkeitä kuin tavallisesti on määrätty. Tällaisia lääkkeitä ovat spesifiset masennuslääkkeet, fenotiatsiinit, karbamatsepiini ja tyypin 1C rytmihäiriölääkkeet (esim. propafenoni, flekainidi ja enkainidi).
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Vaikea neutropenia
Tausta
CLOZARIL voi aiheuttaa neutropeniaa (alhainen absoluuttinen neutrofiilien määrä (ANC)), joka määritellään veren neutrofiilipitoisuuden laskuna hoitoa edeltävän normaalin tason alapuolelle. ANC on yleensä saatavilla täydellisen verenkuvan (CBC) osana, mukaan lukien erotus, ja se on merkityksellisempi lääkkeiden aiheuttaman neutropenian kannalta kuin valkosolujen (WBC) määrä. ANC voidaan myös laskea käyttämällä seuraavaa kaavaa: ANC on yhtä suuri valkosolujen kokonaismäärä kerrottuna differentiaalista saatujen neutrofiilien kokonaisprosenttimäärällä (neutrofiilien "segit" plus neutrofiilien "nauhat"). Muut granulosyytit (basofiilit ja eosinofiilit) edistävät minimaalisesti neutropeniaa, eikä niiden mittaaminen ole tarpeen [ks. HAITTAVAIKUTUKSET ]. Neutropenia voi olla lievä, kohtalainen tai vaikea (ks. taulukot 2 ja 3). Ymmärryksen parantamiseksi ja standardoimiseksi "vaikea neutropenia" korvaa aikaisemmat termit vaikea leukopenia, vaikea granulosytopenia tai agranulosytoosi.
Vaikeaa neutropeniaa, ANC alle (
Alla on kaksi erillistä hallintaalgoritmia, joista ensimmäinen on tarkoitettu yleisen väestön potilaille ja toinen potilaille, joilla on perustilanteen neutropenia.
CLOZARIL-hoito ja seuranta yleisessä potilasjoukossa (katso taulukko 2)
Ota CBC, mukaan lukien ANC-arvo, ennen CLOZARIL 25 mg -hoidon aloittamista varmistaaksesi normaalin lähtötason neutrofiilien määrän (sama tai suurempi kuin 1500/µl) ja mahdollistaaksesi myöhempiä vertailuja. Yleiseen populaatioon kuuluvien potilaiden, joiden ANC on (≥)1500/μl tai suurempi, katsotaan olevan normaalialueella (taulukko 2), ja he voivat aloittaa hoidon. Kaikilta potilailta vaaditaan viikoittainen ANC-seuranta ensimmäisen 6 kuukauden aikana. Jos potilaan ANC on yhtä suuri tai suurempi kuin 1500/μl ensimmäisten 6 hoitokuukauden ajan, seurantatiheyttä voidaan vähentää 2 viikon välein seuraavien 6 kuukauden aikana. Jos ANC on yhtä suuri tai suurempi kuin 1500/μl jatkuvan hoidon toisen 6 kuukauden ajan, ANC-seurantatiheyttä voidaan pienentää sen jälkeen kerran 4 viikossa.
CLOZARIL-hoito ja seuranta potilailla, joilla on hyvänlaatuinen etninen neutropenia (katso taulukko 3)
Hyvänlaatuinen etninen neutropenia (BEN) on tila, jota havaitaan tietyissä etnisissä ryhmissä, joiden keskimääräiset ANC-arvot ovat alhaisemmat kuin neutrofiilien "standardi" laboratorioarvot. Se havaitaan yleisimmin afrikkalaissyntyisillä henkilöillä (noin 25–50 %), joillakin Lähi-idän etnisillä ryhmillä ja muilla ei-valkoihoisilla etnisillä ryhmillä, joilla on tummempi iho. BEN on yleisempi miehillä. BEN-potilailla on normaali hematopoieettisten kantasolujen määrä ja myelooinen kypsyminen, he ovat terveitä eivätkä kärsi toistuvista tai vakavista infektioista. Heillä ei ole lisääntynyttä riskiä saada CLOZARIL-indusoitu neutropenia. Lisäarviointi saattaa olla tarpeen sen määrittämiseksi, johtuuko lähtötilanteen neutropenia BEN:stä. Harkitse hematologiaa ennen CLOZARIL 50 mg -hoidon aloittamista tai sen aikana tarvittaessa.
Potilaat, joilla on BEN, tarvitsevat erilaisen ANC-algoritmin CLOZARIL-hoitoon, koska heidän ANC-arvonsa ovat alhaisemmat. Taulukossa 3 on ohjeita CLOZARIL 100 mg -hoidon hallintaan ja ANC-seurantaan BEN-potilailla.
Yleiset ohjeet kaikkien kuume- tai neutropeniapotilaiden hoitoon
- Kuume: Keskeytä CLOZARIL-hoito varotoimenpiteenä jokaiselle potilaalle, jolle kehittyy kuumetta, joka määritellään 38,5 °C:n [101,3 °F] tai korkeammaksi lämpötilaksi, ja saa ANC-tason. Kuume on usein ensimmäinen merkki neutropeenisesta infektiosta.
- ANC alle 1000/μL: Jos kuumetta esiintyy jollakin potilaalla, jonka ANC on alle 1000/μL, aloita asianmukainen infektion hoito ja hoito ja katso taulukot 2 tai 3 hallinnasta.
- Harkitse hematologian konsultaatiota.
- Katso pahanlaatuinen neuroleptinen oireyhtymä [NMS] ja kuume alla VAROITUKSET JA VAROTOIMET ja Potilasohjeet, alla POTILASTIEDOT .
Uusintahoito alle 500/μl ANC:n jälkeen (vaikea neutropenia)
Joillakin potilailla, joilla on vaikea CLOZARIL-hoitoon liittyvä neutropenia, vakavan psykiatrisen sairauden riski CLOZARIL-hoidon keskeyttämisestä voi olla suurempi kuin uudelleenhoidon riski (esim. potilaat, joilla on vaikea skitsofreeninen sairaus ja joilla ei ole muita hoitovaihtoehtoja kuin CLOZARIL). Hematologian konsultaatio voi olla hyödyllinen päätettäessä potilaan uudelleen haastamisesta. Potilaita, joille kehittyy vaikea neutropenia, ei yleensä kuitenkaan saa ottaa uudelleen käyttöön CLOZARILilla tai klotsapiinivalmisteella.
Jos potilas altistetaan uudelleen, lääkärin tulee ottaa huomioon taulukoissa 2 ja 3 annetut kynnykset, potilaan lääketieteellinen ja psykiatrinen historia, keskustelu potilaan ja hänen hoitajansa kanssa CLOZARIL 50 mg:n uudelleenaltistuksen hyödyistä ja riskeistä sekä neutropeniajakson vakavuus ja ominaisuudet.
CLOZARILIN käyttö muiden neutropeniaan liittyvien lääkkeiden kanssa
On epäselvää, lisääkö muiden neutropeniaa aiheuttavien lääkkeiden samanaikainen käyttö CLOZARIL-indusoiman neutropenian riskiä tai vakavuutta. Ei ole vahvaa tieteellistä perustetta välttää CLOZARIL-hoitoa potilailla, joita hoidetaan samanaikaisesti näillä lääkkeillä. Jos CLOZARIL 100 mg -valmistetta käytetään samanaikaisesti sellaisen aineen kanssa, jonka tiedetään aiheuttavan neutropeniaa (esim. jotkin kemoterapeuttiset aineet), harkitse potilaiden tarkkailua tarkemmin kuin taulukoissa 2 ja 3 on annettu hoitosuosituksissa. Keskustele hoitavan onkologin kanssa potilaista, jotka saavat samanaikaisesti kemoterapiaa.
Clozapine REMS -ohjelma
CLOZARIL on saatavilla vain rajoitetun REMS-ohjelman kautta, jota kutsutaan Clozapine REMS -ohjelmaksi vaikean neutropenian riskin vuoksi.
Clozapine REMS -ohjelman merkittäviä vaatimuksia ovat:
- Terveydenhuollon ammattilaisten, jotka määräävät CLOZARIL 25 mg -valmistetta, on oltava sertifioitu ohjelmaan ilmoittautumalla ja suorittamalla koulutus
- Potilaiden, jotka saavat CLOZARIL 100 mg -valmistetta, on oltava mukana ohjelmassa ja heidän on täytettävä ANC-testaus- ja seurantavaatimukset.
- Apteekkien, jotka jakavat CLOZARIL 50mg -valmistetta, on oltava sertifioitu ohjelmaan ilmoittautumalla ja suorittamalla koulutus, ja apteekkien on jaettava vain potilaille, jotka ovat oikeutettuja saamaan CLOZARIL-hoitoa.
Lisätietoja on saatavilla osoitteesta www.clozapinerems.com tai 1-844-267-8678.
Ortostaattinen hypotensio, bradykardia ja pyörtyminen
Klotsapiinihoidon aikana on esiintynyt hypotensiota, bradykardiaa, pyörtymistä ja sydämenpysähdystä. Riski on suurin alkutitrausjakson aikana, erityisesti kun annosta nostetaan nopeasti. Näitä reaktioita voi ilmetä jo ensimmäisellä annoksella, niinkin pienillä annoksilla kuin 12,5 mg. Nämä reaktiot voivat olla kohtalokkaita. Oireyhtymä on yhdenmukainen hermovälitteisen refleksibradykardian (NMRB) kanssa.
Hoito on aloitettava enimmäisannoksella 12,5 mg kerran vuorokaudessa tai kahdesti vuorokaudessa. Vuorokauden kokonaisannosta voidaan suurentaa 25–50 mg:n lisäyksin vuorokaudessa, jos se on hyvin siedetty, tavoiteannokseen 300–450 mg vuorokaudessa (annosten jaettuina) 2 viikon loppuun mennessä. Sen jälkeen annosta voidaan suurentaa viikoittain tai kahdesti viikossa enintään 100 mg:n lisäyksin. Suurin annos on 900 mg päivässä. Käytä varovaista titrausta ja jaettua annostusaikataulua vakavien kardiovaskulaaristen reaktioiden riskin minimoimiseksi [ks. ANNOSTELU JA HALLINNOINTI ]. Harkitse annoksen pienentämistä, jos hypotensiota ilmenee. Kun aloitat uudelleen potilaat, joilla on ollut lyhytkin tauko CLOZARIL-hoidosta (eli 2 päivää tai enemmän viimeisestä annoksesta), aloita hoito uudelleen annoksella 12,5 mg kerran vuorokaudessa tai kahdesti päivässä [ks. ANNOSTELU JA HALLINNOINTI ].
Käytä CLOZARIL-valmistetta varoen potilailla, joilla on sydän- ja verisuonisairaus (aiemmin sydäninfarkti tai iskemia, sydämen vajaatoiminta tai johtumishäiriöt), aivoverisuonisairaus ja tilat, jotka altistavat potilaat hypotensiolle (esim. verenpainelääkkeiden samanaikainen käyttö, nestehukka ja hypovolemia).
Falls
CLOZARIL 25 mg voi aiheuttaa uneliaisuutta, posturaalista hypotensiota, motorista ja sensorista epävakautta, mikä voi johtaa kaatumisiin ja sen seurauksena murtumiin tai muihin vammoihin. Potilaille, joilla on sairauksia, tiloja tai lääkkeitä, jotka voivat pahentaa näitä vaikutuksia, suorita putoamisriskin arvioinnit antipsykoottista hoitoa aloitettaessa ja toistuvasti potilailla, jotka saavat pitkäaikaista antipsykoottista hoitoa.
Kohtaukset
Kouristuskohtauksia on arvioitu esiintyvän klotsapiinin käytön yhteydessä noin 5 %:n kumulatiivisena esiintymistiheyteen vuoden aikana, perustuen yhden tai useamman kohtauksen esiintymiseen 61:llä 1743:sta klotsapiinille altistuneesta potilaasta sen kliinisen testauksen aikana ennen kotimaan markkinoille saattamista (ts. , raakaöljyn korko 3,5 %). Kohtausten riski on annoksesta riippuvainen. Aloita hoito pienellä annoksella (12,5 mg), titraa hitaasti ja käytä jaettua annostusta.
Noudata varovaisuutta, kun annat CLOZARIL 50 mg -valmistetta potilaille, joilla on ollut kouristuskohtauksia tai muita kohtauksille altistavia riskitekijöitä (esim. pään vamma tai muu keskushermoston patologia, kouristuskynnystä alentavien lääkkeiden käyttö tai alkoholin väärinkäyttö). Koska CLOZARIL-valmisteen käyttöön liittyy huomattava kohtausriski, potilaita on varottava ryhtymästä sellaiseen toimintaan, jossa äkillinen tajunnan menetys voi aiheuttaa vakavan riskin itselleen tai muille (esim. auton ajaminen, monimutkaisten koneiden käyttö, uinti, kiipeily).
Sydänlihastulehdus, kardiomyopatia ja mitraaliläpän epäpätevyys
CLOZARIL-valmisteen käytön yhteydessä on esiintynyt sydänlihastulehdusta ja kardiomyopatiaa. Nämä reaktiot voivat olla kohtalokkaita. Lopeta CLOZARIL 25 mg:n käyttö ja suorita sydänarviointi, jos epäillään sydänlihastulehdusta tai kardiomyopatiaa. Yleensä potilaita, joilla on aiemmin ollut klotsapiiniin liittyvä sydänlihastulehdus tai kardiomyopatia, ei pidä antaa uudelleen CLOZARIL-hoitoa. Jos CLOZARIL 25 mg -hoidon hyödyn katsotaan kuitenkin olevan suurempi kuin mahdolliset uusiutuvan sydänlihastulehduksen tai kardiomyopatian riskit, lääkäri voi harkita CLOZARIL-hoidon aloittamista uudelleen keskusteltuaan kardiologin kanssa, täydellisen sydämen arvioinnin jälkeen ja tiiviissä seurannassa.
Harkitse myokardiitin tai kardiomyopatian mahdollisuutta CLOZARIL-hoitoa saavilla potilailla, joilla on rintakipu, hengenahdistus, jatkuva takykardia levossa, sydämentykytys, kuume, flunssan kaltaiset oireet, hypotensio, muut sydämen vajaatoiminnan merkit tai oireet tai elektrokardiografiset löydökset (matalat jännitteet, ST-T-poikkeavuudet, rytmihäiriöt, oikean akselin poikkeama ja huono R-aallon eteneminen). Sydänlihastulehdus ilmaantuu useimmiten klotsapiinihoidon 2 ensimmäisen kuukauden aikana. Kardiomyopatian oireet ilmaantuvat yleensä myöhemmin kuin klotsapiiniin liittyvä sydänlihastulehdus ja yleensä 8 viikon hoidon jälkeen. Myokardiittia ja kardiomyopatiaa voi kuitenkin esiintyä milloin tahansa CLOZARIL-hoidon aikana. On yleistä, että epäspesifiset flunssan kaltaiset oireet, kuten huonovointisuus, lihaskipu, keuhkopussin rintakipu ja matala-asteinen kuume, edeltävät selvempiä sydämen vajaatoiminnan merkkejä. Tyypillisiä laboratoriolöydöksiä ovat kohonnut troponiini I tai T, kohonnut kreatiniinikinaasi-MB, perifeerinen eosinofilia ja kohonnut C-reaktiivinen proteiini (CRP). Rintakehän röntgenkuvaus voi osoittaa sydämen siluetin laajentumisen, ja sydämen kuvantaminen (kaikukardiogrammi, radionukleotiditutkimukset tai sydämen katetrointi) voi paljastaa merkkejä vasemman kammion toimintahäiriöstä. Potilailla, joilla on diagnosoitu kardiomyopatia CLOZARIL 50 mg:n mitraaliläpän vajaatoimintaa on raportoitu. Nämä tapaukset ilmoittivat joko lievästä tai kohtalaisesta mitraalisesta regurgitaatiosta kaksiulotteisessa kaikukuvauksessa. Jos potilaalla epäillään kardiomyopatiaa, harkitse 2D-echo Doppler -tutkimusta mitraaliläpän epäpätevyyden tunnistamiseksi.
Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. Analyysit 17 lumekontrolloidusta tutkimuksesta (modaalinen kesto 10 viikkoa), pääasiassa potilailla, jotka käyttivät epätyypillisiä psykoosilääkkeitä, osoittivat, että lääkehoitoa saaneiden potilaiden kuolemanriski on 1,6-1,7 kertaa suurempi kuin lumelääkettä saaneiden potilaiden riski. Tyypillisen 10 viikon kontrolloidun tutkimuksen aikana kuolleisuusaste lääkehoidetuilla potilailla oli noin 4,5 % verrattuna lumeryhmässä noin 2,6 %:iin. Vaikka kuolinsyyt vaihtelivat, suurin osa kuolemista näytti olevan joko sydän- ja verisuoniperäisiä (esim. sydämen vajaatoiminta, äkillinen kuolema) tai tarttuvia (esim. keuhkokuume). Havaintotutkimukset viittaavat siihen, että kuten epätyypilliset psykoosilääkkeet, hoito tavanomaisilla psykoosilääkkeillä voi lisätä kuolleisuutta tässä populaatiossa. Ei ole selvää, missä määrin havainnointitutkimuksissa havaitut havainnot lisääntyneestä kuolleisuudesta voidaan johtua psykoosilääkkeestä verrattuna joihinkin potilaiden ominaisuuksiin. CLOZARILIA ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [katso LAATIKKO VAROITUS ].
Ruoansulatuskanavan hypomotiliteetti, johon liittyy vakavia komplikaatioita
Vakavia maha-suolikanavan haittavaikutuksia on esiintynyt CLOZARIL-valmisteen käytön yhteydessä, mikä johtuu pääasiassa sen voimakkaista antikolinergisista vaikutuksista ja siitä johtuvasta maha-suolikanavan hypomotiliteettista. Markkinoille tulon jälkeen raportoidut vaikutukset vaihtelevat ummetuksesta paralyyttiseen ileukseen. Ummetuksen lisääntynyt esiintymistiheys ja viivästynyt diagnoosi ja hoito lisäsivät maha-suolikanavan hypomotiliteettiin liittyvien vakavien komplikaatioiden riskiä, mikä johti suolitukkoon, ulosteen tukkeutumiseen, megakoolonin ja suoliston iskemiaan tai infarktiin [ks. HAITTAVAIKUTUS ]. Nämä reaktiot ovat johtaneet sairaalahoitoon, leikkaukseen ja kuolemaan. Antikolinergiset lääkkeet (ja muut maha-suolikanavan peristaltiikkaa heikentävät lääkkeet) lisäävät vakavien haittavaikutusten riskiä; siksi samanaikaista käyttöä tulee välttää mahdollisuuksien mukaan [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Ennen kuin aloitat CLOZARIL 50 mg -hoidon, seulo ummetuksen varalta ja hoida tarvittaessa. Subjektiiviset ummetuksen oireet eivät välttämättä kuvasta tarkasti CLOZARIL-hoitoa saaneiden potilaiden maha-suolikanavan hypomotiliteettia. Siksi suolen toiminta on arvioitava uudelleen usein kiinnittäen erityistä huomiota mahdollisiin muutoksiin suolen liikkeiden tiheydessä tai luonteessa sekä hypomotiliteettikomplikaatioiden merkit ja oireet (esim. pahoinvointi, oksentelu, vatsan turvotus, vatsakipu). Jos havaitaan ummetusta tai maha-suolikanavan hypomotiliteettia, tarkkaile tarkasti ja käytä tarvittaessa sopivia laksatiiveja vakavien komplikaatioiden estämiseksi. Harkitse profylaktisten laksatiivien käyttöä suuren riskin potilailla.
Eosinofilia
Eosinofiliaa, joka määritellään veren eosinofiilimääräksi yli 700/μl, on esiintynyt CLOZARIL 100 mg -hoidon aikana. Kliinisissä tutkimuksissa noin 1 %:lle potilaista kehittyi eosinofilia. Klotsapiiniin liittyvä eosinofilia ilmenee yleensä ensimmäisen hoitokuukauden aikana. Joillakin potilailla siihen on liittynyt sydänlihastulehdus, haimatulehdus, hepatiitti, paksusuolitulehdus ja nefriitti. Tällainen elinten osallistuminen voi olla yhdenmukainen lääkereaktion kanssa, johon liittyy eosinofiliaa ja systeemisiä oireyhtymiä (DRESS), joka tunnetaan myös nimellä lääkeaineperäinen yliherkkyysoireyhtymä (DIHS). Jos eosinofiliaa kehittyy CLOZARIL-hoidon aikana, arvioi viipymättä systeemisten reaktioiden merkit ja oireet, kuten ihottuma tai muut allergiset oireet, sydänlihastulehdus tai muu eosinofiliaan liittyvä elinspesifinen sairaus. Jos epäillään CLOZARIL-hoitoon liittyvää systeemistä sairautta, lopeta CLOZARIL 50 mg -valmisteen käyttö välittömästi.
Jos eosinofilian syy, joka ei liity CLOZARIL 50 mg:aan, tunnistetaan (esim. astma, allergiat, kollageeniverisuonisairaus, loisinfektiot ja tietyt kasvaimet), käsittele taustalla oleva syy ja jatka CLOZARIL-hoitoa.
Klotsapiiniin liittyvää eosinofiliaa on esiintynyt myös ilman elinten osallistumista, ja se voi hävitä ilman interventiota. On raportoitu onnistuneesta uudelleenalustamisesta klotsapiinihoidon lopettamisen jälkeen ilman eosinofilian uusiutumista. Jos elimillä ei ole vaikutusta, jatka CLOZARIL-valmistetta huolellisen seurannan alla. Jos eosinofiilien kokonaismäärä jatkaa nousuaan useiden viikkojen ajan ilman systeemistä sairautta, päätös CLOZARIL 25 mg -hoidon keskeyttämisestä ja hoidon aloittamisesta uudelleen eosinofiilien määrän vähenemisen jälkeen tulee perustua yleiseen kliiniseen arviointiin sisätautilääkärin tai hematologin kanssa.
QT-ajan pidentyminen
CLOZARIL 100 mg -hoidon aikana on esiintynyt QT-ajan pidentymistä, torsade de pointesia ja muita hengenvaarallisia kammiorytmihäiriöitä, sydämenpysähdyksiä ja äkillistä kuolemaa. Kun määräät CLOZARIL-valmistetta, ota huomioon QT-ajan pidentymisen ja vakavien kardiovaskulaaristen reaktioiden riskitekijöiden olemassaolo. Näitä riskejä lisääviä tiloja ovat seuraavat: QT-ajan pidentyminen, pitkä QT-oireyhtymä, suvussa pitkä QT-oireyhtymä tai äkillinen sydänkuolema, merkittävä sydämen rytmihäiriö, äskettäinen sydäninfarkti, kompensoimaton sydämen vajaatoiminta, hoito muilla QT-ajan pidentymistä aiheuttavilla lääkkeillä, hoito lääkkeillä, jotka estävät klotsapiinin metaboliaa ja elektrolyyttihäiriöitä.
Ennen kuin aloitat CLOZARIL 25 mg -hoidon, suorita huolellinen fyysinen tutkimus, sairaushistoria ja samanaikainen lääkityshistoria. Harkitse perustason EKG:n ja seerumikemian paneelin hankkimista. Korjaa elektrolyyttihäiriöt. Lopeta CLOZARIL 25 mg:n käyttö, jos QTc-aika ylittää 500 ms. Jos potilaalla ilmenee Torsades de Pointes -oireita tai muita rytmihäiriöitä (esim. pyörtyminen, presynkooppi, huimaus tai sydämentykytys), suorita sydänarviointi ja keskeytä CLOZARIL-hoito.
Ole varovainen, kun käytät samanaikaisesti lääkkeitä, jotka pidentävät QT-aikaa tai estävät CLOZARILin metaboliaa. QT-ajan pidentymistä aiheuttavia lääkkeitä ovat: spesifiset psykoosilääkkeet (esim. tsiprasidoni, iloperidoni, klooripromatsiini, tioridatsiini, mesoridatsiini, droperidoli, pimotsidi), spesifiset antibiootit (esim. erytromysiini, gatifloksasiini, moksifloksasiini, sparfloksasiini), luokka 1A, antikvinariini prokaiiniamidi) tai luokan III rytmihäiriölääkkeet (esim. amiodaroni, sotaloli) ja muut (esim. pentamidiini, levometadyyliasetaatti, metadoni, halofantriini, meflokiini, dolasetronimesylaatti, probukoli tai takrolimuusi). Klotsapiini metaboloituu pääasiassa CYP-isoentsyymien 1A2, 2D6 ja 3A4 vaikutuksesta. Samanaikainen hoito näiden entsyymien estäjillä voi lisätä CLOZARILIN pitoisuutta [katso HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Hypokalemia ja hypomagnesemia lisäävät QT-ajan pidentymisen riskiä. Hypokalemia voi johtua diureettihoidosta, ripulista ja muista syistä. Ole varovainen hoidettaessa potilaita, joilla on merkittävä elektrolyyttihäiriön, erityisesti hypokalemian, riski. Ota seerumin kalium- ja magnesiumpitoisuudet lähtötilanteessa ja seuraa elektrolyyttejä säännöllisesti. Korjaa elektrolyyttihäiriöt ennen CLOZARIL-hoidon aloittamista.
Metaboliset muutokset
Epätyypillisiin psykoosilääkkeisiin, mukaan lukien CLOZARIL 50 mg, on liitetty metabolisia muutoksia, jotka voivat lisätä kardiovaskulaarista ja aivoverisuoniriskiä. Näitä metabolisia muutoksia ovat hyperglykemia, dyslipidemia ja painonnousu. Vaikka epätyypilliset psykoosilääkkeet voivat aiheuttaa joitain metabolisia muutoksia, jokaisella luokan lääkkeellä on oma erityinen riskiprofiilinsa.
Hyperglykemia ja diabetes mellitus
Hyperglykemiaa, joissakin tapauksissa äärimmäistä ja joka liittyy ketoasidoosiin tai hyperosmolaariseen koomaan tai kuolemaan, on raportoitu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä, mukaan lukien CLOZARIL. Epätyypillisen psykoosilääkkeiden käytön ja glukoosipoikkeavuuksien välisen suhteen arviointia vaikeuttaa skitsofreniapotilaiden lisääntynyt diabeteksen taustariski ja yleisväestössä lisääntynyt diabetes mellituksen esiintyvyys. Kun otetaan huomioon nämä sekaannukset, epätyypillisen psykoosilääkkeen käytön ja hyperglykemiaan liittyvien haittavaikutusten välistä suhdetta ei täysin ymmärretä. Epidemiologiset tutkimukset viittaavat kuitenkin lisääntyneeseen hoitoon liittyvien hyperglykemiaan liittyvien haittavaikutusten riskiin potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä. Tarkkoja riskiarvioita hyperglykemiaan liittyvistä haittavaikutuksista potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä, ei ole saatavilla.
Potilaita, joilla on todettu diabetes mellitus ja jotka aloitetaan CLOZARIL 100 mg -annoksella, on seurattava säännöllisesti glukoositasapainon heikkenemisen varalta. Potilaille, joilla on diabetes mellituksen riskitekijöitä (esim. liikalihavuus, diabetes suvussa), jotka aloittavat hoidon atyyppisillä psykoosilääkkeillä, tulee tehdä paastoverensokerimittaus hoidon alussa ja määräajoin hoidon aikana. Potilaita, joita hoidetaan epätyypillisillä psykoosilääkkeillä, tulee seurata hyperglykemian oireiden varalta, mukaan lukien polydipsia, polyuria, polyfagia ja heikkous. Potilaille, joille kehittyy hyperglykemian oireita atyyppisten psykoosilääkkeiden käytön aikana, on tehtävä paastoverensokerimittaus. Joissakin tapauksissa hyperglykemia on parantunut, kun epätyypillinen antipsykootti on lopetettu; Jotkut potilaat kuitenkin tarvitsivat diabeteslääkityksen jatkamista huolimatta epäillyn lääkkeen lopettamisesta.
Kahdeksan skitsofreniaa sairastavan aikuispotilaan tutkimuksen yhdistetyssä data-analyysissä keskimääräiset muutokset paastoglukoosipitoisuudessa CLOZARIL 50 mg:n ja klooripromatsiiniryhmissä olivat +11 mg/dl ja +4 mg/dl. Suurempi osa CLOZARIL-ryhmästä osoitti kategorista nousua lähtötasosta paastoglukoosipitoisuuksissa verrattuna klooripromatsiiniryhmään (taulukko 4). CLOZARIL 25 mg:n annokset olivat 100–900 mg päivässä (keskimääräinen modaalinen annos: 512 mg päivässä). Klooripromatsiinin enimmäisannos oli 1800 mg päivässä (keskimääräinen modaalinen annos: 1029 mg päivässä). Altistuksen keston mediaani oli 42 päivää CLOZARILilla ja klooripromatsiinilla.
Dyslipidemia
Ei-toivottuja lipidien muutoksia on esiintynyt potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä, mukaan lukien CLOZARIL. CLOZARIL-valmistetta käyttävien potilaiden kliinistä seurantaa, mukaan lukien lähtötilanteen ja määräajoin tapahtuvaa lipidien seurantaa, suositellaan.
Kymmenen skitsofreniaa sairastavan aikuistutkimuksen yhdistetyssä data-analyysissä CLOZARIL-hoitoon liittyi seerumin kokonaiskolesterolin nousu. LDL- ja HDL-kolesterolista ei kerätty tietoja. Kokonaiskolesterolin keskimääräinen nousu oli 13 mg/dl CLOZARIL 25 mg:n ryhmässä ja 15 mg/dl klooripromatsiiniryhmässä. Kahden skitsofreniaa sairastavien aikuisten tutkimusten yhdistetyn data-analyysin mukaan CLOZARIL 50 mg -hoitoon liittyi seerumin triglyseridipitoisuuden nousu paastossa. Paastotriglyseridin keskimääräinen nousu oli 71 mg/dl (54 %) CLOZARIL 100 mg -ryhmässä ja 39 mg/dl (35 %) klooripromatsiiniryhmässä (taulukko 5). Lisäksi CLOZARIL-hoitoon liittyi seerumin kokonaiskolesteroli- ja triglyseridipitoisuuden kategorinen nousu, kuten taulukosta 6 käy ilmi. Niiden potilaiden osuus, joilla kokonaiskolesteroli tai paastotriglyseridiarvot kohosivat kategorisesti, kasvoi altistuksen keston myötä. CLOZARIL 50 mg:n ja klooripromatsiinialtistuksen mediaanikesto oli 45 päivää ja 38 päivää. CLOZARIL-annosalue oli 100–900 mg vuorokaudessa; suurin klooripromatsiiniannos oli 1800 mg vuorokaudessa.
Painonnousu
Painonnousua on esiintynyt psykoosilääkkeiden, mukaan lukien CLOZARILin, käytön yhteydessä. Seuraa painoa CLOZARIL-hoidon aikana. Taulukossa 7 on yhteenveto painonnousua koskevista tiedoista altistuksen keston perusteella yhdistettynä 11 tutkimuksesta CLOZARILilla ja aktiivisilla vertailuvalmisteilla. Keskimääräinen altistuksen kesto oli 609, 728 ja 42 päivää CLOZARIL 25 mg:n, olantsapiinin ja klooripromatsiinin ryhmässä, tässä järjestyksessä.
Taulukossa 8 on yhteenveto 11 tutkimuksesta skitsofreniaa sairastavilla aikuisilla koehenkilöillä, jotka osoittavat painonnousua ≥ 7 % ruumiinpainosta suhteessa lähtötilanteeseen. Keskimääräinen altistuksen kesto oli 609, 728 ja 42 päivää CLOZARIL-, olantsapiini- ja klooripromatsiiniryhmässä, vastaavasti.
Pahanlaatuinen neuroleptinen oireyhtymä
Antipsykoottiset lääkkeet, mukaan lukien CLOZARIL 50 mg, voivat aiheuttaa mahdollisesti kuolemaan johtavan oireyhtymän, jota kutsutaan pahanlaatuiseksi neuroleptioireyhtymäksi (NMS). NMS:n kliinisiä oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja autonominen epävakaus (epäsäännöllinen pulssi tai verenpaine, takykardia, hikoilu ja sydämen rytmihäiriöt). Aiheeseen liittyviä löydöksiä voivat olla kohonnut kreatiinifosfokinaasi (CPK), myoglobinuria, rabdomyolyysi ja akuutti munuaisten vajaatoiminta.
Tätä oireyhtymää sairastavien potilaiden diagnostinen arviointi on monimutkaista. On tärkeää ottaa huomioon muiden vakavien sairauksien (esim. vaikea neutropenia, infektio, lämpöhalvaus, primaarinen keskushermoston patologia, keskushermoston antikolinerginen toksisuus, ekstrapyramidaaliset oireet ja lääkekuume) olemassaolo.
NMS-taudin hoitoon tulisi kuulua (1) psykoosilääkkeiden ja muiden samanaikaisen hoidon kannalta välttämättömien lääkkeiden välitön lopettaminen, (2) intensiivinen oireenmukainen hoito ja lääketieteellinen seuranta ja (3) samanaikaisten sairauksien hoito. Ei ole yleistä yksimielisyyttä NMS:n erityisistä farmakologisista hoidoista.
Jos potilas tarvitsee psykoosilääkehoitoa NMS:stä toipumisen jälkeen, lääkehoidon mahdollista uudelleen aloittamista tulee harkita huolellisesti. NMS voi toistua. Seuraa tarkasti, jos aloitat hoidon psykoosilääkkeillä uudelleen.
NMS-oireita on esiintynyt CLOZARIL-monoterapian ja samanaikaisten keskushermostoon vaikuttavien lääkkeiden, mukaan lukien litiumin, yhteydessä.
Maksatoksisuus
Markkinoille tulon jälkeisissä tutkimuksissa klotsapiinilla hoidetuilla potilailla on raportoitu vakavaa, hengenvaarallista ja joissakin tapauksissa kuolemaan johtanutta maksatoksisuutta, mukaan lukien maksan vajaatoiminta, maksanekroosi ja hepatiitti [ks. HAITTAVAIKUTUKSET ]. Tarkkaile maksatoksisuuden merkkejä ja oireita, kuten väsymystä, huonovointisuutta, ruokahaluttomuutta, pahoinvointia, keltaisuutta, bilirubinemiaa, koagulopatiaa ja hepaattista enkefalopatiaa. Suorita seerumikokeita maksavaurion varalta ja harkitse hoidon lopettamista pysyvästi, jos hepatiitti tai transaminaasien nousu yhdistettynä muihin systeemisiin oireisiin johtuu klotsapiinista.
Kuume
Klotsapiinihoidon aikana potilailla on ollut ohimenevää, klotsapiiniin liittyvää kuumetta. Huippu ilmaantuvuus on kolmen ensimmäisen hoitoviikon aikana. Vaikka tämä kuume on yleensä hyvänlaatuinen ja itsestään rajoittuva, se voi edellyttää hoidon lopettamista. Kuume voi liittyä valkosolujen määrän lisääntymiseen tai laskuun. Arvioi huolellisesti potilaat, joilla on kuumetta vaikean neutropenian tai infektion sulkemiseksi pois. Harkitse NMS:n mahdollisuutta [katso VAROITUKSET JA VAROTOIMET ].
Keuhkoveritulppa
CLOZARIL-hoitoa saaneilla potilailla on esiintynyt keuhkoemboliaa ja syvälaskimotromboosia. Harkitse keuhkoembolian mahdollisuutta potilailla, joilla on syvä laskimotukos, akuutti hengenahdistus, rintakipu tai muita hengitystieoireita. Ei ole selvää, voidaanko keuhkoembolia ja syvä laskimotukos johtua klotsapiinista tai joistakin potilaiden ominaisuuksista.
Antikolinerginen toksisuus
CLOZARIL 50 mg:lla on voimakas antikolinerginen vaikutus. CLOZARIL-hoito voi johtaa keskushermostoon ja perifeeriseen antikolinergiseen toksisuuteen, erityisesti suuremmilla annoksilla tai yliannostustilanteissa (ks. YLIANNOSTUS ]. Käytä varoen potilailla, joilla on diagnosoitu tai aiempi ummetus, virtsanpidätys, kliinisesti merkittävä eturauhasen liikakasvu tai muut tilat, joissa antikolinergiset vaikutukset voivat johtaa merkittäviin haittavaikutuksiin. Vältä mahdollisuuksien mukaan samanaikaista käyttöä muiden antikolinergisten lääkkeiden kanssa, koska antikolinergisen toksisuuden tai vakavien maha-suolikanavan haittavaikutusten riski on lisääntynyt [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
CLOZARIL voi aiheuttaa sedaatiota ja heikentää kognitiivista ja motorista suorituskykyä. Varo potilaita käyttämästä vaarallisia koneita, mukaan lukien autot, kunnes he ovat kohtuullisen varmoja siitä, että CLOZARIL ei vaikuta heihin haitallisesti. Nämä reaktiot voivat olla annoksesta riippuvaisia. Harkitse annoksen pienentämistä, jos niitä ilmenee.
Tardiivi dyskinesia
Tardiivia dyskinesiaa (TD) on esiintynyt potilailla, joita on hoidettu psykoosilääkkeillä, mukaan lukien CLOZARIL. Oireyhtymä koostuu mahdollisesti peruuttamattomista, tahattomista, dyskineettisistä liikkeistä. TD:n riskin ja todennäköisyyden, että se muuttuu peruuttamattomaksi, uskotaan kasvavan hoidon pitenemisen ja suurempien kumulatiivisten kokonaisannosten myötä. Oireyhtymä voi kuitenkin kehittyä suhteellisen lyhyiden hoitojaksojen jälkeen pienillä annoksilla. Määrää CLOZARIL-valmistetta tavalla, joka todennäköisimmin minimoi TD:n kehittymisen riskin. Käytä pienintä tehokasta annosta ja lyhintä kestoa, joka tarvitaan oireiden hallintaan. Arvioi säännöllisin väliajoin hoidon jatkamisen tarve. Harkitse hoidon lopettamista, jos TD ilmenee. Jotkut potilaat saattavat kuitenkin tarvita CLOZARIL 100 mg -hoitoa oireyhtymästä huolimatta.
TD:lle ei ole tunnettua hoitoa. Oireyhtymä voi kuitenkin levätä osittain tai kokonaan, jos hoito keskeytetään. Antipsykoottinen hoito itsessään voi tukahduttaa (tai osittain tukahduttaa) merkit ja oireet, ja se voi peittää taustalla olevan prosessin. Oireiden tukahdutuksen vaikutusta TD:n pitkäaikaiseen kulkuun ei tunneta.
Aivoverenkierron haittavaikutukset
Kontrolloiduissa tutkimuksissa iäkkäillä potilailla, joilla oli dementiaan liittyvää psykoosia ja joita hoidettiin joillakin epätyypillisillä psykoosilääkkeillä, oli lisääntynyt (verrattuna lumelääkkeeseen) aivoverenkierron haittavaikutusten (esim. aivohalvauksen, ohimenevän iskeemisen kohtauksen) riski, mukaan lukien kuolemantapaukset. Tämän lisääntyneen riskin mekanismia ei tunneta. Lisääntynyttä riskiä ei voida sulkea pois CLOZARIL-valmisteen tai muiden psykoosilääkkeiden tai muiden potilasryhmien kohdalla. CLOZARIL 50 mg -valmistetta tulee käyttää varoen potilailla, joilla on aivoverenkierron haittavaikutusten riskitekijöitä.
Psykoosin ja kolinergisen reboundin uusiutuminen CLOZARIL-hoidon äkillisen lopettamisen jälkeen
Jos CLOZARIL-hoidon äkillinen lopettaminen on välttämätöntä (esimerkiksi vaikean neutropenian tai muun sairauden vuoksi) [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ], seuraa huolellisesti psykoottisten oireiden toistumista ja kolinergiseen reboundiin liittyviä haittavaikutuksia, kuten runsasta hikoilua, päänsärkyä, pahoinvointia, oksentelua ja ripulia.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Pitkäaikaisissa tutkimuksissa hiirillä ja rotilla ei ole osoitettu karsinogeenisuutta annoksilla, jotka olivat 0,3-kertaisia ja 0,4-kertaisia ihmisille suositeltuun enimmäisannokseen (MRHD) verrattuna, joka on 900 mg/vrk mitattuna mg/m² kehon pinta-alasta.
Mutageneesi
Klotsapiini ei ollut genotoksinen, kun sitä testattiin seuraavissa geenimutaatio- ja kromosomipoikkeavuustesteissä: bakteeri-Ames-testi, in vitro nisäkkään V79 kiinanhamsterin soluissa, in vitro suunnittelematon DNA-synteesi rotan maksasoluissa tai in vivo -mikrotumatesti hiirillä.
Hedelmällisyyden heikkeneminen
Klotsapiinilla ei ollut vaikutusta hedelmällisyyteen, raskauteen, sikiön painoon tai postnataaliseen kehitykseen, kun sitä annettiin suun kautta urosrotille 70 päivää ennen parittelua ja naarasrotille 14 päivän ajan ennen parittelua annoksilla, jotka olivat enintään 0,4 kertaa MRHD 900 mg/vrk. mg/m² kehon pinta-alan perusteella.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka B
Riskien yhteenveto
Ei ole olemassa riittäviä tai hyvin kontrolloituja tutkimuksia klotsapiinista raskaana olevilla naisilla.
Lisääntymistutkimuksia on suoritettu rotilla ja kaneilla annoksilla, jotka ovat enintään 0,4-kertaisia ja kaniineilla 0,9-kertaisia verrattuna ihmisen enimmäisannokseen (MRHD) 900 mg/vrk mitattuna mg/m² kehon pinta-alasta. Tutkimukset eivät paljastaneet viitteitä klotsapiinin aiheuttamasta hedelmällisyyden heikkenemisestä tai sikiölle aiheutuneesta haitasta. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, CLOZARIL-valmistetta tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Kliiniset näkökohdat
Ota huomioon psykoosin pahenemisen riski, kun lopetat tai vaihdat antipsykoottisten lääkkeiden käyttöä raskauden ja synnytyksen aikana. Harkitse raskausdiabeteksen varhaista seulontaa potilaille, joita hoidetaan antipsykoottisilla lääkkeillä [katso VAROITUKSET JA VAROTOIMET ]. Vastasyntyneillä, jotka ovat altistuneet antipsykoottisille lääkkeille kolmannen raskauskolmanneksen aikana, on riski saada ekstrapyramidaalisia ja/tai vieroitusoireita synnytyksen jälkeen. Tarkkaile vastasyntyneitä levottomuuden, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja ruokintavaikeuksien varalta. Komplikaatioiden vakavuus voi vaihdella itsestään rajoittuvista oireista joihinkin vastasyntyneisiin, jotka tarvitsevat tehohoitoyksikön tukea ja pitkittyvää sairaalahoitoa.
Eläinten tiedot
Alkion ja sikiön kehitystutkimuksissa klotsapiinilla ei ollut vaikutusta emon parametreihin, pentueen kokoihin tai sikiöparametreihin, kun sitä annettiin suun kautta tiineille rotille ja kaneille organogeneesin aikana annoksina, jotka olivat 0,4-kertaisia ja 0,9-kertaisia MRHD:n 900 mg/vrk. mg/m² kehon pinta-alaa kohti.
Peri/postnataalisissa kehitystutkimuksissa tiineille naarasrotille annettiin klotsapiinia tiineyden viimeisen kolmanneksen aikana ja 21 päivään synnytyksen jälkeen. Havaintoja tehtiin sikiöistä syntyessään ja synnytyksen jälkeisenä aikana; jälkeläisten annettiin saavuttaa sukukypsä ja pariteltu. Klotsapiini aiheutti emojen ruumiinpainon laskun, mutta sillä ei ollut vaikutusta F1- tai F2-sukupolvien pentueen kokoon tai ruumiinpainoon annoksilla, jotka olivat enintään 0,4 kertaa MRHD 900 mg/vrk mitattuna mg/m² kehon pinta-alasta.
Imettävät äidit
CLOZARIL 50 mg erittyy äidinmaitoon. Koska CLOZARIL voi aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imettäminen vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Kliinisissä tutkimuksissa, joissa käytettiin CLOZARIL 50 mg:aa, ei ole ollut riittävästi iäkkäitä potilaita sen määrittämiseksi, eroavatko yli 65-vuotiaat nuoremmista koehenkilöistä vasteessa CLOZARIL-hoitoon.
CLOZARIL 50 mg -hoidon aikana voi esiintyä ortostaattista hypotensiota ja takykardiaa (ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]. Iäkkäät potilaat, erityisesti ne, joiden sydän- ja verisuonitoiminta on heikentynyt, voivat olla herkempiä näille vaikutuksille.
Iäkkäät potilaat voivat olla erityisen herkkiä CLOZARILin antikolinergisille vaikutuksille, kuten virtsan kertymiselle ja ummetukselle [ks. VAROITUKSET JA VAROTOIMET ].
Valitse CLOZARIL 50 mg annokset huolellisesti iäkkäille potilaille ottaen huomioon heidän maksan, munuaisten tai sydämen toiminnan heikkenemisen yleisyys sekä muut samanaikaiset sairaudet ja muut lääkehoidot. Kliiniset kokemukset viittaavat siihen, että tardiivin dyskinesian esiintyvyys näyttää olevan suurin vanhuksilla; varsinkin iäkkäät naiset [katso VAROITUKSET JA VAROTOIMET ].
Potilaat, joilla on munuaisten tai maksan vajaatoiminta
Annoksen pienentäminen voi olla tarpeen potilailla, joilla on merkittävä munuaisten tai maksan vajaatoiminta. Klotsapiinipitoisuudet voivat suurentua näillä potilailla, koska klotsapiini metaboloituu lähes kokonaan ja sitten erittyy [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
CYP2D6 huonot metaboloijat
Annoksen pienentäminen saattaa olla tarpeen potilailla, jotka metaboloivat CYP2D6:ta hitaasti. Klotsapiinipitoisuudet voivat suurentua näillä potilailla, koska klotsapiini metaboloituu lähes kokonaan ja sitten erittyy [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
Saattohoitopotilaat
Saattohoitopotilaiden (eli parantumattomasti sairaiden potilaiden, joiden arvioitu elinajanodote on kuusi kuukautta tai vähemmän) osalta lääkäri voi vähentää ANC-seurantatiheyttä 6 kuukauden välein keskusteltuaan potilaan ja hänen hoitajansa kanssa. Yksilöllisissä hoitopäätöksissä tulee punnita ANC:n seurannan tärkeyttä, kun otetaan huomioon tarve hallita psykiatrisia oireita ja potilaan terminaalista sairautta.
YLIANNOSTUS
Kokemus yliannostuksesta
Yleisimmin raportoidut klotsapiinin yliannostukseen liittyvät merkit ja oireet ovat: sedaatio, delirium, kooma, takykardia, hypotensio, hengityslama tai hengitysvajaus; ja liiallinen syljeneritys. Aspiraatiokeuhkokuumeesta, sydämen rytmihäiriöistä ja kouristuskohtauksista on raportoitu. Klotsapiinin kuolemaan johtaneita yliannostuksia on raportoitu, yleensä yli 2500 mg:n annoksilla. On myös raportoitu potilaita, jotka ovat toipuneet reilusti yli 4 g:n yliannostuksista.
Yliannostuksen hallinta
CLOZARILin yliannostukselle ei ole saatavilla spesifistä vastalääkettä. Luo ja ylläpitää hengitysteitä; varmista riittävä hapetus ja ilmanvaihto. Tarkkaile sydämen tilaa ja elintoimintoja. Käytä yleisiä oireenmukaisia ja tukitoimenpiteitä. Harkitse useiden lääkkeiden vaikutusta.
Ota yhteyttä sertifioituun myrkytyskeskukseen saadaksesi viimeisimmät tiedot yliannostuksen hallinnasta (1-800Â222-1222).
VASTA-AIHEET
CLOZARIL on vasta-aiheinen potilailla, joilla on ollut vakava yliherkkyys klotsapiinille (esim. valoherkkyys, vaskuliitti, erythema multiforme tai Stevens-Johnsonin oireyhtymä) tai jollekin muulle CLOZARILin aineosalle (ks. HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Klotsapiinin vaikutusmekanismia ei tunneta. On kuitenkin ehdotettu, että klotsapiinin terapeuttinen teho skitsofrenian hoidossa välittyy dopamiinityypin 2 (D2) ja serotoniinityypin 2A (5ÂHT2A) -reseptorien antagonismin kautta. CLOZARIL toimii myös adrenergisten, kolinergisten, histaminergisten ja muiden dopaminergisten ja serotonergisten reseptoreiden antagonistina.
Farmakodynamiikka
Klotsapiini osoitti sitoutumisaffiniteettia seuraaviin reseptoreihin: histamiini H1 (Ki 1,1 nM), adrenerginen α1A (Ki 1,6 nM), serotoniini 5-HT6 (Ki 4 nM), serotoniini 5-HT2A (Ki 5,4 nM), muskariini 62 (Ki 62). nM), serotoniini 5-HT7 (Ki 6,3 nM), serotoniini 5-HT2C (Ki 9,4 nM), dopamiini D4 (Ki 24 nM), adrenerginen a2A (Ki 90 nM), serotoniini 5-HT3 (Ki 95 nM), serotoniini 5-HT1A (Ki 120 nM), dopamiini D2 (Ki 160 nM), dopamiini D1 (Ki 270 nM), dopamiini D5 (Ki 454 nM) ja dopamiini D3 (Ki 555 nM).
Klotsapiini aiheuttaa vain vähän tai ei ollenkaan prolaktiinin nousua.
Kliiniset elektroenkefalogrammitutkimukset (EEG) osoittivat, että klotsapiini lisää delta- ja theta-aktiivisuutta ja hidastaa hallitsevia alfataajuuksia. Paranneltu synkronointi tapahtuu. Myös terävä aaltoaktiivisuus ja piikki- ja aaltokompleksit voivat kehittyä. Potilaat ovat raportoineet unen aktiivisuuden voimistumisesta klotsapiinihoidon aikana. REM-unen havaittiin lisääntyneen 85 prosenttiin kokonaisuniajasta. Näillä potilailla REM-uni alkoi melkein heti nukahtamisen jälkeen.
Farmakokinetiikka
Imeytyminen
Ihmisillä CLOZARIL-tabletit (25 mg ja 100 mg) ovat yhtä hyötyosia kuin CLOZARIL-liuos. Kun CLOZARIL-valmistetta annettiin 100 mg kahdesti vuorokaudessa suun kautta, keskimääräinen vakaan tilan huippupitoisuus plasmassa oli 319 ng/ml (vaihteluväli: 102-771 ng/ml), joka ilmaantui keskimäärin 2,5 tunnin kuluttua (vaihteluväli: 1-6 tuntia) annostelu. Keskimääräinen vähimmäispitoisuus vakaassa tilassa oli 122 ng/ml (vaihteluväli: 41-343 ng/ml) 100 mg:n kahdesti vuorokaudessa antamisen jälkeen. Ruoka ei näytä vaikuttavan CLOZARILin systeemiseen hyötyosuuteen. Siten CLOZARIL 50 mg voidaan ottaa ruoan kanssa tai ilman.
Jakelu
Klotsapiini sitoutuu noin 97 % seerumin proteiineihin. Klotsapiinin ja muiden voimakkaasti proteiineihin sitoutuneiden lääkkeiden välistä yhteisvaikutusta ei ole täysin arvioitu, mutta se voi olla tärkeä [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Aineenvaihdunta ja erittyminen
Klotsapiini metaboloituu lähes kokonaan ennen erittymistä, ja virtsasta ja ulosteista havaitaan vain pieniä määriä muuttumatonta lääkettä. Klotsapiini on monien sytokromi P450:n isoentsyymien, erityisesti CYP1A2:n, CYP2D6:n ja CYP3A4:n, substraatti. Noin 50 % annetusta annoksesta erittyy virtsaan ja 30 % ulosteisiin. Demetyloidut, hydroksyloidut ja N-oksidijohdannaiset ovat sekä virtsan että ulosteen komponentteja. Farmakologiset testit ovat osoittaneet, että desmetyylimetaboliitilla (norklotsapiinilla) on vain rajoitettu aktiivisuus, kun taas hydroksyloidut ja N-oksidijohdannaiset olivat inaktiivisia. Klotsapiinin keskimääräinen eliminaation puoliintumisaika 75 mg:n kerta-annoksen jälkeen oli 8 tuntia (vaihteluväli: 4–12 tuntia), verrattuna keskimääräiseen eliminaation puoliintumisaikaan 12 tuntia (vaihteluväli: 4–66 tuntia) vakaan tilan saavuttamisen jälkeen. 100 mg kahdesti vuorokaudessa.
Klotsapiinin kerta- ja usean annoksen annon vertailu osoitti, että eliminaation puoliintumisaika piteni merkittävästi toistuvan annostelun jälkeen verrattuna kerta-annoksen jälkeen, mikä viittaa pitoisuudesta riippuvaisen farmakokinetiikkaan. Vakaassa tilassa havaittiin kuitenkin suunnilleen annokseen suhteutettuja muutoksia suhteessa AUC-arvoon (käyrän alla), huippu- ja minimipitoisuuksiin klotsapiinin plasmassa, kun annettiin 37,5, 75 ja 150 mg kahdesti vuorokaudessa.
Huumeiden väliset vuorovaikutustutkimukset
Fluvoksamiini
Farmakokineettinen tutkimus suoritettiin 16 skitsofreniapotilaalla, jotka saivat klotsapiinia vakaan tilan olosuhteissa. Kun fluvoksamiinia annettiin samanaikaisesti 14 päivän ajan, klotsapiinin ja sen metaboliittien, N-desmetyyliklotsapiinin ja klotsapiini-N-oksidin, keskimääräiset vähimmäispitoisuudet nousivat noin kolminkertaisiksi verrattuna vakaan tilan peruspitoisuuksiin.
Paroksetiini, fluoksetiini ja sertraliini
Tutkimuksessa skitsofreenisilla potilailla (n=14), jotka saivat klotsapiinia vakaan tilan olosuhteissa, paroksetiinin samanaikainen anto aiheutti vain vähäisiä muutoksia klotsapiinin ja sen metaboliittien pitoisuuksissa. Muissa julkaistuissa raporteissa kuvataan kuitenkin vaatimatonta (alle kaksinkertaista) klotsapiini- ja metaboliittipitoisuuksien nousua, kun klotsapiinia otettiin paroksetiinin, fluoksetiinin ja sertraliinin kanssa.
Erityiset väestötutkimukset
Munuaisten tai maksan vajaatoiminta
Mitään erityisiä farmakokineettisiä tutkimuksia ei ole tehty munuaisten tai maksan vajaatoiminnan vaikutusten tutkimiseksi klotsapiinin farmakokinetiikkaan. Suuremmat klotsapiinipitoisuudet plasmassa ovat todennäköisiä potilailla, joilla on merkittävä munuaisten tai maksan vajaatoiminta tavanomaisia annoksia käytettäessä.
CYP2D6 huonot metaboloijat
Osalla väestöstä (3 %–10 %) CYP2D6:n aktiivisuus on vähentynyt (CYP2D6:n hitaat metaboloijat). Näille henkilöille voi kehittyä odotettua korkeampi klotsapiinipitoisuus plasmassa, kun niitä annetaan tavallisilla annoksilla.
Kliiniset tutkimukset
Hoitoa kestävä skitsofrenia
CLOZARIL 100 mg:n teho hoitoresistentissä skitsofrenian hoidossa varmistettiin monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, aktiivisesti kontrolloidussa (klooripromatsiini) tutkimuksessa potilailla, joilla oli DSM-III -diagnoosi skitsofrenia ja jotka eivät saaneet riittävää vastetta vähintään kolmelle eri psykoosilääkkeelle ( vähintään kahdesta eri kemiallisesta luokasta) viimeisten 5 vuoden aikana. Antipsykoottiset tutkimukset on täytynyt arvioida riittäviksi; antipsykoottisten annosten on täytynyt olla yhtä suuria tai suurempia kuin 1 000 mg päivässä klooripromatsiinia vähintään 6 viikon ajan ilman, että oireet ovat vähentyneet merkittävästi. Viiden edeltävien vuoden aikana ei ole täytynyt olla hyvän toiminnan jaksoa. Potilaiden peruspistemäärän on täytynyt olla vähintään 45 tutkijan arvioimalla BPRS-asteikolla (Brief Psychiatric Rating Scale). 18 kohdan BPRS:ssä 1 tarkoittaa oireiden puuttumista ja 7 vakavia oireita; suurin mahdollinen BPRS-pistemäärä on 126. Lähtötilanteessa BPRS-pistemäärän keskiarvo oli 61. Lisäksi potilaiden on täytynyt saada vähintään 4 pisteet vähintään kahdessa seuraavista neljästä yksittäisestä BPRS-kohdasta: käsitteellinen epäjärjestys, epäluuloisuus, hallusinaatiot käyttäytyminen ja epätavallinen ajatussisältö. Potilaiden kliinisen maailmanlaajuisen vaikutelman vakavuusasteikon pistemäärän on täytynyt olla vähintään 4 (kohtalaisen sairas).
Tutkimuksen prospektiivisessa aloitusvaiheessa kaikki potilaat (N=305) saivat aluksi yksisokkohoitoa haloperidolilla (keskimääräinen annos oli 61 mg päivässä) 6 viikon ajan. Yli 80 % potilaista suoritti 6 viikkoa kestäneen tutkimuksen. Potilaat, joilla ei ollut riittävä vaste haloperidoliin (n = 268), satunnaistettiin kaksoissokkohoitoon CLOZARILilla (N = 126) tai klooripromatsiinilla (N = 142). Suurin päivittäinen CLOZARIL-annos oli 900 mg; keskimääräinen vuorokausiannos oli > 600 mg. Suurin päivittäinen klooripromatsiiniannos oli 1800 mg; keskimääräinen vuorokausiannos oli > 1200 mg.
Ensisijainen päätetapahtuma oli hoitovaste, joka määriteltiin ennalta BPRS-pistemäärän laskuna vähintään 20 % ja joko (1) CGI-S-pisteeksi
Toistuva itsemurhakäyttäytyminen skitsofreniassa tai skitsoaffektiivisessa häiriössä
CLOZARILin tehokkuutta toistuvan itsemurhakäyttäytymisen riskin vähentämisessä arvioitiin International Suicide Prevention Trial -tutkimuksessa (InterSePT™, Novartis Pharmaceuticals Corporationin tavaramerkki). Tämä oli prospektiivinen, satunnaistettu, avoin, aktiivisesti kontrolloitu, monikeskus, kansainvälinen rinnakkaisryhmien vertailu CLOZARILista olantsapiiniin (*Zyprexa®, Eli Lilly and Companyn rekisteröity tavaramerkki) 956 potilaalla, joilla oli skitsofrenia tai skitsoaffektiivinen häiriö ( DSM-IV), joiden arvioitiin olevan toistuvan itsemurhakäyttäytymisen riski. Vain noin neljäsosaa näistä potilaista (27 %) pidettiin resistenteinä tavanomaiselle psykoosilääkkeelle. Osallistuakseen tutkimukseen potilaiden on täytettävä yksi seuraavista kriteereistä:
- He olivat yrittäneet itsemurhaa kolmen vuoden aikana ennen lähtötilanteen arviointia.
- Heidät oli viety sairaalaan estääkseen itsemurhayrityksen kolmen vuoden aikana ennen lähtötilanteen arviointia.
- He osoittivat keskivaikeita tai vaikeita itsemurha-ajatuksia masennuskomponentin kanssa viikon sisällä ennen lähtötilanteen arviointia.
- He osoittivat keskivaikeita tai vaikeita itsemurha-ajatuksia, joihin liittyi käskyhalusinaatioita itsensä vahingoittamiseen viikon sisällä ennen lähtötilanteen arviointia.
Yksittäiset tutkijat määrittelivät annostusohjelmat kullekin hoitoryhmälle, ja ne yksilöivät potilaan mukaan. Annostelu oli joustavaa, ja annosalue oli 200–900 mg/vrk CLOZARILille ja 5–20 mg/vrk olantsapiinille. Niille 956 potilaalle, jotka saivat CLOZARILIA tai olantsapiinia tässä tutkimuksessa, käytettiin laajasti samanaikaisia psykotrooppisia lääkkeitä: 84 % psykoosilääkkeiden kanssa, 65 % anksiolyyttien, 53 % masennuslääkkeiden ja 28 % mielialan stabilointiaineiden kanssa. Olantsapiiniryhmän potilailla oli merkittävästi enemmän samanaikaisten psykotrooppisten lääkkeiden käyttöä.
Ensisijainen tehon mitta oli aika (1) merkittävään itsemurhayritykseen, mukaan lukien suoritettu itsemurha; (2) sairaalahoito välittömän itsemurhariskin vuoksi, mukaan lukien jo sairaalassa olevien potilaiden lisääntynyt itsemurhavalvonta; tai (3) itsemurha-asteikon vakavuuden paheneminen, joka osoitetaan "paljon pahenemisena" tai "erittäin pahenevana" lähtötasosta kliinisen globaalin itsemurhavaikutelman vakavuuden arvioinnissa Blinded Psychiatrist  (CGI-SS-BP) -asteikolla. Suicide Monitoring Board (SMB), potilastietojen sokeutunut asiantuntijaryhmä, määritti, täyttikö raportoitu tapahtuma edellä mainitut kriteerit 1 tai 2.
Yhteensä 980 potilasta satunnaistettiin tutkimukseen ja 956 sai tutkimuslääkitystä. 62 prosentilla potilaista diagnosoitiin skitsofrenia, ja lopuilla (38 %) diagnosoitiin skitsoaffektiivinen häiriö. Vain noin neljäsosa koko potilaspopulaatiosta (27 %) tunnistettiin "hoitoresistentiksi" lähtötilanteessa. Tutkimuksessa oli enemmän miehiä kuin naisia (61 % kaikista potilaista oli miehiä). Tutkimukseen osallistuneiden potilaiden keski-ikä oli 37 vuotta (vaihteluväli 18–69). Suurin osa potilaista oli valkoihoisia (71 %), 15 % oli mustia, 1 % oli aasialaisia ja 13 % luokiteltiin "muihin" rotuun.
Potilailla, joita hoidettiin CLOZARIL 100 mg:lla, oli tilastollisesti merkitsevästi pidempi aika toistuvaan itsemurhakäyttäytymiseen verrattuna olantsapiiniin. Tätä tulosta tulee tulkita vain todisteeksi CLOZARILin tehokkuudesta toistuvan itsemurhakäyttäytymisen viivyttämisessä, ei osoituksena CLOZARIL 50 mg:n paremmasta tehosta olantsapiiniin verrattuna.
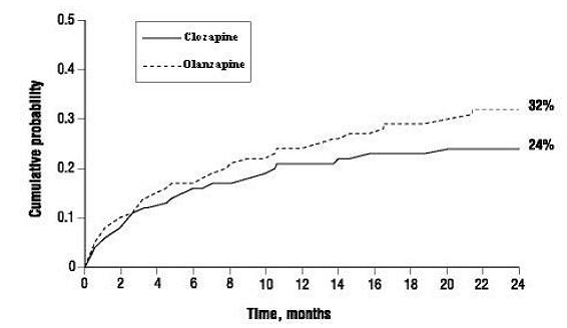
Todennäköisyys joutua (1) merkittävään itsemurhayritykseen, mukaan lukien suoritettu itsemurha, tai (2) sairaalahoitoon välittömän itsemurhariskin vuoksi, mukaan lukien lisääntynyt itsemurhavalvonta jo sairaalahoidossa oleville potilaille, oli pienempi CLOZARIL-potilailla kuin olantsapiinipotilailla. Viikko 104: CLOZARIL 24 % vs. olantsapiini 32 %; 95 % CI erosta: 2 %, 14 % (kuvio 1).
Kuva 1: Merkittävän itsemurhayrityksen tai sairaalahoidon kumulatiivinen todennäköisyys itsemurhan estämiseksi potilailla, joilla on skitsofrenia tai skitsoaffektiivinen häiriö, joilla on suuri itsemurhariski
POTILASTIEDOT
Keskustele potilaiden ja hoitajien kanssa seuraavista asioista:
- Vaikea neutropenia:
- Kerro CLOZARIL-hoidon aloittaville potilaille (ja hoitajille) vakavan neutropenian ja infektion kehittymisen riskistä.
- Neuvo potilaita ilmoittamaan välittömästi lääkärilleen kaikista infektion oireista tai merkeistä (esim. flunssan kaltainen sairaus; kuume; uneliaisuus; yleinen heikkous tai huonovointisuus; limakalvon haavauma; ihon, nielun, emättimen, virtsateiden tai keuhkojen tulehdus; tai äärimmäinen heikkous tai letargia), joita esiintyy milloin tahansa CLOZARIL 100 mg -hoidon aikana, neutropenian arvioinnin helpottamiseksi ja nopean ja asianmukaisen hoidon aloittamiseksi. [katso VAROITUKSET JA VAROTOIMET ].
- Potilaiden ja omaishoitajien tiedottaminen CLOZARIL 25 mg on saatavilla vain rajoitetun ohjelman kautta, nimeltään Clozapine REMS Program, joka on suunniteltu varmistamaan vaadittu veren seuranta vakavan neutropenian kehittymisen riskin vähentämiseksi. Neuvo potilaita ja omaishoitajia verikokeiden tärkeydestä seuraavasti:
- Viikoittainen verikoe vaaditaan ensimmäisten 6 kuukauden ajan.
- ANC vaaditaan 2 viikon välein seuraavien 6 kuukauden ajan, jos hyväksyttävä ANC säilyy jatkuvan hoidon ensimmäisten 6 kuukauden aikana,
- Sen jälkeen ANC vaaditaan 4 viikon välein, jos hyväksyttävä ANC säilyy jatkuvan hoidon toisen 6 kuukauden aikana.
- CLOZARIL 50mg on saatavana vain ohjelmaan osallistuvista sertifioiduista apteekeista. Anna potilaille (ja hoitajille) verkkosivuston tiedot ja puhelinnumero tuotteen hankkimiseksi (www.clozapinerems.com tai 1-844-267-8678) [katso VAROITUKSET JA VAROTOIMET ].
- Ortostaattinen hypotensio, bradykardia ja pyörtyminen: Kerro potilaille ja hoitajille ortostaattisen hypotension ja pyörtymisen riskistä, erityisesti aloitusannoksen titrauksen aikana. Neuvo heitä noudattamaan tarkasti lääkärin antamia annostus- ja annosteluohjeita. Neuvo potilaita ottamaan yhteyttä lääkäriin välittömästi, jos he tuntevat pyörtymistä, menettävät tajuntansa tai heillä on bradykardiaan tai rytmihäiriöön viittaavia merkkejä tai oireita [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ].
- Kohtaukset: Kerro potilaille ja hoitajille merkittävästä kohtausten riskistä CLOZARIL 100 mg -hoidon aikana. Varoita heitä ajamisesta ja kaikesta muusta mahdollisesti vaarallisesta toiminnasta CLOZARIL-hoidon aikana [katso VAROITUKSET JA VAROTOIMET ].
- Ruoansulatuskanavan hypomotiliteetti, johon liittyy vakavia komplikaatioita: Kouluta potilaita ja hoitajia klotsapiinin aiheuttaman ummetuksen riskeistä, ehkäisystä ja hoidosta, mukaan lukien mahdollisuuksien mukaan vältettävät lääkkeet (esim. lääkkeet, joilla on antikolinerginen vaikutus). Edistä asianmukaista nesteytystä, fyysistä aktiivisuutta ja kuidun saantia ja korosta, että ummetuksen tai muiden maha-suolikanavan oireiden kehittymisen nopea huomio ja hoito on ratkaisevan tärkeää vakavien komplikaatioiden ehkäisemisessä. Neuvo potilaita ja hoitajia ottamaan yhteyttä terveydenhuollon tarjoajaan, jos heillä on ummetusoireita (esim. ulostamistiheys, epätäydellinen uloste, vähentynyt suoliston liikuntatiheys) tai muita maha-suolikanavan hypomotiliteettiin liittyviä oireita (esim. oksentelu) [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
- QT-ajan pidentyminen: Neuvo potilaita ottamaan yhteyttä lääkäriin välittömästi, jos he tuntevat pyörtymistä, menettävät tajuntansa tai heillä on rytmihäiriöön viittaavia merkkejä tai oireita. Neuvo potilaita olemaan käyttämättä CLOZARILia muiden QT-ajan pidentymistä aiheuttavien lääkkeiden kanssa. Neuvo potilaita ilmoittamaan lääkäreilleen, että he ottavat CLOZARIL 25 mg ennen mitään uutta lääkettä [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
- Aineenvaihduntamuutokset (hyperglykemia ja diabetes mellitus, dyslipidemia, painonnousu): Kouluta potilaita ja hoitajia aineenvaihdunnan muutosten riskeistä ja erityisen seurannan tarpeesta. Riskejä ovat hyperglykemia ja diabetes mellitus, dyslipidemia, painonnousu ja sydän- ja verisuonireaktiot. Kouluta potilaita ja hoitajia hyperglykemian (korkea verensokeri) ja diabeteksen (esim. polydipsia, polyuria, polyfagia ja heikkous) oireista. Tarkkaile kaikkia potilaita näiden oireiden varalta. Potilaiden, joilla on diagnosoitu diabetes tai joilla on diabeteksen riskitekijöitä (lihavuus, diabetes suvussa), paastoverensokeria tulee seurata ennen hoidon aloittamista ja määräajoin hoidon aikana. Potilaille, joille kehittyy hyperglykemian oireita, tulee arvioida paastoglukoosiarvo. Painon kliinistä seurantaa suositellaan [ks VAROITUKSET JA VAROTOIMET ].
- Kognitiivisen ja motorisen suorituskyvyn häiriintyminen: Koska CLOZARIL saattaa heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee varoittaa vaarallisten koneiden, mukaan lukien autojen, käytöstä, kunnes he ovat kohtuullisen varmoja siitä, että CLOZARIL-hoito ei vaikuta heihin haitallisesti [ks. VAROITUKSET JA VAROTOIMET ].
- Unohtuneet annokset ja hoidon uudelleen aloittaminen: Kerro potilaille ja hoitajille, että jos potilas jättää CLOZARIL 50 mg -annoksen ottamatta yli 2 päivää, heidän ei tule aloittaa uudelleen lääkitystä samalla annoksella, vaan heidän tulee ottaa yhteyttä lääkäriin saadakseen annostusohjeet [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ].
- Raskaus: Potilaiden ja hoitajien tulee ilmoittaa lääkärille, jos potilas tulee raskaaksi tai aikoo tulla raskaaksi hoidon aikana [ks. Käyttö tietyissä populaatioissa ].
- Imetys: Neuvo potilaita ja hoitajia, että potilas ei saa imettää vauvaa, jos he käyttävät CLOZARILia [ks. Käyttö tietyissä populaatioissa ].
- Samanaikainen lääkitys: Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he käyttävät tai suunnittelevat ottavansa mitä tahansa resepti- tai käsikauppalääkkeitä; on mahdollista merkittäviä lääkkeiden välisiä yhteisvaikutuksia [katso ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET ].
