Buspar 5mg, 10mg Buspirone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Buspar on ja miten sitä käytetään?
Buspar 5mg on reseptilääke, jota käytetään ahdistuneisuushäiriöiden oireiden hoitoon. Buspar 5mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Buspar kuuluu lääkkeiden luokkaan, joita kutsutaan antianxiety-aineiksi, anksiolyytiksiksi, ei-bentsodiatsepiineiksi.
Mitkä ovat Busparin mahdolliset sivuvaikutukset?
Mitkä ovat Buspar 5mg:n mahdolliset sivuvaikutukset?
Buspar voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintakipu,
- hengenahdistus ja
- huimaus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Busparin yleisimpiä sivuvaikutuksia ovat:
- päänsärky,
- huimaus,
- uneliaisuus,
- unihäiriö (unettomuus),
- pahoinvointi,
- vatsavaivat ja
- hermostunut tai innostunut tunne
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Busparin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Buspironihydrokloriditabletit, USP, ovat ahdistusta lievittäviä aineita, jotka eivät ole kemiallisesti tai farmakologisesti sukua bentsodiatsepiineille, barbituraateille tai muille rauhoittaville/anksiolyyttisille lääkkeille.
Buspironihydrokloridi, USP, on valkoinen kiteinen jauhe. Se liukenee hyvin veteen; liukenee vapaasti metanoliin ja metyleenikloridiin; niukkaliukoinen etanoliin ja asetonitriiliin; liukenee hyvin heikosti etyyliasetaattiin ja käytännöllisesti katsoen liukenematon heksaaneihin. Sen molekyylipaino on 422. Kemiallisesti buspironihydrokloridi on 8-[4-[4-(2-pyrimidinyyli)-1-piperatsinyyli]butyyli]-8-atsaspiro[4.5]dekaani-7,9-dionimonohydrokloridi. Molekyylikaava C21H31N5O2•HCl esitetään seuraavalla rakennekaavalla:
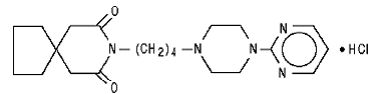
Jokainen oraaliseen käyttöön tarkoitettu buspironihydrokloriditabletti sisältää 5 mg tai 10 mg tai 15 mg tai 30 mg buspironihydrokloridia (vastaa 4,6 mg, 9,1 mg, 13,7 mg ja 27,4 mg vapaata buspironiemästä). Lisäksi jokainen tabletti sisältää seuraavia inaktiivisia aineosia: kolloidinen piidioksidi, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa ja natriumtärkkelysglykolaatti. 5 mg:n ja 10 mg:n tableteissa on jakouurre, jotta ne voidaan jakaa kahtia. Siten 5 mg:n tabletti voi antaa myös 2,5 mg:n annoksen ja 10 mg:n tabletti voi tarjota 5 mg:n annoksen. 15 mg:n ja 30 mg:n tableteissa on jakouurre, jotta ne voidaan joko puolittaa tai jakaa kolmeen osaan. Siten yhdestä 15 mg:n tabletista voidaan saada seuraavat annokset: 15 mg (koko tabletti), 10 mg (kaksi kolmasosaa tabletista), 7,5 mg (puolet tabletista) tai 5 mg (kolmas tabletista) . Yhdellä 30 mg:n tabletilla voidaan saada seuraavat annokset: 30 mg (koko tabletti), 20 mg (kaksi kolmasosaa tabletista), 15 mg (puolet tabletista) tai 10 mg (kolmasosa tabletista).
INDIKAATIOT
Buspironihydrokloriditabletit on tarkoitettu ahdistuneisuushäiriöiden hoitoon tai ahdistuneisuuden oireiden lyhytaikaiseen lievitykseen. Arjen stressiin liittyvä ahdistus tai jännitys ei yleensä vaadi hoitoa anksiolyyttisellä lääkkeellä.
Buspironihydrokloriditablettien teho on osoitettu kontrolloiduissa kliinisissä tutkimuksissa avopotilailla, joiden diagnoosi vastaa karkeasti yleistynyttä ahdistuneisuushäiriötä (GAD). Monilla näihin tutkimuksiin osallistuneilla potilailla oli myös samanaikaisesti esiintyviä masennusoireita, ja buspironihydrokloriditabletit lievittivät ahdistusta näiden rinnakkaisten masennusoireiden yhteydessä. Näissä tutkimuksissa arvioiduilla potilailla oli oireita 1 kuukaudesta yli 1 vuoteen ennen tutkimusta, ja oireiden keskimääräinen kesto oli 6 kuukautta. Yleistynyt ahdistuneisuushäiriö (300.02) on kuvattu American Psychiatric Associationin diagnostisessa ja tilastollisessa käsikirjassa III1 seuraavasti:
Yleistynyt, jatkuva ahdistuneisuus (kesto vähintään 1 kuukausi), joka ilmenee oireina kolmesta seuraavista neljästä kategoriasta:
Moottorin jännitys
Vapina, hermostuneisuus, hyppiminen, vapina, jännitys, lihaskivut, väsymys, kyvyttömyys rentoutua, silmäluomien nykiminen, rypistynyt kulmakarva, kireät kasvot, järkytys, levottomuus, helppo säikähdys.
Autonominen hyperaktiivisuus
Hikoilu, sydämen hakkaaminen tai lyöminen, kylmät, märkät kädet, suun kuivuminen, huimaus, huimaus, parestesiat (käsien tai jalkojen pistely), vatsavaivat, kuumat tai kylmät jaksot, tiheä virtsaaminen, ripuli, epämiellyttävä tunne mahalaukussa, kyhmy kurkussa, punoitus, kalpeus, korkea lepopulssi ja hengitystiheys.
Pelottava odotus
Ahdistus, huoli, pelko, märehtiminen ja itsensä tai muiden onnettomuuden ennakointi.
Valppaus ja skannaus
Ylimääräinen tarkkaavaisuus, joka johtaa häiriötekijöihin, keskittymisvaikeuksiin, unettomuuteen, "reunassa", ärtyneisyyteen, kärsimättömyyteen.
Yllä olevat oireet eivät johtuisi muusta mielenterveyshäiriöstä, kuten masennushäiriöstä tai skitsofreniasta. Lievät masennusoireet ovat kuitenkin yleisiä GAD:ssa.
Buspironihydrokloriditablettien tehoa pitkäaikaisessa käytössä eli yli 3–4 viikon käytössä ei ole osoitettu kontrolloiduissa tutkimuksissa. Ei ole olemassa todisteita, jotka osoittaisivat järjestelmällisesti GAD:n asianmukaisen hoidon keston. Pitkäaikaista käyttöä koskevassa tutkimuksessa 264 potilasta kuitenkin hoidettiin buspironihydrokloriditableteilla vuoden ajan ilman haittavaikutuksia. Siksi lääkärin, joka päättää käyttää buspironihydrokloriditabletteja pitkiä aikoja, tulee säännöllisesti arvioida uudelleen lääkkeen käyttökelpoisuus yksittäiselle potilaalle.
ANNOSTELU JA HALLINNOINTI
Suositeltu aloitusannos on 15 mg vuorokaudessa (7,5 mg kahdesti). Optimaalisen terapeuttisen vasteen saavuttamiseksi annosta voidaan tarvittaessa nostaa 5 mg:lla vuorokaudessa 2–3 päivän välein. Suurin päiväannos ei saa ylittää 60 mg päivässä. Kliinisissä tutkimuksissa, joissa annostitraus mahdollisti, käytettiin yleisesti jaettuja annoksia 20–30 mg päivässä.
Buspironin hyötyosuus lisääntyy, kun se annetaan ruoan kanssa verrattuna paastotilaan (ks KLIININEN FARMAKOLOGIA ). Tästä syystä potilaiden tulee ottaa buspironia johdonmukaisesti annostelun ajoituksen suhteen; joko aina ruoan kanssa tai aina ilman.
Kun buspironia annetaan voimakkaan CYP3A4:n estäjän kanssa, annossuositukset on kuvattu HUUMEIDEN VUOROVAIKUTUKSET kohtaa tulee noudattaa.
MITEN TOIMITETAAN
Buspironihydrokloriditabletit USP, 5 mg ovat valkoisia tai luonnonvalkoisia, kapselin muotoisia, litteäpintaisia, viistoreunaisia tabletteja, joiden toisella puolella on kaiverrus; puolikkaan toisella puolella on 'ZE' ja toisella '36' ja toinen puoli on sileä
Valmistajan tiedot: N/A. Tarkistettu: toukokuuta 2016
SIVUVAIKUTUKSET
Tietoja ei ole annettu.
HUUMEIDEN VUOROVAIKUTUKSET
Psykotrooppiset aineet
MAO-estäjät
On suositeltavaa, että buspironihydrokloriditabletteja ei käytetä samanaikaisesti MAO-estäjien kanssa (ks VAROITUKSET ).
Amitriptyliini
Kun buspironi lisättiin amitriptyliinin annosohjelmaan, amitriptyliinin tai sen metaboliitin nortriptyliinin vakaan tilan farmakokineettisissä parametreissa (Cmax, AUC ja Cmin) ei havaittu tilastollisesti merkitseviä eroja.
Diatsepaami
Kun diatsepaamin annosohjelmaan lisättiin buspironi, vakaan tilan farmakokineettisissä parametreissa (Cmax, AUC ja Cmin) ei havaittu tilastollisesti merkittäviä eroja diatsepaamilla, mutta nordiatsepaamin kohdalla havaittiin noin 15 %:n nousua ja vähäisiä kliinisiä haittavaikutuksia. (huimausta, päänsärkyä ja pahoinvointia).
haloperidoli
Tavallisilla vapaaehtoisilla tehdyssä tutkimuksessa buspironin ja haloperidolin samanaikainen anto johti seerumin haloperidolipitoisuuksien nousuun. Tämän löydön kliininen merkitys ei ole selvä.
Nefatsodoni
[katso Sytokromi P450 3A4:n (CYP3A4) estäjät ja indusoijat ].
Trazodone
Yksi raportti viittaa siihen, että Desyrel®#:n (tratsodonihydrokloridin) ja buspironin samanaikainen käyttö on saattanut aiheuttaa 3–6-kertaisen SGPT:n (ALT) nousun muutamilla potilailla. Samankaltaisessa tutkimuksessa, jossa yritettiin toistaa tämä löydös, ei havaittu interaktiivista vaikutusta maksan transaminaaseihin.
Triatsolaami/fluratsepaami
Buspironin samanaikainen anto triatsolaamin tai fluratsepaamin kanssa ei näyttänyt pidentävän tai tehostavan kummankaan bentsodiatsepiinin rauhoittavia vaikutuksia.
Muut psykotrooppiset aineet
Koska buspironin ja useimpien muiden psykotrooppisten lääkkeiden samanaikaisen käytön vaikutuksia ei ole tutkittu, buspironin samanaikaista käyttöä muiden keskushermostoon vaikuttavien lääkkeiden kanssa tulee suhtautua varoen.
Sytokromi P450 3A4:n (CYP3A4) estäjät ja indusoijat
Buspironin on osoitettu metaboloituvan in vitro CYP3A4:n välityksellä. Tämä havainto on yhdenmukainen buspironin ja seuraavien välillä havaittujen in vivo -vuorovaikutusten kanssa:
Diltiatsemi ja verapamiili
Yhdeksällä terveellä vapaaehtoisella tehdyssä tutkimuksessa buspironin (10 mg kerta-annoksena) ja verapamiilin (80 mg tid) tai diltiatseemin (60 mg tid) samanaikainen anto suurensi plasman buspironipitoisuuksia (verapamiili lisäsi buspironin AUC- ja Cmax-arvoja 3,4-kertaisiksi, kun taas diltiatseemi AUC 5,5-kertaiseksi ja Cmax 4-kertaiseksi.) Buspironista johtuvat haittatapahtumat voivat olla todennäköisempiä käytettäessä samanaikaisesti joko diltiatseemin tai verapamiilin kanssa. Myöhempi annoksen muuttaminen voi olla tarpeen, ja sen tulee perustua kliiniseen arviointiin.
Erytromysiini
Terveillä vapaaehtoisilla tehdyssä tutkimuksessa buspironin (10 mg kerta-annoksena) ja erytromysiinin (1,5 g/vrk 4 päivän ajan) samanaikainen anto suurensi plasman buspironipitoisuuksia (5-kertainen Cmax ja 6-kertainen AUC). Näihin farmakokineettisiin yhteisvaikutuksiin liittyi buspironista johtuvien sivuvaikutusten lisääntynyt ilmaantuvuus. Jos näitä kahta lääkettä käytetään yhdessä, suositellaan pientä buspironiannosta (esim. 2,5 mg kahdesti). Jommankumman lääkkeen myöhemmän annoksen muuttamisen tulee perustua kliiniseen arviointiin.
Greippimehu
Terveillä vapaaehtoisilla tehdyssä tutkimuksessa buspironin (10 mg kerta-annoksena) samanaikainen anto greippimehun kanssa (200 ml kaksinkertainen vahvuus tid 2 päivän ajan) nosti plasman buspironipitoisuuksia (4,3-kertainen Cmax-arvon nousu; 9,2-kertainen AUC-arvon nousu). ). Buspironia saavia potilaita tulee neuvoa välttämään näin suuria määriä greippimehua.
Itrakonatsoli
Terveillä vapaaehtoisilla tehdyssä tutkimuksessa buspironin (10 mg kerta-annoksena) ja itrakonatsolin (200 mg/vrk 4 päivän ajan) samanaikainen anto suurensi plasman buspironipitoisuuksia (13-kertainen Cmax ja 19-kertainen AUC). Näihin farmakokineettisiin yhteisvaikutuksiin liittyi buspironista johtuvien sivuvaikutusten lisääntynyt ilmaantuvuus. Jos näitä kahta lääkettä käytetään yhdessä, suositellaan pientä buspironiannosta (esim. 2,5 mg qd). Jommankumman lääkkeen myöhemmän annoksen muuttamisen tulee perustua kliiniseen arviointiin.
Nefatsodoni
Terveillä vapaaehtoisilla tehdyssä vakaan tilan farmakokinetiikkaa koskevassa tutkimuksessa buspironin (2,5 tai 5 mg kahdesti kahdesti) ja nefatsodonin (250 mg kahdesti kahdesti) samanaikainen anto johti plasman buspironipitoisuuksien huomattavaan nousuun (jopa 20-kertaiseksi Cmax-arvossa ja jopa 50-kertaiseksi). -kertaiseksi AUC-arvossa) ja tilastollisesti merkitsevästi (noin 50 %) buspironin metaboliitin 1-PP:n plasmapitoisuuksien laskua. Kun buspironia annettiin 5 mg kahdesti kahdesti, nefatsodonin (23 %) ja sen metaboliittien hydroksinefatsodonin (HO-NEF) (17 %) ja metakloorifenyylipiperatsiinin (9 %) AUC-arvot nousivat hieman. Nefatsodonilla (8 %) ja sen metaboliitilla HO-NEF:llä (11 %) havaittiin lievää Cmax-arvon nousua.
Koehenkilöt, jotka saivat buspironia 5 mg kahdesti ja nefatsodonia 250 mg kahdesti kahdesti, kokivat huimausta, voimattomuutta, huimausta ja uneliaisuutta. Haittavaikutuksia havaittiin myös käytettäessä jompaakumpaa lääkettä yksinään. Jos näitä kahta lääkettä käytetään yhdessä, suositellaan pientä buspironiannosta (esim. 2,5 mg qd). Jommankumman lääkkeen myöhemmän annoksen muuttamisen tulee perustua kliiniseen arviointiin.
Rifampiini
Terveillä vapaaehtoisilla tehdyssä tutkimuksessa buspironin (30 mg kerta-annoksena) ja rifampiinin (600 mg/vrk 5 päivän ajan) samanaikainen anto alensi plasman pitoisuuksia (83,7 %:n lasku Cmaxissa; 89,6 %:n lasku AUC:ssa) ja farmakodynaamisia vaikutuksia. buspironi. Jos näitä kahta lääkettä käytetään yhdessä, buspironin annosta voi olla tarpeen säätää anksiolyyttisen vaikutuksen säilyttämiseksi.
Muut CYP3A4:n estäjät ja indusoijat
CYP3A4:ää estävät aineet, kuten ketokonatsoli tai ritonaviiri, voivat estää buspironin metaboliaa ja lisätä buspironin pitoisuuksia plasmassa, kun taas CYP3A4:ää indusoivat aineet, kuten deksametasoni, tai tietyt kouristuksia estävät aineet (fenytoiini, fenobarbitaali, karbamatsepiini) voivat nopeuttaa buspironin metaboliaa. Jos potilas on titrattu vakaaseen buspironin annokseen, buspironin annoksen muuttaminen voi olla tarpeen buspironista tai heikentyneestä ahdistusta lievittävästä vaikutuksesta johtuvien haittatapahtumien välttämiseksi. Tästä syystä, kun sitä annetaan voimakkaan CYP3A4:n estäjän kanssa, suositellaan pientä buspironiannosta, jota käytetään varoen. Kun buspironin annosta käytetään yhdessä voimakkaan CYP3A4:n indusoijan kanssa, sen annosta voidaan joutua säätämään ahdistusta lievittävän vaikutuksen säilyttämiseksi.
Muut huumeet
Simetidiini
Buspironin ja simetidiinin samanaikaisen antamisen havaittiin suurentavan Cmax:ia (40 %) ja Tmax:ia (2-kertaisesti), mutta sillä oli minimaaliset vaikutukset buspironin AUC-arvoon.
Proteiinin sitoutuminen
In vitro buspironi ei syrjäytä tiukasti sitoutuneita lääkkeitä, kuten fenytoiinia, propranololia ja varfariinia seerumin proteiineista. On kuitenkin raportoitu, että protrombiiniaika pitenee, kun buspironia lisättiin varfariinilla hoidetun potilaan hoito-ohjelmaan. Potilas sai myös kroonisesti fenytoiinia, fenobarbitaalia, digoksiinia ja Synthroid®*. In vitro buspironi voi syrjäyttää vähemmän lujasti sitoutuneita lääkkeitä, kuten digoksiinia. Tämän ominaisuuden kliinistä merkitystä ei tunneta.
Aspiriinin, desipramiinin, diatsepaamin, fluratsepaamin, ibuprofeenin, propranololin, tioridatsiinin ja tolbutamidin terapeuttisilla tasoilla oli vain rajallinen vaikutus buspironin sitoutumisasteeseen plasman proteiineihin (ks. KLIININEN FARMAKOLOGIA ).
Lääke/laboratoriotestien vuorovaikutukset
Buspironihydrokloridi voi häiritä virtsan metanefriini/katekoliamiinimääritystä. Se on virheellisesti luettu metanefriiniksi feokromosytooman rutiinitestien aikana, mikä on johtanut väärään positiiviseen laboratoriotulokseen. Buspironihydrokloridin käyttö tulee siksi lopettaa vähintään 48 tunniksi ennen virtsankeräämistä katekoliamiinien varalta.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aineluokka
Buspironihydrokloridi ei ole valvottu aine.
Fyysinen ja psykologinen riippuvuus
Ihmisillä ja eläimillä tehdyissä tutkimuksissa buspironi ei ole osoittanut mahdollisia väärinkäytöksiä tai väärinkäytöksiä, eikä ole näyttöä siitä, että se aiheuttaisi toleranssia tai fyysistä tai psyykkistä riippuvuutta. Vapaaehtoisia ihmisiä, jotka olivat aiemmin käyttäneet huumeita tai alkoholia, tutkittiin kahdessa kaksoissokkoutetussa kliinisessä tutkimuksessa. Kukaan koehenkilöistä ei pystynyt erottamaan buspironihydrokloriditabletteja lumelääkkeestä. Sitä vastoin koehenkilöt suosivat tilastollisesti merkitsevästi metakvalonia ja diatsepaamia. Apinoilla, hiirillä ja rotilla tehdyt tutkimukset ovat osoittaneet, että buspironilla ei ole mahdollisuutta väärinkäyttöön. Kroonisen annon jälkeen rotalle buspironin äkillinen lopettaminen ei johtanut painon laskuun, joka on yleisesti havaittu fyysistä riippuvuutta aiheuttavien aineiden yhteydessä.
Vaikka ei ole suoria todisteita siitä, että buspironihydrokloriditabletit aiheuttaisivat fyysistä riippuvuutta tai huumeiden etsintäkäyttäytymistä, on kokeiden perusteella vaikea ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle ja/tai väärinkäyttöön sen jälkeen, kun se on markkinoille tullut. Tästä syystä lääkäreiden tulee huolellisesti arvioida potilaiden anamneesi huumeiden väärinkäytön varalta ja seurata tällaisia potilaita tarkasti ja tarkkailla heitä buspironihydrokloriditablettien väärinkäytön tai väärinkäytön merkkien varalta (esim. toleranssin kehittyminen, annoksen lisääminen, huumeiden etsintäkäyttäytyminen).
Valvottu aineluokka
Buspironihydrokloridi ei ole valvottu aine.
Fyysinen ja psykologinen riippuvuus
Ihmisillä ja eläimillä tehdyissä tutkimuksissa buspironi ei ole osoittanut mahdollisia väärinkäytöksiä tai väärinkäytöksiä, eikä ole näyttöä siitä, että se aiheuttaisi toleranssia tai fyysistä tai psyykkistä riippuvuutta. Vapaaehtoisia ihmisiä, jotka olivat aiemmin käyttäneet huumeita tai alkoholia, tutkittiin kahdessa kaksoissokkoutetussa kliinisessä tutkimuksessa. Kukaan koehenkilöistä ei pystynyt erottamaan buspironihydrokloriditabletteja lumelääkkeestä. Sitä vastoin koehenkilöt suosivat tilastollisesti merkitsevästi metakvalonia ja diatsepaamia. Apinoilla, hiirillä ja rotilla tehdyt tutkimukset ovat osoittaneet, että buspironilla ei ole mahdollisuutta väärinkäyttöön. Kroonisen annon jälkeen rotalle buspironin äkillinen lopettaminen ei johtanut painon laskuun, joka on yleisesti havaittu fyysistä riippuvuutta aiheuttavien aineiden yhteydessä.
Vaikka ei ole suoria todisteita siitä, että buspironihydrokloriditabletit aiheuttaisivat fyysistä riippuvuutta tai huumeiden etsintäkäyttäytymistä, on kokeiden perusteella vaikea ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle ja/tai väärinkäyttöön sen jälkeen, kun se on markkinoille tullut. Tästä syystä lääkäreiden tulee huolellisesti arvioida potilaiden anamneesi huumeiden väärinkäytön varalta ja seurata tällaisia potilaita tarkasti ja tarkkailla heitä buspironihydrokloriditablettien väärinkäytön tai väärinkäytön merkkien varalta (esim. toleranssin kehittyminen, annoksen lisääminen, huumeiden etsintäkäyttäytyminen).
VAROITUKSET
Buspironihydrokloriditablettien antaminen potilaalle, joka käyttää monoamiinioksidaasin estäjää (MAOI), voi aiheuttaa vaaran. Kohonnutta verenpainetta on raportoitu, kun buspironihydrokloriditabletteja on lisätty MAO:n estäjähoitoon. Siksi on suositeltavaa, että buspironihydrokloriditabletteja ei käytetä samanaikaisesti MAO-estäjän kanssa.
Koska buspironihydrokloriditableteilla ei ole todettua antipsykoottista vaikutusta, sitä ei tule käyttää sopivan antipsykoottisen hoidon sijasta.
VAROTOIMENPITEET
Kenraali
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
Tutkimukset osoittavat, että buspironihydrokloriditabletit ovat vähemmän rauhoittavia kuin muut anksiolyytit ja että ne eivät aiheuta merkittävää toimintahäiriötä. Sen keskushermostovaikutuksia yksittäisillä potilailla ei kuitenkaan ehkä voida ennakoida. Siksi potilaita tulee varoittaa ajamasta autoa tai käyttämästä monimutkaisia koneita, kunnes he ovat kohtuullisen varmoja siitä, että buspironihoito ei vaikuta heihin haitallisesti.
Vaikka viralliset tutkimukset buspironihydrokloridin ja alkoholin vuorovaikutuksesta osoittavat, että buspironi ei lisää alkoholin aiheuttamaa motorisen ja henkisen suorituskyvyn heikkenemistä, on järkevää välttää alkoholin ja buspironin samanaikaista käyttöä.
Mahdolliset vieroitusreaktiot rauhoittavilla/hypnoottisilla/anksiolyyttisillä lääkkeistä riippuvaisilla potilailla
Koska buspironihydrokloriditabletit eivät osoita ristitoleranssia bentsodiatsepiinien ja muiden yleisten rauhoittavien/unilääkkeiden kanssa, ne eivät estä vieroitusoireyhtymää, jota esiintyy usein näiden lääkkeiden hoidon lopettamisen yhteydessä. Siksi ennen buspironihydrokloriditablettien aloittamista on suositeltavaa vetää asteittain pois potilaat, erityisesti potilaat, jotka ovat käyttäneet kroonisesti keskushermostoa lamaavaa lääkettä, aiemmasta hoidostaan. Rebound- tai vieroitusoireita voi esiintyä eri ajanjaksoina riippuen osittain lääkkeen tyypistä ja sen tehokkaasta eliminaation puoliintumisajasta.
Rauhoittavien/unilääkkeiden/anksiolyyttisten lääkkeiden vieroitusoireyhtymä voi ilmetä ärtyneisyyden, ahdistuneisuuden, kiihtyneisyyden, unettomuuden, vapina, vatsakrampit, lihaskrampit, oksentelu, hikoilu, flunssan kaltaiset oireet ilman kuumetta ja joskus jopa kohtauksina. .
Mahdollisia huolenaiheita, jotka liittyvät buspironin sitoutumiseen dopamiinireseptoreihin
Koska buspironi voi sitoutua sentraalisiin dopamiinireseptoreihin, on herännyt kysymys sen mahdollisuudesta aiheuttaa akuutteja ja kroonisia muutoksia dopamiinivälitteisessä neurologisessa toiminnassa (esim. dystonia, pseudoparkinsonismi, akatisia ja tardiivi dyskinesia). Kontrolloiduista tutkimuksista saadut kliiniset kokemukset eivät ole osoittaneet mitään merkittävää neuroleptin kaltaista aktiivisuutta; levottomuusoireyhtymää, joka ilmenee pian hoidon aloittamisen jälkeen, on kuitenkin raportoitu joillain pienellä osalla buspironilla hoidetuista potilaista. Syndrooma voidaan selittää monella tavalla. Esimerkiksi buspironi voi lisätä sentraalista noradrenergistä aktiivisuutta; vaihtoehtoisesti vaikutus voi johtua dopaminergisistä vaikutuksista (eli edustaa akatisiaa). Katso HAITTAVAIKUTUKSET : Markkinoinnin jälkeinen kokemus .
Tietoja potilaille
Buspironihydrokloriditablettien turvallisen ja tehokkaan käytön varmistamiseksi potilaille tulee antaa seuraavat tiedot ja ohjeet:
Kerro lääkärillesi kaikista lääkkeistä, reseptilääkkeistä tai ilman reseptiä, alkoholista tai lääkkeistä, joita käytät tai aiot ottaa buspironihydrokloriditablettien aikana.
Kerro lääkärillesi, jos olet raskaana tai suunnittelet raskautta tai jos tulet raskaaksi, kun käytät buspironihydrokloriditabletteja.
Kerro lääkärillesi, jos imetät vauvaa.
Älä aja autoa tai käytä mahdollisesti vaarallisia koneita ennen kuin koet tämän lääkkeen vaikutuksen sinuun.
Sinun tulee ottaa buspironihydrokloridia johdonmukaisesti, joko aina ruoan kanssa tai aina ilman.
Vältä juomasta suuria määriä greippimehua buspironihydrokloriditabletteja käyttäessäsi.
Laboratoriotestit
Erityisiä laboratoriotutkimuksia ei suositella.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Rotilla ei havaittu todisteita karsinogeenisyydestä 24 kuukauden tutkimuksessa, joka oli noin 133 kertaa suurempi kuin suurin suositeltu suun kautta otettava annos. tai hiirillä 18 kuukautta kestäneen tutkimuksen aikana noin 167 kertaa ihmisen suurin suositeltu suun kautta otettava annos.
Metabolisen aktivaation kanssa tai ilman, buspironi ei indusoinut pistemutaatioita viidessä Salmonella typhimurium -kannassa (Ames Test) tai hiiren lymfooma L5178YTK+ -soluviljelmissä, eikä DNA-vaurioita havaittu buspironilla Wi-38-ihmissoluissa. Kromosomipoikkeavuuksia tai poikkeavuuksia ei esiintynyt hiirten luuydinsoluissa, joille annettiin yksi tai viisi päivittäistä annosta buspironia.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka B
Rotilla ja kaniineilla tehdyissä lisääntymistutkimuksissa ei havaittu hedelmällisyyden heikkenemistä tai sikiövaurioita buspironiannoksilla, jotka olivat noin 30-kertaisia ihmisille suositeltuihin enimmäisannoksiin verrattuna. Ihmisillä ei kuitenkaan ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia raskauden aikana. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
Buspironihydrokloridin vaikutusta naisten synnytykseen ja synnytykseen ei tunneta. Rotilla tehdyissä lisääntymistutkimuksissa ei havaittu haittavaikutuksia.
Imettävät äidit
Buspironin tai sen metaboliittien erittymistä äidinmaitoon ei tiedetä. Rotilla buspironi ja sen metaboliitit erittyvät kuitenkin maitoon. Buspironihydrokloriditablettien antamista imettäville naisille tulee välttää, jos se on kliinisesti mahdollista.
Käyttö lapsille
Buspironin turvallisuutta ja tehokkuutta arvioitiin kahdessa lumekontrolloidussa 6 viikkoa kestäneessä tutkimuksessa, joihin osallistui yhteensä 559 lapsipotilasta (6–17-vuotiaat), joilla oli GAD. Tutkitut annokset olivat 7,5-30 mg kahdesti (15-60 mg/vrk). Buspironin ja lumelääkkeen välillä ei ollut merkittäviä eroja GAD:n oireiden suhteen aikuisten GAD:n hoitoon suositeltujen annosten jälkeen. Farmakokineettiset tutkimukset ovat osoittaneet, että samoilla annoksilla plasman altistuminen buspironille ja sen aktiiviselle metaboliitille, 1-PP:lle, on lapsipotilailla yhtä suuri tai suurempi kuin aikuisilla. Näissä kokeissa ei ole yhdistetty buspironiin odottamattomia turvallisuushavaintoja. Pitkäaikaista turvallisuutta tai tehoa koskevia tietoja tässä populaatiossa ei ole.
Geriatrinen käyttö
Yhdessä tutkimuksessa, johon osallistui 6632 potilasta, jotka saivat buspironia ahdistuneisuuden hoitoon, 605 potilasta oli ≥ 65-vuotiaita ja 41 ≥ 75-vuotiaita; turvallisuus- ja tehoprofiilit näillä 605 iäkkäällä potilaalla (keski-ikä = 70,8 vuotta) olivat samanlaiset kuin nuoremman väestön (keski-ikä = 43,3 vuotta). Spontaanisti raportoitujen kliinisten haittatapahtumien tarkastelussa ei ole havaittu eroja iäkkäiden ja nuorempien potilaiden välillä, mutta joidenkin iäkkäiden potilaiden suurempaa herkkyyttä ei voida sulkea pois.
Ikä ei vaikuttanut buspironin farmakokinetiikkaan (ks KLIININEN FARMAKOLOGIA , Erikoispopulaatiot ).
Käyttö potilailla, joilla on heikentynyt maksan tai munuaisten toiminta
Buspironi metaboloituu maksassa ja erittyy munuaisten kautta. Maksan tai munuaisten vajaatoimintaa sairastavilla potilailla suoritettu farmakokineettinen tutkimus osoitti buspironin plasmapitoisuuden nousua ja pidentyneen puoliintumisajan. Siksi buspironihydrokloriditablettien antamista potilaille, joilla on vaikea maksan tai munuaisten vajaatoiminta, ei voida suositella (ks. KLIININEN FARMAKOLOGIA ).
YLIANNOSTUS
Tietoja ei ole annettu.
VASTA-AIHEET
Buspironihydrokloriditabletit ovat vasta-aiheisia potilaille, jotka ovat yliherkkiä buspironihydrokloridille.
KLIININEN FARMAKOLOGIA
Buspironin vaikutusmekanismia ei tunneta. Buspironi eroaa tyypillisistä bentsodiatsepiinianksiolyyteistä siinä, että sillä ei ole kouristuksia estäviä tai lihasrelaksantteja. Siitä puuttuu myös näkyvä rauhoittava vaikutus, joka liittyy tyypillisimpiin anksiolyytteihin. Prekliiniset in vitro -tutkimukset ovat osoittaneet, että buspironilla on korkea affiniteetti serotoniinireseptoreihin (5-HT1A). Buspironilla ei ole merkittävää affiniteettia bentsodiatsepiinireseptoreihin, eikä se vaikuta GABA:n sitoutumiseen in vitro tai in vivo prekliinisissä malleissa testattuna.
Buspironilla on kohtalainen affiniteetti aivojen D2-dopamiinireseptoreihin. Jotkut tutkimukset viittaavat siihen, että buspironilla voi olla epäsuoria vaikutuksia muihin välittäjäainejärjestelmiin.
Buspironihydrokloridi imeytyy nopeasti ihmisessä ja käy läpi laajan ensikierron metabolian. Radioaktiivisesti leimatussa tutkimuksessa plasman muuttumaton buspironi vastasi vain noin 1 % plasman radioaktiivisuudesta. Oraalisen annon jälkeen muuttumattoman buspironin pitoisuudet plasmassa ovat erittäin alhaiset ja vaihtelevat eri henkilöiden välillä. Plasman huippupitoisuudet 1 ng/ml - 6 ng/ml on havaittu 40 - 90 minuuttia 20 mg:n kerta-annoksen jälkeen. Muuttumattoman buspironin kerta-annoksen biologinen hyötyosuus tabletteina otettuna on keskimäärin noin 90 % vastaavasta annoksesta liuosta, mutta vaihtelua on suuria.
Ruoan vaikutuksia buspironihydrokloriditablettien biologiseen hyötyosuuteen on tutkittu kahdeksalla henkilöllä. Heille annettiin 20 mg:n annos ruoan kanssa ja ilman; muuttumattoman buspironin plasmapitoisuus-aikakäyrän (AUC) ja huippupitoisuuden plasmassa (Cmax) alla oleva pinta-ala kasvoi 84 % ja 116 %, mutta immunoreaktiivisen buspironin kokonaismäärä ei muuttunut. Tämä viittaa siihen, että ruoka voi vähentää buspironin presysteemistä puhdistumaa (ks ANNOSTELU JA HALLINNOINTI ).
15 koehenkilöllä tehty usean annoksen tutkimus viittaa siihen, että buspironilla on epälineaarinen farmakokinetiikka. Siten annoksen suurentaminen ja toistuva annostelu voivat johtaa jonkin verran korkeampiin muuttumattoman buspironin pitoisuuksiin veressä kuin kerta-annostutkimusten tulosten perusteella voitaisiin ennustaa.
In vitro -proteiinisitoutumistutkimus osoitti, että noin 86 % buspironista sitoutuu plasman proteiineihin. Havaittiin myös, että aspiriini nosti plasman vapaan buspironin pitoisuutta 23 %, kun taas fluratsepaami alensi vapaan buspironin pitoisuutta plasmassa 20 %. Ei kuitenkaan tiedetä, aiheuttavatko nämä lääkkeet samanlaisia vaikutuksia plasman vapaan buspironin pitoisuuksiin in vivo, tai aiheuttavatko tällaiset muutokset, jos niitä tapahtuu, kliinisesti merkittäviä eroja hoitotuloksissa. In vitro -tutkimus osoitti, että buspironi ei syrjäyttänyt voimakkaasti proteiineihin sitoutuneita lääkkeitä, kuten fenytoiinia, varfariinia ja propranololia, plasman proteiineista ja että buspironi saattaa syrjäyttää digoksiinin.
Buspironi metaboloituu pääasiassa hapettumisen kautta, jonka in vitro on osoitettu välittävän sytokromi P450 3A4 (CYP3A4) (ks. HUUMEIDEN VUOROVAIKUTUKSET ). Tuotetaan useita hydroksyloituja johdannaisia ja farmakologisesti aktiivista metaboliittia, 1-pyrimidinyylipiperatsiinia (1-PP). Anksiolyyttistä potentiaalia ennustavissa eläinmalleissa 1-PP:llä on noin neljännes buspironin aktiivisuudesta, mutta sitä on läsnä jopa 20 kertaa suurempia määriä. Tämä ei kuitenkaan todennäköisesti ole tärkeää ihmisille: verinäytteet ihmisistä, jotka ovat kroonisesti altistuneet buspironihydrokloridille, eivät osoita korkeita 1-PP-tasoja; keskiarvot ovat noin 3 ng/ml ja korkein ihmisveren taso 108 kroonisesti annostellun potilaan joukossa oli 17 ng/ml, mikä on alle 1/200 1-PP-tasoista, jotka löydettiin eläimistä, joille annettiin suuria annoksia buspironia ilman myrkyllisyyden merkkejä.
Kerta-annostutkimuksessa, jossa käytettiin 14C-leimattua buspironia, 29–63 % annoksesta erittyi virtsaan 24 tunnin kuluessa, pääasiassa metaboliitteina; ulosteeseen erittyi 18–38 % annoksesta. Muuttumattoman buspironin keskimääräinen eliminaation puoliintumisaika 10–40 mg:n kerta-annosten jälkeen on noin 2–3 tuntia.
Erikoispopulaatiot
Ikä- ja sukupuolivaikutukset
Aikuisten kerta- tai useiden annosten jälkeen ei havaittu merkittäviä eroja buspironin farmakokinetiikassa (AUC ja Cmax) iäkkäiden ja nuorempien tutkimushenkilöiden tai miesten ja naisten välillä.
Maksan vajaatoiminta
Kun buspironia annettiin useita annoksia maksan vajaatoimintaa sairastaville potilaille, buspironin vakaan tilan AUC suureni 13-kertaiseksi verrattuna terveisiin koehenkilöihin (ks. VAROTOIMENPITEET ).
Munuaisten vajaatoiminta
Buspironin toistuvan annoksen antamisen jälkeen munuaisten vajaatoimintapotilaille (Clcr = 10-70 ml/min/1,73 m2) buspironin vakaan tilan AUC kasvoi nelinkertaiseksi verrattuna terveisiin (Clcr ≥ 80 ml/min/1,73 m2) (katso VAROTOIMENPITEET ).
Kilpailuefektit
Rodun vaikutuksia buspironin farmakokinetiikkaan ei ole tutkittu.
POTILASTIEDOT
Buspironihydrokloridi Tabletit, USP 15 mg ja 30 mg tableteille
KUINKA KÄYTTÄÄ
Reaktio buspironille vaihtelee yksilöiden välillä. Lääkärisi saattaa pitää tarpeellisena muuttaa annostasi oikean vasteen saamiseksi.
Jokainen tabletti on jakouurteinen ja se voidaan rikkoa tarkasti.
Voit rikkoa tabletin tarkasti ja helposti pitämällä tablettia peukaloiden ja etusormiesi välissä sopivan tabletin uurteen (ura) lähellä. Paina sitten tabletin jakouurre sinua kohti ja paina tabletin osat irti (väärin rikkoutuvia osia ei saa käyttää).
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
