Anafranil 10mg, 25mg, 50mg Clomipramine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Anafranil 10mg on ja miten sitä käytetään?
Anafranil 50mg on reseptilääke, jota käytetään pakko-oireisen häiriön oireiden hoitoon. Anafranil 50 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Anafraniili kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, TCA:iksi.
Ei tiedetä, onko Anafranil 50 mg turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitkä ovat Anafranil 25 mg:n mahdolliset sivuvaikutukset?
Anafranil 50 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- ihottuma,
- kuume,
- turvonneet rauhaset,
- flunssan kaltaiset oireet,
- lihassäryt,
- vakava heikkous,
- epätavallinen mustelma,
- ihosi ja silmiesi keltaisuus (keltatauti),
- käyttäytymisen muutokset,
- ahdistus,
- paniikkikohtaukset,
- nukahtamisvaikeuksia,
- impulsiivinen käyttäytyminen,
- ärtyneisyys,
- agitaatio,
- vihamielisyys,
- aggressiivisuus,
- hyperaktiivinen (henkisesti tai fyysisesti),
- masennus,
- itsemurha-ajatuksia,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai turvotus,
- nähdä haloja valojen ympärillä,
- nopea syke,
- vapina tai vapina,
- hämmennystä,
- äärimmäinen pelko,
- kivulias tai vaikea virtsaaminen,
- kohtaus,
- kuume,
- hallusinaatiot,
- hikoilu,
- vapina,
- nopea syke,
- lihasten jäykkyys,
- nykiminen,
- koordinaatiohäiriö,
- pahoinvointi,
- oksentelua ja
- ripuli
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Anafranilin yleisimmät sivuvaikutukset ovat:
- kuiva suu,
- pahoinvointi,
- ärtynyt vatsa,
- ruokahalun menetys,
- ummetus,
- ahdistuksen tunne,
- huimausta,
- uneliaisuus,
- väsynyt,
- unihäiriöt,
- ruokahalun tai painon muutokset,
- muistiongelmia,
- keskittymisvaikeuksia,
- lisääntynyt hikoilu,
- tunnottomuus tai pistely,
- näkö muuttuu,
- vähentynyt seksihalu,
- impotenssi ja
- vaikeuksia saada orgasmi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Anafranilin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
Itsemurha- ja masennuslääkkeet
Masennuslääkkeet lisäsivät plaseboon verrattuna itsemurha-ajattelun ja -käyttäytymisen (itsetuhoisuuden) riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa masennushäiriön (MDD) ja muiden psykiatristen häiriöiden tutkimuksissa. Jokaisen, joka harkitsee klomipramiinihydrokloridin tai minkä tahansa muun masennuslääkkeen käyttöä lapsella, nuorella tai nuorella aikuisella, on tasapainotettava tämä riski kliinisen tarpeen kanssa. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna. Masennus ja tietyt muut psykiatriset häiriöt liittyvät itsemurhariskin lisääntymiseen. Kaiken ikäisiä potilaita, jotka saavat masennuslääkehoitoa, tulee seurata asianmukaisesti ja tarkkailla kliinisen pahenemisen, itsemurha-ajattelun tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa, että heitä on tarkkailtava tarkasti ja kommunikoida lääkärin kanssa. Klomipramiinihydrokloridia ei ole hyväksytty käytettäväksi lapsipotilailla paitsi potilailla, joilla on pakko-oireinen häiriö (OCD) (ks. VAROITUKSET , Kliininen paheneminen ja itsemurhariski ; POTILASTIEDOT ; ja VAROTOIMENPITEET , Käyttö lapsille ).
KUVAUS
Anafranil™ (klomipramiinihydrokloridi) -kapselit USP on pakkomielteinen lääke, joka kuuluu trisyklisinä masennuslääkkeinä tunnettujen farmakologisten aineiden luokkaan (dibentsatsepiini). Anafranilia on saatavana 25, 50 ja 75 mg:n kapseleina suun kautta annettavaksi.
Klomipramiinihydrokloridi USP on 3-kloori-5-[3-(dimetyyliamino)propyyli]-10,11-dihydro5H-dibents[b,f]atsepiinimonohydrokloridi, ja sen rakennekaava on:
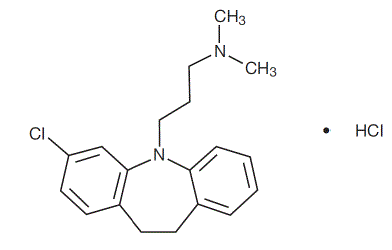
C19H23CIN2 • HCl MW = 351,31
Clomipramine hydrochloride USP on valkoinen tai luonnonvalkoinen kiteinen jauhe. Se liukenee vapaasti veteen, metanoliin ja metyleenikloridiin, eikä liukene etyylieetteriin ja heksaaniin.
Inaktiiviset ainesosat. D&C Red No. 33 (vain 25 mg kapselit), D&C Yellow No. 10, FD&C Blue No. 1 (vain 50 mg kapselit), FD&C Yellow No. 6, gelatiini, magnesiumstearaatti, metyyliparabeeni, propyyliparabeeni, tärkkelys (maissi), ja titaanidioksidia.
INDIKAATIOT
Anafranil™ (klomipramiinihydrokloridi) -kapselit USP on tarkoitettu pakko-oireiden ja pakko-oireiden hoitoon potilailla, joilla on pakko-oireinen häiriö (OCD). Pakkomielteiden tai pakko-oireiden tulee aiheuttaa huomattavaa ahdistusta, olla aikaa vieviä tai merkittävästi häiritseviä sosiaalista tai ammatillista toimintaa, jotta DSM-III-R (noin 1989) OCD-diagnoosi voidaan täyttää.
Pakkomielteet ovat toistuvia, pysyviä ideoita, ajatuksia, kuvia tai impulsseja, jotka ovat ego-dystonisia. Pakotteet ovat toistuvia, tarkoituksellisia ja tahallisia käyttäytymismalleja, jotka suoritetaan vastauksena pakkomielle tai stereotyyppiseen tapaan, ja henkilö tunnistaa ne liialliseksi tai kohtuuttomaksi.
Anafranilin 25 mg tehokkuus OCD:n hoidossa osoitettiin monikeskustutkimuksissa, lumekontrolloiduissa rinnakkaisryhmissä tehdyissä tutkimuksissa, mukaan lukien kaksi 10 viikon tutkimusta aikuisilla ja yksi 8 viikkoa kestänyt tutkimus 10–17-vuotiailla lapsilla ja nuorilla. Kaikissa tutkimuksissa potilailla oli kohtalainen tai vaikea OCD (DSM-III), joiden keskimääräiset lähtötason arvosanat Yale-Brown Obsessive Compulsive -asteikolla (YBOCS) vaihtelivat 26-28 ja NIMH Clinical Global Obsessive -tutkimuksen keskiarvo 10. Pakollinen asteikko (NIMH-OC). CMI:tä saaneiden potilaiden keskimääräinen lasku oli noin 10 YBOCS:ssa, mikä edustaa keskimääräistä parannusta tällä asteikolla 35–42 prosenttia aikuisilla ja 37 prosenttia lapsilla ja nuorilla. CMI-hoitoa saaneiden potilaiden NIMH-OC pieneni 3,5 yksikköä. Plaseboa saaneet potilaat eivät osoittaneet merkittävää kliinistä vastetta kummallakaan asteikolla. Suurin annos oli 250 mg/vrk useimmille aikuisille ja 3 mg/kg/vrk (enintään 200 mg) kaikille lapsille ja nuorille.
Anafranil 25 mg:n tehokkuutta pitkäaikaisessa käytössä (eli yli 10 viikkoa) ei ole arvioitu systemaattisesti lumekontrolloiduissa tutkimuksissa. Lääkärin, joka päättää käyttää Anafranil 10 mg -valmistetta pitkiä aikoja, tulee säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle (ks. ANNOSTELU JA HALLINNOINTI ).
ANNOSTELU JA HALLINNOINTI
Alla kuvatut hoito-ohjelmat perustuvat Anafranil 50 mg:n kontrolloiduissa kliinisissä tutkimuksissa käytettyihin 520 aikuisella ja 91 lapsella ja nuorella, joilla on OCD. Ensimmäisen titrauksen aikana Anafranil tulee antaa jaettuna annoksina aterioiden yhteydessä ruoansulatuskanavan sivuvaikutusten vähentämiseksi. Tämän alkutitrausvaiheen tavoitteena on minimoida sivuvaikutukset sallimalla sivuvaikutusten sietokyvyn kehittyminen tai antamalla potilaalle aikaa sopeutua, jos toleranssi ei kehity.
Koska sekä CMI:llä että sen aktiivisella metaboliitilla DMI:llä on pitkät eliminaation puoliintumisajat, lääkettä määräävän lääkärin tulee ottaa huomioon, että vakaan tilan plasmatasot voidaan saavuttaa vasta 2–3 viikon kuluttua annoksen muuttamisesta (ks. KLIININEN FARMAKOLOGIA ). Siksi ensimmäisen titrauksen jälkeen saattaa olla tarkoituksenmukaista odottaa 2–3 viikkoa annoksen lisämuutosten välillä.
Aloitushoito/annoksen säätäminen (aikuiset)
Anafranil 25 mg -hoito tulee aloittaa 25 mg:n vuorokausiannoksella ja nostaa sitä asteittain siedetyn annoksen mukaan noin 100 mg:aan kahden ensimmäisen viikon aikana. Ensimmäisen titrauksen aikana Anafranil 50 mg tulee antaa jaettuna annoksina aterioiden yhteydessä ruoansulatuskanavan sivuvaikutusten vähentämiseksi. Sen jälkeen annosta voidaan suurentaa asteittain useiden seuraavien viikkojen aikana enintään 250 mg:aan vuorokaudessa. Titrauksen jälkeen vuorokausiannos voidaan antaa kerran vuorokaudessa ennen nukkumaanmenoa päiväsedaation minimoimiseksi.
Aloitushoito/annoksen säätäminen (lapset ja nuoret)
Kuten aikuisillakin, aloitusannos on 25 mg vuorokaudessa, ja sitä tulee nostaa asteittain (myös jaettuina annoksina aterioiden yhteydessä maha-suolikanavan sivuvaikutusten vähentämiseksi) ensimmäisen 2 viikon aikana, siedettäessä, vuorokaudessa enintään 3 mg/kg tai 100 mg sen mukaan, kumpi on pienempi. Sen jälkeen annosta voidaan suurentaa asteittain useiden seuraavien viikkojen aikana päivittäiseen enimmäisannokseen 3 mg/kg tai 200 mg sen mukaan, kumpi on pienempi (ks. VAROTOIMENPITEET , Käyttö lapsille ). Kuten aikuisillakin, vuorokausiannos voidaan titrauksen jälkeen antaa kerran vuorokaudessa ennen nukkumaanmenoa päiväsedaation minimoimiseksi.
Ylläpito/jatkohoito (aikuiset, lapset ja nuoret)
Vaikka ei ole olemassa systemaattisia tutkimuksia, jotka vastaisivat kysymykseen siitä, kuinka kauan Anafranil 10 mg -hoidon jatkamista, OCD on krooninen sairaus, ja on järkevää harkita hoitoon reagoivan potilaan jatkamista. Vaikka Anafranilin 50 mg:n tehoa 10 viikon jälkeen ei ole dokumentoitu kontrolloiduissa tutkimuksissa, potilaiden hoitoa on jatkettu kaksoissokkoutettuina jopa 1 vuoden ajan ilman, että hyöty on heikentynyt. Annosta tulee kuitenkin muuttaa, jotta potilas pysyy pienimmällä tehokkaalla annoksella, ja potilaat tulee säännöllisesti arvioida uudelleen hoidon tarpeen määrittämiseksi. Ylläpidon aikana vuorokausiannos voidaan antaa kerran päivässä nukkumaan mennessä.
Potilaan vaihtaminen psykiatristen häiriöiden hoitoon tarkoitettuun monoamiinioksidaasin estäjään (MAOI)
Psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisen ja Anafranil-hoidon aloittamisen välillä tulee kulua vähintään 14 päivää. Sitä vastoin Anafranil-hoidon lopettamisen jälkeen tulisi varata vähintään 14 päivää ennen kuin aloitetaan MAO:n estäjä psykiatristen häiriöiden hoitoon (ks. VASTA-AIHEET ).
Anafranil 25 mg:n käyttö muiden MAO-estäjien, kuten linetsolidin tai metyleenisinisen, kanssa
Älä aloita Anafranil 50 mg -hoitoa potilaalle, jota hoidetaan linetsolidilla tai suonensisäisellä metyleenisinisellä, koska serotoniinioireyhtymän riski on lisääntynyt. Jos potilas tarvitsee psykiatrisen tilan kiireellistä hoitoa, muita toimenpiteitä, mukaan lukien sairaalahoitoa, tulee harkita (ks. VASTA-AIHEET ).
Joissakin tapauksissa potilas, joka jo saa Anafranil 25 mg -hoitoa, saattaa vaatia kiireellistä linetsolidia tai suonensisäistä metyleenisinistä hoitoa. Jos hyväksyttäviä vaihtoehtoja linetsolidi- tai suonensisäiselle metyleenisinihoidolle ei ole saatavilla ja linetsolidin tai suonensisäisen metyleenisinisen hoidon mahdollisten hyötyjen katsotaan olevan suurempia kuin serotoniinioireyhtymän riskit tietyllä potilaalla, Anafranilin käyttö on lopetettava välittömästi ja linetsolidi tai suonensisäinen metyleenisininen voidaan antaa. Potilasta tulee tarkkailla serotoniinioireyhtymän oireiden varalta kahden viikon ajan tai 24 tunnin ajan viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen sen mukaan, kumpi tulee ensin. Anafranil-hoitoa voidaan jatkaa 24 tuntia viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen (ks. VAROITUKSET ).
Riski, että metyleenisinistä annetaan ei-intravenoosisesti (kuten suun kautta otettavina tabletteina tai paikallisena injektiona) tai suonensisäisinä annoksina, jotka ovat paljon pienempiä kuin 1 mg/kg Anafranil 50 mg:n kanssa, on epäselvä. Kliinikon tulee kuitenkin olla tietoinen serotoniinioireyhtymän oireiden mahdollisuudesta tällaisen käytön yhteydessä (ks. VAROITUKSET ).
MITEN TOIMITETAAN
Anafranil™ (klomipramiinihydrokloridi) -kapselit USP
Kapselit 25 mg – norsunluurunko, jossa musta merkintä ”M” ja meloninkeltainen kansi, jossa musta merkintä ”ANAFRANIL 25 mg”
Pullot 30…………………… … NDC 0406-9906-03
50 mg kapselit – norsunluurunko, jossa musta merkintä ”M” ja vesisininen kansi, jossa musta merkintä ”ANAFRANIL 50 mg”
Pullot 30……………… ..…NDC 0406-9907-03
Kapselit 75 mg – norsunluurunko, jossa musta merkintä ”M” ja keltainen kansi, jossa musta merkintä ”ANAFRANIL 75 mg”
Pullot 30…………...……….....………….. ..…NDC 0406-9908-03
Varastointi
Säilytä 20–25 °C (68–77 °F) [katso USP-ohjattu huonelämpötila ].
Annostele hyvin suljettuihin astioihin, joissa on lapsiturvallinen suljin. Suojaa kosteudelta.
Eläinten toksikologia
Fosfolipidoosia ja kivesten muutoksia, jotka liittyvät yleisesti trisyklisiin yhdisteisiin, on havaittu Anafranilin käytön yhteydessä. Kroonisissa rotilla tehdyissä tutkimuksissa Anafranil 50 mg:aan liittyvät muutokset koostuivat systeemisestä fosfolipidoosista, muutoksista kiveksissä (atrofia, mineralisaatio) ja sekundaarisista muutoksista muissa kudoksissa. Lisäksi sydäntromboosia ja dermatiittia/keratiittia havaittiin rotilla, joita hoidettiin 2 vuotta annoksilla, jotka olivat 24-kertaisia ja 10-kertaisia ihmisen enimmäisvuorokausiannoksia (MRHD) mitattuna mg/kg-perusteisesti ja 4- ja 1,5-kertaisia MRHD-annoksia. vastaavasti mg/m²:n perusteella.
Mallinckrodt, M-merkki, Mallinckrodt Pharmaceuticalsin logo, M Â ja muut tuotemerkit ovat Mallinckrodt-yhtiön tavaramerkkejä.
Valmistaja: Patheon Inc., Whitby, Ontario, Kanada, L1N 5Z5 SpecGx LLC:lle, Webster Groves, MO 63119 USA. Tarkistettu: maaliskuu 2019
SIVUVAIKUTUKSET
Yleisesti havaittu
Yleisimmin havaitut Anafranilin 10 mg:n käyttöön liittyvät haittatapahtumat, joita ei havaittu vastaavalla ilmaantuvuusasteella lumelääkettä saaneiden potilaiden keskuudessa, olivat ruoansulatuskanavan vaivat, mukaan lukien suun kuivuminen, ummetus, pahoinvointi, dyspepsia ja ruokahaluttomuus; hermoston vaivat, mukaan lukien uneliaisuus, vapina, huimaus, hermostuneisuus ja myoklonus; urogenitaaliset vaivat, mukaan lukien muuttunut libido, siemensyöksyhäiriö, impotenssi ja virtsaamishäiriö; ja muut sekalaiset vaivat, mukaan lukien väsymys, hikoilu, lisääntynyt ruokahalu, painonnousu ja näköhäiriöt.
Johti hoidon keskeyttämiseen
Noin 20 % 3 616 potilaasta, jotka saivat Anafranilia Yhdysvalloissa tehdyissä kliinisissä markkinoille saattamista edeltävissä tutkimuksissa, keskeytti hoidon haittatapahtuman vuoksi. Noin puolella hoidon lopettaneista potilaista (9 % kokonaismäärästä) oli useita vaivoja, joista yhtäkään ei voitu luokitella ensisijaiseksi. Jos keskeyttämisen ensisijainen syy pystyttiin tunnistamaan, useimmat potilaat keskeyttivät hoidon hermostovaivojen vuoksi (5,4 %), pääasiassa uneliaisuuden vuoksi. Toiseksi yleisin syy hoidon lopettamiseen olivat ruoansulatuskanavan vaivat (1,3 %), pääasiassa oksentelua ja pahoinvointia.
Haittavaikutusten ja kohonneiden plasman lääkepitoisuuksien välillä ei ollut ilmeistä yhteyttä.
Ilmaantuvuus kontrolloiduissa kliinisissä tutkimuksissa
Seuraavassa taulukossa luetellaan haittatapahtumat, joiden ilmaantuvuus oli vähintään 1 % OCD-potilailla, jotka saivat Anafranilia 10 mg aikuisten tai lasten lumekontrolloiduissa kliinisissä tutkimuksissa. Esiintymistiheydet saatiin yhdistetyistä tiedoista kliinisistä tutkimuksista, joihin osallistui joko Anafranilia (N=322) tai lumelääkettä (N=319) saaneita aikuisia tai Anafranililla (N=46) tai lumelääkettä (N=44) saaneita lapsia. Lääkkeen määrääjän tulee huomioida, että näitä lukuja ei voida käyttää tavanomaisen lääketieteellisen käytännön yhteydessä esiintyvien sivuvaikutusten ilmaantuvuuden ennustamiseen, jolloin potilaan ominaisuudet ja muut tekijät poikkeavat kliinisissä tutkimuksissa vallinneista. Samoin mainittuja esiintymistiheyksiä ei voida verrata lukuihin, jotka on saatu muista kliinisistä tutkimuksista, joissa on mukana erilaisia hoitoja, käyttöjä ja tutkijoita. Mainitut luvut antavat kuitenkin lääkärille perustan arvioida lääkkeiden ja muiden tekijöiden suhteellista osuutta sivuvaikutusten esiintyvyydestä tutkituissa populaatioissa.
Hoidon yhteydessä ilmenneiden haittavaikutusten ilmaantuvuus lumekontrolloiduissa kliinisissä tutkimuksissa (tapahtuman ilmoittaneiden potilaiden prosenttiosuus)
Muut Anafranilin markkinointia edeltävän arvioinnin aikana havaitut tapahtumat
Yhdysvalloissa tehdyissä kliinisissä testeissä Anafranilin 50 mg useita annoksia annettiin noin 3 600 koehenkilölle. Kliiniset tutkijat kirjasivat tähän altistumiseen liittyvät epäsuotuisat tapahtumat käyttämällä omaa valintaansa. Näin ollen ei ole mahdollista antaa mielekästä arviota haittatapahtumia kokeneiden henkilöiden osuudesta ryhmittelemättä ensin samantyyppisiä ei-toivottuja tapahtumia pienempään määrään standardoituja tapahtumaluokkia.
Seuraavissa taulukoissa on käytetty Maailman terveysjärjestön muokattua terminologian sanakirjaa raportoitujen haittatapahtumien luokittelussa. Esitetyt taajuudet edustavat siten osuutta 3525 Anafranilille altistuneesta henkilöstä, jotka kokivat mainitun tyyppisen tapahtuman vähintään kerran saadessaan Anafranilia. Kaikki tapahtumat ovat mukana paitsi ne, jotka on jo lueteltu edellisessä taulukossa, ne, jotka on raportoitu niin yleisillä termeillä, että ne eivät ole informatiivisia, ja ne, joissa yhteys lääkkeeseen oli etäinen. On tärkeää korostaa, että vaikka raportoidut tapahtumat tapahtuivat Anafranil-hoidon aikana, ne eivät välttämättä johtuneet siitä.
Tapahtumat luokitellaan edelleen kehon järjestelmän mukaan ja luetellaan esiintymistiheyden mukaan alenevassa järjestyksessä seuraavien määritelmien mukaisesti: toistuvat haittatapahtumat ovat niitä, joita esiintyy yhden tai useamman kerran vähintään 1/100 potilaalla; harvinaiset haittatapahtumat ovat niitä, joita esiintyy 1/100 - 1/1000 potilaalla; harvinaisia tapahtumia esiintyy alle 1/1000 potilaalla.
Keho kokonaisuutena - Harvinainen - yleinen turvotus, lisääntynyt infektioalttius, huonovointisuus. Harvinainen riippuvainen turvotus, vieroitusoireyhtymä.
Sydän- ja verisuonijärjestelmä - Harvinainen - epänormaali EKG, rytmihäiriö, bradykardia, sydämenpysähdys, ekstrasystolat, kalpeus. Harvinainen - aneurysma, eteislepatus, nippuhaarakatkos, sydämen vajaatoiminta, aivoverenvuoto, sydänkatkos, sydäninfarkti, sydänlihaksen iskemia, perifeerinen iskemia, tromboflebiitti, vasospasmi, kammiotakykardia.
Ruoansulatuselimistö - Harvinainen - epänormaali maksan toiminta, verta ulosteessa, paksusuolentulehdus, pohjukaissuolentulehdus, mahahaava, gastriitti, gastroesofageaalinen refluksi, ientulehdus, glossiitti, peräpukamat, hepatiitti, lisääntynyt syljeneritys, ärtyvän suolen oireyhtymä, peptinen haava, peräsuolen verenvuoto, liian kielen haavaumat. Harvinainen - keiliitti, krooninen enteriitti, värjäytyneet ulosteet, mahalaukun laajentuminen, ienverenvuoto, hikka, suolen tukkeuma, suun/nielun turvotus, paralyyttinen ileus, sylkirauhasten suureneminen.
Endokriiniset järjestelmä - Harvinainen - kilpirauhasen vajaatoiminta. Harvinainen - struuma, gynekomastia, kilpirauhasen liikatoiminta.
Hemic ja lymfaattinen järjestelmä - Harvinainen - lymfadenopatia. Harvinainen - leukemoidireaktio, lymfooman kaltainen häiriö, luuytimen lama.
Aineenvaihdunta- ja ravitsemushäiriö - Harvinainen - kuivuminen, diabetes mellitus, kihti, hyperkolesterolemia, hyperglykemia, hyperurikemia, hypokalemia. Harvinainen - rasva-intoleranssi, glykosuria.
Tuki- ja liikuntaelimistö - Harvinainen - niveltulehdus. Harvinainen - dystonia, eksostoosi, lupus erythematosus -ihottuma, mustelmat, myopatia, myosiitti, polyarteritis nodosa, torticollis.
Hermosto - Usein - epänormaali ajattelu, huimaus. Harvinainen - epänormaali koordinaatio, epänormaali EEG, epänormaali kävely, apatia, ataksia, kooma, kouristukset, delirium, harhaluulo, dyskinesia, dysfonia, enkefalopatia, euforia, ekstrapyramidaalinen häiriö, hallusinaatiot, vihamielisyys, hypergoginesia, mansiini, hypergoginesia, hyppysymys , neuralgia, vainoharhaisuus, fobinen häiriö, psykoosi, aistihäiriöt, somnambulismi, stimulaatio, itsemurha-ajatukset, itsemurhayritys, hampaiden narskuttelu. Harvinaiset - antikolinerginen oireyhtymä, afasia, apraksia, katalepsia, kolinerginen oireyhtymä, koreoatetoosi, yleistynyt kouristukset, hemipareesi, hyperestesia, hyperrefleksia, hypoestesia, illuusio, heikentynyt impulssihallinta, päättämättömyys, mutismi, neuropatia, nystagmus, hermovauriomotorinen reaktio, , stupor, itsemurha.
Hengityselimet - Harvinainen - keuhkoputkentulehdus, hyperventilaatio, lisääntynyt yskös, keuhkokuume. Harvinainen - syanoosi, hemoptysis, hypoventilaatio, kurkunpäänsärky.
Iho ja lisäkkeet - Harvinainen - hiustenlähtö, selluliitti, kysta, ekseema, erytematoottinen ihottuma, sukuelinten kutina, makulopapulaarinen ihottuma, valoherkkyysreaktio, psoriaasi, märkärakkulainen ihottuma, ihon värimuutos. Harvinainen - kloasma, follikuliitti, hypertrichosis, piloerektio, seborrea, ihon liikakasvu, ihon haavaumat.
Erityiset aistit - Harvinainen - epänormaali majoitus, kuurous, diplopia, korvasärky, silmäkipu, vierasesine, hyperakusia, parosmia, valonarkuus, skleriitti, makuaistin menetys. Harvinainen - blefariitti, kromatopsia, sidekalvon verenvuoto, eksoftalmos, glaukooma, keratiitti, labyrinttihäiriö, yösokeus, verkkokalvon häiriö, karsastus, näkökenttävika.
Urogenitaalijärjestelmä - Harvinainen - endometrioosi, lisäkivestulehdus, hematuria, nokturia, oliguria, munasarjakysta, perineaalikipu, polyuria, eturauhasen häiriö, munuaiskivi, munuaiskipu, virtsaputken häiriö, virtsankarkailu, kohdun verenvuoto, emättimen verenvuoto. Harvinaiset - albuminuria, anorgasmia, rintojen turpoaminen, rintojen fibroadenoosi, kohdunkaulan dysplasia, kohdun limakalvon liikakasvu, ennenaikainen siemensyöksy, pyelonefriitti, pyuria, munuaiskysta, kohdun tulehdus, emättimen häiriö.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on raportoitu Anafranilin käytön aikana hyväksynnän jälkeen. Koska tämä reaktio on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida esiintymistiheyttä.
Silmäsairaudet - Kulman sulkeutuva glaukooma.
Immuunijärjestelmän häiriöt - Lääkeihottuma eosinofilialla ja systeemisillä oireilla (DRESS).
Aineenvaihdunta- ja ravitsemushäiriöt - Hyponatremia.
Endokriiniset häiriöt - Epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymä (SIADH).
HUUMEIDEN VUOROVAIKUTUKSET
Anafranilin käytön riskejä yhdessä muiden lääkkeiden kanssa ei ole arvioitu systemaattisesti. Ottaen huomioon Anafranilin ensisijaiset keskushermostovaikutukset, varovaisuutta suositellaan käytettäessä sitä samanaikaisesti muiden keskushermostoon vaikuttavien lääkkeiden kanssa (ks. POTILAS TIEDOT ). Anafranilia ei tule käyttää MAO-estäjien kanssa (ks VASTA-AIHEET ).
Tarkkaa valvontaa ja huolellista annoksen säätämistä tarvitaan, kun Anafranilia annetaan antikolinergisten tai sympatomimeettisten lääkkeiden kanssa.
Useiden trisyklisten masennuslääkkeiden on raportoitu estävän guanetidiinin, klonidiinin tai vastaavien aineiden farmakologisia vaikutuksia, ja tällainen vaikutus voidaan odottaa CMI:n yhteydessä, koska se on rakenteellisesti samankaltainen kuin muut trisykliset masennuslääkkeet.
CMI-pitoisuuden plasmassa on raportoitu kohoavan haloperidolin samanaikaisen antamisen seurauksena; Useiden läheisesti sukua olevien trisyklisten masennuslääkkeiden plasmapitoisuuksien on raportoitu nousevan metyylifenidaatin tai maksaentsyymin estäjien (esim. simetidiinin, fluoksetiinin) samanaikaisen käytön seurauksena ja laskevan maksaentsyymejä indusoivien aineiden (esim. barbituraatit, fenytoiini) samanaikainen antaminen. tällainen vaikutus voidaan odottaa myös CMI:llä. CMI:n antamisen on raportoitu lisäävän plasman fenobarbitaalipitoisuuksia, jos sitä annetaan samanaikaisesti (ks. KLIININEN FARMAKOLOGIA , Vuorovaikutuksia ).
P450 2D6:n metaboloimat lääkkeet
Lääkettä metaboloivan isotsyymin sytokromi P450 2D6:n (debrisokiinihydroksylaasi) biokemiallinen aktiivisuus on heikentynyt osassa valkoihoisia (noin 7–10 % valkoihoisista on niin kutsuttuja "huonoja metaboloijia"); Luotettavia arvioita vähentyneen P450 2D6 -isotsyymiaktiivisuuden esiintyvyydestä aasialaisten, afrikkalaisten ja muiden populaatioiden keskuudessa ei ole vielä saatavilla. Heikoilla metaboloijilla on odotettua korkeammat trisyklisten masennuslääkkeiden (TCA:t) pitoisuudet plasmassa tavanomaisina annoksina. P450 2D6:n metaboloiman lääkkeen fraktion mukaan plasmapitoisuuden nousu voi olla pientä tai melko suurta (8-kertainen TCA:n plasman AUC:n nousu). Lisäksi tietyt lääkkeet estävät tämän isotsyymin aktiivisuutta ja saavat normaalit aineenvaihdunta-aineet muistuttamaan huonoja aineenvaihdunnan tekijöitä. Henkilö, joka on vakaa tietyllä TCA-annoksella, voi tulla äkillisesti toksiseksi, kun hänelle annetaan yhtä näistä estolääkkeistä samanaikaisena hoitona. Sytokromi P450 2D6:ta inhiboivia lääkkeitä ovat jotkin entsyymit eivät metaboloi (kinidiini; simetidiini) ja monet, jotka ovat P450 2D6:n substraatteja (monet muut masennuslääkkeet, fenotiatsiinit ja tyypin 1C rytmihäiriölääkkeet propafenoni ja flekainidi). Vaikka kaikki selektiiviset serotoniinin takaisinoton estäjät (SSRI:t), esim. fluoksetiini, sertraliini, paroksetiini ja fluvoksamiini, estävät P450 2D6:ta, ne voivat vaihdella eston laajuudessa. Fluvoksamiinin on myös osoitettu estävän P450 1A2:ta, isoformia, joka osallistuu myös TCA-metaboliaan. Se, missä määrin SSRI-TCA-vuorovaikutukset voivat aiheuttaa kliinisiä ongelmia, riippuu SSRI:n eston asteesta ja farmakokinetiikasta. Varovaisuutta on kuitenkin noudatettava annettaessa TCA:ita samanaikaisesti minkä tahansa SSRI:n kanssa ja myös vaihdettaessa luokasta toiseen. Erityisen tärkeää on kulua riittävästi aikaa ennen TCA-hoidon aloittamista potilaalla, jolla fluoksetiinihoito lopetetaan, koska lähtöaineen ja aktiivisen metaboliitin puoliintumisaika on pitkä (vähintään 5 viikkoa saattaa olla tarpeen). Trisyklisten masennuslääkkeiden (johon kuuluu Anafranilin) samanaikainen käyttö sytokromi P450 2D6:ta inhiboivien lääkkeiden kanssa saattaa vaatia pienempiä annoksia kuin tavallisesti on määrätty joko trisykliselle masennuslääkkeelle tai toiselle lääkkeelle. Lisäksi aina, kun jokin näistä lääkkeistä poistetaan yhteishoidosta, trisyklisen masennuslääkkeen annosta voidaan tarvita suuremmaksi. On toivottavaa seurata plasman TCA-tasoja aina, kun trisyklisten masennuslääkeluokkaan kuuluvaa ainetta, mukaan lukien Anafranil, aiotaan antaa yhdessä toisen lääkkeen kanssa, jonka tiedetään olevan P450 2D6:n (ja/tai P450 1A2:n) estäjä.
Koska Anafranil sitoutuu voimakkaasti seerumin proteiineihin, Anafranilin antaminen potilaille, jotka käyttävät muita lääkkeitä, jotka sitoutuvat voimakkaasti proteiineihin (esim. varfariini, digoksiini), voi lisätä näiden lääkkeiden pitoisuuksia plasmassa, mikä saattaa aiheuttaa haittavaikutuksia. Sitä vastoin haittavaikutukset voivat johtua proteiiniin sitoutuneen Anafranilin syrjäyttämisestä muilla voimakkaasti sitoutuneilla lääkkeillä (katso KLIININEN FARMAKOLOGIA , Jakelu ).
Monoamiinioksidaasin estäjät (MAOI)
(Katso VASTA-AIHEET , VAROITUKSET , ja ANNOSTELU JA HALLINNOINTI .)
Serotonergiset lääkkeet
(Katso VASTA-AIHEET , VAROITUKSET , ja ANNOSTELU JA HALLINNOINTI .)
Huumeiden väärinkäyttö ja riippuvuus
Anafranilia ei ole systemaattisesti tutkittu eläimillä tai ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Vaikka erilaisia vieroitusoireita on kuvattu Anafranil 50 mg -hoidon lopettamisen yhteydessä (ks. VAROTOIMENPITEET , Vieroitusoireet ), ei ole näyttöä huumeiden etsinnästä, paitsi yksi raportti mahdollisesta Anafranilin väärinkäytöstä potilaalla, jolla on aiemmin ollut riippuvuus kodeiinista, bentsodiatsepiineista ja useista psykoaktiivisista lääkkeistä. Potilas sai Anafranilia masennukseen ja paniikkikohtauksiin ja näytti tulleen riippuvaiseksi sairaalasta kotiutumisen jälkeen.
Huolimatta todisteiden puuttumisesta, jotka viittaavat Anafranilin väärinkäyttövastuuseen ulkomaisessa markkinoinnissa, ei ole mahdollista ennustaa, missä määrin Anafranilia saatetaan väärinkäyttää sen jälkeen, kun se on saatettu markkinoille Yhdysvalloissa. Tästä syystä lääkäreiden tulee arvioida huolellisesti potilaiden historia huumeiden väärinkäytön varalta ja seurata tällaisia potilaita tarkasti.
VAROITUKSET
Kliininen paheneminen ja itsemurhariski
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa. Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden) tutkimusten yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18–24-vuotiaat), joilla on vakava masennus. häiriö (MDD) ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muut psykiatriset häiriöt, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeellä yli 4400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkeplasebon ero itsemurhatapausten määrässä 1000 hoidettua potilasta kohti) on esitetty taulukossa 1.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten kokeissa oli itsemurhia, mutta määrä ei riittänyt päättämään lääkkeiden vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu myös aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä vakavan masennuksen vuoksi. kuten muissakin indikaatioissa, sekä psykiatrisissa että ei-psykiatrisissa. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. alkuvaiheessa tai eivät olleet osa potilaan ilmeneviä oireita.
Masennuslääkkeillä vakavan masennushäiriön tai muiden, sekä psykiatristen että ei-psykiatristen oireiden vuoksi hoidettavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. , sekä itsemurha-ajatuksen ilmaantumista, ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. Yliannostusriskin vähentämiseksi klomipramiinihydrokloridia koskevat reseptit tulee kirjoittaa pienimmälle kapselimäärälle, joka on potilaan hyvän hoidon mukainen.

Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoito pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista masennusoireista kärsivät potilaat tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski; Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia. On huomattava, että klomipramiinihydrokloridia ei ole hyväksytty käytettäväksi kaksisuuntaisen mielialahäiriön hoidossa.
Serotoniinin oireyhtymä
Mahdollisesti hengenvaarallisen serotoniinioireyhtymän kehittymistä on raportoitu käytettäessä SNRI-lääkkeitä ja SSRI-lääkkeitä, mukaan lukien Anafranil 50 mg, yksinään, mutta erityisesti käytettäessä samanaikaisesti muita serotonergisia lääkkeitä (mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi ja mäkikuisma) ja serotoniinin aineenvaihduntaa heikentävien lääkkeiden kanssa (erityisesti MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut, että myös muut, kuten linetsolidi ja suonensisäinen metyleenisininen).
Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia), hermolihasmuutokset (esim. vapina, jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt), kohtaukset ja/tai maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Potilaita tulee seurata serotoniinioireyhtymän ilmaantumisen varalta.
Anafranil 10 mg:n samanaikainen käyttö psykiatristen häiriöiden hoitoon tarkoitettujen MAO-estäjien kanssa on vasta-aiheista. Anafranil 50 mg -hoitoa ei myöskään saa aloittaa potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Kaikki metyleenisinistä koskevat raportit, jotka antoivat tietoa antoreitistä, koskivat suonensisäistä antoa annosalueella 1 mg/kg - 8 mg/kg. Ei raportoitu metyleenisinisen antamista muilla reiteillä (kuten oraalisilla tableteilla tai paikallisilla kudosinjektioilla) tai pienempinä annoksina. Saattaa olla tilanteita, joissa Anafranilia saavan potilaan hoito MAO:n estäjällä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, on ehkä aloitettava. Anafranilin käyttö tulee lopettaa ennen MAO:n estäjähoidon aloittamista (ks VASTA-AIHEET ja ANNOSTELU JA HALLINNOINTI ).
Jos Anafranil 10 mg:n samanaikainen käyttö muiden serotonergisten lääkkeiden, mukaan lukien triptaanien, trisyklisten masennuslääkkeiden, fentanyylin, litiumin, tramadolin, buspironin, tryptofaanin ja mäkikuisman kanssa on kliinisesti perusteltua, potilaiden tulee olla tietoisia mahdollisesta lisääntyneestä riskistä serotoniinioireyhtymä, erityisesti hoidon alussa ja annosta suurennettaessa.
Anafranil 10 mg:n ja muiden samanaikaisten serotonergisten aineiden käyttö on lopetettava välittömästi, jos yllä mainitut tapahtumat ilmenevät, ja oireenmukaista tukihoitoa on aloitettava.
Kulman sulkeutuva glaukooma
Pupillien laajentuminen, joka ilmenee monien masennuslääkkeiden, mukaan lukien Anafranilin, käytön jälkeen voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa.
Kohtaukset
Markkinointia edeltävässä arvioinnissa takavarikko todettiin Anafranilin käytön merkittävimmäksi riskiksi.
Havaittu kumulatiivinen kohtausten ilmaantuvuus potilailla, jotka altistivat Anafranil 25 mg:n annoksilla enintään 300 mg/vrk, oli 0,64 % 90 päivän kohdalla, 1,12 % 180 päivän kohdalla ja 1,45 % 365 päivän kohdalla. Kumulatiiviset osuudet korjaavat 0,7 %:n (25 potilasta 3519:stä) karkean osuuden kliinisissä tutkimuksissa vaihtelevalla altistuksen kestolla.
Vaikka annos näyttää ennustavan kohtauksia, annoksen ja altistuksen keston välillä on sekaannusta, mikä tekee vaikeaksi arvioida itsenäisesti kummankaan tekijän vaikutusta yksinään. Kyky ennustaa kohtausten esiintymistä potilailla, jotka ovat altistuneet yli 250 mg:n CMI-annoksille, on rajoitettu, koska CMI:n pitoisuus plasmassa voi olla annoksesta riippuvainen ja se voi vaihdella saman annoksen saaneiden potilaiden välillä. Lääkäreitä neuvotaan kuitenkin rajoittamaan vuorokausiannos korkeintaan 250 mg:aan aikuisilla ja 3 mg:aan/kg (tai 200 mg:aan) lapsille ja nuorille (ks. ANNOSTELU JA HALLINNOINTI ).
Varovaisuutta tulee noudattaa annettaessa Anafranil 50 mg potilaille, joilla on ollut kouristuskohtauksia tai muita altistavia tekijöitä, esim. eri etiologiaa aivovaurioita, alkoholismia ja samanaikainen käyttö muiden kouristuskynnystä alentavien lääkkeiden kanssa.
Ulkomaisessa markkinoille tulon jälkeisessä seurannassa on raportoitu harvinaisia tapauksia kohtauksiin liittyvistä kuolemantapauksista, mutta ei Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa. Joissakin näistä tapauksista Anafranilia oli annettu muiden epileptogeenisten aineiden kanssa; toisissa potilailla oli mahdollisesti altistavia sairauksia. Siten kausaalista yhteyttä Anafranil 25 mg -hoidon ja näiden kuolemantapausten välillä ei ole osoitettu.
Lääkäreiden tulee keskustella potilaiden kanssa Anafranilin käytön riskeistä, kun he harjoittavat toimintaa, jossa äkillinen tajunnan menetys voi johtaa vakavaan vammaan potilaalle tai muille, esim. monimutkaisten koneiden käyttö, ajaminen, uinti, kiipeily.
PUKEUTUA
Harvinaisia tapauksia lääkeihottumaa, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), on raportoitu klomipramiinin käytön yhteydessä. Jos ilmenee vakavia akuutteja reaktioita, kuten DRESS, lopeta klomipramiinihoito välittömästi ja aloita asianmukainen hoito.
VAROTOIMENPITEET
Kenraali
Itsemurha
Koska masennus on yleinen OCD:n piirre, itsemurhariski on otettava huomioon. Anafranil-resepti tulee kirjoittaa pienimmälle kapselimäärälle, joka on potilaan hyvän hoidon mukainen, jotta voidaan vähentää yliannostusriskiä.
Sydän- ja verisuonivaikutukset
Kohtalaista ortostaattista verenpaineen laskua ja kohtalaista takykardiaa havaittiin kumpikin noin 20 %:lla potilaista, jotka käyttivät Anafranilia 10 mg kliinisissä tutkimuksissa; mutta potilaat olivat usein oireettomia. Noin 1 400 potilaasta, joita hoidettiin CMI-potilailla ennen markkinoille tuloa ja joilla oli EKG:t, 1,5 %:lle kehittyi poikkeavuuksia hoidon aikana verrattuna 3,1 %:iin aktiivisia kontrollilääkkeitä saaneista potilaista ja 0,7 %:lle lumelääkettä saaneista potilaista. Yleisimmät EKG-muutokset olivat PVC:t, ST-T-aallon muutokset ja intraventrikulaariset johtumishäiriöt. Näihin muutoksiin liittyi harvoin merkittäviä kliinisiä oireita. Varovaisuutta on kuitenkin noudatettava hoidettaessa potilaita, joilla on tunnettu sydän- ja verisuonitauti, ja annoksen asteittaista titrausta suositellaan.
Psykoosi, sekavuus ja muut neuropsykiatriset ilmiöt
Anafranil 10 mg:lla hoidetuilla potilailla on raportoitu esiintyvän erilaisia neuropsykiatrisia merkkejä ja oireita, mukaan lukien harhaluulot, hallusinaatiot, psykoottiset jaksot, sekavuus ja vainoharhaisuus. Koska monet tutkimukset ovat luonteeltaan kontrolloimattomia, on mahdotonta antaa tarkkaa arviota Anafranil-hoidon aiheuttaman riskin laajuudesta. Kuten trisykliset masennuslääkkeet, joihin se on läheisesti sukua, Anafranil 25 mg voi laukaista akuutin psykoottisen episodin potilailla, joilla on tunnistamaton skitsofrenia.
Mania/hypomania
Anafranil 10 mg:n markkinoille saattamista edeltävässä testissä mielialahäiriöstä kärsivillä potilailla ilmeni hypomaniaa tai maniaa useilla potilailla. Manian tai hypomanian aktivaatiota on raportoitu myös pienellä osalla mielialahäiriötä sairastavia potilaita, joita on hoidettu myydyillä trisyklisillä masennuslääkkeillä, jotka ovat läheistä sukua Anafranilille.
Maksan muutokset
Markkinoille tuloa edeltävien testausten aikana Anafraniliin liittyi toisinaan SGOT- ja SGPT-arvojen kohoamista (yhtenäinen ilmaantuvuus noin 1 % ja vastaavasti 3 %), joilla oli mahdollista kliinistä merkitystä (eli arvot, jotka ylittivät 3 kertaa normaalin ylärajan). Suurimmassa osassa tapauksista nämä entsyymien nousut eivät liittyneet muihin kliinisiin löydöksiin, jotka viittaavat maksavaurioon; Lisäksi kukaan ei ollut keltainen. Harvinaisia raportteja vakavammasta maksavauriosta, joista osa on johtanut kuolemaan, on raportoitu ulkomaisissa markkinoille tulon jälkeen. Varovaisuutta on noudatettava hoidettaessa potilaita, joilla on tiedossa oleva maksasairaus, ja näille potilaille suositellaan maksaentsyymiarvojen säännöllistä seurantaa.
Hematologiset muutokset
Vaikka Anafranil 25 mg:n markkinoille tuloa edeltävässä kokemuksessa ei havaittu vakavia hematologisia toksisuustapauksia, markkinoille tulon jälkeen on raportoitu leukopeniaa, agranulosytoosia, trombosytopeniaa, anemiaa ja pansytopeniaa Anafranil 50 mg:n käytön yhteydessä. Kuten trisyklisten masennuslääkkeiden kohdalla, joihin Anafranil 25 mg on läheisesti sukua, leukosyytti- ja differentiaalinen veriarvo tulee mitata potilailta, joille kehittyy kuumetta ja kurkkukipua Anafranil-hoidon aikana.
Keskushermosto
Yli 30 hypertermiatapausta on kirjattu muiden kuin kotimaisten markkinoille tulon jälkeisten seurantajärjestelmien avulla. Useimmat tapaukset tapahtuivat, kun Anafranilia käytettiin yhdessä muiden lääkkeiden kanssa. Kun Anafranil 25 mg:aa ja neuroleptia käytettiin samanaikaisesti, tapauksia pidettiin joskus esimerkkeinä pahanlaatuisesta neuroleptisyndroomasta.
Seksuaalinen toimintahäiriö
Seksuaalisen toimintahäiriön määrä OCD:tä sairastavilla miespotilailla, joita hoidettiin Anafranililla ennen markkinoille saattamista, oli huomattavasti lisääntynyt verrattuna lumekontrolleihin (eli 42 %:lla koki siemensyöksyä ja 20 %:lla impotenssia verrattuna vastaavasti 2,0 %:iin ja 2,6 %:iin). lumeryhmässä). Noin 85 % miehistä, joilla oli seksuaalinen toimintahäiriö, päätti jatkaa hoitoa.
Hyponatremia
Hyponatremiaa on esiintynyt klomipramiinihoidon seurauksena. Monissa tapauksissa hyponatremia näyttää olevan seurausta sopimattoman antidiureettisen hormonin erityksen oireyhtymästä (SIADH). Iäkkäillä potilailla saattaa olla suurempi riski saada hyponatremia serotonergisen masennuslääkkeen käytön yhteydessä. Myös potilaat, jotka käyttävät diureetteja tai joilla on muuten nestevajaus, voivat olla suuremmassa vaarassa. Anafranil-hoito on lopetettava potilailla, joilla on oireinen hyponatremia, ja aloitettava asianmukainen lääketieteellinen toimenpide. Hyponatremian merkkejä ja oireita ovat päänsärky, keskittymisvaikeudet, muistin heikkeneminen, sekavuus, heikkous ja epävakaus, jotka voivat johtaa kaatumiseen. Vakavampia ja/tai akuutimpia tapauksia ovat olleet hallusinaatiot, pyörtyminen, kouristukset, kooma, hengityspysähdys ja kuolema.
Painon muutokset
Kontrolloiduissa OCD-tutkimuksissa painonnousua raportoitiin 18 %:lla Anafranilia saaneista potilaista verrattuna 1 %:iin lumelääkettä saaneista potilaista. Näissä tutkimuksissa 28 %:lla Anafranil 25 mg:n potilaista painonnousu oli vähintään 7 % alkuperäisestä painostaan verrattuna 4 %:iin lumelääkettä saaneista potilaista. Useiden potilaiden paino nousi yli 25 % alkuperäisestä painostaan. Sitä vastoin 5 %:lla Anafranilia saaneista potilaista ja 1 %:lla lumelääkettä saaneista potilaista paino putosi vähintään 7 % alkuperäisestä painostaan.
Sähkökonvulsiivinen terapia
Kuten lähisukuisten trisyklisten masennuslääkkeiden kanssa, Anafranilin samanaikainen käyttö sähkökouristuksen kanssa voi lisätä riskejä; tällainen hoito tulee rajoittaa potilaisiin, joille se on välttämätöntä, koska kliinistä kokemusta on vain vähän.
Leikkaus
Ennen elektiivistä leikkausta yleisanestesialla Anafranil 50 mg -hoito tulee keskeyttää niin kauan kuin se on kliinisesti mahdollista, ja anestesialääkäriä on neuvottava.
Käyttö samanaikaisissa sairauksissa
Potilaat, joiden munuaisten toiminta on merkittävästi heikentynyt.
Vieroitusoireet
Anafranil 50 mg:n äkillisen lopettamisen yhteydessä on raportoitu erilaisia vieroitusoireita, mukaan lukien huimaus, pahoinvointi, oksentelu, päänsärky, huonovointisuus, unihäiriöt, hypertermia ja ärtyneisyys. Lisäksi tällaisten potilaiden psykiatrinen tila voi huonontua. Vaikka Anafranil 10 mg:n vieroitusvaikutuksia ei ole arvioitu systemaattisesti kontrolloiduissa tutkimuksissa, ne tunnetaan hyvin läheisesti samankaltaisilla trisyklisillä masennuslääkkeillä, ja on suositeltavaa, että annosta pienennetään asteittain ja potilasta seurataan huolellisesti hoidon lopettamisen aikana (ks. Huumeiden väärinkäyttö ja riippuvuus ).
Tietoja potilaille
Lääkäreiden tai muiden terveydenhuollon ammattilaisten tulee kertoa potilaille, heidän perheilleen ja heidän hoitajilleen klomipramiinihydrokloridihoidon eduista ja riskeistä ja neuvoa heitä sen asianmukaisessa käytössä. Klomipramiinihydrokloridille on saatavilla potilaan lääkitysopas "masennuslääkkeistä, masennuksesta ja muista vakavista mielenterveyssairauksista ja itsemurha-ajatuksista tai -toimista". Lääkkeen määrääjän tai terveydenhuollon ammattilaisen tulee neuvoa potilaita, heidän perheitään ja hoitajiaan lukemaan lääkitysopas ja auttaa heitä ymmärtämään sen sisältö. Potilaille tulee antaa mahdollisuus keskustella lääkitysoppaan sisällöstä ja saada vastauksia mahdollisiin kysymyksiinsä. Lääkitysoppaan koko teksti on painettu uudelleen tämän asiakirjan lopussa.
Potilaita tulee kertoa seuraavista ongelmista ja pyytää heitä varoittamaan lääkäriään, jos niitä ilmenee klomipramiinihydrokloridin käytön aikana.
Kliininen paheneminen ja itsemurhariski
Potilaita, heidän perheitään ja heidän omaisiaan tulee kannustaa olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyneisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. , masennuksen paheneminen ja itsemurha-ajatukset, erityisesti masennuslääkehoidon alkuvaiheessa ja kun annosta muutetaan ylös tai alas. Potilaiden perheitä ja hoitajia tulee neuvoa etsimään tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät olleet osa potilaan oireita. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne voivat viitata erittäin tiiviin seurannan tarpeeseen ja mahdollisesti lääkityksen muutoksiin.
Lääkäreitä kehotetaan keskustelemaan seuraavista asioista potilaiden kanssa, joille he määräävät Anafranilia:
- Kohtausten riski (ks VAROITUKSET );
- Suhteellisen korkea seksuaalisen toimintahäiriön ilmaantuvuus miehillä (ks Seksuaalinen toimintahäiriö );
- Koska Anafranil 50 mg voi heikentää monimutkaisten tehtävien suorittamiseen vaadittavia henkisiä ja/tai fyysisiä kykyjä ja koska Anafranil 25 mg:aan liittyy kohtausten riski, potilaita tulee varoittaa monimutkaisten ja vaarallisten tehtävien suorittamisesta (ks. VAROITUKSET );
- Potilaita tulee varoittaa alkoholin, barbituraattien tai muiden keskushermostoa lamaavien aineiden samanaikaisesta käytöstä, koska Anafranil 50 mg voi liioitella heidän vastetta näihin lääkkeisiin.
- Potilaiden tulee ilmoittaa lääkärilleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi hoidon aikana.
- Potilaiden tulee ilmoittaa lääkärilleen, jos he imettävät.
Potilaille tulee kertoa, että Anafranilin ottaminen voi aiheuttaa lievää pupillien laajentumista, joka voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska kulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkimuksiin sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä ennaltaehkäisevä toimenpide (esim. iridektomia), jos he ovat alttiita.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahdessa 2 vuoden biotestissä rotilla ei havaittu todisteita karsinogeenisuudesta annoksilla 100 mg/kg asti, mikä on 24 ja 4 kertaa suurin suositeltu ihmisen päiväannos (MRHD) mg/kg ja mg/m². , tai 2 vuoden biotestissä hiirillä annoksilla 80 mg/kg asti, mikä on 20 ja 1,5 kertaa MRHD (mg/kg ja mg/m²).
Lisääntymistutkimuksissa ei havaittu vaikutusta hedelmällisyyteen rotilla, joille annettiin enintään 24 mg/kg, mikä on kuusi kertaa ja suunnilleen yhtä suuri kuin MRHD (mg/kg ja mg/m²).
Raskausluokka C
Rotilla ja hiirillä tehdyissä tutkimuksissa ei havaittu teratogeenisia vaikutuksia annoksilla 100 mg/kg asti, mikä on 24 kertaa ihmisen suurin suositeltu päiväannos (MRHD) mg/kg perusteella ja 4 kertaa (rotat) ja 2 kertaa ( hiiret) MRHD mg/m² perusteella. Lieviä epäspesifisiä alkio/sikiötoksisia vaikutuksia havaittiin hoidettujen rottien jälkeläisissä, joille annettiin 50 ja 100 mg/kg, ja käsiteltyjen hiirten, joille annettiin 100 mg/kg.
Ei ole olemassa riittäviä tai hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Vieroitusoireita, kuten hermostuneisuutta, vapinaa ja kouristuksia, on raportoitu vastasyntyneillä, joiden äidit olivat saaneet Anafranil 50 mg synnytykseen asti. Anafranil 10 mg -valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Imettävät äidit
Anafraniilia on löydetty äidinmaidosta. Mahdollisten haittavaikutusten vuoksi on päätettävä, lopetetaanko imettäminen vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Turvallisuutta ja tehokkuutta muilla lapsipotilailla kuin OCD-potilailla ei ole varmistettu (ks LAATIKKO VAROITUS ja VAROITUKSET , Kliininen paheneminen ja itsemurhariski ). Jokaisen, joka harkitsee Anafranilin käyttöä lapsella tai nuorella, on tasapainotettava mahdolliset riskit kliinisen tarpeen kanssa.
Kontrolloidussa kliinisessä tutkimuksessa lapsilla ja nuorilla (10–17-vuotiaat) 46 avopotilasta sai Anafranilia 50 mg enintään 8 viikon ajan. Lisäksi 150 nuorta potilasta on saanut Anafranilia 10 mg avoimissa protokollissa useiden kuukausien tai useiden vuosien ajan. Tutkituista 196 nuoresta 50 oli enintään 13-vuotiaita ja 146 14-17-vuotiaita. Haittavaikutusprofiili tässä ikäryhmässä (ks HAITTAVAIKUTUKSET ) on samanlainen kuin aikuisilla havaittu.
Mahdollisia riskejä, jotka voivat liittyä Anafranilin pitkäaikaiseen käyttöön lapsille ja nuorille, joilla on OCD, ei ole arvioitu systemaattisesti. Todisteet, jotka tukevat sitä päätelmää, että Anafranil 50 mg on turvallinen käyttää lapsille ja nuorille, on saatu suhteellisen lyhytaikaisista kliinisistä tutkimuksista ja aikuispotilaista saatujen kokemusten ekstrapoloinnista. Erityisesti ei ole olemassa tutkimuksia, jotka arvioivat suoraan Anafranil 25 mg:n pitkäaikaisen käytön vaikutuksia lasten ja nuorten kasvuun, kehitykseen ja kypsymiseen. Vaikka ei ole näyttöä siitä, että Anafranil 10 mg vaikuttaisi haitallisesti kasvuun, kehitykseen tai kypsymiseen, tällaisten löydösten puuttuminen ei riitä sulkemaan pois tällaisten vaikutusten mahdollisuutta pitkäaikaisessa käytössä.
Turvallisuutta ja tehoa alle 10-vuotiailla lapsipotilailla ei ole varmistettu. Siksi Anafranilin käytölle alle 10-vuotiaille lapsipotilaille ei voida antaa erityisiä suosituksia.
Geriatrinen käyttö
Anafranil 50 mg:n kliiniset tutkimukset eivät sisältäneet riittävää määrää 65-vuotiaita tai vanhempia, jotta voitaisiin määrittää, reagoivatko he eri tavalla kuin nuoremmat. 152 vähintään 60-vuotiasta potilasta, jotka osallistuivat erilaisiin yhdysvaltalaisiin kliinisiin tutkimuksiin, saivat Anafranilia useista kuukausista useisiin vuosiin. Tässä populaatiossa ei havaittu epätavallisia ikään liittyviä haittavaikutuksia. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovaista, yleensä aloitetaan annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
Anafraniiliin on liitetty kliinisesti merkittävää hyponatremiaa. Iäkkäillä potilailla saattaa olla suurempi riski saada tämä haittavaikutus (ks VAROTOIMENPITEET , Hyponatremia ).
YLIANNOSTUS
Kuolemia voi tapahtua tämän luokan lääkeaineiden yliannostuksesta. Useiden lääkkeiden (mukaan lukien alkoholin) nauttiminen on yleistä tahallisessa trisyklisissä yliannostuksissa. Koska hoito on monimutkaista ja muuttuvaa, on suositeltavaa, että lääkäri ottaa yhteyttä myrkytystietokeskukseen saadakseen ajantasaista tietoa hoidosta. Toksisuuden merkit ja oireet kehittyvät nopeasti trisyklisen yliannostuksen jälkeen. Siksi sairaalan seurantaa tarvitaan mahdollisimman pian.
Inhimillinen kokemus
Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa 2 kuolemaa tapahtui 12 raportoidussa Anafranilin akuutin yliannostuksen tapauksessa joko yksinään tai yhdessä muiden lääkkeiden kanssa. Yksi kuolemantapaus koski potilasta, jonka epäiltiin nauttineen 7000 mg:n annoksen. Toinen kuolemantapaus koski potilasta, jonka epäiltiin nauttineen 5750 mg:n annoksen. Kymmenen ei-kuolemaan johtanutta tapausta koski jopa 5000 mg:n annoksia, joihin liittyi 1010 ng/ml:n plasmapitoisuuksia. Kaikki 10 potilasta toipuivat täysin. Anafranilin yliannostusta koskevista muista maista saatujen raporttien joukossa pienin kuolemaan johtanut annos oli 750 mg. Yhdistyneessä kuningaskunnassa saatujen markkinoille tulon jälkeisten raporttien perusteella CMI:n yliannostuskuolleisuuden katsotaan olevan samanlainen kuin masennuslääkkeinä markkinoiduilla, läheisesti sukulaisilla trisyklisillä yhdisteillä raportoitu.
Ilmestymiset
Merkkien ja oireiden vakavuus vaihtelee riippuen tekijöistä, kuten imeytyneen lääkkeen määrästä, potilaan iästä ja lääkkeen nauttimisesta kuluneesta ajasta. Yliannostuksen kriittisiä oireita ovat sydämen rytmihäiriöt, vaikea hypotensio, kouristukset ja keskushermoston lama, mukaan lukien kooma. Muutokset elektrokardiogrammissa, erityisesti QRS-akselilla tai -leveydellä, ovat kliinisesti merkittäviä indikaattoreita trisyklisestä toksisuudesta. Muita keskushermoston ilmenemismuotoja voivat olla uneliaisuus, tokkuraisuus, ataksia, levottomuus, kiihtyneisyys, delirium, voimakas hikoilu, hyperaktiiviset refleksit, lihasten jäykkyys sekä atetoidiset ja koreiformiset liikkeet. Sydämen poikkeavuuksia voivat olla takykardia, kongestiivisen sydämen vajaatoiminnan merkkejä ja erittäin harvinaisissa tapauksissa sydämenpysähdys. Myös hengityslamaa, syanoosia, sokkia, oksentelua, hyperpyreksiaa, mydriaasia ja oliguriaa tai anuriaa voi esiintyä.
Hallinto
Ota EKG ja aloita välittömästi sydämen seuranta. Suojaa potilaan hengitysteitä, luo suonensisäinen linja ja aloita mahalaukun dekontaminaatio. Vähintään 6 tunnin tarkkailu ja sydämen seuranta sekä keskushermoston tai hengityslaman, hypotension, sydämen rytmihäiriöiden ja/tai johtumishäiriöiden ja kohtausten tarkkailu on tarpeen.
Jos myrkyllisyyden merkkejä ilmenee milloin tahansa tämän ajanjakson aikana, tarvitaan pidennettyä seurantaa. On raportoitu tapauksia potilaista, jotka ovat antaneet kuolemaan johtaneille rytmihäiriöille myöhään yliannostuksen jälkeen; näillä potilailla oli kliinisiä todisteita merkittävästä myrkytyksestä ennen kuolemaa, ja useimmat saivat riittämättömästi maha-suolikanavan dekontaminaatiota. Plasman lääkepitoisuuksien seuranta ei saa ohjata potilaan hoitoa.
Ruoansulatuskanavan puhdistaminen
Kaikki potilaat, joiden epäillään saaneen trisyklisen yliannostuksen, on dekontaminoitava maha-suolikanavassa. Tähän tulisi sisältyä suuri mahahuuhtelu ja sen jälkeen aktiivihiili. Jos tajunta on heikentynyt, hengitystiet tulee varmistaa ennen huuhtelua. Emesis on vasta-aiheinen.
Kardiovaskulaarinen
Raajakytkentäisen QRS:n maksimikesto ≥ 0,10 sekuntia voi olla paras osoitus yliannostuksen vakavuudesta. Suonensisäistä natriumbikarbonaattia tulee käyttää pitämään seerumin pH välillä 7,45–7,55. Jos pH-vaste on riittämätön, voidaan käyttää myös hyperventilaatiota. Hyperventilaatiota ja natriumbikarbonaattia käytettäessä samanaikaisesti tulee noudattaa äärimmäistä varovaisuutta ja pH-arvoa on seurattava säännöllisesti. pH > 7,60 tai pCO2
Harvinaisissa tapauksissa hemoperfuusio voi olla hyödyllinen akuutin refraktaarisen kardiovaskulaarisen epävakauden hoidossa potilailla, joilla on akuutti toksisuus. Hemodialyysin, peritoneaalidialyysin, vaihtosiirtojen ja pakkodiureesin on kuitenkin yleensä raportoitu olevan tehottomia trisyklisissä myrkytyksissä.
CNS
Potilaille, joilla on keskushermoston masennus, suositellaan varhaista intubaatiota, koska se voi huonontua äkillisesti. Kouristuskohtauksia tulee hallita bentsodiatsepiineilla tai jos ne ovat tehottomia, muilla kouristuslääkkeillä (esim. fenobarbitaalilla, fenytoiinilla). Fysostigmiiniä ei suositella paitsi sellaisten hengenvaarallisten oireiden hoitoon, jotka eivät ole reagoineet muihin hoitoihin, ja sitten vain myrkytystietokeskuksen kanssa neuvotellen.
Psykiatrinen seuranta
Koska yliannostus on usein tahallista, potilaat voivat yrittää itsemurhaa muilla tavoilla toipumisvaiheessa. Psykiatrin lähete voi olla sopiva.
Pediatrian hoito
Lapsen ja aikuisen yliannostusten hallintaperiaatteet ovat samanlaiset. On erittäin suositeltavaa, että lääkäri ottaa yhteyttä paikalliseen myrkytystietokeskukseen erityistä lasten hoitoa varten.
VASTA-AIHEET
Anafranil on vasta-aiheinen potilailla, jotka ovat aiemmin olleet yliherkkiä Anafranil 25 mg:lle tai muille trisyklisille masennuslääkkeille.
Monoamiinioksidaasin estäjät (MAOI)
MAO-estäjien käyttö psykiatristen häiriöiden hoitoon Anafranililla tai 14 päivän sisällä Anafranil-hoidon lopettamisesta on vasta-aiheista, koska serotoniinioireyhtymän riski on lisääntynyt. Anafranil 10 mg:n käyttö 14 päivän sisällä psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisesta on myös vasta-aiheista (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ).
Anafranil-hoidon aloittaminen potilaalla, jota hoidetaan linetsolidilla tai suonensisäisellä metyleenisinisellä, on myös vasta-aiheista, koska se lisää serotoniinioireyhtymän riskiä (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ).
Sydäninfarkti
Anafranil on vasta-aiheinen sydäninfarktin jälkeisen akuutin toipumisjakson aikana.
KLIININEN FARMAKOLOGIA
Farmakodynamiikka
Klomipramiinin (CMI) oletetaan vaikuttavan pakkomielteisiin ja pakko-oireisiin käyttäytymiseen sen vaikutusten kautta serotonergiseen hermosolujen välittymiseen. Varsinaista neurokemiallista mekanismia ei tunneta, mutta CMI:n kyvyn estää serotoniinin (5-HT) takaisinottoa pidetään tärkeänä.
Farmakokinetiikka
Imeytyminen/biologinen hyötyosuus
Anafranil 25 mg kapseleiden CMI on yhtä biosaatavissa kuin liuoksen CMI. Ruoka ei vaikuta merkittävästi kapseleiden CMI:n biologiseen hyötyosuuteen.
Annossuhteellisuustutkimuksessa, jossa käytettiin useita CMI-annoksia, CMI:n ja CMI:n tärkeimmän aktiivisen metaboliitin, desmetyyliklomipramiinin (DMI) vakaan tilan plasmapitoisuudet (Css) ja plasman alla oleva pinta-ala-pitoisuus-aikakäyrät (AUC) eivät olleet verrannollisia annokseen. arvioiduilla vaihteluväleillä, eli välillä 25-100 mg/vrk ja välillä 25-150 mg/vrk, vaikka Css ja AUC ovat suunnilleen lineaarisessa suhteessa annokseen välillä 100-150 mg/vrk. Annoksen ja CMI/DMI-pitoisuuksien välistä suhdetta suurempia vuorokausiannoksia käytettäessä ei ole arvioitu systemaattisesti, mutta jos yli 150 mg/vrk annoksilla on merkittävä annosriippuvuus, on olemassa mahdollisuus dramaattisesti korkeampiin Css- ja AUC-arvoihin jopa potilailla, jotka saavat annoksen suositeltu alue. Tämä voi aiheuttaa mahdollisen riskin joillekin potilaille (ks VAROITUKSET ja HUUMEIDEN VUOROVAIKUTUKSET ).
Yhden 50 mg:n oraalisen annoksen jälkeen CMI:n huippupitoisuudet plasmassa ilmaantuvat 2–6 tunnin kuluessa (keskiarvo 4,7 tuntia) ja vaihtelevat välillä 56 ng/ml - 154 ng/ml (keskiarvo 92 ng/ml). Useiden 150 mg:n Anafranilin 25 mg:n päivittäisten annosten jälkeen vakaan tilan huippupitoisuudet plasmassa vaihtelevat välillä 94 ng/ml - 339 ng/ml (keskiarvo, 218 ng/ml) CMI:n osalta ja välillä 134 ng/ml - 532 ng/ml ( keskiarvo, 274 ng/ml) DMI:lle. Lisätiedot nousevan annoksen tutkimuksesta 250 mg:n annoksilla viittaavat siihen, että DMI:llä saattaa olla epälineaarista farmakokinetiikkaa tavanomaisella annosalueella. Anafranil 200 mg:n annoksella potilailla, joilta otettiin yksittäinen verinäyte noin 9–22 tuntia (mediaani 16 tuntia) annoksen jälkeen, plasman pitoisuus oli jopa 605 ng/ml CMI:n osalta ja 781 ng/ml DMI:n osalta. ja 1386 ng/ml molemmille.
Jakelu
CMI jakautuu aivo-selkäydinnesteeseen (CSF) ja aivoihin sekä rintamaitoon. DMI jakautuu myös aivo-selkäydinnesteeseen, ja keskimääräinen CSF/plasma-suhde on 2,6. CMI:n proteiineihin sitoutuminen on noin 97 %, pääasiassa albumiiniin, ja se on riippumaton CMI-pitoisuudesta. CMI:n ja muiden voimakkaasti proteiineihin sitoutuneiden lääkkeiden välistä yhteisvaikutusta ei ole täysin arvioitu, mutta se voi olla tärkeä (ks HUUMEIDEN VUOROVAIKUTUKSET ).
Aineenvaihdunta
CMI biotransformoituu laajalti DMI:ksi ja muiksi metaboliiteiksi ja niiden glukuronidikonjugaateiksi. DMI on farmakologisesti aktiivinen, mutta sen vaikutuksia OCD-käyttäytymiseen ei tunneta. Nämä metaboliitit erittyvät virtsaan ja ulosteisiin sapen kautta eliminoitumisen jälkeen. Radioleimatun 25 mg:n CMI-annoksen jälkeen kahdella koehenkilöllä 60 % ja 51 % annoksesta todettiin virtsassa ja 32 % ja 24 % ulosteessa. Samassa tutkimuksessa CMI:n ja DMI:n yhteenlaskettu virtsaannos oli vain noin 0,8–1,3 % annetusta annoksesta. CMI ei indusoi lääkettä metaboloivia entsyymejä antipyriinin puoliintumisajalla mitattuna.
Eliminointi
Todisteet siitä, että CMI:n ja DMI:n Css- ja AUC-arvot voivat kasvaa suhteettomasti suun kautta otettavien annosten kasvaessa, viittaa siihen, että CMI:n ja DMI:n metabolia voi olla rajoitettua. Tämä seikka on otettava huomioon arvioitaessa alla esitettyjä farmakokineettisten parametrien arvioita, koska ne on saatu henkilöiltä, jotka altistettiin 150 mg:n annoksille. Jos CMI:n ja DMI:n farmakokinetiikka on epälineaarinen yli 150 mg:n annoksilla, niiden eliminaation puoliintumisajat voivat pidentyä huomattavasti annoksilla, jotka ovat lähellä suositellun annosalueen ylärajaa (eli 200 mg/vrk - 250 mg/vrk). Tämän seurauksena CMI ja DMI voivat kasaantua, ja tämä kerääntyminen voi lisätä annoksesta tai plasmapitoisuudesta riippuvaisten haittavaikutusten, erityisesti kohtausten, ilmaantuvuutta (ks. VAROITUKSET ).
150 mg:n annoksen jälkeen CMI:n puoliintumisaika on 19 tunnista 37 tuntiin (keskiarvo 32 tuntia) ja DMI:n puoliintumisaika vaihtelee 54 tunnista 77 tuntiin (keskiarvo 69 tuntia). Vakaan tilan tasot useiden annosten jälkeen saavutetaan tyypillisesti 7–14 päivässä CMI:n osalta. Metaboliitin pitoisuudet plasmassa ylittävät emolääkkeen toistuvalla annostuksella. Toistuvan 150 mg/vrk-annoksen jälkeen CMI:n kumulaatiokerroin on noin 2,5 ja DMI:n 4,6. Tärkeää on, että voi kestää kaksi viikkoa tai pidempään saavuttaa tämä kertymisaste jatkuvalla annostuksella, koska CMI:n ja DMI:n eliminaation puoliintumisajat ovat suhteellisen pitkät (ks. ANNOSTELU JA HALLINNOINTI ). Maksan ja munuaisten vajaatoiminnan vaikutuksia Anafranilin jakautumiseen ei ole määritetty.
Vuorovaikutuksia
Haloperidolin ja CMI:n samanaikainen anto lisää CMI-pitoisuuksia plasmassa. CMI:n samanaikainen anto fenobarbitaalin kanssa lisää fenobarbitaalin plasmapitoisuuksia (ks. HUUMEIDEN VUOROVAIKUTUKSET ). Nuoremmat (18–40-vuotiaat) koehenkilöt sietivät CMI:tä paremmin ja heillä oli merkittävästi alhaisemmat vakaan tilan plasmapitoisuudet kuin yli 65-vuotiailla. Alle 15-vuotiailla lapsilla oli merkittävästi alhaisempi plasmapitoisuus/annossuhde aikuisiin verrattuna. Plasman CMI-pitoisuudet olivat merkittävästi alhaisemmat tupakoitsijoilla kuin tupakoimattomilla.
POTILASTIEDOT
Anafranil™ (klomipramiinihydrokloridi) Kapselit USP
Masennuslääkkeet, masennus ja muut vakavat mielisairaudet ja itsemurha-ajatukset tai -toimet
Lue lääkitysopas, joka tulee sinun tai perheenjäsenesi masennuslääkkeen mukana. Tämä lääkitysopas käsittelee vain itsemurha-ajatusten ja -toimien riskiä masennuslääkkeiden kanssa. Keskustele oman tai perheenjäsenesi terveydenhuollon tarjoajan kanssa seuraavista asioista:
- kaikki masennuslääkehoidon riskit ja edut
- kaikki masennuksen tai muiden vakavien mielenterveyssairauksien hoitovaihtoehdot
Mikä on tärkein tieto, joka minun pitäisi tietää masennuslääkkeistä, masennuksesta ja muista vakavista mielenterveyssairauksista sekä itsetuhoisista ajatuksista tai toimista?
1. Masennuslääkkeet voivat lisätä itsemurha-ajatuksia tai -toimia joillakin lapsilla, teini-ikäisillä ja nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana.
2. Masennus ja muut vakavat mielen sairaudet ovat tärkeimmät syyt itsemurha-ajatuksiin ja -toimiin. Joillakin ihmisillä voi olla erityisen suuri riski saada itsetuhoisia ajatuksia tai toimia. Näitä ovat ihmiset, joilla on kaksisuuntainen mielialahäiriö (tai maanis-depressiivinen sairaus) tai itsetuhoisia ajatuksia tai tekoja.
3. Miten voin tarkkailla ja yrittää estää itsetuhoisia ajatuksia ja tekoja itsessäni tai perheenjäsenessäni?
- Kiinnitä huomiota kaikkiin muutoksiin, erityisesti äkillisiin muutoksiin mielialassa, käyttäytymisessä, ajatuksissa tai tunteissa. Tämä on erittäin tärkeää, kun masennuslääke aloitetaan tai annosta muutetaan.
- Soita välittömästi terveydenhuollon tarjoajalle ilmoittaaksesi uusista tai äkillisistä mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksista.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti. Soita terveydenhuollon tarjoajalle käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajalle, jos sinulla tai perheenjäsenelläsi on jokin seuraavista oireista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- ajatuksia itsemurhasta tai kuolemasta
- yrittää itsemurhaa
- uusi tai pahempi masennus
- uusi tai pahempi ahdistus
- hyvin kiihtynyt tai levoton olo
- paniikkikohtaukset
- unihäiriöt (unettomuus)
- uusi tai pahempi ärtyneisyys
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- vaarallisten impulssien vaikutuksesta
- äärimmäinen lisääntynyt aktiivisuus ja puhuminen (mania)
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Matala suola (natrium) taso veressä. Iäkkäät ihmiset voivat olla alttiimpia tälle. Oireita voivat olla:
- päänsärky
- heikkous tai epävakaus
- sekavuus, keskittymis- tai ajattelu- tai muistiongelmat
Visuaaliset ongelmat
- silmän kipu
- muutoksia näkökyvyssä
- turvotus tai punoitus silmässä tai sen ympärillä
Vain jotkut ihmiset ovat vaarassa saada nämä ongelmat. Haluat ehkä käydä silmätutkimuksessa nähdäksesi, oletko vaarassa, ja saada ehkäisevää hoitoa, jos olet.
Kuka ei saa ottaa Anafranilia?
Älä ota Anafranilia, jos:
- ottaa monoamiinioksidaasin estäjää (MAOI). Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO-estäjää, mukaan lukien antibiootti linetsolidi.
- Älä ota MAO:n estäjää 2 viikon kuluessa Anafranil 25 mg:n käytön lopettamisesta, ellei lääkärisi kehota tekemään niin.
- Älä aloita Anafranil-hoitoa, jos olet lopettanut MAO-estäjän käytön viimeisen 2 viikon aikana, ellei lääkärisi ole niin määrännyt.
Mitä muuta minun on tiedettävä masennuslääkkeistä?
- Älä koskaan lopeta masennuslääkettä keskustelematta ensin terveydenhuollon tarjoajan kanssa. Masennuslääkehoidon äkillinen lopettaminen voi aiheuttaa muita oireita.
- Masennuslääkkeet ovat lääkkeitä, joita käytetään masennuksen ja muiden sairauksien hoitoon. On tärkeää keskustella kaikista masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Potilaiden ja heidän perheidensä tai muiden hoitajien tulee keskustella terveydenhuollon tarjoajan kanssa kaikista hoitovaihtoehdoista, ei vain masennuslääkkeiden käytöstä.
- Masennuslääkkeillä on muita sivuvaikutuksia. Keskustele terveydenhuollon tarjoajan kanssa sinulle tai perheenjäsenellesi määrätyn lääkkeen sivuvaikutuksista.
- Masennuslääkkeet voivat olla vuorovaikutuksessa muiden lääkkeiden kanssa. Tiedä kaikki lääkkeet, joita sinä tai perheenjäsenesi käytät. Pidä luettelo kaikista lääkkeistä näyttääksesi terveydenhuollon tarjoajalle. Älä aloita uusia lääkkeitä keskustelematta ensin terveydenhuollon tarjoajalta.
- Kaikki lapsille määrätyt masennuslääkkeet eivät ole FDA:n hyväksymiä lapsille. Pyydä lisätietoja lapsesi terveydenhuollon tarjoajalta.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
