Protonix 20mg, 40mg Pantoprazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Protonix 40mg on ja miten sitä käytetään?
Protonix 40mg on reseptilääke, jota käytetään gastroesofageaalisen refluksitaudin tai GERD:n ja Zollinger-Ellisonin oireyhtymän tai muiden liiallista mahahappoa aiheuttavien sairauksien hoitoon. Protonix 40 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Protonix kuuluu lääkeryhmään, jota kutsutaan protonipumpun estäjiksi (PPI).
Ei tiedetä, onko Protonix turvallinen ja tehokas alle 5-vuotiaille lapsille.
Mitkä ovat Protonixin mahdolliset sivuvaikutukset?
Protonix voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- ripuli, joka on vetistä tai jossa on verta,
- äkillinen kipu tai lantion, ranteen tai selän liikkumisvaikeus,
- mustelmat tai turvotus pistoskohdassa,
- vähän tai ei ollenkaan virtsaamista,
- verta virtsassa,
- turvotus,
- nopea painonnousu,
- huimaus,
- nopea tai epäsäännöllinen syke,
- vapina (vapina) tai nykivät liikkeet,
- hermostunut olo,
- lihaskrampit tai kouristukset käsissäsi tai jaloissasi,
- yskä,
- tukehtuva tunne,
- nivelkipuja ja
- ihottuma poskissa tai käsivarsissa, joka pahenee yöllä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Protonixin yleisimpiä sivuvaikutuksia ovat:
- päänsärky,
- huimaus,
- vatsakipu,
- kaasu,
- pahoinvointi,
- oksentelua,
- ripuli,
- nivelkipu,
- kuume,
- ihottuma ja
- vilustumisoireet (yleisin lapsilla)
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia Prometriumin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
PROTONIXin (pantopratsolinatrium) viivästetysti vapauttavan oraalisuspension ja PROTONIXin (pantopratsolinatrium) viivästyneen vapautumisen tablettien, PPI:n, vaikuttava aine on substituoitu bentsimidatsoli, natrium 5-(difluorimetoksi)-2-[[(3,4-) dimetoksi-2-pyridinyyli)metyyli]sulfinyyli]-1 H-bentsimidatsoli-seskvihydraatti, yhdiste, joka estää mahahapon eritystä. Sen empiirinen kaava on C16H14F2N3NaO4S x 1,5 H2O, jonka molekyylipaino on 432,4. Rakennekaava on:
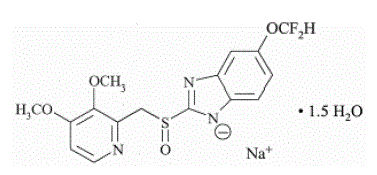
Pantopratsolinatriumseskvihydraatti on valkoinen tai luonnonvalkoinen kiteinen jauhe ja se on raseeminen. Pantopratsolilla on heikosti emäksisiä ja happamia ominaisuuksia. Pantopratsolinatriumseskvihydraatti liukenee vapaasti veteen, liukenee hyvin heikosti fosfaattipuskuriin pH:ssa 7,4 ja käytännöllisesti katsoen liukenematon n-heksaaniin.
Yhdisteen stabiilisuus vesiliuoksessa riippuu pH:sta. Hajoamisnopeus kasvaa pH:n laskiessa. Ympäristön lämpötilassa hajoamisen puoliintumisaika on noin 2,8 tuntia pH:ssa 5 ja noin 220 tuntia pH:ssa 7,8.
PROTONIX 40 mg toimitetaan viivästetysti vapauttavana oraalisuspensiona kerta-annospakkauksissa, saatavilla yhtenä vahvuutena (40 mg) pantopratsolia (vastaa 45,1 mg pantopratsolinatriumia) ja viivästetysti vapauttavana tablettina, saatavana kahdessa vahvuudessa 20 mg pantopratsolia (vastaa 22,56 mg pantopratsolinatriumia) ja 40 mg pantopratsolia (vastaa 45,1 mg pantopratsolinatriumia).
PROTONIX Delay-Release Tablets -tabletit sisältävät seuraavia inaktiivisia aineosia: kalsiumstearaatti, krospovidoni, hypromelloosi, rautaoksidi, mannitoli, metakryylihappokopolymeeri, polysorbaatti 80, povidoni, propyleeniglykoli, natriumkarbonaatti, natriumlauryylisulfaatti, trietyylidioksidi, sittaani ja titaani. PROTONIX Delay-Release Tablets (40 mg ja 20 mg) noudattaa USP:n liukenemistestiä 2.
PROTONIX 40mg viivästetysti vapauttavaan oraalisuspensioon sisältää seuraavat inaktiiviset aineosat: krospovidoni, hypromelloosi, metakryylihappokopolymeeri, mikrokiteinen selluloosa, polysorbaatti 80, povidoni, natriumkarbonaatti, natriumlauryylisulfaatti, talkki, titaaniferriidioksidi ja trietyylisitraatti
INDIKAATIOT
PROTONIX viivästetysti vapauttavalle oraalisuspensiolle ja PROTONIX 40 mg viivästetysti vapauttavalle tabletille on tarkoitettu:
Gastroesofageaaliseen refluksitautiin (GERD) liittyvän eroosiivisen esofagiitin lyhytaikainen hoito
PROTONIX 20mg on tarkoitettu aikuisille ja vähintään 5-vuotiaille lapsipotilaille lyhytaikaiseen (enintään 8 viikkoa) hoitoon erosiivisen esofagiitin (EE) paranemiseen ja oireiden lievitykseen. Niille aikuispotilaille, jotka eivät ole parantuneet 8 viikon hoidon jälkeen, voidaan harkita ylimääräistä 8 viikon PROTONIX-hoitoa. Yli 8 viikon hoidon turvallisuutta lapsipotilailla ei ole osoitettu.
Erosiivisen esofagiitin paranemisen ylläpito
PROTONIX on tarkoitettu EE-taudin paranemisen ylläpitämiseen ja päivä- ja yöajan närästysoireiden uusiutumisen vähentämiseen aikuispotilailla, joilla on GERD. Kontrolloidut tutkimukset eivät kestäneet yli 12 kuukautta.
Patologiset liikaeritystilat mukaan lukien Zollinger-Ellisonin oireyhtymä
PROTONIX 20mg on tarkoitettu patologisten liikaeritystilojen pitkäaikaiseen hoitoon, mukaan lukien Zollinger-Ellisonin (ZE) oireyhtymä.
ANNOSTELU JA HALLINNOINTI
Suositeltu annostusaikataulu
PROTONIX toimitetaan viivästetysti vapauttavina rakeina pakkauksissa oraalisuspensioiden valmistusta varten tai viivästetysti vapauttavina tabletteina. Suositellut annokset on esitetty taulukossa 1.
Hallinto-ohjeet
Kunkin annosmuodon antotapaohjeet on esitetty taulukossa 2.
Ota unohtunut annos mahdollisimman pian. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos normaaliin aikatauluun. Älä ota 2 annosta samanaikaisesti.
PROTONIX viivästyneen vapautumisen tabletit
Niele PROTONIX Delay-Release -tabletit kokonaisina, ruoan kanssa tai ilman vatsaa. Potilaille, jotka eivät pysty nielemään 40 mg:n tablettia, voidaan ottaa kaksi 20 mg:n tablettia. Antasidien samanaikainen anto ei vaikuta PROTONIX Delay-Release Tablets -tablettien imeytymiseen.
PROTONIX viivästetysti vapauttavaan oraalisuspensioon
Anna PROTONIX viivästetysti vapauttavaa oraalisuspensiota varten noin 30 minuuttia ennen ateriaa suun kautta omenamehussa tai omenakastikkeessa tai nenämahaletkussa vain omenamehussa. Koska oikea pH on välttämätön stabiilisuuden kannalta, älä anna PROTONIX 20 mg viivästyneesti vapauttavaa oraalisuspensiota muihin nesteisiin kuin omenamehuun tai muihin ruokiin kuin omenasoseeseen.
Älä jaa 40 mg:n PROTONIX 20 mg viivästetysti vapauttavaa oraalisuspensiopakkausta luodaksesi 20 mg:n annoksen lapsipotilaille, jotka eivät voi ottaa tablettiformulaatiota.
PROTONIX viivästetysti vapauttavaan oraaliseen suspensioon - Suun kautta omenukastikkeessa
- Avaa paketti.
- Ripottele rakeita teelusikalliseen omenasosetta. ÄLÄ KÄYTÄ MUITA RUOKIA TAI MURSKAA TAI PURESKE RAKETTA.
- Ota 10 minuutin kuluessa valmistuksesta.
- Nauti kulauksista vettä varmistaaksesi, että rakeet huuhtoutuvat mahalaukkuun. Toista vesipalat tarpeen mukaan.
PROTONIX viivästetysti vapauttavaan oraaliseen suspensioon - Suun kautta omenamehussa
- Avaa paketti.
- Tyhjennä rakeet pieneen kuppiin tai teelusikalliseen, jossa on yksi teelusikallinen omenamehua.
- Sekoita 5 sekuntia (rakeet eivät liukene) ja niele välittömästi.
- Varmistaaksesi, että koko annos on otettu, huuhtele säiliö kerran tai kahdesti omenamehulla jäljellä olevien rakeiden poistamiseksi. Niele välittömästi.
PROTONIX 40 mg viivästetysti vapautuvaan oraalisuspensioon - Nenämahaletku (NG) tai gastrostomialetku.
Potilaille, joilla on nasogastrinen letku tai gastrostomialetku, PROTONIX 40 mg viivästetysti vapauttavaa oraalisuspensiota voidaan antaa seuraavasti:
- Irrota mäntä 2 unssin (60 ml) katetrikärkisen ruiskun säiliöstä. Hävitä mäntä.
- Liitä ruiskun katetrin kärki 16 ranskalaiseen (tai suurempaan) putkeen.
- Pidä letkuun kiinnitettyä ruiskua mahdollisimman korkealla samalla kun annat PROTONIX For Delay-Release oraalisuspensiota estääksesi letkun taipumisen.
- Tyhjennä pakkauksen sisältö ruiskun säiliöön.
- Lisää 10 ml (2 teelusikallista) omenamehua ja napauta ja/tai ravista varovasti ruiskun säiliötä ruiskun ja letkun huuhtelemiseksi. Toista vähintään kahdesti käyttämällä samaa määrää omenamehua (10 ml tai 2 teelusikallista) joka kerta. Ruiskuun ei saa jäädä rakeita.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Viivästyneen julkaisun tabletit:
- 40 mg pantopratsolia, keltaisia soikeita kaksoiskuperia tabletteja, joiden toiselle puolelle on painettu PROTONIX (ruskea muste)
- 20 mg pantopratsolia, keltaisia soikeita kaksoiskuperia tabletteja, joiden toiselle puolelle on painettu P20 (ruskea muste)
Viivästetyn vapautumisen oraalinen suspensio:
- 40 mg pantopratsolia, vaalean kellertävästä tummanruskeaan, enteropäällysteisiä rakeita kerta-annospakkauksessa
Varastointi ja käsittely
PROTONIX (pantopratsolinatrium) viivästyneen vapautumisen tabletit Toimitetaan keltaisina, soikeina kaksoiskuperina viivästetysti vapauttavina tabletteina, joiden toiselle puolelle on painettu PROTONIX (ruskea muste) ja jotka sisältävät 40 mg pantopratsolia, ja niitä on saatavana seuraavasti:
NDC 0008-0841-81, 90 pulloa
PROTONIX (pantopratsolinatrium) viivästyneen vapautumisen tabletit Toimitetaan keltaisina soikeina kaksoiskuperina viivästetysti vapauttavina tabletteina, joiden toiselle puolelle on painettu P20 (ruskea muste) ja jotka sisältävät 20 mg pantopratsolia, ja niitä on saatavana seuraavasti:
NDC 0008-0843-81, 90 pulloa
PROTONIX (pantopratsolinatrium) viivästetysti vapauttavaan oraalisuspensioon toimitetaan vaalean kellertävän tai tumman ruskehtavana, enteropäällysteisinä rakeina, jotka sisältävät 40 mg pantopratsolia kerta-annospakkauksessa, ja niitä on saatavana seuraavasti:
NDC 0008-0844-02, 30 kappaleen yksikköannospakkaus
Varastointi
Säilytä PROTONIX 40 mg viivästetysti vapauttavia oraalisuspensioita varten ja PROTONIX 20 mg viivästyneesti vapauttavia tabletteja 20–25 °C:ssa (68–77 °F); retket sallitaan 15° - 30°C (59° - 86°F) [katso USP-ohjattu huonelämpötila ].
Jakelija: Wyeth Pharmaceuticals LLC, Pfizer Inc:n tytäryhtiö, Philadelphia, PA 19101. Tarkistettu: marraskuu 2020
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Akuutti tubulointerstitiaalinen nefriitti [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Luun murtuma [katso VAROITUKSET JA VAROTOIMET ]
- Ihon ja systeeminen lupus erythematosus [katso VAROITUKSET JA VAROTOIMET ]
- Syanokobalamiinin (B-12-vitamiinin) puutos [katso VAROITUKSET JA VAROTOIMET ]
- Hypomagnesemia [katso VAROITUKSET JA VAROTOIMET ]
- Pohjarauhasten polyypit [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
PROTONIXin (pantopratsolinatrium) viivästetysti vapauttavien oraalisuspensioiden ja PROTONIXin (pantopratsolinatrium) viivästetysti vapauttavien tablettien haittavaikutusprofiilit ovat samanlaiset.
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Aikuiset
Turvallisuus yhdeksässä satunnaistetussa vertailevassa Yhdysvalloissa tehdyssä kliinisessä tutkimuksessa GERD-potilailla, joihin osallistui 1 473 potilasta, jotka saivat suun kautta otettavaa PROTONIX-hoitoa (20 mg tai 40 mg), 299 potilasta sai H2-reseptorin salpaajaa, 46 potilasta sai toista PPI:tä ja 82 potilasta lumelääkettä. Yleisimmin esiintyvät haittavaikutukset on lueteltu taulukossa 3.
Muita haittavaikutuksia, joita ilmoitettiin PROTONIX 20 mg:n yhteydessä kliinisissä tutkimuksissa ≤ 2 % esiintymistiheydellä, on lueteltu alla kehokohtaisesti:
Keho kokonaisuutena: allerginen reaktio, kuume, valoherkkyysreaktio, kasvojen turvotus
Ruoansulatuskanava: ummetus, suun kuivuminen, hepatiitti
Hematologinen: leukopenia, trombosytopenia
Aineenvaihdunta/ravitsemus: kohonnut CK (kreatiinikinaasi), yleistynyt turvotus, kohonneet triglyseridit, kohonneet maksaentsyymit
Tuki- ja liikuntaelimistö: myalgia
Hermostunut: masennus, huimaus
Iho ja lisäkkeet: urtikaria, ihottuma, kutina
Erityiset aistit: näön hämärtyminen
Pediatriset potilaat
PROTONIXin turvallisuutta GERD:hen liittyvän EE:n hoidossa arvioitiin 1–16-vuotiailla lapsipotilailla kolmessa kliinisessä tutkimuksessa. Turvallisuustutkimuksissa oli mukana lapsipotilaita, joilla oli EE; Koska EE on kuitenkin harvinaista lapsiväestössä, arvioitiin myös 249 lapsipotilasta, joilla oli endoskooppisesti todettu tai oireinen GERD. Kaikkien aikuisten PROTONIX 20 mg:n haittavaikutusten katsotaan olevan merkityksellisiä lapsipotilaille. 1-16-vuotiailla potilailla yleisimmin raportoituja (>4 %) haittavaikutuksia ovat: URI, päänsärky, kuume, ripuli, oksentelu, ihottuma ja vatsakipu.
Turvallisuustiedot alle 1-vuotiaille potilaille, katso Käyttö tietyissä populaatioissa .
Muita haittavaikutuksia, joita ilmoitettiin PROTONIX 20 mg:n yhteydessä lapsipotilailla kliinisissä tutkimuksissa ≤4 % esiintymistiheydellä, on lueteltu alla kehojärjestelmän mukaan:
Keho kokonaisuutena: allerginen reaktio, kasvojen turvotus
Ruoansulatuskanava: ummetus, ilmavaivat, pahoinvointi
Aineenvaihdunta/ravitsemus: kohonneet triglyseridit, kohonneet maksaentsyymiarvot, kohonnut CK (kreatiinikinaasi)
Tuki- ja liikuntaelimistö: nivelkipu, myalgia
Hermostunut: huimaus, huimaus
Iho ja lisäkkeet: urtikaria
Seuraavia aikuisilla kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei raportoitu lapsipotilailla kliinisissä tutkimuksissa, mutta niiden katsotaan olevan merkityksellisiä lapsipotilaille: valoherkkyysreaktio, suun kuivuminen, hepatiitti, trombosytopenia, yleistynyt turvotus, masennus, kutina, leukopenia ja näön hämärtyminen .
Zollinger-Ellisonin (ZE) oireyhtymä
ZE-oireyhtymää koskevissa kliinisissä tutkimuksissa 35 potilaalla, jotka saivat PROTONIXia 80–240 mg/vrk enintään 2 vuoden ajan, raportoidut haittavaikutukset olivat samanlaisia kuin aikuispotilailla, joilla on GERD.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu PROTONIXin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Nämä haittavaikutukset on lueteltu alla kehojärjestelmän mukaan:
Ruoansulatuskanavan häiriöt: pohjarauhasen polyypit
Yleiset häiriöt ja hallinnolliset ehdot: astenia, väsymys, huonovointisuus
Hematologinen: pansytopenia, agranulosytoosi
Maksan ja sappien häiriöt: hepatosellulaarinen vaurio, joka johtaa keltaisuuteen ja maksan vajaatoimintaan
Immuunijärjestelmän häiriöt: anafylaksia (mukaan lukien anafylaktinen sokki), systeeminen lupus erythematosus
Infektiot ja infektiot: Clostridium difficileen liittyvä ripuli
Tutkimukset: painon muutokset
Aineenvaihdunta ja ravitsemushäiriöt: hyponatremia, hypomagnesemia
Tuki- ja liikuntaelinten sairaudet: rabdomyolyysi, luunmurtuma
Hermostunut: ageusia, dysgeusia
Psyykkiset häiriöt: hallusinaatiot, sekavuus, unettomuus, uneliaisuus
Munuaisten ja virtsateiden häiriöt: akuutti tubulointerstitiaalinen nefriitti
Ihon ja ihonalaisten kudosten häiriöt: vakavat dermatologiset reaktiot (joissakin tapauksissa kuolemaan johtavia), mukaan lukien erythema multiforme, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi (TEN, jotkut kuolemaan johtavat), angioödeema (Quincken turvotus) ja ihon lupus erythematosus
HUUMEIDEN VUOROVAIKUTUKSET
Taulukko 4 sisältää lääkkeet, joilla on kliinisesti merkittäviä lääkevuorovaikutuksia ja yhteisvaikutuksia diagnostisten aineiden kanssa, kun niitä annetaan samanaikaisesti PROTONIXin kanssa, sekä ohjeet niiden ehkäisyyn tai hoitoon.
Katso samanaikaisesti käytettyjen lääkkeiden pakkausmerkintöjä saadaksesi lisätietoja yhteisvaikutuksista PPI:iden kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Läsnäolo mahalaukun pahanlaatuisuuden
Aikuisilla PROTONIX-hoidon oireenmukainen vaste ei sulje pois mahalaukun pahanlaatuisuuden esiintymistä. Harkitse lisäseurantaa ja diagnostisia testejä aikuispotilaille, joilla on suboptimaalinen vaste tai varhainen oireinen uusiutuminen PPI-hoidon päätyttyä. Vanhemmilla potilailla harkitse myös endoskopiaa.
Akuutti tubulointerstitiaalinen nefriitti
Akuuttia tubulointerstitiaalista nefriittiä (TIN) on havaittu PPI-lääkkeitä käyttävillä potilailla, ja se voi ilmaantua milloin tahansa PPI-hoidon aikana. Potilailla voi esiintyä erilaisia merkkejä ja oireita oireellisista yliherkkyysreaktioista epäspesifisiin munuaisten toiminnan heikkenemisen oireisiin (esim. huonovointisuus, pahoinvointi, anoreksia). Raportoiduissa tapaussarjoissa joillekin potilaille diagnosoitiin biopsia ja munuaisten ulkopuolisia oireita (esim. kuumetta, ihottumaa tai nivelkipua) ei ilmennyt. Lopeta PROTONIX 20 mg:n käyttö ja arvioi potilaat, joilla epäillään akuuttia TIN:ää [katso VASTA-AIHEET ].
Clostridium difficileen liittyvä ripuli
Julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito, kuten PROTONIX 20 mg, saattaa liittyä lisääntyneeseen Clostridium difficileen liittyvän ripulin riskiin, erityisesti sairaalapotilailla. Tätä diagnoosia tulisi harkita ripulille, joka ei parane [katso HAITTAVAIKUTUKSET ].
Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen.
Luunmurtuma
Useat julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito saattaa liittyä lisääntyneeseen osteoporoosiin liittyvien lonkka-, ranteen- tai selkärangan murtumien riskiin. Murtumariski lisääntyi potilailla, jotka saivat suuria annoksia, jotka määriteltiin useiksi päivittäisiksi annoksiksi, ja pitkäaikaista PPI-hoitoa (vuoden tai pidempään). Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen. Potilaita, joilla on osteoporoosiin liittyvien murtumien riski, tulee hoitaa vahvistettujen hoitoohjeiden mukaisesti [katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET ].
Ihon ja systeeminen lupus erythematosus
Ihon lupus erythematosus (CLE) ja systeeminen lupus erythematosus (SLE) on raportoitu potilailla, jotka käyttävät PPI-lääkkeitä, mukaan lukien pantopratsolinatrium. Nämä tapahtumat ovat ilmenneet sekä uutena ilmaantumisena että olemassa olevan autoimmuunisairauden pahenemisena. Suurin osa PPI:n aiheuttamista lupus erythematous -tapauksista oli CLE.
Yleisin PPI-lääkkeillä hoidetuilla potilailla raportoitu CLE:n muoto oli subakuutti CLE (SCLE), ja se esiintyi viikkojen tai vuosien kuluessa jatkuvan lääkehoidon jälkeen potilailla, jotka vaihtelivat imeväisistä vanhuksiin. Yleensä histologiset löydökset havaittiin ilman elinten osallistumista.
Systeemistä lupus erythematosusta (SLE) on raportoitu harvemmin kuin CLE:tä PPI-lääkkeitä saavilla potilailla. PPI:hen liittyvä SLE on yleensä lievempi kuin ei-lääkkeiden aiheuttama SLE. SLE puhkesi tyypillisesti päivien tai vuosien kuluessa hoidon aloittamisesta ensisijaisesti potilailla, jotka vaihtelivat nuorista aikuisista vanhuksiin. Suurimmalla osalla potilaista oli ihottumaa; kuitenkin myös nivelkipua ja sytopeniaa raportoitiin.
Vältä PPI-lääkkeiden antamista pidempään kuin lääketieteellisesti on tarpeen. Jos PROTONIX 40 mg -valmistetta saavilla potilailla havaitaan CLE:n tai SLE:n mukaisia merkkejä tai oireita, lopeta lääkkeen käyttö ja lähetä potilas asianmukaisen asiantuntijan arvioitavaksi. Useimmat potilaat paranevat, kun pelkkä PPI-hoito lopetetaan 4–12 viikossa. Serologiset testit (esim. ANA) voivat olla positiivisia ja kohonneiden serologisten testien tulosten korjaaminen voi kestää kauemmin kuin kliiniset oireet.
Syanokobalamiinin (B-12-vitamiinin) puutos
Yleensä päivittäinen hoito millä tahansa happoa vähentävillä lääkkeillä pitkän ajan (esim. yli 3 vuoden ajan) voi johtaa syanokobalamiinin (vitamiini B-12) imeytymishäiriöön, jonka aiheuttaa hypo- tai aklorhydria. Kirjallisuudessa on raportoitu harvoin syanokobalamiinin puutteesta happoa vähentävän hoidon yhteydessä. Tätä diagnoosia tulee harkita, jos havaitaan syanokobalamiinin puutteen mukaisia kliinisiä oireita.
Hypomagnesemia
Oireista ja oireetonta hypomagnesemiaa on raportoitu harvoin potilailla, joita on hoidettu PPI-lääkkeillä vähintään kolmen kuukauden ajan ja useimmissa tapauksissa vuoden hoidon jälkeen. Vakavia haittavaikutuksia ovat tetania, rytmihäiriöt ja kouristukset. Useimmilla potilailla hypomagnesemian hoito vaati magnesiumin korvaamista ja PPI:n lopettamista.
Potilaiden, joiden odotetaan saavan pitkäaikaista hoitoa tai jotka käyttävät PPI-lääkkeitä lääkkeiden, kuten digoksiinin tai lääkkeiden kanssa, jotka voivat aiheuttaa hypomagnesemiaa (esim. diureetit), terveydenhuollon ammattilaiset voivat harkita magnesiumpitoisuuden seurantaa ennen PPI-hoidon aloittamista ja määräajoin [ks. HAITTAVAIKUTUKSET ].
Tuumorigeenisyys
GERD:n kroonisesta luonteesta johtuen PROTONIXin pitkittyminen saattaa olla mahdollista. Pitkäaikaisissa jyrsijätutkimuksissa pantopratsoli oli karsinogeeninen ja aiheutti harvinaisia maha-suolikanavan kasvaimia. Näiden löydösten merkitystä kasvaimen kehitykselle ihmisillä ei tunneta [katso Ei-kliininen toksikologia ].
Pohjarauhasten polyypit
PPI:n käyttöön liittyy lisääntynyt pohjukaissuolen polyyppien riski, joka lisääntyy pitkäaikaisessa käytössä, erityisesti yli vuoden. Suurin osa PPI-käyttäjistä, joille kehittyi pohjukaisrauhasen polyyppeja, oli oireettomia ja pohjukaisrauhasen polyypit tunnistettiin sattumalta endoskopiassa. Käytä lyhyintä PPI-hoitoa, joka sopii hoidettavaan sairauteen.
Neuroendokriinisten kasvainten tutkimusten häiriöt
Seerumin kromograniini A (CgA) -tasot nousevat toissijaisesti lääkkeiden aiheuttaman mahalaukun happamuuden laskun seurauksena. Lisääntynyt CgA-taso voi aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa. Terveydenhuollon tarjoajien tulee tilapäisesti lopettaa PROTONIX 20 mg -hoito vähintään 14 päivää ennen CgA-tason arviointia ja harkita testin toistamista, jos CgA-alkutasot ovat korkeat. Jos suoritetaan sarjatestejä (esim. seurantaa varten), testaukseen tulee käyttää samaa kaupallista laboratoriota, koska testien väliset vertailualueet voivat vaihdella [ks. KLIININEN FARMAKOLOGIA ].
THC:n virtsanäytön häiriöt
On raportoitu vääriä positiivisia virtsan seulontatestejä tetrahydrokannabinolin (THC) suhteen potilailla, jotka saavat PPI-lääkkeitä, mukaan lukien PROTONIX (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
PROTONIXin samanaikainen käyttö metotreksaatin kanssa
Kirjallisuus viittaa siihen, että PPI-lääkkeiden samanaikainen käyttö metotreksaatin kanssa (ensisijaisesti suurina annoksina; katso metotreksaatin ohjeet) voi nostaa ja pidentää metotreksaatin ja/tai sen metaboliitin seerumipitoisuuksia, mikä saattaa johtaa metotreksaattitoksisuuteen. Suuria metotreksaattiannoksia käytettäessä PPI:n väliaikaista keskeyttämistä voidaan harkita joillakin potilailla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ja käyttöohjeet ).
Mahalaukun pahanlaatuisuus
Neuvo potilaita palaamaan terveydenhuollon tarjoajansa puoleen, jos heillä ei ole optimaalinen vaste tai varhainen oireinen uusiutuminen [ks. VAROITUKSET JA VAROTOIMET ].
Akuutti tubulointerstitiaalinen nefriitti
Neuvo potilaita soittamaan välittömästi terveydenhuollon tarjoajalleen, jos heillä on merkkejä ja/tai oireita, jotka liittyvät akuuttiin tubulointerstitiaaliseen nefriittiin [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ].
Clostridium Difficilen aiheuttama ripuli
Neuvo potilaita soittamaan välittömästi terveydenhuollon tarjoajalleen, jos heillä on ripuli, joka ei parane [katso VAROITUKSET JA VAROTOIMET ].
Luunmurtuma
Neuvo potilaita ilmoittamaan kaikista murtumista, erityisesti lonkan, ranteen tai selkärangan murtumasta terveydenhuollon tarjoajalleen [ks. VAROITUKSET JA VAROTOIMET ].
Ihon ja systeeminen lupus erythematosus
Neuvo potilaita soittamaan välittömästi terveydenhuollon tarjoajalleen, jos ihon tai systeemisen lupus erythematosuksen aiheuttama uusi tai pahenee oireet [ks. VAROITUKSET JA VAROTOIMET ].
Syanokobalamiinin (B-12-vitamiinin) puutos
Neuvo potilaita ilmoittamaan kaikista kliinisistä oireista, jotka voivat liittyä syanokobalamiinin puutteeseen terveydenhuollon tarjoajalleen, jos he ovat saaneet PROTONIX 40 mg pidempään kuin 3 vuotta [ks. VAROITUKSET JA VAROTOIMET ].
Hypomagnesemia
Neuvo potilaita ilmoittamaan kaikista kliinisistä oireista, jotka voivat liittyä hypomagnesemiaan terveydenhuollon tarjoajalleen, jos he ovat saaneet PROTONIX 40 mg vähintään 3 kuukauden ajan [ks. VAROITUKSET JA VAROTOIMET ].
Huumeiden vuorovaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen kaikista muista lääkkeistä, joita he tällä hetkellä käyttävät, mukaan lukien rilpiviriiniä sisältävät tuotteet [ks. VASTA-AIHEET ] digoksiini [katso VAROITUKSET JA VAROTOIMET ] ja suuriannoksinen metotreksaatti [ks VAROITUKSET JA VAROTOIMET ].
Raskaus
Kerro raskaana olevalle naiselle mahdollisesta riskistä sikiölle. Neuvo lisääntymiskykyisiä naisia ilmoittamaan terveydenhuollon tarjoajalleen tunnetusta tai epäillystä raskaudesta [katso Käyttö tietyissä populaatioissa ].
Hallinto
- Älä halkaise, murskaa tai pureskele PROTONIXia viivästetysti vapauttavia oraalisuspensioita ja PROTONIX 20 mg viivästetysti vapauttavia tabletteja varten.
- PROTONIX-oraalisuspensiopakkaus on kiinteä annos, eikä sitä voi jakaa pienemmäksi annokseksi.
- Niele PROTONIX 20 mg viivästetysti vapauttavat tabletit kokonaisina, ruoan kanssa tai ilman vatsaa.
- Antasidien samanaikainen anto ei vaikuta PROTONIX Delay-Release Tablets -tablettien imeytymiseen.
- Ota PROTONIX 20 mg viivästetysti vapauttavaa oraalisuspensiota noin 30 minuuttia ennen ateriaa.
- Anna PROTONIX For Delay-Release oraalisuspensio omenamehussa tai omenasoseessa käyttöohjeissa kuvatulla tavalla. Älä annostele veteen, muihin nesteisiin tai elintarvikkeisiin.
- Potilaille, joilla on nenä-mahaletku (NG) tai gastrostomialetku, PROTONIX For Delayed Release oral Suspensio voidaan antaa omenamehun kanssa käyttöohjeissa kuvatulla tavalla.
- Ota unohtunut annos mahdollisimman pian. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos normaaliin aikatauluun. Älä ota 2 annosta samanaikaisesti.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
24 kuukautta kestäneessä karsinogeenisuustutkimuksessa Sprague-Dawley-rottia hoidettiin suun kautta pantopratsoliannoksilla 0,5-200 mg/kg/vrk, mikä on noin 0,1-40 kertaa altistus kehon pinta-alalla laskettuna 50-kiloiselle henkilölle, jolle annettiin 40 mg:aa. /päivä. Mahapohjassa hoito annoksella 0,5-200 mg/kg/vrk aiheutti enterokromaffiinin kaltaisten (ECL) solujen liikakasvua ja hyvän- ja pahanlaatuisia neuroendokriinisolukasvaimia annosriippuvaisella tavalla. Etumahassa hoito 50 ja 200 mg/kg/vrk (noin 10 ja 40 kertaa suositeltu annos ihmiselle kehon pinta-alan perusteella) tuotti hyvänlaatuisia okasolupapilloomeja ja pahanlaatuisia okasolusyöpää. Pantopratsolihoitoon liittyviä harvinaisia maha-suolikanavan kasvaimia olivat pohjukaissuolen adenokarsinooma annoksella 50 mg/kg/vrk ja hyvänlaatuiset mahanpohjan polyypit ja adenokarsinoomat annoksella 200 mg/kg/vrk. Maksassa hoito 0,5–200 mg/kg/vrk lisäsi annoksesta riippuvaa maksasoluadenomien ja karsinoomien ilmaantuvuutta. Kilpirauhasessa hoito annoksella 200 mg/kg/vrk lisäsi follikulaaristen solujen adenoomien ja karsinoomien ilmaantuvuutta sekä uros- että naarasrotilla.
24 kuukautta kestäneessä karsinogeenisuustutkimuksessa Fischer 344 -rottia hoidettiin suun kautta pantopratsolin annoksilla 5-50 mg/kg/vrk, joka on noin 1-10 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella. Mahapohjassa hoito annoksella 5-50 mg/kg/vrk aiheutti enterokromaffiinin kaltaisten (ECL) solujen liikakasvua sekä hyvän- ja pahanlaatuisia neuroendokriinisolukasvaimia. Tämän tutkimuksen annoksen valinta ei ehkä ollut riittävä pantopratsolin karsinogeenisen potentiaalin kattavaan arvioimiseen.
24 kuukautta kestäneessä karsinogeenisuustutkimuksessa B6C3F1-hiiriä hoidettiin suun kautta pantopratsolin annoksilla 5-150 mg/kg/vrk, joka on 0,5-15 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella. Maksassa hoito annoksella 150 mg/kg/vrk lisäsi hepatosellulaaristen adenoomien ja karsinoomien ilmaantuvuutta naarashiirillä. Hoito annoksella 5 - 150 mg/kg/päivä aiheutti myös mahalaukun pohjan ECL-solujen liikakasvua.
26 viikkoa kestänyt p53 +/-siirtogeeninen hiiren karsinogeenisuustutkimus ei ollut positiivinen.
Pantopratsoli oli positiivinen ihmisen lymfosyyttien kromosomipoikkeavuusmäärityksissä in vitro, yhdessä kahdesta hiiren mikrotumatestistä klastogeenisten vaikutusten varalta ja in vitro kiinanhamsterin munasarjasolu/HGPRT-mutaatiotestissä mutageenisten vaikutusten toteamiseksi. Epäselviä tuloksia havaittiin in vivo rotan maksan DNA:n kovalenttisessa sitoutumismäärityksessä. Pantopratsoli oli negatiivinen in vitro Amesin mutaatiomäärityksessä, in vitro unscheduled DNA synthesis (UDS) -testissä rotan maksasoluilla, in vitro AS52/GPT nisäkässolujen eteenpäin suuntautuvassa geenimutaatiomäärityksessä, in vitro tymidiinikinaasimutaatiotestissä hiiren lymfoomalla L5178Y solut ja in vivo rotan luuydinsolujen kromosomipoikkeavuusmääritys.
Pantopratsolia ei esiintynyt hedelmällisyyteen tai lisääntymiskykyyn annettaessa suun kautta 500 mg/kg/vrk urosrotille (98 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella) ja 450 mg/kg/vrk naarasrotille. (88 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot julkaistuista havainnointitutkimuksista eivät osoittaneet suurta epämuodostumia tai muita haitallisia raskausvaikutuksia pantopratsolin kanssa.
Lisääntymistutkimuksissa eläimillä ei havaittu pantopratsolin haitallisia kehitystuloksia. Lisääntymistutkimuksia on suoritettu rotilla suun kautta annetuilla annoksilla aina 450 mg/kg/vrk (noin 88 kertaa ihmiselle suositeltuun annokseen verrattuna) ja kaniineilla oraalisilla annoksilla 40 mg/kg/vrk (noin 16 kertaa ihmisille suositeltuun annokseen verrattuna). pantopratsolin antaminen tiineillä eläimillä organogeneesin aikana, eivätkä ne ole paljastaneet todisteita pantopratsolin aiheuttamasta haitasta sikiölle tässä tutkimuksessa (ks. Data ).
Pantopratsolinatriumilla suoritettiin pre- ja postnataalinen kehitystoksisuustutkimus rotilla, jossa oli muita päätepisteitä luuston kehitykseen kohdistuvan vaikutuksen arvioimiseksi. Suun kautta otettavat pantopratsoliannokset 5, 15 ja 30 mg/kg/vrk (noin 1, 3 ja 6 kertaa ihmisannos 40 mg/vrk) annettiin raskaana oleville naisille raskauspäivästä (GD) 6 imetyspäivään (LD). ) 21. Muutoksia luuston morfologiassa havaittiin pentuilla, jotka altistettiin pantopratsolille kohdussa ja maidon kautta imetyksen aikana sekä suun kautta annettaessa synnytyksen jälkeisestä päivästä (PND) 4:stä PND:hen 21 [ks. Käyttö tietyissä populaatioissa ]. Emoeläimillä ei havaittu lääkkeisiin liittyviä löydöksiä. Kerro raskaana oleville naisille mahdollisesta sikiövaurion vaarasta.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Ihmistiedot
Saatavilla olevat tiedot julkaistuista havainnointitutkimuksista eivät osoittaneet yhteyttä raskauteen liittyviin haitallisiin seurauksiin ja pantopratsolin käyttöön. Näiden havainnointitutkimusten metodologiset rajoitukset eivät voi varmasti vahvistaa tai sulkea pois mitään lääkkeisiin liittyvää riskiä raskauden aikana. European Network of Teratology Information Services -verkoston prospektiivisessa tutkimuksessa tuloksia 53 raskaana olevan naisen ryhmästä, joille annettiin pantopratsolin mediaaniannos 40 mg, verrattiin 868 raskaana olevan naisen kontrolliryhmään, jotka eivät käyttäneet protonipumpun estäjiä (PPI). . Suurten epämuodostumien määrässä ei ollut eroa PPI-lääkkeille altistuneiden naisten ja kontrolliryhmän välillä, mikä vastasi suhteellista riskiä (RR) = 0,55, [95 %:n luottamusväli (CI) 0,08-3,95]. Väestöpohjaisessa retrospektiivisessä kohorttitutkimuksessa, joka kattoi kaikki elävänä syntyneet lapset Tanskassa vuosina 1996–2008, vakavien synnynnäisten epämuodostumien määrä ei lisääntynyt merkittävästi 549 elävänä syntyneen ensimmäisen raskauskolmanneksen pantopratsolialtistuksen analysoinnin aikana. Meta-analyysi, jossa verrattiin 1 530 raskaana olevaa naista, jotka olivat altistuneet PPI-lääkkeille vähintään ensimmäisen raskauskolmanneksen aikana 133 410 altistumattomaan raskaana olevaan naiseen, ei osoittanut merkittävää synnynnäisten epämuodostumien tai spontaanin abortin riskin lisääntymistä PPI-lääkkeille altistumisen yhteydessä (suurten epämuodostumien osalta OR = 1,12 ([95%) CI 0,86-1,45] ja spontaaneille aborteille OR=1,29 [95 % CI 0,84-1,97]).
Eläinten tiedot
Lisääntymistutkimuksia on suoritettu rotilla pantopratsoliannoksilla suun kautta 450 mg/kg/vrk asti (noin 88 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella) ja kaniineilla oraalisilla annoksilla 40 mg/kg/vrk asti (noin 16). kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella), kun pantopratsolinatriumia annettiin tiineillä eläimillä organogeneesin aikana. Tutkimukset eivät ole paljastaneet pantopratsolin aiheuttamaa hedelmällisyyden heikkenemistä tai sikiölle aiheutuvaa haittaa.
Pantopratsolinatriumilla suoritettiin pre- ja postnataalinen kehitystoksisuustutkimus rotilla, jossa oli muita päätepisteitä luuston kehitykseen kohdistuvan vaikutuksen arvioimiseksi. Suun kautta otettavat pantopratsoliannokset 5, 15 ja 30 mg/kg/vrk (noin 1, 3 ja 6 kertaa ihmisen 40 mg/vrk kehon pinta-alan perusteella laskettuna) annettiin raskaana oleville naisille raskauspäivästä (GD) alkaen. 6 - laktaatiopäivä (LD) 21. Synnytyksen jälkeisenä päivänä (PND 4) - PND 21, pennuille annettiin suun kautta annoksia 5, 15 ja 30 mg/kg/vrk (noin 1, 2,3 ja 3,2 kertaa altistuminen ( AUC) ihmisillä annoksella 40 mg). Emoeläimillä ei havaittu lääkkeisiin liittyviä löydöksiä. Pentujen vieroitusvaiheessa (PND 4-21) kuolleisuus ja/tai kuolleisuus lisääntyi ja ruumiinpaino ja painonnousu väheni annoksella 5 mg/kg/vrk (suunnilleen samat altistukset (AUC) ihmisillä, jotka saivat 40 mg annos) ja suurempia annoksia. PND 21:ssä jälkeläisillä havaittiin reisiluun keskimääräisen pituuden ja painon pienenemistä ja muutoksia reisiluun luun massassa ja geometriassa annoksella 5 mg/kg/vrk (suunnilleen samat altistukset (AUC) ihmisillä 40 mg:n annoksella) ja suuremmilla annoksilla. Reisiluun löydöksiä olivat pienempi kokonaispinta-ala, luun mineraalipitoisuus ja tiheys, periosteaalin ja endosteaalin ympärysmitta sekä poikkileikkauksen hitausmomentti. Distaalisessa reisiluussa, proksimaalisessa sääriluussa tai nivelissä ei ollut mikroskooppisia muutoksia. Muutokset luuparametreissä olivat osittain palautuvia toipumisjakson jälkeen, ja havainnot PND 70:stä rajoittuivat alempaan reisiluun metafyysiseen kortikaaliseen/subkortikaaliseen luun mineraalitiheyteen naaraspentuilla annoksella 5 mg/kg/vrk (suunnilleen samat altistukset (AUC) ihmisillä 40-vuotiaana) mg annos) ja suurempia annoksia.
Imetys
Riskien yhteenveto
Pantopratsolia on havaittu imettävän äidin rintamaidosta suun kautta otetun 40 mg:n pantopratsolin kerta-annoksen jälkeen. Ei ollut vaikutuksia imetettävään lapseen (ks Data ). Pantopratsolin vaikutuksista maidontuotantoon ei ole tietoa.

Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen PROTONIX 40 mg:n tarve ja mahdolliset pantopratsolin tai äidin taustalla olevan sairauden aiheuttamat haitalliset vaikutukset imetettävään lapseen.
Data
42-vuotiaan naisen rintamaitoa, joka sai 40 mg suun kautta otettavaa pantopratsolia 10 kuukautta synnytyksen jälkeen, tutkittiin 24 tunnin ajan, jotta rintamaidossa havaittiin alhainen pantopratsolipitoisuus. Pantopratsoli oli havaittavissa maidosta vain 2 ja 4 tuntia annoksen jälkeen maidon pitoisuuksilla noin 36 mcg/l ja 24 mcg/l. Maito/plasma-suhde havaittiin 0,022 2 tunnin kuluttua lääkkeen annosta. Pantopratsolia ei havaittu (
Käyttö lapsille
PROTONIXin turvallisuus ja tehokkuus GERD:hen liittyvän EE:n lyhytaikaisessa hoidossa (enintään kahdeksan viikkoa) on osoitettu 1–16-vuotiailla lapsipotilailla. Tehoa EE:n hoidossa ei ole osoitettu alle 1-vuotiailla potilailla. Lisäksi alle 5-vuotiaille potilaille ei ole saatavilla sopivaa annosvahvuutta ikään sopivassa formulaatiossa. Siksi PROTONIX on tarkoitettu GERD:hen liittyvän EE:n lyhytaikaiseen hoitoon 5-vuotiaille ja sitä vanhemmille potilaille. PROTONIXin turvallisuutta ja tehokkuutta muihin lasten kuin EE:n käyttöön ei ole varmistettu.
1 vuoden - 16 vuoden iässä
PROTONIXin käyttöä 1-16-vuotiailla lapsipotilailla GERD:hen liittyvän EE:n lyhytaikaiseen (enintään kahdeksan viikkoa) hoitoon tukee: a) tulosten ekstrapolointi riittävistä ja hyvin kontrolloiduista tutkimuksista, jotka tukivat PROTONIX GERD:hen liittyvän EE:n hoitoon aikuisilla ja b) lapsipotilailla tehdyt turvallisuus-, tehokkuus- ja farmakokineettiset tutkimukset [ks. Kliiniset tutkimukset , KLIININEN FARMAKOLOGIA ].
PROTONIX 40 mg:n turvallisuutta GERD:hen liittyvän EE:n hoidossa 1–16-vuotiailla lapsipotilailla arvioitiin kolmessa monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa rinnakkaishoitotutkimuksessa, joihin osallistui 249 lapsipotilasta, joista 8 sairastaa EE:tä (4 potilasta). ikä 1-5 vuotta ja 4 potilasta 5-11 vuotta). 1–5-vuotiaita lapsia, joilla oli endoskooppisesti diagnosoitu EE (määritelty endoskooppiseksi Hetzel-Dent-pisteeksi ≥2), hoidettiin kerran päivässä 8 viikon ajan yhdellä kahdesta PROTONIX-annostasosta (noin 0,6 mg/kg tai 1,2 mg/kg ). Kaikki 4 näistä EE-potilaista paranivat (Hetzel-Dent-pisteet 0 tai 1) 8 viikon kohdalla. Koska EE on harvinainen lapsiväestössä, näihin tutkimuksiin otettiin mukaan myös pääasiassa lapsipotilaita, joilla oli endoskooppisesti todettu tai oireinen GERD. Potilaita hoidettiin erilaisilla PROTONIX-annoksilla 20 mg kerran päivässä 8 viikon ajan. Katso turvallisuushavainnot HAITTAVAIKUTUKSET Koska näissä lapsitutkimuksissa ei ollut lumelääkettä, aktiivista vertailuainetta tai näyttöä annosvasteesta, tutkimukset eivät olleet vakuuttavia PROTONIX 20 mg:n kliinisen hyödyn suhteen oireisen GERD:n hoidossa lapsiväestössä. PROTONIX 40 mg:n tehokkuutta oireisen GERD:n hoidossa lapsipotilailla ei ole osoitettu.
Vaikka kliinisistä tutkimuksista saadut tiedot tukevat PROTONIXin käyttöä GERD:hen liittyvän EE:n lyhytaikaiseen hoitoon 1–5-vuotiailla lapsipotilailla, ei ole kaupallisesti saatavilla olevaa annosformulaatiota, joka soveltuisi alle 5-vuotiaille potilaille [ks. ANNOSTELU JA HALLINNOINTI ].
Populaatiofarmakokineettisessä analyysissä puhdistumaarvojen mediaaniarvo 1–5-vuotiailla lapsilla, joilla oli endoskooppisesti todettu GERD, oli 2,4 l/h. Pantopratsolin 1,2 mg/kg ekvivalenttiannoksen (15 mg ≤12,5 kg ja 20 mg > 12,5 -
Vastasyntyneet alle vuoden ikäisille
PROTONIX 20 mg:n ei havaittu olevan tehokas monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, hoidon keskeyttämistutkimuksessa, johon osallistui 129 1–11 kuukauden ikäistä lapsipotilasta. Potilaat otettiin mukaan, jos heillä oli oireinen GERD sairaushistorian perusteella eivätkä he olleet reagoineet GERD:n ei-farmakologisiin interventioihin kahteen viikkoon. Potilaat saivat PROTONIXia päivittäin neljän viikon ajan avoimessa vaiheessa, minkä jälkeen potilaat satunnaistettiin saamaan yhtä suuressa suhteessa PROTONIX-hoitoa 40 mg tai lumelääkettä seuraavien neljän viikon ajan kaksoissokkoutettuna. Teho arvioitiin tarkkailemalla aikaa satunnaistamisen ja tutkimuksen keskeyttämisestä oireiden pahenemisen vuoksi neljän viikon hoidon lopetusvaiheen aikana. PROTONIX 20 mg:n ja lumelääkkeen välillä ei ollut tilastollisesti merkitsevää eroa hoidon keskeyttämisasteessa.
Tässä tutkimuksessa haittavaikutukset, joita ilmoitettiin yleisemmin (ero ≥ 4 %) hoidetulla populaatiolla verrattuna lumelääkeryhmään, olivat kohonnut CK, välikorvatulehdus, nuha ja kurkunpäätulehdus.
Populaatiofarmakokineettisessä analyysissä systeeminen altistus oli suurempi alle 1-vuotiailla GERD-potilailla verrattuna aikuisiin, jotka saivat 40 mg:n kerta-annoksen (geometrinen keskimääräinen AUC oli 103 % suurempi keskosilla ja vastasyntyneillä, jotka saivat kerta-annoksen 2,5 mg ja 23 % suurempi 1–11 kuukauden ikäisillä imeväisillä, jotka saavat kerta-annoksen noin 1,2 mg/kg). Näillä potilailla näennäinen puhdistuma (CL/F) suureni iän myötä (mediaanipuhdistuma: 0,6 l/h, vaihteluväli: 0,03-3,2 l/h).
Nämä annokset johtivat farmakodynaamisiin vaikutuksiin mahalaukun, mutta eivät ruokatorven pH-arvoon. Kun ennenaikaisille vauvoille ja vastasyntyneille annettiin kerran vuorokaudessa 2,5 mg PROTONIX 20 mg, mahalaukun pH nousi (4,3:sta lähtötilanteessa 5,2:een vakaassa tilassa) ja keskimääräisenä prosenttiosuutena, jolloin mahalaukun pH oli > 4 ( 60 %:sta lähtötilanteessa 80 %:iin vakaassa tilassa). Kun 1–11 kuukauden ikäisille vauvoille annettiin kerran vuorokaudessa noin 1,2 mg/kg PROTONIX 20 mg, mahalaukun pH nousi (3,1:stä lähtötilanteessa 4,2:een vakaassa tilassa) ja keskimääräinen prosenttiosuus nousi. mahalaukun pH oli > 4 (32 %:sta lähtötilanteessa 60 %:iin vakaassa tilassa). Merkittäviä muutoksia ei kuitenkaan havaittu keskimääräisessä ruokatorven pH:ssa tai prosentteina ajasta, jolloin ruokatorven pH oli alle 4 kummassakaan ikäryhmässä.
Koska PROTONIX 20 mg:n ei osoitettu olevan tehokas satunnaistetussa, lumekontrolloidussa tutkimuksessa tässä ikäryhmässä, PROTONIXin käyttö oireisen GERD:n hoitoon alle 1-vuotiailla vauvoilla ei ole aiheellista.
Eläinten toksisuustiedot
Rotilla tehdyssä pre- ja postnataalisessa kehitystutkimuksessa pennuille annettiin suun kautta pantopratsoliannoksia 5, 15 ja 30 mg/kg/vrk (noin 1, 2,3 ja 3,2 kertaa altistus (AUC) ikäisille lapsille) 6–11 vuotta 40 mg:n annoksella) synnytyksen jälkeisenä päivänä (PND 4) PND 21:een, maidon kautta tapahtuvan imetyksen lisäksi. PND 21:ssä jälkeläisillä havaittiin reisiluun keskimääräisen pituuden ja painon pienenemistä ja muutoksia reisiluun luun massassa ja geometriassa annoksella 5 mg/kg/vrk (suunnilleen samat altistukset (AUC) 6–11-vuotiailla lapsilla 40 mg:n annoksella) ja suurempia annoksia. Muutokset luuparametreissä olivat osittain palautuvia toipumisjakson jälkeen.
Vastasyntyneillä/nuorilla eläimillä (rotilla ja koirilla) toksisuus oli samankaltainen kuin aikuisilla eläimillä, mukaan lukien mahalaukun muutokset, punasolumassan väheneminen, lipidipitoisuuden lisääntyminen, entsyymien induktio ja hepatosellulaarinen hypertrofia. Eosinofiilisten pääsolujen lisääntyminen aikuisilla ja vastasyntyneillä/nuorilla rotilla ja pääsolujen surkastuminen aikuisilla rotilla ja vastasyntyneillä/nuorilla koirilla havaittiin mahalaukun pohjan limakalvolla toistuvan annoksen tutkimuksissa. Näiden vaikutusten täydellinen tai osittainen toipuminen havaittiin molempien ikäryhmien eläimillä toipumisjakson jälkeen.
Geriatrinen käyttö
Lyhytaikaisissa yhdysvaltalaisissa kliinisissä tutkimuksissa EE:n paranemisasteet 107 iäkkäällä potilaalla (≥ 65-vuotiaita), joita hoidettiin PROTONIXilla, olivat samanlaiset kuin alle 65-vuotiailla potilailla. Haittavaikutusten ja laboratorioarvojen poikkeavuuksien ilmaantuvuus ikäisillä potilailla 65-vuotiaat ja sitä vanhemmat olivat samanlaisia kuin alle 65-vuotiailla potilailla.
YLIANNOSTUS
Kokemukset erittäin suuria PROTONIX-annoksia (yli 240 mg) käyttävistä potilaista ovat rajalliset. Spontaanit markkinoille tulon jälkeiset yliannostusraportit ovat yleensä PROTONIXin tunnetun turvallisuusprofiilin sisällä.
Pantopratsoli ei poistu hemodialyysillä. Yliannostustapauksissa hoidon tulee olla oireenmukaista ja tukevaa.
Pantopratsolin kerta-annokset suun kautta 709 mg/kg, 798 mg/kg ja 887 mg/kg olivat tappavia hiirille, rotille ja koirille. Akuutin myrkyllisyyden oireita olivat hypoaktiivisuus, ataksia, kyyryssä istuminen, raajan löystyminen, sivuasento, segregaatio, korvarefleksin puuttuminen ja vapina.
Jos PROTONIX 20 mg:lle ylialtistut, soita Myrkytystietokeskukseen numeroon 1-800-222-1222 saadaksesi ajantasaista tietoa myrkytyksen tai yliannostuksen hoidosta.
VASTA-AIHEET
- PROTONIX on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä jollekin valmisteen aineosalle tai jollekin substituoidulle bentsimidatsolille. Yliherkkyysreaktiot voivat sisältää anafylaksia, anafylaktinen sokki, angioödeema, bronkospasmi, akuutti tubulointerstitiaalinen nefriitti ja urtikaria [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
- Protonipumpun estäjät (PPI), mukaan lukien PROTONIX, ovat vasta-aiheisia potilailla, jotka saavat rilpiviriiniä sisältäviä tuotteita [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Pantopratsoli on PPI, joka estää mahahapon tuotannon viimeisen vaiheen sitoutumalla kovalenttisesti (H+, K+)-ATPaasientsyymijärjestelmään mahalaukun parietaalisolun erityspinnalla. Tämä vaikutus johtaa sekä perus- että stimuloidun mahahapon erityksen estoon ärsykkeestä riippumatta. Sitoutuminen (H+, K+)-ATPaasiin johtaa eritystä estävän vaikutuksen kestoon, joka jatkuu yli 24 tuntia kaikilla testatuilla annoksilla (20 mg - 120 mg).
Farmakodynamiikka
PROTONIX 20 mg viivästetysti vapauttavassa oraalisuspensiossa 40 mg:n on osoitettu olevan verrattavissa PROTONIXin viivästyneesti vapauttaviin tabletteihin pentagastriinistimuloidun MAO:n estämisessä potilailla (n = 49), joilla on GERD ja joilla on ollut EE. Tässä monikeskustutkimuksessa, farmakodynaamisessa crossover-tutkimuksessa 40 mg:n suun kautta otettavaa PROTONIX For Delay-Release Oral Suspensio -annosta, joka annettiin teelusikalliseen omenasosetta, verrattiin 40 mg:n oraaliseen annokseen PROTONIX viivästyneesti vapauttavia tabletteja sen jälkeen, kun kutakin formulaatiota oli annettu kerran päivässä 7 vuorokauden ajan. päivää. Molemmat lääkkeet annettiin 30 minuuttia ennen aamiaista. Pentagastriinistimuloitu (MAO) arvioitiin kello 23–24 vakaassa tilassa.
Antisekretiivinen toiminta
Maksimaalisissa happostimuloivissa olosuhteissa, kun käytetään pentagastriinia, annoksesta riippuvainen mahahapon erityksen lasku tapahtuu terveillä koehenkilöillä kerta-annoksen oraalisen (20-80 mg) tai suonensisäisen (20-120 mg) pantopratsolin kerta-annoksen jälkeen. Kerran vuorokaudessa annettu pantopratsoli lisää mahahapon erityksen estoa. Pantopratsolin 40 mg:n oraalisen aloitusannoksen jälkeen saavutettiin 51 %:n keskimääräinen esto 2,5 tunnissa. Kun annos annettiin kerran päivässä 7 päivän ajan, keskimääräinen esto nousi 85 prosenttiin. Pantopratsoli esti hapon eritystä yli 95 % puolella potilaista. Hapon eritys oli palautunut normaaliksi viikon kuluessa viimeisen pantopratsoliannoksen jälkeen; ei ollut todisteita rebound-hypersekretiosta.
Sarjassa annos-vastetutkimuksia pantopratsoli aiheutti 20–120 mg:n suun kautta otetuilla annoksilla annoksesta riippuvaisia nousuja mahalaukun peruspH:n mediaanissa ja prosentteina, kun mahalaukun pH oli >3 ja >4. Hoito 40 mg:lla pantopratsolia nosti mahalaukun pH:ta merkittävästi enemmän kuin 20 mg:n annos. Yli 40 mg:n (60, 80, 120 mg) annokset eivät nostaneet merkittävästi mahalaukun pH:n mediaaniarvoa. Pantopratsolin vaikutukset mediaani-pH:hen yhdestä kaksoissokkoutetusta ristikkäistutkimuksesta on esitetty taulukossa 5.
Seerumin gastriinivaikutukset
Seerumin paastogastriinipitoisuudet arvioitiin kahdessa kaksoissokkotutkimuksessa EE:n akuutista paranemisesta, joissa 682 gastroesofageaalista refluksitautia (GERD) sairastavaa potilasta sai 10, 20 tai 40 mg PROTONIXia 20 mg enintään 8 viikon ajan. Neljän viikon hoidon kohdalla keskimääräiset gastriinitasot nousivat 7 %, 35 % ja 72 % hoitoa edeltäviin arvoihin verrattuna 10, 20 ja 40 mg:n hoitoryhmissä. Samanlainen nousu seerumin gastriinipitoisuuksissa havaittiin 8 viikon käynnillä, ja keskimääräinen nousu oli 3 %, 26 % ja 84 % kolmessa pantopratsoliannosryhmässä. Seerumin gastriinipitoisuuden mediaani pysyi normaaleissa rajoissa PROTONIX Delay-Release Tablets -tablettien ylläpitohoidon aikana.
Pitkäaikaisissa kansainvälisissä tutkimuksissa, joihin osallistui yli 800 potilasta, havaittiin 2–3-kertainen keskimääräinen nousu hoitoa edeltävästä seerumin paasto-gastriinitasosta pantopratsolihoidon ensimmäisten kuukausien aikana 40 mg:n vuorokausiannoksilla GERD-ylläpitotutkimuksissa ja 40 mg tai enemmän päivässä potilailla, joilla on refraktorinen GERD. Seerumin paastogastriinipitoisuudet pysyivät yleensä noin 2–3 kertaa lähtötasoa korkeammillaan jopa 4 vuoden ajan säännöllisen seurannan ajan kliinisissä tutkimuksissa.
Lyhytaikaisen PROTONIX 20 mg -hoidon jälkeen kohonneet gastriinitasot palautuvat normaaliksi vähintään 3 kuukauden kuluttua.
Enterokromaffiinin kaltaiset (ECL) soluvaikutukset
39 potilaalla, joita hoidettiin pantopratsolia suun kautta 40–240 mg päivässä (enemmistö sai 40–80 mg) enintään 5 vuoden ajan, ECL-solutiheys lisääntyi kohtalaisesti ensimmäisen käyttövuoden jälkeen, mikä vaikutti tasangolla 4 vuoden jälkeen.
Sprague-Dawley-rotilla tehdyssä ei-kliinisessä tutkimuksessa pantopratsolin elinikäinen altistuminen (24 kuukautta) annoksilla 0,5-200 mg/kg/vrk johti annoksesta riippuvaiseen mahalaukun ECL-solujen lisääntymiseen ja mahalaukun neuroendokriinisiin (NE) solukasvaimiin. . Rottien mahalaukun NE-solukasvaimet voivat johtua seerumin gastriinipitoisuuksien kroonisesta noususta. ECL-solujen suuri tiheys rotan mahassa tekee tästä lajista erittäin herkän PPI-lääkkeiden tuottamien kohonneiden gastriinipitoisuuksien proliferatiivisille vaikutuksille. Seerumin gastriinipitoisuuden nousua ei kuitenkaan havaittu, kun pantopratsolia annettiin annoksella 0,5 mg/kg/vrk. Erillisessä tutkimuksessa mahalaukun NE-solukasvain ilman samanaikaisia ECL-solujen proliferatiivisia muutoksia havaittiin yhdellä naarasrotalla sen jälkeen, kun pantopratsolia annettiin 12 kuukautta annoksella 5 mg/kg/vrk ja 9 kuukauden palautuminen annoksen jälkeen [ks. Ei-kliininen toksikologia ].
Endokriiniset vaikutukset
Kliinisfarmakologisessa tutkimuksessa PROTONIX 40 mg kerran vuorokaudessa 2 viikon ajan ei vaikuttanut seuraavien hormonien tasoihin: kortisoli, testosteroni, trijodityroniini (T3), tyroksiini (T4), kilpirauhasta stimuloiva hormoni (TSH), tyroniini- sitova proteiini, lisäkilpirauhashormoni, insuliini, glukagoni, reniini, aldosteroni, follikkelia stimuloiva hormoni, luteinisoiva hormoni, prolaktiini ja kasvuhormoni.
Vuoden kestäneessä tutkimuksessa GERD-potilailla, joita hoidettiin 40 mg:lla tai 20 mg:lla PROTONIXia, ei havaittu muutoksia lähtötasosta T3-, T4- ja TSH-arvoissa.
Farmakokinetiikka
PROTONIX 40 mg viivästetysti vapauttavat tabletit valmistetaan enteropäällysteisiksi tableteiksi, joten pantopratsolin imeytyminen alkaa vasta sen jälkeen, kun tabletti on poistunut mahalaukusta. Seerumin huippupitoisuus (Cmax) ja seerumin pitoisuus-aikakäyrän alla oleva pinta-ala (AUC) suurenevat suhteessa suun kautta ja suonensisäisesti annettuihin annoksiin 10 mg:sta 80 mg:aan. Pantopratsoli ei keräänty, ja sen farmakokinetiikka ei muutu toistuvan päivittäisen annoksen yhteydessä. Suun kautta tai suonensisäisesti annetun pantopratsolin pitoisuus seerumissa pienenee kaksinkertaisesti, ja terminaalinen eliminaation puoliintumisaika on noin yksi tunti.
Nopeilla metaboloijilla, joilla on normaali maksan toiminta ja jotka saavat suun kautta enteropäällysteistä 40 mg:n pantopratsolitablettia, huippupitoisuus (Cmax) on 2,5 μg/ml. aika huippupitoisuuden saavuttamiseen (tmax) on 2,5 tuntia, ja keskimääräinen kokonaispinta-ala plasman pitoisuus-aikakäyrän alla (AUC) on 4,8 µg•h/ml (vaihteluväli 1,4-13,3 μg•h/ml). Kun pantopratsolia on annettu suonensisäisesti nopeille metaboloijille, sen kokonaispuhdistuma on 7,6-14,0 l/h ja näennäinen jakautumistilavuus 11,0-23,6 l.
Yhden oraalisen 40 mg:n PROTONIX For Delay-Release -oraalisuspension annoksen, 40 mg:n, osoitettiin olevan bioekvivalentti, kun se annettiin terveille koehenkilöille (N = 22) rakeina ripottuna teelusikalliseen omenasosetta, rakeina sekoitettuna omenamehuun tai sekoitettuna omenamehu, jonka jälkeen annostelu nenämahaletkun kautta. Plasman farmakokineettiset parametrit terveillä koehenkilöillä tehdystä ristikkäistutkimuksesta on esitetty taulukossa 6.
Imeytyminen
Kun PROTONIX 20 mg viivästyneesti vapauttavia tabletteja annettiin kerran tai useasti suun kautta, pantopratsolin huippupitoisuus plasmassa saavutettiin noin 2,5 tunnissa ja Cmax oli 2,5 μg/ml. Pantopratsolin ensikierron metabolia on vähäistä, minkä seurauksena absoluuttinen biologinen hyötyosuus on noin 77 %. Samanaikainen antasidien anto ei vaikuta pantopratsolin imeytymiseen.
PROTONIX Delay-Release Tablets -tablettien antaminen ruoan kanssa voi viivästyttää niiden imeytymistä jopa 2 tuntia tai kauemmin. Cmax ja pantopratsolin imeytymisen laajuus (AUC) eivät kuitenkaan muutu. Siten PROTONIX 40 mg viivästyneesti vapauttavat tabletit voidaan ottaa riippumatta aterioiden ajoituksesta.
Pantopratsolirakeiden, 40 mg, antaminen runsaan aterian yhteydessä viivästytti plasman huippupitoisuuden saavuttamiseen kuluvaa mediaaniaikaa 2 tunnilla. Samanaikaisen runsasrasvaisen aterian yhteydessä omenasoseeseen ripotettujen pantopratsolirakeiden (40 mg) Cmax-arvo pieneni 51 % ja AUC 29 %. Siksi PROTONIX 20 mg viivästyneeseen vapautumiseen tarkoitettu oraalisuspensio tulee ottaa noin 30 minuuttia ennen ateriaa.
Jakelu
Pantopratsolin näennäinen jakautumistilavuus on noin 11-23,6 l ja jakautuu pääasiassa solunulkoiseen nesteeseen. Pantopratsolin sitoutuminen seerumin proteiineihin on noin 98 %, pääasiassa albumiiniin.
Eliminointi
Aineenvaihdunta
Pantopratsoli metaboloituu laajalti maksassa sytokromi P450 (CYP) -järjestelmän kautta. Pantopratsolin metabolia on riippumaton antoreitistä (laskimoon tai suun kautta). Pääasiallinen aineenvaihduntareitti on demetylaatio CYP2C19:n toimesta ja sen jälkeen sulfatoituminen; muita metaboliareittejä ovat CYP3A4:n aiheuttama hapetus. Ei ole näyttöä siitä, että millään pantopratsolin metaboliiteilla olisi merkittävää farmakologista aktiivisuutta.
Erittyminen
Kun 14C-leimattua pantopratsolia annettiin kerta-annoksena suun kautta tai suonensisäisesti terveille, normaaleille metaboloiville koehenkilöille, noin 71 % annoksesta erittyi virtsaan ja 18 % ulosteeseen sapen kautta. Pantopratsoli ei erittynyt muuttumattomana munuaisten kautta.
Tietyt populaatiot
Geriatriset potilaat
Pantopratsolin AUC:n (43 %) ja Cmax:n (26 %) todettiin vain vähäistä tai kohtalaista nousua iäkkäillä henkilöillä (64–76-vuotiaat) toistuvan oraalisen annon jälkeen verrattuna nuorempiin koehenkilöihin [ks. Käyttö tietyissä populaatioissa ].
Pediatriset potilaat
Pantopratsolin farmakokinetiikkaa tutkittiin alle 16-vuotiailla lapsilla neljässä satunnaistetussa, avoimessa kliinisessä tutkimuksessa lapsipotilailla, joilla oli oletettu/todistettu GERD. Lasten raeformulaatiota tutkittiin alle 5-vuotiailla lapsilla, ja PROTONIX 40 mg viivästyneesti vapauttavia tabletteja tutkittiin yli 5-vuotiailla lapsilla.
Populaatio-PK-analyysissä kokonaispuhdistuma lisääntyi painon noustessa epälineaarisesti. Kokonaispuhdistuma kasvoi myös iän myötä vain alle 3-vuotiailla lapsilla.
Vastasyntynyt 5 vuoden ikään asti
[katso Käyttö tietyissä populaatioissa ]
Lapset ja nuoret 6–16-vuotiaat
PROTONIX Delay-Release Tablets -tablettien farmakokinetiikkaa arvioitiin 6–16-vuotiailla lapsilla, joilla oli kliininen GERD-diagnoosi. PK-parametrit 6–16-vuotiaiden lasten 20 mg:n tai 40 mg:n kerta-annoksen oraalisen PROTONIX 40 mg tablettien jälkeen vaihtelivat suuresti (%CV vaihtelee 40–80 %). Populaatio-PK-analyysistä arvioitu geometrinen keskiarvo AUC 40 mg:n PROTONIX 40 mg tabletin jälkeen lapsipotilailla oli noin 39 % ja 10 % korkeampi 6-11-vuotiailla ja 12-16-vuotiailla lapsilla aikuisiin verrattuna (taulukko 7). .
Mies- ja naispotilaat
Pantopratsolin AUC- ja Cmax-arvot kohoavat hieman naisilla miehiin verrattuna. Painon mukaan normalisoidut puhdistuma-arvot ovat kuitenkin samanlaiset naisilla ja miehillä.
Populaatiofarmakokineettinen analyysi osoittaa, että 1–16-vuotiailla lapsipotilailla sukupuolella ei ollut kliinisesti merkittäviä vaikutuksia pantopratsolin puhdistumaan.
Potilaat, joilla on munuaisten vajaatoiminta
Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla pantopratsolin farmakokineettiset parametrit olivat samanlaiset kuin terveillä koehenkilöillä.
Potilaat, joilla on maksan vajaatoiminta
Potilailla, joilla oli lievä tai vaikea maksan vajaatoiminta (Child-Pugh A-C kirroosi), pantopratsolin maksimipitoisuudet nousivat vain hieman (1,5-kertaisesti) terveisiin koehenkilöihin verrattuna. Vaikka seerumin puoliintumisaika nousi 7-9 tuntiin ja AUC-arvot nousivat 5-7-kertaisesti maksan vajaatoimintaa sairastavilla potilailla, nämä nousut eivät olleet suurempia kuin mitä havaittiin CYP2C19:n hitailla metaboloijilla, joiden osalta annoksen muuttaminen ei ole perusteltua. Nämä farmakokineettiset muutokset maksan vajaatoimintaa sairastavilla potilailla johtavat vähäiseen lääkkeen kertymiseen kerran vuorokaudessa toistuvan annostelun jälkeen. Yli 40 mg/vrk annoksia ei ole tutkittu maksan vajaatoimintapotilailla.
Huumeiden vuorovaikutustutkimukset
Muiden lääkkeiden vaikutus pantopratsoliin
Pantopratsoli metaboloituu pääasiassa CYP2C19:n ja vähäisessä määrin CYP 3A4:n, 2D6:n ja 2C9:n välityksellä. In vivo lääkeaineiden yhteisvaikutustutkimukset CYP2C19-substraattien (diatsepaami [myös CYP3A4-substraatti] ja fenytoiini [myös CYP3A4-induktori] ja klopidogreeli), nifedipiinin, midatsolaamin ja klaritromysiinin (CYP3A4-substraatit), metoprololin (CYP2D6-substraatti) kanssa. , naprokseenin ja piroksikaamin (CYP2C9-substraatit) ja teofylliinin (CYP1A2-substraatti) terveillä koehenkilöillä pantopratsolin farmakokinetiikka ei muuttunut merkitsevästi.
Pantopratsolin vaikutus muihin lääkkeisiin
Klopidogreeli
Klopidogreeli metaboloituu aktiiviseksi metaboliitiksi osittain CYP2C19:n välityksellä. Ristikkäisessä kliinisessä tutkimuksessa 66 terveelle koehenkilölle annettiin klopidogreelia (300 mg:n kyllästysannos ja sen jälkeen 75 mg päivässä) yksinään ja pantopratsolin kanssa (80 mg samaan aikaan klopidogreelin kanssa) 5 päivän ajan. Päivänä 5 klopidogreelin aktiivisen metaboliitin keskimääräinen AUC pieneni noin 14 % (geometrinen keskimääräinen suhde oli 86 % ja 90 % luottamusväli 79–93 %), kun pantopratsolia annettiin samanaikaisesti klopidogreelin kanssa verrattuna pelkkään klopidogreeliin. Myös farmakodynaamiset parametrit mitattiin ja osoitettiin, että muutos verihiutaleiden aggregaation estämisessä (5 μM ADP:n aiheuttama) korreloi klopidogreelin aktiiviselle metaboliitille altistumisen muutokseen. Tämän löydön kliininen merkitys ei ole selvä.
Mykofenolaattimofetiili (MMF)
Pantopratsolin antaminen 40 mg kahdesti vuorokaudessa 4 päivän ajan ja kerta-annos 1000 mg MMF:ää noin tunnin kuluttua viimeisestä pantopratsoliannoksesta 12 terveelle koehenkilölle ristikkäistutkimuksessa pienensi Cmax-arvoa 57 % ja 27 %. MPA:n AUC:ssa. Elinsiirtopotilaita, jotka saivat noin 2000 mg MMF:ää päivässä (n=12), verrattiin elinsiirtopotilaisiin, jotka saivat suunnilleen saman annoksen MMF:ää ja pantopratsolia 40 mg päivässä (n=21). MPA:n Cmax-arvo pieneni 78 % ja AUC 45 % potilailla, jotka saivat sekä pantopratsolia että MMF:ää [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Muut huumeet
In vivo -tutkimukset viittaavat myös siihen, että pantopratsoli ei vaikuta merkittävästi seuraavien lääkkeiden kinetiikkaan (sisapridi, teofylliini, diatsepaami [ja sen aktiivinen metaboliitti desmetyylidiatsepaami], fenytoiini, metoprololi, nifedipiini, karbamatsepiini, midatsolaami, klaritromysiini, diklofenaakki, napro ja suun kautta otettavat ehkäisyvalmisteet [levonorgestreeli/etinyyliestradioli]). Muissa in vivo -tutkimuksissa digoksiinilla, etanolilla, glyburidilla, antipyriinillä, kofeiinilla, metronidatsolilla ja amoksisilliinilla ei ollut kliinisesti merkittäviä yhteisvaikutuksia pantopratsolin kanssa.
Vaikka kliinisissä tutkimuksissa ei ole havaittu merkittäviä lääkkeiden välisiä yhteisvaikutuksia, merkittävien lääkkeiden yhteisvaikutusten mahdollisuutta, kun pantopratsolia käytetään useammin kuin kerran päivässä suurilla annoksilla, ei ole tutkittu hitailla metaboloijilla tai henkilöillä, joilla on maksan vajaatoiminta.
Antasidit
Yhteisvaikutuksia ei myöskään esiintynyt samanaikaisesti annettujen antasidien kanssa.
Farmakogenomiikka
CYP2C19:llä on tunnettu geneettinen polymorfismi, joka johtuu sen puutteesta joissakin alapopulaatioissa (esim. noin 3 % valkoihoisista ja afroamerikkalaisista ja 17-23 % aasialaisista on heikkoja metaboloijia). Vaikka näillä pantopratsolin hitaiden metaboloijien alaryhmillä eliminaation puoliintumisaika on 3,5–10 tuntia aikuisilla, niiden kumuloituminen on silti vähäistä (23 % tai vähemmän) kerran vuorokaudessa annettaessa. Aikuisten potilaiden, jotka metaboloivat CYP2C19:ää hitaasti, annosta ei tarvitse muuttaa.
Samoin kuin aikuisilla, lapsipotilailla, joilla on CYP2C19:n heikosti metaboloijagenotyyppi (CYP2C19 *2/*2), AUC-arvo kasvoi yli 6-kertaiseksi verrattuna lasten laajaan (CYP2C19 *1/*1) ja keskitasoon (CYP2C19 *1) /*x) metaboloijat. Heikoilla metaboloijilla oli noin 10 kertaa pienempi näennäinen oraalinen puhdistuma kuin nopeilla metaboloijilla.
Jos tiedetään, että lapsilla on heikko metaboloija, annoksen pienentämistä tulee harkita.
Kliiniset tutkimukset
PROTONIX 20 mg viivästetysti vapauttavia tabletteja käytettiin seuraavissa kliinisissä tutkimuksissa.
Eroosiva esofagiitti (EE), joka liittyy gastroesofageaaliseen refluksitautiin (GERD)
Aikuiset potilaat
Yhdysvalloissa suoritettiin monikeskus, kaksoissokkoutettu, lumekontrolloitu tutkimus PROTONIXin annoksella 10 mg, 20 mg tai 40 mg kerran vuorokaudessa 603 potilaalla, joilla oli refluksioireita ja endoskooppisesti diagnosoitu EE, jonka aste oli 2 tai korkeampi (Hetzel-Dent-asteikko). Tässä tutkimuksessa noin 25 %:lla osallistuneista potilaista oli 3. asteen vaikea EE ja 10 %:lla 4. Parantuneiden potilaiden prosenttiosuudet (protokollaa kohti, n = 541) tässä tutkimuksessa on esitetty taulukossa 8.
Tässä tutkimuksessa kaikissa PROTONIX-hoitoryhmissä oli merkittävästi suurempi paranemisaste kuin lumeryhmässä. Tämä oli totta riippumatta H. pylori -statuksesta 40 mg ja 20 mg PROTONIX 40 mg -hoitoryhmissä. PROTONIX 20 mg:n 40 mg:n annos johti merkittävästi nopeampaan paranemisnopeuteen kuin joko 20 mg:n tai 10 mg:n annoksella.
Huomattavasti suurempi osa PROTONIX 40 mg:aa saaneista potilaista helpotti täydellisesti päivä- ja yönärästystä ja regurgitaatiota ensimmäisestä hoitopäivästä lähtien lumelääkkeeseen verrattuna. PROTONIXia saaneet potilaat söivät huomattavasti vähemmän antasiditabletteja päivässä kuin lumelääkettä saaneet potilaat.
PROTONIXia 40 mg ja 20 mg kerran vuorokaudessa verrattiin myös nisatidiiniin 150 mg kahdesti vuorokaudessa yhdysvaltalaisessa monikeskustutkimuksessa, johon osallistui 243 potilasta, joilla oli refluksioireita ja endoskooppisesti diagnosoitu EE, aste 2 tai korkeampi. Parantuneiden potilaiden prosenttiosuudet (protokollaa kohti, n = 212) on esitetty taulukossa 9.
Kerran päivässä annettu hoito PROTONIX 40 mg:lla tai 20 mg:lla johti merkittävästi nopeampaan paranemisnopeuteen sekä 4 että 8 viikon kohdalla verrattuna kahdesti päivässä annettuun hoitoon 150 mg:lla nisatidiinia. 40 mg:n hoitoryhmässä saavutettiin merkittävästi suurempi paranemisnopeus verrattuna nisatidiiniin riippumatta H. pylori -statuksesta.
Merkittävästi suurempi osa PROTONIX-hoitoryhmien potilaista koki täydellisen helpotuksen yön närästykseen ja regurgitaatioon ensimmäisestä päivästä alkaen ja päiväsaikaan toisena päivänä verrattuna potilaisiin, jotka ottivat nitsatidiinia 150 mg kahdesti vuorokaudessa. PROTONIXia saaneet potilaat söivät huomattavasti vähemmän antasiditabletteja päivässä kuin nisatidiinia saaneet.
Pediatriset potilaat 5-16-vuotiaat
PROTONIXin teho GERD:hen liittyvän EE:n hoidossa 5–16-vuotiailla lapsipotilailla on ekstrapoloitu riittävistä ja hyvin suoritetuista aikuisilla tehdyistä kokeista, koska patofysiologian uskotaan olevan sama. Neljää lapsipotilasta, joilla oli endoskooppisesti diagnosoitu EE, tutkittiin monikeskustutkimuksissa, satunnaistetuissa kaksoissokkoutetuissa rinnakkaishoidon tutkimuksissa. Lapsia, joilla oli endoskooppisesti diagnosoitu EE (määritelty endoskooppiseksi Hetzel-Dent-pisteeksi ≥2), hoidettiin kerran päivässä 8 viikon ajan yhdellä kahdesta PROTONIX-annostasosta (20 mg tai 40 mg). Kaikki 4 EE-potilasta paranivat (Hetzel-Dent-pisteet 0 tai 1) 8 viikon kohdalla.
Erosiivisen esofagiitin paranemisen pitkäaikainen ylläpito
Kaksi riippumatonta, monikeskusta, satunnaistettua, kaksoissokkoutettua, vertailulääkekontrolloitua identtistä tutkimusta suoritettiin aikuisilla GERD-potilailla, joilla oli endoskooppisesti varmistettu parantunut EE PROTONIXin tehokkuuden osoittamiseksi paranemisen pitkäaikaisessa ylläpidossa. Kahdessa yhdysvaltalaisessa tutkimuksessa otettiin mukaan 386 ja 404 potilasta, jotka saivat joko 10 mg, 20 mg tai 40 mg PROTONIX 40 mg viivästyneen vapautumisen tabletteja kerran päivässä tai 150 mg ranitidiinia kahdesti päivässä. Kuten taulukosta 10 osoitetaan, PROTONIX 40 mg ja 20 mg olivat merkittävästi parempia kuin ranitidiini jokaisessa vaiheessa paranemisen ylläpitämisen suhteen. Lisäksi PROTONIX 40 mg oli parempi kuin kaikki muut tutkitut hoidot.
PROTONIX 40 mg oli parempi kuin ranitidiini vähentäessään päivä- ja yöperäisten närästysjaksojen määrää ensimmäisestä hoitokuukaudesta kahdenteentoista kuukauteen. PROTONIX 20 mg, annettuna kerran vuorokaudessa, vähensi myös tehokkaasti päivä- ja yöoireita yhdessä tutkimuksessa, kuten taulukossa 11 esitetään.
Patologiset liikaeritystilat mukaan lukien Zollinger-Ellisonin oireyhtymä
Monikeskustutkimuksessa, avoimessa tutkimuksessa, johon osallistui 35 potilasta, joilla oli patologisia liikaerityssairauksia, kuten Zollinger-Ellisonin oireyhtymä, joilla oli useita endokriinisiä tyypin I neoplasiaa tai ei, PROTONIX kontrolloi onnistuneesti mahahapon eritystä. Annokset, jotka vaihtelivat 80 mg:sta 240 mg:aan vuorokaudessa, pitivät mahahapon erityksen alle 10 mekvivalenttitunnissa potilailla, joilla ei ollut aikaisempaa happoa vähentävää leikkausta, ja alle 5 mekvivalenttia/h potilailla, joilla oli aikaisempi happoa vähentävä leikkaus.
Annokset titrattiin alun perin potilaan yksilöllisten tarpeiden mukaan, ja joillakin potilailla niitä säädettiin kliinisen vasteen perusteella ajan myötä [ks. ANNOSTELU JA HALLINNOINTI ]. PROTONIX 40 mg oli hyvin siedetty näillä annostasoilla pitkiä aikoja (yli 2 vuotta joillakin potilailla).
POTILASTIEDOT
PROTONIX (pro-TAH-nix) (pantopratsolinatrium) viivästetysti vapautuvat tabletit ja PROTONIX (pro-TAH-nix) (pantopratsolinatrium) viivästetysti vapauttavaan oraalisuspensioon
Mikä on tärkein tieto, joka minun pitäisi tietää PROTONIXista?
Sinun tulee ottaa PROTONIX 20 mg juuri niin kuin on määrätty, pienimmällä mahdollisella annoksella ja lyhyimmän tarvittavan ajan.
PROTONIX voi auttaa happoon liittyvissä oireissasi, mutta sinulla voi silti olla vakavia vatsavaivoja. Keskustele lääkärisi kanssa.
PROTONIX voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Eräänlainen munuaisongelma (akuutti tubulointerstitiaalinen nefriitti). Joillekin ihmisille, jotka käyttävät protonipumpun estäjiä (PPI) sisältäviä lääkkeitä, mukaan lukien PROTONIX 40 mg, voi kehittyä munuaisongelma, jota kutsutaan akuuttiksi tubulointerstitiaaliseksi nefriittiksi ja joka voi ilmaantua milloin tahansa PROTONIX-hoidon aikana. Soita lääkärillesi välittömästi, jos virtsaamasi määrä on vähentynyt tai jos sinulla on verta virtsassasi.
- Ripuli, jonka aiheuttaa suolistotulehdus (Clostridium difficile). Soita lääkärillesi heti, jos sinulla on vetisiä ulosteita tai vatsakipua, joka ei mene pois. Sinulla voi olla kuumetta tai ei.
- Luun murtumat (lonkka-, ranteen- tai selkärangan murtumat). Lonkan, ranteen tai selkärangan luumurtumia voi tapahtua ihmisillä, jotka ottavat useita päivittäisiä annoksia PPI-lääkkeitä ja pitkän ajan (vuoden tai pidempään). Kerro lääkärillesi, jos sinulla on luunmurtuma, erityisesti lonkassa, ranteessa tai selkärangassa.
- Tietyntyyppiset lupus erythematosus. Lupus erythematosus on autoimmuunisairaus (elimistön immuunisolut hyökkäävät kehon muihin soluihin tai elimiin). Joillekin ihmisille, jotka käyttävät PPI-lääkkeitä, mukaan lukien PROTONIX 40 mg, voi kehittyä tietyntyyppinen lupus erythematosus tai heillä jo esiintyvä lupus pahenee. Soita heti lääkärillesi, jos sinulla on uutta tai pahenevaa nivelkipua tai ihottumaa poskissasi tai käsivarsissasi, joka pahenee auringossa.
Keskustele lääkärisi kanssa näiden vakavien sivuvaikutusten riskistä.
PROTONIXilla voi olla muita vakavia sivuvaikutuksia. Katso "Mitä ovat PROTONIXin mahdolliset sivuvaikutukset?"
Mikä on PROTONIX 20mg?
Reseptilääke, jota kutsutaan protonipumpun estäjäksi (PPI), jota käytetään vähentämään hapon määrää mahassasi.
aikuisilla, PROTONIXia käytetään:
- enintään 8 viikkoa happoon liittyvien ruokatorven limakalvovaurioiden (kutsutaan erosiiviseksi esofagiittiksi tai EE) paranemiseksi ja oireiden lievittämiseksi. Lääkärisi voi määrätä vielä 8 viikon PROTONIX 20 mg -valmistetta potilaille, joiden EE ei parane.
- ylläpitää EE:n paranemista ja auttaa estämään GERD:n aiheuttamien närästysoireiden uusiutumista. Ei tiedetä, onko PROTONIX 40mg turvallinen ja tehokas, kun sitä käytetään yli 12 kuukautta tähän tarkoitukseen.
- sairauksien pitkäaikaishoito, jossa mahasi tuottaa liikaa happoa. Tämä sisältää harvinaisen Zollinger-Ellisonin oireyhtymän.
5-vuotiailla ja sitä vanhemmilla lapsilla PROTONIXia käytetään:
- jopa 8 viikkoa EE:n paranemiseen ja oireiden lievitykseen. Ei tiedetä, onko PROTONIX 20 mg turvallista, jos sitä käytetään yli 8 viikkoa lapsille.
PROTONIX 20 mg ei ole tarkoitettu alle 5-vuotiaille lapsille. Ei tiedetä, onko PROTONIX 40 mg turvallinen ja tehokas lapsille muuhun kuin EE-hoitoon.
Älä ota PROTONIX 20 mg:aa, jos olet:
- allerginen pantopratsolinatriumille, jollekin muulle PPI-lääkkeelle tai jollekin PROTONIXin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo ainesosista.
- rilpiviriiniä (EDURANT, COMPLERA, ODEFSEY, JULUCA) sisältävän lääkkeen ottaminen, jota käytetään HIV-1:n (ihmisen immuunikatovirus) hoitoon.
Ennen kuin otat PROTONIXin, kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on alhainen magnesiumpitoisuus veressäsi.
- olet raskaana tai suunnittelet raskautta. PROTONIX 40 mg voi vahingoittaa sikiötäsi. Kerro lääkärillesi, jos tulet raskaaksi tai epäilet olevasi raskaana PROTONIX-hoidon aikana.
- imetät tai aiot imettää. PROTONIX voi erittyä äidinmaitoon. Keskustele lääkärisi kanssa parhaasta tavasta ruokkia vauvasi, jos käytät PROTONIXia.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro erityisesti lääkärillesi, jos otat metotreksaatti (Otrexup, Rasuvo, Trexall, XATMEP), digoksiini (LANOXIN) tai vesipilleri (diureetti).
Kuinka minun pitäisi ottaa PROTONIX 20 mg?
- Ota PROTONIX 40 mg juuri sen verran kuin lääkärisi on määrännyt.
PROTONIX viivästetysti vapauttavat tabletit (PROTONIX 20 mg tabletit):
-
- Älä halkaise, pureskele tai murskaa PROTONIX 40 mg tabletteja.
- Niele PROTONIX 20 mg tabletit kokonaisina, ruoan kanssa tai ilman.
- Kerro lääkärillesi, jos et pysty nielemään PROTONIX 20 mg -tablettiasi.
- Voit käyttää antasideja käyttäessäsi PROTONIX 40 mg tabletteja.
PROTONIX 40 mg viivästetysti vapauttavaan oraalisuspensioon (PROTONIX oraalisuspensioon):
-
- Älä halkaise, pureskele tai murskaa PROTONIX 20 mg oraalisuspensiota varten.
- Ota PROTONIX 40 mg oraalisuspensiota noin 30 minuuttia ennen ateriaa.
- PROTONIX oraalisuspensiota varten tulee antaa vain suun kautta omenamehuun tai omenasoseeseen sekoitettuna tai nenämahaletkun (NG) tai gastrostomialetkun kautta omenamehuun sekoitettuna. Älä sekoita PROTONIXia oraalisuspensiota varten muihin nesteisiin kuin omenamehuun tai muihin ruokiin kuin omenasoseeseen.
- Älä jaa PROTONIX 20 mg oraalisuspensiota varten olevaa pakkausta pienemmän annoksen valmistamiseksi.
- Katso "Käyttöohjeet" Tämän lääkitysoppaan lopussa on ohjeet PROTONIX 40mg oraalisuspension sekoittamisesta ja ottamisesta suun kautta omenasoseeseen tai omenamehuun tai kuinka suspensio sekoitetaan ja annetaan omenamehuun sekoitettuun NG-putken tai gastrostomiaputken kautta.
- Jos unohdat ottaa PROTONIX-annoksen, ota se mahdollisimman pian. Jos on melkein aika ottaa seuraava annos, älä ota unohtunutta annosta. Ota seuraava annos normaaliin aikaan. Älä ota 2 annosta samanaikaisesti.
- Jos otat liikaa PROTONIXia, soita heti lääkärillesi tai myrkytystietokeskukseen numeroon 1-800-222-1222 tai mene lähimpään ensiapuun.
Mitkä ovat PROTONIX 40mg:n mahdolliset sivuvaikutukset?
PROTONIX 20mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää PROTONIXista?"
- Alhainen B-12-vitamiinitaso kehossasi voi tapahtua ihmisillä, jotka ovat käyttäneet PROTONIX 40 mg pitkään (yli 3 vuotta). Kerro lääkärillesi, jos sinulla on alhaisten B-12-vitamiinipitoisuuksien oireita, kuten hengenahdistusta, huimausta, epäsäännöllistä sydämenlyöntiä, lihasheikkoutta, kalpeaa ihoa, väsymystä, mielialan muutoksia ja pistelyä tai tunnottomuutta käsivarsissa ja jaloissa.
- Alhaiset magnesiumtasot kehossasi voi tapahtua ihmisillä, jotka ovat käyttäneet PROTONIXia vähintään 3 kuukautta. Kerro lääkärillesi, jos sinulla on alhaisten magnesiumpitoisuuksien oireita, kuten kouristuksia, huimausta, epäsäännöllistä sydämenlyöntiä, tärinää, lihassärkyä tai -heikkoutta sekä käsien, jalkojen tai äänen kouristuksia.
- Vatsakasvut (pohjarauhasten polyypit). Ihmisillä, jotka käyttävät PPI-lääkkeitä pitkään, on lisääntynyt riski saada tietyntyyppiset mahalaukun kasvaimet, joita kutsutaan fundic rauhasten polyypeiksi, etenkin kun PPI-lääkkeitä on käytetty yli vuoden.
PROTONIX 40 mg:n yleisimmät sivuvaikutukset aikuisilla ovat: päänsärky, ripuli, pahoinvointi, vatsan alueen (vatsakipu), oksentelu, kaasut, huimaus ja nivelkipu.
Yleisimmät PROTONIX 40mg:n sivuvaikutukset lapsilla ovat: ylempien hengitysteiden infektio, päänsärky, kuume, ripuli, oksentelu, ihottuma ja vatsakipu. Nämä eivät ole kaikkia PROTONIXin mahdollisia sivuvaikutuksia. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Miten PROTONIX 40mg pitäisi säilyttää?
Säilytä PROTONIX 20 mg huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
Pidä PROTONIX ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa PROTONIXin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä PROTONIXia sairauteen, johon sitä ei ole määrätty. Älä anna PROTONIX 20 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä lääkäriltäsi tai apteekista tietoja PROTONIX 20 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitkä ovat PROTONIXin ainesosat?
Aktiivinen ainesosa: pantopratsolinatriumseskvihydraatti
PROTONIX-hidastetusti vapauttavien tablettien inaktiiviset ainesosat: kalsiumstearaatti, krospovidoni, hypromelloosi, rautaoksidi, mannitoli, metakryylihappokopolymeeri, polysorbaatti 80, povidoni, propyleeniglykoli, natriumkarbonaatti, natriumlauryylisulfaatti, titaanidioksidi ja trietyylisitraatti.
PROTONIX 40 mg:n viivästetysti vapauttavan oraalisuspension inaktiiviset aineosat: krospovidoni, hypromelloosi, metakryylihappokopolymeeri, mikrokiteinen selluloosa, polysorbaatti 80, povidoni, natriumkarbonaatti, natriumlauryylisulfaatti, talkki, titaanidioksidi, trietyylisitraatti ja keltainen rautaoksidi.
Käyttöohjeet
PROTONIX (pro-TAH-nix) (pantopratsolinatrium) viivästetysti vapauttavaan oraalisuspensioon
PROTONIX 40 mg viivästetysti vapautuvaan oraalisuspensio (PROTONIX 40 mg oraalisuspensiota varten):
Tärkeää tietoa:
- Älä halkaise, pureskele tai murskaa PROTONIXia oraalisuspensiota varten.
- Ota PROTONIX oraalisuspensiota varten noin 30 minuuttia ennen ateriaa.
- PROTONIX oraalisuspensiota varten:
- pitäisi ottaa vain omenasoseen tai omenamehun kanssa.
- pitäisi ei saa sekoittaa veteen tai muihin nesteisiin tai muihin elintarvikkeisiin.
- pakkausta ei pidä jakaa pienemmän annoksen saamiseksi.
PROTONIX 20 mg oraalisuspension ottaminen omenasoseen kanssa:
PROTONIX 40 mg oraalisuspension ottaminen omenamehun kanssa:
PROTONIX 40 mg oraalisuspension antaminen nenämahaletkun (NG) tai gastrostomialetkun kautta:
- PROTONIX oraalisuspensiota varten voidaan antaa NG-letkun tai gastrostomialetkun kautta koko 16 ranskalainen tai suurempi. Älä anna PROTONIX 20 mg oraalisuspensiota NG-letkun tai gastrostomialetkun kautta, joka on pienempi kuin koko 16 French.
- Sekoita PROTONIX 20 mg oraalisuspensiota varten vain omenamehussa kun annetaan NG-letkun tai gastrostomialetkun kautta.
Miten PROTONIX 20mg pitäisi säilyttää?
Säilytä PROTONIX 20 mg huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
Pidä PROTONIX 40 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Tämän lääkitysoppaan ja käyttöohjeet ovat hyväksyneet Yhdysvaltain elintarvike- ja lääkevirasto.
