Prevacid 15mg, 30mg Lansoprazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Prevacid on ja miten sitä käytetään?
Prevacid 15mg on reseptilääke, jota käytetään maha- ja suolihaavojen oireiden hoitoon ja mahassa tuotetun hapon määrän vähentämiseen. Prevacid 15 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Prevacid 15mg on protonipumpun estäjä.
Mitkä ovat Prevacid 30mg:n mahdolliset sivuvaikutukset?
Prevacid 30 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- verta sisältävä ripuli,
- kohtaukset (kouristukset,
- virtsaamisvaikeudet,
- verta virtsassasi,
- turvotus,
- nopea painonnousu,
- huimaus,
- nopea tai epäsäännöllinen syke,
- vapina,
- nykivät lihasliikkeet,
- hermostunut olo,
- lihaskrampit tai kouristukset käsissäsi tai jaloissasi,
- yskiminen,
- tunne, että tukehtuisit,
- nivelkipuja ja
- ihottuma poskissa tai käsivarsissa, joka pahenee auringonvalossa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Prevacid 15mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- vatsakipu,
- ripuli,
- ummetus ja
- päänsärky
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Prevacidin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
PREVACID (lansopratsoli) viivästetysti vapautuvat suun kautta hajoavat tabletit
KUVAUS
PREVACID 30 mg viivästetysti vapauttavien kapseleiden ja PREVACID 15 mg SoluTab viivästyneesti vapauttavien suun kautta hajoavien tablettien vaikuttava aine on lansopratsoli, substituoitu bentsimidatsoli, 2-[[[3-metyyli-4-(2,2,2-trifluorietoksi)] metyyli]sulfinyyli]bentsimidatsoli, yhdiste, joka estää mahahapon eritystä. Sen empiirinen kaava on C16H14F3N3O2S, jonka molekyylipaino on 369,37. Lansopratsolilla on seuraava rakenne:
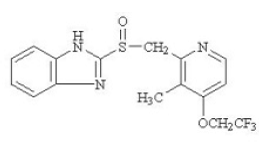
Lansopratsoli on valkoinen tai ruskeanvalkoinen hajuton kiteinen jauhe, joka sulaa hajoamalla noin 166 °C:ssa. Lansopratsoli liukenee vapaasti dimetyyliformamidiin; liukenee metanoliin; niukkaliukoinen etanoliin; liukenee heikosti etyyliasetaattiin, dikloorimetaaniin ja asetonitriiliin; liukenee hyvin vähän eetteriin ja käytännöllisesti katsoen liukenematon heksaaniin ja veteen.
Lansopratsoli on stabiili valolle altistettuna enintään kaksi kuukautta. Yhdisteen hajoamisnopeus vesiliuoksessa kasvaa pH:n laskiessa. Lääkeaineen hajoamisen puoliintumisaika vesiliuoksessa 25 °C:ssa on noin 0,5 tuntia pH:ssa 5,0 ja noin 18 tuntia pH:ssa 7,0.
PREVACID toimitetaan viivästetysti vapauttavissa kapseleissa ja PREVACID 15 mg SoluTab toimitetaan viivästetysti vapauttavina suun kautta hajoavina tabletteina (SoluTab) oraalista antoa varten.
PREVACIDia on saatavana kahtena annosvahvuutena: 15 ja 30 mg lansopratsolia kapselia kohden. Jokainen viivästetysti vapautuva kapseli sisältää enteropäällysteisiä rakeita, jotka koostuvat 15 tai 30 mg:sta lansopratsolia (vaikuttava aineosa) ja seuraavista inaktiivisista ainesosista: sokeripallo, sakkaroosi, metakryylihappokopolymeeri, vähän substituoitu hydroksipropyyliselluloosa, tärkkelys, magnesiumkarbonaatti, talkki, polyeteeni glykoli, titaanidioksidi, polysorbaatti 80, hydroksipropyyliselluloosa, kolloidinen piidioksidi, D&C Red No. 28, FD&C Blue No. 1, FD&C Green No. 31 ja FD&C Red No. 40.
PREVACID 30mg SoluTab on saatavana kahdessa annosvahvuudessa: 15 ja 30 mg lansopratsolia per tabletti. Jokainen viivästetysti vapautuva suun kautta hajoava tabletti sisältää enteropäällysteisiä mikrorakeita, jotka koostuvat 15 tai 30 mg:sta lansopratsolia (vaikuttava aine) ja seuraavista inaktiivisista ainesosista: mannitoli, metakryylihappo, hydroksipropyyliselluloosa, laktoosimonohydraatti-mikrokiteinen selluloosapallo, trietyylikropovidoni,,, polyakrylaatti, magnesiumkarbonaatti, aspartaami2, glyseryylimonostearaatti, hypromelloosi, magnesiumstearaatti, sitruunahappo, titaanidioksidi, talkki, keinotekoinen mansikka-aromi, polyetyleeniglykoli, polysorbaatti 80 ja rautaoksidi.
Vain 1 PREVACID 15 mg kapseli. 2Fenyyliketonuurit: PREVACID SoluTab Sisältää fenyylialaniinia 2,5 mg 15 mg:n tabletissa ja 5,1 mg 30 mg:n tabletissa.
INDIKAATIOT
Aktiivisen pohjukaissuolihaavan hoito
PREVACID ja PREVACID SoluTab on tarkoitettu aikuisille lyhytaikaiseen hoitoon (neljä viikkoa) aktiivisen pohjukaissuolihaavan paranemiseen ja oireiden lievittämiseen (ks. Kliiniset tutkimukset ].
H. pylorin hävittäminen pohjukaissuolihaavan uusiutumisen riskin vähentämiseksi
Kolmoishoito: PREVACID tai PREVACID SoluTab/amoksisilliini/klaritromysiini
PREVACID tai PREVACID 30 mg SoluTab yhdistelmänä amoksisilliinin ja klaritromysiinin kanssa kolmoishoitona on tarkoitettu aikuisille H. pylori -infektion ja pohjukaissuolihaavan hoitoon (aktiivinen tai yhden vuoden pohjukaissuolihaava) H. pylorin hävittämiseksi. H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä [ks. Kliiniset tutkimukset ].
Katso amoksisilliinin ja klaritromysiinin täydelliset reseptitiedot.
Kaksoishoito: PREVACID tai PREVACID SoluTab/amoksisilliini
PREVACID tai PREVACID 15 mg SoluTab yhdistelmänä amoksisilliinin kanssa kaksoishoitona on tarkoitettu aikuisille sellaisten potilaiden hoitoon, joilla on H. pylori -infektio ja pohjukaissuolihaava (aktiivinen tai yhden vuoden pohjukaissuolihaava), jotka ovat joko allergisia tai intolerantteja klaritromysiinille tai joilla tiedetään tai epäillään olevan resistenssiä klaritromysiinille (katso klaritromysiinin ohjeet, Mikrobiologia). H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä [ks. Kliiniset tutkimukset ].
Katso amoksisilliinin täydelliset reseptitiedot.
Parantuneiden pohjukaissuolihaavojen ylläpito
PREVACID ja PREVACID SoluTab on tarkoitettu aikuisille pohjukaissuolihaavojen paranemisen ylläpitämiseen. Kontrolloidut tutkimukset eivät kestä yli 12 kuukautta [katso Kliiniset tutkimukset ].
Aktiivisen hyvänlaatuisen mahahaavan hoito
PREVACID ja PREVACID 30 mg SoluTab on tarkoitettu aikuisille lyhytaikaiseen hoitoon (enintään kahdeksan viikkoa) aktiivisen hyvänlaatuisen mahahaavan paranemiseen ja oireiden lievitykseen [ks. Kliiniset tutkimukset ].
NSAID-lääkkeisiin liittyvän mahahaavan paraneminen
PREVACID 30 mg ja PREVACID SoluTab on tarkoitettu aikuisille tulehduskipulääkkeisiin liittyvän mahahaavan hoitoon potilailla, jotka jatkavat tulehduskipulääkkeiden käyttöä. Kontrolloidut tutkimukset eivät kestäneet kahdeksaa viikkoa kauempaa [katso Kliiniset tutkimukset ].
NSAID-lääkkeisiin liittyvän mahahaavan riskin vähentäminen
PREVACID 15 mg ja PREVACID SoluTab on tarkoitettu aikuisille vähentämään tulehduskipulääkkeisiin liittyvien mahahaavojen riskiä potilailla, joilla on dokumentoitu mahahaava ja jotka tarvitsevat NSAID:n käyttöä. Kontrolloidut tutkimukset eivät kestäneet yli 12 viikkoa [katso Kliiniset tutkimukset ].
Oireisen gastroesofageaalisen refluksitaudin (GERD) hoito
PREVACID 15mg ja PREVACID 30mg SoluTab on tarkoitettu lyhytaikaiseen hoitoon närästyksen hoitoon aikuisille ja 12–17-vuotiaille lapsipotilaille (enintään 8 viikkoa) ja 1–11-vuotiaille (enintään 12 viikkoa) lapsipotilaille. ja muut GERD:hen liittyvät oireet [katso Kliiniset tutkimukset ].
Erosiivisen esofagiitin (EE) hoito
PREVACID 15mg ja PREVACID 30mg SoluTab on tarkoitettu lyhytaikaiseen hoitoon aikuisille ja 12–17-vuotiaille lapsipotilaille (enintään 8 viikkoa) ja 1–11-vuotiaille (enintään 12 viikkoa) lapsipotilaille paranemisen ja oireiden lievittämiseen. kaikista EE-luokista.
Aikuisille, jotka eivät parane PREVACID 30 mg:lla tai PREVACID 15 mg SoluTabilla kahdeksaan viikkoon (5–10 %), voi olla hyödyllistä antaa vielä kahdeksan viikkoa hoitoa. Jos erosiivinen esofagiitti uusiutuu, voidaan harkita kahdeksan viikon lisähoitoa PREVACID 30 mg tai PREVACID SoluTab -valmisteella [ks. Kliiniset tutkimukset ].
EE:n paranemisen ylläpito
PREVACID ja PREVACID SoluTab on tarkoitettu aikuisille EE:n paranemisen ylläpitämiseen. Kontrolloidut tutkimukset eivät kestäneet yli 12 kuukautta [katso Kliiniset tutkimukset ].
Patologiset liikaeritystilat mukaan lukien Zollinger-Ellisonin oireyhtymä (ZES)
PREVACID 15mg ja PREVACID SoluTab on tarkoitettu aikuisille patologisten liikaeritystilojen, mukaan lukien Zollinger-Ellisonin oireyhtymän, pitkäaikaiseen hoitoon (ks. Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Suositeltu aikuisten annostus käyttöaiheen mukaan
Suositeltu lasten annostus käyttöaiheen mukaan
Lapsipotilaat 1–11-vuotiaat
Kliinisissä tutkimuksissa PREVACIDia ei annettu yli 12 viikon ajan 1–11-vuotiaille lapsille. Ei tiedetä, onko PREVACID turvallinen ja tehokas, jos sitä käytetään suositeltua kestoa pidempään. Älä ylitä suositeltua annosta ja käytön kestoa lapsipotilailla alla kuvatulla tavalla [katso Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Suositeltu annos on 15 mg suun kautta päivässä potilaille, joilla on vaikea maksan vajaatoiminta (Child-Pugh C) [ks. Käyttö tietyissä populaatioissa ].
Tärkeitä hallinnollisia tietoja
- Ota PREVACID tai PREVACID 30 mg SoluTab ennen ateriaa.
- Älä murskaa tai pureskele PREVACID 15 mg kapselia tai PREVACID 30 mg SoluTabia.
- Ota PREVACID tai PREVACID 30 mg SoluTab vähintään 30 minuuttia ennen sukralfaattia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Antasideja voidaan käyttää samanaikaisesti PREVACIDin tai PREVACID SoluTabin kanssa.
- Unohtuneet annokset: Jos annos jää väliin, ota se mahdollisimman pian. Jos seuraava annos on kuitenkin tulossa, älä ota unohtunutta annosta, vaan ota seuraava annos ajoissa. Älä ota kahta annosta kerralla korvataksesi unohtamasi annoksen.
PREVACID kapselit
- Niele kokonaisena; älä pureskele.
- Potilaille, joilla on vaikeuksia niellä kapseleita, PREVACID-kapselit voidaan avata ja antaa suun kautta tai nenämahaletkun kautta alla mainittujen pehmeiden ruokien tai nesteiden seassa.
- PREVACIDin antamista muiden kuin alla mainittujen ruokien tai nesteiden kanssa ei ole tutkittu kliinisesti, joten sitä ei suositella.
Annostelu pehmeissä ruoissa (omenasose, ENSURE vanukas, raejuusto, jogurtti tai siivilöidyt päärynät):
Annostelu nesteissä (omenamehu, appelsiinimehu tai tomaattimehu):
Anto omenamehun kanssa nenämahaletkun kautta (≥16 ranskaa)
PREVACID 15 mg SoluTab
- Älä riko tai leikkaa.
- Aseta tabletti kielen päälle, anna sen hajota, veden kanssa tai ilman, kunnes mikrorakeet voidaan niellä. Älä pureskele mikrorakeita.
- Tabletti hajoaa tyypillisesti alle minuutissa.
- Vaihtoehtoisesti lapsille tai muille potilaille, joilla on vaikeuksia niellä tabletteja, PREVACID SoluTab voidaan antaa veden kanssa suuruiskun tai NG-letkun kautta seuraavasti:
Annostelu veden kanssa suuruiskussa
Annostelu vedellä NG-putken kautta (≥8 ranskaa)
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
PREVACID 15 mg viivästetysti vapauttavat kapselit
- 15 mg vahvuus on läpinäkymätön, vaaleanpunainen ja vihreä kapseli, johon on painettu ”TAP” ja ”PREVACID 15”.
- 30 mg vahvuus on läpinäkymätön, vaaleanpunainen ja musta kapseli, johon on painettu ”TAP” ja ”PREVACID 30”.
PREVACID 30 mg SoluTab viivästetysti vapauttavat suun kautta hajottuvat tabletit
- 15 mg:n vahvuus on valkoinen tai kellertävän valkoinen, päällystämätön pyöreä tabletti, joka sisältää oransseja tai tummanruskeita pilkkuja, joiden toiselle puolelle on kaiverrettu "15".
- 30 mg:n vahvuus on valkoinen tai kellertävän valkoinen, päällystämätön pyöreä tabletti, joka sisältää oransseja tai tummanruskeita pilkkuja, joiden toiselle puolelle on kaiverrettu "30".
Varastointi ja käsittely
PREVACID viivästetysti vapauttavat kapselit , 15 mg, ovat läpinäkymättömiä, vaaleanpunaisia ja vihreitä, ja kapseleihin on painettu "TAP" ja "PREVACID 15". 30 mg:n viivästetysti vapauttavat kapselit ovat läpinäkymättömiä, vaaleanpunaisia ja mustia, ja kapseleihin on painettu "TAP" ja "PREVACID 30". Ne ovat saatavilla seuraavasti:
PREVACID 30 mg SoluTab viivästetysti vapautuvat suun kautta hajoavat tabletit , 15 mg, ovat valkoisia tai kellertävän valkoisia, pyöreitä päällystämättömiä tabletteja, joissa on oransseja tai tummanruskeita pilkkuja ja joissa tabletin toiselle puolelle on kaiverrettu "15". 30 mg:n tabletit ovat valkoisia tai kellertävän valkoisia, pyöreitä päällystämättömiä tabletteja, joissa on oransseja tai tummanruskeita pilkkuja ja joissa tabletin toiselle puolelle on kaiverrettu "30". Tabletit ovat saatavilla seuraavasti:
Säilytä 25°C (77°F); retket sallittuja 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ].
Jakelija: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Tarkistettu: kesäkuu 2018
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Akuutti tubulointerstitiaalinen nefriitti [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Luun murtuma [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihohaittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Ihon ja systeeminen lupus erythematosus [katso VAROITUKSET JA VAROTOIMET ]
- Syanokobalamiinin (B12-vitamiinin) puutos [katso VAROITUKSET JA VAROTOIMET ]
- Hypomagnesemia ja mineraaliaineenvaihdunta [katso VAROITUKSET JA VAROTOIMET ]
- Pohjarauhasten polyypit [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Maailmanlaajuisesti yli 10 000 potilasta on hoidettu PREVACID 30 mg:lla faasin 2 tai vaiheen 3 kliinisissä tutkimuksissa, joissa on käytetty erilaisia annoksia ja hoidon kestoja. Yleensä PREVACID 30 mg -hoito on ollut hyvin siedetty sekä lyhyt- että pitkäaikaisissa tutkimuksissa.
Hoitava lääkäri ilmoitti seuraavien haittavaikutusten olevan mahdollinen tai todennäköinen yhteys lääkkeeseen vähintään 1 %:lla PREVACID-hoitoa saaneista potilaista, ja niitä esiintyi useammin PREVACID-hoitoa saaneilla potilailla kuin lumelääkettä saaneilla potilailla taulukossa 1.
Päänsärkyä havaittiin myös yli 1 %:lla, mutta se oli yleisempää lumelääkeryhmässä. Ripulin ilmaantuvuus oli samanlainen lumelääkettä saaneiden potilaiden ja 15 ja 30 mg PREVACIDia saaneiden potilaiden välillä, mutta suurempi potilailla, jotka saivat 60 mg PREVACIDia (2,9, 1,4, 4,2 ja 7,4 %).
Yleisimmin raportoitu mahdollisesti tai todennäköisesti hoitoon liittyvä haittatapahtuma ylläpitohoidon aikana oli ripuli.
PREVACIDin riskinvähennystutkimuksessa tulehduskipulääkkeisiin liittyvien mahahaavojen hoitoon, ripulin esiintyvyys potilailla, joita hoidettiin PREVACID 30 mg:lla, misoprostolia ja lumelääkettä, oli 5 %, 22 % ja lumelääkettä 3 %.
Toinen samaa käyttöaihetta koskeva tutkimus, jossa potilaat käyttivät joko COX-2-estäjää tai lansopratsolia ja naprokseenia, osoitti, että turvallisuusprofiili oli samanlainen kuin aikaisemmassa tutkimuksessa. Muita tämän tutkimuksen reaktioita, joita ei aiemmin havaittu muissa PREVACID 30 mg:n kliinisissä tutkimuksissa, olivat ruhje, pohjukaissuolentulehdus, epämukava tunne ylävatsassa, ruokatorven häiriö, väsymys, nälkä, hiataltyrä, käheys, mahan tyhjenemisen heikkeneminen, metaplasia ja munuaisten vajaatoiminta.
Muita haittavaikutuksia, joita esiintyi alle 1 %:lla potilaista tai tutkimushenkilöistä, jotka saivat PREVACID 15 mg kotimaisissa tutkimuksissa, on esitetty alla:
Keho kokonaisuutena - suurentunut vatsa, allerginen reaktio, voimattomuus, selkäkipu, kandidiaasi, karsinooma, rintakipu (ei toisin täsmennetty), vilunväristykset, turvotus, kuume, flunssaoireyhtymä, halitoosi, infektio (ei toisin määritelty), huonovointisuus, niskakipu, niskan jäykkyys, kipu , lantiokipu
Sydän- ja verisuonijärjestelmä - angina, rytmihäiriöt, bradykardia, aivoverenkiertohäiriö/aivoinfarkti, kohonnut verenpaine/hypotensio, migreeni, sydäninfarkti, sydämentykytys, sokki (verenkierron vajaatoiminta), pyörtyminen, takykardia, vasodilataatio
Ruoansulatuselimistö - epänormaali uloste, ruokahaluttomuus, bezoaari, sydänspasmi, sappikivitauti, paksusuolitulehdus, suun kuivuminen, dyspepsia, dysfagia, enteriitti, eruktaatio, ruokatorven ahtauma, ruokatorven haavauma, esofagiitti, ulosteen värjäytyminen, mahalaukun tulehdus, mahalaukun tulehdus, monisuolitulehdus, mahalaukun tulehdus , maha-suolikanavan häiriö, maha-suolikanavan verenvuoto, glossiitti, ienverenvuoto, hematemesis, lisääntynyt ruokahalu, lisääntynyt syljeneritys, melena, suun haavaumat, pahoinvointi ja oksentelu, pahoinvointi ja oksentelu ja ripuli, ruoansulatuskanavan moniliaasi, peräsuolen häiriö, peräsuolen verenvuoto, peräsuolen verenvuototulehdus kielen häiriö, haavainen paksusuolitulehdus, haavainen stomatiitti
Endokriiniset järjestelmä - diabetes mellitus, struuma, kilpirauhasen vajaatoiminta Hemic ja lymfaattinen järjestelmä - anemia, hemolyysi, lymfadenopatia
Aineenvaihdunta ja ravitsemushäiriöt - avitaminoosi, kihti, nestehukka, hyperglykemia/hypoglykemia, perifeerinen turvotus, painonnousu/-lasku
Tuki- ja liikuntaelimistö - nivelkipu, niveltulehdus, luusairaus, nivelsairaus, jalkakrampit, tuki- ja liikuntaelinten kipu, lihaskipu, myasthenia, ptoosi, niveltulehdus
Hermosto - epänormaalit unet, kiihtyneisyys, muistinmenetys, ahdistuneisuus, apatia, sekavuus, kouristukset, dementia, depersonalisaatio, masennus, diplopia, huimaus, emotionaalinen labilisuus, hallusinaatiot, hemiplegia, vihamielisyyden paheneminen, hyperkinesia, hypertonia, hypestesia, unettomuuden lisääntyminen, hermostuneisuus/unettomuus neuroosi, parestesia, unihäiriö, uneliaisuus, ajattelun poikkeavuus, vapina, huimaus
Hengityselimet - astma, keuhkoputkentulehdus, lisääntynyt yskä, hengenahdistus, nenäverenvuoto, verenvuoto, hikka, kurkunpään neoplasia, keuhkofibroosi, nielutulehdus, keuhkopussin häiriö, keuhkokuume, hengityselinten häiriö, ylempien hengitysteiden tulehdus/infektio, nuha, sinuiitti, stridori
Iho ja lisäkkeet - akne, hiustenlähtö, kosketusihottuma, kuiva iho, kiinteä ihottuma, hiussairaus, makulopapulaarinen ihottuma, kynsisairaus, kutina, ihottuma, ihosyöpä, ihosairaus, hikoilu, urtikaria
Erityiset aistit - epänormaali näkö, amblyopia, blefariitti, näön hämärtyminen, kaihi, sidekalvotulehdus, kuurous, silmien kuivuminen, korva-/silmäsairaus, silmäkipu, glaukooma, välikorvatulehdus, parosmia, valonarkuus, verkkokalvon rappeuma/häiriö, makuaistin menetys, makuaistin vääristyminen, tinnitus, näköhäiriöt kenttävika
Urogenitaalijärjestelmä - epänormaalit kuukautiset, rintojen suureneminen, rintojen kipu, rintojen arkuus, dysmenorrea, dysuria, gynekomastia, impotenssi, munuaiskivi, munuaiskipu, leukorrea, menorragia, kuukautiskierron häiriö, penishäiriö, polyuria, kiveshäiriö, virtsaputken kipu, virtsaamistiheys, virtsatie virtsatietulehdus, virtsaamistarpeet, virtsaamisen heikkeneminen, vaginiitti
Markkinoinnin jälkeinen kokemus
Muita haitallisia kokemuksia on raportoitu sen jälkeen, kun PREVACID ja PREVACID 30 mg SoluTab on tullut markkinoille. Suurin osa näistä tapauksista on peräisin ulkomailta, eikä yhteyttä PREVACID 15 mg:aan tai PREVACID SoluTabiin ole osoitettu. Koska nämä reaktiot on raportoitu vapaaehtoisesti tuntemattoman kokoiselta populaatiolta, esiintyvyyttä ei voida arvioida. Nämä tapahtumat on lueteltu alla COSTART-kehojärjestelmän mukaan.
Keho kokonaisuutena - anafylaktiset/anafylaktoidiset reaktiot, systeeminen lupus erythematosus;
Ruoansulatuselimistö - maksatoksisuus, haimatulehdus, oksentelu;
Hemic ja lymfaattinen järjestelmä - agranulosytoosi, aplastinen anemia, hemolyyttinen anemia, leukopenia, neutropenia, pansytopenia, trombosytopenia ja tromboottinen trombosytopeeninen purppura;
Infektiot ja infektiot - Clostridium difficileen liittyvä ripuli;
Aineenvaihdunta ja ravitsemushäiriöt - hypomagnesemia, hypokalsemia, hypokalemia, hyponatremia;
Tuki- ja liikuntaelimistö - luunmurtuma, myosiitti;
Iho ja lisäkkeet - vakavat dermatologiset reaktiot mukaan lukien erythema multiforme, SJS/TEN (joissakin tapauksissa kuolemaan johtava), DRESS, AGEP, ihon lupus erythematosus;
Erityiset aistit - puhehäiriö;
Urogenitaalijärjestelmä - interstitiaalinen nefriitti, virtsan kertymä.
Yhdistelmähoito amoksisilliinin ja klaritromysiinin kanssa
Kliinisissä tutkimuksissa, joissa käytettiin yhdistelmähoitoa PREVACIDin ja amoksisilliinin ja klaritromysiinin sekä PREVACID 30 mg:n ja amoksisilliinin kanssa, ei havaittu näille lääkeyhdistelmille ominaisia haittavaikutuksia. Haittavaikutukset, joita on esiintynyt, ovat rajoittuneet niihin, joita on raportoitu aiemmin PREVACID 15 mg:n, amoksisilliinin tai klaritromysiinin yhteydessä.
Kolmoishoito: PREVACID/amoksisilliini/klaritromysiini
Yleisimmin raportoidut haittavaikutukset potilailla, jotka saivat kolmoishoitoa 14 päivän ajan, olivat ripuli (7 %), päänsärky (6 %) ja makuaistin vääristyminen (5 %). Raportoitujen haittavaikutusten esiintymistiheydessä ei ollut tilastollisesti merkitseviä eroja 10 ja 14 päivän kolmoishoito-ohjelmien välillä. Hoidon aiheuttamia haittavaikutuksia ei havaittu merkittävästi useammin kolmoishoidolla kuin millään kaksoishoito-ohjelmalla.
Kaksoishoito: PREVACID/amoksisilliini
Yleisimmin raportoidut haittavaikutukset potilailla, jotka saivat PREVACID 30 mg kolmesti päivässä plus amoksisilliinia kolme kertaa päivässä kaksoishoitoa, olivat ripuli (8 %) ja päänsärky (7 %). Hoidon aiheuttamia haittavaikutuksia ei havaittu merkittävästi useammin, kun PREVACID 30 mg kolmesti vuorokaudessa ja amoksisilliini kolme kertaa vuorokaudessa kaksoishoidolla kuin pelkkä PREVACID 15 mg.
Lisätietoja haitallisista reaktioista antibakteeristen aineiden (amoksisilliini ja klaritromysiini), jotka on tarkoitettu käytettäväksi yhdessä PREVACIDin tai PREVACID SoluTabin kanssa, on niiden lääkemääräystietojen Haittavaikutukset-osiossa.
Laboratorioarvot
Seuraavat muutokset laboratorioparametreissa PREVACID 30 mg:aa saaneilla potilailla raportoitiin haittavaikutuksina:
Epänormaalit maksan toimintakokeet, kohonnut SGOT (AST), kohonnut SGPT (ALT), kohonnut kreatiniini, kohonnut alkalinen fosfataasi, kohonnut globuliinit, kohonnut GGTP, lisääntynyt/lasku/epänormaali WBC, poikkeava AG-suhde, poikkeava RBC, bilirubinemia, veren kaliumpitoisuuden nousu, lisääntynyt veren urea, kiteinen virtsa, eosinofilia, hemoglobiinin lasku, hyperlipemia, kohonneet/lasku elektrolyytit, kohonnut/lasku kolesteroli, kohonneet glukokortikoidit, kohonnut LDH, lisääntyneet/laskuneet/epänormaalit verihiutaleet, kohonneet gastriinitasot ja positiivinen piilevä veri ulosteessa. Virtsan poikkeavuuksia, kuten albuminuriaa, glykosuriaa ja hematuriaa, raportoitiin myös. Muita yksittäisiä laboratoriopoikkeavuuksia raportoitiin.
Lumekontrolloiduissa tutkimuksissa, kun SGOT (AST) ja SGPT (ALT) arvioitiin, 0,4 %:lla (4/978) ja 0,4 %:lla (11/2677) lumelääkettä ja PREVACIDia saaneilla potilailla entsyymiarvot olivat suurempia kuin kolme kertaa normaalialueen yläraja viimeisellä hoitokäynnillä. Yksikään näistä potilaista, jotka saivat PREVACID 30 mg, ei ilmoittanut keltaisuudesta missään vaiheessa tutkimuksen aikana.
Kliinisissä tutkimuksissa, joissa käytettiin yhdistelmähoitoa PREVACID 15 mg:n ja amoksisilliinin ja klaritromysiinin sekä PREVACIDin ja amoksisilliinin kanssa, ei havaittu lisääntynyttä laboratorioarvojen poikkeavuuksia näissä lääkeyhdistelmissä.
Lisätietoja laboratorioarvojen muutoksista antibakteerisilla aineilla (amoksisilliini ja klaritromysiini), jotka on tarkoitettu PREVACIDin tai PREVACID 30mg SoluTabin kanssa, on niiden lääkemääräystietojen osiossa Haittavaikutukset.
HUUMEIDEN VUOROVAIKUTUKSET
Taulukot 2 ja 3 sisältävät lääkkeet, joilla on kliinisesti merkittäviä lääkevuorovaikutuksia ja yhteisvaikutuksia diagnostisten tekijöiden kanssa, kun niitä annetaan samanaikaisesti PREVACID 15 mg:n tai PREVACID SoluTabin kanssa, sekä ohjeet niiden ehkäisyyn tai hoitoon.
Katso samanaikaisesti käytettyjen lääkkeiden pakkausmerkintöjä saadaksesi lisätietoja yhteisvaikutuksista PPI:iden kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Läsnäolo mahalaukun pahanlaatuisuuden
Aikuisilla oireenmukainen vaste PREVACID 15 mg- tai PREVACID SoluTab -hoidolle ei sulje pois mahalaukun pahanlaatuisuuden esiintymistä. Harkitse lisäseurantaa ja diagnostisia testejä aikuispotilaille, joilla on suboptimaalinen vaste tai varhainen oireinen uusiutuminen PPI-hoidon päätyttyä. Vanhemmilla potilailla harkitse myös endoskopiaa.
Akuutti tubulointerstitiaalinen nefriitti
Akuuttia tubulointerstiaalista nefriittiä (TIN) on havaittu PPI-lääkkeitä käyttävillä potilailla, ja se voi ilmaantua milloin tahansa PPI-hoidon aikana. Potilailla voi esiintyä erilaisia merkkejä ja oireita oireellisista yliherkkyysreaktioista epäspesifisiin munuaisten toiminnan heikkenemisen oireisiin (esim. huonovointisuus, pahoinvointi, anoreksia). Raportoiduissa tapaussarjoissa joillekin potilaille diagnosoitiin biopsia ja munuaisten ulkopuolisia oireita (esim. kuumetta, ihottumaa tai nivelkipua) ei ilmennyt. Lopeta PREVACID tai PREVACID 15 mg SoluTab ja arvioi potilaat, joilla on epäilty akuutti TIN [ks. VASTA-AIHEET ].
Clostridium Difficilen aiheuttama ripuli
Julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito, kuten PREVACID 30mg ja PREVACID 30mg SoluTab, saattaa liittyä Clostridium difficilen aiheuttaman ripulin (CDAD) lisääntyneeseen riskiin erityisesti sairaalapotilailla. Tätä diagnoosia tulisi harkita ripulille, joka ei parane [katso HAITTAVAIKUTUKSET ].
Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen.
CDAD:ta on raportoitu lähes kaikkien antibakteeristen aineiden käytön yhteydessä. Lisätietoja erityisistä antibakteerisista aineista (klaritromysiini ja amoksisilliini), jotka on tarkoitettu käytettäväksi yhdessä PREVACID 15mg:n tai PREVACID 15mg SoluTabin kanssa, on niiden lääkemääräystietojen Varoitukset ja varotoimet -osiossa.
Luunmurtuma
Useat julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito saattaa liittyä lisääntyneeseen osteoporoosiin liittyvien lonkka-, ranteen- tai selkärangan murtumien riskiin. Murtumariski lisääntyi potilailla, jotka saivat suuria annoksia, jotka määriteltiin useiksi päivittäisiksi annoksiksi, ja pitkäaikaista PPI-hoitoa (vuoden tai pidempään). Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen. Potilaita, joilla on osteoporoosiin liittyvien murtumien riski, tulee hoitaa vahvistettujen hoitoohjeiden mukaisesti [katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET ].
Vakavat ihohaittavaikutukset
PPI-lääkkeiden käytön yhteydessä on raportoitu vaikeita ihon haittavaikutuksia, mukaan lukien Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) ja akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP). [katso HAITTAVAIKUTUKSET ]. Lopeta PREVACID 30 mg:n tai PREVACID SoluTabin käyttö vakavien ihohaittavaikutusten tai muiden yliherkkyysoireiden ensimmäisten merkkien tai oireiden ilmetessä ja harkitse lisäarviointia.
Ihon ja systeeminen lupus erythematosus
Ihon lupus erythematosus (CLE) ja systeeminen lupus erythematosus (SLE) on raportoitu potilailla, jotka käyttävät PPI-lääkkeitä, mukaan lukien lansopratsolia. Nämä tapahtumat ovat ilmenneet sekä uutena ilmaantumisena että olemassa olevan autoimmuunisairauden pahenemisena. Suurin osa PPI:n aiheuttamista lupus erythematosus -tapauksista oli CLE.
Yleisin PPI-lääkkeillä hoidetuilla potilailla raportoitu CLE:n muoto oli subakuutti CLE (SCLE), ja se esiintyi viikkojen tai vuosien kuluessa jatkuvan lääkehoidon jälkeen potilailla, jotka vaihtelivat imeväisistä vanhuksiin. Yleensä histologiset löydökset havaittiin ilman elinten osallistumista.
Systeemistä lupus erythematosusta (SLE) on raportoitu harvemmin kuin CLE:tä PPI-lääkkeitä saavilla potilailla. PPI:hen liittyvä SLE on yleensä lievempi kuin ei-lääkkeiden aiheuttama SLE. SLE puhkesi tyypillisesti päivien tai vuosien kuluessa hoidon aloittamisesta ensisijaisesti potilailla, jotka vaihtelivat nuorista aikuisista vanhuksiin. Suurimmalla osalla potilaista oli ihottumaa; kuitenkin myös nivelkipua ja sytopeniaa raportoitiin.
Vältä PPI-lääkkeiden antamista pidempään kuin lääketieteellisesti on tarpeen. Jos PREVACID 15 mg tai PREVACID SoluTab -valmistetta saavilla potilailla havaitaan CLE:n tai SLE:n mukaisia merkkejä tai oireita, keskeytä lääkkeen käyttö ja lähetä potilas asianmukaisen asiantuntijan arvioitavaksi. Useimmat potilaat paranevat, kun pelkkä PPI-hoito lopetetaan 4–12 viikossa. Serologiset testit (esim. ANA) voivat olla positiivisia ja kohonneiden serologisten testien tulosten korjaaminen voi kestää kauemmin kuin kliiniset oireet.
Syanokobalamiinin (B12-vitamiinin) puutos
Päivittäinen hoito millä tahansa happoa vähentävillä lääkkeillä pitkän ajan (esim. yli kolmen vuoden ajan) voi johtaa syanokobalamiinin (B12-vitamiini) imeytymishäiriöön, jonka aiheuttaa hypo- tai aklorhydria. Kirjallisuudessa on raportoitu harvoin syanokobalamiinin puutteesta happoa vähentävän hoidon yhteydessä. Tätä diagnoosia tulee harkita, jos PREVACID- tai PREVACID SoluTab -hoitoa saavilla potilailla havaitaan syanokobalamiinin puutoksen kliinisiä oireita.
Hypomagnesemia ja mineraaliaineenvaihdunta
Oireista ja oireetonta hypomagnesemiaa on raportoitu harvoin potilailla, joita on hoidettu PPI-lääkkeillä vähintään kolmen kuukauden ajan, useimmissa tapauksissa vuoden hoidon jälkeen. Vakavia haittavaikutuksia ovat tetania, rytmihäiriöt ja kouristukset. Hypomagnesemia voi johtaa hypokalsemiaan ja/tai hypokalemiaan ja voi pahentaa taustalla olevaa hypokalsemiaa riskipotilailla. Useimmilla potilailla hypomagnesemian hoito vaati magnesiumin korvaamista ja PPI:n lopettamista.
Potilaiden, joiden odotetaan saavan pitkäaikaista hoitoa tai jotka käyttävät PPI-lääkkeitä lääkkeiden, kuten digoksiinin tai lääkkeiden kanssa, jotka voivat aiheuttaa hypomagnesemiaa (esim. diureetit), terveydenhuollon ammattilaiset voivat harkita magnesiumpitoisuuden seurantaa ennen PPI-hoidon aloittamista ja määräajoin [ks. HAITTAVAIKUTUKSET ].
Harkitse magnesium- ja kalsiumtasojen seurantaa ennen PREVACID 30 mg:n tai PREVACID SoluTab -hoidon aloittamista ja ajoittain hoidon aikana potilailla, joilla on jo hypokalsemian riski (esim. hypoparatyreoosi). Täydennä tarvittaessa magnesiumia ja/tai kalsiumia. Jos hypokalsemia ei kestä hoitoa, harkitse PPI-hoidon lopettamista.
Vuorovaikutukset neuroendokriinisten kasvainten tutkimusten kanssa
Seerumin kromograniini A (CgA) -tasot nousevat toissijaisesti lääkkeiden aiheuttaman mahalaukun happamuuden laskun seurauksena. Lisääntynyt CgA-taso voi aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa. Terveydenhuollon tarjoajien tulee tilapäisesti lopettaa lansopratsolihoito vähintään 14 päivää ennen CgA-tason arviointia ja harkita testin toistamista, jos CgA-alkutasot ovat korkeat. Jos suoritetaan sarjatestejä (esim. seurantaa varten), testaukseen tulee käyttää samaa kaupallista laboratoriota, koska testien väliset vertailualueet voivat vaihdella [ks. HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
Vuorovaikutus metotreksaatin kanssa
Kirjallisuus viittaa siihen, että PPI-lääkkeiden samanaikainen käyttö metotreksaatin kanssa (pääasiassa suurina annoksina) voi nostaa ja pidentää metotreksaatin ja/tai sen metaboliitin seerumipitoisuuksia, mikä saattaa johtaa metotreksaattitoksisuuteen. Suuria metotreksaattiannoksia käytettäessä PPI:n väliaikaista keskeyttämistä voidaan harkita joillakin potilailla [ks. HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
Potilaat, joilla on fenyyliketonuria
Fenyylialaniini voi olla haitallista potilaille, joilla on fenyyliketonuria (PKU). PREVACID 30mg SoluTab sisältää fenyylialaniinia, joka on aspartaamin komponentti. Yksi 15 mg:n tabletti sisältää 2,5 mg ja jokainen 30 mg:n tabletti 5,1 mg fenyylialaniinia. Ennen kuin määräät PREVACID SoluTabia potilaalle, jolla on PKU, harkitse fenyylialaniinin yhdistettyä päivittäistä määrää kaikista lähteistä, mukaan lukien PREVACID 30 mg SoluTab.
Pohjarauhasten polyypit
PPI:n käyttöön liittyy lisääntynyt pohjukaissuolen polyyppien riski, joka lisääntyy pitkäaikaisessa käytössä, erityisesti yli vuoden. Suurin osa PPI-käyttäjistä, joille kehittyi pohjukaisrauhasen polyyppeja, oli oireettomia ja pohjukaisrauhasen polyypit tunnistettiin sattumalta endoskopiassa. Käytä lyhyintä PPI-hoitoa, joka sopii hoidettavaan sairauteen.
Sydänläppien paksuuntumisen riski alle vuoden ikäisillä lapsipotilailla
PREVACID 30 mg ja PREVACID SoluTab ei ole hyväksytty alle vuoden ikäisille lapsipotilaille. Nuorilla rotilla tehdyt ei-kliiniset tutkimukset lansopratsolilla ovat osoittaneet sydänläpän paksuuntumisen haittavaikutuksen. Sydänläppävaurion riski ei näytä olevan merkityksellinen yhden vuoden ikäisille ja sitä vanhemmille potilaille [katso Käyttö tietyissä populaatioissa ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ja Käyttöohjeet ).
Neuvo potilaita:
Akuutti tubulointerstitiaalinen nefriitti
Soita terveydenhuollon tarjoajalle, jos heillä on merkkejä ja/tai oireita, jotka liittyvät akuuttiin tubulointerstitiaaliseen nefriittiin [ks. VAROITUKSET JA VAROTOIMET ].
Clostridium Difficilen aiheuttama ripuli
Soita välittömästi terveydenhuollon tarjoajalle, jos heillä on ripuli, joka ei parane [katso VAROITUKSET JA VAROTOIMET ].
Luunmurtuma
Ilmoittaa mahdollisista murtumista, erityisesti lonkan, ranteen tai selkärangan murtumasta terveydenhuollon tarjoajalleen [katso VAROITUKSET JA VAROTOIMET ].
Vakavat ihohaittavaikutukset
Jos haluat lopettaa PREVACIDin tai PREVACID 30 mg SoluTabin käytön ja soittaa välittömästi terveydenhuollon tarjoajalle lisäarviointia varten [katso VAROITUKSET JA VAROTOIMET ].
Ihon ja systeeminen lupus erythematosus
Soita välittömästi terveydenhuollon tarjoajalle ihon tai systeemiseen lupus erythematosukseen liittyvien uusien tai pahenevien oireiden varalta [ks. VAROITUKSET JA VAROTOIMET ].
Syanokobalamiinin (B12-vitamiinin) puutos
 Ilmoittaa terveydenhuollon tarjoajalle kaikista kliinisistä oireista, jotka voivat liittyä syanokobalamiinin puutteeseen, jos he ovat saaneet PREVACIDia tai PREVACID SoluTabia yli kolmen vuoden ajan [ks. VAROITUKSET JA VAROTOIMET ].
Hypomagnesemia ja mineraali
Aineenvaihdunta Ilmoittaa terveydenhuollon tarjoajalle kaikista kliinisistä oireista, jotka voivat liittyä hypomagnesemiaan, hypokalsemiaan ja/tai hypokalemiaan, jos he ovat saaneet PREVACID- tai PREVACID 15mg SoluTabia vähintään kolmen kuukauden ajan [ks. VAROITUKSET JA VAROTOIMET ].
Huumeiden vuorovaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he käyttävät rilpiviriiniä sisältäviä tuotteita [ks. VASTA-AIHEET ] tai suuriannoksinen metotreksaatti [ks VAROITUKSET JA VAROTOIMET ].
Raskaus
Kerro raskaana olevalle naiselle mahdollisesta riskistä sikiölle. Neuvo lisääntymiskykyisiä naisia ilmoittamaan terveydenhuollon tarjoajalleen tunnetusta tai epäillystä raskaudesta [katso Käyttö tietyissä populaatioissa ].
Hallinto
- Unohtuneet annokset: Jos annos jää väliin, ota se mahdollisimman pian. Jos seuraava annos on kuitenkin tulossa, älä ota unohtunutta annosta, vaan ota seuraava annos ajoissa. Älä ota kahta annosta kerralla korvataksesi unohtamasi annoksen.
- PREVACID tai PREVACID 30 mg SoluTab tulee ottaa ennen ruokailua.
- Älä murskaa tai pureskele PREVACID 15 mg kapselia tai PREVACID SoluTabia.
- Ota PREVACID tai PREVACID 30 mg SoluTab vähintään 30 minuuttia ennen sukralfaattia.
- Fenyyliketonuurit: Sisältää fenyylialaniinia 2,5 mg 15 mg PREVACID 30 mg SoluTab -tablettia kohti ja 5,1 mg 30 mg PREVACID SoluTab -tablettia kohti.
PREVACID-kapselit
- Niele kokonaisena; älä pureskele.
- Potilaille, joilla on vaikeuksia niellä kapseleita:
- PREVACID 15mg kapselit voidaan avata ja ripotella omenasoseen, ENSURE vanukasen, raejuuston, jogurtin tai siivilöityjen päärynöiden päälle
- PREVACID 15 mg kapselit voidaan myös tyhjentää pieneen määrään joko omenamehua, appelsiinimehua tai tomaattimehua
- Vaihtoehtoisesti PREVACID-kapselit voidaan antaa omenamehun kanssa nenämahaletkun kautta
- Katso käyttöohjeesta kuvaus kaikista valmistus- ja anto-ohjeista
PREVACID SoluTab
- Älä riko tai leikkaa.
- Aseta tabletti kielen päälle; anna sen hajota veden kanssa tai ilman, kunnes hiukkaset voidaan niellä. Älä pureskele hiukkasia.
- Tabletti hajoaa tyypillisesti alle minuutissa.
- Vaihtoehtoisesti lapsille tai muille potilaille, joilla on vaikeuksia niellä tabletteja, PREVACID 30 mg SoluTab voidaan antaa veden kanssa suuruiskun tai NG-letkun kautta käyttöohjeissa kuvatulla tavalla.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahdessa 24 kuukautta kestäneessä karsinogeenisuustutkimuksessa Sprague-Dawley-rottia hoidettiin oraalisilla lansopratsoliannoksilla 5-150 mg/kg/vrk, joka on noin 1-40 kertaa suurempi kuin 50-kiloisen ihmisen kehon pinta-altistus (mg/m²). keskipituus [1,46 m² kehon pinta-ala (BSA)], kun ihmisille suositeltu annos on 30 mg/vrk. Lansopratsoli aiheutti annosriippuvaista mahalaukun enterokromaffiinin kaltaisten (ECL) solujen liikakasvua ja ECL-solukarsinoideja sekä uros- että naarasrotilla. Se lisäsi myös mahalaukun epiteelin suoliston metaplasian ilmaantuvuutta molemmilla sukupuolilla. Lansopratsoli lisäsi urosrotilla annoksesta riippuvaa kivesten interstitiaalisten solujen adenoomien määrää. Näiden adenoomien ilmaantuvuus rotilla, jotka saivat annoksia 15-150 mg/kg/vrk (4-40 kertaa suositeltu ihmisannos BSA:n perusteella), ylitti tämän rotkakannan alhaisen taustan esiintyvyyden (vaihteluväli = 1,4-10 %).
24 kuukautta kestäneessä karsinogeenisuustutkimuksessa CD-1-hiiriä hoidettiin suun kautta annetulla lansopratsoliannoksilla 15–600 mg/kg/vrk, 2–80 kertaa BSA:n perusteella ihmiselle suositeltu annos. Lansopratsoli lisäsi annoksesta riippuvaa mahalaukun ECL-solujen liikakasvua. Se lisäsi myös maksakasvainten (maksasoluadenooma ja karsinooma) ilmaantuvuutta. Kasvainten ilmaantuvuus uroshiirillä, joita hoidettiin annoksella 300 ja 600 mg/kg/vrk (40–80 kertaa suositeltu ihmisannos BSA:n perusteella) ja naarashiirillä, joita hoidettiin annoksella 150–600 mg/kg/vrk (20–80 kertaa suositeltu ihmiselle BSA:han perustuva annos) ylitti taustan esiintymistiheysalueet historiallisissa kontrolleissa tälle hiirikannalle. Lansopratsolihoito aiheutti rete kiveksen adenooman uroshiirillä, jotka saivat 75-600 mg/kg/vrk (10-80 kertaa suositeltu annos ihmiselle BSA:n perusteella).
26 viikon p53 (+/-) siirtogeenisen hiiren karsinogeenisuustutkimus ei ollut positiivinen.
Lansopratsoli oli positiivinen Ames-testissä ja ihmisen lymfosyyttien kromosomipoikkeamamäärityksessä in vitro. Lansopratsoli ei ollut genotoksinen ex vivo rotan hepatosyyttien suunnittelemattomassa DNA-synteesi (UDS) testissä, in vivo hiiren mikrotumatestissä eikä rotan luuydinsolujen kromosomipoikkeavuustestissä.
Lansopratsolin oraalisilla annoksilla 150 mg/kg/vrk asti (40 kertaa suositeltu ihmisannos BSA:n perusteella) ei havaittu vaikuttavan uros- ja naarasrottien hedelmällisyyteen eikä lisääntymiskykyyn.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot julkaistuista havainnointitutkimuksista eivät yleisesti viittaa haitallisten raskauden tulosten ja lansopratsolihoidon väliseen yhteyttä (ks. Data ).
Lisääntymistutkimuksissa eläinkokeissa lansopratsolin oraalinen antaminen rotille organogeneesin aikana imetyksen aikana 6,4-kertaisena ihmiselle suositeltuun enimmäisannokseen verrattuna pienensi jälkeläisten reisiluun painoa, reisiluun pituutta, kruunun ja lantion pituutta ja kasvulevyn paksuutta (vain urokset) syntymän jälkeisenä päivänä. 21 (katso Data ). Nämä vaikutukset liittyivät painonnousun vähenemiseen. Kerro raskaana oleville naisille mahdollisista riskeistä sikiölle.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Jos PREVACID 15mg tai PREVACID 15mg SoluTab annetaan klaritromysiinin kanssa, klaritromysiinin raskaustiedot koskevat myös yhdistelmähoitoa. Lisätietoja käytöstä raskauden aikana on klaritromysiinin ohjetiedoissa.
Data
Ihmistiedot
Saatavilla olevat tiedot julkaistuista havaintotutkimuksista eivät osoittaneet yhteyttä raskauteen liittyvien haitallisten tulosten ja lansopratsolin käytön välillä. Näiden havainnointitutkimusten metodologiset rajoitukset eivät voi varmasti vahvistaa tai sulkea pois mitään lääkkeisiin liittyvää riskiä raskauden aikana. European Network of Teratology Information Services -verkoston prospektiivisessa tutkimuksessa tuloksia 62 raskaana olevan naisen ryhmästä, joille annettiin 30 mg:n lansopratsolin keskimääräinen päivittäinen annos, verrattiin kontrolliryhmään, jossa oli 868 raskaana olevaa naista, jotka eivät käyttäneet PPI-lääkkeitä. Suurten epämuodostumien määrässä ei ollut eroa PPI-lääkkeille altistuneiden naisten ja kontrolliryhmän välillä, mikä vastasi suhteellista riskiä (RR) = 1,04, [95 %:n luottamusväli (CI) 0,25-4,21]. Väestöpohjaisessa retrospektiivisessä kohorttitutkimuksessa, joka kattoi kaikki elävänä syntyneet lapset Tanskassa vuosina 1996–2008, vakavien synnynnäisten epämuodostumien määrä ei lisääntynyt merkittävästi, kun analysoitiin ensimmäisen raskauskolmanneksen lansopratsolialtistusta 794 elävänä syntyneessä. Meta-analyysi, jossa verrattiin 1 530 raskaana olevaa naista, jotka olivat altistuneet PPI-lääkkeille ainakin ensimmäisen raskauskolmanneksen aikana 133 410 altistumattomaan raskaana olevaan naiseen, ei osoittanut merkittävää synnynnäisten epämuodostumien tai spontaanin abortin riskin lisääntymistä PPI-lääkkeille altistumisen yhteydessä (vakavien epämuodostumien todennäköisyyssuhde (OR) = 1,12) , [95 % CI 0,86-1,45] ja spontaanien aborttien osalta TAI = 1,29, [95 % CI 0,841,97]).
Eläinten tiedot
Ei havaittu haitallisia vaikutuksia alkion ja sikiön kehitykseen tutkimuksissa, jotka suoritettiin tiineillä rotilla oraalisilla lansopratsoliannoksilla aina 150 mg/kg/vrk asti (40 kertaa suositeltu ihmisannos [30 mg/vrk] kehon pinta-alan perusteella) organogeneesin ja raskaana oleville kaneille oraalisilla lansopratsoliannoksilla enintään 30 mg/kg/vrk (16 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella) organogeneesin aikana.
Pre- ja postnataalinen kehitystoksisuustutkimus rotilla, joissa oli muita päätepisteitä luun kehityksen arvioimiseksi, suoritettiin lansopratsolilla oraalisilla annoksilla 10-100 mg/kg/vrk (0,7-6,4 kertaa ihmisen suurin suositeltu lansopratsoliannos 30 mg AUC:n perusteella. [plasman pitoisuus-aikakäyrän alla oleva pinta-ala]) annetaan organogeneesin aikana imetyksen aikana. Äidillä havaittuja vaikutuksia annoksella 100 mg/kg/vrk (6,4 kertaa ihmisen suurin suositeltu lansopratsoliannos 30 mg AUC:n perusteella) olivat tiineyden piteneminen, painonnousun väheneminen raskauden aikana ja ruoan kulutuksen väheneminen. Kuolleena syntyneiden määrä lisääntyi tällä annoksella, mikä saattoi johtua äidin toksisuudesta. Pentujen ruumiinpainoa pienennettiin annoksella 100 mg/kg/vrk alkaen syntymän jälkeisestä päivästä 11. Reisiluun painoa, reisiluun pituutta ja kruunun lantion pituutta pienennettiin annoksella 100 mg/kg/vrk synnytyksen jälkeisenä päivänä 21. Reisiluun paino laski edelleen 100 mg/kg/vrk ryhmä 17-18 viikon iässä. Kasvulevyn paksuus pieneni 100 mg/kg/vrk miehillä syntymän jälkeisenä päivänä 21, ja kasvoi 30 ja 100 mg/kg/vrk miehillä 17-18 viikon iässä. Vaikutukset luuparametreihin liittyivät painonnousun vähenemiseen.
Imetys
Riskien yhteenveto
Lansopratsolin erittymisestä äidinmaitoon, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon ei ole tietoa. Lansopratsolia ja sen metaboliitteja on kuitenkin rotan maidossa. Imetyksen kehitys- ja terveyshyötyjä tulee ottaa huomioon äidin PREVACID 30mg tai PREVACID 30mg SoluTab kliinisen tarpeen sekä PREVACID 30mg:n tai PREVACID SoluTabin mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Käyttö lapsille
PREVACID 15 mg:n ja PREVACID 30 mg SoluTabin turvallisuus ja tehokkuus on osoitettu 1–17-vuotiailla lapsipotilailla oireisen GERD:n ja erosiivisen esofagiitin lyhytaikaisessa hoidossa.
Oireisen GERD:n ja erosiivisen ruokatorven tulehduksen kliinisissä tutkimuksissa PREVACID 30 mg:aa ei annettu yli 12 viikon ajan 1–11-vuotiaille potilaille. Ei tiedetä, ovatko PREVACID 30mg ja PREVACID SoluTab turvallisia ja tehokkaita, jos niitä käytetään suositeltua kestoa pidempään. Älä ylitä suositeltua annosta ja käytön kestoa lapsipotilailla (ks Nuorten eläinten toksisuustiedot ).
PREVACID ei ollut tehokas lapsipotilailla, joilla oli oireinen GERD yhden kuukauden ja alle vuoden iässä lumelääkekontrolloidussa monikeskustutkimuksessa kaksoissokkoutetussa tutkimuksessa. Siksi turvallisuutta ja tehoa ei ole osoitettu alle vuoden ikäisillä potilailla. Nuorilla rotilla tehdyt ei-kliiniset tutkimukset ovat osoittaneet sydänläpän paksuuntumisen ja luun muutosten haitallisen vaikutuksen käytettäessä lansopratsoliannoksia, jotka ovat suurempia kuin ihmiselle suositeltu enimmäisannos.
Vastasyntyneestä alle vuoden ikään
Lansopratsolin farmakokinetiikkaa tutkittiin alle 28 päivän ikäisillä ja 1–11 kuukauden ikäisillä lapsipotilailla, joilla oli GERD. Verrattuna terveisiin aikuisiin, jotka saivat 30 mg, vastasyntyneillä oli suurempi altistus (keskimääräiset painoon perustuvat normalisoidut AUC-arvot 2,04 ja 1,88 kertaa suuremmat annoksilla 0,5 ja 1 mg/kg/vrk). ≤10 viikon ikäisten imeväisten puhdistuma- ja altistusarvot olivat samanlaiset kuin vastasyntyneillä. Yli 10 viikon ikäisten imeväisten, jotka saivat 1 mg/kg/vrk, keskimääräiset AUC-arvot olivat samanlaiset kuin aikuisilla, jotka saivat 30 mg:n annosta.
Lansopratsolin ei havaittu olevan tehokas yhdysvaltalaisessa ja puolalaisessa neljän viikon monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, rinnakkaisryhmätutkimuksessa, johon osallistui 162 potilasta, joiden ikä oli yhden kuukauden ja alle 12 kuukauden ikäinen ja joilla oli oireinen GERD sairaushistorian perusteella. itku/häiriö/ärtyneisyys, joka liittyy ruokkimiseen, joka ei ollut reagoinut konservatiiviseen GERD-hoitoon (eli ei-farmakologiseen hoitoon) 7-14 päivään. Potilaat vastaanotettu
lansopratsoli suspensiona päivittäin (0,2-0,3 mg/kg/vrk ≤10 viikon ikäisille imeväisille tai 1,0-1,5 mg/kg/vrk yli 10 viikon ikäisille imeväisille tai lumelääke) enintään neljän viikon kaksoissokkohoidon ajan.
Ensisijaisena tehokkuuden päätetapahtumana arvioitiin yli 50 %:n väheneminen lähtötasosta joko itku-/häiriö-/ärtyneisyysjakson aiheuttamien ruokintakertojen prosenttiosuudessa tai itku-/häti-/ärtyvyysjakson kestona (minuutteina) tunnin sisällä ruokinnasta.
Vastaajien prosenttiosuudessa ei ollut eroa lasten lansopratsolisuspensioryhmän ja lumelääkeryhmän välillä (54 % molemmissa ryhmissä).
Lapsipotilailla tehdyissä kliinisissä tutkimuksissa (yhdestä kuukaudesta alle 12 kuukauden ikään) ei raportoitu haittavaikutuksia, joita ei aiemmin havaittu aikuisilla.
Vaiheen 3 tehokkuustutkimuksen tulosten perusteella lansopratsolin ei osoitettu olevan tehokas. Siksi nämä tulokset eivät tue lansopratsolin käyttöä oireisen GERD:n hoidossa imeväisillä.
Vuodesta 11 vuoden ikään
Kontrolloimattomassa, avoimessa yhdysvaltalaisessa monikeskustutkimuksessa 66 GERD-potilaalle (1-11-vuotiaalle) määrättiin ruumiinpainon perusteella aloitusannos PREVACID 15 mg vuorokaudessa, jos paino oli ≤30 kg tai PREVACID 30 mg päivässä, jos paino on yli 30 kg, annettuna 8-12 viikon ajan. PREVACID-annosta suurennettiin (30 mg:aan kahdesti vuorokaudessa) 24:llä 66:sta lapsipotilaasta kahden tai useamman viikon hoidon jälkeen, jos heillä oli edelleen oireita. Lähtötilanteessa 85 %:lla potilaista oli lieviä tai keskivaikeita GERD-oireita (arvioitu tutkijan haastattelulla), 58 %:lla ei-eroosioinen GERD ja 42 %:lla erosiivinen esofagiitti (arvioitu endoskopialla).
8–12 viikon PREVACID 15 mg -hoidon jälkeen intent-to-treat -analyysi osoitti, että GERD-oireiden esiintymistiheys ja vakavuus vähenivät noin 50 %.
Kaksikymmentäyksi 27 erosiivista esofagiittipotilaasta parani kahdeksan viikon kohdalla ja 100 % potilaista parani 12 viikon kohdalla endoskopialla (taulukko 4).
Tutkimuksessa, johon osallistui 66 lapsipotilasta ikäryhmässä, jotka olivat 1–11-vuotiaita, sen jälkeen, kun PREVACID 15 mg annettiin suun kautta annoksina 15 mg vuorokaudessa - 30 mg kahdesti vuorokaudessa, seerumin gastriinipitoisuuksien nousu oli samanlaista kuin aikuistutkimuksissa havaittu. Seerumin gastriinipitoisuuden keskiarvo paasto kasvoi 89 % lähtötilanteen arvosta 51 pg/ml arvoon 97 pg/ml [kvartiiliväli (25. - 75. prosenttipiste) 71 - 130 pg/ml] viimeisellä käynnillä.
PREVACID 30 mg -kapseleiden turvallisuus lapsille on arvioitu 66:lla 1–11-vuotiaalla lapsipotilaalla. 66 GERD-potilaasta 85 % (56/66) otti PREVACID 30 mg kahdeksan viikon ajan ja 15 % (10/66) otti sitä 12 viikon ajan.
Yleisimmin raportoidut (kaksi tai useampi potilasta) hoitoon liittyvät haittavaikutukset 1–11-vuotiailla potilailla (N=66) olivat ummetus (5 %) ja päänsärky (3 %).
12-17 vuoden ikään
Kontrolloimattomassa avoimessa yhdysvaltalaisessa monikeskustutkimuksessa 87 nuorta potilasta (12-17-vuotiaita), joilla oli oireinen GERD, hoidettiin PREVACIDilla 8-12 viikon ajan. Ylempien endoskopioiden lähtötasolla nämä potilaat luokiteltiin kahteen ryhmään: 64 (74 %) ei-eroosiota GERD:tä ja 23 (26 %) erosiivista esofagiittia (EE). Ei-eroosioiset GERD-potilaat saivat PREVACIDia 15 mg päivässä kahdeksan viikon ajan ja EE-potilaat saivat PREVACIDia 30 mg päivässä 8-12 viikon ajan. Lähtötilanteessa 89 %:lla näistä potilaista oli lieviä tai kohtalaisia GERD-oireita (tutkijan haastatteluilla arvioitu). Kahdeksan viikon aikana 15 mg PREVACID-hoidon aikana nuorilla potilailla GERD-oireiden esiintyvyys väheni 63 % ja vaikeusaste 69 % päiväkirjan tulosten perusteella.
Kaksikymmentäyksi 22:sta (95,5 %) nuoresta erosiivinen ruokatorvitulehdus parantui kahdeksan viikon PREVACID 15 mg -hoidon jälkeen. Yksi potilas pysyi parantumattomana 12 viikon hoidon jälkeen (taulukko 5).
Näillä 87 nuorella potilaalla seerumin gastriinipitoisuuksien nousu oli samanlaista kuin aikuistutkimuksissa havaittu, seerumin paastogastriinipitoisuudet nousivat 42 % lähtötilanteen 45 pg/ml:sta 64 pg/ml:aan [kvartiiliväli (25.–75. prosenttipiste) 44 - 88 pg/ml] viimeisellä käynnillä. (Normaalit seerumin gastriinitasot ovat 25-111 pg/ml.)
PREVACID-kapseleiden turvallisuus on arvioitu näillä 87 nuorella potilaalla. 87 nuoresta GERD-potilaasta 6 % (5/87) otti PREVACID 15 mg alle kuuden viikon ajan, 93 % (81/87) 6-10 viikkoa ja 1 % (1/87) yli 10 viikkoa. .
Näillä potilailla yleisimmin raportoidut (vähintään 3 %) hoitoon liittyvät haittavaikutukset olivat päänsärky (7 %), vatsakipu (5 %), pahoinvointi (3 %) ja huimaus (3 %). Hoitoon liittyvää huimausta, jota näissä ohjetiedoissa raportoitiin esiintyvän alle 1 %:lla aikuispotilaista, raportoi tässä tutkimuksessa kolme nuorta potilasta, joilla oli ei-eroosiota GERD ja joilla oli huimausta samanaikaisesti muiden reaktioiden kanssa (kuten migreeni, hengenahdistus, ja oksentelu).
Nuorten eläinten toksisuustiedot
Sydänläppien paksuuntuminen
Kahdessa suun kautta tapahtuvassa toksisuustutkimuksessa lansopratsolilla hoidetuilla nuorilla rotilla ilmeni mitraaliläpän paksuuntumista. Sydänläpän paksuuntumista havaittiin ensisijaisesti suun kautta tapahtuvalla annostelulla, joka aloitettiin syntymän jälkeisenä päivänä 7 (ikää vastaava vastasyntyneen ihmisen ikä) ja syntymän jälkeisenä päivänä 14 (ihmisikää vastaava noin yksi vuosi) annoksilla 250 mg/kg/vrk ja suuremmilla annoksilla (7. syntymän jälkeinen päivä). ja synnytyksen jälkeinen päivä 14, vastaavasti 6,2-kertainen ja 4,2-kertainen lasten päiväannos 15 mg 1–11-vuotiailla lapsipotilailla, jotka painavat 30 kg tai vähemmän, AUC:n perusteella). Sydänläpän paksuuntumiseen liittyvät hoitoajat vaihtelivat 5 päivästä 8 viikkoon. Löydökset kääntyivät päinvastaiseksi tai suuntautuivat palautumaan 4 viikon lääkkeettömän toipumisjakson jälkeen. Sydämenläpän paksuuntumisen ilmaantuvuus annostelun aloittamisen jälkeen synnytyksen jälkeisenä päivänä 21 (ihmis-ikää vastaava noin kaksi vuotta) rajoittui yhteen rotaan (1/24) ryhmissä, joille annettiin 500 mg/kg/vrk 4 tai 8 viikon ajan (noin 5,2 kertaa lasten 15 mg:n vuorokausiannos 1–11-vuotiailla lapsipotilailla, jotka painavat 30 kg tai vähemmän, AUC:n perusteella). Altistumismarginaalien perusteella sydänläppävaurion riski ei näytä olevan relevantti yhden vuoden ikäisille ja sitä vanhemmille potilaille.
Luun muutokset
Kahdeksan viikkoa kestäneessä myrkyllisyystutkimuksessa nuorilla rotilla, joiden annostus aloitettiin syntymän jälkeisenä päivänä 7, annokset olivat vähintään 100 mg/kg/vrk (2,5 kertaa lasten 15 mg:n päiväannos 1–11-vuotiaille ja 30-vuotiaille lapsille) kg tai vähemmän, AUC:n perusteella) aiheutti kasvun viivästymisen ja painonnousun heikkenemistä havaittiin jo syntymän jälkeisenä päivänä 10 (ikä vastaa vastasyntyneitä ihmisiä). Hoidon lopussa merkkejä kasvun heikkenemisestä annoksella 100 mg/kg/vrk ja suuremmilla annoksilla olivat ruumiinpainon aleneminen (14-44 % verrokkeihin verrattuna), useiden elinten absoluuttinen paino, reisiluun paino, reisiluun pituus ja kruunu. lantion pituus. Femoraalisen kasvulevyn paksuus pieneni vain miehillä ja vain annoksella 500 mg/kg/vrk. Kasvun viivästymiseen liittyvät vaikutukset säilyivät neljän viikon toipumisjakson loppuun asti. Pidemmän aikavälin tietoja ei kerätty.
Geriatrinen käyttö
PREVACIDin kliinisissä tutkimuksissa potilaiden kokonaismäärästä (n=21 486) 16 % potilaista oli vähintään 65-vuotiaita ja 4 % yli 75-vuotiaita. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet merkittäviä eroja vasteissa geriatristen ja nuorempien potilaiden välillä, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois [ks. KLIININEN FARMAKOLOGIA ].

Maksan vajaatoiminta
Potilailla, joilla oli eriasteinen krooninen maksan vajaatoiminta, lansopratsolialtistus oli suurentunut verrattuna terveisiin koehenkilöihin, joiden maksan toiminta oli normaali [ks. KLIININEN FARMAKOLOGIA ]. PREVACID- tai PREVACID SoluTab -annosta ei tarvitse muuttaa potilailla, joilla on lievä (Child-Pugh-luokka A) tai kohtalainen (Child-Pugh-luokka B) maksan vajaatoiminta. Suositeltu annos on 15 mg suun kautta päivittäin potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C) [ks. ANNOSTELU JA HALLINNOINTI ].
YLIANNOSTUS
Lansopratsoli ei poistu verenkierrosta hemodialyysillä. Yhdessä raportoidussa yliannostuksessa potilas söi 600 mg PREVACID 15 mg:aa ilman haittavaikutuksia. Suun kautta annetut lansopratsoliannokset 5 000 mg/kg asti rotilla [noin 1 300 kertaa ihmisen 30 mg:n annos kehon pinta-alan perusteella (BSA)] ja hiirillä (noin 675,7 kertaa ihmisen 30 mg:n annos BSA:n perusteella) eivät aiheuttaneet kuolemia tai mitään kliinisiä oireita.
Liiallisen altistuksen tapauksessa hoidon tulee olla oireenmukaista ja tukevaa.
Jos ilmenee liiallista altistusta, soita myrkytystietokeskukseen numeroon 1-800-222-1222 saadaksesi ajantasaista tietoa myrkytyksen tai liiallisen altistuksen hallinnasta.
VASTA-AIHEET
- PREVACID 15mg ja PREVACID 15mg SoluTab ovat vasta-aiheisia potilaille, joiden tiedetään olevan yliherkkiä jollekin valmisteen aineosalle. Yliherkkyysreaktiot voivat sisältää anafylaksia, anafylaktinen sokki, angioödeema, bronkospasmi, akuutti tubulointerstitiaalinen nefriitti ja urtikaria [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
- Protonipumpun estäjät (PPI), mukaan lukien PREVACID ja PREVACID SoluTab, ovat vasta-aiheisia rilpiviriiniä sisältävien tuotteiden kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Lisätietoja antibakteeristen aineiden (klaritromysiini ja amoksisilliini) vasta-aiheista, jotka on tarkoitettu käytettäväksi yhdessä PREVACIDin tai PREVACID 30 mg SoluTabin kanssa, katso niiden reseptitietojen kohdasta Vasta-aiheet.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Lansopratsoli kuuluu eritystä vähentävien yhdisteiden luokkaan, substituoituihin bentsimidatsoleihin, jotka estävät mahahapon eritystä estämällä spesifisesti (H+, K+)-ATPaasientsyymijärjestelmää mahalaukun parietaalisolun erityspinnalla. Koska tätä entsyymijärjestelmää pidetään parietaalisolun happo(protoni)pumppuna, lansopratsolia on luonnehdittu mahahapon pumpun estäjäksi, koska se estää hapon tuotannon viimeisen vaiheen. Tämä vaikutus on annoksesta riippuvainen ja johtaa sekä perus- että stimuloidun mahahapon erityksen estoon ärsykkeestä riippumatta. Lansopratsolilla ei ole antikolinergistä tai tyypin 2 histamiiniantagonistivaikutusta.
Farmakodynamiikka
Antisekretiivinen toiminta
Suun kautta antamisen jälkeen lansopratsolin osoitettiin vähentävän merkittävästi perushapon eritystä ja lisäävän merkittävästi mahalaukun pH:ta ja prosentteina ajasta, jolloin mahalaukun pH oli suurempi kuin kolme ja suurempi kuin neljä. Lansopratsoli vähensi myös merkittävästi aterialla stimuloimaa mahahapon eritystä ja eritystilavuutta sekä pentagastriinistimuloimaa hapon tuotantoa. Potilailla, joilla oli liiallista hapon eritystä, lansopratsoli vähensi merkitsevästi perus- ja pentagastriinistimuloimaa mahahapon eritystä. Lansopratsoli esti insuliinin aiheuttamaa normaalia erittymistilavuuden, happamuuden ja haponerityksen lisääntymistä.
Taulukossa 6 on esitetty mahalaukunsisäisen pH:n tulokset viiden päivän farmakodynaamisesta ristikkäistutkimuksesta 15 ja 30 mg kerran vuorokaudessa lansopratsolia:
Aloitusannoksen jälkeen tässä tutkimuksessa mahalaukun pH:ta havaittiin 1–2 tunnin kuluessa 30 mg:lla lansopratsolia ja 2–3 tunnissa 15 mg:lla lansopratsolia. Toistuvan päivittäisen annostelun jälkeen mahalaukun pH:ta havaittiin ensimmäisen tunnin kuluessa lansopratsolin 30 mg:n annostelusta ja 1-2 tunnin kuluessa lansopratsolin 15 mg:n annostelusta.
Hapon vähentäminen voi tehostaa mikrobilääkkeiden vaikutusta Helicobacter pylorin (H. pylori) hävittämisessä. Prosenttiosuus ajankohdasta, jolloin mahalaukun pH nousi yli viiden ja kuuden, arvioitiin ristikkäistutkimuksessa, jossa PREVACID annettiin päivittäin, kahdesti päivässä ja kolmesti päivässä (taulukko 7).
Mahahapon erittymisen esto mahalaukunsisäisellä pH:lla mitattuna palautui vähitellen normaaliksi kahdesta neljään päivään useiden annosten jälkeen. Mitään merkkejä mahalaukun happamuuden palautumisesta ei ollut.
Enterokromafiinia muistuttavat (ECL) soluvaikutukset
Rottien elinikäisen altistuksen aikana, kun lansopratsolia annettiin enintään 150 mg/kg/vrk seitsemänä päivänä viikossa, havaittiin huomattavaa hypergastrinemiaa, jota seurasi ECL-solujen proliferaatio ja karsinoidikasvainten muodostuminen, erityisesti naarasrotilla. Noin 150 potilaalta, joita hoidettiin jatkuvasti lansopratsolilla vähintään vuoden ajan, mahalaukun biopsianäytteet eivät osoittaneet samanlaisia ECL-soluvaikutuksia kuin rottatutkimuksissa. Pitemmän aikavälin tietoja tarvitaan, jotta voidaan sulkea pois mahalaukun kasvainten kehittymisriskin mahdollisuus potilailla, jotka saavat pitkäaikaista lansopratsolihoitoa [ks. Ei-kliininen toksikologia ].
Muut mahavaikutukset ihmisillä
Lansopratsoli ei vaikuttanut merkittävästi limakalvon verenkiertoon mahanpohjassa. Mahahapon erittymisen eston aiheuttaman normaalin fysiologisen vaikutuksen vuoksi veren virtaus pieneni noin 17 % antrumissa, pyloruksessa ja pohjukaissuolen sipulissa. Lansopratsoli hidasti merkittävästi sulavan kiintoaineen mahalaukun tyhjenemistä. Lansopratsoli lisäsi seerumin pepsinogeenitasoja ja vähensi pepsiiniaktiivisuutta perusolosuhteissa ja vasteena aterian stimulaatioon tai insuliinin injektioon. Kuten muidenkin mahalaukun pH:ta nostavien aineiden kohdalla, mahalaukun pH:n nousu liittyi nitraattia vähentävien bakteerien lisääntymiseen ja mahahaavapotilaiden mahanesteen nitriittipitoisuuden nousuun. Nitrosamiinipitoisuuksissa ei havaittu merkittävää nousua.
Seerumin gastriinivaikutukset
Yli 2 100 potilaalla seerumin gastriinipitoisuuden paasto nousi 50–100 % lähtötasosta, mutta pysyi normaalialueella 15–60 mg:n oraalisen lansopratsolihoidon jälkeen. Nämä nousut saavuttivat tasanteen kahden kuukauden kuluessa hoidosta ja palasivat hoitoa edeltäneelle tasolle neljän viikon kuluessa hoidon lopettamisesta.
Lisääntynyt gastriini aiheuttaa enterokromafiinia muistuttavaa solujen liikakasvua ja kohonneita seerumin CgA-tasoja. Kohonneet CgA-tasot voivat aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa [katso VAROITUKSET JA VAROTOIMET ].
Endokriiniset vaikutukset
Enintään vuoden kestäneissä ihmisillä tehdyissä tutkimuksissa ei ole havaittu kliinisesti merkittäviä vaikutuksia hormonitoimintaan. Tutkittuja hormoneja ovat testosteroni, luteinisoiva hormoni (LH), follikkelia stimuloiva hormoni (FSH), sukupuolihormoneja sitova globuliini (SHBG), dehydroepiandrosteronisulfaatti (DHEA-S), prolaktiini, kortisoli, estradioli, insuliini, aldosteroni, parathormoni, glukagoni, kilpirauhasta stimuloiva hormoni (TSH), trijodityroniini (T3), tyroksiini (T4) ja somatotrooppinen hormoni (STH). Lansopratsoli 15–60 mg:n suun kautta enintään vuoden ajan ei vaikuttanut kliinisesti merkitsevästi seksuaaliseen toimintaan. Lisäksi lansopratsolilla ei ollut kliinisesti merkitsevää vaikutusta kilpirauhasen toimintaan suun kautta annetulla 15–60 mg:n annoksilla 2–8 viikon ajan. 24 kuukautta kestäneissä karsinogeenisuustutkimuksissa Sprague-Dawley-rotilla lansopratsolin päivittäisillä annoksilla 150 mg/kg asti, proliferatiiviset muutokset kivesten Leydig-soluissa, mukaan lukien hyvänlaatuiset kasvaimet, lisääntyivät vertailurottioihin verrattuna.
Muut tehosteet
Lansopratsolilla ei ole havaittu systeemisiä vaikutuksia keskushermostoon, imusolmukkeisiin, hematopoieettisiin, munuais-, maksa-, sydän- ja verisuoni- tai hengityselimiin ihmisillä. Niillä 56 potilaalla, joille tehtiin laajat lähtötilanteen silmätutkimukset, ei havaittu visuaalista toksisuutta lansopratsolihoidon (enintään 180 mg/vrk) jälkeen 58 kuukauden ajan. Elinikäisen lansopratsolialtistuksen jälkeen rotilla havaittiin fokaalista haiman surkastumista, diffuusia lymfaattista hyperplasiaa kateenkorvassa ja spontaania verkkokalvon surkastumista.
Farmakokinetiikka
Imeytyminen
PREVACID 15mg ja PREVACID SoluTab sisältävät enteropäällysteisen lansopratsolin raeformulaatiota (koska lansopratsoli on happolabiili), joten lansopratsolin imeytyminen alkaa vasta rakeiden poistuttua mahasta. Lansopratsolin keskimääräiset huippupitoisuudet plasmassa saavutetaan noin 1,7 tunnin kuluttua. Kun lansopratsolia oli annettu 15–60 mg:n kerta-annos suun kautta, lansopratsolin huippupitoisuudet plasmassa (Cmax) ja lansopratsolin plasmapitoisuuskäyrien alla oleva pinta-ala (AUC:t) olivat suunnilleen verrannollisia annettuun annokseen. Lansopratsoli ei keräänty, eikä sen farmakokinetiikka muutu useilla annostuksilla. Absoluuttinen hyötyosuus on yli 80 %. Terveillä koehenkilöillä keskimääräinen (±SD) puoliintumisaika plasmassa oli 1,5 (±1,0) tuntia. Sekä Cmax että AUC pienenevät noin 50–70 %, jos lansopratsoli annetaan 30 minuuttia ruokailun jälkeen, verrattuna paastotilaan. Ruoalla ei ole merkittävää vaikutusta, jos lansopratsoli annetaan ennen ateriaa.
Jakelu
Lansopratsoli sitoutuu 97 % plasman proteiineihin. Sitoutuminen plasman proteiineihin on vakio 0,05 - 5 mikrog/ml konsentraatioalueella.
Eliminointi
Aineenvaihdunta
Lansopratsoli metaboloituu laajalti maksassa. Plasmasta on tunnistettu kaksi metaboliittia mitattavissa määrin (lansopratsolin hydroksyloidut sulfinyyli- ja sulfonijohdannaiset). Näillä metaboliiteilla on hyvin vähän tai ei ollenkaan eritystä estävää vaikutusta. Lansopratsolin uskotaan muuntuvan kahdeksi aktiiviseksi lajiksi, jotka estävät hapon eritystä estämällä protonipumpun [(H+, K+)-ATPaasientsyymijärjestelmä] mahalaukun parietaalisolun erityspinnalla. Näitä kahta aktiivista lajia ei ole läsnä systeemisessä verenkierrossa. Lansopratsolin eliminaation puoliintumisaika plasmassa on alle kaksi tuntia, kun taas happoa estävä vaikutus kestää yli 24 tuntia. Siksi lansopratsolin plasman eliminaation puoliintumisaika ei heijasta sen mahahapon erittymisen suppression kestoa.
Erittyminen
Kun kerta-annos PREVACIDia annettiin suun kautta, lansopratsolia ei käytännössä erittynyt virtsaan muuttumattomana. Eräässä tutkimuksessa 14-klansopratsolin kerta-annoksen jälkeen noin kolmasosa annetusta säteilystä erittyi virtsaan ja kaksi kolmasosaa ulosteisiin. Tämä tarkoittaa lansopratsolin metaboliittien merkittävää erittymistä sappeen.
Tietyt populaatiot
Pediatriset potilaat
Yhdestä 17 vuoden ikään
Lansopratsolin farmakokinetiikkaa tutkittiin kahdessa erillisessä kliinisessä tutkimuksessa 1–11-vuotiailla ja 12–17-vuotiailla lapsipotilailla, joilla oli GERD. 1–11-vuotiaille lapsille lansopratsolia annettiin 15 mg vuorokaudessa ≤30 kg painaville koehenkilöille ja 30 mg vuorokaudessa yli 30 kg painaville. Keskimääräiset Cmax- ja AUC-arvot, jotka havaittiin 5. annostuspäivänä, olivat samankaltaisia kahdessa annosryhmässä, eikä paino tai ikä vaikuttanut niihin kussakin tutkimuksessa käytetyssä painon mukaan säädetyssä annosryhmässä. 12–17-vuotiailla nuorilla koehenkilöt satunnaistettiin saamaan lansopratsolia 15 tai 30 mg päivässä. Ruumiinpaino tai ikä eivät vaikuttaneet lansopratsolin keskimääräisiin Cmax- ja AUC-arvoihin; ja lähes annokseen suhteutettuja nousuja keskimääräisissä Cmax- ja AUC-arvoissa havaittiin kahden annosryhmän välillä tutkimuksessa. Kaiken kaikkiaan lansopratsolin farmakokinetiikka 1–17-vuotiailla lapsipotilailla oli samanlainen kuin terveillä aikuisilla.
Geriatriset potilaat
Lansopratsolin puhdistuma on hidastunut vanhuksilla, ja eliminaation puoliintumisaika pitenee noin 50-100 %. Koska keskimääräinen puoliintumisaika vanhuksilla on 1,9-2,9 tuntia, toistuva kerran vuorokaudessa annostelu ei johda lansopratsolin kertymiseen. Plasman huippupitoisuudet eivät nousseet vanhuksilla [katso Käyttö tietyissä populaatioissa ].
Mies- ja naispotilaat
Tutkimuksessa, jossa verrattiin 12 miespuolista ja kuutta naispuolista ihmistä, jotka saivat lansopratsolia, ei havaittu sukupuoleen liittyviä eroja farmakokinetiikassa ja mahalaukun pH-tuloksissa.
Rotu- tai etniset ryhmät
PREVACIDin yhdistettyjä keskimääräisiä farmakokineettisiä parametreja kahdestatoista Yhdysvalloissa tehdystä tutkimuksesta (N=513) verrattiin kahden aasialaisen tutkimuksen (N=20) keskimääräisiin farmakokineettisiin parametreihin. PREVACID 30 mg:n keskimääräiset AUC-arvot aasialaisilla koehenkilöillä olivat noin kaksi kertaa suuremmat kuin yhdistetyissä USA:n tiedoissa; yksilöiden välinen vaihtelu oli kuitenkin suurta. Cmax-arvot olivat vertailukelpoisia.
Potilaat, joilla on munuaisten vajaatoiminta
Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla sitoutuminen plasman proteiineihin väheni 1–1,5 % 60 mg:n lansopratsoliannoksen jälkeen. Potilailla, joilla oli munuaisten vajaatoiminta, eliminaation puoliintumisaika lyheni ja kokonais-AUC (vapaa ja sitoutunut) pieneni. Vapaan lansopratsolin AUC-arvo plasmassa ei kuitenkaan liittynyt munuaisten vajaatoiminnan asteeseen; ja Cmax ja Tmax (aika maksimipitoisuuden saavuttamiseen) eivät eronneet Cmax- ja Tmax-arvoista potilailla, joiden munuaistoiminta oli normaali. Siksi lansopratsolin farmakokinetiikka ei ollut kliinisesti erilainen potilailla, joilla oli lievä, kohtalainen tai vaikea munuaisten vajaatoiminta, verrattuna terveisiin koehenkilöihin, joiden munuaisten toiminta oli normaali.
Potilaat, joilla on maksan vajaatoiminta
Potilailla, joilla oli lievä (Child-Pugh luokka A) tai keskivaikea (Child-Pugh luokka B) maksan vajaatoiminta, keskimääräinen AUC kasvoi noin kolminkertaiseksi verrattuna terveisiin koehenkilöihin, joiden maksan toiminta oli normaali, toistuvien suun kautta otettavien 30 mg PREVACID 30 mg:n annosten jälkeen. seitsemän päivän ajan. Lansopratsolin vastaava keskimääräinen puoliintumisaika plasmassa pidentyi 1,5 tunnista neljään tuntiin (Child-Pugh A) tai viiteen tuntiin (Child-Pugh B).
Potilailla, joilla oli kompensoitunut kirroosi ja dekompensoitunut kirroosi, AUC oli noin 6-kertainen ja vastaavasti 5-kertainen verrattuna terveisiin koehenkilöihin, joiden maksan toiminta oli normaali, 30 mg:n PREVACID-kerta-annoksen jälkeen [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
Lansopratsolin vaikutus muihin lääkkeisiin
Sytokromi P450 -vuorovaikutukset
Lansopratsoli metaboloituu sytokromi P450 -järjestelmän, erityisesti CYP3A- ja CYP2C19-isoentsyymien kautta. Tutkimukset ovat osoittaneet, että PREVACID 15 mg:lla ei ole kliinisesti merkittäviä yhteisvaikutuksia muiden sytokromi P450 -järjestelmän kautta metaboloituvien lääkkeiden, kuten varfariinin, antipyriinin, indometasiinin, ibuprofeenin, fenytoiinin, propranololin, prednisonin, diatsepaamin tai klaritromysiinin kanssa terveillä koehenkilöillä. Nämä yhdisteet metaboloituvat useiden sytokromi P450-isoentsyymien kautta, mukaan lukien CYP1A2, CYP2C9, CYP2C19, CYP2D6 ja CYP3A.
Teofylliini
Kun PREVACID 30 mg annettiin samanaikaisesti teofylliinin (CYP1A2, CYP3A) kanssa, teofylliinin puhdistuma lisääntyi hieman (10 %). Teofylliinin puhdistumaan kohdistuvan vaikutuksen pienen suuruuden ja suunnan vuoksi tällä yhteisvaikutuksella ei todennäköisesti ole kliinistä huolta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Metotreksaatti ja 7-hydroksimetotreksaatti
Avoimessa, yksihaaraisessa, kahdeksan päivän farmakokineettisessä tutkimuksessa, johon osallistui 28 aikuista nivelreumapotilasta (jotka vaativat pitkäaikaista 7,5–15 mg metotreksaattia viikossa annettuna), 7 päivän ajan naprokseenia 500 mg kahdesti vuorokaudessa ja PREVACIDia. 30 mg:lla päivässä ei ollut vaikutusta metotreksaatin ja 7-hydroksimetotreksaatin farmakokinetiikkaan. Vaikka tätä tutkimusta ei suunniteltu arvioimaan tämän lääkeyhdistelmän turvallisuutta, merkittäviä haittavaikutuksia ei havaittu. Tämä tutkimus tehtiin kuitenkin pienillä metotreksaattiannoksilla. Lääkkeiden yhteisvaikutustutkimusta suurilla metotreksaattiannoksilla ei ole tehty [katso VAROITUKSET JA VAROTOIMET ].
Amoksisilliini
PREVACID 30 mg:lla ei myöskään ole osoitettu olevan kliinisesti merkitseviä yhteisvaikutuksia amoksisilliinin kanssa.
Sukralfaatti
Kerta-annostutkimuksessa, jossa tarkasteltiin PREVACID 30 mg:a yksin annettuna ja samanaikaisesti 1 gramman sukralfaatin kanssa, lansopratsolin imeytyminen viivästyi ja biologinen hyötyosuus pieneni 17 %, kun sitä annettiin samanaikaisesti sukralfaatin kanssa [ks. ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET ].
Antasidit
Kliinisissä tutkimuksissa antasideja annettiin samanaikaisesti PREVACID 15 mg:n kanssa, eikä näyttöä PREVACIDin tehon muuttamisesta havaittu.
Klopidogreeli
Klopidogreeli metaboloituu aktiiviseksi metaboliitiksi osittain CYP2C19:n välityksellä. Suoritettiin tutkimus terveillä koehenkilöillä, jotka olivat CYP2C19:n nopeita metaboloijia ja saivat kerran vuorokaudessa klopidogreelia 75 mg yksinään tai samanaikaisesti PREVACID 30 mg:n kanssa (n=40) yhdeksän päivän ajan. Klopidogreelin aktiivisen metaboliitin keskimääräinen AUC pieneni noin 14 % (keskimääräinen AUC-suhde oli 86 % ja 90 % luottamusväli 80-92 %), kun PREVACIDia annettiin samanaikaisesti verrattuna pelkän klopidogreelin antamiseen.
Myös farmakodynaamiset parametrit mitattiin ja osoitettiin, että muutos verihiutaleiden aggregaation estämisessä (5 mcM ADP:n aiheuttama) liittyi muutokseen altistuksessa klopidogreelin aktiiviselle metaboliitille. Vaikutusta klopidogreelin aktiiviselle metaboliitille altistumiseen ja klopidogreelin aiheuttamaan verihiutaleiden estoon ei pidetä kliinisesti tärkeänä.
Muiden lääkkeiden vaikutus lansopratsoliin
Koska lansopratsoli metaboloituu CYP2C19:n ja CYP3A4:n välityksellä, näiden entsyymien induktorit ja estäjät voivat mahdollisesti muuttaa lansopratsolialtistusta.
Mikrobiologia
Mikrobiologia
Lansopratsolin, klaritromysiinin ja/tai amoksisilliinin on osoitettu olevan aktiivisia useimpia Helicobacter pylori -kantoja vastaan in vitro ja kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Helicobacter Pylori esikäsittelyresistenssi
Klaritromysiiniresistenssi esikäsittelyä varten (≥2,0 mcg/ml) oli 9,5 % (91/960) E-testillä ja 11,3 % (12/106) agar-laimennuksella kaksois- ja kolmoishoidon kliinisissä tutkimuksissa (M93-125, M93-130, M93131, M95-392 ja M95-399).
Amoksisilliinille herkkiä isolaatteja (≤0,25 mcg/ml) esiintyi 97,8 %:lla (936/957) ja 98,0 %:lla (98/100) potilaista kliinisissä kaksois- ja kolmoishoitotutkimuksissa E-testillä ja agarlaimennuksella. Kahdellakymmenelläyhdellä 957 potilaasta (2,2 %) E-testillä ja kahdella 100 potilaasta (2,0 %) agarlaimennuksella oli amoksisilliinin esikäsittelyn MIC-arvot yli 0,25 mcg/ml. Yhdellä potilaalla, joka käytti 14 päivän kolminkertaista hoito-ohjelmaa, oli vahvistamaton amoksisilliinin minimiinhiboiva pitoisuus (MIC) ennen hoitoa yli 256 mcg/ml E-testillä ja potilaalta hävitettiin H. pylori (taulukko 8).
Potilailla, joita ei ole hävitetty H. pyloria lansopratsoli/amoksisilliini/klaritromysiini-kolmoishoidon jälkeen, on todennäköisesti klaritromysiiniresistentti H. pylori. Siksi niille potilaille, joiden hoito epäonnistuu, klaritromysiiniherkkyystesti tulee tehdä mahdollisuuksien mukaan. Potilaita, joilla on klaritromysiiniresistentti H. pylori, ei tule hoitaa lansopratsoli/amoksisilliini/klaritromysiini-kolmoishoidolla tai sellaisilla hoito-ohjelmilla, joissa klaritromysiini on ainoa antimikrobinen lääke.
Amoksisilliiniherkkyystestin tulokset ja kliiniset/bakteriologiset tulokset
Kaksi- ja kolmoishoitoa koskevissa kliinisissä tutkimuksissa 82,6 %:lta (195/236) potilaista, joilla oli ennen hoitoa amoksisilliinille herkkä MIC-arvo (≤0,25 mcg/ml), hävitettiin H. pylori. Niistä, joiden amoksisilliinin MIC-arvo ennen hoitoa oli yli 0,25 mcg/ml, kolmella kuudesta H. pylori oli hävitetty. Yhteensä 30 %:lla (21/70) potilaista lansopratsoli 30 mg kolmesti vuorokaudessa/amoksisilliini 1 g kolmesti vuorokaudessa kaksoishoito epäonnistui ja yhteensä 12,8 % (22/172) potilaista epäonnistui 10 ja 14 päivän kolminkertaisessa hoidossa. hoito-ohjelmat. Hoidon jälkeisiä herkkyystuloksia ei saatu 11 potilaalta, joiden hoito epäonnistui. Yhdeksällä niistä 11 potilaasta, joilla oli amoksisilliinin MIC-arvot hoidon jälkeen ja jotka epäonnistuivat kolmoishoito-ohjelmassa, oli myös klaritromysiiniresistenttejä H. pylori-isolaatteja.
Herkkyystesti Helicobacter pylorille
Lisätietoja Helicobacter pylorin herkkyystestauksesta on kohdassa Mikrobiologiaosio klaritromysiinin ja amoksisilliinin reseptiohjeissa .
Kliiniset tutkimukset
Pohjukaissuolihaava
Yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, annos-vastetutkimuksessa (15, 30 ja 60 mg PREVACIDia kerran vuorokaudessa), johon osallistui 284 potilasta, joilla oli endoskooppisesti dokumentoitu pohjukaissuolihaava, kahden ja neljän viikon jälkeen parantuneiden potilaiden prosenttiosuus oli huomattavasti korkeampi kaikilla PREVACID-annoksilla kuin lumelääkettä käytettäessä. Ei ollut näyttöä suuremmasta tai aikaisemmasta vasteesta kahdella suuremmalla annoksella verrattuna PREVACID 15 mg:aan. Tämän tutkimuksen ja alla kuvatun toisen tutkimuksen perusteella PREVACID 15 mg:n suositeltu annos pohjukaissuolihaavaan on 15 mg päivässä (taulukko 9).
PREVACID 15 mg oli lumelääkettä huomattavasti tehokkaampi vähentämään päivä- ja yöperäistä vatsakipua ja vähentämään päivässä otettavan antasidin määrää.
Toisessa yhdysvaltalaisessa monikeskustutkimuksessa, myös kaksoissokkoutetussa, lumekontrolloidussa, annosvertailussa (15 ja 30 mg PREVACIDia 15 mg kerran vuorokaudessa) ja vertailu ranitidiiniin, 280 potilaalla, joilla oli endoskooppisesti dokumentoitu pohjukaissuolihaava. Neljän viikon jälkeen parantuneiden potilaiden määrä oli merkittävästi korkeampi molemmilla PREVACID 15 mg -annoksilla kuin lumelääkettä saaneilla. Ei ollut näyttöä suuremmasta tai aikaisemmasta vasteesta suuremmalla PREVACID-annoksella. Vaikka PREVACIDin 15 mg:n annos oli parempi kuin ranitidiini neljän viikon kohdalla, merkitsevän eron puuttuminen kahdessa viikossa ja eron puuttuminen 30 mg:n PREVACIDin ja ranitidiinin välillä jättää näiden kahden aineen vertailun tehokkuuden määrittelemättä (taulukko 10). katso KÄYTTÖAIHEET JA KÄYTTÖ ].
H. pylorin hävittäminen pohjukaissuolihaavan uusiutumisen riskin vähentämiseksi
Yhdysvalloissa tehdyissä satunnaistetuissa kaksoissokkoutetuissa kliinisissä tutkimuksissa potilailla, joilla oli helikobakteeri ja pohjukaissuolihaava (määritelty aktiiviseksi haavaksi tai haavaksi yhden vuoden sisällä), arvioitiin PREVACIDin tehokkuus yhdessä amoksisilliinin ja klaritromysiinin kanssa kolminkertaisena 14 päivähoitoa tai yhdessä amoksisilliinin kanssa 14 päivän kaksoishoitona H. pylorin hävittämiseen. Näiden tutkimusten tulosten perusteella määritettiin kahden erilaisen hävittämisohjelman turvallisuus ja teho:
Kolminkertainen terapia : PREVACID 30 mg kahdesti vuorokaudessa / amoksisilliini 1 g kahdesti vuorokaudessa / klaritromysiini 500 mg kahdesti vuorokaudessa
Kaksoisterapia : PREVACID 30 mg kolme kertaa päivässä/amoksisilliini 1 g kolme kertaa päivässä
Kaikki hoidot kestivät 14 päivää. H. pylorin hävittäminen määriteltiin kahdeksi negatiiviseksi kokeeksi (viljely ja histologia) neljästä kuuteen viikkoa hoidon päättymisen jälkeen.
Kolmoisterapian osoitettiin olevan tehokkaampi kuin kaikki mahdolliset kaksoishoitoyhdistelmät. Kaksoishoito osoittautui tehokkaammaksi kuin molemmat monoterapiat. H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
Yhdysvalloissa tehdyssä satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa potilailla, joilla oli helikobakteeri ja pohjukaissuolihaava (määritelty aktiiviseksi haavaksi tai haavaksi aiemman vuoden sisällä), verrattiin PREVACID-kolmoishoidon tehoa 10 ja 14 päivän ajan. Tämä tutkimus vahvisti, että 10 päivän kolmoishoito vastasi 14 päivän kolmoishoitoa H. pylorin hävittämisessä (taulukot 11 ja 12) [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Parantuneiden pohjukaissuolihaavojen ylläpito
PREVACIDin on osoitettu estävän pohjukaissuolihaavojen uusiutumista. Kaksi riippumatonta, kaksoissokkoutettua monikeskustutkimusta suoritettiin potilailla, joilla oli endoskooppisesti varmistettu parantunut pohjukaissuolihaava. Potilaat paranivat merkittävästi pidempään ja pohjukaissuolihaavojen uusiutumisten määrä oli merkittävästi pienempi potilailla, joita hoidettiin PREVACID 15 mg:lla kuin potilailla, joita hoidettiin lumelääkettä 12 kuukauden ajan (taulukko 13) [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Kokeessa 2 ei havaittu merkitsevää eroa PREVACID 15:n ja 30 mg:n välillä remission ylläpitämisessä.
Mahahaava
Yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 253 potilaalla, joilla oli endoskooppisesti dokumentoitu mahahaava, neljän ja kahdeksan viikon kohdalla parantuneiden potilaiden prosenttiosuus oli merkitsevästi korkeampi, kun PREVACID 15 ja 30 mg kerran vuorokaudessa saivat kuin lumelääke (taulukko 14). ) [katso KÄYTTÖAIHEET JA KÄYTTÖ ].
Potilaat, joita hoidettiin millä tahansa PREVACID-annoksella, ilmoittivat merkitsevästi vähemmän päivä- ja yöperäistä vatsakipua sekä vähemmän antasideja ja vähemmän antasiditabletteja päivässä kuin lumeryhmässä.
PREVACID 30 mg:n tehokkuuden riippumaton näyttö saatiin julkaistujen ja julkaisemattomien tietojen meta-analyysillä.
NSAID-lääkkeisiin liittyvän mahahaavan paraneminen
Kahdessa yhdysvaltalaisessa ja kanadalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, aktiivisesti kontrolloidussa tutkimuksessa potilailla, joilla oli endoskooppisesti varmistettu tulehduskipulääkkeisiin liittyvä mahahaava ja jotka jatkoivat tulehduskipulääkkeiden käyttöä, kahdeksan viikon jälkeen parantuneiden potilaiden prosenttiosuus oli tilastollisesti merkitsevästi korkeampi 30 mg:lla PREVACIDia kuin saaneilla potilailla. aktiivinen ohjaus. Tutkimukseen otettiin yhteensä 711 potilasta, ja 701 potilasta hoidettiin. Potilaiden ikä vaihteli 18–88-vuotiaista (mediaani-ikä 59 vuotta), joista 67 % oli naispotilaita ja 33 % miespotilaita. Rotu jakautui seuraavasti: 87 % valkoihoisia, 8 % mustia, 5 % muita. PREVACID 30 mg vuorokausiannoksen ja aktiivisen kontrollin välillä ei ollut tilastollisesti merkitsevää eroa oireiden (eli vatsakivun) lievittämisessä (taulukko 15) [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
NSAID-lääkkeisiin liittyvän mahahaavan riskin vähentäminen
Yhdessä suuressa yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, lumelääke- ja misoprostolikontrolloidussa (misoprostolisokkoutettuna vain endoskopistille) tutkimuksessa potilailla, jotka tarvitsivat kroonista tulehduskipulääkkeen käyttöä ja joilla on ollut endoskooppisesti dokumentoitu mahahaava. potilaiden mahahaava neljän, kahdeksan ja 12 viikon kohdalla oli merkitsevästi suurempi 15 tai 30 mg:lla PREVACID 15 mg:lla kuin lumelääkkeellä. Tutkimukseen otettiin yhteensä 537 potilasta, ja 535 potilasta hoidettiin. Potilaiden ikä vaihteli välillä 23-89 vuotta (mediaani-ikä 60 vuotta), joista 65 % oli naispotilaita ja 35 % miehiä. Rotu jakautui seuraavasti: 90 % valkoihoisia, 6 % mustia, 4 % muita. PREVACIDin 30 mg:n annos ei osoittanut lisähyötyä tulehduskipulääkkeisiin liittyvän mahahaavan riskin vähentämisessä kuin 15 mg:n annos (taulukko 16) [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Oireinen gastroesofageaalinen refluksitauti (GERD)
Oireinen GERD
Yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 214 potilaalla, joilla oli toistuvia GERD-oireita, mutta ei ruokatorven eroosiota endoskopian perusteella, GERD:hen liittyvä närästys helpottui merkittävästi paremmin, kun lansopratsolia annettiin 15 mg kerran päivässä kahdeksaan asti. viikkoa kuin lumelääkkeellä. Lansopratsolin 30 mg kerran vuorokaudessa annoksilla ei havaittu merkittävää lisähyötyä.
Intent-to-treat -analyysit osoittivat, että päivä- ja yönärästyksen esiintymistiheys ja vaikeusaste vähenivät merkittävästi. Tiedot yleisyydestä ja vaikeusasteesta kahdeksan viikon hoitojakson aikana on esitetty taulukossa 17 ja kuvissa 1 ja 2:
Kuva 1: Päivän närästyksen keskimääräinen vaikeusaste arvioitavissa olevilla potilailla tutkimuspäivinä (3 = vaikea, 2 = kohtalainen, 1 = lievä, 0 = ei mitään)
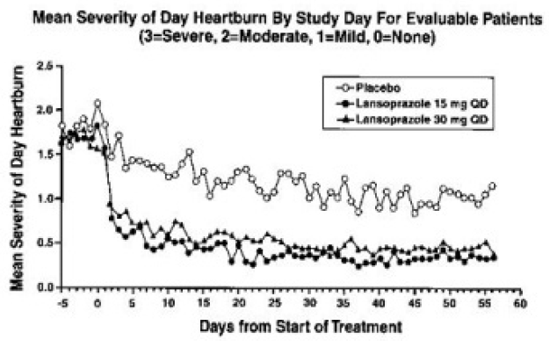
Kuva 2: Yönärästyksen keskimääräinen vakavuus tutkimuspäivänä arvioitavilla potilailla (3 = vaikea, 2 = kohtalainen, 1 = lievä, 0 = ei mitään)
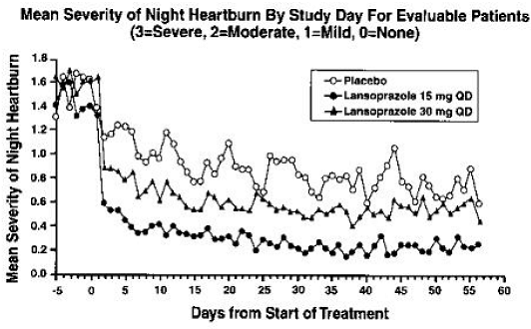
Kahdessa yhdysvaltalaisessa monikeskustutkimuksessa, ranitidiinikontrolloidussa kaksoissokkoutetussa tutkimuksessa, joihin osallistui yhteensä 925 potilasta, joilla oli usein GERD-oireita, mutta ei ruokatorven eroosiota endoskopian mukaan, lansopratsoli 15 mg oli parempi kuin ranitidiini 150 mg (kahdesti vuorokaudessa) vähentäen vuorokauden esiintymistiheyttä ja vaikeutta. ja GERD:hen liittyvä yönärästys kahdeksan viikon hoitojakson ajan. Lansopratsolista 30 mg kerran vuorokaudessa ei havaittu merkittävää lisähyötyä [ks KÄYTTÖAIHEET JA KÄYTTÖ ].
Erosiivinen esofagiitti
Yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa, johon osallistui 269 potilasta, joilla oli endoskooppinen esofagiittidiagnoosi, jonka limakalvon luokitus on vähintään kaksi ja asteet 3 ja 4, jotka tarkoittivat erosiivista sairautta, parantuneiden potilaiden prosenttiosuudet on esitetty taulukossa. 18:
Tässä tutkimuksessa kaikki PREVACID-ryhmät ilmoittivat huomattavasti helpommin närästyksen ja vähemmän päivä- ja yövatsakipuja sekä vähemmän antasidin päiviä ja vähemmän antasiditabletteja päivässä kuin lumeryhmässä. Vaikka kaikki annokset olivat tehokkaita, kahden suuremman annoksen aikaisempi paraneminen ehdottaa 30 mg:n päivittäistä suositusta.
PREVACIDia verrattiin myös yhdysvaltalaisessa, monikeskustutkimuksessa, kaksoissokkotutkimuksessa pieneen ranitidiiniannokseen 242 potilaalla, joilla oli eroosiivinen refluksiesofagiitti. PREVACID annoksella 30 mg oli merkittävästi tehokkaampi kuin ranitidiini 150 mg kahdesti vuorokaudessa, kuten alla esitetään (taulukko 19).
Lisäksi PREVACID 30 mg:lla hoidetut potilaat ilmoittivat vähemmän päivä- ja yönärästystä ja söivät vähemmän antasiditabletteja harvemmin kuin potilaat, jotka ottivat ranitidiinia 150 mg kahdesti vuorokaudessa.
Vaikka tämä tutkimus osoittaa PREVACID 15 mg:n tehokkuuden erosiivisen esofagiitin parantamisessa, se ei ole riittävä vertailu ranitidiiniin, koska suositeltu ranitidiiniannos ruokatorven tulehdukseen on 150 mg neljä kertaa päivässä, kaksi kertaa tässä tutkimuksessa käytetty annos.
Kahdessa kuvatussa tutkimuksessa ja useissa pienemmissä tutkimuksissa, joihin osallistui potilaita, joilla oli kohtalainen tai vaikea erosiivinen ruokatorvitulehdus, PREVACID tuotti samanlaisia paranemisnopeuksia kuin yllä on esitetty.
Yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa, aktiivikontrolloidussa tutkimuksessa 30 mg PREVACID 30 mg:aa verrattiin ranitidiiniin 150 mg kahdesti vuorokaudessa 151 potilaalla, joilla oli eroosiivinen refluksiesofagiitti, joka reagoi huonosti vähintään 12 viikon hoitoon vähintään yksi H2-reseptorin salpaaja annettuna annoksena, joka on osoitettu oireiden lievittämiseksi tai suuremmalla, nimittäin simetidiinillä 800 mg/vrk, ranitidiinilla 300 mg/vrk, famotidiinilla 40 mg/vrk tai nitsatidiinilla 300 mg/vrk. PREVACID 30 mg oli tehokkaampi kuin ranitidiini 150 mg kahdesti vuorokaudessa parantuvan refluksiesofagiitin hoidossa, ja parantuneiden potilaiden prosenttiosuus oli seuraava. Tässä tutkimuksessa ei verrata histamiini H2-reseptoriantagonistien tehokkuutta PREVACID 30 mg:aan, koska kaikki potilaat eivät olleet reagoineet histamiini H2-reseptoriantagonistihoitoon. Se osoittaa kuitenkin, että PREVACID 30 mg voi olla hyödyllinen potilaille, jotka eivät saa histamiini-H2-reseptorin antagonistia (taulukko 20) [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Erosiivisen esofagiitin paranemisen ylläpito
Kaksi riippumatonta, kaksoissokkoutettua, monikeskus-kontrolloitua tutkimusta suoritettiin potilailla, joilla oli endoskooppisesti varmistettu parantunut esofagiitti. Potilaat pysyivät remissiossa merkittävästi pidempään ja erosiivisen ruokatorven uusiutumisen määrä oli merkitsevästi pienempi potilailla, joita hoidettiin PREVACID 30 mg:lla kuin potilailla, joita hoidettiin lumelääkettä 12 kuukauden ajan (taulukko 21).
Erosiivisen esofagiitin alkuasteesta riippumatta PREVACID 15 ja 30 mg olivat samanlaisia remission ylläpitämisessä.
Yhdysvaltalaisessa satunnaistetussa kaksoissokkotutkimuksessa PREVACID 15 mg vuorokaudessa (n = 100) verrattiin ranitidiiniin 150 mg kahdesti vuorokaudessa (n = 106) suositellulla annoksella potilailla, joilla oli endoskooppisesti todettu parantunut erosiivinen ruokatorvitulehdus yli vuoden ajan. 12 kuukauden ajanjakso. Hoito PREVACID 15 mg:lla johti siihen, että potilaat paranivat (asteen 0 leesiot) erosiivisesta ruokatorvitulehduksesta merkittävästi pidempään kuin ranitidiinilla hoidetut (p KÄYTTÖAIHEET JA KÄYTTÖ ].
Patologiset liikaeritystilat mukaan lukien Zollinger-Ellisonin oireyhtymä
Avoimissa tutkimuksissa 57 potilaalla, joilla oli patologisia liikaerityssairauksia, kuten Zollinger-Ellisonin oireyhtymä (ZES), johon liittyy useita endokriinisiä adenoomia tai ilman niitä, PREVACID 15 mg esti merkittävästi mahahapon eritystä ja kontrolloi niihin liittyviä ripulin, ruokahaluttomuuden ja kivun oireita. Annokset, jotka vaihtelivat 15 mg:sta joka toinen päivä - 180 mg:aan vuorokaudessa, pitivät perushapon erityksen alle 10 mekvivalenttitunnissa potilailla, joilla ei ollut aikaisemmin mahaleikkausta, ja alle 5 mekvivalenttia/h potilailla, joilla oli aiemmin mahaleikkaus.
Alkuannokset titrattiin potilaan yksilöllisen tarpeen mukaan, ja säädöt olivat tarpeen ajan myötä joillakin potilailla [ks. ANNOSTELU JA HALLINNOINTI ]. PREVACID oli hyvin siedetty näillä suurilla annoksilla pitkiä aikoja (joillakin potilailla yli neljä vuotta). Useimmilla ZES-potilailla PREVACID ei muuttanut seerumin gastriinipitoisuutta. Kuitenkin joillakin potilailla seerumin gastriini nousi tasolle, joka oli suurempi kuin ennen lansopratsolihoidon aloittamista [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
POTILASTIEDOT
PREVACID (prev-a-sid) (lansopratsoli) viivästyttävästi vapautuvat kapselit, suun kautta käytettäväksi ja
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansopratsoli) viivästetysti vapautuvat suun kautta hajoavat tabletit
Mikä on tärkein tieto, joka minun pitäisi tietää PREVACIDista ja PREVACID 15mg SoluTabista?
Sinun tulee ottaa PREVACID ja PREVACID 15 mg SoluTab täsmälleen määräyksen mukaisesti, pienimmällä mahdollisella annoksella ja lyhyimmän tarvittavan ajan.
PREVACID ja PREVACID SoluTab voivat auttaa happoon liittyviä oireitasi, mutta sinulla voi silti olla vakavia vatsavaivoja.
Keskustele lääkärisi kanssa. PREVACID 30mg ja PREVACID 30mg SoluTab voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Eräänlainen munuaisongelma (akuutti tubulointerstitiaalinen nefriitti). Joillekin ihmisille, jotka käyttävät protonipumpun estäjiä (PPI) sisältäviä lääkkeitä, mukaan lukien PREVACID 30mg ja PREVACID 15mg SoluTab, voi kehittyä munuaisongelma, jota kutsutaan akuutiksi tubulointerstitiaaliseksi nefriittiksi ja joka voi ilmaantua milloin tahansa PPI-lääkkeiden, mukaan lukien PREVACID ja PREVACID SoluTab, hoidon aikana. Soita lääkärillesi välittömästi, jos virtsaamasi määrä on vähentynyt tai jos sinulla on verta virtsassasi.
- Ripuli, jonka aiheuttaa suolistotulehdus (Clostridium difficile). Soita lääkärillesi heti, jos sinulla on vetisiä ulosteita tai vatsakipua, joka ei mene pois. Sinulla voi olla kuumetta tai ei.
- Luun murtumat (lonkka-, ranteen- tai selkärangan murtumat). Lonkan, ranteen tai selkärangan luumurtumia voi tapahtua ihmisillä, jotka ottavat useita päivittäisiä annoksia PPI-lääkkeitä ja pitkän ajan (vuoden tai pidempään). Kerro lääkärillesi, jos sinulla on luunmurtuma, erityisesti lonkassa, ranteessa tai selkärangassa.
- Tietyntyyppiset lupus erythematosus. Lupus erythematosus on autoimmuunisairaus (elimistön immuunisolut hyökkäävät kehon muihin soluihin tai elimiin). Joillekin ihmisille, jotka käyttävät PPI-lääkkeitä, mukaan lukien PREVACID 15mg ja PREVACID 30mg SoluTab, voi kehittyä tietyntyyppinen lupus erythematosus tai heillä jo oleva lupus voi pahentua. Soita heti lääkärillesi, jos sinulla on uutta tai pahenevaa nivelkipua tai ihottumaa poskissasi tai käsivarsissasi, joka pahenee auringossa.
Keskustele lääkärisi kanssa näiden vakavien sivuvaikutusten riskistä.
PREVACID 15mg ja PREVACID SoluTab voivat aiheuttaa muita vakavia sivuvaikutuksia. Katso "Mitä ovat PREVACIDin ja PREVACID SoluTabin mahdolliset sivuvaikutukset?".
Mitä ovat PREVACID ja PREVACID 30mg SoluTab?
Reseptilääke, jota kutsutaan protonipumpun estäjäksi (PPI), jota käytetään vähentämään hapon määrää mahassasi.
aikuisilla, PREVACID 15mg ja PREVACID SoluTab käytetään:
- 4 viikkoa pohjukaissuolihaavan paranemiseen ja oireiden lievitykseen.
- 10–14 päivää tiettyjen antibioottien kanssa H. pylori -nimisen bakteerin aiheuttaman infektion hoitoon.
- pohjukaissuolihaavojen paranemisen ylläpitäminen. PREVACID 30 mg:aa ei ole tutkittu yli 12 kuukauden ajan tähän tarkoitukseen.
- jopa 8 viikkoa mahahaavojen paranemiseen ja oireiden lievitykseen.
- enintään 8 viikkoa mahahaavojen paranemiseen ihmisillä, jotka käyttävät kipulääkkeitä, joita kutsutaan ei-steroidisiksi tulehduskipulääkkeiksi (NSAID). PREVACID 30 mg:aa ei ole tutkittu yli 8 viikon ajan tähän tarkoitukseen.
- vähentää mahahaavojen riskiä ihmisillä, joilla on riski saada mahahaava NSAID-lääkkeiden käytön yhteydessä. PREVACIDia ei ole tutkittu tätä tarkoitusta varten yli 12 viikon ajan.
- enintään 8 viikkoa närästyksen ja muiden gastroesofageaalisen refluksitaudin (GERD) oireiden hoitoon. GERD tapahtuu, kun mahassasi oleva happo palautuu putkeen (ruokatorveen), joka yhdistää suun vatsaasi. Tämä voi aiheuttaa polttavaa tunnetta rinnassa tai kurkussa, hapan makua tai röyhtäilyä.
- enintään 8 viikkoa happoon liittyvien ruokatorven limakalvovaurioiden (kutsutaan erosiiviseksi esofagiittiksi tai EE) paranemiseksi ja oireiden lievittämiseksi. Lääkärisi voi määrätä vielä 8–16 viikon PREVACID- tai PREVACID 15 mg SoluTab -valmistetta potilaille, joiden EE ei parane tai joiden oireet palaavat.
- ylläpitää EE:n paranemista. PREVACIDia ei ole tutkittu tätä tarkoitusta varten yli 12 kuukauden ajan.
- sairauksien pitkäaikaishoito, jossa mahasi tuottaa liikaa happoa. Tämä sisältää harvinaisen Zollinger-Ellisonin oireyhtymän.
Lapset: Anna PREVACID 30mg ja PREVACID 30mg SoluTab juuri sen verran kuin lapsesi lääkäri on määrännyt. Älä suurenna PREVACID- ja PREVACID SoluTab -annosta tai anna lapsellesi PREVACID 15 mg ja PREVACID 15 mg SoluTab pidempään kuin lääkärisi on määrännyt.
1-11-vuotiailla lapsilla PREVACID 15mg ja PREVACID 15mg SoluTab käytetään:
- jopa 12 viikkoa närästyksen ja muiden GERD:n aiheuttamien oireiden hoitoon.
- jopa 12 viikkoa EE:n paranemiseen ja oireiden lievitykseen.
12-17-vuotiailla lapsilla PREVACIDia ja PREVACID SoluTabia käytetään:
- jopa 8 viikkoa närästyksen ja muiden GERD:n aiheuttamien oireiden hoitoon.
- jopa 8 viikkoa EE:n paranemiseen ja oireiden lievitykseen.
PREVACID 30 mg ja PREVACID SoluTab ei suositella GERD-oireiden hoitoon alle 1-vuotiailla lapsilla, ja ne voivat vahingoittaa heitä.
Älä ota PREVACID- tai PREVACID 15 mg SoluTabia, jos olet:
- allerginen lansopratsolille, jollekin muulle PPI-lääkkeelle tai jollekin PREVACID 15mg:n tai PREVACID 30mg SoluTabin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo PREVACIDin ja PREVACID 30mg SoluTabin ainesosista.
- rilpiviriiniä (EDURANT, COMPLERA, ODEFSEY, JULUCA) sisältävän lääkkeen ottaminen, jota käytetään HIV-1:n (ihmisen immuunikatovirus) hoitoon.
Ennen kuin otat PREVACID 15 mg tai PREVACID SoluTabia, kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on alhaiset magnesium-, kalsium-, kalium- tai natriumtasot veressäsi tai käytät diureettia.
- sinulla on maksaongelmia.
- sinulla on fenyyliketonuria. PREVACID SoluTab sisältää aspartaamia.
- olet raskaana, epäilet olevasi raskaana tai suunnittelet raskautta. PREVACID tai PREVACID SoluTab voivat vahingoittaa sikiötäsi. Keskustele lääkärisi kanssa mahdollisista riskeistä sikiölle, jos PREVACID 30mg tai PREVACID 15mg SoluTab otetaan raskauden aikana.
- imetät tai aiot imettää. Ei tiedetä, erittyykö PREVACID tai PREVACID 30 mg SoluTab äidinmaitoon. Keskustele lääkärisi kanssa parhaasta tavasta ruokkia vauvasi, jos käytät PREVACIDia tai PREVACID SoluTabia.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro lääkärillesi erityisesti, jos käytät metotreksaattia (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
Kuinka minun pitäisi ottaa PREVACID 15mg ja PREVACID 30mg SoluTab?
- Ota PREVACID 30 mg tai PREVACID SoluTab juuri sen verran kuin lääkärisi on määrännyt.
- Älä muuta annostasi tai lopeta PREVACID 30 mg:n tai PREVACID SoluTabin käyttöä keskustelematta lääkärisi kanssa.
- Ota PREVACID 30mg tai PREVACID 15mg SoluTab ennen ateriaa.
PREVACID 15 mg kapselit:
-
- Niele PREVACID 30 mg kapselit kokonaisina.
- Älä murskaa tai pureskele PREVACID-kapseleita.
- Jos sinulla on vaikeuksia niellä kokonaista kapselia, voit avata kapselin ja ottaa sen sisällön tiettyjen ruokien tai mehujen kanssa. Katso "Käyttöohjeet" tämän lääkitysoppaan lopusta saadaksesi ohjeet PREVACID 30 mg -kapseleiden ottamisesta tiettyjen ruokien tai mehujen kanssa.
- Katso "Käyttöohjeet" tämän lääkitysoppaan lopusta saadaksesi ohjeet PREVACID 30 mg -kapseleiden sekoittamisesta ja antamisesta nenämahaletkun (NG-letkun) kautta.
PREVACID SoluTab:
-
- PREVACID 30mg SoluTab on tabletti, joka sulaa suussa veden kanssa tai ilman.
- Älä riko, leikkaa, murskaa tai pureskele tabletteja.
- Katso "Käyttöohjeet" tämän lääkitysoppaan lopusta saadaksesi ohjeet PREVACID SoluTabin sekoittamisesta ja antamisesta ruiskun ja maakaasuputken kautta.
- Jos unohdat ottaa PREVACID- tai PREVACID 30 mg SoluTab-annoksen, ota se heti kun muistat. Jos on melkein aika ottaa seuraava annos, älä ota unohtunutta annosta. Ota seuraava annos normaaliin aikaan. Älä ota 2 annosta samanaikaisesti.
- Jos otat liikaa PREVACID- tai PREVACID 30mg SoluTabia, soita heti lääkärillesi tai myrkytystietokeskukseesi numeroon 1-800-222-1222 tai mene lähimmän sairaalan ensiapuun.
Mitkä ovat PREVACIDin ja PREVACID SoluTabin mahdolliset sivuvaikutukset?
PREVACID ja PREVACID SoluTab voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää PREVACID 30mg:sta ja PREVACID SoluTabista?".
- Matala B12-vitamiinitaso elimistössä voi tapahtua ihmisillä, jotka ovat käyttäneet PREVACID 30 mg tai PREVACID SoluTab -valmistetta pitkään (yli 3 vuotta). Kerro lääkärillesi, jos sinulla on alhaisten B12-vitamiinipitoisuuksien oireita, kuten hengenahdistusta, huimausta, epäsäännöllistä sydämenlyöntiä, lihasheikkoutta, kalpeaa ihoa, väsymystä, mielialan muutoksia ja pistelyä tai puutumista käsivarsissa ja jaloissa.
- Vatsakasvut (pohjarauhasten polyypit). Pitkään PPI-lääkkeitä käyttävillä ihmisillä on lisääntynyt riski saada tietyntyyppinen mahalaukun kasvu, jota kutsutaan pohjarauhasen polyypeiksi, etenkin kun PPI-lääkkeitä on käytetty yli vuoden.
- Alhaiset magnesiumtasot kehossa voi tapahtua ihmisillä, jotka ovat käyttäneet PREVACIDia vähintään 3 kuukautta. Kerro heti lääkärillesi, jos sinulla on alhaisten magnesiumpitoisuuksien oireita, kuten kouristuksia, huimausta, epäsäännöllistä sydämenlyöntiä, hermostuneisuutta, lihassärkyä tai -heikkoutta sekä käsien, jalkojen tai äänen kouristuksia.
- Vaikeat ihoreaktiot. PREVACID 15 mg voi aiheuttaa harvinaisia mutta vakavia ihoreaktioita, jotka voivat vaikuttaa mihin tahansa kehon osaan. Nämä vakavat ihoreaktiot saattavat vaatia hoitoa sairaalassa ja voivat olla hengenvaarallisia:
- Ihottuma, jossa voi esiintyä rakkuloita, hilseilyä tai verenvuotoa missä tahansa ihon osassa (mukaan lukien huulet, silmät, suu, nenä, sukuelimet, kädet tai jalat).
- Sinulla voi myös olla kuumetta, vilunväristyksiä, kehon kipuja, hengenahdistusta tai suurentuneet imusolmukkeet.
Lopeta PREVACIDin käyttö ja ota heti yhteys lääkäriin. Nämä oireet voivat olla ensimmäinen merkki vakavasta ihoreaktiosta.
PREVACIDin ja PREVACID SoluTabin yleisimmät sivuvaikutukset ovat: ripuli, vatsakipu, pahoinvointi ja ummetus.
Nämä eivät ole kaikkia PREVACID 30mg:n ja PREVACID 30mg SoluTabin mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista.
Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää PREVACID ja PREVACID 30mg SoluTab?
Säilytä PREVACID huoneenlämmössä välillä 68°F - 77°F (20°C - 25°C).
Pidä PREVACID 15mg ja PREVACID SoluTab ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa PREVACID 15mg:n ja PREVACID SoluTabin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä PREVACID- tai PREVACID 30mg SoluTabia sairauksiin, joihin sitä ei ole määrätty. Älä anna PREVACID 30 mg tai PREVACID SoluTab muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä lääkäriltäsi tai apteekista tietoja PREVACID 30mg:sta ja PREVACID 15mg SoluTabista, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä aineosia PREVACID ja PREVACID SoluTab sisältävät?
Aktiivinen ainesosa: lansopratsoli.
PREVACID 30 mg kapseleiden inaktiiviset aineet: sokeripallo, sakkaroosi, metakryylihappokopolymeeri, vähän substituoitu hydroksipropyyliselluloosa, tärkkelys, magnesiumkarbonaatti, talkki, polyetyleeniglykoli, titaanidioksidi, polysorbaatti 80, hydroksipropyyliselluloosa, kolloidinen piidioksidi, D&C Red No. 28, FD1, Blue No. FD&C Red nro 40.
Vain PREVACID 15 mg kapseli: FD&C Green nro 3.
PREVACID 15mg SoluTabin inaktiiviset aineosat: mannitoli, metakryylihappo, hydroksipropyyliselluloosa, laktoosimonohydraatti-mikrokiteinen selluloosapallo, trietyylisitraatti, krospovidoni, polyakrylaatti, magnesiumkarbonaatti, aspartaami, glyseryylimonostearaatti, hypromelloosi, keinotekoinen aine, magnesiumstearaatti, glykoli-dioksidi, talli-, polyeetti-, titaani-, sitruunahappo, titaani polysorbaatti 80 ja rautaoksidi.
PREVACID SoluTab sisältää 2,5 mg fenyylialaniinia jokaisessa 15 mg:n tabletissa ja 5,1 mg fenyylialaniinia jokaisessa 30 mg:n tabletissa.
KÄYTTÖOHJEET
PREVACID (prev-a-sid) (lansopratsoli) viivästyttävästi vapautuvat kapselit, suun kautta käytettäväksi ja
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansopratsoli) viivästetysti vapautuvat suun kautta hajoavat tabletit
Tärkeä:
- Ota PREVACID 15 mg tai PREVACID 15 mg SoluTab ennen ateriaa.
- Älä murskaa tai pureskele PREVACID 15 mg -kapseleita tai PREVACID 30 mg SoluTabia.
- PREVACID tai PREVACID 15 mg SoluTab tulee käyttää vain alla lueteltujen ruokien ja mehujen kanssa.
PREVACID viivästetysti vapauttavat kapselit (PREVACID 30 mg kapselit)
PREVACID 15 mg kapseleiden ottaminen tiettyjen ruokien kanssa:
Voit käyttää vain omenasosetta, ENSURE vanukasta, raejuustoa, jogurttia tai siivilöityjä päärynöitä.
PREVACID-kapseleiden ottaminen tiettyjen mehujen kanssa:
Voit käyttää vain omenamehua, appelsiinimehua tai tomaattimehua.
PREVACID-kapseleiden antaminen nenämahaletkun (NG-letkun) kautta, jonka koko on 16 ranska tai suurempi:
Voit käyttää vain omenamehua.
PREVACID 15 mg SoluTab viivästyneesti vapauttavat suun kautta hajoavat tabletit (PREVACID SoluTab)
Potilaille, joilla on vaikeuksia niellä tabletteja, PREVACID SoluTab voidaan antaa seuraavasti:
PREVACID SoluTabin antaminen veden kanssa suuruiskulla:
PREVACID 15 mg SoluTabin antaminen veden kanssa nenämahaletkun (NG-letkun) kautta, jonka koko on 8 ranskaa tai suurempi:
Kuinka minun pitäisi säilyttää PREVACID ja PREVACID 30mg SoluTab?
- Säilytä PREVACID-kapselit ja PREVACID 15 mg SoluTab huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
Pidä PREVACID ja PREVACID 30mg SoluTab ja kaikki lääkkeet poissa lasten ulottuvilta.
Tämän käyttöohjeen on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
