Pentasa 400mg Mesalamine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Pentasa on ja miten sitä käytetään?
Pentasa on reseptilääke, jota käytetään haavaisen paksusuolitulehduksen oireiden hoitoon. Pentasa 400 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Pentasa kuuluu lääkeryhmään, jota kutsutaan 5-aminosalisyylihappojohdannaisiksi.
Ei tiedetä, onko Pentasa turvallinen ja tehokas yli 5-vuotiaille lapsille.
Mitkä ovat Pentasan mahdolliset sivuvaikutukset?
Pentasa voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- vatsakrampit,
- verinen ripuli,
- kuume,
- päänsärky,
- ihottuma,
- veriset tai tervamaiset ulosteet,
- yskii verta,
- oksennusta, joka näyttää kahvinporolta,
- vähän tai ei ollenkaan virtsaamista,
- kivulias tai vaikea virtsaaminen,
- turvotus jaloissasi tai nilkoissasi,
- väsymyksen tai hengenahdistuksen tunne,
- ruokahalun menetys,
- ylävatsakipu,
- väsymys,
- helppo mustelma tai verenvuoto,
- tumma virtsa,
- savenväriset ulosteet ja
- ihon tai silmien keltaisuus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Pentasa 400 mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- oksentelua,
- vatsakipu,
- ripuli,
- ruoansulatushäiriöt,
- kaasu,
- päänsärky,
- ihottuma ja
- epänormaalit maksan toimintakokeet
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Pentasan mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
KUVAUS
Suun kautta annettava PENTASA (mesalamiini) on kontrolloidusti vapautuva formulaatio mesalamiinista, aminosalisylaattista anti-inflammatorista ainetta ruoansulatuskanavan käyttöön.
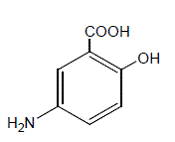
Kemiallisesti mesalamiini on 5-amino-2-hydroksibentsoehappo. Sen molekyylipaino on 153,14.
Rakennekaava on:
Jokainen 250 mg:n kapseli sisältää 250 mg mesalamiinia. Se sisältää myös seuraavia inaktiivisia ainesosia: asetyloitu monoglyseridi, risiiniöljy, kolloidinen piidioksidi, etyyliselluloosa, hydroksipropyylimetyyliselluloosa, tärkkelys, steariinihappo, sokeri, talkki ja valkoinen vaha. Kapselin kuori sisältää D&C Yellow #10, FD&C Blue #1, FD&C Green #3, gelatiinia, titaanidioksidia ja muita ainesosia.
Jokainen 500 mg:n kapseli sisältää 500 mg mesalamiinia. Se sisältää myös seuraavia inaktiivisia ainesosia: asetyloitu monoglyseridi, risiiniöljy, kolloidinen piidioksidi, etyyliselluloosa, hydroksipropyylimetyyliselluloosa, tärkkelys, steariinihappo, sokeri, talkki ja valkoinen vaha. Kapselin kuori sisältää FD&C Blue #1:tä, gelatiinia, titaanidioksidia ja muita ainesosia.
INDIKAATIOT
PENTASA 400 mg on tarkoitettu lievästi tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen induktioon ja hoitoon aikuispotilaille.
ANNOSTELU JA HALLINNOINTI
Suositeltu annos remission induktioon ja lievästi tai kohtalaisen aktiivisen haavaisen paksusuolentulehduksen oireenmukaiseen hoitoon aikuisilla on 1 g (4 PENTASA 250 mg kapselia tai 2 PENTASA 500 mg kapselia) 4 kertaa vuorokaudessa, jolloin päivittäinen kokonaisannos on 4 g. Hoidon kesto kontrolloiduissa tutkimuksissa oli jopa 8 viikkoa.
PENTASA-kapselit voidaan niellä kokonaisina tai vaihtoehtoisesti kapseli voidaan avata ja koko sisältö ripotella omenasoseen tai jogurtin päälle. Koko sisältö tulee kuluttaa välittömästi. Kapseleita ja kapselin sisältöä ei saa murskata tai pureskella.
Juo riittävä määrä nesteitä.
PENTASA 400 mg:n turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
MITEN TOIMITETAAN
PENTASA pitkävaikutteinen 250 mg kapselit toimitetaan 240 kapselin pulloissa ( NDC 54092-189-81). Jokainen vihreä ja sininen kapseli sisältää 250 mg mesalamiinia pitkitetysti vapauttavina helminä. PENTASA-depotkapselit on merkitty viisikulmaisella starburst-logolla ja numerolla 2010 vihreässä osassa ja S429 250 mg kapseleiden sinisessä osassa.
PENTASA pitkävaikutteinen 500 mg kapselit toimitetaan 120 kapselin pulloissa ( NDC 54092-191-12). Jokainen sininen kapseli sisältää 500 mg mesalamiinia pitkävaikutteisissa helmissä. PENTASA 400 mg depotkapselit on merkitty viisikulmaisella starburst-logolla ja S429 500 mg kapseleissa.
Säilytä 25°C (77°F); retket sallitaan 15 °C - 30 °C (59 °F - 86 °F) [katso USP:n ohjaama huonelämpötila].
Jos haluat ilmoittaa EPÄILLEISTÄ HAITTAVAIKUTUKSISTA, ota yhteyttä Takeda Pharmaceuticalsiin numeroon 1800-828-2088 tai FDA:han numeroon 1-800-FDA-1088 tai www.fda.gov/medwatch.
Jakelija: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, USA. Tarkistettu: marraskuuta 2021
SIVUVAIKUTUKSET
Yhdistetyissä kotimaisissa ja ulkomaisissa kliinisissä tutkimuksissa yli 2100 haavaista paksusuolentulehdusta tai Crohnin tautia sairastavaa potilasta sai PENTASA-hoitoa. Yleensä PENTASA-hoito oli hyvin siedetty. Yleisimmät tapahtumat (eli suurempi tai yhtä suuri kuin 1 %) olivat ripuli (3,4 %), päänsärky (2,0 %), pahoinvointi (1,8 %), vatsakipu (1,7 %), dyspepsia (1,6 %), oksentelu (1,5 %). %) ja ihottuma (1,0 %).
Kahdessa kotimaisessa lumekontrolloidussa tutkimuksessa, joihin osallistui yli 600 haavaista paksusuolitulehdusta sairastavaa potilasta, haittatapahtumat olivat vähemmän PENTASA- (mesalamiini) hoidetuilla potilailla kuin lumeryhmässä (PENTASA 14 % vs. lumelääke 18 %) eivätkä ne olleet annoksesta riippuvaisia. Tapahtumat, joita esiintyy yli 1 %:ssa, on esitetty alla olevassa taulukossa. Näistä vain pahoinvointi ja oksentelu olivat yleisempiä PENTASA-ryhmässä. Hoidosta keskeyttäminen haittatapahtumien vuoksi oli yleisempää lumelääkettä saaneilla kuin PENTASAlla (7 % vs 4 %).
Kliiniset laboratoriomittaukset eivät osoittaneet merkittäviä poikkeavia suuntauksia missään testissä, mukaan lukien hematologisen, maksan ja munuaisten toiminnan mittaaminen.
Seuraavia kehon järjestelmäkohtaisia haittavaikutuksia raportoitiin harvoin (eli alle 1 %) kotimaisten haavaista paksusuolitulehdusta ja Crohnin tautia koskevien tutkimusten aikana. Monissa tapauksissa yhteyttä PENTASAan ei ole vahvistettu.
Ruoansulatuskanava: vatsan turvotus, ruokahaluttomuus, ummetus, pohjukaissuolihaava, dysfagia, eryktaatio, ruokatorven haavauma, ulosteen pidätyskyvyttömyys, GGTP:n nousu, GI-verenvuoto, lisääntynyt alkalinen fosfataasi, LDH:n nousu, suun haavauma, suun moniliaasi, haimatulehdus, SPTGOT:n lisääntyminen, peräsuolen lisääntyminen ulosteiden poikkeavuudet (värin tai koostumuksen muutos), jano
Ihotauti: akne, hiustenlähtö, kuiva iho, ekseema, erythema nodosum, kynsien häiriö, valoherkkyys, kutina, hikoilu, urtikaria
Hermosto: masennus, huimaus, unettomuus, uneliaisuus, parestesia
Sydän: sydämentykytys, perikardiitti, vasodilataatio
Muuta: albuminuria, amenorrea, amylaasin lisääntyminen, nivelkipu, voimattomuus, rintojen kipu, sidekalvotulehdus, mustelma, turvotus, kuume, hematuria, hypomenorrea, Kawasakin kaltainen oireyhtymä, jalkakrampit, lichen planus, lipaasin lisääntyminen, huonovointisuus, menorrhagia, metrorrhagia, myalfiltria , trombosytemia, trombosytopenia, virtsaamistiheys
Viikko 8 viikon haavaisen paksusuolitulehduksen tutkimuksen päättymisen jälkeen 72-vuotiaalle miehelle, jolla ei ollut aiemmin ollut keuhkosairauksia, kehittyi hengenahdistus. Tämän jälkeen yksi lääkäri diagnosoi potilaalla interstitiaalisen keuhkofibroosin ilman eosinofiliaa ja toinen lääkäri totesi keuhkoputkentulehduksen, johon liittyi keuhkotulehdus. Syy-yhteyttä tämän tapahtuman ja mesalamiinihoidon välillä ei ole osoitettu.
Julkaistuissa tapausraporteissa ja/tai spontaanissa markkinoille tulon jälkeisessä seurannassa on kuvattu harvoin perikardiittia, kuolemaan johtanutta sydänlihastulehdusta, rintakipuja ja T-aallon poikkeavuuksia, yliherkkyyskeuhkotulehdusta, haimatulehdusta, nefroottista oireyhtymää, interstitiaalista nefriittiä, hepatiittia, aplastista anemiaa, pancytosopeniaa, agranu-leukutopeniaa, pansytopeniaa tai T-aallon poikkeavuuksia. anemiaa mesalamiinihoidon aikana. Anemia voi olla osa tulehduksellisen suolistosairauden kliinistä esitystä. PENTASA 400 mg -hoidon yhteydessä voidaan havaita allergisia reaktioita, joihin saattaa liittyä eosinofiliaa.
Markkinoinnin jälkeiset raportit
Seuraavat tapahtumat on tunnistettu PENTASA-tuotemerkin mesalamiinin hyväksymisen jälkeisen käytön aikana kliinisessä käytännössä. Koska ne raportoidaan vapaaehtoisesti tuntemattoman kokoisesta populaatiosta, arvioita esiintymistiheydestä ei voida tehdä. Nämä tapahtumat on valittu sisällytettäväksi vakavuuden, ilmoitustiheyden tai mahdollisen syy-yhteyden mesalamiiniin yhdistelmän vuoksi:
Ruoansulatuskanava: Raportit maksatoksisuudesta, mukaan lukien kohonneet maksaentsyymiarvot (SGOT/AST, SGPT/ALT, GGT, LDH, alkalinen fosfataasi, bilirubiini), hepatiitti, keltaisuus, kolestaattinen keltaisuus, kirroosi ja mahdollinen maksasoluvaurio mukaan lukien maksanekroosi ja maksan vajaatoiminta. Jotkut näistä tapauksista olivat kohtalokkaita. Yksi tapaus Kawasakin kaltaisesta oireyhtymästä, joka sisälsi maksan toiminnan muutoksia, raportoitiin myös.
Muuta: anafylaktinen reaktio, SJS/TEN, DRESS, AGEP, keuhkopussintulehdus/keuhkopussintulehdus, pneumoniitti, granulosytopenia, systeeminen lupus erythematosus, lupus-kaltainen oireyhtymä, akuutti munuaisten vajaatoiminta, interstitiaalinen keuhkosairaus, yliherkkyyskeuhkosairaus (mukaan lukien interstitiaalinen pneumoniitti, allerginen alveoliitti krooninen munuaisten vajaatoiminta, nefrogeeninen diabetes insipidus, munuaiskivitauti, kallonsisäinen verenpainetauti, angioedeema ja oligospermia (reversiibeli).
HUUMEIDEN VUOROVAIKUTUKSET
PENTASA 400 mg:n ja muiden lääkkeiden yhteisvaikutuksia ei ole tutkittu. Seuraavia lääkkeiden välisiä yhteisvaikutuksia on kuitenkin raportoitu mesalamiinia sisältävillä tuotteilla:
Nefrotoksiset aineet, mukaan lukien ei-steroidiset tulehduskipulääkkeet
Mesalamiinin samanaikainen käyttö tunnettujen munuaistoksisten aineiden kanssa, mukaan lukien ei-steroidiset tulehduskipulääkkeet (NSAID), voi lisätä munuaistoksisuuden riskiä. Tarkkaile munuaistoksisia lääkkeitä käyttäviä potilaita munuaisten toiminnan muutosten ja mesalamiiniin liittyvien haittavaikutusten varalta.

atsatiopriini tai 6-merkaptopuriini
Mesalamiinin samanaikainen käyttö atsatiopriinin tai 6-merkaptopuriinin ja/tai muiden lääkkeiden kanssa, joiden tiedetään aiheuttavan myelotoksisuutta, voi lisätä verisairauksien, luuytimen vajaatoiminnan ja niihin liittyvien komplikaatioiden riskiä. Jos PENTASAn ja atsatiopriinin tai 6-merkaptopuriinin samanaikaista käyttöä ei voida välttää, seuraa verikokeita, mukaan lukien täydellinen verisolujen määrä ja verihiutaleiden määrä.
VAROITUKSET
Tietoja ei toimitettu
VAROTOIMENPITEET
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa, mukaan lukien minimaalinen muutossairaus, akuuttia ja kroonista interstitiaalista nefriittiä ja munuaisten vajaatoimintaa on raportoitu potilailla, jotka ovat saaneet PENTASAa tai muita mesalamiinia sisältäviä tai mesalamiiniksi muuntuvia tuotteita.
Mesalamiinin tiedetään erittyvän pääosin munuaisten kautta, ja haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Arvioi kaikkien potilaiden munuaisten toiminta ennen PENTASA-hoidon aloittamista ja ajoittain sen aikana. Arvioi PENTASAn käytön riskit ja hyödyt potilailla, joilla on todettu munuaisten vajaatoiminta tai joilla on aiemmin ollut munuaissairaus tai jotka käyttävät samanaikaisesti munuaistoksisia lääkkeitä.
Mesalamiinin aiheuttama akuutti intoleranssioireyhtymä
Mesalamiini on yhdistetty akuuttiin intoleranssioireyhtymään, jota voi olla vaikea erottaa tulehduksellisesta suolistosairaudesta. Oireita ovat kouristukset, akuutti vatsakipu, verinen ripuli ja joskus kuume, päänsärky ja ihottuma. Tarkkaile potilaita näiden oireiden pahenemisen varalta hoidon aikana. Jos epäillään akuuttia intoleranssioireyhtymää, lopeta PENTASA-hoito välittömästi.
Yliherkkyysreaktiot
Yliherkkyysreaktioita on raportoitu potilailla, jotka käyttävät sulfasalatsiinia. Joillakin potilailla voi olla samanlainen reaktio PENTASAn tai muiden yhdisteiden kanssa, jotka sisältävät tai muuttuvat mesalamiiniksi.
Kuten sulfasalatsiinin kohdalla, mesalamiinin aiheuttamat yliherkkyysreaktiot voivat ilmetä sisäelinten vaikutuksena, mukaan lukien sydänlihastulehdus, perikardiitti, nefriitti, hepatiitti, keuhkotulehdus ja hematologiset poikkeavuudet. Arvioi potilas välittömästi, jos sinulla on yliherkkyysreaktion merkkejä tai oireita. Lopeta PENTASA-hoito, jos oireiden ja oireiden vaihtoehtoista etiologiaa ei voida määrittää.
Maksan vajaatoiminta
Maksan vajaatoimintaa on raportoitu potilailla, joilla on aiempi maksasairaus ja jotka ovat saaneet muita mesalamiinia sisältäviä valmisteita. Arvioi riskit ja hyödyt PENTASA 400 mg:n käytöstä potilailla, joilla on maksan vajaatoiminta.
Vakavat ihohaittavaikutukset
Vakavia ihon haittavaikutuksia, kuten Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) ja akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP), on raportoitu mesalamiinin käytön yhteydessä. (katso HAITTAVAIKUTUKSET ). Lopeta PENTASAn käyttö vakavien ihohaittavaikutusten tai muiden yliherkkyysoireiden ensimmäisten merkkien tai oireiden ilmetessä ja harkitse lisäarviointia.
Valoherkkyys
Potilaat, joilla on aiemmin ollut ihosairauksia, kuten atooppinen ihottuma ja atooppinen ihottuma, ovat raportoineet vakavammista valoherkkyysreaktioista. Neuvo potilaita välttämään auringolle altistumista, käyttämään suojavaatetusta ja laajavaikutteista aurinkovoidetta ulkona.
Munuaiskivitauti
Mesalamiinin käytön yhteydessä on raportoitu munuaiskivitautitapauksia, mukaan lukien kivet, joiden mesalamiinipitoisuus on 100 %. Mesalamiinia sisältävät kivet ovat radioläpinäkyviä eikä niitä voida havaita tavallisella radiografialla tai tietokonetomografialla (CT). Varmista riittävä nesteytys hoidon aikana.
Häiriö laboratoriotutkimuksiin
Mesalamiinin käyttö voi johtaa virheellisesti kohonneisiin testituloksiin, kun virtsan normetanefriiniä mitataan nestekromatografialla sähkökemiallisella detektiolla, koska normetanefriinin ja mesalamiinin päämetaboliitin, N-asetyyli-5-aminosalisyylihapon (N-Ac-5-ASA) kromatogrammit ovat samankaltaisia. ). Harkitse vaihtoehtoista, selektiivistä määritystä normetanefriinille.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Mesalamiinin 104 viikkoa kestäneessä ravinnon karsinogeenisuustutkimuksessa CD-1-hiiriä hoidettiin annoksilla 2500 mg/kg/vrk asti, eikä se ollut kasvaimia aiheuttava. 50-kiloiselle keskipitkälle henkilölle (1,46 m2 kehon pinta-ala) tämä on 2,5 kertaa ihmisen suositeltu annos kehon pinta-alalla laskettuna (2960 mg/m2/vrk). Wistar-rotilla tehdyssä 104 viikkoa kestäneessä ravinnon syöpää aiheuttavassa tutkimuksessa mesalamiini annoksella 800 mg/kg/vrk ei ollut kasvaimia aiheuttava. Tämä annos on 1,5 kertaa ihmiselle suositeltu annos kehon pinta-alasta laskettuna.
Mitään näyttöä mutageenisuudesta ei havaittu Amesin in vitro -testissä eikä hiiren mikrotumatestissä in vivo.
Uros- tai naarasrotilla ei havaittu vaikutuksia hedelmällisyyteen tai lisääntymiskykyyn oraalisilla mesalamiiniannoksilla 400 mg/kg/vrk asti (0,8 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella).
Siemennesteen poikkeavuuksia ja hedelmättömyyttä miehillä, joita on raportoitu sulfasalatsiinin käytön yhteydessä, ei ole havaittu PENTASA 400 mg kapseleilla kontrolloiduissa kliinisissä tutkimuksissa.
Raskaus
Teratogeeniset vaikutukset
Julkaistut tiedot meta-analyyseistä, kohorttitutkimuksista ja tapaussarjoista mesalamiinin käytöstä raskauden aikana eivät ole osoittaneet luotettavaa yhteyttä mesalamiiniin ja merkittäviin synnynnäisiin epämuodostuksiin, keskenmenoon tai haitallisiin äidin tai sikiön seurauksiin. Ei ole selvää näyttöä siitä, että mesalamiinialtistus raskauden alkuvaiheessa liittyisi vakavien synnynnäisten epämuodostumien, mukaan lukien sydämen epämuodostumien, lisääntyneeseen riskiin. Julkaistuissa epidemiologisissa tutkimuksissa on tärkeitä metodologisia rajoituksia, jotka haittaavat tietojen tulkintaa, mukaan lukien kyvyttömyys hallita sekatekijöitä, kuten taustalla olevaa äidin sairautta, äidin samanaikaisten lääkkeiden käyttöä ja puuttuvat tiedot mesalamiinituotteiden annoksesta ja käytön kestosta. PENTASAa tulee käyttää raskauden aikana vain, jos hyödyt ovat riskejä suuremmat.
Eläinten lisääntymistutkimuksissa mesalamiinin oraalinen antaminen organogeneesin aikana raskaana oleville rotille annoksina 1000 mg/kg/vrk (5900 mg/m²) asti ja kaneille annoksina 800 mg/kg/vrk (6856 mg/m²) ei osoittanut näyttöä. teratogeenisiä vaikutuksia tai sikiövaurioita mesalamiinin vuoksi.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenojen arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Ei-teratogeeniset vaikutukset
Julkaistut tiedot viittaavat siihen, että lisääntynyt sairauden aktiivisuus liittyy riskiin saada haitallisia raskaustuloksia naisilla, joilla on haavainen paksusuolitulehdus. Haitallisia raskauden tuloksia ovat ennenaikainen synnytys (ennen 37 raskausviikkoa), alhainen syntymäpaino (alle 2500 g) ja pieni syntymän raskausikään nähden.
Imettävät äidit
Julkaistun kirjallisuuden tiedot raportoivat mesalamiinin ja sen metaboliitin, N-asetyyli-5-aminosalisyylihapon, esiintyvän äidinmaidossa pieninä määrinä, ja mesalamiinin suhteellinen infant-annos (RID) on 0,1 % tai vähemmän. Tämän kliinistä merkitystä ei ole määritetty, ja mesalamiinin käytöstä imettävistä naisista on vain vähän kokemusta.
Mesalamiinille altistuneilla imeväisillä on raportoitu ripulia. PENTASA 400 mg:n vaikutusta maidontuotantoon ei tunneta. Noudata varovaisuutta, jos PENTASA 400 mg:aa annetaan imettävälle naiselle, ja tarkkaile rintaruokittujen imeväisten ripulia.
Julkaistuissa imetystutkimuksissa äidin mesalamiiniannokset erilaisista oraalisista ja rektaalisista formulaatioista ja tuotteista vaihtelivat välillä 500 mg - 4,8 g päivässä. Mesalamiinin keskimääräinen pitoisuus maidossa vaihteli havaitsemattomasta arvoon 0,5 mg/l. N-asetyyli-5-aminosalisyylihapon keskimääräinen pitoisuus maidossa vaihteli välillä 0,2-9,3 mg/l. Näiden pitoisuuksien perusteella arvioidut vauvan päivittäiset annokset yksinomaan rintaruokitetulle lapselle ovat 0–0,075 mg/kg/vrk mesalamiinia (RID 0–0,1 %) ja 0,03–1,4 mg/kg/vrk N-asetyyli-5-aminosalisyylihappoa. happoa.
Käyttö lapsille
PENTASAn turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
PENTASA 400 mg:n kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia potilaita sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat. Kontrolloimattomista kliinisistä tutkimuksista ja markkinoille tulon jälkeisistä raportointijärjestelmistä saadut raportit viittaavat siihen, että veren dyskrasiat (eli agranulosytoosi, neutropenia ja pansytopenia) saivat enemmän mesalamiinia sisältäviä valmisteita, kuten PENTASA 400 mg ja jotka olivat 65-vuotiaita tai vanhempia kuin nuoremmat potilaat. Seuraa täydellistä verisolujen määrää ja verihiutaleiden määrää iäkkäillä potilailla PENTASA-hoidon aikana.
Yleensä ottaen huomioon maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyys iäkkäillä potilailla PENTASAa määrättäessä.
YLIANNOSTUS
PENTASA 400mg on aminosalisylaatti, ja salisylaattimyrkytyksen oireet voivat olla mahdollisia, kuten: pahoinvointi, oksentelu, vatsakipu, takypnea, hyperpnea, tinnitus ja neurologiset oireet (päänsärky, huimaus, sekavuus, kouristukset). Vaikea salisylaattimyrkytys voi johtaa elektrolyytti- ja veren pH-epätasapainoon ja mahdollisesti muiden elinten (esim. munuaisten ja maksan) vaurioihin.
Yliannostuksen hoito
Mesalamiinin yliannostukselle ei ole spesifistä vastalääkettä; kuitenkin tavanomainen salisylaattitoksisuuden hoito voi olla hyödyllistä akuutin yliannostuksen tapauksessa, ja se voi sisältää maha-suolikanavan dekontaminaation lisäabsorption estämiseksi. Korjaa neste- ja elektrolyyttitasapaino antamalla asianmukaista suonensisäistä hoitoa ja ylläpitää riittävä munuaisten toiminta.
VASTA-AIHEET
PENTASA on vasta-aiheinen potilaille, joiden tiedetään tai epäillään olevan yliherkkiä salisylaateille, aminosalisylaateille tai jollekin tämän lääkkeen aineosalle.
KLIININEN FARMAKOLOGIA
Sulfasalatsiini hajoaa bakteerien vaikutuksesta paksusuolessa sulfapyridiiniksi (SP) ja mesalamiiniksi (5-ASA). Tavallinen suun kautta otettava sulfasalatsiiniannos aktiivisen haavaisen paksusuolitulehduksen hoitoon aikuisilla on 2–4 g vuorokaudessa jaettuna annoksiin. Neljä grammaa sulfasalatsiinia antaa 1,6 g vapaata mesalamiinia paksusuoleen.
Mesalamiinin (ja sulfasalatsiinin) vaikutusmekanismia ei täysin tunneta, mutta se näyttää olevan paikallinen tulehdusta estävä vaikutus paksusuolen epiteelisoluihin. Arakidonihapon (AA) metaboliittien limakalvon tuotanto sekä syklo-oksigenaasireittien (eli prostanoidit) että lipoksigenaasireittien (eli leukotrieenit (LT) ja hydroksi-ikosatetraeenihapot (HETE) kautta lisääntyy potilailla, joilla on haavainen paksusuolitulehdus, ja se on on mahdollista, että mesalamiini vähentää tulehdusta estämällä syklo-oksigenaasia ja estämällä prostaglandiinien (PG) tuotantoa paksusuolessa.
Ihmisen farmakokinetiikka ja aineenvaihdunta
Imeytyminen
PENTASA on etyyliselluloosalla päällystetty pitkävaikutteinen mesalamiiniformulaatio, joka on suunniteltu vapauttamaan terapeuttisia määriä mesalamiinia koko ruoansulatuskanavassa. Virtsaan erittymistä koskevien tietojen perusteella 20–30 % PENTASAn mesalamiinista imeytyy. Sitä vastoin, kun mesalamiinia annetaan suun kautta formuloimattomana 1 g:n vesipitoisena suspensiona, mesalamiini imeytyy noin 80-prosenttisesti.
Plasman mesalamiinipitoisuus saavutti huippunsa noin 1 mikrog/ml 3 tuntia 1 g PENTASA-annoksen jälkeen ja laski kaksivaiheisesti. Kirjallisuudessa kuvataan mesalamiinin keskimääräinen terminaalinen puoliintumisaika suonensisäisen annon jälkeen 42 minuuttia. Koska mesalamiini vapautuu ja imeytyy jatkuvasti PENTASAsta koko maha-suolikanavassa, todellista eliminaation puoliintumisaikaa ei voida määrittää oraalisen annon jälkeen. N-asetyyli-5-aminosalisyylihappo, mesalamiinin (5-aminosalisyylihappo) päämetaboliitti, saavutti huippunsa noin 3 tunnin kuluttua pitoisuudella 1,8 mcg/ml, ja sen pitoisuus seurasi kaksivaiheista laskua. N-asetyyli-5-aminosalisyylihapon farmakologisia vaikutuksia ei tunneta, eikä muita metaboliitteja ole tunnistettu.
Oraalisen mesalamiinin farmakokinetiikka oli epälineaarinen, kun PENTASA-kapseleita annettiin 250 mg:sta 1 g:aan neljä kertaa vuorokaudessa, ja vakaan tilan mesalamiinipitoisuudet plasmassa nousivat noin yhdeksän kertaa, 0,14 mikrogrammasta/ml arvoon 1,21 mikrogrammaa/ml, mikä viittaa kyllästyneeseen ensikierron aineenvaihduntaan. N-asetyyli-5-aminosalisyylihapon farmakokinetiikka oli lineaarinen.
Eliminointi
Noin 130 mg vapaata mesalamiinia löydettiin ulosteesta yhden 1 g:n PENTASA 400 mg:n annoksen jälkeen, mikä oli verrattavissa 140 mg:aan mesalamiinia, joka saatiin talteen 2,5 g:n mooliekvivalenttiannoksesta sulfasalatsiinitablettia. Vapaan mesalamiinin ja salisylaattien eliminaatio ulosteessa lisääntyi suhteessa PENTASA-annokseen. N-asetyyli-5-aminosalisyylihappo oli pääasiallinen virtsaan erittynyt yhdiste (19–30 %) PENTASA 400 mg:n annostelun jälkeen.
Kliiniset tutkimukset
Kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, annos-vastetutkimuksessa (UC-1 ja UC-2) 625 potilaalla, joilla oli aktiivinen lievä tai kohtalainen haavainen paksusuolitulehdus, PENTASA 400 mg suun kautta 4 g/vrk annettuna 1 g neljä kertaa päivässä, tuotti johdonmukaisen parannuksen prospektiivisesti tunnistetuissa ensisijaisissa tehokkuusparametreissa, PGA:ssa, Tx F:ssä ja SI:ssä alla olevan taulukon mukaisesti.
4 gramman PENTASA-annos paransi myös johdonmukaisesti toissijaisia tehokkuusparametreja, nimittäin wc-käyntien tiheyttä, ulosteiden konsistenssia, peräsuolen verenvuotoa, vatsan/peräsuolen kipua ja kiireellisyyttä. 4 gramman PENTASA-annos aiheutti remission endoskooppisten ja oireenmukaisten päätepisteiden perusteella arvioituna.
Joillakin potilailla PENTASA 400 mg:n 2 g:n annoksen havaittiin parantavan mitattuja tehoparametreja. 2 gramman annos antoi kuitenkin epäjohdonmukaisia tuloksia ensisijaisissa tehokkuusparametreissa kahdessa riittävässä ja hyvin kontrolloidussa tutkimuksessa.
POTILASTIEDOT
Tietoja ei toimitettu. Katso VAROTOIMENPITEET osio.
