Aciphex 10mg, 20mg Rabeprazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Aciphex 10mg on ja miten sitä käytetään?
Aciphex 10mg on reseptilääke, jota käytetään gastroesofageaalisen refluksitaudin (GERD), Helicobacter Pylorin ja suoliston haavaumien oireiden hoitoon. Aciphex 10mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Aciphex on protonipumpun estäjä.
Ei tiedetä, onko Aciphex 20 mg viivästetysti vapauttava tabletti turvallinen ja tehokas alle 12-vuotiaille lapsille. Ei tiedetä, onko Aciphex 10 mg viivästetysti vapauttava tabletti (sprinklit) turvallinen ja tehokas alle 1-vuotiaille lapsille.
Mitkä ovat Aciphex 10mg:n mahdolliset sivuvaikutukset?
Aciphex voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- verinen ripuli,
- äkillinen kipu tai lonkan, ranteen tai selän liikkumisvaikeus,
- kohtaukset (kouristukset),
- virtsata tavallista vähemmän,
- verta virtsassasi,
- turvotus,
- nopea painonnousu,
- nivelkipu,
- ihottuma poskissasi tai käsivarsissasi, jota auringonvalo pahentaa,
- huimaus,
- nopea tai epäsäännöllinen syke,
- tärisevät tai nykivät lihasliikkeet (vapina),
- hermostunut olo,
- lihaskrampit tai kouristukset käsissäsi tai jaloissasi,
- yskä,
- nielemis- tai tukehtumisvaikeudet,
- päänsärky,
- heikkous,
- mustelmat,
- epätavallinen verenvuoto (nenäverenvuoto, ikenet),
- punainen tai vaaleanpunainen virtsa,
- kova kuukautisvuoto,
- veriset tai tervamaiset ulosteet,
- veren yskiminen tai oksennus, joka näyttää kahvinporolta,
- vaikeasti hallittava verenvuoto,
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Aciphexin yleisimpiä sivuvaikutuksia ovat:
- päänsärky,
- pahoinvointi,
- oksentelua,
- ripuli,
- ummetus,
- vatsakipu,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Aciphexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
KUVAUS
ACIPHEX 20 mg viivästetysti vapauttavien tablettien vaikuttava aine on rabepratsolinatrium, joka on protonipumpun estäjä. Se on substituoitu bentsimidatsoli, joka tunnetaan kemiallisesti 2-[[[4-(3-metoksipropoksi)-3-metyyli-2-pyridinyyli]-metyyli]sulfinyyli]-1H-bentsimidatsolin natriumsuolana. Sen empiirinen kaava on C18H20N3NaO3S ja molekyylipaino 381,42. Rabepratsolinatrium on valkoinen tai hieman kellertävänvalkoinen kiinteä aine. Se liukenee hyvin veteen ja metanoliin, liukenee vapaasti etanoliin, kloroformiin ja etyyliasetaattiin ja liukenematon eetteriin ja n-heksaaniin. Rabepratsolinatriumin stabiilisuus on pH:n funktio; se hajoaa nopeasti happamissa väliaineissa ja on vakaampi alkalisissa olosuhteissa. Rakennekuva on:
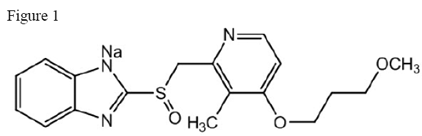
ACIPHEX on saatavana suun kautta annettavina viivästetysti vapauttavina enteropäällysteisinä tabletteina, jotka sisältävät 20 mg rabepratsolinatriumia.
20 mg:n tabletin inaktiiviset aineet ovat karnaubavaha, krospovidoni, diasetyloidut monoglyseridit, etyyliselluloosa, hydroksipropyyliselluloosa, hypromelloosiftalaatti, magnesiumstearaatti, mannitoli, propyleeniglykoli, natriumhydroksidi, natriumstearyylifumaraatti, talkki ja talkki. Keltainen rautaoksidi on tabletin päällysteen väriaine. Punainen rautaoksidi on mustepigmentti.
INDIKAATIOT
Erosiivisen tai haavaisen GERD:n paraneminen aikuisilla
ACIPHEX 20 mg viivästetysti vapauttavat tabletit on tarkoitettu lyhytaikaiseen (4–8 viikkoa) hoitoon erosiivisen tai haavaisen gastroesofageaalisen refluksitaudin (GERD) paranemiseen ja oireiden lievitykseen. Niille potilaille, jotka eivät ole parantuneet 8 viikon hoidon jälkeen, voidaan harkita ylimääräistä 8 viikon ACIPHEX-hoitoa.
Erosiivisen tai haavaisen GERD:n paranemisen ylläpito aikuisilla
ACIPHEX-tabletit on tarkoitettu närästysoireiden paranemisen ylläpitämiseen ja uusiutumisasteen vähentämiseen potilailla, joilla on eroosiivinen tai haavainen gastroesofageaalinen refluksitauti (GERD-hoito). Kontrolloidut tutkimukset eivät kestä yli 12 kuukautta.
Oireisen GERD:n hoito aikuisilla
ACIPHEX 20 mg viivästyneesti vapauttavat tabletit on tarkoitettu päivä- ja yönärästyksen ja muiden GERD:hen liittyvien oireiden hoitoon aikuisilla enintään 4 viikon ajan.
Pohjukaissuolihaavojen paraneminen aikuisilla
ACIPHEX 20 mg viivästetysti vapauttavat tabletit on tarkoitettu lyhytaikaiseen (enintään neljä viikkoa) hoitoon pohjukaissuolihaavojen paranemiseen ja oireiden lievitykseen. Suurin osa potilaista paranee neljässä viikossa.
Helicobacter Pylori -hävitys vähentää pohjukaissuolihaavan uusiutumisen riskiä aikuisilla
ACIPHEX 10 mg viivästetysti vapautuvat tabletit yhdessä amoksisilliinin ja klaritromysiinin kanssa kolmena lääkkeenä on tarkoitettu H. pylori -infektion ja pohjukaissuolen haavataudin (aktiivinen tai anamneesissa viimeisten 5 vuoden aikana) hoitoon H. pylorin hävittämiseksi. . H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
Potilaille, joiden hoito epäonnistuu, on tehtävä herkkyystesti. Jos osoitetaan resistenssi klaritromysiinille tai herkkyystestaus ei ole mahdollista, on aloitettava vaihtoehtoinen antimikrobinen hoito [ks. KLIININEN FARMAKOLOGIA ja täydelliset klaritromysiinin reseptitiedot].
Patologisten liikaerittävien tilojen hoito, mukaan lukien Zollinger-Ellisonin oireyhtymä aikuisilla
ACIPHEX-tabletit on tarkoitettu pitkäaikaiseen patologisten liikaeritystilojen, mukaan lukien Zollinger-Ellisonin oireyhtymän, hoitoon.
Oireisen GERD:n hoito 12-vuotiailla ja sitä vanhemmilla nuorilla
ACIPHEX 20 mg viivästetysti vapauttavat tabletit on tarkoitettu oireisen GERD:n hoitoon 12-vuotiaille ja sitä vanhemmille nuorille enintään 8 viikon ajan.
ANNOSTELU JA HALLINNOINTI
Taulukossa 1 on esitetty ACIPHEX-viiveesti vapauttavien tablettien suositeltu annostus aikuisille ja 12-vuotiaille ja sitä vanhemmille nuorille. ACIPHEX-viivästystablettien käyttöä ei suositella 1-vuotiaille ja alle 12-vuotiaille lapsipotilaille, koska pienin saatavilla oleva tabletin vahvuus (20 mg) ylittää näille potilaille suositellun annoksen. Käytä toista rabepratsoliformulaatiota lapsipotilaille, joiden ikä on 1–12 vuotta.
Hallinto-ohjeet
- Niele ACIPHEX 20 mg viivästetysti vapauttavat tabletit kokonaisina. Älä pureskele, murskaa tai halkaise tabletteja.
- Pohjukaissuolihaavojen hoitoon ota ACIPHEX-depottabletit aterian jälkeen.
- Helicobacter pylori -hävittämiseen ota ACIPHEX 20 mg viivästetysti vapauttavat tabletit ruoan kanssa.
- Kaikissa muissa käyttöaiheissa ACIPHEX-depottabletit voidaan ottaa ruoan kanssa tai ilman.
- Ota unohtunut annos mahdollisimman pian. Jos on melkein aika ottaa seuraava annos, jätä unohtunut annos väliin ja palaa normaaliin aikatauluun. Älä ota kahta annosta samanaikaisesti.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
ACIPHEX 10 mg viivästetysti vapauttavia tabletteja on saatavilla yhtenä vahvuutena, 20 mg. Tabletit ovat pyöreitä, vaaleankeltaisia, enteropäällysteisiä, kaksoiskuperia tabletteja. "ACIPHEX 20" on painettu punaisella tabletin toiselle puolelle.
Varastointi ja käsittely
ACIPHEX 20 mg toimitetaan viivästetysti vapauttavina vaaleankeltaisina enteropäällysteisinä tabletteina. Nimi ja vahvuus milligrammoina (ACIPHEX 20) on painettu toiselle puolelle.
Pullot 30 ( NDC 69784-243-30)
Säilytä 25°C (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ]. Suojaa kosteudelta.
Jakelija: Eisai Inc., Woodcliff Lake, NJ 07677. Tarkistettu: maaliskuu 2022
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Akuutti tubulointerstitiaalinen nefriitti [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Luun murtuma [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihohaittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Ihon ja systeeminen lupus erythematosus [katso VAROITUKSET JA VAROTOIMET ]
- Syanokobalamiinin (B-12-vitamiinin) puutos [katso VAROITUKSET JA VAROTOIMET ]
- Hypomagnesemia ja mineraaliaineenvaihdunta [katso VAROITUKSET JA VAROTOIMET ]
- Pohjarauhasten polyypit [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset suoritetaan vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset
Alla kuvatut tiedot heijastavat altistumista ACIPHEX-tableteille 1064 aikuispotilaalla, jotka olivat altistuneet enintään 8 viikon ajan. Tutkimukset olivat pääasiassa lumelääke- ja aktiivikontrolloituja tutkimuksia aikuispotilailla, joilla oli eroosiivinen tai haavainen gastroesofageaalinen refluksitauti (GERD), pohjukaissuolihaava ja mahahaava. Väestön keski-ikä oli 53 vuotta (vaihteluväli 18-89 vuotta), ja sen suhde oli noin 60 % miehiä ja 40 % naisia. Rotujakauma oli 86 % valkoihoisia, 8 % afroamerikkalaisia, 2 % aasialaisia ja 5 % muita. Useimmat potilaat saivat joko 10 mg, 20 mg tai 40 mg päivässä ACIPHEX 20 mg viivästetysti vapauttavia tabletteja.
Analyysi haittavaikutuksista, joita esiintyi ≥ 2 %:lla potilaista, joita hoidettiin ACIPHEX 10 mg:n viivästetysti vapauttavilla tableteilla (n = 1064) ja joita esiintyi useammin kuin lumelääkettä (n = 89) kontrolloiduissa Pohjois-Amerikan ja Euroopan akuuttihoitotutkimuksissa, paljasti seuraavan haittavaikutukset: kipu (3 % vs. 1 %), nielutulehdus (3 % vs. 2 %), ilmavaivat (3 % vs. 1 %), infektio (2 % vs. 1 %) ja ummetus (2 % vs. 1 %). 1 %).
Kolme pitkäaikaista ylläpitotutkimusta käsitti yhteensä 740 aikuista potilasta; vähintään 54 % aikuisista potilaista altistui ACIPHEX 20 mg viivästystableteille 6 kuukauden ajan ja vähintään 33 % altistui 12 kuukauden ajan. 740 aikuispotilaasta 247 (33 %) ja 241 (33 %) potilasta sai 10 mg ja 20 mg ACIPHEX 20 mg viivästetysti vapauttavia tabletteja, kun taas 169 (23 %) potilasta sai lumelääkettä ja 83 (11 %) potilasta. omepratsoli.
Rabepratsolin turvallisuusprofiili aikuisten ylläpitotutkimuksissa oli yhdenmukainen akuuteissa tutkimuksissa havaitun kanssa.
Harvempia haittavaikutuksia, joita on havaittu kontrolloiduissa kliinisissä tutkimuksissa (
Yhdistelmähoito amoksisilliinilla ja klaritromysiinillä
Kliinisissä tutkimuksissa, joissa käytettiin yhdistelmähoitoa rabepratsolin sekä amoksisilliinin ja klaritromysiinin (RAC) kanssa, ei havaittu tälle lääkeyhdistelmälle ainutlaatuisia haittavaikutuksia. Yhdysvalloissa tehdyssä monikeskustutkimuksessa yleisimmin raportoidut lääkkeeseen liittyvät haittavaikutukset potilailla, jotka saivat RAC-hoitoa 7 tai 10 päivän ajan, olivat ripuli (8 % ja 7 %) ja makuaistin vääristymä (6 % ja 10 %).
Kliinisesti merkittäviä laboratorioarvojen poikkeavuuksia ei havaittu erityisesti lääkeyhdistelmissä.
Lisätietoja amoksisilliinin tai klaritromysiinin aiheuttamista haittavaikutuksista tai laboratoriomuutoksista on niiden vastaavissa lääkemääräystiedoissa Haittavaikutukset-osiossa.
Pediatria
Monikeskustutkimuksessa avoimessa tutkimuksessa 12–16-vuotiailla nuorilla potilailla, joilla oli kliininen diagnoosi oireinen GERD tai endoskooppisesti todettu GERD, haittavaikutusprofiili oli samanlainen kuin aikuisilla. Haittavaikutukset, joita raportoitiin ilman yhteyttä ACIPHEX 20 mg:n viivästetysti vapauttaviin tabletteihin ja joita esiintyi ≥ 2 %:lla 111 potilaasta, olivat päänsärky (9,9 %), ripuli (4,5 %), pahoinvointi (4,5 %), oksentelu (3,6 %) ja vatsakipu (3,6 %). Tähän liittyvät raportoidut haittavaikutukset, joita esiintyi ≥ 2 %:lla potilaista, olivat päänsärky (5,4 %) ja pahoinvointi (1,8 %). Tässä tutkimuksessa ei raportoitu haittavaikutuksia, joita ei aiemmin havaittu aikuisilla.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu rabepratsolin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
Veri- ja imusolmukkeiden häiriöt: agranulosytoosi, hemolyyttinen anemia, leukopenia, pansytopenia, trombosytopenia
Korva- ja labyrinttihäiriöt: huimaus
Silmäsairaudet: näön hämärtyminen
Ruoansulatuskanavan häiriöt: pohjarauhasen polyypit
Yleiset häiriöt ja hallintosivuston ehdot: äkkikuolema
Maksan ja sappien häiriöt: keltaisuus
Immuunijärjestelmän häiriöt: anafylaksia, angioödeema, systeeminen lupus erythematosus, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi (joissakin tapauksissa kuolemaan johtava), DRESS, AGEP
Infektiot ja infektiot: Clostridium difficileen liittyvä ripuli
Tutkimukset: Protrombiiniajan/INR:n nousu (potilailla, joita hoidetaan samanaikaisesti varfariinilla), TSH:n nousu
Aineenvaihdunta- ja ravitsemushäiriöt: hyperammonemia, hypomagnesemia, hypokalsemia, hypokalemia [Varoitukset ja varotoimet 5.8], hyponatremia
Tuki- ja liikuntaelimistön häiriöt: luunmurtuma, rabdomyolyysi
Hermoston häiriöt: kooma
Psyykkiset häiriöt: delirium, desorientaatio
Munuaisten ja virtsateiden häiriöt: interstitiaalinen nefriitti
Hengityselinten, rintakehän ja välikarsinan häiriöt: interstitiaalinen keuhkokuume
Ihon ja ihonalaisten kudosten häiriöt: vakavat dermatologiset reaktiot, mukaan lukien rakkula- ja muut ihottumat, ihon lupus erythematosus, erythema multiforme
HUUMEIDEN VUOROVAIKUTUKSET
Taulukko 2 sisältää lääkkeet, joilla on kliinisesti merkittäviä lääkkeiden yhteisvaikutuksia ja yhteisvaikutuksia diagnostisten tekijöiden kanssa, kun niitä annetaan samanaikaisesti ACIPHEX 10 mg:n viivästetysti vapauttavien tablettien kanssa, sekä ohjeet niiden ehkäisyyn tai hoitoon.
Katso samanaikaisesti käytettyjen lääkkeiden pakkausmerkintöjä saadaksesi lisätietoja yhteisvaikutuksista PPI:iden kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Läsnäolo mahalaukun pahanlaatuisuuden
Aikuisilla oireenmukainen vaste ACIPHEX 10 mg -hoidolle ei sulje pois mahalaukun pahanlaatuisuuden esiintymistä. Harkitse lisäseurantaa ja diagnostisia testejä aikuispotilaille, joilla on suboptimaalinen vaste tai varhainen oireinen uusiutuminen PPI-hoidon päätyttyä.
Vuorovaikutus varfariinin kanssa
Rabepratsolin ja varfariinin vakaan tilan yhteisvaikutuksia ei ole arvioitu riittävästi potilailla. INR:n ja protrombiiniajan pidentymistä on raportoitu potilailla, jotka ovat saaneet samanaikaisesti protonipumpun estäjää ja varfariinia. INR:n ja protrombiiniajan pidentyminen voi johtaa epänormaaliin verenvuotoon ja jopa kuolemaan. Potilaita, joita hoidetaan ACIPHEX 10 mg viivästetysti vapauttavilla tableteilla ja varfariinilla samanaikaisesti, on ehkä seurattava INR:n ja protrombiiniajan pidentymisen varalta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Akuutti tubulointerstitiaalinen nefriitti
Akuuttia tubulointerstitiaalista nefriittiä (TIN) on havaittu PPI-lääkkeitä käyttävillä potilailla, ja se voi ilmaantua milloin tahansa PPI-hoidon aikana. Potilailla voi esiintyä erilaisia merkkejä ja oireita oireellisista yliherkkyysreaktioista epäspesifisiin munuaisten toiminnan heikkenemisen oireisiin (esim. huonovointisuus, pahoinvointi, anoreksia). Raportoiduissa tapaussarjoissa joillekin potilaille diagnosoitiin biopsia ja munuaisten ulkopuolisia oireita (esim. kuumetta, ihottumaa tai nivelkipua) ei ilmennyt.
Lopeta ACIPHEX ja arvioi potilaat, joilla epäillään akuuttia TIN:ää [katso VASTA-AIHEET ].
Clostridium Difficilen aiheuttama ripuli
Julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito, kuten ACIPHEX, saattaa liittyä Clostridium difficilen aiheuttaman ripulin lisääntyneeseen riskiin, erityisesti sairaalapotilailla. Tätä diagnoosia tulisi harkita ripulille, joka ei parane [katso HAITTAVAIKUTUKSET ].
Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen.
Clostridium difficile -bakteeriin liittyvää ripulia (CDAD) on raportoitu lähes kaikkien antibakteeristen aineiden käytön yhteydessä. Lisätietoja spesifistä antibakteerisista aineista (klaritromysiini ja amoksisilliini), jotka on tarkoitettu käytettäväksi yhdessä ACIPHEXin kanssa, on vastaavien lääkemääräystietojen osioissa Varoitukset ja varotoimet.
Luunmurtuma
Useat julkaistut aikuisilla tehdyt havaintotutkimukset viittaavat siihen, että PPI-hoito saattaa liittyä lisääntyneeseen osteoporoosiin liittyvien lonkka-, ranteen- tai selkärangan murtumien riskiin. Murtumariski lisääntyi potilailla, jotka saivat suuria annoksia, jotka määriteltiin useiksi päivittäisiksi annoksiksi, ja pitkäaikaista PPI-hoitoa (vuoden tai pidempään). Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen. Potilaita, joilla on osteoporoosiin liittyvien murtumien riski, tulee hoitaa vahvistettujen hoitoohjeiden mukaisesti [katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET ].
Vakavat ihohaittavaikutukset
PPI-lääkkeiden käytön yhteydessä on raportoitu vaikeita ihon haittavaikutuksia, mukaan lukien Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) ja akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP). [katso HAITTAVAIKUTUKSET ]. Lopeta ACIPHEX-hoito vakavien ihohaittavaikutusten tai muiden yliherkkyysoireiden ensimmäisten merkkien tai oireiden ilmetessä ja harkitse lisäarviointia.
Ihon ja systeeminen lupus erythematosus
Ihon lupus erythematosus (CLE) ja systeeminen lupus erythematosus (SLE) on raportoitu potilailla, jotka käyttävät PPI-lääkkeitä, mukaan lukien rabepratsolia. Nämä tapahtumat ovat ilmenneet sekä uutena ilmaantumisena että olemassa olevan autoimmuunisairauden pahenemisena. Suurin osa PPI:n aiheuttamista lupus erythematosus -tapauksista oli CLE.
Yleisin PPI-lääkkeillä hoidetuilla potilailla raportoitu CLE:n muoto oli subakuutti CLE (SCLE), ja se esiintyi viikkojen tai vuosien kuluessa jatkuvan lääkehoidon jälkeen potilailla, jotka vaihtelivat imeväisistä vanhuksiin. Yleensä histologiset löydökset havaittiin ilman elinten osallistumista.
Systeemistä lupus erythematosusta (SLE) on raportoitu harvemmin kuin CLE:tä PPI-lääkkeitä saavilla potilailla. PPI:hen liittyvä SLE on yleensä lievempi kuin ei-lääkkeiden aiheuttama SLE. SLE puhkesi tyypillisesti päivien tai vuosien kuluessa hoidon aloittamisesta ensisijaisesti potilailla, jotka vaihtelivat nuorista aikuisista vanhuksiin. Suurimmalla osalla potilaista oli ihottumaa; kuitenkin myös nivelkipua ja sytopeniaa raportoitiin.
Vältä PPI-lääkkeiden antamista pidempään kuin lääketieteellisesti on tarpeen. Jos ACIPHEX-hoitoa saavilla potilailla havaitaan CLE:n tai SLE:n mukaisia merkkejä tai oireita, lopeta lääkkeen käyttö ja lähetä potilas asianmukaisen asiantuntijan arvioitavaksi. Useimmat potilaat paranevat, kun pelkkä PPI-hoito lopetetaan 4–12 viikossa. Serologiset testit (esim. ANA) voivat olla positiivisia ja kohonneiden serologisten testien tulosten korjaaminen voi kestää kauemmin kuin kliiniset oireet.
Syanokobalamiinin (B-12-vitamiinin) puutos
Päivittäinen hoito millä tahansa happoa vähentävillä lääkkeillä pitkän ajan (esim. yli 3 vuoden ajan) voi johtaa syanokobalamiinin (B-12-vitamiinin) imeytymishäiriöön, jonka aiheuttaa hypo- tai aklorhydria. Kirjallisuudessa on raportoitu harvoin syanokobalamiinin puutteesta happoa vähentävän hoidon yhteydessä. Tätä diagnoosia tulee harkita, jos ACIPHEX-hoitoa saavilla potilailla havaitaan syanokobalamiinin puutteen mukaisia kliinisiä oireita.
Hypomagnesemia ja mineraaliaineenvaihdunta
Oireista ja oireetonta hypomagnesemiaa on raportoitu harvoin potilailla, joita on hoidettu PPI-lääkkeillä vähintään kolmen kuukauden ajan, useimmissa tapauksissa vuoden hoidon jälkeen. Vakavia haittavaikutuksia ovat tetania, rytmihäiriöt ja kouristukset. Hypomagnesemia voi johtaa hypokalsemiaan ja/tai hypokalemiaan ja voi pahentaa taustalla olevaa hypokalsemiaa riskipotilailla. Useimmilla potilailla hypomagnesemian hoito vaati magnesiumin korvaamista ja PPI:n lopettamista.
Potilaiden, joiden odotetaan saavan pitkäaikaista hoitoa tai jotka käyttävät PPI-lääkkeitä lääkkeiden, kuten digoksiinin tai lääkkeiden kanssa, jotka voivat aiheuttaa hypomagnesemiaa (esim. diureetit), terveydenhuollon ammattilaiset voivat harkita magnesiumpitoisuuden seurantaa ennen PPI-hoidon aloittamista ja määräajoin [ks. HAITTAVAIKUTUKSET ].
Harkitse magnesium- ja kalsiumtasojen seurantaa ennen ACIPHEX-hoidon aloittamista ja ajoittain hoidon aikana potilailla, joilla on hypokalsemian riski (esim. hypoparatyreoosi). Täydennä tarvittaessa magnesiumia ja/tai kalsiumia. Jos hypokalsemia ei kestä hoitoa, harkitse PPI-hoidon lopettamista.
Vuorovaikutus metotreksaatin kanssa
Kirjallisuus viittaa siihen, että PPI-lääkkeiden samanaikainen käyttö metotreksaatin kanssa (ensisijaisesti suurina annoksina; katso metotreksaatin ohjeet) voi nostaa ja pidentää metotreksaatin ja/tai sen metaboliitin pitoisuuksia seerumissa, mikä saattaa johtaa metotreksaattitoksisuuteen. Suuria metotreksaattiannoksia käytettäessä PPI:n väliaikaista keskeyttämistä voidaan harkita joillakin potilailla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Pohjarauhasten polyypit
PPI:n käyttöön liittyy lisääntynyt pohjukaissuolen polyyppien riski, joka lisääntyy pitkäaikaisessa käytössä, erityisesti yli vuoden. Suurin osa PPI-käyttäjistä, joille kehittyi pohjukaisrauhasen polyyppeja, oli oireettomia ja pohjukaisrauhasen polyypit tunnistettiin sattumalta endoskopiassa. Käytä lyhyintä PPI-hoitoa, joka sopii hoidettavaan sairauteen.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Akuutti tubulointerstitiaalinen nefriitti
Neuvo potilasta tai hoitajaa soittamaan välittömästi potilaan terveydenhuollon tarjoajalle, jos heillä on akuuttiin tubulointerstitiaaliseen nefriittiin liittyviä merkkejä ja/tai oireita [ks. VAROITUKSET JA VAROTOIMET ].
Clostridium Difficilen aiheuttama ripuli
Neuvo potilasta tai hoitajaa soittamaan välittömästi potilaan terveydenhuollon tarjoajalle, jos heillä on ripuli, joka ei parane [katso VAROITUKSET JA VAROTOIMET ].
Luunmurtuma
Neuvo potilasta tai hoitajaa ilmoittamaan kaikista murtumista, erityisesti lonkan, ranteen tai selkärangan murtumista, potilaan terveydenhuollon tarjoajalle [katso VAROITUKSET JA VAROTOIMET ].
Vakavat ihohaittavaikutukset
Neuvo potilasta tai hoitajaa lopettamaan ACIPHEX 20 mg:n käyttö ja ilmoittamaan terveydenhuollon tarjoajalle kaikista vakavan ihohaittareaktion merkeistä ja oireista tai muista yliherkkyysoireista [ks. VAROITUKSET JA VAROTOIMET ].
Ihon ja systeeminen lupus erythematosus
Neuvo potilasta tai hoitajaa soittamaan välittömästi potilaan terveydenhuollon tarjoajalle uusien tai pahenevien oireiden vuoksi, jotka liittyvät ihon tai systeemiseen lupus erythematosukseen [ks. VAROITUKSET JA VAROTOIMET ].
Syanokobalamiinin (B-12-vitamiinin) puutos
Neuvo potilasta tai hoitajaa ilmoittamaan kaikista kliinisistä oireista, jotka voivat liittyä syanokobalamiinin puutteeseen potilaan terveydenhuollon tarjoajalle, jos he ovat saaneet ACIPHEX 20 mg pidempään kuin 3 vuotta [ks. VAROITUKSET JA VAROTOIMET ].
Hypomagnesemia ja mineraaliaineenvaihdunta
Neuvo potilasta tai hoitajaa ilmoittamaan kaikista kliinisistä oireista, jotka voivat liittyä hypomagnesemiaan, hypokalsemiaan, hypokalemiaan ja hyponatremiaan potilaan terveydenhuollon tarjoajalle, jos he ovat saaneet ACIPHEXia vähintään 3 kuukauden ajan [ks. VAROITUKSET JA VAROTOIMET ].
Huumeiden vuorovaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he käyttävät rilpiviriiniä sisältäviä tuotteita [ks. VASTA-AIHEET ], varfariini, digoksiini tai suuriannoksinen metotreksaatti [ks VAROITUKSET JA VAROTOIMET ].
Hallinto
- Niele ACIPHEX 10 mg viivästetysti vapauttavat tabletit kokonaisina. Älä pureskele, murskaa tai halkaise tabletteja.
- Pohjukaissuolihaavojen hoitoon ota ACIPHEX-depottabletit aterian jälkeen.
- Helicobacter pylori -hävittämiseen ota ACIPHEX 20 mg viivästetysti vapauttavat tabletit ruoan kanssa.
- Kaikissa muissa käyttöaiheissa ACIPHEX 10 mg viivästetysti vapauttavat tabletit voidaan ottaa ruoan kanssa tai ilman.
- Ota unohtunut annos mahdollisimman pian. Jos on melkein aika ottaa seuraava annos, jätä unohtunut annos väliin ja palaa normaaliin aikatauluun. Älä ota kahta annosta samanaikaisesti.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
88/104 viikkoa kestäneessä karsinogeenisuustutkimuksessa CD-1-hiirillä rabepratsoli oraalisilla annoksilla 100 mg/kg/vrk asti ei lisännyt kasvainten esiintymistä. Suurin testattu annos aiheutti systeemisen altistuksen rabepratsolille (AUC) 1,40 μg•hr/ml, joka on 1,6 kertaa ihmisen altistus (plasman AUC0-∞ = 0,88 μg•hr/ml) suositellulla GERD-annoksella (20 mg/ml). päivä). 28 viikkoa kestäneessä karsinogeenisuustutkimuksessa p53+/-siirtogeenisillä hiirillä rabepratsoli oraalisilla annoksilla 20, 60 ja 200 mg/kg/vrk ei lisännyt kasvainten ilmaantuvuutta, mutta aiheutti mahalaukun limakalvon liikakasvua kaikilla annoksilla. Systeeminen altistus rabepratsolille annoksella 200 mg/kg/vrk on noin 17-24 kertaa suurempi kuin ihmisen altistuminen suositellulla GERD-annoksella. Sprague-Dawley-rotilla tehdyssä 104 viikkoa kestäneessä karsinogeenisuustutkimuksessa uroksia hoidettiin oraalisilla annoksilla 5, 15, 30 ja 60 mg/kg/vrk ja naaraita 5, 15, 30, 60 ja 120 mg/kg/vrk. . Rabepratsoli aiheutti mahalaukun enterokromafiinia muistuttavia (ECL) solujen liikakasvua uros- ja naarasrotilla ja ECL-solukarsinoidikasvaimia naarasrotilla kaikilla annoksilla, pienimmällä testatulla annoksella mukaan lukien. Pienin annos (5 mg/kg/vrk) sai aikaan noin 0,1 μg•h/ml systeemisen altistuksen rabepratsolille (AUC), joka on noin 0,1 kertaa suurempi kuin ihmisen altistuminen suositellulla GERD-annoksella. Urosrotilla ei havaittu hoitoon liittyviä kasvaimia annoksilla 60 mg/kg/vrk asti, jolloin rabepratsolin plasmaaltistus (AUC) oli noin 0,2 μg•h/ml (0,2 kertaa ihmisen altistus suositellulla GERD-annoksella).
Rabepratsoli oli positiivinen Ames-testissä, kiinanhamsterin munasarjasolujen (CHO/HGPRT) eteenpäin suuntautuvassa geenimutaatiotestissä ja hiiren lymfoomasolun (L5178Y/TK+/–) eteenpäin suuntautuvassa geenimutaatiotestissä. Sen demetyloitunut metaboliitti oli myös positiivinen Amesin testissä. Rabepratsoli oli negatiivinen in vitro kiinanhamsterin keuhkosolujen kromosomipoikkeavuustestissä, in vivo hiiren mikrotumatestissä sekä in vivo ja ex vivo rotan hepatosyyttien unscheduled DNA synthesis (UDS) -testeissä.
Rabepratsolin suonensisäisillä annoksilla 30 mg/kg/vrk asti (plasman AUC 8,8 μg•h/ml, noin 10 kertaa suurempi kuin ihmisen altistus suositellulla GERD-annoksella) ei havaittu vaikuttavan uros- ja lisääntymiskykyyn. naarasrotat.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
ACIPHEX 10 mg:n käytöstä raskaana oleville naisille ei ole saatavilla ihmisillä koskevia tietoja, jotka kertoisivat lääkkeeseen liittyvistä riskeistä. Vakavien synnynnäisten epämuodostumien ja keskenmenon taustariskiä mainituilla populaatioilla ei tunneta. Vakavien synnynnäisten epämuodostumien taustariski Yhdysvalloissa on kuitenkin 2–4 % ja keskenmenon 15–20 % kliinisesti tunnistetuista raskauksista. Haitallisia kehitysvaikutuksia ei havaittu eläimillä tehdyissä lisääntymistutkimuksissa, joissa rabepratsolia annettiin organogeneesin aikana 13-kertaisella ja 8-kertaisella ihmisellä plasman pitoisuus-aikakäyrän alapuolella (AUC) suositellulla GERD-annoksella rotilla ja kaniineilla [ks. Data ].
Muutoksia luun morfologiassa havaittiin rottien jälkeläisillä, joita hoidettiin suun kautta eri PPI-annoksilla suurimman osan raskauden ja imetyksen ajan. Kun äidin antaminen rajoittui vain raskauteen, jälkeläisten luun fysikaaliseen morfologiaan ei ollut vaikutuksia missään iässä [ks. Data ].
Data
Eläinten tiedot
Alkion ja sikiön kehitystutkimuksia on tehty rotilla organogeneesin aikana suonensisäisillä rabepratsolin annoksilla 50 mg/kg/vrk asti (plasman AUC 11,8 μg•hr/ml, noin 13 kertaa suurempi kuin ihmisen altistus suositellulla suun kautta otetulla GERD-annoksella). ja kaniinit laskimonsisäisillä annoksilla 30 mg/kg/vrk asti (plasman AUC 7,3 μg•hr/ml, noin 8 kertaa suurempi kuin ihmisen altistuminen suositellulla suun kautta otetulla GERD-annoksella) eivätkä ne ole osoittaneet näyttöä sikiölle aiheutuvista haitoista. rabepratsoli.
Rabepratsolin antaminen rotille tiineyden loppuvaiheessa ja imetyksen aikana 400 mg/kg/vrk suun kautta (noin 195-kertainen ihmisen oraaliannos mg/m2:n perusteella) johti poikasten painonnousun vähenemiseen.
Pre- ja postnataalinen kehitystoksisuustutkimus rotilla, joissa oli muita päätepisteitä luun kehityksen arvioimiseksi, suoritettiin käyttämällä erilaista PPI:tä noin 3,4–57 kertaa ihmisen suun kautta otettavaan annokseen verrattuna kehon pinta-alan perusteella. Vähentynyt reisiluun pituus, aivokuoren leveys ja paksuus, pienentynyt sääriluun kasvulevyn paksuus ja vähäisestä lievään luuytimen hyposellulaarisuus havaittiin tämän PPI:n annoksilla, jotka olivat yhtä suuria tai suurempia kuin 3,4 kertaa suun kautta otettu annos ihmiselle kehon pinta-alasta laskettuna. . Fyysistä dysplasiaa reisiluun havaittiin myös jälkeläisillä sen jälkeen, kun jälkeläiset olivat altistuneet PPI:lle annoksilla, jotka olivat yhtä suuria tai suurempia kuin 33,6 kertaa ihmisen suun kautta otettu annos kehon pinta-alasta laskettuna. Vaikutuksia emon luuhun havaittiin raskaana olevilla ja imettävillä rotilla pre- ja postnataalisessa toksisuustutkimuksessa, kun PPI:tä annettiin suun kautta annoksina, jotka olivat 3,4–57 kertaa ihmisen suun kautta otettu annos kehon pinta-alalla laskettuna. Kun rotille annettiin annosta gestaatiopäivästä 7 vieroituspäivään 21. postnataalisena päivänä, havaittiin tilastollisesti merkitsevä jopa 14 %:n lasku emon reisiluun painossa (verrattuna lumelääkehoitoon) annoksilla, jotka olivat vähintään 33,6 kertaa suun kautta otetut ihmisannokset. kehon pinta-alan perusteella.
Rotilla tehty kehitystoksisuustutkimus, jossa oli lisäaikapisteitä poikien luun kehityksen arvioimiseksi syntymän jälkeisestä päivästä 2 aikuisuuteen, suoritettiin eri PPI:llä oraalisilla annoksilla 280 mg/kg/vrk (noin 68 kertaa suun kautta otettava annos ihmiselle kehon pinta-alan perusteella), jolloin lääkettä annettiin joko 7. raskauspäivästä tai 16. raskauspäivästä synnytykseen asti. Kun äidin antaminen rajoittui vain raskauteen, jälkeläisten luun fysikaaliseen morfologiaan ei ollut vaikutuksia missään iässä.
Imetys
Riskien yhteenveto
Imetystutkimuksia ei ole suoritettu arvioimaan rabepratsolin esiintymistä äidinmaidossa, rabepratsolin vaikutuksia imetettävään lapseen tai rabepratsolin vaikutuksia maidontuotantoon. Rabepratsolia on rotan maidossa. Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä ACIPHEX-tarvetta ja ACIPHEXin mahdollisia haitallisia vaikutuksia imetettävään lapseen tai äidin taustalla olevaa tilaa.
Käyttö lapsille
ACIPHEX 20 mg viivästetysti vapauttavien tablettien turvallisuus ja tehokkuus on osoitettu lapsipotilailla 12-vuotiaille ja sitä vanhemmille nuorille potilaille oireisen GERD:n hoidossa. ACIPHEX 20 mg viivästetysti vapauttavien tablettien käyttöä tässä ikäryhmässä tukevat riittävät ja hyvin kontrolloidut tutkimukset aikuisilla ja monikeskustutkimus, satunnaistettu, avoin rinnakkaisryhmätutkimus, johon osallistui 111 12–16-vuotiasta nuorta potilasta. Potilailla oli kliininen diagnoosi oireisesta GERD:stä tai epäilty tai endoskooppisesti todistettu GERD, ja heidät satunnaistettiin saamaan joko 10 mg tai 20 mg kerran päivässä enintään 8 viikon ajan turvallisuuden ja tehon arvioimiseksi. Haittavaikutusprofiili nuorilla potilailla oli samanlainen kuin aikuisilla. Tähän liittyvät raportoidut haittavaikutukset, joita esiintyi ≥ 2 %:lla potilaista, olivat päänsärky (5 %) ja pahoinvointi (2 %). Näissä tutkimuksissa ei raportoitu haittavaikutuksia, joita ei aiemmin havaittu aikuisilla.
ACIPHEX 10 mg viivästettyjen tablettien turvallisuutta ja tehoa ei ole osoitettu lapsipotilailla seuraavissa tapauksissa:
- Erosiivisen tai haavaisen GERD:n paraneminen
- Erosiivisen tai haavaisen GERD:n paranemisen ylläpito
- Oireisen GERD:n hoito
- Pohjukaissuolihaavojen paraneminen
- Helicobacter pylori -hävitys vähentää pohjukaissuolihaavan uusiutumisen riskiä
- Patologisten liikaerittävien tilojen hoito, mukaan lukien Zollinger-Ellisonin oireyhtymä
ACIPHEX 20 mg:n viivästetysti vapauttavia tabletteja ei suositella käytettäväksi alle 12-vuotiaille lapsipotilaille, koska tabletin vahvuus ylittää näille potilaille suositellun annoksen (ks. ANNOSTELU JA HALLINNOINTI ]. Harkitse toista rabepratsolimuotoa 1–12-vuotiaille lapsipotilaille. Rabepratsolin eri annostusmuodon ja -vahvuuden turvallisuus ja tehokkuus on osoitettu 1–11-vuotiailla lapsipotilailla GERD:n hoidossa.
Nuorten eläinten tiedot
Suoritettiin tutkimuksia nuorilla ja nuorilla aikuisilla rotilla ja koirilla. Nuorten eläinkokeissa rabepratsolinatriumia annettiin suun kautta rotille enintään 5 viikon ajan ja koirille enintään 13 viikon ajan, kumpikin aloitettiin 7. päivänä synnytyksen jälkeen ja sitä seurasi 13 viikon toipumisjakso. Rotille annettiin 5, 25 tai 150 mg/kg/päivä ja koirille 3, 10 tai 30 mg/kg/päivä. Näiden tutkimusten tiedot olivat verrattavissa nuorille aikuisille eläimille raportoituihin tietoihin. Farmakologisesti välittömiä muutoksia, mukaan lukien kohonneet seerumin gastriinipitoisuudet ja mahalaukun muutokset, havaittiin kaikilla annostasoilla sekä rotilla että koirilla. Nämä havainnot palautuivat 13 viikon toipumisjakson aikana. Vaikka ruumiinpaino ja/tai kruunun ja lantion pituudet pienenivät minimaalisesti annostelun aikana, ei havaittu mitään vaikutusta kehitysparametreihin nuorilla rotilla tai koirilla.
Kun nuoria eläimiä hoidettiin 28 päivän ajan eri PPI:llä annoksilla, jotka olivat yhtä suuria tai suurempia kuin 34 kertaa ihmisen päivittäinen oraalinen annos kehon pinta-alasta laskettuna, kokonaiskasvu vaikutti ja hoitoon liittyvä ruumiinpaino laski (noin 14 %). ja ruumiinpainon nousua sekä reisiluun painon ja pituuden vähenemistä havaittiin.
Geriatrinen käyttö
ACIPHEX 20 mg viivästetysti vapauttavien tablettien kliinisissä tutkimuksissa koehenkilöiden kokonaismäärästä (n=2009) 19 % oli 65-vuotiaita ja sitä vanhempia ja 4 % 75-vuotiaita tai vanhempia. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Maksan vajaatoiminta
ACIPHEX-viivästystablettien antaminen potilaille, joilla oli lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokka A ja B), johti lisääntyneeseen altistukseen ja vähentyneeseen eliminaatioon [ks. KLIININEN FARMAKOLOGIA ]. Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. Ei ole tietoa potilaista, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C). Vältä ACIPHEX-viivästystablettien käyttöä potilailla, joilla on vaikea maksan vajaatoiminta; Jos hoito on kuitenkin tarpeen, seuraa potilaita haittavaikutusten varalta [katso VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
YLIANNOSTUS
Rabepratsolin tahattomasta yliannostuksesta on saatu seitsemän ilmoitusta. Suurin raportoitu yliannostus oli 80 mg. Ilmoitettuihin yliannostuksiin ei liittynyt kliinisiä merkkejä tai oireita. Zollinger-Ellisonin oireyhtymää sairastavia potilaita on hoidettu enintään 120 mg:lla rabepratsolia kerran vuorokaudessa. Rabepratsolille ei tunneta spesifistä vastalääkettä. Rabepratsoli sitoutuu laajasti proteiineihin, eikä se ole helposti dialysoitavissa.
Yliannostustapauksissa hoidon tulee olla oireenmukaista ja tukevaa.
Jos ylialtistuminen tapahtuu, soita Myrkytystietokeskukseen numeroon 1-800-222-1222 saadaksesi ajantasaista tietoa myrkytyksen tai yliannostuksen hallinnasta.
VASTA-AIHEET
- ACIPHEX 10mg on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä rabepratsolille, substituoiduille bentsimidatsoleille tai jollekin valmisteen aineosalle. Yliherkkyysreaktiot voivat sisältää anafylaksia, anafylaktinen sokki, angioödeema, bronkospasmi, akuutti tubulointerstitiaalinen nefriitti ja urtikaria [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
- PPI:t, mukaan lukien ACIPHEX, ovat vasta-aiheisia rilpiviriiniä sisältävien tuotteiden kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Lisätietoja antibakteeristen aineiden (klaritromysiini ja amoksisilliini) vasta-aiheista, jotka on tarkoitettu käytettäväksi yhdessä ACIPHEX 20 mg:n viivästetysti vapauttavien tablettien kanssa, on niiden pakkausselosteen Vasta-aiheet-osiossa.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Rabepratsoli kuuluu eritystä vähentävien yhdisteiden luokkaan (substituoidut bentsimidatsoliprotonipumpun estäjät), joilla ei ole antikolinergisiä tai histamiini-H2-reseptorin antagonistisia ominaisuuksia, mutta ne estävät mahahapon eritystä estämällä mahalaukun H+, K+ATPaasia mahalaukun erityspinnalla. parietaalisolu. Koska tätä entsyymiä pidetään parietaalisolun happo(protoni)pumppuna, rabepratsolia on luonnehdittu mahalaukun protonipumpun estäjäksi. Rabepratsoli estää mahahapon erityksen viimeisen vaiheen.
Mahalaukun parietaalisoluissa rabepratsoli protonoituu, kerääntyy ja muuttuu aktiiviseksi sulfenamidiksi. In vitro tutkittuna rabepratsoli aktivoituu kemiallisesti pH:ssa 1,2 puoliintumisajan ollessa 78 sekuntia. Se estää hapon kuljetusta sian maharakkuloissa puoliintumisajalla 90 sekuntia.
Farmakodynamiikka
Antisekretiivinen toiminta
Eritystä estävä vaikutus alkaa tunnin kuluessa 20 mg:n ACIPHEX 20 mg:n viivästyneen vapautumisen tablettien oraalisen annon jälkeen. Rabepratsolin mediaani estävä vaikutus mahalaukun happamuuteen 24 tunnin kuluttua on 88 % maksimista ensimmäisen annoksen jälkeen. 20 mg:n annos ACIPHEX-viivästystabletteja estää perus- ja peptoniaterian stimuloimaa haponeritystä lumelääkkeeseen verrattuna 86 % ja 95 %, ja lisää prosenttiosuutta 24 tunnin ajanjaksosta, jolloin mahalaukun pH > 3 10 %:sta 65 % (katso alla oleva taulukko). Tämä suhteellisen pitkittynyt farmakodynaaminen vaikutus lyhyeen farmakokineettiseen puoliintumisaikaan (1-2 tuntia) verrattuna heijastaa H+, K+ATPaasin jatkuvaa inaktivoitumista.
Verrattuna lumelääkkeeseen 10 mg, 20 mg ja 40 mg ACIPHEX-tabletteja, jotka annettiin kerran vuorokaudessa 7 päivän ajan, vähensivät merkittävästi mahalaukun happamuutta kaikilla annoksilla jokaisella neljällä ateriavälillä ja 24 tunnin ajanjaksolla kokonaisuudessaan. Tässä tutkimuksessa annosten välillä ei ollut tilastollisesti merkitseviä eroja; mahalaukunsisäinen happamuus väheni kuitenkin merkittävästi annosriippuvaisesti. Rabepratsolin kykyä vähentää annoksesta riippuvaa keskimääräistä mahalaukun happamuutta on kuvattu alla.

Kun 20 mg:n ACIPHEX 20 mg:n viivästetysti vapauttavia tabletteja annettiin kerran päivässä kahdeksan päivän ajan, keskimääräinen prosenttiosuus ajasta, jolloin mahalaukun pH oli yli 3 tai mahalaukun pH yli 4 yhden annoksen (päivä 1) ja useiden annosten (päivä 8) jälkeen, oli huomattavasti enemmän kuin lumelääke (katso taulukko alla). Mahalaukun happamuuden laskua ja mahalaukun pH:n nousua, joka havaittiin 20 mg:n ACIPHEX 10 mg:n viivästyneen vapautumisen tabletteilla kerran vuorokaudessa kahdeksan päivän ajan, verrattiin samoihin parametreihin lumelääkkeellä, kuten alla on kuvattu:
Vaikutukset ruokatorven happoaltistukseen
Potilailla, joilla oli GERD ja keskivaikea tai vaikea ruokatorven happoaltistus, 20 mg:n ja 40 mg:n vuorokausiannos ACIPHEX 20 mg:n viivästetysti vapauttavia tabletteja vähensi 24 tunnin ruokatorven happoaltistusta. Seitsemän päivän hoidon jälkeen sen ajan prosenttiosuus, jolloin ruokatorven pH oli alle 4, laski lähtötasoista 24,7 % annoksella 20 mg ja 23,7 % 40 mg:lla 5,1 prosenttiin ja 2,0 prosenttiin. 24 tunnin intraesofageaalisen happoaltistuksen normalisoituminen korreloi mahalaukun pH-arvoon yli 4 vähintään 35 %:lla 24 tunnin ajanjaksosta; tämä taso saavutettiin 90 %:lla potilaista, jotka saivat ACIPHEXia 20 mg, ja 100 %:lla potilaista, jotka saivat ACIPHEXia 40 mg. ACIPHEX 20 mg:lla ja 40 mg:lla päivässä merkittäviä vaikutuksia mahalaukun ja ruokatorven pH-arvoon havaittiin yhden hoitopäivän jälkeen ja selvempiä seitsemän päivän hoidon jälkeen.
Vaikutukset seerumiin Gastriini
Keskimääräinen paastogastriinitaso nousi annoksesta riippuvalla tavalla potilailla, joita hoidettiin kerran vuorokaudessa ACIPHEX 10 mg:n viivästetysti vapauttavilla tableteilla enintään kahdeksan viikon ajan haavaisen tai erosiivisen ruokatorven tulehduksen vuoksi, ja potilailla, joita hoidettiin enintään 52 viikkoa taudin uusiutumisen estämiseksi. Ryhmän mediaaniarvot pysyivät normaalin rajoissa.
Ryhmässä potilaita, joita hoidettiin 20 mg:n ACIPHEX-tableteilla 4 viikon ajan, havaittiin seerumin gastriinipitoisuuksien kaksinkertaistuminen. Noin 35 %:lle näistä hoidetuista koehenkilöistä kehittyi seerumin gastriinipitoisuudet yli normaalin ylärajan.
Vaikutukset enterokromaffiinin kaltaisiin (ECL) soluihin
Lisääntynyt seerumin gastriinitaso, joka on sekundaarista eritystä vähentävien aineiden vaikutuksesta stimuloi mahalaukun ECL-solujen lisääntymistä, mikä voi ajan myötä johtaa ECL-solujen liikakasvuun rotilla ja hiirillä ja mahalaukun karsinoideihin rotilla, erityisesti naarailla [ks. Ei-kliininen toksikologia ].
Yli 400 potilaalla, joita hoidettiin viivästetysti vapauttavilla ACIPHEX-tableteilla (10 tai 20 mg) kerran vuorokaudessa enintään vuoden ajan, ECL-solujen hyperplasian ilmaantuvuus lisääntyi ajan ja annoksen myötä, mikä on yhdenmukainen protonipumpun estäjän farmakologisen vaikutuksen kanssa. Yhdellekään potilaalle ei kehittynyt mahalaukun limakalvon ECL-solujen adenomatoidisia, dysplastisia tai neoplastisia muutoksia. Yhdellekään potilaalle ei kehittynyt rotilla havaittuja karsinoidikasvaimia.
Endokriiniset vaikutukset
Ihmisillä tehdyt tutkimukset, jotka kestivät enintään yhden vuoden, eivät ole osoittaneet kliinisesti merkittäviä vaikutuksia hormonitoimintaan. Terveillä miespuolisilla koehenkilöillä, joita on hoidettu ACIPHEX-depottableteilla 13 päivän ajan, ei ole havaittu kliinisesti merkittäviä muutoksia seuraavissa tutkituissa endokriinisissä parametreissä: 17 β-estradioli, kilpirauhasta stimuloiva hormoni, trijodityroniini, tyroksiini, tyroksiinia sitova proteiini, lisäkilpirauhanen hormoni, insuliini, glukagoni, reniini, aldosteroni, follikkelia stimuloiva hormoni, luteotrofinen hormoni, prolaktiini, somatotrofinen hormoni, dehydroepiandrosteroni, kortisolia sitova globuliini ja virtsan 6β-hydroksikortisoli, seerumin testosteroni ja vuorokausikortisoliprofiili
Muut tehosteet
Ihmisillä, joita on hoidettu ACIPHEX 10 mg viivästetysti vapauttavilla tableteilla enintään vuoden ajan, ei ole havaittu systeemisiä vaikutuksia keskushermostoon, lymfaattiseen, hematopoieettiseen, munuais-, maksa-, sydän- ja verisuonijärjestelmään tai hengityselimiin. Tietoja ei ole saatavilla pitkäaikaisesta hoidosta ACIPHEX 10 mg viivästysti vapauttavilla tableteilla ja silmävaikutuksista.
Farmakokinetiikka
Suun kautta annetun 20 mg:n ACIPHEX 10 mg:n viivästyneen vapautumisen tablettien jälkeen rabepratsolin huippupitoisuudet plasmassa (Cmax) saavutetaan 2–5 tunnin kuluessa (Tmax). Rabepratsolin Cmax ja AUC ovat lineaarisia suun kautta otetulla 10–40 mg:n annosalueella. Merkittävää kumuloitumista ei tapahdu, kun 10–40 mg:n annoksia annetaan 24 tunnin välein; rabepratsolin farmakokinetiikka ei muutu toistuvassa annoksessa.
Imeytyminen
Rabepratsolin 20 mg:n oraalisen tabletin absoluuttinen biologinen hyötyosuus (verrattuna suonensisäiseen antoon) on noin 52 %. Kun ACIPHEX 10 mg viivästetysti vapauttavia tabletteja annetaan runsaan rasvaisen aterian yhteydessä, Tmax on vaihteleva; Samanaikainen ruoan nauttiminen voi viivästyttää imeytymistä jopa 4 tuntia tai kauemmin. Rabepratsolin Cmax ja imeytymisen laajuus (AUC) eivät kuitenkaan muutu merkittävästi. Siten ACIPHEX-depottabletit voidaan ottaa aterioiden ajoituksesta riippumatta.
Jakelu
Rabepratsoli sitoutuu 96,3 %:sti ihmisen plasman proteiineihin.
Eliminointi
Aineenvaihdunta
Rabepratsoli metaboloituu laajasti. Merkittävä osa rabepratsolista metaboloituu systeemisen ei-entsymaattisen pelkistyksen kautta tioeetteriyhdisteeksi. Rabepratsoli metaboloituu myös sulfoni- ja desmetyyliyhdisteiksi sytokromi P450:n kautta maksassa. Tioeetteri ja sulfoni ovat ihmisen plasmasta mitatut ensisijaiset metaboliitit. Näillä metaboliiteilla ei havaittu olevan merkittävää eritystä estävää aktiivisuutta. In vitro -tutkimukset ovat osoittaneet, että rabepratsoli metaboloituu maksassa ensisijaisesti sytokromit P450 3A (CYP3A) sulfonimetaboliitiksi ja sytokromi P450 2C19 (CYP2C19) desmetyylirabepratsoliksi. CYP2C19:llä on tunnettu geneettinen polymorfismi, joka johtuu sen puutteesta joissakin alapopulaatioissa (esim. 3-5 % valkoihoisista ja 17-20 % aasialaisista). Rabepratsolin metabolia on hidasta näissä alapopulaatioissa, minkä vuoksi heitä kutsutaan lääkkeen huonoiksi metaboloijiksi.
Erittyminen
Kun 14C-leimattua rabepratsolia annettiin suun kautta 20 mg:n kerta-annoksena, noin 90 % lääkkeestä erittyi virtsaan, pääasiassa tioeetterikarboksyylihappona; sen glukuronidi ja merkaptuurihappometaboliitit. Loput annoksesta löytyi ulosteesta. Radioaktiivisuuden kokonaissaanto oli 99,8 %. Muuttumatonta rabepratsolia ei havaittu virtsasta tai ulosteesta.
Tietyt populaatiot
Geriatriset potilaat
20 terveellä iäkkäällä koehenkilöllä, joille annettiin 20 mg:n viivästetysti vapauttavia ACIPHEX-tabletteja kerran vuorokaudessa seitsemän päivän ajan, AUC-arvot noin kaksinkertaistuivat ja Cmax nousi 60 % verrattuna rinnakkaisen nuoremman kontrolliryhmän arvoihin. Ei ollut näyttöä lääkkeiden kertymisestä kerran vuorokaudessa otetun annon jälkeen [katso Käyttö tietyssä väestössä ].
Pediatriset potilaat
Rabepratsolin farmakokinetiikkaa tutkittiin monikeskustutkimuksessa 12 nuorella 12–16-vuotiaalla GERD-potilaalla. Potilaat saivat 20 mg ACIPHEX-tabletteja viivästyneen vapautumisen jälkeen kerran päivässä viiden tai seitsemän päivän ajan. Rabepratsolialtistuksessa havaittiin noin 40 %:n lisäys 5–7 päivän annostelun jälkeen verrattuna 1 vuorokauden annoksen jälkeen. Farmakokineettiset parametrit 12–16-vuotiailla GERD-potilailla olivat terveillä aikuisilla koehenkilöillä havaittujen rajojen sisällä.
Mies- ja naispotilaat sekä rodulliset tai etniset ryhmät
Ruumiinmassaan ja pituuteen mukautetuissa analyyseissä rabepratsolin farmakokinetiikka ei osoittanut kliinisesti merkittäviä eroja mies- ja naispuolisten koehenkilöiden välillä. Tutkimuksissa, joissa käytettiin erilaisia rabepratsoliformulaatioita, AUC0-∞-arvot terveillä japanilaisilla miehillä olivat noin 50–60 % korkeammat kuin arvot, jotka saatiin yhdysvaltalaisilta terveiltä miehiltä kerätyistä tiedoista.
Potilaat, joilla on munuaisten vajaatoiminta
Kymmenellä potilaalla, joilla oli stabiili loppuvaiheen munuaissairaus, joka vaati ylläpitohoitoa hemodialyysiä (kreatiniinipuhdistuma ≤5 ml/min/1,73 m²), rabepratsolin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja 20 mg:n kerta-annoksen jälkeen ACIPHEX 20 mg viivästetysti vapauttavia tabletteja. verrattuna 10 terveeseen henkilöön.
Potilaat, joilla on maksan vajaatoiminta
Kerta-annostutkimuksessa, johon osallistui 10 potilasta, joilla oli lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokka A ja B), joille annettiin kerta-annos 20 mg:n kerta-annos ACIPHEX 10 mg viivästetysti vapauttavia tabletteja, AUC0-24 noin kaksinkertaistui, eliminaatio puoliintumisaika oli 2-3 kertaa korkeampi ja kokonaispuhdistuma laski alle puoleen terveiden miesten arvoihin verrattuna.
Toistuvassa tutkimuksessa, johon osallistui 12 potilasta, joilla oli lievä tai kohtalainen maksan vajaatoiminta ja joille annettiin 20 mg ACIPHEX 10 mg viivästetysti vapauttavia tabletteja kerran päivässä kahdeksan päivän ajan, AUC0-∞- ja Cmax-arvot nousivat noin 20 % verrattuna terveiden iän ja sukupuolen arvoihin. aiheita. Nämä nousut eivät olleet tilastollisesti merkitseviä.
Ei ole tietoa rabepratsolin jakautumisesta potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C) [ks. Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
Yhdistetty anto mikrobilääkkeiden kanssa
Kuusitoista tervettä koehenkilöä, joiden genotyyppi oli CYP2C19:n suhteen nopea metaboloija, sai 20 mg ACIPHEX-tabletteja, 1 000 mg amoksisilliinia, 500 mg klaritromysiiniä tai kaikkia kolmea lääkettä nelisuuntaisessa ristikkäistutkimuksessa. Kukin neljästä hoito-ohjelmasta annettiin kahdesti päivässä 6 päivän ajan. Klaritromysiinin ja amoksisilliinin AUC- ja Cmax-arvot eivät eronneet yhdistelmäannostelun jälkeen verrattuna kerta-annoksen jälkeisiin arvoihin. Rabepratsolin AUC nousi kuitenkin 11 % ja Cmax 34 % yhdistelmäannostelun jälkeen. Myös 14-hydroksiklaritromysiinin (klaritromysiinin aktiivinen metaboliitti) AUC nousi 42 % ja Cmax 46 %. Tämän rabepratsolille ja 14-hydroksiklaritromysiinille altistumisen lisääntymisen ei odoteta aiheuttavan turvallisuusongelmia.
Muiden lääkkeiden vaikutukset rabepratsoliin
Antasidit
ACIPHEX 20 mg viivästetysti vapauttavien tablettien ja antasidien samanaikainen anto ei aiheuttanut kliinisesti merkittäviä muutoksia plasman rabepratsolipitoisuuksissa.
Rabepratsolin vaikutukset muihin lääkkeisiin
Terveillä koehenkilöillä tehdyt tutkimukset ovat osoittaneet, että rabepratsolilla ei ole kliinisesti merkittäviä yhteisvaikutuksia muiden CYP450-järjestelmän kautta metaboloituvien lääkkeiden kanssa, kuten teofylliinin (CYP1A2) kerta-annoksena suun kautta, diatsepaamin (CYP2C9 ja CYP3A4) kerta-annoksena laskimoon ja fenytoiinin ( CYP2C9 ja CYP2C19) kerta-annoksena suonensisäisenä (lisäannoksena suun kautta). Rabepratsolin ja muiden tämän entsyymijärjestelmän kautta metaboloituvien lääkkeiden vakaan tilan yhteisvaikutuksia ei ole tutkittu potilailla.
Klopidogreeli
Klopidogreeli metaboloituu aktiiviseksi metaboliitiksi osittain CYP2C19:n välityksellä. Suoritettiin tutkimus terveillä koehenkilöillä, mukaan lukien CYP2C19:n laajat ja keskivaikeat metaboloijat, jotka saivat kerran vuorokaudessa 75 mg klopidogreelia samanaikaisesti lumelääkkeen tai 20 mg:n ACIPHEX 20 mg:n viivästyneen vapautumisen tablettien kanssa (n=36) 7 päivän ajan. Klopidogreelin aktiivisen metaboliitin keskimääräinen AUC pieneni noin 12 % (keskimääräinen AUC-suhde oli 88 % ja 90 % luottamusväli 81,7 - 95,5 %), kun ACIPHEX-tabletteja annettiin samanaikaisesti, verrattuna klopidogreelin antamiseen lumelääkkeen kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Digoksiini
Terveillä aikuisilla koehenkilöillä (n=16) 20 mg rabepratsolinatrium viivästetysti vapautuvien tablettien ja 2,5 mg:n kerran vuorokaudessa annettavien digoksiiniannosten samanaikainen anto vakaassa tilassa johti noin 29 % ja 19 %:n nousuun keskimääräisissä Cmax- ja AUC-arvoissa (0- 24) digoksiinin [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Ketokonatsoli
Terveillä aikuisilla koehenkilöillä (n=19) 20 mg:n rabepratsolinatrium viivästetysti vapautuvien tablettien anto vakaassa tilassa yhdessä 400 mg:n suun kautta otettavan ketokonatsolin kerta-annoksen kanssa pienensi keskimäärin noin 31 % sekä Cmax- että AUC-arvoja (0- inf) ketokonatsoli [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Syklosporiini
In vitro -inkubaatiot, joissa käytettiin ihmisen maksan mikrosomeja, osoittivat, että rabepratsoli esti siklosporiinin metaboliaa IC50:llä 62 mikromolaarisella pitoisuudella, joka on yli 50 kertaa korkeampi kuin terveillä vapaaehtoisilla saavutettu Cmax, kun 14 päivän ajan oli annettu 20 mg ACIPHEX 10 mg viivästettyä tablettia. Tämä estoaste on samanlainen kuin omepratsolin vastaavalla pitoisuudella.
Mikrobiologia
Seuraavat in vitro -tiedot ovat saatavilla, mutta kliinistä merkitystä ei tunneta.
Rabepratsolinatriumin, amoksisilliinin ja klaritromysiinin kolmena lääkehoitona on osoitettu olevan aktiivisia useimpia Helicobacter pylori -kantoja vastaan in vitro ja kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ , Kliiniset tutkimukset ].
Helicobacter pylori
H. pylori -isolaattien herkkyystesti suoritettiin amoksisilliinille ja klaritromysiinille käyttämällä agarlaimennusmetodologiaa1, ja määritettiin vähimmäisinhibiittoripitoisuudet (MIC).
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollimikro-organismien käyttöä laboratoriomenetelmien teknisten näkökohtien hallitsemiseksi.
Antibioottiresistenttien organismien esiintyvyys kliinisissä isolaattien joukossa
Esikäsittelyn vastustuskyky
Klaritromysiinin hoitoa edeltävä resistenssiaste (MIC ≥1 mcg/ml) H. pylorille oli lähtötasolla 9 % (51/560) kaikissa hoitoryhmissä yhdistettynä. Yli 99 %:lla (558/560) potilaista oli H. pylori -isolaatteja, joiden katsottiin olevan herkkiä (MIC ≤ 0,25 mcg/ml) amoksisilliinille lähtötilanteessa. Kahdella potilaalla oli lähtötilanteessa H. pylori -isolaatteja, joiden amoksisilliinin MIC oli 0,5 mcg/ml.
Katso Helicobacter pylorin herkkyystestitiedot mikrobiologia-osiosta klaritromysiinin ja amoksisilliinin lääkemääräystiedoissa.
Potilailla, joilla on jatkuva H. pylori -infektio rabepratsoli-, amoksisilliini- ja klaritromysiinihoidon jälkeen, on todennäköisesti klaritromysiiniresistenttejä kliinisiä isolaatteja. Siksi klaritromysiiniherkkyystesti tulee tehdä mahdollisuuksien mukaan. Jos osoitetaan resistenssi klaritromysiinille tai herkkyystestaus ei ole mahdollista, on aloitettava vaihtoehtoinen antimikrobinen hoito.
Amoksisilliiniherkkyystestin tulokset ja kliiniset/bakteriologiset tulokset
Yhdysvalloissa tehdyssä monikeskustutkimuksessa yli 99 %:lla (558/560) potilaista oli H. pylori -isolaatteja, joiden katsottiin olevan herkkiä (MIC ≤ 0,25 mcg/ml) amoksisilliinille lähtötilanteessa. Kahdella muulla potilaalla oli lähtötilanteessa H. pylori -isolaatteja, joiden amoksisilliinin MIC oli 0,5 mcg/ml, ja molemmat isolaatit olivat klaritromysiiniresistenttejä lähtötilanteessa; yhdessä tapauksessa H. pylori hävitettiin. 75 % (107/145) ja 10 vuorokauden hoitoryhmissä 79 % (112/142) potilaista, joilla oli ennen hoitoa amoksisilliinille herkkiä MIC-arvoja (≤0,25 mcg/ml), H. pylori hävitettiin. . Yhdellekään potilaalle ei kehittynyt amoksisilliiniresistenttiä H. pyloria hoidon aikana.
Farmakogenomiikka
Kliinisessä tutkimuksessa, jossa arvioitiin ACIPHEX-viiveesti vapauttavia tabletteja japanilaisilla aikuispotilailla, jotka luokiteltiin CYP2C19-genotyypin mukaan (n = 6 genotyyppiluokkaa kohti), mahahapon suppressio oli voimakkaampaa hitailla metaboloijilla kuin nopeilla metaboloijilla. Tämä saattaa johtua korkeammista rabepratsolipitoisuuksista plasmassa hitailla metaboloijilla. Tämän kliinistä merkitystä ei tunneta. Ei ole tutkittu, olisivatko rabepratsolinatriumin yhteisvaikutukset muiden CYP2C19:n kautta metaboloituvien lääkkeiden kanssa erilaisia nopeiden ja hitaiden metaboloijien välillä.
Kliiniset tutkimukset
Erosiivisen tai haavaisen GERD:n paraneminen aikuisilla
Yhdysvaltalaisessa monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 103 potilasta hoidettiin enintään kahdeksan viikon ajan lumelääkkeellä, 10 mg, 20 mg tai 40 mg ACIPHEX-tableteilla kerran vuorokaudessa. Tähän ja kaikkiin GERD:n paranemista koskeviin tutkimuksiin vain potilaat, joilla oli GERD-oireita ja vähintään asteen 2 esofagiitti (muokattu Hetzel-Dent-luokitusasteikko), olivat kelvollisia osallistumaan. Endoskooppinen paraneminen määriteltiin asteikoksi 0 tai 1. Jokainen rabepratsoliannos oli merkitsevästi parempi kuin lumelääke endoskooppisen paranemisen tuottamisessa neljän ja kahdeksan viikon hoidon jälkeen. Endoskooppisen paranemisen osoittaneiden potilaiden prosenttiosuus oli seuraava:
Lisäksi tilastollisesti merkitsevä ero oli ACIPHEX 10 mg, 20 mg ja 40 mg annoksilla lumelääkkeeseen verrattuna viikoilla 4 ja 8 GERD-närästysfrekvenssin täydellisessä häviämisessä (p≤0,026). Kaikki ACIPHEX-ryhmät raportoivat GERD:n päiväsaikaan närästyksen vaikeusasteen täydellisestä paranemisesta lumelääkkeeseen verrattuna viikoilla 4 ja 8 (p≤0,036). Päivittäisen antasidiannoksen keskimääräinen lasku lähtötasosta oli tilastollisesti merkitsevä kaikissa ACIPHEX-ryhmissä lumelääkkeeseen verrattuna sekä viikolla 4 että 8 (p≤0,007).
Pohjois-Amerikan monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, aktiivikontrolloidussa 336 potilaan tutkimuksessa endoskopiassa neljän ja kahdeksan viikon hoidon jälkeen parantuneiden potilaiden prosenttiosuus oli tilastollisesti parempi potilailla, joita hoidettiin viivästyneesti vapauttavilla ACIPHEX-tableteilla verrattuna ranitidiiniin. :
20 mg:n annos kerran vuorokaudessa ACIPHEX-tabletteja viivästyttinä oli merkittävästi tehokkaampi kuin ranitidiini 150 mg neljästi vuorokaudessa niiden potilaiden prosenttiosuudessa, joilla närästys hävisi kokonaan viikoilla 4 ja 8 (p
Suositeltu ACIPHEX 10 mg:n viivästetysti vapauttavien tablettien annostus on 20 mg kerran vuorokaudessa 4-8 viikon ajan.
Erosiivisen tai haavaisen GERD:n paranemisen pitkäaikainen ylläpito aikuisilla
Pitkäaikaista paranemisen ylläpitoa potilailla, joilla oli eroosiivinen tai haavainen GERD, jotka olivat aiemmin parantuneet mahalaukun eritystä estävällä hoidolla, arvioitiin kahdessa yhdysvaltalaisessa, satunnaistetussa, kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa, jotka olivat identtisiä ja kestivät 52 viikkoa. Näissä kahdessa tutkimuksessa satunnaistettiin 209 potilasta ja 285 potilasta saamaan joko 10 mg tai 20 mg viivästetysti vapauttavia ACIPHEX-tabletteja kerran vuorokaudessa tai lumelääkettä. Kuten alla olevista taulukoista 10 ja 11 käy ilmi, potilaat, joita hoidettiin viivästetysti vapauttavilla ACIPHEX-tableteilla, olivat molemmissa tutkimuksissa huomattavasti parempia kuin lumelääke GERD:n paranemisen ylläpidossa ja niiden potilaiden osissa, joilla ei ollut närästysoireita 52 viikon kohdalla. Suositeltu ACIPHEX 20 mg viivästetysti vapauttavien tablettien annostus on 20 mg kerran vuorokaudessa.
Oireisen GERD:n hoito aikuisilla
Kaksi yhdysvaltalaista monikeskustutkimusta kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa suoritettiin 316 aikuispotilaalla, joilla oli päivä- ja yönärästystä. Potilaat ilmoittivat viidestä tai useammasta kohtalaisesta tai erittäin vaikeasta närästysjaksosta lumelääkehoitovaiheen aikana satunnaistamista edeltävällä viikolla. Potilailla ei varmistettu endoskopialla ruokatorven eroosiota.
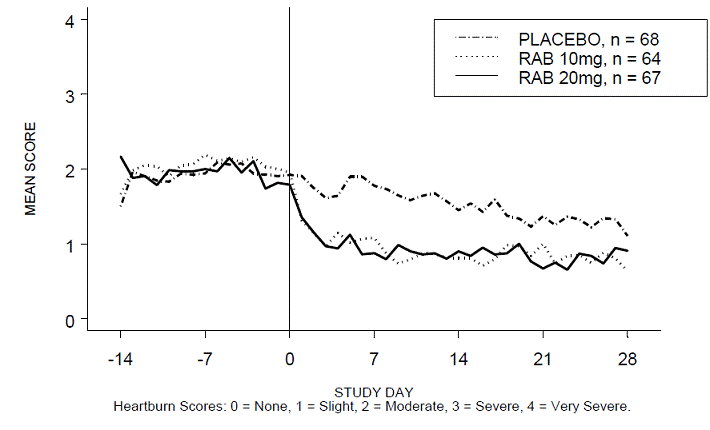
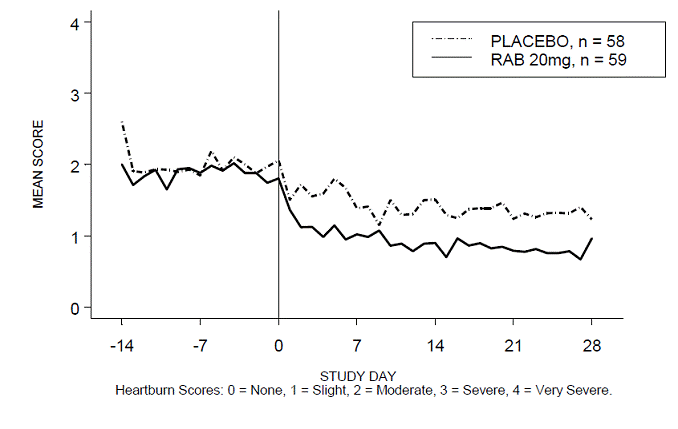
Närästysvapaiden päivä- ja/tai yöaikojen prosenttiosuus oli suurempi 20 mg:n ACIPHEX 20 mg:n viivästyneen vapautumisen tabletteilla verrattuna lumelääkkeeseen neljän viikon aikana tutkimuksessa RABUSA-2 (47 % vs. 23 %) ja tutkimuksessa RAB-USA- 3 (52 % vs. 28 %). Keskimääräiset päivä- ja yöajan närästyspisteiden keskimääräiset laskut lähtötasosta olivat merkittävästi suurempia ACIPHEX 20 mg:lla verrattuna lumelääkkeeseen viikolla 4. Graafiset näytöt, jotka kuvaavat päivittäisiä keskimääräisiä päivä- ja yöaikaisia pisteitä, on esitetty kuvissa 2–5.
Kuva 2: Keskimääräiset päiväaikaiset närästyspisteet RAB-USA-2
Kuva 3: Keskimääräiset yöaikaiset närästyspisteet RAB-USA-2
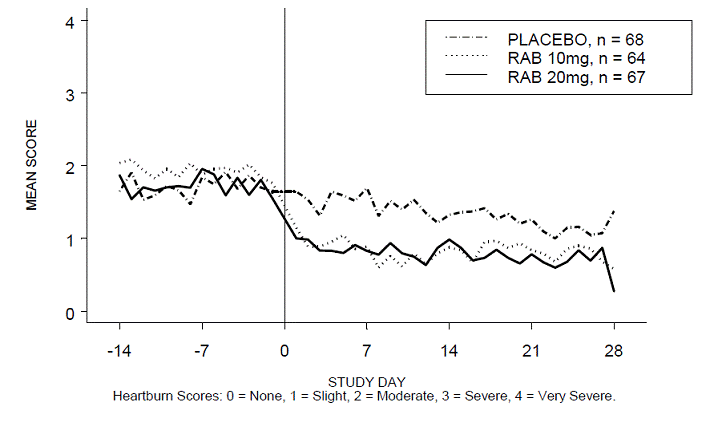
Kuva 4: Keskimääräiset päiväsaikaan närästyspisteet RAB-USA-3 Kuva 3: Keskimääräiset päiväsaikaan närästyspisteet RAB - USA –3
Kuva 5: Keskimääräiset yöaikaiset närästyspisteet RAB-USA-3
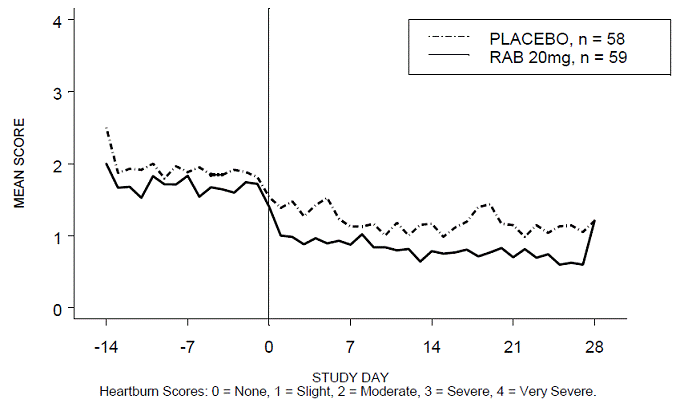
Lisäksi näiden kahden tutkimuksen yhdistetty analyysi osoitti, että 20 mg ACIPHEX 10 mg:n viivästetysti vapauttavia tabletteja paransi merkittävästi muita GERD:hen liittyviä oireita (regurgitaatio, röyhtäily ja varhainen kylläisyyden tunne) viikkoon 4 mennessä lumelääkkeeseen verrattuna (kaikki p-arvot
Myös 20 mg:n ACIPHEX 20 mg:n viivästetysti vapauttavien tablettien annos vähensi merkittävästi päivittäistä antasidin kulutusta lumelääkkeeseen verrattuna 4 viikon ajan (p
Suositeltu ACIPHEX-tablettien annostus on 20 mg kerran vuorokaudessa 4 viikon ajan.
Pohjukaissuolihaavojen paraneminen aikuisilla
Yhdysvaltalaisessa satunnaistetussa kaksoissokkoutetussa monikeskustutkimuksessa, jossa arvioitiin 20 mg:n ja 40 mg:n ACIPHEX 10 mg:n viivästetysti vapauttavien tablettien tehoa kerran vuorokaudessa verrattuna lumelääkkeeseen endoskooppisesti määriteltyjen pohjukaissuolihaavojen parantamiseksi, 100 potilasta hoidettiin enintään neljän viikon ajan. ACIPHEX oli merkitsevästi parempi kuin lumelääke pohjukaissuolihaavojen paranemisessa. Alla on esitetty endoskooppisesti parantuneiden potilaiden prosenttiosuudet:
Viikoilla 2 ja 4 ACIPHEX 20 ja 40 mg:n ryhmissä merkittävästi useammat potilaat ilmoittivat haavakivun esiintymistiheyden (p≤0,018), päiväsaikaan (p≤0,023) ja kivun vakavuuden yöaikaan (p≤0,035) hävinneen täydellisesti. lumelääkepotilaita. Ainoa poikkeus oli 40 mg:n ryhmä plaseboon verrattuna viikolla 2 pohjukaissuolihaavan kivun esiintymistiheyden osalta (p=0,094). Merkittäviä eroja päivä- ja yökivun erottelussa havaittiin molemmissa ACIPHEX-ryhmissä lumelääkkeeseen verrattuna tutkimuksen ensimmäisen viikon loppuun mennessä. Myös päivittäinen antasidien käyttö väheni merkittävästi molemmissa ACIPHEX-ryhmissä lumelääkkeeseen verrattuna viikolla 2 ja 4 (p
Kansainvälinen satunnaistettu, kaksoissokkoutettu, aktiivikontrolloitu tutkimus suoritettiin 205 potilaalla, jossa verrattiin 20 mg:n ACIPHEX-tabletteja kerran vuorokaudessa 20 mg:n omepratsolia kerran vuorokaudessa. Tutkimus suunniteltiin antamaan vähintään 80 % tehoa vähintään 10 % eron sulkemiseksi ACIPHEX 10 mg:n ja omepratsolin välillä olettaen, että molemmissa ryhmissä neljän viikon paranemisvaste on 93 %. Endoskooppisesti määriteltyjä pohjukaissuolihaavoja sairastavilla potilailla, joita hoidettiin enintään neljä viikkoa, ACIPHEX oli verrattavissa omepratsoliin pohjukaissuolihaavan paranemisen tuottamisessa. Alla on esitetty niiden potilaiden prosenttiosuudet, jotka paranivat endoskooppisesti kahden ja neljän viikon kohdalla:
ACIPHEX 20 mg ja omepratsoli olivat vertailukelpoisia oireiden täydellisessä häviämisessä.
Suositeltu ACIPHEX 20 mg:n viivästetysti vapauttavien tablettien annostus on 20 mg kerran vuorokaudessa 4 viikon ajan.
Helicobacter pylorin hävittäminen potilailla, joilla on peptinen haavatauti tai oireinen ei-haavaumatauti aikuisilla
Yhdysvalloissa tehty monikeskustutkimus oli kaksoissokkoutettu rinnakkaisryhmävertailu ACIPHEX-tabletteja, amoksisilliinia ja klaritromysiiniä 3, 7 tai 10 päivän ajan vs. omepratsoli, amoksisilliini ja klaritromysiini 10 päivän ajan. Hoito koostui rabepratsolia 20 mg kahdesti vuorokaudessa, amoksisilliinia 1000 mg kahdesti vuorokaudessa ja klaritromysiiniä 500 mg kahdesti vuorokaudessa (RAC) tai omepratsolia 20 mg kahdesti vuorokaudessa, amoksisilliinia 1000 mg kahdesti vuorokaudessa ja klaritromysiiniä 500 mg kahdesti vuorokaudessa (OAC). Potilaat, joilla oli H. pylori -infektio, jaettiin suhteessa 1:1 potilaille, joilla oli mahahaava (aktiivinen tai joilla on ollut haava viimeisten viiden vuoden aikana) [PUD] ja potilaat, joilla oli oireita, mutta joilla ei ollut peptistä haavatautia [NPUD], ylemmän maha-suolikanavan endoskopialla määritettynä. Seuraavassa taulukossa esitetään H. pylorin hävittämisluvut, jotka on määritelty negatiivisiksi 13C-UBT:ksi H. pylorin osalta ≥ 6 viikon kuluttua hoidon päättymisestä. Hävitysasteen 7 ja 10 päivän RAC-hoito-ohjelmissa havaittiin olevan samanlaisia kuin 10 päivän OAC-ohjelmassa joko Intent-to-Treat (ITT) tai Per-Protocol (PP) -populaatioita. Hävitysasteet RAC:n 3 päivän hoito-ohjelmassa olivat huonompia kuin muissa hoito-ohjelmissa.
Suositeltu ACIPHEX 20 mg:n viivästetysti vapauttavien tablettien annostus on 20 mg kahdesti vuorokaudessa amoksisilliinin ja klaritromysiinin kanssa 7 päivän ajan.
Patologiset liikaeritystilat, mukaan lukien Zollinger-Ellisonin oireyhtymä aikuisilla
Kahdettatoista potilasta, joilla on idiopaattinen mahalaukun liikaeritys tai Zollinger-Ellisonin oireyhtymä, on hoidettu menestyksekkäästi ACIPHEX 10 mg:n viivästyneesti vapauttavilla tableteilla annoksina 20–120 mg enintään 12 kuukauden ajan. ACIPHEX 10 mg esti tyydyttävästi mahahapon eritystä kaikilla potilailla ja hävisi täydellisesti happo-peptisen taudin merkit ja oireet, jos niitä esiintyi. ACIPHEX 20 mg esti myös mahalaukun liikaerityksen uusiutumisen ja happo-peptisen taudin ilmenemismuodot kaikilla potilailla. Suuret ACIPHEX-annokset, joita käytettiin tämän pienen mahalaukun liikaeritystä sairastavien potilaiden hoitoon, olivat hyvin siedettyjä.
Suositeltu aloitusannos ACIPHEX viivästyneesti vapauttavien tablettien on 60 mg kerran vuorokaudessa.
VIITTEET
1. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardin kymmenes painos. CLSI Document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
POTILASTIEDOT
ACIPHEX® (a-se-feks) (rabepratsolinatrium) viivästetysti vapauttavat tabletit
Mikä on tärkein tieto, joka minun pitäisi tietää ACIPHEX 10mg:sta?
Sinun tulee ottaa ACIPHEX 20 mg juuri niin kuin on määrätty, pienimmällä mahdollisella annoksella ja lyhyimmän tarvittavan ajan.
ACIPHEX 20 mg voi auttaa happoon liittyvissä oireissasi, mutta sinulla voi silti olla vakavia vatsavaivoja. Keskustele lääkärisi kanssa.
ACIPHEX 20mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Eräänlainen munuaisongelma (akuutti tubulointerstitiaalinen nefriitti). Joillekin ihmisille, jotka käyttävät protonipumpun estäjiä (PPI) sisältäviä lääkkeitä, mukaan lukien ACIPHEX, voi kehittyä munuaisongelma, jota kutsutaan akuutiksi tubulointerstitiaaliseksi nefriittiksi ja joka voi ilmaantua milloin tahansa ACIPHEX-hoidon aikana. Soita lääkärillesi välittömästi, jos virtsaamasi määrä on vähentynyt tai jos sinulla on verta virtsassasi.
- Ripuli, jonka aiheuttaa suolistotulehdus (Clostridium difficile). Soita lääkärillesi heti, jos sinulla on vetisiä ulosteita tai vatsakipua, joka ei mene pois. Sinulla voi olla kuumetta tai ei.
- Luun murtumat (lonkka-, ranteen- tai selkärangan murtumat). Lonkan, ranteen tai selkärangan luumurtumia voi tapahtua ihmisillä, jotka ottavat useita päivittäisiä annoksia PPI-lääkkeitä ja pitkän ajan (vuoden tai pidempään). Kerro lääkärillesi, jos sinulla on luunmurtuma, erityisesti lonkassa, ranteessa tai selkärangassa.
- Tietyntyyppiset lupus erythematosus. Lupus erythematosus on autoimmuunisairaus (elimistön immuunisolut hyökkäävät kehon muihin soluihin tai elimiin). Joillekin ihmisille, jotka käyttävät PPI-lääkkeitä, mukaan lukien ACIPHEX, voi kehittyä tietyntyyppinen lupus erythematosus tai heillä jo oleva lupus pahenee. Soita heti lääkärillesi, jos sinulla on uutta tai pahenevaa nivelkipua tai ihottumaa poskissasi tai käsivarsissasi, joka pahenee auringossa.
Keskustele lääkärisi kanssa näiden vakavien sivuvaikutusten riskistä.
ACIPHEX 10 mg:lla voi olla muita vakavia sivuvaikutuksia. Katso "Mitkä ovat ACIPHEX 10mg:n mahdolliset sivuvaikutukset?"
Mikä on ACIPHEX 20mg?
ACIPHEX 10mg on reseptilääke, jota kutsutaan protonipumpun estäjäksi (PPI).
ACIPHEX 20mg vähentää mahahapon määrää.
aikuisilla, ACIPHEXia käytetään:
- 8 viikosta 16 viikkoon parantaakseen happoon liittyviä ruokatorven limakalvovaurioita (kutsutaan erosiiviseksi esofagiittiksi tai EE:ksi) ja lievittääkseen oireita, kuten närästyskipua.
- ruokatorven paranemisen ylläpitäminen ja EE:hen liittyvien oireiden lievitys. Ei tiedetä, onko ACIPHEX 20mg turvallinen ja tehokas, jos sitä käytetään yli 12 kuukautta (1 vuosi).
- enintään 4 viikkoa päivä- ja yöperäisen närästyksen ja muiden gastroesofageaalisen refluksitaudin (GERD) aiheuttamien oireiden hoitoon.
- enintään 4 viikkoa pohjukaissuolihaavojen paranemiseen ja oireiden lievitykseen.
- 7 päivää tiettyjen antibioottilääkkeiden kanssa H. pylori -nimisen bakteerin aiheuttaman infektion ja mahahaavan (pohjukaissuolihaavan) hoitoon.
- sairauksien pitkäaikaishoito, jossa mahasi tuottaa liikaa happoa. Tämä sisältää harvinaisen Zollinger-Ellisonin oireyhtymän.
12-vuotiailla ja sitä vanhemmilla nuorilla ACIPHEX 10mg -valmistetta käytetään enintään 8 viikon ajan GERD-oireiden hoitoon.
Ei tiedetä, onko ACIPHEX turvallinen ja tehokas alle 12-vuotiaille lapsille muuhun käyttöön.
ACIPHEX-tabletteja ei tule käyttää alle 12-vuotiaille lapsille.
Älä ota ACIPHEX 10 mg:aa, jos sinulla on:
- allerginen rabepratsolille, jollekin muulle PPI-lääkkeelle tai jollekin ACIPHEXin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo ainesosista.
- käytät rilpiviriiniä (EDURANT, COMPLERA, ODEFSEY) sisältävää lääkettä, jota käytetään HIV-1:n (ihmisen immuunikatovirus) hoitoon.
Ennen kuin otat ACIPHEXia, kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on alhainen magnesium-, alhainen kalsium- ja alhainen kaliumtaso veressäsi.
- sinulla on maksaongelmia.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, voiko ACIPHEX 20 mg vahingoittaa sikiötäsi.
- imetät tai aiot imettää. Ei tiedetä, erittyykö ACIPHEX 10 mg rintamaitoon. Keskustele lääkärisi kanssa siitä, mikä on paras tapa ruokkia vauvasi, jos käytät ACIPHEXia.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro varsinkin lääkärillesi jos käytät antibioottia, joka sisältää klaritromysiiniä tai amoksisilliinia tai jos käytät varfariinia (COUMADIN, JANTOVEN), metotreksaattia (OTREXUP, RASUVO, TREXALL, XATMEP), digoksiinia (LANOXIN) tai vesipilleriä (diureetti).
Miten minun pitäisi ottaa ACIPHEX?
- Ota ACIPHEX juuri niin kuin on määrätty.
- ACIPHEX otetaan yleensä kerran päivässä. Lääkärisi kertoo sinulle vuorokaudenajan, jolloin sinun tulee ottaa ACIPHEX lääketieteellisen tilasi perusteella.
- ACIPHEX 10 mg voidaan ottaa ruoan kanssa tai ilman. Lääkärisi kertoo sinulle, otatko tämän lääkkeen ruoan kanssa vai ilman sitä sairautesi perusteella.
- Niele jokainen ACIPHEX 20 mg tabletti kokonaisena. Älä pureskele, murskaa tai halkaise ACIPHEX 10 mg tabletteja. Kerro lääkärillesi, jos et voi niellä tabletteja kokonaisina.
- Jos unohdat ottaa ACIPHEX 10 mg -annoksen, ota se mahdollisimman pian. Jos on melkein aika ottaa seuraava annos, älä ota unohtunutta annosta. Sinun tulee ottaa seuraava annos normaaliin aikaan. Älä ota 2 annosta samanaikaisesti.
- Jos otat liian paljon ACIPHEX 20 mg -valmistetta, soita heti lääkärillesi tai myrkytystietokeskukseen numeroon 1-800-222-1222 tai mene lähimpään ensiapuun.
- Jos lääkärisi määrää antibioottilääkkeitä ACIPHEXin kanssa, lue antibioottilääkkeiden mukana tulevat potilastiedot ennen niiden ottamista.
Mitkä ovat ACIPHEX 20mg:n mahdolliset sivuvaikutukset?
ACIPHEX 10mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää ACIPHEX 20mg:sta?"
- Vuorovaikutus varfariinin kanssa. Varfariinin ottaminen PPI-lääkkeen kanssa voi lisätä verenvuodon ja kuoleman riskiä. Jos käytät varfariinia, lääkäri voi tarkistaa verisi nähdäkseen, onko sinulla lisääntynyt verenvuotoriski. Jos käytät varfariinia ACIPHEX 20 mg -hoidon aikana, kerro heti lääkärillesi, jos sinulla on verenvuodon merkkejä tai oireita, mukaan lukien:
- kipua, turvotusta tai epämukavuutta
- päänsärkyä, huimausta tai heikkoutta
- epätavalliset mustelmat (mustelmat, jotka tapahtuvat ilman tunnettua syytä tai jotka kasvavat kokoon)
- nenäverenvuoto
- vuotavat ikenet
- leikkauksista johtuva verenvuoto pysähtyy pitkään
- kuukautisvuoto, joka on normaalia raskaampaa
- vaaleanpunainen tai ruskea virtsa
- punaiset tai mustat ulosteet
- veren yskiminen
- oksentaa verta tai oksentelua, joka näyttää kahvinporoilta
- Matala B-12-vitamiinitaso elimistössä voi ilmaantua ihmisillä, jotka ovat ottaneet ACIPHEX 10 mg pitkään (yli 3 vuotta). Kerro lääkärillesi, jos sinulla on alhaisten B-12-vitamiinipitoisuuksien oireita, kuten hengenahdistusta, huimausta, epäsäännöllistä sydämenlyöntiä, lihasheikkoutta, kalpeaa ihoa, väsymystä, mielialan muutoksia ja pistelyä tai tunnottomuutta käsivarsissa ja jaloissa.
- Alhaiset magnesiumtasot kehossa voi tapahtua ihmisillä, jotka ovat käyttäneet ACIPHEX 20 mg vähintään 3 kuukautta. Kerro lääkärillesi, jos sinulla on alhaisten magnesiumpitoisuuksien oireita, kuten kouristuksia, huimausta, epäsäännöllistä sydämenlyöntiä, tärinää, lihassärkyä tai -heikkoutta sekä käsien, jalkojen tai äänen kouristuksia.
- Vatsakasvut (pohjarauhasten polyypit). Ihmisillä, jotka käyttävät PPI-lääkkeitä pitkään, on lisääntynyt riski saada tietyntyyppiset mahalaukun kasvaimet, joita kutsutaan fundic rauhasten polyypeiksi, etenkin kun PPI-lääkkeitä on käytetty yli vuoden.
- Vaikeat ihoreaktiot. ACIPHEX voi aiheuttaa harvinaisia mutta vakavia ihoreaktioita, jotka voivat vaikuttaa mihin tahansa kehoosi. Nämä vakavat ihoreaktiot saattavat vaatia hoitoa sairaalassa ja voivat olla hengenvaarallisia:
- Ihottuma, jossa voi esiintyä rakkuloita, hilseilyä tai verenvuotoa missä tahansa ihon osassa (mukaan lukien huulet, silmät, suu, nenä, sukuelimet, kädet tai jalat).
- Sinulla voi myös olla kuumetta, vilunväristyksiä, kehon kipuja, hengenahdistusta tai suurentuneet imusolmukkeet.
Lopeta ACIPHEX 20 mg:n käyttö ja ota heti yhteys lääkäriin. Nämä oireet voivat olla ensimmäinen merkki vakavasta ihoreaktiosta.
ACIPHEX 20mg:n yleisimmät sivuvaikutukset aikuisilla ovat: kipu, kurkkukipu, kaasut, infektio ja ummetus.
ACIPHEXin yleisimmät sivuvaikutukset 12-vuotiailla ja sitä vanhemmilla nuorilla ovat: päänsärky, ripuli, pahoinvointi, oksentelu ja maha-alueen (vatsakipu).
Nämä eivät ole kaikkia ACIPHEXin mahdollisia sivuvaikutuksia. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää ACIPHEX?
Säilytä ACIPHEX-tabletit kuivassa paikassa huoneenlämmössä 20 °C - 25 °C (68–77 °F).
Pidä ACIPHEX 20 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa ACIPHEXin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä ACIPHEXia sairauksiin, joihin sitä ei ole määrätty. Älä anna ACIPHEXia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Voit kysyä lääkäriltäsi tai apteekista ACIPHEX-valmistetta koskevia tietoja, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia ACIPHEX 10mg sisältää?
Aktiivinen ainesosa: rabepratsolinatrium
Inaktiiviset ainesosat: karnaubavaha, krospovidoni, diasetyloidut monoglyseridit, etyyliselluloosa, hydroksipropyyliselluloosa, hypromelloosiftalaatti, magnesiumstearaatti, mannitoli, natriumhydroksidi, natriumstearyylifumaraatti, talkki ja titaanidioksidi. Keltainen rautaoksidi on tabletin päällysteen väriaine. Punainen rautaoksidi on mustepigmentti.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto. Tarkistettu: 03/2022
