Pepcid 20mg, 40mg Famotidine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Pepcid on ja miten sitä käytetään?
Pepcidiä (famotidiinia) käytetään närästyksen, GERD:n ja Zollinger-Ellisonin oireyhtymän hoitoon. Se on saatavana käsikauppana. Pepcid 20mg on saatavana geneerisenä lääkkeenä.
Mitä haittavaikutuksia Pepcidin käytöstä voi olla?
Haittavaikutukset ovat harvinaisia, mutta ne voivat sisältää:
- väsymys,
- oksentelua,
- pahoinvointi,
- vatsakipu,
- anoreksia,
- kuiva suu,
- ihottuma ja
- lihaskrampit
KUVAUS
PEPCID®:n (famotidiini) vaikuttava aine on histamiini H2-reseptorin antagonisti. Famotidiini on N'(aminosulfonyyli)-3-[[[2-[(diaminometyleeni)amino]-4-tiatsolyyli]metyyli]tio]propaani-imidamidi. Famotidiinin empiirinen kaava on C8H15N7O2S3 ja sen molekyylipaino on 337,43. Sen rakennekaava on:
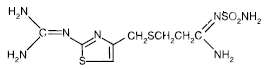
Famotidiini on valkoisesta vaaleankeltaiseen kiteinen yhdiste, joka liukenee vapaasti jääetikkaan, liukenee heikosti metanoliin, liukenee hyvin heikosti veteen ja käytännössä liukenematon etanoliin.
Jokainen oraaliseen käyttöön tarkoitettu tabletti sisältää joko 20 mg tai 40 mg famotidiinia ja seuraavia inaktiivisia aineosia: hydroksipropyyliselluloosa, hypromelloosi, rautaoksidit, magnesiumstearaatti, mikrokiteinen selluloosa, maissitärkkelys, talkki, titaanidioksidi ja karnaubavaha.
INDIKAATIOT
PEPCID 40mg on merkitty seuraaviin:
ANNOSTELU JA HALLINNOINTI
Pohjukaissuolihaava
Akuutti terapia: Suositeltu aikuisten suun kautta otettava annos aktiivisen pohjukaissuolihaavan hoitoon on 40 mg kerran vuorokaudessa ennen nukkumaanmenoa. Useimmat potilaat paranevat 4 viikossa; on harvoin syytä käyttää PEPCIDiä täydellä annoksella pidempään kuin 6-8 viikkoa. Myös 20 mg:n annos on tehokas.
Ylläpitoterapia: Suositeltu aikuisten suun kautta otettava annos on 20 mg kerran vuorokaudessa nukkumaan mennessä.
Hyvälaatuinen mahahaava
Akuutti terapia: Suositeltu aikuisten suun kautta otettava annos aktiivisen hyvänlaatuisen mahahaavan hoitoon on 40 mg kerran vuorokaudessa nukkumaan mennessä.
Gastroesofageaalinen refluksitauti (GERD)
Suositeltu suun kautta annettava annos aikuispotilaille, joilla on GERD-oireita, on 20 mg kahdesti 6 viikon ajan. Suositeltu oraalinen annos aikuispotilaille, joilla on esofagiitti, mukaan lukien eroosiot ja haavaumat sekä GERD:n aiheuttamat oireet, on 20 tai 40 mg kahdesti vuorokaudessa enintään 12 viikon ajan (ks. KLIININEN FARMAKOLOGIA aikuisilla , Kliiniset tutkimukset ).
Annostus alle 1 vuoden ikäisille lapsipotilaille gastroesofageaalinen refluksitauti (GERD)
Katso VAROTOIMENPITEET , Alle 1-vuotiaat lapsipotilaat.
Kohdassa VAROTOIMET, Alle 1-vuotiaat lapsipotilaat kuvatut tutkimukset ehdottavat seuraavia aloitusannoksia alle 1-vuotiaille lapsipotilaille: Gastroesofageaalinen refluksitauti (GERD) -0,5 mg/kg/annos famotidiinioraalisuspensiota GERD:n hoitoon. enintään 8 viikkoa kerran vuorokaudessa
Annostus 1–16-vuotiaille lapsipotilaille
Katso VAROTOIMENPITEET , 1-16-vuotiaat lapsipotilaat.
Kohdassa VAROTOIMET, 1–16-vuotiaat lapsipotilaat kuvatut tutkimukset ehdottavat seuraavia aloitusannoksia 1–16-vuotiaille lapsipotilaille:
Peptinen haava - 0,5 mg/kg/vrk po ennen nukkumaanmenoa tai jaettuna annokseen 40 mg/vrk asti.
Gastroesofageaalinen refluksitauti, johon liittyy tai ei ole esofagiittia, mukaan lukien eroosiot ja haavaumat - 1,0 mg/kg/vrk po jaettuna kahdesti 40 mg:aan asti
Vaikka julkaistut kontrolloimattomat tutkimukset viittaavat famotidiinin tehokkuuteen gastroesofageaalisen refluksitaudin ja peptisen haavan hoidossa, tiedot lapsipotilaista eivät riitä määrittämään prosentuaalista vastetta annoksella ja hoidon kestolla. Siksi hoidon kesto (alun perin aikuisten kestosuositusten perusteella) ja annos tulee yksilöidä kliinisen vasteen ja/tai pH-määrityksen (mahalaukun tai ruokatorven) ja endoskopian perusteella. Julkaistuissa kontrolloimattomissa kliinisissä tutkimuksissa 1–16-vuotiailla lapsipotilailla on käytetty annoksia jopa 1 mg/kg/vrk peptiseen haavaumaan ja 2 mg/kg/vrk GERD:hen, johon liittyy tai ei ole esofagiittia, mukaan lukien eroosiot ja haavaumat.
Patologiset liikaeritystilat (esim. Zollinger-Ellisonin oireyhtymä, useat endokriiniset adenoomat)
PEPCID-annostus potilailla, joilla on patologisia liikaeritystä, vaihtelee yksittäisen potilaan mukaan. Suositeltu aikuisen oraalinen aloitusannos patologisten liikaeritystilojen hoitoon on 20 mg 6 h välein. Joillakin potilailla voidaan tarvita suurempi aloitusannos. Annokset on sovitettava potilaan yksilöllisten tarpeiden mukaan, ja niitä tulee jatkaa niin kauan kuin kliinisesti on aiheellista. Joillekin aikuispotilaille, joilla on vaikea Zollinger-Ellisonin oireyhtymä, on annettu jopa 160 mg:n annoksia 6 h välein.
Antasidien samanaikainen käyttö
Antasideja voidaan antaa tarvittaessa samanaikaisesti.
Annoksen säätö potilaille, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta
Aikuisilla potilailla, joilla on kohtalainen (kreatiniinipuhdistuma
PEPCID:n farmakokineettisten parametrien vertailun perusteella aikuisilla ja lapsipotilailla annoksen muuttamista lapsipotilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta, tulee harkita.
MITEN TOIMITETAAN
PEPCID 40 mg tabletit 20 mg, ovat beigenvärisiä, pyöreitä, neliön muotoisia, kalvopäällysteisiä tabletteja, joiden toisella puolella on MSD-koodi ja toinen puoli sileä. Ne toimitetaan seuraavasti:
NDC 42998-639-09 käyttöyksikköpullot 30 kappaletta NDC 42998-639-98 käyttöyksikköä 100 pulloa.
PEPCID 40 mg -tabletit, 40 mg, ovat kullanruskeita, pyöreitä, neliön muotoisia, kalvopäällysteisiä tabletteja, joiden toisella puolella on MSD-koodi ja toinen puoli sileä. Ne toimitetaan seuraavasti:
NDC 42998-649-09 käyttöyksikköpullot 30 kappaletta NDC 42998-649-98 käyttöyksikköä 100 pulloa. Varastointi
Säilytä valvotussa huoneenlämmössä.
PEPCID® (famotidiini) -tabletit 20 mg ja tabletit 40 mg on valmistettu: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA. Julkaistu helmikuussa 2014.
SIVUVAIKUTUKSET
Alla lueteltuja haittavaikutuksia on raportoitu kotimaisissa ja kansainvälisissä kliinisissä tutkimuksissa noin 2500 potilaalla. Niissä kontrolloiduissa kliinisissä tutkimuksissa, joissa PEPCID 40 mg -tabletteja verrattiin lumelääkkeeseen, haittavaikutusten ilmaantuvuus ryhmässä, joka sai PEPCID-tabletteja 40 mg ennen nukkumaanmenoa, oli samanlainen kuin lumeryhmässä.
Seuraavia haittavaikutuksia on raportoitu yli 1 %:lla PEPCID-hoitoa saaneista potilaista kontrolloiduissa kliinisissä tutkimuksissa, ja ne voivat olla syy-yhteydessä lääkkeeseen: päänsärky (4,7 %), huimaus (1,3 %), ummetus (1,2 % ) ja ripuli (1,7 %).
Seuraavia muita haittavaikutuksia on raportoitu harvoin kliinisissä tutkimuksissa tai lääkkeen markkinoille tulon jälkeen. Suhde PEPCID 20 mg -hoitoon on ollut monissa tapauksissa epäselvä. Jokaisessa luokassa haittavaikutukset on lueteltu alenevassa järjestyksessä:
Keho kokonaisuutena: kuume, voimattomuus, väsymys
Sydän: rytmihäiriö, AV-katkos, sydämentykytys. Pidentynyttä QT-aikaa on raportoitu hyvin harvoin potilailla, joilla on munuaisten vajaatoiminta.
Ruoansulatuskanava: kolestaattinen keltaisuus, hepatiitti, maksaentsyymihäiriöt, oksentelu, pahoinvointi, vatsakipu, anoreksia, suun kuivuminen
Hematologinen: harvinaisissa tapauksissa agranulosytoosi, pansytopenia, leukopenia, trombosytopenia
Yliherkkyys: anafylaksia, angioödeema, silmän tai kasvojen turvotus, urtikaria, ihottuma, sidekalvon injektio
Tuki- ja liikuntaelimistö: rabdomyolyysi, tuki- ja liikuntaelinten kipu, mukaan lukien lihaskrampit, nivelkipu
Hermosto/psykiatriset: grand mal -kohtaus; psyykkiset häiriöt, jotka olivat palautuvia tapauksissa, joihin on saatu seurantaa, mukaan lukien hallusinaatiot, sekavuus, kiihtyneisyys, masennus, ahdistuneisuus, libidon heikkeneminen; parestesia; unettomuus; uneliaisuus. Munuaisten vajaatoimintaa sairastavien potilaiden kouristuksia on raportoitu hyvin harvoin.
Hengitys: bronkospasmi, interstitiaalinen keuhkokuume
Iho: toksinen epidermaalinen nekrolyysi/Stevens-Johnsonin oireyhtymä (erittäin harvinainen), hiustenlähtö, akne, kutina, ihon kuivuus, punoitus
Erityiset aistit: tinnitus, makuaistin häiriö
Muuta: harvinaisia tapauksia impotenssia ja harvinaisia tapauksia gynekomastiaa on raportoitu; Kuitenkin kontrolloiduissa kliinisissä tutkimuksissa ilmaantuvuus ei ollut suurempi kuin lumelääkettä saaneiden.
PEPCID-tablettien yhteydessä raportoituja haittavaikutuksia saattaa esiintyä myös PEPCID 20 mg oraalisuspensiota käytettäessä.
Pediatriset potilaat
Kliinisessä tutkimuksessa, johon osallistui 35 alle 1-vuotiasta lapsipotilasta, joilla oli GERD-oireita [esim. oksentelua (sylkemistä), ärtyneisyyttä (ärtyneisyyttä)], levottomuutta havaittiin viidellä famotidiinia saaneella potilaalla, joka hävisi, kun lääkitys lopetettiin.
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeiden yhteisvaikutuksia ei ole tunnistettu. Tutkimukset famotidiinilla ihmisillä, eläinmalleilla ja in vitro eivät ole osoittaneet merkittävää häiriötä maksan mikrosomaalisten entsyymien, esim. sytokromi P450 -järjestelmän, metaboloimien yhdisteiden jakautumisessa. Ihmisillä testattuja yhdisteitä ovat varfariini, teofylliini, fenytoiini, diatsepaami, aminopyriini ja antipyriini. Indosyaniinivihreää maksan lääkkeen erittymisen indeksinä on testattu, eikä merkittäviä vaikutuksia ole havaittu.
VAROITUKSET
Tietoja ei ole annettu
VAROTOIMENPITEET
Kenraali
Oireinen vaste PEPCID-hoitoon ei sulje pois mahalaukun pahanlaatuisuuden esiintymistä.
Potilaat, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta
Koska keskushermostoon kohdistuvia haittavaikutuksia on raportoitu potilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta, pidempiä annosväliä tai pienempiä annoksia saatetaan tarvita potilailla, joilla on kohtalainen (kreatiniinipuhdistuma KLIININEN FARMAKOLOGIA aikuisilla ja ANNOSTELU JA HALLINNOINTI ). QT-ajan pidentymistä on raportoitu hyvin harvoin potilailla, joilla on heikentynyt munuaisten toiminta ja joiden famotidiiniannosta/annostusväliä ei ehkä ole muutettu asianmukaisesti.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
106 viikkoa kestäneessä tutkimuksessa rotilla ja 92 viikkoa kestäneessä tutkimuksessa hiirillä, joille annettiin suun kautta enintään 2 000 mg/kg/vrk (noin 2 500 kertaa ihmiselle suositeltu annos aktiiviselle pohjukaissuolihaavalle), ei havaittu näyttöä karsinogeenisestä mahdollisuudesta PEPCID.
Famotidiini oli negatiivinen mikrobi-mutageenitestissä (Ames-testi), jossa käytettiin Salmonella typhimurium- ja Escherichia coli -bakteeria rotan maksaentsyymiaktivaation kanssa tai ilman sitä pitoisuuksilla 10 000 mikrogrammaan asti/levy. In vivo -tutkimuksissa hiirillä, joissa suoritettiin mikrotumatesti ja kromosomipoikkeamatesti, ei havaittu näyttöä mutageenisesta vaikutuksesta.
Rotilla tehdyissä tutkimuksissa, joille annettiin suun kautta enintään 2000 mg/kg/vrk tai suonensisäisinä annoksina enintään 200 mg/kg/vrk, hedelmällisyyteen ja lisääntymiskykyyn ei ollut vaikutusta.

Raskaus
Raskausluokka B
Lisääntymistutkimuksia on suoritettu rotilla ja kaneilla suun kautta annetuilla annoksilla 2000 mg/kg/vrk asti ja molemmilla lajeilla iv-annoksilla enintään 200 mg/kg/vrk, eivätkä ne ole paljastaneet merkittäviä todisteita PEPCID:n aiheuttama heikentynyt hedelmällisyys tai haitta sikiölle. Vaikka suoria sikiötoksisia vaikutuksia ei ole havaittu, satunnaisia abortteja, joita esiintyi vain emoilla, joiden ravinnonsaanti oli selvästi vähentynyt, havaittiin joillakin kaniineilla oraalisilla annoksilla 200 mg/kg/vrk (250 kertaa tavallinen ihmisannos) tai suurempi. Ei kuitenkaan ole olemassa riittäviä tai hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Imettävät äidit
Imettävillä rotilla tehdyt tutkimukset ovat osoittaneet, että famotidiini erittyy äidinmaitoon. Ohimenevää kasvun hidastumista havaittiin nuorilla rotilla, jotka olivat imettäneet emoja, joita oli hoidettu emolle toksisilla annoksilla, jotka olivat vähintään 600-kertaisia ihmisen tavanomaiseen annokseen verrattuna. Famotidiini on havaittavissa äidinmaidossa. Koska PEPCID voi aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imettäminen vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Alle 1 vuoden ikäiset lapsipotilaat
PEPCID 20 mg:n käyttöä alle 1-vuotiailla lapsipotilailla tukevat riittävät ja hyvin kontrolloidut PEPCID-tutkimukset aikuisilla ja seuraavat tutkimukset alle 1-vuotiailla lapsipotilailla.
Kaksi farmakokineettistä tutkimusta alle 1-vuotiailla lapsipotilailla (N=48) osoitti, että famotidiinin puhdistuma yli 3 kuukauden - 1 vuoden ikäisillä potilailla on samanlainen kuin vanhemmilla lapsipotilailla (1-15-vuotiailla) ja aikuisilla. . Sitä vastoin 0–3 kuukauden ikäisillä lapsipotilailla famotidiinin puhdistumaarvot olivat 2–4 kertaa pienemmät kuin vanhemmilla lapsipotilailla ja aikuisilla. Nämä tutkimukset osoittavat myös, että keskimääräinen biologinen hyötyosuus alle 1-vuotiailla lapsipotilailla oraalisen annostelun jälkeen on samanlainen kuin iäkkäillä lapsipotilailla ja aikuisilla. Farmakodynaamiset tiedot 0–3 kuukauden ikäisistä lapsipotilaista viittaavat siihen, että haponsuppression kesto on pidempi kuin iäkkäillä lapsipotilailla, mikä vastaa pidempään famotidiinin puoliintumisaikaa 0–3 kuukauden ikäisillä lapsipotilailla. (Katso KLIININEN FARMAKOLOGIA Lapsipotilailla , Farmakokinetiikka ja farmakodynamiikka .)
Kaksoissokkoutetussa, satunnaistetussa, hoidon lopettamista koskevassa tutkimuksessa 35 alle 1-vuotiasta lapsipotilasta, joilla diagnosoitiin gastroesofageaalinen refluksitauti, hoidettiin enintään 4 viikon ajan famotidiinioraalisuspensiolla (0,5 mg/kg/annos tai 1 mg). /kg/annos). Vaikka suonensisäinen famotidiiniformulaatio oli saatavilla, potilasta ei hoidettu suonensisäisellä famotidiinilla tässä tutkimuksessa. Myös omaishoitajia ohjeistettiin antamaan konservatiivista hoitoa, mukaan lukien sakeutettu ruokinta. Ilmoittautuneilla potilailla diagnosoitiin ensisijaisesti oksentelu (sylkeminen) ja ärtyneisyys (herätys). Famotidiinin annostusohjelma oli kerran päivässä alle 3 kuukauden ikäisille potilaille ja kahdesti päivässä ≥ 3 kuukauden ikäisille potilaille. 4 viikon hoidon jälkeen potilaat lopetettiin satunnaisesti hoidosta ja seurattiin vielä 4 viikkoa haittatapahtumien ja oireiden varalta. Potilailta arvioitiin oksentelua (sylkemistä), ärtyneisyyttä (herkkyyttä) ja yleisiä arvioita paranemisesta. Tutkimuspotilaiden ikä vaihteli aloittaessaan 1,3 - 10,5 kuukautta (keskiarvo 5,6 ± 2,9 kuukautta), 57 % oli naisia, 91 % valkoisia ja 6 % mustia. Suurin osa potilaista (27/35) jatkoi tutkimuksen hoidon lopetusvaiheeseen. Kaksi potilasta keskeytti famotidiinin käytön haittavaikutusten vuoksi. Useimmat potilaat paranivat tutkimuksen alkuhoitovaiheessa. Hoidon lopetusvaiheen tuloksia oli vaikea tulkita, koska potilaita oli vähän. Tutkimukseen osallistuneista 35 potilaasta viidellä famotidiinia saaneella potilaalla havaittiin kiihtyneisyyttä, joka hävisi, kun lääkitys lopetettiin; levottomuutta ei havaittu lumelääkettä saaneilla potilailla (ks HAITTAVAIKUTUKSET , Pediatriset potilaat ).
Nämä tutkimukset viittaavat siihen, että famotidiinioraalisuspension aloitusannos 0,5 mg/kg/annos voi olla hyödyllinen GERD:n hoidossa enintään 4 viikon ajan kerran vuorokaudessa alle 3 kuukauden ikäisillä potilailla ja kahdesti vuorokaudessa 3 kuukauden ikäisillä potilailla 1 vuoden ikäinen; yli 4 viikkoa kestävän famotidiinihoidon turvallisuutta ja hyötyä ei ole osoitettu. Famotidiinia tulee harkita GERD:n hoidossa vain, jos samanaikaisesti käytetään konservatiivisia toimenpiteitä (esim. sakeutettua ruokintaa) ja jos mahdollinen hyöty on riskiä suurempi.
1-16-vuotiaat lapsipotilaat
PEPCID 40 mg:n käyttöä 1–16-vuotiailla lapsipotilailla tukevat riittävät ja hyvin kontrolloidut PEPCID-tutkimukset aikuisilla sekä seuraavat lapsipotilailla tehdyt tutkimukset: Julkaistuissa tutkimuksissa pienellä määrällä 1–15-vuotiaita lapsipotilaita Famotidiinin puhdistuma oli samanlainen kuin aikuisilla. 11–15-vuotiailla lapsipotilailla suun kautta otettuihin 0,5 mg/kg:n annoksiin liittyi keskimääräinen käyrän alla oleva pinta-ala (AUC), joka oli samanlainen kuin aikuisilla, joita hoidettiin suun kautta 40 mg:lla. Samoin 1–15-vuotiailla lapsipotilailla laskimonsisäisiin 0,5 mg/kg:n annoksiin liittyi samanlainen keskimääräinen AUC kuin aikuisilla, joita hoidettiin suonensisäisesti 40 mg:lla. Rajoitetut julkaistut tutkimukset viittaavat myös siihen, että seerumipitoisuuden ja happamuuden vähentämisen välinen suhde on samanlainen 1–15-vuotiailla lapsipotilailla verrattuna aikuisiin. Nämä tutkimukset ehdottavat aloitusannosta 1–16-vuotiaille lapsipotilaille seuraavasti:
Peptinen haava - 0,5 mg/kg/vrk po nukkumaanmenoaikana tai jaettu tarjous Enintään 40 mg/vrk.
Gastroesofageaalinen refluksitauti, johon liittyy tai ei ole esofagiittia, mukaan lukien eroosiot ja haavaumat - 1,0 mg/kg/vrk po jaettuna kahdesti 40 mg:aan asti
Vaikka julkaistut kontrolloimattomat tutkimukset viittaavat famotidiinin tehokkuuteen gastroesofageaalisen refluksitaudin ja peptisen haavan hoidossa, tiedot lapsipotilaista eivät riitä määrittämään prosentuaalista vastetta annoksella ja hoidon kestolla. Siksi hoidon kesto (alun perin aikuisten kestosuositusten perusteella) ja annos tulee yksilöidä kliinisen vasteen ja/tai pH-määrityksen (mahalaukun tai ruokatorven) ja endoskopian perusteella. Julkaistuissa kontrolloimattomissa kliinisissä tutkimuksissa lapsipotilailla on käytetty annoksia enintään 1 mg/kg/vrk peptiseen haavaumaan ja 2 mg/kg/vrk GERD:hen, johon liittyy tai ei ole esofagiittia, mukaan lukien eroosiot ja haavaumat.
Geriatrinen käyttö
Kliinisissä tutkimuksissa famotidiinilla hoidetuista 4 966 henkilöstä 488 (9,8 %) oli 65-vuotiaita tai vanhempia ja 88 (1,7 %) yli 75-vuotiaita. Näiden ja nuorempien koehenkilöiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa. Joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei kuitenkaan voida sulkea pois.
Annosta ei tarvitse muuttaa iän perusteella (ks KLIININEN FARMAKOLOGIA aikuisilla , Farmakokinetiikka ). Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä. Annosta on muutettava, jos munuaisten vajaatoiminta on kohtalainen tai vaikea (ks VAROTOIMENPITEET , Potilaat, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta ja ANNOSTELU JA HALLINNOINTI , Annoksen säätö potilaille, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta ).
YLIANNOSTUS
Yliannostustapauksissa havaitut haittavaikutukset ovat samanlaisia kuin normaalissa kliinisessä kokemuksessa havaitut haittavaikutukset (ks HAITTAVAIKUTUKSET ). Suun kautta jopa 640 mg/vrk annoksia on annettu aikuispotilaille, joilla on patologisia liikaerityssairauksia ilman vakavia haittavaikutuksia. Yliannostustapauksissa hoidon tulee olla oireenmukaista ja tukevaa. Imeytymätön aines tulee poistaa maha-suolikanavasta, potilasta on seurattava ja tukihoitoa tulee käyttää.
Famotidiinin oraalinen LD50 uros- ja naarasrotilla ja hiirillä oli yli 3000 mg/kg ja pienin tappava akuutti suun kautta otettava annos koirilla yli 2000 mg/kg. Famotidiini ei aiheuttanut selviä vaikutuksia suurilla suun kautta otetuilla annoksilla hiirillä, rotilla, kissoilla ja koirilla, mutta se aiheutti merkittävää anoreksiaa ja kasvun lamaantumista kaneissa alkaen annoksella 200 mg/kg/vrk suun kautta. Famotidiinin suonensisäinen LD50 hiirillä ja rotilla vaihteli välillä 254-563 mg/kg ja pienin tappava kerta-annos suonensisäisesti koirilla oli noin 300 mg/kg. Akuutin myrkytyksen merkkejä suonensisäisesti hoidetuilla koirilla olivat oksentelu, levottomuus, limakalvojen kalpeus tai suun ja korvien punoitus, hypotensio, takykardia ja kollapsi.
VASTA-AIHEET
Yliherkkyys jollekin näiden tuotteiden komponentille. Ristiherkkyyttä tässä yhdisteluokassa on havaittu. Siksi PEPCID 40 mg:aa ei pidä antaa potilaille, joilla on aiemmin ollut yliherkkyys muille H2-reseptorin salpaajille.
KLIININEN FARMAKOLOGIA
Kliininen farmakologia aikuisilla
GI-tehosteet
PEPCID on kilpaileva histamiini H2-reseptoreiden estäjä. PEPCID 40 mg:n ensisijainen kliinisesti tärkeä farmakologinen vaikutus on mahalaukun erittymisen estäminen. PEPCID suppressoi sekä happopitoisuutta että mahan erityksen tilavuutta, kun taas pepsiinin erityksen muutokset ovat verrannollisia tilavuuteen.
Tavallisilla vapaaehtoisilla ja ylierittäjillä PEPCID 20 mg esti mahalaukun perus- ja yöeritystä sekä ruoan ja pentagastriinin stimuloimaa eritystä. Suun kautta antamisen jälkeen eritystä estävä vaikutus alkoi tunnin sisällä; Suurin vaikutus oli annoksesta riippuvainen, ja se ilmaantui 1–3 tunnin kuluessa. Erityksen eston kesto annoksilla 20 ja 40 mg oli 10-12 tuntia.
Yksittäiset ilta-annokset 20 ja 40 mg:n suun kautta estivät perus- ja yöhapon erittymistä kaikilla koehenkilöillä; Keskimääräinen yöllinen mahahapon eritys estyi 86 %:lla ja 94 %:lla vähintään 10 tunnin ajan. Aamulla annetut samat annokset estivät ruoan stimuloimaa haponeritystä kaikilla koehenkilöillä. Keskimääräinen suppressio oli 76 % ja 84 % 3-5 tuntia annon jälkeen ja 25 % ja 30 % 8-10 tuntia annon jälkeen. Joillakin potilailla, jotka saivat 20 mg:n annoksen, eritystä estävä vaikutus kuitenkin hävisi 6-8 tunnissa. Toistuvilla annoksilla ei ollut kumulatiivista vaikutusta. Yöllinen mahalaukunsisäinen pH nostettiin ilta-annoksilla 20 ja 40 mg PEPCID:tä keskiarvoihin 5,0 ja 6,4, vastaavasti. Kun PEPCID 40 mg annettiin aamiaisen jälkeen, peruspäivän interdigestiivisen pH 3 ja 8 tunnin kuluttua 20 tai 40 mg PEPCID 40 mg:sta nostettiin noin 5:een.
PEPCID 40 mg:lla oli vain vähän tai ei ollenkaan vaikutusta seerumin gastriinitasoihin paasto- tai aterian jälkeen. PEPCID ei vaikuttanut mahalaukun tyhjenemiseen ja eksokriiniseen haiman toimintaan.
Muut tehosteet
Kliinisissä farmakologisissa tutkimuksissa ei havaittu PEPCID:n systeemisiä vaikutuksia keskushermostoon, sydän- ja verisuonijärjestelmään, hengityselimistöihin tai endokriinisiin järjestelmiin. Myöskään antiandrogeenisiä vaikutuksia ei havaittu. (Katso HAITTAVAIKUTUKSET .) Seerumin hormonitasot, mukaan lukien prolaktiini, kortisoli, tyroksiini (T4) ja testosteroni, eivät muuttuneet PEPCID-hoidon jälkeen.
Farmakokinetiikka
PEPCID 20mg imeytyy epätäydellisesti. Suun kautta otettujen annosten biologinen hyötyosuus on 40-45 %. Biologinen hyötyosuus voi suurentua hieman ruoan vaikutuksesta tai hieman laskea antasidit; näillä vaikutuksilla ei kuitenkaan ole kliinistä merkitystä. PEPCID käy läpi minimaalisen ensikierron metabolian. Suun kautta otetun annoksen jälkeen plasman huippupitoisuus saavutetaan 1-3 tunnissa. Plasman tasot useiden annosten jälkeen ovat samanlaisia kuin yksittäisten annosten jälkeen. 15–20 % plasmassa olevasta PEPCID 20 mg:sta sitoutuu proteiineihin. PEPCIDin eliminaation puoliintumisaika on 2,5-3,5 tuntia. PEPCID eliminoituu munuaisten (65-70 %) ja metabolisen (30-35 %) kautta. Munuaispuhdistuma on 250-450 ml/min, mikä viittaa jonkin verran tubulaariseen erittymiseen. 25-30 % suun kautta annetusta annoksesta ja 65-70 % suonensisäisestä annoksesta erittyy virtsaan muuttumattomana yhdisteenä. Ainoa ihmisellä tunnistettu metaboliitti on S-oksidi.
Kreatiniinipuhdistumaarvojen ja PEPCIDin eliminaation puoliintumisajan välillä on läheinen yhteys. Potilailla, joilla on vaikea munuaisten vajaatoiminta, ts. kreatiniinipuhdistuma alle 10 ml/min, PEPCIDin eliminaation puoliintumisaika voi olla yli 20 tuntia ja annoksen tai annosteluvälien muuttaminen keskivaikeassa ja vaikeassa munuaisten vajaatoiminnassa saattaa olla tarpeen (ks. VAROTOIMENPITEET , ANNOSTELU JA HALLINNOINTI ).
Iäkkäillä potilailla PEPCIDin farmakokinetiikassa ei ole kliinisesti merkittäviä ikään liittyviä muutoksia. Iäkkäillä potilailla, joilla on heikentynyt munuaisten toiminta, lääkkeen puhdistuma voi kuitenkin pienentyä (ks VAROTOIMENPITEET , Geriatrinen käyttö ).
Kliiniset tutkimukset
Pohjukaissuolihaava
Yhdysvaltalaisessa kaksoissokkotutkimuksessa avohoitopotilailla, joilla oli endoskooppisesti varmistettu pohjukaissuolihaava, suun kautta annettua PEPCID:tä verrattiin lumelääkkeeseen. Kuten taulukosta 1 käy ilmi, 70 % potilaista, joita hoidettiin PEPCID:llä 40 mg hs, parani viikkoon 4 mennessä.
Potilaita, jotka eivät parantuneet viikkoon 4 mennessä, jatkettiin tutkimuksessa. Viikolle 8 mennessä 83 % PEPCID:llä hoidetuista potilaista oli parantunut verrattuna 45 % lumelääkettä saaneisiin potilaisiin. Haavojen paranemisen ilmaantuvuus PEPCIDillä oli merkitsevästi korkeampi kuin lumelääkettä saaneilla kullakin aikapisteellä endoskooppisesti vahvistettujen parantuneiden haavaumien osuuden perusteella.
Tässä tutkimuksessa päivä- ja yökivun lievittymiseen kulunut aika oli merkittävästi lyhyempi PEPCID-potilailla kuin lumelääkettä saaneilla potilailla; PEPCIDiä saaneet potilaat ottivat myös vähemmän antasidia kuin lumelääkettä saaneet potilaat.
Pohjukaissuolihaavojen pitkäaikainen ylläpitohoito
PEPCID 40 mg, 20 mg pohs, verrattiin lumelääkkeeseen ylläpitohoitona kahdessa kaksoissokkoutetussa, monikeskustutkimuksessa potilailla, joilla oli endoskooppisesti vahvistettu pohjukaissuolihaava. Yhdysvalloissa tehdyssä tutkimuksessa havaittu haavaumien ilmaantuvuus 12 kuukauden sisällä lumelääkettä saaneilla potilailla oli 2,4 kertaa suurempi kuin PEPCID-hoitoa saaneilla potilailla. Niillä 89 potilaalla, joita hoidettiin PEPCID:llä, kumulatiivinen havaittu haavan ilmaantuvuus oli 23,4 % verrattuna havaittuun haavaumiin 56,6 % 89 lumelääkettä saaneella potilaalla (p
Mahahaava
Sekä yhdysvaltalaisessa että kansainvälisessä monikeskustutkimuksessa potilailla, joilla oli endoskooppisesti varmistettu aktiivinen hyvänlaatuinen mahahaava, verrattiin suun kautta annettua PEPCID:tä 20 mg, 40 mg hs plaseboon. Antasidit olivat sallittuja tutkimusten aikana, mutta niiden kulutus ei eronnut merkittävästi. PEPCID- ja lumeryhmien välillä. Kuten taulukosta 2 käy ilmi, haavan paranemisen ilmaantuvuus (poistuneet lasketaan parantumattomiksi) PEPCID 20 mg:lla oli tilastollisesti merkitsevästi parempi kuin lumelääke viikoilla 6 ja 8 yhdysvaltalaisessa tutkimuksessa ja viikoilla 4, 6 ja 8 kansainvälisessä tutkimuksessa. parantuneiden haavaumien lukumäärästä, joka vahvistettiin endoskopialla.
Päivä- ja yökivun täydellinen lievittyminen oli tilastollisesti merkitsevästi lyhyempi potilailla, jotka saivat 20 mg PEPCID:tä kuin lumelääkettä saaneilla potilailla; Kummassakaan tutkimuksessa ei kuitenkaan ollut tilastollisesti merkitsevää eroa niiden potilaiden osuudessa, joiden kipu lievittyi tutkimuksen loppuun mennessä (viikko 8).
Gastroesofageaalinen refluksitauti (GERD)
Suun kautta annettua PEPCIDiä verrattiin lumelääkkeeseen yhdysvaltalaisessa tutkimuksessa, johon otettiin potilaita, joilla oli GERD-oireita ja joilla ei ollut endoskopiaa ruokatorven eroosiosta tai haavaumista. PEPCID 20 mg bid oli tilastollisesti merkitsevästi parempi kuin 40 mg hs ja lumelääke onnistuneen oireenmukaisen lopputuloksen saavuttamisessa, mikä määritellään kohtalaiseksi tai erinomaiseksi oireiden paranemiseksi (taulukko 3).
Kahden viikon hoidon jälkeen oireenmukaista menestystä havaittiin suuremmalla prosentilla potilaista, jotka ottivat PEPCID:tä 20 mg kahdesti kahdesti verrattuna lumelääkkeeseen (p ≤ 0,01).
Endoskooppisesti varmennettujen eroosioiden ja haavaumien oireiden paranemista ja paranemista tutkittiin kahdessa lisätutkimuksessa. Paraneminen määriteltiin kaikkien endoskopialla näkyvien eroosioiden tai haavaumien täydelliseksi häviämiseksi. Yhdysvaltalainen tutkimus, jossa verrattiin PEPCID 40 mg pobid plaseboon ja PEPCID 20 mg pobid, osoitti merkittävästi suuremman prosenttiosuuden parantumisesta PEPCID 40 mg kahdesti viikossa viikoilla 6 ja 12 (taulukko 4).
Verrattuna lumelääkkeeseen PEPCID-hoitoa saaneiden potilaiden päivä- ja yönärästys helpotti nopeammin, ja suurempi prosenttiosuus potilaista koki yön närästyksen täydellisen helpotuksen. Nämä erot olivat tilastollisesti merkittäviä.
Kansainvälisessä tutkimuksessa, kun PEPCID 40 mg kahdesti verrattiin ranitidiiniin 150 mg kahdesti, tilastollisesti merkitsevästi suurempi paranemisprosentti havaittiin PEPCID 40 mg kahdesti kahdesti viikossa viikolla 12 (taulukko 5). Hoidoissa ei kuitenkaan ollut merkittävää eroa oireiden lievittämisessä.
Patologiset liikaeritystilat (esim. Zollinger-Ellisonin oireyhtymä, useat endokriiniset adenoomat)
Tutkimuksissa potilailla, joilla oli patologisia liikaerityssairauksia, kuten Zollinger-Ellisonin oireyhtymä, jossa oli useita endokriinisiä adenoomia tai ei niitä, PEPCID esti merkittävästi mahahapon eritystä ja kontrolloi siihen liittyviä oireita. Suun kautta annetut annokset 20 - 160 mg q 6 h pitivät perushapon erityksen alle 10 meekv./h; aloitusannokset titrattiin potilaan yksilöllisen tarpeen mukaan, ja myöhemmät muutokset olivat tarpeen ajan myötä joillakin potilailla. PEPCID 40mg oli hyvin siedetty näillä suurilla annoksilla pitkiä aikoja (yli 12 kuukautta) kahdeksalla potilaalla, eikä yhtään gynekomastiaa, kohonneita prolaktiinipitoisuuksia tai impotenssia raportoitu tapauksia, joiden katsottiin johtuvan lääkkeestä.
Kliininen farmakologia lapsipotilailla
Farmakokinetiikka
Taulukossa 6 on esitetty farmakokineettiset tiedot kliinisistä tutkimuksista ja julkaistusta tutkimuksesta lapsipotilailla (
Plasman puhdistuma pienenee ja eliminaation puoliintumisaika pitenee 0–3 kuukauden ikäisillä lapsipotilailla verrattuna vanhempiin lapsipotilaisiin. Farmakokineettiset parametrit yli 3 kuukauden ja 15 vuoden ikäisillä lapsipotilailla ovat verrattavissa aikuisilla saatuihin parametreihin.
Kahdeksan (11–15-vuotiaat) lapsipotilaan biologista hyötyosuutta koskevat tutkimukset osoittivat oraalisen hyötyosuuden olevan keskimäärin 0,5 verrattuna aikuisten arvoihin 0,42–0,49. Suun kautta annetuilla 0,5 mg/kg:n annoksilla saavutettiin AUC-arvot 645 ± 249 ng-h/ml ja 580 ± 60 ng-h/ml alle 1-vuotiailla lapsipotilailla (N=5) ja 11-15-vuotiailla lapsipotilailla. vastaavasti verrattuna 482 ± 181 ng-h/ml aikuisilla, joita hoidettiin 40 mg:lla suun kautta.
Farmakodynamiikka
Famotidiinin farmakodynamiikkaa arvioitiin viidellä 2–13-vuotiaalla lapsipotilaalla käyttämällä sigmoidi-Emax-mallia. Nämä tiedot viittaavat siihen, että seerumin famotidiinipitoisuuden ja mahahapon suppression välinen suhde on samanlainen kuin yhdessä aikuisilla tehdyssä tutkimuksessa havaittu (taulukko 7).
Viidessä julkaistussa tutkimuksessa (taulukko 8) tutkittiin famotidiinin vaikutusta mahalaukun pH:hon ja hapon suppression kestoon lapsipotilailla. Vaikka jokaisella tutkimuksella oli erilainen suunnittelu, hapon suppressiotiedot ajan mittaan on tiivistetty seuraavasti:
Yhdessä tutkimuksessa famotidiinin IV 0,5 mg/kg vaikutuksen mahan pH:hon ja happamuuden vähentämiseen osoitettiin olevan pidempi alle 1 kuukauden ikäisillä lapsipotilailla kuin vanhemmilla lapsipotilailla. Tämä mahahapon suppression pidempi kesto on yhdenmukainen alle 3 kuukauden ikäisten lapsipotilaiden pienentyneen puhdistuman kanssa (ks. taulukko 6).
POTILASTIEDOT
Tietoja ei ole annettu. Katso VAROTOIMENPITEET osio.
