Prilosec 40mg, 10mg, 20mg Omeprazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Prilosec 40mg on ja miten sitä käytetään?
Prilosec 40mg on resepti- ja käsikauppalääke, jota käytetään gastroesofageaalisen refluksitaudin (GERD) oireiden, mahahaavojen ja muiden liiallisesta mahahapon aiheuttamien sairauksien hoitoon. Prilosec 10 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Prilosec kuuluu lääkeryhmään nimeltä protonipumpun estäjät.
Ei tiedetä, onko Prilosec 40 mg turvallinen ja tehokas alle 1 kuukauden ikäisille lapsille.
Mitkä ovat Prilosec 10mg:n mahdolliset sivuvaikutukset?
Prilosec voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- vetistä tai veristä ripulia,
- uusi tai epätavallinen kipu ranteessa, reidessä, lonkassa tai selässä,
- kohtaukset (kouristukset),
- vähän tai ei ollenkaan virtsaamista,
- verta virtsassasi,
- turvotus,
- nopea painonnousu,
- huimaus,
- epäsäännölliset sydämenlyönnit,
- hermostunut olo,
- lihaskrampit,
- lihaskouristukset,
- yskä,
- tukehtuva tunne,
- nivelkipuja ja
- ihottuma poskissa tai käsivarsissa, joka pahenee auringonvalon vaikutuksesta
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Prilosecin yleisimmät sivuvaikutukset ovat:
- vatsakipu,
- kaasu,
- pahoinvointi,
- oksentelua,
- ripuli ja
- päänsärky
KUVAUS
PRILOSEC (omepratsoli) viivästetysti vapautuvien kapseleiden vaikuttava aine on substituoitu bentsimidatsoli, 5-metoksi-2-[[(4-metoksi-3,5-dimetyyli-2-pyridinyyli)metyyli]sulfinyyli]-1H-bentsimidatsoli, yhdiste, joka estää mahahapon eritystä. Sen empiirinen kaava on C17H19N3O3S, jonka molekyylipaino on 345,42. Rakennekaava on:
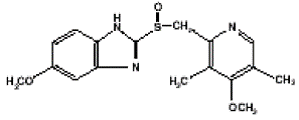
Omepratsoli on valkoinen tai luonnonvalkoinen kiteinen jauhe, joka sulaa hajoamalla noin 155 °C:ssa. Se on heikko emäs, liukenee vapaasti etanoliin ja metanoliin ja liukenee hieman asetoniin ja isopropanoliin ja liukenee hyvin heikosti veteen. Omepratsolin stabiilisuus on pH:n funktio; se hajoaa nopeasti happamissa väliaineissa, mutta sillä on hyväksyttävä stabiilisuus alkalisissa olosuhteissa.
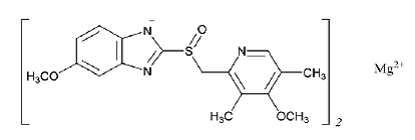
PRILOSECin (omepratsolimagnesium) vaikuttava ainesosa viivästetysti vapauttavassa oraalisuspensiossa on 5-metoksi-2-[[(4-metoksi-3,5-dimetyyli-2-pyridinyyli)metyyli]sulfinyyli]-1H-bentsimidatsoli, magnesium suola (2:1)
Omepratsolimagnesium on valkoinen tai luonnonvalkoinen jauhe, jonka sulamispiste hajoaa 200 °C:ssa. Suola liukenee heikosti (0,25 mg/ml) veteen 25 °C:ssa ja se liukenee metanoliin. Puoliintumisaika riippuu suuresti pH:sta.
Omepratsolimagnesiumin empiirinen kaava on (C17H18N3O3S)2 Mg, molekyylipaino on 713,12 ja rakennekaava on:
PRILOSEC toimitetaan viivästetysti vapauttavina kapseleina suun kautta annettavaksi. Yksi viivästetysti vapautuva kapseli sisältää joko 10 mg, 20 mg tai 40 mg omepratsolia enteropäällystettyjen rakeiden muodossa, ja seuraavat inaktiiviset aineosat: selluloosa, dinatriumvetyfosfaatti, hydroksipropyyliselluloosa, hypromelloosi, laktoosi, mannitoli, natriumlauryylisulfaatti ja muita ainesosia. Kapselin kuorissa on seuraavat inaktiiviset ainesosat: gelatiini-NF, FD&C Blue #1, FD&C Red #40, D&C Red #28, titaanidioksidi, synteettinen musta rautaoksidi, isopropanoli, butyylialkoholi, FD&C Blue #2, D&C Red #7 Calcium Lake, ja lisäksi 10 mg ja 40 mg kapselin kuoret sisältävät myös D&C Yellow #10:tä.
Jokainen PRILOSEC For Delay-Release oraalisuspension pakkaus sisältää joko 2,8 mg tai 11,2 mg omepratsolimagnesiumia (vastaa 2,5 mg tai 10 mg omepratsolia) enteropäällystettyjen rakeiden muodossa, joissa on seuraavat inaktiiviset aineosat: glyseryylimonostearaatti, hydroksipropyyli selluloosa, hypromelloosi, magnesiumstearaatti, metakryylihappokopolymeeri C, polysorbaatti, sokeripallot, talkki ja trietyylisitraatti sekä myös inaktiiviset rakeet. Inaktiiviset rakeet koostuvat seuraavista ainesosista: sitruunahappo, krospovidoni, dekstroosi, hydroksipropyyliselluloosa, rautaoksidi ja ksantaamikumi. Omepratsolirakeet ja inaktiiviset rakeet muodostetaan veteen suspension muodostamiseksi, ja ne annetaan suun kautta, nenä-mahaseen tai suoraan mahalaukkuun.
INDIKAATIOT
Aktiivisen pohjukaissuolihaavan hoito
PRILOSEC 20mg on tarkoitettu aktiivisen pohjukaissuolihaavan lyhytaikaiseen hoitoon aikuisilla. Suurin osa potilaista paranee neljässä viikossa. Jotkut potilaat saattavat tarvita neljän lisäviikon hoitoa.
Helicobacter pylori -hävitys vähentää pohjukaissuolihaavan uusiutumisen riskiä
H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
Kolminkertainen terapia
PRILOSEC 40 mg yhdessä klaritromysiinin ja amoksisilliinin kanssa on tarkoitettu potilaiden hoitoon, joilla on H. pylori -infektio ja pohjukaissuolihaava (aktiivinen tai enintään 1 vuoden historia) H. pylorin hävittämiseksi aikuisilla.
Kaksoisterapia
PRILOSEC yhdessä klaritromysiinin kanssa on tarkoitettu H. pylori -infektion ja pohjukaissuolihaavan hoitoon aikuisten H. pylorin hävittämiseksi.
Potilailla, joiden hoito epäonnistuu, PRILOSEC ja klaritromysiini liittyvät todennäköisemmin klaritromysiiniresistenssin kehittymiseen verrattuna kolmoishoitoon. Potilaille, joiden hoito epäonnistuu, on tehtävä herkkyystesti. Jos osoitetaan resistenssi klaritromysiinille tai herkkyystestaus ei ole mahdollista, on aloitettava vaihtoehtoinen antimikrobinen hoito [ks. KLIININEN FARMAKOLOGIA ja klaritromysiinin reseptitiedot, mikrobiologia-osio].
Aktiivisen hyvänlaatuisen mahahaavan hoito
PRILOSEC on tarkoitettu aikuisten aktiivisen hyvänlaatuisen mahahaavan lyhytaikaiseen (4-8 viikkoa) hoitoon.
Oireisen gastroesofageaalisen refluksitaudin (GERD) hoito
PRILOSEC on tarkoitettu närästyksen ja muiden GERD:hen liittyvien oireiden hoitoon enintään 4 viikon ajan 1-vuotiaille ja sitä vanhemmille potilaille.
Happovälitteisen GERD:n aiheuttaman eroosiivisen esofagiitin (EE) hoito
Lapsipotilaat 1 vuoden iästä aikuisiin
PRILOSEC 20mg on tarkoitettu EE:n lyhytaikaiseen (4–8 viikkoa) hoitoon, joka johtuu happovälitteisestä GERD:stä, joka on diagnosoitu endoskopialla 1-vuotiailla ja sitä vanhemmilla potilailla.
Yli 8 viikon ajan käytettynä PRILOSEC 10 mg:n tehoa EE-potilailla ei ole osoitettu. Jos potilas ei reagoi 8 viikon hoitoon, voidaan antaa 4 viikon lisähoitoa. Jos EE- tai GERD-oireet (esim. närästys) uusiutuvat, voidaan harkita 4–8 viikon lisäkuuria PRILOSEC-hoitoa.
Pediatriset potilaat 1 kuukauden - alle 1 vuoden ikäisillä
PRILOSEC on tarkoitettu lyhytaikaiseen (enintään 6 viikkoa) EE:n hoitoon, joka johtuu happovälitteisestä GERD:stä 1 kuukauden - alle 1 vuoden ikäisille lapsipotilaille.
Happovälitteisen GERD:n aiheuttaman EE:n paranemisen ylläpito
PRILOSEC 40mg on tarkoitettu happovälitteisen GERD:n aiheuttaman EE:n ylläpitohoitoon 1-vuotiaille ja sitä vanhemmille potilaille.
Kontrolloidut tutkimukset eivät kestä yli 12 kuukautta.
Patologiset liikaeritystilat
PRILOSEC 40 mg on tarkoitettu aikuisten patologisten liikaeritystilojen (esim. Zollinger-Ellisonin oireyhtymä, multippeli endokriiniset adenoomat ja systeeminen mastosytoosi) pitkäaikaiseen hoitoon.
ANNOSTELU JA HALLINNOINTI
Suositeltu annostus aikuisille indikaatioiden mukaan
Taulukossa 1 on esitetty PRILOSEC 40 mg:n suositeltu annos aikuispotilaille käyttöaiheittain.
Suositeltu lasten annostus ohjeaiheen mukaan
Taulukossa 2 esitetään PRILOSECin suositeltu annos lapsipotilaille käyttöaiheittain.
Hallinto-ohjeet
- PRILOSEC 40mg on tarkoitettu valmistettavaksi veteen ja annettavaksi suun kautta tai nenämahaletkun (NG) tai mahaletkun kautta.
- Ota PRILOSEC 40 mg ennen ateriaa.
- Antasideja voidaan käyttää samanaikaisesti PRILOSECin kanssa.
- Unohtuneet annokset: Jos annos jää väliin, ota se mahdollisimman pian. Jos seuraava annos on kuitenkin tulossa, älä ota unohtunutta annosta, vaan ota seuraava annos ajoissa. Älä ota kahta annosta kerralla korvataksesi unohtamasi annoksen.
Suun kautta antaminen vedessä
Annostelu vedellä NG- tai mahaletkun kautta (koko 6 tai suurempi)
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
PRILOSEC viivästetysti vapauttavaan oraalisuspensioon: 2,5 mg ja 10 mg omepratsolia yksikköannospakkauksissa, jotka sisältävät hienon keltaisen jauheen, joka koostuu valkoisista tai ruskehtavista omepratsolimagnesiumrakeista ja vaaleankeltaisista inaktiivisista rakeista.
Varastointi ja käsittely
PRILOSEC (omepratsolimagnesium) viivästetysti vapauttavaa oraalisuspensiota varten, 2,5 mg tai 10 mg omepratsolia, toimitetaan kerta-annospakkauksessa, joka sisältää hienon keltaisen jauheen, joka koostuu valkoisista tai ruskehtavista omepratsolimagnesiumrakeista ja vaaleankeltaisista inaktiivisista rakeista. PRILOSEC-yksikköannospakkaukset toimitetaan seuraavasti:
NDC 70515-625–01 30 kappaleen yksikköannospakkaukset: 2,5 mg:n pakkaukset NDC 70515-610–01 30 yksikköannospakkaukset: 10 mg:n pakkaukset
Varastointi
Säilytä PRILOSEC viivästetysti vapauttavaa oraalisuspensiota varten 25 °C:ssa (77 °F); retket sallittuja 15–30 °C:een (59–86 °F). [Katso USP-ohjattu huonelämpötila .]
Valmistettu: Covis Pharma, Zug, 6300 Switzerland. Tarkistettu: maaliskuu 2022
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Akuutti tubulointerstitiaalinen nefriitti [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Luun murtuma [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihohaittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Ihon ja systeeminen lupus erythematosus [katso VAROITUKSET JA VAROTOIMET ]
- Syanokobalamiinin (B-12-vitamiinin) puutos [katso VAROITUKSET JA VAROTOIMET ]
- Hypomagnesemia ja mineraaliaineenvaihdunta [katso VAROITUKSET JA VAROTOIMET ]
- Pohjarauhasten polyypit [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista PRILOSECin kanssa
Monoterapia
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Alla kuvatut turvallisuustiedot heijastavat altistumista omepratsolimagnesiumille viivästetysti vapauttaville kapseleille 3096 potilaalla maailmanlaajuisista kliinisistä tutkimuksista (465 potilasta yhdysvaltalaisista tutkimuksista ja 2631 potilasta kansainvälisistä tutkimuksista). Yhdysvalloissa tehdyissä tutkimuksissa kliinisesti tutkittuja indikaatioita olivat pohjukaissuolihaava, resistentti haavauma ja Zollinger-Ellisonin oireyhtymä. Kansainväliset kliiniset tutkimukset olivat suunnittelultaan kaksoissokkoutettuja ja avoimia. Näihin tutkimuksiin osallistuneiden PRILOSEC-hoitoa saaneiden potilaiden yleisimmät raportoidut haittavaikutukset (eli ilmaantuvuus ≥ 2 %) olivat päänsärky (7 %), vatsakipu (5 %), pahoinvointi (4 %), ripuli (4 %). ), oksentelua (3 %) ja ilmavaivoja (3 %).
Muita haittavaikutuksia, joiden ilmaantuvuus oli ≥ 1 %, olivat hapon regurgitaatio (2 %), ylempien hengitysteiden tulehdus (2 %), ummetus (2 %), huimaus (2 %), ihottuma (2 %), voimattomuus (1 %). ), selkäkipu (1 %) ja yskä (1 %).
Kliinisen tutkimuksen turvallisuusprofiili yli 65-vuotiailla potilailla oli samanlainen kuin 65-vuotiailla tai sitä nuoremmilla potilailla.
Kliinisen tutkimuksen turvallisuusprofiili lapsipotilailla, jotka saivat omepratsolimagnesiumia viivästetysti vapauttavia kapseleita, oli samanlainen kuin aikuispotilailla. Ainutlaatuista lapsiväestölle hengityselimiin kohdistuvia haittavaikutuksia ilmoitettiin kuitenkin usein 1 kuukauden - Käyttö tietyissä populaatioissa ].
Kokemus kliinisistä kokeista PRILOSEC 20 mg:n yhdistelmähoidossa helikobakteerin hävittämiseen
Kliinisissä tutkimuksissa, joissa käytettiin joko kaksoishoitoa omepratsolimagnesiumkapseleilla ja klaritromysiinillä, tai kolmoishoitoa omepratsolimagnesium-hidastetusti vapauttavilla kapseleilla, klaritromysiinillä ja amoksisilliinilla, ei havaittu näille lääkeyhdistelmille ainutlaatuisia haittavaikutuksia. Havaitut haittavaikutukset rajoittuivat aiemmin raportoituihin pelkän omepratsolin, klaritromysiinin tai amoksisilliinin yhteydessä.
Kaksoisterapia (omepratsolimagnesium viivästyneesti vapautuvat kapselit / klaritromysiini)
Kontrolloiduissa kliinisissä tutkimuksissa, joissa käytettiin yhdistelmähoitoa omepratsolimagnesiumkapseleilla ja klaritromysiinillä (n = 346), havaitut haittavaikutukset, jotka poikkesivat aiemmin pelkistä omepratsolimagnesium-hidastetusti vapauttavista kapseleista kuvatuista haittavaikutuksista, olivat makuaistin vääristyminen (15 %), kielen värjäytyminen (2). %), nuha (2 %), nielutulehdus (1 %) ja flunssa-oireyhtymä (1 %). (Lisätietoja klaritromysiinistä on klaritromysiinin reseptitietojen kohdassa Haittavaikutukset.)
Kolmoisterapia (omepratsolimagnesium viivästyneesti vapautuvat kapselit/klaritromysiini/amoksisilliini)
Yleisimmät kliinisissä tutkimuksissa havaitut haittavaikutukset, joissa käytettiin yhdistelmähoitoa omepratsolimagnesiumkapseleiden, klaritromysiinin ja amoksisilliinin (n = 274) kanssa, olivat ripuli (14 %), makuaistin vääristyminen (10 %) ja päänsärky (7 %). Mitään näistä ei esiintynyt useammin kuin pelkkiä mikrobilääkkeitä käyttävien potilaiden raportoimat. (Lisätietoja klaritromysiinistä tai amoksisilliinista on vastaavissa lääkemääräystiedoissa, Haittavaikutukset-osiossa.)
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu omepratsolin hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on vapaaehtoisesti raportoitu epävarman kokoisesta populaatiosta, ei aina ole mahdollista luotettavasti arvioida niiden todellista esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keho kokonaisuutena: Yliherkkyysreaktiot, mukaan lukien anafylaksia, anafylaktinen sokki, angioödeema, bronkospasmi, interstitiaalinen nefriitti, nokkosihottuma (ks. myös Iho alla); kuume; kipu; väsymys; huonovointisuus; systeeminen lupus erythematosus
Sydän: Rintakipu tai angina, takykardia, bradykardia, sydämentykytys, kohonnut verenpaine, perifeerinen turvotus
Endokriiniset: Gynekomastia
Ruoansulatuskanava: Haimatulehdus (joissakin tapauksissa kuolemaan johtava), anoreksia, ärtyvä paksusuolen, ulosteen värjäytyminen, ruokatorven kandidiaasi, kielen limakalvon surkastuminen, suutulehdus, vatsan turvotus, suun kuivuminen, mikroskooppinen paksusuolitulehdus, pohjarauhasen polyypit.
Ruoansulatuskanavan karsinoideja on raportoitu ZE-oireyhtymää sairastavilla potilailla, jotka ovat saaneet pitkäaikaista omepratsolihoitoa. Tämän löydön uskotaan olevan ilmentymä taustalla olevasta tilasta, jonka tiedetään liittyvän tällaisiin kasvaimiin.
Maksa: Maksasairaus, mukaan lukien maksan vajaatoiminta (osa kuolemaan johtavaa), maksanekroosi (osa kuolemaan johtavaa), hepaattinen enkefalopatia hepatosellulaarinen sairaus, kolestaattinen sairaus, sekahepatiitti, keltaisuus ja maksan toimintakokeiden kohoaminen [ALT, ASAT, GGT, alkalinen fosfataasi ja bilirubiini]
Infektiot ja infektiot: Clostridium difficileen liittyvä ripuli
Aineenvaihdunta ja ravitsemushäiriöt: Hypomagnesemia, hypokalsemia, hypokalemia [Varoitukset ja varotoimet 5.9], hyponatremia, hypoglykemia, painonnousu
Tuki- ja liikuntaelimistö: Lihasheikkous, myalgia, lihaskrampit, nivelkipu, jalkakipu, luunmurtuma
Hermosto/psykiatriset: Psykiatriset ja unihäiriöt, mukaan lukien masennus, kiihtyneisyys, aggressio, hallusinaatiot, sekavuus, unettomuus, hermostuneisuus, apatia, uneliaisuus, ahdistuneisuus ja unen poikkeavuudet; vapina, parestesia; huimaus
Hengitys: Nenäverenvuoto, nielukipu
Iho: Vakavat yleistyneet ihoreaktiot, mukaan lukien toksinen SJS/TEN (joissakin tapauksissa kuolemaan johtava), DRESS, AGEP, ihon lupus erythematosus ja erythema multiforme; valoherkkyys; urtikaria; ihottuma; ihon tulehdus; kutina; petekiat; purppura; hiustenlähtö; kuiva iho; liikahikoilu
Erityiset aistit: Tinnitus, makuaistin vääristyminen
Silmä: Näön surkastuminen, anteriorinen iskeeminen optinen neuropatia, näköhermotulehdus, kuivasilmäisyysoireyhtymä, silmän ärsytys, näön hämärtyminen, kaksoisnäkö
Urogenitaaliset: Interstitiaalinen nefriitti, hematuria, proteinuria, kohonnut seerumin kreatiniini, mikroskooppinen pyuria, virtsatieinfektio, glykosuria, virtsaamistiheys, kivesten kipu
Hematologinen: Agranulosytoosi (joissakin tapauksissa kuolemaan johtava), hemolyyttinen anemia, pansytopenia, neutropenia, anemia, trombosytopenia, leukopenia, leukosytoosi
HUUMEIDEN VUOROVAIKUTUKSET
Taulukot 3 ja 4 sisältävät lääkkeet, joilla on kliinisesti merkittäviä lääkevuorovaikutuksia ja yhteisvaikutuksia diagnostisten tekijöiden kanssa, kun niitä annetaan samanaikaisesti omepratsolin kanssa, sekä ohjeet niiden ehkäisyyn tai hoitoon.
Katso samanaikaisesti käytettyjen lääkkeiden pakkausmerkintöjä saadaksesi lisätietoja yhteisvaikutuksista PPI:iden kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Läsnäolo mahalaukun pahanlaatuisuuden
Aikuisilla oireenmukainen vaste PRILOSEC-hoitoon ei sulje pois mahalaukun pahanlaatuisuuden esiintymistä. Harkitse lisäseurantaa ja diagnostisia testejä aikuispotilaille, joilla on suboptimaalinen vaste tai varhainen oireinen uusiutuminen PPI-hoidon päätyttyä. Vanhemmilla potilailla harkitse myös endoskopiaa.
Akuutti tubulointerstitiaalinen nefriitti
Akuuttia tubulointerstitiaalista nefriittiä (TIN) on havaittu PPI-lääkkeitä käyttävillä potilailla, ja se voi ilmaantua milloin tahansa PPI-hoidon aikana. Potilailla voi esiintyä erilaisia merkkejä ja oireita oireellisista yliherkkyysreaktioista epäspesifisiin munuaisten toiminnan heikkenemisen oireisiin (esim. huonovointisuus, pahoinvointi, anoreksia). Raportoiduissa tapaussarjoissa joillekin potilaille diagnosoitiin biopsia ja munuaisten ulkopuolisia oireita (esim. kuumetta, ihottumaa tai nivelkipua) ei ilmennyt. Lopeta PRILOSEC 40mg ja arvioi potilaat, joilla epäillään akuuttia TIN:ää [katso VASTA-AIHEET ].
Clostridium Difficilen aiheuttama ripuli
Julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito, kuten PRILOSEC, saattaa liittyä Clostridium difficilen aiheuttaman ripulin lisääntyneeseen riskiin, erityisesti sairaalapotilailla. Tätä diagnoosia tulisi harkita ripulille, joka ei parane [katso HAITTAVAIKUTUKSET ].
Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen.
Clostridium difficile -bakteeriin liittyvää ripulia (CDAD) on raportoitu lähes kaikkien antibakteeristen aineiden käytön yhteydessä. Lisätietoja erityisistä antibakteerisista aineista (klaritromysiini ja amoksisilliini), jotka on tarkoitettu käytettäväksi PRILOSECin kanssa, on vastaavien lääkemääräystietojen Varoitukset ja varotoimet.
Luunmurtuma
Useat julkaistut havaintotutkimukset viittaavat siihen, että protonipumpun estäjähoito (PPI) saattaa liittyä lisääntyneeseen osteoporoosiin liittyvien lonkka-, ranteen- tai selkärangan murtumien riskiin. Murtumariski lisääntyi potilailla, jotka saivat suuria annoksia, jotka määriteltiin useiksi päivittäisiksi annoksiksi, ja pitkäaikaista PPI-hoitoa (vuoden tai pidempään). Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen. Potilaita, joilla on osteoporoosiin liittyvien murtumien riski, tulee hoitaa vahvistettujen hoitoohjeiden mukaisesti [katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET ].
Vakavat ihohaittavaikutukset
PPI-lääkkeiden käytön yhteydessä on raportoitu vaikeita ihon haittavaikutuksia, mukaan lukien Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) ja akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP). [katso HAITTAVAIKUTUKSET ]. Lopeta PRILOSEC-hoito, kun havaitset ensimmäisiä merkkejä tai oireita vakavista ihon haittavaikutuksista tai muista yliherkkyysoireista, ja harkitse lisäarviointia.
Ihon ja systeeminen lupus erythematosus
Ihon lupus erythematosus (CLE) ja systeeminen lupus erythematosus (SLE) on raportoitu potilailla, jotka käyttävät PPI-lääkkeitä, mukaan lukien omepratsolia. Nämä tapahtumat ovat ilmenneet sekä uutena ilmaantumisena että olemassa olevan autoimmuunisairauden pahenemisena. Suurin osa PPI:n aiheuttamista lupus erythematosus -tapauksista oli CLE.
Yleisin PPI-lääkkeillä hoidetuilla potilailla raportoitu CLE:n muoto oli subakuutti CLE (SCLE), ja se esiintyi viikkojen tai vuosien kuluessa jatkuvan lääkehoidon jälkeen potilailla, jotka vaihtelivat imeväisistä vanhuksiin. Yleensä histologiset löydökset havaittiin ilman elinten osallistumista.
Systeemistä lupus erythematosusta (SLE) on raportoitu harvemmin kuin CLE:tä PPI-lääkkeitä saavilla potilailla. PPI:hen liittyvä SLE on yleensä lievempi kuin ei-lääkkeiden aiheuttama SLE. SLE puhkesi tyypillisesti päivien tai vuosien kuluessa hoidon aloittamisesta ensisijaisesti potilailla, jotka vaihtelivat nuorista aikuisista vanhuksiin. Suurimmalla osalla potilaista oli ihottumaa; kuitenkin myös nivelkipua ja sytopeniaa raportoitiin.
Vältä PPI-lääkkeiden antamista pidempään kuin lääketieteellisesti on tarpeen. Jos PRILOSEC 10 mg -valmistetta saavilla potilailla havaitaan CLE:n tai SLE:n mukaisia merkkejä tai oireita, keskeytä lääkkeen käyttö ja lähetä potilas asianmukaisen asiantuntijan arvioitavaksi. Useimmat potilaat paranevat, kun pelkkä PPI-hoito lopetetaan 4–12 viikossa. Serologiset testit (esim. ANA) voivat olla positiivisia ja kohonneiden serologisten testien tulosten korjaaminen voi kestää kauemmin kuin kliiniset oireet.
Yhteisvaikutukset klopidogreelin kanssa
Vältä PRILOSEC 10 mg:n samanaikaista käyttöä klopidogreelin kanssa. Klopidogreeli on aihiolääke. Klopidogreelin aiheuttama verihiutaleiden aggregaation esto johtuu kokonaan aktiivisesta metaboliitista. Klopidogreelin metaboloituminen aktiiviseksi metaboliitiksi voi heikentyä, jos sitä käytetään samanaikaisesti CYP2C19-aktiivisuutta estävien lääkkeiden, kuten omepratsolin, kanssa. Klopidogreelin ja 80 mg:n omepratsolin samanaikainen käyttö heikentää klopidogreelin farmakologista aktiivisuutta, vaikka antoväli olisi 12 tuntia.
Kun käytät PRILOSECia, harkitse vaihtoehtoista verihiutaleiden vastaista hoitoa [katso HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Syanokobalamiinin (B-12-vitamiinin) puutos
Päivittäinen hoito millä tahansa happoa vähentävillä lääkkeillä pitkän ajan (esim. yli 3 vuoden ajan) voi johtaa syanokobalamiinin (B-12-vitamiinin) imeytymishäiriöön, jonka aiheuttaa hypo- tai aklorhydria. Kirjallisuudessa on raportoitu harvoin syanokobalamiinin puutteesta happoa vähentävän hoidon yhteydessä. Tätä diagnoosia tulee harkita, jos PRILOSECilla hoidetuilla potilailla havaitaan syanokobalamiinin puutoksen kliinisiä oireita.
Hypomagnesemia ja mineraaliaineenvaihdunta
Oireista ja oireetonta hypomagnesemiaa on raportoitu harvoin potilailla, joita on hoidettu PPI-lääkkeillä vähintään kolmen kuukauden ajan, useimmissa tapauksissa vuoden hoidon jälkeen. Vakavia haittavaikutuksia ovat tetania, rytmihäiriöt ja kouristukset. Hypomagnesemia voi johtaa hypokalsemiaan ja/tai hypokalemiaan ja voi pahentaa taustalla olevaa hypokalsemiaa riskipotilailla. Useimmilla potilailla hypomagnesemian hoito vaati magnesiumin korvaamista ja PPI:n lopettamista.
Potilaiden, joiden odotetaan saavan pitkäaikaista hoitoa tai jotka käyttävät PPI-lääkkeitä lääkkeiden, kuten digoksiinin tai lääkkeiden kanssa, jotka voivat aiheuttaa hypomagnesemiaa (esim. diureetit), terveydenhuollon ammattilaiset voivat harkita magnesiumpitoisuuden seurantaa ennen PPI-hoidon aloittamista ja määräajoin [ks. HAITTAVAIKUTUKSET ].
Harkitse magnesium- ja kalsiumtasojen seurantaa ennen PRILOSEC-hoidon aloittamista ja ajoittain hoidon aikana potilailla, joilla on jo hypokalsemian riski (esim. hypoparatyreoosi). Täydennä tarvittaessa magnesiumia ja/tai kalsiumia. Jos hypokalsemia ei kestä hoitoa, harkitse PPI-hoidon lopettamista.
Vuorovaikutus mäkikuisman tai rifampiinin kanssa
Lääkkeet, jotka indusoivat CYP2C19:ää tai CYP3A4:ää (kuten mäkikuisma tai rifampiini) voivat vähentää merkittävästi omepratsolipitoisuuksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Vältä PRILOSECin samanaikaista käyttöä mäkikuisman tai rifampiinin kanssa.
Vuorovaikutukset neuroendokriinisten kasvainten diagnostisten tutkimusten kanssa
Seerumin kromograniini A (CgA) -tasot nousevat toissijaisesti lääkkeiden aiheuttaman mahalaukun happamuuden laskun seurauksena. Lisääntynyt CgA-taso voi aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa. Terveydenhuollon tarjoajien tulee tilapäisesti lopettaa PRILOSEC 20 mg -hoito vähintään 14 päivää ennen CgA-tason arviointia ja harkita testin toistamista, jos CgA-alkutasot ovat korkeat. Jos suoritetaan sarjatestejä (esim. seurantaa varten), testaukseen tulee käyttää samaa kaupallista laboratoriota, koska testien väliset vertailualueet voivat vaihdella [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vuorovaikutus metotreksaatin kanssa
Kirjallisuus viittaa siihen, että PPI-lääkkeiden samanaikainen käyttö metotreksaatin kanssa (pääasiassa suurina annoksina) voi nostaa ja pidentää metotreksaatin ja/tai sen metaboliitin seerumipitoisuuksia, mikä saattaa johtaa metotreksaattitoksisuuteen. Käytettäessä suuria annoksia metotreksaattia voidaan harkita PPI:n väliaikaista keskeyttämistä joillakin potilailla [ks HUUMEIDEN VUOROVAIKUTUKSET ].
Pohjarauhasten polyypit
PPI:n käyttöön liittyy lisääntynyt pohjukaissuolen polyyppien riski, joka lisääntyy pitkäaikaisessa käytössä, erityisesti yli vuoden. Suurin osa PPI-käyttäjistä, joille kehittyi pohjukaisrauhasen polyyppeja, oli oireettomia ja pohjukaisrauhasen polyypit tunnistettiin sattumalta endoskopiassa. Käytä lyhyintä PPI-hoitoa, joka sopii hoidettavaan sairauteen.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ja käyttöohjeet ).
Akuutti tubulointerstitiaalinen nefriitti
Neuvo potilasta tai hoitajaa soittamaan välittömästi potilaan terveydenhuollon tarjoajalle, jos heillä on merkkejä ja/tai oireita, jotka liittyvät akuuttiin tubulointerstitiaaliseen nefriittiin [ks. VAROITUKSET JA VAROTOIMET ].
Clostridium Difficilen aiheuttama ripuli
Neuvo potilasta tai hoitajaa soittamaan välittömästi potilaan terveydenhuollon tarjoajalle, jos heillä on ripuli, joka ei parane [katso VAROITUKSET JA VAROTOIMET ].
Luunmurtuma
Neuvo potilasta tai hoitajaa ilmoittamaan kaikista murtumista, erityisesti lonkan, ranteen tai selkärangan murtumista, potilaan terveydenhuollon tarjoajalle [katso VAROITUKSET JA VAROTOIMET ].
Vakavat ihohaittavaikutukset
Neuvo potilasta tai hoitajaa lopettamaan PRILOSEC 40 mg -valmisteen käyttö ja ilmoittamaan terveydenhuollon tarjoajalle, kun ilmenee ensimmäinen vakava ihohaittareaktio tai muu yliherkkyysmerkki [ks. VAROITUKSET JA VAROTOIMET ].
Ihon ja systeeminen lupus erythematosus
Neuvo potilasta tai hoitajaa soittamaan välittömästi potilaan terveydenhuollon tarjoajalle uusien tai pahenevien oireiden vuoksi, jotka liittyvät ihon tai systeemiseen lupus erythematosukseen [ks. VAROITUKSET JA VAROTOIMET ]
Syanokobalamiinin (B-12-vitamiinin) puutos
Neuvo potilasta tai hoitajaa ilmoittamaan kaikista kliinisistä oireista, jotka voivat liittyä syanokobalamiinin puutteeseen potilaan terveydenhuollon tarjoajalle, jos he ovat saaneet PRILOSECia yli 3 vuotta [ks. VAROITUKSET JA VAROTOIMET ].
Hypomagnesemia ja mineraaliaineenvaihdunta
Neuvo potilasta tai hoitajaa ilmoittamaan kaikista kliinisistä oireista, jotka voivat liittyä hypomagnesemiaan, hypokalsemiaan ja/tai hypokalemiaan, potilaan terveydenhuollon tarjoajalle, jos he ovat saaneet PRILOSECia vähintään 3 kuukauden ajan [ks. VAROITUKSET JA VAROTOIMET ].
Huumeiden vuorovaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he aloittavat hoidon rilpiviriiniä sisältävillä tuotteilla, klopidogreelilla, mäkikuismalla tai rifampiinilla; tai jos he käyttävät suuria annoksia metotreksaattia [ks VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ].
Hallinto
- PRILOSEC on tarkoitettu valmistettavaksi veteen ja annettavaksi suun kautta tai nenämahaletkun (NG) tai mahaletkun kautta lääkitysoppaassa kuvatulla tavalla.
- Ota PRILOSEC ennen ateriaa.
- Antasideja voidaan käyttää samanaikaisesti PRILOSECin kanssa.
- Unohtuneet annokset: Jos annos jää väliin, ota se mahdollisimman pian. Jos seuraava annos on kuitenkin tulossa, älä ota unohtunutta annosta, vaan ota seuraava annos ajoissa. Älä ota kahta annosta kerralla korvataksesi unohtamasi annoksen.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahdessa 24 kuukauden karsinogeenisuustutkimuksessa rotilla omepratsolia vuorokausiannoksilla 1,7, 3,4, 13,8, 44,0 ja 140,8 mg/kg/vrk (noin 0,4-34 kertaa ihmisen annos 40 mg/vrk, kehon pinnalla ilmaistuna pinta-alan perusteella) tuotti mahalaukun ECL-solukarsinoideja annoksesta riippuvalla tavalla sekä uros- että naarasrotilla; tämän vaikutuksen ilmaantuvuus oli huomattavasti suurempi naarasrotilla, joilla oli korkeammat veren omepratsolipitoisuudet. Hoitamattomalla rotalla mahalaukun karsinoideja esiintyy harvoin. Lisäksi ECL-solujen hyperplasiaa esiintyi kaikissa hoidetuissa molempien sukupuolten ryhmissä. Yhdessä näistä tutkimuksista naarasrottia hoidettiin 13,8 mg:lla omepratsolia/kg/vrk (noin 3,4 kertaa ihmisen annos 40 mg/vrk, kehon pinta-alan perusteella) yhden vuoden ajan, minkä jälkeen niitä seurattiin vielä vuoden ajan ilman huume. Näissä rotissa ei havaittu karsinoideja. Hoitoon liittyvän ECL-solujen liikakasvun ilmaantuvuuden havaittiin lisääntyneen vuoden lopussa (94 % hoidetuista vs. 10 % kontrolleista). Toiseen vuoteen ero käsiteltyjen ja kontrollirottien välillä oli paljon pienempi (46 % vs. 26 %), mutta osoitti silti enemmän hyperplasiaa hoidetussa ryhmässä. Mahalaukun adenokarsinooma havaittiin yhdellä rotalla (2 %). Samanlaista kasvainta ei havaittu kahden vuoden ajan hoidetuilla uros- tai naarasrotilla. Tälle rottikannalle ei ole havaittu historiallisesti samanlaista kasvainta, mutta löydöstä, joka koskee vain yhtä kasvainta, on vaikea tulkita. Sprague-Dawley-rotilla tehdyssä 52 viikkoa kestäneessä toksisuustutkimuksessa aivojen astrosytoomat havaittiin pienellä määrällä uroksia, jotka saivat omepratsolia annoksilla 0,4, 2 ja 16 mg/kg/vrk (noin 0,1-3,9 kertaa ihmisen annos 40 mg/vrk, kehon pinta-alan perusteella). Naarasrotilla ei havaittu astrosytoomaa tässä tutkimuksessa. Sprague-Dawley-rotilla tehdyssä kaksivuotisessa karsinogeenisuustutkimuksessa uroksilla tai naarailla ei havaittu astrosytoomaa suurella annoksella 140,8 mg/kg/vrk (noin 34 kertaa ihmisen annos 40 mg/vrk kehon pinta-alan perusteella laskettuna). . Omepratsolin 78 viikkoa kestänyt hiirillä tehty karsinogeenisuustutkimus ei osoittanut lisääntynyttä kasvainten esiintymistä, mutta tutkimus ei ollut ratkaiseva. 26 viikkoa kestänyt p53 (+/-) siirtogeenisten hiirten karsinogeenisuustutkimus ei ollut positiivinen.
Omepratsoli oli positiivinen klastogeenisten vaikutusten suhteen ihmisen lymfosyyttien kromosomipoikkeavuuskokeessa in vitro, toisessa kahdesta hiiren mikrotumatestistä in vivo ja in vivo luuydinsolujen kromosomipoikkeavuuskokeessa. Omepratsoli oli negatiivinen in vitro Ames-testissä, in vitro hiiren lymfoomasolun eteenpäin suuntautuvassa mutaatiomäärityksessä ja in vivo rotan maksan DNA-vauriomäärityksessä.
Omepratsolin oraalisilla annoksilla aina 138 mg/kg/vrk asti rotilla (noin 34 kertaa suun kautta otettava annos 40 mg ihmisen kehon pinta-alasta laskettuna) ei havaittu vaikuttavan hedelmällisyyteen eikä lisääntymiskykyyn.
24 kuukauden karsinogeenisuustutkimuksissa rotilla havaittiin annoksesta riippuvaa merkittävää mahalaukun karsinoidikasvaimien ja ECL-solujen liikakasvun lisääntymistä sekä uros- että naaraseläimillä [ks. VAROITUKSET JA VAROTOIMET ]. Karsinoidikasvaimia on havaittu myös rotilla, joille on tehty fundektomia tai pitkäaikainen hoito muilla protonipumpun estäjillä tai suurilla H2-reseptoriantagonistiannoksilla.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Omepratsolin käytöstä raskaana oleville naisille ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Saatavilla olevat epidemiologiset tiedot eivät osoita suurentunutta vakavien synnynnäisten epämuodostumien tai muiden haitallisten raskaustulosten riskiä omepratsolin käytön ensimmäisen kolmanneksen aikana. Rotilla ja kaniineilla tehdyt lisääntymistutkimukset johtivat annoksesta riippuvaiseen alkiokuolleisuuteen omepratsolin annoksilla, jotka olivat noin 3,4–34 kertaa suun kautta otettavan 40 mg:n ihmisen annosta (60 kg painavan henkilön kehon pinta-alan perusteella).
Teratogeenisuutta ei havaittu lisääntymistutkimuksissa eläimillä, kun esomepratsolia (omepratsolin enantiomeeri) magnesiumia annettiin oraalisesti rotille ja kaniineille organogeneesin aikana noin 68-kertaisilla annoksilla ja kaniineilla 42-kertaisilla annoksilla ihmisille suun kautta annetulla 40 mg esomepratsoliannoksella tai 40 mg omepratsolia. 60 kg painavan henkilön kehon pinta-alan perusteella).
Muutoksia luuston morfologiassa havaittiin rottien jälkeläisillä, joille annettiin suurimman osan tiineyden ja imetyksen ajan annoksia, jotka olivat vähintään 34 kertaa suuremmat kuin suun kautta otettava 40 mg esomepratsoli- tai 40 mg omepratsoliannos. Kun äidin antaminen rajoittui vain raskauteen, jälkeläisten luun fysikaaliseen morfologiaan ei ollut vaikutuksia missään iässä [ks. Data ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioituja taustariskejä mainitulle väestölle ei tunneta. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Data
Ihmistiedot
Neljässä julkaistussa epidemiologisessa tutkimuksessa verrattiin synnynnäisten poikkeavuuksien esiintymistiheyttä omepratsolia raskauden aikana käyttäneille naisille syntyneillä vauvoilla H2-reseptorin salpaajille tai muille verrokeille altistuneiden naisten vauvojen poikkeavuuksien esiintymistiheyteen.
Ruotsin lääketieteellisen syntymärekisterin suorittama väestöpohjainen retrospektiivinen kohorttiepidemiologinen tutkimus, joka kattoi noin 99 % raskauksista vuosina 1995-99, raportoi 955 lapsesta (824 altistui ensimmäisen raskauskolmanneksen aikana, joista 39 altistui ensimmäisen raskauskolmanneksen jälkeen ja 131. ensimmäisen raskauskolmanneksen jälkeen), joiden äidit käyttivät omepratsolia raskauden aikana. Kohdussa omepratsolille altistuneiden imeväisten määrä, joilla oli epämuodostumia, alhainen syntymäpaino, alhainen Apgar-pistemäärä tai joutui sairaalaan, oli samanlainen kuin tässä populaatiossa havaittu määrä. Kammioväliseinävaurioilla syntyneiden imeväisten ja kuolleena syntyneiden lasten määrä oli hieman suurempi omepratsolille altistuneilla lapsilla kuin odotettu määrä tässä populaatiossa.
Väestöpohjainen retrospektiivinen kohorttitutkimus, joka kattoi kaikki elävänä syntyneet Tanskassa vuosina 1996–2009, raportoi 1 800 elävänä syntyneestä, joiden äidit käyttivät omepratsolia ensimmäisen raskauskolmanneksen aikana, ja 837 317 elävänä syntynyttä lasta, joiden äidit eivät käyttäneet protonipumpun estäjää. Synnynnäisten epämuodostumien kokonaismäärä vauvoilla, joiden äidit ovat saaneet ensimmäisen raskauskolmanneksen altistuksen omepratsolille, oli 2,9 % ja 2,6 % lapsilla, joiden äidit eivät olleet altistuneet protonipumpun estäjille ensimmäisen raskauskolmanneksen aikana.
Retrospektiivinen kohorttitutkimus raportoi 689 raskaana olevasta naisesta, jotka olivat altistuneet joko H2-salpaajille tai omepratsolille ensimmäisen raskauskolmanneksen aikana (134 altistettiin omepratsolille) ja 1 572 raskaana olevaa naista, jotka eivät olleet altistuneet kummallekaan ensimmäisen kolmanneksen aikana. Epämuodostumien kokonaismäärä jälkeläisillä, jotka syntyivät ensimmäisen raskauskolmanneksen aikana omepratsolille, H2-salpaajalle, tai jotka eivät olleet altistuneet, oli vastaavasti 3,6 %, 5,5 % ja 4,1 %.
Pienessä prospektiivisessa havainnoivassa kohorttitutkimuksessa seurattiin 113 naista, jotka olivat altistuneet omepratsolille raskauden aikana (89 % ensimmäisen raskauskolmanneksen altistumisesta). Vakavien synnynnäisten epämuodostumien raportoitu määrä oli 4 % omepratsoliryhmässä, 2 % ei-teratogeeneille altistuneilla kontrolleilla ja 2,8 % sairauspariryhmillä. Spontaanien ja elektiivisten aborttien, ennenaikaisten synnytysten, raskausaika synnytyksen aikana ja keskimääräinen syntymäpaino olivat samanlaiset ryhmissä.
Useat tutkimukset eivät ole raportoineet ilmeisiä haitallisia lyhytaikaisia vaikutuksia lapseen, kun omepratsolia annettiin kerta-annoksena suun kautta tai suonensisäisesti yli 200 raskaana olevalle naiselle esilääkityksenä keisarinleikkaukseen yleisanestesiassa.
Eläinten tiedot
Omepratsoli
Lisääntymistutkimukset, jotka on suoritettu omepratsolilla rotilla 138 mg/kg/vrk suun kautta otetuilla annoksilla (noin 34 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alasta laskettuna) ja kaniineilla annoksilla 69,1 mg/kg/vrk. noin 34 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alan perusteella laskettuna) organogeneesin aikana ei paljastanut todisteita omepratsolin teratogeenisesta potentiaalista. Kaneille organogeneesin aikana annettu omepratsoli annosvälillä 6,9–69,1 mg/kg/vrk (noin 3,4–34 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alasta laskettuna) aiheutti annosriippuvaisen alkiokuolleisuuden lisääntymisen. sikiön resorptiot ja raskauden häiriöt. Rotilla havaittiin annosriippuvaista alkio-/sikiötoksisuutta ja synnytyksen jälkeistä kehitystoksisuutta jälkeläisillä, jotka olivat peräisin vanhemmista, joita hoidettiin omepratsoliannoksella 13,8-138,0 mg/kg/vrk (noin 3,4-34 kertaa ihmisen suun kautta annetut 40 mg:n annokset kehon pinnalla pinta-alan perusteella), annettu ennen parittelua laktaatiojakson ajan.
Esomepratsoli
Alla kuvatut tiedot on saatu tutkimuksista, joissa käytettiin esomepratsolia, omepratsolin enantiomeeriä. Annoskerrat eläimestä ihmiseen perustuvat oletukseen, että ihmisillä on yhtäläinen systeeminen esomepratsolialtistus joko 40 mg esomepratsolin tai 40 mg omepratsolin oraalisen annon jälkeen.
Lisääntymistutkimuksissa ei havaittu vaikutuksia alkion ja sikiön kehitykseen rotilla oraalisilla annoksilla 280 mg/kg/vrk asti (noin 68 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alasta laskettuna) tai kaniineilla oraaliset annokset aina 86 mg/kg/vrk asti (noin 42 kertaa ihmisen oraalinen annos 40 mg esomepratsolia tai 40 mg omepratsolia kehon pinta-alan perusteella) organogeneesin aikana.
Pre- ja postnataalinen kehitystoksisuustutkimus rotilla, joissa oli muita päätepisteitä luun kehityksen arvioimiseksi, suoritettiin esomepratsolimagnesiumilla suun kautta annetuilla annoksilla 14–280 mg/kg/vrk (noin 3,4–68 kertaa ihmisen oraalinen annos 40 mg esomepratsolia tai 40 mg/vrk). mg omepratsolia kehon pinta-alan perusteella). Vastasyntyneen/varhaisen postnataalisen (syntymästä vieroittamiseen) eloonjääminen väheni annoksilla, jotka olivat yhtä suuria tai suurempia kuin 138 mg/kg/vrk (noin 34 kertaa suun kautta otettava 40 mg esomepratsoli- tai 40 mg omepratsoliannos kehon pinta-alasta laskettuna). Paino ja painonnousu vähenivät ja hermokäyttäytymisen tai yleisen kehityksen viivästykset välittömästi vieroituksen jälkeisellä aikavälillä olivat ilmeisiä annoksilla, jotka olivat yhtä suuria tai suurempia kuin 69 mg/kg/vrk (noin 17 kertaa suun kautta otettava esomepratsoliannos 40 mg tai 40 mg). mg omepratsolia kehon pinta-alan perusteella). Lisäksi todettiin reisiluun pituuden, aivokuoren leveyden ja paksuuden pienenemistä, sääriluun kasvulevyn paksuuden pienenemistä ja vähäisestä lievään luuytimen hyposellulaarisuutta annoksilla, jotka olivat yhtä suuria tai suurempia kuin 14 mg/kg/vrk (noin 3,4 kertaa suun kautta otettuun ihmiseen verrattuna). 40 mg esomepratsolia tai 40 mg omepratsolia kehon pinta-alan perusteella). Fyysistä dysplasiaa reisiluun havaittiin rottien jälkeläisillä, joille annettiin oraalisia esomepratsolimagnesiumiannoksia 138 mg/kg/vrk tai suurempina annoksina (noin 34 kertaa ihmisen oraalinen annos 40 mg esomepratsolia tai 40 mg omepratsolia kehossa pinta-alan perusteella).
Vaikutuksia emon luuhun havaittiin raskaana olevilla ja imettävillä rotilla pre- ja postnataalisessa toksisuustutkimuksessa, kun esomepratsolimagnesiumia annettiin suun kautta annoksina 14-280 mg/kg/vrk (noin 3,4-68 kertaa ihmisen suun kautta otettava 40 mg esomepratsoliannos). tai 40 mg omepratsolia kehon pinta-alan perusteella). Kun rotille annettiin annosta gestaatiopäivästä 7 vieroituspäivään postnataalisena päivänä 21, emon reisiluun painossa havaittiin tilastollisesti merkitsevä, jopa 14 %:n lasku (verrattuna plasebohoitoon) annoksilla, jotka olivat yhtä suuria tai suurempia kuin 138 mg/kg/vrk. (noin 34 kertaa ihmisen suun kautta otettava 40 mg esomepratsoli- tai 40 mg omepratsoliannos kehon pinta-alasta laskettuna).
Pre- ja postnataalinen kehitystutkimus rotilla esomepratsolistrontiumilla (käytettäessä ekvimolaarisia annoksia esomepratsolimagnesiumtutkimukseen verrattuna) tuotti samanlaisia tuloksia emoilla ja pennuilla kuin edellä on kuvattu.
Rotilla tehty kehitystoksisuustutkimus, jossa oli lisäaikapisteitä poikasten luun kehityksen arvioimiseksi syntymän jälkeisestä päivästä 2 aikuisuuteen, suoritettiin esomepratsolimagnesiumilla oraalisilla annoksilla 280 mg/kg/vrk (noin 68 kertaa suun kautta otettava 40 mg ihmisen annos kehon pinta-alan perusteella), jolloin esomepratsolia annettiin joko 7. raskauspäivästä tai 16. gestaatiopäivästä synnytykseen asti. Kun äidin antaminen rajoittui vain raskauteen, jälkeläisten luun fysikaaliseen morfologiaan ei ollut vaikutuksia missään iässä.
Imetys
Riskien yhteenveto
Rajalliset tiedot viittaavat siihen, että omepratsoli voi erittyä äidinmaitoon. Omepratsolin vaikutuksista imetettävään lapseen tai maidontuotantoon ei ole kliinistä tietoa. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin kliininen PRILOSEC 40 mg:n tarve ja PRILOSEC 20 mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Käyttö lapsille
PRILOSEC 40 mg:n turvallisuus ja tehokkuus on osoitettu 1–16-vuotiailla lapsipotilailla oireisen GERD:n, happovälitteisen GERD:n aiheuttaman EE:n hoidossa ja happovälitteisen GERD:n aiheuttaman EE:n paranemisen ylläpitämisessä. PRILOSEC 10 mg:n käyttöä tässä ikäryhmässä tukevat riittävät ja hyvin kontrolloidut tutkimukset aikuisilla sekä kontrolloimattomat turvallisuus-, tehokkuus- ja farmakokineettiset tutkimukset lapsi- ja nuorisopotilailla [ks. KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset ].
PRILOSEC 10 mg:n turvallisuus ja tehokkuus on osoitettu 1 kuukauden – alle 1 vuoden ikäisillä lapsipotilailla happovälitteisen GERD:n aiheuttaman EE:n hoidossa, ja sitä tukevat riittävät ja hyvin kontrolloidut tutkimukset aikuisilla sekä turvallisuus-, farmakokineettiset, ja lapsipotilailla tehdyt farmakodynaamiset tutkimukset [katso KLIININEN FARMAKOLOGIA ].
Lapsiväestössä hengityselimiin kohdistuvia haittavaikutuksia raportoitiin usein koko ikäryhmässä (1 kuukaudesta 16 vuoteen). Välikorvan tulehdusta raportoitiin usein 1 kuukauden - HAITTAVAIKUTUKSET ].
PRILOSECin turvallisuutta ja tehokkuutta ei ole varmistettu:
- alle 1-vuotiaat potilaat:
- Oireisen GERD:n hoito
- Happovälitteisen GERD:n aiheuttaman EE:n paranemisen ylläpitäminen
- lapsipotilaat:
- Aktiivisen pohjukaissuolihaavan hoito
- H. pylori -hävitys pohjukaissuolihaavan uusiutumisen riskin vähentämiseksi
- Aktiivisen hyvänlaatuisen mahahaavan hoito
- Patologiset liikaeritystilat
- alle 1 kuukauden ikäisille potilaille minkä tahansa käyttöaiheen osalta.
Nuorten eläinten tiedot
Esomepratsolin, omepratsolin enantiomeerin, osoitettiin vähentävän kehon painoa, painonnousua, reisiluun painoa, reisiluun pituutta ja kokonaiskasvua suun kautta otetuilla annoksilla, jotka ovat noin 34–68 kertaa ihmisen 40 mg:n esomepratsolin tai 40 mg:n omepratsolin vuorokausiannos kehon perusteella. pinta-ala nuorten rottien toksisuustutkimuksessa. Annoskerrat eläimestä ihmiseen perustuvat oletukseen, että ihmisillä on yhtäläinen systeeminen esomepratsolialtistus joko 40 mg esomepratsolin tai 40 mg omepratsolin oraalisen annon jälkeen.
Nuorilla rotilla suoritettiin 28 päivän toksisuustutkimus 14 päivän palautumisvaiheella esomepratsolimagnesiumia annoksilla 70-280 mg/kg/vrk (noin 17-68 kertaa ihmisen vuorokausiannos 40 mg esomepratsolia tai 40 mg suun kautta). omepratsoli kehon pinta-alan perusteella). Kuolemien määrä lisääntyi suurella annoksella 280 mg/kg/vrk, kun nuorille rotille annettiin esomepratsolimagnesiumia syntymän jälkeisestä päivästä 7. päivään 35. Lisäksi annokset olivat vähintään 140 mg/kg/vrk. vuorokaudessa (noin 34 kertaa vuorokaudessa suun kautta otettava annos ihmiselle 40 mg esomepratsolia tai 40 mg omepratsolia kehon pinta-alasta laskettuna), aiheutti hoitoon liittyvää painon laskua (noin 14 %) ja painon nousua, reisiluun painon ja reisiluun laskua. pituutta ja vaikutti kokonaiskasvuun. Yllä kuvattuja vertailukelpoisia löydöksiä on havaittu myös tässä tutkimuksessa toisen esomepratsolisuolan, esomepratsolin strontiumin kanssa esomepratsolin ekvimolaarisilla annoksilla.
Geriatrinen käyttö
Omepratsolia annettiin yli 2000 iäkkäälle henkilölle (≥ 65-vuotiaalle) kliinisissä tutkimuksissa Yhdysvalloissa ja Euroopassa. Turvallisuudessa ja tehokkuudessa ei ollut eroja iäkkäiden ja nuorempien koehenkilöiden välillä. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien koehenkilöiden vasteessa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Farmakokineettiset tutkimukset ovat osoittaneet, että eliminaationopeus oli jonkin verran hidastunut vanhuksilla ja biologinen hyötyosuus lisääntyi. Omepratsolin plasmapuhdistuma oli 250 ml/min (noin puolet nuorten vapaaehtoisten puhdistumasta) ja sen puoliintumisaika plasmassa oli keskimäärin yksi tunti, noin kaksi kertaa nuorten terveiden vapaaehtoisten puhdistuma. Annoksen muuttaminen ei kuitenkaan ole tarpeen vanhuksilla [katso KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla (Child-Pugh-luokka A, B tai C) omepratsolialtistus suureni huomattavasti terveisiin koehenkilöihin verrattuna. PRILOSEC-annoksen pienentämistä 10 mg:sta 10 mg:aan kerran päivässä suositellaan potilaille, joilla on maksan vajaatoiminta EE:n paranemisen ylläpitämiseksi [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
Aasian väestö
Terveillä koehenkilöillä tehdyissä tutkimuksissa aasialaisten altistuminen oli noin neljä kertaa suurempi kuin valkoihoisilla. PRILOSECin annoksen pienentämistä 20 mg:sta 10 mg:aan kerran vuorokaudessa suositellaan aasialaispotilaille EE:n paranemisen ylläpitämiseksi [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Omepratsolin yliannostuksista ihmisillä on raportoitu. Annokset vaihtelivat jopa 2 400 mg:aan (120 kertaa tavallinen suositeltu kliininen annos). Ilmiöt olivat vaihtelevia, mutta niihin sisältyi sekavuutta, uneliaisuutta, näön hämärtymistä, takykardiaa, pahoinvointia, oksentelua, hikoilua, punoitusta, päänsärkyä, suun kuivumista ja muita haittavaikutuksia, jotka olivat samanlaisia kuin normaalissa kliinisessä kokemuksessa [ks. HAITTAVAIKUTUKSET ]. Oireet olivat ohimeneviä, eikä vakavia kliinisiä seurauksia ole raportoitu, kun PRILOSEC 20 mg otettiin yksinään. Spesifistä vastalääkettä omepratsolin yliannostukseen ei tunneta.
Omepratsoli sitoutuu laajasti proteiineihin, joten se ei ole helposti dialysoitavissa. Yliannostustapauksissa hoidon tulee olla oireenmukaista ja tukevaa.
Jos ylialtistuminen tapahtuu, soita Myrkytystietokeskukseen numeroon 1-800-222-1222 saadaksesi ajantasaista tietoa myrkytyksen tai yliannostuksen hallinnasta.
VASTA-AIHEET
- PRILOSEC on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä substituoiduille bentsimidatsoleille tai jollekin valmisteen aineosalle. Yliherkkyysreaktiot voivat sisältää anafylaksia, anafylaktinen sokki, angioödeema, bronkospasmi, akuutti tubulointerstitiaalinen nefriitti ja urtikaria [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
- Protonipumpun estäjät (PPI), mukaan lukien PRILOSEC 10 mg, ovat vasta-aiheisia potilailla, jotka saavat rilpiviriiniä sisältäviä tuotteita [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Lisätietoja antibakteeristen aineiden (klaritromysiini ja amoksisilliini) vasta-aiheista yhdessä PRILOSEC 40 mg:n kanssa on niiden pakkausselosteen VASTA-AIHEET-osiossa.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Omepratsoli kuuluu eritystä vähentävien yhdisteiden luokkaan, substituoituihin bentsimidatsoleihin, jotka estävät mahahapon eritystä estämällä spesifisesti H+/K+ ATPaasientsyymijärjestelmää mahalaukun parietaalisolun erityspinnalla. Koska tätä entsyymijärjestelmää pidetään mahalaukun limakalvon happo(protoni)pumppuna, omepratsolia on luonnehdittu mahahapon pumpun estäjäksi, koska se estää hapon tuotannon viimeisen vaiheen. Tämä vaikutus on annoksesta riippuvainen ja johtaa sekä perus- että stimuloidun haponerityksen estoon ärsykkeestä riippumatta.
Farmakodynamiikka
Antisekretiivinen toiminta
Oraalisen annon jälkeen omepratsolin eritystä estävä vaikutus alkaa tunnin kuluessa, ja suurin vaikutus saavutetaan kahdessa tunnissa. Erittymisen esto on noin 50 % maksimista 24 tunnin kohdalla ja eston kesto on jopa 72 tuntia. Eritystä estävä vaikutus kestää näin ollen paljon pidempään kuin olisi odotettavissa erittäin lyhyen (alle tunnin) plasman puoliintumisajan perusteella, mikä johtuu ilmeisesti pidentyneestä sitoutumisesta parietaaliseen H+/K+ ATPaasientsyymiin. Kun lääke lopetetaan, eritystoiminta palautuu vähitellen, 3–5 päivän kuluessa. Omepratsolin onhapon eritystä estävä vaikutus lisääntyy toistuvalla kerran vuorokaudessa otetulla annostuksella ja saavuttaa tasanne neljän päivän kuluttua.
Alla on esitetty tulokset lukuisista tutkimuksista, jotka koskevat useiden 20 mg:n ja 40 mg:n omepratsoliannosten eritystä estävää vaikutusta terveillä koehenkilöillä ja potilailla. "Max"-arvo edustaa määrityksiä maksimivaikutuksen ajankohtana (2–6 tuntia annostuksen jälkeen), kun taas "min"-arvot ovat 24 tuntia viimeisen omepratsoliannoksen jälkeen.
Omepratsolin kerta-annokset suun kautta 10 mg:sta 40 mg:aan ovat saaneet joillakin potilailla 100 %:n 24 tunnin mahahappamuuden eston.
Seerumin gastriinivaikutukset
Tutkimuksissa, joihin osallistui yli 200 potilasta, seerumin gastriinitasot nousivat ensimmäisten 1-2 viikon aikana, kun omepratsolia annettiin kerran päivässä terapeuttisilla annoksilla samanaikaisesti haponerityksen eston kanssa. Seerumin gastriinipitoisuuden nousua ei enää esiintynyt hoidon jatkuessa. Verrattuna histamiini-H2-reseptorin salpaajiin 20 mg:n omepratsoliannosten tuottama mediaanilisäys oli suurempi (1,3-3,6-kertainen vs. 1,1-1,8-kertainen nousu). Gastriiniarvot palasivat hoitoa edeltäville tasoille, yleensä 1-2 viikon kuluessa hoidon lopettamisesta.
Lisääntynyt gastriini aiheuttaa enterokromafiinia muistuttavaa solujen liikakasvua ja seerumin kromograniini A:n (CgA) nousua. Kohonneet CgA-tasot voivat aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa [katso VAROITUKSET JA VAROTOIMET ].
Enterokromafiinia muistuttavat (ECL) soluvaikutukset
Ihmisen mahalaukun biopsianäytteet on otettu yli 3 000 potilaalta (sekä lapsilta että aikuisilta), joita on hoidettu omepratsolilla pitkäaikaisissa kliinisissä tutkimuksissa. ECL-solujen hyperplasian ilmaantuvuus näissä tutkimuksissa lisääntyi ajan myötä; näillä potilailla ei kuitenkaan ole havaittu ECL-solukarsinoideja, dysplasiaa tai neoplasiaa. Nämä tutkimukset ovat kuitenkin kestoltaan ja kooltaan riittämättömiä sulkemaan pois omepratsolin pitkäaikaisen käytön mahdollisen vaikutuksen pahanlaatuisten tai pahanlaatuisten tilojen kehittymiseen.
Muut tehosteet
Omepratsolin systeemisiä vaikutuksia keskushermostoon, sydän- ja verisuonijärjestelmään ja hengityselimiin ei ole toistaiseksi havaittu. Omepratsoli, annettuna 30 tai 40 mg:n suun kautta 2–4 viikon ajan, ei vaikuttanut kilpirauhasen toimintaan, hiilihydraattien aineenvaihduntaan eikä lisäkilpirauhashormonin, kortisolin, estradiolin, testosteronin, prolaktiinin, kolekystokiniinin tai sekretiinin tasoihin.
Mitään vaikutusta koeaterian kiinteiden ja nestemäisten komponenttien mahalaukun tyhjenemiseen ei osoitettu yhden 90 mg:n omepratsolin annoksen jälkeen. Terveillä koehenkilöillä omepratsolin suonensisäisellä kerta-annoksella (0,35 mg/kg) ei ollut vaikutusta tekijän sisäiseen erittymiseen. Mitään systemaattista annoksesta riippuvaa vaikutusta pepsiinin perus- tai stimuloituun tuotantoon ei ole havaittu ihmisillä.
Kuitenkin, kun mahalaukunsisäinen pH pidetään arvossa 4,0 tai sen yläpuolella, pepsiinin perustuotanto on alhainen ja pepsiiniaktiivisuus vähenee.
Kuten muutkin mahansisäistä pH:ta nostavat aineet, omepratsoli, jota annettiin 14 päivän ajan terveille koehenkilöille, lisäsi merkittävästi elävien bakteerien mahansisäisiä pitoisuuksia. Bakteerilajin kuvio pysyi muuttumattomana syljestä yleisesti löydetystä. Kaikki muutokset korjaantuivat kolmen päivän kuluessa hoidon lopettamisesta.
Barrettin ruokatorven kulkua 106 potilaalla arvioitiin yhdysvaltalaisessa kaksoissokkoutetussa kontrolloidussa tutkimuksessa PRILOSECilla 40 mg kahdesti vuorokaudessa 12 kuukauden ajan, mitä seurasi 20 mg kahdesti vuorokaudessa 12 kuukauden ajan tai ranitidiinia 300 mg kahdesti vuorokaudessa 24 kuukauden ajan. Eritystä estävällä hoidolla ei havaittu kliinisesti merkittävää vaikutusta Barrettin limakalvoon. Vaikka neosquamous epiteeli kehittyi eritystä estävän hoidon aikana, Barrettin limakalvon täydellistä eliminaatiota ei saavutettu. Hoitoryhmien välillä ei havaittu merkitsevää eroa dysplasian kehittymisessä Barrettin limakalvolla, eikä yhdellekään potilaalle kehittynyt ruokatorven karsinoomaa hoidon aikana. Hoitoryhmien välillä ei havaittu merkittäviä eroja ECL-soluhyperplasian, corpus atrofisen gastriitin, corpus intestinal metaplasian tai paksusuolen polyyppien, joiden halkaisija oli yli 3 mm, kehittymisessä.
Farmakokinetiikka
Imeytyminen
PRILOSEC 20mg viivästetysti vapauttavaan oraalisuspensioon sisältää omepratsolimagnesiumrakeita ja inaktiivisia rakeita, jotka annetaan veteen. Omepratsolin imeytyminen alkaa vasta, kun gastroresistentit rakeet poistuvat mahasta. Omepratsolin farmakokinetiikka on ajasta riippuvainen, ja vakaan tilan pitoisuudet plasmassa ovat korkeammat kuin kerta-annoksen jälkeen. Omepratsolin systeeminen altistus (AUC ja Cmax) on 51 % ja 58 % korkeampi, kun kerran vuorokaudessa on annettu 20 mg viivästetysti vapauttavaa oraalisuspensiota 5 päivän ajan, kuin ensimmäisen annoksen jälkeen. Omepratsolin huippupitoisuudet plasmassa toistuvien viivästetysti vapauttavien oraalisuspensioiden annosten jälkeen saavutetaan 1,5–2 tunnin kuluessa. Terveillä koehenkilöillä puoliintumisaika plasmassa on 0,5-1 tunti.
Jakelu
Proteiineihin sitoutuminen on noin 95 %.
Eliminointi
Aineenvaihdunta
Omepratsoli metaboloituu laajalti sytokromi P450 (CYP) -entsyymijärjestelmän kautta. Suurin osa sen metaboliasta on riippuvainen polymorfisesti ilmentyneestä CYP2C19:stä, joka on vastuussa plasman päämetaboliitin, hydroksiomepratsolin, muodostumisesta. Loppuosa on riippuvainen toisesta spesifisestä isoformista, CYP3A4:stä, joka on vastuussa omepratsolisulfonin muodostumisesta.
Erittyminen
Puskuroidun omepratsoliliuoksen oraalisen kerta-annoksen jälkeen lääkettä erittyi virtsaan vain vähän tai muuttumattomana. Suurin osa annoksesta (noin 77 %) erittyi virtsaan vähintään kuudena metaboliittina. Kaksi tunnistettiin hydroksiomepratsoliksi ja vastaavaksi karboksyylihapoksi. Loput annoksesta saatiin talteen ulosteessa. Tämä merkitsee omepratsolin metaboliittien merkittävää sappeen erittymistä. Plasmasta on tunnistettu kolme metaboliittia, omepratsolin ja hydroksiomepratsolin sulfidi- ja sulfonijohdannaiset. Näillä metaboliiteilla on hyvin vähän tai ei ollenkaan eritystä estävää vaikutusta.
Yhdistelmähoito mikrobilääkkeiden kanssa
Omepratsolia 40 mg vuorokaudessa annettiin yhdessä klaritromysiinin 500 mg:n kanssa 8 tunnin välein terveille aikuisille miehille. Omepratsolin vakaan tilan pitoisuudet plasmassa nousivat (Cmax, AUC0-24 ja T½:n nousu 30 %, 89 % ja 34 %, vastaavasti) klaritromysiinin samanaikaisen käytön seurauksena. Plasman omepratsolipitoisuuden havaittu nousu liittyi seuraaviin farmakologisiin vaikutuksiin. Keskimääräinen 24 tunnin mahalaukun pH-arvo oli, kun omepratsolia annettiin yksinään, ja 5,7, kun annettiin yhdessä klaritromysiinin kanssa.
Klaritromysiinin ja 14-hydroksiklaritromysiinin pitoisuudet plasmassa suurentuvat, kun omepratsolia annettiin samanaikaisesti. Klaritromysiinin keskimääräinen Cmax oli 10 % suurempi, keskimääräinen Cmin oli 27 % suurempi ja keskimääräinen AUC0-8 oli 15 % suurempi, kun klaritromysiiniä annettiin yhdessä omepratsolin kanssa, kuin silloin, kun klaritromysiiniä annettiin yksinään. Samanlaisia tuloksia havaittiin 14-hydroksiklaritromysiinillä, keskimääräinen Cmax oli 45 % suurempi, keskimääräinen Cmin oli 57 % suurempi ja keskimääräinen AUC0-8 oli 45 % suurempi. Myös klaritromysiinipitoisuudet mahakudoksessa ja limassa lisääntyivät, kun omepratsolia annettiin samanaikaisesti.
Tietyt populaatiot
Geriatriset potilaat
Omepratsolin eliminaationopeus oli jonkin verran hidastunut vanhuksilla ja hyötyosuus lisääntyi. Omepratsolin biologinen hyötyosuus oli 76 %, kun terveille iäkkäille vapaaehtoisille annettiin 40 mg:n oraalinen omepratsolin (puskuroitu liuos) kerta-annos verrattuna 58 %:iin nuorilla vapaaehtoisilla, joille annettiin sama annos. Lähes 70 % annoksesta erittyi virtsaan omepratsolin metaboliitteina, eikä muuttumatonta lääkettä havaittu. Omepratsolin plasmapuhdistuma oli 250 ml/min (noin puolet nuorten vapaaehtoisten puhdistumasta) ja sen puoliintumisaika plasmassa oli keskimäärin yksi tunti, noin kaksi kertaa nuorten terveiden vapaaehtoisten puhdistuma.
Pediatriset potilaat
2-16 vuoden iässä
Omepratsolin farmakokinetiikkaa on tutkittu 2–16-vuotiailla lapsipotilailla:
Vertailukelpoisten mg/kg omepratsoliannosten jälkeen nuorempien lasten (2–5-vuotiaiden) AUC-arvot ovat alhaisemmat kuin 6–16-vuotiailla lapsilla tai aikuisilla; Kahden jälkimmäisen ryhmän AUC-arvot eivät eronneet [katso ANNOSTELU JA HALLINNOINTI ].
1-11 kuukauden ikäinen
Sopivien PRILOSEC 40 mg -annosten määrittämiseen lapsipotilaille käytettiin populaatiofarmakokinetiikkaa
1 kuukaudesta alle 1 vuoden ikään happovälitteisen GERD:n aiheuttaman erosiivisen ruokatorven tulehduksen hoitoon (enintään 6 viikkoa). Malli perustui 64 lapsen tietoihin, 0,5 kuukauden iästä 16 vuoden ikään. Alle 1-vuotiaista lapsista oli saatavilla vain rajoitetusti tietoa. Omepratsolia annettiin näissä tutkimuksissa lapsipotilaille oraalisuspensiona, joka oli valmistettu viivästetysti vapauttavista kapseleista. Lasten annoksia simuloitiin 1–11 kuukauden ikäryhmässä, jotta saavutettaisiin vertailukelpoiset omepratsolialtistukset aikuisten kanssa 20 mg:n kerran vuorokaudessa annetun hoidon jälkeen [ks. ANNOSTELU JA HALLINNOINTI ].
Rotu- tai etniset ryhmät
[Katso KLIININEN FARMAKOLOGIA ].
Potilaat, joilla on munuaisten vajaatoiminta
Potilailla, joilla oli krooninen munuaisten vajaatoiminta (kreatiniinipuhdistuma 10-62 ml/min/1,73 m²), omepratsolin jakautuminen oli hyvin samanlainen kuin terveillä koehenkilöillä, vaikkakin hyötyosuus parani hieman. Koska erittyminen virtsaan on omepratsolin metaboliittien ensisijainen erittymisreitti, niiden eliminaatio hidastui suhteessa vähentyneeseen kreatiniinipuhdistumaan. Tätä biologisen hyötyosuuden lisääntymistä ei pidetä kliinisesti merkittävänä.
Potilaat, joilla on maksan vajaatoiminta
Child-Pugh-luokkiin A (n=3), B (n=4) ja C (n=1) luokiteltuilla kroonista maksasairautta sairastavilla potilailla biologinen hyötyosuus nousi noin 100 %:iin verrattuna terveisiin koehenkilöihin, mikä heijastaa ensikierron heikkenemistä. vaikutus, ja lääkkeen puoliintumisaika plasmassa nousi lähes 3 tuntiin verrattuna terveiden koehenkilöiden puoliintumisaikaan 0,5-1 tuntiin. Plasman puhdistuma oli keskimäärin 70 ml/min verrattuna arvoon 500-600 ml/min terveillä koehenkilöillä [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
Omepratsolin vaikutus muihin lääkkeisiin
Omepratsoli on ajasta riippuvainen CYP2C19:n estäjä ja voi lisätä systeemistä altistusta samanaikaisesti annetuille lääkkeille, jotka ovat CYP2C19:n substraatteja. Lisäksi omepratsolin anto lisää mahalaukun pH:ta ja voi muuttaa systeemistä altistusta tietyille lääkkeille, joiden liukoisuus on pH-riippuvainen.
Antiretroviraaliset lääkkeet
Joidenkin antiretroviraalisten lääkkeiden, kuten rilpiviriinin, atatsanaviirin ja nelfinaviirin, seerumipitoisuuksia on raportoitu, kun niitä on annettu yhdessä omepratsolin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Rilpiviriini: Rilpiviriinin (150 mg, päivittäin) ja omepratsolin (20 mg, päivittäin) toistuvien annosten jälkeen rilpiviriinin AUC pieneni 40 %, Cmax 40 % ja Cmin 33 %.
Nelfinaviiri: Nelfinaviirin (1250 mg, kahdesti vuorokaudessa) ja omepratsolin (40 mg päivässä) toistuvien annosten jälkeen nelfinaviirin AUC pieneni 36 % ja 92 %, Cmax 37 % ja 89 % ja Cmin 39 % ja M8 75 %. .
Atatsanaviiri: Atatsanaviirin (400 mg, päivittäin) ja omepratsolin (40 mg, päivittäin, 2 tuntia ennen atatsanaviiria) useiden annosten jälkeen AUC pieneni 94 %, Cmax 96 % ja Cmin 95 %.
Sakinaviiri: Kun sakinaviiria/ritonaviiria (1000/100 mg) annettiin toistuvasti kahdesti vuorokaudessa 15 päivän ajan, omepratsolia 40 mg päivässä annettiin samanaikaisesti päivinä 11-15.
AUC nousi 82 %, Cmax 75 % ja Cmin 106 %. Tämän vuorovaikutuksen takana olevaa mekanismia ei ole täysin selvitetty.
Klopidogreeli
Ristikkäisessä kliinisessä tutkimuksessa 72 terveelle henkilölle annettiin klopidogreelia (300 mg:n kyllästysannos, jota seurasi 75 mg päivässä) yksinään ja omepratsolin kanssa (80 mg samaan aikaan klopidogreelin kanssa) 5 päivän ajan. Altistuminen klopidogreelin aktiiviselle metaboliitille pieneni 46 % (päivä 1) ja 42 % (päivä 5), kun klopidogreelia ja omepratsolia annettiin yhdessä.
Tulokset toisesta ristikkäistutkimuksesta terveillä koehenkilöillä osoittivat samanlaisen farmakokineettisen yhteisvaikutuksen klopidogreelin (300 mg kyllästysannos/75 mg vuorokausiannos) ja omepratsolin 80 mg vuorokaudessa, kun niitä annettiin samanaikaisesti 30 päivän ajan. Altistuminen klopidogreelin aktiiviselle metaboliitille pieneni 41–46 % tänä aikana.
Toisessa tutkimuksessa 72 terveelle koehenkilölle annettiin samat annokset klopidogreelia ja 80 mg omepratsolia, mutta lääkkeet annettiin 12 tunnin välein. tulokset olivat samanlaisia, mikä osoittaa, että klopidogreelin ja omepratsolin antaminen eri aikoina ei estä niiden yhteisvaikutusta [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Mykofenolaattimofetiili
Omepratsolin 20 mg kahdesti vuorokaudessa 4 päivän ajan ja kerta-annoksena 1000 mg MMF:ää noin tunnin kuluttua viimeisen omepratsoliannoksen antaminen 12 terveelle koehenkilölle ristikkäistutkimuksessa johti 52 %:n laskuun Cmax-arvossa ja 23 %:lla. MPA:n AUC:ssa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
silostatsoli
Omepratsoli toimii CYP2C19:n estäjänä. Omepratsoli, joka annettiin 40 mg:n annoksina vuorokaudessa yhden viikon ajan 20 terveelle koehenkilölle ristikkäistutkimuksessa, nosti silostatsolin Cmax-arvoa 18 % ja AUC-arvoa 26 %. Yhden aktiivisen metaboliitin, 3,4-dihydrosilostatsolin, jonka aktiivisuus on 4-7 kertaa silostatsolin aktiivisuus, Cmax nousi 29 % ja AUC 69 %. Silostatsolin ja omepratsolin samanaikaisen antamisen odotetaan lisäävän silostatsolin ja edellä mainitun aktiivisen metaboliitin pitoisuuksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Diatsepaami
Kun omepratsolia 20 mg kerran vuorokaudessa ja 0,1 mg/kg diatsepaamia annettiin laskimoon, puhdistuma pieneni 27 % ja diatsepaamin puoliintumisaika piteni 36 % [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Digoksiini
Omepratsolin 20 mg kerran vuorokaudessa ja digoksiinin samanaikainen anto terveille koehenkilöille lisäsi digoksiinin biologista hyötyosuutta 10 % (30 % kahdella koehenkilöllä) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Muiden lääkkeiden vaikutus omepratsoliin
Vorikonatsoli
Omepratsolin ja vorikonatsolin (CYP2C19:n ja CYP3A4:n yhdistetty estäjä) samanaikainen anto johti omepratsolialtistuksen yli kaksinkertaistumiseen. Kun vorikonatsolia (400 mg joka 12. tunti yhden päivän ajan, minkä jälkeen 200 mg kerran vuorokaudessa 6 päivän ajan) annettiin terveille koehenkilöille omepratsolin kanssa (40 mg kerran päivässä 7 päivän ajan), omepratsolin vakaan tilan Cmax ja AUC0-24 lisääntyi merkittävästi: keskimäärin 2 kertaa (90 % CI: 1,8, 2,6) ja 4 kertaa (90 % CI: 3,3, 4,4) verrattuna siihen, kun omepratsolia annettiin ilman vorikonatsolia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Mikrobiologia
Omepratsolin ja klaritromysiinin kaksoishoidon sekä omepratsolin, klaritromysiinin ja amoksisilliinin kolmoishoidon on osoitettu olevan aktiivisia useimpia Helicobacter pylori -kantoja vastaan in vitro ja kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ , Kliiniset tutkimukset ].
Helicobacter pylori
H. pylori -isolaattien herkkyystesti suoritettiin amoksisilliinille ja klaritromysiinille käyttämällä agarlaimennusmetodologiaa1, ja määritettiin vähimmäisinhibiittoripitoisuudet (MIC).
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollimikro-organismien käyttöä laboratoriomenetelmien teknisten näkökohtien hallitsemiseksi.
Esikäsittelyn vastustuskyky
Klaritromysiiniresistenssi ennen hoitoa oli 3,5 % (4/113) omepratsoli/klaritromysiini-kaksoishoitotutkimuksissa (4 ja 5) ja 9,3 % (41/439) omepratsoli/klaritromysiini/amoksisilliini-kolmoishoitotutkimuksissa (1, 2 ja 3).
Amoksisilliinille herkkiä isolaatteja (≤ 0,25 μg/ml) löydettiin 99,3 %:lta (436/439) potilaista omepratsoli/klaritromysiini/amoksisilliinikolmoishoitotutkimuksissa (1, 2 ja 3). Amoksisilliinin hoitoa edeltävät vähimmäisinhiboivat pitoisuudet (MIC) > 0,25 μg/ml esiintyi 0,7 %:lla (3/439) potilaista, jotka kaikki kuuluivat klaritromysiini- ja amoksisilliinitutkimusryhmään. Yhdellä potilaalla amoksisilliinin vähimmäisinhiboiva konsentraatio (MIC) oli Etest®-testillä yli 256 μg/ml ennen hoitoa.
Potilailla, joita ei ole hävitetty H. pyloria omepratsoli/klaritromysiini/amoksisilliini-kolmoishoidon tai omepratsoli/klaritromysiini-kaksoishoidon jälkeen, on todennäköisesti klaritromysiiniresistenttejä H. pylori-isolaatteja. Siksi klaritromysiiniherkkyystesti tulee tehdä, jos mahdollista. Potilaita, joilla on klaritromysiiniresistentti H. pylori, ei tule hoitaa millään seuraavista: omepratsoli/klaritromysiini-kaksoishoito, omepratsoli/klaritromysiini/amoksisilliini-kolmoishoito tai muut hoito-ohjelmat, joissa klaritromysiini on ainoa antimikrobinen lääke.
Amoksisilliiniherkkyystestin tulokset ja kliiniset/bakteriologiset tulokset
Kolmoishoidon kliinisissä tutkimuksissa 84,9 %:lta (157/185) omepratsoli/klaritromysiini/amoksisilliinihoitoryhmän potilaista, joilla oli ennen hoitoa amoksisilliinille herkkä MIC-arvo (≤ 0,25 µg/ml), H. pylori ja 2185 % (2185 µg/ml) hävisivät. /185) epäonnistunut terapia. Niistä 28 potilaasta, jotka epäonnistuivat kolmoishoidossa, 11:llä ei ollut hoidon jälkeisiä herkkyystestejä ja 17:llä oli hoidon jälkeen H. pylori-isolaatteja, joilla oli amoksisilliinille herkkiä MIC-arvoja. Yhdellätoista potilaalla, joilla kolmoishoito epäonnistui, oli myös hoidon jälkeen H. pylori -isolaatteja, joilla oli klaritromysiiniresistenttejä MIC-arvoja.
Herkkyystesti Helicobacter pylorille
Katso Helicobacter pylorin herkkyystestitiedot mikrobiologia-osiosta klaritromysiinin ja amoksisilliinin lääkemääräystiedoissa.
Vaikutukset maha-suolikanavan mikrobiekologiaan
Mahalaukun happamuuden väheneminen, joka johtuu kaikista keinoista, mukaan lukien protonipumpun estäjät, lisää ruoansulatuskanavassa normaalisti esiintyvien bakteerien määrää mahassa. Hoito protonipumpun estäjillä voi lisätä hieman ruoansulatuskanavan infektioiden, kuten Salmonellan ja Campylobacterin, riskiä ja sairaalapotilailla mahdollisesti myös Clostridium difficile -infektiota.
Farmakogenomiikka
CYP2C19, polymorfinen entsyymi, osallistuu omepratsolin metaboliaan. CYP2C19*1-alleeli on täysin toimiva, kun taas CYP2C19*2- ja *3-alleelit eivät toimi. On olemassa muita alleeleja, joihin ei liity entsymaattista toimintaa tai se on vähentynyt. Potilaat, joilla on kaksi täysin toimivaa alleelia, ovat laajoja metaboloijia ja ne, joilla on kaksi toiminnan menettämisen alleelia, ovat huonoja metaboloijia. Nopeilla metaboloijilla omepratsoli metaboloituu pääasiassa CYP2C19:n välityksellä.
Systeeminen omepratsolialtistus vaihtelee potilaan aineenvaihdunnan tilan mukaan: heikot metaboloijat > keskipitkät metaboloijat > nopeat metaboloijat. Noin 3 % valkoihoisista ja 15–20 % aasialaisista on CYP2C19:n heikkoja metaboloijia.
Farmakokineettisessä tutkimuksessa 20 mg:n omepratsolin kerta-annoksella omepratsolin AUC aasialaisilla koehenkilöillä oli noin nelinkertainen valkoihoisiin verrattuna [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Kliiniset tutkimukset
Aktiivinen pohjukaissuolihaava
Monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 147 potilaalla, joilla oli endoskooppisesti dokumentoitu pohjukaissuolihaava, potilaiden prosenttiosuus (protokollaa kohti) 2 ja 4 viikon kohdalla oli merkitsevästi suurempi omepratsolimagnesiumia viivästetysti vapauttavilla kapseleilla 20 mg kerran vuorokaudessa kuin lumelääkkeellä (p ≤ 0,01).
Aktiivisen pohjukaissuolihaavan hoito % parantuneista potilaista
Täydellinen päivä- ja yökivun lievitys tapahtui merkitsevästi nopeammin (p ≤ 0,01) potilailla, joita hoidettiin 20 mg:n omepratsolimagnesiumia viivästyneesti vapauttavilla kapseleilla kuin lumelääkettä saaneilla potilailla. Tutkimuksen lopussa merkittävästi useammilla potilailla, jotka olivat saaneet omepratsolimagnesiumia viivästetysti vapauttavia kapseleita, päivä- (p ≤ 0,05) ja yökipu (p ≤ 0,01) helpotti täydellisesti.
Monikeskustutkimuksessa kaksoissokkoutetussa tutkimuksessa 293 potilaalla, joilla oli endoskooppisesti dokumentoitu pohjukaissuolihaava, parantuneiden potilaiden prosenttiosuus (protokollaa kohti) 4 viikon kohdalla oli merkittävästi korkeampi omepratsolimagnesiumia viivästyneesti vapauttavilla kapseleilla 20 mg kerran vuorokaudessa kuin ranitidiinilla 150 mg kahdesti. p
Aktiivisen pohjukaissuolihaavan hoito % parantuneista potilaista
Paraneminen tapahtui merkitsevästi nopeammin potilailla, joita hoidettiin omepratsolimagnesium-hidastetusti vapauttavilla kapseleilla kuin potilailla, joita hoidettiin ranitidiinilla 150 mg bid (p
Ulkomaisessa monikansallisessa satunnaistetussa kaksoissokkotutkimuksessa, johon osallistui 105 potilasta, joilla oli endoskooppisesti dokumentoitu pohjukaissuolihaava, 20 mg ja 40 mg omepratsolimagnesiumia viivästetysti vapauttavia kapseleita verrattiin ranitidiiniin 150 mg 2 kertaa 2, 4 ja 8 viikon kohdalla. Viikon 2 ja 4 kohdalla molemmat PRILOSEC 10 mg:n annokset olivat tilastollisesti parempia (protokollaa kohti) kuin ranitidiini, mutta 40 mg ei ollut parempi kuin 20 mg omepratsolimagnesiumia viivästetysti vapauttavia kapseleita, ja 8 viikon kohdalla ei havaittu merkitsevää eroa minkään annoksen välillä. aktiiviset lääkkeet.
Aktiivisen pohjukaissuolihaavan hoito % parantuneista potilaista
H. pylorin hävittäminen potilailla, joilla on pohjukaissuolihaava
Kolmoisterapia (omepratsolimagnesium viivästyneesti vapautuvat kapselit/klaritromysiini/amoksisilliini)
Kolmessa Yhdysvalloissa tehdyssä, satunnaistetussa, kaksoissokkoutetussa kliinisessä tutkimuksessa potilailla, joilla oli helikobakteeri-infektio ja pohjukaissuolihaava (n = 558), verrattiin omepratsolimagnesiumia viivästyneesti vapauttavia kapseleita sekä klaritromysiiniä ja amoksisilliinia klaritromysiiniin ja amoksisilliiniin. Kaksi tutkimusta (1 ja 2) suoritettiin potilailla, joilla oli aktiivinen pohjukaissuolihaava, ja toinen tutkimus (3) tehtiin potilailla, joilla on ollut pohjukaissuolihaava viimeisten 5 vuoden aikana, mutta joilla ei ollut haavaumaa ilmoittautumisajankohtana. . Annostusohjelma tutkimuksissa oli omepratsolimagnesiumia viivästetysti vapauttavia kapseleita 20 mg kahdesti vuorokaudessa plus klaritromysiini 500 mg kahdesti vuorokaudessa sekä amoksisilliini 1 g kahdesti vuorokaudessa 10 päivän ajan; tai klaritromysiini 500 mg kahdesti vuorokaudessa plus amoksisilliini 1 g kahdesti vuorokaudessa 10 päivän ajan. Tutkimuksissa 1 ja 2 potilaat, jotka käyttivät omepratsolihoitoa, saivat lisäksi 18 päivän ajan 20 mg omepratsolimagnesiumia viivästetysti vapauttavia kapseleita kerran vuorokaudessa. Tutkitut päätepisteet olivat H. pylorin hävittäminen ja pohjukaissuolihaavan paraneminen (vain tutkimukset 1 ja 2). H. pylori -status määritettiin CLOtest®:llä, histologialla ja viljelmällä kaikissa kolmessa tutkimuksessa. Tietyllä potilaalla H. pylori katsottiin hävinneeksi, jos vähintään kaksi näistä testeistä oli negatiivinen, eikä yksikään ollut positiivinen.
Omepratsolin, klaritromysiinin ja amoksisilliinin yhdistelmä oli tehokas H. pylorin hävittämisessä.
Kaksoisterapia (omepratsolimagnesium viivästyneesti vapautuvat kapselit / klaritromysiini)
Neljässä satunnaistetussa, kaksoissokkoutetussa, monikeskustutkimuksessa (4, 5, 6 ja 7) arvioitiin 40 mg:n omepratsolimagnesiumia viivästetysti vapauttavia kapseleita kerran vuorokaudessa ja klaritromysiiniä 500 mg kolmesti päivässä 14 päivän ajan, minkä jälkeen omepratsolimagnesiumia viivästytti vapautuminen. kapselit 20 mg kerran vuorokaudessa (tutkimukset 4, 5 ja 7) tai omepratsolimagnesiumia viivästyttävästi vapauttavat kapselit 40 mg kerran vuorokaudessa (tutkimus 6) vielä 14 päivän ajan potilaille, joilla on aktiivinen pohjukaissuolihaava, johon liittyy H. pylori. Tutkimukset 4 ja 5 suoritettiin Yhdysvalloissa ja Kanadassa, ja niihin osallistui 242 ja 256 potilasta. H. pylori -infektio ja pohjukaissuolihaava varmistettiin 219 potilaalla tutkimuksessa 4 ja 228 potilaalla tutkimuksessa 5. Näissä tutkimuksissa yhdistelmähoitoa verrattiin omepratsolimagnesiumin viivästetysti vapauttaviin kapseleihin ja klaritromysiinimonohoitoihin. Tutkimukset 6 ja 7 suoritettiin Euroopassa, ja niihin osallistui 154 ja 215 potilasta. H. pylori -infektio ja pohjukaissuolihaava varmistettiin 148 potilaalla tutkimuksessa 6 ja 208 potilaalla tutkimuksessa 7. Näissä tutkimuksissa verrattiin yhdistelmähoitoa omepratsolin monoterapiaan. Näiden tutkimusten tehokkuusanalyysien tulokset on kuvattu alla. H. pylori -hävitys määriteltiin positiiviseksi testiksi (viljely tai histologia) 4 viikon kuluttua hoidon päättymisestä, ja kaksi negatiivista testiä vaadittiin, jotta H. pylori oli hävitetty. Protokollakohtaisessa analyysissä suljettiin pois seuraavat potilaat: keskeyttäneet potilaat, potilaat, joilta puuttuivat H. pylori -testit hoidon jälkeen, ja potilaat, joilta ei arvioitu H. pylori -hävittämisen suhteen, koska heillä todettiin haava hoidon lopussa .
Omepratsolin ja klaritromysiinin yhdistelmä oli tehokas H. pylorin hävittämisessä.
Haavojen paraneminen ei eronnut merkittävästi, kun klaritromysiini lisättiin omepratsolihoitoon verrattuna pelkkään omepratsolihoitoon.
Omepratsolin ja klaritromysiinin yhdistelmä oli tehokas H. pylorin hävittämisessä ja vähensi pohjukaissuolihaavan uusiutumista.
Aktiivinen hyvänlaatuinen mahahaava
Yhdysvaltalaisessa monikeskustutkimuksessa, jossa käytettiin omepratsolia 40 mg kerran vuorokaudessa, 20 mg kerran vuorokaudessa ja lumelääkettä 520 potilaalla, joilla oli endoskooppisesti diagnosoitu mahahaava, saatiin seuraavat tulokset.
Mahahaavojen hoito % parantuneista potilaista (kaikki hoidetut potilaat)
Potilasryhmissä, joiden haavan koko oli pienempi tai yhtä suuri kuin 1 cm, ei havaittu eroa paranemisnopeuksissa 40 mg:n ja 20 mg:n välillä 4 tai 8 viikon kohdalla. Potilailla, joiden haavan koko oli suurempi kuin 1 cm, 40 mg oli merkittävästi tehokkaampi kuin 20 mg 8 viikon kohdalla.
Ulkomaisessa, monikansallisessa kaksoissokkotutkimuksessa, johon osallistui 602 potilasta, joilla oli endoskooppisesti diagnosoitu mahahaava, arvioitiin omepratsolia 40 mg kerran vuorokaudessa, 20 mg kerran vuorokaudessa ja ranitidiinia 150 mg kahdesti päivässä.
Mahahaavojen hoito % parantuneista potilaista (kaikki hoidetut potilaat)
Oireinen GERD
Skandinaviassa suoritettiin lumekontrolloitu tutkimus, jossa verrattiin 20 mg:n tai 10 mg:n omepratsolin tehoa kerran päivässä enintään 4 viikon ajan närästyksen ja muiden oireiden hoidossa GERD-potilailla, joilla ei ole EE:tä. Tulokset on esitetty alla.
% Onnistunut oireinen tulos1
EE Happovälitteisen GERD:n vuoksi
Yhdysvaltalaisessa monikeskustutkimuksessa kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa 20 mg tai 40 mg omepratsolimagnesiumia viivästetysti vapauttavia kapseleita potilailla, joilla oli GERD-oireita ja endoskooppisesti diagnosoitu EE, aste 2 tai korkeampi, prosentuaalinen paranemisaste (protokollaa kohti) oli seuraava. :
Tässä tutkimuksessa 40 mg:n annos ei ollut parempi kuin 20 mg:n annos omepratsolimagnesiumia viivästetysti vapauttavien kapseleiden prosentuaalisella paranemisnopeudella. Muut kontrolloidut kliiniset tutkimukset ovat myös osoittaneet, että omepratsolimagnesium-hidastetusti vapauttavat kapselit ovat tehokkaita vaikeassa GERD:ssä. Vertailussa histamiini-H2-reseptorin salpaajiin potilailla, joilla oli EE, aste 2 tai korkeampi, omepratsolimagnesium-hidastetusti vapautuvat kapselit 20 mg:n annoksena olivat merkittävästi tehokkaampia kuin aktiiviset kontrollit. Täydellinen päivä- ja yönäön närästys helpottui merkitsevästi nopeammin (p
Tässä ja viidessä muussa kontrolloidussa GERD-tutkimuksessa 20 mg omepratsolia saaneet potilaat (84 %) ilmoittivat GERD-oireiden täydellisestä helpotuksesta kuin lumelääkettä saaneet potilaat (12 %).
Happovälitteisen GERD:n aiheuttaman EE:n paranemisen ylläpito
Yhdysvaltalaisessa kaksoissokkoutetussa, satunnaistetussa, monikeskustutkimuksessa lumekontrolloidussa tutkimuksessa tutkittiin kahta omepratsolimagnesiumin viivästetysti vapautuvien kapseleiden annostusohjelmaa potilailla, joilla oli endoskooppisesti vahvistettu parantunut ruokatorvitulehdus. Tulokset EE:n paranemisen ylläpidon määrittämiseksi on esitetty alla.
Elämäntaulukon analyysi
Kansainvälisessä monikeskustutkimuksessa kaksoissokkotutkimuksessa omepratsolimagnesiumia viivästyneesti vapauttavia kapseleita 20 mg vuorokaudessa ja 10 mg vuorokaudessa verrattiin ranitidiiniin 150 mg kahdesti vuorokaudessa potilailla, joilla oli endoskooppisesti vahvistettu parantunut ruokatorvitulehdus. Alla oleva taulukko sisältää tämän tutkimuksen tulokset EE:n paranemisen ylläpitämiseksi.
Elämäntaulukon analyysi
Potilailla, joilla oli alun perin 3. tai 4. asteen eroosiivinen ruokatorvitulehdus, 20 mg omepratsolimagnesiumia viivästyneesti vapauttavia kapseleita päivässä oli tehon parantamisen jälkeisenä ylläpitona, kun taas 10 mg ei osoittanut tehoa.
Patologiset liikaeritystilat
Avoimissa tutkimuksissa 136 potilaalla, joilla oli patologisia hypersekretorisia tiloja, kuten Zollinger-Ellisonin (ZE) oireyhtymä, johon liittyi useita endokriinisiä adenoomia tai ilman niitä, omepratsolimagnesiumin viivästyneen vapautumisen kapselit estivät merkittävästi mahahapon eritystä ja kontrolloivat siihen liittyviä ripulin, anoreksian ja kivun oireita. Annokset, jotka vaihtelivat 20 mg:sta joka toinen päivä - 360 mg:aan vuorokaudessa, pitivät perushapon erityksen alle 10 mekvivalenttitunnissa potilailla, joilla ei ollut aiempaa mahaleikkausta, ja alle 5 mekvivalenttia/h potilailla, joilla oli aiemmin mahaleikkaus.
Alkuannokset titrattiin potilaan yksilöllisen tarpeen mukaan, ja säädöt olivat tarpeen ajan myötä joillakin potilailla [ks. ANNOSTELU JA HALLINNOINTI ]. Omepratsolimagnesium-hidastetusti vapautuvat kapselit olivat hyvin siedettyjä näillä suurilla annoksilla pitkiä aikoja (> 5 vuotta joillakin potilailla). Useimmilla ZE-potilailla seerumin gastriinipitoisuudet eivät muuttuneet omepratsolimagnesium-hidastetusti vapautuvilla kapseleilla. Joillakin potilailla seerumin gastriini nousi kuitenkin tasolle, joka oli suurempi kuin ennen omepratsolihoidon aloittamista. Ainakin 11 ZE-oireyhtymää sairastavalle potilaalle, jotka saivat pitkäaikaista hoitoa omepratsolimagnesium-hidastetusti vapauttavilla kapseleilla, kehittyi mahakarsinoideja. Näiden löydösten uskotaan olevan ilmentymä taustalla olevasta tilasta, jonka tiedetään liittyvän tällaisiin kasvaimiin, eivätkä ne johtuvat omepratsolimagnesium-hidastetusti vapautuvien kapseleiden antamisesta [ks. HAITTAVAIKUTUKSET ].
Pediatriset tutkimukset oireisen GERD:n hoitoon, happovälitteisen GERD:n aiheuttaman EE:n hoitoon ja happovälitteisen GERD:n aiheuttaman EE:n paranemisen ylläpitämiseen
Oireisen GERD:n hoito
Omepratsolimagnesium-hidastetusti vapauttavien kapseleiden tehokkuus oireisen GERD:n hoidossa 1–16-vuotiailla lapsipotilailla perustuu osittain tietoihin, jotka on saatu 125 lapsipotilaalta kahdessa kontrolloimattomassa kliinisessä tutkimuksessa.
Ensimmäiseen tutkimukseen otettiin mukaan 12 1–2-vuotiasta lapsipotilasta, joilla oli kliinisesti diagnosoitu GERD. Potilaille annettiin kerta-annos omepratsolia (0,5 mg/kg, 1 mg/kg tai 1,5 mg/kg) 8 viikon ajan avoimena kapselina 8,4 % natriumbikarbonaattiliuoksessa. 75 prosentilla (9/12) potilaista oksentelu-/regurgitaatiojaksot vähenivät lähtötasosta vähintään 50 %.
Toiseen tutkimukseen osallistui 113 2–16-vuotiasta lapsipotilasta, joilla on ollut oireelliseen GERD:hen viittaavia oireita. Potilaille annettiin kerta-annos omepratsolia (10 mg tai 20 mg painon mukaan) 4 viikon ajan joko ehjänä tai avoimena kapselina omenasoseessa. Onnistunut vaste määriteltiin siten, että ei ollut keskivaikeita tai vaikeita kipuun liittyviä oireita tai oksentelua/regurgitaatiota viimeisen 4 päivän aikana. Tulokset osoittivat, että onnistumisaste oli 60 % (9/15; 10 mg omepratsolia) ja 59 % (58/98; 20 mg omepratsolia).
Happovälitteisen GERD:n aiheuttaman EE:n hoito
Kontrolloimattomassa, avoimessa annostitraustutkimuksessa EE:n hoitoon 1–16-vuotiailla lapsipotilailla tarvittiin annoksia, jotka vaihtelivat 0,7–3,5 mg/kg/vrk (80 mg/vrk). Annokset aloitettiin annoksella 0,7 mg/kg/vrk. Annoksia suurennettiin 0,7 mg/kg/vrk (jos ruokatorven pH osoitti pH:ta
Happovälitteisen GERD:n aiheuttaman EE:n paranemisen ylläpito
Kontrolloimattomassa, avoimessa tutkimuksessa EE:n paranemisen ylläpitämisestä 46:lla 1–16-vuotiaalla lapsipotilaalla 54 % potilaista tarvitsi puolet paranemisannoksesta. Loput potilaat suurensivat parantavaa annosta (0,7 - enintään 2,8 mg/kg/vrk) joko koko ylläpitojakson ajaksi tai palasivat puoleen annoksesta ennen hoidon päättymistä. Ylläpitovaiheeseen siirtyneistä 46 potilaasta 19:llä (41 %) ei ollut uusiutumista seurannan aikana (vaihteluväli 4–25 kuukautta). Lisäksi EE-potilaiden ylläpitohoito johti siihen, että 63 %:lla potilaista ei ollut yleisiä oireita.
VIITTEET
1. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardin kymmenes painos. CLSI Document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
POTILASTIEDOT
PRILOSEC® (pry-lo-sec) (omepratsolimagnesium) viivästetysti vapauttavaan oraalisuspensioon
Mikä on tärkein tieto, joka minun pitäisi tietää PRILOSECista?
PRILOSEC 10mg voi auttaa happoon liittyvissä oireissasi, mutta sinulla voi silti olla vakavia vatsavaivoja. Keskustele lääkärisi kanssa.
PRILOSEC voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Eräänlainen munuaisongelma (akuutti tubulointerstitiaalinen nefriitti). Joillekin ihmisille, jotka käyttävät protonipumpun estäjiä (PPI) sisältäviä lääkkeitä, mukaan lukien PRILOSEC, voi kehittyä munuaisongelma, jota kutsutaan akuutiksi tubulointerstitiaaliseksi nefriittiksi ja joka voi ilmaantua milloin tahansa PRILOSEC-hoidon aikana. Soita lääkärillesi välittömästi, jos virtsaamasi määrä on vähentynyt tai jos sinulla on verta virtsassasi.
- Ripuli, jonka aiheuttaa suolistotulehdus (Clostridium difficile). Soita lääkärillesi heti, jos sinulla on vetisiä ulosteita tai vatsakipua, joka ei mene pois. Sinulla voi olla kuumetta tai ei.
- Luun murtumat (lonkka-, ranteen- tai selkärangan murtumat). Lonkan, ranteen tai selkärangan luumurtumia voi tapahtua ihmisillä, jotka ottavat useita päivittäisiä annoksia PPI-lääkkeitä ja pitkän ajan (vuoden tai pidempään). Kerro lääkärillesi, jos sinulla on luunmurtuma, erityisesti lonkassa, ranteessa tai selkärangassa.
- Tietyntyyppiset lupus erythematosus. Lupus erythematosus on autoimmuunisairaus (elimistön immuunisolut hyökkäävät kehon muihin soluihin tai elimiin). Joillekin ihmisille, jotka käyttävät PPI-lääkkeitä, mukaan lukien PRILOSEC 10 mg, voi kehittyä tietyntyyppinen lupus erythematosus tai heillä jo oleva lupus voi pahentua. Soita heti lääkärillesi, jos sinulla on uutta tai pahenevaa nivelkipua tai ihottumaa poskissasi tai käsivarsissasi, joka pahenee auringossa.
Keskustele lääkärisi kanssa näiden vakavien sivuvaikutusten riskistä. PRILOSEC 10 mg:lla voi olla muita vakavia sivuvaikutuksia. Katso "Mitkä ovat PRILOSEC 20mg:n mahdolliset sivuvaikutukset?"
Mikä on PRILOSEC 20mg?
Reseptilääke, jota kutsutaan protonipumpun estäjäksi (PPI), jota käytetään vähentämään hapon määrää mahassasi.
aikuisilla, PRILOSEC 20 mg:aa käytetään:
- enintään 8 viikkoa pohjukaissuolihaavojen paranemiseen.
- 10–14 päivää tiettyjen antibioottien kanssa H. pylori -nimisen bakteerin aiheuttaman infektion hoitoon. Tarvittaessa lääkärisi voi määrätä vielä 14–18 päivän PRILOSEC-hoitoa antibioottihoidon jälkeen.
- jopa 8 viikkoa mahahaavojen paranemiseen.
- enintään 4 viikkoa närästyksen ja muiden gastroesofageaalisen refluksitaudin (GERD) oireiden hoitoon.
- enintään 8 viikkoa happoon liittyvien ruokatorven limakalvovaurioiden (kutsutaan erosiiviseksi esofagiittiksi tai EE) paranemiseksi ja oireiden lievittämiseksi. Lääkärisi voi määrätä vielä neljä viikkoa PRILOSEC 20 mg -valmistetta potilaille, joiden EE ei parane.
- ylläpitää EE:n paranemista ja auttaa estämään GERD:n aiheuttamien närästysoireiden uusiutumista. Ei tiedetä, onko PRILOSEC turvallinen ja tehokas, kun sitä käytetään yli 12 kuukautta tähän tarkoitukseen.
- sairauksien pitkäaikaishoito, jossa mahasi tuottaa liikaa happoa. Tämä sisältää harvinaisen Zollinger-Ellisonin oireyhtymän.
1-16-vuotiailla lapsilla PRILOSEC 20 mg:aa käytetään:
- enintään 4 viikkoa närästyksen ja muiden GERD:n aiheuttamien oireiden hoitoon.
- enintään 8 viikkoa GERD:n hoitoon EE:llä.
- ylläpitää EE:n paranemista ja auttaa estämään GERD:n aiheuttamien närästysoireiden uusiutumista. Ei tiedetä, onko PRILOSEC turvallinen ja tehokas, kun sitä käytetään yli 12 kuukautta tähän tarkoitukseen.
1 kuukauden - alle 12 kuukauden ikäisillä lapsilla PRILOSEC 10 mg:aa käytetään:
- enintään 6 viikkoa GERD:n hoitamiseksi EE:llä. Ei tiedetä, onko PRILOSEC turvallinen ja tehokas muuhun käyttöön 1 kuukauden - alle 12 kuukauden ikäisillä lapsilla tai alle 1 kuukauden ikäisillä lapsilla.
Älä ota PRILOSECia, jos sinulla on:
- allerginen omepratsolille, jollekin muulle PPI-lääkkeelle tai jollekin PRILOSECin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo ainesosista.
- käytät rilpiviriiniä (EDURANT, COMPLERA, ODEFSEY) sisältävää lääkettä, jota käytetään HIV-1:n (ihmisen immuunikatovirus) hoitoon.
Ennen kuin otat PRILOSEC 20 mg -valmistetta, kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on alhainen magnesium-, alhainen kalsium- ja alhainen kaliumtaso veressäsi.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako PRILOSEC 10 mg sikiötäsi.
- imetät tai aiot imettää. PRILOSEC 40 mg voi erittyä äidinmaitoon. Keskustele lääkärisi kanssa parhaasta tavasta ruokkia vauvasi, jos käytät PRILOSECia.
- Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro erityisesti lääkärillesi, jos otat lääke, joka sisältää klaritromysiiniä tai amoksisilliinia, klopidogreelia (Plavix), metotreksaattia (Otrxup, Rasuvo, Trexall, XATMEP), digoksiinia (LANOXIN), vesipilleriä (diureetti), mäkikuismaa (Hypericum perforatum) tai rifampiinia (Rimactane, Rifater, Rifamate).
Kuinka minun pitäisi ottaa PRILOSEC 20 mg?
- Ota PRILOSEC 20 mg juuri sen verran kuin lääkärisi on määrännyt.
- Älä muuta annostasi tai lopeta PRILOSEC 40 mg:n käyttöä keskustelematta lääkärisi kanssa.
- PRILOSEC otetaan yleensä kerran päivässä.
- Ota PRILOSEC 20 mg ennen ateriaa.
- Antasideja voidaan ottaa PRILOSECin kanssa.
- PRILOSEC sekoitetaan veteen ja se voidaan ottaa suun kautta tai antaa nenämahaletkun (NG) tai mahaletkun kautta.
- Katso "Käyttöohjeet" Tämän lääkitysoppaan lopussa on ohjeet PRILOSEC 10mg:n sekoittamisesta ja ottamisesta suun kautta veteen tai kuinka PRILOSEC sekoitetaan ja annetaan veteen sekoitettuna NG-letkun tai mahaletkun kautta.
- Jos unohdat ottaa PRILOSEC-annoksen, ota se heti kun muistat. Jos on melkein aika ottaa seuraava annos, älä ota unohtunutta annosta. Ota seuraava annos normaaliin aikaan. Älä ota 2 annosta samanaikaisesti.
- Jos otat liikaa PRILOSECia, soita heti lääkärillesi tai myrkytystietokeskukseen numeroon 1-800-222-1222 tai mene lähimpään ensiapuun.
Mitkä ovat PRILOSEC 40mg:n mahdolliset sivuvaikutukset?
PRILOSEC voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää PRILOSEC 40mg:sta?"
- Matala B-12-vitamiinitaso elimistössäsi voi tapahtua ihmisillä, jotka ovat käyttäneet PRILOSEC 40 mg -valmistetta pitkään (yli 3 vuotta). Kerro lääkärillesi, jos sinulla on alhaisten B-12-vitamiinipitoisuuksien oireita, kuten hengenahdistusta, huimausta, epäsäännöllistä sydämenlyöntiä, lihasheikkoutta, kalpeaa ihoa, väsymystä, mielialan muutoksia ja pistelyä tai tunnottomuutta käsivarsissa ja jaloissa.
- Alhaiset magnesiumtasot ja mineraalien aineenvaihdunta kehossasi voi tapahtua ihmisillä, jotka ovat käyttäneet PRILOSECia vähintään 3 kuukautta. Kerro lääkärillesi, jos sinulla on alhaisten magnesiumpitoisuuksien oireita, kuten kouristuksia, huimausta, epäsäännöllistä sydämenlyöntiä, tärinää, lihassärkyä tai -heikkoutta sekä käsien, jalkojen tai äänen kouristuksia.
- Vatsakasvut (pohjarauhasten polyypit). Ihmisillä, jotka käyttävät PPI-lääkkeitä pitkään, on lisääntynyt riski saada tietyn tyyppiset mahalaukun kasvaimet, joita kutsutaan pohjukaissuolen polyypeiksi, varsinkin kun PPI-lääkkeitä on käytetty yli vuoden.
- Vaikeat ihoreaktiot. PRILOSEC voi aiheuttaa harvinaisia mutta vakavia ihoreaktioita, jotka voivat vaikuttaa mihin tahansa kehon osaan. Nämä vakavat ihoreaktiot saattavat vaatia hoitoa sairaalassa ja voivat olla hengenvaarallisia:
- Ihottuma, jossa voi esiintyä rakkuloita, hilseilyä tai verenvuotoa missä tahansa ihon osassa (mukaan lukien huulet, silmät, suu, nenä, sukuelimet, kädet tai jalat).
- Sinulla voi myös olla kuumetta, vilunväristyksiä, kehon kipuja, hengenahdistusta tai suurentuneet imusolmukkeet.
Lopeta PRILOSEC 20 mg:n käyttö ja soita heti lääkärillesi. Nämä oireet voivat olla ensimmäinen merkki vakavasta ihoreaktiosta.
PRILOSEC 40 mg:n yleisimmät sivuvaikutukset aikuisilla ovat: päänsärky, vatsan alueen (vatsan) kipu, pahoinvointi, ripuli, oksentelu ja kaasut.
PRILOSECin yleisimmät sivuvaikutukset 1–16-vuotiailla lapsilla ovat: ylempien hengitysteiden infektio, kuume, päänsärky, vatsan alueen (vatsakipu), pahoinvointi, ripuli, oksentelu ja kaasut. Nämä eivät ole kaikkia PRILOSECin mahdollisia sivuvaikutuksia. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää PRILOSEC 40mg?
Säilytä PRILOSEC huoneenlämmössä välillä 68 °F - 77 °F (20 °C - 25 °C).
Pidä PRILOSEC 20 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa PRILOSECin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä PRILOSECia sairauteen, johon sitä ei ole määrätty. Älä anna PRILOSEC 40 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä lääkäriltäsi tai apteekista lisätietoja PRILOSEC 20 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia PRILOSEC sisältää?
Aktiivinen ainesosa: omepratsoli magnesium
Inaktiiviset ainesosat: glyseryylimonostearaatti, hydroksipropyyliselluloosa, hypromelloosi, magnesiumstearaatti, metakryylihappokopolymeeri C, polysorbaatti, sokeripallot, talkki ja trietyylisitraatti sekä myös inaktiiviset rakeet. Inaktiiviset rakeet koostuvat sitruunahaposta, krospovidonista, dekstroosista, hydroksipropyyliselluloosasta, rautaoksidista ja ksantaanikumista.
KÄYTTÖOHJEET
PRILOSEC® (pry-lo-sec) (omepratsolimagnesium) viivästetysti vapauttavaan oraalisuspensioon
PRILOSEC 40 mg:n ottaminen vedessä:
PRILOSECin antaminen veden kanssa nenämahaletkun (NG) tai mahaletkun kautta:
Ihmisille, joilla on NG-letku tai mahaletku, jonka koko on 6 tai suurempi, PRILOSEC voidaan antaa seuraavasti:
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto
