Plavix 75mg Clopidogrel Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Plavix 75mg on ja miten sitä käytetään?
Plavix 75mg on reseptilääke, jota käytetään akuutin sepelvaltimooireyhtymän oireiden, kuten aivohalvauksen, veritulpan tai vakavan sydänongelman, sydänkohtauksen jälkeen, vakavan rintakivun tai verenkiertohäiriöiden hoitoon. Plavix 75 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Plavix 75 mg kuuluu lääkeryhmään, jota kutsutaan verihiutaleiden estoaineiksi, sydän- ja verisuonilääkkeiksi, verihiutaleiden vastaisiksi lääkkeiksi, hematologiseksi.
Ei tiedetä, onko Plavix turvallinen ja tehokas lapsille.
Mitkä ovat Plavix 75mg:n mahdolliset sivuvaikutukset?
Plavix 75 mg voi aiheuttaa vakavia sivuvaikutuksia, kuten:
- kalpea iho,
- helppo mustelma,
- violetit täplät ihon alla tai suussa,
- ihosi tai silmiesi keltaisuus (keltatauti),
- nopeat sydämenlyönnit,
- hengenahdistus,
- päänsärky,
- kuume,
- heikkous,
- väsynyt olo,
- vähän tai ei ollenkaan virtsaamista,
- kohtaukset (kouristukset),
- äkillinen tunnottomuus tai heikkous,
- hämmennystä ja
- näkö- tai puheongelmia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Plavixin yleisimpiä sivuvaikutuksia ovat:
- lisääntynyt verenvuoto,
- nenäverenvuoto,
- päänsäryt,
- kutinaa ja
- mustelmia
VAROITUS
VÄHENNYT VERKOTTELUA estävä vaikutus potilailla, joilla on kaksi CYP2C19-GEEENIN TOIMINNON MENETTEÄ ALLEELIA
Plavix 75 mg:n tehokkuus johtuu sen verihiutaleiden vastaisesta vaikutuksesta, joka riippuu sen muuttumisesta aktiiviseksi metaboliitiksi sytokromi P450 (CYP) -järjestelmän, pääasiassa CYP2C19:n toimesta [ks. VAROITUKSET JA VAROTOIMET , KLIININEN FARMAKOLOGIA ]. Plavix muodostaa suositelluilla annoksilla vähemmän aktiivista metaboliittia ja siten heikentää verihiutaleiden aktiivisuutta potilailla, jotka ovat homotsygoottisia CYP2C19-geenin toimimattomien alleelien suhteen (nimeltään "CYP2C19-heikot metaboloijat"). Testejä on saatavilla sellaisten potilaiden tunnistamiseksi, jotka ovat CYP2C19:n heikkoja metaboloijia [katso KLIININEN FARMAKOLOGIA ]. Harkitse toisen verihiutaleiden P2Y12-estäjän käyttöä potilailla, joiden on tunnistettu olevan heikko CYP2C19-metabolia.
KUVAUS
Plavix (klopidogreelibisulfaatti) on tienopyridiiniluokan P2Y12 ADP-verihiutalereseptorien estäjä. Kemiallisesti se on metyyli-(+)-(S)-a-(2-kloorifenyyli)-6,7-dihydrotieno[3,2-c]pyridiini-5(4H)-asetaattisulfaatti (1:1). Klopidogreelibisulfaatin empiirinen kaava on C16H16ClNO2S•H2SO4 ja sen molekyylipaino on 419,9. Rakennekaava on seuraava:

Clopidogrel bisulfate on valkoinen tai luonnonvalkoinen jauhe. Se on käytännössä liukenematon veteen neutraalissa pH:ssa, mutta liukenee vapaasti pH:ssa 1. Se liukenee myös vapaasti metanoliin, liukenee niukasti metyleenikloridiin ja on käytännössä liukenematon etyylieetteriin. Sen optinen ominaiskierto on noin +56°.
Suun kautta annettava Plavix on joko vaaleanpunainen, pyöreä, kaksoiskupera, kohokuvioinen, kalvopäällysteinen tabletti, joka sisältää 97,875 mg klopidogreelibisulfaattia, joka vastaa 75 mg klopidogreeliemästä, tai vaaleanpunaisina, pitkänomaisina, kohokuorina kalvopäällysteisinä tabletteina, jotka sisältävät 391,5 mg klopidogreelibisulfaattia, joka vastaa 300 mg:aa klopidogreeliemästä.
Jokainen tabletti sisältää hydrattua risiiniöljyä, hydroksipropyyliselluloosaa, mannitolia, mikrokiteistä selluloosaa ja polyetyleeniglykoli 6000:ta inaktiivisina aineosina. Vaaleanpunainen kalvopinnoite sisältää rautaoksidia, hypromelloosi 2910:tä, laktoosimonohydraattia, titaanidioksidia ja triasetiinia. Tabletit on kiillotettu karnaubavahalla.
INDIKAATIOT
Akuutti koronaarioireyhtymä (ACS)
- Plavix 75 mg on tarkoitettu vähentämään sydäninfarktin (MI) ja aivohalvauksen määrää potilailla, joilla ei ole ST-segmentin nousua ACS (epästabiili angina pectoris [UA] / ST-korkeamaton sydäninfarkti [NSTEMI]), mukaan lukien potilaat, jotka hoidetaan lääketieteellisesti ja ne, joita hoidetaan sepelvaltimon revaskularisaatiolla. Plavix 75 mg tulee antaa yhdessä aspiriinin kanssa.
- Plavix on tarkoitettu vähentämään sydäninfarktin ja aivohalvauksen esiintyvyyttä potilailla, joilla on akuutti ST-nousu sydäninfarkti (STEMI), joita hoidetaan lääketieteellisesti. Plavix 75 mg tulee antaa yhdessä aspiriinin kanssa.
Äskettäinen MI, äskettäinen aivohalvaus tai todettu perifeerinen valtimotauti
Potilaille, joilla on todettu ääreisvaltimotauti tai joilla on äskettäin ollut sydäninfarkti (MI) tai äskettäinen aivohalvaus, Plavix 75 mg on tarkoitettu vähentämään sydäninfarktin ja aivohalvauksen määrää.
ANNOSTELU JA HALLINNOINTI
Akuutti sepelvaltimo-oireyhtymä
Potilaille, jotka tarvitsevat verihiutaleiden estovaikutusta muutaman tunnin sisällä, Plavix aloitetaan yhdellä 300 mg:n oraalisella kyllästysannoksella ja jatka sitten annoksella 75 mg kerran vuorokaudessa. Plavix 75 mg -hoidon aloittaminen ilman kyllästysannosta hidastaa verihiutaleiden vastaisen vaikutuksen muodostumista useilla päivillä [ks. KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ].
Äskettäinen MI, äskettäinen aivohalvaus tai todettu perifeerinen valtimotauti
75 mg kerran päivässä suun kautta ilman latausannosta [katso KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 75 mg tabletit: Vaaleanpunaiset, pyöreät, kaksoiskuperat, kalvopäällysteiset tabletit, joiden toiselle puolelle on kaiverrettu "75" ja toiselle puolelle "1171"
- 300 mg tabletit: Vaaleanpunaiset, pitkänomaiset, kalvopäällysteiset tabletit, joiden toiselle puolelle on kaiverrettu "300" ja toiselle puolelle "1332"
Varastointi ja käsittely
Plavix (klopidogreelibisulfaatti) 75 mg Tabletit ovat vaaleanpunaisia, pyöreitä, kaksoiskuperia, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on kaiverrettu "75" ja toiselle puolelle "1171". Tabletit toimitetaan seuraavasti:
NDC 63653-1171-6 30 pulloa NDC 63653-1171-1 90 pulloa NDC 63653-1171-5 500 pulloa NDC 63653-1171-3 100 kuplia
Plavix (klopidogreelibisulfaatti) 300 mg tabletteja on saatavana vaaleanpunaisina, pitkänomaisina, kalvopäällysteisinä tabletteina, joiden toiselle puolelle on kaiverrettu "300" ja toiselle puolelle "1332". Tabletit toimitetaan seuraavasti:
NDC 63653-1332-2 30 kappaleen yksikköannospakkaukset
Säilytä 25°C (77°F); retket sallitaan 15°C-30°C (59°F-86°F) [katso USP-ohjattu huonelämpötila ].
Jakelija: Bristol-Myers Squibb/Sanofi Pharmaceuticals Partnership, Bridgewater, NJ 08807. Tarkistettu: maaliskuu 2021
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään alla ja muualla merkinnöissä:
- Verenvuoto [katso VAROITUKSET JA VAROTOIMET ]
- Tromboottinen trombosytopeeninen purppura [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa ja seurannan kestoissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Plavixin turvallisuutta on arvioitu yli 54 000 potilaalla, mukaan lukien yli 21 000 potilasta, joita on hoidettu vähintään vuoden ajan. Kliinisesti tärkeitä haittavaikutuksia, joita havaittiin tutkimuksissa, joissa Plavix 75 mg plus aspiriinia verrattiin lumelääkkeeseen ja aspiriiniin sekä tutkimuksissa, joissa Plavixia verrattiin pelkkään aspiriiniin, käsitellään alla.
Verenvuoto
PARANTAA
CURE-tutkimuksessa Plavixin käyttö aspiriinin kanssa liittyi suuren verenvuodon lisääntymiseen (pääasiassa maha-suolikanavan ja pistoskohdissa) verrattuna lumelääkkeeseen ja aspiriiniin (katso taulukko 1). Intrakraniaalisen verenvuodon (0,1 %) ja kuolemaan johtaneen verenvuodon (0,2 %) esiintyvyys oli sama molemmissa ryhmissä. Muita verenvuototapahtumia, joita ilmoitettiin useammin klopidogreeliryhmässä, olivat nenäverenvuoto, hematuria ja mustelmat.
Verenvuodon yleinen ilmaantuvuus on kuvattu taulukossa 1.
TEHDÄ
COMMIT-tutkimuksessa havaittiin samanlainen suuri verenvuoto Plavix 75 mg:n ja lumelääkeryhmän ryhmissä, jotka molemmat saivat myös aspiriinia (katso taulukko 2).
CAPRIE (Plavix vs Aspirin)
CAPRIE-tutkimuksessa maha-suolikanavan verenvuotoa esiintyi 2,0 %:lla Plavixia 75 mg saaneilla ja 2,7 %:lla aspiriinia saaneilla; sairaalahoitoa vaativaa verenvuotoa esiintyi 0,7 %:lla ja 1,1 %:lla. Intrakraniaalisen verenvuodon ilmaantuvuus oli 0,4 % Plavixilla verrattuna 0,5 % aspiriiniin.
Muita verenvuototapahtumia, joita ilmoitettiin useammin Plavix 75 mg -ryhmässä, olivat nenäverenvuoto ja hematooma.
Muut haittatapahtumat
CURE- ja CHARISMA-tutkimuksissa, joissa Plavixia plus aspiriinia verrattiin pelkkään aspiriiniin, ei havaittu eroa haittatapahtumien (muiden kuin verenvuotojen) määrässä Plavixin ja lumelääkkeen välillä.
CAPRIE-tutkimuksessa, jossa Plavix 75 mg:aa verrattiin aspiriiniin, kutinaa raportoitiin useammin Plavixia saaneilla. Mitään muuta eroa haittatapahtumien määrässä (muiden kuin verenvuoto) ei raportoitu.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on havaittu Plavixin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti tuntemattoman kokoiselta populaatiolta, ei aina ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkealtistukseen.
Plavixilla hoidetuilla potilailla on raportoitu verenvuotoja, myös kuolemaan johtaneita.
- Veri- ja imukudosjärjestelmän häiriöt: Agranulosytoosi, aplastinen anemia/pansytopenia, tromboottinen trombosytopeeninen purppura (TTP), hankittu hemofilia A
- Ruoansulatuskanavan häiriöt: Koliitti (mukaan lukien haavainen tai lymfosyyttinen paksusuolitulehdus), haimatulehdus, suutulehdus, maha-/pohjukaissuolihaava, ripuli
- Yleiset häiriöt ja antokohdan kunto: Kuume
- Maksa-sappihäiriöt: Akuutti maksan vajaatoiminta, hepatiitti (ei-tarttuva), epänormaali maksan toimintakoe
- Immuunijärjestelmän häiriöt: Yliherkkyysreaktiot, anafylaktoidiset reaktiot, seerumitauti, insuliinin autoimmuunisyndrooma, jotka voivat johtaa vakavaan hypoglykemiaan
- Tuki- ja liikuntaelimistön, sidekudoksen ja luuston häiriöt: Myalgia, nivelkipu, niveltulehdus
- Hermoston häiriöt: Makuhäiriöt, päänsärky, ageusia
- Psyykkiset häiriöt: Hämmennys, hallusinaatiot
- Hengityselimet, rintakehä ja välikarsina: Bronkospasmi, interstitiaalinen pneumoniitti, eosinofiilinen keuhkokuume
- Munuaisten ja virtsateiden häiriöt: Lisääntynyt kreatiniinitaso
- Ihon ja ihonalaisen kudoksen häiriöt: Makulopapulaarinen, punoittava tai eksfoliatiivinen ihottuma, nokkosihottuma, rakkulainen ihottuma, ekseema, toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä, akuutti yleistynyt eksantematoottinen pustuloosi (AGEP), angioödeema, lääkkeiden aiheuttama yliherkkyysoireyhtymä, lääkeihottuma, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) erythema multiforme, lichen planus, yleistynyt kutina
- Verisuonihäiriöt: Vaskuliitti, hypotensio
HUUMEIDEN VUOROVAIKUTUKSET
CYP2C19-indusoijat
Koska klopidogreeli metaboloituu aktiiviseksi metaboliitiksi osittain CYP2C19:n vaikutuksesta, tämän entsyymin aktiivisuutta indusoivien lääkkeiden käytön odotetaan johtavan klopidogreelin aktiivisen metaboliitin lääkepitoisuuksien nousuun.
Rifampiini indusoi voimakkaasti CYP2C19:ää, mikä lisää sekä klopidogreelin aktiivisen metaboliitin tasoa että verihiutaleiden estoa, mikä saattaa erityisesti lisätä verenvuotoriskiä. Varotoimenpiteenä vältä voimakkaiden CYP2C19-induktorien samanaikaista käyttöä [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
CYP2C19:n estäjät
Klopidogreeli metaboloituu aktiiviseksi metaboliitiksi osittain CYP2C19:n välityksellä. Tämän entsyymin aktiivisuutta estävien lääkkeiden samanaikainen käyttö johtaa klopidogreelin aktiivisen metaboliitin plasmapitoisuuden vähenemiseen ja verihiutaleiden eston vähenemiseen [ks. VAROITUKSET JA VAROTOIMET ].
Omepratsoli tai Esomepratsoli
Vältä Plavix 75 mg:n samanaikaista käyttöä omepratsolin tai esomepratsolin kanssa. Kliinisissä tutkimuksissa omepratsolin osoitettiin heikentävän merkittävästi Plavix 75 mg:n verihiutaleiden estovaikutusta, kun se annettiin samanaikaisesti tai 12 tunnin välein. Samanlainen verihiutaleiden vastaisen vaikutuksen väheneminen havaittiin esomepratsolin kanssa, kun sitä annettiin samanaikaisesti Plavixin kanssa. Dekslansopratsolilla, lansopratsolilla ja pantopratsolilla oli vähemmän vaikutusta Plavixin verihiutaleiden vastaiseen aktiivisuuteen kuin omepratsolilla tai esomepratsolilla [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Opioidit
Kuten muidenkin suun kautta otettavien P2Y12-estäjien kanssa, opioidiagonistien samanaikainen anto viivästyttää ja vähentää klopidogreelin imeytymistä, oletettavasti mahalaukun hidastumisen vuoksi, mikä vähentää altistumista sen metaboliiteille [ks. KLIININEN FARMAKOLOGIA ]. Harkitse parenteraalisen verihiutaleiden vastaisen aineen käyttöä akuutissa sepelvaltimotautipotilaissa, jotka tarvitsevat samanaikaisesti morfiinia tai muita opioidiagonisteja.
Ei-steroidiset tulehduskipulääkkeet (NSAID)
Plavix 75 mg:n ja tulehduskipulääkkeiden samanaikainen käyttö lisää maha-suolikanavan verenvuodon riskiä.
Varfariini (CYP2C9-substraatit)
Vaikka klopidogreelin 75 mg vuorokausiannos ei muuttanut S-varfariinin (CYP2C9-substraatti) tai INR:n farmakokinetiikkaa potilailla, jotka saavat pitkäaikaista varfariinihoitoa, Plavix 75 mg:n samanaikainen anto varfariinin kanssa lisää verenvuotoriskiä riippumattomien vaikutusten vuoksi. hemostaasi.
Suurina pitoisuuksina in vitro klopidogreeli kuitenkin estää CYP2C9:ää.
SSRI:t ja SNRI:t
Koska selektiiviset serotoniinin takaisinoton estäjät (SSRI) ja serotoniinin norepinefriinin takaisinoton estäjät (SNRI) vaikuttavat verihiutaleiden aktivaatioon, SSRI-lääkkeiden ja SNRI-lääkkeiden samanaikainen käyttö klopidogreelin kanssa voi lisätä verenvuotoriskiä.
Repaglinidi (CYP2C8-substraatit)
Klopidogreelin asyyli-β-glukuronidimetaboliitti on voimakas CYP2C8:n estäjä. Plavix 75 mg voi lisätä systeemistä altistusta lääkkeille, jotka pääasiallisesti eliminoituvat CYP2C8:n kautta, minkä vuoksi annosta on muutettava ja tarkkailtava.
Plavix lisäsi repaglinidialtistusta 3,9-kertaiseksi - 5,1-kertaiseksi [ks KLIININEN FARMAKOLOGIA ]. Vältä repaglinidin samanaikaista käyttöä Plavixin kanssa. Jos samanaikaista käyttöä ei voida välttää, aloita repaglinidiannos 0,5 mg ennen jokaista ateriaa, äläkä ylitä 4 mg:n vuorokausiannosta. Samanaikaisen käytön aikana saattaa olla tarpeen seurata glukoosin seurantaa useammin.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Vähentynyt verihiutaleiden vastainen aktiivisuus potilailla, joilla on heikentynyt CYP2C19-toiminta
Klopidogreeli on aihiolääke. Klopidogreeli estää verihiutaleiden aggregaatiota aktiivisen metaboliitin kautta. CYP2C19:n geneettiset vaihtelut voivat heikentää klopidogreelin metaboloitumista sen aktiiviseksi metaboliitiksi [ks. LAATIKKO VAROITUS ].
Klopidogreelin metaboliaa voivat heikentää myös CYP2C19:ää estävät lääkkeet, kuten omepratsoli tai esomepratsoli. Vältä Plavixin samanaikaista käyttöä omepratsolin tai esomepratsolin kanssa, koska molemmat vähentävät merkittävästi Plavixin verihiutaleiden vastaista aktiivisuutta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Yleinen verenvuotoriski
P2Y12-estäjät (tienopyridiinit), mukaan lukien Plavix, lisäävät verenvuotoriskiä.
P2Y12-estäjät (tienopyridiinit) estävät verihiutaleiden aggregaatiota verihiutaleiden eliniän ajan (7-10 päivää). Koska klopidogreelin aktiivisen metaboliitin puoliintumisaika on lyhyt, hemostaasi voi olla mahdollista palauttaa antamalla eksogeenisiä verihiutaleita. verihiutaleiden siirrot 4 tunnin sisällä kyllästysannoksesta tai 2 tunnin sisällä ylläpitoannoksesta voivat kuitenkin olla tehottomampia.
CYP2C19:n aktiivisuutta indusoivien lääkkeiden käytön odotetaan johtavan klopidogreelin aktiivisen metaboliitin lääkepitoisuuden nousuun ja saattaa lisätä verenvuotoriskiä. Varotoimenpiteenä vältä voimakkaiden CYP2C19-induktorien samanaikaista käyttöä [katso HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Plavixin lopettaminen
Plavix-hoidon lopettaminen lisää kardiovaskulaaristen tapahtumien riskiä. Jos Plavix-hoito on keskeytettävä väliaikaisesti (esim. verenvuodon hoitoon tai leikkaukseen, jossa on suuri verenvuotoriski), aloita se uudelleen mahdollisimman pian. Jos mahdollista, keskeytä Plavix-hoito viideksi päiväksi ennen leikkausta. Jatka Plavix 75 mg -annosta heti, kun hemostaasi on saavutettu.
Tromboottinen trombosytopeeninen purppura (TTP)
TTP:tä, joskus kuolemaan johtanutta, on raportoitu Plavix 75 mg:n käytön jälkeen, joskus lyhyen ( HAITTAVAIKUTUKSET ].
Tienopyridiinien ristireaktiivisuus
Yliherkkyyttä, mukaan lukien ihottuma, angioödeema tai hematologinen reaktio, on raportoitu potilailla, jotka ovat saaneet Plavixia 75 mg, mukaan lukien potilaat, joilla on ollut yliherkkyys tai hematologinen reaktio muille tienopyridiineille [ks. VASTA-AIHEET ja HAITTAVAIKUTUKSET ].
Potilasneuvontatiedot
Neuvo potilaita lukemaan FDA:n hyväksymät potilasmerkinnät ( Lääkitysopas ).
Lopettaminen
Neuvo potilaita olemaan lopettamatta Plavix-hoitoa keskustelematta siitä ensin sen määränneen terveydenhuollon tarjoajan kanssa [ks. VAROITUKSET JA VAROTOIMET ].
Verenvuoto
Kerro potilaille, että he:
- tulee helpommin mustelmia ja verta
- kestää tavallista kauemmin verenvuodon pysäyttämiseen
- on ilmoitettava kaikista odottamattomista, pitkittyneistä tai liiallisista verenvuodoista tai verestä ulosteessa tai virtsassa [ks. VAROITUKSET JA VAROTOIMET ]
Tromboottinen trombosytopeeninen purppura
Neuvo potilaita hakemaan nopeaa lääketieteellistä apua, jos heillä on TTP-oireita, joita ei muuten voida selittää [katso VAROITUKSET JA VAROTOIMET ].
Invasiiviset toimenpiteet
Neuvo potilaita ilmoittamaan lääkäreille ja hammaslääkäreille, että he käyttävät Plavixia ennen leikkausta tai hammashoitoa [ks. VAROITUKSET JA VAROTOIMET ].
Protonipumpun estäjät
Neuvo potilaita olemaan käyttämättä omepratsolia tai esomepratsolia Plavix-hoidon aikana. Dekslansopratsolilla, lansopratsolilla ja pantopratsolilla oli vähemmän selvä vaikutus Plavix 75 mg:n verihiutaleiden vastaiseen aktiivisuuteen kuin omepratsolilla tai esomepratsolilla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Tuumorigeenisyydestä ei havaittu näyttöä, kun klopidogreelia annettiin 78 viikon ajan hiirille ja 104 viikon ajan rotille annoksilla 77 mg/kg/vrk asti, mikä johti yli 25-kertaiseen plasmaaltistukseen verrattuna suositellulla 75 mg:n vuorokausiannoksella.
Klopidogreeli ei ollut genotoksinen neljässä in vitro -testissä (Ames-testi, DNA-korjaustesti rotan maksasoluilla, geenimutaatiomääritys kiinanhamsterin fibroblasteissa ja ihmisen lymfosyyttien metafaasikromosomianalyysi) ja yhdessä in vivo -testissä (mikronukleustesti suun kautta hiiret).
Klopidogreelin ei havaittu vaikuttavan uros- ja naarasrottien hedelmällisyyteen, kun niitä hoidettiin ennen parin muodostumista ja koko tiineyden ajan suun kautta annetuilla annoksilla 400 mg/kg/vrk asti (52 kertaa suositeltu ihmisannos mg/m²:n perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Käytettävissä olevat tiedot julkaistussa kirjallisuudessa raportoiduista tapauksista ja markkinoille tulon jälkeisessä seurannassa klopidogreelin käytöstä raskaana oleville naisille eivät ole havainneet lääkkeisiin liittyviä riskejä vakaville synnynnäisille epämuodostumille tai keskenmenolle [ks. Data ]. Sydäninfarktiin ja aivohalvaukseen liittyy riskejä raskaana olevalle naiselle ja sikiölle [katso Kliiniset näkökohdat ]. Sikiötoksisuudesta ei havaittu näyttöä, kun klopidogreelia annettiin tiineille rotille ja kaniineille organogeneesin aikana annoksilla, jotka vastasivat 65- ja 78-kertaisia suositeltuja päivittäisiä ihmisannoksia [ks. Data ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustariski synnynnäisille epämuodostumille, menetyksille tai muille haitallisille seurauksille. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Sydäninfarkti ja aivohalvaus ovat lääketieteellisiä hätätapauksia. Raskaana olevan naisen hoitoa ei pidä keskeyttää klopidogreelin sikiöön kohdistuvien vaikutusten vuoksi.
Työ tai toimitus
Klopidogreelin käyttö synnytyksen tai synnytyksen aikana lisää äidin verenvuodon ja verenvuodon riskiä. Vältä neuraksiaalista salpausta klopidogreelin käytön aikana selkärangan hematooman riskin vuoksi. Jos mahdollista, lopeta klopidogreelin käyttö 5–7 päivää ennen synnytystä, synnytystä tai hermoston salpausta.
Data
Ihmistiedot
Saatavilla olevat tiedot julkaistuista tapausraporteista kahden vuosikymmenen ajalta markkinoille tulon jälkeen eivät ole havainneet yhteyttä klopidogreelin käyttöön raskauden ja vakavien synnynnäisten epämuodostumien, keskenmenon tai haitallisten sikiövaikutusten yhteydessä.
Eläinten tiedot
Alkion ja sikiön kehitystoksikologiset tutkimukset suoritettiin tiineillä rotilla ja kaneilla annoksilla 500 ja 300 mg/kg/vrk organogeneesin aikana. Nämä annokset, jotka vastaavat 65-kertaisia ja 78-kertaisia ihmisille suositeltuja vuorokausiantoja mg/m²:n perusteella, eivät osoittaneet viitteitä klopidogreelin aiheuttamasta hedelmällisyyden heikkenemisestä tai sikiötoksisuudesta.
Imetys
Riskien yhteenveto
Klopidogreelin erittymisestä äidinmaitoon tai sen vaikutuksista maidontuotantoon ei ole tietoa. Mitään haittavaikutuksia rintaruokitetuille imeväisille ei ole havaittu äidin klopidogreelin käytön aikana imetyksen aikana pienessä määrässä markkinoille tulon jälkeen. Rotilla tehdyt tutkimukset ovat osoittaneet, että klopidogreelia ja/tai sen metaboliitteja erittyy maitoon. Kun lääkettä on eläimen maidossa, on todennäköistä, että lääkettä on äidinmaidossa. Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä PLAVIX-tarvetta ja PLAVIX 75 mg:n mahdollisia haitallisia vaikutuksia imetettävään lapseen tai äidin taustalla olevaa tilaa.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Satunnaistettu, lumekontrolloitu tutkimus (CLARINET) ei osoittanut kliinistä hyötyä klopidogreelista vastasyntyneillä ja pikkulapsilla, joilla oli syanoottinen synnynnäinen sydänsairaus, jota lievitettiin systeemisestä keuhkovaltimoiden shuntista. Mahdollisia tähän tulokseen vaikuttavia tekijöitä olivat klopidogreeliannos, samanaikainen aspiriinin anto ja hoidon myöhäinen aloitus shuntin lievityksen jälkeen. Ei voida sulkea pois mahdollisuutta, että erilaisella suunnitelmalla tehty tutkimus osoittaisi kliinistä hyötyä tälle potilasryhmälle.
Geriatrinen käyttö
CAPRIE- ja CURE-kontrolloitujen kliinisten tutkimusten koehenkilöiden kokonaismäärästä noin 50 % Plavixilla hoidetuista potilaista oli vähintään 65-vuotiaita ja 15 % oli 75-vuotiaita tai vanhempia. COMMIT-tutkimuksessa noin 58 % Plavix 75 mg:lla hoidetuista potilaista oli 60-vuotiaita tai vanhempia, joista 26 % oli 70-vuotiaita tai vanhempia.
Havaittu verenvuotoriski Plavix 75 mg:n ja aspiriinin kanssa verrattuna lumelääkkeeseen ja aspiriiniin ikäluokittain on esitetty taulukossa 1 ja taulukossa 2 CURE- ja COMMIT-tutkimuksissa, vastaavasti [ks. HAITTAVAIKUTUKSET ]. Annosta ei tarvitse muuttaa iäkkäillä potilailla.
Munuaisten vajaatoiminta
Kokemus on rajallinen potilaista, joilla on vaikea ja kohtalainen munuaisten vajaatoiminta [ks KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen potilailla, joilla on maksan vajaatoiminta [katso KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Plavixin aiheuttama verihiutaleiden esto on peruuttamaton ja kestää verihiutaleiden eliniän. Yliannostus klopidogreelin annon jälkeen voi aiheuttaa verenvuotokomplikaatioita. Yksi oraalinen klopidogreeliannos 1500 tai 2000 mg/kg oli tappava hiirille ja rotille ja 3000 mg/kg paviaaneille. Akuutin toksisuuden oireita olivat oksentelu, uupumus, hengitysvaikeudet ja maha-suolikanavan verenvuoto eläimillä.
Biologisen uskottavuuden perusteella verihiutaleiden siirto voi palauttaa hyytymiskyvyn.
VASTA-AIHEET
Aktiivinen verenvuoto
Plavix on vasta-aiheinen potilailla, joilla on aktiivinen patologinen verenvuoto, kuten peptinen haava tai kallonsisäinen verenvuoto.
Yliherkkyys
Plavix 75 mg on vasta-aiheinen potilailla, jotka ovat yliherkkiä (esim. anafylaksia) klopidogreelille tai jollekin tuotteen komponentille [ks. HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Klopidogreeli estää verihiutaleiden aktivaatiota ja aggregaatiota, koska sen aktiivinen metaboliitti sitoutuu palautumattomasti verihiutaleiden ADP-reseptorien P2Y12-luokkaan.
Farmakodynamiikka
Klopidogreeli on metaboloitava CYP450-entsyymien toimesta, jotta muodostuu aktiivinen metaboliitti, joka estää verihiutaleiden aggregaatiota. Klopidogreelin aktiivinen metaboliitti estää selektiivisesti adenosiinidifosfaatin (ADP) sitoutumista verihiutaleiden P2Y12-reseptoriinsa ja sitä seuraavaa ADP-välitteistä glykoproteiini-GPIIb/IIIa-kompleksin aktivaatiota, mikä estää verihiutaleiden aggregaatiota. Tämä toimenpide on peruuttamaton. Tämän seurauksena verihiutaleet, jotka altistuvat klopidogreelin aktiiviselle metaboliitille, vaikuttavat niiden loppuelämän ajaksi (noin 7-10 päivää). Muiden agonistien kuin ADP:n indusoima verihiutaleiden aggregaatio estyy myös estämällä vapautuneen ADP:n aiheuttaman verihiutaleiden aktivoitumisen vahvistumisen.
Annosriippuvainen verihiutaleiden aggregaation esto voidaan havaita 2 tuntia suun kautta otetun Plavix-kerta-annoksen jälkeen. Toistetut 75 mg:n Plavix-annokset vuorokaudessa estävät ADP:n aiheuttamaa verihiutaleiden aggregaatiota ensimmäisenä päivänä, ja esto saavuttaa vakaan tilan 3. ja 7. päivän välillä. Vakaassa tilassa keskimääräinen estotaso, joka havaittiin 75 mg:n vuorokausiannoksella Plavixia oli 40 % ja 60 % välillä. Verihiutaleiden aggregaatio ja vuotoaika palautuvat vähitellen lähtötasolle hoidon lopettamisen jälkeen, yleensä noin 5 päivässä.
Geriatriset potilaat
Iäkkäillä (≥ 75-vuotiailla) ja nuorilla terveillä koehenkilöillä oli samanlaiset vaikutukset verihiutaleiden aggregaatioon.
Munuaisten vajaatoimintapotilaat
Toistuvien 75 mg:n Plavix 75 mg:n vuorokausiannosten jälkeen potilailla, joilla oli vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma 5–15 ml/min) ja kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma 30–60 ml/min), havaittiin vähäistä (25 %):n estoa. ADP:n aiheuttama verihiutaleiden aggregaatio.
Maksan vajaatoimintapotilaat
Toistuvien 75 mg:n Plavix-annosten jälkeen vuorokaudessa 10 päivän ajan potilailla, joilla oli vaikea maksan vajaatoiminta, ADP:n aiheuttaman verihiutaleiden aggregaation esto oli samanlaista kuin terveillä koehenkilöillä.
Sukupuoli
Pienessä tutkimuksessa, jossa verrattiin miehiä ja naisia, naisilla havaittiin vähemmän ADP:n aiheuttamaa verihiutaleiden aggregaatiota.
Farmakokinetiikka
Klopidogreeli on aihiolääke ja metaboloituu farmakologisesti aktiiviseksi metaboliitiksi ja inaktiivisiksi metaboliiteiksi.
Imeytyminen
Klopidogreeli imeytyy nopeasti kerta-annosten ja toistuvien oraalisten 75 mg:n vuorokausiannosten jälkeen. Imeytyminen on vähintään 50 % perustuen klopidogreelin metaboliittien virtsaan erittymiseen.
Ruoan vaikutus
Plavix voidaan antaa ruoan kanssa tai ilman. Terveillä miespuolisilla koehenkilöillä tehdyssä tutkimuksessa, kun Plavixia annettiin 75 mg päivässä tavallisen aamiaisen yhteydessä, ADP:n aiheuttaman verihiutaleiden aggregaation keskimääräinen esto väheni alle 9 %. Aktiivinen metaboliitti AUC0-24 pysyi muuttumattomana ruoan kanssa, kun taas aktiivisen metaboliitin Cmax pieneni 57 %. Samanlaisia tuloksia havaittiin, kun Plavix 300 mg:n kyllästysannos annettiin rasvaisen aamiaisen kanssa.
Aineenvaihdunta
Klopidogreeli metaboloituu laajalti kahdella pääaineenvaihduntareitillä: toinen esteraasien välittämä ja johtaa hydrolyysiin inaktiiviseksi karboksyylihappojohdannaiseksi (85 % kiertävistä metaboliiteista) ja toinen useiden sytokromi P450 -entsyymien välittämä. Sytokromit hapettavat ensin klopidogreelin 2-oksoklopidogreelin välituotemetaboliitiksi. 2-oksoklopidogreelin välituotemetaboliitin myöhempi metabolia johtaa aktiivisen metaboliitin, klopidogreelin tiolijohdannaisen, muodostumiseen. Aktiivinen metaboliitti muodostuu pääasiassa CYP2C19:n vaikutuksesta useiden muiden CYP-entsyymien, mukaan lukien CYP1A2, CYP2B6 ja CYP3A, myötä. Aktiivinen tiolimetaboliitti sitoutuu nopeasti ja palautumattomasti verihiutaleiden reseptoreihin ja estää siten verihiutaleiden aggregaatiota verihiutaleiden elinkaaren ajan.
Aktiivisen metaboliitin Cmax on kaksi kertaa korkeampi klopidogreelin 300 mg:n kyllästysannoksen jälkeen kuin neljän päivän 75 mg:n ylläpitoannoksen jälkeen. Cmax saavutetaan noin 30-60 minuutin kuluttua annostelusta. Annosalueella 75–300 mg aktiivisen metaboliitin farmakokinetiikka poikkeaa suhteessa annokseen: 4-kertainen annos johtaa 2,0-kertaiseen ja 2,7-kertaiseen Cmax- ja AUC-arvoon.
Eliminointi
Ihmisille suun kautta annetun 14C-leimatun klopidogreeliannoksen jälkeen noin 50 % kokonaisradioaktiivisuudesta erittyi virtsaan ja noin 46 % ulosteeseen 5 päivän aikana annostelun jälkeen. Suun kautta annetun 75 mg:n kerta-annoksen jälkeen klopidogreelin puoliintumisaika on noin 6 tuntia. Aktiivisen metaboliitin puoliintumisaika on noin 30 minuuttia.
Huumeiden vuorovaikutukset
Muiden lääkkeiden vaikutus Plavixiin
Klopidogreeli metaboloituu aktiiviseksi metaboliitiksi osittain CYP2C19:n välityksellä.
CYP2C19-indusoijat
Voimakkaiden CYP2C19-induktorien samanaikainen käyttö lisää klopidogreelin aktiivisen metaboliitin pitoisuutta plasmassa ja lisää verihiutaleiden estoa.
Rifampiini: Rifampiinin 300 mg kahdesti vuorokaudessa 7 päivän ajan 600 mg:n kyllästysannoksen klopidogreelia antaminen terveille aikuisille suurensi klopidogreelin tiolimetaboliittien keskimääräistä AUC- ja Cmax-arvoa 3,8-kertaiseksi. Verihiutaleiden aggregaation keskimääräinen esto 4 tunnin kuluttua annoksen ottamisesta oli 34 % suurempi rifampiinin läsnä ollessa verrattuna pelkkään klopidogreeliin.
CYP2C19:n estäjät
Tiettyjen tämän entsyymin estäjien samanaikainen käyttö johtaa klopidogreelin aktiivisen metaboliitin plasmapitoisuuksien vähenemiseen ja verihiutaleiden eston vähenemiseen.
Protonipumpun estäjät (PPI)
Protonipumpun estäjien (PPI) vaikutus systeemiseen altistukseen klopidogreelin aktiiviselle metaboliitille toistuvien 75 mg:n Plavix-annosten jälkeen, joka on arvioitu erityisissä lääkkeiden yhteisvaikutustutkimuksissa, on esitetty kuvassa 1.
Kuva 1: Altistuminen klopidogreelin aktiiviselle aineenvaihduntatuotteelle useiden Plavix 75 mg -annosten jälkeen yksinään tai protonipumpun estäjien (PPI) kanssa
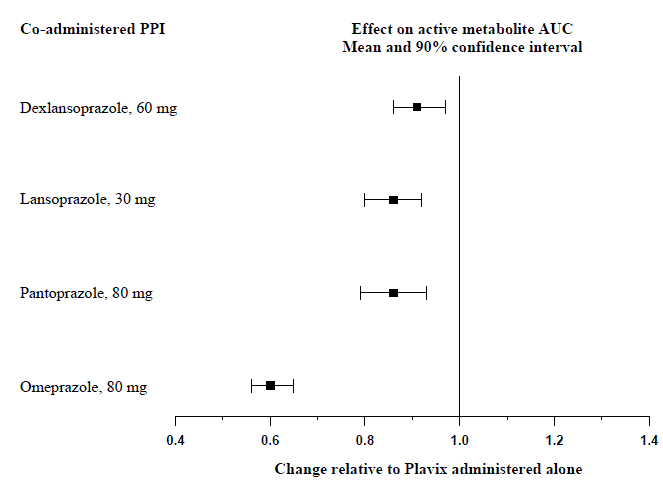
Näissä tutkimuksissa mitatut farmakodynaamiset ja farmakokineettiset parametrit osoittivat, että yhteisvaikutus oli suurin omepratsolin ja vähiten dekslansopratsolin kanssa.
Opioidit
5 mg:n laskimonsisäisen morfiinin ja 600 mg:n klopidogreelin kyllästysannoksen samanaikainen anto terveillä aikuisilla alensi klopidogreelin tiolimetaboliittien AUC- ja Cmax-arvoja 34 %. Keskimääräinen verihiutaleiden aggregaatio oli korkeampi 2–4 tuntiin, kun morfiinia annettiin samanaikaisesti.
Plavix 75mg:n vaikutus muihin lääkkeisiin
In vitro -tutkimukset ovat osoittaneet, että klopidogreelin glukuronidimetaboliitti on voimakas CYP2C8:n estäjä. Repaglinidin samanaikainen anto Plavixin kanssa lisäsi systeemistä altistusta repaglinidille (AUC0-∞) 5,1-kertaiseksi kyllästysannoksen (300 mg) jälkeen ja 3,9-kertaiseksi Plavixin ylläpitoannoksen (75 mg) 3. päivänä [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Farmakogenomiikka
CYP2C19 osallistuu sekä aktiivisen metaboliitin että 2-oksoklopidogreelin välimetaboliitin muodostumiseen. Klopidogreelin aktiivisen metaboliitin farmakokinetiikka ja verihiutaleiden aggregaatiota estävät vaikutukset, mitattuna ex vivo verihiutaleiden aggregaatiomäärityksillä, vaihtelevat CYP2C19-genotyypin mukaan. Potilaita, jotka ovat homotsygoottisia CYP2C19-geenin ei-funktionaalisten alleelien suhteen, kutsutaan "CYP2C19:n hitaiksi metaboloijiksi". Noin 2 % valkoisista ja 4 % mustista potilaista on heikkoja metaboloijia; huonon aineenvaihdunnan esiintyvyys on suurempi aasialaispotilailla (esim. 14 % kiinalaisista). Käytettävissä on testejä sellaisten potilaiden tunnistamiseksi, jotka ovat CYP2C19:n heikkoja metaboloijia.
Crossover-tutkimuksessa, johon osallistui 40 tervettä henkilöä, joista kussakin oli 10 neljässä CYP2C19-metaboliaryhmässä, arvioitiin farmakokineettisiä ja verihiutaleiden vastaisia vasteita käyttämällä 300 mg:aa, jota seurasi 75 mg päivässä ja 600 mg ja 150 mg päivässä, kutakin yhteensä 5 päivän ajan. Altistuminen aktiiviselle metaboliitille ja vähentynyt verihiutaleiden aggregaation esto havaittiin hitailla metaboloijilla verrattuna muihin ryhmiin.
Kliiniset tutkimukset
Akuutti sepelvaltimo-oireyhtymä
PARANTAA
CURE-tutkimukseen osallistui 12 562 potilasta, joilla oli ACS ilman ST-nousua (UA tai NSTEMI) ja jotka ilmenivät 24 tunnin sisällä viimeisimmän rintakipujakson tai iskemian oireiden alkamisesta. Potilailta vaadittiin joko EKG:n muutoksia, jotka olivat yhteensopivia uuden iskemian kanssa (ilman ST-kohotusta) tai kohonneet sydänentsyymit tai troponiini I tai T vähintään kaksinkertaiseksi normaalin ylärajaan verrattuna.
Potilaat satunnaistettiin saamaan Plavixia (300 mg:n kyllästysannos, jota seurasi 75 mg kerran vuorokaudessa) tai lumelääkettä, ja heitä hoidettiin enintään vuoden ajan. Potilaat saivat myös aspiriinia (75-325 mg kerran päivässä) ja muita tavanomaisia hoitoja, kuten hepariinia. GPIIb/IIIa-estäjien käyttöä ei sallittu kolmeen päivään ennen satunnaistamista.
Potilaspopulaatio oli suurelta osin valkoihoinen (82 %), ja 38 % oli naisia ja 52 % oli vähintään 65-vuotiaita. Vain noin 20 %:lle potilaista tehtiin revaskularisaatio ensimmäisen sairaalahoidon aikana, ja harvalle tehtiin väliaikainen tai kiireellinen revaskularisaatio.
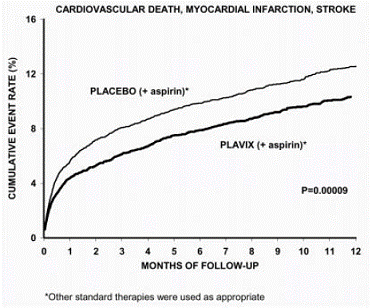
Ensisijaisen lopputuloksen (CV-kuolema, sydäninfarkti tai aivohalvaus) kokeneiden potilaiden määrä oli 582 (9,3 %) Plavix-hoitoa saaneessa ryhmässä ja 719 (11,4 %) lumelääkeryhmässä, mikä pienensi suhteellista riskiä 20 % (95). % CI 10 % - 28 %; p
Suurin osa Plavixin hyödystä ilmeni kahden ensimmäisen kuukauden aikana, mutta ero lumelääkkeeseen säilyi koko tutkimuksen ajan (12 kuukauteen asti) (katso kuva 2).
Kuva 2: Sydänkuolema, sydäninfarkti ja aivohalvaus CURE-tutkimuksessa
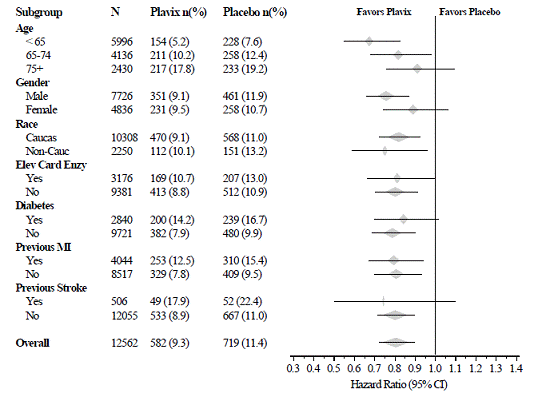
Plavix 75 mg:n vaikutus ei eronnut merkittävästi eri alaryhmissä, kuten kuvasta 3 näkyy. Plavix 75 mg:aan liittyvät hyödyt olivat riippumattomia muiden akuuttien ja pitkäaikaisten sydän- ja verisuonihoitojen käytöstä, mukaan lukien hepariini/LMWH, suonensisäinen glykoproteiini IIb/IIIa (GPIIb/IIIa) estäjät, lipidejä alentavat lääkkeet, beetasalpaajat ja ACE:n estäjät. Plavixin tehoa havaittiin riippumatta aspiriiniannoksesta (75-325 mg kerran vuorokaudessa). Suun kautta otettavien antikoagulanttien, ei-tutkittujen verihiutalelääkkeiden ja kroonisten tulehduskipulääkkeiden käyttö ei ollut sallittua CUREssa.
Kuva 3: Potilaan lähtötilanteen ominaisuuksien ja tutkimuksen aikana käytettävien samanaikaisten lääkkeiden/interventioiden riskisuhde CURE-tutkimuksessa
Kuva 3: Potilaan lähtötilanteen ominaisuuksien ja tutkimuksen aikana käytettävien samanaikaisten lääkkeiden/interventioiden riskisuhde CURE-tutkimuksessa (jatkuu)
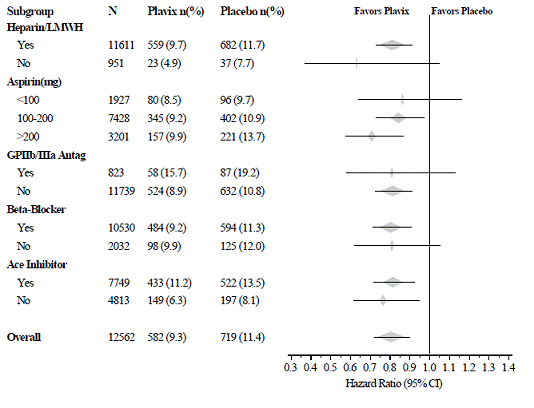
Plavixin käyttö CUREssa liittyi trombolyyttisen hoidon käytön vähenemiseen (71 potilasta [1,1 %] Plavix 75 mg:n ryhmässä, 126 potilasta [2,0 %] lumelääkeryhmässä; suhteellinen riski pieneni 43 %) ja GPIIb/IIIa-estäjät (369 potilasta [5,9 %] Plavix 75 mg:n ryhmässä, 454 potilasta [7,2 %] lumelääkeryhmässä, suhteellinen riskin lasku 18 %). Plavix 75 mg:n käyttö CUREssa ei vaikuttanut CABG:llä tai PCI:llä (stentauksen kanssa tai ilman) hoidettujen potilaiden lukumäärään (2253 potilasta [36,0 %] Plavix 75 mg -ryhmässä, 2 324 potilasta [36,9 %] lumelääkeryhmässä; suhteellinen riskin pieneneminen 4,0 prosenttia.
TEHDÄ
STEMI-potilailla Plavixin turvallisuutta ja tehoa arvioitiin satunnaistetussa, lumekontrolloidussa kaksoissokkotutkimuksessa COMMIT. COMMIT-tutkimukseen osallistui 45 852 potilasta, jotka ilmaantuivat 24 tunnin sisällä sydäninfarktin oireiden alkamisesta ja niitä tukevia EKG-poikkeavuuksia (esim. ST-korkeus, ST-depressio tai vasemman haarakatkos). Potilaat satunnaistettiin saamaan Plavixia (75 mg kerran vuorokaudessa) tai lumelääkettä yhdessä aspiriinin kanssa (162 mg päivässä) 28 päivän ajan tai sairaalasta kotiutumiseen saakka sen mukaan, kumpi tuli ensin.
Ensisijaiset päätetapahtumat olivat kuolema mistä tahansa syystä ja uusintainfarktin, aivohalvauksen tai kuoleman ensimmäinen esiintyminen.
Potilaspopulaatiosta 28 % oli naisia ja 58 % ikä ≥ 60 vuotta (26 % ikä ≥ 70 vuotta). Viisikymmentäviisi prosenttia (55 %) potilaista sai trombolyyttisiä lääkkeitä ja vain 3 %:lle tehtiin PCI.
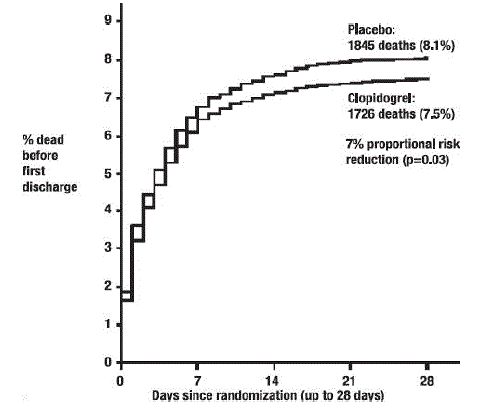
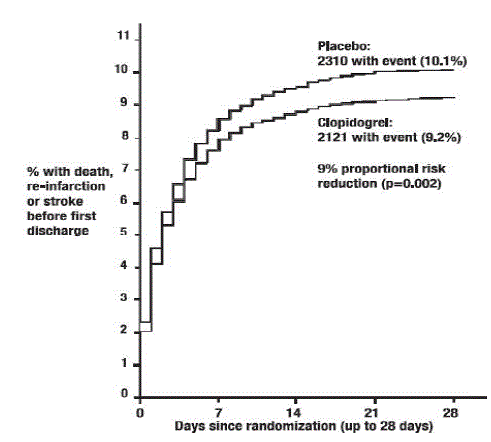
Kuten alla olevista taulukoista 5 ja kuvioista 4 ja 5 näkyy, Plavix vähensi merkittävästi suhteellista riskiä kuolla mistä tahansa syystä 7 % (p=0,029) ja suhteellista riskiä uusintainfarktin, aivohalvauksen tai kuoleman yhdistelmästä 9 % ( p = 0,002).
Kuva 4: Kumulatiivinen kuolemantapausten määrä COMMIT-tutkimuksessa*
Kuva 5: Kumulatiivinen tapahtumatiheys yhdistetyn päätepisteen uusintainfarktin, aivohalvauksen tai kuoleman osalta COMMIT-tutkimuksessa*
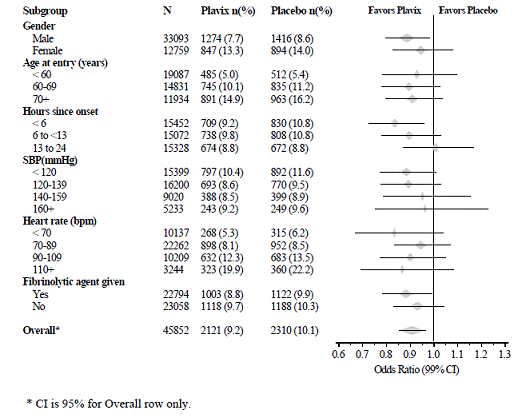
Plavix 75 mg:n vaikutus ei eronnut merkittävästi useissa ennalta määritellyissä alaryhmissä, kuten kuvassa 6 on esitetty. Vaikutus oli samanlainen myös ennalta määrittämättömissä alaryhmissä, mukaan lukien infarktin sijaintiin, Killip-luokkaan tai aikaisempaan MI-historiaan perustuvissa alaryhmissä. Tällaisia alaryhmäanalyysejä tulee tulkita varoen.
Kuva 6: Plavix 75 mg:n lisäämisen vaikutukset aspiriiniin yhdistettyyn ensisijaiseen päätepisteeseen COMMIT-tutkimuksen lähtötason ja samanaikaisen lääkityksen alaryhmissä
Äskettäinen sydäninfarkti, äskettäinen aivohalvaus tai todettu perifeerinen valtimotauti
CAPRIE
CAPRIE-tutkimus oli 19 185 potilaan 304 keskuksen kansainvälinen, satunnaistettu kaksoissokkoutettu rinnakkaisryhmätutkimus, jossa verrattiin Plavixia (75 mg päivässä) aspiriiniin (325 mg päivässä). Voidakseen osallistua potilailla täytyi olla: 1) äskettäin ollut sydäninfarkti (35 päivän sisällä); 2) äskettäiset iskeemisen aivohalvauksen historiat (6 kuukauden sisällä), joissa on vähintään viikon jäljellä olevia neurologisia oireita; ja/tai 3) todettu perifeerinen valtimotauti (PAD). Potilaat saivat satunnaistettua hoitoa keskimäärin 1,6 vuoden ajan (enintään 3 vuotta).
Tutkimuksen ensisijainen tulos oli aika uuden iskeemisen aivohalvauksen (kuolemaan johtavan tai ei), uuden sydäninfarktin (kuolemaan johtava tai ei) tai muun verisuonikuoleman esiintymiseen. Kuolemat, jotka eivät helposti johdu ei-vaskulaarisista syistä, luokiteltiin kaikki verisuoniperäisiksi.
Kuten taulukosta 6 käy ilmi, Plavixin lopputulostapahtumien, pääasiassa sydäninfarktin, ilmaantuvuus oli pienempi. Suhteellisen riskin kokonaisvähennys (9,8 % vs 10,6 %) oli 8,7 %, p=0,045. Samanlaiset tulokset saatiin laskettaessa kaikista syistä johtuvaa kuolleisuutta ja aivohalvauksia verisuonikuolleisuuden ja iskeemisten aivohalvausten sijaan (riskin vähennys 6,9 %). Potilailla, jotka selvisivät hengissä tutkimuksen aikana aivohalvauksesta tai sydäninfarktista, myöhempien tapahtumien ilmaantuvuus oli pienempi Plavix 75 mg -ryhmässä.
Tapahtumien yleistä määrää osoittavat käyrät on esitetty kuvassa 7. Tapahtumakäyrät erottuivat aikaisin ja jatkoivat eroaan 3 vuoden seurantajakson ajan.
Kuva 7: Kuolemaan johtaneet tai ei-kuolemaan johtavat verisuonitapahtumat CAPRIE-tutkimuksessa
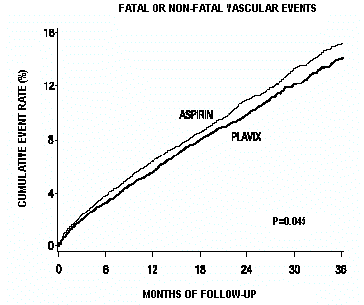
Tilastollinen merkitsevyys, joka suosi Plavix 75 mg:aa aspiriiniin verrattuna, oli marginaalinen (p=0,045). Koska aspiriini kuitenkin vähentää tehokkaasti sydän- ja verisuonitapahtumia potilailla, joilla on äskettäin ollut sydäninfarkti tai aivohalvaus, Plavix 75 mg:n vaikutus on huomattava.
CAPRIE-tutkimukseen otettiin mukaan väestö, jolla oli äskettäin MI, äskettäin aivohalvaus tai PAD. Plavix 75 mg:n teho suhteessa aspiriiniin oli heterogeeninen näissä alaryhmissä (p=0,043) (katso kuva 8). Tämä ero voi kuitenkin olla sattuma, koska CAPRIE-tutkimusta ei suunniteltu arvioimaan Plavix 75 mg:n suhteellista hyötyä aspiriiniin verrattuna yksittäisissä potilasalaryhmissä. Hyöty oli ilmeisin potilailla, jotka oli otettu mukaan ääreisvaltimotaudin vuoksi, ja vähemmän ilmeinen aivohalvauspotilailla. Potilailla, jotka otettiin mukaan tutkimukseen pelkästään äskettäisen sydäninfarktin perusteella, Plavix 75 mg ei ollut numeerisesti parempi kuin aspiriini.
Kuva 8: Hazard Ratio ja 95 % CI perustason alaryhmittäin CAPRIE-tutkimuksessa
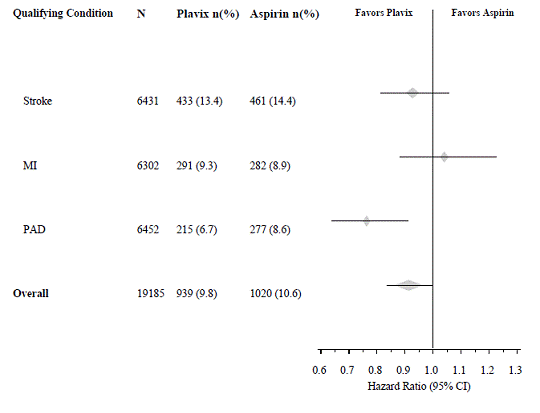
Plavix 75 mg:n ja aspiriinin yhdistelmästä ei ole osoitettua hyötyä potilailla, joilla on useita riskitekijöitä tai todettu verisuonisairaus
KARISMA
CHARISMA-tutkimus oli 15 603 henkilön satunnaistettu, kaksoissokkoutettu rinnakkaisryhmätutkimus, jossa Plavixia (75 mg päivässä) verrattiin lumelääkkeeseen iskeemisten tapahtumien ehkäisyssä potilailla, joilla oli verisuonisairaus tai useita ateroskleroosin riskitekijöitä. Kaikkia koehenkilöitä hoidettiin aspiriinilla 75-162 mg päivässä. Keskimääräinen hoidon kesto oli 23 kuukautta. Tutkimus ei onnistunut osoittamaan ensisijaisen päätetapahtuman, sydän- ja verisuonitautikuoleman, sydäninfarktin tai aivohalvauksen yhdistelmän, esiintymisen vähenemistä. Yhteensä 534 (6,9 %) potilasta Plavix-ryhmässä ja 573 (7,4 %) potilasta lumeryhmässä koki ensisijaisen lopputuloksen (p=0,22). Kaiken vaikeusasteinen verenvuoto oli yleisempää Plavixiin satunnaistetuilla koehenkilöillä.
POTILASTIEDOT
Plavix® (PLAV-iks) (klopidogreelibisulfaatti) tabletit
Lue tämä lääkitysopas ennen kuin aloitat Plavixin käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa sitä, että keskustelet lääkärisi kanssa sairaudesta tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää Plavix 75 mg:sta?
1. Plavix ei ehkä toimi yhtä hyvin ihmisillä, jotka:
- joilla on tiettyjä geneettisiä tekijöitä, jotka vaikuttavat siihen, miten keho hajottaa Plavixia. Lääkärisi voi tehdä geneettisiä testejä varmistaakseen, että Plavix sopii sinulle.
- ottaa tiettyjä lääkkeitä, erityisesti omepratsolia (Prilosec®) tai esomepratsolia (Nexium®). Lääkärisi saattaa vaihtaa lääkettä, jota käytät mahahappoongelmiin Plavix-hoidon aikana.
2. Plavix 75 mg voi aiheuttaa verenvuotoa, joka voi olla vakavaa ja voi joskus johtaa kuolemaan. Plavix on verta ohentava lääke, joka vähentää verihyytymien muodostumisen mahdollisuutta kehossasi. Kun otat Plavixia:
- saatat saada mustelmia ja verenvuotoa helpommin
- sinulla on todennäköisemmin nenäverenvuoto
- kestää kauemmin, ennen kuin verenvuodon pysähtyy
Soita lääkärillesi välittömästi, jos sinulla on jokin näistä verenvuodon merkeistä tai oireista:
- odottamaton verenvuoto tai verenvuoto, joka kestää pitkään
- verta virtsassasi (vaaleanpunainen, punainen tai ruskea virtsa)
- punaiset tai mustat ulosteet (näyttää tervalta)
- mustelmat, jotka tapahtuvat ilman tunnettua syytä tai kasvavat
- yskiä verta tai veritulppia
- oksenna verta tai oksennuksesi näyttää kahvinporolta
Älä lopeta Plavix 75 mg -valmisteen käyttöä keskustelematta sitä sinulle määränneen lääkärin kanssa. Ihmisillä, jotka lopettavat Plavix 75 mg:n käytön liian aikaisin, on suurempi riski saada sydänkohtaus tai kuolla. Jos sinun on lopetettava Plavix verenvuodon vuoksi, sydänkohtauksen riskisi voi olla suurempi.
Mikä on Plavix 75 mg?
Plavix on reseptilääke, jota käytetään sellaisten ihmisten hoitoon, joilla on jokin seuraavista:
- sydänongelmista johtuva rintakipu
- huono verenkierto jaloissa (perifeerinen valtimotauti)
- sydänkohtaus
- halvaus
Plavixia käytetään yksinään tai aspiriinin kanssa vähentämään mahdollisuuttasi saada toinen vakava sydän- tai verisuoniongelma, kuten sydänkohtaus, aivohalvaus tai veritulppa, joka voi johtaa kuolemaan.
Verihiutaleet ovat verisoluja, jotka auttavat veren hyytymistä normaalisti. Plavix 75 mg auttaa estämään verihiutaleita tarttumasta yhteen ja muodostamasta hyytymää, joka voi tukkia valtimon.
Ei tiedetä, onko Plavix 75 mg turvallinen ja tehokas lapsille.
Kuka ei saa ottaa Plavix 75 mg -valmistetta?
Älä ota Plavixia, jos:
- sinulla on tällä hetkellä verenvuotoa aiheuttava sairaus, kuten mahahaava
- olet allerginen klopidogreelille tai muille Plavixin aineosille. Katso tämän pakkausselosteen lopusta täydellinen luettelo Plavixin ainesosista.
Mitä minun tulee kertoa lääkärilleni ennen Plavix 75 mg:n ottamista?
Ennen kuin otat Plavixia, kerro lääkärillesi, jos:
- sinulla on ollut suolisto- (ruoansulatuskanavan) tai mahahaavoja
- sinulla on ollut verenvuotoongelmia
- suunnittelee leikkausta tai hammashoitoa. Katso "Kuinka minun pitäisi ottaa Plavixia?"
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako Plavix 75 mg sikiötäsi
- imetät tai aiot imettää. Ei tiedetä, erittyykö Plavix 75 mg rintamaitoon. Terveydenhuollon tarjoajan kanssa tulee tehdä päätös imetyksen välttämisestä tai lopettamisesta, kun Plavix-hoidon jatkaminen on tarpeen.
- sinulla on ollut allergia tai reaktio jollekin sairautesi hoitoon käytetylle lääkkeelle.
Kerro kaikille lääkäreille ja hammaslääkärille, että käytät Plavixia. Heidän tulee keskustella lääkärin kanssa, joka on määrännyt sinulle Plavix 75 mg -valmistetta, ennen kuin sinulle tehdään leikkausta tai invasiivista toimenpidettä.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet, reseptivapaat lääkkeet, vitamiinit ja yrttilisät.
Plavix 75 mg voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa Plavixin tehoon. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää Plavix 75 mg:sta?"
Plavix 75 mg voi lisätä muiden lääkkeiden, kuten repaglinidin (Prandin®) pitoisuuksia veressä.
Plavixin ottaminen tiettyjen muiden lääkkeiden kanssa voi lisätä verenvuotoriskiäsi.
Kerro lääkärillesi erityisesti, jos otat:
- aspiriinia, varsinkin jos sinulla on ollut aivohalvaus. Keskustele aina lääkärisi kanssa siitä, pitäisikö sinun ottaa aspiriinia yhdessä Plavix 75 mg:n kanssa sairautesi hoitamiseksi.
- Ei-steroidiset tulehduskipulääkkeet (NSAID). Pyydä lääkäriltäsi tai apteekista luettelo NSAID-lääkkeistä, jos olet epävarma.
- varfariini (Coumadin®, Jantoven®).
- selektiiviset serotoniinin takaisinoton estäjät (SSRI) ja serotoniinin norepinefriinin takaisinoton estäjät (SNRI:t). Pyydä lääkäriltäsi tai apteekista luettelo SSRI- tai SNRI-lääkkeistä, jos et ole varma.
- rifampiini (käytetään vaikeiden infektioiden hoitoon)
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi lääkärillesi tai apteekkiin, kun saat uuden lääkkeen.
Kuinka minun pitäisi ottaa Plavixia?
- Ota Plavixia juuri sen verran kuin lääkärisi on määrännyt.
- Älä muuta annostasi tai lopeta Plavix 75 mg -valmisteen käyttöä keskustelematta ensin lääkärin kanssa. Plavixin lopettaminen voi lisätä sydänkohtauksen tai aivohalvauksen riskiä.
- Ota Plavix 75 mg aspiriinin kanssa lääkärisi ohjeiden mukaan.
- Jos unohdat ottaa annoksen, ota Plavix heti kun muistat. Jos on melkein aika ottaa seuraava annos, jätä unohtunut annos väliin. Ota seuraava annos normaaliin aikaan. Älä ota kahta Plavix 75 mg -annosta samanaikaisesti, ellei lääkärisi niin määrää.
- Jos otat liikaa Plavixia, soita heti lääkärillesi tai mene lähimpään ensiapuun.
- Keskustele lääkärisi kanssa Plavix 75 mg -hoidon lopettamisesta ennen leikkausta. Lääkärisi saattaa kehottaa sinua lopettamaan Plavix 75 mg -valmisteen käytön vähintään 5 päivää ennen leikkausta välttääksesi liiallisen verenvuodon leikkauksen aikana.
Mitkä ovat Plavixin mahdolliset sivuvaikutukset?
Plavix 75 mg voi aiheuttaa vakavia sivuvaikutuksia, kuten:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää Plavixista?"
- Veren hyytymisongelma nimeltä tromboottinen trombosytopeeninen purppura (TTP). TTP voi tapahtua Plavix 75 mg:n kanssa, joskus lyhyen ajan kuluttua (alle 2 viikon kuluttua). TTP on veren hyytymisongelma, jossa verihyytymiä muodostuu verisuonissa; ja voi tapahtua missä tahansa kehossa. TTP on hoidettava välittömästi sairaalassa, koska se voi aiheuttaa kuoleman. Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin näistä oireista, eikä niitä voida selittää muulla sairaudella:
- violetit täplät (kutsutaan purppuraksi) iholla tai suussa (limakalvoilla) ihon alaisen verenvuodon vuoksi
- ihosi tai silmänvalkuaisesi ovat keltaisia (keltatauti)
- tunnet olevasi väsynyt tai heikko
- ihosi näyttää hyvin vaalealta
- kuume
- nopea syke tai hengenahdistus
- päänsärky
- puhe muuttuu
- hämmennystä
- kooma
- aivohalvaus
- kohtaus
- pieni määrä virtsaa tai virtsa, joka on vaaleanpunaista tai jossa on verta
- vatsan alueen (vatsan) kipu
- pahoinvointia, oksentelua tai ripulia
- näkö muuttuu
- jatkuvat matalan verensokerin oireet
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä. Kerro lääkärillesi, jos saat Plavix-hoidon aikana allergisen reaktion, mukaan lukien ihoreaktiot.
Nämä eivät ole kaikkia Plavixin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää Plavix 75 mg?
- Säilytä Plavix 75 mg 59 °F - 86 °F (15 °C - 30 °C) lämpötilassa.
Pidä Plavix ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä Plavixista
Lääkkeitä käytetään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä ota Plavix 75 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna Plavixia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas tiivistää tärkeimmät tiedot Plavixista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Kysy lääkäriltäsi tai apteekista lisätietoja Plavixista, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta www.sanofi-aventis.us tai www.bms.com tai soittamalla numeroon 1-800-321-1335.
Mitä ainesosia Plavix 75 mg sisältää?
Aktiivinen ainesosa: klopidogreelibisulfaatti
Inaktiiviset ainesosat:
Tabletti: hydrattu risiiniöljy, hydroksipropyyliselluloosa, mannitoli, mikrokiteinen selluloosa, polyetyleeniglykoli 6000
Kalvopinnoite: rautaoksidi, hypromelloosi 2910, laktoosimonohydraatti, titaanidioksidi, triasetiini, karnaubavaha
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
