Cordarone 100mg, 50mg Amiodarone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Cordarone 100mg on ja miten sitä käytetään?
Cordarone 100mg IV on reseptilääke, jota käytetään sydämen epäsäännöllisen rytmin (kammioarytmioiden) oireiden hoitoon.
- Cordarone IV:tä voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Cordarone 50 mg IV kuuluu lääkeryhmään nimeltä Antidysrythmisc, III.
Mitkä ovat Cordarone 100 mg:n mahdolliset sivuvaikutukset?
Cordarone 100 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hengenahdistus,
- pyörtyminen,
- nopeat tai epäsäännölliset sydämenlyönnit,
- rintakipu,
- hengityksen vinkuminen ja
- vaikeuksia hengittää
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Cordarone 100mg IV:n yleisimmät sivuvaikutukset ovat:
- matala verenpaine (hypotensio),
- hidas syke,
- sydämenpysähdys,
- pahoinvointi,
- kuume,
- sydämen vajaatoiminta,
- epänormaali sydämen rytmi,
- kardiogeeninen shokki ja
- maksan toimintakokeiden poikkeavuudet
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Cordaronen mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
KESKUU-, MAKSA- JA SYDÄNMYRKYLLISYYS
CORDARONE 100mg on tarkoitettu käytettäväksi vain potilailla, joilla on osoitettu hengenvaarallisia rytmihäiriöitä, koska sen käyttöön liittyy merkittävää toksisuutta (katso KÄYTTÖAIHEET JA KÄYTTÖ).
CORDARONE voi aiheuttaa keuhkotoksisuutta (yliherkkyyskeuhkotulehdus tai interstitiaalinen/alveolaarinen keuhkokuume), joka on johtanut kliinisesti ilmenevään sairauteen jopa 17 %:lla joissakin potilassarjoissa. Keuhkotoksisuus on ollut kohtalokas noin 10 % ajasta. Ota lähtötilanteen rintakehän röntgenkuvaus ja keuhkojen toimintatestit, mukaan lukien diffuusiokapasiteetti, kun CORDARONE 100 mg -hoito aloitetaan. Toista historia, fyysinen koe ja rintakehän röntgenkuvaus 3–6 kuukauden välein [katso VAROITUKSET JA VAROTOIMET].
CORDARONE voi aiheuttaa maksatoksisuutta, joka voi olla hengenvaarallinen. Hanki lähtötaso ja säännölliset maksan transaminaasiarvot ja keskeytä tai pienennä annosta, jos nousu ylittää kolme kertaa normaalin tai kaksinkertaistuu potilaalla, jonka lähtötaso on kohonnut. Lopeta CORDARONE-hoito, jos potilaalla ilmenee kliinisen maksavaurion merkkejä tai oireita (katso VAROITUKSET JA VAROTOIMET].
CORDARONE voi pahentaa rytmihäiriöitä. Aloita CORDARONE 50 mg kliinisessä ympäristössä, jossa jatkuvat elektrokardiogrammit ja sydämen elvytys ovat saatavilla [katso VAROITUKSET JA VAROTOIMET].
KUVAUS
CORDARONE (amiodaroni HCl) on rytmihäiriölääke, joka on saatavana suun kautta annettavaksi vaaleanpunaisina, jakouurteisina tabletteina, jotka sisältävät 200 mg amiodaronihydrokloridia. Inaktiiviset ainesosat ovat kolloidinen piidioksidi, laktoosi, magnesiumstearaatti, povidoni, tärkkelys ja FD&C Red 40. CORDARONE on bentsofuraanijohdannainen: 2-butyyli-3-bentsofuranyyli-4-[2-(dietyyliamino)-etoksi]-3, 5-dijodifenyyliketonihydrokloridi.
Rakennekaava on seuraava:
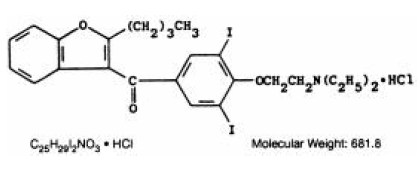
Amiodaroni HCl on valkoinen tai kermanvärinen kiteinen jauhe. Se liukenee heikosti veteen, liukenee alkoholiin ja liukenee vapaasti kloroformiin. Se sisältää 37,3 painoprosenttia jodia.
INDIKAATIOT
CORDARONE on tarkoitettu dokumentoidun, hengenvaarallisen toistuvan kammiovärinän ja hengenvaarallisen toistuvan hemodynaamisesti epästabiilin takykardian hoitoon aikuisilla, jotka eivät ole reagoineet riittäviin annoksiin muita saatavilla olevia rytmihäiriölääkkeitä tai kun vaihtoehtoisia lääkkeitä ei voida sietää.
ANNOSTELU JA HALLINNOINTI
Annostus on yksilöitävä rytmihäiriön vaikeusasteen ja vasteen mukaan. Käytä pienintä tehokasta annosta. Hanki lähtötilanteen rintakehän röntgenkuvaus, keuhkojen toimintakokeet, kilpirauhasen toimintakokeet ja maksan aminotransferaasit. Korjaa hypokalemia, hypomagnesemia ja hypokalsemia ennen hoidon aloittamista
Suositeltu annostus
Aloita hoito kyllästysannoksilla 800–1600 mg/vrk, kunnes ensimmäinen terapeuttinen vaste saavutetaan (yleensä 1–3 viikkoa). Kun riittävä rytmihäiriön hallinta on saavutettu tai jos sivuvaikutukset tulevat esiin, pienennä CORDARONE 50 mg annosta 600-800 mg:aan/vrk yhden kuukauden ajan ja sitten ylläpitoannokseen, tavallisesti 400 mg/vrk.
Hallinto
Anna CORDARONEa johdonmukaisesti aterioiden suhteen [katso KLIININEN FARMAKOLOGIA ]. CORDARONE-valmisteen antoa jaettuina annoksina aterioiden yhteydessä suositellaan 1000 mg:n tai suuremmille vuorokausiannoksille tai kun ilmenee maha-suolikanavan intoleranssia.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
200 mg tabletit: pyöreät, kuperapintaiset, vaaleanpunaiset tabletit, joiden toisella puolella on kohotettu ”C” ja merkintä ”200”, toisella puolella jakouurre sekä merkinnät ”WYETH” ja ”4188”.
Varastointi ja käsittely
CORDARONE® (amiodaroni HCl) -tabletit ovat saatavilla 60 tabletin pulloissa seuraavasti:
200 mg , NDC 0008-4188-04, pyöreä, kuperapintainen, vaaleanpunainen tabletti, jonka toisella puolella on kohotettu "C" ja merkintä "200", toisella puolella jakouurre ja merkinnät "WYETH" ja "4188".
Säilytettävä tiiviisti suljettuna.
Säilytä kontrolloidussa huoneenlämmössä, 20–25 °C (68–77 °F).
Suojaa valolta.
Annostele valonkestävään, tiiviiseen astiaan.
Valmistaja Sanofi Winthrop Industrie, 1, rue de la Vierge, 33440 Ambares, Ranska. Jakelija: Wyeth Pharmaceuticals Inc., Pfizer Inc:n tytäryhtiö, Philadelphia, PA 19101. Tarkistettu: lokakuu 2018
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia on kuvattu yksityiskohtaisemmin reseptitietojen muissa osissa:
- Keuhkojen toksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Maksavaurio [katso VAROITUKSET JA VAROTOIMET ]
- Pahentunut rytmihäiriö [katso VAROITUKSET JA VAROTOIMET ]
- Näön heikkeneminen ja näön menetys [katso VAROITUKSET JA VAROTOIMET ]
- Kilpirauhasen poikkeavuudet [katso VAROITUKSET JA VAROTOIMET ]
- Bradykardia [katso VAROITUKSET JA VAROTOIMET ]
- Perifeerinen neuropatia [katso VAROITUKSET JA VAROTOIMET ]
- Valoherkkyys ja ihon värjäytyminen [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Tavallisella ylläpitoannoksella (400 mg/vrk) ja sitä suuremmalla CORDARONE 100 mg aiheuttaa haittavaikutuksia noin kolmelle neljäsosalle kaikista potilaista, mikä johtaa hoidon keskeyttämiseen 7–18 %:lla.
Tutkimuksissa, joihin osallistui lähes 5 000 potilasta, joita hoidettiin avoimissa Yhdysvalloissa tehdyissä tutkimuksissa ja julkaistuissa CORDARONE-hoitoraporteissa, haittavaikutuksia, jotka vaativat useimmiten CORDARONE-hoidon lopettamista, olivat keuhkoinfiltraatit tai -fibroosi, kohtauksellinen kammiotakykardia, kongestiivinen sydämen vajaatoiminta ja maksaentsyymien nousu. Muita harvemmin keskeyttäviä oireita olivat näköhäiriöt, valoherkkyys, ihon sinertyminen, kilpirauhasen liikatoiminta ja kilpirauhasen vajaatoiminta.
Seuraavat sivuvaikutusten määrät perustuvat retrospektiiviseen tutkimukseen, jossa oli 241 potilasta, joita hoidettiin 2–1 515 päivää (keskiarvo 441,3 päivää):
Kilpirauhanen
Yleiset: Kilpirauhasen vajaatoiminta, kilpirauhasen liikatoiminta.
Kardiovaskulaarinen
Yleiset: Kongestiivinen sydämen vajaatoiminta, sydämen rytmihäiriöt, SA-solmun toimintahäiriö.
Ruoansulatuskanava
Hyvin yleiset: pahoinvointi, oksentelu.
Yleiset: Ummetus, anoreksia, vatsakipu.
Ihotauti
Yleinen: Aurinkoihottuma/valoherkkyys.
Neurologinen
Yleiset: Pahoinvointi ja väsymys, vapina/epänormaalit tahattomat liikkeet, koordinaation puute, epänormaali kävely/ataksia, huimaus, parestesiat, libidon heikkeneminen, unettomuus, päänsärky, unihäiriöt.
Oftalminen
Yleiset: Näköhäiriöt.
Maksa
Yleiset: Epänormaalit maksan toimintakokeet, epäspesifiset maksahäiriöt.
Hengitys
Yleiset: Keuhkotulehdus tai fibroosi.
muu
Yleiset: punoitus, epänormaali maku ja haju, turvotus, epänormaali syljeneritys, hyytymishäiriöt.
Melko harvinainen: ihon sinertyminen, ihottuma, spontaani mustelma, hiustenlähtö, hypotensio ja sydämen johtumishäiriöt.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu CORDARONEen hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Hematologinen hemolyyttinen anemia, aplastinen anemia, pansytopenia, neutropenia, trombosytopenia, agranulosytoosi, granulooma.
Immuuni : anafylaktinen/anafylaktoidinen reaktio (mukaan lukien sokki), angioedeema.
Neurologinen : pseudotumor cerebri, parkinsonin oireet, kuten akinesia ja bradykinesia (joskus korjaantuu hoidon lopettamisen jälkeen), demyelinisoiva polyneuropatia.
Psykiatrinen : hallusinaatiot, sekavuustila, desorientaatio, delirium.
Sydämen : hypotensio (joskus kuolemaan johtava), poskiontelopysähdys.
Hengitys : eosinofiilinen keuhkokuume, akuutti hengitysvaikeusoireyhtymä leikkauksen jälkeen, bronkospasmi, obliteroiva keuhkoputkentulehdus, keuhkoalveolaarinen verenvuoto, keuhkopussin effuusio, keuhkopussin tulehdus.
Ruoansulatuskanava : haimatulehdus, akuutti haimatulehdus.
Maksa : hepatiitti, kolestaattinen hepatiitti, kirroosi.
Ihon ja ihonalaisten kudosten häiriöt nokkosihottuma, toksinen epidermaalinen nekrolyysi (joskus kuolemaan johtava), erythema multiforme, Stevens-Johnsonin oireyhtymä, eksfoliatiivinen ihotulehdus, rakkula ihottuma, lääkeihottuma, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), ekseema, kutina, ihosyöpä, lupuksen kaltainen oireyhtymä.
Tuki- ja liikuntaelimistön : myopatia, lihasheikkous, rabdomyolyysi.
Munuaiset : munuaisten vajaatoiminta, munuaisten vajaatoiminta, akuutti munuaisten vajaatoiminta.
Lisääntyvä : lisäkivestulehdus, impotenssi.
Runko kokonaisuutena : kuume, suun kuivuminen.
Endokriininen ja metabolinen : kilpirauhasen kyhmyt / kilpirauhassyöpä, epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymä (SIADH).
Vaskulaarinen : vaskuliitti.
HUUMEIDEN VUOROVAIKUTUKSET
Amiodaronin pitkän puoliintumisajan vuoksi lääkeinteraktioiden odotetaan jatkuvan viikkoja tai kuukausia amiodaronin käytön lopettamisen jälkeen.
Lääkkeiden yhteisvaikutukset amiodaronin kanssa on kuvattu alla olevassa taulukossa 1.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Haitallisten vaikutusten pysyvyys
Amiodaronin pitkän puoliintumisajan (15-142 päivää) ja sen aktiivisen metaboliitin desetyyliamiodaronin (14-75 päivää) vuoksi haittavaikutukset ja lääkeinteraktiot voivat jatkua useita viikkoja amiodaronin käytön lopettamisen jälkeen (ks. KLIININEN FARMAKOLOGIA ].
Keuhkojen toksisuus
CORDARONE voi aiheuttaa yskän ja etenevän hengenahdistuksen kliinisen oireyhtymän, johon liittyy keuhkotoksisuuteen liittyviä toiminnallisia, radiografisia, galliumskannaus- ja patologisia tietoja. CORDARONEen aiheuttama sekundaarinen keuhkotoksisuus voi johtua joko epäsuorasta tai suorasta toksisuudesta, jota edustaa yliherkkyyskeuhkotulehdus (mukaan lukien eosinofiilinen keuhkokuume) tai interstitiaalinen/alveolaarinen pneumoniitti. Keuhkotoksisuuden on raportoitu olevan jopa 17 %, ja se on tappava noin 10 %:ssa tapauksista. Ota lähtötilanteen rintakehän röntgenkuvaus ja keuhkojen toimintatestit, mukaan lukien diffuusiokapasiteetti, kun CORDARONE 50 mg -hoito aloitetaan. Toista historia, fyysinen koe ja rintakehän röntgenkuvaus 3–6 kuukauden välein tai jos oireita ilmenee. Harkitse vaihtoehtoista rytmihäiriölääkitystä, jos potilaalla ilmenee keuhkotoksisuuden merkkejä tai oireita. Prednisoni 40–60 mg/vrk, jota pienennetään useiden viikkojen ajan, voi olla hyödyllinen keuhkotoksisuuden hoidossa.
Aikuisten hengitysvaikeusoireyhtymä (ARDS)
Leikkauksen jälkeen ARDS:n esiintymistä on raportoitu CORDARONE-hoitoa saavilla potilailla, joille on tehty joko sydänleikkaus tai muu kuin sydänleikkaus. Vaikka potilaat reagoivat yleensä hyvin voimakkaaseen hengityshoitoon, harvoissa tapauksissa lopputulos on ollut kohtalokas.
Maksavaurio
Oireetonta maksaentsyymiarvojen nousua havaitaan usein, mutta CORDARONE 100 mg voi aiheuttaa hengenvaarallisen maksavaurion. Histologia on muistuttanut alkoholihepatiitin tai kirroosin histologiaa. Hanki lähtötilanne ja jaksolliset maksan transaminaasit. Jos transaminaasit ylittävät kolme kertaa normaalit tai kaksinkertaistuvat potilaalla, jonka lähtötaso on kohonnut, keskeytä CORDARONE 100 mg:n annosta tai pienennä annosta, hanki seurantatestit ja aloita asianmukainen hoito.
Pahentunut rytmihäiriö
CORDARONE 100 mg voi pahentaa ilmenevää rytmihäiriötä noin 2–5 %:lla potilaista tai aiheuttaa uutta kammiovärinää, lakkaamatonta kammiotakykardiaa, lisääntynyttä vastustuskykyä kardioversiolle ja polymorfista kammiotakykardiaa, joka liittyy QTc-ajan pidentymiseen (Torsade de Pointes [TdP]).
Korjaa hypokalemia, hypomagnesemia ja hypokalsemia ennen CORDARONE-hoidon aloittamista, koska nämä häiriöt voivat liioitella QTc-ajan pidentymistä ja lisätä TdP:n mahdollisuutta. Kiinnitä erityistä huomiota elektrolyytti- ja happo-emästasapainoon potilailla, joilla on vaikea tai pitkittynyt ripuli tai jotka saavat elektrolyyttitasoihin vaikuttavia lääkkeitä, kuten diureetteja, laksatiiveja, systeemisiä kortikosteroideja tai amfoterisiini B:tä.
Näön heikkeneminen ja näön menetys
Optinen neuropatia ja optinen hermotulehdus
Amiodaronilla hoidetuilla potilailla on raportoitu optista neuropatiaa ja näköhermotulehdusta, jotka yleensä johtavat näön heikkenemiseen ja joskus pysyvään sokeuteen, ja niitä voi esiintyä milloin tahansa hoidon aikana. Jos näön heikkenemisen oireita, kuten muutoksia näöntarkkuudessa ja perifeerisen näön heikkenemistä, ilmaantuu, harkitse CORDARONE 100 mg -hoidon lopettamista ja hakeudu välittömästi silmätutkimukseen. Säännöllinen oftalminen tutkimus, mukaan lukien silmänpohjan tähystys ja rakolamppututkimus, on suositeltavaa CORDARONE-hoidon aikana [ks. HAITTAVAIKUTUKSET ].
Sarveiskalvon mikrojäämät
Sarveiskalvon mikrokertymiä esiintyy useimmilla CORDARONE-hoitoa saaneilla aikuisilla. Ne havaitaan yleensä vain rakolamppututkimuksella, mutta ne aiheuttavat oireita, kuten näköhaloja tai näön hämärtymistä jopa 10 %:lla potilaista. Sarveiskalvon mikrokertymät palautuvat, kun annosta pienennetään tai hoito lopetetaan. Oireettomat mikrosaostumat eivät yksinään ole syy annoksen pienentämiseen tai hoidon lopettamiseen [katso HAITTAVAIKUTUKSET ].
Kilpirauhasen poikkeavuudet
CORDARONE 50 mg estää tyroksiinin (T4) perifeeristä konversiota trijodityroniiniksi (T3) ja voi aiheuttaa kohonneita tyroksiinipitoisuuksia, alentuneita T3-tasoja ja kohottaa inaktiivisen käänteisen T3:n (rT3) tasoa kliinisesti eutyreoosipotilailla. CORDARONE 50 mg voi aiheuttaa joko kilpirauhasen vajaatoimintaa (raportoitu jopa 10 %:lla potilaista) tai hypertyreoosia (noin 2 %:lla potilaista). Kilpirauhasen toimintaa on seurattava ennen hoitoa ja määräajoin sen jälkeen, erityisesti iäkkäillä potilailla ja kaikilla potilailla, joilla on ollut kilpirauhasen kyhmyjä, struumaa tai muita kilpirauhasen toimintahäiriöitä.
Kilpirauhasen liikatoiminta voi aiheuttaa rytmihäiriön läpimurron. Jos uusia rytmihäiriön merkkejä ilmaantuu, kilpirauhasen liikatoiminnan mahdollisuus on otettava huomioon. Kilpirauhasen liikatoiminnan oireiden hoitoon voi olla tarpeen käyttää kilpirauhaslääkkeitä, beeta-adrenergisiä salpaajia, tilapäistä kortikosteroidihoitoa. Kilpirauhasen vastaisten lääkkeiden vaikutus voi viivästyä amiodaronin aiheuttamassa tyrotoksikoosissa, koska rauhaseen on varastoitunut suuria määriä ennalta muodostuneita kilpirauhashormoneja. Radioaktiivinen jodihoito on vasta-aiheista, koska amiodaronin aiheuttamaan kilpirauhasen liikatoimintaan liittyy alhainen radiojodin otto. CORDARONE-indusoitua kilpirauhasen liikatoimintaa voi seurata ohimenevä kilpirauhasen vajaatoiminta.
Kilpirauhasen vajaatoiminta voi olla ensisijaista tai aikaisemman amiodaronin aiheuttaman hypertyreoosin paranemisen jälkeen. Vakavaa kilpirauhasen vajaatoimintaa ja myksedeemakoomaa, joskus kuolemaan johtaneita, on raportoitu amiodaronihoidon yhteydessä. Joillakin kliinisesti hypotyreoosi amiodaronihoitoa saavilla potilailla vapaan tyroksiiniindeksin arvot voivat olla normaaleja. Hallitse kilpirauhasen vajaatoimintaa pienentämällä CORDARONE- ja kilpirauhashormonilisän annosta tai lopettamalla niiden käyttö.
Bradykardia
CORDARONE aiheuttaa oireenmukaista bradykardiaa tai poskiontelopysähdyksen ja pakopesäkkeiden tukahduttamista 2–4 %:lla potilaista. Riskiä lisäävät elektrolyyttiset häiriöt tai samanaikainen rytmihäiriölääkkeiden tai negatiivisten kronotrooppien käyttö [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Bradykardia voi vaatia sydämentahdistimen nopeuden hallintaan.
Markkinoille tulon jälkeen on raportoitu oireista bradykardiaa, joista osa vaati sydämentahdistimen asentamista ja ainakin yksi kuolemaan johtanut tapaus, kun ledipasviiri/sofosbuviiri tai sofosbuviiri ja simepreviiri aloitettiin amiodaronia saavilla potilailla. Bradykardia ilmaantui yleensä tunneista päiviin, mutta joissakin tapauksissa jopa 2 viikkoa viruslääkityksen aloittamisen jälkeen. Bradykardia parani yleensä viruslääkityksen lopettamisen jälkeen. Tämän vaikutuksen mekanismia ei tunneta. Seuraa sykettä potilailla, jotka käyttävät tai äskettäin lopettavat amiodaronin käytön aloittaessaan viruslääkityksen [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Istutettavat sydänlaitteet
Jos potilaalla on implantoitu defibrillaattori tai sydämentahdistin, rytmihäiriölääkkeiden jatkuva antaminen voi vaikuttaa tahdistus- tai defibrillointikynnyksiin. Siksi tahdistus- ja defibrillointikynnykset on arvioitava amiodaronihoidon alussa ja sen aikana.
Sikiön toksisuus
CORDARONE voi vahingoittaa sikiötä, kun sitä annetaan raskaana olevalle naiselle. Sikiön altistuminen voi lisätä sydän-, kilpirauhasen-, hermoston kehitys-, neurologisten ja kasvuvaikutusten mahdollisuutta vastasyntyneellä [ks. Käyttö tietyissä populaatioissa ].
Perifeerinen neuropatia
CORDARONEen jatkuva antaminen voi johtaa perifeeriseen neuropatiaan, joka ei välttämättä parane, kun CORDARONE-hoito lopetetaan.
Valoherkkyys ja ihon värimuutos
CORDARONE aiheuttaa valoherkkyyttä noin 10 %:lla potilaista; jonkin verran suojaa voidaan tarjota auringonsuojavoiteet tai suojavaatteet. Pitkäaikaisen hoidon aikana paljastunut iho saattaa muuttua siniharmaaksi. Riski voi kasvaa potilailla, joilla on vaalea iho tai jotka altistuvat liiallisesti auringolle. Lääkkeen käytön lopettamisen jälkeen saattaa ilmetä jonkin verran värjäytymistä.
Leikkaus
Haihtuvat anestesia-aineet
CORDARONE 100 mg -hoitoa saavat potilaat voivat olla herkempiä halogenoitujen inhalaatiopuudutusaineiden sydänlihasta lamaaville ja johtumisvaikutuksille.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Kerro raskaana oleville naisille mahdollisista riskeistä sikiölle. Kehota lisääntymiskykyisiä naisia ilmoittamaan lääkkeen määrääjälleen tunnetusta tai epäillystä raskaudesta [katso Käyttö tietyissä populaatioissa ].
Kerro naisille, että imettämistä ei suositella CORDARONE-hoidon aikana [katso Käyttö tietyissä populaatioissa ].
Neuvo potilaita välttämään greippimehua ja mäkikuismaa.
Neuvo potilaita hakeutumaan lääkärin hoitoon, jos he kokevat keuhkomyrkytysoireita, pahenevan rytmihäiriön, bradykardian, näkövajeen tai kilpirauhasen vajaatoimintaa tai hypertyreoosia.
Tämän tuotteen etiketti on saatettu päivittää. Katso täydelliset reseptitiedot osoitteesta www.pfizer.com.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Amiodaronihydrokloridi liittyi tilastollisesti merkitsevään, annoksesta riippuvaiseen lisääntymiseen kilpirauhaskasvainten (follikulaarinen adenooman ja/tai karsinooman) ilmaantuvuus rotilla. Kilpirauhaskasvainten ilmaantuvuus oli suurempi kuin verrokki pienimmällä testatulla annostasolla eli 5 mg/kg/vrk (noin 0,08 kertaa ihmisen suurin suositeltu ylläpitoannos*).
CORDARONElla tehdyt mutageenisuustutkimukset (Ames-, mikrotuma- ja lysogeenisuustestit) olivat negatiivisia.
Tutkimuksessa, jossa uros- ja naarasrotille annettiin amiodaronihydrokloridia 9 viikkoa ennen parittelua, havaittiin hedelmällisyyden heikkeneminen annostasolla 90 mg/kg/vrk (noin 1,4 kertaa ihmisen suurin suositeltu ylläpitoannos*).
*600 mg 60 kg painavalla potilaalla (annosta verrataan kehon pinta-alaan)
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot markkinoille tulon jälkeisistä raporteista ja julkaistuista tapaussarjoista osoittavat, että amiodaronin käyttö raskaana olevilla naisilla voi lisätä riskiä sikiöön kohdistuville haittavaikutuksille, mukaan lukien vastasyntyneen hypo- ja hypertyreoosi, vastasyntyneen bradykardia, hermoston kehityshäiriöt, ennenaikainen synnytys ja sikiön kasvun rajoittuminen. Amiodaroni ja sen metaboliitti desetyyliamiodaroni (DEA) läpäisevät istukan. Hoitamattomat taustalla olevat rytmihäiriöt, mukaan lukien kammioperäiset rytmihäiriöt, raskauden aikana, aiheuttavat riskin äidille ja sikiölle (ks. Kliiniset näkökohdat ). Eläinkokeissa amiodaronin antaminen kaneille, rotille ja hiirille organogeneesin aikana johti alkio- ja sikiötoksisuuteen annoksilla, jotka olivat pienempiä kuin ihmisille suositeltu enimmäisylläpitoannos (ks. Data ). Kerro raskaana oleville naisille mahdollisista riskeistä sikiölle.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %.
Kliiniset näkökohdat
Äidin ja tai alkion/sikiön sairauteen liittyvä riski
Ventrikulaarisen takykardian ilmaantuvuus lisääntyy ja voi olla oireellista raskauden aikana. Kammiorytmihäiriöitä esiintyy useimmiten raskaana olevilla naisilla, joilla on taustalla kardiomyopatia, synnynnäinen sydänsairaus, sydänläppäsairaus tai mitraaliläpän esiinluiskahdus. Useimmat takykardiajaksot alkavat kohdunulkoisella lyönnillä, ja siksi rytmihäiriöjaksojen esiintyminen voi lisääntyä raskauden aikana johtuen lisääntyneestä taipumuksesta kohdunulkoiseen toimintaan. Rytmihäiriöitä voi esiintyä myös raskauden aikana, koska terapeuttisia hoitotasoja voi olla vaikea ylläpitää lisääntyneen jakautumistilavuuden ja lisääntyneen lääkeaineenvaihdunnan vuoksi, joka on ominaista raskaana olevalle olomuodolle.
Sikiön/vastasyntyneen haittavaikutukset
Amiodaronin ja sen metaboliitin on osoitettu läpäisevän istukan. Äidin amiodaronin käyttöön raskauden aikana liittyviä haitallisia sikiövaikutuksia voivat olla vastasyntyneen bradykardia, QT-ajan piteneminen ja jaksoittaiset kammion ekstrasystolat, vastasyntyneen kilpirauhasen vajaatoiminta (johon liittyy struumaa tai ilman), joka on todettu synnytystä edeltävästi tai vastasyntyneellä ja raportoitu jopa muutaman päivän altistuksen jälkeen, vastasyntyneen hypertyroksinemia, kilpirauhasen toiminnasta riippumattomat hermoston kehityksen poikkeavuudet, mukaan lukien puheen viivästyminen ja vaikeudet kirjoitetun kielen ja laskutaidon kanssa, viivästynyt motorinen kehitys ja ataksia, nystagmus synkronisella pään titubaatiolla, sikiön kasvun hidastuminen ja ennenaikainen synnytys. Tarkkaile vastasyntynyttä kilpirauhashäiriön ja sydämen rytmihäiriöiden merkkien ja oireiden varalta.
Työ ja toimitus
Rytmihäiriöiden riski voi lisääntyä synnytyksen ja synnytyksen aikana. CORDARONE-hoitoa saaneita potilaita tulee seurata jatkuvasti synnytyksen ja synnytyksen aikana [ks VAROITUKSET JA VAROTOIMET ].
Data
Eläinten tiedot
Tiineillä rotilla ja kaniineilla organogeneesin aikana amiodaronihydrokloridi annoksina 25 mg/kg/vrk (noin 0,4-kertainen ja vastaavasti 0,9-kertainen ihmisen enimmäisylläpitoannos*) ei vaikuttanut haitallisesti sikiöön. Kanilla 75 mg/kg/vrk (noin 2,7 kertaa ihmisen suurin suositeltu ylläpitoannos*) aiheutti abortin yli 90 %:lle eläimistä. Rotilla 50 mg/kg/vrk tai suuremmat annokset liittyivät lievään kivesten siirtymiseen ja joidenkin kallon ja sormusluiden epätäydellisen luutumisen lisääntymiseen. 100 mg/kg/päivä tai enemmän sikiön painot laskivat; 200 mg/kg/vrk sikiön resorption ilmaantuvuus lisääntyi. (Nämä annokset rotilla ovat noin 0,8, 1,6 ja 3,2 kertaa suuremmat ihmisille suositellut ylläpitoannokset*) Haitallisia vaikutuksia sikiön kasvuun ja eloonjäämiseen havaittiin myös yhdellä kahdesta hiirikannasta annoksella 5 mg/kg/vrk ( noin 0,04 kertaa ihmisen suurin suositeltu ylläpitoannos*).
*600 mg 60 kg painavalla potilaalla (annoksia verrataan kehon pinta-alaan)
Imetys
Riskien yhteenveto
Amiodaronia ja yhtä sen tärkeimmistä metaboliiteista, DEA:ta, on äidinmaidossa 3,5–45 % äidin painoon mukautetusta amiodaronin annoksesta. Imetetyillä imeväisillä on kilpirauhasen vajaatoimintaa ja bradykardiaa, vaikka on epäselvää, johtuvatko nämä vaikutukset amiodaronialtistumisesta äidinmaidossa. Imetystä ei suositella CORDARONE-hoidon aikana [katso VAROITUKSET JA VAROTOIMET ].
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Eläinten hedelmällisyystutkimusten perusteella CORDARONE saattaa heikentää naisten ja miesten hedelmällisyyttä. Ei tiedetä, onko tämä vaikutus palautuva. [katso Ei-kliininen toksikologia ].
Käyttö lapsille
CORDARONE-valmisteen turvallisuutta ja tehokkuutta lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
Normaalit yli 65-vuotiaat koehenkilöt osoittavat pienemmät puhdistumat ja pidentynyt lääkkeen puoliintumisaika kuin nuoremmilla [ks. KLIININEN FARMAKOLOGIA ]. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
YLIANNOSTUS
On ollut tapauksia, joista osa on johtanut kuolemaan, CORDARONE 50 mg:n yliannostustapauksia.
Seuraa potilaan sydämen rytmiä ja verenpainetta, ja jos bradykardiaa ilmenee, voidaan käyttää β-adrenergistä agonistia tai sydämentahdistinta. Hoida hypotensiota riittämättömällä kudosperfuusiolla positiivisilla inotrooppisilla ja vasopressoreilla aineilla. CORDARONE 50 mg tai sen metaboliitti eivät ole dialysoitavissa.
VASTA-AIHEET
- Kardiogeeninen sokki.
- Sairas sinus-oireyhtymä, toisen tai kolmannen asteen eteiskammiokatkos, bradykardia, joka johtaa pyörtymiseen ilman toimivaa tahdistinta.
- Tunnettu yliherkkyys lääkkeelle tai jollekin sen aineosalle, mukaan lukien jodille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Amiodaronia pidetään luokan III rytmihäiriölääkkeenä, mutta sillä on kaikkien neljän Vaughan Williams -luokan sähköfysiologisia ominaisuuksia. Kuten luokan I lääkkeet, amiodaroni salpaa natriumkanavia nopeilla tahdistustaajuuksilla, ja luokan II lääkkeiden tavoin amiodaronilla on ei-kilpaileva antisympaattinen vaikutus. Yksi sen päävaikutuksista pitkäaikaisessa käytössä on sydämen toimintapotentiaalin pidentäminen, luokan III vaikutus. Amiodaronin negatiivinen kronotrooppinen vaikutus solmukudoksissa on samanlainen kuin luokan IV lääkkeiden vaikutus. Natriumkanavien salpaamisen lisäksi amiodaroni estää sydänlihaksen kaliumkanavia, mikä osaltaan hidastaa johtumista ja pidentää tulenkestävyyttä. Antisympaattinen vaikutus ja kalsium- ja kaliumkanavien esto ovat vastuussa negatiivisista dromotrooppisista vaikutuksista sinussolmukkeeseen sekä johtumisen hidastumisesta ja refraktorikyvyn pidentämisestä eteiskammiosolmukkeessa (AV). Sen verisuonia laajentava vaikutus voi vähentää sydämen työmäärää ja siten sydänlihaksen hapenkulutusta.
CORDARONE pidentää kaikkien sydämen säikeiden toimintapotentiaalin kestoa ja vähentää samalla minimaalista dV/dt:tä (aktiivisuuspotentiaalin maksimi ylösiskunopeus). Tulenkestävä aika pitenee kaikissa sydänkudoksissa. CORDARONE lisää sydämen refraktaarista ajanjaksoa vaikuttamatta lepokalvopotentiaaliin, paitsi automaattisissa soluissa, joissa prepotentiaalin kaltevuus pienenee, mikä yleensä vähentää automaattisuutta. Nämä sähköfysiologiset vaikutukset näkyvät alentuneena sinusnopeudena 15-20 %, pidentyneenä PR- ja QT-välinä noin 10 %, U-aaltojen kehittymisenä ja T-aallon muodon muutoksina. Näiden muutosten ei pitäisi edellyttää CORDARONE 50 mg:n hoidon lopettamista, koska ne ovat todiste sen farmakologisesta vaikutuksesta, vaikka CORDARONE voi aiheuttaa huomattavaa sinusbradykardiaa tai poskiontelopysähdystä ja sydäntukoksia [ks. VAROITUKSET JA VAROTOIMET ].
Hemodynamiikka
Eläinkokeissa ja ihmisille laskimonsisäisen annon jälkeen CORDARONE 100 mg rentouttaa verisuonten sileää lihasta, vähentää perifeeristä verisuonten vastusta (jälkikuormitus) ja lisää hieman sydänindeksiä. Oraalisen annostelun jälkeen CORDARONE 100 mg ei kuitenkaan aiheuta merkittävää muutosta vasemman kammion ejektiofraktiossa (LVEF), edes potilailla, joilla on masentunut LVEF. Akuutin laskimonsisäisen annostelun jälkeen CORDARONE 100 mg:lla voi olla lievä negatiivinen inotrooppinen vaikutus.
Farmakodynamiikka
Plasman pitoisuuden ja tehokkuuden välillä ei ole vakiintunutta yhteyttä, mutta näyttää siltä, että paljon alle 1 mg/l pitoisuudet ovat usein tehottomia ja että yli 2,5 mg/l tasoja ei yleensä tarvita. Plasmakonsentraatiomittauksia voidaan käyttää tunnistamaan potilaat, joiden tasot ovat epätavallisen alhaiset ja jotka saattavat hyötyä annoksen suurentamisesta tai epätavallisen suuresta ja joiden annosta saatetaan pienentää sivuvaikutusten minimoimisen toivossa.
Vaikutuksia epänormaaliin rytmiin ei havaita ennen 2–3 päivää, ja ne vaativat yleensä 1–3 viikkoa, vaikka kyllästysannosta käytettäisiinkin. Vaikutus voi jatkua vielä pidempäänkin. On näyttöä siitä, että vaikutusaika on lyhyempi, kun käytetään kyllästysannosohjelmaa.
Hitaan eliminaationopeuden mukaisesti rytmihäiriöiden vastaiset vaikutukset jatkuvat viikkoja tai kuukausia CORDARONE 50 mg:n käytön lopettamisen jälkeen, mutta uusiutumisaika on vaihteleva ja arvaamaton. Yleensä, kun lääkettä jatketaan rytmihäiriön toistumisen jälkeen, kontrolli saadaan suhteellisen nopeasti alkuvasteeseen verrattuna, oletettavasti siksi, että kudosvarastot eivät olleet täysin tyhjentyneet.
Farmakokinetiikka
Imeytyminen
Suun kautta annettuna ihmisille CORDARONE imeytyy hitaasti ja vaihtelevasti. CORDARONE-valmisteen biologinen hyötyosuus on noin 50 %. Plasman huippupitoisuudet saavutetaan 3–7 tunnin kuluttua kerta-annoksesta. Plasman pitoisuudet jatkuvalla annostuksella 100–600 mg/vrk ovat suunnilleen suhteessa annokseen, ja pitoisuudet kasvavat keskimäärin 0,5 mg/l jokaista 100 mg/vrk kohden. Näihin keinoihin sisältyy kuitenkin huomattavaa yksilöllistä vaihtelua.
Ruoka nopeuttaa ja lisää CORDARONE-valmisteen imeytymistä. Ruoan vaikutuksia CORDARONEen biologiseen hyötyosuuteen on tutkittu 30 terveellä koehenkilöllä, jotka saivat kerta-annoksen 600 mg välittömästi rasvaisen aterian nauttimisen ja yön yli paaston jälkeen. Plasman pitoisuus-aikakäyrän alla oleva pinta-ala (AUC) ja amiodaronin huippupitoisuus plasmassa (Cmax) suurenivat 2,3 (vaihteluväli 1,7 - 3,6) ja 3,8 (vaihteluväli 2,7 - 4,4) kertaa ruoan kanssa. Ruoka lisäsi myös amiodaronin imeytymisnopeutta ja lyhensi plasman huippupitoisuuden saavuttamiseen kuluvaa aikaa (Tmax) 37 %. Amiodaronin päämetaboliitin DEA:n keskimääräinen AUC ja keskimääräinen Cmax nousivat 55 % (vaihteluväli 58–101 %) ja 32 % (vaihteluväli 4–84 %), mutta Tmax ei muuttunut, kun läsnä oli ruokaa.
Jakelu
CORDARONE sitoutuu voimakkaasti proteiineihin (noin 96 %). CORDARONElla on erittäin suuri, mutta vaihteleva jakautumistilavuus, keskimäärin noin 60 l/kg, koska se kerääntyy laajasti eri kohtiin, erityisesti rasvakudokseen ja voimakkaasti perfuusioituihin elimiin, kuten maksaan, keuhkoihin ja pernaan.
Yksi CORDARONE 50 mg:n päämetaboliitista, DEA, on tunnistettu ihmisellä; se kerääntyy vielä enemmän lähes kaikkiin kudoksiin. DEA:n aktiivisuudesta ihmisillä ei ole tietoja, mutta eläimillä sillä on merkittäviä elektrofysiologisia ja rytmihäiriöitä estäviä vaikutuksia, jotka ovat yleensä samanlaisia kuin itse amiodaronilla. DEA:n tarkkaa roolia ja vaikutusta suun kautta otettavan amiodaronin rytmihäiriöiden vastaiseen toimintaan ei ole varma. Maksimi kammioluokan III vaikutusten kehittyminen ihmisille suun kautta annetun CORDARONE 100 mg:n annon jälkeen korreloi enemmän DEA:n kertymisen kanssa ajan kuluessa kuin amiodaronin kertymisen kanssa.
Eliminointi
Kun 12 terveelle koehenkilölle annettiin kerta-annos, CORDARONE osoitti moniosastoista farmakokinetiikkaa ja keskimääräinen näennäinen plasman terminaalinen eliminaation puoliintumisaika amiodaronilla oli 58 päivää (vaihteluväli 15 - 142 päivää) ja 36 päivää (vaihteluväli 14 - 75 päivää) aktiivisilla aineilla. metaboliitti (DEA). Kroonisen oraalisen hoidon lopettamisen jälkeen CORDARONE 100 mg:n on osoitettu eliminoituvan kaksivaiheisesti potilailla, joiden plasmapitoisuudet pienenevät aluksi 50 % 2,5–10 päivän kuluttua. Paljon hitaampi terminaalinen plasmaeliminaatiovaihe osoittaa lähtöaineen puoliintumisajan vaihtelevan välillä 26-107 päivää, keskimäärin noin 53 päivää ja useimpien potilaiden välillä 40-55 päivää. Ilman kyllästysannosjaksoa vakaan tilan pitoisuudet plasmassa saavutettaisiin vakiona suun kautta annettaessa 130-535 päivässä, keskimäärin 265 päivässä. Metaboliitin keskimääräinen plasmaeliminaation puoliintumisaika oli noin 61 päivää. Nämä tiedot heijastavat luultavasti lääkkeen alkuvaiheen eliminaatiota hyvin perfusoidusta kudoksesta (2,5-10 päivän puoliintumisaika), jota seuraa loppuvaihe, joka edustaa erittäin hidasta eliminaatiota huonosti perfusoiduista kudososastoista, kuten rasvasta.
Huomattava yksilöiden välinen vaihtelu molemmissa eliminaation vaiheissa sekä epävarmuus siitä, mikä osasto on kriittinen lääkkeen vaikutukselle, vaatii huomiota yksilöllisiin vasteisiin, kun rytmihäiriöt saadaan hallintaan kyllästysannoksilla, koska oikea ylläpitoannos määritetään osittain. eliminointiasteiden mukaan. Yksilöi CORDARONE-ylläpitoannokset [katso ANNOSTELU JA HALLINNOINTI ].
Aineenvaihdunta
Amiodaroni metaboloituu DEA:ksi sytokromi P450 (CYP) -entsyymiryhmän, erityisesti CYP3A:n ja CYP2C8:n, vaikutuksesta. CYP3A-isoentsyymiä on sekä maksassa että suolistossa. In vitro amiodaronilla ja DEA:lla on mahdollisuus estää CYP2C9, CYP2C19, CYP2D6, CYP3A, CYP2A6, CYP2B6 ja CYP2C8. Amiodaronilla ja DEA:lla on myös potentiaalia estää joitain kuljettajia, kuten P-glykoproteiinia ja orgaanisen kationin kuljettajaa (OCT2).
Erittyminen
Amiodaroni eliminoituu ensisijaisesti maksametaboliassa ja sappeen erittyessä, ja amiodaronin tai DEA:n erittyminen virtsaan on vähäistä. Amiodaroni tai DEA eivät ole dialysoitavissa.
Tietyt populaatiot
Iän vaikutus
Normaalit yli 65-vuotiaat koehenkilöt osoittavat pienemmät puhdistumat (noin 100 ml/h/kg) kuin nuoremmilla koehenkilöillä (noin 150 ml/h/kg) ja t½ pitenevät noin 20 päivästä 47 päivään.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta ei vaikuta amiodaronin tai DEA:n farmakokinetiikkaan.
Maksan vajaatoiminta
Kun kirroosipotilaille on annettu kerta-annos suonensisäistä amiodaronia, DEA:n Cmax- ja keskimääräiset pitoisuusarvot ovat huomattavasti alhaisemmat, mutta keskimääräiset amiodaronipitoisuudet eivät muutu.
Sydänsairaus
Potilailla, joilla on vaikea vasemman kammion toimintahäiriö, amiodaronin farmakokinetiikka ei muutu merkittävästi, mutta DEA:n terminaalinen eliminaatio t½ pitenee.
Vaikka annosta ei ole muutettu potilaille, joilla on munuaisten, maksan tai sydämen poikkeavuuksia, oraalisen amiodaronihoidon aikana ei ole määritetty, iäkkäiden potilaiden ja potilaiden, joilla on vaikea vasemman kammion toimintahäiriö, tarkka kliininen seuranta on tarkoituksenmukaista.
Huumeiden vuorovaikutukset
Muiden aineiden vaikutukset amiodaroniin
Greippimehu: Terveille vapaaehtoisille annettu greippimehu lisäsi amiodaronin AUC-arvoa 50 % ja Cmax-arvoa 84 % ja laski DEA:ta määrittämättömiin pitoisuuksiin.
Simetidiini estää CYP3A:ta ja voi nostaa seerumin amiodaronipitoisuutta.
Kolestyramiini vähentää amiodaronin enterohepaattista verenkiertoa ja lisää siten sen eliminaatiota. Tämä johtaa amiodaronin seerumipitoisuuden ja puoliintumisajan alenemiseen.
Amiodaronin vaikutukset aineisiin
CYP3A-substraatit
Amiodaroni samanaikaisesti kinidiinin kanssa nostaa seerumin kinidiinipitoisuutta 33 % kahden päivän kuluttua. Amiodaroni, joka otetaan samanaikaisesti prokaiiniamidin kanssa alle seitsemän päivän ajan, lisää prokaiiniamidin pitoisuutta plasmassa 55 % ja n-asetyyliprokaiiniamidia 33 %.
Loratadiini, ei-sedatiivinen antihistamiini, metaboloituu pääasiassa CYP3A:n vaikutuksesta ja amiodaroni voi estää sen metaboliaa.
Amiodaroni voi estää lidokaiinin metaboliaa.
Syklofosfamidi on aihiolääke, joka metaboloituu CYP450:n, mukaan lukien CYP3A:n, vaikutuksesta aktiiviseksi metaboliitiksi. Amiodaroni voi estää syklofosfamidin metaboliaa.
Klopidogreeli, inaktiivinen tienopyridiinin aihiolääke, metaboloituu maksassa CYP3A:n vaikutuksesta aktiiviseksi metaboliitiksi. Klopidogreelin ja amiodaronin välillä on raportoitu mahdollista yhteisvaikutusta, joka johtaa tehottoman verihiutaleiden aggregaation estämiseen.
Makrolidi/ketolidiantibiootit
Amiodaroni voi estää makrolidi/ketolidiantibioottien (paitsi atsitromysiinin) ja systeemisten atsoli-sienilääkkeiden metaboliaa.
P-glykoproteiinisubstraatit
Amiodaroni samanaikaisesti otettuna digoksiinin kanssa lisää seerumin digoksiinipitoisuutta 70 % yhden vuorokauden kuluttua.
Dabigatraanieteksilaatti voi nostaa seerumin dabigatraanipitoisuutta, kun sitä otetaan samanaikaisesti suun kautta otettavan amiodaronin kanssa.
Dekstrometorfaani on sekä CYP2D6:n että CYP3A:n substraatti. Amiodaroni estää CYP2D6:ta. Pitkään (> 2 viikkoa) suun kautta otettava amiodaronin anto heikentää dekstrometorfaanin metaboliaa ja voi johtaa seerumin pitoisuuksien nousuun.
POTILASTIEDOT
CORDARONE® (KOR-DU-RON) (amiodaroni) tabletit
Mikä on tärkein tieto, joka minun pitäisi tietää CORDARONE 50 mg:sta?
CORDARONE voi aiheuttaa vakavia sivuvaikutuksia, jotka voivat johtaa kuolemaan, mukaan lukien:
- keuhko-ongelmia
- maksaongelmia
- sykeongelmien paheneminen
Soita terveydenhuollon tarjoajallesi tai hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin seuraavista oireista CORDARONE-hoidon aikana:
- hengitysvaikeudet, hengityksen vinkuminen, hengenahdistus, yskiminen rintakipu, veren sylkeminen tai kuume
- pahoinvointi tai oksentelu, ruskea tai tumma virtsa, tavallista väsyneempi olo, ihosi tai silmänvalkuaisten kellastuminen (keltatauti) tai oikean ylävatsan alueen kipu
- sydämen hakkaaminen, lyönnin väliin jääminen, nopea tai hitaasti lyövä olo, pyörrytys tai jos pyörryt
- näköhäiriöt, mukaan lukien näön hämärtyminen, sädekehät tai silmäsi herkistyvät valolle. Sinun tulee käydä säännöllisesti silmätutkimuksissa ennen CORDARONE-hoitoa ja sen aikana.
CORDARONE-hoito tulee aloittaa sairaalassa, jotta terveydentilaasi voidaan seurata huolellisesti.
CORDARONEa tulee käyttää vain sellaisten ihmisten hoitoon, joilla on diagnosoitu hengenvaarallisia sykehäiriöitä, joita kutsutaan kammiorytmihäiriöiksi, kun muut hoidot eivät tehonneet tai et siedä niitä.
CORDARONE 50 mg voi aiheuttaa muita vakavia sivuvaikutuksia. Katso "Mitkä ovat CORDARONE 100mg:n mahdolliset sivuvaikutukset?" Jos saat vakavia haittavaikutuksia hoidon aikana, sinun on ehkä lopetettava CORDARONE-hoito, muutettava annostasi tai hakeuduttava lääkärinhoitoon. Keskustele terveydenhuollon tarjoajan kanssa ennen kuin lopetat CORDARONE-hoidon.
Sinulla saattaa edelleen esiintyä haittavaikutuksia CORDARONE-hoidon lopettamisen jälkeen, koska lääke pysyy kehossasi kuukausia hoidon lopettamisen jälkeen.
Sinun tulee käydä säännöllisesti tarkastuksissa, verikokeissa ja rintakehän röntgenkuvissa ennen CORDARONE 100 mg -hoitoa ja sen aikana vakavien sivuvaikutusten tarkistamiseksi. Sinun tulee myös tehdä keuhkojen toimintakokeet ennen CORDARONE-hoidon aloittamista.
Mikä on CORDARONE?
CORDARONE on reseptilääke, jota käytetään sellaisten ihmisten hoitoon, joilla on diagnosoitu hengenvaarallisia sykehäiriöitä, joita kutsutaan kammiorytmihäiriöiksi, kun muut hoidot eivät tehonneet tai et siedä niitä. Ei tiedetä, onko CORDARONE turvallinen ja tehokas lapsille.
Kuka ei saa ottaa CORDARONE 100 mg -valmistetta?
Älä ota CORDARONE 100 mg:aa, jos:
- sinulla on vakava sydänsairaus, jota kutsutaan kardiogeeniseksi sokiksi
- sinulla on tietyntyyppinen sydänsairaus, jota kutsutaan sydänblokaukseksi, hitaan sykkeen kanssa tai ilman
- sinulla on hidas syke, johon liittyy huimausta tai huimausta, eikä sinulla ole istutettua sydämentahdistinta
- olet allerginen amiodaronille, jodille tai jollekin muulle CORDARONE-valmisteen aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo CORDARONEen ainesosista.
Ennen kuin otat CORDARONE 100 mg -valmistetta, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on keuhko- tai hengitysvaikeuksia
- sinulla on maksaongelmia
- sinulla on tai on ollut kilpirauhasen ongelmia
- sinulla on hidas syke tai verenpaineongelmia
- sinulla on ripuli tai sinulla on ollut ripuli pitkään
- sinulle on kerrottu, että veresi kalium-, magnesium- tai kalsiumpitoisuus on alhainen
- sinulla on implantoitu sydämentahdistin tai defribrillaattori
- jos suunnittelet leikkausta yleisanestesiassa
- olet raskaana tai suunnittelet raskautta. CORDARONE voi vahingoittaa sikiötäsi. Kerro heti terveydenhuollon tarjoajallesi, jos tulet raskaaksi CORDARONE-hoidon aikana. CORDARONE 100 mg voi pysyä kehossasi kuukausia hoidon lopettamisen jälkeen.
- imetät tai aiot imettää. CORDARONE 100 mg voi erittyä äidinmaitoon ja vahingoittaa vauvaasi. Älä imetä CORDARONE-hoidon aikana. CORDARONE voi pysyä kehossasi kuukausia hoidon lopettamisen jälkeen. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi tänä aikana.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. CORDARONE 50mg ja tietyt muut lääkkeet voivat vaikuttaa toisiinsa ja aiheuttaa vakavia sivuvaikutuksia. Voit pyytää apteekista luettelon lääkkeistä, joilla on vuorovaikutus CORDARONEen kanssa.
Miten minun pitäisi ottaa CORDARONEa?
- Kun pääset sairaalasta, ota CORDARONE juuri sen verran kuin lääkärisi on määrännyt.
- Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon CORDARONEa sinun tulee ottaa ja milloin se tulee ottaa.
- Terveydenhuollon tarjoaja voi muuttaa CORDARONE 50 mg annostasi tarpeen mukaan, jos sydämesi rytmi on hallinnassa tai jos sinulla on tiettyjä sivuvaikutuksia. Terveydenhuollon tarjoajasi tulee seurata sinua huolellisesti, kun CORDARONE 50 mg -annostasi muutetaan.
- Ota CORDARONE-annoksesi joka kerta samalla tavalla, joko ruoan kanssa tai ilman.
- Jos otat liikaa CORDARONE 100 mg -valmistetta, soita välittömästi terveydenhuollon tarjoajalle tai mene lähimmän sairaalan ensiapuun. Jos unohdat ottaa annoksen, odota ja ota seuraava annos tavalliseen aikaan. Älä ota kahta annosta samanaikaisesti. Jatka seuraavalla säännöllisesti suunnitellulla annoksellasi.
Mitä minun pitäisi välttää CORDARONE-hoidon aikana?
- Vältä greippimehun juomista CORDARONE-hoidon aikana. Greippimehun juominen CORDARONE 50 mg:n kanssa voi lisätä CORDARONE-pitoisuutta veressäsi, mikä voi johtaa sivuvaikutuksiin.
- CORDARONE 100mg voi tehdä ihosi herkäksi auringonvalolle. Saatat saada vakavan auringonpolttaman. Käytä aurinkovoidetta ja käytä hattua ja ihoa peittäviä vaatteita suojaamaan sinua, jos joudut olemaan auringonpaisteessa. Keskustele terveydenhuollon kanssa, jos saat auringonpolttaman. Katso "Ihoongelmat" Lääkitysopas-osiossa "Mitä ovat CORDARONEen mahdolliset sivuvaikutukset?" alla.
Mitkä ovat CORDARONEen mahdolliset sivuvaikutukset?
CORADARONE voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää CORDARONEsta?"
- Hermoongelmat. CORDARONE 100mg voi aiheuttaa hermoongelmia. Soita terveydenhuollon tarjoajallesi, jos sinulle ilmaantuu hermoongelmien oireita, mukaan lukien: "pistelyn ja neulan" tunne tai tunnottomuus käsissä, jaloissa tai jaloissa, lihasheikkous, hallitsemattomat liikkeet, huono koordinaatio tai kävelyvaikeudet.
- Iho-ongelmat. CORDARONE voi tehdä ihosi herkemmäksi auringolle tai saada ihosi sinertävän harmaaksi. Ihmiset, joilla on vaalea iho tai ihmiset, jotka altistuvat paljon auringolle, voivat olla suuremmassa vaarassa saada nämä iho-ongelmat. Osa siniharmaasta ihonväristä saattaa palata normaaliksi CORDARONE-hoidon lopettamisen jälkeen.
- Kilpirauhasen ongelmat. CORDARONE voi aiheuttaa sinulle joko heikentyneen kilpirauhasen toiminnan (hypotyreoosi), joka voi joskus olla vaikeaa, tai kilpirauhasen liikatoimintaa (hypertyreoosi), joka voi olla vaikeaa.
- Jos kilpirauhasen toiminta heikkenee CORDARONE-hoidon aikana, terveydenhuollon tarjoajasi saattaa joutua pienentämään annostasi tai lopettamaan CORDARONE-hoitosi ja mahdollisesti määräämään lääkettä kilpirauhashormonin korvaamiseksi.
- Kilpirauhasen liikatoiminta voi saada sinut tuottamaan liikaa kilpirauhashormonia. Sinulla voi olla epänormaalia sydämenlyöntiä myös CORDARONE-hoidon aikana. Terveydenhuollon tarjoaja voi määrätä tiettyjä lääkkeitä kilpirauhasen liikatoiminnan hoitoon. Soita terveydenhuollon tarjoajallesi, jos saat epänormaalia sydämenlyöntiä CORDARONE-hoidon aikana. Tämä voi tarkoittaa, että sinulla on yliaktiivinen kilpirauhanen.
- Terveydenhuollon tarjoajasi tulee tehdä tutkimuksia kilpirauhasen toiminnan tarkistamiseksi ennen CORDARONE-hoidon aloittamista ja sen aikana.
- Soita terveydenhuollon tarjoajallesi, jos sinulle ilmaantuu jokin seuraavista kilpirauhasen ongelman oireista CORDARONE-hoidon aikana:
- heikkous
- laihtuminen tai painonnousu
- kuumuuden tai kylmän sietokyky
- hiusten oheneminen
- hikoilu
- muutoksia kuukautiskierrossasi
- niskan turvotus (struuma)
- hermostuneisuus
- ärtyneisyys
- levottomuus
- vähentynyt keskittyminen
- masentunut olo (vanhukset)
- vapina
CORDARONEen yleisimpiä sivuvaikutuksia ovat:
- keuhko-ongelmia
- sydämen syke ongelmia
- sydänongelmat
- maksaongelmia
CORDARONE 50 mg voi vaikuttaa miesten ja naisten hedelmällisyyteen. Ei tiedetä, ovatko vaikutukset palautuvia. Keskustele terveydenhuollon tarjoajan kanssa, jos olet huolissasi hedelmällisyydestä.
Nämä eivät ole kaikkia CORDARONEen mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää CORDARONE?
- Säilytä CORDARONE 100 mg huoneenlämmössä 20–25 °C (68–77 °F).
- Pidä CORDARONE tiiviisti suljetussa astiassa ja pidä CORDARONE 50 mg poissa valolta.
Pidä CORDARONE 50 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa CORDARONEen turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä CORDARONEa sairauteen, johon sitä ei ole määrätty. Älä anna CORDARONEa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä apteekista tai terveydenhuollon tarjoajalta CORDARONE-tietoa, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia CORDARONE 100mg sisältää?
Aktiivinen ainesosa: amiodaroni HCl
Ei-aktiiviset ainesosat: kolloidinen piidioksidi, laktoosi, magnesiumstearaatti, povidoni, tärkkelys ja FD&C Red 40.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
