Cardizem 30mg, 60mg, 90mg, 120mg, 180mg Diltiazem Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Cardizem 120mg on ja miten sitä käytetään?
Cardizem on reseptilääke, jota käytetään rintakivun (angina), korkean verenpaineen (hypertension) sekä tiettyjen sydämen rytmihäiriöiden, kuten vaarallisen nopeiden sydämenlyöntien (paroksismaalinen supraventrikulaarinen takykardia) ja eteisvärinä/lepatus, hoitoon. Cardizemia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Cardizem kuuluu huumeiden luokkaan nimeltä Antidysrythmics, IV; Kalsiumkanavan salpaajat; Kalsiumkanavasalpaajat, ei-dihydropyridiini.
Mitkä ovat Cardizem 120mg:n mahdolliset sivuvaikutukset?
Cardizem voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintakipu,
- hitaat sydämenlyönnit,
- hakkaavia sydämenlyöntejä tai lepatusta rinnassasi,
- huimaus,
- turvotus,
- nopea painonnousu ja
- hengenahdistuksen tunne
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Cardizemin yleisimpiä sivuvaikutuksia ovat:
- turvotus,
- huimaus,
- heikkous,
- päänsärky,
- pahoinvointi ja
- ihottuma
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Cardizemin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
CARDIZEM® (diltiatsemihydrokloridi) on kalsiumionien solujen sisäänvirtauksen estäjä (hidaskanavan salpaaja tai kalsiumin antagonisti). Kemiallisesti diltiatseemihydrokloridi on 1,5-bentsotiatsepin-4(5H)-oni, 3-(asetyylioksi)-5-[2-(dimetyyliamino)etyyli]-2,3-dihydro-2-(4-metoksifenyyli)-, monohydrokloridi, (+)-cis-. Kemiallinen rakenne on:
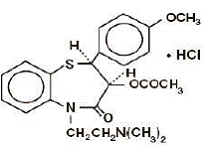
Diltiatsemihydrokloridi on valkoinen tai luonnonvalkoinen kiteinen jauhe, jolla on karvas maku. Se liukenee veteen, metanoliin ja kloroformiin. Sen molekyylipaino on 450,98. Jokainen CARDIZEM 60 mg tabletti sisältää 30 mg, 60 mg, 90 mg tai 120 mg diltiatseemihydrokloridia.
Sisältää myös: kolloidinen piidioksidi, D&C Yellow #10 Aluminium Lake, FD&C Blue #1 Aluminium Lake (30 mg ja 90 mg), FD&C Yellow #6 Aluminium Lake (60 mg ja 120 mg), hydroksipropyyliselluloosa, hypromelloosi, laktoosi, magnesium stearaatti, metyyliparabeeni, mikrokiteinen selluloosa ja polyetyleeniglykoli.
Suun kautta annettavaksi.
INDIKAATIOT
CARDIZEM 120mg on tarkoitettu kroonisen stabiilin angina pectoris ja sepelvaltimon kouristuksen aiheuttaman angina pectoriksen hoitoon.
ANNOSTELU JA HALLINNOINTI
Ateroskleroottisesta sepelvaltimotaudista johtuva rasitusrintakipu tai levossa sepelvaltimon spasmin aiheuttama angina pectoris
Annostus on sovitettava kunkin potilaan tarpeiden mukaan. Alkaen 30 mg:lla neljä kertaa vuorokaudessa, ennen ateriaa ja nukkumaanmenoa, annosta tulee suurentaa asteittain (jaettuina annoksina kolme tai neljä kertaa päivässä) 1-2 päivän välein, kunnes saavutetaan optimaalinen vaste. Vaikka yksittäiset potilaat voivat reagoida mihin tahansa annostasoon, keskimääräinen optimaalinen annostusalue näyttää olevan 180-360 mg/vrk. Ei ole saatavilla tietoja annostustarpeista potilailla, joilla on munuaisten tai maksan vajaatoiminta. Jos lääkettä on käytettävä tällaisille potilaille, titraus on suoritettava erityisen varoen.
Samanaikainen käyttö muiden sydän- ja verisuonilääkkeiden kanssa
Niele Cardizem-tabletit kokonaisina; älä halkaise, murskaa tai pureskele tabletteja.
MITEN TOIMITETAAN
CARDIZEM 30 mg Tabletit toimitetaan 100 ( NDC 0187-0771-47) ja 500 ( NDC 0187-0771-55). Jokaisen vaaleanvihreän pyöreän tabletin toisella puolella on kaiverrus MARION ja toisella 1771.
CARDIZEM 60 mg jakouurteiset tabletit toimitetaan 100 ( NDC 0187-0772-47). Jokaisen vaaleankeltaisen, pyöreän tabletin toisella puolella on kaiverrus MARION ja toisella 1772.
CARDIZEM 90 mg jakouurteiset tabletit toimitetaan 100 ( NDC 0187-0791-47). Jokaisen vihreän, pitkänomaisen tabletin toisella puolella on kaiverrus CARDIZEM ja toisella 90 mg.
CARDIZEM 120 mg jakouurteiset tabletit toimitetaan 100 ( NDC 0187-0792-47). Jokaisen vaaleankeltaisen kapselin muotoisen tabletin toisella puolella on kaiverrus CARDIZEM ja toisella 120 mg.
Säilytä 25°C (77°); kierrokset sallitaan 15-30°C (59-86°) [katso USP-ohjattu huonelämpötila ].
Vältä liiallista kosteutta.
Jakelija: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Valmistettu Kanadassa. Tarkistettu. 14.11
SIVUVAIKUTUKSET
Vakavat haittavaikutukset ovat olleet harvinaisia tähän mennessä tehdyissä tutkimuksissa, mutta on otettava huomioon, että potilaat, joilla on heikentynyt kammiotoiminta ja sydämen johtumishäiriöt, on yleensä jätetty pois.
Kotimaisissa lumekontrolloiduissa anginatutkimuksissa CARDIZEM-hoidon aikana raportoitujen haittavaikutusten ilmaantuvuus ei ollut suurempi kuin lumelääkehoidon aikana.
Seuraavat ovat rintakipupotilailla tehdyissä kliinisissä tutkimuksissa havaittuja tapahtumia. Monissa tapauksissa yhteyttä CARDIZEMiin ei ole vahvistettu. Näissä tutkimuksissa yleisimmät esiintymät ja niiden esiintymistiheys ovat turvotus (2,4 %), päänsärky (2,1 %), pahoinvointi (1,9 %), huimaus (1,5 %), ihottuma (1,3 %) ja voimattomuus (1,2 %). %). Lisäksi seuraavia tapahtumia ilmoitettiin harvoin (alle 1 %):
Kardiovaskulaarinen
Angina pectoris, rytmihäiriöt, AV-katkos (ensimmäisen asteen), AV-katkos (toinen tai kolmas astetta – ks. VAROITUKSET , Sydämen johtuminen ), bradykardia, haarakatkos, kongestiivinen sydämen vajaatoiminta, EKG:n poikkeavuus, punoitus, hypotensio, sydämentykytys, pyörtyminen, takykardia, kammioiden ekstrasystolat.
Hermosto
Epänormaalit unet, muistinmenetys, masennus, kävelyhäiriöt, hallusinaatiot, unettomuus, hermostuneisuus, parestesia, persoonallisuuden muutos, uneliaisuus, vapina.
Ruoansulatuskanava
Anoreksia, ummetus, ripuli, dysgeusia, dyspepsia, lievä alkalisen fosfataasin, SGOT-, SGPT- ja LDH-arvon nousu (ks. VAROITUKSET , Akuutti maksavaurio ), jano, oksentelu, painon nousu.
Dermatologinen
Petekiat, valoherkkyys, kutina, urtikaria.
muu
Amblyopia, CPK-arvon nousu, suun kuivuminen, hengenahdistus, nenäverenvuoto, silmien ärsytys, hyperglykemia, hyperurikemia, impotenssi, lihaskrampit, nenän tukkoisuus, nokturia, nivelkipu, polyuria, seksuaaliset vaikeudet, tinnitus.
Seuraavia markkinoille tulon jälkeisiä tapahtumia on raportoitu harvoin CARDIZEM-hoitoa saaneilla potilailla: akuutti yleistynyt eksantematoottinen pustuloosi, allergiset reaktiot, hiustenlähtö, angioedeema (mukaan lukien kasvojen tai periorbitaalinen turvotus), asystolia, erythema multiforme (mukaan lukien Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi), ekstrapyramidaaliset oireet , ienten liikakasvu, hemolyyttinen anemia, pidentynyt verenvuotoaika, leukopenia, valoherkkyys (mukaan lukien jäkäläinen keratoosi ja hyperpigmentaatio auringonvalolle altistuvilla ihoalueilla), purppura, retinopatia, myopatia ja trombosytopenia. Yleistynyttä ihottumaa on havaittu, joista osa on luonnehdittu leukosytoklastiseksi vaskuliitiksi. Lisäksi on havaittu tapahtumia, kuten sydäninfarkti, joita ei voida helposti erottaa näiden potilaiden taudin luonnollisesta historiasta. Lopullista syy-seuraussuhdetta näiden tapahtumien ja CARDIZEM-hoidon välillä ei voida vielä vahvistaa. Eksfoliatiivista ihotulehdusta (todistetusti uudelleenaltistuksessa) on myös raportoitu.
HUUMEIDEN VUOROVAIKUTUKSET
Mahdollisten additiivisten vaikutusten vuoksi varovaisuutta ja huolellista titrausta on syytä noudattaa potilailla, jotka saavat CARDIZEM 180 mg samanaikaisesti minkä tahansa aineen kanssa, jonka tiedetään vaikuttavan sydämen supistumiskykyyn ja/tai johtumiseen (ks. VAROITUKSET ).
Farmakologiset tutkimukset osoittavat, että AV johtumisen pidentämisessä voi olla additiivinen vaikutus, kun beetasalpaajia tai digitalista käytetään samanaikaisesti CARDIZEMin kanssa (ks. VAROITUKSET ).
Kuten kaikkien lääkkeiden kohdalla, varovaisuutta on noudatettava hoidettaessa potilaita useilla lääkkeillä. Diltiatsemi on sekä sytokromi P-450 3A4 -entsyymijärjestelmän substraatti että estäjä. Muilla lääkkeillä, jotka ovat tämän entsyymijärjestelmän spesifisiä substraatteja, estäjiä tai indusoijia, voi olla merkittävä vaikutus diltiatseemin tehoon ja sivuvaikutusprofiiliin. Potilaat, jotka käyttävät muita lääkkeitä, jotka ovat CYP450 3A4:n substraatteja, ja erityisesti potilaat, joilla on munuaisten ja/tai maksan vajaatoiminta, saattavat tarvita annoksen muuttamista aloitettaessa tai lopetettaessa samanaikainen diltiatseemihoito optimaalisen terapeuttisen veren tason ylläpitämiseksi.
Anestesia-aineet
Kalsiumkanavasalpaajat voivat tehostaa sydämen supistumiskykyä, johtokykyä ja automaattisuutta sekä anestesia-aineisiin liittyvää verisuonten laajentumista. Kun anestesia-aineita ja kalsiuminsalpaajia käytetään samanaikaisesti, ne tulee titrata huolellisesti.
Bentsodiatsepiinit
Tutkimukset osoittivat, että diltiatseemi suurensi midatsolaamin ja triatsolaamin AUC-arvoa 3-4-kertaiseksi ja Cmax-arvoa 2-kertaiseksi lumelääkkeeseen verrattuna. Midatsolaamin ja triatsolaamin eliminaation puoliintumisaika piteni myös (1,5-2,5-kertaiseksi), kun niitä annettiin samanaikaisesti diltiatseemin kanssa. Nämä farmakokineettiset vaikutukset, jotka havaitaan diltiatseemin samanaikaisen annon aikana, voivat lisätä sekä midatsolaamin että triatsolaamin kliinisiä vaikutuksia (esim. pitkittynyt sedaatio).
Beetasalpaajat
Kontrolloidut ja kontrolloimattomat kotimaiset tutkimukset viittaavat siihen, että CARDIZEM 180 mg:n ja beetasalpaajien samanaikainen käyttö on yleensä hyvin siedettyä. Saatavilla olevat tiedot eivät kuitenkaan riitä ennustamaan samanaikaisen hoidon vaikutuksia etenkään potilailla, joilla on vasemman kammion toimintahäiriö tai sydämen johtumishäiriö.
CARDIZEMin (diltiatsemihydrokloridin) antaminen samanaikaisesti propranololin kanssa viidellä normaalilla vapaaehtoisella johti propranololipitoisuuden nousuun kaikilla koehenkilöillä, ja propranololin hyötyosuus kasvoi noin 50%. In vitro diltiatseemi näyttää syrjäyttävän propranololin sitoutumiskohdistaan. Jos yhdistelmähoito aloitetaan tai lopetetaan yhdessä propranololin kanssa, propranololin annoksen muuttaminen saattaa olla perusteltua (ks. VAROITUKSET ).
Buspironi
Yhdeksällä terveellä koehenkilöllä diltiatseemi suurensi merkittävästi buspironin keskimääräistä AUC-arvoa 5,5-kertaiseksi ja Cmax-arvoa 4,1-kertaiseksi lumelääkkeeseen verrattuna. Diltiatseemi ei vaikuttanut merkittävästi buspironin T½- ja Tmax-arvoihin. Buspironin tehostuneet vaikutukset ja toksisuus voivat olla mahdollisia käytettäessä samanaikaisesti diltiatseemin kanssa. Myöhemmät annoksen muuttaminen voi olla tarpeen samanaikaisen käytön aikana, ja sen tulee perustua kliiniseen arviointiin.

Karbamatsepiini
Diltiatseemin ja karbamatsepiinin samanaikaisen annon on raportoitu nostaneen seerumin karbamatsepiinin pitoisuutta (nousu 40 % - 72 %), mikä joissakin tapauksissa aiheuttaa toksisuutta. Potilaita, jotka saavat näitä lääkkeitä samanaikaisesti, tulee tarkkailla mahdollisen lääkevuorovaikutuksen varalta.
Simetidiini
Kuudella terveellä vapaaehtoisella tehdyssä tutkimuksessa on osoitettu merkittävän nousun diltiatseemin huippupitoisuuksissa plasmassa (58 %) ja käyrän alapuolella (53 %) viikon mittaisen simetidiinihoidon jälkeen 1 200 mg:lla päivässä ja kerta-annoksella diltiatseemi 60 mg. Ranitidiini aiheutti pienempiä, ei-merkittäviä lisäyksiä. Vaikutus saattaa johtua siitä, että simetidiini estää maksan sytokromi P-450:n, diltiatseemin ensikierron metaboliasta vastaavan entsyymijärjestelmän. Tällä hetkellä diltiatseemihoitoa saavia potilaita tulee tarkkailla huolellisesti farmakologisen vaikutuksen muutosten varalta, kun simetidiinihoito aloitetaan ja lopetetaan. Diltiatseemiannoksen muuttaminen saattaa olla perusteltua.
Klonidiini
Sinusbradykardiaa, joka on johtanut sairaalahoitoon ja sydämentahdistimen asettamiseen, on raportoitu klonidiinin käytön yhteydessä diltiatseemin kanssa. Seuraa sykettä potilailla, jotka saavat samanaikaisesti diltiatseemia ja klonidiinia.
Syklosporiini
Farmakokineettinen yhteisvaikutus diltiatseemin ja siklosporiinin välillä on havaittu tutkimuksissa, joihin osallistui munuais- ja sydämensiirtopotilaita. Munuais- ja sydämensiirtopotilailla siklosporiinin minimiannosta oli pienennettävä 15–48 %, jotta pitoisuudet säilyisivät samanlaisina kuin ennen diltiatseemin lisäämistä. Jos näitä aineita annetaan samanaikaisesti, siklosporiinipitoisuuksia on seurattava, erityisesti kun diltiatseemihoito aloitetaan, sitä muutetaan tai lopetetaan. Siklosporiinin vaikutusta diltiatseemin pitoisuuksiin plasmassa ei ole arvioitu.
Digitalis
CARDIZEM 180 mg:n anto digoksiinin kanssa 24 terveelle mieshenkilölle nosti plasman digoksiinipitoisuuksia noin 20 %. Toinen tutkija ei löytänyt digoksiinitasojen nousua 12 potilaalla, joilla oli sepelvaltimotauti. Koska digoksiinitasojen vaikutuksesta on saatu ristiriitaisia tuloksia, on suositeltavaa, että digoksiinipitoisuuksia seurataan CARDIZEM 60 mg -hoitoa aloitettaessa, säädettäessä ja lopetettaessa mahdollisen liiallisen tai alidigitalisoinnin välttämiseksi (ks. VAROITUKSET ).
Kinidiini
Diltiatsemi lisää merkittävästi kinidiinin AUC-arvoa (0→infin;) 51 %, T½:tä 36 % ja vähentää sen CLoraalia 33 %. Kinidiinin haittavaikutusten seuranta voi olla perusteltua ja annosta muuttaa vastaavasti.
Rifampiini
Rifampiinin samanaikainen anto diltiatseemin kanssa alensi diltiatseemipitoisuudet plasmassa havaitsemattomille tasoille. Diltiatsemin ja rifampiinin tai minkä tahansa tunnetun CYP3A4-induktorin samanaikaista käyttöä tulee välttää mahdollisuuksien mukaan ja harkita vaihtoehtoista hoitoa.
Statiinit
Diltiatsemi on CYP3A4:n estäjä, ja sen on osoitettu suurentavan merkittävästi joidenkin statiinien AUC-arvoa. CYP3A4:n kautta metaboloituvien statiinien myopatian ja rabdomyolyysin riski voi lisääntyä, jos diltiatseemia käytetään samanaikaisesti. Jos mahdollista, käytä ei-CYP3A4-metaboloituvaa statiinia yhdessä diltiatseemin kanssa; Muussa tapauksessa tulee harkita sekä diltiatseemin että statiinin annoksen muuttamista sekä tarkkaa tarkkailua statiiniin liittyvien haittatapahtumien merkkien ja oireiden varalta.
Terveessä vapaaehtoisessa ristikkäistutkimuksessa (N=10) simvastatiinin kerta-annoksen 20 mg anto samanaikaisesti 120 mg:n annoksen diltiatseemi SR:n kanssa kahdesti vuorokaudessa 14 päivän hoidon lopussa johti simvastatiinin keskimääräisen AUC-arvon 5-kertaiseen nousuun. verrattuna pelkkään simvastatiiniin. Koehenkilöillä, joilla oli suurentunut keskimääräinen vakaan tilan altistus diltiatseemille, simvastatiinialtistus moninkertaistui. Tietokonepohjaiset simulaatiot osoittivat, että päivittäisellä 480 mg:n diltiatseemiannoksella voidaan odottaa 8-9-kertaista simvastatiinin AUC:n keskimääräistä nousua. Jos simvastatiinin ja diltiatseemin samanaikainen anto on tarpeen, rajaa simvastatiinin vuorokausiannos 10 mg:aan ja diltiatseemin 240 mg:aan.
Kymmenen henkilön satunnaistetussa, avoimessa, 4-suuntaisessa cross-over-tutkimuksessa diltiatseemin (120 mg kahdesti vuorokaudessa diltiatseemi SR:n 2 viikon ajan) samanaikainen anto lovastatiinin 20 mg:n kerta-annoksen kanssa johti 3-4-kertaiseen nousuun. keskimääräisissä lovastatiinin AUC- ja Cmax-arvoissa verrattuna pelkkään lovastatiiniin. Samassa tutkimuksessa ei havaittu merkitsevää muutosta 20 mg:n kerta-annoksen pravastatiinin AUC- ja Cmax-arvoissa, kun diltiatseemi annettiin samanaikaisesti. Lovastatiini tai pravastatiini eivät vaikuttaneet merkittävästi diltiatseemipitoisuuksiin plasmassa.
VAROITUKSET
VAROTOIMENPITEET
Kenraali
CARDIZEM (diltiatsemihydrokloridi) metaboloituu laajalti maksassa ja erittyy munuaisten ja sapen kautta. Kuten minkä tahansa pidempiaikaisen lääkkeen kohdalla, munuaisten ja maksan toiminnan laboratorioparametreja tulee seurata säännöllisin väliajoin. Lääkettä tulee käyttää varoen potilailla, joilla on munuaisten tai maksan vajaatoiminta. Subakuuteissa ja kroonisissa koirilla ja rotilla tehdyissä tutkimuksissa, joiden tarkoituksena oli aiheuttaa toksisuutta, suuriin diltiatseemiannoksiin liittyi maksavaurioita. Erityisissä subakuuteissa maksatutkimuksissa suun kautta annetut 125 mg/kg:n tai suuremmat annokset rotilla liittyivät histologisiin muutoksiin maksassa, jotka palautuivat, kun lääke lopetettiin. Koirilla annokset 20 mg/kg liittyivät myös maksan muutoksiin; nämä muutokset kuitenkin korjautuivat annostelua jatkettaessa. Dermatologiset tapahtumat (ks HAITTAVAIKUTUKSET voi olla ohimenevää ja hävitä huolimatta CARDIZEMin jatkuvasta käytöstä. Harvoin on kuitenkin raportoitu myös ihottumia, jotka etenevät erythema multiformeksi ja/tai eksfoliatiiviseksi dermatiitiksi. Jos dermatologinen reaktio jatkuu, lääke on lopetettava.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
24 kuukautta kestäneessä tutkimuksessa rotilla ja 21 kuukauden tutkimuksessa hiirillä ei havaittu todisteita karsinogeenisuudesta. Mutageenista vastetta ei myöskään havaittu in vitro -bakteerikokeissa. Rotilla ei havaittu luontaista vaikutusta hedelmällisyyteen.
Raskaus
Luokka C
Lisääntymistutkimuksia on tehty hiirillä, rotilla ja kaniineilla. Viidestä kymmeneen kertaa suurempien annosten antaminen (mg/kg perusteella) kuin päivittäinen suositeltu terapeuttinen annos on johtanut alkio- ja sikiökuolleisuuteen. Näiden annosten on joissakin tutkimuksissa raportoitu aiheuttavan luuston poikkeavuuksia. Perinataalisissa/postnataalisissa tutkimuksissa yksilöiden varhaisten pentujen painot ja eloonjäämisluvut vähenivät jonkin verran. Kuolleena syntyneiden ilmaantuvuus lisääntyi annoksilla, jotka olivat 20 kertaa suurempia kuin ihmisannos.
Ei ole olemassa hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla; siksi käytä CARDIZEM-valmistetta raskaana oleville naisille vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle.
Imettävät äidit
Diltiatsemi erittyy äidinmaitoon. Eräässä raportissa ehdotetaan, että pitoisuudet rintamaidossa voivat olla likimääräisiä seerumipitoisuuksia. Jos CARDIZEM-valmisteen käyttö katsotaan välttämättömäksi, on otettava käyttöön vaihtoehtoinen pikkulasten ruokintamenetelmä.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Kliinisissä diltiatseemitutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
YLIANNOSTUS
Suun kautta otettavat LD50:t hiirillä ja rotilla vaihtelevat 415 - 740 mg/kg ja 560 - 810 mg/kg, vastaavasti. Laskimonsisäiset LD50-arvot näissä lajeissa olivat 60 ja 38 mg/kg. Oraalisen LD50:n koirilla katsotaan olevan yli 50 mg/kg, kun taas apinoilla havaittiin kuolleisuutta annoksella 360 mg/kg.
Myrkyllistä annosta ihmiselle ei tunneta. Laajan aineenvaihdunnan vuoksi veren pitoisuudet diltiatseemin vakioannoksen jälkeen voivat vaihdella yli kymmenkertaisesti, mikä rajoittaa veripitoisuuksien käyttökelpoisuutta yliannostustapauksissa.
Diltiatseemin yliannostusta on raportoitu määrinä, jotka vaihtelevat välillä
Diltiatseemin yliannostuksen jälkeen havaittuja tapahtumia olivat bradykardia, hypotensio, sydänkatkos ja sydämen vajaatoiminta. Useimmissa yliannostusraporteissa kuvattiin jotain tukitoimenpiteitä ja/tai lääkehoitoa. Bradykardia reagoi usein suotuisasti atropiiniin, samoin kuin sydänkatkos, vaikka sydämentahdistusta käytettiin usein myös sydäntukoksen hoitoon. Verenpaineen ylläpitämiseen käytettiin nesteitä ja vasopressoreita, ja sydämen vajaatoiminnan tapauksissa annettiin inotrooppisia aineita. Lisäksi jotkut potilaat saivat hoitoa hengitystuella, mahahuuhtelulla, aktiivihiilellä ja/tai suonensisäisellä kalsiumilla.
Kalsiumin suonensisäisen annon tehokkuus diltiatseemin yliannostuksen farmakologisten vaikutusten kumoamisessa on ollut epäjohdonmukainen. Muutamissa raportoiduissa tapauksissa kalsiumkanavasalpaajien yliannostus, johon liittyi hypotensiota ja bradykardiaa, joka oli alun perin resistentti atropiinille, reagoi paremmin atropiiniin sen jälkeen, kun potilaat saivat suonensisäistä kalsiumia. Joissakin tapauksissa suonensisäistä kalsiumia on annettu (1 g kalsiumkloridia tai 3 g kalsiumglukonaattia) 5 minuutin aikana ja toistettu 10–20 minuutin välein tarpeen mukaan. Kalsiumglukonaattia on myös annettu jatkuvana infuusiona nopeudella 2 g tunnissa 10 tunnin ajan. Kalsiumin infuusiota 24 tuntia tai pidempään voidaan tarvita. Potilaita tulee seurata hyperkalsemian merkkien varalta.
Yliannostuksen tai liiallisen vasteen sattuessa on käytettävä asianmukaisia tukitoimenpiteitä ruoansulatuskanavan dekontaminaation lisäksi. Diltiatsemi ei näytä poistuvan peritoneaalisella tai hemodialyysillä. Rajalliset tiedot viittaavat siihen, että plasmafereesi tai hiilen hemoperfuusio voivat nopeuttaa diltiatseemin eliminaatiota yliannostuksen jälkeen. Diltiatseemin tunnettujen farmakologisten vaikutusten ja/tai raportoitujen kliinisten kokemusten perusteella voidaan harkita seuraavia toimenpiteitä:
Bradykardia: Anna atropiinia (0,60-1,0 mg). Jos emättimen salpaus ei anna vastetta, anna isoproterenolia varoen.
Korkean asteen AV-esto: Käsittele kuten yllä olevaa bradykardiaa. Kiinteä korkea-asteinen AV-katkos tulee hoitaa sydämentahdistuksella.
Sydämen vajaatoiminta: Anna inotrooppisia aineita (isoproterenolia, dopamiinia tai dobutamiinia) ja diureetteja.
Hypotensio: Vasopressorit (esim. dopamiini tai norepinefriini).
Todellisen hoidon ja annoksen tulee riippua kliinisen tilanteen vakavuudesta sekä hoitavan lääkärin harkinnasta ja kokemuksesta.
VASTA-AIHEET
CARDIZEM on vasta-aiheinen (1) potilailla, joilla on sairas sinus-oireyhtymä, paitsi jos käytössä on toimiva kammiotahdistin, (2) potilailla, joilla on toisen tai kolmannen asteen AV-salpaus paitsi jos läsnä on toimiva kammiotahdistin, (3) potilailla, joilla on hypotensio (alle 90 mmHg systolinen), (4) potilaat, jotka ovat osoittaneet yliherkkyyttä lääkkeelle, ja (5) potilaat, joilla on akuutti sydäninfarkti ja keuhkokongestio, jotka on dokumentoitu röntgenkuvauksella vastaanoton yhteydessä.
KLIININEN FARMAKOLOGIA
CARDIZEM 180 mg:lla saavutettujen terapeuttisten hyötyjen uskotaan liittyvän sen kykyyn estää kalsiumionien virtaa sydämen ja verisuonten sileän lihaksen kalvon depolarisaation aikana.
Toimintamekanismit
Vaikka CARDIZEM 120mg:n antianginaalisen vaikutuksen tarkat mekanismit ovat edelleen rajaamassa, sen uskotaan vaikuttavan seuraavilla tavoilla:
Eläinmalleissa diltiatseemi häiritsee hidasta sisäänpäin suuntautuvaa (depolarisoivaa) virtaa kiihtyvässä kudoksessa. Se aiheuttaa viritys-supistus irtoamisen eri sydänkudoksissa ilman muutoksia toimintapotentiaalin konfiguraatiossa. Diltiatsemi saa aikaan sepelvaltimoiden sileän lihaksen rentoutumisen ja sekä suurten että pienten sepelvaltimoiden laajentamisen lääketasoilla, jotka aiheuttavat vain vähän tai ei ollenkaan negatiivista inotrooppista vaikutusta. Seurauksena oleva sepelvaltimon verenvirtauksen (epikardiaalinen ja subendokardiaalinen) lisääntyminen tapahtuu iskeemisissä ja ei-iskeemisissä malleissa, ja niihin liittyy annosriippuvainen systeemisen verenpaineen lasku ja perifeerisen vastuksen lasku.
Hemodynaamiset ja sähköfysiologiset vaikutukset
Kuten muutkin kalsiumantagonistit, diltiatseemi vähentää sinoatriaalista ja atrioventrikulaarista johtumista eristetyissä kudoksissa ja sillä on negatiivinen inotrooppinen vaikutus eristettyissä valmisteissa. Terveellä eläimellä AH-välin pidentymistä voidaan havaita suuremmilla annoksilla.
Ihmisellä diltiatseemi ehkäisee spontaaneja ja ergonoviinin aiheuttamia sepelvaltimon kouristuksia. Se aiheuttaa perifeerisen verisuonten vastuksen laskua ja lievää verenpaineen laskua, ja se alentaa iskeemistä sydänsairautta sairastavien potilaiden rasitustoleranssitutkimuksissa syke-verenpainetuotetta missä tahansa työkuormissa. Tähän mennessä tehdyt tutkimukset, pääasiassa potilailla, joilla on hyvä kammiotoiminta, eivät ole paljastaneet todisteita negatiivisesta inotrooppisesta vaikutuksesta; sydämen minuuttitilavuus, ejektiofraktio ja vasemman kammion loppudiastolinen paine eivät ole muuttuneet. Toistaiseksi on vähän tietoa diltiatseemin ja beetasalpaajien yhteisvaikutuksista. Leposyke yleensä pysyy ennallaan tai laskee hieman diltiatseemi.
Laskimonsisäinen diltiatseemi 20 mg:n annoksina pidentää AH:n johtumisaikaa ja AV-solmukkeen toiminnallista ja tehokasta refraktaarista ajanjaksoa noin 20 %. Tutkimuksessa, jossa annettiin 300 mg:n CARDIZEM 60 mg:n kerta-annoksia suun kautta kuudelle normaalille vapaaehtoiselle, keskimääräinen maksimaalinen PR-ajan piteneminen oli 14 % ilman ensimmäisen asteen AV-salpausta suurempia tapauksia. Diltiatseemiin liittyvä AH-ajan pidentyminen ei ole selvempää potilailla, joilla on ensimmäisen asteen sydänkatkos. Potilailla, joilla on sairas poskiontelooireyhtymä, diltiatseemi pidentää merkittävästi poskiontelosyklin pituutta (jopa 50 % joissakin tapauksissa).
CARDIZEMin jatkuva oraalinen antaminen annoksina 240 mg/vrk asti on johtanut PR-välin vähäiseen pidentymiseen, mutta se ei yleensä ole aiheuttanut epänormaalia pidentymistä.
Farmakokinetiikka ja aineenvaihdunta
Diltiatsemi imeytyy hyvin maha-suolikanavasta ja sillä on laaja ensikierron vaikutus, jolloin absoluuttinen biologinen hyötyosuus (verrattuna suonensisäiseen annostukseen) on noin 40 %. CARDIZEM käy läpi laajan metabolian, jossa 2–4 % muuttumattomasta lääkkeestä erittyy virtsaan. In vitro -sitoutumistutkimukset osoittavat, että CARDIZEM 90 mg sitoutuu 70–80 % plasman proteiineihin. Kilpailevat in vitro ligandisitoutumistutkimukset ovat myös osoittaneet, että digoksiinin, hydroklooritiatsidin, fenyylibutatsonin, propranololin, salisyylihapon tai varfariinin terapeuttiset pitoisuudet eivät muuta CARDIZEM 120 mg:n sitoutumista. Plasman eliminaation puoliintumisaika yhden tai useamman lääkkeen annon jälkeen on noin 3,0-4,5 tuntia. Desasetyylidiltiatseemia on myös plasmassa 10-20 % alkuperäisestä lääkkeestä ja se on 25-50 % yhtä tehokas sepelvaltimon vasodilataattorina kuin diltiatseemi. CARDIZEM 120 mg:n terapeuttiset plasman vähimmäistasot näyttävät olevan 50-200 ng/ml. Lineaarisuudesta poikkeaa, kun annosvahvuuksia lisätään. Tutkimuksessa, jossa verrattiin potilaita, joilla oli normaali maksan toimintakyky, potilaisiin, joilla on kirroosi, havaittiin maksan vajaatoimintapotilaiden puoliintumisajan pidentyminen ja AUC:n (plasman alla oleva pitoisuus vs. aikakäyrä) nousu 69 %. Yhdessä tutkimuksessa yhdeksällä potilaalla, joilla oli vakava munuaisten vajaatoiminta, ei havaittu eroa diltiatseemin farmakokineettisessä profiilissa verrattuna potilaisiin, joilla oli normaali munuaisten toiminta.
CARDIZEM 120 mg tabletit . Diltiatsemi imeytyy tablettiformulaatiosta noin 98 %:iin vertailuliuoksesta. CARDIZEM 30 mg tablettien 30–120 mg:n kerta-annokset suun kautta johtavat havaittaviin plasmapitoisuuksiin 30–60 minuutissa ja huippupitoisuuksiin plasmassa 2–4 tunnin kuluttua lääkkeen annosta. Kun CARDIZEM 120 mg tablettien annosta nostetaan vuorokausiannoksesta 120 mg (30 mg qid) 240 mg:aan (60 mg qid) päivässä, käyrän alla oleva pinta-ala kasvaa 2,3-kertaiseksi. Kun annosta nostetaan 240 mg:sta 360 mg:aan päivässä, käyrän alla oleva pinta-ala kasvaa 1,8-kertaiseksi.
POTILASTIEDOT
Niele Cardizem-tabletit kokonaisina; älä halkaise, murskaa tai pureskele. Cardizem 180mg:n lääkitys on muotoiltu vapautumaan hitaasti.
