Micardis 20mg, 40mg, 80mg Telmisartan Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Micardis 40mg on ja miten sitä käytetään?
Micardis on reseptilääke, jota käytetään korkean verenpaineen (hypertension) oireiden hoitoon ja sydän- ja verisuonitautien, kuten aivohalvauksen ja sydänkohtauksen, riskin vähentämiseen. Micardis 20 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Micardis 80 mg kuuluu ARB-lääkkeiden luokkaan.
Ei tiedetä, onko Micardis turvallinen ja tehokas alle 18-vuotiaille lapsille.
Mitkä ovat Micardisin mahdolliset sivuvaikutukset?
Micardis 80 mg voi aiheuttaa vakavia sivuvaikutuksia, kuten:
- huimaus,
- turvotus,
- nopea painonnousu,
- pahoinvointi,
- heikkous,
- kihelmöivä tunne,
- rintakipu,
- epäsäännölliset sydämenlyönnit ja
- liikkeen menetys
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Micardisin yleisimpiä sivuvaikutuksia ovat:
- tukkoinen nenä,
- poskiontelokipu,
- selkäkipuja ja
- ripuli
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Micardisin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta MICARDIS 40 mg:n käyttö mahdollisimman pian [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
- Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vammoja ja kuoleman kehittyvälle sikiölle [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
KUVAUS
MICARDIS 40 mg on peptidittömän angiotensiini II -reseptorin (tyyppi AT1) antagonisti.
Telmisartaani kuvataan kemiallisesti 4'-[(1,4'-dimetyyli-2'-propyyli-[2,6'-bi-1 H-bentsimidatsol]-1'-yyli)metyyli ]-[1,1'-bifenyyli]-2-karboksyylihappo. Sen empiirinen kaava on C33H30N4O2, sen molekyylipaino on 514,63 ja sen rakennekaava:
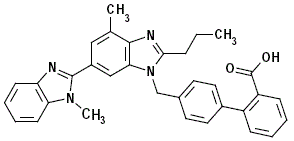
Telmisartaani on valkoinen tai hieman kellertävä kiinteä aine. Se on käytännössä liukenematon veteen ja pH-alueella 3-9, liukenee niukasti vahvaan happoon (paitsi suolahappoon liukenematon) ja liukenee vahvaan emäkseen.
MICARDIS 20 mg on saatavana tabletteina suun kautta, ja ne sisältävät 20 mg, 40 mg tai 80 mg telmisartaania. Tabletit sisältävät seuraavia inaktiivisia aineita: natriumhydroksidi, meglumiini, povidoni, sorbitoli ja magnesiumstearaatti. MICARDIS-tabletit ovat hygroskooppisia ja vaativat suojaa kosteudelta.
INDIKAATIOT
MICARDIS HCT (telmisartaani ja hydroklooritiatsidi) on tarkoitettu verenpainetaudin hoitoon, verenpaineen alentamiseen. Verenpaineen alentaminen vähentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, erityisesti aivohalvausten ja sydäninfarktien, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on tehty verenpainelääkkeitä useista eri farmakologisista luokista, mukaan lukien luokat, joihin tämä lääke pääasiallisesti kuuluu. Ei ole olemassa kontrolloituja tutkimuksia, jotka osoittaisivat riskin pienenemisen MICARDIS HCT:llä.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat useamman kuin yhden lääkkeen saavuttaakseen verenpainetavoitteensa. Tarkempia neuvoja tavoitteista ja hallinnasta on julkaistuissa ohjeissa, kuten kansallisen korkean verenpaineen koulutusohjelman kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa [katso Kliiniset tutkimukset ].
MICARDIS 40 mg HCT ei ole tarkoitettu hypertension hoidon alkuhoitoon [katso ANNOSTELU JA HALLINNOINTI ].
MICARDIS HCT:tä voidaan käyttää yksinään tai yhdessä muiden verenpainelääkkeiden kanssa.
ANNOSTELU JA HALLINNOINTI
Annostelutiedot
Aloita potilas, jonka verenpainetta ei saada riittävästi hallintaan telmisartaanimonoterapialla 80 mg MICARDIS 40 mg HCT, 80 mg/12,5 mg kerran vuorokaudessa. Tarvittaessa annosta voidaan titrata 160 mg/25 mg:aan 2–4 viikon kuluttua.
Aloita hoito MICARDIS HCT 80 mg/12,5 mg kerran vuorokaudessa potilaalle, jonka verenpainetta ei saada riittävästi hallintaan 25 mg kerran vuorokaudessa annettavalla hydroklooritiatsidilla tai jonka verenpainetta ei saada riittävästi hallintaan, mutta jolla on hypokalemia tällä hoito-ohjelmalla. Tarvittaessa annosta voidaan titrata 160 mg/25 mg:aan 2–4 viikon kuluttua.
Potilaat, jotka on titrattu yksittäisten aineosien (telmisartaanin ja hydroklooritiatsidin) mukaan, voivat sen sijaan saada vastaavan MICARDIS 20 mg HCT -annoksen.
MICARDIS 20 mg HCT voidaan antaa muiden verenpainelääkkeiden kanssa.
Annoksen säätö maksan vajaatoimintaa varten
Potilaat, joilla on sapen ahtauttavia sairauksia tai maksan vajaatoimintaa, aloitetaan tarkassa lääkärin valvonnassa käyttämällä 40 mg/12,5 mg yhdistelmää. MICARDIS 40 mg HCT-tabletteja ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (ks. Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Tärkeät hallintaohjeet
MICARDIS HCT -tabletit tulee poistaa läpipainopakkauksista vasta juuri ennen antoa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 40 mg/12,5 mg, punavalkoiset tabletit, joissa on Boehringer Ingelheim -logo ja H4
- 80 mg/12,5 mg, punavalkoiset tabletit, joissa on Boehringer Ingelheim -logo ja H8
- 80 mg/25 mg, keltaiset ja valkoiset tabletit, joissa on Boehringer Ingelheim -logo ja H9
Varastointi ja käsittely
MICARDIS 20 mg HCT on saatavana kolmea vahvuutta kaksoiskuperina kaksikerroksisina, pitkänomaisina, päällystämättöminä tabletteina, jotka sisältävät telmisartaania ja hydroklooritiatsidia:
- 40 mg/12,5 mg tabletti: punainen ja valkoinen (voi sisältää punaisia pilkkuja), merkitty Boehringer Ingelheim -yhtiötunnuksella ja H4:llä; yksittäin läpipainopakkauksissa 30 tabletin pahvikoteloissa 3 x 10 korttina ( NDC 0597-0043-37)
- 80 mg/12,5 mg tabletti: punainen ja valkoinen (voi sisältää punaisia pilkkuja), merkitty Boehringer Ingelheim -yhtiötunnuksella ja H8:lla; yksittäin läpipainopakkauksissa 30 tabletin pahvikoteloissa 3 x 10 korttina ( NDC 0597-0044-37)
- 80 mg/25 mg tabletti: keltainen ja valkoinen (saattaa sisältää keltaisia pilkkuja), merkitty Boehringer Ingelheim -yhtiötunnuksella ja H9:llä; yksittäin läpipainopakkauksissa 30 tabletin pahvikoteloissa 3 x 10 korttina ( NDC 0597-0042-37)
Varastointi
Säilytä 25°C (77°F); retket sallitaan 15°C-30°C (59°F-86°F) [katso USP Controlled Room Temperature]. Tabletit tulee poistaa läpipainopakkauksista vasta juuri ennen antoa.
Jakelija: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Tarkistettu: lokakuuta 2018
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään muualla merkinnöissä:
- Hypotensio [katso VAROITUKSET JA VAROTOIMET ]
- Munuaisten vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ]
- Elektrolyytit ja aineenvaihduntahäiriöt [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
MICARDIS HCT:n turvallisuutta on arvioitu yli 1 700 potilaalla, joista 716 sai hypertensiota yli 6 kuukautta ja 420 yli vuoden. Haittavaikutukset ovat rajoittuneet niihin, joita on raportoitu aiemmin telmisartaanin ja/tai hydroklooritiatsidin yhteydessä.
Haittavaikutukset, joiden ilmaantuvuus on ≥2 % telmisartaanilla/hydroklooritiatsidilla hoidetuilla potilailla ja useammin kuin lumelääkettä saaneilla potilailla, on esitetty taulukossa 1 [ks. Kliiniset tutkimukset ].
Muita telmisartaanin/hydroklooritiatsidin yhteydessä havaittuja haittavaikutuksia olivat: kipu (mukaan lukien selkä- ja vatsakipu), dyspepsia, punoitus, oksentelu, keuhkoputkentulehdus ja nielutulehdus.
Haittavaikutuksia esiintyi suunnilleen samalla tavalla miehillä ja naisilla, vanhemmilla ja nuoremmilla potilailla sekä mustaihoisilla ja muilla potilailla.
Telmisartaani
Muut telmisartaanin käytön yhteydessä raportoidut haittatapahtumat on lueteltu alla:
Autonominen hermosto: impotenssi, lisääntynyt hikoilu, punoitus
Keho kokonaisuutena: allergia, kuume, jalkakipu, rintakipu
Sydän: sydämentykytys, angina pectoris, epänormaali EKG, verenpainetauti, perifeerinen turvotus
Keskushermosto: unettomuus, uneliaisuus, migreeni, parestesia, tahattomat lihassupistukset, hypoestesia
Ruoansulatuskanava: ilmavaivat, ummetus, gastriitti, suun kuivuminen, peräpukamat, gastroesofageaalinen refluksi, hammassärky
Maksa-sappi: kohonneet maksaentsyymiarvot tai seerumin bilirubiini
Metabolinen: kihti, hyperkolesterolemia, diabetes mellitus
Tuki- ja liikuntaelimistö: niveltulehdus, nivelkipu, jalkakrampit, lihaskipu
Psykiatrinen: ahdistus, masennus, hermostuneisuus
Vastusmekanismi: infektio, paise, välikorvatulehdus
Hengitys: astma, nuha, hengenahdistus, nenäverenvuoto
Iho: ihottuma, ekseema, kutina
Virtsatie: virtsaamistiheys, kystiitti
Verisuoni: aivoverenkiertohäiriö
Erityiset aistit: epänormaali näkö, sidekalvotulehdus, tinnitus, korvasärky
Hydroklooritiatsidi
Muut hydroklooritiatsidin yhteydessä raportoidut haittatapahtumat on lueteltu alla:
Keho kokonaisuutena: heikkous
Ruoansulatus: haimatulehdus, keltaisuus (intrahepaattinen kolestaattinen keltaisuus), sialadeniitti, kouristukset, mahalaukun ärsytys
Hematologinen: aplastinen anemia, agranulosytoosi, leukopenia, hemolyyttinen anemia, trombosytopenia
Yliherkkyys: purppura, valoherkkyys, nokkosihottuma, nekrotisoiva angiiitti (vaskuliitti ja ihon vaskuliitti), kuume, hengitysvaikeudet mukaan lukien keuhkotulehdus ja keuhkopöhö, anafylaktiset reaktiot
Metabolinen: hyperglykemia, glykosuria
Tuki- ja liikuntaelimistö: lihaskouristus
Hermosto/psykiatriset: levottomuus
Munuaiset: interstitiaalinen nefriitti
Iho: erythema multiforme mukaan lukien Stevens-Johnsonin oireyhtymä, eksfoliatiivinen dermatiitti mukaan lukien toksinen epidermaalinen nekrolyysi
Erityiset aistit: ohimenevä näön hämärtyminen, ksanthopsia
Kliiniset laboratoriotulokset
Kreatiniini, veren ureatyppi (BUN)
BUN-arvon (≥11,2 mg/dl) ja seerumin kreatiniiniarvon (≥0,5 mg/dl) nousua havaittiin 2,8 %:lla ja 1,4 %:lla essentiaalista hypertensiota sairastavista potilaista, joita hoidettiin MICARDIS 80 mg HCT-tableteilla kontrolloiduissa tutkimuksissa. Yksikään potilas ei keskeyttänyt hoitoa MICARDIS 80 mg HCT-tableteilla BUN- tai kreatiniiniarvon nousun vuoksi [ks. VAROITUKSET JA VAROTOIMET ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu MICARDIS HCT:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei aina ole mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imusolmukkeiden häiriöt: eosinofilia
Sydänhäiriöt: eteisvärinä, kongestiivinen sydämen vajaatoiminta, sydäninfarkti, takykardia, bradykardia
Korva- ja labyrinttihäiriöt: huimaus
Yleiset häiriöt ja hallintosivuston ehdot: astenia, turvotus
Maksa-sappi: Epänormaali maksan toiminta/maksahäiriö
Immuunijärjestelmän häiriöt: anafylaktinen reaktio
Infektiot ja infektiot: virtsatieinfektio
Tutkimukset: lisääntynyt CPK
Aineenvaihdunta- ja ravitsemushäiriöt: hypoglykemia (diabeettisilla potilailla)
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt: jännekipu (mukaan lukien jännetulehdus, tenosynoviitti), rabdomyolyysi
Hermoston häiriöt: pyörtyminen, päänsärky
Munuaisten ja virtsateiden häiriöt: munuaisten vajaatoiminta, munuaisten vajaatoiminta mukaan lukien akuutti munuaisten vajaatoiminta
Lisääntymisjärjestelmän ja rintojen häiriöt: erektiohäiriö
Hengityselinten, rintakehän ja välikarsinan häiriöt: yskiminen
Ihon ja ihonalaisten kudosten häiriöt: lääkepurkaus (toksinen ihottuma, joka on raportoitu enimmäkseen toksikodermana, ihottumana ja urtikariana), angioedeema (kuolemaan johtava)
Verisuonihäiriö: ortostaattinen hypotensio
HUUMEIDEN VUOROVAIKUTUKSET
Seerumin kaliumia lisäävät aineet
Telmisartaanin samanaikainen käyttö muiden seerumin kaliumpitoisuutta nostavien lääkkeiden kanssa voi johtaa hyperkalemiaan. Seuraa seerumin kaliumarvoa tällaisilla potilailla.
Litium
Seerumin litiumpitoisuuksien nousua ja litiumtoksisuutta on raportoitu käytettäessä samanaikaisesti tiatsididiureetteja tai angiotensiini II -reseptorin salpaajia, mukaan lukien telmisartaania. Seuraa litiumpitoisuutta potilailla, jotka saavat MICARDIS 80 mg HCT:tä ja litiumia.
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklooksigenas E-2:n estäjät
Telmisartaani
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklo-oksigenaasi-2:n estäjät (COX-2-estäjät): Iäkkäille, nestevajaisille (mukaan lukien diureettihoitoa saaville) tai munuaisten vajaatoimintapotilaille, tulehduskipulääkkeiden samanaikainen käyttö, mukaan lukien selektiiviset COX-2-estäjät ja ARB:t, mukaan lukien telmisartaani, voivat heikentää munuaisten toimintaa, mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Tulehduskipulääkkeet voivat heikentää ARB-lääkkeiden verenpainetta alentavaa vaikutusta. Seuraa siksi munuaisten toimintaa ja verenpainetta säännöllisesti potilailla, jotka saavat MICARDIS 40 mg HCT:tä ja tulehduskipulääkkeitä.
Hydroklooritiatsidi
Ei-steroidisen tulehduskipuaineen, mukaan lukien selektiivisen COX2-estäjän, antaminen voi vähentää diureettien diureettisia, natriureettisia ja verenpainetta alentavia vaikutuksia. Siksi, kun MICARDIS HCT:tä ja ei-steroidisia tulehduskipulääkkeitä, mukaan lukien selektiiviset COX2-estäjät, käytetään samanaikaisesti, tarkkaile tarkasti, saavutetaanko diureetin haluttu vaikutus.
Reniini-angiotens-aldosteronijärjestelmän kaksoisesto ja muutokset munuaisten toiminnassa
Reniini-angiotensiini-aldosteronijärjestelmän (RAS) kaksoissalpaus angiotensiinisalpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, hyperkalemian ja munuaisten vajaatoiminnan riskiin. ONTARGET-tutkimukseen otettiin mukaan 25 620 potilasta, jotka olivat vähintään 55-vuotiaita, joilla oli ateroskleroottinen sairaus tai diabetes, joilla oli elinvaurioita. Heidät satunnaistettiin saamaan vain telmisartaania (ARB), vain ramipriiliä (ACE-estäjä) tai yhdistelmää, ja heitä seurattiin keskimäärin 56 kuukauden ajan. . Potilaat, jotka saivat ARB:n ja ACE:n estäjän yhdistelmää, eivät saaneet lisähyötyä (ei lisävähentynyttä sydän- ja verisuoniperäisen kuoleman, sydäninfarktin, aivohalvauksen tai sydämen vajaatoiminnan vuoksi sairaalahoitoon joutumisen riskiä) verrattuna ARB-monoterapiaan tai ACE-estäjän monoterapiaan, mutta he kokivat lisääntyneen munuaisten vajaatoiminnan ilmaantuvuus (esim. akuutti munuaisten vajaatoiminta) verrattuna monoterapiaryhmiin.
Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat MICARDIS 40 mg HCT:tä ja muita RAS:iin vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti MICARDIS HCT:n kanssa diabeetikoille. Vältä aliskireenin samanaikaista käyttöä MICARDIS HCT:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
Digoksiini
Kun telmisartaania annettiin samanaikaisesti digoksiinin kanssa, plasman digoksiinin huippupitoisuuden (49 %) ja alimman pitoisuuden (20 %) keskimääräisen nousun havaittiin. Seuraa digoksiinipitoisuutta potilailla, jotka käyttävät samanaikaisesti MICARDIS 40 mg HCT:tä ja digoksiinia.
Diabeteslääkkeet (oraaliset aineet ja insuliini)
Diabeteslääkkeiden annostuksen muuttaminen saattaa olla tarpeen, kun niitä annetaan samanaikaisesti hydroklooritiatsidin kanssa.
Kolestyramiini ja kolestipolihartsit
Hydroklooritiatsidin imeytyminen heikkenee anioninvaihtohartsien läsnä ollessa. Porrastetaan hydroklooritiatsidin ja hartsin annostusta siten, että hydroklooritiatsidi annetaan vähintään 4 tuntia ennen tai 4–6 tuntia hartsin annon jälkeen.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Sikiön toksisuus
Telmisartaani
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta MICARDIS HCT -hoito mahdollisimman pian.
Hydroklooritiatsidi
Tiatsidit läpäisevät istukan ja näkyvät napanuoraveressä. Haittavaikutuksia ovat sikiön tai vastasyntyneen keltaisuus ja trombosytopenia [katso Käyttö tietyissä populaatioissa ].
Hypotensio volyymi- tai suolapuutteellisilla potilailla
Potilailla, joilla on aktivoitunut reniini-angiotensiinijärjestelmä, kuten neste- tai suolavaje (esim. potilailla, joita hoidetaan suurilla diureetiannoksilla), oireista hypotensiota voi esiintyä MICARDIS HCT -hoidon aloittamisen jälkeen. Korjaa neste- tai suolavaje ennen MICARDIS 80 mg HCT:n antamista.
Munuaisten vajaatoiminta
Muutoksia munuaisten toiminnassa, mukaan lukien akuutti munuaisten vajaatoiminta, voivat aiheuttaa reninangiotensiinijärjestelmää estävät lääkkeet ja diureetit. Potilailla, joiden munuaisten toiminta saattaa riippua osittain reniini-angiotensiinijärjestelmän aktiivisuudesta (esim. potilaat, joilla on munuaisvaltimon ahtauma, krooninen munuaissairaus, vaikea sydämen vajaatoiminta tai tilavuusvaje), voi olla erityinen riski sairastua oliguriaan, etenevään atsotemiaan. tai akuutti munuaisten vajaatoiminta MICARDIS HCT:llä. Seuraa näiden potilaiden munuaisten toimintaa säännöllisesti. Harkitse hoidon keskeyttämistä tai lopettamista potilailla, joiden munuaisten toiminta heikkenee kliinisesti merkitsevästi MICARDIS HCT -hoidon aikana.
Elektrolyytit ja aineenvaihduntahäiriöt
Lääkkeet, mukaan lukien telmisartaani, jotka estävät reniini-angiotensiinijärjestelmää, voivat aiheuttaa hyperkalemiaa, erityisesti potilailla, joilla on munuaisten vajaatoiminta, diabetes tai yhdistelmähoito muiden angiotensiinireseptorin salpaajien tai ACE:n estäjien kanssa ja muiden seerumin kaliumtasoja nostavien lääkkeiden samanaikainen käyttö [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Hydroklooritiatsidi voi aiheuttaa hypokalemiaa ja hyponatremiaa. Tiatsidien on osoitettu lisäävän magnesiumin erittymistä virtsaan; tämä voi johtaa hypomagnesemiaan. Hypomagnesemia voi johtaa hypokalemiaan, jota voi olla vaikea hoitaa kaliumin lisääntymisestä huolimatta. Tarkkaile seerumin elektrolyyttejä säännöllisesti.
Kontrolloiduissa tutkimuksissa, joissa käytettiin telmisartaani/hydroklooritiatsidi-yhdistelmähoitoa, yksikään potilas, jolle annettiin annoksia 40 mg/12,5 mg, 80 mg/12,5 mg tai 80 mg/25 mg, ei kokenut kaliumtason laskua ≥ 1,4 mEq/l, eikä yhdelläkään potilaalla esiintynyt hyperkalemiaa.
Hydroklooritiatsidi vähentää kalsiumin erittymistä virtsaan ja voi aiheuttaa seerumin kalsiumpitoisuuden nousua.
Hydroklooritiatsidi voi muuttaa glukoosinsietokykyä ja nostaa seerumin kolesteroli- ja triglyseridipitoisuuksia.
Tietyillä tiatsidihoitoa saavilla potilailla saattaa esiintyä hyperurikemiaa tai kihtiä. Koska telmisartaani vähentää virtsahappoa, telmisartaani yhdessä hydroklooritiatsidin kanssa heikentää diureettien aiheuttamaa hyperurikemiaa.
Yliherkkyysreaktio
Hydroklooritiatsidi
Yliherkkyysreaktioita hydroklooritiatsidille voi esiintyä potilailla, joilla on tai ei ole aiemmin ollut allergiaa tai keuhkoastmaa, mutta ne ovat todennäköisempiä potilailla, joilla on tällainen historia [ks. VASTA-AIHEET ].
Akuutti likinäköisyys ja toissijainen kulmaglaukooma
Hydroklooritiatsidi, sulfonamidi, voi aiheuttaa idiosynkraattisen reaktion, joka johtaa akuuttiin ohimenevään likinäköisyyteen ja akuuttiin sulkeutumiskulmaglaukoomaan. Oireita ovat akuutti näöntarkkuuden heikkeneminen tai silmäkipu, ja ne ilmenevät tyypillisesti tunneista viikkoihin lääkkeen aloittamisen jälkeen. Hoitamaton akuutti kulmaglaukooma voi johtaa pysyvään näön menetykseen. Ensisijainen hoito on hydroklooritiatsidin käytön lopettaminen mahdollisimman nopeasti. Nopeaa lääketieteellistä tai kirurgista hoitoa voidaan joutua harkitsemaan, jos silmänpaine pysyy hallitsemattomana. Akuutin kulmaglaukooman kehittymisen riskitekijöihin voi kuulua aiempi sulfonamidi- tai penisilliiniallergia.
Systeeminen lupus erythematosus
Tiatsididiureettien on raportoitu aiheuttavan systeemisen lupus erythematosuksen pahenemista tai aktivoitumista.
Postsympathectomy potilaat
Hydroklooritiatsidin verenpainetta alentavat vaikutukset voivat voimistua sympathektomiapotilailla.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Raskaus
Neuvo hedelmällisessä iässä oleville naispotilaille MICARDIS 40 mg HCT:lle raskauden aikana altistumisen seurauksista. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Kerro potilaille ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Imetys
Neuvo imettäviä naisia olemaan imettämättä MICARDIS HCT -hoidon aikana [katso Käyttö tietyissä populaatioissa ].
Oireinen hypotensio ja pyörtyminen
Kerro potilaille, että huimausta voi esiintyä, erityisesti hoidon ensimmäisten päivien aikana, ja ilmoittaa siitä terveydenhuollon tarjoajalleen. Kerro potilaille, että riittämätön nesteen saanti, liiallinen hikoilu, ripuli tai oksentelu voivat johtaa liialliseen verenpaineen laskuun, jolla on samat seuraukset, kuten huimaus ja mahdollinen pyörtyminen. Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan, jos pyörtyminen tapahtuu [katso VAROITUKSET JA VAROTOIMET ].
Kaliumlisät
Neuvo potilaita olemaan käyttämättä kaliumlisäaineita tai suolan korvikkeita, jotka sisältävät kaliumia neuvottelematta lääkärin määräävän terveydenhuollon tarjoajan kanssa [katso VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Akuutti likinäköisyys ja toissijainen kulmaglaukooma
Neuvo potilaita lopettamaan MICARDIS 80 mg HCT:n käyttö ja hakeutumaan välittömästi lääkärin hoitoon, jos heillä on akuutin likinäköisyyden tai sekundaarisen kulmaglaukooman oireita [ks. VAROITUKSET JA VAROTOIMET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Telmisartaani ja hydroklooritiatsidi
Telmisartaanin ja hydroklooritiatsidin yhdistelmällä ei ole tehty karsinogeenisuus-, mutageenisuus- tai hedelmällisyystutkimuksia.
Telmisartaani
Ei ollut todisteita karsinogeenisuudesta, kun telmisartaania annettiin ruokavaliossa hiirille ja rotille enintään 2 vuoden ajan. Korkeimmat hiirille (1000 mg/kg/vrk) ja rotille (100 mg/kg/vrk) annetut annokset ovat mg/m2:n perusteella laskettuna noin 59-kertaisia ja 13-kertaisia ihmisille suositeltuihin enimmäisannoksiin (MRHD). telmisartaani. Näiden samojen annosten on osoitettu saavan aikaan keskimääräisen systeemisen altistuksen telmisartaanille >100-kertaisesti ja >25-kertaisena verrattuna ihmisiin, jotka saavat telmisartaanin MRHD:tä (80 mg/vrk).
Genotoksisuuskokeet eivät paljastaneet telmisartaaniin liittyviä vaikutuksia geeni- tai kromosomitasolla. Näihin määrityksiin sisältyivät bakteerien mutageenisuustestit Salmonellalla ja E. colilla (Ames), geenimutaatiotesti kiinanhamsterin V79-soluilla, sytogeneettinen testi ihmisen lymfosyyteillä ja hiiren mikrotumatesti.
Mitään lääkkeisiin liittyviä vaikutuksia uros- ja naarasrottien lisääntymiskykyyn ei havaittu 100 mg/kg/vrk (suurin annettu annos), noin 13 kertaa telmisartaanin MRHD:n mg/m2 perusteella. Tämä annos rotalla johti keskimääräiseen systeemiseen altistukseen (telmisartaanin AUC määritettynä 6. raskauspäivänä) vähintään 50 kertaa suurempi kuin keskimääräinen systeeminen altistus ihmisillä MRHD:llä (80 mg/vrk).
Hydroklooritiatsidi
Kansallisen toksikologiaohjelman (NTP) alaisuudessa tehdyt kaksivuotiset ruokintatutkimukset hiirillä ja rotilla eivät paljastaneet näyttöä hydroklooritiatsidin syöpää aiheuttavasta potentiaalista naarashiirillä (annoksilla enintään noin 600 mg/kg/vrk) tai uroksilla. ja naarasrotilla (annoksilla enintään noin 100 mg/kg/vrk). NTP löysi kuitenkin kiistanalaisia todisteita hepatokarsinogeenisuudesta uroshiirillä.
Hydroklooritiatsidi ei ollut genotoksinen in vitro Salmonella typhimurium -kantojen TA 98, TA 100, TA 1535, TA 1537 ja TA 1538 Amesin mutageenisuuskokeessa eikä kiinalaisen hamsterin munasarjan (CHO) testissä kromosomien in vivoation tai aberation in aberration hiiren itusolujen kromosomit, kiinanhamsterin luuytimen kromosomit ja Drosophilan sukupuoleen liittyvä resessiivinen tappava piirregeeni. Positiiviset testitulokset saatiin in vitro CHO Sister Chromatid Exchange (klastogeenisuus) -määrityksessä, hiiren lymfoomasolumäärityksessä (mutageenisuus) ja Aspergillus nidulansin ei-disjunktiomäärityksessä.
Hydroklooritiatsidilla ei ollut haitallisia vaikutuksia kummankaan sukupuolen hiirten ja rottien hedelmällisyyteen tutkimuksissa, joissa nämä lajit altistettiin ruokavalionsa kautta annoksille, jotka olivat 100 ja 4 mg/kg, vastaavasti ennen parittelua ja koko tiineyden ajan.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
MICARDIS HCT voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa (ks. Kliiniset näkökohdat ). Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Telmisartaanilla tehdyt tutkimukset rotilla ja kaniineilla osoittivat sikiötoksisuutta vain emolle toksisilla annoksilla (ks. Data ). Kun raskaus havaitaan, lopeta MICARDIS HCT -hoito mahdollisimman pian.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Sairauteen liittyvä äidin ja/tai alkion/sikiön riski
Raskaudenaikainen hypertensio lisää äidin riskiä pre-eklampsialle, raskausdiabetekselle, ennenaikaisille synnytyksille ja synnytyskomplikaatioille (esim. keisarileikkauksen tarve ja synnytyksen jälkeinen verenvuoto). Hypertensio lisää sikiön riskiä kohdunsisäiseen kasvun rajoittumiseen ja kohdunsisäiseen kuolemaan. Verenpainetautia sairastavia raskaana olevia naisia tulee seurata huolellisesti ja hoitaa sen mukaisesti.
Sikiön/vastasyntyneen haittavaikutukset
Telmisartaani
RAS:iin vaikuttavien lääkkeiden käyttö raskauden toisella ja kolmannella kolmanneksella voi aiheuttaa seuraavia seurauksia: oligohydramnion, sikiön munuaisten vajaatoiminta, joka johtaa anuriaan ja munuaisten vajaatoimintaan, sikiön keuhkojen hypoplasia, luuston epämuodostumat, mukaan lukien kallon hypoplasia, hypotensio ja kuolema. . Siinä epätavallisessa tapauksessa, että reniini-angiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisesta riskistä sikiölle.
Potilaille, jotka käyttävät MICARDIS HCT:tä raskauden aikana, suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Sikiön testaus voi olla tarkoituksenmukaista raskausviikon perusteella. Jos havaitaan oligohydramnionia, lopeta MICARDIS HCT -hoito, ellei sitä pidetä äidin hengenpelastajana. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion.
Tarkkaile tarkasti lapsia, jotka ovat altistuneet kohdussa MICARDIS 20 mg HCT:lle hypotension, oligurian ja hyperkalemian vuoksi. Jos esiintyy oliguriaa tai hypotensiota, tue verenpainetta ja munuaisten perfuusiota. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona kääntää hypotensio ja korvata munuaisten toiminta [ks. Käyttö tietyissä populaatioissa ].
Hydroklooritiatsidi
Tiatsidit läpäisevät istukan, ja tiatsidien käyttöön raskauden aikana liittyy sikiön tai vastasyntyneen keltaisuuden, trombosytopenian ja mahdollisten muiden aikuisilla esiintyneiden haittavaikutusten riski.
Data
Eläinten tiedot
MICARDIS 40 mg HCT
Rotilla suoritettiin kehitystoksisuustutkimus telmisartaanin/hydroklooritiatsidin annoksilla 3,2/1,0, 15/4,7, 50/15,6 ja 0/15,6 mg/kg/vrk. Vaikka kaksi suuremman annoksen yhdistelmää näyttivät olevan myrkyllisempiä (merkittävä ruumiinpainon nousu) emoille kuin kumpikaan lääke yksinään, kehittyvien alkioiden toksisuus ei näyttänyt lisääntyvän.
Telmisartaani
Teratogeenisia vaikutuksia ei havaittu, kun telmisartaania annettiin tiineille rotille suun kautta enintään 50 mg/kg/vrk ja tiineille kaniineille suun kautta annetuilla annoksilla 45 mg/kg/vrk. Kaneilla havaittiin emotoksisuuteen (kehon painon nousun ja ruoan kulutuksen väheneminen) liittyvää alkiokuolleisuutta annoksella 45 mg/kg/vrk (noin 12 kertaa suurempi kuin ihmiselle suositeltu enimmäisannos [MRHD], 80 mg/m2). Rotilla havaittiin emolle toksisten (vähentynyt painonnousu ja ruuankulutus) telmisartaaniannosten 15 mg/kg/vrk (noin 1,9 kertaa MRHD mg/m2:n perusteella) annettaessa haittavaikutuksia myöhäisen tiineyden ja imetyksen aikana. vastasyntyneillä, mukaan lukien heikentynyt elinkelpoisuus, alhainen syntymäpaino, viivästynyt kypsyminen ja vähentynyt painonnousu. Annokset, joilla ei havaittu vaikutusta kehitysmyrkyllisyyteen rotilla ja kaniineilla, 5 ja 15 mg/kg/vrk, ovat vastaavasti noin 0,64 ja 3,7 kertaa telmisartaanin MRHD (80 mg/vrk) mg/m2 perusteella. ).
Hydroklooritiatsidi
Tutkimuksissa, joissa hydroklooritiatsidia annettiin raskaana oleville hiirille ja rotille niiden merkittävien organogeneesijaksojen aikana annoksina 3 000 ja 1 000 mg/kg/vrk (noin 600 ja 400 kertaa MRHD), ei saatu näyttöä sikiölle aiheutuneesta haitasta. .
Tiatsidit voivat läpäistä istukan, ja napalaskimossa saavutetut pitoisuudet ovat lähellä äidin plasman pitoisuuksia. Hydroklooritiatsidi, kuten muutkin diureetit, voi aiheuttaa istukan hypoperfuusiota. Se kerääntyy lapsiveteen, ja raportoitujen pitoisuuksien on jopa 19 kertaa suurempi kuin napalaskimon plasmassa. Tiatsidien käyttöön raskauden aikana liittyy sikiön tai vastasyntyneen keltaisuuden tai trombosytopenian riski. Koska ne eivät estä tai muuta EPH:n (turvotus, proteinuria, hypertensio) gestoosin (pre-eklampsia) etenemistä, näitä lääkkeitä ei tule käyttää raskaana olevien naisten kohonneen verenpaineen hoitoon. Hydroklooritiatsidin käyttöä muihin käyttöaiheisiin (esim. sydänsairaus) raskauden aikana tulee välttää.
Imetys
Riskien yhteenveto
Ei ole tietoa MICARDIS 20 mg HCT:n tai telmisartaanin erittymisestä äidinmaitoon, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon. Rajoitetut julkaistut tutkimukset raportoivat, että hydroklooritiatsidia erittyy äidinmaitoon. Ei kuitenkaan ole riittävästi tietoa hydroklooritiatsidin vaikutuksista imetettävään lapseen tai hydroklooritiatsidin vaikutuksiin maidontuotantoon. Telmisartaania erittyy imettävien rottien maidossa. (katso Data ). Koska imetettävälle lapselle voi aiheutua vakavia haittavaikutuksia, kuten hypotensio, hyperkalemia ja munuaisten vajaatoiminta, kehota imettävää naista olemaan imettämättä MICARDIS HCT -hoidon aikana.
Data
Telmisartaania esiintyi imettävien rottien maidossa pitoisuuksina, jotka olivat 1,5–2 kertaa plasmassa havaitut pitoisuudet 4–8 tunnin kuluttua annosta.
Käyttö lapsille
MICARDIS HCT:n turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Vastasyntyneet, jotka ovat aiemmin altistuneet kohdussa MICARDIS HCT:lle
Jos esiintyy oliguriaa tai hypotensiota, tue verenpainetta ja munuaisten perfuusiota. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja/tai korvata häiriintynyttä munuaisten toimintaa.
Geriatrinen käyttö
Kontrolloiduissa kliinisissä tutkimuksissa (n=1017) noin 20 % telmisartaanilla/hydroklooritiatsidilla hoidetuista potilaista oli 65-vuotiaita tai vanhempia ja 5 % oli 75-vuotiaita tai vanhempia. Telmisartaanin/hydroklooritiatsidin tehossa ja turvallisuudessa ei havaittu yleisiä eroja näillä potilailla nuorempiin potilaisiin verrattuna. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois. Yleensä iäkkäille potilaille annosvalinnassa tulee olla varovaista, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisten sairauksien tai muun lääkehoidon yleisempää esiintymistä.
Käyttö potilailla, joilla on maksan vajaatoiminta
Potilaiden, joilla on sapen ahtauttavia sairauksia tai maksan vajaatoimintaa, hoito tulee aloittaa tarkassa lääkärin valvonnassa käyttämällä 40 mg/12,5 mg yhdistelmää.
Telmisartaani
Koska suurin osa telmisartaanista eliminoituu sapen kautta, potilailla, joilla on sapen ahtauttavia sairauksia tai maksan vajaatoimintaa, voidaan olettaa olevan alentunut puhdistuma ja korkeampi veren pitoisuus.
Hydroklooritiatsidi
Pienet neste- ja elektrolyyttitasapainon muutokset voivat aiheuttaa maksakooman potilailla, joilla on maksan vajaatoiminta tai etenevä maksasairaus.
Käyttö potilailla, joilla on munuaisten vajaatoiminta
MICARDIS 40 mg HCT:n turvallisuutta ja tehoa potilailla, joilla on vaikea munuaisten vajaatoiminta (CrCl ≤30 ml/min), ei ole osoitettu. MICARDIS 80 mg HCT-tabletteja ei suositella potilaille, joilla on vaikea munuaisten vajaatoiminta. Annosta ei tarvitse muuttaa potilailla, joilla on lievä (CrCl 60 - 90 ml/min) tai kohtalainen (CrCl 30 - 60 ml/min) munuaisten vajaatoiminta.
YLIANNOSTUS
Telmisartaani
Telmisartaanin yliannostuksesta ihmisille on saatavilla rajoitetusti tietoa. Telmisartaanin yliannostuksen todennäköisimpiä oireita ovat hypotensio, huimaus ja takykardia; bradykardia voi johtua parasympaattisesta (vagaalisesta) stimulaatiosta. Jos oireista hypotensiota ilmenee, tukihoitoa tulee aloittaa. Telmisartaani ei poistu hemodialyysillä.
Hydroklooritiatsidi
Yleisimmät hydroklooritiatsidin yliannostuksen saaneilla potilailla havaitut merkit ja oireet ovat elektrolyyttivajauksesta (hypokalemia, hypokloremia, hyponatremia) ja liiallisesta diureesista johtuvasta nestehukasta johtuvat oireet. Jos myös digitalista on annettu, hypokalemia voi pahentaa sydämen rytmihäiriöitä. Sitä, missä määrin hydroklooritiatsidi poistuu hemodialyysillä, ei ole varmistettu. Hydroklooritiatsidin oraalinen LD on yli 10 g/kg sekä hiirillä että rotilla.
VASTA-AIHEET
MICARDIS HCT on vasta-aiheinen:
- Potilailla, jotka ovat yliherkkiä jollekin tämän tuotteen komponentille [katso VAROITUKSET JA VAROTOIMET ].
- Anuriasta kärsivillä potilailla.
- Yhteiskäyttö aliskireenin kanssa diabetespotilailla [ks HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
MICARDIS 40 mg HCT
MICARDIS 20 mg HCT on kahden verenpainetta alentavan lääkkeen yhdistelmä: tiatsididiureetti, hydroklooritiatsidi ja angiotensiini II -reseptorin salpaaja (ARB), telmisartaani.
Telmisartaani
Angiotensiini II muodostuu angiotensiini I:stä angiotensiiniä konvertoivan entsyymin (ACE, kininaasi II) katalysoimassa reaktiossa. Angiotensiini II on reniini-angiotensiinijärjestelmän pääasiallinen painetta aiheuttava aine, jonka vaikutuksia ovat verisuonten supistuminen, aldosteronin synteesin ja vapautumisen stimulaatio, sydämen stimulaatio ja natriumin uudelleenabsorptio. Telmisartaani estää angiotensiini II:n vasokonstriktori- ja aldosteronia erittävät vaikutukset estämällä selektiivisesti angiotensiini II:n sitoutumisen AT1-reseptoriin monissa kudoksissa, kuten verisuonten sileässä lihaksessa ja lisämunuaisessa. Siksi sen vaikutus on riippumaton angiotensiini II -synteesin reiteistä.
Monissa kudoksissa on myös AT2-reseptori, mutta AT2:n ei tiedetä liittyvän kardiovaskulaariseen homeostaasiin. Telmisartaanilla on paljon suurempi affiniteetti (> 3 000-kertainen) AT1-reseptoriin kuin AT2-reseptoriin.
Telmisartaani ei estä ACE:ta (kininaasi II) eikä sitoudu tai estä muita hormonireseptoreja tai ionikanavia, joiden tiedetään olevan tärkeitä kardiovaskulaarisen säätelyn kannalta.
Angiotensiini II -reseptorin salpaus estää angiotensiini II:n negatiivisen säätelyn takaisinkytkennän reniinin erittymiseen, mutta sen seurauksena lisääntynyt plasman reniiniaktiivisuus ja angiotensiini II:n verenkierrossa olevat tasot eivät voita telmisartaanin vaikutusta verenpaineeseen.
Hydroklooritiatsidi
Hydroklooritiatsidi on tiatsididiureetti. Tiatsidit vaikuttavat elektrolyyttien takaisinabsorption munuaisten tubulusmekanismeihin ja lisäävät suoraan natriumsuolan ja kloridin erittymistä suunnilleen vastaavina määrinä. Hydroklooritiatsidin diureettinen vaikutus vähentää epäsuorasti plasman tilavuutta, minkä seurauksena plasman reniiniaktiivisuus lisääntyy, aldosteronin eritys lisääntyy, virtsan kaliumhäviö lisääntyy ja seerumin kaliumpitoisuus vähenee. Angiotensiini II välittää reniini-aldosteroniyhteyttä, joten ARB:n samanaikainen anto pyrkii kääntämään näiden diureettien aiheuttaman kaliumhäviön. Tiatsidien verenpainetta alentavan vaikutuksen mekanismia ei täysin tunneta.
Farmakodynamiikka
Telmisartaani
Tavallisilla vapaaehtoisilla 80 mg:n telmisartaaniannos esti suonensisäisen angiotensiini II:n infuusion painevasteen noin 90 % plasman huippupitoisuuksilla ja noin 40 %:n eston jatkuessa 24 tuntia.
Plasman angiotensiini II:n pitoisuus ja plasman reniiniaktiivisuus nousivat annoksesta riippuvaisella tavalla, kun telmisartaania annettiin kerta-annoksena terveille koehenkilöille ja toistuvasti verenpainepotilaille. Kerran vuorokaudessa annettu 80 mg telmisartaania terveille koehenkilöille ei vaikuttanut plasman aldosteronipitoisuuksiin. Verenpainepotilailla tehdyissä toistuvia annoksia koskevissa tutkimuksissa ei havaittu kliinisesti merkittäviä muutoksia elektrolyytteissä (seerumin kaliumissa tai natriumissa) eikä aineenvaihduntatoiminnassa (mukaan lukien seerumin kolesteroli-, triglyseridi-, HDL-, LDL-, glukoosi- tai virtsahappotasot).
Telmisartaanin verenpainetta alentavia vaikutuksia on tutkittu kuudessa lumekontrolloidussa kliinisessä tutkimuksessa, joihin osallistui yhteensä 1 773 potilasta, joilla oli lievä tai keskivaikea verenpaine (diastolinen verenpaine 95 - 114 mmHg), joista 1 031 sai telmisartaania. Kerran vuorokaudessa annetun telmisartaanin verenpaineen laskun suuruus verrattuna lähtötasoon lumelääkkeen vähentämisen jälkeen oli noin (SBP/DBP) 6-8/6 mmHg 20 mg:lla, 9-13/6-8 mmHg 40 mg:lla ja 12 -13/7-8 mmHg 80 mg:lle. Suuremmat annokset (jopa 160 mg) eivät näyttäneet aiheuttavan verenpaineen laskua entisestään.
Verenpainetta alentava vaikutus alkaa 3 tunnin kuluessa ja vähenee maksimissaan noin 4 viikossa. 20, 40 ja 80 mg:n annoksilla telmisartaanin kerran vuorokaudessa annetun verenpainetta alentava vaikutus säilyi koko 24 tunnin annosvälin ajan.
30 verenpainepotilaalla, joilla oli normaali munuaisten toiminta ja joita hoidettiin 8 viikon ajan telmisartaanilla 80 mg tai 80 mg telmisartaanilla yhdessä 12,5 mg:n hydroklooritiatsidin kanssa, ei havaittu kliinisesti merkittäviä muutoksia lähtötasoon verrattuna munuaisten verenkierrossa, glomerulusten suodatusnopeudessa, suodatusfraktiossa, renovaskulaarisessa resistenssissä, tai kreatiniinipuhdistuma.
Hydroklooritiatsidi
Hydroklooritiatsidin oraalisen annon jälkeen diureesi alkaa 2 tunnin kuluessa, saavuttaa huippunsa noin 4 tunnin kuluttua ja kestää noin 6-12 tuntia.
Huumeiden vuorovaikutukset
Hydroklooritiatsidi
Alkoholi, barbituraatit tai huumeet
Ortostaattinen hypotensio voi voimistua.
Luuston lihasrelaksantit
Mahdollisesti lisääntynyt herkkyys lihasrelaksanteille, kuten curare-johdannaisille.
Kortikosteroidit, ACTH
Tehostettu elektrolyyttivajaus, erityisesti hypokalemia.
Painetta aiheuttavat amiinit (esim. norepinefriini)
Mahdollisesti heikentynyt vaste paineamiineille, mutta ei riitä estämään niiden käyttöä.
Farmakokinetiikka
Telmisartaani
Imeytyminen:
Suun kautta otetun telmisartaanin huippupitoisuudet (Cmax) saavutetaan 0,5–1 tunnissa annostelun jälkeen. Ruoka alentaa hieman telmisartaanin biologista hyötyosuutta, ja plasman pitoisuus-aikakäyrän alla oleva pinta-ala (AUC) pienenee noin 6 % 40 mg:n annoksella ja noin 20 % 160 mg:n annoksen jälkeen. MICARDIS 20 mg HCT voidaan ottaa ruoan kanssa tai ilman. Telmisartaanin absoluuttinen hyötyosuus on annoksesta riippuvainen. Annoksilla 40 ja 160 mg biologinen hyötyosuus oli 42 % ja 58 %. Telmisartaanin farmakokinetiikka suun kautta annetun MICARDIS 20 mg:n kanssa on epälineaarinen annosalueella 20–160 mg, ja plasman pitoisuudet (Cmax ja AUC) suurenevat enemmän kuin suhteellisesti annoksen kasvaessa. Telmisartaanilla on kaksi eksponentiaalista hajoamiskinetiikkaa ja terminaalinen eliminaation puoliintumisaika on noin 24 tuntia. Kerran vuorokaudessa otettaessa telmisartaanin pienimmät pitoisuudet plasmassa ovat noin 10–25 % plasman huippupitoisuuksista. Telmisartaanin kumulaatioindeksi plasmassa on 1,5-2,0, kun sitä annetaan toistuvasti kerran vuorokaudessa.
Jakelu:
Telmisartaani sitoutuu voimakkaasti plasman proteiineihin (> 99,5 %), pääasiassa albumiiniin ja happamaan α1-glykoproteiiniin. Sitoutuminen plasman proteiineihin on vakio suositelluilla annoksilla saavutetulla pitoisuusalueella. Telmisartaanin jakautumistilavuus on noin 500 litraa, mikä viittaa lisäsitoutumiseen kudoksiin.
Aineenvaihdunta:
Telmisartaani metaboloituu konjugoimalla muodostaen farmakologisesti inaktiivisen asyyliglukuronidin; emoyhdisteen glukuronidi on ainoa metaboliitti, joka on tunnistettu ihmisen plasmasta ja virtsasta. Kerta-annoksen jälkeen glukuronidi edustaa noin 11 % plasman mitatusta radioaktiivisuudesta. Sytokromi P450-isoentsyymit eivät osallistu telmisartaanin metaboliaan.
Eliminaatio:
Kun 14C-merkittyä telmisartaania annettiin joko suonensisäisesti tai suun kautta, suurin osa annetusta annoksesta (> 97 %) poistui muuttumattomana ulosteen mukana sapen kautta. virtsasta löydettiin vain pieniä määriä (0,91 % ja 0,49 % kokonaisradioaktiivisuudesta).
Telmisartaanin plasman kokonaispuhdistuma on > 800 ml/min. Terminaalinen puoliintumisaika ja kokonaispuhdistuma näyttävät olevan annoksesta riippumattomia.
Hydroklooritiatsidi
Hydroklooritiatsidi ei metaboloidu, vaan eliminoituu nopeasti munuaisten kautta. Kun plasman pitoisuuksia on seurattu vähintään 24 tuntia, plasman puoliintumisajan on havaittu vaihtelevan 5,6 ja 14,8 tunnin välillä. Vähintään 61 % suun kautta otetusta annoksesta eliminoituu muuttumattomana 24 tunnin kuluessa.
Hydroklooritiatsidi läpäisee istukan mutta ei veri-aivoestettä ja erittyy äidinmaitoon.
Tietyt populaatiot
Telmisartaani
Munuaisten vajaatoiminta
Telmisartaani ei poistu verestä hemofiltraatiolla [katso VAROITUKSET JA VAROTOIMET , ja Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla telmisartaanin pitoisuudet plasmassa ovat suurentuneet ja absoluuttinen hyötyosuus on lähes 100 % [ks. Käyttö tietyissä populaatioissa ].
Sukupuoli
Plasman telmisartaanipitoisuudet ovat yleensä 2–3 kertaa korkeammat naisilla kuin miehillä. Kliinisissä tutkimuksissa naisilla ei kuitenkaan havaittu merkittävää verenpainevasteen tai ortostaattisen hypotension ilmaantuvuuden lisääntymistä. Annoksen säätäminen ei ole tarpeen.
Geriatriset potilaat
Telmisartaanin farmakokinetiikka ei eroa iäkkäiden ja alle 65-vuotiaiden välillä.
Huumeiden vuorovaikutustutkimukset
Telmisartaani
Ramipril
Telmisartaanin 80 mg kerran vuorokaudessa ja ramipriilin 10 mg kerran vuorokaudessa samanaikainen anto terveille koehenkilöille nostaa ramipriilin vakaan tilan Cmax- ja AUC-arvoja 2,1-kertaisesti ja ramiprilaatin Cmax-arvoja 2,4- ja AUC-arvoja 1,5-kertaisiksi. . Sitä vastoin telmisartaanin Cmax pienenee 31 % ja AUC 16 %. Kun telmisartaania ja ramipriiliä annetaan samanaikaisesti, vaste voi olla suurempi johtuen yhdistelmälääkkeiden mahdollisesti additiivisista farmakodynaamisista vaikutuksista ja myös lisääntyneestä ramipriilille ja ramiprilaatille altistumisesta telmisartaanin läsnä ollessa.
Muut huumeet
Telmisartaanin samanaikainen anto ei johtanut kliinisesti merkittävään yhteisvaikutukseen asetaminofeenin, amlodipiinin, glyburidin, simvastatiinin, hydroklooritiatsidin, varfariinin tai ibuprofeenin kanssa. Telmisartaani ei metaboloidu sytokromi P450 -järjestelmän toimesta, eikä sillä ollut in vitro vaikutuksia sytokromi P450 -entsyymeihin, lukuun ottamatta jonkin verran CYP2C19:n estoa. Telmisartaanin ei odoteta olevan yhteisvaikutuksia sytokromi P450 -entsyymejä estävien lääkkeiden kanssa. sillä ei myöskään odoteta olevan yhteisvaikutuksia sytokromi P450 -entsyymien metaboloimien lääkkeiden kanssa, lukuun ottamatta mahdollista CYP2C19:n kautta metaboloituvien lääkkeiden metaboliaa.
Kliiniset tutkimukset
Telmisartaani ja hydroklooritiatsidi
Kontrolloiduissa kliinisissä tutkimuksissa, joihin osallistui yli 2 500 verenpainepotilasta, 1 017 potilasta altistui telmisartaanille (20–160 mg) ja samanaikaisesti hydroklooritiatsidille (6,25–25 mg). Näihin tutkimuksiin sisältyi yksi tekijätutkimus (tutkimus 1), jossa telmisartaanin (20 mg, 40 mg, 80 mg, 160 mg tai lumelääke) ja hydroklooritiatsidin (6,25 mg, 12,5 mg, 25 mg ja lumelääke) yhdistelmiä. Faktoriaalitutkimuksessa satunnaistettiin 818 potilasta, joista 493 (60 %) miehiä; 596 (73 %) ei-mustia ja 222 (27 %) mustia; ja 143 (18 %) ≥ 65-vuotias (mediaani-ikä oli 53 vuotta). Keskimääräinen verenpaine makuulla lähtötilanteessa koko väestölle oli 154/101 mmHg.
Telmisartaanin ja hydroklooritiatsidin yhdistelmä johti additiiviseen lumelääketasolla systolisen ja diastolisen verenpaineen laskuun alimmillaan 16-21/9-11 mmHg annoksilla 40 mg/12,5-80 mg/25 mg verrattuna 9-13:een. /7-8 mmHg telmisartaanin 40–80 mg monoterapiassa ja 4/4 mmHg hydroklooritiatsidin 12,5 mg monoterapiassa. Verenpainetta alentava vaikutus oli iästä tai sukupuolesta riippumaton. Plasebokontrolloidussa tutkimuksessa telmisartaanin ja hydroklooritiatsidin yhdistelmällä hoidettujen potilaiden sydämen sykkeessä ei havaittu oleellisesti muutoksia.
Neljä muuta vähintään kuusi kuukautta kestänyt hypertensiopotilaiden tutkimusta mahdollisti hydroklooritiatsidin lisäämisen potilaille, jotka eivät joko olleet riittävässä hallinnassa satunnaistetulla telmisartaanimonoterapiaannoksella tai jotka eivät olleet saavuttaneet riittävää verenpainevastetta telmisartaanin titrauksen päätyttyä. Aktiivikontrolloiduissa tutkimuksissa 12,5 mg:n hydroklooritiatsidin lisääminen titrattuihin telmisartaaniannoksiin potilailla, jotka eivät saavuttaneet tai säilyttäneet riittävää vastetta telmisartaanimonoterapialla, alensivat edelleen systolista ja diastolista verenpainetta.
POTILASTIEDOT
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan ja hydroklooritiatsidi) Tabletit
Lue nämä potilastiedot ennen kuin aloitat MICARDIS HCT -tablettien käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää MICARDIS 20 mg HCT -tableteista?
MICARDIS HCT voi aiheuttaa vahinkoa tai kuoleman sikiölle. Keskustele lääkärisi kanssa muista tavoista alentaa verenpainettasi, jos suunnittelet raskautta. Jos tulet raskaaksi MICARDIS 20 mg HCT -hoidon aikana, kerro siitä heti lääkärillesi.
Mikä on MICARDIS HCT?
MICARDIS 40mg HCT on reseptilääke, jota käytetään korkean verenpaineen (hypertension) hoitoon.
MICARDIS 40mg HCT sisältää:
- telmisartaani, angiotensiinireseptorin salpaaja (ARB)
- hydroklooritiatsidi, vesipilleri tai diureetti
Lääkärisi voi määrätä sinulle muita lääkkeitä käytettäväksi yhdessä MICARDIS 80 mg HCT:n kanssa korkean verenpaineesi hoitoon.
Ei tiedetä, onko MICARDIS 40 mg HCT turvallinen ja tehokas lapsille.
Älä ota MICARDIS 20 mg HCT -tabletteja, jos:
- virtsaneritystä on vähän tai ei ollenkaan
- olet allerginen (yliherkkä) vaikuttaville aineille (telmisartaanille tai hydroklooritiatsidille) tai jollekin muulle tämän pakkausselosteen lopussa luetellulle aineelle
Mitä minun tulee kertoa lääkärilleni ennen MICARDIS 40 mg HCT -tablettien käyttöä?
Ennen kuin otat MICARDIS 20 mg HCT -tabletteja, kerro lääkärillesi, jos:
- olet raskaana tai suunnittelet raskautta. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää MICARDIS 20mg HCT -tableteista?"
- imetät tai aiot imettää. MICARDIS 80 mg HCT voi erittyä äidinmaitoon ja vahingoittaa vauvaasi. Sinun ja lääkärisi tulee päättää, otatko MICARDIS HCT:tä vai imetätkö. Sinun ei pitäisi tehdä molempia. Keskustele lääkärisi kanssa siitä, mikä on paras tapa ruokkia vauvasi, jos otat MICARDIS HCT -tabletteja.
- sinulle on kerrottu, että veresi suolatasot (elektrolyyttipitoisuudet) ovat epänormaalit
- sinulla on maksaongelmia
- sinulla on astma tai sinulla on astma
- on lupus
- on diabetes
- on munuaisongelmia
- sinulla on muita sairauksia
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Kerro myös lääkärillesi, jos juot alkoholia.
MICARDIS 20 mg HCT voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa MICARDIS 20 mg HCT:n tehoon. Kerro lääkärillesi erityisesti, jos otat:
- aliskireeni
- digoksiini (Lanoxin®)
- litium (Lithobid®, litiumkarbonaatti, litiumsitraatti)
- muita lääkkeitä, joita käytetään korkean verenpaineesi tai sydänvaivojen hoitoon
- vesipillerit (diureetti)
- aspiriini tai muut ei-steroidiset tulehduskipulääkkeet (NSAID)
- kaliumlisät tai kaliumia sisältävä suolan korvike
- diabeteksen hoitoon käytettävä lääke, mukaan lukien insuliini
- huumausaineet kipulääkkeet
- unilääkkeet
- steroidilääke tai adrenokortikotrofinen hormoni (ACTH)
- barbituraatit
- tietyt kolesterolia alentavat lääkkeet (hartsit, joita käytetään kolesterolin alentamiseen, esim. kolestyramiini ja kolestipolihartsit)
Kysy lääkäriltäsi, jos et ole varma, käytätkö jotakin yllä luetelluista lääkkeistä.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa ja näytä se lääkärillesi tai apteekkiin, kun saat uuden lääkkeen.
Miten minun tulee ottaa MICARDIS HCT -tabletit?
- Ota MICARDIS 40 mg HCT -tabletit juuri sen verran kuin lääkärisi on määrännyt.
- Lääkärisi kertoo sinulle, kuinka paljon MICARDIS HCT:tä sinun tulee ottaa ja milloin se tulee ottaa.
- Älä muuta annostasi, ellei lääkärisi kehota sinua tekemään niin.
- Ota MICARDIS HCT kerran päivässä.
- Ota MICARDIS 20 mg HCT -tabletit ruoan kanssa tai ilman.
- Jos otat liikaa MICARDIS HCT:tä, soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
- Lue "Kuinka läpipainopakkaus avataan" tämän pakkausselosteen lopussa ennen kuin käytät MICARDIS 20mg HCT:tä. Keskustele lääkärisi kanssa, jos et ymmärrä ohjeita.
Mitkä ovat MICARDIS 80 mg HCT -tablettien mahdolliset sivuvaikutukset?
MICARDIS 20 mg HCT-tabletit voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Syntymättömän lapsesi loukkaantuminen tai kuolema. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää MICARDIS HCT -tableteista?"
- Matala verenpaine (hypotensoitu ioni) tapahtuu todennäköisimmin, jos myös:
- ottaa vesipillereitä (diureetteja)
- ovat vähäsuolaisella ruokavaliolla
- saada dialyysihoitoja
- on sydänongelmia
- sairastaa oksentelua tai ripulia
- älä juo tarpeeksi nesteitä
- hikoilla paljon
- Munuaisongelmat, joka voi pahentua, jos sinulla on jo munuaissairaus. Sinulla voi olla muutoksia munuaistestituloksissasi ja saatat tarvita pienempää annosta MICARDIS 40 mg HCT-tabletteja. Soita lääkärillesi, jos saat:
- turvotusta jaloissasi, nilkoissasi tai käsissäsi
- selittämätön painonnousu
- maksaongelmia, joka voi pahentua ihmisillä, joilla on jo maksaongelmia ja jotka käyttävät MICARDIS 40 mg HCT:tä.
- Silmäongelmat. Yksi MICARDIS HCT:n sisältämistä lääkkeistä voi aiheuttaa silmäongelmia, jotka voivat johtaa näön menetykseen. Silmäongelmien oireet voivat ilmaantua tunneista viikkoihin MICARDIS-hoidon aloittamisen jälkeen
HCT. Kerro heti lääkärillesi, jos sinulla on:
- näön heikkeneminen
- silmän kipu
- Allergiset reaktiot . Kerro heti lääkärillesi, jos saat jonkin seuraavista oireista:
- kasvojen, kielen, kurkun turvotus
- vaikeuksia hengittää
- Pahentaa lupuksen loppumista. Kerro lääkärillesi, jos lupussi pahenee tai aktivoituu MICARDIS 20 mg HCT -hoidon aikana.
- Muutos kehon suolojen (elektrolyyttien) pitoisuudessa veressäsi ja nesteongelmat. Lääkärisi voi tehdä kokeita veren tarkistamiseksi. Soita lääkärillesi heti, jos sinulla on:
- kuiva suu
- jano
- väsymys
- uneliaisuus
- levottomuus
- hämmennystä
- kohtauksia
- nopeat sydämenlyönnit
- heikkous
- lihaskipuja tai -kramppeja
- erittäin alhainen virtsan eritys
- pahoinvointia tai oksentelua
Jos tunnet pyörrytystä tai huimausta, mene makuulle ja soita heti lääkärillesi.
Soita lääkärillesi välittömästi, jos saat jonkin yllä mainituista oireista.
MICARDIS 80 mg HCT -tablettien yleisimmät sivuvaikutukset ovat:
- ylempien hengitysteiden infektiot, mukaan lukien poskiontelokipu/tukkoisuus ja kurkkukipu
- huimaus
- väsynyt olo
- flunssan kaltaiset oireet
- selkäkipu
- ripuli
- pahoinvointi
Nämä eivät ole kaikkia MICARDIS 20 mg HCT -tablettien mahdollisia sivuvaikutuksia. Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Miten MICARDIS 80 mg HCT -tabletit tulee säilyttää?
- Säilytä MICARDIS HCT -tabletit huoneenlämmössä 68 °F - 77 °F (20 °C - 25 °C).
- Poista MICARDIS 40 mg HCT -tabletit läpipainopakkauksista vasta juuri ennen niiden ottamista.
Pidä MICARDIS 80 mg HCT -tabletit ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa MICARDIS 40mg HCT -tableteista:
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä MICARDIS HCT -tabletteja sairauksiin, joihin sitä ei ole määrätty. Älä anna MICARDIS 20 mg HCT -tabletteja muille ihmisille, vaikka heillä olisi sama sairaus kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen sisältää yhteenvedon tärkeimmistä tiedoista MICARDIS HCT -tableteista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltäsi tietoa MICARDIS 20mg HCT -tableteista, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Saat nykyiset reseptitiedot skannaamalla alla olevan koodin tai soittamalla Boehringer Ingelheim Pharmaceuticals, Inc:lle numeroon 1-800-542-6257 tai (TTY) 1-800-459-9906.
Mitä ainesosia MICARDIS 20mg HCT -tabletit sisältävät?
Vaikuttavat aineet: telmisartaani ja hydroklooritiatsidi
Inaktiiviset ainesosat: natriumhydroksidi, meglumiini, povidoni, sorbitoli, magnesiumstearaatti, laktoosimonohydraatti, mikrokiteinen selluloosa, maissitärkkelys ja natriumtärkkelysglykolaatti
40 mg/12,5 mg ja 80 mg/12,5 mg tabletit sisältävät myös: punaista rautaoksidia.
80 mg/25 mg tabletit sisältävät myös: keltaista rautaoksidia.
Mikä on korkea verenpaine (hypertensio)?
Verenpaine on voima verisuonissasi, kun sydämesi lyö ja kun sydämesi lepää. Sinulla on korkea verenpaine, kun voimaa on liikaa. Verenpainetta alentavat lääkkeet vähentävät mahdollisuutta saada aivohalvaus tai sydänkohtaus.
Korkea verenpaine saa sydämen työskentelemään kovemmin pumppaamaan verta kehon läpi ja aiheuttaa vaurioita verisuonille. MICARDIS 80 mg HCT-tabletit voivat auttaa verisuonia rentoutumaan, jolloin verenpaineesi laskee.
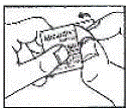
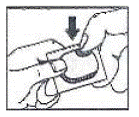
Kuinka läpipainopakkaus avataan:
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
