Nimotop 30mg Nimodipine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Nimotop 30mg on ja miten sitä käytetään?
Nimotop on reseptilääke, jota käytetään aneurysman (subaraknoidisen verenvuodon) oireiden hoitoon. Nimotopia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Nimotop kuuluu lääkeluokkaan, jota kutsutaan kalsiumkanavan salpaajiksi; Neurologia, muut; Kalsiumkanavan salpaajat, dihydrofyridiini.
Ei tiedetä, onko Nimotop 30mg turvallinen ja tehokas lapsille.
Mitkä ovat Nimotopin mahdolliset sivuvaikutukset?
Nimotop voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- huimaus,
- nopea tai hidas syke ja
- turvotusta tai nilkkojasi tai jalkojasi
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Nimotopin yleisimmät sivuvaikutukset ovat:
- matala verenpaine (pyörrytys),
- pahoinvointi,
- ärtynyt vatsa,
- hitaat sydämenlyönnit ja
- lihaskipu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Nimotopin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
ÄLÄ ANNA NIMOTOPIA (nimodipiinia) LASKINSEEN TAI MUITA PARENTERAALISIA REITTEITÄ. KUOLEMAA JA VAKAVIA, HENKIVAARALAISET HAITTATAPAHTUMAT ON TAPAHTUNUT, KUN NIMOTOP (nimodipiini) -kapseleiden SISÄLTÖ ON PISTETTY parenteraalisesti (ks. VAROITUKSET ja ANNOSTUS JA ANTO-OHJEET).
KUVAUS
Nimotop® (nimodipiini) kuuluu kalsiumkanavasalpaajina tunnettujen farmakologisten aineiden luokkaan. Nimodipiini on isopropyyli-2-metoksietyyli-1,4-dihydro-2,6-dimetyyli-4-(m-nitrofenyyli)-3,5-pyridiinidikarboksylaatti. Sen molekyylipaino on 418,5 ja molekyylikaava C21H26N2O7. Rakennekaava on:
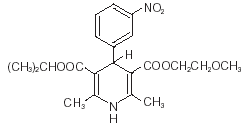
Nimodipiini on keltainen kiteinen aine, joka ei käytännössä liukene veteen.
NIMOTOP® (nimodipiini) kapselit on formuloitu pehmeiksi gelatiinikapseleiksi suun kautta annettaviksi. Jokainen nesteellä täytetty kapseli sisältää 30 mg nimodipiinia glyseriinin, piparminttuöljyn, puhdistetun veden ja polyetyleeniglykoli 400:n vehikkelissä. Pehmeä gelatiinikapselin kuori sisältää gelatiinia, glyseriiniä, puhdistettua vettä ja titaanidioksidia.
INDIKAATIOT
Nimotop® (nimodipiini) on tarkoitettu parantamaan neurologista lopputulosta vähentämällä iskeemisten vajavuuksien ilmaantuvuutta ja vakavuutta potilailla, joilla on kallonsisäisten marja-aneurysmien repeämien aiheuttama subarachnoidaalinen verenvuoto riippumatta heidän post-ictus -neurologisesta tilastaan (eli Hunt ja Hess IV asteet).
ANNOSTELU JA HALLINNOINTI
ÄLÄ ANNA NIMOTOP (nimodipiini) KAPSELEJA LASKINSEEN TAI MUITA PARENTERAALISIA REITTIÄ (ks. VAROITUKSET). Jos Nimotopia (nimodipiinia) annetaan vahingossa suonensisäisesti, kliinisesti merkittävä hypotensio saattaa vaatia sydän- ja verisuonitukilääkkeitä. Kalsiumkanavasalpaajan yliannostukseen on myös annettava erityisiä hoitoja.
Nimotop (nimodipiini) annetaan suun kautta norsunluunvärisinä pehmeinä gelatiinikapseleina 30 mg subarachnoidaaliseen verenvuotoon.
Suun kautta otettava annos on 60 mg (kaksi 30 mg:n kapselia) 4 tunnin välein 21 peräkkäisenä päivänä, mieluiten vähintään tunti ennen ateriaa tai kaksi tuntia aterian jälkeen. Suun kautta annettava Nimotop® (nimodipiini) -hoito tulee aloittaa 96 tunnin sisällä subarachnoidaalisen verenvuodon jälkeen.
Jos kapselia ei voida niellä esim. leikkauksen aikana tai jos potilas on tajuton, kapselin molempiin päihin tulee tehdä reikä 18 gaugen neulalla ja kapselin sisältö vedetään ruiskuun. Parenteraalista ruiskua voidaan käyttää nesteen poistamiseen kapselin sisällä, mutta neste tulee aina siirtää ruiskuun, joka ei kestä neulaa ja joka on suunniteltu annettavaksi suun kautta tai nenä-mahaletkun tai PEG:n kautta. Annosteluvirheiden minimoimiseksi on suositeltavaa, että antoa varten käytettävä ruisku on merkitty "Ei tarkoitettu suonensisäiseen käyttöön". Sisältö tulee sitten tyhjentää potilaan in situnaso-mahaputkeen ja pestä letku 30 ml:lla normaalia suolaliuosta (0,9 %). Tämän antotavan tehoa ja turvallisuutta ei ole osoitettu kliinisissä tutkimuksissa.
Maksakirroosipotilailla puhdistuma on huomattavasti pienentynyt ja Cmax noin kaksinkertaistunut. Annostus on pienennettävä 30 mg:aan 4 tunnin välein ja seurataan tarkasti verenpainetta ja sykettä.
MITEN TOIMITETAAN
Jokaiseen norsunluunväriseen, pehmeä gelatiini NIMOTOP® (nimodipiini) kapseliin on painettu sana Nimotop 30mg ja se sisältää 30 mg nimodipiinia. 30 mg:n kapselit on pakattu yksikköannosfoliopusseihin ja toimitetaan 100 kapselin laatikoihin. Tuotetta on saatavana myös lapsiturvallisissa kerta-annospakkausfoliopusseissa, joissa on 30 kapselia pakkauksessa. Kapselit tulee säilyttää valmistajan alkuperäisessä foliopakkauksessa 25 °C:ssa (77 °F) ja 15–30 °C:n lämpötilassa (59–86 °F) [katso USP:n valvoma huonelämpötila.]
Kapselit tulee suojata valolta ja jäätymiseltä.
Jakelija: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Valmistaja: Catalent Pharma Solutions St. Petersburg, FL 33716. FDA:n tarkistuspäivämäärä: 20.1.2006
SIVUVAIKUTUKSET
Haitallisia kokemuksia ilmoitti 92 823 potilaasta, joilla oli subarachnoidaalinen verenvuoto (11,2 %) ja jotka saivat nimodipiinia. Yleisin raportoitu haittavaikutus oli verenpaineen lasku 4,4 %:lla näistä potilaista. 29 479 lumelääkettä saaneesta potilaasta (6,1 %) ilmoitti myös haittavaikutuksista. Tapahtumat, joiden esiintymistiheys on suurempi kuin 1 %, näkyvät alla annoksen mukaan.
ANNOS q4h Potilaiden lukumäärä (%) Nimodipiini
Potilaat, joille annettiin 0,35 mg/kg q4h, 30 mg q4h tai 120 mg q4h, eivät raportoineet muita haittavaikutuksia. Haitallisia kokemuksia, joiden ilmaantuvuus oli alle 1 % 60 mg q4h annosryhmässä, olivat: hepatiitti; kutina; maha-suolikanavan verenvuoto; trombosytopenia; anemia; sydämentykytys; oksentelu; huuhtelu; diaforeesi; hengityksen vinkuminen; fenytoiinin toksisuus; huimaus; huimaus; rebound vasospasmi; keltaisuus; verenpainetauti; hematooma.
Haitallisia kokemuksia, joiden ilmaantuvuus oli alle 1 % 90 mg q4h annosryhmässä, olivat: kutina, maha-suolikanavan verenvuoto; trombosytopenia; neurologinen heikkeneminen; oksentelu; diaforeesi; sydämen vajaatoiminta; hyponatremia; verihiutaleiden määrän lasku; disseminoitu intravaskulaarinen koagulaatio; syvä laskimotromboosi.
Kuten taulukosta voidaan nähdä, sivuvaikutuksia, jotka näyttävät liittyvän nimodipiinin käyttöön, joka perustuu lisääntyneeseen esiintyvyyteen suuremmalla annoksella tai korkeammalla esiintymistiheydellä verrattuna lumelääkekontrolliin, olivat verenpaineen lasku, turvotus ja päänsärky, jotka ovat kalsiumkanavasalpaajien tunnettuja farmakologisia vaikutuksia. On kuitenkin huomattava, että SAH-oireyhtymään liittyy usein tajunnan muutoksia, jotka johtavat haitallisten kokemusten vähäiseen raportointiin. Potilaat, jotka saivat nimodipiinia kliinisissä tutkimuksissa muihin käyttöaiheisiin, ilmoittivat punoitusta (2,1 %), päänsärkyä (4,1 %) ja nesteen kertymistä (0,3 %), jotka olivat tyypillisiä vasteita kalsiumkanavasalpaajille. Kalsiumkanavan salpaajana nimodipiini saattaa pahentaa sydämen vajaatoimintaa herkillä potilailla tai häiritä AV-johtumista, mutta näitä tapahtumia ei havaittu.
Mitään kliinisesti merkittäviä vaikutuksia hematologisiin tekijöihin, munuaisten tai maksan toimintaan tai hiilihydraattiaineenvaihduntaan ei ole yhdistetty oraaliseen nimodipiiniin. Yksittäisiä tapauksia kohonneista seerumin glukoosipitoisuuksista (0,8 %), kohonneista LDH-tasoista (0,4 %), verihiutaleiden määrästä (0,3 %), kohonneista alkalisen fosfataasin tasoista (0,2 %) ja kohonneista SGPT-tasoista (0,2 %) on raportoitu yksittäisiä tapauksia. harvoin.

Huumeiden väärinkäyttö ja riippuvuus
Ei ole raportoitu tapauksia huumeiden väärinkäytöstä tai riippuvuudesta Nimotop®:n (nimodipiini) kanssa.
HUUMEIDEN VUOROVAIKUTUKSET
On mahdollista, että muiden kalsiumkanavasalpaajien sydän- ja verisuonitoimintaa voitaisiin tehostaa lisäämällä Nimotop® (nimodipiini).
Euroopassa Nimotop®:n (nimodipiini) havaittiin ajoittain tehostavan verenpainelääkkeiden vaikutusta, joita potilaat ottavat samanaikaisesti verenpaineesta kärsivien potilaiden kanssa; tätä ilmiötä ei havaittu Pohjois-Amerikan kliinisissä tutkimuksissa.
Kahdeksalla terveellä vapaaehtoisella tehdyssä tutkimuksessa nimodipiinin keskimääräiset huippupitoisuudet plasmassa kasvoivat 50 % ja keskimääräinen käyrän alla oleva pinta-ala kasvoi 90 % yhden viikon simetidiinin annoksella 1 000 mg/vrk ja nimodipiinin annoksella 90 mg/vrk. . Tämä vaikutus saattaa johtua siitä, että simetidiini estää maksan sytokromi P-450:tä, mikä saattaa heikentää nimodipiinin ensikierron metaboliaa.
VAROITUKSET
KUOLEMA TAHOTTAMATTOMASTA LASKINSEEN ANTAMISESTA: ÄLÄ ANNA NIMOTOPIA (nimodipiinia) LASKINSEEN TAI MUITA PAENTERAALISTA ANTOREITTIÄ. KUOLEMAJA JA VAKAVIA, HENKINUALEIA HAITTATAPAHTUMAA, MUKAAN LUKIEN SYDÄMENPYSÄHTYMINEN, SYDÄN-VERENSUUNNON KOLAPSIA, HYPOTENSIO JA BRADYKARDIA, OVAT TAPAHTUVAT, KUN NIMOTOPIN (NIMODIPIININ) SISÄLTÖ ON VÄHÄN MUKAUTTU.
VAROTOIMENPITEET
Yleistä: Verenpaine: Nimodipiinilla on kalsiumkanavasalpaajalta odotetut hemodynaamiset vaikutukset, vaikka ne eivät yleensä ole merkittäviä. Nimotop (nimodipiini) -kapseleiden sisällön suonensisäinen antaminen on kuitenkin johtanut vakaviin haitallisiin seurauksiin, mukaan lukien kuolema, sydämenpysähdys, kardiovaskulaarinen kollapsi, hypotensio ja bradykardia. Kliinisissä tutkimuksissa Nimotop® (nimodipiini) saaneilla potilailla, joilla oli subarachnoidaalinen verenvuoto, noin 5 %:lla ilmoitettiin verenpaineen laskeneen ja noin 1 % poistui tutkimuksesta tämän vuoksi (kaikkia ei voitu katsoa nimodipiinin ansioksi). Siitä huolimatta verenpainetta tulee seurata huolellisesti Nimotop®-hoidon (nimodipiini) aikana sen tunnetun farmakologian ja kalsiumkanavasalpaajien tunnettujen vaikutusten perusteella. (katso VAROITUKSET ja ANNOSTELU JA HALLINNOINTI )
Maksasairaus: Nimotop® (nimodipiini) metabolia on heikentynyt potilailla, joilla on heikentynyt maksan toiminta. Tällaisten potilaiden verenpainetta ja pulssia tulee seurata tarkasti ja heille tulee antaa pienempi annos (ks ANNOSTELU JA HALLINNOINTI ).
Suoliston pseudotukoksia ja ileusta on raportoitu harvoin potilailla, joita on hoidettu nimodipiinilla. Syy-yhteyttä ei ole vahvistettu. Tilanne on reagoinut konservatiiviseen hallintoon.
Laboratoriokokeiden vuorovaikutukset: Ei tiedossa.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen: Kaksivuotisessa tutkimuksessa havaittiin korkeampi kohdun adenokarsinooman ja kivesten Leydig-soluadenooman esiintyvyys rotilla, joille annettiin ruokavaliota 1800 ppm nimodipiinia (vastaa 91-121 mg/kg/vrk nimodipiinia) kuin lumekontrolleilla. . Erot eivät kuitenkaan olleet tilastollisesti merkittäviä, ja korkeammat luvut olivat hyvin historiallisen kontrollialueen sisällä näille Wistar-kannan kasvaimille.
Nimodipiinin ei havaittu olevan karsinogeeninen 91 viikkoa kestäneessä hiirillä tehdyssä tutkimuksessa, mutta suuri annos 1800 ppm nimodipiinia rehussa (546-774 mg/kg/vrk) lyhensi eläinten elinajanodotetta. Mutageenisuustutkimukset, mukaan lukien Ames-, mikronukleus- ja dominanttikokeet, olivat negatiivisia. Nimodipiini ei heikentänyt Wistar-uros- ja -naarasrottien hedelmällisyyttä eikä yleistä lisääntymiskykyä, kun sitä annettiin suun kautta enintään 30 mg/kg/vrk, kun sitä annettiin päivittäin yli 10 viikon ajan uroksille ja 3 viikon ajan naaraille ennen parittelua ja jatkui. raskauden 7 päivään. Tämä annos rotalla on noin 4 kertaa vastaava kliininen annos 60 mg q4h 50 kg painavalla potilaalla.
Raskaus: Raskausluokka C. Nimodipiinin on osoitettu olevan teratogeeninen vaikutus Himalajan kaneissa. Epämuodostumien ja kitukasvuisten sikiöiden ilmaantuvuus lisääntyi suun kautta annetuilla annoksilla 1 ja 10 mg/kg/vrk (letkuletkulla) 6. päivän ja 18. päivän välisenä aikana, mutta ei annoksella 3,0 mg/kg/vrk toisessa kahdesta identtisestä kanitutkimuksesta. Toisessa tutkimuksessa kitukasvuisten sikiöiden ilmaantuvuus lisääntyi annoksella 1,0 mg/kg/vrk, mutta ei suuremmilla annoksilla. Nimodipiini oli sikiötoksinen aiheuttaen resorptiota ja sikiöiden kasvun hidastumista Long Evans -rotilla annoksella 100 mg/kg/vrk letkulla 6. päivästä 15. päivään raskausajan. Kahdessa muussa rotalla tehdyssä tutkimuksessa 30 mg/kg/vrk nimodipiiniannoksia, jotka annettiin letkulla 16. tiineyspäivästä alkaen ja jatkettiin lopettamiseen asti (raskauden 20. päivä tai 21. synnytyksen jälkeinen päivä), liittyi luuston vaihteluiden, kitukasvuisten sikiöiden ja kuolleena syntyneitä, mutta ei epämuodostumia. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla, joilla voitaisiin suoraan arvioida vaikutusta ihmissikiöön. Nimodipiinia tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle.
Imettävät äidit: Nimodipiinin ja/tai sen metaboliittien on osoitettu esiintyvän rotan maidossa pitoisuuksina, jotka ovat paljon suurempia kuin äidin plasmassa. Ei tiedetä, erittyykö lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, imettäviä äitejä kehotetaan olemaan imettämättä vauvaansa lääkkeen käytön aikana.
Käyttö lapsille: Turvallisuutta ja tehoa lapsilla ei ole osoitettu.
Geriatrinen käyttö: Nimodipiinin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkäiden potilaiden annostelussa on oltava varovainen, koska maksan, munuaisten tai sydämen toiminta on heikentynyt sekä samanaikainen sairaus tai muu lääkehoito.
YLIANNOSTUS
Ei ole raportoitu yliannostusta Nimotop®:n (nimodipiinin) oraalisesta antamisesta. Yliannostuksen oireiden oletetaan liittyvän kardiovaskulaarisiin vaikutuksiin, kuten liialliseen perifeeriseen vasodilataatioon ja huomattavaan systeemiseen hypotensioon. Nimotop® (nimodipiini) yliannostuksesta johtuva kliinisesti merkittävä hypotensio saattaa vaatia aktiivista sydän- ja verisuonitukitoimintaa painetta lisäävillä aineilla. Kalsiumkanavasalpaajan yliannostukseen on myös annettava erityisiä hoitoja. Koska Nimotop® (nimodipiini) sitoutuu voimakkaasti proteiineihin, dialyysistä ei todennäköisesti ole hyötyä.
VASTA-AIHEET
Ei tiedossa.
KLIININEN FARMAKOLOGIA
Toimintamekanismi: Nimodipiini on kalsiumkanavan salpaaja. Sileiden lihassolujen supistumisprosessit ovat riippuvaisia kalsium-ioneista, jotka tulevat näihin soluihin depolarisaation aikana hitaina ionitransmembraanisina virroina. Nimodipiini estää kalsiumionien siirtymistä näihin soluihin ja estää siten verisuonten sileän lihaksen supistuksia. Eläinkokeissa nimodipiinilla oli suurempi vaikutus aivovaltimoihin kuin muualla kehossa oleviin valtimoihin ehkä siksi, että se on erittäin lipofiilinen, jolloin se läpäisi veri-aivoesteen; jopa 12,5 ng/ml nimodipiinipitoisuuksia on havaittu aivo-selkäydinnesteessä nimodipiinilla hoidetuilla subaraknoidaalista verenvuotoa (SAH) sairastavilla potilailla. Nimodipiinin tarkkaa vaikutusmekanismia ihmisillä ei tunneta. Vaikka alla kuvatut kliiniset tutkimukset osoittavat nimodipiinin suotuisan vaikutuksen SAH:n jälkeisen aivovasospasmin aiheuttamien neurologisten vajeiden vakavuuteen, ei ole arteriografista näyttöä siitä, että lääke ehkäisee tai lievittää näiden valtimoiden kouristuksia. Ei kuitenkaan tiedetä, oliko käytetty arteriografinen metodologia riittävä havaitsemaan kliinisesti merkittävä vaikutus, jos sellaista on, vasospasmiin.
Farmakokinetiikka ja aineenvaihdunta: Ihmisellä nimodipiini imeytyy nopeasti oraalisen annon jälkeen, ja huippupitoisuudet saavutetaan yleensä tunnin kuluessa. Lopullinen eliminaation puoliintumisaika on noin 8–9 tuntia, mutta aikaisemmat eliminaationopeudet ovat paljon nopeampia, mikä vastaa 1–2 tunnin puoliintumisaikaa; seurauksena on tarve annostella usein (4 tunnin välein). Mitään merkkejä kertymisestä ei havaittu, kun nimodipiinia annettiin kolme kertaa päivässä seitsemän päivän ajan. Nimodipiini sitoutuu yli 95 % plasman proteiineihin. Sitoutuminen oli pitoisuudesta riippumatonta alueella 10 ng/ml - 10 ug/ml. Nimodipiini eliminoituu lähes yksinomaan metaboliitteina ja alle 1 % erittyy virtsaan muuttumattomana lääkkeenä. On tunnistettu lukuisia metaboliitteja, jotka kaikki ovat joko inaktiivisia tai huomattavasti vähemmän aktiivisia kuin lähtöaine. Korkean ensikierron metabolian vuoksi nimodipiinin biologinen hyötyosuus on keskimäärin 13 % oraalisen annon jälkeen. Biologinen hyötyosuus on merkittävästi lisääntynyt potilailla, joilla on maksakirroosi, ja Cmax on noin kaksinkertainen normaaliin verrattuna, mikä edellyttää annoksen pienentämistä tässä potilasryhmässä (ks. ANNOSTELU JA HALLINNOINTI ). Tutkimuksessa, johon osallistui 24 tervettä miespuolista vapaaehtoista, nimodipiinikapseleiden antaminen tavallisen aamiaisen jälkeen johti 68 % pienempään huippupitoisuuteen plasmassa ja 38 % pienempään hyötyosuuteen verrattuna annokseen paastotilassa.
Yhdessä rinnakkaisryhmätutkimuksessa, johon osallistui 24 iäkkää henkilöä (ikä 59-79) ja 24 nuorempaa henkilöä (ikä 22-40), nimodipiinin havaittu AUC ja Cmax olivat noin 2 kertaa korkeammat vanhuksilla verrattuna nuorempaan tutkimukseen. koehenkilöillä oraalisen annon jälkeen (30 mg:n kerta-annoksena ja vakaan tilan annoksella 30 mg tid 6 päivän ajan). Kliinistä vastetta näihin ikään liittyviin farmakokineettisiin eroihin ei kuitenkaan pidetty merkittävänä. (Katso VAROTOIMENPITEET : Vanhempi käyttö.)
Kliiniset tutkimukset: Nimodipiinin on osoitettu neljässä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa vähentävän vasospasmista johtuvien neurologisten vajavuuksien vakavuutta potilailla, joilla on äskettäin ollut subarachnoidaalinen verenvuoto (SAH). Kokeissa käytettiin annoksia, jotka vaihtelivat 20-30 mg:sta 90 mg:aan 4 tunnin välein, ja lääkettä annettiin kolmessa tutkimuksessa 21 päivän ajan ja toisessa vähintään 18 päivän ajan. Kolmessa neljästä tutkimuksesta seurattiin potilaita 3-6 kuukauden ajan. Kolmessa tutkimuksessa tutkittiin suhteellisen terveitä potilaita. Kaikki tai useimmat potilaat olivat Hunt- ja Hess-asteilla I-III (olennaisesti ilman fokaalivajetta ensimmäisen verenvuodon jälkeen). Neljännessä tutkittiin paljon sairaampia potilaita, Hunt- ja Hess-asteella III-V. Kaksi tutkimusta , yksi yhdysvaltalainen, yksi ranskalainen, olivat rakenteeltaan samanlaisia, ja suhteellisen terveet SAH-potilaat satunnaistettiin saamaan nimodipiinia tai lumelääkettä. Jokaisessa arvioitiin, johtuiko jokin myöhään kehittynyt puute kouristuskohtauksesta tai muista syistä, ja puutteet arvioitiin. Molemmat tutkimukset osoittivat merkittävästi vähemmän vakavia puutteita kouristuksesta nimodipiiniryhmässä; toinen (ranskalainen) tutkimus osoitti vähemmän kouristukseen liittyviä kaiken vaikeusasteita. Mitään vaikutusta ei havaittu puutteisiin, jotka eivät liittyneet kouristukseen.
Kolmas, suuri tutkimus suoritettiin Yhdistyneessä kuningaskunnassa SAH-potilailla, joilla oli kaikki vakavuusasteet (mutta 89 % oli asteita I–III). Nimodipiinia annettiin 60 mg 4 tunnin välein. Tuloksia ei määritelty kouristukseen liittyviksi tai ei, mutta infarktien kokonaismäärä ja vakavasti vammauttava neurologinen lopputulos väheni merkittävästi 3 kuukauden kohdalla:
Kanadalaiseen tutkimukseen osallistui paljon sairaampia potilaita (Hunt ja Hess, asteet III-V), joilla oli korkea kuolleisuus ja työkyvyttömyys, ja he käyttivät 90 mg:n annosta 4 tunnin välein, mutta olivat muuten samanlaisia kuin kaksi ensimmäistä tutkimusta. Viivästyneiden iskeemisten puutteiden analyysi, joista monet johtuvat kouristuksesta, osoitti kouristukseen liittyvien puutteiden vähenemisen merkittävästi. Analysoiduilla potilailla (72 nimodipiinia, 82 lumelääkettä) oli seuraavat tulokset.
Kun yhdistettiin Kanadan ja Yhdistyneen kuningaskunnan tutkimusten tiedot, hoidon ero onnistumisasteessa (eli hyvässä toipumisessa) Glasgow'n tulosasteikolla oli 25,3 % (nimodipiini) verrattuna 10,9 %:iin (plasebo) Huntilla ja Hessillä, luokka IV tai V. Alla oleva taulukko osoittaa, että nimodipiinilla on taipumus parantaa hyvää toipumista SAH-potilailla, joilla on huono neurologinen tila post-ictus, samalla kun se vähentää vakavan vamman ja vegetatiivisen eloonjäämisen määrää.
Annosvaihtelututkimuksessa, jossa verrattiin 30, 60 ja 90 mg:n annoksia, havaittiin yleisesti alhainen kouristukseen liittyvien neurologisten puutteiden määrä, mutta ei annosvastesuhdetta.
POTILASTIEDOT
Tietoja ei ole annettu. Katso VAROITUKSET ja VAROTOIMENPITEET osiot.
