Vatsan hoito: Nexium 20mg, 40mg Esomeprazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Nexium on ja miten sitä käytetään?
Nexium on reseptilääke, jota käytetään gastroesofageaalisen refluksitaudin (GERD) ja muiden tilojen, joissa on liiallista mahahappoa, kuten Zollinger-Ellisonin oireyhtymä, hoitoon. Nexiumia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Nexium 20mg on protonipumpun estäjä.
Ei tiedetä, onko Nexium 20mg turvallinen ja tehokas alle 1 kuukauden ikäisille lapsille suonensisäisenä lääkityksenä ja 1 vuoden ikäisille lapsille suun kautta.
Mitä sivuvaikutuksia Nexium 40 mg:lla on?
Nexium voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- vetistä tai veristä ripulia,
- kohtaukset (kouristukset),
- vähän tai ei ollenkaan virtsaamista,
- verta virtsassa,
- turvotus,
- nopea painonnousu,
- huimaus,
- nopea tai epäsäännöllinen syke,
- vapina tai nykivät lihasliikkeet,
- hermostunut olo,
- lihaskrampit,
- lihaskouristukset käsissäsi ja jaloissasi,
- yskä tai tukehtumistunne,
- nivelkipuja ja
- ihottuma poskissa tai käsivarsissa, joka pahenee auringossa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Nexium 40mg:n yleisimmät sivuvaikutukset ovat:
- päänsärky,
- uneliaisuus,
- lievä ripuli,
- pahoinvointi,
- vatsakipu,
- kaasu,
- ummetus ja
- kuiva suu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Nexiumin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
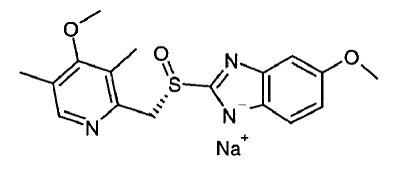
NEXIUM® IV:n (esomepratsolinatrium) injektiovalmisteen vaikuttava ainesosa on (S)-5-metoksi-2[[(4-metoksi-3,5-dimetyyli-2-pyridinyyli)metyyli]sulfinyyli]-1 H-bentsimidatsoli natrium, protonipumpun estäjä, joka estää mahahapon eritystä. Esomepratsoli on omepratsolin S-isomeeri, joka on S- ja R-isomeerien seos. Sen empiirinen kaava on C17H18N3O3SNa, jonka molekyylipaino on 367,4 g/mol (natriumsuola) ja 345,4 g/mol (emoyhdiste).
Esomepratsolinatrium liukenee hyvin veteen ja liukenee vapaasti etanoliin (95 %). Rakennekaava on:
NEXIUM 20mg IV injektiota varten toimitetaan steriilinä, pakastekuivattuna, valkoisena tai luonnonvalkoisena, huokoisena kakkuna tai jauheena 5 ml:n injektiopullossa, joka on tarkoitettu annettavaksi laskimoon sen jälkeen, kun se on liuotettu 0,9 % natriumkloridi-injektioon, USP; Ringerin laktaattiruiske, USP tai 5 % dekstroosiinjektio, USP. NEXIUM IV for Injection sisältää esomepratsolinatriumia 21,3 mg tai 42,5 mg, joka vastaa 20 mg tai 40 mg esomepratsolia, 1,5 mg dinatriumedetaattia ja natriumhydroksidia qs pH:n säätämistä varten. Käyttövalmiiksi saatetun NEXIUM IV -injektioliuoksen pH riippuu käyttövalmiiksi saattamisen tilavuudesta ja on pH-alueella 9–11. Esomepratsolinatriumin stabiilisuus vesiliuoksessa riippuu voimakkaasti pH:sta. Hajoamisnopeus kasvaa pH:n laskiessa.
INDIKAATIOT
Gastroesofageaalisen refluksitaudin (GERD) hoito eroosiivisella esofagiitilla (EE)
NEXIUM IV on tarkoitettu EE:n GERD:n lyhytaikaiseen hoitoon aikuisilla ja 1 kuukauden–17-vuotiailla lapsipotilailla, mukaan lukien vaihtoehtona suun kautta otettavalle hoidolle, kun suun kautta otettava NEXIUM 40 mg ei ole mahdollista tai tarkoituksenmukaista.
Maha- tai pohjukaissuolihaavojen uudelleenverenvuotoriskin vähentäminen terapeuttisen endoskopian jälkeen aikuisilla
NEXIUM 40mg IV on tarkoitettu vähentämään maha- tai pohjukaissuolihaavojen uudelleenverenvuotoa aikuisten akuutin verenvuodon maha- tai pohjukaissuolihaavan terapeuttisen endoskopian jälkeen.
ANNOSTELU JA HALLINNOINTI
Annostus GERD:lle EE:n kanssa
Aikuiset potilaat
Suositeltu aikuisten annos on joko 20 mg tai 40 mg NEXIUM 40 mg IV annettuna kerran päivässä laskimonsisäisenä injektiona (vähintään 3 minuutin aikana) tai suonensisäisenä infuusiona (10 minuutista 30 minuuttiin) enintään 10 päivän ajan [ks. ANNOSTELU JA HALLINNOINTI ].
Pediatriset potilaat
Suositeltu annostus lapsipotilaille perustuu ikään ja ruumiinpainoon alla olevan taulukon 1 mukaisesti. Anna suonensisäisenä infuusiona 10-30 minuutin aikana kerran päivässä enintään 10 päivän ajan [ks. ANNOSTELU JA HALLINNOINTI ].
Hoidon loppuun saattaminen
- NEXIUM 20 mg IV:n turvallisuutta ja tehokkuutta yli 10 päivän ajan ei ole osoitettu.
- Heti kun oraalinen hoito on mahdollista tai tarkoituksenmukaista, lopeta laskimonsisäinen NEXIUM 40 mg IV -hoito ja jatka oraalista NEXIUM 20 mg -hoitoa.
Annostus maha- tai pohjukaissuolihaavojen uudelleenverenvuodon vähentämiseksi terapeuttisen endoskopian jälkeen aikuisilla
Suositeltu aikuisten annos on 80 mg NEXIUM IV -infuusiona laskimonsisäisenä infuusiona 30 minuutin aikana, jota seuraa jatkuva infuusio 8 mg/tunti hoidon kokonaiskeston ollessa 72 tuntia (eli sisältää 30 minuutin aloitusannoksen plus 71,5 tuntia jatkuvaa infuusiota). infuusio) [katso ANNOSTELU JA HALLINNOINTI ].
Laskimonsisäinen hoito on tarkoitettu yksinomaan vuotavien maha- tai pohjukaissuolihaavojen akuuttiin alkuhoitoon, eikä se ole täyttä hoitoa. Anna suun kautta happoa vähentävää hoitoa suonensisäisen hoidon jälkeen koko hoitojakson ajan.
Annoksen säätö maksan vajaatoimintaa varten
GERD EE:n kanssa
Potilaille, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C), enimmäisannos on 20 mg kerran päivässä [ks. Käyttö tietyissä populaatioissa ].
Maha- tai pohjukaissuolihaavojen uudelleenverenvuotoriskin vähentäminen terapeuttisen endoskopian jälkeen aikuisilla
Potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokat A ja B), annettiin 80 mg suonensisäisenä infuusiona 30 minuutin aikana, minkä jälkeen annettiin jatkuva infuusio 6 mg/tunti 71,5 tunnin ajan.
Potilaille, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C), annettiin 80 mg suonensisäisenä infuusiona 30 minuutin aikana, mitä seurasi jatkuva infuusio 4 mg/tunti 71,5 tunnin ajan [ks. Käyttö tietyissä populaatioissa ].
Valmistelu- ja anto-ohjeet GERD:lle EE:n kanssa
Älä anna NEXIUM 40 mg IV samanaikaisesti minkään muun lääkkeen kanssa saman suonensisäisen kohdan ja/tai letkun kautta.
Suun kautta otettavia antasideja voidaan käyttää NEXIUM 20mg IV -hoidon aikana
Laskimonsisäinen injektio vähintään 3 minuutin ajan aikuispotilailla
Laskimonsisäinen infuusio yli 10 minuutista 30 minuuttiin aikuisilla ja lapsipotilailla
Varastointi
Säilytä lopullinen (laimennettu) NEXIUM IV -liuos huoneenlämmössä korkeintaan 30 °C:ssa (86 °F) ja anna määrätyn ajanjakson kuluessa alla olevan taulukon 2 mukaisesti.
Valmistelu- ja anto-ohjeet maha- tai pohjukaissuolihaavojen uudelleenverenvuotoriskin vähentämiseksi aikuisilla
Älä anna NEXIUM 40 mg IV samanaikaisesti minkään muun lääkkeen kanssa saman suonensisäisen kohdan ja/tai letkun kautta.
Suun kautta otettavia antasideja voidaan käyttää NEXIUM IV -hoidon aikana
Latausannos (80 mg)
Jatkuva infuusio
Varastointi
- Säilytä lopullinen (laimennettu) NEXIUM IV -liuos huoneenlämmössä korkeintaan 30 °C:ssa (86 °F) ja annostele 12 tunnin kuluessa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Injektio: 40 mg esomepratsolia valkoisena tai luonnonvalkoisena kylmäkuivattuna jauheena kerta-annoksen injektiopullossa käyttövalmiiksi saattamista varten.
Varastointi ja käsittely
NEXIUM 20mg IV toimitetaan kerta-annoksen injektiopullossa valkoisena tai luonnonvalkoisena kylmäkuivattuna jauheena liuotettaviksi, joka sisältää 40 mg esomepratsolia.
NEXIUM 40 mg IV . on saatavilla seuraavasti:
Varastointi
Säilytä 25°C (77°F); sallitaan 15° - 30°C (59° - 86°F). [Katso USP-ohjattu huonelämpötila .] Suojaa valolta. Säilytä laatikossa käyttöhetkeen asti.
Käyttövalmiiksi saattamisen ja annon jälkeen hävitä käyttämättä jäänyt esomepratsoliliuoksen osa [katso ANNOSTELU JA HALLINNOINTI ].
Valmistettu: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Tarkistettu: maaliskuu 2022
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Akuutti tubulointerstitiaalinen nefriitti [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Luun murtuma [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihohaittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Ihon ja systeeminen lupus erythematosus [katso VAROITUKSET JA VAROTOIMET ]
- Hypomagnesemia ja mineraaliaineenvaihdunta [katso VAROITUKSET JA VAROTOIMET ]
- Pohjarauhasten polyypit [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Oireinen GERD ja EE
Aikuiset
NEXIUM IV:n turvallisuus perustuu tuloksiin kliinisistä tutkimuksista, jotka on suoritettu neljässä eri populaatiossa, mukaan lukien terveet koehenkilöt (n=204) ja potilaat, joilla on verenvuotoa maha- tai pohjukaissuolihaava (n=375). Alla kuvatut tiedot heijastavat altistumista NEXIUM 20 mg IV:lle 359 potilaalla aktiivisesti kontrolloiduissa tutkimuksissa: oireinen GERD, jolla on tai ei ole ollut EE:tä (n=199) ja EE-potilaat (n=160). Väestö oli 18-77-vuotiaita; 45 % miehiä, 52 % valkoihoisia, 17 % mustia, 3 % aasialaisia ja 28 % muuta rotua. Useimmat potilaat saivat joko 20 tai 40 mg:n annoksia joko infuusiona tai injektiona. Haittavaikutukset, joita esiintyy vähintään 1 %:lla potilaista, on lueteltu alla taulukossa 3:
Laskimonsisäisellä hoidolla NEXIUM 20 mg IV 20 ja 40 mg injektiona tai infuusiona annettuna turvallisuusprofiilin havaittiin olevan samanlainen kuin suun kautta otettavan esomepratsolin turvallisuusprofiilin.
Pediatria
Suoritettiin satunnaistettu, avoin, monikansallinen tutkimus, jossa arvioitiin kerran päivässä NEXIUM IV:n toistuvien suonensisäisten annosten farmakokinetiikkaa 1 kuukauden–17-vuotiailla lapsipotilailla [ks. KLIININEN FARMAKOLOGIA ]. Turvallisuustulokset ovat yhdenmukaisia esomepratsolin tunnetun turvallisuusprofiilin kanssa, eikä odottamattomia turvallisuussignaaleja havaittu.
Maha- tai pohjukaissuolihaavojen uudelleenverenvuotoriskin vähentäminen aikuisilla
Alla olevassa taulukossa 4 kuvatut tiedot kuvaavat altistusta NEXIUM 20 mg IV:lle 375 potilaalla, joilla esiintyi endoskooppisesti vahvistettua maha- tai pohjukaissuolihaavaverenvuotoa lumekontrolloidussa tutkimuksessa. Väestö oli 18-98-vuotiaita; 68 % miehiä, 87 % valkoihoisia, 1 % mustia, 7 % aasialaisia ja 4 % muuta rotua. Endoskooppisen hemostaasin jälkeen potilaat saivat joko lumelääkettä tai 80 mg NEXIUM IV -infuusiota suonensisäisenä infuusiona 30 minuutin aikana, mitä seurasi jatkuva infuusio 8 mg/tunti 72 tunnin kokonaishoidon ajan. Ensimmäisen 72 tunnin jakson jälkeen kaikki potilaat saivat oraalista PPI:tä 27 päivän ajan.
Lukuun ottamatta yllä kuvattuja pistoskohdan reaktioita, laskimonsisäisellä NEXIUM 20 mg IV -hoidolla, joka annettiin injektiona tai infuusiona, todettiin olevan samanlainen turvallisuusprofiili kuin oraalisen esomepratsolin turvallisuusprofiili.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on havaittu esomepratsolin hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imusolmukkeiden häiriöt: agranulosytoosi, pansytopenia;
Silmäsairaudet: näön hämärtyminen;
Ruoansulatuskanavan häiriöt: haimatulehdus; stomatiitti; mikroskooppinen koliitti; pohjarauhasen polyypit;
Maksan ja sappien häiriöt: maksan vajaatoiminta, hepatiitti, johon liittyy tai ei ole keltaisuutta;
Immuunijärjestelmän häiriöt: anafylaktinen reaktio/sokki; systeeminen lupus erythematosus;
Infektiot ja infektiot: GI kandidiaasi;
Aineenvaihdunta ja ravitsemushäiriöt: hypomagnesemia (voi johtaa hypokalsemiaan ja/tai hypokalemiaan) [katso VAROITUKSET JA VAROTOIMET ], hyponatremia;
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt: lihasheikkous, myalgia, luunmurtuma;
Hermoston häiriöt: maksan enkefalopatia, makuaistin häiriöt;
Psyykkiset häiriöt: aggressio, kiihtyneisyys, masennus, hallusinaatiot;
Munuaisten ja virtsateiden häiriöt: interstitiaalinen nefriitti;
Lisääntymisjärjestelmän ja rintojen häiriöt: gynekomastia;
Hengityselinten, rintakehän ja välikarsinan häiriöt: bronkospasmi;
Ihon ja ihonalaisten kudosten häiriöt: hiustenlähtö, erythema multiforme, liikahikoilu, valoherkkyys, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi (TEN, jotkut kuolemaan johtavat), lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS) ja akuutti yleistynyt eksantematoottinen pustuloosi (AGEP), ihon lupus erythematosus.
Omepratsoliin liittyviä haittavaikutuksia voidaan odottaa esiintyvän myös NEXIUM IV:n käytön yhteydessä. Katso täydelliset turvallisuustiedot suun kautta otettavan omepratsolin täydellisestä reseptitiedosta.
HUUMEIDEN VUOROVAIKUTUKSET
Taulukot 5 ja 6 sisältävät lääkkeet, joilla on kliinisesti merkittäviä lääkevuorovaikutuksia ja vuorovaikutuksia diagnostisten tekijöiden kanssa, kun niitä annetaan samanaikaisesti esomepratsolin kanssa, sekä ohjeet niiden ehkäisyyn tai hoitoon.
Katso samanaikaisesti käytettyjen lääkkeiden pakkausmerkintöjä saadaksesi lisätietoja yhteisvaikutuksista PPI:iden kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Läsnäolo mahalaukun pahanlaatuisuuden
Aikuisilla oireenmukainen vaste NEXIUM IV -hoitoon ei sulje pois mahalaukun pahanlaatuisuuden esiintymistä. Harkitse lisäseurantaa ja diagnostisia testejä aikuispotilailla, joilla on suboptimaalinen vaste tai varhainen oireiden uusiutuminen PPI-hoidon päätyttyä. Vanhemmilla potilailla harkitse myös endoskopiaa.
Akuutti tubulointerstitiaalinen nefriitti
Akuuttia tubulointerstitiaalista nefriittiä (TIN) on havaittu PPI-lääkkeitä käyttävillä potilailla, ja se voi ilmaantua milloin tahansa PPI-hoidon aikana. Potilailla voi esiintyä erilaisia merkkejä ja oireita oireellisista yliherkkyysreaktioista epäspesifisiin munuaisten toiminnan heikkenemisen oireisiin (esim. huonovointisuus, pahoinvointi, anoreksia). Raportoiduissa tapaussarjoissa joillekin potilaille diagnosoitiin biopsia ja munuaisten ulkopuolisia oireita (esim. kuumetta, ihottumaa tai nivelkipua) ei ilmennyt. Lopeta NEXIUM 20mg IV ja arvioi potilaat, joilla epäillään akuuttia TIN:ää [ks. VASTA-AIHEET ].
Clostridium Difficilen aiheuttama ripuli
Julkaistut havaintotutkimukset viittaavat siihen, että PPI-hoito, kuten NEXIUM 20 mg IV, saattaa liittyä Clostridium difficilen aiheuttaman ripulin lisääntyneeseen riskiin, erityisesti sairaalapotilailla. Tätä diagnoosia tulisi harkita ripulille, joka ei parane [katso HAITTAVAIKUTUKSET ].
Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen.
Luunmurtuma
Useat julkaistut havaintotutkimukset viittaavat siihen, että protonipumpun estäjähoito (PPI) saattaa liittyä lisääntyneeseen osteoporoosiin liittyvien lonkka-, ranteen- tai selkärangan murtumien riskiin. Murtumariski lisääntyi potilailla, jotka saivat suuria annoksia, jotka määriteltiin useiksi päivittäisiksi annoksiksi, ja pitkäaikaista PPI-hoitoa (vuoden tai pidempään). Potilaiden tulee käyttää pienintä annosta ja lyhyintä PPI-hoitoa, jotka sopivat hoidettavaan sairauteen. Potilaita, joilla on osteoporoosiin liittyvien murtumien riski, tulee hoitaa vahvistettujen hoitoohjeiden mukaisesti [katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET ].
Vakavat ihohaittavaikutukset
PPI-lääkkeiden käytön yhteydessä on raportoitu vaikeita ihon haittavaikutuksia, mukaan lukien Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) ja akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP). [katso HAITTAVAIKUTUKSET ]. Lopeta NEXIUM IV -hoito, kun havaitset ensimmäisiä merkkejä tai oireita vakavista ihon haittavaikutuksista tai muista yliherkkyysoireista, ja harkitse lisäarviointia.
Ihon ja systeeminen lupus erythematosus
Ihon lupus erythematosus (CLE) ja systeeminen lupus erythematosus (SLE) on raportoitu potilailla, jotka käyttävät PPI-lääkkeitä, mukaan lukien esomepratsoli. Nämä tapahtumat ovat ilmenneet sekä uutena ilmaantumisena että olemassa olevan autoimmuunisairauden pahenemisena. Suurin osa PPI:n aiheuttamista lupus erythematosus -tapauksista oli CLE.
Yleisin PPI-lääkkeillä hoidetuilla potilailla raportoitu CLE:n muoto oli subakuutti CLE (SCLE), ja se esiintyi viikkojen tai vuosien kuluessa jatkuvan lääkehoidon jälkeen potilailla, jotka vaihtelivat imeväisistä vanhuksiin. Yleensä histologiset löydökset havaittiin ilman elinten osallistumista.
Systeemistä lupus erythematosusta (SLE) on raportoitu harvemmin kuin CLE:tä PPI-lääkkeitä saavilla potilailla. PPI:hen liittyvä SLE on yleensä lievempi kuin ei-lääkkeiden aiheuttama SLE. SLE puhkesi tyypillisesti päivien tai vuosien kuluessa hoidon aloittamisesta ensisijaisesti potilailla, jotka vaihtelivat nuorista aikuisista vanhuksiin. Suurimmalla osalla potilaista oli ihottumaa; kuitenkin myös nivelkipua ja sytopeniaa raportoitiin.
Vältä PPI-lääkkeiden antamista pidempään kuin lääketieteellisesti on tarpeen. Jos potilailla, jotka saavat NEXIUM 20mg IV, havaitaan CLE:n tai SLE:n mukaisia merkkejä tai oireita, lopeta lääkkeen käyttö ja lähetä potilas asianmukaisen asiantuntijan arvioitavaksi. Useimmat potilaat paranevat, kun pelkkä PPI-hoito lopetetaan 4–12 viikossa. Serologiset testit (esim. ANA) voivat olla positiivisia ja kohonneiden serologisten testien tulosten korjaaminen voi kestää kauemmin kuin kliiniset oireet.
Yhteisvaikutukset klopidogreelin kanssa
Vältä NEXIUM IV:n samanaikaista käyttöä klopidogreelin kanssa. Klopidogreeli on aihiolääke. Klopidogreelin aiheuttama verihiutaleiden aggregaation esto johtuu kokonaan aktiivisesta metaboliitista. Klopidogreelin metabolia aktiiviseksi metaboliitiksi voi heikentyä, jos sitä käytetään samanaikaisesti CYP2C19:n aktiivisuutta estävien lääkkeiden, kuten esomepratsolin, kanssa. Klopidogreelin samanaikainen käyttö 40 mg esomepratsolin kanssa vähentää klopidogreelin farmakologista aktiivisuutta. Kun käytät NEXIUM IV -valmistetta, harkitse vaihtoehtoista verihiutaleiden vastaista hoitoa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Hypomagnesemia ja mineraaliaineenvaihdunta
Oireista ja oireetonta hypomagnesemiaa on raportoitu harvoin potilailla, joita on hoidettu PPI-lääkkeillä vähintään kolmen kuukauden ajan, useimmissa tapauksissa vuoden hoidon jälkeen. Vakavia haittavaikutuksia ovat tetania, rytmihäiriöt ja kouristukset. Hypomagnesemia voi johtaa hypokalsemiaan ja/tai hypokalemiaan ja voi pahentaa taustalla olevaa hypokalsemiaa riskipotilailla. Useimmilla potilailla hypomagnesemian hoito vaati magnesiumin korvaamista ja PPI:n lopettamista.
Potilaiden, joiden odotetaan saavan pitkäaikaista hoitoa tai jotka käyttävät PPI-lääkkeitä lääkkeiden, kuten digoksiinin tai lääkkeiden kanssa, jotka voivat aiheuttaa hypomagnesemiaa (esim. diureetit), terveydenhuollon ammattilaiset voivat harkita magnesiumpitoisuuden seurantaa ennen PPI-hoidon aloittamista ja määräajoin [ks. HAITTAVAIKUTUKSET ].
Harkitse magnesium- ja kalsiumtasojen seurantaa ennen NEXIUM IV -hoidon aloittamista ja ajoittain hoidon aikana potilailla, joilla on hypokalsemian riski (esim. hypoparatyreoosi). Täydennä tarvittaessa magnesiumia ja/tai kalsiumia. Jos hypokalsemia ei kestä hoitoa, harkitse PPI-hoidon lopettamista.
Vuorovaikutus mäkikuisman tai rifampiinin kanssa
Lääkkeet, jotka indusoivat CYP2C19:ää tai CYP3A4:ää (kuten mäkikuisma tai rifampiini) voivat vähentää merkittävästi esomepratsolipitoisuuksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Vältä NEXIUM 40 mg IV:n samanaikaista käyttöä mäkikuisman tai rifampiinin kanssa.
Vuorovaikutukset neuroendokriinisten kasvainten diagnostisten tutkimusten kanssa
Seerumin kromograniini A (CgA) -tasot nousevat toissijaisesti lääkkeiden aiheuttaman mahalaukun happamuuden laskun seurauksena. Lisääntynyt CgA-taso voi aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa. Terveydenhuollon tarjoajien tulee tilapäisesti lopettaa esomepratsolihoito vähintään 14 päivää ennen CgA-tason arviointia ja harkita testin toistamista, jos CgA-alkutasot ovat korkeat. Jos suoritetaan sarjatestejä (esim. seurantaa varten), testaukseen tulee käyttää samaa kaupallista laboratoriota, koska testien väliset vertailualueet voivat vaihdella [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vuorovaikutus metotreksaatin kanssa
Kirjallisuus viittaa siihen, että PPI-lääkkeiden samanaikainen käyttö metotreksaatin kanssa (ensisijaisesti suurina annoksina; katso metotreksaatin ohjeet) voi nostaa ja pidentää metotreksaatin ja/tai sen metaboliitin seerumipitoisuuksia, mikä saattaa johtaa metotreksaattitoksisuuteen. Suuria metotreksaattiannoksia käytettäessä PPI:n väliaikaista keskeyttämistä voidaan harkita joillakin potilailla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Pohjarauhasten polyypit
PPI:n käyttöön liittyy lisääntynyt pohjukaissuolen polyyppien riski, joka lisääntyy pitkäaikaisessa käytössä, erityisesti yli vuoden. Suurin osa PPI-käyttäjistä, joille kehittyi pohjukaisrauhasen polyyppeja, oli oireettomia ja pohjukaisrauhasen polyypit tunnistettiin sattumalta endoskopiassa. Käytä lyhyintä PPI-hoitoa, joka sopii hoidettavaan sairauteen.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Esomepratsolin karsinogeenisuus arvioitiin omepratsolitutkimuksilla. Kahdessa 24 kuukauden karsinogeenisuustutkimuksessa rotilla omepratsolia vuorokausiannoksina 1,7, 3,4, 13,8, 44,0 ja 140,8 mg/kg/vrk (noin 0,4-34 kertaa ihmisen annos 40 mg/vrk ilmaistuna kehon pinnalla pinta-alan perusteella) tuotti mahalaukun ECL-solukarsinoideja annoksesta riippuvalla tavalla sekä uros- että naarasrotilla; tämän vaikutuksen ilmaantuvuus oli huomattavasti suurempi naarasrotilla, joilla oli korkeammat veren omepratsolipitoisuudet. Hoitamattomalla rotalla mahalaukun karsinoideja esiintyy harvoin. Lisäksi ECL-solujen hyperplasiaa esiintyi kaikissa hoidetuissa molempien sukupuolten ryhmissä. Yhdessä näistä tutkimuksista naarasrottia hoidettiin 13,8 mg:lla omepratsolia/kg/vrk (noin 3,4 kertaa ihmisen annos 40 mg/vrk kehon pinta-alan perusteella laskettuna) yhden vuoden ajan, minkä jälkeen niitä seurattiin vielä vuoden ajan ilman lääkettä. . Näissä rotissa ei havaittu karsinoideja. Hoitoon liittyvän ECL-soluhyperplasian ilmaantuvuuden havaittiin lisääntyneen 1 vuoden lopussa (94 % hoidetuista vs. 10 % kontrolleista). Toiseen vuoteen ero käsiteltyjen ja kontrollirottien välillä oli paljon pienempi (46 % vs. 26 %), mutta osoitti silti enemmän hyperplasiaa hoidetussa ryhmässä. Mahalaukun adenokarsinooma havaittiin yhdellä rotalla (2 %). Samanlaista kasvainta ei havaittu uros- tai naarasrotilla, joita hoidettiin 2 vuoden ajan. Tälle rottikannalle ei ole havaittu historiallisesti samanlaista kasvainta, mutta löydöstä, joka koskee vain yhtä kasvainta, on vaikea tulkita. 78 viikkoa kestänyt omepratsolin karsinogeenisuustutkimus hiirillä suun kautta ei osoittanut kasvainten esiintymisen lisääntymistä, mutta tutkimus ei ollut ratkaiseva.
Esomepratsoli oli negatiivinen Amesin mutaatiotestissä, rotan luuytimen solukromosomipoikkeavuustestissä in vivo ja hiiren mikrotumatestissä in vivo. Esomepratsoli oli kuitenkin positiivinen ihmisen lymfosyyttien kromosomipoikkeavuustestissä in vitro. Omepratsoli oli positiivinen in vitro ihmisen lymfosyyttien kromosomipoikkeavuustestissä, in vivo hiiren luuydinsolujen kromosomipoikkeavuustestissä ja in vivo hiiren mikrotumatestissä.
Esomepratsolin mahdollisia vaikutuksia hedelmällisyyteen ja lisääntymiskykyyn arvioitiin omepratsolitutkimuksilla. Omepratsolin oraalisilla annoksilla 138 mg/kg/vrk asti rotilla (noin 34 kertaa ihmisen annos 40 mg/vrk kehon pinta-alasta laskettuna) ei havaittu vaikuttavan emoeläinten lisääntymiskykyyn.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia esomepratsolilla raskaana olevilla naisilla. Esomepratsoli on omepratsolin s-isomeeri. Saatavilla olevat epidemiologiset tiedot eivät osoita suurentunutta vakavien synnynnäisten epämuodostumien tai muiden haitallisten raskaustulosten riskiä omepratsolin käytön ensimmäisen kolmanneksen aikana. Rotilla ja kaniineilla tehdyt lisääntymistutkimukset johtivat annoksesta riippuvaiseen alkiokuolleisuuteen omepratsolin annoksilla, jotka olivat noin 3,4–34 kertaa suun kautta otettavan 40 mg:n ihmisen annosta (60 kg painavan henkilön kehon pinta-alan perusteella).
Teratogeenisuutta ei havaittu lisääntymistutkimuksissa eläimillä, kun esomepratsolimagnesiumia annettiin rotille suun kautta noin 68-kertaisilla annoksilla ja kaniineilla 42-kertaisilla annoksilla ihmisen 40 mg:n suun kautta (perustuen kehon pinta-alaan 60 kg:n painoisella henkilöllä). . Muutoksia luuston morfologiassa havaittiin rottien jälkeläisillä, joille annettiin suurimman osan tiineyden ja imetyksen ajan annoksia, jotka olivat yhtä suuria tai suurempia kuin noin 34 kertaa suun kautta otettava 40 mg:n ihmisannos. Kun äidin antaminen rajoittui vain raskauteen, jälkeläisten luun fyysiseen morfologiaan ei ollut vaikutuksia missään iässä (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioituja taustariskejä mainitulle väestölle ei tunneta. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Data
Ihmistiedot
Esomepratsoli on omepratsolin S-isomeeri. Neljässä epidemiologisessa tutkimuksessa verrattiin synnynnäisten poikkeavuuksien esiintymistiheyttä omepratsolia raskauden aikana käyttäneille naisille syntyneillä pikkulapsilla H2-reseptorin salpaajille tai muille verrokeille altistuneiden naisten vauvojen poikkeavuuksien esiintymistiheyteen.
Ruotsin lääketieteellisen syntymärekisterin suorittama väestöpohjainen retrospektiivinen kohorttiepidemiologinen tutkimus, joka kattoi noin 99 % raskauksista vuosina 1995–99, raportoi 955 lapsesta (824 lapsesta ensimmäisen raskauskolmanneksen aikana, joista 39 altistui ensimmäisen raskauskolmanneksen jälkeen ja 131 lapsesta sen jälkeen. ensimmäisen raskauskolmanneksen aikana), joiden äidit käyttivät omepratsolia raskauden aikana. Kohdussa omepratsolille altistuneiden imeväisten määrä, joilla oli epämuodostumia, alhainen syntymäpaino, alhainen Apgar-pistemäärä tai joutui sairaalaan, oli samanlainen kuin tässä populaatiossa havaittu määrä. Kammioväliseinävaurioilla syntyneiden imeväisten ja kuolleena syntyneiden lasten määrä oli hieman suurempi omepratsolille altistuneilla lapsilla kuin odotettu määrä tässä populaatiossa.

Väestöpohjainen retrospektiivinen kohorttitutkimus, joka kattoi kaikki elävänä syntyneet Tanskassa vuosina 1996–2009, raportoi 1 800 elävänä syntyneestä, joiden äidit käyttivät omepratsolia ensimmäisen raskauskolmanneksen aikana, ja 837 317 elävänä syntynyttä lasta, joiden äidit eivät käyttäneet protonipumpun estäjää. Synnynnäisten epämuodostumien kokonaismäärä vauvoilla, joiden äidit ovat saaneet ensimmäisen raskauskolmanneksen altistuksen omepratsolille, oli 2,9 % ja 2,6 % lapsilla, joiden äidit eivät olleet altistuneet protonipumpun estäjille ensimmäisen raskauskolmanneksen aikana.
Retrospektiivinen kohorttitutkimus raportoi 689 raskaana olevasta naisesta, jotka olivat altistuneet joko H2-salpaajille tai omepratsolille ensimmäisen raskauskolmanneksen aikana (134 altistettiin omepratsolille) ja 1 572 raskaana olevaa naista, jotka eivät olleet altistuneet kummallekaan ensimmäisen kolmanneksen aikana. Epämuodostumien kokonaismäärä jälkeläisillä, jotka syntyivät ensimmäisen raskauskolmanneksen aikana omepratsolille, H2-salpaajalle, tai jotka eivät olleet altistuneet, oli vastaavasti 3,6 %, 5,5 % ja 4,1 %.
Pienessä prospektiivisessa havainnoivassa kohorttitutkimuksessa seurattiin 113 naista, jotka olivat altistuneet omepratsolille raskauden aikana (89 % ensimmäisen raskauskolmanneksen altistumisesta). Vakavien synnynnäisten epämuodostumien raportoitu määrä oli 4 % omepratsoliryhmässä, 2 % ei-teratogeeneille altistuneilla kontrolleilla ja 2,8 % sairauspariryhmissä. Spontaanien ja elektiivisten aborttien, ennenaikaisten synnytysten, raskausaika synnytyksen aikana ja keskimääräinen syntymäpaino olivat samanlaiset ryhmissä.
Useat tutkimukset eivät ole raportoineet ilmeisiä haitallisia lyhytaikaisia vaikutuksia lapseen, kun omepratsolia annettiin kerta-annoksena suun kautta tai suonensisäisesti yli 200 raskaana olevalle naiselle esilääkityksenä keisarinleikkaukseen yleisanestesiassa.
Eläinten tiedot
Omepratsoli
Lisääntymistutkimukset, jotka on suoritettu omepratsolilla rotilla 138 mg/kg/vrk suun kautta otetuilla annoksilla (noin 34 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alasta laskettuna) ja kaniineilla annoksilla 69,1 mg/kg/vrk. noin 34 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alan perusteella laskettuna) organogeneesin aikana ei paljastanut todisteita omepratsolin teratogeenisesta potentiaalista. Kaneille organogeneesin aikana annettu omepratsoli annosvälillä 6,9–69,1 mg/kg/vrk (noin 3,4–34 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alasta laskettuna) aiheutti annosriippuvaisen alkiokuolleisuuden lisääntymisen. sikiön resorptiot ja raskauden häiriöt. Rotilla havaittiin annosriippuvaista alkio-/sikiötoksisuutta ja synnytyksen jälkeistä kehitystoksisuutta jälkeläisillä, jotka olivat peräisin vanhemmista, joita hoidettiin omepratsoliannoksella 13,8-138,0 mg/kg/vrk (noin 3,4-34 kertaa ihmisen oraalinen 40 mg:n annos kehon pinnalla pinta-alan perusteella), annettu ennen parittelua laktaatiojakson ajan.
Esomepratsoli
Lisääntymistutkimuksissa ei havaittu vaikutuksia alkion ja sikiön kehitykseen rotilla oraalisilla annoksilla 280 mg/kg/vrk asti (noin 68 kertaa ihmisen oraalinen annos 40 mg kehon pinta-alasta laskettuna) tai kaniineilla oraaliset annokset aina 86 mg/kg/vrk asti (noin 41 kertaa ihmisen annos kehon pinta-alasta laskettuna), jotka annettiin organogeneesin aikana.
Pre- ja postnataalinen kehitystoksisuustutkimus rotilla, joissa oli muita päätepisteitä luun kehityksen arvioimiseksi, suoritettiin esomepratsolimagnesiumilla oraalisilla annoksilla 14-280 mg/kg/vrk (noin 3,4-68 kertaa ihmisen oraalinen 40 mg:n annos kehossa pinta-alan perusteella). Vastasyntyneen/varhaisen postnataalisen (syntymästä vieroittamiseen) eloonjääminen väheni annoksilla, jotka olivat yhtä suuria tai suurempia kuin 138 mg/kg/vrk (noin 34 kertaa suun kautta otettava 40 mg:n annos ihmiselle kehon pinta-alasta laskettuna). Paino ja painonnousu vähenivät ja hermokäyttäytymisen tai yleisen kehityksen viivästykset välittömässä vieroituksen jälkeisessä aikavälissä olivat ilmeisiä annoksilla, jotka olivat yhtä suuria tai suurempia kuin 69 mg/kg/vrk (noin 17 kertaa ihmisen oraalinen 40 mg:n annos keholle pinta-alan perusteella). Lisäksi todettiin reisiluun pituuden, aivokuoren leveyden ja paksuuden pienenemistä, sääriluun kasvulevyn paksuuden pienenemistä ja vähäisestä lievään luuytimen hyposellulaarisuutta annoksilla, jotka olivat yhtä suuria tai suurempia kuin 14 mg/kg/vrk (noin 3,4 kertaa suun kautta otettuun ihmiseen verrattuna). 40 mg:n annos kehon pinta-alasta laskettuna). Fyysistä dysplasiaa reisiluussa havaittiin rottien jälkeläisillä, joille annettiin oraalisia esomepratsolimagnesiumiannoksia 138 mg/kg/vrk tai suurempina annoksina (noin 34 kertaa suun kautta otettava annos ihmiselle 40 mg kehon pinta-alasta laskettuna).
Vaikutuksia emon luuhun havaittiin raskaana olevilla ja imettävillä rotilla pre- ja postnataalisessa toksisuustutkimuksessa, kun esomepratsolimagnesiumia annettiin suun kautta annoksina 14-280 mg/kg/vrk (noin 3,4-68 kertaa suun kautta otettava 40 mg ihmisen annos kehon pinta-alan perusteella). Kun rotille annettiin annosta gestaatiopäivästä 7 vieroituspäivään postnataalisena päivänä 21, emon reisiluun painossa havaittiin tilastollisesti merkitsevä, jopa 14 %:n lasku (verrattuna plasebohoitoon) annoksilla, jotka olivat yhtä suuria tai suurempia kuin 138 mg/kg/vrk. (noin 34 kertaa ihmisen 40 mg:n suun kautta otettava annos kehon pinta-alasta laskettuna).
Pre- ja postnataalinen kehitystutkimus rotilla esomepratsolistrontiumilla (käytettäessä ekvimolaarisia annoksia esomepratsolimagnesiumtutkimukseen verrattuna) tuotti samanlaisia tuloksia emoilla ja pennuilla kuin edellä on kuvattu.
Rotilla tehty kehitystoksisuustutkimus, jossa oli lisäaikapisteitä poikasten luun kehityksen arvioimiseksi syntymän jälkeisestä päivästä 2 aikuisuuteen, suoritettiin esomepratsolimagnesiumilla oraalisilla annoksilla 280 mg/kg/vrk (noin 68 kertaa suun kautta otettava 40 mg ihmisen annos kehon pinta-alan perusteella), jolloin esomepratsolia annettiin joko 7. raskauspäivästä tai 16. gestaatiopäivästä synnytykseen asti. Kun äidin antaminen rajoittui vain raskauteen, jälkeläisten luun fysikaaliseen morfologiaan ei ollut vaikutuksia missään iässä.
Imetys
Riskien yhteenveto
Esomepratsoli on omepratsolin S-isomeeri, ja rajalliset tiedot viittaavat siihen, että omepratsoli voi erittyä äidinmaitoon. Esomepratsolin vaikutuksista imetettävään lapseen tai maidontuotantoon ei ole kliinistä tietoa. Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä NEXIUM 20 mg:n tarvetta ja mahdollisia haitallisia vaikutuksia imetettävään lapseen NEXIUMista tai äidin taustalla olevasta tilasta.
Käyttö lapsille
NEXIUM 20 mg IV:n turvallisuus ja tehokkuus on osoitettu 1 kuukauden–17-vuotiailla lapsipotilailla EE:n aiheuttaman GERD:n lyhytaikaisessa hoidossa vaihtoehtona suun kautta otettavalle hoidolle, kun suun kautta otettava NEXIUM 40 mg ei ole mahdollista tai tarkoituksenmukaista.
NEXIUM 40 mg IV:n käyttö tässä ikäryhmässä perustuu aikuisten tehon ekstrapolointiin lapsiin ja annoksen valintaan, joka perustuu lasten ja aikuisten altistumisen yhteensovittamiseen, jota tukevat seuraavat todisteet: a) tulokset farmakokineettisestä (PK) tutkimuksesta NEXIUM 20mg IV injektioon lapsipotilaille, b) ennusteet populaatio-PK-mallista, jossa verrataan IV PK-tietoja aikuis- ja lapsipotilaiden välillä, ja c) suhde altistuksen ja farmakodynaamisten tulosten välillä, jotka on saatu aikuisten IV- ja lasten suun kautta annetuista tiedoista, ja d) PK-tulokset riittävät ja hyvin kontrolloidut tutkimukset, jotka tukivat NEXIUM 40 mg IV:n hyväksymistä aikuisilla [katso HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset ].
NEXIUM IV:n turvallisuutta ja tehokkuutta ei ole osoitettu alle 1 kuukauden ikäisillä potilailla EE:n aiheuttaman GERD:n hoidossa tai maha- tai pohjukaissuolihaavan uudelleenverenvuotoriskin vähentämisessä terapeuttisen endoskopian jälkeen.
Nuorten eläinten tiedot
Nuorten rottien toksisuustutkimuksessa esomepratsolia annettiin sekä magnesium- että strontiumsuolojen kanssa suun kautta noin 34–68 kertaa ihmisen 40 mg:n vuorokausiannoksina kehon pinta-alan perusteella. Kuolleisuus lisääntyi suurella annoksella, ja kaikilla esomepratsolin annoksilla ruumiinpaino laski, painon nousu, reisiluun paino ja reisiluun pituus sekä kokonaiskasvu väheni [ks. Ei-kliininen toksikologia ].
Geriatrinen käyttö
Kliinisessä tutkimuksessa potilailla, joilla oli verenvuoto maha- tai pohjukaissuolihaava, 52 % 375 NEXIUM IV -hoitoon satunnaistetusta potilaasta oli vähintään 65-vuotiaita. Turvallisuudessa ja tehossa ei havaittu yleisiä eroja iäkkäiden ja nuorempien henkilöiden välillä, ja muut raportoidut kliiniset kokemukset NEXIUM 40 mg IV:n ja suun kautta otettavan esomepratsolin käytöstä eivät ole havainneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida poissuljettu.
Maksan vajaatoiminta
GERD EE:n kanssa
Esomepratsolialtistus lisääntyi merkittävästi potilailla, joilla oli vaikea maksan vajaatoiminta (Child-Pugh-luokka C), mutta ei potilailla, joilla oli lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokat A ja B) verrattuna potilaisiin, joilla oli normaali maksan toiminta [ks. KLIININEN FARMAKOLOGIA ].
Aikuisten potilaiden annostusta ei tarvitse muuttaa lievän tai kohtalaisen maksan vajaatoiminnan vuoksi. Potilaille, joilla on vaikea maksan vajaatoiminta, suurin suositeltu annos on 20 mg kerran päivässä [ks ANNOSTELU JA HALLINNOINTI ].
Maha- tai pohjukaissuolihaavojen uudelleenverenvuotoriskin vähentäminen terapeuttisen endoskopian jälkeen
Ei ole saatavilla farmakokineettisiä tietoja NEXIUM 20 mg IV:n jatkuvasta suonensisäisestä annostelusta potilaille, joilla on maksan vajaatoiminta. Altistuminen suonensisäiselle omepratsolille, jonka enantiomeeri on esomepratsoli, lisääntyi potilailla, joilla oli kaikenasteinen maksan vajaatoiminta verrattuna potilaisiin, joiden maksan toiminta oli normaali [ks. KLIININEN FARMAKOLOGIA ].
Aikuisilla potilailla NEXIUM IV 80 mg:n aloitusannoksen annosta ei tarvitse muuttaa potilailla, joilla on minkä tahansa asteinen maksan vajaatoiminta. Pienennä jatkuvan infuusion nopeutta 6 mg:aan/tunti potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokat A ja B) ja 4 mg/tunti potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C) [ks. ANNOSTELU JA HALLINNOINTI ].
YLIANNOSTUS
Tahallisen NEXIUM 40 mg:n yliannostuksen yhteydessä kuvatut oireet (rajoitettu kokemus yli 240 mg/vrk annoksista) ovat ohimeneviä. Raportit omepratsolin yliannostuksista ihmisillä voivat myös olla merkityksellisiä. Annokset vaihtelivat jopa 2 400 mg:aan (120 kertaa tavallinen suositeltu kliininen annos). Ilmiöt olivat vaihtelevia, mutta niihin sisältyi sekavuutta, uneliaisuutta, näön hämärtymistä, takykardiaa, pahoinvointia, hikoilua, punoitusta, päänsärkyä, suun kuivumista ja muita haittavaikutuksia, jotka olivat samanlaisia kuin suositelluilla annoksilla. Katso täydelliset turvallisuustiedot suun kautta otettavan omepratsolin täydellisestä lääkemääräyksestä. Esomepratsolille ei tunneta spesifistä vastalääkettä. Koska esomepratsoli sitoutuu laajalti proteiineihin, sen ei odoteta poistuvan dialyysillä. Yliannostustapauksissa hoidon tulee olla oireenmukaista ja tukevaa.
Jos ylialtistuminen tapahtuu, soita Myrkytystietokeskukseen numeroon 1-800-222-1222 saadaksesi ajantasaista tietoa myrkytyksen tai yliannostuksen hallinnasta.
VASTA-AIHEET
- NEXIUM 20mg IV on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä substituoiduille bentsimidatsoleille tai jollekin valmisteen aineosalle. Yliherkkyysreaktiot voivat sisältää anafylaksia, anafylaktinen sokki, angioödeema, bronkospasmi, akuutti tubulointerstitiaalinen nefriitti ja urtikaria [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
- Protonipumpun estäjät (PPI), mukaan lukien NEXIUM 20 mg IV, ovat vasta-aiheisia potilailla, jotka saavat rilpiviriiniä sisältäviä tuotteita [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Esomepratsoli kuuluu eritystä vähentävien yhdisteiden luokkaan, substituoituihin bentsimidatsoleihin, jotka estävät mahahapon eritystä estämällä spesifisesti H+/K+ ATPaasientsyymijärjestelmää mahalaukun parietaalisolun erityspinnalla. Esomepratsoli protonoituu ja muuttuu parietaalisolun happamassa osassa muodostaen aktiivisen inhibiittorin, akiraalisen sulfenamidin. Koska tätä entsyymijärjestelmää pidetään mahalaukun limakalvon happo(protoni)pumppuna, esomepratsolia on luonnehdittu mahahapon pumpun estäjäksi, koska se estää hapon tuotannon viimeisen vaiheen. Tämä vaikutus on annoksesta riippuvainen ja johtaa sekä perus- että stimuloidun haponerityksen estoon ärsykkeestä riippumatta.
Farmakodynamiikka
Antisekretiivinen toiminta
Esomepratsolin vaikutusta 24 tunnin mahalaukun pH:hon terveillä koehenkilöillä arvioitiin kahdessa tutkimuksessa, joissa 20 mg ja 40 mg NEXIUM 20 mg IV infuusiona laskimoon kerran päivässä 30 minuutin aikana 5 päivän ajan, kuten taulukossa 7 esitetään.
Esomepratsolin vaikutuksia mahalaukun 24 tunnin pH-arvoon 80 mg NEXIUM.IV:n laskimonsisäisen infuusion antamisen jälkeen 30 minuutin ajan ja sen jälkeen 8 mg/tunti 23,5 tunnin ajan arvioitiin kahdessa tutkimuksessa.
H. pylori-negatiivisilla terveillä valkoihoisilla koehenkilöillä (n=24) prosentuaalinen aika 24 tunnin aikana (95 % CI), kun mahalaukunsisäinen pH oli > 6 ja > 7, oli 52,3 % (40,3, 64,4) ja 4,8 % (1,8, 7.8), vastaavasti.
H. pylori-positiivisilla (n=8) ja H. pylori-negatiivisilla (n=11) terveillä kiinalaisilla koehenkilöillä prosentuaalinen aika 24 tunnin aikana (95 % CI), kun mahalaukunsisäinen pH oli > 6 ja > 7, oli 53 % ( 45,6, 60,3) ja 15,1 % (9,5, 20,7). Ajan prosenttiosuus, jonka mahansisäinen pH oli > 6 [59 % vs. 47 %] ja pH > 7 [17 % vs. 11 %], oli yleensä suurempi H. pylori-positiivisilla koehenkilöillä verrattuna H. pylori-negatiivisiin henkilöihin.
Seerumin gastriinivaikutukset
Esomepratsolin vaikutusta seerumin gastriinipitoisuuksiin arvioitiin noin 2 700 potilaalla suun kautta otetun esomepratsolin kliinisissä tutkimuksissa enintään 8 viikon ajan ja yli 1 300 potilaalla, joita hoidettiin enintään 12 kuukauden ajan. Keskimääräinen paastogastriinitaso nousi annoksesta riippuvalla tavalla. Seerumin gastriinipitoisuuksien nousu saavutti tasanteen 2–3 kuukauden kuluessa hoidon aloittamisesta ja palasi lähtötasolle neljän viikon kuluessa hoidon lopettamisen jälkeen.
Lisääntynyt gastriini aiheuttaa enterokromafiinia muistuttavaa solujen liikakasvua ja seerumin kromograniini A:n (CgA) nousua. Kohonneet CgA-tasot voivat aiheuttaa vääriä positiivisia tuloksia neuroendokriinisten kasvainten diagnostisissa tutkimuksissa [katso VAROITUKSET JA VAROTOIMET ].
Enterokromafiinia muistuttavat (ECL) soluvaikutukset
Suonensisäisen esomepratsolin vaikutuksista ECL-soluihin ei ole saatavilla tietoja.
Ihmisen mahalaukun biopsianäytteet on otettu yli 3 000 potilaalta (sekä lapsilta että aikuisilta), joita on hoidettu suun kautta omepratsolilla pitkäaikaisissa kliinisissä tutkimuksissa. ECL-solujen hyperplasian ilmaantuvuus näissä tutkimuksissa lisääntyi ajan myötä; näillä potilailla ei kuitenkaan ole havaittu ECL-solukarsinoiditapauksia, dysplasiaa tai neoplasiaa [ks. Ei-kliininen toksikologia ].
Yli 1 000 potilaalla, joita hoidettiin oraalisella esomepratsolilla (10 mg, 20 mg tai 40 mg/vrk) enintään 12 kuukauden ajan, ECL-solujen liikakasvun esiintyvyys lisääntyi ajan ja annoksen myötä. Yhdellekään potilaalle ei kehittynyt ECL-solukarsinoideja, dysplasiaa tai neoplasiaa mahalaukun limakalvolle.
Endokriiniset vaikutukset
Esomepratsolilla ei ollut vaikutusta kilpirauhasen toimintaan, kun sitä annettiin 20 mg:n tai 40 mg:n suun kautta 4 viikon ajan. Muita esomepratsolin vaikutuksia endokriiniseen järjestelmään arvioitiin omepratsolitutkimuksissa. Oraaliset omepratsolin annokset 30 mg tai 40 mg päivässä 2–4 viikon ajan eivät vaikuttaneet hiilihydraattien aineenvaihduntaan, lisäkilpirauhashormonin, kortisolin, estradiolin, testosteronin, prolaktiinin, kolekystokiniinin tai sekretiinin tasoihin.
Farmakokinetiikka
Imeytyminen
Esomepratsolin farmakokinetiikka terveillä koehenkilöillä sen jälkeen, kun NEXIUM IV 20 mg ja 40 mg kerran vuorokaudessa annettiin laskimonsisäisenä infuusiona 30 minuutin aikana 5 päivän ajan, on esitetty taulukossa 8.
Kun NEXIUM 40 mg laskimoon annettiin suonensisäisesti 24 terveelle henkilölle 80 mg:n kyllästysannoksena 30 minuutin aikana, minkä jälkeen annettiin jatkuva infuusio 8 mg/tunti 23,5 tunnin ajan (yhteensä 24 tunnin ajan), esomepratsolin farmakokineettiset parametrit [geometrinen keskiarvo (95 % CI)] olivat seuraavat: AUCt 111,1 mikromol*h/L (100,5, 122,7 mikromol*h/l), Cmax 15,0 mikromol/l (13,5, 16,6 mikromol/L) ja vakaan tilan plasmapitoisuus (Css) 3,9 mikromoolia/l (3,5, 4,5 mikromoolia/l). Toisessa tutkimuksessa terveillä valkoihoisilla koehenkilöillä annettiin samaa hoito-ohjelmaa.
Esomepratsoli on ajasta riippuvainen CYP2C19:n estäjä, mikä johtaa autoinhibitioon ja epälineaariseen farmakokinetiikkaan. Systeeminen altistuminen lisääntyy enemmän kuin annokseen verrannollisesti, kun esomepratsolia on otettu toistuvasti suun kautta. Ensimmäiseen annokseen verrattuna systeeminen altistus (Cmax ja AUC0-24h) vakaassa tilassa kerran vuorokaudessa otetun annoksen jälkeen lisääntyi 43 % ja 90 % verrattuna ensimmäisen 20 mg:n annoksen jälkeen ja kasvoi 95 %. ja 159 % 40 mg:n annoksella.
Jakelu
Esomepratsoli sitoutuu 97 % plasman proteiineihin. Sitoutuminen plasman proteiineihin on vakio 2-20 mikromol/l pitoisuusalueella. Näennäinen jakautumistilavuus vakaassa tilassa terveillä koehenkilöillä on noin 16 l.
Eliminointi
Aineenvaihdunta
Esomepratsoli metaboloituu laajalti maksassa sytokromi P450 (CYP) -entsyymijärjestelmän avulla. Esomepratsolin metaboliiteilla ei ole eritystä estävää vaikutusta. Suurin osa esomepratsolin metaboliasta on riippuvainen CYP2C19-isoentsyymistä, joka muodostaa hydroksi- ja desmetyylimetaboliitit. Jäljelle jäävä määrä on riippuvainen CYP3A4:stä, joka muodostaa sulfonimetaboliitin.
Erittyminen
Esomepratsoli erittyy metaboliitteina pääasiassa virtsaan, mutta myös ulosteeseen. Alle 1 % lähtölääkkeestä erittyy virtsaan. Esomepratsoli eliminoituu kokonaan plasmasta, eikä kertymistä tapahdu kerran vuorokaudessa annettaessa. Esomepratsolin plasman eliminaation puoliintumisaika NEXIUM IV:n laskimonsisäisen annon jälkeen on noin 1,1-1,4 tuntia, ja se pitenee annosten kasvaessa.
Plasman puhdistuma (CL) on noin 5,9 - 7,2 l/h annettaessa NEXIUM 40 mg IV 80 mg:n laskimonsisäisenä infuusiona 30 minuutin aikana, jota seuraa jatkuva infuusio 8 mg/tunti 23,5 tunnin ajan.
Tietyt populaatiot
Geriatriset potilaat
Esomepratsolin AUC- ja Cmax-arvot olivat hieman korkeammat (25 % ja 18 % vastaavasti) vanhuksilla verrattuna nuorempiin potilaisiin vakaassa tilassa. Tätä altistuksen lisääntymistä ei pidetä kliinisesti merkityksellisenä.
Pediatriset potilaat
Esomepratsolin farmakokinetiikkaa arvioitiin 50:llä 17-vuotiaalla lapsipotilaalla, mukaan lukien (joista 44 lapsipotilasta oli 1 kk - 17-vuotiaita) satunnaistetussa, avoimessa, monikansallisessa, toistuvassa 20 mg:n NEXIUM-annostutkimuksessa. 40 mg suonensisäisenä injektiona kerran päivässä 3 minuutin pituisena suonensisäisenä injektiona. Esomepratsolin plasman AUC-arvot olivat 183 % ja 60 % korkeammat 6–11-vuotiailla ja 12–17-vuotiailla lapsipotilailla aikuisiin verrattuna.
Myöhemmät farmakokineettiset analyysit ennustivat seuraavilla annostusohjelmilla saavuttavan samanlaiset vakaan tilan plasma-altistukset (AUC0-24) kuin aikuispotilailla, joille annettiin 20 mg NEXIUM IV -valmistetta kerran vuorokaudessa: 0,5 mg/kg kerran vuorokaudessa lapsipotilaille 1 kuukaudesta 11 kuukauteen. iältään 10 mg kerran vuorokaudessa 1-17-vuotiaille lapsipotilaille, joiden paino on alle 55 kg, ja 20 mg kerran vuorokaudessa 1-17-vuotiaille lapsipotilaille, joiden paino on 55 kg tai enemmän. Infuusion keston pidentämisen 3 minuutista 10 minuuttiin tai 30 minuuttiin ennustettiin tuottavan vakaan tilan Cmax-arvot, jotka olivat verrattavissa aikuispotilailla 40 mg:n ja 20 mg:n NEXIUM IV -annoksilla, vastaavasti [ks. Käyttö tietyissä populaatioissa ].
Mies- ja naispotilaat
Esomepratsolin AUC- ja Cmax-arvot olivat hieman korkeammat (13 %) naisilla kuin miehillä vakaassa tilassa, kun niitä annettiin suun kautta. Samanlaisia eroja on havaittu esomepratsolin suonensisäisessä annossa. Tätä altistuksen lisääntymistä ei pidetä kliinisesti merkityksellisenä.
Potilaat, joilla on munuaisten vajaatoiminta
Esomepratsolin farmakokinetiikan ei odoteta muuttuvan munuaisten vajaatoimintaa sairastavilla potilailla verrattuna terveisiin koehenkilöihin, koska alle 1 % esomepratsolista erittyy muuttumattomana virtsaan.
Potilaat, joilla on maksan vajaatoiminta
Esomepratsolin vakaan tilan farmakokinetiikka, joka saatiin, kun 40 mg suun kautta kerran vuorokaudessa annettiin 4 potilaalle, joilla kullakin oli lievä (Child-Pugh luokka A), keskivaikea (Child-Pugh luokka B) ja vaikea (Child-Pugh luokka C) maksan vajaatoiminta. verrattuna 36 mies- ja naispuoliseen GERD-potilaaseen, joilla oli normaali maksan toiminta. Potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta, AUC-arvot olivat alueella, joka voitiin odottaa potilailla, joiden maksan toiminta on normaali. Potilailla, joilla oli vaikea maksan vajaatoiminta, AUC-arvot olivat 2–3 kertaa korkeammat kuin potilailla, joiden maksan toiminta oli normaali. [katso Käyttö tietyissä populaatioissa ].
Ei ole saatavilla farmakokineettisiä tietoja esomepratsolin jatkuvasta suonensisäisestä annostelusta potilaille, joilla on maksan vajaatoiminta. Laskimonsisäisen omepratsolin 80 mg:n farmakokinetiikka infuusiona 30 minuutin aikana ja sen jälkeen 8 mg/tunti 47,5 tunnin aikana potilailla, joilla on lievä (Child-Pugh-luokka A; n=5), keskivaikea (Child-Pugh-luokka B; n=4) ja Vaikeaa (Child-Pugh-luokka C; n=3) maksan vajaatoimintaa verrattiin 24 terveen mies- ja naispuolisen koehenkilön tuloksiin. Potilailla, joilla on lievä ja kohtalainen maksan vajaatoiminta, omepratsolin puhdistuma ja vakaan tilan plasmapitoisuus olivat noin 35 % alhaisemmat ja 50 % korkeammat kuin terveillä koehenkilöillä. Potilailla, joilla oli vaikea maksan vajaatoiminta, omepratsolin puhdistuma oli 50 % terveiden koehenkilöiden puhdistumasta ja vakaan tilan plasmapitoisuus oli kaksinkertainen verrattuna terveisiin [ks. Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
Esomepratsolin/omepratsolin vaikutus muihin lääkkeisiin
In vitro- ja in vivo -tutkimukset ovat osoittaneet, että esomepratsoli ei todennäköisesti estä CYP:ita 1A2, 2A6, 2C9, 2D6, 2E1 ja 3A4.
Antiretroviraaliset lääkkeet
Joidenkin antiretroviraalisten lääkkeiden, kuten rilpiviriinin, atatsanaviirin ja nelfinaviirin, seerumipitoisuuksia on raportoitu, kun niitä on annettu yhdessä omepratsolin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Rilpiviriini
Rilpiviriinin (150 mg, päivittäin) ja omepratsolin (20 mg, päivittäin) toistuvien annosten jälkeen rilpiviriinin AUC pieneni 40 %, Cmax 40 % ja Cmin 33 % [ks. VASTA-AIHEET ].
Nelfinaviiri
Nelfinaviirin (1250 mg, kahdesti vuorokaudessa) ja omepratsolin (40 mg päivässä) toistuvien annosten jälkeen nelfinaviirin AUC pieneni 36 % ja 92 %, Cmax 37 % ja 89 % ja Cmin 39 % ja M8 75 %. .
Atatsanaviiri
Atatsanaviirin (400 mg, päivittäin) ja omepratsolin (40 mg, päivittäin, 2 tuntia ennen atatsanaviiria) useiden annosten jälkeen AUC pieneni 94 %, Cmax 96 % ja Cmin 95 %.
Sakinaviiri
Kun sakinaviiria/ritonaviiria (1000/100 mg) annettiin toistuvasti kahdesti vuorokaudessa 15 päivän ajan omepratsoliannoksella 40 mg päivässä, annettiin samanaikaisesti päivinä 11-15. AUC nousi 82 %, Cmax 75 % ja Cmin 106 %. Tämän vuorovaikutuksen takana olevaa mekanismia ei ole täysin selvitetty.
Klopidogreeli
Crossover-tutkimuksessa terveille koehenkilöille annettiin klopidogreelia (300 mg kyllästysannos, jota seurasi 75 mg päivässä ylläpitoannoksena 28 päivän ajan) ja esomepratsolia (40 mg suun kautta kerran päivässä samaan aikaan klopidogreelin kanssa) 29 päivän ajan. Altistuminen klopidogreelin aktiiviselle metaboliitille pieneni 35–40 % tänä aikana, kun klopidogreelia ja esomepratsolia annettiin yhdessä. Myös farmakodynaamiset parametrit mitattiin ja osoitettiin, että muutos verihiutaleiden aggregaation estämisessä oli yhteydessä muutokseen altistuksessa klopidogreelin aktiiviselle metaboliitille [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Mykofenolaattimofetiili
Omepratsolin 20 mg kahdesti vuorokaudessa 4 päivän ajan ja kerta-annoksena 1000 mg MMF:ää noin tunnin kuluttua viimeisen omepratsoliannoksen antaminen 12 terveelle koehenkilölle ristikkäistutkimuksessa johti 52 %:n laskuun Cmax-arvossa ja 23 %:lla. MPA:n AUC:ssa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
silostatsoli
Omepratsoli toimii CYP2C19:n estäjänä. Omepratsoli, joka annettiin 40 mg:n annoksina vuorokaudessa yhden viikon ajan 20 terveelle koehenkilölle ristikkäistutkimuksessa, nosti silostatsolin Cmax-arvoa 18 % ja AUC-arvoa 26 %. Yhden aktiivisen metaboliitin, 3,4-dihydrosilostatsolin, jonka aktiivisuus on 4-7 kertaa silostatsolin aktiivisuus, Cmax nousi 29 % ja AUC 69 %. Silostatsolin ja omepratsolin samanaikaisen antamisen odotetaan lisäävän silostatsolin ja edellä mainitun aktiivisen metaboliitin pitoisuuksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Diatsepaami
Esomepratsolin 30 mg:n ja diatsepaamin, CYP2C19-substraatin, samanaikainen anto johti 45 %:n laskuun diatsepaamin puhdistumassa. Diatsepaamipitoisuuksien nousu plasmassa havaittiin 12 tunnin kuluttua annostelusta ja siitä eteenpäin. Kuitenkin tuolloin plasman diatsepaamipitoisuudet olivat terapeuttisen intervallin alapuolella, joten tällä yhteisvaikutuksella ei todennäköisesti ole kliinistä merkitystä.
Digoksiini
Omepratsolin 20 mg kerran vuorokaudessa ja digoksiinin samanaikainen anto terveille koehenkilöille lisäsi digoksiinin biologista hyötyosuutta 10 % (30 % kahdella koehenkilöllä) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Muut huumeet
Esomepratsolin ja jommankumman naprokseenin (ei-selektiivinen NSAID) samanaikainen anto ei osoittanut kliinisesti merkittäviä muutoksia näiden tulehduskipulääkkeiden farmakokineettisissä profiileissa.
Muiden lääkkeiden vaikutus esomepratsoliin/omepratsoliin
mäkikuisma
Cross-over-tutkimuksessa, jossa oli mukana 12 tervettä miespuolista henkilöä, mäkikuisma (300 mg kolmesti päivässä 14 päivän ajan) vähensi merkittävästi systeemistä omepratsolialtistusta CYP2C19:n hitailla metaboloijilla (Cmax ja AUC pienenivät 37,5 % ja 37,9 %) ja nopeat metaboloijat (Cmax ja AUC pienenivät 49,6 % ja 43,9 %, vastaavasti) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vorikonatsoli
Omepratsolin ja vorikonatsolin (CYP2C19:n ja CYP3A4:n yhdistetty estäjä) samanaikainen anto johti omepratsolialtistuksen yli kaksinkertaistumiseen. Kun vorikonatsolia (400 mg joka 12. tunti yhden päivän ajan, minkä jälkeen 200 mg kerran vuorokaudessa 6 päivän ajan) annettiin terveille koehenkilöille omepratsolin kanssa (40 mg kerran päivässä 7 päivän ajan), omepratsolin vakaan tilan Cmax ja AUC0-24 lisääntyi merkittävästi: keskimäärin 2 kertaa (90 % CI: 1,8, 2,6) ja 4 kertaa (90 % CI: 3,3, 4,4) verrattuna siihen, kun omepratsolia annettiin ilman vorikonatsolia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Muut huumeet
Esomepratsolin samanaikainen anto oraalisten ehkäisyvalmisteiden, diatsepaamin, fenytoiinin, kinidiinin, naprokseenin (ei-selektiivinen NSAID) kanssa ei näyttänyt muuttavan esomepratsolin farmakokineettistä profiilia.
Mikrobiologia
Vaikutukset maha-suolikanavan mikrobiekologiaan
Mahalaukun happamuuden väheneminen, joka johtuu kaikista keinoista, mukaan lukien protonipumpun estäjät, lisää ruoansulatuskanavassa normaalisti esiintyvien bakteerien määrää mahassa. Hoito protonipumpun estäjillä voi lisätä hieman ruoansulatuskanavan infektioiden, kuten Salmonellan ja Campylobacterin, riskiä ja sairaalapotilailla mahdollisesti myös Clostridium difficile -infektiota.
Farmakogenomiikka
CYP2C19, polymorfinen entsyymi, osallistuu esomepratsolin metaboliaan. CYP2C19*1-alleeli on täysin toimiva, kun taas CYP2C19*2- ja *3-alleelit eivät toimi. On olemassa muita alleeleja, joihin ei liity entsymaattista toimintaa tai se on vähentynyt. Potilaat, joilla on kaksi täysin toimivaa alleelia, ovat laajoja metaboloijia ja ne, joilla on kaksi toiminnan menettämisen alleelia, ovat huonoja metaboloijia. Systeeminen esomepratsolialtistus vaihtelee potilaan aineenvaihdunnan tilan mukaan: heikot metaboloijat > keskipitkät metaboloijat > nopeat metaboloijat. Noin 3 % valkoihoisista ja 15–20 % aasialaisista on CYP2C19:n heikkoja metaboloijia.
Systeeminen esomepratsolialtistus oli hieman korkeampi (noin 17 %) CYP2C19:n välimetaboloijilla (IM; n=6) verrattuna CYP2C19:n nopeisiin metaboloijeihin (EM; n=17). Samanlaisia farmakokineettisiä eroja havaittiin näiden genotyyppien välillä terveillä kiinalaisilla koehenkilöillä tehdyssä tutkimuksessa, joka sisälsi 7 EM:tä ja 11 IM:tä. Näistä tutkimuksista on saatavilla hyvin vähän farmakokineettisiä tietoja hitaista metaboloijista (PM).
Vakaassa tilassa kerran vuorokaudessa annetun NEXIUM 40 mg 40 mg:n laskimonsisäisen annostelun jälkeen AUC:n suhde huonoihin metaboloijeihin verrattuna muun väestön AUC-arvoon on noin 1,5. Tätä altistuksen muutosta ei pidetä kliinisesti merkityksellisenä.
Eläinten toksikologia ja/tai farmakologia
Lisääntymistutkimukset
Lisääntymistutkimuksia on suoritettu rotilla suun kautta annetuilla annoksilla aina 280 mg/kg/vrk asti (noin 68 kertaa suun kautta otettava annos ihmiselle 40 mg kehon pinta-alasta laskettuna) ja kaniineilla oraalisilla annoksilla 86 mg/kg/vrk asti. (noin 42 kertaa suun kautta otettava annos ihmiselle 40 mg kehon pinta-alasta laskettuna) eivätkä ne ole paljastaneet esomepratsolin aiheuttamaa hedelmällisyyden heikkenemistä tai sikiölle aiheutuvaa haittaa [ks. Käyttö tietyissä populaatioissa ].
Nuorten eläinten tutkimus
28 päivän toksisuustutkimus, jossa oli 14 päivän palautumisvaihe, suoritettiin nuorilla rotilla esomepratsolimagnesiumilla annoksilla 70-280 mg/kg/vrk (noin 17-68 kertaa ihmisen vuorokausiannos 40 mg suun kautta kehon pinnalle alueen perusteella). Kuolemien määrä lisääntyi suurella annoksella 280 mg/kg/vrk, kun nuorille rotille annettiin esomepratsolimagnesiumia syntymän jälkeisestä päivästä 7. päivään 35. Lisäksi annokset olivat vähintään 140 mg/kg/vrk. päivässä (noin 34 kertaa ihmisen 40 mg:n vuorokausiannos kehon pinta-alasta laskettuna), aiheuttivat hoitoon liittyvää painon laskua (noin 14 %) ja painonnousua, reisiluun painon ja reisiluun pituuden laskua ja kokonaisvaikutuksia. kasvu. Yllä kuvattuja vertailukelpoisia löydöksiä on havaittu myös tässä tutkimuksessa toisen esomepratsolisuolan, esomepratsolin strontiumin kanssa esomepratsolin ekvimolaarisilla annoksilla.
Kliiniset tutkimukset
Hapon vähentäminen GERD:ssä
Tehtiin neljä avointa monikeskustutkimusta, jossa verrattiin esomepratsolin farmakodynaamisia vaikutuksia suonensisäisen tai oraalisen annon jälkeen hapon suppressioon 206 potilaalla, joilla oli GERD-oireita, joihin liittyy tai ei ollut erosiivista esofagiittia. Potilaat satunnaistettiin saamaan joko 20 tai 40 mg NEXIUM 40 mg IV tai oraalista esomepratsolia kerran päivässä 10 päivän ajan (jakso 1), ja sitten jaksossa 2 vaihdettiin toiseen formulaatioon 10 päiväksi, mikä vastaa heidän vastaavaa annosta jaksolta 1. NEXIUM 40 mg IV 20 mg ja 40 mg annettiin 3 minuutin injektiona kahdessa tutkimuksessa ja 15 minuutin infuusiona kahdessa muussa tutkimuksessa.
Potilaspopulaatio vaihteli 18-72-vuotiaista; 54 % oli naisia; 53 % valkoihoisia, 24 % mustia, 5 % aasialaisia ja 17 % muita rotuja. Perushapon tuotanto (BAO) ja maksimaalinen hapon tuotanto (MAO) määritettiin 22 - 24 tuntia annoksen jälkeen jaksolla 1, päivänä 11; jaksolla 2, päivänä 3; ja jaksolla 2, päivänä 11. BAO ja MAO arvioitiin 1 tunnin jatkuvasta mahan sisällön keräämisestä ennen ja sen jälkeen (vastaavasti) subkutaanista 6,0 mcg/kg pentagastriiniinjektiota.
Näissä tutkimuksissa NEXIUM IV 20 mg ja 40 mg kerran vuorokaudessa annettujen 10 päivän jälkeen olivat samanlaisia kuin vastaavat oraaliset esomepratsoliannokset niiden kyvyn osalta suppressoida BAO:ta ja MAO:ta näillä GERD-potilailla (katso taulukko 9 alla).
Hapon suppressiossa ei tapahtunut merkittäviä muutoksia vaihdettaessa suonensisäisen ja oraalisen annosmuodon välillä.
Verenvuoto maha- tai pohjukaissuolihaava
Satunnaistettu, kaksoissokkoutettu, lumekontrolloitu kliininen tutkimus suoritettiin 764 potilaalla, joilla oli endoskooppisesti vahvistettu maha- tai pohjukaissuolihaavaverenvuoto. Väestö oli 18-98-vuotiaita; 68 % oli miehiä, 87 % valkoihoisia, 1 % mustia, 7 % aasialaisia ja 4 % muuta rotua. Endoskooppisen hemostaasin jälkeen potilaat satunnaistettiin saamaan joko lumelääkettä tai NEXIUM IV 80 mg:aa suonensisäisenä infuusiona 30 minuutin aikana, mitä seurasi jatkuva infuusio 8 mg/tunti yhteensä 72 tunnin ajan. Ensimmäisen 72 tunnin jakson jälkeen kaikki potilaat saivat oraalista PPI:tä 27 päivän ajan. Uudelleenverenvuoto 3 päivän sisällä satunnaistamisesta oli 5,9 % NEXIUM 20 mg IV-hoitoa saaneessa ryhmässä verrattuna 10,3 %:iin lumeryhmässä (hoidon ero -4,4 %; 95 %:n luottamusväli: -8,3 %, -0,6 %; p=0,03 ). Tämä hoitoero oli samanlainen kuin päivänä 7 ja päivänä 30 havaittu ero, jolloin kaikki potilaat saivat suun kautta annettavaa PPI:tä.
Hongkongissa suoritettu satunnaistettu, kaksoissokkoutettu, lumekontrolloitu yksikeskustutkimus osoitti myös lumelääkkeeseen verrattuna pienentyneen 72 tunnin sisällä verenvuodon uusiutumisen riskissä potilailla, joilla oli verenvuotoa maha- tai pohjukaissuolihaava ja jotka saivat raseemista omepratsolia, josta 50 % on S-enantiomeeri esomepratsoli.
POTILASTIEDOT
Haittavaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos heillä on merkkejä tai oireita, jotka vastaavat:
- Yliherkkyysreaktiot [katso VASTA-AIHEET ]
- Akuutti tubulointerstitiaalinen nefriitti [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Luun murtuma [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihohaittavaikutukset [katso VAROITUKSET JA VAROTOIMET ].
- Ihon ja systeeminen lupus erythematosus [katso VAROITUKSET JA VAROTOIMET ]
- Hypomagnesemia ja mineraaliaineenvaihdunta [katso VAROITUKSET JA VAROTOIMET ]
Huumeiden vuorovaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen ennen kuin he aloittavat hoidon jollakin seuraavista:
- Rilpiviriiniä sisältävät tuotteet [katso VASTA-AIHEET ]
- Klopidogreeli [katso VAROITUKSET JA VAROTOIMET ]
- mäkikuisma tai rifampiini [katso VAROITUKSET JA VAROTOIMET ]
- Suuriannoksinen metotreksaatti [ks VAROITUKSET JA VAROTOIMET ]
Hallinto
- Kerro potilaille, että antasideja voidaan käyttää NEXIUM 40mg IV -hoidon aikana
