Sydän- ja verisuonitautien hoito: Coumadin 1mg, 2mg, 5mg Warfarin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Coumadin on ja miten sitä käytetään?
Coumadin on reseptilääke, jota käytetään verihyytymien hoitoon ja veritulppien muodostumisen mahdollisuuteen kehossasi. Veritulpat voivat aiheuttaa aivohalvauksen, sydänkohtauksen tai muita vakavia tiloja, jos niitä muodostuu jalkoihin tai keuhkoihin.
Mitä sivuvaikutuksia Coumadinilla on?
Coumadin voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Ihokudoksen kuolema (ihon kuolio tai kuolio). Tämä voi tapahtua pian Coumadinin aloittamisen jälkeen. Se tapahtuu, koska verihyytymät muodostuvat ja estävät veren virtauksen kehosi alueelle. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on kipua, väriä tai lämpötilan muutosta jollakin kehon alueella. Saatat tarvita välittömästi lääkärinhoitoa estääksesi sairastuneen ruumiinosan kuoleman tai menetyksen (amputaatio).
- Munuaisongelmat. Munuaisvaurio voi tapahtua ihmisillä, jotka käyttävät Coumadinia. Kerro heti terveydenhuollon tarjoajalle, jos virtsassasi on verta. Terveydenhuollon tarjoaja voi tehdä testejä useammin Coumadin-hoidon aikana verenvuodon tarkistamiseksi, jos sinulla on jo munuaisongelmia.
- "Violet varpaat -oireyhtymä." Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on kipua varpaissasi ja ne näyttävät violetilta tai tummalta.
Nämä eivät ole kaikki Coumadinin sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VERENVUOTOVAARA
- COUMADIN voi aiheuttaa vakavaa tai kuolemaan johtavaa verenvuotoa [katso VAROITUKSET JA VAROTOIMET ].
- Seuraa säännöllisesti INR-arvoa kaikilla hoidetuilla potilailla [katso ANNOSTELU JA HALLINNOINTI ].
- Lääkkeet, ruokavaliomuutokset ja muut tekijät vaikuttavat COUMADIN 5 mg -hoidolla saavutettuihin INR-tasoihin [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Neuvo potilaita ehkäisytoimenpiteistä verenvuodon riskin minimoimiseksi ja verenvuodon merkeistä ja oireista ilmoittamisesta [katso POTILASTIEDOT ].
KUVAUS
COUMADIN (varfariininatrium) -tabletit ja COUMADIN (varfariininatrium) injektiota varten sisältävät varfariininatriumia, antikoagulanttia, joka toimii estämällä K⌈-vitamiinista riippuvaisia hyytymistekijöitä. Varfariininatriumin kemiallinen nimi on 3-(α-asetonyylibentsyyli)-4-hydroksikumariininatriumsuola, joka on R- ja S-enantiomeerien raseeminen seos. Kiteinen varfariininatrium on isopropanoliklatraatti. Sen empiirinen kaava on C19H15NaO4, ja sen rakennekaavaa edustaa seuraava:
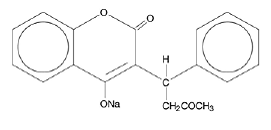
Kiteinen varfariininatrium esiintyy valkoisena, hajuttomana, kiteisenä jauheena, jonka väri muuttuu valon vaikutuksesta. Se liukenee hyvin veteen, liukenee vapaasti alkoholiin ja liukenee hyvin vähän kloroformiin ja eetteriin.
Suun kautta käytettävät COUMADIN-tabletit sisältävät myös:
COUMADIN 1mg injektiota varten suonensisäiseen käyttöön toimitetaan steriilinä, lyofilisoituna jauheena, joka liuotettuaan 2,7 ml:aan steriiliä injektionesteisiin käytettävää vettä sisältää:
INDIKAATIOT
COUMADIN® on tarkoitettu:
- Laskimotromboosin ja sen laajenemisen, keuhkoembolian (PE) ehkäisy ja hoito.
- Eteisvärinään (AF) ja/tai sydänläpän korvaamiseen liittyvien tromboembolisten komplikaatioiden ehkäisy ja hoito.
- Kuoleman, toistuvan sydäninfarktin (MI) ja tromboembolisten tapahtumien, kuten aivohalvauksen tai systeemisen embolisaation, riskin pienentäminen sydäninfarktin jälkeen.
Käyttörajoitukset
COUMADIN 2 mg:lla ei ole suoraa vaikutusta muodostuneeseen veritulppaan, eikä se korjaa iskeemistä kudosvauriota. Kun veritulppa on kuitenkin ilmaantunut, antikoagulanttihoidon tavoitteena on estää muodostuneen hyytymän laajeneminen edelleen ja sekundaariset tromboemboliset komplikaatiot, jotka voivat johtaa vakaviin ja mahdollisesti kuolemaan johtaviin seurauksiin.
ANNOSTELU JA HALLINNOINTI
Yksilöllinen annostelu
COUMADIN 2 mg:n annostus ja anto on yksilöitävä kullekin potilaalle potilaan INR-vasteen mukaan. Säädä annosta potilaan INR:n ja hoidettavan tilan perusteella. Tutustu viimeisimpiin näyttöön perustuviin kliinisen käytännön ohjeisiin koskien antikoagulaation kestoa ja intensiteettiä osoitetuissa tiloissa.
Suositellut INR-tavoitealueet ja -kestot yksittäisille indikaatioille
INR, joka on suurempi kuin 4,0, ei näytä tarjoavan ylimääräistä terapeuttista hyötyä useilla potilailla, ja siihen liittyy suurempi verenvuotoriski.
Laskimotromboembolia (mukaan lukien syvä laskimotukos [DVT] ja PE)
Säädä varfariiniannosta niin, että INR-tavoite pysyy 2,5:ssä (INR-alue 2,0–3,0) kaikkien hoidon kestojen ajan.
Hoidon kesto perustuu käyttöaiheeseen seuraavasti:
- Potilaille, joilla on ohimenevän (reversiibelin) riskitekijän aiheuttama syvänlaskimotauti tai PE, suositellaan 3 kuukauden varfariinihoitoa.
- Potilaille, joilla on provosoimaton DVT tai PE, varfariinihoitoa suositellaan vähintään 3 kuukauden ajan. 3 kuukauden hoidon jälkeen arvioi pitkän aikavälin hoidon riski-hyötysuhde yksittäiselle potilaalle.
- Pitkäaikaista varfariinihoitoa suositellaan potilaille, joilla on kaksi provosoimattoman syvän laskimotukoksen tai PE-jaksoa. Jos potilas saa pitkäaikaista antikoagulanttihoitoa, arvioi säännöllisesti uudelleen tällaisen hoidon jatkamisen riski-hyötysuhde yksittäisellä potilaalla.
Eteisvärinä
Potilaille, joilla on ei-läppäperäinen AF, antikoaguloi varfariinilla INR:n tavoitteeksi 2,5 (vaihteluväli 2,0-3,0).
- Potilailla, joilla on ei-läppäperäinen AF, joka on jatkuva tai kohtauksellinen ja jolla on suuri aivohalvausriski (eli joilla on jokin seuraavista ominaisuuksista: aikaisempi iskeeminen aivohalvaus, ohimenevä iskeeminen kohtaus tai systeeminen embolia tai 2 seuraavista riskitekijöistä: ikää suurempi yli 75-vuotiaat, kohtalaisesti tai vakavasti heikentynyt vasemman kammion systolinen toiminta ja/tai sydämen vajaatoiminta, hypertensio tai diabetes mellitus), suositellaan pitkäaikaista antikoagulaatiota varfariinilla.
- Potilailla, joilla ei-läppäperäinen AF on jatkuva tai kohtauksellinen ja jolla on keskimääräinen iskeemisen aivohalvauksen riski (eli joilla on yksi seuraavista riskitekijöistä: ikä yli 75 vuotta, kohtalainen tai vakava vasemman kammion systolinen toimintahäiriö ja/tai sydämen vajaatoiminta , verenpainetauti tai diabetes mellitus), suositellaan pitkäaikaista antikoagulaatiota varfariinilla.
- Potilaille, joilla on AF ja mitraalistenoosi, suositellaan pitkäaikaista antikoagulaatiota varfariinilla.
- Potilaille, joilla on AF ja sydänläppäproteesit, suositellaan pitkäaikaista antikoagulaatiota varfariinilla; tavoite-INR-arvoa voidaan suurentaa ja aspiriinia lisätä riippuen venttiilin tyypistä ja asennosta sekä potilastekijöistä.
Mekaaniset ja bioproteettiset sydänläppäimet
- Potilaille, joilla on mekaaninen bileaflet-venttiili tai Medtronic Hall (Minneapolis, MN) kallistuslevyventtiili aortta-asennossa ja jotka ovat sinusrytmissä ja joilla ei ole vasemman eteisen laajentumista, varfariinihoitoa INR-tavoitteeseen 2,5 (alue 2,0-3,0) on suositeltavaa.
- Potilaille, joilla on kallistettavat levyventtiilit ja mekaaniset bileaflet-venttiilit mitraaliasennossa, suositellaan varfariinihoitoa INR-tavoitearvoon 3,0 (alue 2,5-3,5).
- Potilaille, joilla on häkkipallo- tai häkkiläppäventtiilit, suositellaan varfariinihoitoa INR-tavoitearvoon 3,0 (alue 2,5-3,5).
- Potilaille, joilla on bioproteesi läppä mitraaliasennossa, suositellaan varfariinihoitoa INR:n tavoitearvoon 2,5 (alue 2,0-3,0) ensimmäisten 3 kuukauden ajan läpän asettamisen jälkeen. Jos tromboemboliaan liittyy muita riskitekijöitä (AF, aiempi tromboembolia, vasemman kammion toimintahäiriö), INR-tavoitearvoksi suositellaan 2,5 (alue 2,0-3,0).
Sydäninfarktin jälkeinen
- Korkean riskin MI-potilaille (esim. niille, joilla on suuri etummainen sydäninfarkti, joilla on merkittävä sydämen vajaatoiminta, joilla on intrakardiaalinen trombi, joka näkyy rintakehän kaikukuvauksessa, AF-potilaat ja ne, joilla on ollut tromboembolinen tapahtuma) yhdistelmähoitoa. kohtalaisen intensiteetin (INR, 2,0-3,0) varfariinia ja pieniannoksisia aspiriinia (≤100 mg/vrk) suositellaan vähintään 3 kuukauden ajan sydäninfarktin jälkeen.
Toistuva systeeminen embolia ja muut oireet
Oraalista antikoagulaatiohoitoa varfariinilla ei ole täysin arvioitu kliinisissä tutkimuksissa potilailla, joilla on AF:hen liittyvä läppäsairaus, potilailla, joilla on mitraalisen ahtauma, tai potilailla, joilla on toistuva systeeminen embolia, jonka etiologia on tuntematon. Näille potilaille voidaan kuitenkin käyttää kohtalaista annosohjelmaa (INR 2,0-3,0).
Alku- ja huoltoannostelu
Sopiva COUMADIN 2 mg:n aloitusannos vaihtelee suuresti eri potilailla. Kaikkia varfariiniannoksen vaihteluun vaikuttavia tekijöitä ei tunneta, ja alkuannokseen vaikuttavat:
- Kliiniset tekijät, mukaan lukien ikä, rotu, paino, sukupuoli, samanaikaiset lääkkeet ja samanaikaiset sairaudet
- Geneettiset tekijät (CYP2C9- ja VKORC1-genotyypit) [katso KLIININEN FARMAKOLOGIA ].
Valitse aloitusannos odotetun ylläpitoannoksen perusteella ottaen huomioon edellä mainitut tekijät. Muuta tätä annosta potilaskohtaisten kliinisten tekijöiden perusteella. Harkitse pienempiä aloitus- ja ylläpitoannoksia iäkkäille ja/tai heikkokuntoisille potilaille ja aasialaisille potilaille [katso Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ]. Kyllästysannosten rutiininomaista käyttöä ei suositella, koska tämä käytäntö voi lisätä verenvuotoa ja muita komplikaatioita eikä tarjoa nopeampaa suojaa hyytymien muodostumiselta.
Määritä hoidon kesto jokaiselle potilaalle yksilöllisesti. Yleensä antikoagulanttihoitoa tulee jatkaa, kunnes tromboosin ja embolian vaara on ohitettu [ks. Suositellut INR-tavoitealueet ja -kestot yksittäisille indikaatioille ].
Annostussuositukset ottamatta huomioon genotyyppiä
Jos potilaan CYP2C9- ja VKORC1-genotyyppejä ei tunneta, COUMADIN 1 mg:n aloitusannos on yleensä 2–5 mg kerran vuorokaudessa. Määritä kunkin potilaan annostustarpeet seuraamalla tarkasti INR-vastetta ja harkitsemalla hoidettavaa käyttöaihetta. Tyypilliset ylläpitoannokset ovat 2–10 mg kerran päivässä.
Annostussuositukset genotyypin huomioon ottaen
Taulukossa 1 on esitetty kolme vaihteluväliä odotetuista COUMADIN-ylläpitoannoksista, joita havaittiin potilaiden alaryhmissä, joilla oli erilaisia CYP2C9- ja VKORC1-geenivarianttien yhdistelmiä [ks. KLIININEN FARMAKOLOGIA ]. Jos potilaan CYP2C9- ja/tai VKORC1-genotyyppi tunnetaan, ota nämä vaihteluvälit huomioon aloitusannosta valittaessa. Potilaat, joilla on CYP2C9 *1/*3, *2/*2, *2/*3 ja *3/*3, saattavat tarvita pidemmän ajan (> 2–4 viikkoa) saavuttaakseen maksimaalisen INR-vaikutuksen tietyllä annostusohjelmalla kuin potilailla, joilla ei ole näitä CYP-variantteja.
Seuranta optimaalisen antikoagulaation saavuttamiseksi
COUMADINin terapeuttinen alue (indeksi) on kapea, ja sen toimintaan voivat vaikuttaa tekijät, kuten muut lääkkeet ja ravinnon K-vitamiini. Siksi antikoagulaatiota on seurattava huolellisesti COUMADIN-hoidon aikana. Määritä INR päivittäin aloitusannoksen annon jälkeen, kunnes INR-tulokset vakiintuvat terapeuttiselle alueelle. Stabiloitumisen jälkeen pidä annostus terapeuttisella alueella suorittamalla säännöllisiä INR-arvoja. INR-mittaustiheyden tulee perustua kliiniseen tilanteeseen, mutta yleisesti hyväksyttävät välit INR-määrityksissä ovat 1–4 viikkoa. Suorita ylimääräisiä INR-testejä, kun muita varfariinituotteita vaihdetaan COUMADINin kanssa, sekä aina kun muita lääkkeitä aloitetaan, lopetetaan tai niitä otetaan epäsäännöllisesti. Hepariini, yleinen samanaikainen lääke, lisää INR:ää [katso Muuntaminen muista antikoagulanteista ja HUUMEIDEN VUOROVAIKUTUKSET ].
Kokoveren hyytymis- ja vuotoaikojen määritykset eivät ole tehokkaita toimenpiteitä COUMADIN 5 mg -hoidon seurannassa.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta. Tarkkaile INR-arvoa useammin potilailla, joilla on heikentynyt munuaisten toiminta, jotta INR pysyy terapeuttisella alueella [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Unohtunut annos
COUMADINin antikoagulanttivaikutus säilyy yli 24 tuntia. Jos potilas unohtaa ottaa COUMADIN-annoksen aiottuun aikaan vuorokaudesta, potilaan tulee ottaa annos mahdollisimman pian samana päivänä. Potilas ei saa kaksinkertaistaa annosta seuraavana päivänä korvatakseen unohtuneen annoksen.
Suonensisäinen antoreitti
Suonensisäinen COUMADIN 1 mg -annos on sama kuin suun kautta otettava annos. Käyttövalmiiksi saattamisen jälkeen anna COUMADIN injektiota varten hitaana bolusinjektiona perifeeriseen laskimoon 1-2 minuutin aikana.
COUMADIN 2 mg injektiota varten ei suositella annettavaksi lihakseen.
Liuotetaan injektiopullo 2,7 ml:lla steriiliä injektionesteisiin käytettävää vettä. Saatu saanto on 2,5 ml 2 mg/ml liuosta (5 mg yhteensä). Parenteraaliset lääkevalmisteet tulee tarkastaa silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa aina, kun liuos ja säiliö sen sallivat. Älä käytä, jos havaitset hiukkasia tai värimuutoksia.
Käyttövalmiiksi saattamisen jälkeen COUMADIN injektiota varten on stabiili 4 tuntia huoneenlämmössä. Se ei sisällä antimikrobista säilöntäainetta, ja siksi valmistetun liuoksen steriiliyden varmistamisesta on huolehdittava. Injektiopullo on vain kertakäyttöinen, hävitä käyttämättä jäänyt liuos.
Hoito hammaslääketieteen ja leikkauksen aikana
Jotkut hammaslääketieteelliset tai kirurgiset toimenpiteet voivat edellyttää COUMADIN-hoidon keskeyttämistä tai annoksen muuttamista. Harkitse hyödyt ja riskit, kun lopetat COUMADIN 2mg:n käytön jopa lyhyeksi ajaksi. Määritä INR välittömästi ennen hammaslääketieteellistä tai kirurgista toimenpidettä. Potilailla, joille tehdään minimaalisesti invasiivisia toimenpiteitä ja jotka on antikoaguloitu ennen näitä toimenpiteitä, niiden aikana tai välittömästi niiden jälkeen, COUMADIN-annoksen säätäminen INR-arvon pitämiseksi terapeuttisen alueen alimmassa päässä voi turvallisesti mahdollistaa antikoagulaation jatkamisen.
Muuntaminen muista antikoagulanteista
Hepariini
Koska COUMADIN 2 mg:n täyttä antikoagulanttivaikutusta ei saavuteta useisiin päiviin, hepariinia suositellaan ensisijaisesti nopeaan antikoagulaatioon. Alkuvaiheessa COUMADIN-hoidon aikana hepariinin antikoagulaation häiriöllä on minimaalinen kliininen merkitys. COUMADIN-hoitoon siirtyminen voi alkaa samanaikaisesti hepariinihoidon kanssa tai sitä voi viivästyä 3–6 päivää. Terapeuttisen antikoagulaation varmistamiseksi jatka täyden annoksen hepariinihoitoa ja päällekkäistä COUMADIN-hoitoa hepariinin kanssa 4–5 päivän ajan, kunnes COUMADIN 2 mg on tuottanut halutun terapeuttisen vasteen INR:n mukaan, jolloin hepariinihoito voidaan lopettaa.
Koska hepariini voi vaikuttaa INR-arvoon, potilaiden, jotka saavat sekä hepariinia että COUMADIN 1 mg, tulee seurata vähintään:
- 5 tuntia viimeisen hepariinin suonensisäisen bolusannoksen jälkeen tai
- 4 tuntia jatkuvan suonensisäisen hepariiniinfuusion lopettamisen jälkeen tai
- 24 tuntia viimeisen ihonalaisen hepariiniinjektion jälkeen.
COUMADIN 1 mg voi pidentää aktivoidun osittaisen tromboplastiiniajan (aPTT) testiä, vaikka hepariinia ei olisikaan. Vakava kohoaminen (>50 sekuntia) aPTT:ssä INR:n ollessa halutulla alueella on havaittu osoituksena lisääntyneestä postoperatiivisen verenvuodon riskistä.
Muut antikoagulantit
Katso muiden antikoagulanttien merkinnöistä ohjeita COUMADIN-valmisteeksi muuttamisesta.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit
COUMADIN yksipisteiset tabletit
Injektiota varten
Injektioon: 5 mg, lyofilisoitu jauhe kerta-annoksen injektiopullossa.
Varastointi ja käsittely
Tabletit
COUMADIN-tabletit ovat yksijakoisia, ja niiden toiselle puolelle on painettu numeerisesti 1, 2, 2-1/2, 3, 4, 5, 6, 7-1/2 tai 10 päällekkäin ja merkintä "COUMADIN" ja vastakkaiselle puolelle. tavallinen. COUMADIN on saatavana pulloissa ja sairaalan kerta-annospainopakkauksissa, joiden tehot ja värit ovat seuraavat:
Suojaa valolta ja kosteudelta. Säilytä kontrolloidussa huoneenlämmössä (59°-86°F, 15°-30°C). Annostele tiiviissä, valonkestävässä astiassa USP:n mukaisesti.
Säilytä sairaalan kerta-annos-läpipainopakkaukset pakkauksessa, kunnes sisältö on käytetty.
Injektio
COUMADIN injektiopullot antavat 5 mg varfariinia, kun se on liuotettu 2,7 ml:aan steriiliä injektionesteisiin käytettävää vettä (maksimi saanto on 2,5 ml 2 mg/ml liuosta). Injektiopullon nettosisältö on 5,4 mg lyofilisoitua jauhetta.
5 mg injektiopullo (6 kpl laatikko) - NDC 0590-0324-35
Suojaa valolta. Säilytä injektiopullo laatikossa käyttöön asti. Säilytä kontrolloidussa huoneenlämmössä (59°-86°F, 15°-30°C).
Säilytä käyttövalmiiksi saattamisen jälkeen valvotussa huoneenlämmössä (59°-86°F, 15°-30°C) ja käytä 4 tunnin kuluessa.
Älä jäähdytä. Hävitä käyttämättä jäänyt liuos.
Erikoiskäsittely
Mahdollisesti vaarallisten lääkkeiden asianmukaista käsittelyä ja hävittämistä koskevia menettelyjä tulee harkita.
Tätä aihetta koskevat ohjeet on julkaistu [ katso VIITTEET ].
Raskaana olevan apteekin ja kliinisen henkilökunnan tulee välttää altistumista murskatuille tai rikkoutuneille tableteille [katso Käyttö tietyissä populaatioissa ].
VIITTEET
OSHA:n vaaralliset lääkkeet. OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Jakelija: Bristol-Myers Squibb Company, Princeton, New Jersey 08543 USA. Tarkistettu: kesäkuuta 2017
SIVUVAIKUTUKSET
Seuraavia COUMADIN 2mg:n vakavia haittavaikutuksia käsitellään yksityiskohtaisemmin muissa merkintöjen osissa:
- Verenvuoto [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ja YLIANNOSTUS ]
- Kudosnekroosi [katso VAROITUKSET JA VAROTOIMET ]
- Kalsifylaksia [katso VAROITUKSET JA VAROTOIMET ]
- Akuutti munuaisvaurio [katso VAROITUKSET JA VAROTOIMET ]
- Systeemiset ateroembolit ja kolesterolimikroembolit [katso VAROITUKSET JA VAROTOIMET ]
- Raajojen iskemia, nekroosi ja kuolio potilailla, joilla on HIT ja HITTS [katso VAROITUKSET JA VAROTOIMET ]
- Muut kliiniset asetukset, joissa riskit ovat lisääntyneet [katso VAROITUKSET JA VAROTOIMET ]
Muita COUMADIN 1mg:n haittavaikutuksia ovat:
- Immuunijärjestelmä: yliherkkyys/allergiset reaktiot (mukaan lukien urtikaria ja anafylaktiset reaktiot)
- Verisuonihäiriöt: vaskuliitti
- Maksa ja sappi: hepatiitti, kohonneet maksaentsyymiarvot. Kolestaattinen hepatiitti on yhdistetty COUMADINin ja tiklopidiinin samanaikaiseen käyttöön.
- Ruoansulatuskanavan häiriöt: pahoinvointi, oksentelu, ripuli, makuaistin vääristyminen, vatsakipu, ilmavaivat, turvotus
- Ihosairaudet: ihottuma, ihotulehdus (mukaan lukien rakkuloita), kutina, hiustenlähtö
- Hengityselinten häiriöt: henkitorven tai trakeobronkiaalinen kalkkeutuminen
- Yleiset häiriöt: vilunväristykset
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeet voivat olla vuorovaikutuksessa COUMADIN 5 mg:n kanssa farmakodynaamisten tai farmakokineettisten mekanismien kautta. Farmakodynaamisia mekanismeja lääkkeiden yhteisvaikutuksissa COUMADIN 2 mg:n kanssa ovat synergismi (heikentynyt hemostaasi, vähentynyt hyytymistekijän synteesi), kilpaileva antagonismi (K-vitamiini) ja K-vitamiinin aineenvaihdunnan fysiologisen säätösilmukan muuttuminen (perinnöllinen resistenssi). Farmakokineettiset mekanismit lääkeaineiden yhteisvaikutuksille COUMADINin kanssa ovat pääasiassa entsyymien induktio, entsyymin esto ja vähentynyt plasman proteiineihin sitoutuminen. On tärkeää huomata, että jotkut lääkkeet voivat olla vuorovaikutuksessa useammalla kuin yhdellä mekanismilla. INR-arvoa tulee seurata useammin, kun aloitetaan tai lopetetaan muita lääkkeitä, mukaan lukien kasviperäiset lääkkeet, tai kun muutetaan muiden lääkkeiden, mukaan lukien lyhytaikaiseen käyttöön tarkoitettujen lääkkeiden (esim. antibiootit, sienilääkkeet, kortikosteroidit) annosta [ks. LAATIKKO VAROITUS ].
Tutustu kaikkien samanaikaisesti käytettyjen lääkkeiden merkintöihin saadaksesi lisätietoja yhteisvaikutuksista COUMADINin kanssa tai verenvuotoon liittyvistä haittavaikutuksista.
CYP450 Yhteisvaikutukset
Varfariinin metaboliaan osallistuvia CYP450-isotsyymejä ovat CYP2C9, 2C19, 2C8, 2C18, 1A2 ja 3A4. Voimakkaampi varfariini S-enantiomeeri metaboloituu CYP2C9:n kautta, kun taas R-enantiomeeri metaboloituu CYP1A2:n ja 3A4:n välityksellä.
- CYP2C9-, 1A2- ja/tai 3A4-inhibiittorit voivat lisätä varfariinin vaikutusta (lisää INR-arvoa) lisäämällä varfariinialtistusta.
- CYP2C9-, 1A2- ja/tai 3A4-indusoijat voivat heikentää varfariinin vaikutusta (vähentää INR-arvoa) vähentämällä varfariinialtistusta.
Esimerkkejä CYP2C9:n, 1A2:n ja 3A4:n estäjistä ja indusoijista on alla taulukossa 2; tätä luetteloa ei kuitenkaan pidä pitää kaiken kattavana. Katso kaikkien samanaikaisesti käytettyjen lääkkeiden merkinnät saadaksesi lisätietoja CYP450-interaktiomahdollisuuksista. CYP450:n esto- ja induktiopotentiaali tulee ottaa huomioon aloitettaessa, lopetettaessa tai muuttaessa annosta samanaikaisesti. Seuraa INR-arvoa tarkasti, jos samanaikainen lääke on CYP2C9-, 1A2- ja/tai 3A4-inhibiittori tai -induktori.
Lääkkeet, jotka lisäävät verenvuotoriskiä
Taulukossa 3 on esimerkkejä lääkkeistä, joiden tiedetään lisäävän verenvuotoriskiä. Koska verenvuotoriski kasvaa, kun näitä lääkkeitä käytetään samanaikaisesti varfariinin kanssa, seuraa tarkasti potilaita, jotka saavat tällaista lääkettä varfariinin kanssa.
Antibiootit ja sienilääkkeet
Varfariinia ja antibiootteja tai sienilääkkeitä käyttävillä potilailla on raportoitu muutoksia INR-arvossa, mutta kliiniset farmakokineettiset tutkimukset eivät ole osoittaneet näiden aineiden johdonmukaisia vaikutuksia plasman varfariinipitoisuuksiin.
Seuraa INR-arvoa tarkasti, kun aloitat tai lopetat antibioottien tai sienilääkityksen varfariinia käyttävillä potilailla.
Kasvitieteelliset (yrtti)tuotteet ja -elintarvikkeet
INR-seurantaa tulee suorittaa useammin, kun kasvitieteellisiä hoitoja aloitetaan tai lopetetaan.
On olemassa vain vähän riittäviä, hyvin kontrolloituja tutkimuksia, joissa on arvioitu mahdollisia metabolisia ja/tai farmakologisia yhteisvaikutuksia kasviperäisten aineiden ja COUMADIN 2 mg:n välillä. Kasvitieteellisten lääkevalmisteiden valmistuksen standardoinnin puutteen vuoksi vaikuttavien aineiden määrät voivat vaihdella. Tämä saattaa edelleen hämmentää kykyä arvioida mahdollisia yhteisvaikutuksia ja vaikutuksia antikoagulaatioon.
Jotkut kasvit voivat aiheuttaa verenvuototapahtumia, kun niitä käytetään yksinään (esim. valkosipuli ja Ginkgo biloba), ja niillä voi olla antikoagulantteja, verihiutaleita estäviä ja/tai fibrinolyyttisiä ominaisuuksia. Näiden vaikutusten odotetaan täydentävän COUMADINin antikoagulanttivaikutuksia. Toisaalta jotkin kasviperäiset aineet voivat heikentää COUMADINin vaikutuksia (esim. koentsyymi Q10, mäkikuisma, ginseng). Jotkut kasvit ja elintarvikkeet voivat olla vuorovaikutuksessa COUMADIN 2 mg:n kanssa CYP450-vuorovaikutusten kautta (esim. echinacea, greippimehu, neidonhiuspuu, kultavarsi, mäkikuisma).
Ruoan K-vitamiinin määrä voi vaikuttaa COUMADIN-hoitoon. Neuvo COUMADIN 1 mg:aa käyttäviä potilaita syömään normaalia, tasapainoista ruokavaliota säilyttäen tasaisen määrän K-vitamiinia. COUMADIN 5 mg:aa käyttävien potilaiden tulee välttää rajuja muutoksia ruokailutottumuksissaan, kuten syömästä suuria määriä vihreitä lehtivihanneksia.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Verenvuoto
COUMADIN voi aiheuttaa vakavaa tai kuolemaan johtavaa verenvuotoa. Verenvuoto on todennäköisempää ensimmäisen kuukauden aikana. Verenvuodon riskitekijöitä ovat korkea antikoagulaatiointensiteetti (INR > 4,0), ikä yli tai yhtä suuri kuin 65, anamneesissa erittäin vaihtelevat INR-arvot, aiemmin esiintynyt maha-suolikanavan verenvuoto, verenpainetauti, aivoverisuonitauti, anemia, pahanlaatuisuus, trauma, munuaisten vajaatoiminta, tietyt geneettiset tekijät [katso KLIININEN FARMAKOLOGIA ], tietyt samanaikaiset lääkkeet [katso HUUMEIDEN VUOROVAIKUTUKSET ] ja pitkäkestoinen varfariinihoito.
Seuraa säännöllisesti kaikkien hoidettujen potilaiden INR-arvoa. Ne, joilla on korkea verenvuotoriski, voivat hyötyä tiheämmästä INR:n seurannasta, huolellisesta annoksen säätämisestä haluttuun INR:ään ja lyhyimmästä kliiniseen tilaan sopivasta hoidon kestosta. INR-arvon ylläpitäminen terapeuttisella alueella ei kuitenkaan poista verenvuotoriskiä.
Lääkkeet, ruokavaliomuutokset ja muut tekijät vaikuttavat COUMADIN 1 mg -hoidolla saavutettuihin INR-tasoihin. Suorita useammin INR-seuranta, kun aloitat tai lopetat muita lääkkeitä, mukaan lukien kasviperäiset lääkkeet, tai kun muutat muiden lääkkeiden annosta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Neuvo potilaita ehkäisytoimenpiteistä verenvuodon riskin minimoimiseksi ja verenvuodon merkeistä ja oireista ilmoittamisesta [katso POTILASTIEDOT ].
Kudosnekroosi
Ihon ja muiden kudosten nekroosi ja/tai kuolio on harvinainen mutta vakava riski (
Huolellinen kliininen arviointi vaaditaan sen määrittämiseksi, johtuuko nekroosi perussairaudesta. Vaikka erilaisia hoitoja on yritetty, mitään nekroosin hoitoa ei ole pidetty yhtenäisesti tehokkaana. Lopeta COUMADIN 5 mg -hoito, jos ilmenee nekroosia. Harkitse vaihtoehtoisten lääkkeiden käyttöä, jos antikoagulaatiohoito on tarpeen.
Kalsifylaksia
Kuolemaan johtavaa ja vakavaa kalsifylaksiaa tai kalsiumureemista arteriolopatiaa on raportoitu potilailla, joilla on tai ei ole loppuvaiheen munuaissairaus. Kun näillä potilailla diagnosoidaan kalsifylaksia, keskeytä COUMADIN 5 mg:n käyttö ja hoida kalsifylaksia tarpeen mukaan. Harkitse vaihtoehtoista antikoagulaatiohoitoa.
Akuutti munuaisvaurio
Potilailla, joilla on muuttunut munuaiskerästen eheys tai joilla on aiemmin ollut munuaissairaus, COUMADIN 2 mg:n käyttö voi aiheuttaa akuuttia munuaisvauriota, mahdollisesti liiallisen antikoagulaation ja hematurian yhteydessä [ks. Käyttö tietyissä populaatioissa ]. Antikoagulaatiota on seurattava useammin potilailla, joiden munuaisten toiminta on heikentynyt.
Systeemiset ateroembolit ja kolesterolimikroembolit
Antikoagulaatiohoito COUMADINilla voi tehostaa atheromatous plakin embolien vapautumista. Systeemiset ateroembolit ja kolesterolimikroembolit voivat ilmaista erilaisia merkkejä ja oireita riippuen embolisaatiopaikasta. Yleisimmin mukana olevat viskeraaliset elimet ovat munuaiset, joita seuraa haima, perna ja maksa. Jotkut tapaukset ovat edenneet nekroosiin tai kuolemaan. Erityinen oireyhtymä, joka johtuu jalkojen mikroembolista, tunnetaan nimellä "violettien varpaiden oireyhtymä". Lopeta COUMADIN-hoito, jos tällaisia ilmiöitä havaitaan. Harkitse vaihtoehtoisten lääkkeiden käyttöä, jos antikoagulaatiohoito on tarpeen.
Raajojen iskemia, nekroosi ja kuolio potilailla, joilla on osuma ja osuma
Älä käytä COUMADINia alkuhoitona potilailla, joilla on hepariinin aiheuttama trombosytopenia (HIT) ja hepariinin aiheuttama trombosytopenia ja tromboosioireyhtymä (HITTS). HIT- ja HITTS-potilailla on esiintynyt raajan iskemiaa, nekroosia ja kuolioa, kun hepariinihoito lopetettiin ja varfariinihoito aloitettiin tai sitä jatkettiin. Joillakin potilailla on seurauksia ollut kyseessä olevan alueen amputaatio ja/tai kuolema. COUMADIN-hoitoa voidaan harkita, kun verihiutaleiden määrä on normalisoitunut.
Käyttö raskaana oleville naisille, joilla on mekaaniset sydänläppäimet
COUMADIN voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Vaikka COUMADIN on vasta-aiheinen raskauden aikana, COUMADIN 1 mg:n käytön mahdolliset hyödyt voivat olla suurempia kuin riskit raskaana oleville naisille, joilla on mekaaniset sydänläppäimet ja joilla on suuri tromboembolian riski. Näissä yksittäisissä tilanteissa päätös COUMADIN 2mg -hoidon aloittamisesta tai jatkamisesta on tarkistettava potilaan kanssa ottaen huomioon yksittäisen potilaan lääketieteelliseen tilanteeseen liittyvät erityiset riskit ja hyödyt sekä uusimmat lääketieteelliset ohjeet. COUMADIN-altistuminen raskauden aikana aiheuttaa tunnustettuja vakavia synnynnäisiä epämuodostumia (varfariinin embryopatia ja sikiötoksisuus), kuolemaan johtavia sikiön verenvuotoja ja lisääntynyttä spontaanin abortin ja sikiökuolleisuuden riskiä. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle [ks. Käyttö tietyissä populaatioissa ].
Muut kliiniset olosuhteet, joissa riskit ovat lisääntyneet
COUMADIN-hoidon riskit voivat kasvaa seuraavissa kliinisissä olosuhteissa:
- Keskivaikea tai vaikea maksan vajaatoiminta
- Tartuntataudit tai suolistoflooran häiriöt (esim. sprue, antibioottihoito)
- Kestokatetrin käyttö
- Vaikea tai kohtalainen verenpainetauti
- Proteiini C -välitteisen antikoagulanttivasteen puute: COUMADIN vähentää luonnossa esiintyvien antikoagulanttien, proteiini C:n ja proteiini S:n synteesiä. Proteiini C:n tai sen kofaktorin, proteiini S:n, perinnölliset tai hankitut puutteet on liitetty kudosnekroosiin varfariinin annon jälkeen. Samanaikainen antikoagulaatiohoito hepariinin kanssa 5–7 päivän ajan COUMADIN 2 mg -hoidon aloituksen aikana saattaa minimoida kudosnekroosin esiintyvyyden näillä potilailla.
- Silmäleikkaus: Kaihileikkauksessa COUMADINin käyttöön liittyi terävän neulan ja paikallispuudutuksen aiheuttamien pienten komplikaatioiden merkittävä lisääntyminen, mutta siihen ei liittynyt mahdollisesti näköä uhkaavia leikkauksia aiheuttavia verenvuotokomplikaatioita. Koska COUMADIN 5 mg:n hoidon lopettaminen tai vähentäminen voi johtaa vakaviin tromboembolisiin komplikaatioihin, päätöksen COUMADIN-hoidon keskeyttämisestä ennen suhteellisen vähemmän invasiivista ja monimutkaista silmäleikkausta, kuten linssileikkausta, tulee perustua antikoagulanttihoidon riskeihin verrattuna hyötyihin.
- Polycythemia vera
- Vaskuliitti
- Diabetes mellitus
Endogeeniset tekijät, jotka vaikuttavat INR:ään
Seuraavat tekijät voivat olla vastuussa lisääntyneestä INR-vasteesta: ripuli, maksahäiriöt, huono ravitsemustila, steatorrhea tai K-vitamiinin puutos.
Seuraavat tekijät voivat olla syynä heikentyneeseen INR-vasteeseen: lisääntynyt K-vitamiinin saanti tai perinnöllinen varfariiniresistenssi.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Ohjeet potilaille
Neuvo potilaita:
- Noudata tiukasti määrättyä annostusaikataulua [katso ANNOSTELU JA HALLINNOINTI ].
- Jos sinulle määrätty COUMADIN 1 mg -annos unohtuu, ota annos mahdollisimman pian samana päivänä, mutta älä ota kaksinkertaista COUMADIN 5 mg annosta seuraavana päivänä korvataksesi unohtuneet annokset [ks. ANNOSTELU JA HALLINNOINTI ].
- Hanki protrombiiniaikatestit ja käy säännöllisesti lääkärin tai klinikan luona hoidon seuraamiseksi [katso ANNOSTELU JA HALLINNOINTI ] .
- Huomaa, että jos COUMADIN-hoito keskeytetään, COUMADIN 5 mg:n antikoagulanttivaikutukset voivat kestää noin 2-5 päivää [ks. KLIININEN FARMAKOLOGIA ].
- Vältä kaikkea toimintaa tai urheilua, joka voi johtaa traumaattiseen vammaan [katso Käyttö tietyissä populaatioissa ]. Ja kertoa lääkärilleen, jos he kaatuvat usein, koska tämä voi lisätä komplikaatioiden riskiä.
- Syö normaalia, tasapainoista ruokavaliota ylläpitääksesi jatkuvaa K-vitamiinin saantia. Vältä rajuja muutoksia ruokailutottumuksissa, kuten syömästä suuria määriä lehtivihanneksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Ota yhteyttä lääkäriin ilmoittaaksesi kaikista vakavista sairauksista, kuten vaikeasta ripulista, infektiosta tai kuumeesta [katso VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
- Ota mukaan henkilöllisyystodistus, jossa ilmoitetaan, että he käyttävät COUMADINia.
Verenvuotoriskit
Neuvo potilaita
- Ilmoita välittömästi lääkärille, jos ilmenee epätavallista verenvuotoa tai oireita. Verenvuodon merkkejä ja oireita ovat: kipu, turvotus tai epämukava tunne, pitkittynyt verenvuoto leikkauksista, lisääntynyt kuukautiskierto tai emättimen verenvuoto, nenäverenvuoto, ikenien verenvuoto harjauksesta, epätavallinen verenvuoto tai mustelmat, punainen tai tummanruskea virtsa, punaiset tai tervamustat ulosteet, päänsärky, huimaus tai heikkous [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Samanaikaiset lääkkeet ja kasvit (yrtit)
Neuvo potilaita:
- Älä ota tai lopeta muita lääkkeitä, mukaan lukien salisylaatit (esim. aspiriini ja paikalliset kipulääkkeet), muut reseptivapaat lääkkeet ja kasviperäiset (yrtti)tuotteet, paitsi jos lääkärisi neuvoo [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Raskaus ja Imettäminen
Neuvo potilaita:
- Ota yhteyttä lääkäriin
- heti, jos he luulevat olevansa raskaana [katso Käyttö tietyissä populaatioissa ],
- keskustella raskauden suunnittelusta [katso Käyttö tietyissä populaatioissa ],
- jos he harkitsevat imetystä [ks Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Varfariinilla ei ole tehty karsinogeenisuus-, mutageenisuus- tai hedelmällisyystutkimuksia.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
COUMADIN 1mg on vasta-aiheinen raskaana oleville naisille, paitsi raskaana oleville naisille, joilla on mekaaniset sydänläppäimet, joilla on suuri tromboembolian riski ja joille COUMADIN 5 mg:n hyödyt voivat olla riskejä suuremmat [ks. VAROITUKSET JA VAROTOIMET ]. COUMADIN 1mg voi aiheuttaa sikiövaurioita. Altistuminen varfariinille raskauden ensimmäisen kolmanneksen aikana aiheutti synnynnäisiä epämuodostumia noin 5 %:lle altistuneista jälkeläisistä. Koska näitä tietoja ei kerätty riittävissä ja hyvin kontrolloiduissa tutkimuksissa, tämä vakavien synnynnäisten epämuodostumien ilmaantuvuus ei ole riittävä perusta vertailulle arvioituihin ilmaantuvuuksiin kontrolliryhmässä tai Yhdysvaltojen väestössä, eikä se välttämättä heijasta käytännössä havaittuja ilmaantuuksia. Harkitse COUMADINin hyödyt ja riskit sekä mahdolliset riskit sikiölle, kun määräät COUMADINia raskaana olevalle naiselle.
Raskauden haitallisia seurauksia esiintyy äidin terveydestä tai lääkkeiden käytöstä riippumatta. Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Sikiön/vastasyntyneen haittavaikutukset
Ihmisillä varfariini läpäisee istukan, ja pitoisuudet sikiön plasmassa lähestyvät äidin arvoja. Altistuminen varfariinille raskauden ensimmäisen kolmanneksen aikana aiheutti synnynnäisiä epämuodostumia noin 5 %:lle altistuneista jälkeläisistä. Varfariini embryopatialle on tyypillistä nenän hypoplasia, johon liittyy tai ei ole näppyjä epifyysejä (chondrodysplasia punctata) ja kasvun hidastuminen (mukaan lukien alhainen syntymäpaino). Keskushermoston ja silmien poikkeavuuksia on myös raportoitu, mukaan lukien selän keskilinjan dysplasia, jolle on tunnusomaista corpus callosumin ageneesi, Dandy-Walkerin epämuodostumat, keskiviivan pikkuaivojen surkastuminen ja vatsan keskilinjan dysplasia, jolle on ominaista optinen atrofia. Henkistä jälkeenjääneisyyttä, sokeutta, skitsencefaliaa, mikrokefaliaa, vesipää ja muita haitallisia raskauden tuloksia on raportoitu varfariinialtistuksen jälkeen raskauden toisen ja kolmannen kolmanneksen aikana [ks. VASTA-AIHEET ].
Imetys
Riskien yhteenveto
Varfariinia ei ollut äidinmaidossa varfariinilla hoidetuilta äideiltä rajoitetussa julkaistussa tutkimuksessa. Vakavien haittavaikutusten, mukaan lukien verenvuoto rintaruokinnassa, vuoksi harkitse imetyksen kehitys- ja terveyshyötyjä sekä äidin kliinistä COUMADIN-tarvetta ja COUMADIN 2 mg:n mahdollisia haitallisia vaikutuksia imetettävään lapseen tai äidin taustalla olevasta tilasta. ennen COUMADIN 5 mg:n määräämistä imettävälle naiselle.
Kliiniset näkökohdat
Tarkkaile imettäviä lapsia mustelmien tai verenvuodon varalta.
Data
Ihmistiedot
15 imettävän äidin julkaistujen tietojen perusteella varfariinia ei havaittu äidinmaidossa. 15 täysiaikaisesta vastasyntyneestä kuudella imetettävällä lapsella oli dokumentoidut protrombiiniajat odotetulla alueella. Muilta 9 imeväiseltä ei saatu protrombiiniaikoja. Vaikutuksia keskosilla ei ole arvioitu.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Raskaustestaus
COUMADIN voi aiheuttaa sikiövaurioita [katso Käyttö tietyissä populaatioissa ].
Tarkista lisääntymiskykyisten naisten raskaustila ennen COUMADIN-hoidon aloittamista.
Ehkäisy
Naaraat
Kehota lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä hoidon aikana ja vähintään kuukauden ajan viimeisen COUMADIN-annoksen jälkeen.
Käyttö lapsille
Riittäviä ja hyvin kontrolloituja tutkimuksia COUMADINilla ei ole tehty millään lapsipotilailla, ja optimaalista annostusta, turvallisuutta ja tehoa lapsipotilailla ei tunneta. COUMADINin käyttö lapsille perustuu aikuisten tietoihin ja suosituksiin sekä saatavilla olevaan rajoitettuun havainnointitutkimuksista ja potilasrekistereistä saatuihin pediatrisiin tietoihin. Lapsipotilaiden, joille annetaan COUMADIN 1 mg, tulee välttää kaikkea toimintaa tai urheilua, joka voi johtaa traumaattiseen vammaan.
Imeväisten ja lasten kehittyvä hemostaattinen järjestelmä johtaa tromboosin fysiologian ja antikoagulanttivasteen muuttumiseen. Varfariinin annostus lapsiväestössä vaihtelee potilaan iän mukaan, ja pikkulapsilla annostarve on yleensä korkein ja nuorilla pienin milligrammaa kilogrammaa kohti, jotta INR-tavoitteet säilyvät. Koska varfariinivaatimukset muuttuvat iän, samanaikaisten lääkkeiden, ruokavalion ja olemassa olevan sairauden vuoksi, INR-tavoitealueita voi olla vaikea saavuttaa ja ylläpitää lapsipotilailla, ja INR-määrityksiä suositellaan tiheämmin.
Verenvuotoluvut vaihtelivat potilasväestön ja kliinisen hoitokeskuksen mukaan lasten havainnointitutkimuksissa ja potilasrekistereissä.
Imeväiset ja lapset, jotka saavat K-vitamiinilla täydennettyä ravintoa, mukaan lukien äidinmaidonkorvikkeet, voivat olla resistenttejä varfariinihoidolle, kun taas äidinmaidolla ruokitut imeväiset voivat olla herkkiä varfariinihoidolle.
Geriatrinen käyttö
Varfariininatriumia saaneiden potilaiden kokonaismäärästä kontrolloiduissa kliinisissä tutkimuksissa, joista oli saatavilla tietoja analysoitavaksi, 1885 potilasta (24,4 %) oli vähintään 65-vuotiaita, kun taas 185 potilasta (2,4 %) oli 75-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja tehokkuudessa tai turvallisuudessa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
60-vuotiailla tai vanhemmilla potilailla näyttää olevan odotettua suurempi INR-vaste varfariinin antikoagulanttivaikutuksiin [ks. KLIININEN FARMAKOLOGIA ]. COUMADIN on vasta-aiheinen kaikille valvomattomille potilaille, joilla on seniili. Noudata varovaisuutta annettaessa COUMADINia iäkkäille potilaille missä tahansa tilanteessa tai missä tahansa fyysisessä tilassa, jossa on lisätty verenvuodon riski. Harkitse COUMADINin pienempiä aloitus- ja ylläpitoannoksia iäkkäillä potilailla [katso ANNOSTELU JA HALLINNOINTI ].
Munuaisten vajaatoiminta
Munuaispuhdistumaa pidetään vähäisenä varfariinin antikoagulanttivasteen määrääjänä. Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta. Neuvo potilaita, joilla on munuaisten vajaatoiminta ja jotka käyttävät varfariinia, seuraamaan INR-arvoaan useammin [katso VAROITUKSET JA VAROTOIMET ].
Maksan vajaatoiminta
Maksan vajaatoiminta voi voimistaa vastetta varfariinille heikentyneen hyytymistekijöiden synteesin ja heikentyneen varfariinin metabolian kautta. Ole varovainen käyttäessäsi COUMADINia näillä potilailla.
YLIANNOSTUS
Merkit ja oireet
Verenvuoto (esim. veren ilmaantuminen ulosteessa tai virtsassa, hematuria, runsas kuukautisvuoto, melena, petekiat, liialliset mustelmat tai jatkuva tihkuminen pinnallisista vammoista, selittämätön hemoglobiinin lasku) on osoitus liiallisesta antikoagulaatiosta.
Hoito
Liiallisen antikoagulaation hoito perustuu INR-tasoon, verenvuodon esiintymiseen tai puuttumiseen ja kliinisiin olosuhteisiin. COUMADIN 2 mg:n antikoagulaatio voidaan kumota keskeyttämällä COUMADIN 1 mg -hoito ja tarvittaessa antamalla suun kautta tai parenteraalisesti K1-vitamiinia.
K1-vitamiinin käyttö heikentää vastetta myöhempään COUMADIN-hoitoon, ja potilaat voivat palata hoitoa edeltävään tromboottiseen tilaan pitkittyneen INR-arvon nopean kääntymisen jälkeen. COUMADIN 2 mg:n annon jatkaminen kumoaa K-vitamiinin vaikutuksen, ja terapeuttinen INR voidaan jälleen saavuttaa huolellisella annosta säätämällä. Jos nopea uudelleen antikoagulaatio on aiheellista, hepariini saattaa olla parempi aloitushoitona.
Protrombiinikompleksikonsentraatti (PCC), tuore pakastettu plasma tai aktivoitu tekijä VII -hoito voidaan harkita, jos COUMADIN 2 mg:n vaikutusten kumoaminen on kiireellistä. Verivalmisteiden käyttöön liittyy hepatiitin ja muiden virussairauksien riski; PCC ja aktivoitu tekijä VII liittyvät myös kohonneeseen tromboosiriskiin. Siksi näitä valmisteita tulee käyttää vain poikkeuksellisissa tai henkeä uhkaavissa vuotojaksoissa, jotka ovat seurausta COUMADIN 2 mg:n yliannostuksesta.
VASTA-AIHEET
COUMADIN 1mg on vasta-aiheinen:
- Raskaus
COUMADIN 2mg on vasta-aiheinen raskaana oleville naisille, paitsi raskaana oleville naisille, joilla on mekaaniset sydänläppäimet ja joilla on suuri tromboembolian riski [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ]. COUMADIN 2mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. COUMADIN-altistuminen raskauden aikana aiheuttaa tunnustettuja vakavia synnynnäisiä epämuodostumia (varfariinin embryopatia ja sikiötoksisuus), kuolemaan johtavia sikiön verenvuotoja ja lisääntynyttä spontaanin abortin ja sikiökuolleisuuden riskiä. Jos COUMADINia käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle [ks. Käyttö tietyissä populaatioissa ].
COUMADIN on vasta-aiheinen potilailla, joilla on:
- Hemorragiset taipumukset tai veren dyskrasiat
- Äskettäin tehty tai suunniteltu keskushermoston tai silmän leikkaus tai traumaattinen leikkaus, joka johtaa suuriin avoimiin pintoihin [ks. VAROITUKSET JA VAROTOIMET ]
- Verenvuototaipumus, joka liittyy:
- Ruoansulatuskanavan, virtsaelinten tai hengitysteiden aktiivinen haavauma tai selvä verenvuoto
- Keskushermoston verenvuoto
- Aivojen aneurysmat, leikkaava aortta
- Perikardiitti ja perikardiaaliset effuusiot
- Bakteerien endokardiitti
- Uhkaa abortti, eklampsia ja preeklampsia
- Valvomattomat potilaat, joilla on sairauksia, joihin liittyy mahdollisesti suuri määräysten noudattamatta jättäminen
- Spinaalipunktio ja muut diagnostiset tai terapeuttiset toimenpiteet, jotka voivat aiheuttaa hallitsematonta verenvuotoa
- Yliherkkyys varfariinille tai muille tämän tuotteen aineosille (esim. anafylaksia) [ks HAITTAVAIKUTUKSET ]
- Tärkeä alueellinen tai lannerangan anestesia
- Pahanlaatuinen verenpainetauti
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Varfariini toimii estämällä K-vitamiinista riippuvien hyytymistekijöiden synteesiä, joihin kuuluvat tekijät II, VII, IX ja X sekä antikoagulanttiproteiinit C ja S. K-vitamiini on välttämätön kofaktori K-vitamiinin postribosomaalisessa synteesissä. riippuvaisia hyytymistekijöitä. K-vitamiini edistää γ-karboksiglutamiinihappotähteiden biosynteesiä proteiineissa, jotka ovat välttämättömiä biologiselle aktiivisuudelle. Varfariinin uskotaan häiritsevän hyytymistekijän synteesiä estämällä K-vitamiinin epoksidireduktaasin (VKORC1) entsyymikompleksin C1-alayksikköä, mikä vähentää K1-vitamiiniepoksidin regeneraatiota [ks. Farmakogenomiikka ].
Farmakodynamiikka
Antikoagulaatiovaikutus ilmenee yleensä 24 tunnin kuluessa varfariinin annosta. Antikoagulantin huippuvaikutus voi kuitenkin viivästyä 72–96 tuntia. Raseemisen varfariinin kerta-annoksen vaikutusaika on 2–5 päivää. COUMADIN 1mg:n vaikutukset voivat tulla selvemmiksi, kun päivittäisten ylläpitoannosten vaikutukset menevät päällekkäin. Tämä vastaa K-vitamiinista riippuvien hyytymistekijöiden ja antikoagulaatioproteiinien puoliintumisaikoja: tekijä II - 60 tuntia, VII - 4 - 6 tuntia, IX - 24 tuntia, X - 48 - 72 tuntia ja proteiinit C ja S ovat noin 8 tuntia ja 30 tuntia, vastaavasti.
Farmakokinetiikka
COUMADIN on varfariinin R- ja S-enantiomeerien raseeminen seos. S-enantiomeeri osoittaa 2-5 kertaa enemmän antikoagulanttiaktiivisuutta kuin R-enantiomeeri ihmisissä, mutta sillä on yleensä nopeampi puhdistuma.
Imeytyminen
Varfariini imeytyy lähes täydellisesti suun kautta annetun annon jälkeen, ja huippupitoisuus saavutetaan yleensä ensimmäisten 4 tunnin aikana.
Jakelu
Varfariini jakautuu suhteellisen pieneen näennäiseen jakautumistilavuuteen, noin 0,14 l/kg. Jakautumisvaihe, joka kestää 6-12 tuntia, on havaittavissa vesiliuoksen nopean suonensisäisen tai oraalisen annon jälkeen. Noin 99 % lääkkeestä sitoutuu plasman proteiineihin.
Aineenvaihdunta
Varfariini eliminoituu lähes kokonaan aineenvaihdunnan kautta. Varfariini metaboloituu stereoselektiivisesti maksan sytokromi P-450 (CYP450) mikrosomaalisten entsyymien vaikutuksesta inaktiivisiksi hydroksyloiduiksi metaboliiteiksi (pääasiallinen reitti) ja reduktaasien kautta pelkistyneiksi metaboliiteiksi (varfariinialkoholeiksi), joilla on minimaalista antikoagulanttivaikutusta. Varfariinin tunnistettuja metaboliitteja ovat dehydrovarfariini, kaksi diastereoisomeerialkoholia ja 4'-, 6-, 7-, 8- ja 10-hydroksivarfariini. Varfariinin metaboliaan osallistuvia CYP450-isotsyymejä ovat CYP2C9, 2C19, 2C8, 2C18, 1A2 ja 3A4. CYP2C9, polymorfinen entsyymi, on todennäköisesti ihmisen maksan CYP450:n pääasiallinen muoto, joka moduloi varfariinin in vivo antikoagulanttivaikutusta. Potilailla, joilla on yksi tai useampi CYP2C9-alleelimuunnos, on vähentynyt S-varfariinin puhdistuma [katso Farmakogenomiikka ].
Erittyminen
Varfariinin terminaalinen puoliintumisaika kerta-annoksen jälkeen on noin 1 viikko; tehokas puoliintumisaika on kuitenkin 20 - 60 tuntia, keskiarvo noin 40 tuntia. R-varfariinin puhdistuma on yleensä puolet S-varfariinin puhdistumasta, joten koska jakautumistilavuudet ovat samanlaiset, rwarfariinin puoliintumisaika on pidempi kuin S-varfariinin. R-varfariinin puoliintumisaika vaihtelee 37-89 tunnin välillä, kun taas S-varfariinin puoliintumisaika vaihtelee 21-43 tunnin välillä. Radioaktiivisella lääkkeellä tehdyt tutkimukset ovat osoittaneet, että jopa 92 % suun kautta annetusta annoksesta erittyy virtsaan. Hyvin vähän varfariinia erittyy muuttumattomana virtsaan. Virtsaan erittyminen tapahtuu metaboliittien muodossa.
Geriatriset potilaat
60-vuotiailla tai sitä vanhemmilla potilailla näyttää olevan odotettua suurempi INR-vaste varfariinin antikoagulanttivaikutuksiin. Syytä lisääntyneeseen herkkyyteen varfariinin antikoagulanttisille vaikutuksille tässä ikäryhmässä ei tunneta, mutta se voi johtua farmakokineettisten ja farmakodynaamisten tekijöiden yhdistelmästä. Rajoitettu tieto viittaa siihen, että S-varfariinin puhdistumassa ei ole eroa; R-varfariinin puhdistuma voi kuitenkin hieman laskea vanhuksilla verrattuna nuoriin. Siksi potilaan iän kasvaessa tarvitaan yleensä pienempi varfariiniannos terapeuttisen antikoagulaation aikaansaamiseksi [ks. ANNOSTELU JA HALLINNOINTI ].
Aasialaiset potilaat
Aasialaiset potilaat saattavat tarvita pienempiä varfariinin aloitus- ja ylläpitoannoksia. Ei-kontrolloidussa tutkimuksessa, johon osallistui 151 kiinalaista avohoitopotilasta, jotka saivat stabiloitua varfariinia eri indikaatioihin, raportoi, että varfariinin keskimääräinen päivittäinen tarve oli 3,3 ± 1,4 mg INR:n 2–2,5 saavuttamiseksi. Potilaan ikä oli tärkein varfariinintarpeen määräävä tekijä näillä potilailla, ja varfariinin tarve pieneni iän myötä.
Farmakogenomiikka
CYP2C9- ja VKORC1-polymorfismit
Varfariinin S-enantiomeeri metaboloituu pääasiassa 7-hydroksivarfariiniksi CYP2C9:n, polymorfisen entsyymin, vaikutuksesta. Muunnosalleelit, CYP2C9*2 ja CYP2C9*3, johtavat heikentyneeseen S-varfariinin CYP2C9:n entsymaattiseen 7-hydroksylaatioon in vitro. Näiden alleelien esiintymistiheys valkoihoisilla on noin 11 % CYP2C9*2:lla ja 7 % CYP2C9*3:lla.
Muita CYP2C9-alleeleja, jotka liittyvät vähentyneeseen entsymaattiseen aktiivisuuteen, esiintyy pienemmillä frekvenssillä, mukaan lukien *5-, *6- ja *11-alleelit afrikkalaisissa syntyperäpopulaatioissa ja *5-, *9- ja *11-alleelit valkoihoisissa.
Varfariini vähentää K-vitamiinin uusiutumista K-vitamiiniepoksidista K-vitamiinikierrossa estämällä VKOR:n, moniproteiinientsyymikompleksin, toimintaa. Tietyt yksittäisen nukleotidin polymorfismit VKORC1-geenissä (esim. .1639G>A) on liitetty vaihteleviin varfariiniannosvaatimuksiin.
VKORC1- ja CYP2C9-geenivariantit selittävät yleensä suurimman osan tunnetusta vaihtelusta varfariiniannosvaatimuksissa.
CYP2C9- ja VKORC1-genotyyppitiedot, mikäli saatavilla, voivat auttaa varfariinin aloitusannoksen valinnassa [ks. ANNOSTELU JA HALLINNOINTI ].
Kliiniset tutkimukset
Eteisvärinä
Viidessä prospektiivisessa, satunnaistetussa, kontrolloidussa kliinisessä tutkimuksessa, joihin osallistui 3 711 ei-reumaattista AF-potilasta, varfariini vähensi merkittävästi systeemisen tromboembolian, mukaan lukien aivohalvauksen, riskiä (ks. taulukko 4). Riskivähennys vaihteli 60 prosentista 86 prosenttiin kaikissa paitsi yhdessä tutkimuksessa (CAFA: 45 %), joka lopetettiin aikaisin kahden näistä kokeista julkaistujen positiivisten tulosten vuoksi. Vakavien verenvuotojen ilmaantuvuus näissä tutkimuksissa vaihteli 0,6 %:sta 2,7 %:iin (ks. taulukko 4).
Kokeet potilailla, joilla on sekä AF- että mitraalistenoosi, viittaavat COUMADINin antikoagulaation hyötyyn [ks. ANNOSTELU JA HALLINNOINTI ].
Mekaaniset ja bioproteettiset sydänläppäimet
Prospektiivisessa, satunnaistetussa, avoimessa, positiivisesti kontrolloidussa tutkimuksessa, johon osallistui 254 potilasta, joilla oli mekaaniset sydänläppäproteesit, tromboemboliattomien aikavälien havaittiin olevan merkitsevästi pitempi pelkällä varfariinilla hoidetuilla potilailla verrattuna dipyridamoli/aspiriinihoitoa saaviin potilaisiin (p.
Prospektiivisessa avoimessa kliinisessä tutkimuksessa, jossa verrattiin kohtalaista (INR 2,65) ja korkean intensiteetin (INR 9,0) varfariinihoitoa 258 potilaalla, joilla oli mekaaniset sydänläppäproteesit, tromboemboliaa esiintyi molemmissa ryhmissä yhtä usein (4,0 ja 3,7 tapahtumaa 100:aa kohti). potilasvuodet, vastaavasti). Suuri verenvuoto oli yleisempää korkean intensiteetin ryhmässä. Tämän tutkimuksen tulokset on esitetty taulukossa 6.
Satunnaistetussa 210 potilaalla tehdyssä tutkimuksessa, jossa verrattiin kahta varfariinihoidon intensiteettiä (INR 2,0-2,25 vs. INR 2,5-4,0) kolmen kuukauden ajan kudossydänläpän korvaamisen jälkeen, tromboemboliaa esiintyi kahdessa ryhmässä samalla tiheydellä (suuret emboliatapahtumat). 2,0 % vs. 1,9 % ja pienet emboliset tapahtumat 10,8 % vs. 10,2 %). Vakavia verenvuotoja esiintyi 4,6 %:lla potilaista korkeamman intensiteetin INR-ryhmässä verrattuna nollaan alhaisemman intensiteetin INR-ryhmään.
Sydäninfarkti
WARIS (The Warfarin Re-Infarction Study) oli kaksoissokkoutettu, satunnaistettu tutkimus, johon osallistui 1 214 potilasta 2–4 viikkoa infarktin jälkeen ja joita hoidettiin varfariinilla INR-tavoitteen ollessa 2,8–4,8. Ensisijainen päätetapahtuma oli kokonaiskuolleisuuden ja toistuvan infarktin yhdistelmä. Aivoverisuonitapahtumien toissijainen päätetapahtuma arvioitiin. Potilaiden keskimääräinen seuranta-aika oli 37 kuukautta. Tulokset kullekin päätepisteelle erikseen, mukaan lukien verisuonikuoleman analyysi, esitetään taulukossa 7.
WARIS II (The Warfarin, Aspirin, Re-Infarction Study) oli avoin, satunnaistettu tutkimus, johon osallistui 3 630 potilasta, jotka joutuivat sairaalaan akuutin sydäninfarktin vuoksi varfariinilla tavoitearvoon INR 2,8–4,2, aspiriinilla 160 mg päivässä tai varfariinilla tavoite INR 2,0–2,5 plus aspiriini 75 mg päivässä ennen sairaalasta kotiutumista. Ensisijainen päätetapahtuma oli kuoleman, ei-fataalin uudelleeninfarktin tai tromboembolisen aivohalvauksen yhdistelmä. Keskimääräinen tarkkailuaika oli noin 4 vuotta. WARIS II:n tulokset on esitetty taulukossa 8.
Kahdessa varfariinia saaneessa ryhmässä oli noin neljä kertaa enemmän vakavia verenvuotojaksoja kuin pelkkää aspiriinia saaneessa ryhmässä. Vakavat verenvuotojaksot eivät olleet yleisempiä aspiriinia ja varfariinia saaneilla potilailla kuin niillä, jotka saivat pelkkää varfariinia, mutta vähäisten verenvuotojaksojen ilmaantuvuus oli suurempi yhdistelmähoitoryhmässä.
POTILASTIEDOT
COUMADIN® (COU-ma-din) (varfariininatrium)
Mikä on tärkein tieto, joka minun pitäisi tietää COUMADIN 5mg:sta?
COUMADIN voi aiheuttaa verenvuotoa, joka voi olla vakavaa ja joskus johtaa kuolemaan. Tämä johtuu siitä, että COUMADIN on verta ohentava lääke, joka vähentää veritulppien muodostumisen mahdollisuutta kehossasi.
- Sinulla voi olla suurempi verenvuotoriski, jos käytät COUMADINia ja:
- ovat 65-vuotiaita tai vanhempia
- sinulla on ollut maha- tai suolistoverenvuotoa
- sinulla on korkea verenpaine (hypertensio)
- sinulla on ollut aivohalvaus tai "mini-aivohalvaus" (lyhytaikainen iskeeminen kohtaus tai TIA)
- on vakava sydänsairaus
- sinulla on alhainen veriarvo tai syöpä
- sinulla on ollut trauma, kuten onnettomuus tai leikkaus
- on munuaisongelmia
- ottaa muita lääkkeitä, jotka lisäävät verenvuotoriskiäsi, mukaan lukien:
- hepariinia sisältävä lääke
- muut lääkkeet veritulppien ehkäisyyn tai hoitoon
- ei-steroidiset tulehduskipulääkkeet (NSAID)
- ota varfariininatriumia pitkään. Varfariininatrium on COUMADINin vaikuttava aine.
Kerro terveydenhuollon tarjoajallesi, jos käytät jotakin näistä lääkkeistä. Kysy terveydenhuollon tarjoajaltasi, jos et ole varma, onko lääkkeesi jokin edellä mainituista.
Monet muut lääkkeet voivat olla vuorovaikutuksessa COUMADIN 1 mg:n kanssa ja vaikuttaa tarvitsemaasi annokseen tai lisätä COUMADIN 1 mg:n sivuvaikutuksia. Älä muuta tai lopeta lääkkeitäsi tai aloita uusia lääkkeitä ennen kuin keskustelet terveydenhuollon tarjoajasi kanssa.
Älä käytä muita varfariininatriumia sisältäviä lääkkeitä COUMADIN-hoidon aikana.
- Ota säännöllinen verikoe tarkistaaksesi vasteesi COUMADINiin. Tätä verikoetta kutsutaan INR-testiksi. INR-testi tarkistaa, kuinka nopeasti veri hyytyy. Terveydenhuollon tarjoaja päättää, mitkä INR-luvut ovat sinulle sopivimmat. COUMADIN 2 mg annostasi muutetaan niin, että INR pysyy tavoitealueellasi.
- Soita välittömästi terveydenhuollon tarjoajallesi, jos saat jonkin seuraavista verenvuoto-ongelmien merkeistä tai oireista:
- kipua, turvotusta tai epämukavuutta
- päänsärkyä, huimausta tai heikkoutta
- epätavalliset mustelmat (mustelmat, jotka kehittyvät ilman tunnettua syytä tai kasvavat kokoon)
- nenäverenvuoto
- vuotavat ikenet
- leikkauksista johtuva verenvuoto pysähtyy pitkään
- kuukautisvuoto tai emättimen verenvuoto, joka on normaalia raskaampaa
- vaaleanpunainen tai ruskea virtsa
- punaiset tai mustat ulosteet
- veren yskiminen
- oksentaa verta tai materiaalia, joka näyttää kahvinporoilta
- Jotkut ruoat ja juomat voivat olla vuorovaikutuksessa COUMADINin kanssa ja vaikuttaa hoitoon ja annokseen.
- Syö normaalia, tasapainoista ruokavaliota. Keskustele terveydenhuollon tarjoajan kanssa ennen kuin teet mitään ruokavaliomuutoksia. Älä syö suuria määriä lehtivihanneksia. Vihreät lehtivihannekset sisältävät K-vitamiinia. Tietyt kasviöljyt sisältävät myös suuria määriä K-vitamiinia. Liian suuri määrä K-vitamiinia voi heikentää COUMADINin vaikutusta.
- Kerro aina kaikille terveydenhuollon tarjoajille, että käytät COUMADINia.
- Käytä tai kanna tietoja, että käytät COUMADINia.
Katso "Mitkä ovat COUMADIN 1mg:n mahdolliset sivuvaikutukset?" lisätietoja sivuvaikutuksista.
Mikä on COUMADIN?
COUMADIN on reseptilääke, jota käytetään verihyytymien hoitoon ja verihyytymien muodostumisen mahdollisuuteen kehossasi. Veritulpat voivat aiheuttaa aivohalvauksen, sydänkohtauksen tai muita vakavia tiloja, jos niitä muodostuu jalkoihin tai keuhkoihin.
Kuka ei saa ottaa COUMADINia?
Älä ota COUMADIN 5 mg, jos:
- verenvuotoongelmien riski on suurempi kuin hoidosta saatava hyöty. Terveydenhuollon tarjoaja päättää, sopiiko COUMADIN sinulle.
- olet raskaana, ellei sinulla ole mekaanista sydänläppä. COUMADIN voi aiheuttaa sikiövaurioita, keskenmenon tai syntymättömän lapsesi kuoleman.
- olet allerginen varfariinille tai jollekin muulle COUMADINin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo COUMADINin ainesosista.
Ennen kuin otat COUMADINia
Kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on verenvuoto-ongelmia
- putoaa usein
- sinulla on maksaongelmia
- sinulla on munuaisongelmia tai olet dialyysihoidossa
- on korkea verenpaine
- sinulla on sydämen vajaatoiminta nimeltä sydämen vajaatoiminta
- on diabetes
- suunnittelet leikkausta tai hammashoitoa
- sinulla on muita sairauksia
- olet raskaana tai suunnittelet raskautta. Katso "Kuka ei saa ottaa COUMADIN 2mg?" Terveydenhuollon tarjoaja tekee raskaustestin ennen kuin aloitat COUMADIN-hoidon. Naisten, jotka voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä hoidon aikana ja vähintään kuukauden ajan viimeisen COUMADIN-annoksen jälkeen.
- imettävät. Sinun ja terveydenhuollon tarjoajasi tulee päättää, otatko COUMADINia ja imetät. Tarkista vauvasi mustelmien tai verenvuodon varalta, jos käytät COUMADINia ja imetät.
Kerro kaikille terveydenhuollon tarjoajille ja hammaslääkäreille, että käytät COUMADINia. Heidän tulee keskustella terveydenhuollon tarjoajan kanssa, joka on määrännyt sinulle COUMADIN 1 mg:n ennen kuin saat minkä tahansa leikkaus tai hammashoito. COUMADIN-hoito on ehkä keskeytettävä lyhyeksi ajaksi tai sinun on ehkä muutettava annostasi.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Jotkut muut lääkkeesi voivat vaikuttaa COUMADINin toimintaan. Tietyt lääkkeet voivat lisätä verenvuotoriskiäsi. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää COUMADINista?"
Miten minun pitäisi ottaa COUMADIN 1mg?
- Ota COUMADIN 1 mg täsmälleen ohjeen mukaan. Terveydenhuollon tarjoaja muuttaa annostasi ajoittain riippuen vastestasi COUMADINiin.
- Sinun tulee ottaa säännöllisesti verikoe ja käydä terveydenhuollon tarjoajan kanssa tilasi seuraamiseksi.
- Jos unohdat ottaa COUMADIN-annoksen, soita terveydenhuollon tarjoajallesi. Ota annos mahdollisimman pian samana päivänä. Älä ota seuraavana päivänä kaksinkertainen annos COUMADIN 5 mg korvataksesi unohtamasi annoksen.
- Soita heti terveydenhuollon tarjoajallesi, jos:
- ota liikaa COUMADINia
- sinulla on ripuli, tulehdus tai kuumetta
- pudota tai loukkaa itseäsi, varsinkin jos osut päähän. Terveydenhuollon tarjoajasi saattaa joutua tarkistamaan sinut.
Mitä minun pitäisi välttää COUMADIN 5 mg:n käytön aikana?
- Älä harrasta toimintaa tai urheilua, joka voi aiheuttaa vakavan vamman.
Mitkä ovat COUMADINin mahdolliset sivuvaikutukset?
COUMADIN voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää COUMADINista?"
- Ihokudoksen kuolema (ihon kuolio tai kuolio). Tämä voi tapahtua pian COUMADINin aloittamisen jälkeen. Se tapahtuu, koska verihyytymät muodostuvat ja estävät veren virtauksen kehosi alueelle. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on kipua, väriä tai lämpötilan muutosta jollakin kehon alueella. Saatat tarvita välittömästi lääkärinhoitoa estääksesi sairastuneen ruumiinosan kuoleman tai menetyksen (amputaatio).
- Munuaisongelmat. COUMADINia käyttävillä ihmisillä voi tapahtua munuaisvaurioita. Kerro heti terveydenhuollon tarjoajalle, jos virtsassasi on verta. Terveydenhuollon tarjoaja voi tehdä testejä useammin COUMADIN 2 mg -hoidon aikana verenvuodon tarkistamiseksi, jos sinulla on jo munuaisongelmia.
- "Violet varpaat -oireyhtymä." Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on kipua varpaissasi ja ne näyttävät violetilta tai tummalta.
Nämä eivät ole kaikki COUMADINin sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista. Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle osoitteessa 1..800-FDA-1088.
Kuinka minun pitäisi säilyttää COUMADIN 5mg?
- Säilytä COUMADINia 59 °F - 86 °F (15 °C - 30 °C) lämpötilassa.
- Säilytä COUMADIN 2 mg tiiviisti suljetussa astiassa
- Pidä COUMADIN poissa valolta ja kosteudelta.
- Noudata terveydenhuollon tarjoajan tai apteekkihenkilökunnan ohjeita oikean tavan heittää pois vanhentunut tai käyttämätön COUMADIN.
- Raskaana olevat naiset eivät saa käsitellä murskattuja tai rikkoutuneita COUMADIN-tabletteja.
Pidä COUMADIN 1mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa COUMADINin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä COUMADIN 5 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna COUMADIN 2 mg muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista tietoja COUMADINista, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia COUMADIN 1mg tabletit sisältävät?
Aktiivinen ainesosa: varfariininatrium
Inaktiiviset ainesosat: laktoosi, tärkkelys ja magnesiumstearaatti, lisäksi:
1 mg: D&C Red No. 6 Barium Lake
2 mg: FD&C Blue No. 2 Aluminium Lake ja FD&C Red No. 40 Aluminium Lake
2,5 mg: D&C Yellow No. 10 Aluminium Lake ja FD&C Blue No. 1 Aluminium Lake
3 mg: FD&C Yellow No. 6 Aluminium Lake, FD&C Blue No. 2 Aluminium Lake ja FD&C Red No. 40 Aluminium Lake
4 mg: FD&C Blue No. 1 Aluminium Lake
5 mg: FD&C Yellow No. 6 Aluminium Lake
mg: FD&C Yellow No. 6 Aluminium Lake ja FD&C Blue No. 1 Aluminium Lake
7,5 mg: D&C Yellow No. 10 Aluminium Lake ja FD&C Yellow No. 6 Aluminium Lake
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
