Precose 25mg, 50mg Acarbose Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Precose 50mg on ja miten sitä käytetään?
Precose (akarboositabletit) on suun kautta otettava alfa-glukosidaasi-inhibiittori, jota käytetään tyypin 2 diabeteksen hoitoon. Precose 50 mg:aa käytetään joskus yhdessä insuliinin tai muiden suun kautta otettavien diabeteslääkkeiden kanssa. Precose 25mg on saatavana geneerisessä muodossa.
Mitkä ovat Precose 25mg:n sivuvaikutukset?
Precosen yleisiä sivuvaikutuksia ovat:
- ripuli,
- kaasu,
- turvotus,
- vatsavaivat tai
- vatsakipu hoidon ensimmäisten viikkojen aikana, kun kehosi tottuu tähän lääkkeeseen, mutta yleensä paranee ajan myötä.
Muita Precose 50mg:n sivuvaikutuksia ovat ihottuma tai kutina. Kerro lääkärillesi, jos sinulla on harvinaisia mutta erittäin vakavia Precose 25 mg:n sivuvaikutuksia, mukaan lukien:
- epätavallinen väsymys,
- jatkuva pahoinvointi tai oksentelu,
- vaikea vatsakipu tai vatsakipu,
- peräsuolen verenvuoto,
- keltaiset silmät tai iho tai
- tumma virtsa.
KUVAUS
PRECOSE® (akarboositabletit) on suun kautta otettava alfa-glukosidaasin estäjä käytettäväksi tyypin 2 diabeteksen hoidossa. Akarboosi on oligosakkaridi, jota saadaan mikro-organismin, Actinoplanes utahensis, käymisprosesseista ja joka tunnetaan kemiallisesti nimellä O-4,6-dideoksi4-[[(1S,4R,5S,6S)-4,5,6-trihydroksi- 3-(hydroksimetyyli)-2-sykloheksen-1-yyli]amino]-a-D-glukopyranosyyli-(1->4)-O-a-D-glukopyranosyyli-(1->4)-D-glukoosi. Se on valkoista luonnonvalkoista jauhetta, jonka molekyylipaino on 645,6. Akarboosi liukenee veteen ja sen pKa on 5,1. Sen empiirinen kaava on C25H43NO18 ja sen kemiallinen rakenne on seuraava:
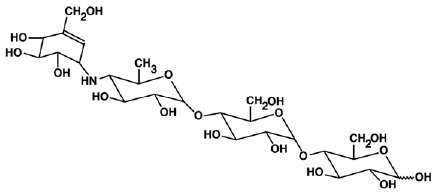
PRECOSE 50mg on saatavana 25 mg:n, 50 mg:n ja 100 mg:n tabletteina suun kautta käytettäväksi. Inaktiiviset aineet ovat tärkkelys, mikrokiteinen selluloosa, magnesiumstearaatti ja kolloidinen piidioksidi.
INDIKAATIOT
PRECOSE on tarkoitettu tyypin 2 diabetes mellitusta sairastavien aikuisten glukoositasapainon parantamiseen ruokavalion ja liikunnan lisänä.
ANNOSTELU JA HALLINNOINTI
Diabetes mellituksen hoitoon PRECOSElla tai millä tahansa muulla farmakologisella aineella ei ole kiinteää annostusohjelmaa. PRECOSE 25 mg:n annos on yksilöitävä sekä tehon että sietokyvyn perusteella, mutta se ei saa ylittää suositeltua enimmäisannosta 100 mg tid. PRECOSE tulee ottaa kolme kertaa päivässä jokaisen pääaterian alussa (ensimmäisellä puremalla).
PRECOSE-hoito tulee aloittaa pienellä annoksella ja asteittain nostamalla annosta alla kuvatulla tavalla sekä ruoansulatuskanavan sivuvaikutusten vähentämiseksi että potilaan riittävän glukoositasapainon edellyttämän vähimmäisannoksen tunnistamiseksi. Jos määrättyä ruokavaliota ei noudateta, suoliston sivuvaikutukset voivat voimistua. Jos diabeetikon ruokavalion noudattamisesta huolimatta ilmaantuu voimakkaasti ahdistavia oireita, on otettava yhteyttä lääkäriin ja annosta pienennettävä tilapäisesti tai pysyvästi.
Hoidon aloituksen ja annosta titrattaessa (katso alla) tunnin aterian jälkeistä plasman glukoosia voidaan käyttää PRECOSE-hoidon terapeuttisen vasteen määrittämiseen ja potilaan pienimmän tehokkaan annoksen määrittämiseen. Sen jälkeen glykosyloitunut hemoglobiini tulee mitata noin kolmen kuukauden välein. Terapeuttisena tavoitteena tulee olla sekä aterian jälkeisen plasman glukoosi- että glykosyloituneen hemoglobiinin alentaminen normaaliksi tai lähes normaaliksi käyttämällä pienintä tehokasta PRECOSE-annosta joko monoterapiana tai yhdessä sulfonyyliureoiden, insuliinin tai metformiinin kanssa.
Alkuannostus
PRECOSE 25 mg:n suositeltu aloitusannos on 25 mg suun kautta kolme kertaa päivässä jokaisen pääaterian alussa (ensimmäisellä puremalla). Jotkut potilaat voivat kuitenkin hyötyä asteittaisesta annoksen titrauksesta ruoansulatuskanavan sivuvaikutusten minimoimiseksi. Tämä voidaan saavuttaa aloittamalla hoito annoksella 25 mg kerran vuorokaudessa ja lisäämällä sen jälkeen antotiheyttä, jotta saavutetaan 25 mg tid.
Ylläpitoannostus
Kun 25 mg tid -annostus on saavutettu, PRECOSE 50 mg -annosta tulee säätää 4–8 viikon välein yhden tunnin aterian jälkeisen glukoosi- tai glykosyloituneen hemoglobiinitason ja toleranssin perusteella. Annosta voidaan nostaa 25 mg:sta tid 50 mg:aan tid. Jotkut potilaat voivat hyötyä annoksen nostamisesta edelleen 100 mg:aan tid. Ylläpitoannos vaihtelee välillä 50 mg tid - 100 mg tid. Koska kuitenkin pienipainoisilla potilailla kohonneiden seerumin transaminaasiarvojen riski, vain yli 60 kg painavien potilaiden annoksen titrausta tulee harkita yli 50 mg tid (ks. VAROTOIMENPITEET ). Jos aterian jälkeisissä glukoosi- tai glykosyloituneen hemoglobiinin pitoisuuksissa ei havaita alenevan enempää titraus 100 mg:aan tid, annoksen pienentämistä tulee harkita. Kun tehokas ja siedetty annos on määritetty, se tulee säilyttää.
Suurin annostus
Suurin suositeltu annos potilaille, joiden paino on ≤ 60 kg, on 50 mg tid. Suurin suositeltu annos yli 60 kg painaville potilaille on 100 mg tid
Potilaat, jotka saavat sulfonyyliureoita tai insuliinia
Sulfonyyliurea-aineet tai insuliini voivat aiheuttaa hypoglykemiaa. PRECOSE annettuna yhdessä sulfonyyliurean tai insuliinin kanssa alentaa edelleen verensokeria ja voi lisätä hypoglykemian mahdollisuutta. Jos hypoglykemiaa ilmaantuu, näiden lääkkeiden annosta on muutettava asianmukaisesti.
MITEN TOIMITETAAN
PRECOSE on saatavana 25 mg:n, 50 mg:n tai 100 mg:n pyöreinä, jakouurrettamattomina tabletteina. Jokainen tabletin vahvuus on väriltään valkoisesta keltaiseen. 25 mg:n tabletin toisella puolella on koodi "PRECOSE" ja toisella puolella "25". 50 mg:n tabletissa on koodi "PRECOSE" ja "50" samalla puolella. 100 mg:n tabletissa on koodi "PRECOSE" ja "100" samalla puolella. PRECOSE on saatavana 100 ja 50 mg:n pulloissa 100 mg:n yksikköannospakkauksissa.
Säilytä alle 25°C (77°F). Suojaa kosteudelta. Pullot säilytetään tiiviisti suljettuina.
Bayer HealthCare Pharmaceuticals Inc. Wayne, NJ 07470. Valmistettu Saksassa. 11/11
SIVUVAIKUTUKSET
Ruoansulatuskanava
Ruoansulatuskanavan oireet ovat PRECOSEN yleisimmät reaktiot. Yhdysvalloissa tehdyissä lumekontrolloiduissa tutkimuksissa vatsakipujen, ripulin ja ilmavaivat olivat 19 %, 31 % ja ilmavaivat 74 % 1255 potilaasta, joita hoidettiin PRECOSElla 50–300 mg tid, kun taas vastaavat esiintyvuudet olivat 9 %, 12 %. ja 29 % 999 lumelääkettä saaneesta potilaasta.
Vuoden kestäneessä turvallisuustutkimuksessa, jonka aikana potilaat pitivät päiväkirjaa maha-suolikanavan oireista, vatsakipu ja ripuli palasivat ajan myötä hoitoa edeltäneelle tasolle, ja ilmavaivojen esiintymistiheydellä ja voimakkuudella oli taipumus vähentyä ajan myötä. Lisääntyneet ruoansulatuskanavan oireet potilailla, joita hoidetaan PRECOSE 50 mg:lla, ovat PRECOSEN vaikutusmekanismin ilmentymä ja liittyvät sulamattomien hiilihydraattien esiintymiseen ruoansulatuskanavan alaosassa.
Jos määrättyä ruokavaliota ei noudateta, suoliston sivuvaikutukset voivat voimistua. Jos diabeetikon ruokavalion noudattamisesta huolimatta ilmaantuu voimakkaasti ahdistavia oireita, on otettava yhteyttä lääkäriin ja annosta pienennettävä tilapäisesti tai pysyvästi.
Kohonneet seerumin transaminaasitasot
Katso VAROTOIMENPITEET .
Muut epänormaalit laboratoriolöydöt
Pieniä hematokriitin laskua esiintyi useammin PRECOSE-hoitoa saaneilla potilailla kuin lumelääkettä saaneilla potilailla, mutta niihin ei liittynyt hemoglobiinin laskua. Alhaiset seerumin kalsium- ja alhaiset plasman B6-vitamiinipitoisuudet liittyivät PRECOSE 50 mg -hoitoon, mutta niiden katsotaan olevan joko harhaanjohtavia tai joilla ei ole kliinistä merkitystä.
Markkinoinnin jälkeiset haittatapahtumaraportit
Muita maailmanlaajuisista markkinoille tulon jälkeen raportoituja haittavaikutuksia ovat kuolemaan johtava fulminantti hepatiitti, yliherkkyysreaktiot (esimerkiksi ihottuma, punoitus, eksanteema ja utikaria), turvotus, ileus/subileus, keltaisuus ja/tai hepatiitti ja siihen liittyvät maksavauriot, trombosytopenia ja pneumatoosi cystoides intestinalis (katso VAROTOIMENPITEET ).
Pneumatoosi Cystoides Intestinalis
Markkinoille tulon jälkeen on raportoitu harvoin pneumatosis cystoides intestinalis -oireita, jotka liittyvät alfa-glukosidaasin estäjien, mukaan lukien Precosen, käyttöön. Pneumatosis cystoides intestinalis voi ilmetä ripulin, limanerityksen, peräsuolen verenvuodon ja ummetuksen oireita. Komplikaatioita voivat olla pneumoperitoneum, volvulus, suolitukos, suolisto, suolen verenvuoto ja suolen perforaatio. Jos epäillään pneumatosis cystoides intestinalis -bakteeria, lopeta Precose 25mg -hoito ja suorita asianmukainen diagnostinen kuvantaminen.
HUUMEIDEN VUOROVAIKUTUKSET
Tietyt lääkkeet aiheuttavat yleensä hyperglykemiaa ja voivat johtaa verensokerin hallinnan menettämiseen. Näitä lääkkeitä ovat tiatsidit ja muut diureetit, kortikosteroidit, fenotiatsiinit, kilpirauhasvalmisteet, estrogeenit, suun kautta otettavat ehkäisyvalmisteet, fenytoiini, nikotiinihappo, sympatomimeetit, kalsiumkanavaa salpaavat lääkkeet ja isoniatsidi. Kun tällaisia lääkkeitä annetaan potilaalle, joka saa PRECOSE 25 mg, potilasta on tarkkailtava tarkasti verensokerin hallinnan heikkenemisen varalta. Kun tällaiset lääkkeet poistetaan potilailta, jotka saavat PRECOSE 50 mg:aa yhdessä sulfonyyliureoiden tai insuliinin kanssa, potilaita on tarkkailtava huolellisesti mahdollisten hypoglykemian merkkien varalta.
Potilaat, jotka saavat sulfonyyliureoita tai insuliinia: Sulfonyyliurea-aineet tai insuliini voivat aiheuttaa hypoglykemiaa. PRECOSE 25 mg yhdistelmänä sulfonyyliurean tai insuliinin kanssa voi alentaa verensokeria entisestään ja lisätä hypoglykemian mahdollisuutta. Jos hypoglykemiaa ilmaantuu, näiden lääkkeiden annosta on muutettava asianmukaisesti. Hyvin harvoin yksittäisiä hypoglykeemisiä sokkitapauksia on raportoitu potilailla, jotka ovat saaneet PRECOSE-hoitoa yhdessä sulfonyyliureoiden ja/tai insuliinin kanssa.
Suoliston adsorbentit (esimerkiksi puuhiili) ja ruoansulatusentsyymivalmisteet, jotka sisältävät hiilihydraatteja pilkkovia entsyymejä (esim. amylaasi, pankreatiini) voivat heikentää PRECOSE-valmisteen vaikutusta, eikä niitä tule käyttää samanaikaisesti.
PRECOSE 25 mg:n on osoitettu muuttavan digoksiinin biologista hyötyosuutta, kun niitä käytetään samanaikaisesti, mikä saattaa edellyttää digoksiinin annoksen muuttamista. (Katso KLIININEN FARMAKOLOGIA , Huumeiden väliset vuorovaikutukset .)
VAROITUKSET
Tietoja ei ole annettu
VAROTOIMENPITEET
Kenraali
Makrovaskulaariset tulokset
Ei ole tehty kliinisiä tutkimuksia, jotka osoittaisivat lopullista näyttöä makrovaskulaarisen riskin pienenemisestä PRECOSE 25 mg:n tai minkä tahansa muun diabeteslääkkeen käytön yhteydessä.
Hypoglykemia
Vaikutusmekanisminsa vuoksi PRECOSE ei yksinään annettuna saa aiheuttaa hypoglykemiaa paastotilassa tai aterian jälkeen. Sulfonyyliurea-aineet tai insuliini voivat aiheuttaa hypoglykemiaa. Koska PRECOSE 50 mg yhdistettynä sulfonyyliurean tai insuliinin kanssa alentaa edelleen verensokeria, se voi lisätä hypoglykemian mahdollisuutta. Hypoglykemiaa ei esiinny potilailla, jotka saavat pelkkää metformiinia tavanomaisissa käyttöolosuhteissa, eikä hypoglykemian esiintyvyyden lisääntymistä havaittu potilailla, kun PRECOSE 50 mg lisättiin metformiinihoitoon.
Suun kautta otettavaa glukoosia (dekstroosia), jonka imeytymistä PRECOSE ei estä, tulee käyttää sakkaroosin (ruokosokerin) sijasta lievän tai kohtalaisen hypoglykemian hoidossa. Sakkaroosi, jonka hydrolyysiä glukoosiksi ja fruktoosiksi estää PRECOSE, ei sovellu hypoglykemian nopeaan korjaamiseen. Vaikea hypoglykemia saattaa vaatia joko suonensisäisen glukoosi-infuusion tai glukagonin injektion käyttöä.
Kohonneet seerumin transaminaasitasot
Yhdysvalloissa tehdyissä pitkäaikaisissa tutkimuksissa (jopa 12 kuukautta, mukaan lukien PRECOSE 25 mg annokset 300 mg tid asti) hoidosta johtuvat seerumin transaminaasiarvojen (AST ja/tai ALAT) nousut yli normaalin ylärajan (ULN). ), yli 1,8 kertaa ULN ja yli 3 kertaa ULN esiintyi 14 %:lla, 6 %:lla ja 3 %:lla PRECOSE-hoitoa saaneista potilaista verrattuna vastaavasti 7 %:iin, 2 %:iin ja 1 %:iin. lumelääkettä saaneista potilaista. Vaikka nämä erot hoitojen välillä olivat tilastollisesti merkitseviä, nämä nousut olivat oireettomia, palautuvia, yleisempiä naisilla eivätkä yleensä liittyneet muihin maksan toimintahäiriöihin. Lisäksi nämä seerumin transaminaasitason nousut näyttivät olevan annoksesta riippuvaisia. Yhdysvaltalaisissa tutkimuksissa, joihin sisältyivät PRECOSE 50 mg annokset 100 mg tid:n enimmäisannokseen asti, hoidon aiheuttama ASAT- ja/tai ALAT-arvon kohoaminen millä tahansa vaikeusasteella oli samanlainen PRECOSE-hoitoa saaneiden potilaiden ja lumelääkettä saaneiden potilaiden välillä (p ≥ 0,496). .
Noin 3 miljoonan potilasvuoden kansainvälisen PRECOSE 50 mg:n markkinoille tulon jälkeisen kokemuksen aikana on raportoitu 62 tapausta, joissa seerumin transaminaasiarvot kohosivat > 500 IU/l (joista 29 liittyi keltaisuuteen). Näistä 62 potilaasta 41 sai hoitoa vähintään 100 mg:lla kolme kertaa päivässä, ja 33 45 potilaasta, joiden ilmoitettiin painon, painoi alle 60 kg. Niissä 59 tapauksessa, joissa seuranta kirjattiin, maksan poikkeavuudet paranivat tai hävisivät PRECOSE-hoidon lopettamisen jälkeen ja pysyivät ennallaan kahdessa tapauksessa. Kuolemaan johtaneita fulminanttia hepatiittitapauksia on raportoitu; suhde akarboosiin on epäselvä.
Verensokerin hallinnan menetys
Kun diabeetikot altistuvat stressille, kuten kuumeelle, traumalle, infektiolle tai leikkaukselle, verensokeritasapainon hallinnan tilapäinen menetys voi tapahtua. Tällöin tilapäinen insuliinihoito voi olla tarpeen.
Laboratoriotestit
PRECOSEN terapeuttista vastetta tulee seurata määräajoin verensokerimittauksilla. Glykosyloituneen hemoglobiinitason mittaamista suositellaan pitkäaikaisen glukoositasapainon seuraamiseksi.
PRECOSE 25 mg, erityisesti yli 50 mg tid annoksilla, voi aiheuttaa seerumin transaminaasiarvojen nousua ja harvinaisissa tapauksissa hyperbilirubinemiaa. On suositeltavaa, että seerumin transaminaasiarvot tarkistetaan 3 kuukauden välein PRECOSE-hoidon ensimmäisen vuoden aikana ja määräajoin sen jälkeen. Jos transaminaasiarvojen nousua havaitaan, annoksen pienentäminen tai hoidon lopettaminen voi olla aiheellista, varsinkin jos nousut jatkuvat.
Munuaisten vajaatoiminta
Plasman PRECOSE-pitoisuudet munuaisten vajaatoimintaa sairastavilla vapaaehtoisilla kasvoivat suhteessa munuaisten vajaatoiminnan asteeseen. Pitkäaikaisia kliinisiä tutkimuksia diabeetikoilla, joilla on merkittävä munuaisten toimintahäiriö (seerumin kreatiniini > 2,0 mg/dl), ei ole tehty. Siksi näiden potilaiden hoitoa PRECOSE 50 mg:lla ei suositella.
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
Akarboosilla tehtiin kahdeksan karsinogeenisuustutkimusta. Rotilla suoritettiin kuusi tutkimusta (kaksi kantaa, Sprague-Dawley ja Wistar) ja kaksi tutkimusta hamstereilla.
Ensimmäisessä rottatutkimuksessa Sprague-Dawley-rotat saivat akarboosia rehussa suurina annoksina (jopa noin 500 mg/kg ruumiinpainoa) 104 viikon ajan. Akarboosihoito lisäsi merkittävästi munuaiskasvainten (adenoomien ja adenokarsinoomien) ja hyvänlaatuisten Leydig-solukasvainten ilmaantuvuutta. Tämä tutkimus toistettiin samanlaisella tuloksella. Lisätutkimuksia tehtiin akarboosin suorien karsinogeenisten vaikutusten erottamiseksi epäsuorista vaikutuksista, jotka johtuivat tutkimuksissa käytettyjen suurten akarboosiannosten aiheuttamasta hiilihydraattialiravitsemuksesta. Eräässä tutkimuksessa, jossa käytettiin Sprague-Dawley-rottia, akarboosia sekoitettiin rehuun, mutta hiilihydraattien puute estettiin lisäämällä glukoosia ruokavalioon.

Sprague-Dawley-rotilla tehdyssä 26 kuukautta kestäneessä tutkimuksessa akarboosia annettiin päivittäin aterian jälkeisellä letkuletkulla lääkkeen farmakologisten vaikutusten välttämiseksi. Molemmissa näissä tutkimuksissa alkuperäisissä tutkimuksissa havaittua lisääntynyttä munuaiskasvainten ilmaantuvuutta ei esiintynyt. Akarboosia annettiin myös ruuan mukana ja aterian jälkeen letkulla kahdessa erillisessä tutkimuksessa Wistar-rotilla. Kummassakaan näistä Wistar-rottatutkimuksista ei havaittu lisääntynyttä munuaiskasvainten ilmaantuvuutta. Kahdessa hamstereiden ruokintatutkimuksessa glukoosilisalla ja ilman sitä ei myöskään havaittu todisteita karsinogeenisuudesta.
Akarboosi ei indusoinut DNA-vaurioita in vitro CHO-kromosomipoikkeavuusmäärityksessä, bakteerimutageneesimäärityksessä (Ames) tai DNA:n sitoutumismäärityksessä. In vivo DNA-vaurioita ei havaittu uroshiirten dominoivassa letaalisessa testissä tai hiiren mikrotumatestissä.
Rotilla oraalisen annon jälkeen tehdyt hedelmällisyystutkimukset eivät tuottaneet haitallisia vaikutuksia hedelmällisyyteen tai yleiseen lisääntymiskykyyn.
Raskaus
Teratogeeniset vaikutukset: Raskausluokka B.
PRECOSEN turvallisuutta raskaana oleville naisille ei ole varmistettu. Lisääntymistutkimuksia on suoritettu rotilla annoksilla 480 mg/kg asti (vastaa 9-kertaista altistusta ihmiselle, laskettuna lääkeainepitoisuuksista veressä), eikä niissä ole havaittu näyttöä akarboosin aiheuttamasta hedelmällisyyden heikkenemisestä tai sikiölle aiheutuneesta haitasta. Kaneilla emon painonnousu, joka todennäköisesti johtuu suurten akarboosiannosten farmakodynaamisesta aktiivisuudesta suolistossa, saattoi olla syynä alkion menetysten määrän lievään lisääntymiseen. Kaniinit, joille annettiin 160 mg/kg akarboosia (vastaten 10 kertaa ihmisen annosta, kehon pinta-alan perusteella), ei osoittanut merkkejä alkiotoksisuudesta eikä teratogeenisyyttä annoksella, joka oli 32-kertainen ihmisen annosta (kehon mukaan laskettuna). pinta-ala). PRECOSE 25 mg:n käytöstä raskaana oleville naisille ei kuitenkaan ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen. Koska nykyiset tiedot viittaavat vahvasti siihen, että epänormaalit verensokeritasot raskauden aikana liittyvät lisääntyneeseen synnynnäisten epämuodostumien ilmaantuvuuteen sekä lisääntyneeseen vastasyntyneiden sairastuvuuteen ja kuolleisuuteen, useimmat asiantuntijat suosittelevat insuliinin käyttöä raskauden aikana verensokeritason pitämiseksi mahdollisimman lähellä normaalia. .
Imettävät äidit
Pieni määrä radioaktiivisuutta on havaittu imettävien rottien maidosta radioaktiivisesti leimatun akarboosin antamisen jälkeen. Ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, PRECOSE 25 mg -valmistetta ei tule antaa imettäville naisille.
Käyttö lapsille
PRECOSE 25 mg:n turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
PRECOSE 25 mg:n kliinisissä tutkimuksissa Yhdysvalloissa 27 % oli 65-vuotiaita ja vanhempia ja 4 % 75-vuotiaita tai vanhempia. Näiden ja nuorempien koehenkilöiden välillä ei havaittu yleisiä eroja turvallisuudessa ja tehokkuudessa. Keskimääräinen vakaan tilan käyrän alla oleva pinta-ala (AUC) ja akarboosin maksimipitoisuudet olivat noin 1,5 kertaa suuremmat vanhuksilla kuin nuorilla vapaaehtoisilla; nämä erot eivät kuitenkaan olleet tilastollisesti merkittäviä.
YLIANNOSTUS
Toisin kuin sulfonyyliureat tai insuliini, PRECOSEN yliannostus ei johda hypoglykemiaan. Yliannostus voi aiheuttaa ohimenevää ilmavaivat, ripulia ja vatsakivun lisääntymistä, jotka häviävät pian. Yliannostustapauksissa potilaalle ei pidä antaa hiilihydraatteja (polysakkarideja, oligosakkarideja ja disakkarideja) sisältäviä juomia tai aterioita seuraavien 4–6 tunnin aikana.
VASTA-AIHEET
PRECOSE 25 mg on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä lääkkeelle. Precose 25 mg on vasta-aiheinen potilailla, joilla on diabeettinen ketoasidoosi tai kirroosi. PRECOSE 25 mg on myös vasta-aiheinen potilaille, joilla on tulehduksellinen suolistosairaus, paksusuolen haavauma, osittainen suolitukos tai potilailla, jotka ovat alttiita suolitukkoon. Lisäksi PRECOSE on vasta-aiheinen potilailla, joilla on krooninen suolistosairaus, johon liittyy merkittäviä ruoansulatus- tai imeytymishäiriöitä, ja potilaille, joilla on sairauksia, jotka voivat pahentua lisääntyneen kaasunmuodostuksen seurauksena suolistossa.
KLIININEN FARMAKOLOGIA
Akarboosi on monimutkainen oligosakkaridi, joka hidastaa nautittujen hiilihydraattien sulamista, mikä johtaa pienempään verensokeripitoisuuden nousuun aterioiden jälkeen. Plasman glukoosin alenemisen seurauksena PRECOSE alentaa glykosyloituneen hemoglobiinin tasoja potilailla, joilla on tyypin 2 diabetes mellitus. Systeeminen ei-entsymaattinen proteiiniglykosylaatio, joka näkyy glykosyloidun hemoglobiinin tasoissa, on keskimääräisen veren glukoosipitoisuuden funktio ajan kuluessa.
Toimintamekanismi
Toisin kuin sulfonyyliureat, PRECOSE 50 mg ei lisää insuliinin eritystä. Akarboosin antihyperglykeeminen vaikutus johtuu haiman alfa-amylaasi- ja kalvoon sitoutuneiden suoliston alfa-glukosidihydrolaasientsyymien kompetitiivisesta, palautuvasta estämisestä. Haiman alfa-amylaasi hydrolysoi monimutkaiset tärkkelykset oligosakkarideiksi ohutsuolen ontelossa, kun taas kalvoon sitoutuneet suolen alfa-glukosidaasit hydrolysoivat oligosakkarideja, trisakkarideja ja disakkarideja glukoosiksi ja muiksi monosakkarideiksi ohutsuolen harjan reunassa. Diabeettisilla potilailla tämä entsyymin esto johtaa glukoosin imeytymisen viivästymiseen ja aterian jälkeisen hyperglykemian alenemiseen.
Koska PRECOSE:n vaikutusmekanismi on erilainen, verensokerin hallintaa tehostava vaikutus on additiivinen sulfonyyliureoiden, insuliinin tai metformiinin vaikutukseen, kun niitä käytetään yhdessä. Lisäksi PRECOSE 50mg vähentää sulfonyyliureoiden insulinotrooppisia ja painoa lisääviä vaikutuksia.
Akarboosilla ei ole laktaasia estävää vaikutusta, eikä sen näin ollen odoteta aiheuttavan laktoosi-intoleranssia.
Farmakokinetiikka
Imeytyminen
Kuuden terveen miehen tutkimuksessa alle 2 % oraalisesta akarboosiannoksesta imeytyi aktiivisena lääkkeenä, kun taas noin 35 % kokonaisradioaktiivisuudesta 14C-leimatusta oraalisesta annoksesta imeytyi. Keskimäärin 51 % suun kautta otetusta annoksesta erittyi ulosteisiin imeytymättömänä lääkkeeseen liittyvänä radioaktiivisena aineena 96 tunnin kuluessa nauttimisesta. Koska akarboosi vaikuttaa paikallisesti maha-suolikanavassa, tämä lähtöyhdisteen alhainen systeeminen biologinen hyötyosuus on terapeuttisesti toivottavaa. Kun terveille vapaaehtoisille annettiin suun kautta 14C-leimattua akarboosia, radioaktiivisuuden huippupitoisuudet plasmassa saavutettiin 14–24 tunnin kuluttua annostelusta, kun taas aktiivisen lääkkeen huippupitoisuudet plasmassa saavutettiin noin tunnin kuluttua. Akarboosiin liittyvän radioaktiivisuuden viivästynyt imeytyminen heijastaa metaboliittien imeytymistä, joita voivat muodostua joko suolistobakteerit tai suoliston entsymaattinen hydrolyysi.
Aineenvaihdunta
Akarboosi metaboloituu yksinomaan maha-suolikanavassa, pääasiassa suolistobakteerien, mutta myös ruoansulatusentsyymien vaikutuksesta. Osa näistä metaboliiteista (noin 34 % annoksesta) imeytyi ja erittyi myöhemmin virtsaan. Ainakin 13 metaboliittia on erotettu kromatografisesti virtsanäytteistä. Tärkeimmät metaboliitit on tunnistettu 4-metyylipyrogallolijohdannaisiksi (eli sulfaatti-, metyyli- ja glukuronidikonjugaateiksi). Yhdellä metaboliitilla (joka muodostuu glukoosimolekyylin pilkkoutumisesta akarboosista) on myös alfa-glukosidaasia estävää vaikutusta. Tämä metaboliitti yhdessä virtsasta erittyneen emoyhdisteen kanssa muodostaa alle 2 % annetusta kokonaisannoksesta.
Erittyminen
Eheenä lääkkeenä imeytynyt akarboosin fraktio erittyy lähes kokonaan munuaisten kautta. Kun akarboosia annettiin suonensisäisesti, 89 % annoksesta erittyi virtsaan aktiivisena lääkkeenä 48 tunnin kuluessa. Sitä vastoin alle 2 % oraalisesta annoksesta havaittiin virtsassa aktiivisena (eli lähtöaineena ja aktiivisena metaboliittina) lääkkeenä. Tämä on yhdenmukainen alkuperäisen lääkkeen alhaisen biologisen hyötyosuuden kanssa. Akarboosiaktiivisuuden plasman eliminaation puoliintumisaika on noin 2 tuntia terveillä vapaaehtoisilla. Näin ollen lääkkeen kertymistä ei tapahdu kolme kertaa päivässä (tid) suun kautta otettaessa.
Erikoispopulaatiot
Keskimääräinen vakaan tilan käyrän alla oleva pinta-ala (AUC) ja akarboosin maksimipitoisuudet olivat noin 1,5 kertaa suuremmat vanhuksilla kuin nuorilla vapaaehtoisilla; nämä erot eivät kuitenkaan olleet tilastollisesti merkittäviä. Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (Clcr
Huumeiden väliset vuorovaikutukset
Terveillä vapaaehtoisilla tehdyt tutkimukset ovat osoittaneet, että PRECOSE ei vaikuta nifedipiinin, propranololin tai ranitidiinin farmakokinetiikkaan tai farmakodynamiikkaan. PRECOSE ei häirinnyt sulfonyyliurea-glyburidin imeytymistä tai jakautumista diabeettisilla potilailla. PRECOSE voi vaikuttaa digoksiinin hyötyosuuteen ja saattaa vaatia digoksiinin annosta muuttamaan 16 % (90 %:n luottamusväli: 8-23 %), laskemaan digoksiinin keskimääräistä Cmax-arvoa 26 % (90 %:n luottamusväli: 16-34 %) ja alentamaan keskimääräistä pohjaa. digoksiinipitoisuudet 9 % (90 %:n luottamusraja: 19 %:n lasku 2 %:iin). (Katso VAROTOIMENPITEET: HUUMEIDEN VUOROVAIKUTUKSET .)
Plasman AUC-arvot osoittavat, että PRECOSE-hoidon aikana imeytynyt metformiinin määrä oli bioekvivalentti lumelääkettä saaneen imeytyneen määrän kanssa. Metformiinin huippupitoisuus plasmassa kuitenkin pieneni noin 20 %, kun PRECOSE otettiin, koska metformiinin imeytyminen viivästyi hieman. PRECOSEN ja metformiinin välillä on vain vähän tai ei ollenkaan kliinisesti merkittävää yhteisvaikutusta.
Kliiniset tutkimukset
Kliiniset kokemukset annoksenmääritystutkimuksista tyypin 2 diabetes mellituspotilailla, jotka saavat vain ruokavaliohoitoa
Tulokset kuudesta kontrolloidusta kiinteäannoksista monoterapiatutkimuksesta PRECOSElla tyypin 2 diabeteksen hoidossa, joihin osallistui 769 PRECOSElla hoidettua potilasta, yhdistettiin ja painotettu keskiarvo erosta lumelääkkeeseen glykosyloidun hemoglobiinin keskimääräisessä muutoksessa lähtötasosta ( HbA1c) laskettiin kullekin annostasolle alla esitetyllä tavalla:
Vaikka tutkimuksissa käytettiin enimmäisannosta 200 tai 300 mg tid, suurin suositeltu annos alle 60 kg painaville potilaille on 50 mg tid; suurin suositeltu annos yli 60 kg painaville potilaille on 100 mg tid
Näiden kuuden kiinteän annoksen monoterapiatutkimuksen tulokset yhdistettiin myös, jotta saatiin painotettu keskiarvo erosta lumelääkkeeseen verrattuna keskimääräisessä muutoksessa lähtötasosta yhden tunnin aterian jälkeisessä plasman glukoosipitoisuudessa, kuten seuraavassa kuvassa:
Kuvio 1 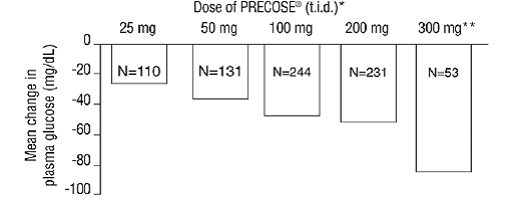
* PRECOSE 50 mg erosi tilastollisesti merkitsevästi lumelääkkeestä kaikilla annoksilla, mitä tulee vaikutukseen tunnin kuluttua aterian jälkeiseen plasman glukoosiin. **300 mg tid PRECOSE 50 mg -ohjelma oli parempi kuin pienemmät annokset, mutta tilastollisesti merkitseviä eroja 50-200 mg tid välillä ei ollut.
Kliininen kokemus tyypin 2 diabetespotilaista monoterapiassa tai yhdessä sulfonyyliureoiden, metformiinin tai insuliinin kanssa
PRECOSEa tutkittiin monoterapiana ja yhdistelmähoitona sulfonyyliurea-, metformiini- tai insuliinihoidon kanssa. Hoidon vaikutukset HbA1c-tasoihin ja tunnin aterian jälkeisiin glukoositasoihin on yhteenveto neljässä lumekontrolloidussa, kaksoissokkoutetussa satunnaistetussa tutkimuksessa, jotka suoritettiin Yhdysvalloissa, taulukoissa 2 ja 3, vastaavasti. Plasebo-vähennetty hoitoerot, joista on yhteenveto alla, olivat tilastollisesti merkitseviä molemmille muuttujille kaikissa näissä tutkimuksissa.
Tutkimukseen 1 (n = 109) osallistui potilaita, jotka saivat taustahoitoa pelkällä ruokavaliolla. PRECOSEN lisäämisen ruokavaliohoitoon keskimääräinen vaikutus oli -0,78 %:n muutos HbA1c:ssä ja tunnin aterian jälkeisen glukoosin parantuminen -74,4 mg/dl.
Tutkimuksessa 2 (n = 137) PRECOSE 25 mg:n lisäämisen keskimääräinen vaikutus sulfonyyliureahoidon maksimimäärään oli -0,54 %:n muutos HbA1c:ssä ja tunnin aterian jälkeisen glukoosin parantuminen -33,5 mg/dl.
Tutkimuksessa 3 (n=147) PRECOSE 50 mg:n lisäyksen keskimääräinen vaikutus maksimimetformiinihoitoon oli -0,65 %:n muutos HbA1c:ssä ja tunnin aterian jälkeisen glukoosin parantuminen -34,3 mg/dl.
Tutkimus 4 (n = 145) osoitti, että PRECOSE lisättiin potilaille, jotka saivat taustahoitoa insuliinilla, johtivat HbA1c:n keskimääräiseen muutokseen -0,69 % ja yhden tunnin aterian jälkeiseen glukoosipitoisuuteen -36,0 mg/dl.
Kanadassa suoritettiin yhden vuoden tutkimus PRECOSEsta monoterapiana tai yhdistelmänä sulfonyyliurean, metformiinin tai insuliinihoidon kanssa, jossa 316 potilasta sisällytettiin ensisijaiseen tehokkuusanalyysiin (kuva 2). Ruokavalio-, sulfonyyliurea- ja metformiiniryhmissä PRECOSE 50 mg:n lisäämisen tuottama HbA1c:n keskimääräinen lasku oli tilastollisesti merkitsevä kuuden kuukauden kohdalla, ja tämä vaikutus oli jatkuva yhden vuoden kohdalla. PRECOSE-hoitoa saaneilla insuliinia saaneilla potilailla HbA1c väheni tilastollisesti merkitsevästi kuuden kuukauden kohdalla ja laskusuuntaus yhden vuoden kohdalla.
Kuva 2 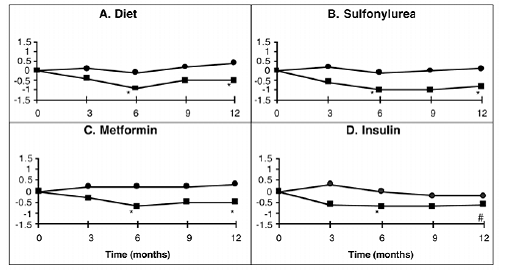
Kuva 2: PRECOSE (III ) ja lumelääke ( III ) vaikutukset HbA1c-tasojen keskimääräiseen muutokseen lähtötasosta vuoden kestäneessä tutkimuksessa potilailla, joilla on tyypin 2 diabetes, kun niitä käytettiin yhdessä seuraavien kanssa: (A) pelkkä ruokavalio; (B) sulfonyyliurea; (C) metformiini; tai (D) insuliinia. Hoitoerot 6 ja 12 kuukauden kohdalla testattiin: * p
POTILASTIEDOT
Potilaita tulee neuvoa ottamaan PRECOSE 50 mg suun kautta kolme kertaa päivässä jokaisen pääaterian alussa (ensimmäisellä puremalla). On tärkeää, että potilaat jatkavat ruokavalio-ohjeiden noudattamista, säännöllistä harjoittelua ja säännöllistä virtsan ja/tai verensokerin mittausta.
PRECOSE ei itsessään aiheuta hypoglykemiaa edes silloin, kun sitä annettaisiin potilaille paastotilassa. Sulfonyyliurealääkkeet ja insuliini voivat kuitenkin alentaa verensokeritasoja tarpeeksi aiheuttaakseen oireita tai joskus hengenvaarallisen hypoglykemian. Koska PRECOSE yhdistettynä sulfonyyliurean tai insuliinin kanssa alentaa edelleen verensokeria, se voi lisätä näiden aineiden hypoglykeemistä potentiaalia. Hypoglykemiaa ei esiinny potilailla, jotka saavat pelkkää metformiinia tavanomaisissa käyttöolosuhteissa, eikä hypoglykemian esiintyvyyden lisääntymistä havaittu potilailla, kun PRECOSE lisättiin metformiinihoitoon. Potilaiden ja vastuullisten perheenjäsenten tulee ymmärtää hypoglykemian riski, sen oireet ja hoito sekä sen kehittymiselle altistavat olosuhteet. Koska PRECOSE 50mg estää ruokasokerin hajoamisen, potilailla tulee olla helposti saatavilla oleva glukoosilähde (dekstroosi, D-glukoosi) matalan verensokerin oireiden hoitoon, kun PRECOSEa käytetään yhdessä sulfonyyliurean tai insuliinin kanssa.
Jos PRECOSEN kanssa ilmenee sivuvaikutuksia, ne kehittyvät yleensä muutaman ensimmäisen hoitoviikon aikana. Ne ovat yleisimmin lieviä tai kohtalaisia maha-suolikanavan vaikutuksia, kuten ilmavaivat, ripuli tai vatsakipu, ja yleensä niiden esiintymistiheys ja voimakkuus vähenevät ajan myötä.
