Glucovance 400/2.50mg, 500/5mg Metformin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Glucovance 2,50 mg on ja miten sitä käytetään?
Glucovance 400mg on reseptilääke, jota käytetään tyypin 2 diabeteksen oireiden hoitoon. Glucovancea voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Glukovance kuuluu lääkeluokkaan, jota kutsutaan diabeteslääkkeiksi, sulfonyyliureoiksi/biguanideiksi.
Ei tiedetä, onko Glucovance 2,50 mg turvallinen ja tehokas lapsille.
Mitkä ovat Glucovance 400mg:n mahdolliset sivuvaikutukset?
Glucovance voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- turvotus,
- nopea painonnousu,
- hengenahdistus,
- äärimmäinen heikkous,
- näön hämärtyminen,
- hikoilu,
- ongelmia puhumisessa,
- vapina,
- vatsakipu,
- hämmennystä,
- kohtaukset,
- epätavallinen lihaskipu,
- vaikeuksia hengittää,
- vatsakipu,
- oksentelua,
- epäsäännöllinen syke,
- huimaus,
- kylmä olo,
- heikkous ja
- väsymys
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Glucovancen yleisimpiä sivuvaikutuksia ovat:
- matala verensokeri,
- pahoinvointi,
- ripuli,
- vatsavaivat ja
- päänsärky
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Glucovancen mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
GLUCOVANCE® (Glyburide ja Metformin HCl) -tabletit sisältävät 2 suun kautta otettavaa verensokeria alentavaa lääkettä, joita käytetään tyypin 2 diabeteksen hoitoon, glyburidia ja metformiinihydrokloridia.
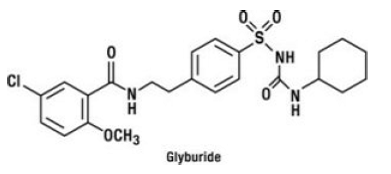
Glyburidi on oraalinen antihyperglykeeminen lääke, joka kuuluu sulfonyyliurearyhmään. Glyburidin kemiallinen nimi on 1-[[p-[2-(5-kloori-o-anisamido)etyyli]fenyyli]sulfonyyli]-3-sykloheksyyliurea. Glyburidi on valkoinen tai luonnonvalkoinen kiteinen yhdiste, jonka molekyylikaava on C23H28ClN3O5S ja molekyylipaino 494,01. GLUCOVANCE 5mg:ssa käytetyn glyburidin hiukkaskokojakauma on 25 % alimitoista enintään 6 μm, 50 % alikokoarvo enintään 7–10 μm ja 75 % alikokoarvo enintään 21 μm. Rakennekaava on esitetty alla.
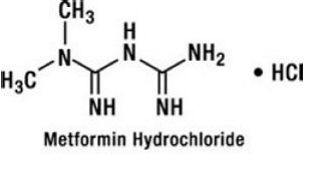
Metformiinihydrokloridi on suun kautta otettava antihyperglykeeminen lääke, jota käytetään tyypin 2 diabeteksen hoidossa. Metformiinihydrokloridi (N,N-dimetyyli-imidodikarbonimidiamidimonohydrokloridi) ei ole kemiallisesti tai farmakologisesti sukua sulfonyyliureoille, tiatsolidiinidioneille tai α-glukosidaasin estäjille. Se on valkoinen tai luonnonvalkoinen kiteinen yhdiste, jonka molekyylikaava on C4H12ClN5 (monohydrokloridi) ja molekyylipaino 165,63. Metformiinihydrokloridi liukenee vapaasti veteen ja on käytännössä liukenematon asetoniin, eetteriin ja kloroformiin. Metformiinin pKa on 12,4. Metformiinihydrokloridin 1-prosenttisen vesiliuoksen pH on 6,68. Rakennekaava on seuraavanlainen:
GLUCOVANCE 500 mg on saatavana suun kautta annettavaksi tabletteina, jotka sisältävät 1,25 mg glyburidia ja 250 mg metformiinihydrokloridia, 2,5 mg glyburidia ja 500 mg metformiinihydrokloridia ja 5 mg glyburidia ja 500 mg metformiinihydrokloridia. Lisäksi jokainen tabletti sisältää seuraavia inaktiivisia aineosia: mikrokiteinen selluloosa, povidoni, kroskarmelloosinatrium ja magnesiumstearaatti. Tabletit ovat kalvopäällysteisiä, mikä mahdollistaa värin erottelun.
INDIKAATIOT
GLUCOVANCE (Glyburide ja Metformin HCl) -tabletit on tarkoitettu ruokavalion ja liikunnan lisäravinteena parantamaan tyypin 2 diabetes mellitusta sairastavien aikuisten glukoositasapainoa.
ANNOSTELU JA HALLINNOINTI
Yleisiä huomioita
GLUCOVANCE-annos on yksilöitävä sekä tehon että sietokyvyn perusteella, mutta se ei saa ylittää suurinta suositeltua päivittäistä annosta 20 mg glyburidia/2000 mg metformiinia. GLUCOVANCE tulee antaa aterioiden yhteydessä ja se tulee aloittaa pienellä annoksella ja asteittain nostamalla annosta alla kuvatulla tavalla, jotta vältetään hypoglykemia (johtuu suurelta osin glyburidista), vähennetään ruoansulatuskanavan sivuvaikutuksia (johtuen suurelta osin metformiinista) ja mahdollistetaan verensokerin määrittäminen. pienin tehokas annos yksittäisen potilaan verensokerin riittävään hallintaan.
Alkuhoidon ja annoksen titrauksen aikana tulee käyttää asianmukaista verensokerin seurantaa GLUCOVANCE 2,50 mg:n terapeuttisen vasteen ja potilaan pienimmän tehokkaan annoksen määrittämiseksi. Sen jälkeen HbA1c tulee mitata noin 3 kuukauden välein hoidon tehokkuuden arvioimiseksi. Terapeuttinen tavoite kaikilla tyypin 2 diabetespotilailla on vähentää FPG:tä, PPG:tä ja HbA1c:tä normaaliksi tai mahdollisimman lähelle normaalia. Ihannetapauksessa vaste hoitoon tulisi arvioida käyttämällä HbA:ta (glykosyloitunut hemoglobiini), joka on parempi pitkän aikavälin glukoositason hallinta kuin pelkkä FPG.
Ei ole tehty tutkimuksia, joissa olisi erityisesti tutkittu GLUCOVANCE 400 mg -hoitoon siirtymisen turvallisuutta ja tehoa potilailla, jotka saavat samanaikaisesti glyburidia (tai muuta sulfonyyliureaa) ja metformiinia. Tällaisilla potilailla saattaa esiintyä muutoksia verensokeritasapainossa, jolloin joko hyperglykemia tai hypoglykemia on mahdollista. Tyypin 2 diabeteksen hoitoon tehtävät muutokset tulee tehdä huolella ja asianmukaista seurantaa noudattaen.
GLUCOVANCE potilailla, joilla on riittämätön glukoositasapaino ruokavalion ja liikunnan aikana
Suositeltu aloitusannos: 1,25 mg/250 mg kerran tai kahdesti päivässä aterioiden yhteydessä.
Tyypin 2 diabetesta sairastaville potilaille, joiden hyperglykemiaa ei voida hoitaa tyydyttävästi pelkällä ruokavaliolla ja liikunnalla, suositeltu GLUCOVANCE 400 mg:n aloitusannos on 1,25 mg/250 mg kerran vuorokaudessa aterian yhteydessä. Aloitushoitona potilaille, joiden lähtötilanteen HbA1c on > 9 % tai FPG > 200 mg/dl, voidaan käyttää aloitusannosta GLUCOVANCE 1,25 mg/250 mg kahdesti vuorokaudessa aamu- ja ilta-aterioiden yhteydessä. Annosta tulee suurentaa 1,25 mg/250 mg päivässä joka toinen viikko vähimmäistehoon asti, joka tarvitaan riittävän verensokerin hallintaan. Kliinisissä tutkimuksissa, joissa GLUCOVANCE-valmistetta käytettiin aloitushoitona, ei ollut kokemusta yli 10 mg/2000 mg:n vuorokausiannoksilla. GLUCOVANCE 5 mg/500 mg -valmistetta ei tule käyttää aloitushoitona hypoglykemian lisääntyneen riskin vuoksi.
GLUCOVANCE 500 mg:n käyttö potilailla, joilla on riittämätön glukoositasapaino sulfonyyliurealla ja/tai metformiinilla
Suositeltu aloitusannos: 2,5 mg/500 mg tai 5 mg/500 mg kahdesti vuorokaudessa aterioiden yhteydessä.
Potilaille, jotka eivät saa riittävästi hallintaa pelkällä glyburidilla (tai toisella sulfonyyliurealla) tai metformiinilla, suositeltu GLUCOVANCE-aloitusannos on 2,5 mg/500 mg tai 5 mg/500 mg kahdesti vuorokaudessa aamu- ja ilta-aterioiden yhteydessä. Hypoglykemian välttämiseksi GLUCOVANCE 2,50 mg:n aloitusannos ei saa ylittää jo otettuja glyburidin tai metformiinin vuorokausiannoksia. Vuorokausiannosta tulee titrata korkeintaan 5 mg/500 mg:n välein pienimpään tehokkaaseen annokseen, jotta verensokeritaso saadaan hallintaan, tai enimmäisannokseen 20 mg/2000 mg päivässä.
Jos potilaalla on aiemmin hoidettu glyburidin (tai muun sulfonyyliurean) ja metformiinin yhdistelmähoitoa, aloitusannos ei saa ylittää glyburidin (tai vastaavan toisen sulfonyyliurean) ja metformiinin vuorokausiannosta, joka on jo otettu. Potilaita tulee seurata tarkasti hypoglykemian merkkien ja oireiden varalta tällaisen vaihdon jälkeen, ja GLUCOVANCE-annos tulee titrata yllä kuvatulla tavalla, jotta verensokeri saadaan hallintaan.
Tiatsolidiinidionien lisääminen GLUCOVANCE-hoitoon
Jos potilas ei saa riittävästi hallintaa GLUCOVANCE-hoidolla, GLUCOVANCE 400 mg -hoitoon voidaan lisätä tiatsolidiinidioni. Kun tiatsolidiinidioni lisätään GLUCOVANCE-hoitoon, nykyistä GLUCOVANCE 500 mg -annosta voidaan jatkaa ja tiatsolidiinidionin käyttö aloitetaan suositellulla aloitusannoksella. Potilaille, jotka tarvitsevat lisäglukoositason hallintaa, tiatsolidiinidionin annosta voidaan suurentaa sen suositellun titrausaikataulun mukaisesti. GLUCOVANCE-yhdistelmällä ja tiatsolidiinidionilla saavutettava kohonnut glukoositasapaino voi lisätä hypoglykemian mahdollisuutta mihin aikaan päivästä tahansa. Potilailla, joille kehittyy hypoglykemia GLUCOVANCE 5 mg:n ja tiatsolidiinidionin käytön yhteydessä, on harkittava GLUCOVANCE-valmisteen glyburidikomponentin annoksen pienentämistä. Kuten kliinisesti on perusteltua, myös muiden diabeteslääkityksen osien annosten säätämistä tulee harkita.
Potilaat, jotka saavat kolesevelaamia
Kun kolesevelaamia annetaan samanaikaisesti glyburidin kanssa, plasman maksimipitoisuus ja kokonaisaltistus glyburidille vähenevät. Siksi GLUCOVANCE tulee antaa vähintään 4 tuntia ennen kolesevelaamia.
Tietyt potilasryhmät
GLUCOVANCE-valmistetta ei suositella käytettäväksi raskauden aikana. GLUCOVANCE-valmisteen aloitus- ja ylläpitoannostelun tulee olla konservatiivisia iäkkäillä potilailla, koska munuaisten toiminta saattaa heikentyä tässä populaatiossa. Annoksen muuttaminen edellyttää huolellista munuaisten toiminnan arviointia. Yleensä iäkkäitä, vammautuneita ja aliravittuja potilaita ei pidä titrata GLUCOVANCE-annoksen enimmäismäärään hypoglykemiariskin välttämiseksi. Munuaisten toiminnan seuranta on välttämätöntä metformiiniin liittyvän maitohappoasidoosin ehkäisemiseksi erityisesti vanhuksilla. (Katso VAROITUKSET .)
MITEN TOIMITETAAN
GLUCOVANCE® (glyburidi ja metformiini HCl) -tabletit
GLUCOVANCE 1,25 mg/250 mg Tabletti on vaaleankeltainen, kapselin muotoinen, viistoreunainen, kaksoiskupera, kalvopäällysteinen tabletti, jossa on " BMS " toisella puolella kaiverrus ja " 6072 ” kaiverrettu vastakkaiselle puolelle.
GLUCOVANCE 2,5 mg/500 mg tabletti on vaalean oranssi, kapselin muotoinen, viistoreunainen, kaksoiskupera, kalvopäällysteinen tabletti, jossa on " BMS " toisella puolella kaiverrus ja " 6073 ” kaiverrettu vastakkaiselle puolelle.
GLUCOVANCE 5 mg/500 mg Tabletti on keltainen, kapselin muotoinen, viistoreunainen, kaksoiskupera, kalvopäällysteinen tabletti, jossa on " BMS " toisella puolella kaiverrus ja " 6074 ” kaiverrettu vastakkaiselle puolelle.
Varastointi
Säilytä korkeintaan 25°C (77°F) lämpötilassa. [Katso USP-ohjattu huonelämpötila .]
Annostele valonkestävissä astioissa.
Jakelija: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 1158884A7. Tarkastus loka 2013
SIVUVAIKUTUKSET
GLUCOVANCE
Kaksoissokkoutetuissa kliinisissä tutkimuksissa, joissa GLUCOVANCE 2,50 mg aloitti tai toisen linjan hoitona, yhteensä 642 potilasta sai GLUCOVANCE 2,50 mg, 312 sai metformiinihoitoa, 324 sai glyburidihoitoa ja 161 sai lumelääkettä. Taulukossa 6 on GLUCOVANCE- (kaikki vahvuudet) kliinisissä tutkimuksissa raportoitujen tapahtumien ja haittavaikutusten tyypit prosenttiosuus ensihoitona ja toisen linjan hoitona.
Kontrolloidussa kliinisessä tutkimuksessa, jossa rosiglitatsonia ja lumelääkettä yhdistettiin GLUCOVANCE-hoitoa saaneilla potilailla (n=365), 181 potilasta sai GLUCOVANCE-valmistetta 5 mg rosiglitatsonin kanssa ja 184 GLUCOVANCE-valmistetta lumelääkkeen kanssa.
Turvotusta raportoitiin 7,7 %:lla (14/181) rosiglitatsonilla hoidetuista potilaista verrattuna 2,2 %:iin (4/184) lumelääkettä saaneista potilaista. Rosiglitatsonilla hoidetuilla potilailla havaittiin keskimäärin 3 kg:n painonnousu.
Disulfiraamin kaltaisia reaktioita on raportoitu hyvin harvoin potilailla, joita on hoidettu glyburiditableteilla.
Hypoglykemia
GLUCOVANCE 5 mg:n kontrolloiduissa kliinisissä tutkimuksissa ei havaittu hypoglykemiakohtauksia, jotka vaatisivat lääketieteellistä toimenpiteitä ja/tai farmakologista hoitoa. kaikki tapahtumat hoitivat potilaat. Ilmoitettujen hypoglykemiaoireiden (kuten huimaus, vapina, hikoilu ja nälkä) esiintyvyys GLUCOVANCE 2,50 mg:n alkuhoitotutkimuksessa on esitetty taulukossa 7. Hypoglykeemisten oireiden esiintyvyys potilailla, joita hoidettiin GLUCOVANCE 1,25 mg/250 mg:lla oli korkein potilailla, joiden lähtötilanteen HbA1c oli 8 %. Potilailla, joiden lähtötilanteen HbA1c oli 8–11 % ja joita hoidettiin GLUCOVANCE 2,5 mg/500 mg:lla aloitushoitona, hypoglykeemisten oireiden esiintymistiheys oli 30–35 %. Toisen linjan hoitona potilailla, joiden hallinta ei ollut riittävää pelkällä sulfonyyliurealla, noin 6,8 % kaikista GLUCOVANCE 2,50 mg:lla hoidetuista potilaista koki hypoglykeemisiä oireita. Kun rosiglitatsoni lisättiin GLUCOVANCE 2,50 mg -hoitoon, 22 % potilaista ilmoitti yhden tai useamman sormenpään glukoosimittauksen olevan ≤ 50 mg/dl verrattuna 3,3 %:iin lumelääkettä saaneista potilaista. Potilaat hoitivat kaikki hypoglykemiatapahtumat, ja vain yksi potilas keskeytti hoidon hypoglykemian vuoksi. (Katso VAROTOIMENPITEET : Kenraali : Tiatsolidiinidionien lisääminen GLUCOVANCE-hoitoon .)
Ruoansulatuskanavan reaktiot
Ruoansulatuskanavan sivuvaikutusten (ripuli, pahoinvointi/oksentelu ja vatsakipu) esiintyvyys ensimmäisessä hoitotutkimuksessa on esitetty taulukossa 7. Kaikissa GLUCOVANCE 500 mg -tutkimuksissa maha-suolikanavan oireet olivat GLUCOVANCE 400 mg:n yleisimpiä haittavaikutuksia. useammin suuremmilla annoksilla.
Kontrolloiduissa tutkimuksissa
Markkinoille tulon jälkeen saattaa harvoin esiintyä kolestaattista keltaisuutta ja hepatiittia, jotka voivat edetä maksan vajaatoiminnaksi; Jos näin tapahtuu, GLUCOVANCE 5 mg -hoito tulee lopettaa.
HUUMEIDEN VUOROVAIKUTUKSET
GLUCOVANCE
Tietyt lääkkeet aiheuttavat yleensä hyperglykemiaa ja voivat johtaa verensokerin hallinnan menettämiseen. Näitä lääkkeitä ovat tiatsidit ja muut diureetit, kortikosteroidit, fenotiatsiinit, kilpirauhasvalmisteet, estrogeenit, suun kautta otettavat ehkäisyvalmisteet, fenytoiini, nikotiinihappo, sympatomimeetit, kalsiumkanavaa salpaavat lääkkeet ja isoniatsidi. Kun tällaisia lääkkeitä annetaan potilaalle, joka saa GLUCOVANCE 400 mg -valmistetta, potilasta on tarkkailtava tarkasti verensokerin hallinnan heikkenemisen varalta. Kun tällaiset lääkkeet poistetaan GLUCOVANCE-valmistetta saavalta potilaalta, potilasta tulee tarkkailla huolellisesti hypoglykemian varalta. Metformiini sitoutuu vähäisessä määrin plasman proteiineihin, ja siksi sillä on vähemmän todennäköistä yhteisvaikutuksia voimakkaasti proteiineihin sitoutuneiden lääkkeiden, kuten salisylaattien, sulfonamidien, kloramfenikolin ja probenesidin, kanssa verrattuna sulfonyyliureoihin, jotka sitoutuvat laajasti seerumin proteiineihin.
Glyburidi
Tietyt lääkkeet, mukaan lukien ei-steroidiset tulehduskipulääkkeet ja muut voimakkaasti proteiineihin sitoutuvat lääkkeet, salisylaatit, sulfonamidit, kloramfenikoli, probenesidi, kumariinit, monoamiinioksidaasin estäjät ja beetasalpaajat, voivat tehostaa sulfonyyliureoiden hypoglykeemistä vaikutusta. Kun tällaisia lääkkeitä annetaan GLUCOVANCE-hoitoa saavalle potilaalle, potilasta on tarkkailtava huolellisesti hypoglykemian varalta. Kun tällaiset lääkkeet poistetaan potilaalta, joka saa GLUCOVANCE 2,50 mg:aa, potilasta tulee tarkkailla tarkasti verensokerin hallinnan heikkenemisen varalta.
Maksaentsyymien nousun riski havaittiin potilailla, jotka saivat glyburidia samanaikaisesti bosentaanin kanssa. Siksi GLUCOVANCE-valmisteen ja bosentaanin samanaikainen käyttö on vasta-aiheista.
Glyburidin ja siprofloksasiinin, fluorokinoloniantibiootin, välillä on raportoitu mahdollista yhteisvaikutusta, mikä voimistaa glyburidin hypoglykeemistä vaikutusta. Tämän yhteisvaikutuksen mekanismia ei tunneta.
Suun kautta otettavan mikonatsolin ja oraalisten hypoglykeemisten aineiden välillä on raportoitu mahdollista yhteisvaikutusta, joka johtaa vakavaan hypoglykemiaan. Ei tiedetä, esiintyykö tätä yhteisvaikutusta myös suonensisäisten, paikallisesti tai emättimeen annettavien mikonatsolivalmisteiden kanssa.
Kolesevelaami: Kolesevelamin ja glyburidin samanaikainen anto pienensi glyburidin AUC-arvoa 32 % ja Cmax 47 %. Glyburidin AUC:n ja Cmax:n pieneneminen oli 20 % ja Cmax 15 %, kun se annettiin 1 tunti ennen, eivätkä ne muuttuneet merkitsevästi (-7 % ja vastaavasti 4 %), kun se annettiin 4 tuntia ennen kolesevelaamia.
Metformiinihydrokloridi
Furosemidi
Terveillä koehenkilöillä tehdyssä metformiini-furosemidin kerta-annoksen yhteisvaikutustutkimuksessa osoitti, että samanaikainen anto vaikutti molempien yhdisteiden farmakokineettisiin parametreihin. Furosemidi nosti metformiinin plasman ja veren Cmax-arvoa 22 % ja veren AUC:tä 15 % ilman merkittäviä muutoksia metformiinin munuaispuhdistumassa. Metformiinin kanssa annettaessa furosemidin Cmax-arvo oli 31 % ja AUC 12 % pienempi kuin yksinään annettaessa, ja terminaalinen puoliintumisaika lyheni 32 % ilman, että furosemidin munuaispuhdistuma muuttui merkittävästi. Metformiinin ja furosemidin yhteisvaikutuksista kroonisessa yhteiskäytössä ei ole tietoa.
Nifedipiini
Metformiinin ja nifedipiinin kerta-annoksen yhteisvaikutustutkimus normaaleilla terveillä vapaaehtoisilla osoitti, että nifedipiinin samanaikainen anto nosti plasman metformiinin Cmax-arvoa 20 % ja AUC 9 %:lla ja lisäsi virtsaan erittyvää määrää. Tmax ja puoliintumisaika eivät muuttuneet. Nifedipiini näyttää tehostavan metformiinin imeytymistä. Metformiinilla oli minimaaliset vaikutukset nifedipiiniin.
Kationiset lääkkeet
Kationisilla lääkkeillä (esim. amiloridi, digoksiini, morfiini, prokaiiniamidi, kinidiini, kiniini, ranitidiini, triamtereeni, trimetopriimi tai vankomysiini), jotka eliminoituvat munuaisten tubuluserityksen kautta, on teoriassa mahdollisuus yhteisvaikutukseen metformiinin kanssa kilpailemalla yhteisistä munuaisten tubuluskuljetusjärjestelmistä. Tällaista metformiinin ja suun kautta otettavan simetidiinin välistä yhteisvaikutusta on havaittu normaaleilla terveillä vapaaehtoisilla sekä kerta- että usean annoksen metformiinin ja simetidiinin yhteisvaikutustutkimuksissa, jolloin plasman ja kokoveren huippupitoisuudet metformiinissa nousivat 60 % ja plasmassa 40 %. ja kokoveren metformiinin AUC. Eliminaation puoliintumisajassa ei tapahtunut muutoksia kerta-annostutkimuksessa. Metformiinilla ei ollut vaikutusta simetidiinin farmakokinetiikkaan. Vaikka tällaiset yhteisvaikutukset pysyvät teoreettisina (simetidiiniä lukuun ottamatta), potilaan huolellista seurantaa ja GLUCOVANCE- ja/tai häiritsevän lääkkeen annoksen säätämistä suositellaan potilaille, jotka käyttävät kationisia lääkkeitä, jotka erittyvät proksimaalisen munuaistiehyen eritysjärjestelmän kautta.
muu
Terveillä vapaaehtoisilla kerta-annoksen yhteisvaikutustutkimuksissa metformiinin ja propranololin sekä metformiinin ja ibuprofeenin farmakokinetiikka ei muuttunut, kun niitä annettiin samanaikaisesti.
VAROITUKSET
Metformiinihydrokloridi
Maitohappoasidoosi
Maitohappoasidoosi on harvinainen, mutta vakava metabolinen komplikaatio, joka voi johtua metformiinin kertymisestä GLUCOVANCE (Glyburide and Metformin HCl) -tablettien aikana. kun se tapahtuu, se on tappava noin 50 prosentissa tapauksista. Maitohappoasidoosia voi esiintyä myös useiden patofysiologisten tilojen, mukaan lukien diabetes mellituksen, yhteydessä ja aina, kun kudosten hypoperfuusio ja hypoksemia on merkittävää. Maitohappoasidoosille on tunnusomaista kohonneet veren laktaattipitoisuudet (> 5 mmol/L), alentunut veren pH, elektrolyyttihäiriöt, joihin liittyy suurentunut anioniväli, ja kohonnut laktaatti/pyruvaatti-suhde. Kun metformiinia pidetään maitohappoasidoosin aiheuttajana, plasman metformiinipitoisuudet ovat yleensä > 5 µg/ml.
Raportoitu maitohappoasidoosin ilmaantuvuus metformiinihydrokloridia saavilla potilailla on erittäin alhainen (noin 0,03 tapausta / 1000 potilasvuotta ja noin 0,015 kuolemaan johtanutta tapausta / 1000 potilasvuotta). Yli 20 000 potilasvuotta kestäneen altistuksen aikana metformiinille kliinisissä tutkimuksissa ei raportoitu maitohappoasidoosia. Raportoituja tapauksia on esiintynyt pääasiassa diabeetikoilla, joilla on merkittävä munuaisten vajaatoiminta, mukaan lukien sekä luontainen munuaissairaus että munuaisten hypoperfuusio, usein useiden samanaikaisten lääketieteellisten/kirurgisten ongelmien ja useiden samanaikaisten lääkkeiden taustalla. Potilailla, joilla on kongestiivista sydämen vajaatoimintaa, joka vaatii farmakologista hoitoa, erityisesti potilailla, joilla on epästabiili tai akuutti sydämen vajaatoiminta ja joilla on hypoperfuusion ja hypoksemian riski, on lisääntynyt maitohappoasidoosin riski. Maitohappoasidoosin riski kasvaa munuaisten vajaatoiminnan asteen ja potilaan iän myötä. Maitohappoasidoosin riskiä voidaan siksi pienentää merkittävästi seuraamalla säännöllisesti metformiinia käyttävien potilaiden munuaisten toimintaa ja käyttämällä pienintä tehokasta metformiiniannosta. Erityisesti iäkkäiden hoitoon tulee liittää munuaisten toiminnan huolellinen seuranta. GLUCOVANCE 2,50 mg -hoitoa ei tule aloittaa ≥ 80-vuotiaille potilaille, ellei kreatiniinipuhdistuman mittaukset osoita, että munuaisten toiminta ei ole heikentynyt, koska nämä potilaat ovat herkempiä sairastumaan maitohappoasidoosiin. Lisäksi GLUCOVANCE-hoito tulee keskeyttää välittömästi, jos sinulla on hypoksemiaan, kuivumiseen tai sepsikseen liittyvä tila. Koska maksan vajaatoiminta saattaa merkittävästi rajoittaa laktaatin poistumiskykyä, GLUCOVANCE-valmistetta tulee yleensä välttää potilailla, joilla on kliinisiä tai laboratoriotutkimuksia maksasairauksista. Potilaita tulee varoittaa liiallisesta alkoholinkäytöstä, joko akuutista tai kroonisesta, GLUCOVANCE 2,50 mg:n käytön aikana, koska alkoholi voimistaa metformiinihydrokloridin vaikutuksia laktaattiaineenvaihduntaan. Lisäksi GLUCOVANCE 5 mg:n käyttö tulee väliaikaisesti keskeyttää ennen intravaskulaarista radiokontrastitutkimusta ja leikkaustoimenpiteitä (ks. myös VAROTOIMET).
Maitohappoasidoosin puhkeaminen on usein hienovaraista, ja siihen liittyy vain epäspesifisiä oireita, kuten huonovointisuutta, lihaskipuja, hengitysvaikeutta, lisääntyvää uneliaisuutta ja epäspesifistä vatsavaivoja. Siihen voi liittyä hypotermiaa, hypotensiota ja resistenttejä bradyarytmioita, joihin liittyy voimakkaampi asidoosi. Potilaan ja potilaan lääkärin on oltava tietoisia tällaisten oireiden mahdollisesta tärkeydestä ja potilasta tulee neuvoa ilmoittamaan välittömästi lääkärille, jos niitä ilmaantuu (ks. myös VAROTOIMET). GLUCOVANCE 500mg on keskeytettävä, kunnes tilanne on selvitetty. Seerumin elektrolyytit, ketonit, veren glukoosi ja tarvittaessa veren pH, laktaattitasot ja jopa veren metformiinitasot voivat olla hyödyllisiä. Kun potilas on stabiloitunut millä tahansa GLUCOVANCE-annoksella, ruoansulatuskanavan oireet, jotka ovat yleisiä metformiinihoidon alussa, eivät todennäköisesti liity lääkkeeseen. Myöhemmin maha-suolikanavan oireet voivat johtua maitohappoasidoosista tai muusta vakavasta sairaudesta.
Plasman paastolaskimolaktaattitasot yli normaalin ylärajan mutta alle 5 mmol/l GLUCOVANCE-hoitoa saavilla potilailla eivät välttämättä tarkoita uhkaavaa maitohappoasidoosia, ja ne voivat olla selitettävissä muilla mekanismeilla, kuten huonosti hallinnassa olevalla diabeteksella tai liikalihavuudella, voimakkaalla fyysisellä aktiivisuudella, tai teknisiä ongelmia runsaassa käsittelyssä. (Katso myös VAROTOIMET.)
Maitohappoasidoosia tulee epäillä kaikilla diabeetikoilla, joilla on metabolinen asidoosi ja joilta puuttuu merkkejä ketoasidoosista (ketonuria ja ketonemia).
Maitohappoasidoosi on lääketieteellinen hätätilanne, joka on hoidettava sairaalassa. Maitohappoasidoosipotilaalla, joka käyttää GLUCOVANCE 500 mg -valmistetta, lääkkeen käyttö on lopetettava välittömästi ja yleiset tukitoimenpiteet aloitettava välittömästi. Koska metformiinihydrokloridi on dialysoitavissa (puhdistuma on jopa 170 ml/min hyvissä hemodynaamisissa olosuhteissa), nopeaa hemodialyysiä suositellaan asidoosin korjaamiseksi ja kerääntyneen metformiinin poistamiseksi. Tällainen hoito johtaa usein oireiden nopeaan palautumiseen ja paranemiseen. (Katso myös VASTA-AIHEET ja VAROTOIMET.)
ERITYISVAROITUS KOHOAN SYDÄN-VERENISYNTIKUOLLEISUUDEN RISKISTA
Oraalisten hypoglykeemisten lääkkeiden antamisen on raportoitu liittyvän lisääntyneeseen kardiovaskulaariseen kuolleisuuteen verrattuna hoitoon pelkällä ruokavaliolla tai ruokavaliolla ja insuliinilla. Tämä varoitus perustuu University Group Diabetes Programin (UGDP) tutkimukseen, joka on pitkäaikainen prospektiivinen kliininen tutkimus, jonka tarkoituksena on arvioida glukoosia alentavien lääkkeiden tehokkuutta verisuonikomplikaatioiden ehkäisyssä tai viivästymisessä potilailla, joilla on insuliinista riippumaton diabetes. Tutkimukseen osallistui 823 potilasta, jotka jaettiin satunnaisesti yhteen neljästä hoitoryhmästä (Diabetes 19 (Suppl. 2): 747-830, 1970).
UGDP raportoi, että potilailla, joita hoidettiin 5–8 vuoden ajan ruokavaliolla ja kiinteällä tolbutamidiannoksella (1,5 g päivässä), kardiovaskulaarinen kuolleisuusaste oli noin 2½ kertaa suurempi kuin pelkällä ruokavaliolla hoidetuilla potilailla. Merkittävää lisääntymistä kokonaiskuolleisuudessa ei havaittu, mutta tolbutamidin käyttö lopetettiin sydän- ja verisuoniperäisen kuolleisuuden lisääntymisen vuoksi, mikä rajoitti tutkimuksen mahdollisuutta osoittaa kokonaiskuolleisuuden lisääntyminen. Huolimatta näiden tulosten tulkintaa koskevasta kiistasta, UGDP-tutkimuksen tulokset tarjoavat riittävän perustan tälle varoitukselle. Potilaalle tulee kertoa glyburidin mahdollisista riskeistä ja hyödyistä sekä vaihtoehtoisista hoitomuodoista.
Vaikka tähän tutkimukseen sisältyi vain yksi sulfonyyliurea-luokan lääke (tolbutamidi), on turvallisuuden kannalta järkevää ottaa huomioon, että tämä varoitus voi koskea myös muita tämän luokan hypoglykeemisiä lääkkeitä, koska niiden vaikutustapa on hyvin samankaltainen. ja kemiallinen rakenne.
VAROTOIMENPITEET
Kenraali
Makrovaskulaariset tulokset
Ei ole tehty kliinisiä tutkimuksia, jotka osoittaisivat lopullista näyttöä makrovaskulaarisen riskin vähentämisestä GLUCOVANCE 5 mg:n tai minkä tahansa muun diabeteslääkkeen käytön yhteydessä.
GLUCOVANCE
Hypoglykemia
GLUCOVANCE 400 mg voi aiheuttaa hypoglykemiaa tai hypoglykemian oireita, joten oikea potilaan valinta, annostelu ja ohjeet ovat tärkeitä mahdollisten hypoglykeemisten jaksojen välttämiseksi. Hypoglykemian riski kasvaa, kun kalorien saanti on puutteellista, kun raskasta harjoittelua ei kompensoida kalorilisällä tai kun sitä käytetään samanaikaisesti muiden glukoosia alentavien aineiden tai etanolin kanssa. Munuaisten tai maksan vajaatoiminta voi aiheuttaa sekä glyburidin että metformiinihydrokloridin kohonneita lääkepitoisuuksia, ja maksan vajaatoiminta voi myös heikentää glukoneogeenistä kapasiteettia, mikä lisää hypoglykeemisten reaktioiden riskiä. Iäkkäät, heikentyneet tai aliravitut potilaat sekä lisämunuaisen tai aivolisäkkeen vajaatoimintaa sairastavat tai alkoholimyrkytykset ovat erityisen herkkiä hypoglykeemisille vaikutuksille. Hypoglykemiaa voi olla vaikea tunnistaa vanhuksilla ja ihmisillä, jotka käyttävät beetasalpaavia lääkkeitä.
Glyburidi
Hemolyyttinen anemia
Potilaiden, joilla on glukoosi-6-fosfaattidehydrogenaasin (G6PD) puutos, hoito sulfonyyliurea-aineilla voi johtaa hemolyyttiseen anemiaan. Koska GLUCOVANCE 400 mg kuuluu sulfonyyliurealääkkeiden luokkaan, varovaisuutta on noudatettava potilailla, joilla on G6PD-puutos, ja harkittava vaihtoehtoa, joka ei ole sulfonyyliurea. Markkinoille tulon jälkeisissä raporteissa hemolyyttistä anemiaa on raportoitu myös potilailla, joilla ei ollut tiedossa G6PD-puutostilaa.
Metformiinihydrokloridi
Munuaisten toiminnan seuranta
Metformiinin tiedetään erittyvän pääosin munuaisten kautta, ja metformiinin kertymisen ja maitohappoasidoosin riski kasvaa munuaisten toiminnan heikkenemisen myötä. Siten potilaiden, joiden seerumin kreatiniiniarvot ylittävät ikänsä normaalin ylärajan, ei pidä saada GLUCOVANCE-valmistetta. Ikääntyneiden potilaiden GLUCOVANCE 400 mg -annos tulee titrata huolellisesti vähimmäisannoksen määrittämiseksi riittävän glykeemisen vaikutuksen saavuttamiseksi, koska ikääntyminen liittyy heikentyneeseen munuaisten toimintaan. Iäkkäillä potilailla, erityisesti ≥ 80-vuotiailla potilailla, munuaisten toimintaa tulee seurata säännöllisesti, eikä GLUCOVANCE 2,50 mg:n annosta yleensä tulisi titrata enimmäisannokseen (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ). Ennen GLUCOVANCE 2,50 mg -hoidon aloittamista ja vähintään vuosittain sen jälkeen munuaisten toiminta tulee arvioida ja varmistaa normaalisti. Potilailla, joilla on odotettavissa munuaisten vajaatoimintaa, munuaisten toiminta on arvioitava useammin ja GLUCOVANCE-hoito keskeytettävä, jos on näyttöä munuaisten vajaatoiminnasta.
Samanaikaisten lääkkeiden käyttö, jotka voivat vaikuttaa munuaisten toimintaan tai metformiiniin
Samanaikaiset lääkkeet, jotka voivat vaikuttaa munuaisten toimintaan tai aiheuttaa merkittäviä hemodynaamisia muutoksia tai häiritä metformiinin jakautumista, kuten kationiset lääkkeet, jotka eliminoituvat munuaisten tubuluserityksen kautta (ks. HUUMEIDEN VUOROVAIKUTUKSET ), tulee käyttää varoen.
Radiologiset tutkimukset, joissa käytetään intravaskulaarisia jodattuja varjoaineita (esim. suonensisäinen urogrammi, suonensisäinen kolangiografia, angiografia ja tietokonetomografia (CT) verisuonensisäisillä varjoaineilla)
Suonensisäiset kontrastitutkimukset jodatuilla materiaaleilla voivat aiheuttaa akuutteja muutoksia munuaisten toiminnassa ja niihin on liittynyt maitohappoasidoosia metformiinia saavilla potilailla (ks. VASTA-AIHEET ). Siksi potilailla, joille suunnitellaan tällaista tutkimusta, GLUCOVANCE 400 mg -annos tulee keskeyttää väliaikaisesti toimenpiteen aikana tai ennen sitä, lopettaa 48 tunnin ajan toimenpiteen jälkeen ja aloittaa uudelleen vasta, kun munuaisten toiminta on arvioitu uudelleen ja todettu normaali.
Hypoksiset valtiot
Sydän- ja verisuonitauti (sokki) mistä tahansa syystä, akuutti kongestiivinen sydämen vajaatoiminta, akuutti sydäninfarkti ja muut tilat, joille on ominaista hypoksemia, on liitetty maitohappoasidoosiin ja voivat myös aiheuttaa prerenaalista atsotemiaa. Kun tällaisia tapahtumia ilmenee potilailla, jotka saavat GLUCOVANCE 2,50 mg -hoitoa, lääkkeen käyttö on lopetettava välittömästi.
Kirurgiset toimenpiteet
GLUCOVANCE 400 mg -hoito on keskeytettävä tilapäisesti minkä tahansa kirurgisen toimenpiteen ajaksi (lukuun ottamatta pieniä toimenpiteitä, joihin ei liity rajoitettua ruoan ja nesteiden saantia), eikä sitä saa aloittaa uudelleen ennen kuin potilaan ottaminen suun kautta on jatkunut ja munuaisten toiminta on arvioitu normaaliksi.
Alkoholin saanti
Alkoholin tiedetään voimistavan metformiinin vaikutusta laktaattiaineenvaihduntaan. Potilaita tulee siksi varoittaa liiallisesta alkoholinkäytöstä, akuutista tai kroonisesta, GLUCOVANCE-hoidon aikana. Koska alkoholi vaikuttaa maksan glukoneogeeniseen kapasiteettiin, se voi myös lisätä hypoglykemian riskiä.
Maksan vajaatoiminta
Koska maksan vajaatoiminta on liittynyt joihinkin maitohappoasidoositapauksiin, GLUCOVANCE 500 mg:n käyttöä tulee yleensä välttää potilailla, joilla on kliinisiä tai laboratoriotutkimuksia maksasairauksia.
B12-vitamiinin tasot
29 viikkoa kestäneissä kontrolloiduissa kliinisissä tutkimuksissa metformiinilla noin 7 %:lla potilaista havaittiin seerumin B12-vitamiinipitoisuuden alenemista normaalia pienemmiksi ilman kliinisiä oireita. Tällainen väheneminen, joka saattaa johtua B12:n imeytymisen häiriintymisestä B12:n luontaisen tekijän kompleksista, liittyy kuitenkin hyvin harvoin anemiaan ja näyttää korjaantuvan nopeasti, kun metformiinin tai B-vitamiinilisän käyttö lopetetaan. Hematologisten parametrien mittaamista vuosittain suositellaan metformiinia saaville potilaille, ja kaikki ilmeiset poikkeavuudet tulee tutkia ja hoitaa asianmukaisesti (ks. VAROTOIMENPITEET : Laboratoriotestit ).
Tietyt henkilöt (jotka eivät saa riittävästi B12-vitamiinia tai kalsiumia tai imeytyvät) näyttävät olevan alttiita kehittymään normaalia pienemmille B12-vitamiinitasoille. Näillä potilailla rutiininomaiset seerumin B12-vitamiinimittaukset 2–3 vuoden välein voivat olla hyödyllisiä.
Muutos aiemmin hallinnassa olevaa tyypin 2 diabetesta sairastavien potilaiden kliinisessä tilassa
Tyypin 2 diabetesta sairastava potilas, joka on ollut aiemmin hyvin hallinnassa metformiinilla ja jolla on poikkeavuuksia laboratorioarvoista tai kliininen sairaus (erityisesti epämääräinen ja huonosti määritelty sairaus), on tutkittava viipymättä ketoasidoosin tai maitohappoasidoosin varalta. Arviointiin tulee sisältyä seerumin elektrolyytit ja ketonit, veren glukoosi ja tarvittaessa veren pH, laktaatti-, pyruvaatti- ja metformiinitasot. Jos jompikumpi asidoosimuoto ilmaantuu, GLUCOVANCE on lopetettava välittömästi ja aloitettava muut asianmukaiset korjaavat toimenpiteet (katso myös VAROITUKSET ).
Tiatsolidiinidionien lisääminen GLUCOVANCE 500 mg -hoitoon
Hypoglykemia
Potilailla, jotka saavat GLUCOVANCE 2,50 mg:aa yhdessä tiatsolidiinidionin kanssa, saattaa olla hypoglykemian riski.
Painonnousu
Painon nousua havaittiin, kun rosiglitatsonia lisättiin GLUCOVANCE 5 mg:aan, samanlaista kuin pelkän tiatsolidiinidionihoidon yhteydessä.
Maksavaikutukset
Kun tiatsolidiinidionia käytetään yhdessä GLUCOVANCE 2,50 mg:n kanssa, maksan toimintakokeita tulee seurata säännöllisesti tiatsolidiinidionille annettujen suositusten mukaisesti.
Tietoja potilaille
GLUCOVANCE
Potilaille tulee kertoa GLUCOVANCE 500 mg:n ja vaihtoehtoisten hoitomuotojen mahdollisista riskeistä ja hyödyistä. Heille olisi myös kerrottava ruokavalio-ohjeiden noudattamisen tärkeydestä. säännöllinen harjoitusohjelma; ja verensokerin, glykosyloidun hemoglobiinin, munuaisten toiminnan ja hematologisten parametrien säännöllinen testaus.
Potilaille on selitettävä metformiinihoitoon liittyvät maitohappoasidoosin riskit, sen oireet ja sen kehittymiselle altistavat tilat, kuten VAROITUKSET ja VAROTOIMET osioissa mainitaan. Potilaita tulee neuvoa lopettamaan GLUCOVANCE-hoito välittömästi ja ilmoittamaan välittömästi terveydenhuollon ammattilaiselle, jos ilmaantuu selittämätöntä hyperventilaatiota, lihaskipua, huonovointisuutta, epätavallista uneliaisuutta tai muita epäspesifisiä oireita. Kun potilas on vakiintunut millä tahansa GLUCOVANCE-annoksella, ruoansulatuskanavan oireet, jotka ovat yleisiä metformiinihoidon alussa, eivät todennäköisesti liity lääkkeeseen. Myöhemmin maha-suolikanavan oireet voivat johtua maitohappoasidoosista tai muusta vakavasta sairaudesta.
Potilaille ja vastuullisille perheenjäsenille tulee selittää hypoglykemian riskit, sen oireet ja hoito sekä sen kehittymiselle altistavat sairaudet.
Potilaita tulee neuvoa välttämään liiallista alkoholinkäyttöä, joko akuuttia tai kroonista, GLUCOVANCE-hoidon aikana. (Katso POTILASTIEDOT painettu alla.)
Laboratoriotestit
Terapeuttisen vasteen seuraamiseksi tulee suorittaa säännöllisiä paastoverenglukoosi- (FBG) ja HbA1c-mittauksia.
Hematologisten parametrien (esim. hemoglobiini/hematokriitti ja punasoluindeksit) ja munuaisten toiminnan (seerumin kreatiniini) ensimmäinen ja säännöllinen seuranta tulee suorittaa vähintään kerran vuodessa. Megaloblastista anemiaa on harvoin havaittu metformiinihoidon yhteydessä, mutta jos sitä epäillään, B12-vitamiinin puutos tulee sulkea pois.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Yhdistetyillä GLUCOVANCE-valmisteilla ei ole tehty eläinkokeita. Seuraavat tiedot perustuvat yksittäisillä tuotteilla tehtyjen tutkimusten tuloksiin.
Glyburidi
Rotilla tehdyt tutkimukset pelkällä glyburidilla annoksilla 300 mg/kg/vrk asti (noin 145 kertaa GLUCOVANCE 5 mg:n glyburidikomponentin suurin suositeltu päivittäinen [MRHD] annos 20 mg kehon pinta-alavertailujen perusteella) paljastivat 18 kuukauden ajan. ei syöpää aiheuttavia vaikutuksia. Kaksivuotisessa glyburidin onkogeenisuustutkimuksessa hiirillä ei ollut näyttöä hoitoon liittyvistä kasvaimista.
Seuraavissa in vitro -testeissä ei havaittu näyttöä pelkästään glyburidin mutageenisesta potentiaalista: Salmonella-mikrosomitesti (Ames-testi) ja DNA-vaurio/emäksinen eluutiomääritys.
Metformiinihydrokloridi
Pitkäaikaiset karsinogeenisuustutkimukset suoritettiin metformiinilla yksinään rotilla (annostuksen kesto 104 viikkoa) ja hiirillä (annostuksen kesto 91 viikkoa) annoksilla 900 mg/kg/vrk mukaan lukien ja vastaavasti 1500 mg/kg/vrk. Nämä annokset ovat molemmat noin 4 kertaa 2000 mg:n MRHD-annos GLUCOVANCE 400 mg:n metformiinikomponentista kehon pinta-alavertailujen perusteella. Pelkän metformiinin karsinogeenisuudesta ei löydetty näyttöä uros- tai naarashiirillä. Samalla tavoin ei havaittu kasvaimia aiheuttavaa potentiaalia pelkällä metformiinilla urosrotilla. Hyvänlaatuisten kohdun stroomapolyyppien ilmaantuvuus kuitenkin lisääntyi naarasrotilla, joita hoidettiin pelkällä metformiinilla 900 mg/kg/vrk.
Pelkän metformiinin mutageenisuudesta ei löytynyt näyttöä seuraavissa in vitro -testeissä: Ames-testi (S. typhimurium), geenimutaatiotesti (hiiren lymfoomasolut) tai kromosomipoikkeavuustesti (ihmisen lymfosyytit). Tulokset in vivo hiiren mikrotumatestissä olivat myös negatiivisia.
Pelkästään metformiini ei vaikuttanut uros- tai naarasrottien hedelmällisyyteen, kun metformiinia annettiin jopa 600 mg/kg/vrk, mikä on noin 3 kertaa suurempi kuin GLUCOVANCE 400 mg:n metformiinikomponentin MRHD-annos kehon pinta-alavertailujen perusteella.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka B
Viimeaikaiset tiedot viittaavat vahvasti siihen, että epänormaalit verensokeritasot raskauden aikana liittyvät lisääntyneeseen synnynnäisten epämuodostumien ilmaantumiseen. Useimmat asiantuntijat suosittelevat insuliinin käyttöä raskauden aikana, jotta verensokeri pysyy mahdollisimman lähellä normaalia. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, GLUCOVANCE 400 mg:aa ei tule käyttää raskauden aikana, ellei se ole selvästi tarpeen. (Katso alempaa.)

Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla GLUCOVANCE-valmisteella tai sen yksittäisillä aineilla. Yhdistetyillä GLUCOVANCE-valmisteilla ei ole tehty eläinkokeita. Seuraavat tiedot perustuvat yksittäisillä tuotteilla tehtyjen tutkimusten tuloksiin.
Glyburidi
Lisääntymistutkimuksia suoritettiin rotilla ja kaniineilla annoksilla, jotka olivat jopa 500-kertaisia GLUCOVANCE 500 mg:n glyburidikomponentin MRHD-annoksen 20 mg:n annoksilla kehon pinta-alavertailujen perusteella, eikä niissä havaittu näyttöä glyburidin aiheuttamasta hedelmällisyyden heikkenemisestä tai sikiölle aiheutuneesta haitasta.
Metformiinihydrokloridi
Pelkästään metformiini ei ollut teratogeeninen rotilla tai kaniineilla annoksilla 600 mg/kg/vrk asti. Tämä vastaa noin 2- ja 6-kertaista altistusta GLUCOVANCE 500 mg:n metformiinikomponentin 2000 mg:n MRHD-annokseen verrattuna rottien ja kanien ruumiinpinta-alan vertailuihin, vastaavasti. Sikiön pitoisuuksien määrittäminen osoitti osittaisen istukan esteen metformiinille.
Ei-teratogeeniset vaikutukset
Pitkittynyttä vaikeaa hypoglykemiaa (4–10 päivää) on raportoitu vastasyntyneillä, joiden äidit saivat sulfonyyliurealääkettä synnytyksen aikana. Tätä on raportoitu useammin käytettäessä aineita, joilla on pidentynyt puoliintumisaika. GLUCOVANCE 400 mg:n käyttöä raskauden aikana ei suositella. Jos sitä kuitenkin käytetään, GLUCOVANCE-hoito tulee lopettaa vähintään 2 viikkoa ennen arvioitua toimituspäivää. (Katso Raskaus : Teratogeeniset vaikutukset : Raskausluokka B .)
Imettävät äidit
Vaikka ei tiedetä, erittyykö glyburidi äidinmaitoon, joidenkin sulfonyyliurealääkkeiden tiedetään erittyvän äidinmaitoon. Imettävillä rotilla tehdyt tutkimukset osoittavat, että metformiini erittyy maitoon ja saavuttaa vastaavat pitoisuudet kuin plasmassa. Vastaavia tutkimuksia ei ole tehty imettävillä äideillä. Koska imeväisillä saattaa olla hypoglykemian mahdollisuus, on tehtävä päätös, lopetetaanko imettäminen vai GLUCOVANCE-hoito ottaen huomioon lääkkeen merkitys äidille. Jos GLUCOVANCE-hoito lopetetaan ja jos ruokavalio yksinään ei riitä verensokerin hallintaan, insuliinihoitoa tulee harkita.
Käyttö lapsille
GLUCOVANCE 500 mg:n turvallisuutta ja tehoa arvioitiin aktiivisesti kontrolloidussa kaksoissokkoutetussa 26 viikkoa kestäneessä satunnaistetussa tutkimuksessa, johon osallistui yhteensä 167 tyypin 2 diabetesta sairastavaa lapsipotilasta (9–16-vuotiaat). GLUCOVANCE 500 mg:n ei osoitettu tilastollisesti olevan parempi kuin metformiini tai glyburidi HbA1c-arvon alentamisessa lähtötasosta (ks. taulukko 5). Tässä tutkimuksessa GLUCOVANCE 2,50 mg:n käyttöön ei liittynyt odottamattomia turvallisuushavaintoja.
Geriatrinen käyttö
Kliinisissä kaksoissokkotutkimuksissa GLUCOVANCE-valmistetta saaneista 642 potilaasta 23,8 % oli 65-vuotiaita tai vanhempia ja 2,8 % 75-vuotiaita tai vanhempia. Niistä 1 302 potilaasta, jotka saivat GLUCOVANCE 500 mg avoimissa kliinisissä tutkimuksissa, 20,7 % oli 65-vuotiaita tai vanhempia ja 2,5 % 75-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja tehokkuudessa tai turvallisuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteessa, mutta joidenkin vanhempien potilaiden suurempaa herkkyyttä ei voida sulkea pois.
Metformiinihydrokloridin tiedetään erittyvän pääosin munuaisten kautta, ja koska lääkkeen aiheuttamien vakavien haittavaikutusten riski on suurempi potilailla, joilla on heikentynyt munuaisten toiminta, GLUCOVANCE 500 mg -valmistetta tulee käyttää vain potilaille, joiden munuaisten toiminta on normaali (ks. VASTA-AIHEET , VAROITUKSET , ja KLIININEN FARMAKOLOGIA : Farmakokinetiikka ). Koska ikääntyminen liittyy heikentyneeseen munuaisten toimintaan, GLUCOVANCE 5 mg:aa tulee käyttää varoen iän kasvaessa. Annoksen valinnassa on oltava varovainen, ja sen tulee perustua huolelliseen ja säännölliseen munuaisten toiminnan seurantaan. Yleensä iäkkäitä potilaita ei pidä titrata GLUCOVANCE-valmisteen enimmäisannosta (katso myös VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ).
YLIANNOSTUS
Glyburidi
Sulfonyyliureoiden, mukaan lukien glyburiditabletit, yliannostus voi aiheuttaa hypoglykemian. Lieviä hypoglykeemisiä oireita, ilman tajunnan menetystä tai neurologisia löydöksiä, tulee hoitaa aggressiivisesti suun kautta otettavalla glukoosilla ja lääkkeen annostuksen ja/tai ruokailun muutoksilla. Tarkkaa seurantaa tulee jatkaa, kunnes lääkäri on varma, että potilas on poissa vaarasta. Vakavia hypoglykeemisiä reaktioita, joihin liittyy kooma, kouristuksia tai muu neurologinen häiriö, esiintyy harvoin, mutta ne ovat lääketieteellisiä hätätilanteita, jotka vaativat välitöntä sairaalahoitoa. Jos hypoglykeeminen kooma diagnosoidaan tai sitä epäillään, potilaalle tulee antaa nopea suonensisäinen injektio tiivistettyä (50 %) glukoosiliuosta. Tämän jälkeen tulee antaa jatkuva infuusio laimeampaa (10 %) glukoosiliuosta nopeudella, joka pitää verensokerin yli 100 mg/dl. Potilaita tulee seurata tarkasti vähintään 24–48 tunnin ajan, koska hypoglykemia voi uusiutua ilmeisen kliinisen toipumisen jälkeen.
Metformiinihydrokloridi
Metformiinihydrokloridin yliannostusta on esiintynyt, mukaan lukien yli 50 g:n annosten nauttiminen. Hypoglykemiaa raportoitiin noin 10 %:ssa tapauksista, mutta syy-yhteyttä metformiinihydrokloridin kanssa ei ole osoitettu. Maitohappoasidoosia on raportoitu noin 32 %:lla metformiinin yliannostustapauksista (ks VAROITUKSET ). Metformiini on dialysoitavissa, ja sen puhdistuma on jopa 170 ml/min hyvissä hemodynaamisissa olosuhteissa. Siksi hemodialyysi voi olla hyödyllinen poistamaan kerääntynyttä lääkettä potilailta, joilla epäillään metformiinin yliannostusta.
VASTA-AIHEET
GLUCOVANCE 2,50 mg on vasta-aiheinen potilailla, joilla on:
GLUCOVANCE 500 mg -valmisteen käyttö tulee väliaikaisesti lopettaa potilailla, joille tehdään radiologisia tutkimuksia, joihin kuuluu jodattujen varjoaineiden intravaskulaarinen annostelu, koska tällaisten valmisteiden käyttö voi aiheuttaa akuutteja muutoksia munuaisten toiminnassa. (Katso myös VAROTOIMENPITEET .)
KLIININEN FARMAKOLOGIA
Toimintamekanismi
GLUCOVANCE yhdistää glyburidin ja metformiinihydrokloridin, 2 antihyperglykeemistä ainetta, joilla on toisiaan täydentäviä vaikutusmekanismeja, parantaakseen tyypin 2 diabetespotilaiden glukoositasapainoa.
Glyburidi näyttää alentavan verensokeria akuutisti stimuloimalla insuliinin vapautumista haimasta. Tämä vaikutus riippuu toimivista beetasoluista haiman saarekkeissa. Mekanismia, jolla glyburidi alentaa verensokeria pitkäaikaisen annon aikana, ei ole selkeästi osoitettu. Kroonisessa käytössä tyypin 2 diabetesta sairastaville potilaille verensokeria alentava vaikutus säilyy huolimatta lääkkeen insuliinin eritysvasteen asteittaisesta heikkenemisestä. Haiman ulkopuoliset vaikutukset voivat olla osallisena suun kautta otettavien sulfonyyliurean hypoglykeemisten lääkkeiden vaikutusmekanismissa.
Metformiinihydrokloridi on verensokeria alentava lääke, joka parantaa tyypin 2 diabetespotilaiden glukoosinsietokykyä ja alentaa plasman perus- ja aterianjälkeistä glukoosia. Metformiinihydrokloridi vähentää maksan glukoosin tuotantoa, vähentää glukoosin imeytymistä suolistosta ja parantaa insuliiniherkkyyttä lisäämällä perifeeristä glukoosin ottoa ja käyttöä.
Farmakokinetiikka
Imeytyminen ja biologinen hyötyosuus
GLUCOVANCE
GLUCOVANCE 2,5 mg/500 mg:n ja 5 mg/500 mg:n biologista hyötyosuutta koskevissa tutkimuksissa glyburidikomponentin plasmapitoisuus-aikakäyrän (AUC) keskimääräinen pinta-ala oli 18 % ja 7 % suurempi kuin Micronase®:n. glyburidin merkki, jota annetaan yhdessä metformiinin kanssa. Siksi GLUCOVANCE-valmisteen glyburidikomponentti ei ole bioekvivalentti Micronase®:n kanssa. GLUCOVANCE 400 mg:n metformiinikomponentti on bioekvivalentti metformiinin kanssa, jota annetaan yhdessä glyburidin kanssa.
Kun yksi GLUCOVANCE 5 mg/500 mg tabletti annettiin ruoan kanssa joko 20 % glukoosiliuoksen tai 20 % glukoosiliuoksen kanssa, ruualla ei ollut vaikutusta Cmax:iin ja ruoan vaikutus glyburidin AUC-arvoon oli suhteellisen pieni. komponentti. Glyburidikomponentin Tmax-arvo lyheni 7,5 tunnista 2,75 tuntiin ruoan kanssa verrattuna samaan tablettivahvuuteen, joka annettiin paastossa 20-prosenttisella glukoosiliuoksella. Glyburidin aikaisemman Tmax-arvon kliinistä merkitystä ruokailun jälkeen ei tunneta. Ruoan vaikutus metformiinikomponentin farmakokinetiikkaan oli määrittelemätön.
Glyburidi
Micronase®-tableteilla tehdyt kerta-annostutkimukset normaaleilla koehenkilöillä osoittavat glyburidin merkittävän imeytymisen 1 tunnin sisällä, lääkeainehuipun noin 4 tunnissa ja alhaiset, mutta havaittavissa olevat tasot 24 tunnin kuluttua. Glyburidin keskimääräiset seerumipitoisuudet, kuten seerumin pitoisuus-aikakäyrän alla näkyvät alueet, kasvavat suhteessa vastaaviin annoksen lisäyksiin. Bioekvivalenssia GLUCOVANCE 500 mg:n ja yhden ainesosan glyburidituotteiden välillä ei ole vahvistettu.
Metformiinihydrokloridi
Paasto-olosuhteissa annetun 500 mg:n metformiinihydrokloriditabletin absoluuttinen hyötyosuus on noin 50–60 %. Tutkimukset, joissa käytettiin 500 mg:n ja 1500 mg:n metformiinitablettien oraalisia kerta-annoksia ja 850–2550 mg:aa, osoittavat, että annoksen suhteellisuus ei ole annoksen kasvaessa, mikä johtuu pikemminkin vähentyneestä imeytymisestä kuin muutoksesta eliminaatiossa. Ruoka vähentää metformiinin imeytymistä ja hidastaa sitä hieman, mikä näkyy noin 40 % alhaisemmalla huippupitoisuudella ja 25 % pienemmällä AUC:lla plasmassa ja 35 minuutin pidentyneenä aika plasman huippupitoisuuden saavuttamiseen kerta-annoksen 850 mg annon jälkeen. metformiinitabletti ruuan kanssa verrattuna samaan tabletin vahvuuteen paastohoitona. Näiden laskujen kliinistä merkitystä ei tunneta.
Jakelu
Glyburidi
Sulfonyyliurealääkkeet sitoutuvat laajasti seerumin proteiineihin. Muiden lääkkeiden aiheuttama syrjäytyminen proteiineja sitovista kohdista voi johtaa hypoglykeemisen vaikutuksen lisääntymiseen. In vitro glyburidin sitoutuminen proteiineihin on pääasiassa ionitonta, kun taas muiden sulfonyyliureoiden (klooripropamidi, tolbutamidi, tolatsamidi) sitoutuminen proteiineihin on pääasiassa ionista. Happamat lääkkeet, kuten fenyylibutatsoni, varfariini ja salisylaatit, syrjäyttävät ioneja sitovat sulfonyyliureat seerumiproteiineista paljon suuremmassa määrin kuin ei-ioni sitova glyburidi. Ei ole osoitettu, että tämä ero proteiineihin sitoutumisessa johtaisi vähemmän lääkeaineiden yhteisvaikutukseen glyburiditablettien kanssa kliinisessä käytössä.
Metformiinihydrokloridi
Metformiinin näennäinen jakautumistilavuus (V/F) oraalisten 850 mg:n kerta-annosten jälkeen oli keskimäärin 654±358 l. Metformiini sitoutuu vähäisessä määrin plasman proteiineihin. Metformiini jakautuu punasoluiksi, todennäköisesti ajan funktiona. Metformiinin tavanomaisilla kliinisillä annoksilla ja annostusaikatauluilla vakaan tilan metformiinipitoisuudet plasmassa saavutetaan 24–48 tunnin kuluessa ja ne ovat yleensä
Aineenvaihdunta ja eliminaatio
Glyburidi
Glyburidin väheneminen normaalien terveiden yksilöiden seerumissa on kaksivaiheista; terminaalinen puoliintumisaika on noin 10 tuntia. Glyburidin tärkein metaboliitti on 4-trans-hydroksijohdannainen. Myös toinen metaboliitti, 3-cis-hydroksijohdannainen, esiintyy. Näillä metaboliiteilla ei todennäköisesti ole merkittävää hypoglykeemistä vaikutusta ihmisillä, koska ne ovat vain heikosti aktiivisia (1/400 ja 1/40 aktiivisena glyburidina) kaneissa. Glyburidi erittyy metaboliitteina sappeen ja virtsaan, noin 50 % kumpaakin reittiä pitkin. Tämä kaksoiseritysreitti eroaa laadullisesti muista sulfonyyliureoista, jotka erittyvät pääasiassa virtsaan.
Metformiinihydrokloridi
Laskimonsisäiset kerta-annostutkimukset normaaleilla koehenkilöillä osoittavat, että metformiini erittyy muuttumattomana virtsaan eikä metaboloidu maksassa (ihmisillä ei ole tunnistettu metaboliitteja) eikä sappeen. Munuaispuhdistuma (katso taulukko 1) on noin 3,5 kertaa suurempi kuin kreatiniinipuhdistuma, mikä osoittaa, että tubuluseritys on pääasiallinen metformiinin eliminaatioreitti. Oraalisen annon jälkeen noin 90 % imeytyneestä lääkkeestä eliminoituu munuaisten kautta ensimmäisten 24 tunnin aikana, ja plasman eliminaation puoliintumisaika on noin 6,2 tuntia. Veressä eliminaation puoliintumisaika on noin 17,6 tuntia, mikä viittaa siihen, että erytrosyyttimassa voi olla jakautumisosasto.
Erikoispopulaatiot
Potilaat, joilla on tyypin 2 diabetes
Glyburidin usean annoksen tutkimukset tyypin 2 diabetespotilailla osoittavat lääketason pitoisuus-aikakäyrät, jotka ovat samankaltaisia kuin kerta-annostutkimukset, mikä osoittaa, että lääkeaine ei kerry kudosvarastoihin.
Jos munuaisten toiminta on normaali, metformiinin kerta- tai usean annoksen farmakokinetiikassa ei ole eroja tyypin 2 diabetesta sairastavien potilaiden ja normaaleiden koehenkilöiden välillä (katso taulukko 1), eikä metformiinin kertymistä tapahdu kumpaankaan ryhmään tavanomaisissa kliinisissä olosuhteissa. annokset.
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla ei ole tehty farmakokineettisiä tutkimuksia glyburidilla tai metformiinilla.
Munuaisten vajaatoiminta
Glyburidin farmakokinetiikasta munuaisten vajaatoimintaa sairastavilla potilailla ei ole tietoa.
Potilailla, joiden munuaisten toiminta on heikentynyt (perustuu kreatiniinipuhdistumaan), metformiinin puoliintumisaika plasmassa ja veressä pitenee ja munuaispuhdistuma pienenee suhteessa kreatiniinipuhdistuman vähenemiseen (ks. taulukko 1; myös ks. VAROITUKSET ).
Geriatria
Glyburidin farmakokinetiikasta iäkkäillä potilailla ei ole tietoa.
Rajoitetut tiedot metformiinin kontrolloiduista farmakokineettisistä tutkimuksista terveillä iäkkäillä henkilöillä viittaavat siihen, että plasman kokonaispuhdistuma pienenee, puoliintumisaika pitenee ja Cmax kasvaa terveisiin nuoriin koehenkilöihin verrattuna. Näistä tiedoista näyttää siltä, että metformiinin farmakokinetiikan muutos ikääntymisen myötä johtuu ensisijaisesti muutoksesta munuaisten toiminnassa (katso taulukko 1). Metformiinihoitoa ei saa aloittaa ≥ 80-vuotiaille potilaille, ellei kreatiniinipuhdistuma osoita, että munuaisten toiminta ei ole heikentynyt.
Pediatria
Yksittäisen suun kautta otettavan GLUCOPHAGE® (metformiinihydrokloridi) 500 mg:n tabletin aterian jälkeen metformiinin geometrinen keskiarvo Cmax ja AUC erosivat
Kun yksi GLUCOVANCE-tabletti otettiin suun kautta ruuan kanssa, annoksen mukaan normalisoitu geometrinen keskimääräinen glyburidi C ja AUC poikkesivat tyypin 2 diabetesta sairastavilla lapsipotilailla (11-16-vuotiaat, n=28, keskipaino 97 kg)
Sukupuoli
Ei ole tietoa sukupuolen vaikutuksesta glyburidin farmakokinetiikkaan.
Metformiinin farmakokineettiset parametrit eivät eronneet merkitsevästi koehenkilöillä, joilla oli tai ei ollut tyypin 2 diabetesta, kun niitä analysoitiin sukupuolen mukaan (miehet = 19, naiset = 16). Vastaavasti kontrolloiduissa kliinisissä tutkimuksissa tyypin 2 diabetesta sairastavilla potilailla metformiinin verensokeria alentava vaikutus oli vertailukelpoinen miehillä ja naisilla.
Rotu
Rotujen eroista glyburidin farmakokinetiikassa ei ole saatavilla tietoa.
Metformiinin farmakokineettisiä parametreja rodun perusteella ei ole tehty. Kontrolloiduissa kliinisissä tutkimuksissa metformiinilla tyypin 2 diabetesta sairastavilla potilailla antihyperglykeeminen vaikutus oli vertailukelpoinen valkoisilla (n=249), mustilla (n=51) ja latinalaisamerikkalaisilla (n=24).
Kliiniset tutkimukset
Potilaat, joiden glukoositasapaino on riittämätön ruokavaliolla ja harjoittelulla yksin
20 viikkoa kestäneessä Yhdysvalloissa tehdyssä kaksoissokkoutetussa kliinisessä monikeskustutkimuksessa yhteensä 806 tyypin 2 diabetespotilasta, jotka eivät olleet aiemmin käyttäneet lääkkeitä ja joiden hyperglykemiaa ei saatu riittävästi hallintaan pelkällä ruokavaliolla ja liikunnalla (plasman paastoglukoosi [FPG]
GLUCOVANCE-hoito johti merkittävästi enemmän HbA:n ja aterian jälkeisen plasman glukoosin (PPG) laskuun verrattuna glyburidiin, metformiiniin tai lumelääkkeeseen. Myös GLUCOVANCE-hoito johti suurempaa FPG:n vähenemiseen verrattuna glyburidiin, metformiiniin tai lumelääkkeeseen, mutta erot glyburidiin ja metformiiniin eivät saavuttaneet tilastollista merkitystä.
GLUCOVANCE 2,50 mg -hoitoon liittyvät lipidiprofiilin muutokset olivat samanlaisia kuin glyburidilla, metformiinilla ja lumelääkkeellä.
Yllä kuvattu kaksoissokkoutettu, lumekontrolloitu tutkimus rajoitti tutkimukseen potilaita, joiden HbA1c
Potilaat, joilla on riittämätön glukoositasapaino pelkällä sulfonyyliurealla
16 viikkoa kestäneessä kaksoissokkoutetussa, aktiivikontrolloidussa kliinisessä yhdysvaltalaisessa tutkimuksessa yhteensä 639 potilasta, joilla oli tyypin 2 diabetes, ei ollut riittävästi hallinnassa (keskimääräinen lähtötilanteen HbA1c 9,5 %, keskimääräinen lähtötason FPG 213 mg/dl), kun heitä hoidettiin vähintään puolet sulfonyyliurean enimmäisannoksesta (esim. glyburidi 10 mg, glipitsidi 20 mg) satunnaistettiin saamaan glyburidia (kiinteä annos, 20 mg), metformiinia (500 mg), GLUCOVANCE 2,5 mg/500 mg tai GLUCOVANCE 5 mg /500 mg. Metformiinin ja GLUCOVANCE:n annokset titrattiin enintään 4 tablettiin vuorokaudessa tarpeen mukaan FPG:n saavuttamiseksi
16 viikon jälkeen HbA:n keskiarvo ei muuttunut merkitsevästi potilailla, jotka oli satunnaistettu saamaan glyburidi- tai metformiinihoitoa. Hoito GLUCOVANCE 2,50 mg:lla annoksilla 20 mg/2000 mg/vrk asti johti HbA:n, FPG:n ja PPG:n merkittävään laskuun lähtötasosta verrattuna pelkkään glyburidiin tai metformiiniin.
Tiatsolidiinidionien lisääminen GLUCOVANCE 400 mg -hoitoon
24 viikkoa kestäneessä Yhdysvalloissa tehdyssä kaksoissokkoutetussa monikeskustutkimuksessa tyypin 2 diabetesta sairastavat potilaat, jotka eivät olleet riittävästi hallinnassa nykyisellä suun kautta otetulla verensokeria alentavalla hoidolla (joko monoterapialla tai yhdistelmähoidolla), siirrettiin ensin avoimeen GLUCOVANCE 2,5 mg/500 mg tablettiin ja titrattiin. enimmäisvuorokausiannokseen 10 mg/2000 mg. Yhteensä 365 potilasta, joiden hallinta oli riittämätön (HbA1c > 7,0 % ja ≤ 10 %), kun GLUCOVANCE 500 mg:n päivittäinen annos oli vähintään 7,5 mg/1500 mg, satunnaistettiin 10–12 viikon ajan saamaan lisähoitoa rosiglitatsonilla 4 mg tai lumelääke kerran vuorokaudessa. . 8 viikon kuluttua rosiglitatsonin annosta nostettiin enintään 8 mg:aan vuorokaudessa tarpeen mukaan, jotta saavutettiin tavoitekeskimääräinen vuorokausiglukoosiarvo 126 mg/dl tai HbA1c
Potilailla, jotka eivät saavuttaneet riittävää glukoositasapainoa GLUCOVANCE 400 mg:lla, rosiglitatsonin lisääminen lumelääkkeeseen alensi merkittävästi HbA- ja FPG-arvoja.
POTILASTIEDOT
GLUCOVANCE® (glyburidi ja metformiini HCl) Tabletit
VAROITUS: Pienelle määrälle metformiinihydrokloridia käyttäneitä ihmisiä on kehittynyt vakava tila, jota kutsutaan maitohappoasidoosiksi. Kunnollisesti toimivia munuaisia tarvitaan estämään maitohappoasidoosia. Useimpien munuaisongelmista kärsivien ihmisten ei tule ottaa GLUCOVANCE-valmistetta. (Katso kysymykset 9-13.)
Q1. Miksi minun on otettava GLUCOVANCE 5 mg?
Lääkärisi on määrännyt GLUCOVANCE 500 mg -valmistetta tyypin 2 diabeteksesi hoitoon. Tämä tunnetaan myös nimellä insuliinista riippumaton diabetes mellitus.
Q2. Mikä on tyypin 2 diabetes?
Diabetespotilaat eivät pysty tuottamaan tarpeeksi insuliinia ja/tai reagoimaan normaalisti kehonsa tuottamaan insuliiniin. Kun näin tapahtuu, sokeria (glukoosia) kertyy vereen. Tämä voi johtaa vakaviin lääketieteellisiin ongelmiin, kuten munuaisvaurioihin, amputaatioihin ja sokeuteen. Diabetes liittyy myös läheisesti sydänsairauksiin. Diabeteksen hoidon päätavoite on alentaa verensokeria normaalille tasolle.
Q3. Miksi tyypin 2 diabeteksen hallinta on tärkeää?
Diabeteksen hoidon päätavoite on alentaa verensokeria normaalille tasolle. Tutkimukset ovat osoittaneet, että hyvä verensokerin hallinta voi estää tai viivyttää komplikaatioita, kuten sydänsairauksia, munuaissairaus tai sokeus.
Q4. Miten tyypin 2 diabetes yleensä hallitaan?
Korkeaa verensokeria voidaan alentaa ruokavaliolla ja liikunnalla, useilla suun kautta otetuilla lääkkeillä ja insuliinipistoksilla. Ennen kuin otat GLUCOVANCE 2,50 mg -valmistetta, sinun tulee ensin yrittää saada diabeteksesi hallintaan harjoituksella ja laihduttamalla. Vaikka käytät GLUCOVANCE-valmistetta, sinun tulee silti harjoitella ja noudattaa diabeteksesi hoitoon suositeltua ruokavaliota.
Q5. Toimiiko GLUCOVANCE 400mg eri tavalla kuin muut verensokeria säätelevät lääkkeet?
Kyllä. GLUCOVANCE 400mg yhdistää 2 glukoosia alentavaa lääkettä, glyburidin ja metformiinin. Nämä kaksi lääkettä toimivat yhdessä parantaen tyypin 2 diabeteksessa havaittuja aineenvaihduntahäiriöitä. Glyburidi alentaa verensokeria ensisijaisesti vapauttamalla enemmän kehon omaa insuliinia, ja metformiini alentaa verensokeria osittain auttamalla kehoasi käyttämään omaa insuliiniasi tehokkaammin. Yhdessä ne auttavat sinua saavuttamaan paremman glukoosinhallinnan.
Q6. Mitä tapahtuu, jos verensokerini on edelleen liian korkea?
Jos GLUCOVANCE ei pysty alentamaan verensokeria riittävästi, lääkärisi voi määrätä sinulle ruiskeena annettavaa insuliinia tai ryhtyä muihin toimenpiteisiin diabeteksesi hallintaan.
Q7. Voiko GLUCOVANCE 400mg aiheuttaa haittavaikutuksia?
GLUCOVANCE 2,50 mg, kuten kaikki verensokeria alentavat lääkkeet, voi aiheuttaa haittavaikutuksia joillekin potilaille. Useimmat näistä sivuvaikutuksista ovat vähäisiä. GLUCOVANCE-valmisteeseen liittyy kuitenkin myös vakavia, mutta harvinaisia sivuvaikutuksia (ks. Q9-Q13).
Q8. Mitkä ovat GLUCOVANCE 500 mg:n yleisimmät sivuvaikutukset?
GLUCOVANCE 5 mg:n yleisimmät sivuvaikutukset ovat yleensä vähäisiä, kuten ripuli, pahoinvointi ja vatsavaivoja. Jos näitä sivuvaikutuksia ilmenee, ne ilmenevät yleensä muutaman ensimmäisen hoitoviikon aikana. GLUCOVANCE-valmisteen ottaminen aterioiden yhteydessä voi auttaa vähentämään näitä sivuvaikutuksia.
Harvemmin voi esiintyä hypoglykemian (matala verensokeri) oireita, kuten huimausta, huimausta, vapinaa tai nälkää. Hypoglykeemisten oireiden riski kasvaa, kun ateriat jätetään väliin, juodaan liikaa alkoholia tai harjoitetaan raskaasti ilman tarpeeksi ruokaa. Lääkärin neuvojen noudattaminen voi auttaa sinua välttämään näitä oireita.
Q9. Onko olemassa vakavia sivuvaikutuksia, joita GLUCOVANCE voi aiheuttaa?
Ihmisille, joilla on glukoosi-6-fosfaattidehydrogenaasin (G6PD) puutos ja jotka käyttävät GLUCOVANCE-valmistetta, voi kehittyä hemolyyttinen anemia (punasolujen nopea hajoaminen). G6PD-puutos esiintyy yleensä perheissä. Kerro lääkärillesi, jos sinulla tai jollain perheenjäsenelläsi on diagnosoitu G6PD-puutos, ennen kuin aloitat GLUCOVANCE-hoidon.
GLUCOVANCE aiheuttaa harvoin vakavia sivuvaikutuksia. Vakavin sivuvaikutus, jonka GLUCOVANCE 2,50 mg voi aiheuttaa, on maitohappoasidoosi.
Q10. Mitä maitohappoasidos on ja voiko se tapahtua minulle?
Maitohappoasidoosi johtuu maitohapon kertymisestä vereen. Metformiiniin liittyvä maitohappoasidoosi on harvinainen ja sitä on esiintynyt enimmäkseen ihmisillä, joiden munuaiset eivät toimineet normaalisti. Maitohappoasidoosia on raportoitu noin yhdellä 33 000 potilaasta, jotka ovat käyttäneet metformiinia vuoden aikana. Vaikka maitohappoasidoosia esiintyykin harvinaista, se voi olla tappava jopa puolessa tapauksista.
On myös tärkeää, että maksasi toimii normaalisti, kun otat GLUCOVANCE-valmistetta. Maksasi auttaa poistamaan maitohappoa verenkierrosta.
Lääkärisi seuraa diabetestasi ja saattaa tehdä sinulle verikokeita ajoittain varmistaakseen, että munuaisesi ja maksasi toimivat normaalisti.
Ei ole näyttöä siitä, että GLUCOVANCE vahingoittaisi munuaisia tai maksaa.
Q11. Onko muita maitohappoasidoosin riskitekijöitä?
Riskisi sairastua maitohappoasidoosiin GLUCOVANCE 400 mg:n käytön seurauksena on hyvin pieni, kunhan munuaisesi ja maksasi ovat terveet. Jotkut tekijät voivat kuitenkin lisätä riskiäsi, koska ne voivat vaikuttaa munuaisten ja maksan toimintaan. Sinun tulee keskustella riskeistäsi lääkärisi kanssa.
Älä ota GLUCOVANCE 400 mg:aa, jos:
- Sinulla on kroonisia munuais- tai maksaongelmia
- Sinulla on kongestiivinen sydämen vajaatoiminta, jota hoidetaan lääkkeillä, kuten digoksiinilla (Lanoxin®) tai furosemidilla (Lasix®)
- Juot alkoholia liikaa (koko ajan tai lyhytaikainen humalajuominen)
- Olet vakavasti kuivunut (olet menettänyt suuren määrän kehon nesteitä)
- Sinulla on tiettyjä röntgentoimenpiteitä ruiskutettavilla varjoaineilla
- Olet menossa leikkaukseen
- Sinulle kehittyy vakava tila, kuten sydänkohtaus, vakava infektio tai aivohalvaus
- Olet ≥ 80-vuotias, etkä ole testannut munuaistoimintaasi
Q12. Mitkä ovat maitohappoasidoosin oireet?
Joitakin oireita ovat: erittäin heikko, väsynyt tai epämukava olo; epätavallinen lihaskipu; vaikeuksia hengittää; epätavallinen tai odottamaton vatsakipu; kylmä tunne; huimaus tai huimaus; tai äkillinen hidas tai epäsäännöllinen sydämenlyönti.
Jos huomaat näitä oireita tai jos sairautesi on äkillisesti muuttunut, lopeta GLUCOVANCE-tablettien käyttö ja ota heti yhteys lääkäriin. Maitohappoasidoosi on lääketieteellinen hätätilanne, joka on hoidettava sairaalassa.
Q13. Mitä lääkärini tarvitsee tietää vähentääkseen maitohappoasidoosiriskiäni?
Kerro lääkärillesi, jos sinulla on sairaus, joka aiheuttaa vaikeaa oksentelua, ripulia ja/tai kuumetta, tai jos nesteenkäyttösi on vähentynyt merkittävästi. Nämä tilanteet voivat johtaa vakavaan kuivumiseen, ja GLUCOVANCE 400 mg:n käyttö saattaa olla tarpeen lopettaa väliaikaisesti.
Kerro lääkärillesi, jos olet menossa mihinkään leikkaukseen tai erityisiin röntgentoimenpiteisiin, jotka edellyttävät varjoaineinjektiota. GLUCOVANCE 2,50 mg -hoito on lopetettava väliaikaisesti tällaisissa tapauksissa.
Q14. Voinko ottaa GLUCOVANCE 500 mg:aa muiden lääkkeiden kanssa?
Muistuta lääkäriäsi, että käytät GLUCOVANCE 2,50 mg -valmistetta, kun sinulle määrätään uutta lääkettä tai jos jo määrätyn lääkkeen käyttötapaa muutetaan. GLUCOVANCE 400 mg voi häiritä joidenkin lääkkeiden vaikutusta ja jotkut lääkkeet voivat häiritä GLUCOVANCE-valmisteen toimintaa.
Älä käytä GLUCOVANCE-valmistetta, jos käytät bosentaania, jota käytetään keuhkoverenpainetautiin (PAH), joka on korkea verenpaine keuhkojen verisuonissa.
Q15. Entä jos tulen raskaaksi GLUCOVANCE 400 mg -hoidon aikana?
Kerro lääkärillesi, jos suunnittelet raskautta tai olet tullut raskaaksi. Kuten muitakin suun kautta otettavia glukoosinhallintalääkkeitä, sinun ei tule käyttää GLUCOVANCE-valmistetta raskauden aikana.
Yleensä lääkärisi määrää insuliinia raskauden aikana. Kuten kaikkien lääkkeiden kohdalla, sinun ja lääkärisi tulee keskustella GLUCOVANCE 5 mg:n käytöstä, jos imetät lasta.
Q16. Kuinka otan GLUCOVANCE-valmistetta?
Lääkärisi kertoo sinulle, kuinka monta GLUCOVANCE-tablettia sinun tulee ottaa ja kuinka usein. Tämä on myös painettava reseptisi etikettiin. Aloitat todennäköisesti pienellä GLUCOVANCE 400 mg -annoksella ja annostasi nostetaan asteittain, kunnes verensokerisi on hallinnassa.
Q17. Mistä saan lisätietoja GLUCOVANCE 400mg:sta?
Tämä pakkausseloste on tiivistelmä tärkeimmistä GLUCOVANCE-tiedoista. Jos sinulla on kysyttävää tai ongelmia, keskustele lääkärisi tai muun terveydenhuollon ammattilaisen kanssa tyypin 2 diabeteksesta sekä GLUCOVANCEsta ja sen sivuvaikutuksista. Siellä on myös terveydenhuollon ammattilaisille kirjoitettu esite (pakkausseloste), jonka apteekki voi antaa sinun lukea.
