Amaryl 1mg, 2mg, 4mg Glimepiride Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Amaryl 1mg on ja miten sitä käytetään?
Amaryl 4mg on reseptilääke, jota käytetään tyypin 2 diabeteksen oireiden hoitoon. Amaryl 4mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Amaryl 2mg kuuluu lääkeryhmään, jota kutsutaan diabeteslääkkeiksi, sulfonyyliureiksi.
Ei tiedetä, onko Amaryl turvallinen ja tehokas lapsille.
Mitkä ovat Amarylin mahdolliset sivuvaikutukset?
Amaryl voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vaalea tai kellastunut iho,
- tumma virtsa,
- hämmennystä,
- heikkous ja
- kuume
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Amarylin yleisimpiä sivuvaikutuksia ovat:
- päänsärky,
- huimaus,
- heikkous,
- pahoinvointi ja
- matala verensokeri
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Amarylin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
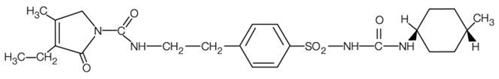
AMARYL on oraalinen sulfonyyliurea, joka sisältää vaikuttavana aineena glimepiridiä. Kemiallisesti glimepiridi tunnistetaan 1-[[p-[2-(3-etyyli-4-metyyli-2-okso-3-pyrroliini-1-karboksamido)etyyli]fenyyli]sulfonyyli]-3-(trans-4- metyylisykloheksyyli)urea (C24H34N4O5S), jonka molekyylipaino on 490,62. Glimepiridi on valkoinen tai kellertävänvalkoinen, kiteinen, hajuton tai lähes hajuton jauhe ja se on käytännöllisesti katsoen veteen liukenematon. Rakennekaava on:
AMARYL-tabletit sisältävät vaikuttavana aineena glimepiridiä ja seuraavia inaktiivisia aineita: laktoosi (vesipitoinen), natriumtärkkelysglykolaatti, povidoni, mikrokiteinen selluloosa ja magnesiumstearaatti. Lisäksi AMARYL 1 mg tabletit sisältävät rautaoksidin punaista, AMARYL 2 mg tabletit sisältävät rautaoksidikeltaista ja FD&C Blue #2 Aluminium Lakea ja AMARYL 4 mg tabletit sisältävät FD&C Blue #2 Aluminium Lake.
INDIKAATIOT
AMARYL 2mg on tarkoitettu ruokavalion ja liikunnan lisänä parantamaan glukoositasapainoa aikuisilla, joilla on tyypin 2 diabetes (ks. Kliiniset tutkimukset ].
Tärkeitä käytön rajoituksia
AMARYL-valmistetta ei tule käyttää tyypin 1 diabeteksen tai diabeettisen ketoasidoosin hoitoon, koska se ei ole tehokas näissä olosuhteissa.
ANNOSTELU JA HALLINNOINTI
Suositeltu annostus
AMARYL 1mg tulee ottaa aamiaisen tai päivän ensimmäisen pääaterian yhteydessä.
AMARYLin suositeltu aloitusannos on 1 mg tai 2 mg kerran vuorokaudessa. Potilaiden, joilla on lisääntynyt hypoglykemian riski (esim. vanhukset tai potilaat, joilla on munuaisten vajaatoiminta), tulee aloittaa annoksella 1 mg kerran vuorokaudessa (ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Kun vuorokausiannos on 2 mg, annosta voidaan suurentaa edelleen 1 mg:n tai 2 mg:n lisäyksin potilaan glykeemisen vasteen perusteella. Uptitraation ei tulisi tapahtua useammin kuin 1-2 viikon välein. Konservatiivista titrausjärjestelmää suositellaan potilaille, joilla on lisääntynyt hypoglykemian riski [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Suurin suositeltu annos on 8 mg kerran vuorokaudessa.
Potilailla, jotka siirretään AMARYL 1 mg:aan pidemmän puoliintumisajan sulfonyyliureoista (esim. klooripropamidista), lääkkeen vaikutus voi olla päällekkäinen 1-2 viikon ajan, ja heitä tulee seurata asianmukaisesti hypoglykemian varalta.
Kun kolesevelaamia annetaan samanaikaisesti glimepiridin kanssa, plasman huippupitoisuus ja kokonaisaltistus glimepiridille vähenevät. Siksi AMARYL 2 mg tulee antaa vähintään 4 tuntia ennen kolesevelaamia.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
AMARYL 4mg on muotoiltu tabletteina:
- 1 mg (vaaleanpunainen, litteäpintainen, pitkänomainen, uurretut sivut kaksinkertaisessa puolikkaassa, toiselle puolelle painettu "AMA RYL")
- 2 mg (vihreä, litteäpintainen, pitkänomainen, uurretut sivut kaksinkertaisessa puolittimessa, painatus ”AMA RYL” toisella puolella)
- 4 mg (sininen, litteäpintainen, pitkänomainen, uurretut sivut kaksinkertaisessa puolikkaassa, painatus ”AMA RYL” toisella puolella)
Varastointi ja käsittely
AMARYL tabletteja on saatavana seuraavina vahvuuksina ja pakkauskokoina:
1 mg (vaaleanpunainen, litteäpintainen, pitkulainen, uurretut sivut kaksinkertaisessa puolittimessa, merkintä "AMA RYL" toisella puolella) 100 pulloissa ( NDC 0039-0221-10)
2 mg (vihreä, litteäpintainen, pitkänomainen, uurretut sivut kaksinkertaisessa puolittimessa, merkintä "AMA RYL" toisella puolella) 100 pulloissa ( NDC 0039-0222-10)
4 mg (sininen, litteäpintainen, pitkänomainen, uurretut sivut kaksinkertaisessa puolittimessa, toiselle puolelle painettu "AMA RYL") 100 pulloissa ( NDC 0039-0223-10)
Säilytä 25°C (77°F); retket sallitaan 20 - 25°C (68 - 77°F) (katso USP-ohjattu huonelämpötila ).
Annostele hyvin suljetuissa säiliöissä, joissa on turvasulkimet.
sanofi-aventis US LLC, Bridgewater, NJ 08807, SANOFI-YHTIÖ. Tarkistettu joulukuussa 2016
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään yksityiskohtaisemmin alla ja muualla merkinnöissä:
- Hypoglykemia [katso VAROITUKSET JA VAROTOIMET ]
- Hemolyyttinen anemia [katso VAROITUKSET JA VAROTOIMET ]
Kliinisissä tutkimuksissa AMARYL 4 mg:n yleisimmät haittavaikutukset olivat hypoglykemia, huimaus, voimattomuus, päänsärky ja pahoinvointi.
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Noin 2 800 tyypin 2 diabetesta sairastavaa potilasta on hoidettu AMARYL 4 mg:lla kontrolloiduissa kliinisissä tutkimuksissa. Näissä tutkimuksissa noin 1 700 potilasta hoidettiin AMARYLilla vähintään vuoden ajan.
Taulukossa 1 on yhteenveto haittatapahtumista, hypoglykemiaa lukuun ottamatta, jotka raportoitiin 11 yhdistetyssä lumekontrolloidussa tutkimuksessa riippumatta siitä, onko niiden katsottu mahdollisesti tai todennäköisesti liittyvän tutkimuslääkitykseen. Hoidon kesto oli 13 viikosta 12 kuukauteen. Raportoidut termit edustavat niitä, joita esiintyi ≥ 5 %:lla AMARYL-hoitoa saaneista potilaista ja yleisemmin kuin lumelääkettä saaneilla potilailla.
Hypoglykemia
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monoterapiatutkimuksessa, joka kesti 14 viikkoa, potilaille, jotka olivat jo saaneet sulfonyyliureahoitoa, tehtiin 3 viikon poistumisjakso, jonka jälkeen ne satunnaistettiin saamaan AMARYL 1 mg, 4 mg, 8 mg tai lumelääkettä. Potilaille, jotka satunnaistettiin saamaan AMARYL 4 mg tai 8 mg, tehtiin pakkotitraus 1 mg:n aloitusannoksesta näihin viimeisiin annoksiin, kuten siedettiin [ks. Kliiniset tutkimukset ]. Mahdollisen hypoglykemian yleinen ilmaantuvuus (määritelty vähintään yhden oireen esiintymisenä, jonka tutkija uskoi saaneen liittyä hypoglykemiaan; samanaikaista glukoosimittausta ei vaadittu) oli 4 % AMARYL 1 mg:lla, 17 % AMARYL 4 mg:lla, 16 % AMARYL 8 mg:lla ja 0 % lumelääkevalmisteella. Kaikki nämä tapahtumat hoidettiin itse.
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monoterapiatutkimuksessa, joka kesti 22 viikkoa, potilaat saivat joko 1 mg:n AMARYL- tai lumelääkeannoksen päivittäin. AMARYL 2 mg:n annos titrattiin tavoitearvoon paastoplasman glukoosiarvo 90-150 mg/dl. AMARYL 2 mg:n lopulliset päivittäiset annokset olivat 1, 2, 3, 4, 6 tai 8 mg [ks. Kliiniset tutkimukset ]. Mahdollisen hypoglykemian (kuten edellä 14 viikon tutkimuksessa määriteltiin) yleinen ilmaantuvuus AMARYLilla verrattuna lumelääkkeeseen oli 19,7 % vs. 3,2 %. Kaikki nämä tapahtumat hoidettiin itse.
Painonnousu: AMARYL, kuten kaikki sulfonyyliureat, voi aiheuttaa painonnousua [katso Kliiniset tutkimukset ].
Allergiset reaktiot: Kliinisissä tutkimuksissa allergisia reaktioita, kuten kutinaa, punoitusta, urtikariaa ja morbilliformisia tai makulopapulaarisia ihottumia, esiintyi alle 1 %:lla AMARYL-hoitoa saaneista potilaista. Nämä voivat hävitä huolimatta AMARYL-hoidon jatkamisesta. Markkinoille tulon jälkeen on raportoitu vakavammista allergisista reaktioista (esim. hengenahdistus, hypotensio, sokki) [ks. VAROITUKSET JA VAROTOIMET ].
Laboratoriotestit
Kohonnut seerumin alaniiniaminotransferaasi (ALT): 11 yhdistetyssä lumekontrolloidussa AMARYL-tutkimuksessa 1,9 %:lle AMARYL-hoitoa saaneista potilaista ja 0,8 %:lle lumelääkettä saaneista potilaista seerumin ALAT-arvo kehittyi yli 2 kertaa vertailualueen ylärajan.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu AMARYLin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
- Vakavat yliherkkyysreaktiot, mukaan lukien anafylaksia, angioödeema ja Stevens-Johnsonin oireyhtymä [ks. VAROITUKSET JA VAROTOIMET ]
- Hemolyyttinen anemia potilailla, joilla on G6PD-puutos ja ilman sitä [katso VAROITUKSET JA VAROTOIMET ]
- Maksan toiminnan heikkeneminen (esim. kolestaasi ja keltaisuus) sekä hepatiitti, joka voi edetä maksan vajaatoimintaan.
- Porphyria cutanea tarda, valoherkkyysreaktiot ja allerginen vaskuliitti
- Leukopenia, agranulosytoosi, aplastinen anemia ja pansytopenia
- Trombosytopenia (mukaan lukien vaikeat tapaukset, joissa verihiutaleiden määrä on alle 10 000/μl) ja trombosytopeeninen purppura
- Maksan porfyriareaktiot ja disulfiraamin kaltaiset reaktiot
- Hyponatremia ja epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymä (SIADH), useimmiten potilailla, jotka käyttävät muita lääkkeitä tai joilla on sairaus, jonka tiedetään aiheuttavan hyponatremiaa tai lisäävän antidiureettisen hormonin vapautumista
- Dysgeusia
- Hiustenlähtö
HUUMEIDEN VUOROVAIKUTUKSET
Glukoosiaineenvaihduntaan vaikuttavat lääkkeet
Monet lääkkeet vaikuttavat glukoosin aineenvaihduntaan ja saattavat vaatia AMARYL 4 mg:n annoksen säätämistä ja erityisen tarkkaa seurantaa hypoglykemian tai verensokeritasapainon heikkenemisen varalta.
Seuraavat ovat esimerkkejä lääkkeistä, jotka voivat lisätä sulfonyyliureoiden, mukaan lukien AMARYL 2 mg, glukoosia alentavaa vaikutusta, lisäämällä hypoglykemian herkkyyttä ja/tai voimakkuutta: suun kautta otettavat diabeteslääkkeet, pramlintidiasetaatti, insuliini, angiotensiinikonvertaasin (ACE) estäjät, H2-reseptoriantagonistit, fibraatit, propoksifeeni, pentoksifylliini, somatostatiinianalogit, anaboliset steroidit ja androgeenit, syklofosfamidi, fenyramidoli, guanetidiini, flukonatsoli, sulfiinipyratsoni, tetrasykliinit, klaritromysiini, disopyramidi ja flunssasidotut lääkkeet, kuten proteiinit, kinolonit ei-steroidiset tulehduskipulääkkeet, salisylaatit, sulfonamidit, kloramfenikoli, kumariinit, probenesidi ja monoamiinioksidaasin estäjät. Kun näitä lääkkeitä annetaan AMARYL-hoitoa saavalle potilaalle, tarkkaile potilasta tarkasti hypoglykemian varalta. Kun nämä lääkkeet poistetaan potilaalta, joka saa AMARYL 2 mg:aa, seuraa potilasta tarkasti verensokeritasapainon huonontumisen varalta.
Seuraavat ovat esimerkkejä lääkkeistä, jotka voivat heikentää sulfonyyliureoiden, mukaan lukien AMARYLin, glukoosia alentavaa vaikutusta, mikä johtaa glukoositason heikkenemiseen: danatsoli, glukagoni, somatropiini, proteaasi-inhibiittorit, epätyypilliset psykoosilääkkeet (esim. olantsapiini ja klotsapiini), barbituraatit, diatsoksidit, , rifampiini, tiatsidit ja muut diureetit, kortikosteroidit, fenotiatsiinit, kilpirauhashormonit, estrogeenit, suun kautta otettavat ehkäisyvalmisteet, fenytoiini, nikotiinihappo, sympatomimeetit (esim. epinefriini, albuteroli, terbutaliini) ja isoniatsidi. Kun näitä lääkkeitä annetaan potilaalle, joka saa AMARYL 2 mg, seuraa potilasta tarkasti verensokeritasapainon huonontumisen varalta. Kun nämä lääkkeet poistetaan potilaalta, joka saa AMARYL 2 mg, seuraa potilasta tarkasti hypoglykemian varalta.
Beetasalpaajat, klonidiini ja reserpiini voivat joko voimistaa tai heikentää AMARYLin glukoosia alentavaa vaikutusta.
Sekä akuutti että krooninen alkoholinkäyttö voi voimistaa tai heikentää AMARYL 1 mg:n glukoosia alentavaa vaikutusta arvaamattomalla tavalla.
Hypoglykemian oireet voivat vähentyä tai puuttua potilailla, jotka käyttävät sympatolyyttisiä lääkkeitä, kuten beetasalpaajia, klonidiinia, guanetidiinia ja reserpiiniä.
Mikonatsoli
Suun kautta otettavan mikonatsolin ja sulfonyyliureoiden välillä on raportoitu mahdollista yhteisvaikutusta, joka voi johtaa vakavaan hypoglykemiaan. Ei tiedetä, esiintyykö tätä yhteisvaikutusta myös muiden mikonatsolin annosmuotojen kanssa.
Sytokromi P450 2C9 -vuorovaikutukset
Glimepiridin ja sytokromi P450 2C9:n estäjien (esim. flukonatsoli) ja induktorien (esim. rifampiini) välillä voi olla yhteisvaikutuksia. Flukonatsoli saattaa estää glimepiridin metaboliaa, mikä lisää glimepiridin pitoisuuksia plasmassa, mikä voi johtaa hypoglykemiaan. Rifampiini saattaa indusoida glimepiridin metaboliaa, mikä aiheuttaa plasman glimepiridipitoisuuksien laskua, mikä voi johtaa verensokeritasapainon heikkenemiseen.
Colesevelamin samanaikainen anto
Kolesevelaami voi pienentää glimepiridin huippupitoisuutta plasmassa ja kokonaisaltistusta, kun näitä kahta käytetään samanaikaisesti. Imeytyminen ei kuitenkaan vähene, kun glimepiridiä annetaan 4 tuntia ennen kolesevelaamia. Siksi AMARYL tulee antaa vähintään 4 tuntia ennen kolesevelaamia.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Hypoglykemia
Kaikki sulfonyyliureat, mukaan lukien AMARYL, voivat aiheuttaa vakavan hypoglykemian [katso HAITTAVAIKUTUKSET ]. Potilaan keskittymis- ja reaktiokyky saattaa heikentyä hypoglykemian seurauksena. Nämä heikentymiset voivat aiheuttaa riskin tilanteissa, joissa nämä kyvyt ovat erityisen tärkeitä, kuten autolla ajettaessa tai muiden koneiden käyttö. Vaikea hypoglykemia voi johtaa tajuttomuuteen tai kouristukseen ja voi johtaa tilapäiseen tai pysyvään aivotoiminnan heikkenemiseen tai kuolemaan.
Potilaita on koulutettava tunnistamaan ja hallitsemaan hypoglykemia. Ole varovainen aloittaessasi ja suurentaessasi AMARYL 2 mg -annoksia potilailla, jotka voivat olla alttiita hypoglykemialle (esim. vanhukset, potilaat, joilla on munuaisten vajaatoiminta, potilaat, jotka käyttävät muita diabeteslääkkeitä). Heikentyneet tai aliravitut potilaat sekä lisämunuaisen, aivolisäkkeen tai maksan vajaatoimintaa sairastavat potilaat ovat erityisen herkkiä glukoosia alentavien lääkkeiden hypoglykeemiselle vaikutukselle. Hypoglykemiaa esiintyy myös todennäköisemmin, kun kalorien saanti on puutteellista, vakavan tai pitkäaikaisen harjoituksen jälkeen tai kun alkoholia nautitaan.
Hypoglykemian varhaisvaroitusoireet voivat olla erilaisia tai lievempiä potilailla, joilla on autonominen neuropatia, vanhuksilla ja potilailla, jotka käyttävät beetasalpaavia lääkkeitä tai muita sympatolyyttisiä aineita. Nämä tilanteet voivat johtaa vakavaan hypoglykemiaan ennen kuin potilas on tietoinen hypoglykemiasta.
Yliherkkyysreaktiot
Markkinoille tulon jälkeen on raportoitu yliherkkyysreaktioita AMARYLilla hoidetuilla potilailla, mukaan lukien vakavia reaktioita, kuten anafylaksia, angioedeema ja Stevens-Johnsonin oireyhtymä. Jos epäillään yliherkkyysreaktiota, lopeta AMARYL-hoito välittömästi, arvioi muut mahdolliset reaktion syyt ja aloita diabeteksen vaihtoehtoinen hoito.
Hemolyyttinen anemia
Sulfonyyliureat voivat aiheuttaa hemolyyttistä anemiaa potilailla, joilla on glukoosi-6-fosfaattidehydrogenaasin (G6PD) puutos. Koska AMARYL 4mg on sulfonyyliurea, ole varovainen potilailla, joilla on G6PD-puutos, ja harkitse muun kuin sulfonyyliurean käyttöä. Markkinoille tulon jälkeen on myös raportoitu hemolyyttisestä anemiasta potilailla, jotka saavat AMARYL 1 mg ja joilla ei ollut tunnettua G6PD:n puutetta [ks. HAITTAVAIKUTUKSET ].
Suurentunut sydän- ja verisuoniperäisen kuolleisuuden riski sulfonyyliureoilla
Oraalisten hypoglykeemisten lääkkeiden antamisen on raportoitu liittyvän lisääntyneeseen kardiovaskulaariseen kuolleisuuteen verrattuna hoitoon pelkällä ruokavaliolla tai ruokavaliolla ja insuliinilla. Tämä varoitus perustuu University Group Diabetes Programin (UGDP) tutkimukseen, joka on pitkäaikainen, prospektiivinen kliininen tutkimus, jonka tarkoituksena on arvioida glukoosia alentavien lääkkeiden tehokkuutta verisuonikomplikaatioiden ehkäisyssä tai viivästyksessä potilailla, joilla ei ole insuliinista riippuvaisia. diabetes. Tutkimukseen osallistui 823 potilasta, jotka jaettiin satunnaisesti yhteen neljästä hoitoryhmästä, UGDP raportoi, että potilailla, joita hoidettiin 5–8 vuoden ajan ruokavaliolla ja kiinteällä tolbutamidiannoksella (1,5 grammaa päivässä), sydän- ja verisuonikuolleisuus oli noin 2–½ kertaa suurempi. pelkällä ruokavaliolla hoidetuilla potilailla. Merkittävää lisääntymistä kokonaiskuolleisuudessa ei havaittu, mutta tolbutamidin käyttö lopetettiin sydän- ja verisuoniperäisen kuolleisuuden lisääntymisen vuoksi, mikä rajoitti tutkimuksen mahdollisuutta osoittaa kokonaiskuolleisuuden lisääntyminen. Huolimatta näiden tulosten tulkintaa koskevasta kiistasta, UGDP-tutkimuksen tulokset tarjoavat riittävän perustan tälle varoitukselle. Potilaalle tulee kertoa AMARYL 4 mg:n mahdollisista riskeistä ja eduista sekä vaihtoehtoisista hoitomuodoista. Vaikka tähän tutkimukseen sisältyi vain yksi sulfonyyliurea-luokan lääke (tolbutamidi), on turvallisuuden kannalta järkevää ottaa huomioon, että tämä varoitus voi koskea myös muita tämän luokan suun kautta otettavia hypoglykeemisiä lääkkeitä, koska ne ovat samankaltaisia. toiminta ja kemiallinen rakenne.
Makrovaskulaariset tulokset
Ei ole tehty kliinisiä tutkimuksia, jotka osoittaisivat kiistatonta näyttöä makrovaskulaarisen riskin vähentämisestä AMARYLin tai minkä tahansa muun diabeteslääkkeen käytön yhteydessä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
Rotilla tehdyt 30 kuukauden tutkimukset annoksilla 5 000 miljoonasosaa (ppm) asti täysrehussa (noin 340 kertaa suurin suositeltu annos ihmiselle pinta-alan perusteella) 30 kuukauden ajan eivät osoittaneet merkkejä karsinogeneesistä. Hiirillä glimepiridin anto 24 kuukauden ajan johti hyvänlaatuisen haiman adenooman muodostumisen lisääntymiseen, mikä oli annoksesta riippuvaa ja jonka uskottiin johtuvan kroonisesta haiman stimulaatiosta. Adenooman muodostumista hiirillä ei havaittu annoksella 320 ppm täysrehussa tai 46-54 mg/kg ruumiinpainoa/päivä. Tämä on noin 35 kertaa suurempi kuin ihmisen suurin suositeltu annos 8 mg kerran vuorokaudessa pinta-alan perusteella.
Glimepiridi ei ollut mutageeninen useissa in vitro ja in vivo mutageenisuustutkimuksissa (Ames-testi, somaattisten solujen mutaatio, kromosomipoikkeavuus, suunnittelematon DNA-synteesi ja hiiren mikrotumatesti).
Glimepiridillä ei ollut vaikutusta uroshiirien hedelmällisyyteen eläimillä, jotka altistettiin annokselle 2 500 mg/kg ruumiinpainoa (> 1 700 kertaa ihmisen suurin suositeltu annos pinta-alan perusteella). Glimepiridillä ei ollut vaikutusta uros- ja naarasrottien hedelmällisyyteen, kun sitä annettiin annoksella 4 000 mg/kg ruumiinpainoa (noin 4 000 kertaa suurin suositeltu ihmisannos pinta-alan perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
AMARYL 2 mg:n käytöstä raskaana oleville naisille ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Eläintutkimuksissa synnynnäisten epämuodostumien määrä ei lisääntynyt, mutta sikiökuolemien määrä lisääntyi rotilla ja kaniineilla, kun glimepiridiannos oli 50-kertainen (rotilla) ja 0,1-kertainen (kaniinit) ihmiselle suositeltuun enimmäisannokseen verrattuna (kehon pinta-alan perusteella). Tämän sikiötoksisuuden, joka havaitaan vain äidin hypoglykemiaa aiheuttavilla annoksilla, uskotaan liittyvän suoraan glimepiridin farmakologiseen (hypoglykeemiseen) vaikutukseen, ja se on havaittu samalla tavalla muiden sulfonyyliureoiden yhteydessä. AMARYL-valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin. Koska tiedot viittaavat siihen, että epänormaali verensokeri raskauden aikana liittyy lisääntyneeseen synnynnäisten epämuodostumien ilmaantuvuuteen, raskaudenaikaisen diabeteksen hoidon tulee pitää verensokeri mahdollisimman lähellä normaalia.
Ei-teratogeeniset vaikutukset
Pitkäkestoista vaikeaa hypoglykemiaa (4–10 päivää) on raportoitu vastasyntyneillä, joiden äidit ovat saaneet sulfonyyliureaa synnytyksen aikana.
Imettävät äidit
Ei tiedetä, erittyykö AMARYL 1 mg äidinmaitoon. Pre- ja postnataalisissa tutkimuksissa rotilla rintamaidossa ja pentujen seerumissa oli merkittäviä glimepiridipitoisuuksia. Raskauden ja imetyksen aikana korkeille glimepiridipitoisuuksille altistuneiden rottien jälkeläisille kehittyi luuston epämuodostumia, jotka koostuivat olkaluun lyhenemisestä, paksuuntumisesta ja taipumisesta synnytyksen jälkeisenä aikana. Näiden luuston muodonmuutosten määritettiin johtuvan glimepiridille altistuneiden äitien imettämisestä. Näiden eläintietojen ja imetettävän lapsen hypoglykemian mahdollisuuden perusteella on päätettävä, lopetetaanko imetys vai AMARYL 2mg -hoito, ottaen huomioon AMARYLin merkitys äidille.
Käyttö lapsille
AMARYL 4 mg:n farmakokinetiikka, teho ja turvallisuus on arvioitu tyypin 2 diabetesta sairastavilla lapsipotilailla alla kuvatulla tavalla. AMARYL 4 mg:aa ei suositella lapsipotilaille, koska sillä on haitallisia vaikutuksia kehon painoon ja hypoglykemiaan.
AMARYLin 1 mg:n kerta-annoksen farmakokinetiikkaa arvioitiin 30 potilaalla, joilla oli tyypin 2 diabetes (mies = 7; nainen = 23) iässä 10–17 vuotta. Glimepiridin AUC (339±203 ng·hr/ml), Cmax (102±48 ng/ml) ja t½ (3,1±1,7 tuntia) keskiarvo (± SD) olivat verrattavissa aikuisten historiallisiin tietoihin (AUC(0-viimeinen) ) 315±96 ng·hr/ml, Cmax 103±34 ng/ml ja t½ 5,3±4,1 tuntia).
AMARYLin turvallisuutta ja tehoa lapsipotilailla arvioitiin yksisokkoutetussa 24 viikkoa kestäneessä tutkimuksessa, jossa 272 tyypin 2 diabetesta sairastavaa potilasta (8-17 vuotta) satunnaistettiin AMARYL- (n=135) tai metformiiniin (n=137). ). Sekä potilaat, jotka eivät olleet aiemmin saaneet hoitoa (ne, joita hoidettiin pelkällä ruokavaliolla ja liikunnalla vähintään 2 viikkoa ennen satunnaistamista) että aiemmin hoidetut potilaat (ne, joita on aiemmin hoidettu tai joita hoidettiin tällä hetkellä muilla suun kautta otetuilla diabeteslääkkeillä vähintään 3 kuukautta) olivat kelvollisia osallistumaan. Potilaat, jotka saivat suun kautta otettavia diabeteslääkkeitä tutkimukseen tullessa, lopettivat näiden lääkkeiden käytön ennen satunnaistamista ilman poistumisjaksoa. AMARYL aloitettiin annoksella 1 mg ja titrattiin sitten 2, 4 tai 8 mg:aan (keskimääräinen viimeinen annos 4 mg) viikkoon 12 saakka, jolloin tavoite oli itsevalvottu paastosormenpään verensokeri
24 viikon jälkeen AMARYL 4 mg:n ja metformiinin HbA1c:n keskimääräinen hoitoero oli 0,2 %, suosien metformiinia (95 %:n luottamusväli -0,3 % - +0,6 %). Näiden tulosten perusteella koe ei saavuttanut ensisijaista tavoitettaan osoittaa HbA1c:n samanlainen lasku AMARYL 4 mg:lla verrattuna metformiiniin.
Haittavaikutusten profiili AMARYL 2 mg:lla hoidetuilla lapsipotilailla oli samanlainen kuin aikuisilla [ks. HAITTAVAIKUTUKSET ].
Hypoglykeemisiä tapahtumia, jotka dokumentoitiin verensokeriarvoilla
Geriatrinen käyttö
AMARYL 2 mg:n kliinisissä tutkimuksissa 1053 potilaasta 3491:stä (30 %) oli yli 65-vuotiaita. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Glimepiridin farmakokinetiikassa ei ollut merkittäviä eroja potilaiden välillä, joilla oli tyypin 2 diabetes ≤ 65-vuotiaat (n=49) ja yli 65-vuotiaat (n=42) [ks. KLIININEN FARMAKOLOGIA ].
Glimepiridi erittyy pääosin munuaisten kautta. Iäkkäillä potilailla on todennäköisemmin munuaisten vajaatoiminta. Lisäksi hypoglykemiaa voi olla vaikea tunnistaa vanhuksilla [katso ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ]. Ole varovainen aloittaessasi AMARYL-hoidon ja suurentaessasi AMARYL 1 mg annosta tässä potilasryhmässä.
Munuaisten vajaatoiminta
Hypoglykemian riskin minimoimiseksi AMARYLin suositeltu aloitusannos on 1 mg päivässä kaikille potilaille, joilla on tyypin 2 diabetes ja munuaisten vajaatoiminta (ks. ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
Toistuvan annoksen titraustutkimus suoritettiin 16 tyypin 2 diabetesta ja munuaisten vajaatoimintaa sairastavalla potilaalla käyttäen annoksia, jotka vaihtelivat 1–8 mg päivässä 3 kuukauden ajan. Lähtötason kreatiniinipuhdistuma vaihteli välillä 10-60 ml/min. AMARYLin farmakokinetiikka arvioitiin toistuvan annoksen titraustutkimuksessa, ja tulokset vastasivat kerta-annostutkimukseen osallistuneilla potilailla saatuja tuloksia. Molemmissa tutkimuksissa AMARYLin suhteellinen kokonaispuhdistuma lisääntyi, kun munuaisten toiminta oli heikentynyt. Molemmat tutkimukset osoittivat myös, että kahden päämetaboliitin eliminaatio väheni munuaisten vajaatoimintaa sairastavilla potilailla [ks. KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
AMARYL 2 mg:n yliannostus, kuten muidenkin sulfonyyliureoiden, voi aiheuttaa vakavan hypoglykemian. Lieviä hypoglykemiajaksoja voidaan hoitaa suun kautta otettavalla glukoosilla. Vakavat hypoglykeemiset reaktiot ovat lääketieteellisiä hätätilanteita, jotka vaativat välitöntä hoitoa. Vaikea hypoglykemia, johon liittyy kooma, kouristuskohtauksia tai neurologisia häiriöitä, voidaan hoitaa glukagonilla tai suonensisäisellä glukoosilla. Jatkuva tarkkailu ja hiilihydraattien lisäsaanti voivat olla tarpeen, koska hypoglykemia voi uusiutua ilmeisen kliinisen toipumisen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
VASTA-AIHEET
AMARYL on vasta-aiheinen potilailla, joilla on aiemmin ollut yliherkkyysreaktio:
- Glimepiridi tai mikä tahansa tuotteen ainesosa [katso VAROITUKSET JA VAROTOIMET ].
Sulfonamidijohdannaiset: Potilaille, joille on kehittynyt allerginen reaktio sulfonamidijohdannaisille, saattaa kehittyä allerginen reaktio AMARYLille. Älä käytä AMARYL 4 mg:aa potilaille, joilla on aiemmin ollut allerginen reaktio sulfonamidijohdannaisille.
Raportoituja yliherkkyysreaktioita ovat ihon eruptiot kutinalla tai ilman, sekä vakavammat reaktiot (esim. anafylaksia, angioödeema, Stevens-Johnsonin oireyhtymä, hengenahdistus) [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Glimepiridi alentaa ensisijaisesti verensokeria stimuloimalla insuliinin vapautumista haiman beetasoluista. Sulfonyyliureat sitoutuvat sulfonyyliureareseptoriin haiman beetasolujen plasmakalvossa, mikä johtaa ATP-herkän kaliumkanavan sulkeutumiseen, mikä stimuloi insuliinin vapautumista.
Farmakodynamiikka
Terveillä koehenkilöillä aika maksimaalisen vaikutuksen (veren glukoosin vähimmäispitoisuudet) saavuttamiseen oli noin 2-3 tuntia AMARYLin kerta-annosten jälkeen. AMARYLin vaikutuksia HbA1c:hen, plasman paastoglukoosiin ja aterian jälkeiseen glukoosiin on arvioitu kliinisissä tutkimuksissa [ks. Kliiniset tutkimukset ].
Farmakokinetiikka
Imeytyminen
Glimepiridin kerta-annoksilla suun kautta annetuilla tutkimuksilla terveillä koehenkilöillä ja toistuvilla suun kautta otetuilla annoksilla tyypin 2 diabetespotilailla osoitti huippupitoisuudet (Cmax) 2–3 tuntia annoksen jälkeen. Kun glimepiridiä annettiin aterioiden yhteydessä, keskimääräinen Cmax ja AUC (käyrän alla oleva pinta-ala) pienenivät 8 % ja 9 %.
Glimepiridi ei kerry seerumiin toistuvan annostelun jälkeen. Glimepiridin farmakokinetiikka ei eroa terveiden koehenkilöiden ja tyypin 2 diabetespotilaiden välillä. Glimepiridin puhdistuma suun kautta annetun annon jälkeen ei muutu 1–8 mg:n annosalueella, mikä viittaa lineaariseen farmakokinetiikkaan.
Terveillä koehenkilöillä glimepiridin farmakokineettisten parametrien sisäiset ja yksilöiden väliset vaihtelut olivat 15-23 % ja 24-29 %.
Jakelu
Terveille koehenkilöille suonensisäisen annostelun jälkeen jakautumistilavuus (Vd) oli 8,8 l (113 ml/kg) ja kokonaispuhdistuma (CL) oli 47,8 ml/min. Proteiineihin sitoutuminen oli yli 99,5 %.
Aineenvaihdunta
Glimepiridi metaboloituu kokonaan oksidatiivisen biotransformaation kautta joko suonensisäisen tai suun kautta annetun annoksen jälkeen. Tärkeimmät metaboliitit ovat sykloheksyylihydroksimetyylijohdannainen (M1) ja karboksyylijohdannainen (M2). Sytokromi P450 2C9 osallistuu glimepiridin biotransformaatioon M1:ksi. M1 metaboloituu edelleen M2:ksi yhden tai useamman sytosolisen entsyymin toimesta. M2 ei ole aktiivinen. Eläimillä M1:llä on noin kolmasosa glimepiridin farmakologisesta aktiivisuudesta, mutta on epäselvää, onko M1:llä kliinisesti merkittäviä vaikutuksia ihmisen verensokeriin.
Erittyminen
Kun 14C-glimepiridiä annettiin suun kautta kolmelle terveelle mieshenkilölle, noin 60 % kokonaisradioaktiivisuudesta havaittiin virtsassa 7 päivässä. M1 ja M2 olivat 80-90 % virtsaan talteenotetusta radioaktiivisuudesta. M1:n ja M2:n suhde virtsassa oli noin 3:2 kahdella koehenkilöllä ja 4:1 yhdellä koehenkilöllä. Noin 40 % kokonaisradioaktiivisuudesta havaittiin ulosteessa. M1:n ja M2:n osuus oli noin 70 % (M1:n ja M2:n suhde 1:3) ulosteeseen talteenotetusta radioaktiivisuudesta. Virtsasta tai ulosteesta ei löytynyt emolääkettä. Suonensisäisen annostelun jälkeen ei havaittu glimepiridin tai sen M1-metaboliitin merkittävää erittymistä sappeen.
Geriatriset potilaat
Glimepiridin farmakokinetiikan vertailu potilailla, joilla oli tyypin 2 diabetes ≤ 65-vuotiaat ja yli 65-vuotiaat, arvioitiin toistuvassa tutkimuksessa, jossa käytettiin AMARYL 6 mg vuorokaudessa. Glimepiridin farmakokinetiikassa ei ollut merkittäviä eroja kahden ikäryhmän välillä. Keskimääräinen AUC vakaassa tilassa oli vanhemmilla potilailla noin 13 % pienempi kuin nuoremmilla potilailla; keskimääräinen painoon suhteutettu puhdistuma vanhemmilla potilailla oli noin 11 % suurempi kuin nuoremmilla potilailla.
Sukupuoli
Glimepiridin farmakokinetiikassa ei havaittu eroja miesten ja naisten välillä, kun painoerojen mukaisia muutoksia tehtiin.
Rotu
Ei ole tehty tutkimuksia rodun vaikutusten arvioimiseksi glimepiridin farmakokinetiikkaan, mutta lumekontrolloiduissa AMARYL 2 mg:n tutkimuksissa tyypin 2 diabetesta sairastavilla potilailla HbA:n lasku oli verrattavissa valkoihoisilla (n = 536), mustilla (n = 63). ja latinalaisamerikkalaiset (n = 63).
Munuaisten vajaatoiminta
Kerta-annos, avoin tutkimus AMARYL 3 mg annettiin potilaille, joilla oli lievä, keskivaikea ja vaikea munuaisten vajaatoiminta kreatiniinipuhdistuman (CLcr) perusteella: Ryhmä I koostui 5 potilaasta, joilla oli lievä munuaisten vajaatoiminta (CLcr > 50 ml/min). ), Ryhmä II koostui 3 potilaasta, joilla oli kohtalainen munuaisten vajaatoiminta (CLcr = 20-50 ml/min) ja ryhmä III koostui 7 potilaasta, joilla oli vaikea munuaisten vajaatoiminta (CLcr
Maksan vajaatoiminta
Ei tiedetä, vaikuttaako maksan vajaatoiminta AMARYL 1 mg:n farmakokinetiikkaan, koska AMARYL 1 mg:n farmakokinetiikkaa ei ole arvioitu riittävästi potilailla, joilla on maksan vajaatoiminta.
Liikalihavat potilaat
Glimepiridin ja sen metaboliittien farmakokinetiikkaa mitattiin kerta-annostutkimuksessa, johon osallistui 28 tyypin 2 diabetespotilasta, joilla oli joko normaali paino tai sairaalloisesti lihavia. Vaikka glimepiridin tmax, puhdistuma ja jakautumistilavuus sairaalloisesti lihavilla potilailla olivat samanlaiset kuin normaalipainoisilla potilailla, sairaalloisesti lihavilla potilailla oli alhaisempi Cmax ja AUC kuin normaalipainoisilla. Glimepiridin keskimääräiset Cmax-, AUC0-24-, AUC0-∞-arvot normaaleilla vs. sairaalloisesti lihavilla potilailla olivat 547 ± 218 ng/ml vs. 410 ± 124 ng/ml, 3210 ± 1030 tuntia·ng/ml vs. 28110 tuntia·ng/ml ja 4000 ± 1320 tuntia·ng/ml vs. 3280±1360 tuntia·ng/ml, vastaavasti.
Huumeiden vuorovaikutukset
Aspiriini: Satunnaistetussa, kaksoissokkoutetussa, kaksijaksoisessa risteyttävässä tutkimuksessa terveille koehenkilöille annettiin joko lumelääkettä tai aspiriinia 1 gramma kolme kertaa päivässä 5 päivän kokonaishoitojakson ajan. Kunkin tutkimusjakson 4. päivänä annettiin yksi 1 mg:n AMARYL-annos 4 mg. AMARYL 4 mg annokset erotettiin 14 päivän pesujaksolla. Aspiriinin ja AMARYL 4 mg:n samanaikainen käyttö pienensi glimepiridin keskimääräistä AUC-arvoa 34 % ja glimepiridin keskimääräistä Cmax-arvoa 4 %.
Colesevelam: Kolesevelamin ja glimepiridin samanaikainen käyttö pienensi glimepiridin AUC0-∞-arvoa 18 % ja Cmax 8 %. Kun glimepiridiä annettiin 4 tuntia ennen kolesevelaamia, glimepiridin AUC0-∞- ja Cmax-arvoissa ei tapahtunut merkittävää muutosta, -6 % ja 3 % [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
Simetidiini ja ranitidiini: Satunnaistetussa, avoimessa, 3-suuntaisessa ristikkäistutkimuksessa terveet koehenkilöt saivat joko kerta-annoksen AMARYL-valmistetta yksinään, AMARYL-valmistetta ranitidiinin kanssa (150 mg kahdesti päivässä 4 päivän ajan; AMARYL 2 mg annettiin päivänä 3) tai AMARYL-valmistetta. 2 mg simetidiinin kanssa (800 mg päivässä 4 päivän ajan; AMARYL annettiin päivänä 3). Simetidiinin tai ranitidiinin samanaikainen antaminen 4 mg:n kerta-annoksen AMARYL 4 mg:n kanssa ei merkittävästi muuttanut glimepiridin imeytymistä ja jakautumista.
Propranololi: Satunnaistetussa, kaksoissokkoutetussa, kahden jakson risteyttävässä tutkimuksessa terveille koehenkilöille annettiin joko lumelääkettä tai propranololia 40 mg kolme kertaa päivässä 5 päivän kokonaishoitojakson ajan. Päivänä 4 tai kullakin tutkimusjaksolla annettiin yksi 2 mg:n AMARYL-annos 4 mg. AMARYL 4 mg annokset erotettiin 14 päivän pesujaksolla. Propranololin ja AMARYL 1 mg:n samanaikainen anto suurensi merkitsevästi glimepiridin Cmax-arvoa, AUC-arvoa 23 %, 22 % ja T½ 15 %:lla ja pienensi glimepiridin CL/f-arvoa 18 %. M1:n ja M2:n palautuminen virtsasta ei muuttunut.
Varfariini: Avoimessa, kaksisuuntaisessa ristikkäistutkimuksessa terveet koehenkilöt saivat 4 mg AMARYL-valmistetta 2 mg päivässä 10 päivän ajan. Yksittäisiä 25 mg:n varfariiniannoksia annettiin 6 päivää ennen AMARYL-hoidon aloittamista ja AMARYL-annon 4. päivänä. AMARYLin samanaikainen anto ei muuttanut R- ja S-varfariinienantiomeerien farmakokinetiikkaa. Varfariinin sitoutumisessa plasman proteiineihin ei havaittu muutoksia. AMARYL 1 mg heikensi tilastollisesti merkitsevästi varfariinin farmakodynaamista vastetta. Keskimääräisen protrombiiniaikakäyrän (PT) alle jääneen alueen pieneneminen ja maksimi PT-arvojen pieneneminen AMARYL-hoidon aikana olivat 3,3 % ja 9,9 %, eivätkä ne todennäköisesti ole kliinisesti merkityksellisiä.
Kliiniset tutkimukset
Monoterapia
Yhteensä 304 tyypin 2 diabetesta sairastavaa potilasta, joita oli jo hoidettu sulfonyyliureahoidolla, osallistui 14 viikkoa kestäneeseen, satunnaistettuun, kaksoissokkoutettuun lumekontrolloituun tutkimukseen, jossa arvioitiin AMARYL 1 mg -monoterapian turvallisuutta ja tehoa. Potilaat keskeyttivät sulfonyyliureahoidon ja aloittivat 3 viikon lumelääkkeen poistojakson, jonka jälkeen satunnaistettiin yhteen neljästä hoitoryhmästä: lumelääke (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) ja AMARYL. 8 mg (n = 76). Kaikki potilaat, jotka satunnaistettiin saamaan AMARYL 4 mg, aloittivat annoksen 1 mg päivässä. Potilaat, jotka satunnaistettiin saamaan AMARYL 4 mg tai 8 mg, olivat sokkoutettuja, pakotettuja AMARYL 2 mg:n annoksen titrausta viikoittain ensin 4 mg:aan ja sitten 8 mg:aan niin kauan kuin annos siedettiin, kunnes satunnaistettu annos saavutettiin. Potilaat, jotka satunnaistettiin saamaan 4 mg:n annoksen, saavuttivat sovitun annoksen viikolla 2. Potilaat, jotka satunnaistettiin saamaan 8 mg:n annoksen, saavuttivat sovitun annoksen viikolla 3. Kun satunnaistettu annostaso oli saavutettu, potilaita oli jatkettava tällä annoksella viikkoon 14 asti. Noin 66 % lumelääkettä saaneista potilaista suoritti tutkimuksen päätökseen verrattuna 81 %:iin potilaista, jotka saivat glimepiridiä 1 mg:lla ja 92 %:lla potilaista, joita hoidettiin glimepiridillä 4 mg tai 8 mg. Plaseboon verrattuna hoito AMARYLilla 1 mg, 4 mg ja 8 mg päivässä paransi HbA1c:tä tilastollisesti merkitsevästi lumelääkkeeseen verrattuna (taulukko 3).
Yhteensä 249 potilasta, jotka eivät olleet aiemmin saaneet hoitoa tai jotka olivat aiemmin saaneet rajoitetusti diabeteslääkitystä, satunnaistettiin saamaan 22 viikon hoitoa joko AMARYL-valmisteella (n=123) tai lumelääke (n=126) satunnaistetussa monikeskuksessa. , kaksoissokkoutettu, lumekontrolloitu, annostitraustutkimus. AMARYLin aloitusannos oli 1 mg vuorokaudessa ja sitä titrattiin ylös- tai alaspäin 2 viikon välein FPG:n tavoitearvoon 90-150 mg/dl. Sekä FPG:n että PPG:n verensokeriarvot analysoitiin laboratoriossa. 10 viikon annoksen muuttamisen jälkeen potilaita pidettiin optimaalisella annoksellaan (1, 2, 3, 4, 6 tai 8 mg) tutkimuksen jäljellä olevan 12 viikon ajan. Hoito AMARYL 2 mg:lla paransi tilastollisesti merkitseviä HbA1c- ja FPG-arvoja lumelääkkeeseen verrattuna (taulukko 4).
POTILASTIEDOT
Kerro potilaille ruokavalio-ohjeiden noudattamisen, säännöllisen harjoitteluohjelman ja säännöllisen verensokerin mittauksen tärkeydestä.
Kerro potilaille AMARYL 1mg:n mahdollisista sivuvaikutuksista, mukaan lukien hypoglykemia ja painonnousu.
Selitä hypoglykemian oireet ja hoito sekä tilat, jotka altistavat hypoglykemialle. Potilaille tulee kertoa, että kyky keskittyä ja reagoida voi heikentyä hypoglykemian seurauksena. Tämä voi aiheuttaa riskin tilanteissa, joissa nämä kyvyt ovat erityisen tärkeitä, kuten autolla ajettaessa tai muiden koneiden käyttö.
Diabetespotilaita tulee neuvoa ilmoittamaan terveydenhuollon tarjoajalleen, jos he ovat raskaana, suunnittelevat raskautta, imettävät tai suunnittelevat imetystä.
