Actos 15mg, 30mg Pioglitazone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Actos on ja miten sitä käytetään?
Actos 15mg on reseptilääke, jota käytetään tyypin 2 diabeteksen oireiden hoitoon. Actosia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Actos on diabeteslääke, tiatsolidiinidionilääke.
Ei tiedetä, onko Actos 15 mg turvallinen ja tehokas lapsille.
Mitkä ovat Actos 15mg:n mahdolliset sivuvaikutukset?
Actos voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hengenahdistus (etenkin makuulla),
- epätavallinen väsymys,
- turvotus,
- nopea painonnousu,
- vaaleanpunainen tai punainen virtsa,
- kivulias tai vaikea virtsaaminen,
- uusi tai paheneva virtsaamistarve,
- näkö muuttuu ja
- äkillinen, epätavallinen kipu kädessä, käsivarressa tai jalassa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Actosin yleisimmät sivuvaikutukset ovat:
- päänsärky,
- lihaskipuja ja
- vilustumisoireet (nenän tukkoisuus, poskiontelokipu, aivastelu, kurkkukipu)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Nämä eivät ole kaikkia Actosin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SYDÄMEN VAJAATOIMINTA
- Tiatsolidiinidionit, mukaan lukien ACTOS 15 mg, aiheuttavat tai pahentavat kongestiivista sydämen vajaatoimintaa joillakin potilailla [ks. VAROITUKSET JA VAROTOIMET ].
- ACTOS 30 mg:n käytön aloittamisen jälkeen ja annoksen suurentamisen jälkeen on seurattava potilaita huolellisesti sydämen vajaatoiminnan merkkien ja oireiden varalta (esim. liiallinen, nopea painonnousu, hengenahdistus ja/tai turvotus). Jos sydämen vajaatoiminta kehittyy, sitä tulee hoitaa nykyisten hoitostandardien mukaisesti ja ACTOS 15 mg -annoksen lopettamista tai annoksen pienentämistä on harkittava.
- ACTOSia ei suositella potilaille, joilla on oireinen sydämen vajaatoiminta.
- ACTOS-hoidon aloittaminen potilailla, joilla on vakiintunut New York Heart Associationin (NYHA) luokan III tai IV sydämen vajaatoiminta, on vasta-aiheista [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
KUVAUS
ACTOS-tabletit ovat tiatsolidiinidioni ja peroksisomiproliferaattori-aktivoidun reseptorin (PPAR) gamma-agonisti, joka sisältää suun kautta otettavaa diabeteslääkettä: pioglitatsonia.
Pioglitatsoni [(±)-5-[[4-[2-(5-etyyli-2-pyridinyyli)etoksi]fenyyli]metyyli]-2,4-]tiatsolidiinidionimonohydrokloridi sisältää yhden asymmetrisen hiilen, ja yhdiste syntetisoidaan ja käytetään raseemisena seoksena. Pioglitatsonin kaksi enantiomeeriä muuntuvat keskenään in vivo. Farmakologisessa aktiivisuudessa ei havaittu eroja näiden kahden enantiomeerin välillä. Rakennekaava on seuraavanlainen:
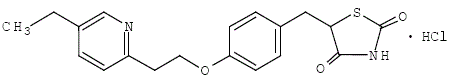
Pioglitatsonihydrokloridi on hajuton valkoinen kiteinen jauhe, jonka molekyylikaava on C19H20N2O3S•HCl ja molekyylipaino 392,90 daltonia. Se liukenee N,N-dimetyyliformamidiin, liukenee hieman vedettömään etanoliin, liukenee hyvin vähän asetoniin ja asetonitriiliin, käytännössä liukenematon veteen ja liukenematon eetteriin.
ACTOS on saatavana tabletteina suun kautta annettavaksi, joka sisältää 15 mg, 30 mg tai 45 mg pioglitatsonia (emäksenä), joka on formuloitu seuraavien apuaineiden kanssa: laktos 30 mg monohydraatti NF, hydroksipropyyliselluloosa NF, karboksimetyyliselluloosa kalsium NF ja magnesiumstearaatti NF.
INDIKAATIOT
Monoterapia ja yhdistelmähoito
ACTOS 30mg on tarkoitettu ruokavalion ja liikunnan lisänä parantamaan verensokerin hallintaa tyypin 2 diabetes mellitusta sairastavilla aikuisilla useissa kliinisissä olosuhteissa [ks. Kliiniset tutkimukset ].
Tärkeitä käytön rajoituksia
ACTOS 15 mg:lla on antihyperglykeeminen vaikutus vain endogeenisen insuliinin läsnä ollessa. ACTOS 30mg -valmistetta ei tule käyttää tyypin 1 diabeteksen tai diabeettisen ketoasidoosin hoitoon, koska se ei ole tehokas näissä olosuhteissa.
Ole varovainen potilailla, joilla on maksasairaus [katso VAROITUKSET JA VAROTOIMET ].
ANNOSTELU JA HALLINNOINTI
Suosituksia kaikille potilaille
ACTOS 15 mg tulee ottaa kerran päivässä, ja se voidaan ottaa aterioista riippumatta.
Suositeltu aloitusannos potilaille, joilla ei ole kongestiivista sydämen vajaatoimintaa, on 15 mg tai 30 mg kerran vuorokaudessa.
Suositeltu aloitusannos potilaille, joilla on kongestiivista sydämen vajaatoimintaa (NYHA-luokka I tai II), on 15 mg kerran vuorokaudessa.
Annosta voidaan titrata 15 mg:n kerrallaan enintään 45 mg:aan kerran vuorokaudessa HbA1c:n määrittämän glykeemisen vasteen perusteella.
ACTOS 30 mg:n käytön aloittamisen jälkeen tai annosta suurennettaessa, seuraa potilaita huolellisesti nesteretentioon liittyvien haittavaikutusten varalta, kuten painonnousu, turvotus ja kongestiivisen sydämen vajaatoiminnan merkit ja oireet [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Maksakokeet (seerumin alaniini- ja aspartaattiaminotransferaasit, alkalinen fosfataasi ja kokonaisbilirubiini) tulee ottaa ennen ACTOS-hoidon aloittamista. Maksakokeiden rutiininomaista säännöllistä seurantaa ACTOS 30 mg -hoidon aikana ei suositella potilaille, joilla ei ole maksasairautta. Potilaita, joilla on poikkeavuuksia maksakokeissa ennen ACTOS-hoidon aloittamista tai joiden maksakokeissa todetaan poikkeavia ACTOS-hoidon aikana, tulee hoitaa kohdassa Varoitukset ja varotoimet kuvatulla tavalla [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Samanaikainen käyttö insuliinin eritystä lisäävän aineen tai insuliinin kanssa
Jos potilaalla, joka saa samanaikaisesti ACTOS 30 mg:n ja insuliinin eritystä lisäävää ainetta (esim. sulfonyyliureaa), ilmenee hypoglykemiaa, insuliinin eritystä lisäävän aineen annosta on pienennettävä.
Jos potilaalla, jolle annettiin samanaikaisesti ACTOS 30 mg insuliinia, ilmenee hypoglykemiaa, insuliiniannosta tulee pienentää 10–25 %. Insuliiniannoksen lisäsäädöt tulee tehdä yksilöllisesti glykeemisen vasteen perusteella.
Samanaikainen käyttö vahvojen CYP2C8-estäjien kanssa
ACTOS 30 mg:n ja gemfibrotsiilin, vahvan CYP2C8-estäjän, samanaikainen käyttö lisää pioglitatsonialtistusta noin kolminkertaiseksi. Siksi ACTOSin suurin suositeltu annos on 15 mg päivässä, kun sitä käytetään yhdessä gemfibrotsiilin tai muiden vahvojen CYP2C8-estäjien kanssa (ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Pyöreä tabletti sisältää pioglitatsonia seuraavasti:
- 15 mg: Valkoinen tai luonnonvalkoinen, jonka toisella puolella on kaiverrus "ACTOS" ja toisella puolella "15"
- 30 mg: Valkoinen tai luonnonvalkoinen, jonka toisella puolella on kaiverrus ”ACTOS” ja toisella ”30”
- 45 mg: Valkoinen tai luonnonvalkoinen, jonka toisella puolella on kaiverrus "ACTOS" ja toisella puolella "45"
Varastointi ja käsittely
ACTOS on saatavana 15 mg, 30 mg ja 45 mg tabletteina seuraavasti:
15 mg tabletti : Valkoinen tai luonnonvalkoinen, pyöreä, kupera, jakouurteinen tabletti, jonka toisella puolella on merkintä "ACTOS" ja toisella puolella "15", saatavilla:
NDC 64764-151-04 30 pullot NDC 64764-151-05 90 pullot NDC 64764-151-06 500 pullot
30 mg tabletti Valkoinen tai luonnonvalkoinen, pyöreä, litteä, jakouurteinen tabletti, jonka toisella puolella on ”ACTOS” ja toisella ”30”, saatavilla
NDC 64764-301-14 30 pulloa NDC 64764-301-15 90 pulloa NDC 64764-301-16 500 pulloa
45 mg tabletti : Valkoinen tai luonnonvalkoinen, pyöreä, litteä, jakouurteinen tabletti, jonka toisella puolella on ”ACTOS” ja toisella ”45”, saatavana seuraavilla kielillä:
NDC 64764-451-24 30 pulloa NDC 64764-451-25 90 pulloa NDC 64764-451-26 500 pulloa
Varastointi
Säilytä 25°C (77°F); retket sallitaan 15-30 °C:seen (59-86 °F) [katso USP Controlled Room Temperature]. Säilytä tiiviisti suljettuna ja suojaa valolta, kosteudelta ja kosteudelta.
Jakelija: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Tarkistettu: joulukuu 2017
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään muualla merkinnöissä:
- Kongestiivinen sydämen vajaatoiminta [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Turvotus [katso VAROITUKSET JA VAROTOIMET ]
- Murtumat [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yli 8 500 tyypin 2 diabetesta sairastavaa potilasta on hoidettu ACTOS:lla satunnaistetuissa, kaksoissokkoutetuissa, kontrolloiduissa kliinisissä tutkimuksissa, mukaan lukien 2 605 potilasta, joilla on tyypin 2 diabetes ja makrovaskulaarinen sairaus, joita hoidettiin ACTOS 30 mg:lla PROactive-kliinisessä tutkimuksessa. Näissä tutkimuksissa yli 6 000 potilasta on hoidettu ACTOS:lla kuuden kuukauden ajan tai pidempään, yli 4 500 potilasta on hoidettu ACTOS 15 mg:lla vähintään vuoden ajan, ja yli 3 000 potilasta on hoidettu ACTOS:lla vähintään kahden vuoden ajan.
Kuudessa yhdistetyssä 16–26 viikkoa kestäneessä lumekontrolloidussa monoterapiatutkimuksessa ja 16–24 viikkoa kestäneessä lisäyhdistelmähoitotutkimuksessa haittavaikutuksista johtuvien keskeytysten ilmaantuvuus oli 4,5 % potilaista, joita hoidettiin ACTOS 30 mg:lla ja 5,8 % vertailuvalmisteella. hoidettuja potilaita. Yleisimmät vieroitusoireisiin johtaneet haittatapahtumat liittyivät riittämättömään verensokeritasapainoon, vaikka näiden tapahtumien ilmaantuvuus oli pienempi (1,5 %) ACTOS 30 mg:lla kuin lumelääkkeellä (3,0 %).
PROactive-tutkimuksessa haittavaikutuksista johtuvien keskeytysten ilmaantuvuus oli 9,0 % ACTOS 30 mg:lla hoidetuista potilaista ja 7,7 % lumelääkettä saaneista potilaista. Kongestiivinen sydämen vajaatoiminta oli yleisin vakava haittatapahtuma, joka johti vieroitusoireisiin 1,3 %:lla ACTOS 30 mg:lla hoidetuista potilaista ja 0,6 %:lla lumelääkettä saaneista potilaista.
Yleiset haittatapahtumat: 16–26 viikon monoterapiatutkimukset
Taulukossa 1 on yhteenveto yleisten haittatapahtumien esiintyvyydestä ja tyypeistä, jotka on raportoitu kolmessa yhdistetyssä 16–26 viikkoa kestäneessä lumekontrolloidussa ACTOS-monoterapiatutkimuksessa. Raportoidut termit edustavat niitä, joita esiintyi yli 5 %:n ilmaantuvuudella ja useammin. ACTOS 15 mg:lla hoidetuilla potilailla kuin lumelääkettä saaneilla potilailla. Mikään näistä haittatapahtumista ei liittynyt ACTOS-annokseen.
Yleiset haittatapahtumat: 16–24 viikkoa kestävät lisäyhdistelmähoitokokeet
Taulukossa 2 on yhteenveto yleisistä haittatapahtumista ja yleisistä haittatapahtumien tyypeistä, jotka on raportoitu ACTOS-lisäaineella sulfonyyliureaan. annos ACTOSia.
Taulukossa 3 on yhteenveto ACTOS 30 mg metformiinin lisäravinteen tutkimuksissa raportoitujen yleisten haittatapahtumien yleisestä ilmaantumisesta ja tyypeistä. Raportoidut termit edustavat niitä, joita esiintyi yli 5 %:n ilmaantuvuudella ja yleisemmin korkeimmalla. testattu ACTOS-annos.
Taulukossa 4 on yhteenveto insuliinin ACTOS-lisäaineen tutkimuksissa raportoitujen yleisten haittatapahtumien esiintyvyydestä ja tyypeistä. Raportoidut termit edustavat niitä, jotka esiintyivät yli 5 %:n ilmaantuvuudella ja yleisemmin suurimmalla testatulla ACTOS-annoksella.
Taulukossa 5 on yhteenveto PROactive-tutkimuksessa raportoitujen yleisten haittatapahtumien yleisestä esiintyvyydestä ja tyypeistä. Raportoidut termit edustavat niitä, joita esiintyi >5 %:lla ja yleisemmin ACTOS-hoitoa saaneilla potilailla kuin potilailla, jotka saivat sai lumelääkettä.
Sydämen vajaatoiminta
Taulukossa 6 on yhteenveto kongestiiviseen sydämen vajaatoimintaan liittyvien haittatapahtumien esiintyvyydestä 16–24 viikkoa kestäneille sulfonyyliureatutkimuksille, 16–24 viikkoa kestäneille insuliinitutkimuksille ja 16-24 viikon lisä metformiinitutkimuksiin. Mikään tapahtuma ei ollut kohtalokas.
Tyypin 2 diabetesta ja NYHA-luokan II tai varhaisen luokan III kongestiivista sydämen vajaatoimintaa sairastavat potilaat satunnaistettiin saamaan 24 viikon kaksoissokkohoitoa joko 30 mg ACTOS:lla 30-45 mg:n vuorokausiannoksilla (n=262) tai glyburidilla päivittäisinä annoksina. 10 mg - 15 mg (n = 256). Taulukossa 7 on yhteenveto tässä tutkimuksessa raportoitujen kongestiiviseen sydämen vajaatoimintaan liittyvien haittatapahtumien esiintyvyydestä.
Taulukossa 8 on yhteenveto PROactive-tutkimuksen aikana tapahtuneesta kongestiivisesta sydämen vajaatoiminnasta, joka johti sairaalahoitoon.
Sydän- ja verisuoniturvallisuus
PROactive-tutkimuksessa 5238 potilasta, joilla oli tyypin 2 diabetes ja joilla oli aiemmin ollut makrovaskulaarinen sairaus, satunnaistettiin ACTOS:iin (N=2605), titrattiin 45 mg:aan päivässä tai lumelääkkeeseen (N=2633) normaalihoidon lisäksi. Lähes kaikki potilaat (95 %) saivat sydän- ja verisuonilääkkeitä (beetasalpaajia, ACE:n estäjiä, angiotensiini II -reseptorin salpaajia, kalsiumkanavasalpaajia, nitraatteja, diureetteja, aspiriinia, statiineja ja fibraatteja). Lähtötilanteessa potilaiden keski-ikä oli 62 vuotta, diabeteksen keskimääräinen kesto 9,5 vuotta ja keskimääräinen HbA1c 8,1 %. Keskimääräinen seuranta-aika oli 34,5 kuukautta. Tämän tutkimuksen ensisijaisena tavoitteena oli tutkia ACTOS:n vaikutusta kuolleisuuteen ja makrovaskulaariseen sairastumiseen potilailla, joilla oli tyypin 2 diabetes mellitus ja joilla oli suuri riski saada makrovaskulaarisia tapahtumia. Ensisijainen tehokkuusmuuttuja oli aika minkä tahansa tapahtuman ensimmäiseen esiintymiseen kardiovaskulaarisessa yhdistetyssä päätetapahtumassa, joka sisälsi kuolleisuuden kaikista syistä, ei-fataali sydäninfarkti (MI), mukaan lukien hiljainen MI, aivohalvaus, akuutti sepelvaltimooireyhtymä, sydämen interventio, mukaan lukien sepelvaltimon ohitusleikkaus tai perkutaaninen interventio, suuri jalan amputaatio nilkan yläpuolella ja ohitusleikkaus tai revaskularisaatio jalassa. Yhteensä 514 (19,7 %) potilasta, joita hoidettiin ACTOS 15 mg:lla ja 572 (21,7 %) lumelääkettä, koki ainakin yhden tapahtuman ensisijaisesta yhdistetystä päätepisteestä (riskisuhde 0,90; 95 %:n luottamusväli: 0,80, 1,02; p=0,10 ).
Vaikka ACTOS:n ja lumelääkkeen välillä ei ollut tilastollisesti merkitsevää eroa kolmen vuoden ensimmäisen tapahtuman ilmaantuvuudessa tässä yhdistelmässä, ACTOS ei lisännyt kuolleisuutta tai makrovaskulaaristen tapahtumien kokonaismäärää. Ensisijaiseen yhdistettyyn päätepisteeseen vaikuttaneiden ensimmäisten esiintymien ja yksittäisten tapahtumien kokonaismäärä on esitetty taulukossa 9.
Painonnousu
Annosriippuvaista painonnousua tapahtuu, kun ACTOS 30 mg:aa käytetään yksinään tai yhdessä muiden diabeteslääkkeiden kanssa. Painonnousun mekanismi on epäselvä, mutta siihen liittyy todennäköisesti nesteen kertymisen ja rasvan kertymisen yhdistelmä.
Taulukoissa 10 ja 11 on yhteenveto kehon painon muutoksista ACTOS:n ja lumelääkkeen kanssa 16–26 viikon satunnaistetuissa, kaksoissokkoutetuissa monoterapiatutkimuksissa ja 16–24 viikkoa kestäneissä yhdistelmähoitotutkimuksissa sekä PROactive-tutkimuksessa.
Turvotus
ACTOS-hoidon aiheuttama turvotus palautuu, kun ACTOS-hoito lopetetaan. Turvotus ei yleensä vaadi sairaalahoitoa, ellei samanaikaisesti ole kongestiivinen sydämen vajaatoiminta. Taulukossa 12 on yhteenveto ACTOS 30 mg:n kliinisissä tutkimuksissa esiintyneiden turvotushaittatapahtumien yleisyydestä ja tyypeistä.
Maksavaikutukset
ACTOSin kontrolloidussa kliinisessä tutkimustietokannassa ei ole toistaiseksi havaittu näyttöä ACTOSin aiheuttamasta maksatoksisuudesta. Yksi satunnaistettu, kaksoissokkoutettu 3 vuoden tutkimus, jossa verrattiin ACTOS 15 mg:aa glyburidiin metformiinin ja insuliinihoidon lisänä, suunniteltiin erityisesti arvioimaan seerumin ALAT-arvon nousua yli kolme kertaa viitealueen ylärajaan verrattuna, mitattuna joka kerta. kahdeksan viikkoa ensimmäisen 48 viikon kokeilujakson ajan ja sen jälkeen 12 viikon välein. Yhteensä 3/1051 (0,3 %) ACTOS-hoitoa saaneesta potilaasta ja 9 1046 (0,9 %) glyburidilla hoidetusta potilaasta sai ALAT-arvot yli kolme kertaa vertailualueen ylärajan. Yhdelläkään ACTOS-hoidolla hoidetuista potilaista ACTOS-kontrolloitujen kliinisten tutkimusten tietokannassa ei ole tähän mennessä ollut seerumin ALT-arvo yli kolme kertaa vertailualueen ylärajaa ja vastaava kokonaisbilirubiini yli kaksi kertaa vertailualueen yläraja. yhdistelmä, joka ennakoi vakavan lääkkeiden aiheuttaman maksavaurion mahdollisuutta.
Hypoglykemia
ACTOS 15 mg:n kliinisissä tutkimuksissa hypoglykemian haittatapahtumia raportoitiin tutkijoiden kliinisen arvion perusteella, eivätkä ne vaatineet vahvistusta sormenpään glukoositestauksella.
16 viikkoa kestäneessä sulfonyyliurean lisätutkimuksessa raportoitujen hypoglykemian ilmaantuvuus oli 3,7 % ACTOS 30 mg:lla ja 0,5 % lumelääkkeellä. 16 viikkoa kestäneessä insuliinitutkimuksessa raportoitujen hypoglykemian ilmaantuvuus oli 7,9 % ACTOS 15 mg:lla, 15,4 % ACTOS 30 mg:lla ja 4,8 % lumelääkkeellä.
Ilmoitettujen hypoglykemian ilmaantuvuus oli suurempi ACTOS 45 mg:lla verrattuna ACTOS 30 mg:aan sekä 24 viikon sulfonyyliureatutkimuksessa (15,7 % vs. 13,4 %) että 24 viikon insuliinin lisätutkimuksessa (47,8). % vs. 43,5 %).
Kolme potilasta näissä neljässä tutkimuksessa joutui sairaalaan hypoglykemian vuoksi. Kaikki kolme potilasta saivat ACTOS 30 mg (0,9 %) 24 viikkoa kestäneessä insuliinin lisätutkimuksessa. Lisäksi 14 potilasta ilmoitti vakavasta hypoglykemiasta (määritelty aiheuttavan huomattavaa häiriötä potilaan tavallisiin toimintoihin), joka ei vaatinut sairaalahoitoa. Nämä potilaat saivat ACTOS 45 mg yhdessä sulfonyyliurean kanssa (n = 2) tai ACTOS 30 mg tai 45 mg yhdessä insuliinin kanssa (n = 12).
Virtsarakon kasvaimet
Kasvaimia havaittiin urosrottien virtsarakossa kaksivuotisessa karsinogeenisuustutkimuksessa [ks. Ei-kliininen toksikologia ]. Kolmivuotisen kliinisen PROactive-tutkimuksen aikana 14 potilaalla 2605:stä (0,54 %) ACTOS:iin satunnaistetusta potilaasta ja 5 2633:sta lumelääkkeeseen satunnaistetusta potilaasta (0,19 %) diagnosoitiin virtsarakon syöpä. Kun poissuljettiin potilaat, joiden altistuminen tutkimuslääkkeelle oli alle vuoden virtsarakon syövän diagnosointihetkellä, ACTOS 15 mg:n tapauksia oli 6 (0,23 %) ja lumelääkettä kaksi (0,08 %). Tutkimuksen päätyttyä suurta osaryhmää potilaita tarkkailtiin vielä 10 vuoden ajan, ja ACTOS-altistus oli vähäistä. Sekä PROaktiivisen että havainnoivan seurannan 13 vuoden aikana virtsarakon syövän esiintyvyys ei eronnut ACTOS:iin tai lumelääkkeeseen satunnaistettujen potilaiden välillä (HR = 1,00; 95 % CI: 0,59-1,72) [ks. VAROITUKSET JA VAROTOIMET ].
Laboratoriohäiriöt
Hematologiset vaikutukset
ACTOS 15 mg voi aiheuttaa hemoglobiinin ja hematokriitin laskua. Plasebokontrolloiduissa monoterapiatutkimuksissa keskimääräiset hemoglobiiniarvot laskivat 2–4 % ACTOS-hoitoa saaneilla potilailla, kun taas lumelääkettä saaneiden potilaiden hemoglobiinin keskimääräinen muutos oli -1–+1 %. Nämä muutokset ilmenivät pääasiassa ensimmäisten 4–12 hoitoviikon aikana ja pysyivät suhteellisen vakioina sen jälkeen. Nämä muutokset voivat liittyä ACTOS 30 mg -hoitoon liittyvään suurentuneeseen plasmatilavuuteen, eivätkä ne todennäköisesti liity kliinisesti merkittäviin hematologisiin vaikutuksiin.
Kreatiinifosfokinaasi
Protokollaspesifisen seerumin kreatiinifosfokinaasin (CPK) mittauksen aikana ACTOS:n 15 mg:n kliinisissä tutkimuksissa CPK:n erillinen nousu yli 10-kertaiseksi viitealueen ylärajaan verrattuna havaittiin yhdeksällä (0,2 %) ACTOS-hoidolla saaneella potilaalla (arvot 2150-11400 IU/l) eikä vertailuvalmisteilla hoidetuilla potilailla. Kuusi näistä yhdeksästä potilaasta jatkoi ACTOS 15 mg:n saamista, kahdella potilaalla havaittiin CPK-arvon nousu viimeisenä annostuspäivänä ja yksi potilas keskeytti ACTOS-hoidon kohonneen annoksen vuoksi. Nämä nousut hävisivät ilman näkyviä kliinisiä seurauksia. Näiden tapahtumien yhteyttä ACTOS 30 mg -hoitoon ei tunneta.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu ACTOSin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei yleensä ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
- Uusi tai paheneva diabeettinen makulaturvotus ja heikentynyt näöntarkkuus [katso VAROITUKSET JA VAROTOIMET ].
- Kuolemaan johtava ja ei-fataali maksan vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ].
Markkinoille tulon jälkeen on raportoitu kongestiivista sydämen vajaatoimintaa potilailla, joita on hoidettu ACTOS:lla, sekä potilailla, joilla on aiemmin tunnettu sydänsairaus tai ilman sitä ja sekä samanaikaisesti insuliinin kanssa että ilman sitä.
Markkinoille tulon jälkeen on raportoitu epätavallisen nopeaa painonnousua ja kliinisissä tutkimuksissa yleensä havaittua suurempia painonnousuja. Potilailta, jotka kokevat tällaista nousua, tulee arvioida nesteen kertymistä ja tilavuuteen liittyviä tapahtumia, kuten liiallista turvotusta ja sydämen vajaatoimintaa [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
HUUMEIDEN VUOROVAIKUTUKSET
Vahvat CYP2C8:n estäjät
CYP2C8:n estäjä (esim. gemfibrotsiili) lisää merkittävästi pioglitatsonin altistusta (seerumin pitoisuus-aikakäyrän tai AUC:n alla oleva pinta-ala) ja puoliintumisaikaa (t½). Siksi ACTOSin suurin suositeltu annos on 15 mg päivässä, jos sitä käytetään yhdessä gemfibrotsiilin tai muiden vahvojen CYP2C8-estäjien kanssa (ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
CYP2C8-indusoijat
CYP2C8:n indusoija (esim. rifampiini) voi merkittävästi pienentää pioglitatsonin altistusta (AUC). Siksi, jos CYP2C8:n indusoija aloitetaan tai lopetetaan ACTOS 30 mg -hoidon aikana, diabeteksen hoitoon saatetaan tarvita muutoksia kliinisen vasteen perusteella ylittämättä kuitenkaan ACTOSin suositeltua enimmäisvuorokausiannosta 45 mg [ks. KLIININEN FARMAKOLOGIA ].
Topiramaatti
Pioglitatsonin ja sen aktiivisten metaboliittien altistumisen havaittiin pienenevän, kun pioglitatsonia ja topiramaatia annettiin samanaikaisesti [ks. KLIININEN FARMAKOLOGIA ]. Tämän laskun kliinistä merkitystä ei tunneta; kuitenkin, kun ACTOSia ja topiramaattia käytetään samanaikaisesti, potilaiden verensokeritasapainon on oltava riittävän hallinnassa.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Sydämen vajaatoiminta
ACTOS 15mg, kuten muutkin tiatsolidiinidionit, voi aiheuttaa annoksesta riippuvaa nesteretentiota, kun sitä käytetään yksinään tai yhdessä muiden diabeteslääkkeiden kanssa, ja se on yleisin, kun ACTOS 30 mg:aa käytetään yhdessä insuliinin kanssa. Nesteen kertyminen voi johtaa sydämen vajaatoimintaan tai pahentaa sitä. Potilaita tulee tarkkailla kongestiivisen sydämen vajaatoiminnan merkkien ja oireiden varalta. Jos sydämen vajaatoiminta kehittyy, sitä tulee hoitaa nykyisten hoitostandardien mukaisesti ja ACTOS-hoidon lopettamista tai annoksen pienentämistä on harkittava [ks. LAATIKKO VAROITUS , VASTA-AIHEET , ja HAITTAVAIKUTUKSET ].
Hypoglykemia
Potilailla, jotka saavat ACTOSia yhdessä insuliinin tai muiden diabeteslääkkeiden (erityisesti insuliinin eritystä lisäävien aineiden, kuten sulfonyyliureoiden) kanssa, voi olla hypoglykemian riski. Samanaikaisen diabeteslääkkeen annoksen pienentäminen saattaa olla tarpeen hypoglykemian riskin vähentämiseksi [ks. ANNOSTELU JA HALLINNOINTI ].
Maksavaikutukset
Markkinoille tulon jälkeen on raportoitu kuolemaan johtaneesta ja ei-kuolemaan johtaneesta maksan vajaatoiminnasta potilailla, jotka ovat saaneet ACTOS 15 mg:aa, vaikka raportit eivät sisälläkään riittävästi tietoa todennäköisen syyn määrittämiseksi. ACTOS 30 mg:n kontrolloidussa kliinisessä tutkimustietokannassa ei ole tähän mennessä ollut todisteita lääkkeiden aiheuttamasta maksatoksisuudesta [ks. HAITTAVAIKUTUKSET ].
Tyypin 2 diabetesta sairastavilla potilailla voi olla rasvamaksasairaus tai sydänsairaus, johon liittyy episodista kongestiivista sydämen vajaatoimintaa, jotka molemmat voivat aiheuttaa poikkeavuuksia maksakokeissa, ja heillä voi olla myös muita maksasairauden muotoja, joista monia voidaan hoitaa tai hoitaa. Siksi on suositeltavaa hankkia maksatestipaneeli (seerumin alaniiniaminotransferaasi [ALT], aspartaattiaminotransferaasi [AST], alkalinen fosfataasi ja kokonaisbilirubiini) ja arvioida potilas ennen ACTOS-hoidon aloittamista. ACTOS 15 mg -hoito tulee aloittaa varoen potilailla, joiden maksakokeiden tulokset ovat poikkeavia.
Mittaa maksakokeet viipymättä potilailta, jotka ilmoittavat oireista, jotka voivat viitata maksavaurioon, mukaan lukien väsymys, anoreksia, epämukava tunne oikealla ylävatsassa, tumma virtsa tai keltaisuus. Tässä kliinisessä tilanteessa, jos potilaalla todetaan poikkeavia maksakokeita (ALAT yli 3 kertaa vertailualueen yläraja), ACTOS 15 mg -hoito tulee keskeyttää ja tehdä tutkimus todennäköisen syyn selvittämiseksi. ACTOS-hoitoa ei pidä aloittaa uudelleen näillä potilailla ilman muuta selitystä maksakokeiden poikkeavuuksille.
Potilailla, joiden seerumin ALAT on yli kolme kertaa vertailualue ja seerumin kokonaisbilirubiini yli kaksi kertaa vertailualue ilman vaihtoehtoisia syitä, on vaarassa saada vakava lääkkeiden aiheuttama maksavaurio, eikä ACTOS-hoitoa tule aloittaa uudelleen. ACTOS-hoitoa voidaan käyttää varoen potilaille, joilla on vähäisemmät seerumin ALAT- tai bilirubiinipitoisuudet ja joilla on jokin toinen todennäköinen syy.
Virtsarakon kasvaimet
Kasvaimia havaittiin urosrottien virtsarakossa kaksivuotisessa karsinogeenisuustutkimuksessa [ks. Ei-kliininen toksikologia ]. Lisäksi kolmivuotisen kliinisen PROactive-tutkimuksen aikana 14 potilaalla 2605:stä (0,54 %), jotka satunnaistettiin saamaan ACTOS 15 mg, ja 5 potilaalla 2 633:sta (0,19 %) lumelääkkeeseen, diagnosoitiin virtsarakon syöpä. Kun poissuljettiin potilaat, joiden altistus tutkimuslääkkeelle oli alle vuoden virtsarakon syövän diagnosointihetkellä, ACTOS 30 mg:n tapauksia oli 6 (0,23 %) ja lumelääkettä kaksi (0,08 %). Tutkimuksen päätyttyä suurta osaryhmää potilaita tarkkailtiin vielä 10 vuoden ajan, ja ACTOS-altistus oli vähäistä. Sekä PROaktiivisen että havainnollisen seurannan 13 vuoden aikana virtsarakon syövän esiintyvyys ei eronnut potilailla, jotka oli satunnaistettu saamaan ACTOS 30 mg tai lumelääkettä (HR = 1,00; [95 % CI: 0,59-1,72]).
Löydökset virtsarakon syövän riskistä potilailla, jotka ovat altistuneet ACTOS:lle, vaihtelevat havainnointitutkimuksissa; Jotkut eivät havainneet lisääntynyttä virtsarakon syövän riskiä ACTOS 30 mg:n käyttöön liittyen, kun taas toiset havaitsivat.
Yhdysvalloissa suoritettu laaja prospektiivinen 10 vuoden havaintokohorttitutkimus ei löytänyt tilastollisesti merkitsevää lisäystä virtsarakon syövän riskissä diabeetikoilla, jotka eivät koskaan olleet altistuneet ACTOS:lle, verrattuna potilaisiin, jotka eivät koskaan olleet altistuneet ACTOS:lle (HR = 1,06 [95 % CI 0,89-1,26) ]).
Yhdistyneen kuningaskunnan tiedoilla suoritettu retrospektiivinen kohorttitutkimus havaitsi tilastollisesti merkitsevän yhteyden ACTOS-altistuksen ja virtsarakon syövän välillä (HR: 1,63; [95 % CI: 1,22-2,19]).
Yhteyttä kumulatiivisen annoksen tai ACTOS 15 mg:lle altistumisen kumulatiivisen keston ja virtsarakon syövän välillä ei havaittu joissakin tutkimuksissa, mukaan lukien 10 vuoden havainnointitutkimuksessa Yhdysvalloissa, mutta toisissa havaittiin. Näihin ja muihin tutkimuksiin liittyvät epäjohdonmukaiset havainnot ja rajoitukset estävät havaintotietojen ratkaisevan tulkinnan.
ACTOS saattaa liittyä virtsarakon kasvainten riskin lisääntymiseen. Ei ole riittävästi tietoa sen määrittämiseksi, onko pioglitatsoni kasvainpromoottori virtsarakon kasvaimissa.
Tämän vuoksi ACTOSia ei tule käyttää potilailla, joilla on aktiivinen virtsarakon syöpä, ja verensokerin hallinnan hyötyjä verrattuna ACTOS:n aiheuttaman syövän uusiutumisen tuntemattomiin riskeihin tulee harkita potilailla, joilla on aiemmin ollut virtsarakon syöpä.
Turvotus
Kontrolloiduissa kliinisissä tutkimuksissa turvotusta raportoitiin useammin potilailla, joita hoidettiin ACTOS 30 mg:lla kuin lumelääkettä saaneilla potilailla, ja se on annoksesta riippuvaista [ks. HAITTAVAIKUTUKSET ]. Markkinoille tulon jälkeen on saatu raportteja turvotuksen uudesta tai pahenemisesta.
ACTOS 15 mg:aa tulee käyttää varoen potilailla, joilla on turvotus. Koska tiatsolidiinidionit, mukaan lukien ACTOS, voivat aiheuttaa nesteretentiota, mikä voi pahentaa sydämen vajaatoimintaa tai johtaa kongestiiviseen sydämen vajaatoimintaan, ACTOS 30 mg:aa tulee käyttää varoen potilailla, joilla on kongestiivisen sydämen vajaatoiminnan riski. ACTOS-hoitoa saavia potilaita tulee seurata kongestiivisen sydämen vajaatoiminnan merkkien ja oireiden varalta [katso LAATIKKO VAROITUS , Sydämen vajaatoiminta ja POTILASTIEDOT ].
Murtumia
PROactivessa (Prospective Pioglitazone Clinical Trial in Macrovascular Events) 5238 potilasta, joilla oli tyypin 2 diabetes ja joilla oli aiemmin ollut makrovaskulaarinen sairaus, satunnaistettiin ACTOS-ryhmään (N = 2605), voimatitrattiin 45 mg:aan päivässä tai lumelääkkeeseen (N = 2633). normaalin hoidon lisäksi. Keskimääräisen 34,5 kuukauden seurantajakson aikana luunmurtumien ilmaantuvuus naisilla oli 5,1 % (44/870) ACTOS 30 mg:lla verrattuna 2,5 %:iin (23/905) lumelääkettä saaneilla. Tämä ero havaittiin ensimmäisen hoitovuoden jälkeen ja säilyi tutkimuksen ajan. Suurin osa naispotilailla havaituista murtumista oli muita kuin nikamamurtumia, mukaan lukien alaraajojen ja distaalisen yläraajan murtumia. Murtumien ilmaantuvuuden lisääntymistä ei havaittu ACTOS-hoitoa saaneilla miehillä (1,7 %) verrattuna lumelääkkeeseen (2,1 %). Murtumariski tulee ottaa huomioon hoidettaessa potilaita, erityisesti naispotilaita, joita hoidetaan ACTOS:lla, ja huomiota tulee kiinnittää luun terveyden arviointiin ja ylläpitämiseen nykyisten hoitostandardien mukaisesti.
Makulaarinen turvotus
Makulaarista turvotusta on raportoitu markkinoille tulon jälkeen diabeetikoilla, jotka käyttivät ACTOS-valmistetta tai muuta tiatsolidiinidionia. Joillakin potilailla oli näön hämärtymistä tai näöntarkkuuden heikkenemistä, mutta toiset diagnosoitiin rutiininomaisessa oftalmologisessa tutkimuksessa.
Useimmilla potilailla oli perifeerinen turvotus silloin, kun makulaturvotus diagnosoitiin. Joillakin potilailla makulaturvotus parani tiatsolidiinidionin käytön lopettamisen jälkeen.
Diabetespotilaiden tulee käydä säännöllisesti silmälääkärin näöntarkastuksessa nykyisten hoitostandardien mukaisesti. Diabetespotilaat, jotka ilmoittavat kaikista näköoireista, tulee lähettää viipymättä silmälääkärille riippumatta potilaan taustalla olevista lääkkeistä tai muista fyysisistä löydöksistä [ks. HAITTAVAIKUTUKSET ].
Makrovaskulaariset tulokset
Ei ole tehty kliinisiä tutkimuksia, jotka osoittaisivat vakuuttavaa näyttöä makrovaskulaarisen riskin pienenemisestä ACTOS:lla.
Potilasneuvontatiedot
Katso FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
- On tärkeää ohjeistaa potilaita noudattamaan ruokavalio-ohjeita ja mittaamaan säännöllisesti verensokerin ja glykosyloidun hemoglobiinin. Stressin aikana, kuten kuumeen, trauman, infektion tai leikkauksen aikana, lääkitysvaatimukset voivat muuttua, ja potilaita on muistutettava hakeutumaan välittömästi lääkärin hoitoon.
- Potilaiden, jotka kokevat epätavallisen nopeaa painonnousua tai turvotusta tai joille kehittyy hengenahdistusta tai muita sydämen vajaatoiminnan oireita ACTOS-hoidon aikana, tulee välittömästi ilmoittaa näistä oireista lääkärille.
- Kerro potilaille, että he lopettavat välittömästi ACTOSin käytön ja hakeuduttava välittömästi lääkärin hoitoon, jos ilmaantuu selittämätöntä pahoinvointia, oksentelua, vatsakipua, väsymystä, ruokahaluttomuutta tai tummaa virtsaa, koska nämä oireet voivat johtua maksatoksisuudesta.
- Pyydä potilaita ilmoittamaan viipymättä kaikista makroskooppisen hematurian merkeistä tai muista oireista, kuten dysuriasta tai virtsaamistarpeesta, jotka kehittyvät tai lisääntyvät hoidon aikana, koska ne voivat johtua virtsarakon syövästä.
- Kerro potilaille, että he ottavat ACTOS 15 mg kerran päivässä. ACTOS 15 mg voidaan ottaa aterian yhteydessä tai ilman. Jos annos jää väliin jonakin päivänä, annosta ei saa kaksinkertaistaa seuraavana päivänä.
- Käytettäessä yhdistelmähoitoa insuliinin tai muiden diabeteslääkkeiden kanssa hypoglykemian riskit, sen oireet ja hoito sekä sen kehittymiselle altistavat tilat tulee selittää potilaille ja heidän perheenjäsenilleen.
- Kerro naispotilaille, että ACTOS 30 mg:n hoito, kuten muutkin tiatsolidiinidionit, voi johtaa tahattomaan raskauteen joillakin premenopausaalisilla anovulaatiota aiheuttavilla naisilla sen vaikutuksensa vuoksi ovulaatioon [ks. Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kaksivuotinen karsinogeenisuustutkimus suoritettiin uros- ja naarasrotilla suun kautta annetuilla annoksilla 63 mg/kg asti (noin 14 kertaa suurempi kuin ihmiselle suositeltu suurin suun kautta otettava annos 45 mg perustuen mg/m2). Lääkkeiden aiheuttamia kasvaimia ei havaittu missään elimessä paitsi urosrottien virtsarakossa. Hyvänlaatuisia ja/tai pahanlaatuisia siirtymäsolukasvaimia havaittiin urosrotilla annoksella 4 mg/kg/vrk ja enemmän (suunnilleen sama kuin suurin suositeltu ihmisen suun kautta otettava annos mg/m2:n perusteella). Virtsakiven ja sitä seuranneen ärsytyksen ja hyperplasian oletettiin olevan urosrotilla havaittujen virtsarakon kasvainten mekanismi. Kaksivuotinen mekanistinen tutkimus urosrotilla, joissa hyödynnettiin ravinnon happamoittamista hammaskiven muodostumisen vähentämiseksi, valmistui vuonna 2009. Ruokavalion happamoittaminen vähensi, mutta ei poistanut virtsarakon hyperplastisia muutoksia. Kivikiven esiintyminen pahensi hyperplastista vastetta pioglitatsonille, mutta sitä ei pidetty hyperplastisten muutosten ensisijaisena syynä.
Urosrotan virtsarakon löydösten merkitystä ihmisille ei voida sulkea pois.
Kaksivuotinen karsinogeenisuustutkimus tehtiin myös uros- ja naarashiirillä suun kautta annetuilla annoksilla aina 100 mg/kg/vrk asti (noin 11 kertaa suurin suositeltu ihmiselle suun kautta otettava annos mg/m2:n perusteella). Missään elimessä ei havaittu lääkkeiden aiheuttamia kasvaimia.
Pioglitatsonihydrokloridi ei ollut mutageeninen joukossa geneettisiä toksikologisia tutkimuksia, mukaan lukien Amesin bakteerimääritys, nisäkässolujen eteenpäin suuntautuva geenimutaatiomääritys (CHO/HPRT ja AS52/XPRT), in vitro sytogeneettinen määritys CHL-soluja käyttäen, suunnittelematon DNA-synteesimääritys ja in vivo -mikronukleusmääritys.
Mitään haitallisia vaikutuksia hedelmällisyyteen ei havaittu uros- ja naarasrotilla, kun pioglitatsonihydrokloridia annettiin suun kautta 40 mg/kg:aan vuorokaudessa ennen parittelua ja tiineyttä ja sen aikana (noin yhdeksän kertaa suurin suositeltu ihmiselle suun kautta otettava annos mg/m2:n perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Rajoitetut tiedot ACTOS:sta raskaana oleville naisille eivät riitä määrittämään lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Raskauden aikana huonosti hallittavaan diabetekseen liittyy riskejä äidille ja sikiölle [katso Kliiniset näkökohdat ].
Eläinten lisääntymistutkimuksissa ei havaittu haitallisia kehitysvaikutuksia, kun pioglitatsonia annettiin tiineille rotille ja kaneille organogeneesin aikana altistuksilla, jotka olivat korkeintaan 5-kertaisia ja 35-kertaisia 45 mg:n kliiniseen annokseen verrattuna kehon pinta-alan perusteella [ks. Data ].
Vakavien synnynnäisten epämuodostumien taustariski on 6–10 % naisilla, joilla on raskausta edeltävä diabetes ja HbA1c >7, ja sen on raportoitu olevan jopa 20–25 % naisilla, joiden HbA1c on >10. Arvioitua keskenmenon taustariskiä mainitulle väestölle ei tunneta. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Huonosti hallittu raskausdiabetes lisää äidin riskiä sairastua diabeettiseen ketoasidoosiin, pre-eklampsiaan, spontaaniin aborttiin, ennenaikaiseen synnytykseen, kuolleena synnytykseen ja synnytyksen komplikaatioihin. Huonosti hallittu diabetes lisää sikiön vakavien synnynnäisten epämuodostumien, kuolleena syntymisen ja makrosomiaan liittyvän sairastuvuuden riskiä.
Data
Eläinten tiedot
Tiineille rotille organogeneesin aikana annettu pioglitatsoni ei aiheuttanut haitallisia kehitysvaikutuksia annoksella 20 mg/kg (noin 5 kertaa kliininen annos 45 mg), mutta viivästytti synnytystä ja heikensi alkion ja sikiön elinkelpoisuutta annoksilla 40 ja 80 mg/kg tai ≥ 9-kertainen kliiniseen 45 mg:n annokseen verrattuna kehon pinta-alan mukaan. Tiineillä kaniineilla, joille annettiin pioglitatsonia organogeneesin aikana, ei havaittu haitallisia kehitysvaikutuksia annoksella 80 mg/kg (noin 35-kertainen kliininen annos 45 mg), mutta heikensi alkion ja sikiön elinkelpoisuutta annoksella 160 mg/kg tai noin 69-kertaisesti verrattuna 45 mg:n kliiniseen annokseen. annos kehon pinta-alan mukaan. Kun tiineille rotille annettiin pioglitatsonia myöhään tiineyden ja imetyksen aikana, jälkeläisillä esiintyi 10 mg/kg:n ja sitä suuremmilla annoksilla tai ≥ 2 kertaa kliiniseen 45 mg:n annokseen verrattuna ruumiin pinta-alan mukaan laskettua ruumiinpainon laskusta johtuvaa syntymän jälkeistä kehitystä.
Imetys
Riskien yhteenveto
Ei ole tietoa pioglitatsonin esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon. Pioglitatsonia on rotan maidossa; Lajikohtaisten erojen vuoksi imetyksen fysiologiassa eläintiedot eivät kuitenkaan välttämättä ennusta luotettavasti äidinmaidon lääkepitoisuuksia. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen ACTOS 15 mg -annoksen tarve ja ACTOS 30 mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Keskustele ei-toivotun raskauden mahdollisuudesta premenopausaalisten naisten kanssa, koska ACTOS-hoito, kuten muutkin tiatsolidiinidionit, voi aiheuttaa ovulaation joillakin anovulaatiota saavilla naisilla.
Käyttö lapsille
ACTOSin turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
ACTOS 15 mg:aa ei suositella käytettäväksi lapsipotilailla aikuisilla havaittujen haittavaikutusten perusteella, mukaan lukien nesteen kertyminen ja sydämen vajaatoiminta, murtumat ja virtsarakon kasvaimet [ks. VAROITUKSET JA VAROTOIMET ].
Geriatrinen käyttö
Yhteensä 92 potilasta (15,2 %), joita hoidettiin ACTOS:lla kolmessa yhdistetyssä 16–26 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa, monoterapiatutkimuksessa, oli ≥65-vuotiaita ja kaksi potilasta (0,3 %) oli ≥75-vuotiaita. Kahdessa yhdistetyssä 16–24 viikkoa kestäneessä sulfonyyliurean lisätutkimuksessa 201 potilasta (18,7 %), joita hoidettiin ACTOS 30 mg:lla, oli ≥65-vuotiaita ja 19 (1,8 %) ≥75-vuotiaita. Kahdessa yhdistetyssä 16–24 viikkoa kestäneessä metformiinin lisätutkimuksessa 155 ACTOS:lla hoidettua potilasta (15,5 %) oli ≥65-vuotiaita ja 19 (1,9 %) ≥75-vuotiaita. Kahdessa yhdistetyssä 16–24 viikkoa kestäneessä insuliinitutkimuksessa 272 ACTOS:lla hoidettua potilasta (25,4 %) oli ≥65-vuotiaita ja 22 (2,1 %) ≥75-vuotiaita.
PROactive-tutkimuksessa 1068 ACTOS:lla hoidettua potilasta (41,0 %) oli ≥65-vuotiaita ja 42 (1,6 %) ≥75-vuotiaita.
Pioglitatsonin farmakokineettisissä tutkimuksissa ei havaittu merkittäviä eroja iäkkäiden ja nuorempien potilaiden farmakokineettisissä parametreissa [ks. KLIININEN FARMAKOLOGIA ].
Vaikka kliiniset kokemukset eivät ole havainneet eroja tehokkuudessa ja turvallisuudessa iäkkäiden (≥65-vuotiaiden) ja nuorempien potilaiden välillä, näitä päätelmiä rajoittaa 75-vuotiaiden potilaiden pienet otokset.
YLIANNOSTUS
Kontrolloiduissa kliinisissä tutkimuksissa raportoitiin yksi ACTOS 30 mg:n yliannostustapaus. Miespotilas otti 120 mg päivässä neljän päivän ajan, sitten 180 mg päivässä seitsemän päivän ajan. Potilas kielsi kaikki kliiniset oireet tänä aikana.
Yliannostustapauksessa on aloitettava asianmukainen tukihoito potilaan kliinisten merkkien ja oireiden mukaisesti.
VASTA-AIHEET
- Aloitus potilailla, joilla on todettu NYHA-luokan III tai IV sydämen vajaatoiminta [katso LAATIKKO VAROITUS ].
- Käyttö potilailla, joiden tiedetään olevan yliherkkiä pioglitatsonille tai jollekin muulle ACTOSin aineosalle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
ACTOS 15mg on tiatsolidiinidioni, jonka vaikutusmekanismi riippuu insuliinin läsnäolosta. ACTOS vähentää insuliiniresistenssiä periferiassa ja maksassa, mikä johtaa lisääntyneeseen insuliinista riippuvaisen glukoosin hävittämiseen ja hepaattisen glukoosin tuotannon vähenemiseen. Pioglitatsoni ei ole insuliinin eritystä lisäävä aine. Pioglitatsoni on peroksisomiproliferaattorilla aktivoidun reseptori-gamma-reseptori (PPARa) agonisti. PPAR-reseptoreita löytyy kudoksista, jotka ovat tärkeitä insuliinitoiminnan kannalta, kuten rasvakudoksessa, luustolihaksessa ja maksassa. PPAR:n aktivointi? tumareseptorit moduloivat useiden insuliiniresponsiivisten geenien transkriptiota, jotka osallistuvat glukoosi- ja lipidiaineenvaihdunnan säätelyyn.
Diabetes-eläinmalleissa pioglitatsoni vähentää hyperglykemiaa, hyperinsulinemiaa ja hypertriglyseridemiaa, jotka ovat ominaisia insuliiniresistenteille tiloille, kuten tyypin 2 diabetekselle. Pioglitatsonin tuottamat metaboliset muutokset johtavat insuliinista riippuvaisten kudosten lisääntyneeseen vasteeseen, ja niitä havaitaan useissa insuliiniresistenssin eläinmalleissa.
Koska pioglitatsoni tehostaa kiertävän insuliinin vaikutuksia (vähentämällä insuliiniresistenssiä), se ei alenna verensokeria eläinmalleissa, joista puuttuu endogeeninen insuliini.
Farmakodynamiikka
Kliiniset tutkimukset osoittavat, että ACTOS 15mg parantaa insuliiniherkkyyttä insuliiniresistenteillä potilailla. ACTOS parantaa solujen vastetta insuliinille, lisää insuliinista riippuvaista glukoosin hävittämistä ja parantaa maksan herkkyyttä insuliinille. Tyypin 2 diabetesta sairastavilla potilailla ACTOS:n aiheuttama vähentynyt insuliiniresistenssi johtaa alhaisempiin plasman glukoosipitoisuuksiin, alhaisempiin plasman insuliinipitoisuuksiin ja alhaisempiin HbA1c-arvoihin. Kontrolloiduissa kliinisissä tutkimuksissa ACTOS:lla oli additiivinen vaikutus glukoositasapainoon, kun sitä käytettiin yhdessä sulfonyyliurean, metformiinin tai insuliinin kanssa [ks. Kliiniset tutkimukset ].
Potilaat, joilla oli lipidipoikkeavuuksia, otettiin mukaan ACTOSin kliinisiin tutkimuksiin. Kaiken kaikkiaan ACTOS 15 mg:lla hoidetuilla potilailla seerumin triglyseridiarvot laskivat keskimäärin, HDL-kolesteroli nousi keskimäärin, eikä LDL- ja kokonaiskolesteroliarvoissa ollut johdonmukaisia keskimääräisiä muutoksia. ACTOSin makrovaskulaarisesta hyödystä ei ole ratkaisevaa näyttöä [katso VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
26 viikkoa kestäneessä lumekontrolloidussa, annosvaihteluissa monoterapiatutkimuksessa seerumin triglyseridien keskiarvo laski 15 mg:n, 30 mg:n ja 45 mg:n ACTOS:n 15 mg:n annosryhmissä verrattuna keskimääräiseen nousuun lumeryhmässä. Keskimääräinen HDL-kolesteroli nousi enemmän potilailla, joita hoidettiin ACTOS 30 mg:lla kuin lumelääkettä saaneilla potilailla. ACTOS-hoitoa saaneiden potilaiden LDL- ja kokonaiskolesteroliarvoissa ei ollut johdonmukaisia eroja lumelääkkeeseen verrattuna (katso taulukko 14).
Kahdessa muussa monoterapiatutkimuksessa (16 viikkoa ja 24 viikkoa) ja yhdistelmähoitotutkimuksissa, joissa käytettiin sulfonyyliureaa (16 viikkoa ja 24 viikkoa), metformiinia (16 viikkoa ja 24 viikkoa) tai insuliinia (16 viikkoa ja 24 viikkoa), tulokset olivat yleensä sopusoinnussa yllä olevien tietojen kanssa.
Farmakokinetiikka
Kerran vuorokaudessa 15 mg:n ACTOS:n annon jälkeen sekä pioglitatsonin että sen tärkeimpien aktiivisten metaboliittien M-III:n (pioglitatsonin ketojohdannainen) ja M-IV:n (pioglitatsonin hydroksyylijohdannainen) vakaan tilan seerumipitoisuudet saavutetaan seitsemän päivän kuluessa. Vakaassa tilassa M-III ja M-IV saavuttavat seerumipitoisuudet, jotka ovat yhtä suuret tai suuremmat kuin pioglitatsonin. Vakaassa tilassa pioglitatsoni muodostaa sekä terveillä vapaaehtoisilla että tyypin 2 diabetespotilailla noin 30–50 % pioglitatsonin seerumin huippupitoisuudesta (pioglitatsoni plus aktiiviset metaboliitit) ja 20–25 % kokonais-AUC:sta.
Pioglitatsonin ja M-III:n ja M-IV:n Cmax, AUC ja seerumin alimmat pitoisuudet (Cmin) nousivat suhteessa 15 mg:n ja 30 mg:n vuorokausiannoksilla.
Imeytyminen
Pioglitatsonin oraalisen annon jälkeen pioglitatsonin Tmax oli kahden tunnin sisällä. Ruoka viivästyttää Tmax-arvoa 3–4 tuntiin, mutta ei muuta imeytymisen laajuutta (AUC).
Jakelu
Pioglitatsonin keskimääräinen näennäinen jakautumistilavuus (Vd/F) kerta-annoksen jälkeen on 0,63 ± 0,41 (keskiarvo ± SD) l/painokilo. Pioglitatsoni sitoutuu laajasti (> 99 %) proteiineihin ihmisen seerumissa, pääasiassa seerumin albumiiniin. Pioglitatsoni sitoutuu myös muihin seerumin proteiineihin, mutta pienemmällä affiniteetilla. M-III ja M-IV sitoutuvat myös laajasti (>98 %) seerumin albumiiniin.
Aineenvaihdunta
Pioglitatsoni metaboloituu laajalti hydroksylaation ja hapettumisen kautta; metaboliitit muuttuvat myös osittain glukuronidi- tai sulfaattikonjugaateiksi. Metaboliitit M-III ja M-IV ovat tärkeimmät verenkierrossa olevat aktiiviset metaboliitit ihmisillä.
In vitro -tiedot osoittavat, että pioglitatsonin metaboliaan osallistuu useita CYP-isoformeja, joihin kuuluvat CYP2C8 ja vähäisemmässä määrin CYP3A4 sekä useat muut isomuodot, mukaan lukien pääasiassa maksan ulkopuolinen CYP1A1. In vivo -tutkimus pioglitatsonista yhdessä gemfibrotsiilin kanssa, joka on voimakas CYP2C8-estäjä, osoitti, että pioglitatsoni on CYP2C8-substraatti [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ]. ACTOS 30 mg:lla hoidetuilla potilailla mitatut virtsan 6β-hydroksikortisoli/kortisolisuhteet osoittivat, että pioglitatsoni ei ole voimakas CYP3A4-entsyymin indusoija.
Erittyminen ja Eliminaatio
Suun kautta otetun pioglitatsonin annoksesta noin 15–30 % erittyy virtsaan. Pioglitatsonin eliminaatio munuaisten kautta on vähäistä, ja lääke erittyy pääasiassa metaboliitteina ja niiden konjugaatteina. Suurimman osan suun kautta otetusta annoksesta oletetaan erittyvän sappeen joko muuttumattomana tai metaboliitteina ja ulosteen mukana.
Pioglitatsonin ja sen metaboliittien (M-III ja M-IV) keskimääräinen puoliintumisaika seerumissa (t1/2) on 3–7 tuntia ja 16–24 tuntia. Pioglitatsonin näennäinen puhdistuma, CL/F, on laskettu 5-7 l/h.
Munuaisten vajaatoiminta
Pioglitatsonin, M-III:n ja M-IV:n eliminaation puoliintumisaika seerumissa pysyy muuttumattomana potilailla, joilla on keskivaikea (kreatiniinipuhdistuma [CLcr] 30-50 ml/min) ja vaikea (CLcr
Maksan vajaatoiminta
Terveisiin verrokkeihin verrattuna potilailla, joilla on maksan vajaatoiminta (Child-Turcotte-Pugh aste B/C), pioglitatsonin ja kokonaispioglitatsonin (pioglitatsoni, M-III ja M-IV) keskimääräinen Cmax pienenee noin 45 %, mutta ei muutosta keskimääräiset AUC-arvot. Siksi annosta ei tarvitse muuttaa potilailla, joilla on maksan vajaatoiminta.
Markkinoille tulon jälkeen on raportoitu maksan vajaatoiminnasta ACTOS:n yhteydessä, ja kliinisissä tutkimuksissa on yleensä suljettu pois potilaat, joiden seerumin ALAT on > 2,5 kertaa vertailualueen yläraja. Ole varovainen potilailla, joilla on maksasairaus [katso VAROITUKSET JA VAROTOIMET ].
Geriatriset potilaat
Terveillä iäkkäillä koehenkilöillä pioglitatsonin Cmax ei eronnut merkitsevästi, mutta AUC-arvot olivat noin 21 % korkeammat kuin nuoremmilla koehenkilöillä. Pioglitatsonin keskimääräinen t1/2 oli myös pidentynyt iäkkäillä koehenkilöillä (noin kymmenen tuntia) verrattuna nuorempiin koehenkilöihin (noin seitsemän tuntia). Nämä muutokset eivät olleet sellaisia, että niitä pidettäisiin kliinisesti merkittävinä.
Pediatriset potilaat
Pioglitatsonin turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu. ACTOS 15 mg:aa ei suositella käytettäväksi lapsipotilailla [katso Käyttö tietyissä populaatioissa ].
Sukupuoli
Pioglitatsonin keskimääräiset Cmax- ja AUC-arvot suurenivat naisilla 20–60 % miehiin verrattuna. Kontrolloiduissa kliinisissä tutkimuksissa HbA1c:n lasku lähtötasosta oli yleensä suurempi naisilla kuin miehillä (keskimääräinen HbA1c:n ero 0,5 %). Koska hoito tulee räätälöidä kullekin potilaalle yksilöllisesti glykeemisen tason saavuttamiseksi, annoksen muuttamista ei suositella pelkästään sukupuolen perusteella.
Etnisyys
Eri etnisten ryhmien farmakokineettisiä tietoja ei ole saatavilla.
Huumeiden väliset vuorovaikutukset
Eläinten toksikologia ja/tai farmakologia
Sydämen suurenemista on havaittu hiirillä (100 mg/kg), rotilla (4 mg/kg ja enemmän) ja koirilla (3 mg/kg), joita on hoidettu oraalisesti pioglitatsonihydrokloridilla (noin 11, 1 ja 2 kertaa suurin suositeltu suun kautta annettava ihmiselle) hiirille, rotille ja koirille, vastaavasti, perustuen mg/m2:een). Vuoden kestäneessä rotalla tehdyssä tutkimuksessa lääkkeeseen liittyvä varhainen kuolema ilmeisen sydämen toimintahäiriön vuoksi tapahtui suun kautta annetulla annoksella 160 mg/kg/vrk (noin 35 kertaa suurin suositeltu ihmisen suun kautta otettava annos mg/m2:n perusteella). Sydämen suurenemista havaittiin 13 viikkoa kestäneessä tutkimuksessa apinoilla suun kautta annetuilla annoksilla 8,9 mg/kg tai enemmän (noin neljä kertaa suurin suositeltu ihmisen suun kautta otettava annos mg/m2:n perusteella), mutta ei 52 viikon tutkimuksessa suun kautta otetuilla annoksilla. jopa 32 mg/kg (noin 13 kertaa suurin suositeltu suun kautta otettava annos, joka perustuu mg/m2:een).
Kliiniset tutkimukset
Monoterapia
Kolme satunnaistettua, kaksoissokkoutettua, lumekontrolloitua tutkimusta, jotka kestivät 16–26 viikkoa, suoritettiin arvioimaan ACTOSin käyttöä monoterapiana tyypin 2 diabetespotilailla. Näissä tutkimuksissa tutkittiin ACTOS 15 mg annoksilla enintään 45 mg tai lumelääke kerran vuorokaudessa yhteensä 865 potilaalla.
26 viikkoa kestäneessä monoterapiatutkimuksessa 408 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin saamaan 7,5 mg, 15 mg, 30 mg tai 45 mg ACTOSia tai lumelääkettä kerran päivässä. Hoito millä tahansa aikaisemmalla diabeteslääkkeellä lopetettiin kahdeksan viikkoa ennen kaksoissokkojaksoa. Hoito 15 mg:lla, 30 mg:lla ja 45 mg:lla ACTOS 30 mg:aa tuotti tilastollisesti merkitseviä parannuksia HbA1c:ssä ja plasman paastoglukoosissa (FPG) päätepisteessä lumelääkkeeseen verrattuna (katso kuva 1, taulukko 17).
Kuvassa 1 on esitetty HbA1c:n muutosten aikakulku tässä 26 viikkoa kestäneessä tutkimuksessa.
Kuva 1. HbA1c:n keskimääräinen muutos lähtötilanteesta 26 viikon lumekontrolloidussa annosvälitutkimuksessa (havaitut arvot)
24 viikkoa kestäneessä lumekontrolloidussa monoterapiatutkimuksessa 260 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin johonkin kahdesta pakkotitraushoitoryhmästä ACTOS-hoitoryhmään tai valetitraus lumelääkeryhmään. Hoito millä tahansa aikaisemmalla diabeteslääkkeellä lopetettiin kuusi viikkoa ennen kaksoissokkojaksoa. Yhdessä ACTOS 15 mg:n hoitoryhmässä potilaat saivat aloitusannoksen 7,5 mg kerran vuorokaudessa. Neljän viikon kuluttua annosta nostettiin 15 mg:aan kerran vuorokaudessa ja seuraavan neljän viikon kuluttua annos nostettiin 30 mg:aan kerran vuorokaudessa tutkimuksen loppuajan (16 viikkoa). Toisessa ACTOS-hoitoryhmässä potilaat saivat aloitusannoksen 15 mg kerran vuorokaudessa ja titrattiin 30 mg:aan kerran vuorokaudessa ja 45 mg:aan kerran vuorokaudessa samalla tavalla. Kuvattu hoito ACTOS 15 mg:lla sai aikaan tilastollisesti merkitseviä parannuksia HbA1c- ja FPG-arvoissa päätepisteessä lumelääkkeeseen verrattuna (katso taulukko 18).
16 viikkoa kestäneessä monoterapiatutkimuksessa 197 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin saamaan 30 mg ACTOSia tai lumelääkettä kerran päivässä. Hoito millä tahansa aikaisemmalla diabeteslääkkeellä lopetettiin kuusi viikkoa ennen kaksoissokkojaksoa. Hoito 30 mg:lla ACTOS:a tuotti tilastollisesti merkitseviä parannuksia HbA1c- ja FPG-arvoihin päätepisteessä verrattuna lumelääkkeeseen (katso taulukko 19).
Yhdistelmäterapia
Kolme 16 viikon satunnaistettua, kaksoissokkoutettua, lumekontrolloitua kliinistä tutkimusta suoritettiin arvioimaan ACTOS:n (15 mg ja/tai 30 mg) vaikutuksia verensokeritasapainoon tyypin 2 diabetesta sairastavilla potilailla, jotka eivät olleet riittävästi hallinnassa (HbA1c ≥8). %) huolimatta nykyisestä sulfonyyliurea-, metformiini- tai insuliinihoidosta. Lisäksi suoritettiin kolme 24 viikon satunnaistettua, kaksoissokkoutettua kliinistä tutkimusta, joissa arvioitiin ACTOS 30 mg:n vs. ACTOS 45 mg:n vaikutuksia verensokeritasapainoon tyypin 2 diabetesta sairastavilla potilailla, jotka eivät olleet riittävässä hallinnassa (HbA1c ≥8 %) nykyisestä huolimatta. hoito sulfonyyliurealla, metformiinilla tai insuliinilla. Aiempi diabeteksen hoito on voinut olla monoterapiaa tai yhdistelmähoitoa.
Lisäys sulfonyyliureakokeisiin
Kaksi kliinistä tutkimusta suoritettiin ACTOS:lla yhdessä sulfonyyliurean kanssa. Molempiin tutkimuksiin osallistui tyypin 2 diabetesta sairastavia potilaita, jotka saivat mitä tahansa sulfonyyliureaannosta joko yksinään tai yhdessä toisen diabeteslääkkeen kanssa. Kaikki muut diabeteslääkkeet poistettiin käytöstä vähintään kolme viikkoa ennen tutkimushoidon aloittamista.
Ensimmäisessä tutkimuksessa 560 potilasta satunnaistettiin saamaan 15 mg tai 30 mg ACTOS 30 mg tai lumelääke kerran vuorokaudessa 16 viikon ajan nykyisen sulfonyyliureahoitonsa lisäksi. Hoito ACTOS:lla sulfonyyliurean lisänä tuotti tilastollisesti merkitseviä parannuksia HbA1c- ja FPG-arvoissa päätepisteessä verrattuna lumelääkkeeseen sulfonyyliureaan (katso taulukko 20).
Toisessa tutkimuksessa 702 potilasta satunnaistettiin saamaan 30 mg tai 45 mg ACTOSia kerran päivässä 24 viikon ajan nykyisen sulfonyyliureahoitonsa lisäksi. HbA1c:n keskimääräinen lasku lähtötasosta viikolla 24 oli 1,6 % 30 mg:n annoksella ja 1,7 % 45 mg:n annoksella (katso taulukko 21). FPG:n keskimääräinen lasku lähtötasosta viikolla 24 oli 52 mg/dl 30 mg:n annoksella ja 56 mg/dl 45 mg:n annoksella.
ACTOS:n terapeuttinen vaikutus yhdessä sulfonyyliurean kanssa havaittiin potilailla sulfonyyliurean annoksesta riippumatta.
Lisäys metformiinitutkimuksiin
Kaksi kliinistä tutkimusta suoritettiin ACTOS 30 mg:lla yhdessä metformiinin kanssa. Molempiin tutkimuksiin osallistui tyypin 2 diabetesta sairastavia potilaita, jotka saivat mitä tahansa metformiiniannosta joko yksinään tai yhdessä toisen diabeteslääkkeen kanssa. Kaikki muut diabeteslääkkeet poistettiin käytöstä vähintään kolme viikkoa ennen tutkimushoidon aloittamista.
Ensimmäisessä tutkimuksessa 328 potilasta satunnaistettiin saamaan joko 30 mg ACTOSia tai lumelääkettä kerran päivässä 16 viikon ajan nykyisen metformiinihoitonsa lisäksi. Hoito ACTOS 30 mg:lla metformiinin lisänä tuotti tilastollisesti merkitseviä parannuksia HbA1c- ja FPG-arvoissa päätepisteessä verrattuna lumelääkkeeseen metformiinin lisänä (katso taulukko 22).
Toisessa tutkimuksessa 827 potilasta satunnaistettiin saamaan joko 30 mg tai 45 mg ACTOS 30 mg kerran päivässä 24 viikon ajan nykyisen metformiinihoitonsa lisäksi. HbA1c:n keskimääräinen lasku lähtötasosta viikolla 24 oli 0,8 % 30 mg:n annoksella ja 1,0 % 45 mg:n annoksella (katso taulukko 23). FPG:n keskimääräinen lasku lähtötasosta viikolla 24 oli 38 mg/dl 30 mg:n annoksella ja 51 mg/dl 45 mg:n annoksella.
ACTOS:n terapeuttinen vaikutus yhdessä metformiinin kanssa havaittiin potilailla metformiiniannoksesta riippumatta.
Lisäys insuliinitutkimuksiin
Kaksi kliinistä tutkimusta suoritettiin ACTOS 15 mg:lla yhdessä insuliinin kanssa. Molempiin tutkimuksiin osallistui tyypin 2 diabetesta sairastavia potilaita, jotka saivat insuliinia joko yksinään tai yhdessä toisen diabeteslääkkeen kanssa. Kaikki muut diabeteslääkkeet poistettiin käytöstä ennen tutkimushoidon aloittamista. Ensimmäisessä tutkimuksessa 566 potilasta satunnaistettiin saamaan joko 15 mg tai 30 mg ACTOS 15 mg:aa tai lumelääkettä kerran vuorokaudessa 16 viikon ajan insuliinihoitonsa lisäksi. Hoito ACTOS 30 mg:lla insuliinin lisäravinteena tuotti tilastollisesti merkitseviä parannuksia HbA1c- ja FPG-arvoissa päätepisteessä verrattuna lumelääkkeeseen insuliinin kanssa (katso taulukko 24). Keskimääräinen päivittäinen insuliiniannos lähtötilanteessa kussakin hoitoryhmässä oli noin 70 yksikköä. Suurimmalla osalla potilaista (75 %:lla kaikkiaan, 86 %:lla hoidettiin lumelääkettä, 77 %:lla hoidettiin ACTOS:lla 15 mg ja 61 %:lla hoidettiin ACTOS:lla 30 mg) päivittäisessä insuliiniannoksessa ei ollut muutosta lähtötasosta viimeiseen tutkimuskäyntiin. Keskimääräinen muutos lähtötilanteesta päivittäisessä insuliiniannoksessa (mukaan lukien potilaat, joilla insuliiniannosta ei muutettu) oli -3 yksikköä potilailla, jotka saivat ACTOS 15 mg:lla, -8 yksikköä potilailla, joita hoidettiin ACTOS 30 mg:lla ja -1 yksikkö potilailla. hoidettu lumelääkkeellä.
Toisessa tutkimuksessa 690 potilasta, jotka saivat keskimäärin 60 yksikköä päivässä insuliinia, satunnaistettiin saamaan joko 30 mg tai 45 mg ACTOSia kerran päivässä 24 viikon ajan nykyisen insuliiniohjelmansa lisäksi. HbA1c:n keskimääräinen lasku lähtötasosta viikolla 24 oli 1,2 % 30 mg:n annoksella ja 1,5 % 45 mg:n annoksella. FPG:n keskimääräinen lasku lähtötasosta viikolla 24 oli 32 mg/dl 30 mg:n annoksella ja 46 mg/dl 45 mg:n annoksella (katso taulukko 25). Keskimääräinen päivittäinen insuliiniannos lähtötilanteessa molemmissa hoitoryhmissä oli noin 70 yksikköä. Suurimmalla osalla potilaista (kokonaisuudessaan 55 %, ACTOS 30 mg:lla hoidetuista 58 % ja ACTOS 45 mg:lla hoidetuista 52 %) päivittäisessä insuliiniannoksessa ei ollut muutosta lähtötasosta viimeiseen tutkimuskäyntiin. Keskimääräinen muutos lähtötilanteesta päivittäisessä insuliiniannoksessa (mukaan lukien potilaat, joilla insuliiniannosta ei muutettu) oli -5 yksikköä potilailla, joita hoidettiin ACTOS 30 mg:lla ja -8 yksikköä potilailla, joita hoidettiin ACTOS 45 mg:lla.
ACTOSin terapeuttinen vaikutus yhdessä insuliinin kanssa havaittiin potilailla insuliiniannoksesta riippumatta.
POTILASTIEDOT
ACTOS (ak-TOS) (pioglitatsoni) -tabletit
Lue tämä lääkitysopas huolellisesti ennen kuin aloitat ACTOS 15 mg:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi. Jos sinulla on kysyttävää ACTOS-valmisteesta, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mikä on tärkein tieto, joka minun pitäisi tietää ACTOS:sta?
ACTOS voi aiheuttaa vakavia sivuvaikutuksia, kuten uuden tai pahemman sydämen vajaatoiminnan.
- ACTOS 15mg voi saada kehosi keräämään ylimääräistä nestettä (nesteen kertymä), mikä johtaa turvotukseen (edeemaan) ja painonnousuun. Ylimääräinen kehon neste voi pahentaa joitain sydänongelmia tai johtaa sydämen vajaatoimintaan. Sydämen vajaatoiminta tarkoittaa, että sydämesi ei pumppaa verta tarpeeksi hyvin
- Älä käytä ACTOSia, jos sinulla on vaikea sydämen vajaatoiminta
- Jos sinulla on sydämen vajaatoiminta, johon liittyy oireita (kuten hengenahdistusta tai turvotusta), vaikka nämä oireet eivät olisikaan vakavia, ACTOS ei ehkä sovi sinulle
Soita lääkärillesi välittömästi, jos sinulla on jokin seuraavista:
- turvotusta tai nesteen kertymistä, erityisesti nilkoissa tai jaloissa
- hengenahdistus tai hengitysvaikeudet, varsinkin kun makaat
- epätavallisen nopea painon nousu
- epätavallinen väsymys
ACTOS:lla voi olla muita vakavia sivuvaikutuksia. Katso "Mitkä ovat ACTOSin mahdolliset sivuvaikutukset?"
Mikä on ACTOS?
ACTOS 15mg on reseptilääke, jota käytetään ruokavalion ja liikunnan kanssa parantamaan verensokerin (glukoosin) hallintaa tyypin 2 diabetesta sairastavilla aikuisilla. ACTOS on pioglitatsoni-niminen diabeteslääke, joka voidaan ottaa yksinään tai muiden diabeteslääkkeiden kanssa.
Ei tiedetä, onko ACTOS turvallinen ja tehokas alle 18-vuotiaille lapsille. ACTOSia ei suositella käytettäväksi lapsille.
ACTOS ei ole tarkoitettu tyypin 1 diabetesta sairastaville.
ACTOS 30mg ei ole tarkoitettu diabeettista ketoasidoosia sairastaville (ketonien lisääntyminen veressä tai virtsassa).
Kuka ei saa ottaa ACTOSia?
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää ACTOS 15mg:sta?"
Älä ota ACTOS 15 mg:aa, jos:
- on vaikea sydämen vajaatoiminta
- olet allerginen jollekin ACTOSin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo ACTOSin ainesosista
Keskustele lääkärin kanssa ennen kuin otat ACTOSia, jos sinulla on jompikumpi näistä tiloista.
Mitä minun pitäisi kertoa lääkärilleni ennen ACTOS 30 mg:n ottamista?
Ennen kuin otat ACTOS-valmistetta, kerro lääkärillesi, jos:
- on sydämen vajaatoiminta
- sinulla on tyypin 1 ("nuorten") diabetes tai diabeettinen ketoasidoosi
- sinulla on diabeettinen silmäsairaus, joka aiheuttaa turvotusta silmän takaosassa (makulaturvotus)
- sinulla on maksaongelmia
- sinulla on tai on ollut virtsarakon syöpä
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, voiko ACTOS 15 mg vahingoittaa sikiötäsi. Keskustele lääkärisi kanssa, jos olet raskaana tai suunnittelet raskautta, mikä on paras tapa hallita verensokeria raskauden aikana
- olet premenopausaalinen nainen (ennen "elämänmuutosta"), jolla ei ole säännöllisesti tai ollenkaan kuukautisia. ACTOS 30 mg voi lisätä mahdollisuuttasi tulla raskaaksi. Keskustele lääkärisi kanssa ehkäisyvalinnoista ACTOS-hoidon aikana. Kerro heti lääkärillesi, jos tulet raskaaksi ACTOS-hoidon aikana
- imetät tai aiot imettää. Ei tiedetä, erittyykö ACTOS maitoon ja voiko se vahingoittaa vauvaasi. Keskustele lääkärisi kanssa parhaasta tavasta hallita verensokeria imetyksen aikana
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
ACTOS 30 mg ja jotkut muut lääkkeesi voivat vaikuttaa toisiinsa. Saatat joutua muuttamaan ACTOS 15 mg -annostasi tai tiettyjä muita lääkkeitä.
Tunne käyttämäsi lääkkeet. Pidä luetteloa lääkkeistäsi ja näytä se lääkärillesi ja apteekkiin ennen kuin aloitat uuden lääkkeen. He kertovat sinulle, voidaanko ACTOS 15 mg:aa ottaa muiden lääkkeiden kanssa.
Miten minun pitäisi ottaa ACTOS 15 mg?
- Ota ACTOS 15 mg juuri sen verran kuin lääkärisi on määrännyt
- Lääkärisi saattaa muuttaa ACTOS-annostasi. Älä muuta ACTOS-annostasi, ellei lääkärisi kehota sinua tekemään niin
- ACTOS voidaan määrätä yksinään tai muiden diabeteslääkkeiden kanssa. Tämä riippuu siitä, kuinka hyvin verensokerisi on hallinnassa
- Ota ACTOS 15 mg kerran päivässä ruoan kanssa tai ilman
- Jos unohdat ottaa ACTOS 15 mg -annoksen, ota seuraava annos ohjeiden mukaan, ellei lääkärisi määrää toisin. Älä ota kahta annosta kerralla seuraavana päivänä
- Jos otat liikaa ACTOSia, soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun
- Jos kehosi on stressissä, kuten kuumeen, infektion, tapaturman tai leikkauksen vuoksi, diabeteslääkkeiden annosta on ehkä muutettava. Soita lääkärillesi välittömästi
- Pysy ruokavalio- ja harjoitusohjelmissasi ja mittaa verensokerisi säännöllisesti ACTOS-hoidon aikana
- Lääkärisi tulee tehdä tiettyjä verikokeita ennen kuin aloitat ACTOS-hoidon ja ottamisen aikana
- Lääkärisi tulee myös tehdä hemoglobiini A1C -testi tarkistaakseen, kuinka hyvin verensokerisi on hallinnassa ACTOS:lla
- Lääkärin tulee tarkistaa silmäsi säännöllisesti ACTOS-hoidon aikana
Mitkä ovat ACTOSin mahdolliset sivuvaikutukset?
ACTOS voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää ACTOSista?"
- matala verensokeri (hypoglykemia). Tämä voi tapahtua, jos ohitat ateriat, jos käytät myös toista verensokeria alentavaa lääkettä tai jos sinulla on tiettyjä lääketieteellisiä ongelmia. Huimausta, huimausta, vapinaa tai nälkää voi esiintyä, jos verensokerisi on liian alhainen. Soita lääkärillesi, jos matala verensokeri on sinulle ongelma
- maksaongelmia. Soita lääkärillesi heti, jos sinulla on:
- pahoinvointia tai oksentelua
- vatsakipu
- epätavallinen tai selittämätön väsymys
- ruokahalun menetys
- tumma virtsa
- ihosi tai silmänvalkuaisten keltaisuus
- virtsarakon syöpä. ACTOS-hoidon aikana voi olla suurempi mahdollisuus saada virtsarakon syöpä. Älä ota ACTOS 15 mg -valmistetta, jos saat hoitoa virtsarakon syöpää varten. Kerro heti lääkärillesi, jos sinulla on jokin seuraavista virtsarakon syövän oireista:
- verta tai punaista väriä virtsassasi
- lisääntynyt virtsaamistarve
- kipu virtsatessa
- murtumat luut (murtumat). Yleensä naisilla kädessä, olkavarressa tai jalassa. Keskustele lääkärisi kanssa saadaksesi neuvoja siitä, kuinka pitää luusi terveenä.
- diabeettinen silmäsairaus, johon liittyy turvotusta silmän takaosassa (makulaturvotus). Kerro heti lääkärillesi, jos näkösi muuttuu. Lääkärin tulee tarkistaa silmäsi säännöllisesti
- munasolun vapautuminen naisen munasarjasta (ovulaatio), mikä johtaa raskauteen. Ovulaatio voi tapahtua, kun premenopausaalisilla naisilla, joilla ei ole säännöllisiä kuukautisia, otetaan ACTOS. Tämä voi lisätä mahdollisuuttasi tulla raskaaksi
- vilustumisen kaltaiset oireet (ylempien hengitysteiden tulehdus)
- päänsärky
- poskiontelon tulehdus
- lihaskipu
- kipeä kurkku
ACTOSin yleisimpiä sivuvaikutuksia ovat:
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikki ACTOSin sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää ACTOS 15mg?
- Säilytä ACTOS 15 mg 20 - 25 °C:ssa (68 °F - 77 °F). Säilytä ACTOS alkuperäispakkauksessa ja suojassa valolta
- Pidä ACTOS-pullo tiiviisti suljettuna ja pidä tabletit kuivina
- Pidä ACTOS ja kaikki lääkkeet poissa lasten ulottuvilta
Yleistä tietoa ACTOSin turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä ACTOSia sairauteen, johon sitä ei ole määrätty. Älä anna ACTOSia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä ACTOS-tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä lääkäriltäsi tai apteekista terveydenhuollon ammattilaisille kirjoitettuja ACTOS-tietoja. Lisätietoja saat osoitteesta www.actos.com tai soittamalla numeroon 1-877-825-3327.
Mitä ainesosia ACTOS 15mg sisältää?
Vaikuttava ainesosa: pioglitatsoni Inaktiiviset ainesosat: laktos 15 mg monohydraatti, hydroksipropyyliselluloosa, karboksimetyyliselluloosa kalsium ja magnesiumstearaatti
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
