Prandin 0.5mg, 1mg, 2mg Repaglinide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Prandin 2mg on ja miten sitä käytetään?
Prandin 1mg on reseptilääke, jota käytetään tyypin 2 diabeteksen oireiden hoitoon. Prandinia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Prandin kuuluu lääkeryhmään, jota kutsutaan diabeteslääkkeiksi, maglitinidijohdannaisiksi.
Ei tiedetä, onko Prandin 1mg turvallinen ja tehokas lapsille.
Mitkä ovat Prandinin mahdolliset sivuvaikutukset?
Prandin voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- voimakas kipu ylävatsassa, joka leviää selkään,
- pahoinvointi,
- oksentelua,
- nopea syke,
- vaalea tai kellastunut iho,
- tumma virtsa,
- kuume,
- hämmennystä,
- heikkous,
- kipeä kurkku,
- polttaa silmissäsi,
- ihokipu ja
- jota seuraa punainen tai violetti ihottuma, joka leviää (etenkin kasvoille tai ylävartalolle) ja aiheuttaa rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Prandinin yleisimpiä sivuvaikutuksia ovat:
- matala verensokeri,
- pahoinvointi,
- ripuli,
- päänsärky,
- selkäkipu,
- nivelkipuja ja
- vilustumisoireet (nenän tukkoisuus, aivastelu, kurkkukipu)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Prandinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
PRANDIN (repaglinidi) on suun kautta otettava verensokeria alentava lääke, joka kuuluu glinidiluokkaan. Repaglinidi, S(+)2-etoksi-4(2((3-metyyli-1-(2-(1piperidinyyli)fenyyli)butyyli)amino)-2-oksoetyyli)bentsoehappo, ei ole kemiallisesti sukua suun kautta otettavalle sulfonyyliurea-insuliinille. eritysagogit.
Repaglinidin rakennekaava
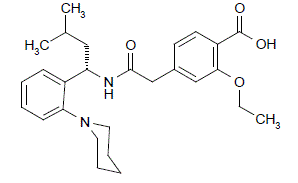
Repaglinidi on valkoinen tai luonnonvalkoinen jauhe, jonka molekyylikaava on C27H36N2O4 ja molekyylipaino 452,6. PANDIN-tabletit sisältävät 0,5 mg, 1 mg tai 2 mg repaglinidia. Lisäksi jokainen tabletti sisältää seuraavat inaktiiviset aineet: kalsiumvetyfosfaatti (vedetön), mikrokiteinen selluloosa, maissitärkkelys, polakriliinikalium, povidoni, glyseroli (85 %), magnesiumstearaatti, meglumiini ja poloksameeri. 1 mg:n ja 2 mg:n tabletit sisältävät rautaoksideja (keltainen ja punainen) väriaineina.
INDIKAATIOT
PANDIN on tarkoitettu tyypin 2 diabetes mellitusta sairastavien aikuisten glukoositasapainon parantamiseen ruokavalion ja liikunnan lisänä.
Käytön rajoitus
PRANDINia ei tule käyttää potilailla, joilla on tyypin 1 diabetes tai diabeettisen ketoasidoosin hoitoon.
ANNOSTELU JA HALLINNOINTI
Suositeltu annostus ja antotapa
Suositeltu aloitusannos potilaille, joiden HbA1c on alle 8 %, on 0,5 mg suun kautta ennen jokaista ateriaa. Potilaille, joiden HbA1c on 8 % tai enemmän, aloitusannos on 1 tai 2 mg suun kautta ennen jokaista ateriaa.
Suositeltu annosalue on 0,5–4 mg ennen ateriaa, ja suurin vuorokausiannos on 16 mg. Potilaan annos tulee kaksinkertaistaa 4 mg:aan asti jokaisen aterian yhteydessä, kunnes tyydyttävä glykeeminen hallinta on saavutettu. Jokaisen annoksen muuttamisen jälkeen tulee kulua vähintään yksi viikko vasteen arvioimiseksi.
Neuvo potilaita ottamaan PANDIN 30 minuutin sisällä ennen ateriaa. PANDIN 2 mg voidaan annostella 2, 3 tai 4 kertaa vuorokaudessa vastauksena potilaan ruokailutottumuksiin.
Potilaita, jotka jättävät ateriat väliin, kehota potilasta jättämään väliin suunniteltu PRANDIN 1 mg:n annos hypoglykemian riskin vähentämiseksi. Potilailla, joilla on hypoglykemia, PRANDIN 1 mg annosta tulee pienentää [katso VAROITUKSET JA VAROTOIMET ].
Potilaat, joilla on vaikea munuaisten vajaatoiminta
Potilaille, joilla on vaikea munuaisten vajaatoiminta (CrCl = 20-40 ml/min), aloita PRANDIN 0,5 mg suun kautta ennen jokaista ateriaa. Titraa annosta asteittain tarvittaessa glykeemisen tason saavuttamiseksi.
Annosmuutokset huumeiden yhteisvaikutuksia varten
Annoksen muuttamista suositellaan potilaille, jotka käyttävät samanaikaisesti vahvoja CYP3A4- tai CYP2C8-estäjiä tai vahvoja CYP3A4- tai CYP2C8-induktoreita (ks. HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
Samanaikainen käyttö gemfibrotsiilin kanssa on vasta-aiheista [katso VASTA-AIHEET ].
Vältä PRANDIN 2 mg:n samanaikaista käyttöä klopidogreelin kanssa. Jos samanaikaista käyttöä ei voida välttää, aloita PANDIN 0,5 mg:lla ennen jokaista ateriaa äläkä ylitä 4 mg:n päivittäistä kokonaisannosta [ks. HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
Älä ylitä päivittäistä kokonaisannosta 6 mg PRANDIN 2 mg potilailla, jotka saavat siklosporiinia [ks. HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- mg tabletit (keltaiset, pyöreät, kaksoiskuperit tabletit, joiden toisella puolella on merkintä "745" ja toisella puolella "C")
- 2 mg tabletit (vaaleanpunaiset, pyöreät, kaksoiskuperit tabletit, joiden toisella puolella on merkintä "747" ja toisella puolella "C")
PRANDIN (repaglinidi) tabletit, 1 mg , toimitetaan keltaisina, pyöreinä, kaksoiskuperina tabletteina, joiden toisella puolella on merkintä "745" ja toisella puolella "C". Ne ovat saatavilla seuraavasti:
Pullot 100 NDC 60846-882-01
PRANDIN (repaglinidi) tabletit, 2 mg , toimitetaan vaaleanpunaisina, pyöreinä, kaksoiskuperina tabletteina, joiden toisella puolella on merkintä "747" ja toisella puolella "C". Ne ovat saatavilla seuraavasti:
Pullot 100 NDC 60846-884-01
Säilytä 20–25 °C (68–77 °F) [katso USP:n ohjaama huonelämpötila]. Suojaa kosteudelta. Pidä pullot tiiviisti suljettuina.
Annostele tiiviisiin säiliöihin, joissa on turvasulkimet.
Jakelija: Amneal Specialty, Amneal Pharmaceuticals LLC:n osasto Bridgewater, NJ 08807. Tarkistettu: maaliskuu 2019
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu myös muualla merkinnöissä:
Hypoglykemia [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliinisissä tutkimuksissa on hyvin erilaisia suunnitelmia, yhdessä kliinisessä tutkimuksessa raportoituja haittavaikutuksia ei ehkä ole helppo verrata toisessa kliinisessä tutkimuksessa raportoituihin määriin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä todellisuudessa havaittuja määriä.
PANDIN 1mg on annettu 2931 henkilölle kliinisissä tutkimuksissa. Noin 1 500 näistä tyypin 2 diabetesta sairastavista henkilöistä on hoidettu vähintään 3 kuukautta, 1 000 vähintään 6 kuukautta ja 800 vähintään 1 vuoden ajan. Suurin osa näistä henkilöistä (1 228) sai PRANDINia yhdessä viidestä yhden vuoden, aktiivisesti kontrolloidusta tutkimuksesta. Yli vuoden aikana 13 % PRANDIN 1 mg:n potilaista keskeytettiin haittavaikutusten vuoksi. Yleisimmät vieroitusoireisiin johtaneet haittavaikutukset olivat hyperglykemia, hypoglykemia ja niihin liittyvät oireet.
Taulukossa 1 luetellaan yleiset haittavaikutukset PRANDIN-potilaille verrattuna lumelääkkeeseen 12–24 viikkoa kestäneissä tutkimuksissa.
Hypoglykemia
Kliinisissä tutkimuksissa PRANDIN 1 mg:lla hypoglykemia on yleisin havaittu haittavaikutus. Lievää tai kohtalaista hypoglykemiaa esiintyi 31 %:lla PRANDIN 1 mg:lla hoidetuista potilaista ja 7 %:lla lumelääkettä saaneista potilaista [ks. VAROITUKSET JA VAROTOIMET ].
Hypoglykemiaa raportoitiin 16 %:lla 1228 PRANDIN-potilaasta, 20 %:lla 417 glyburidipotilaasta ja 19 %:lla 81 glipitsidipotilaasta vuoden kontrolloiduissa tutkimuksissa. PANDINilla hoidetuista potilaista, joilla oli oireinen hypoglykemia, kenellekään ei kehittynyt koomaa tai tarvinnut sairaalahoitoa.
24 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa hypoglykemiaa esiintyi useammin potilailla, jotka eivät olleet aiemmin saaneet oraalista hypoglykeemistä lääkehoitoa, ja potilailla, joiden HbA1c oli lähtötilanteessa alle 8 %.
Painonnousu
Keskimääräistä painonnousua ei havaittu, kun potilaat, joita oli aiemmin hoidettu suun kautta otetuilla hypoglykeemisillä aineilla, siirrettiin PRANDINiin. Keskimääräinen painonnousu potilailla, joita hoidettiin PRANDIN 0,5 mg:lla ja joita ei ole aiemmin hoidettu sulfonyyliurealääkkeillä, oli 3,3 %.
Sydäntapahtumat
Vakavien kardiovaskulaaristen haittavaikutusten, mukaan lukien iskemian, ilmaantuvuus oli korkeampi PRANDIN-valmisteella (51/1228 tai 4 %) kuin sulfonyyliurealääkkeillä (13/498 tai 3 %) kontrolloiduissa vertailukliinisissä tutkimuksissa.
Seitsemään kontrolloituun kliiniseen tutkimukseen sisältyi PRANDIN-yhdistelmähoito NPH-insuliinin kanssa (n=431), pelkkä insuliinivalmiste (n=388) tai muita yhdistelmiä (sulfonyyliurea plus NPH-insuliini tai PRANDIN 1 mg plus metformiini) (n=120). Kahdessa tutkimuksessa havaittiin kuusi vakavaa sydänlihasiskemian haittatapahtumaa potilailla, joita hoidettiin PRANDINilla 0,5 mg plus NPH-insuliinilla, ja yksi tapahtuma potilailla, jotka käyttivät pelkkää insuliinivalmistetta toisesta tutkimuksesta [ks. VAROITUKSET JA VAROTOIMET ].
Yhdistelmähoito tiatsolidiinidionien kanssa
Hypoglykemia
24 viikkoa kestäneiden PRANDIN-rosiglitatsoni- tai PRANDIN-pioglitatsoni-yhdistelmähoidon kliinisissä tutkimuksissa (yhteensä 250 potilasta yhdistelmähoidossa) hypoglykemiaa (verensokeri
Perifeerinen turvotus ja sydämen vajaatoiminta
Perifeeristä turvotusta raportoitiin 12:lla 250:stä (4,8 %) PRANDIN-tiatsolidiinidionin yhdistelmähoitoa saaneesta potilaasta ja 3:lla 124:stä (2,4 %) tiatsolidiinidioni-monoterapiapotilaasta. Näissä PRANDIN-monoterapiatutkimuksissa ei raportoitu yhtään tapausta. Kahdella 250 potilaasta (0,8 %), joita hoidettiin PRANDIN-tiatsolidiinidionihoidolla, raportoitiin turvotusjaksoja, joihin liittyi kongestiivista sydämen vajaatoimintaa. Molemmilla potilailla oli aiempi sepelvaltimotauti, ja he toipuivat diureettihoidon jälkeen. Vastaavia tapauksia ei raportoitu monoterapiaryhmissä.
Painonnousu
Yhdistelmä-, PRANDIN- ja pioglitatsonihoitoon liittyvä keskimääräinen painonnousu oli 5,5 kg, 0,3 kg ja 2,0 kg. Yhdistelmä-, PRANDIN- ja rosiglitatsonihoitoon liittyvä keskimääräinen painonnousu oli 4,5 kg, 1,3 kg ja 3,3 kg.
Harvinaiset haittatapahtumat (
Harvempia kliinisissä tutkimuksissa havaittuja haittavaikutuksia olivat kohonneet maksaentsyymiarvot, trombosytopenia, leukopenia ja anafylaktoidiset reaktiot.
Markkinoinnin jälkeinen kokemus
Seuraavat lisähaittavaikutukset on tunnistettu PRANDINin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei yleensä ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai syy-yhteyttä lääkealtistukseen.
- Hiustenlähtö
- Hemolyyttinen anemia
- Haimatulehdus
- Stevens-Johnsonin oireyhtymä
- Vaikea maksan toimintahäiriö mukaan lukien keltaisuus ja hepatiitti
HUUMEIDEN VUOROVAIKUTUKSET
Kliinisesti tärkeät lääkevuorovaikutukset PRANDINin kanssa
Taulukossa 3 on luettelo lääkkeistä, joilla on kliinisesti merkittäviä yhteisvaikutuksia PRANDIN 1 mg:n kanssa, sekä ohjeet niiden ehkäisyyn tai hoitoon.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Hypoglykemia
Kaikki glinidit, mukaan lukien PANDIN 0,5 mg, voivat aiheuttaa hypoglykemiaa [katso HAITTAVAIKUTUKSET ]. Vaikea hypoglykemia voi aiheuttaa kohtauksia, olla hengenvaarallinen tai aiheuttaa kuoleman. Hypoglykemia voi heikentää keskittymiskykyä ja reaktioaikaa; tämä voi asettaa yksilön ja muut vaaraan tilanteissa, joissa nämä kyvyt ovat tärkeitä (esim. ajaminen tai muiden koneiden käyttö).
Hypoglykemia voi tapahtua äkillisesti ja oireet voivat vaihdella jokaisella yksilöllä ja muuttua ajan myötä samalla yksilöllä. Oireinen tietoisuus hypoglykemiasta voi olla vähemmän ilmeistä potilailla, joilla on pitkäaikainen diabetes, diabeettista hermosairautta sairastavilla potilailla, potilailla, jotka käyttävät sympaattista hermostoa estäviä lääkkeitä (esim. beetasalpaajia) [ks. HUUMEIDEN VUOROVAIKUTUKSET ] tai potilailla, joilla on toistuva hypoglykemia.
Tekijöitä, jotka voivat lisätä hypoglykemian riskiä, ovat muutokset ateriamallissa (esim. makroravinteiden sisältö), muutokset fyysisen aktiivisuuden tasossa, muutokset samanaikaisesti annettaviin lääkkeisiin [ks. HUUMEIDEN VUOROVAIKUTUKSET ] ja samanaikainen käyttö muiden diabeteslääkkeiden kanssa. Potilailla, joilla on munuaisten tai maksan vajaatoiminta, voi olla suurempi hypoglykemian riski [katso Käyttö tietyissä populaatioissa ].
Potilaita tulee antaa PRANDIN 0,5 mg ennen ateriaa, ja heitä on neuvottava jättämään PRANDIN-annos väliin, jos ateria jätetään väliin. Potilailla, joilla on hypoglykemia, PRANDIN-annosta tulee pienentää [katso ANNOSTELU JA HALLINNOINTI ]. Potilaita ja hoitajia on koulutettava tunnistamaan ja hallitsemaan hypoglykemia. Verensokerin omavalvonnalla on keskeinen rooli hypoglykemian ehkäisyssä ja hoidossa. Potilaiden, joilla on suurempi hypoglykemian riski, ja potilaiden, joiden oireinen tietoisuus hypoglykemiasta on heikentynyt, suositellaan verensokerin tiheämpää seurantaa.
Vakavat sydän- ja verisuonihaittavaikutukset, kun niitä käytetään samanaikaisesti NPH-insuliinin kanssa
Seitsemässä kontrolloidussa tutkimuksessa todettiin kuusi vakavaa sydänlihasiskemian haittatapahtumaa potilailla, joita hoidettiin PRANDINilla 0,5 mg plus NPH-insuliinia kahdesta tutkimuksesta, ja yksi tapahtuma potilailla, jotka käyttivät pelkkää insuliinivalmistetta toisesta tutkimuksesta [ks. HAITTAVAIKUTUKSET ]. PANDINia ei ole tarkoitettu käytettäväksi yhdessä NPH-insuliinin kanssa.
Makrovaskulaariset tulokset
Ei ole tehty kliinisiä tutkimuksia, jotka osoittaisivat vakuuttavaa näyttöä makrovaskulaarisen riskin vähentämisestä PANDINin käytön yhteydessä.

Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
104 viikkoa kestäneessä karsinogeenisuustutkimuksessa rotilla annoksilla 120 mg/kg/vrk, mikä on noin 60 kertaa kliininen altistus mg/m2:n perusteella laskettuna, kilpirauhasen ja maksan hyvänlaatuisten adenoomien ilmaantuvuus lisääntyi urosrotilla. Naarasrotilla ei havaittu todisteita karsinogeenisuudesta. Kilpirauhas- ja maksakasvainten esiintyvyyttä ei havaittu urosrotilla pienemmällä annoksella 30 mg/kg/vrk ja 60 mg/kg/vrk (jotka ovat vastaavasti yli 15 ja 30 kertaa kliiniset altistukset mg/m2:lla. perusta). Hiirillä tehdyssä 104 viikkoa kestäneessä karsinogeenisuustutkimuksessa annoksilla 500 mg/kg/vrk asti ei havaittu näyttöä karsinogeenisuudesta hiirillä (mg/m2:n perusteella laskettuna noin 125 kertaa kliininen altistus).
Repaglinidi ei ollut genotoksinen useissa in vivo- ja in vitro -tutkimuksissa: bakteerimutageneesi (Ames-testi), in vitro eteenpäin suuntautuva solumutaatiomääritys V79-soluissa (HGPRT), in vitro kromosomipoikkeamamääritys ihmisen lymfosyyteissä, suunnittelematon ja replikoituva DNA-synteesi rotan maksassa ja in vivo hiiren ja rotan mikrotumatesteissä.
Rotilla tehdyssä hedelmällisyystutkimuksessa repaglinidia annettiin urosrotille annoksina 300 mg/kg/vrk ja naarasrotille 80 mg/kg/vrk. Hedelmällisyyteen kohdistuvia haittavaikutuksia ei havaittu (jotka ovat yli 40-kertaisia kliiniseen altistukseen mg/m2:n perusteella laskettuna).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Rajoitetut tiedot PRANDINin ja repaglinidin käytöstä raskaana oleville naisille eivät riitä kertomaan lääkkeeseen liittyvästä vakavien synnynnäisten epämuodostumien tai keskenmenon riskistä. Raskauden aikana huonosti hallittavaan diabetekseen liittyy riskejä äidille ja sikiölle [katso Kliiniset näkökohdat ].
Repaglidiinin ei osoitettu olevan teratogeeninen eläinkokeissa (rotilla ja kaniinilla). Embryotoksisuutta, raajojen epänormaalia kehitystä rotan sikiössä havaittiin naarasrotilla, jotka altistettiin suurille annoksille raskauden viimeisessä vaiheessa.
Vakavien synnynnäisten epämuodostumien taustariski on 6–10 % naisilla, joilla on raskausta edeltävä diabetes ja HbA1c >7, ja sen on raportoitu olevan jopa 20–25 % naisilla, joiden HbA1c on >10. Arvioitua keskenmenon taustariskiä mainitulle väestölle ei tunneta. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Sairauteen liittyvä äidin ja/tai alkion/sikiön riski
Huonosti hallittu raskausdiabetes lisää äidin riskiä sairastua diabeettiseen ketoasidoosiin, pre-eklampsiaan, spontaaniin aborttiin, ennenaikaiseen synnytykseen, kuolleena synnytykseen ja synnytyksen komplikaatioihin. Huonosti hallittu diabetes lisää sikiön vakavien synnynnäisten epämuodostumien, kuolleena syntymisen ja makrosomiaan liittyvän sairastuvuuden riskiä.
Data
Ihmistiedot
Ei ole olemassa riittäviä tietoja PRANDIN 2 mg:n käyttöön liittyvistä kehitysriskeistä raskaana oleville naisille.
Eläinten tiedot
Repaglinidi ei ollut teratogeeninen rotilla tai kaneilla annoksilla, jotka olivat 40-kertaisia (rotat) ja noin 0,8-kertaisia (kaniinit) kliinisen altistuksen (mg/m2 perusteella) koko raskauden ajan. Repaglinidille altistuneiden rotan emojen jälkeläisille, jotka olivat altistuneet 15-kertaiselle kliiniselle altistukselle mg/m2:n perusteella 17–22 tiineyspäivänä ja imetyksen aikana, kehittyi ei-teratogeenisiä luuston epämuodostumia, jotka koostuivat olkaluun lyhenemisestä, paksuuntumisesta ja taipumisesta synnytyksen jälkeisenä aikana. Tätä vaikutusta ei havaittu annoksilla, jotka olivat korkeintaan 2,5-kertaisia kliiniseen altistukseen verrattuna (mg/m2:n perusteella) raskauspäivinä 1-22 tai suuremmilla annoksilla 1-16 raskauspäivinä.
Imetys
Riskien yhteenveto
Ei ole tietoa PANDIN 0,5 mg:n esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon. Repaglinidia havaittiin rotan maidosta, vaikka imetyksen fysiologiassa esiintyvien lajikohtaisten erojen vuoksi eläintiedot eivät ehkä ennusta luotettavasti lääkepitoisuutta äidinmaidossa. Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä PRANDIN-tarvetta ja mahdollisia PRANDINin tai äidin taustalla olevista sairauksista aiheutuvia haitallisia vaikutuksia imetettävään lapseen.
Kliiniset näkökohdat
Vaikka ei tiedetä, erittyykö repaglinidi äidinmaitoon, joidenkin suun kautta otettavien aineiden tiedetään erittyvän tätä reittiä pitkin. Koska imeväisillä saattaa olla hypoglykemian mahdollisuus ja koska vaikutukset imettäviin eläimiin, on päätettävä, pitäisikö PRANDIN-hoito lopettaa imettäville äideille vai pitäisikö äitien lopettaa imetys. Jos PANDIN-hoito lopetetaan ja jos ruokavalio yksinään ei riitä verensokerin hallintaan, insuliinihoitoa tulee harkita.
Data
Rotilla tehdyissä lisääntymistutkimuksissa emojen rintamaidosta havaittiin mitattavissa olevia repaglinidipitoisuuksia ja pennuilla havaittiin alentuneita verensokeripitoisuuksia. Ristiin edistävät tutkimukset osoittivat, että luuston muutokset [katso Raskaus ] voi indusoitua hoidettujen emojen imettämillä kontrollipennuilla, vaikka tätä esiintyi vähemmän kuin kohdussa hoidetuilla pennuilla.
Käyttö lapsille
Turvallisuutta ja tehoa ei ole osoitettu lapsipotilailla.
Geriatrinen käyttö
Yli 24 viikkoa kestäneissä kliinisissä tutkimuksissa 415 potilasta oli yli 65-vuotiaita, eikä yksikään potilas ollut yli 75-vuotias. Vuoden kestäneissä aktiivikontrolloiduissa tutkimuksissa ei havaittu eroja tehokkuudessa tai haittatapahtumissa näiden ja alle 65-vuotiaiden välillä. Hypoglykemian esiintymistiheys tai vakavuus ei lisääntynyt vanhemmilla koehenkilöillä, mutta joidenkin vanhempien henkilöiden herkkyys oli suurempi. PANDIN 0,5 mg -hoitoa ei voida sulkea pois.
Munuaisten vajaatoiminta
Repaglinidin farmakokineettiset tutkimukset suoritettiin potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta (CrCl = 40-80 ml/min) ja vaikea munuaisten vajaatoiminta (CrCl = 20-40 ml/min). Aloitusannosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Potilaiden, joilla on vaikea munuaisten vajaatoiminta, tulee kuitenkin aloittaa PRANDIN-hoito 0,5 mg:n annoksella ja titrata huolellisesti (ks. ANNOSTELU JA HALLINNOINTI ].
Tutkimuksia ei suoritettu potilailla, joiden kreatiniinipuhdistuma oli alle 20 ml/min, tai potilailla, joilla on hemodialyysihoitoa vaativa munuaisten vajaatoiminta.
Maksan vajaatoiminta
Kerta-annostutkimus tehtiin 12 potilaalla, joilla oli krooninen maksasairaus. Potilailla, joilla oli kohtalainen tai vaikea maksan vajaatoiminta, seerumipitoisuudet olivat korkeammat ja pitkittyneet. Siksi PRANDIN 0,5 mg:aa tulee käyttää varoen potilailla, joilla on maksan vajaatoiminta. Pidempiä aikavälejä annoksen muutosten välillä saatetaan tarvita vasteen täydellisen arvioinnin mahdollistamiseksi.
YLIANNOSTUS
Vakavia hypoglykeemisiä reaktioita, joihin liittyy kooma, kouristuksia tai muu neurologinen häiriö, voi esiintyä ja ne ovat lääketieteellisiä hätätilanteita, jotka vaativat välitöntä sairaalahoitoa. Hypoglykeemiset oireet ilman tajunnan menetystä tai neurologisia löydöksiä tulee hoitaa aggressiivisesti suun kautta otettavalla glukoosilla ja lääkkeen annosta ja/tai ateriaa muuttamalla. Tarkkaa seurantaa voidaan jatkaa, kunnes lääkäri on varma, että potilas on poissa vaarasta. Potilaita tulee seurata tarkasti vähintään 24–48 tunnin ajan, koska hypoglykemia voi uusiutua ilmeisen kliinisen toipumisen jälkeen. Ei ole näyttöä siitä, että PANDIN olisi dialysoitavissa hemodialyysillä.
VASTA-AIHEET
PANDIN on vasta-aiheinen potilaille, joilla on:
- Gemfibrotsiilin samanaikainen käyttö [ks HUUMEIDEN VUOROVAIKUTUKSET ]
- Tunnettu yliherkkyys repaglinidille tai jollekin inaktiiviselle aineelle
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Repaglinidi alentaa verensokeria stimuloimalla insuliinin vapautumista haimasta. Tämä vaikutus riippuu toimivista beeta- (ß) -soluista haiman saarekkeissa. Insuliinin vapautuminen on glukoosiriippuvaista ja vähenee alhaisilla glukoosipitoisuuksilla.
Repaglinidi sulkee ATP-riippuvaisia kaliumkanavia ß-solukalvossa sitoutumalla karakterisoitaviin kohtiin. Tämä kaliumkanavasalpaus depolarisoi ß-solut, mikä johtaa kalsiumkanavien avautumiseen. Tuloksena oleva lisääntynyt kalsiumin virtaus indusoi insuliinin eritystä. Ionikanavamekanismi on erittäin kudosselektiivinen ja sillä on alhainen affiniteetti sydämeen ja luustolihakseen.
Farmakodynamiikka
Neljän viikon, kaksoissokkoutettu, lumekontrolloitu annos-vastetutkimus suoritettiin 138 tyypin 2 diabetespotilaalla käyttäen annoksia 0,25 (ei hyväksytty annos) - 4 mg jokaisen kolmen aterian yhteydessä. PANDIN-hoito johti annokseen suhteutettuun glukoosin alenemiseen koko annosalueella. Plasman insuliinitasot nousivat aterioiden jälkeen ja palasivat lähtötasolle ennen seuraavaa ateriaa. Suurin osa verensokeria paastossa alentavasta vaikutuksesta osoitettiin 1–2 viikon kuluessa.
Kaksoissokkoutetussa, lumekontrolloidussa, 3 kuukauden annostitraustutkimuksessa PANDINin 0,5 mg:n tai lumelääkeannokset kullekin potilaalle nostettiin viikoittain 0,25 mg:sta (ei hyväksytty annos) 0,5, 1 ja 2 mg:aan maksimiannokseen. 4 mg, kunnes plasman paastoglukoositaso (FPG)
PRANDIN 0,5 mg:n annosta suhteessa ateriaan liittyvään insuliinin vapautumiseen tutkittiin kolmessa tutkimuksessa, joihin osallistui 58 potilasta. Glykeeminen hallinta säilyi jakson aikana, jolloin ateriaa ja annostelutapaa vaihdeltiin (2, 3 tai 4 ateriaa päivässä; ennen ateriaa x 2, 3 tai 4) verrattuna ajanjaksoon, jossa oli 3 säännöllistä ateriaa ja 3 annosta päivässä ( ennen ateriaa x 3). Verensokeria alentava vaikutus ei eronnut, kun PRANDIN 0,5 mg annettiin aterian alussa, 15 minuuttia ennen ateriaa tai 30 minuuttia ennen ateriaa.
Farmakokinetiikka
Repaglinidin farmakokineettiset parametrit, jotka saatiin kerta-annostutkimuksesta terveillä koehenkilöillä ja rinnakkaisannoksella suoritetusta annoksen suhteellisesta (0,5, 1, 2 ja 4 mg) tutkimuksesta tyypin 2 diabetesta sairastavilla potilailla, on esitetty taulukoissa. 5 ja 6. Nämä tiedot osoittavat, että repaglinidi ei kertynyt seerumiin. Suun kautta otetun repaglinidin puhdistuma ei muuttunut 0,5–4 mg:n annosalueella, mikä osoittaa lineaarisen suhteen annoksen ja plasman lääketasojen välillä.
Imeytyminen
Suun kautta annetun repaglinidi imeytyy kokonaan maha-suolikanavasta. Terveillä koehenkilöillä tai potilailla kerta-annosten ja toistuvien oraalisten annosten jälkeen plasman huippulääkkeiden pitoisuus (Cmax) saavutetaan 1 tunnin kuluessa (Tmax). Repaglinidi eliminoituu verenkierrosta puoliintumisajalla noin 1 tunti. Keskimääräinen absoluuttinen hyötyosuus on 56 %. Kun repaglinidia annettiin ruoan kanssa, keskimääräinen Tmax ei muuttunut, mutta keskimääräinen Cmax ja AUC (aika/plasmapitoisuuskäyrän alla oleva pinta-ala) pienenivät 20 % ja 12,4 %.
Jakelu
Terveille koehenkilöille suonensisäisen (IV) annostelun jälkeen jakautumistilavuus vakaassa tilassa (Vss) oli 31 l ja kokonaispuhdistuma (CL) oli 38 l/h. Proteiineihin sitoutuminen ja sitoutuminen ihmisen seerumin albumiiniin oli yli 98 %.
Aineenvaihdunta ja eliminaatio
Repaglinidi metaboloituu täysin oksidatiivisen biotransformaation ja suoran konjugoinnin kautta glukuronihapon kanssa joko suonensisäisen tai suun kautta annetun annoksen jälkeen. Tärkeimmät metaboliitit ovat hapettunut dikarboksyylihappo (M2), aromaattinen amiini (M1) ja asyyliglukuronidi (M7). Sytokromi P-450 -entsyymijärjestelmän, erityisesti 2C8:n ja 3A4:n, on osoitettu osallistuvan repaglinidin N-dealkylaatioon M2:ksi ja edelleen hapettumiseen Ml:ksi. Metaboliitit eivät vaikuta repaglinidin glukoosia alentavaan vaikutukseen. 96 tunnin kuluessa 14C-repaglinidin kerta-annoksen oraalisesta annostelusta noin 90 % radioaktiivisesta leimasta erittyi ulosteeseen ja noin 8 % virtsaan. Vain 0,1 % annoksesta erittyy virtsaan lähtöaineena. Päämetaboliitin (M2) osuus oli 60 % annetusta annoksesta. Alle 2 % emolääkkeestä löydettiin ulosteessa. Repaglinidi näyttää olevan substraatti aktiiviselle maksan sisäänoton kuljettajalle (orgaaninen anioneja kuljettava proteiini OATP1B1).
Altistuksen vaihtelu
Repaglinidin AUC vaihtelee useilla 0,25–4 mg:n annoksilla jokaisen aterian yhteydessä. Yksilöiden sisäiset ja yksilöiden väliset variaatiokertoimet olivat 36 % ja 69 %. Terapeuttisella annosalueella AUC sisälsi 69-1005 ng/ml*h, mutta AUC-altistus 5417 ng/ml*h asti saavutettiin annoksen korotustutkimuksissa ilman ilmeisiä haittavaikutuksia.
Tietyt populaatiot
Geriatric
Terveitä vapaaehtoisia hoidettiin 2 mg PRANDIN 0,5 mg:lla ennen jokaista kolmea ateriaa. Repaglinidin farmakokinetiikassa ei ollut merkittäviä eroja alle 65-vuotiaiden potilaiden ryhmän ja vastaavankokoisen ≥65-vuotiaiden potilasryhmän välillä [ks. Käyttö tietyissä populaatioissa ].
Sukupuoli
Farmakokinetiikkaa vertailtaessa miehillä ja naisilla osoitti, että AUC oli 0,5–4 mg:n annosalueella 15–70 % suurempi naisilla, joilla on tyypin 2 diabetes. Tämä ero ei näkynyt hypoglykeemisten jaksojen (miehet: 16 %; naiset: 17 %) tai muissa haittatapahtumissa.
Rotu
Farmakokineettisiä tutkimuksia rodun vaikutusten arvioimiseksi ei ole tehty, mutta yhdysvaltalaisessa 1 vuoden tutkimuksessa tyypin 2 diabetesta sairastavilla potilailla verensokeria alentava vaikutus oli verrattavissa valkoihoisilla (n=297) ja afroamerikkalaisilla (n=). 33). Yhdysvaltalaisessa annos-vastetutkimuksessa valkoihoisten (n=74) ja latinalaisamerikkalaisten (n=33) välillä ei havaittu ilmeistä eroa altistumisessa (AUC).
Munuaisten vajaatoiminta
Repaglinidin kerta-annoksen ja vakaan tilan farmakokinetiikkaa verrattiin potilailla, joilla oli tyypin 2 diabetes ja normaali munuaisten toiminta (CrCl > 80 ml/min), lievä tai kohtalainen munuaisten vajaatoiminta (CrCl = 40-80 ml/min) ja vaikea munuaisten vajaatoiminta (CrCl = 20-40 ml/min). Repaglinidin AUC- ja Cmax-arvot olivat samanlaiset potilailla, joilla oli normaali ja lievä tai kohtalainen munuaisten vajaatoiminta (keskiarvot 56,7 ng/ml*h vs 57,2 ng/ml*h ja 37,5 ng/ml vs. 37,7 ng/ml). vakavasti heikentyneen munuaisten vajaatoiminnan omaavilla potilailla oli kohonneet keskimääräiset AUC- ja Cmax-arvot (98,0 ng/ml*h ja 50,7 ng/ml), mutta tämä tutkimus osoitti vain heikkoa korrelaatiota repaglinidipitoisuuksien ja kreatiniinipuhdistuman välillä.
Maksan vajaatoiminta
Avoin kerta-annostutkimus suoritettiin 12 terveellä koehenkilöllä ja 12 potilaalla, joilla oli krooninen maksasairaus (CLD), jotka luokiteltiin Child-Pugh-asteikon ja kofeiinipuhdistuman mukaan. Keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastavien potilaiden seerumin kokonais- ja sitoutumattoman repaglinidin pitoisuudet olivat korkeammat ja pitkittyneet kuin terveillä koehenkilöillä (AUChealthy: 91,6 ng/ml*h; AUCCLD-potilaat: 368,9 ng/ml*h; Cmax, terve: 46,7 ng/ml; Cmax, CLD-potilaat: 105,4 ng/ml). AUC korreloi tilastollisesti kofeiinin puhdistumaan. Potilasryhmien välillä ei havaittu eroa glukoosiprofiileissa.
Huumeiden väliset vuorovaikutukset
Terveillä vapaaehtoisilla tehdyt lääkkeiden yhteisvaikutustutkimukset osoittavat, että PRANDIN 0,5 mg:lla ei ollut kliinisesti merkittävää vaikutusta digoksiinin, teofylliinin tai varfariinin farmakokineettisiin ominaisuuksiin. Simetidiinin samanaikainen anto PRANDIN 1 mg:n kanssa ei merkittävästi muuttanut repaglinidin imeytymistä ja jakautumista.
Lisäksi seuraavia lääkkeitä tutkittiin terveillä vapaaehtoisilla, kun annettiin samanaikaisesti PRANDINia.
Kliiniset tutkimukset
Monoterapiakokeet
Kaksoissokkoutettu, lumekontrolloitu tutkimus suoritettiin 362 potilaalla, joita hoidettiin 24 viikon ajan. HbA1c PRANDINilla hoidetuilla ryhmillä (1 ja 4 mg:n ryhmät yhteensä) pieneni tutkimuksen lopussa verrattuna lumelääkeryhmään aiemmin hoitamattomilla potilailla ja potilailla, joita on aiemmin hoidettu suun kautta otetuilla hypoglykeemisillä aineilla, 2,1 % ja 1,7 %. vastaavasti. Tässä kiinteäannoksisessa tutkimuksessa potilailla, jotka eivät olleet aiemmin saaneet oraalista hypoglykeemistä lääkehoitoa, ja potilailla, joiden HbA1c oli lähtötilanteessa alle 8 %, havaittiin voimakkaampaa verensokerin laskua.
Yhdistelmäkokeet
PANDIN Yhdessä metformiinin kanssa
PRANDINia tutkittiin yhdessä metformiinin kanssa 83 potilaalla, jotka eivät pysyneet tyydyttävästi hallinnassa liikunnan, ruokavalion ja metformiinin avulla. PANDIN 2 mg:n annosta titrattiin 4–8 viikon ajan, minkä jälkeen seurasi 3 kuukauden ylläpitojakso. Yhdistelmähoito PRANDIN 1 mg:n ja metformiinin kanssa johti tilastollisesti merkitsevään parannukseen HbA1c:ssä ja plasman paastoglukoosissa (FPG) verrattuna PRANDIN 2 mg:n tai metformiinin monoterapiaan (taulukko 8). Tässä tutkimuksessa, jossa metformiiniannos pidettiin vakiona, PRANDINin ja metformiinin yhdistelmähoito osoitti annosta säästäviä vaikutuksia PRANDINiin verrattuna. Yhdistelmäryhmän HbA1c- ja FPG-arvojen paraneminen saavutettiin pienemmällä päivittäisellä 0,5 mg:n PRANDIN-annoksella kuin PANDIN-monoterapiaryhmässä (taulukko 8).
PANDIN 1 mg yhdistelmänä pioglitatsonin kanssa
PRANDINin ja pioglitatsonin (N = 123) yhdistelmähoitoa verrattiin pelkkään PRANDINiin (N = 61) ja pioglitatsoniin (N = 62) 24 viikkoa kestäneessä tutkimuksessa, johon osallistui 246 potilasta, joita oli aiemmin hoidettu sulfonyyliurealla tai metformiinimonoterapialla (HbA1c). > 7,0 %). PANDIN 1 mg:n annosta titrattiin ensimmäisten 12 viikon aikana, minkä jälkeen seurasi 12 viikon ylläpitojakso. Yhdistelmähoito johti tilastollisesti merkitsevään parannukseen HbA1c- ja FPG-arvoissa verrattuna monoterapiaan (kuvio 1). FPG:n (mg/dl) ja HbA1c:n (%) muutokset lähtötasosta olivat: -39,8 mg/dl ja -0,1 % PRANDINilla, -35,3 mg/dl ja -0,1 % pioglitatsonilla ja -92,4 mg/l. dl ja -1,9 % yhdistelmälle. Tässä tutkimuksessa, jossa pioglitatsonin annostus pidettiin vakiona, yhdistelmähoitoryhmä osoitti annosta säästäviä vaikutuksia PRANDINin suhteen (katso kuvion 1 selite). Yhdistelmäryhmän HbA1c- ja FPG-arvojen paraneminen saavutettiin pienemmällä päivittäisellä PRANDIN-annoksella kuin PRANDIN-monoterapiaryhmässä.
Kuva 1: PRANDIN yhdistelmänä pioglitatsonin kanssa: HbA1c-arvot
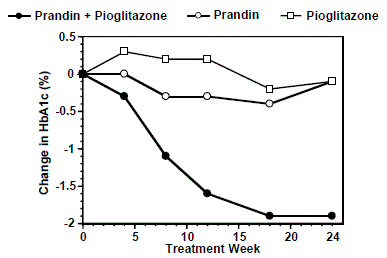
LEGENDA
HbA1c-arvot tutkimusviikkoittain potilailla, jotka ovat päättäneet tutkimuksen (yhdistelmä, N = 101; PANDIN 1 mg, N = 35, pioglitatsoni, N = 26). Koehenkilöt, joiden FPG oli yli 270 mg/dl, poistettiin tutkimuksesta.
Pioglitatsonin annos: kiinteä 30 mg/vrk; PANDIN 1 mg:n keskimääräinen lopullinen annos: 6 mg/vrk yhdistelmähoidossa ja 10 mg/vrk monoterapiassa.
PRANDIN Yhdessä rosiglitatsonin kanssa
PRANDINin ja rosiglitatsonin yhdistelmähoitoa verrattiin monoterapiaan molemmilla aineilla yksinään 24 viikkoa kestäneessä tutkimuksessa, johon osallistui 252 potilasta, joita oli aiemmin hoidettu sulfonyyliurealla tai metformiinilla (HbA1c > 7,0 %). Yhdistelmähoito johti tilastollisesti merkitsevään parannukseen HbA1c- ja FPG-arvoissa verrattuna monoterapiaan (taulukko 9 alla). Yhdistelmähoidon glykeemiset vaikutukset olivat annosta säästäviä sekä PRANDIN 1 mg:n päivittäisen kokonaisannoksen että rosiglitatsonin päivittäisen kokonaisannoksen suhteen (katso Taulukko 9 Selite). Yhdistelmähoitoryhmän HbA1c- ja FPG-arvojen paraneminen saavutettiin pienemmällä PRANDIN 1 mg:n ja rosiglitatsonin päiväannoksella verrattuna vastaaviin monoterapiaryhmiin.
POTILASTIEDOT
Hypoglykemia
Kerro potilaille, että PRANDIN 2mg voi aiheuttaa hypoglykemiaa, ja opasta potilaita ja heidän hoitajiaan itsehoitomenetelmistä, mukaan lukien glukoosin seuranta ja hypoglykemian hallinta. Kerro potilaille, että heidän keskittymis- ja reaktiokykynsä voivat heikentyä hypoglykemian seurauksena. Potilailla, joilla on suurempi hypoglykemian riski, ja potilailla, joiden oireinen tietoisuus hypoglykemiasta on heikentynyt, suositellaan tiheämpää verensokerin seurantaa (ks. VAROITUKSET JA VAROTOIMET ].
Hallinto
Neuvo potilaita ottamaan PANDIN 0,5 mg 30 minuutin sisällä ennen ateriaa. Neuvo potilaita ohittamaan PRANDIN-annoksensa, kun ateria jätetään väliin [katso ANNOSTELU JA HALLINNOINTI ].
Huumeiden vuorovaikutukset
Keskustele mahdollisista lääkevuorovaikutuksista potilaiden kanssa ja kerro heille mahdollisista lääkkeiden yhteisvaikutuksista PRANDINin kanssa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
