Diabeteksen hoito: Glucophage 500mg, 850mg, 1000mg Metformin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Glucophage on ja miten sitä käytetään?
Glucophage on reseptilääke, jota käytetään parantamaan verensokerin hallintaa aikuisilla, joilla on tyypin 2 diabetes. Glucophagea voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Glucophage 850mg kuuluu diabeteslääkkeiden luokkaan.
Ei tiedetä, onko Glucophage turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitkä ovat Glucophagen mahdolliset sivuvaikutukset?
- epätavallinen lihaskipu,
- kylmä olo,
- vaikeuksia hengittää,
- huimausta tai huimausta,
- väsymys,
- heikkous,
- vatsakipu,
- oksentelua ja
- hidas tai epäsäännöllinen syke
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Glucophagen yleisimpiä sivuvaikutuksia ovat:
- matala verensokeri,
- pahoinvointi,
- vatsavaivat ja
- ripuli
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Glucophagen mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
MAITOhappoasidoosi
Markkinoille tulon jälkeen metformiiniin liittyvä maitohappoasidoosi on johtanut kuolemaan, hypotermiaan, hypotensioon ja vastustuskykyisiin bradyarytmioihin. Metformiiniin liittyvä maitohappoasidoosi alkaa usein hienovaraisesti, ja siihen liittyy vain epäspesifisiä oireita, kuten huonovointisuutta, lihaskipuja, hengitysvaikeutta, uneliaisuutta ja vatsakipua. Metformiiniin liittyvälle maitohappoasidoosille oli tunnusomaista kohonneet veren laktaattipitoisuudet (>5 mmol/l), anioniväliasidoosi (ilman ketonurian tai ketonemian merkkejä), lisääntynyt laktaatti/pyruvaatti-suhde; ja metformiinin plasmatasot yleensä > 5 mcg/ml [ks. VAROITUKSET JA VAROTOIMET].
Metformiiniin liittyvän maitohappoasidoosin riskitekijöitä ovat munuaisten vajaatoiminta, tiettyjen lääkkeiden (esim. hiilihappoanhydraasin estäjien, kuten topiramaatti) samanaikainen käyttö, vähintään 65-vuotiaat, varjoainetutkimukset, leikkaus ja muut toimenpiteet, hypoksiset tilat (esim. , akuutti kongestiivinen sydämen vajaatoiminta), liiallinen alkoholinkäyttö ja maksan vajaatoiminta.
Näissä korkean riskin ryhmissä tarjotaan toimenpiteitä metformiiniin liittyvän maitohappoasidoosin riskin vähentämiseksi ja hallitsemiseksi [katso ANNOSTUS JA ANNOSTUS, VASTA-AIHEET, VAROITUKSET JA VAROTOIMET].
Jos epäillään metformiiniin liittyvää maitohappoasidoosia, lopeta välittömästi GLUCOPHAGE- tai GLUCOPHAGE XR -hoito ja aloita yleiset tukitoimenpiteet sairaalassa. Nopea hemodialyysi on suositeltavaa [katso VAROITUKSET JA VAROTOIMET].
KUVAUS
GLUCOPHAGE/GLUCOPHAGE 500mg XR sisältää antihyperglykeemistä ainetta metformiinia, joka on biguanidi, monohydrokloridina. Metformiinihydrokloridin kemiallinen nimi on N,N-dimetyyli-imidodikarbonimidiamidihydrokloridi. Rakennekaava on seuraavanlainen:
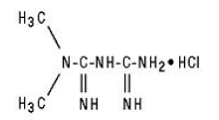
Metformiinihydrokloridi on valkoinen tai luonnonvalkoinen kiteinen yhdiste, jonka molekyylikaava on C4H11N5 • HCl ja molekyylipaino 165,63. Se liukenee vapaasti veteen ja on käytännössä liukenematon asetoniin, eetteriin ja kloroformiin. Metformiinin pKa on 12,4. Metformiinihydrokloridin 1-prosenttisen vesiliuoksen pH on 6,68.
GLUCOPHAGE-tabletit sisältävät 500 mg, 850 mg tai 1000 mg metformiinihydrokloridia, mikä vastaa vastaavasti 389,93 mg, 662,88 mg ja 779,86 mg metformiiniemästä. Jokainen tabletti sisältää inaktiivisia aineita povidonia ja magnesiumstearaattia. Lisäksi 500 mg:n ja 850 mg:n tablettien päällyste sisältää hypromelloosia ja 1000 mg:n tablettien päällyste sisältää hypromelloosia ja polyetyleeniglykolia.
GLUCOPHAGE 500 mg XR sisältää 500 mg tai 750 mg metformiinihydrokloridia, mikä vastaa vastaavasti 389,93 mg ja 584,90 mg metformiiniemästä.
GLUCOPHAGE XR 500 mg tabletit sisältävät inaktiivisia aineita hypromelloosia, mikrokiteistä selluloosaa, natriumkarboksimetyyliselluloosaa ja magnesiumstearaattia.
GLUCOPHAGE 850mg XR 750 mg tabletit sisältävät inaktiivisia aineita hypromelloosia, natriumkarboksimetyyliselluloosaa, magnesiumstearaattia ja rautaoksidipigmenttipunaista.
INDIKAATIOT
GLUCOPHAGE 850mg on tarkoitettu ruokavalion ja liikunnan lisäravinteena parantamaan glukoositasapainoa aikuisille ja vähintään 10-vuotiaille lapsipotilaille, joilla on tyypin 2 diabetes mellitus.
GLUCOPHAGE XR on tarkoitettu tyypin 2 diabetes mellitusta sairastavien aikuisten glukoositasapainon parantamiseen ruokavalion ja liikunnan lisänä.
ANNOSTELU JA HALLINNOINTI
Aikuisten annostus
Glucophage
- GLUCOPHAGE 850 mg:n suositeltu aloitusannos on 500 mg suun kautta kahdesti vuorokaudessa tai 850 mg kerran vuorokaudessa aterioiden yhteydessä.
- Suurenna annosta 500 mg:lla viikoittain tai 850 mg:lla 2 viikon välein glykeemisen tason ja siedettävyyden perusteella enintään 2550 mg:n vuorokausiannokseen jaettuna annoksina.
- Yli 2000 mg:n annokset voivat olla paremmin siedettyjä, kun ne annetaan 3 kertaa päivässä aterioiden yhteydessä.
Glucophage XR
- Niele GLUCOPHAGE XR -tabletit kokonaisina äläkä koskaan murskaa, leikkaa tai pureskele.
- GLUCOPHAGE XR:n suositeltu aloitusannos on 500 mg suun kautta kerran vuorokaudessa ilta-aterian yhteydessä.
- Nosta annosta 500 mg:lla viikoittain glukoositasapainon ja siedettävyyden perusteella enintään 2000 mg:aan kerran vuorokaudessa ilta-aterian yhteydessä.
- Jos sokeritasapainoa ei saada hallintaan GLUCOPHAGE XR 2000 mg:lla kerran vuorokaudessa, harkitse GLUCOPHAGE 850mg XR 1000 mg kahdesti päivässä koetta. Jos tarvitaan suurempia annoksia, vaihda GLUCOPHAGE 500 mg:aan enintään 2 550 mg:n vuorokausiannoksilla jaettuna vuorokausiannoksiin yllä kuvatulla tavalla.
- Potilaat, jotka saavat GLUCOPHAGE 1000 mg, voidaan vaihtaa GLUCOPHAGE 850 mg XR:ään kerran vuorokaudessa samalla kokonaisvuorokausiannoksella, enintään 2 000 mg kerran vuorokaudessa.
Lasten annostus Glucophagelle
- Suositeltu GLUCOPHAGE 850 mg:n aloitusannos 10-vuotiaille ja sitä vanhemmille lapsipotilaille on 500 mg suun kautta kahdesti päivässä aterioiden yhteydessä.
- Suurenna annosta 500 mg:lla viikoittain glukoositasapainon ja siedettävyyden perusteella, enintään 2000 mg:aan vuorokaudessa jaettuna kahdesti vuorokaudessa.
Suositukset käyttöön munuaisten vajaatoiminnassa
- Arvioi munuaisten toiminta ennen GLUCOPHAGE/GLUCOPHAGE 500 mg XR -hoidon aloittamista ja ajoittain sen jälkeen.
- GLUCOPHAGE/GLUCOPHAGE 500 mg XR on vasta-aiheinen potilailla, joiden arvioitu glomerulussuodatusnopeus (eGFR) on alle 30 ml/min/1,73 m2.
- GLUCOPHAGE/GLUCOPHAGE 850 mg XR:n aloittamista ei suositella potilaille, joiden eGFR on 30–45 ml/min/1,73 m2.
- GLUCOPHAGE/GLUCOPHAGE 1000 mg XR:ää käyttävien potilaiden eGFR-arvo laskee myöhemmin alle 45 ml/min/1,73 m2, arvioi hoidon jatkamisen hyöty-riski.
- Lopeta GLUCOPHAGE/GLUCOPHAGE 1000mg XR, jos potilaan eGFR myöhemmin laskee alle 30 ml/min/1,73 m2 [ks. VAROITUKSET JA VAROTOIMET ].
Jodipitoisten varjoainekuvausmenetelmien lopettaminen
Lopeta GLUCOPHAGE/GLUCOPHAGE XR jodikontrastikuvaustoimenpiteen aikana tai ennen sitä potilailla, joiden eGFR on 30–60 ml/min/1,73 m2; potilailla, joilla on ollut maksasairaus, alkoholismi tai sydämen vajaatoiminta; tai potilailla, joille annetaan valtimonsisäistä jodattua varjoainetta. Arvioi eGFR uudelleen 48 tuntia kuvantamistoimenpiteen jälkeen; käynnistä GLUCOPHAGE/GLUCOPHAGE XR uudelleen, jos munuaisten toiminta on vakaa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
GLUCOPHAGE 850mg on saatavana seuraavasti:
- Tabletit: 500 mg pyöreät, valkoiset tai luonnonvalkoiset, kalvopäällysteiset tabletit, joiden toisella puolella on merkintä "BMS 6060" ja toisella puolella "500".
- Tabletit: 850 mg pyöreät, valkoiset tai luonnonvalkoiset, kalvopäällysteiset tabletit, joiden toiselle puolelle on kaiverrettu "BMS 6070" ja toiselle puolelle "850".
- Tabletit: 1000 mg valkoinen, soikea, kaksoiskupera, kalvopäällysteinen, jossa toiselle puolelle on kaiverrettu "BMS 6071" ja toiselle puolelle "1000" ja molemmilla puolilla puolittava viiva.
GLUCOPHAGE XR on saatavana seuraavasti:
- Depottabletit: 500 mg valkoisia tai luonnonvalkoisia, kapselin muotoisia, kaksoiskuperia, toiselle puolelle on painettu "BMS 6063" ja toiselle puolelle "500".
- Pitkävaikutteiset tabletit: 750 mg vaaleanpunaiset ja voivat olla pilkullisia, kapselin muotoisia, kaksoiskuperia, joiden toiselle puolelle on kaiverrettu "BMS 6064" ja toiselle puolelle "750".
Varastointi ja käsittely
Varastointi
Säilytä 20–25 °C (68–77 °F); retket sallitaan 15–30 °C:seen (59–86 °F). [Katso USP:n ohjaama huonelämpötila.]
Annostele valonkestävissä astioissa.
Jakelija: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Tarkistettu: toukokuuta 2018.
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään myös muualla merkinnöissä:
- Maitohappoasidoosi [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- B12-vitamiinin puutos [katso VAROITUKSET JA VAROTOIMET ]
- Hypoglykemia [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Glucophage
Yhdysvalloissa tehdyssä kliinisessä tutkimuksessa GLUCOPHAGE 850 mg potilailla, joilla oli tyypin 2 diabetes mellitus, yhteensä 141 potilasta sai GLUCOPHAGE 1000 mg aina 2550 mg:aan päivässä. Yli 5 %:lla GLUCOPHAGE 500 mg:lla hoidetuista potilaista raportoidut haittavaikutukset, jotka olivat yleisempiä kuin lumelääkettä saaneilla potilailla, on lueteltu taulukossa 1.
Ripuli johti GLUCOPHAGE 500 mg:n käytön lopettamiseen 6 %:lla potilaista. Lisäksi seuraavia haittavaikutuksia raportoitiin ≥1 % - ≤5 %:lla GLUCOPHAGElla hoidetuista potilaista, ja niitä raportoitiin useammin GLUCOPHAGElla kuin lumelääkkeellä: epänormaalit ulosteet, hypoglykemia, lihaskipu, huimaus, hengenahdistus, kynsihäiriö, ihottuma, lisääntynyt hikoilu, makuaisti häiriö, epämukava tunne rinnassa, vilunväristykset, flunssaoireyhtymä, punoitus, sydämentykytys.
29 viikkoa kestäneissä GLUCOPHAGE 500 mg:n kliinisissä tutkimuksissa seerumin B12-vitamiinipitoisuuksien aleneminen alinormaalille havaittiin noin 7 %:lla potilaista.
Pediatriset potilaat
GLUCOPHAGElla tehdyissä kliinisissä tutkimuksissa tyypin 2 diabetes mellitusta sairastavilla lapsipotilailla haittavaikutusten profiili oli samanlainen kuin aikuisilla havaittu.
Glucopage XR
Lumekontrolloiduissa tutkimuksissa 781 potilaalle annettiin GLUCOPHAGE 1000 mg XR:ää. Haittavaikutukset, joita raportoitiin yli 5 %:lla GLUCOPHAGE 850 mg XR -potilaista ja jotka olivat yleisempiä GLUCOPHAGE XR:llä kuin lumelääkettä saaneilla potilailla, on lueteltu taulukossa 2.
Ripuli johti GLUCOPHAGE XR -hoidon keskeyttämiseen 0,6 %:lla potilaista. Lisäksi seuraavia haittavaikutuksia raportoitiin ≥ 1,0 % - ≤ 5,0 % GLUCOPHAGE XR -potilaista, ja niitä raportoitiin useammin GLUCOPHAGE XR:n kuin lumelääkehoidon yhteydessä: vatsakipu, ummetus, vatsan turvotus, dyspepsia/närästys, ilmavaivat, huimaus yläosassa, päänsärky, päänsärky hengitystieinfektio, makuaistin häiriö.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu metformiinin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Metformiinin markkinoille tulon jälkeen on raportoitu kolestaattista, hepatosellulaarista ja sekamuotoista hepatosellulaarista maksavauriota.
HUUMEIDEN VUOROVAIKUTUKSET
Taulukko 3 esittää kliinisesti merkittäviä lääkevuorovaikutuksia GLUCOPHAGE/GLUCOPHAGE XR:n kanssa.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Maitohappoasidoosi
Markkinoille tulon jälkeen on havaittu metformiiniin liittyvää maitohappoasidoosia, mukaan lukien kuolemaan johtaneet tapaukset. Nämä tapaukset alkoivat hienovaraisesti, ja niihin liittyi epäspesifisiä oireita, kuten huonovointisuutta, lihaskipuja, vatsakipua, hengitysvaikeutta tai lisääntynyttä uneliaisuutta; hypotensiota ja resistenttejä bradyarytmioita on kuitenkin esiintynyt vakavan asidoosin yhteydessä. Metformiiniin liittyvälle maitohappoasidoosille oli tunnusomaista kohonneet veren laktaattipitoisuudet (>5 mmol/L), anioniväliasidoosi (ilman merkkejä ketonuriasta tai ketonemiasta) ja lisääntynyt laktaatti:pyruvaatti-suhde; metformiinin plasmapitoisuudet olivat yleensä >5 mcg/ml. Metformiini vähentää laktaatin imeytymistä maksaan ja nostaa veren laktaattipitoisuutta, mikä voi lisätä maitohappoasidoosin riskiä erityisesti riskipotilailla.
Jos metformiiniin liittyvää maitohappoasidoosia epäillään, yleiset tukitoimenpiteet on aloitettava välittömästi sairaalassa ja GLUCOPHAGE/GLUCOPHAGE 500 mg XR -hoito on lopetettava välittömästi. GLUCOPHAGE/GLUCOPHAGE XR:llä hoidetuilla potilailla, joilla on maitohappoasidoosidiagnoosi tai vahva epäilys siitä, suositellaan nopeaa hemodialyysihoitoa asidoosin korjaamiseksi ja kerääntyneen metformiinin poistamiseksi (metformiinihydrokloridi on dialysoitavissa puhdistumalla jopa 170 ml/min hyvissä hemodynaamisissa olosuhteissa). Hemodialyysi on usein johtanut oireiden kääntymiseen ja toipumiseen.
Kerro potilaille ja heidän perheilleen maitohappoasidoosin oireista ja, jos näitä oireita ilmenee, neuvo heitä lopettamaan GLUCOPHAGE/GLUCOPHAGE 1000mg XR -valmisteen käyttö ja ilmoittamaan näistä oireista terveydenhuollon tarjoajalleen.
Jokaisen metformiiniin liittyvän maitohappoasidoosin tunnetun ja mahdollisen riskitekijän osalta alla on annettu suosituksia metformiiniin liittyvän maitohappoasidoosin riskin vähentämiseksi ja hoitamiseksi:
- Munuaisten vajaatoiminta – Markkinoille tulon jälkeen metformiiniin liittyvä maitohappoasidoosi esiintyi pääasiassa potilailla, joilla oli merkittävä munuaisten vajaatoiminta.
Metformiinin kertymisen ja metformiiniin liittyvän maitohappoasidoosin riski kasvaa munuaisten vajaatoiminnan vaikeusasteen myötä, koska metformiini erittyy olennaisesti munuaisten kautta. Kliiniset suositukset, jotka perustuvat potilaan munuaisten toimintaan, sisältävät [katso ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ]:
- Ennen kuin aloitat GLUCOPHAGE/GLUCOPHAGE 850 mg XR:n, hanki arvioitu glomerulussuodatusnopeus (eGFR).
- GLUCOPHAGE/GLUCOPHAGE XR on vasta-aiheinen potilailla, joiden eGFR on alle 30 ml/min/1,73 m2 [ks. VASTA-AIHEET ].
- GLUCOPHAGE/GLUCOPHAGE XR -hoidon aloittamista ei suositella potilaille, joiden eGFR on välillä 30-45 ml/min/1,73 m2.
- Hanki eGFR vähintään kerran vuodessa kaikilta GLUCOPHAGE/GLUCOPHAGE 1000mg XR:ää käyttäviltä potilailta. Potilailla, joilla on riski saada munuaisten vajaatoiminta (esim. vanhukset), munuaisten toiminta tulee arvioida useammin.
- Arvioi hoidon jatkamisen hyöty ja riski potilailla, jotka käyttävät GLUCOPHAGE/GLUCOPHAGE 500 mg XR:ää ja joiden eGFR on alle 45 ml/min/1,73 m2.
- Lääkkeiden yhteisvaikutukset – GLUCOPHAGE/GLUCOPHAGE XR:n samanaikainen käyttö tiettyjen lääkkeiden kanssa voi lisätä metformiiniin liittyvän maitohappoasidoosin riskiä: lääkkeet, jotka heikentävät munuaisten toimintaa, johtavat merkittäviin hemodynaamisiin muutoksiin, häiritsevät happo-emästasapainoa tai lisäävät metformiinin kertymistä. Harkitse potilaiden tiheämpää seurantaa.
- Ikä 65 tai vanhempi – Metformiiniin liittyvän maitohappoasidoosin riski kasvaa potilaan iän myötä, koska iäkkäillä potilailla on suurempi todennäköisyys sairastua maksan, munuaisten tai sydämen vajaatoimintaan kuin nuoremmilla potilailla. Arvioi munuaisten toiminta useammin iäkkäillä potilailla.
- Radiologiset tutkimukset varjoaineella — Suonensisäisten jodattujen varjoaineiden antaminen metformiinilla hoidetuille potilaille on johtanut akuuttiin munuaisten toiminnan heikkenemiseen ja maitohappoasidoosin esiintymiseen. Lopeta GLUCOPHAGE/GLUCOPHAGE XR jodia sisältävän kontrastikuvaustoimenpiteen aikana tai ennen sitä potilailla, joiden eGFR on välillä 30–60 ml/min/1,73 m2; potilailla, joilla on ollut maksan vajaatoimintaa, alkoholismia tai sydämen vajaatoimintaa; tai potilailla, joille annetaan valtimonsisäistä jodattua varjoainetta. Arvioi eGFR uudelleen 48 tunnin kuluttua kuvantamistoimenpiteestä ja käynnistä GLUCOPHAGE/GLUCOPHAGE XR uudelleen, jos munuaisten toiminta on vakaa.
- Leikkaus ja muut toimenpiteet – Ruoan ja nesteiden pidättäminen kirurgisten tai muiden toimenpiteiden aikana voi lisätä tilavuuden vähenemisen, hypotension ja munuaisten vajaatoiminnan riskiä. GLUCOPHAGE/GLUCOPHAGE XR tulee tilapäisesti lopettaa, kun potilaat ovat rajoittaneet ruoan ja nesteen saantia.
- Hypoksiset tilat – Useat metformiiniin liittyvän maitohappoasidoosin markkinoille tulon jälkeisistä tapauksista ilmeni akuutin kongestiivisen sydämen vajaatoiminnan yhteydessä (erityisesti kun siihen liittyi hypoperfuusio ja hypoksemia). Kardiovaskulaarinen kollapsi (sokki), akuutti sydäninfarkti, sepsis ja muut hypoksemiaan liittyvät tilat on liitetty maitohappoasidoosiin ja voivat aiheuttaa prerenaalista atsotemiaa. Jos tällainen tapahtuma ilmenee, lopeta GLUCOPHAGE/GLUCOPHAGE 1000mg XR -hoito.
- Liiallinen alkoholin nauttiminen – Alkoholi voimistaa metformiinin vaikutusta laktaattiaineenvaihduntaan. Potilaita tulee varoittaa liiallisesta alkoholinkäytöstä GLUCOPHAGE/GLUCOPHAGE XR -hoidon aikana.
- Maksan vajaatoiminta – Maksan vajaatoimintaa sairastaville potilaille on kehittynyt tapauksia metformiiniin liittyvästä maitohappoasidoosista. Tämä voi johtua heikentyneestä laktaatin puhdistumasta, mikä johtaa korkeampiin veren laktaattipitoisuuksiin. Vältä siksi GLUCOPHAGE/GLUCOPHAGE XR:n käyttöä potilailla, joilla on kliinisiä tai laboratoriotutkimuksia maksasairauksista.
B12-vitamiinin puutos
29 viikkoa kestäneissä GLUCOPHAGE 1000 mg:n kliinisissä tutkimuksissa seerumin B12-vitamiinipitoisuuksien aleneminen alinormaalille havaittiin noin 7 %:lla potilaista. Tällainen lasku, joka johtuu mahdollisesti B12:n imeytymisen häiriintymisestä B12:n luontaisesta tekijäkompleksista, voi liittyä anemiaan, mutta näyttää korjaantuvan nopeasti, kun GLUCOPHAGE tai B12-vitamiinilisän käyttö lopetetaan. Tietyt henkilöt (jotka eivät saa riittävästi B12-vitamiinia tai kalsiumia tai imeytyvät) näyttävät olevan alttiita kehittymään normaalia pienemmille B12-vitamiinitasoille. Mittaa hematologisia parametreja vuosittain ja B12-vitamiinia 2–3 vuoden välein potilailla, jotka saavat GLUCOPHAGE/GLUCOPHAGE 500 mg XR:ää, ja hallitse poikkeavuuksia [ks. HAITTAVAIKUTUKSET ].
Hypoglykemia, kun käytetään samanaikaisesti insuliinia ja insuliinia
Secretagogit
Insuliinin ja insuliinin eritystä lisäävien aineiden (esim. sulfonyyliurean) tiedetään aiheuttavan hypoglykemiaa. GLUCOPHAGE/GLUCOPHAGE XR voi lisätä hypoglykemian riskiä, kun sitä käytetään yhdessä insuliinin ja/tai insuliinin eritystä lisäävän aineen kanssa. Siksi pienempi annos insuliinia tai insuliinin eritystä lisäävää lääkettä saattaa olla tarpeen hypoglykemiariskin minimoimiseksi, kun sitä käytetään yhdessä GLUCOPHAGE/GLUCOPHAGE XR:n kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Makrovaskulaariset tulokset
Ei ole tehty kliinisiä tutkimuksia, jotka osoittaisivat ratkaisevaa näyttöä makrovaskulaarisen riskin pienenemisestä GLUCOPHAGE/GLUCOPHAGE 850 mg XR:llä.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Maitohappoasidoosi
Selitä maitohappoasidoosin riskit, sen oireet ja tilat, jotka altistavat sen kehittymiselle. Neuvo potilaita lopettamaan GLUCOPHAGE/GLUCOPHAGE XR -hoito välittömästi ja ilmoittamaan välittömästi terveydenhuollon tarjoajalleen, jos ilmaantuu selittämätöntä hyperventilaatiota, lihaskipuja, huonovointisuutta, epätavallista uneliaisuutta tai muita epäspesifisiä oireita. Neuvo potilaita välttämään liiallista alkoholinkäyttöä ja kerro potilaille munuaisten toiminnan säännöllisen testauksen tärkeydestä GLUCOPHAGE/GLUCOPHAGE XR -hoidon aikana. Neuvo potilaita ilmoittamaan lääkärilleen, että he käyttävät GLUCOPHAGE/GLUCOPHAGE 500 mg XR -valmistetta ennen mitään kirurgista tai radiologista toimenpidettä, koska tilapäinen lopettaminen saattaa olla tarpeen [ks. VAROITUKSET JA VAROTOIMET ].
Hypoglykemia
Kerro potilaille, että hypoglykemiaa voi esiintyä, kun GLUCOPHAGE/GLUCOPHAGE XR:ää annetaan samanaikaisesti suun kautta otettavien sulfonyyliureoiden ja insuliinin kanssa. Selitä samanaikaista hoitoa saaville potilaille hypoglykemian riskejä, sen oireita ja hoitoa sekä tiloja, jotka altistavat sen kehittymiselle [ks. VAROITUKSET JA VAROTOIMET ].
B12-vitamiinin puutos
Kerro potilaille säännöllisten hematologisten parametrien tärkeydestä GLUCOPHAGE/GLUCOPHAGE XR -hoidon aikana [katso VAROITUKSET JA VAROTOIMET ].
Lisääntymisiässä olevat naiset
Kerro naisille, että GLUCOPHAGE/GLUCOPHAGE XR -hoito voi aiheuttaa ovulaation joillakin premenopausaalisilla anovulaatiota saavilla naisilla, mikä voi johtaa tahattomaan raskauteen [ks. Käyttö tietyissä populaatioissa ].
Glucophage XR -hallinnointitiedot
Kerro potilaille, että GLUCOPHAGE 500mg XR on nieltävä kokonaisena, eikä sitä saa murskata, leikata tai pureskella, ja että inaktiiviset ainesosat voivat toisinaan erittyä ulosteeseen pehmeänä massana, joka saattaa muistuttaa alkuperäistä tablettia.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikaisia karsinogeenisuustutkimuksia on suoritettu rotilla (annostuksen kesto 104 viikkoa) ja hiirillä (annostuksen kesto 91 viikkoa) annoksilla, jotka ovat enintään 900 mg/kg/vrk ja 1500 mg/kg/vrk. Nämä annokset ovat molemmat noin 3 kertaa suurempia kuin ihmisille suositeltu enimmäisvuorokausiannos 2550 mg kehon pinta-alan vertailun perusteella. Metformiinin karsinogeenisuudesta ei löydetty näyttöä uros- tai naarashiirillä. Metformiinilla ei myöskään havaittu kasvaimia aiheuttavaa potentiaalia urosrotilla. Hyvänlaatuisten stromaalisten kohdun polyyppien ilmaantuvuus kuitenkin lisääntyi naarasrotilla, joita hoidettiin 900 mg/kg/vrk.
Seuraavissa in vitro -testeissä ei havaittu näyttöä metformiinin mutageenisesta potentiaalista: Ames-testi (S. typhimurium), geenimutaatiotesti (hiiren lymfoomasolut) tai kromosomipoikkeavuustesti (ihmisen lymfosyytit). Tulokset in vivo hiiren mikrotumatestissä olivat myös negatiivisia.
Metformiini ei vaikuttanut uros- tai naarasrottien hedelmällisyyteen, kun metformiinia annettiin jopa 600 mg/kg/vrk, mikä on noin 2 kertaa suurempi kuin ihmisen suurin suositeltu vuorokausiannos 2550 mg kehon pinta-alan vertailun perusteella.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Rajoitetut tiedot GLUCOPHAGE/GLUCOPHAGE XR:stä raskaana oleville naisille eivät riitä määrittämään lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Julkaistut tutkimukset metformiinin käytöstä raskauden aikana eivät ole raportoineet selkeää yhteyttä metformiiniin ja vakaviin synnynnäisiin epämuodostumisiin tai keskenmenon riskiin [ks. Data ]. Raskauden aikana huonosti hallittavaan diabetes mellitukseen liittyy riskejä äidille ja sikiölle [katso Kliiniset näkökohdat ].
Mitään haitallisia kehitysvaikutuksia ei havaittu, kun metformiinia annettiin raskaana oleville Sprague Dawley -rotille ja kaneille organogeneesin aikana annoksilla, jotka olivat korkeintaan 2- ja 5-kertaisia kliiniseen 2550 mg:n annokseen verrattuna kehon pinta-alan perusteella [ks. Data ].
Vakavien synnynnäisten epämuodostumien taustariski on 6–10 % naisilla, joilla on esiraskausdiabetes ja HbA1C >7, ja sen on raportoitu olevan jopa 20–25 % naisilla, joiden HbA1C >10. Arvioitua keskenmenon taustariskiä mainitulle väestölle ei tunneta. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Huonosti hallittu raskauden diabetes lisää äidin riskiä sairastua diabeettiseen ketoasidoosiin, preeklampsiaan, spontaaniin aborttiin, ennenaikaiseen synnytykseen, kuolleena synnytykseen ja synnytyskomplikaatioihin. Huonosti hallittu diabetes mellitus lisää sikiön vakavien synnynnäisten epämuodostumien, kuolleena syntymisen ja makrosomiaan liittyvän sairastuvuuden riskiä.
Data
Ihmistiedot
Markkinoille tulon jälkeisistä tutkimuksista julkaistut tiedot eivät ole raportoineet selkeästä yhteydestä metformiiniin ja merkittäviin synnynnäisiin epämuodostuksiin, keskenmenoon tai haitallisiin äidin tai sikiön seurauksiin, kun metformiinia käytettiin raskauden aikana. Nämä tutkimukset eivät kuitenkaan pysty varmasti osoittamaan metformiiniin liittyvän riskin puuttumista metodologisten rajoitusten vuoksi, mukaan lukien pieni otoskoko ja epäjohdonmukaiset vertailuryhmät.
Eläinten tiedot
Metformiinihydrokloridi ei vaikuttanut haitallisesti kehitystuloksiin, kun sitä annettiin raskaana oleville rotille ja kaniineille annoksina 600 mg/kg/vrk asti. Tämä vastaa noin 2-kertaista ja 5-kertaista altistusta 2550 mg:n kliiniseen annokseen perustuen rottien ja kaniinien kehon pinta-alan vertailuihin. Sikiön pitoisuuksien määrittäminen osoitti osittaisen istukan esteen metformiinille.
Imetys
Riskien yhteenveto
Rajoitetut julkaistut tutkimukset raportoivat, että metformiinia on äidinmaidossa [katso Data ]. Metformiinin vaikutusten määrittämiseksi imetettävään lapseen ei kuitenkaan ole riittävästi tietoa, eikä metformiinin vaikutuksista maidontuotantoon ole saatavilla tietoa. Siksi imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin kliininen tarve GLUCOPHAGE/GLUCOPHAGE 500mg XR:lle ja GLUCOPHAGE/GLUCOPHAGE 850mg XR:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Data
Julkaistut kliiniset imetystutkimukset raportoivat, että metformiinia on äidinmaidossa, mikä johti imeväisten annoksiin, jotka olivat noin 0,11–1 % äidin painon mukaan sovitetusta annoksesta ja maito/plasma-suhteen vaihteluvälillä 0,13–1. Tutkimuksia ei kuitenkaan suunniteltu Metformiinin käytön riski imetyksen aikana on ehdottomasti osoitettava pienen otoskoon ja imeväisillä kerättyjen haittavaikutusten rajallisen tiedon vuoksi.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Keskustele ei-toivotun raskauden mahdollisuudesta premenopausaalisten naisten kanssa, koska GLUCOPHAGE/GLUCOPHAGE XR -hoito voi johtaa ovulaatioon joillakin anovulaatiota saavilla naisilla.
Käyttö lapsille
Glucophage
GLUCOPHAGEn turvallisuus ja tehokkuus tyypin 2 diabeteksen hoidossa on osoitettu 10–16-vuotiailla lapsipotilailla. GLUCOPHAGEn turvallisuutta ja tehokkuutta ei ole osoitettu alle 10-vuotiailla lapsipotilailla.
GLUCOPHAGE 850 mg:n käyttöä 10–16-vuotiailla lapsipotilailla tyypin 2 diabeteksen hoitoon tukevat riittävät ja hyvin kontrolloidut GLUCOPHAGE-tutkimukset aikuisilla sekä lisätiedot kontrolloidusta kliinisestä tutkimuksesta 10–16-vuotiailla lapsipotilailla. vanhat, joilla oli tyypin 2 diabetes, joka osoitti samanlaisen vasteen glukoositasapainossa kuin aikuisilla [ks. Kliiniset tutkimukset ]. Tässä tutkimuksessa haittavaikutukset olivat samanlaisia kuin aikuisilla kuvatut. Suositeltu GLUCOPHAGE 1000 mg:n enimmäisvuorokausiannos on 2000 mg. [Katso ANNOSTELU JA HALLINNOINTI .]
Glucophage 1000mg XR
GLUCOPHAGE XR:n turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
GLUCOPHAGE/GLUCOPHAGE XR:n kontrolloidut kliiniset tutkimukset eivät sisältäneet riittävää määrää iäkkäitä potilaita sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovaista, yleensä aloitettava annosalueen alimmasta päästä, mikä heijastaa useammin heikentynyttä maksan, munuaisten tai sydämen toimintaa sekä samanaikaista sairautta tai muuta lääkehoitoa ja suurempi riski. maitohappoasidoosista. Arvioi munuaisten toiminta useammin iäkkäillä potilailla [katso VAROITUKSET JA VAROTOIMET ].
Munuaisten vajaatoiminta
Metformiini erittyy pääosin munuaisten kautta, ja metformiinin kertymisen ja maitohappoasidoosin riski kasvaa munuaisten vajaatoiminnan asteen myötä. GLUCOPHAGE/GLUCOPHAGE 850mg XR on vasta-aiheinen vaikeassa munuaisten vajaatoiminnassa, potilailla, joiden arvioitu glomerulussuodatusnopeus (eGFR) on alle 30 ml/min/1,73 m2 [ks. ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Metformiinin käyttöön potilailla, joilla on maksan vajaatoiminta, on liittynyt joitakin maitohappoasidoositapauksia. GLUCOPHAGE/GLUCOPHAGE 500 mg XR:ää ei suositella potilaille, joilla on maksan vajaatoiminta. [katso VAROITUKSET JA VAROTOIMET ].

YLIANNOSTUS
Metformiinihydrokloridin yliannostusta on esiintynyt, mukaan lukien yli 50 grammaa suurempien määrien nauttiminen. Hypoglykemiaa raportoitiin noin 10 %:ssa tapauksista, mutta syy-yhteyttä metformiiniin ei ole osoitettu. Maitohappoasidoosia on raportoitu noin 32 prosentissa metformiinin yliannostustapauksista [katso VAROITUKSET JA VAROTOIMET ]. Metformiini on dialysoitavissa, ja sen puhdistuma on jopa 170 ml/min hyvissä hemodynaamisissa olosuhteissa. Siksi hemodialyysi voi olla hyödyllinen poistamaan kerääntynyttä lääkettä potilailta, joilla epäillään metformiinin yliannostusta.
VASTA-AIHEET
GLUCOPHAGE 1000mg ja GLUCOPHAGE 850mg XR ovat vasta-aiheisia potilaille, joilla on:
- Vaikea munuaisten vajaatoiminta (eGFR alle 30 ml/min/1,73 m2) [ks. VAROITUKSET JA VAROTOIMET ].
- Yliherkkyys metformiinille.
- Akuutti tai krooninen metabolinen asidoosi, mukaan lukien diabeettinen ketoasidoosi, kooman kanssa tai ilman.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Metformiini on verensokeria alentava lääke, joka parantaa tyypin 2 diabetes mellitusta sairastavien potilaiden glukoosinsietokykyä alentaen sekä perus- että aterianjälkeistä plasman glukoosipitoisuutta. Metformiini vähentää maksan glukoosin tuotantoa, vähentää glukoosin imeytymistä suolistosta ja parantaa insuliiniherkkyyttä lisäämällä perifeeristä glukoosin ottoa ja käyttöä. Metformiinihoidon aikana insuliinin eritys pysyy muuttumattomana, kun taas paastoinsuliinitasot ja päivän mittainen plasman insuliinivaste voivat laskea.
Farmakokinetiikka
Imeytyminen
GLUCOPHAGE 500 mg tabletin absoluuttinen biologinen hyötyosuus annettuna paasto-olosuhteissa on noin 50-60 %. GLUCOPHAGEn 500–1500 mg:n ja 850–2550 mg:n kerta-annoksilla suun kautta annetut tutkimukset osoittavat, että annosten suhteellisuus ei ole suhteessa annokseen, mikä johtuu pikemminkin vähentyneestä imeytymisestä kuin muutoksesta eliminaatiossa. Tavallisilla GLUCOPHAGEn kliinisillä annoksilla ja annostusaikatauluilla metformiinin vakaan tilan plasmapitoisuudet saavutetaan 24–48 tunnin kuluessa ja ne ovat yleensä
GLUCOPHAGE 500 mg XR:n kerta-annoksen oraalisen jälkeen Cmax saavutetaan mediaaniarvolla 7 tuntia ja vaihteluvälillä 4–8 tuntia. Plasman huippupitoisuudet ovat noin 20 % alhaisemmat verrattuna samaan GLUCOPHAGE 1000 mg:n annokseen, mutta imeytymisen laajuus (AUC:lla mitattuna) on verrattavissa GLUCOPHAGEn annokseen.
Vakaassa tilassa AUC ja Cmax ovat pienempiä kuin annokseen suhteutettu GLUCOPHAGE XR:n välillä 500-2000 mg kerran päivässä annettuna. Plasman huippupitoisuudet ovat noin 0,6, 1,1, 1,4 ja 1,8 mikrog/ml 500, 1000, 1500 ja 2000 mg:n kerran vuorokaudessa annettavilla annoksilla, vastaavasti. Metformiinin imeytymisen laajuus (AUC:lla mitattuna) GLUCOPHAGE 500 mg XR:stä 2 000 mg:n kerran vuorokaudessa annoksella on samanlainen kuin sama kokonaisvuorokausiannos, joka annettiin GLUCOPHAGE 850 mg tabletteina 1 000 mg kahdesti vuorokaudessa. GLUCOPHAGE XR:n toistuvan annon jälkeen metformiini ei kertynyt plasmaan.
Ruoan vaikutus:
Ruoka vähentää metformiinin imeytymistä ja hidastaa hieman sen imeytymistä, mikä näkyy noin 40 % alhaisemmalla keskimääräisellä plasman huippupitoisuudella (Cmax), 25 % pienemmällä pinta-alalla plasman pitoisuus/aikakäyrän alla (AUC) ja 35 %:lla plasman huippupitoisuuden saavuttamiseen kuluvan ajan (Tmax) minuutin piteneminen yhden 850 mg:n GLUCOPHAGE-tabletin antamisen jälkeen ruoan kanssa verrattuna saman tabletin vahvuuteen paastolla.
Vaikka metformiinin imeytyminen (AUC:lla mitattuna) GLUCOPHAGE XR -tabletista lisääntyi noin 50 %, kun se annettiin ruoan kanssa, ruoka ei vaikuttanut metformiinin Cmax- ja Tmax-arvoihin. Sekä runsas- että vähärasvaisilla aterioilla oli sama vaikutus GLUCOPHAGE XR:n farmakokinetiikkaan.
Jakelu
Metformiinin näennäinen jakautumistilavuus (V/F) GLUCOPHAGE 850 mg:n kerta-annosten jälkeen oli keskimäärin 654 ± 358 l. Metformiini sitoutuu vähäisessä määrin plasman proteiineihin. Metformiini jakautuu punasoluiksi, todennäköisesti ajan funktiona.
Aineenvaihdunta
Laskimonsisäiset kerta-annostutkimukset normaaleilla koehenkilöillä osoittavat, että metformiini erittyy muuttumattomana virtsaan eikä metaboloidu maksassa (ihmisillä ei ole tunnistettu metaboliitteja) eikä sappeen.
Eliminointi
Munuaispuhdistuma (katso taulukko 4) on noin 3,5 kertaa suurempi kuin kreatiniinipuhdistuma, mikä osoittaa, että tubuluseritys on pääasiallinen metformiinin eliminaatioreitti. Oraalisen annon jälkeen noin 90 % imeytyneestä lääkkeestä eliminoituu munuaisten kautta ensimmäisten 24 tunnin aikana, ja plasman eliminaation puoliintumisaika on noin 6,2 tuntia. Veressä eliminaation puoliintumisaika on noin 17,6 tuntia, mikä viittaa siihen, että erytrosyyttimassa voi olla jakautumisosasto.
Tietyt populaatiot
Munuaisten vajaatoiminta
Potilailla, joiden munuaisten toiminta on heikentynyt, metformiinin puoliintumisaika plasmassa ja veressä on pidentynyt ja munuaispuhdistuma pienentynyt (katso taulukko 3). ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Metformiinin farmakokineettisiä tutkimuksia ei ole tehty potilailla, joilla on maksan vajaatoiminta [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Geriatria
Rajoitetut tiedot GLUCOPHAGE 1000 mg:n kontrolloiduista farmakokineettisistä tutkimuksista terveillä iäkkäillä koehenkilöillä viittaavat siihen, että metformiinin kokonaispuhdistuma plasmasta vähenee, puoliintumisaika pitenee ja Cmax kasvaa terveisiin nuoriin koehenkilöihin verrattuna. Näyttää siltä, että metformiinin farmakokinetiikan muutos ikääntymisen myötä johtuu ensisijaisesti muutoksesta munuaisten toiminnassa (katso taulukko 4). [Katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Pediatria
Kun yksi GLUCOPHAGE 500 mg tabletti otettiin suun kautta ruuan kanssa, metformiinin geometrinen keskiarvo Cmax ja AUC erosivat alle 5 % tyypin 2 diabeetikoiden (12-16-vuotiaat) ja sukupuolensa ja painoltaan vastaavien terveiden aikuisten (20 45-vuotiaat), joilla kaikilla on normaali munuaisten toiminta.
Sukupuoli
Metformiinin farmakokineettiset parametrit eivät eronneet merkitsevästi normaaleilla koehenkilöillä ja tyypin 2 diabetes mellitusta sairastavilla potilailla, kun niitä analysoitiin sukupuolen mukaan (miehet = 19, naiset = 16).
Rotu
Metformiinin farmakokineettisiä parametreja rodun perusteella ei ole tehty.
Huumeiden vuorovaikutukset
In vivo -arviointi huumeiden yhteisvaikutuksista
Kliiniset tutkimukset
Glucophage
Aikuisten kliiniset tutkimukset
Suoritettiin kaksoissokkoutettu, lumekontrolloitu, monikeskustutkimus Yhdysvalloissa, jossa oli mukana lihavia potilaita, joilla oli tyypin 2 diabetes mellitus ja joiden hyperglykemiaa ei saatu riittävästi hallintaan pelkällä ruokavaliohoidolla (plasman paastoglukoosi [FPG] noin 240 mg/dl). Potilaita hoidettiin GLUCOPHAGElla (enintään 2550 mg/vrk) tai lumelääkevalmisteella 29 viikon ajan. Tulokset on esitetty taulukossa 7.
Keskimääräinen lähtöpaino oli 201 lbs ja 206 lbs GLUCOPHAGE 850 mg:n ja lumelääkehaaroissa, vastaavasti. Keskimääräinen ruumiinpainon muutos lähtötilanteesta viikkoon 29 oli -1,4 lbs GLUCOPHAGE 1000 mg ja lumelääkehaaroissa -2,4 lbs. 29 viikkoa kestänyt, kaksoissokkoutettu, lumekontrolloitu tutkimus GLUCOPHAGEsta ja glyburidista yksin ja yhdistelmänä , suoritettiin lihavilla potilailla, joilla oli tyypin 2 diabetes mellitus ja jotka eivät olleet saavuttaneet riittävää glukoositasapainoa glyburidin enimmäisannoksilla (perustason FPG noin 250 mg/dl). Yhdistelmähaaraan satunnaistetut potilaat aloittivat hoidon GLUCOPHAGElla 500 mg ja glyburidilla 20 mg:lla. Tutkimuksen ensimmäisten 4 viikon jokaisen viikon lopussa näiden potilaiden GLUCOPHAGE 500 mg -annoksia nostettiin 500 mg:lla, jos he eivät olleet saavuttaneet plasman paastoglukoosiarvoa. Viikon 4 jälkeen tällaisia annosmuutoksia tehtiin kuukausittain, vaikka yksikään potilas ei saanut ylittää GLUCOPHAGE 2500 mg:aa. Potilaat vain GLUCOPHAGE-haarassa (metformiini plus lumelääke) keskeyttivät glyburidin käytön ja noudattivat samaa titrausaikataulua. Potilaat glyburidihaarassa jatkoivat samaa glyburidiannosta. Kokeen lopussa noin 70 % yhdistelmäryhmän potilaista käytti GLUCOPHAGE 2000 mg/glyburidia 20 mg tai GLUCOPHAGE 2500 mg/glyburidia 20 mg. Tulokset näkyvät taulukossa 8.
Keskimääräinen lähtöpaino oli 202 lbs, 203 lbs ja 204 lbs GLUCOPHAGE/glyburidi-, glyburidi- ja GLUCOPHAGE 500 mg -haaroissa, vastaavasti. Keskimääräinen ruumiinpainon muutos lähtötasosta viikkoon 29 oli 0,9 lbs, -0,7 lbs ja -8,4 lbs GLUCOPHAGE/glyburidi-, glyburidi- ja GLUCOPHAGE 850 mg -haaroissa, vastaavasti.
Lasten kliiniset tutkimukset
Kaksoissokkoutettu, lumekontrolloitu tutkimus 10–16-vuotiailla lapsipotilailla, joilla oli tyypin 2 diabetes (keskimääräinen FPG 182,2 mg/dl), GLUCOPHAGE-hoito (jopa 2000 mg/vrk) enintään 16 viikon ajan (keskimääräinen kesto). 11 viikkoa) suoritettiin. Tulokset näkyvät taulukossa 9.
Keskimääräinen lähtöpaino oli 205 lbs ja 189 lbs GLUCOPHAGE 850 mg:n ja lumelääkehaaroissa, vastaavasti. Keskimääräinen ruumiinpainon muutos lähtötilanteesta viikkoon 16 oli -3,3 lbs ja -2,0 lbs GLUCOPHAGE 500 mg:n ja lumelääkehaaroissa, vastaavasti.
Glucophage XR
24 viikkoa kestänyt, kaksoissokkoutettu, lumekontrolloitu tutkimus GLUCOPHAGE 1000 mg XR:stä, joka otettiin kerran päivässä ilta-aterian yhteydessä, suoritettiin potilailla, joilla oli tyypin 2 diabetes mellitus ja jotka eivät olleet saavuttaneet glukoositasapainoa ruokavaliolla ja liikunnalla. Tutkimukseen osallistuneiden potilaiden keskimääräinen lähtötason HbA1c oli 8,0 % ja keskimääräinen lähtötason FPG 176 mg/dl. Hoitoannosta nostettiin 1 500 mg:aan kerran vuorokaudessa, jos viikolla 12 HbA1c oli ≥ 7,0 % mutta
16 viikkoa kestänyt kaksoissokkoutettu, lumekontrolloitu annos-vastetutkimus GLUCOPHAGE 500 mg XR:stä, joka otettiin kerran vuorokaudessa ilta-aterian yhteydessä tai kahdesti päivässä aterioiden yhteydessä, suoritettiin potilailla, joilla oli tyypin 2 diabetes mellitus ja jotka eivät olleet saavuttaneet glukoosia. valvoa ruokavaliolla ja liikunnalla. Tulokset on esitetty taulukossa 10.
Keskimääräinen lähtöpaino oli 193 lbs, 192 lbs, 188 lbs, 196 lbs, 193 lbs ja 194 lbs GLUCOPHAGE XR:ssä 500 mg, 1000 mg, 1500 mg ja 20010 mg ms kerran päivässä, vastaavasti 20010 mg ms kerran päivässä. . Keskimääräinen ruumiinpainon muutos lähtötasosta viikkoon 16 oli -1,3 lbs, -1,3 lbs, -0,7 lbs, -1,5 lbs, -2,2 lbs ja -1,8 lbs.
24 viikkoa kestänyt, kaksoissokkoutettu, satunnaistettu tutkimus GLUCOPHAGE XR:stä, joka otettiin kerran vuorokaudessa ilta-aterian yhteydessä, ja GLUCOPHAGE 500 mg:lla kahdesti vuorokaudessa (aamiaisen ja ilta-aterian yhteydessä), suoritettiin potilailla, joilla oli tyypin 2 diabetes mellitus. hoidettiin GLUCOPHAGElla 500 mg kahdesti vuorokaudessa vähintään 8 viikon ajan ennen tutkimukseen osallistumista. Tulokset on esitetty taulukossa 11.
Keskimääräinen lähtöpaino oli 210 lbs, 203 lbs ja 193 lbs GLUCOPHAGE 500mg kahdesti vuorokaudessa ja GLUCOPHAGE XR 1000mg ja 1500mg kerran vuorokaudessa, vastaavasti. Keskimääräinen ruumiinpainon muutos lähtötilanteesta viikkoon 24 oli 0,9 lbs, 1,1 lbs ja 0,9 lbs.
POTILASTIEDOT
GLUCOPHAGE® [gloo-ko-fahzh] (metformiinihydrokloridi) Tabletit
ja
GLUCOPHAGE® XR [gloo-ko-fahzh XR] (metformiinihydrokloridi) pitkävaikutteiset tabletit
Lue GLUCOPHAGEn ja GLUCOPHAGE 1000mg XR:n mukana tulevat potilastiedot ennen kuin aloitat niiden käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä pakkausseloste ei korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää GLUCOPHAGE 1000mg:sta ja GLUCOPHAGE 500mg XR:stä?
GLUCOPHAGEa tai GLUCOPHAGE 1000mg XR:ää käyttävillä ihmisillä voi esiintyä vakavia sivuvaikutuksia, mukaan lukien:
Maitohappoasidoosi. Metformiinihydrokloridi, GLUCOPHAGE 500 mg:n ja GLUCOPHAGE XR:n sisältämä lääke, voi aiheuttaa harvinaisen, mutta vakavan sivuvaikutuksen, jota kutsutaan maitohappoasidoosiksi (maitohapon kertyminen vereen), joka voi aiheuttaa kuoleman. Maitohappoasidoosi on lääketieteellinen hätätilanne, ja se on hoidettava sairaalassa.
Lopeta GLUCOPHAGE tai GLUCOPHAGE 500mg XR -valmisteen käyttö ja soita heti terveydenhuollon tarjoajalle, jos saat jonkin seuraavista maitohappoasidoosin oireista:
- tuntuu erittäin heikolta ja väsyneeltä
- sinulla on epätavallinen (ei normaali) lihaskipu
- on hengitysvaikeuksia
- sinulla on epätavallista uneliaisuutta tai nukut tavallista pidempään
- sinulla on selittämättömiä maha- tai suolisto-ongelmia, joihin liittyy pahoinvointia ja oksentelua tai ripulia
- tuntuu kylmältä, etenkin käsissäsi ja jaloissasi
- huimausta tai huimausta
- sinulla on hidas tai epäsäännöllinen sydämenlyönti
Sinulla on suurempi mahdollisuus saada maitohappoasidoosi, jos:
- on munuaisongelmia. Ihmisten, joiden munuaiset eivät toimi kunnolla, ei tule käyttää GLUCOPHAGE 850 mg TAI GLUCOPHAGE XR -valmistetta.
- sinulla on maksaongelmia.
- sinulla on kongestiivinen sydämen vajaatoiminta, joka vaatii hoitoa lääkkeillä.
- juo paljon alkoholia (hyvin usein tai lyhytaikainen humalajuominen).
- kuivua (menettää suuri määrä kehon nesteitä). Tämä voi tapahtua, jos sinulla on kuumetta, oksentelua tai ripulia. Kuivumista voi tapahtua myös silloin, kun hikoilet paljon liikunnan tai liikunnan aikana etkä juo tarpeeksi nesteitä.
- tehdä tiettyjä röntgenkokeita injektoivilla väriaineilla tai varjoaineilla.
- käydä leikkauksessa.
- sinulla on sydänkohtaus, vakava infektio tai aivohalvaus.
- olet 80-vuotias tai vanhempi, etkä ole testannut munuaistoimintaasi.
Mitä ovat GLUCOPHAGE ja GLUCOPHAGE 1000mg XR?
- GLUCOPHAGE ja GLUCOPHAGE XR ovat reseptilääkkeitä, jotka sisältävät metformiinihydrokloridia. GLUCOPHAGE 500mg ja GLUCOPHAGE 1000mg XR käytetään ruokavalion ja liikunnan kanssa auttamaan hallitsemaan korkeaa verensokeria (hyperglykemiaa) aikuisilla, joilla on tyypin 2 diabetes.
- GLUCOPHAGE 850mg ja GLUCOPHAGE 500mg XR eivät ole tarkoitettu tyypin 1 diabetesta sairastaville.
- GLUCOPHAGE 850mg ja GLUCOPHAGE 500mg XR eivät ole tarkoitettu ihmisille, joilla on diabeettinen ketoasidoosi (ketonien lisääntyminen veressä tai virtsassa).
GLUCOPHAGE 850mg:ssa ja GLUCOPHAGE 1000mg XR:ssä on sama vaikuttava aine. GLUCOPHAGE XR toimii kuitenkin pidempään kehossasi. Molemmat lääkkeet auttavat hallitsemaan verensokeriasi monin tavoin. Näitä ovat auttamalla elimistösi reagoimaan paremmin sen luonnollisesti tuottamaan insuliiniin, vähentämään maksan tuottaman sokerin määrää ja vähentämään suolistosi absorboiman sokerin määrää. GLUCOPHAGE 1000mg ja GLUCOPHAGE 850mg XR eivät saa elimistöäsi tuottamaan lisää insuliinia.
Kuka ei saa käyttää GLUCOPHAGEa tai GLUCOPHAGE 850mg XR:ää?
Jotkut sairaudet lisäävät mahdollisuutta saada maitohappoasidoosi tai aiheuttavat muita ongelmia, jos käytät jompaakumpaa näistä lääkkeistä. Useimmat alla luetellut sairaudet voivat lisätä mahdollisuuttasi saada maitohappoasidoosi.
Älä ota GLUCOPHAGE 1000 mg tai GLUCOPHAGE 500 mg XR:ää, jos:
- on munuaisongelmia
- olet allerginen GLUCOPHAGE- tai GLUCOPHAGE 850mg XR -valmisteen metformiinihydrokloridille tai jollekin GLUCOPHAGE- tai GLUCOPHAGE XR -valmisteen aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo GLUCOPHAGEn ja GLUCOPHAGE XR:n ainesosista.
- saat väri- tai varjoaineruiskeen röntgenhoitoa varten tai jos olet menossa leikkaukseen etkä pysty syömään tai juomaan paljon. Näissä tilanteissa GLUCOPHAGE 1000mg tai GLUCOPHAGE XR on keskeytettävä lyhyeksi ajaksi. Keskustele terveydenhuollon tarjoajan kanssa siitä, milloin sinun tulee lopettaa GLUCOPHAGE 850mg tai GLUCOPHAGE 850mg XR ja milloin sinun pitäisi aloittaa GLUCOPHAGE tai GLUCOPHAGE XR uudelleen. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää GLUCOPHAGEsta tai GLUCOPHAGE XR:stä?"
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen GLUCOPHAGEn tai GLUCOPHAGE 1000mg XR:n ottamista?
Kerro terveydenhuollon tarjoajallesi ennen GLUCOPHAGE 500 mg:n tai GLUCOPHAGE XR:n ottamista, jos:
- on tyypin 1 diabetes. GLUCOPHAGE 850mg tai GLUCOPHAGE 500mg XR ei tule käyttää tyypin 1 diabetesta sairastavien potilaiden hoitoon.
- sinulla on ollut diabeettinen ketoasidoosi tai riski sairastua (korkea määrä tiettyjä happoja, joita kutsutaan ketoneiksi, veressä tai virtsassa). GLUCOPHAGE 1000mg tai GLUCOPHAGE XR ei tule käyttää diabeettisen ketoasidoosin hoitoon.
- on munuaisongelmia.
- sinulla on maksaongelmia.
- sinulla on sydänongelmia, mukaan lukien sydämen vajaatoiminta.
- ovat yli 80-vuotiaita. Jos olet yli 80-vuotias, älä käytä GLUCOPHAGE 1000 mg tai GLUCOPHAGE XR -valmistetta, ellei munuaisesi ole tutkittu ja ne ovat normaaleja.
- juo alkoholia hyvin usein tai juo paljon alkoholia lyhytaikaisen "ahkauksen" aikana.
- ottavat insuliinia.
- sinulla on muita sairauksia.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako GLUCOPHAGE tai GLUCOPHAGE 850mg XR sikiötäsi. Jos olet raskaana, keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta hallita verensokeria raskauden aikana.
- imetät tai aiot imettää. Ei tiedetä, erittyykö GLUCOPHAGE 850mg tai GLUCOPHAGE XR rintamaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi, kun käytät GLUCOPHAGE 500mg tai GLUCOPHAGE 500mg XR -valmistetta.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
- GLUCOPHAGE tai GLUCOPHAGE XR voivat vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa GLUCOPHAGEn tai GLUCOPHAGE XR:n toimintaan.
Voidaanko GLUCOPHAGEa tai GLUCOPHAGE 500mg XR:ää käyttää lapsille?
GLUCOPHAGE 1000mg:n on osoitettu alentavan tehokkaasti glukoositasoja lapsilla (10-16-vuotiaat), joilla on tyypin 2 diabetes. GLUCOPHAGE 1000 mg:aa ei ole tutkittu alle 10-vuotiailla lapsilla. GLUCOPHAGE 500 mg:aa ei ole tutkittu yhdessä muiden suun kautta otettavien glukoositason säätölääkkeiden tai insuliinin kanssa lapsille. Jos sinulla on kysyttävää GLUCOPHAGE 1000mg:n käytöstä lapsilla, keskustele lääkärisi tai muun terveydenhuollon tarjoajan kanssa.
GLUCOPHAGE XR:ää ei ole tutkittu lapsilla.
Kuinka minun pitäisi ottaa GLUCOPHAGE tai GLUCOPHAGE XR?
- Ota GLUCOPHAGE 850mg tai GLUCOPHAGE 850mg XR juuri sen verran kuin terveydenhuollon tarjoajasi on neuvonut.
- GLUCOPHAGE tai GLUCOPHAGE 850mg XR tulee ottaa aterioiden yhteydessä vatsavaivojen sivuvaikutuksen vähentämiseksi.
- Niele GLUCOPHAGE tai GLUCOPHAGE 500 mg XR kokonaisena. Älä murskaa, leikkaa tai pureskele GLUCOPHAGE 1000mg XR:ää.
- Saatat joskus erittää ulosteessa pehmeää massaa (suolen liike), joka näyttää GLUCOPHAGE 850 mg:n tai GLUCOPHAGE XR -tableteilta. Tämä ei ole haitallista eikä vaikuta tapaan, jolla GLUCOPHAGE 850mg XR vaikuttaa diabeteksen hallintaan.
- Kun kehosi on tietyntyyppisen stressin, kuten kuumeen, trauman (kuten auto-onnettomuuden), infektion tai leikkauksen alla, tarvitsemasi diabeteslääkkeen määrä voi muuttua. Kerro heti terveydenhuollon tarjoajallesi, jos sinulla on jokin näistä ongelmista.
- Terveydenhuollon tarjoajasi tulee tehdä verikokeita varmistaakseen, kuinka hyvin munuaisesi toimivat ennen GLUCOPHAGE 1000mg- tai GLUCOPHAGE 500mg XR -hoitoa ja sen aikana.
- Terveydenhuollon tarjoaja tarkistaa diabeteksesi säännöllisillä verikokeilla, mukaan lukien verensokeriarvosi ja hemoglobiini A1C.
- Noudata terveydenhuollon tarjoajan ohjeita liian alhaisen verensokerin (hypoglykemia) hoidossa. Keskustele terveydenhuollon tarjoajan kanssa, jos matala verensokeri on sinulle ongelma. Katso "Mitkä ovat GLUCOPHAGEn tai GLUCOPHAGE XR:n mahdolliset sivuvaikutukset?"
- Tarkista verensokerisi terveydenhuollon tarjoajan ohjeiden mukaan.
- Pysy määrätyssä ruokavaliossa ja harjoitusohjelmassa, kun käytät GLUCOPHAGE 850 mg tai GLUCOPHAGE 850 mg XR -valmistetta.
- Jos unohdat ottaa GLUCOPHAGE 1000 mg tai GLUCOPHAGE 850 mg XR -annoksen, ota seuraava annos ohjeiden mukaan, ellei terveydenhuollon tarjoaja kerro toisin. Älä ota ylimääräistä annosta seuraavana päivänä.
- Jos otat liikaa GLUCOPHAGE 500 mg tai GLUCOPHAGE 500 mg XR -valmistetta, soita välittömästi terveydenhuollon tarjoajallesi, paikalliseen myrkytystietokeskukseen tai mene lähimmän sairaalan ensiapuun.
Mitä minun tulisi välttää käyttäessäni GLUCOPHAGEa tai GLUCOPHAGE 1000mg XR:ää?
Älä juo paljon alkoholijuomia GLUCOPHAGE- tai GLUCOPHAGE XR -hoidon aikana. Tämä tarkoittaa, että sinun ei pitäisi humalajuomaa lyhyitä aikoja, eikä sinun pitäisi juoda paljon alkoholia säännöllisesti. Alkoholi voi lisätä maitohappoasidoosin riskiä.
Mitkä ovat GLUCOPHAGEn ja GLUCOPHAGE XR:n sivuvaikutukset?
- Maitohappoasidoosi. Metformiini, GLUCOPHAGE 1000 mg:n ja GLUCOPHAGE 500 mg XR:n vaikuttava aine, voi aiheuttaa harvinaisen mutta vakavan tilan, jota kutsutaan maitohappoasidoosiksi (hapon kertyminen vereen), joka voi aiheuttaa kuoleman. Maitohappoasidoosi on lääketieteellinen hätätilanne, ja se on hoidettava sairaalassa.
Soita lääkärillesi välittömästi, jos sinulla on jokin seuraavista oireista, jotka voivat olla maitohappoasidoosin merkkejä:
- tunnet kylmää käsissäsi tai jaloissasi
- tunnet huimausta tai huimausta
- sinulla on hidas tai epäsäännöllinen sydämenlyönti
- tunnet itsesi hyvin heikoksi tai väsyneeksi
- sinulla on hengitysvaikeuksia
- tunnet itsesi uneliaaksi tai uneliaaksi
- sinulla on vatsakipuja, pahoinvointia tai oksentelua
Useimmilla ihmisillä, joilla on ollut maitohappoasidoosi metformiinin kanssa, on muita asioita, jotka yhdessä metformiinin kanssa johtivat maitohappoasidoosiin. Kerro lääkärillesi, jos sinulla on jokin seuraavista, koska sinulla on suurempi mahdollisuus saada maitohappoasidoosi GLUCOPHAGE 850 mg:n tai GLUCOPHAGE 500 mg XR:n käytön yhteydessä, jos:
- sinulla on vakavia munuaisongelmia tai tietyt röntgentutkimukset, joissa käytetään ruiskeena käytettävää väriainetta, vaikuttavat munuaisiin
- sinulla on maksaongelmia
- juo alkoholia hyvin usein tai juo paljon alkoholia lyhytaikaisen "ahkauksen" aikana
- kuivua (menettää suuri määrä kehon nesteitä). Tämä voi tapahtua, jos sinulla on kuumetta, oksentelua tai ripulia. Kuivumista voi tapahtua myös silloin, kun hikoilet paljon liikunnan tai liikunnan aikana etkä juo tarpeeksi nesteitä
- käydä leikkauksessa
- sinulla on sydänkohtaus, vakava infektio tai aivohalvaus
GLUCOPHAGE 500 mg:n ja GLUCOPHAGE 1000 mg XR:n yleisiä sivuvaikutuksia ovat ripuli, pahoinvointi ja vatsavaivoja. Nämä haittavaikutukset häviävät yleensä, kun olet ottanut lääkettä jonkin aikaa. Lääkkeen ottaminen aterioiden yhteydessä voi auttaa vähentämään näitä sivuvaikutuksia. Kerro lääkärillesi, jos haittavaikutukset häiritsevät sinua paljon, kestävät yli muutaman viikon, palaavat, kun ne ovat hävinneet, tai jos ne alkavat myöhemmin hoidon aikana. Saatat tarvita pienemmän annoksen tai lopettaa lääkkeen käytön lyhyeksi ajaksi tai pysyvästi.
Noin kolmella sadasta GLUCOPHAGEa tai GLUCOPHAGE 1000mg XR:ää käyttävästä ihmisestä on epämiellyttävä metallin maku, kun he alkavat käyttää lääkettä. Se kestää lyhyen aikaa.
GLUCOPHAGE 850mg ja GLUCOPHAGE 500mg XR aiheuttavat harvoin hypoglykemiaa (matala verensokeri) itsestään. Hypoglykemia voi kuitenkin tapahtua, jos et syö tarpeeksi, jos juot alkoholia tai käytät muita verensokeria alentavia lääkkeitä.
Kuinka GLUCOPHAGE 500mg ja GLUCOPHAGE XR säilytetään?
Säilytä GLUCOPHAGE ja GLUCOPHAGE 850 mg XR 20 - 25 °C:ssa (68 °F - 77 °F).
Pidä GLUCOPHAGE 850mg ja GLUCOPHAGE 500mg XR ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa GLUCOPHAGE 850mg:n ja GLUCOPHAGE 850mg XR:n käytöstä
Jos sinulla on kysyttävää tai ongelmia, keskustele lääkärisi tai muun terveydenhuollon tarjoajan kanssa. Voit kysyä lääkäriltäsi tai apteekista GLUCOPHAGE 850mg:sta ja GLUCOPHAGE 500mg XR:stä terveydenhuollon ammattilaisille kirjoitettuja tietoja. Lääkkeitä määrätään joskus muihin kuin potilasohjeessa mainittuihin tarkoituksiin. Älä käytä GLUCOPHAGE 1000mg tai GLUCOPHAGE 1000mg XR sairauksiin, joihin sitä ei ole määrätty. Älä jaa lääkettäsi muiden ihmisten kanssa.
Mitkä ovat GLUCOPHAGEn ja GLUCOPHAGE 500mg XR:n aineosat?
GLUCOPHAGE:n vaikuttavat aineet: metformiinihydrokloridi.
Inaktiiviset aineosat jokaisessa GLUCOPHAGE-tabletissa: povidoni ja magnesiumstearaatti. Lisäksi 500 mg:n ja 850 mg:n tablettien päällyste sisältää hypromelloosia ja 1000 mg:n tablettien päällyste sisältää hypromelloosia ja polyetyleeniglykolia.
GLUCOPHAGE 1000mg XR:n vaikuttavat aineet: metformiinihydrokloridi.
Inaktiiviset aineet jokaisessa GLUCOPHAGE 1000mg XR 500 mg tabletissa: natriumkarboksimetyyliselluloosa, hypromelloosi, mikrokiteinen selluloosa ja magnesiumstearaatti.
Inaktiiviset aineet jokaisessa GLUCOPHAGE XR 750 mg tabletissa: natriumkarboksimetyyliselluloosa, hypromelloosi ja magnesiumstearaatti.
Mikä on tyypin 2 diabetes?
Tyypin 2 diabetes on tila, jossa elimistö ei tuota tarpeeksi insuliinia ja kehosi tuottama insuliini ei toimi niin hyvin kuin sen pitäisi. Kehosi voi myös tuottaa liikaa sokeria. Kun näin tapahtuu, sokeria (glukoosia) kertyy vereen. Tämä voi johtaa vakaviin lääketieteellisiin ongelmiin.
Diabeteksen hoidon päätavoite on alentaa verensokeria normaalille tasolle.
Korkeaa verensokeria voidaan alentaa ruokavaliolla ja liikunnalla sekä tarvittaessa tietyillä lääkkeillä.
Keskustele terveydenhuollon tarjoajasi kanssa siitä, kuinka voit ehkäistä, tunnistaa ja hoitaa matalaa verensokeria (hypoglykemiaa), korkeaa verensokeria (hyperglykemiaa) ja diabeteksesi aiheuttamia ongelmia.
