Flonase Nasal Spray 50mcg Fluticasone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Flonase on ja miten sitä käytetään?
Flonase on reseptilääke, jota käytetään allergisen nuhan (aivastelu, nenän vuotaminen ja kutisevat tai vetiset silmät) ja nenäpolyyppien oireiden hoitoon. Flonaasia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Flonaasi kuuluu lääkeluokkaan, jota kutsutaan kortikosteroidiksi, intranasaaliseksi, immunosuppressiiviseksi, PHD:ksi.
Ei tiedetä, onko Flonase turvallinen ja tehokas alle 4-vuotiaille lapsille.
Mitkä ovat Flonasen mahdolliset sivuvaikutukset?
Flonaasi voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vaikea tai jatkuva nenäverenvuoto,
- meluisa hengitys,
- vuotava nenä,
- kuoriutuu sieraimien ympärille,
- punoitusta, haavaumia tai valkoisia läiskiä suussa tai kurkussa,
- kuume,
- vilunväristykset,
- kehon kivut,
- näön hämärtyminen,
- silmäkipu,
- nähdä haloja valojen ympärillä,
- haavat, jotka eivät parane,
- paheneva väsymys,
- lihas heikkous,
- huimaus,
- pahoinvointi ja
- oksentelua
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Flonasen yleisimmät sivuvaikutukset ovat:
- vähäinen nenäverenvuoto,
- polttava tai kutina nenässäsi,
- haavaumia tai valkoisia läiskiä nenän sisällä tai ympärillä,
- yskä,
- vaikeuksia hengittää,
- päänsärky,
- selkäkipu,
- poskiontelokipu,
- kipeä kurkku,
- kuume,
- pahoinvointi ja
- oksentelua
KUVAUS
FLONASE nenäsumutteen 50 mikrogramman aktiivinen komponentti on flutikasonipropionaatti, kortikosteroidi, jonka kemiallinen nimi on S-(fluorimetyyli) 6α,9-difluori-11β,17-dihydroksi-16α-metyyli-3oksoandrosta-1,4-dieeni-17β-karbotioaatti. , 17-propionaatti ja seuraava kemiallinen rakenne:
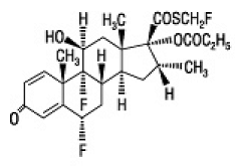
Flutikasonipropionaatti on valkoinen jauhe, jonka molekyylipaino on 500,6, ja empiirinen kaava on C25H31F3O5S. Se on käytännössä liukenematon veteen, liukenee vapaasti dimetyylisulfoksidiin ja dimetyyliformamidiin ja liukenee heikosti metanoliin ja 95 % etanoliin.
FLONASE nenäsumute, 50 mcg on vesipitoinen mikrohieno flutikasonipropionaatin suspensio, joka on tarkoitettu annettavaksi paikallisesti nenän limakalvolle annostelevan, sumuttavan suihkepumpun avulla. FLONASE Nenäsumute 50 mcg sisältää myös mikrokiteistä selluloosaa ja karboksimetyyliselluloosanatriumia, dekstroosia, 0,02 % w/w bentsalkoniumkloridia, polysorbaatti 80:tä ja 0,25 % w/w fenyylietyylialkoholia, ja sen pH on 5-7.
Ensimmäisen esikäsittelyn jälkeen jokainen painallus antaa 50 mikrogrammaa flutikasonipropionaattia 100 mg:ssa formulaatiota nenäadapterin kautta.
INDIKAATIOT
FLONASE®-nenäsumute on tarkoitettu ympärivuotisen ei-allergisen nuhan nenäoireiden hoitoon 4-vuotiaille ja sitä vanhemmille aikuis- ja lapsipotilaille.
ANNOSTELU JA HALLINNOINTI
Anna FLONASE-nenäsumutetta vain intranasaalisesti. Pohjusta FLONASE-nenäsumutetta ennen ensimmäistä käyttöä tai käytön jälkeen (1 viikko tai kauemmin) ravistamalla sisältöä hyvin ja päästämällä 6 suihketta ilmaan pois kasvoilta. Ravista FLONASE-nenäsumutetta varovasti ennen jokaista käyttöä.
Potilaiden tulee käyttää FLONASE-nenäsumutetta säännöllisin väliajoin, koska sen tehokkuus riippuu sen säännöllisestä käytöstä. Maksimivaikutus voi kestää useita päiviä, ja yksittäiset potilaat kokevat vaihtelevan ajan ilmaantumiseen ja oireiden lievittymiseen eriasteisesti.
Aikuiset
Suositeltu aloitusannos aikuisille on 2 suihketta (kukin 50 mikrog flutikasonipropionaattia) kumpaankin sieraimeen kerran päivässä (kokonaisvuorokausiannos, 200 mikrog). Sama kokonaispäiväannos, 1 suihke kumpaankin sieraimeen kahdesti päivässä (esim. klo 8 ja 20) on myös tehokas. Ensimmäisten päivien jälkeen potilaat voivat pystyä pienentämään annoksensa yhteen suihkeeseen kumpaankin sieraimeen kerran päivässä ylläpitohoitoa varten.
Päivittäiset enimmäisannokset eivät saa ylittää kahta suihketta kumpaankin sieraimeen (kokonaisannos, 200 mikrogrammaa päivässä). Ei ole näyttöä siitä, että suositellun annoksen ylittäminen olisi tehokkaampaa.
Nuoret ja lapset (4-vuotiaat ja sitä vanhemmat)
Suositeltu aloitusannos 4-vuotiaille ja sitä vanhemmille nuorille ja lapsille on 1 suihke kumpaankin sieraimeen kerran päivässä (kokonaisvuorokausiannos, 100 mikrogrammaa). Potilaat, jotka eivät reagoi riittävästi yhteen suihkeeseen kumpaankin sieraimeen, voivat käyttää 2 suihketta kumpaankin sieraimeen kerran päivässä (kokonaisvuorokausiannos, 200 mikrogrammaa). Kun riittävä hallinta on saavutettu, annosta tulee pienentää yhteen suihkeeseen kumpaankin sieraimeen kerran päivässä.
Päivittäinen enimmäisannos ei saa ylittää kahta suihketta kumpaankin sieraimeen (200 mikrogrammaa päivässä). Ei ole näyttöä siitä, että suositellun annoksen ylittäminen olisi tehokkaampaa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
FLONASE Nenäsumute on nenäsumutesuspensio. Jokainen 100 mg:n suihke antaa 50 mikrogrammaa flutikasonipropionaattia.
Varastointi ja käsittely
FLONAASI Nenäsumute, 50 mcg, toimitetaan kullanruskeassa lasipullossa, jossa on valkoinen annostussumutuspumppu, valkoinen nenäsovitin ja vihreä pölysuoja 1 ( NDC 0173-0453-01) ja FDA:n hyväksymä Potilaan merkintä (katso Potilasohjeet laitteen oikeaa käyttöä varten ). Jokaisen pullon nettäyttöpaino on 16 g, ja se antaa 120 käyttökertaa. Jokainen painallus antaa 50 mikrogrammaa flutikasonipropionaattia 100 mg:ssa formulaatiota nenäadapterin kautta. Oikeaa lääkemäärää jokaisessa suihkeessa ei voida taata 120 ruiskutuksen jälkeen, vaikka pullo ei olekaan täysin tyhjä. Pullo on hävitettävä, kun merkinnöissä mainittu määrä toimenpiteitä on käytetty.
Säilytä 4° - 30°C (39° - 86°F).
GlaxoSmithKline Research Triangle Park, NC 27709. Tarkistettu: tammikuu 2015
SIVUVAIKUTUKSET
Systeeminen ja paikallinen kortikosteroidien käyttö voi johtaa seuraaviin:
- Nenäverenvuoto, nenän haavaumat, Candida albicans -infektio, nenän väliseinän perforaatio ja heikentynyt haavan paraneminen [ks. VAROITUKSET JA VAROTOIMET ]
- Kaihi ja glaukooma [katso VAROITUKSET JA VAROTOIMET ]
- Immunosuppressio [katso VAROITUKSET JA VAROTOIMET ]
- Hyperkortisismi ja lisämunuaisten vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ]
- Vaikutus kasvuun [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
USA:n kontrolloiduissa kliinisissä tutkimuksissa yli 3 300 allergista ja ei-allergista nuhaa sairastavaa henkilöä sai hoitoa intranasaalisella flutikasonipropionaatilla. Yleensä kliinisissä tutkimuksissa haittavaikutukset on liitetty ensisijaisesti nenän limakalvojen ärsytykseen, ja haittavaikutuksia raportoitiin suunnilleen samalla tiheydellä lumelääkettä saaneilla koehenkilöillä. Alle 2 % kliinisissä tutkimuksissa olevista henkilöistä keskeytti hoidon haittavaikutusten vuoksi; tämä osuus oli samanlainen vehikkelillä saaneilla lumelääkevalmisteilla ja aktiivisilla vertailuvalmisteilla.
Alla kuvatut turvallisuustiedot perustuvat 7 plasebokontrolloituun kliiniseen tutkimukseen potilailla, joilla on allerginen nuha. Seitsemään tutkimukseen osallistui 536 koehenkilöä (57 tyttöä ja 108 poikaa iältään 4-11 vuotta, 137 naista ja 234 miespuolista nuorta ja aikuista), joita hoidettiin FLONASE 200 mikrogrammalla kerran päivässä 2-4 viikon ajan ja 2 lumekontrolloitua kliinistä tutkimusta, joihin osallistui 246 henkilöä. (119 naista ja 127 miespuolista nuorta ja aikuista), joita hoidettiin FLONASE 200 mikrogrammalla kerran päivässä 6 kuukauden ajan (taulukko 1). Taulukkoon 1 sisältyvät myös haittavaikutukset kahdesta tutkimuksesta, joissa 167 lasta (45 tyttöä ja 122 poikaa, iältään 4–11 vuotta) hoidettiin FLONASE 100 mikrogrammalla kerran päivässä 2–4 viikon ajan.
Muita haittavaikutuksia FLONASE nenäsumuteella 50 mikrogrammaa, joiden ilmaantuvuus on pienempi tai yhtä suuri kuin 3 %, mutta suurempi tai yhtä suuri kuin 1 % ja yleisempiä kuin lumelääkettä käytettäessä, mukaan lukien: verta nenän limassa, vuotava nenä, vatsakipu, ripuli, kuume, flunssan kaltaiset oireet, kivut, huimaus ja keuhkoputkentulehdus.
Markkinoinnin jälkeinen kokemus
Kliinisissä tutkimuksissa raportoitujen haittatapahtumien lisäksi seuraavat haittatapahtumat on tunnistettu intranasaalisen flutikasonipropionaatin käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Nämä tapahtumat on valittu sisällytettäväksi joko niiden vakavuuden, ilmoitustiheyden tai syy-yhteyden flutikasonipropionaattiin tai näiden tekijöiden yhdistelmän vuoksi.
Yleiset häiriöt ja hallintopaikan ehdot
Yliherkkyysreaktiot, mukaan lukien angioödeema, ihottuma, kasvojen ja kielen turvotus, kutina, nokkosihottuma, bronkospasmi, hengityksen vinkuminen, hengenahdistus ja anafylaksia/anafylaktoidireaktiot, jotka harvoissa tapauksissa olivat vakavia.
Korva- ja labyrinttihäiriöt
Maku- ja/tai hajuaistin muuttuminen tai menetys ja harvoin nenän väliseinän perforaatio, nenähaava, kurkkukipu, kurkun ärsytys ja kuivuus, yskä, käheys ja äänen muutokset.
Silmäsairaudet
Kuivuus ja ärsytys, sidekalvotulehdus, näön hämärtyminen, glaukooma, kohonnut silmänpaine ja kaihi.
Kasvun suppressiotapauksia on raportoitu intranasaalisilla kortikosteroideilla, mukaan lukien FLONASE [ks. VAROITUKSET JA VAROTOIMET ].
HUUMEIDEN VUOROVAIKUTUKSET
Sytokromi P450 3A4:n estäjät
Flutikasonipropionaatti on CYP3A4:n substraatti. Vahvojen CYP3A4:n estäjien (esim. ritonaviiri, atatsanaviiri, klaritromysiini, indinaviiri, itrakonatsoli, nefatsodoni, nelfinaviiri, sakinaviiri, ketokonatsoli, telitromysiini, konivaptaani, lopinaviiri, nefatsodoni, vorikonatsoli) käyttöä FLONASE-suihkeen kanssa ei suositella, koska nasaalijärjestelmän haittavaikutuksia ei suositella. saattaa esiintyä.
Ritonaviiri
Lääkkeiden yhteisvaikutustutkimus flutikasonipropionaatin vesipitoisella nenäsumutteella terveillä koehenkilöillä on osoittanut, että ritonaviiri (vahva CYP3A4:n estäjä) voi merkittävästi lisätä plasman flutikasonipropionaattialtistusta, mikä johtaa merkittävästi seerumin kortisolipitoisuuksien vähenemiseen [ks. KLIININEN FARMAKOLOGIA ]. Markkinoille tulon jälkeisen käytön aikana on raportoitu kliinisesti merkittäviä yhteisvaikutuksia potilailla, jotka ovat saaneet flutikasonipropionaattivalmisteita, mukaan lukien FLONASE, ritonaviirin kanssa, mikä on johtanut systeemisiin kortikosteroidivaikutuksiin, mukaan lukien Cushingin oireyhtymä ja lisämunuaisten vajaatoiminta.
Ketokonatsoli
Suun kautta inhaloitavan flutikasonipropionaatin (1 000 mikrog) ja ketokonatsolin (200 mg kerran vuorokaudessa) samanaikainen anto johti 1,9-kertaiseen plasman flutikasonipropionaattialtistukseen ja 45 %:n laskuun plasman kortisolin käyrän alla (AUC), mutta sillä ei ollut vaikutusta kortisolin erittymiseen virtsaan.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Paikalliset nenävaikutukset
Nenäverenvuoto
2–26 viikkoa kestäneissä kliinisissä tutkimuksissa nenäverenvuotoa havaittiin useammin FLONASE-nenäsumuteella hoidetuilla potilailla kuin lumelääkettä saaneilla [ks. HAITTAVAIKUTUKSET ].
Nenän haavauma
Markkinoille tulon jälkeen nenän haavaumia on raportoitu potilailla, joita on hoidettu FLONASE-nenäsumutteella [ks. HAITTAVAIKUTUKSET ].
Candida-infektio
Kliinisissä tutkimuksissa, joissa flutikasonipropionaattia annettiin intranasaalisesti, on esiintynyt Candida albicansin aiheuttamia paikallisia infektioita nenään ja nieluun. Kun tällainen infektio kehittyy, se voi vaatia hoitoa sopivalla paikallisella hoidolla ja FLONASE-nenäsumutteen lopettamista. Potilaat, jotka käyttävät FLONASE-nenäsumutetta useiden kuukausien ajan tai pidempään, tulee tutkia säännöllisesti Candida-infektion tai muiden nenän limakalvojen haittavaikutusten merkkien varalta.
Nenän väliseinän perforaatio
Markkinoille tulon jälkeen nenän väliseinän perforaatiotapauksia on raportoitu potilailla, joita on hoidettu FLONASE-nenäsumutteella [ks. HAITTAVAIKUTUKSET ].
Heikentynyt haavan paraneminen
Kortikosteroidien haavan paranemista estävän vaikutuksen vuoksi potilaiden, joilla on äskettäin ollut nenähaavoja, nenäleikkauksia tai nenävammoja, tulee välttää FLONASE-nenäsumutteen käyttöä, kunnes ne ovat parantuneet.
Glaukooma ja kaihi
Intranasaalisten ja inhaloitavien kortikosteroidien käyttö voi johtaa glaukooman ja/tai kaihien kehittymiseen. Siksi tarkka seuranta on aiheellista potilailla, joiden näkö on muuttunut tai joilla on aiemmin ollut kohonnut silmänpaine, glaukooma ja/tai kaihi.
Yliherkkyysreaktiot mukaan lukien anafylaksia
Yliherkkyysreaktioita (esim. anafylaksia, angioödeema, nokkosihottuma, kosketusihottuma ja ihottuma) on raportoitu FLONASE-nenäsumutteen annon jälkeen. Lopeta FLONASE
Nenäsumutetta, jos tällaisia reaktioita esiintyy [katso VASTA-AIHEET ]. Välittömiä yliherkkyysreaktioita saattaa esiintyä harvoin FLONASE-nenäsumutteen annon jälkeen.
Immunosuppressio
Ihmiset, jotka käyttävät immuunijärjestelmää heikentäviä lääkkeitä, ovat alttiimpia infektioille kuin terveet henkilöt. Esimerkiksi vesirokko ja tuhkarokko voivat olla vakavampia tai jopa kuolemaan johtavia kortikosteroideja käyttävillä herkillä lapsilla tai aikuisilla. Tällaisilla lapsilla tai aikuisilla, joilla ei ole ollut näitä sairauksia tai jotka eivät ole asianmukaisesti rokotettuja, tulee olla erityisen varovaisia altistumisen välttämiseksi. Ei tiedetä, miten kortikosteroidien annos, reitti ja annon kesto vaikuttavat levinneen infektion kehittymisriskiin. Perussairauden ja/tai aiemman kortikosteroidihoidon osuutta riskiin ei myöskään tunneta. Jos potilas altistuu vesirokolle, ehkäisy varicella zoster -immunoglobuliinilla (VZIG) voi olla aiheellinen. Jos potilas altistuu tuhkarokolle, ehkäisy yhdistetyn intramuskulaarisen immunoglobuliinin (IG) avulla voi olla aiheellista. (Katso VZIG:n ja IG:n täydelliset reseptitiedot. Jos vesirokko kehittyy, hoitoa viruslääkkeillä voidaan harkita.
Intranasaalisia kortikosteroideja tulee käyttää varoen, jos ollenkaan, potilailla, joilla on aktiivinen tai lepotilassa oleva hengitysteiden tuberkuloosiinfektio. systeemiset sieni-, bakteeri-, virus- tai loisinfektiot; tai silmän herpes simplex.
Hyperkortisismi ja lisämunuaisten vajaatoiminta
Kun intranasaalisia kortikosteroideja käytetään suositeltua suurempina annoksina tai herkille henkilöille suositelluilla annoksilla, systeemisiä kortikosteroidivaikutuksia, kuten hyperkortisismia ja lisämunuaisten vajaatoimintaa, saattaa ilmetä. Jos tällaisia muutoksia tapahtuu, FLONASE-nenäsumutteen annostelu on lopetettava hitaasti suun kautta otetun kortikosteroidihoidon lopettamista koskevien hyväksyttyjen menettelyjen mukaisesti.
Systeemisen kortikosteroidin korvaamiseen paikallisella kortikosteroidilla voi liittyä merkkejä lisämunuaisten vajaatoiminnasta. Lisäksi joillakin potilailla saattaa ilmetä kortikosteroidien vieroitusoireita (esim. nivel- ja/tai lihaskipua, väsymystä, masennusta). Potilaita, joita on aiemmin hoidettu pitkiä aikoja systeemisillä kortikosteroideilla ja jotka on siirretty paikallisiin kortikosteroideihin, on seurattava huolellisesti akuutin lisämunuaisen vajaatoiminnan varalta vasteena stressiin. Potilailla, joilla on astma tai muu kliininen sairaus, joka vaatii pitkäaikaista systeemistä kortikosteroidihoitoa, systeemisten kortikosteroidiannosten nopea pienentäminen voi aiheuttaa vakavan oireiden pahenemisen.
Lääkevuorovaikutukset vahvojen sytokromi P450 3A4 -estäjien kanssa
Voimakkaiden sytokromi P450 3A4:n (CYP3A4) estäjien (esim. ritonaviiri, atatsanaviiri, klaritromysiini, indinaviiri, itrakonatsoli, nefatsodoni, nelfinaviiri, sakinaviiri, ketokonatsoli, telitromysiini, konivaptaani, natsolinaviiri, nefatsodonaviiri) käyttöä ei suositella, koska voratsokonatsoliviiri ei suositella Lisääntyneitä systeemisiä kortikosteroidihaittavaikutuksia voi esiintyä [katso HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
Vaikutus kasvuun
Nenänsisäiset kortikosteroidit voivat hidastaa kasvunopeutta, kun niitä annetaan lapsipotilaille [ks. Käyttö tietyissä populaatioissa ]. Seuraa rutiininomaisesti FLONASE-nenäsumutetta saavien lapsipotilaiden kasvua. Intranasaalisten kortikosteroidien systeemisten vaikutusten minimoimiseksi, mukaan lukien FLONASE-nenäsumute, titraa kunkin potilaan annos pienimpään annokseen, joka hallitsee tehokkaasti hänen oireitaan [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ja käyttöohjeet ).
Paikalliset nenävaikutukset
Kerro potilaille, että hoito FLONASE-nenäsumuteella 50 mikrogrammaa voi aiheuttaa haittavaikutuksia, kuten nenäverenvuotoa ja nenän haavaumia. Candida-infektiota voi esiintyä myös FLONASE-nenäsumutetta käytettäessä. Lisäksi FLONASE nenäsumute 50 mikrogrammaa on yhdistetty nenän väliseinän perforaatioon ja heikentyneeseen haavan paranemiseen. Potilaiden, jotka ovat kokeneet äskettäin nenähaavoja, nenäleikkauksia tai nenävamman, ei tule käyttää FLONASE nenäsumutetta 50 mikrogrammaa ennen kuin parantunut on tapahtunut [ks. VAROITUKSET JA VAROTOIMET ].
Glaukooma ja kaihi
Kerro potilaille, että glaukooma ja kaihi liittyvät nenän ja inhaloitavien kortikosteroidien käyttöön. Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajilleen, jos näönmuutosta havaitaan käytettäessä FLONASE-nenäsumutetta [katso VAROITUKSET JA VAROTOIMET ].
Yliherkkyysreaktiot, mukaan lukien anafylaksia
Kerro potilaille, että yliherkkyysreaktioita, mukaan lukien anafylaksia, angioödeema, nokkosihottuma, kosketusihottuma ja ihottuma, voi ilmetä FLONASE-nenäsumutteen antamisen jälkeen. Jos tällaisia reaktioita ilmenee, potilaiden tulee lopettaa FLONASE-nenäsumutteen käyttö [katso VAROITUKSET JA VAROTOIMET ].
Immunosuppressio
Varoita potilaita, jotka saavat immuunivastetta heikentäviä kortikosteroidiannoksia, välttämään altistumista vesirokolle tai tuhkarokkolle, ja jos he altistuvat, ottamaan yhteyttä terveydenhuollon tarjoajaan viipymättä. Kerro potilaille olemassa olevan tuberkuloosin mahdollisesta pahenemisesta; sieni-, bakteeri-, virus- tai loisinfektiot; tai silmän herpes simplex [katso VAROITUKSET JA VAROTOIMET ].
Alennettu kasvunopeus
Kerro vanhemmille, että FLONASE nenäsumute 50 mikrogrammaa saattaa hidastaa kasvunopeutta, kun sitä annetaan lapsipotilaille. Lääkäreiden tulee seurata tarkasti lasten ja nuorten kasvua, jotka käyttävät kortikosteroideja millä tahansa reitillä [ks. VAROITUKSET JA VAROTOIMET , Käyttö lapsille ].
Käytä päivittäin parhaan vaikutuksen saavuttamiseksi
Kerro potilaille, että heidän tulee käyttää FLONASE 50 mikrogrammaa nenäsumutetta säännöllisesti. FLONASE nenäsumute 50mcg, kuten muutkin kortikosteroidit, ei vaikuta välittömästi nuhan oireisiin. Suurin hyöty ei välttämättä saavu useaan päivään. Potilaiden ei tule suurentaa määrättyä annosta, vaan heidän tulee ottaa yhteyttä terveydenhuollon tarjoajiin, jos oireet eivät parane tai tila pahenee.
Pidä suihke poissa silmistä ja suusta
Kerro potilaille, etteivät he ruiskuttaisi FLONASE-nenäsumutetta silmiinsä ja suuhunsa.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Flutikasonipropionaatti ei osoittanut kasvaimia aiheuttavaa potentiaalia hiirillä 1 000 mikrog/kg suun kautta otetuilla annoksilla (noin 20 kertaa MRHDID aikuisilla ja noin 10 kertaa MRHDID lapsilla mikrogrammaa/m²) 78 viikon ajan eikä rotilla inhalaatioannoksilla suurempina. 57 mcg/kg (noin 2 kertaa MRHDID aikuisilla ja suunnilleen sama kuin MRHDID lapsilla mikrog/m² perusteella) 104 viikon ajan.
Flutikasonipropionaatti ei indusoinut geenimutaatioita prokaryootti- tai eukaryoottisoluissa in vitro. Merkittävää klastogeenistä vaikutusta ei havaittu viljellyissä ihmisen perifeerisissä lymfosyyteissä in vitro eikä hiiren mikrotumatestissä.
Mitään viitteitä hedelmällisyyden heikkenemisestä ei havaittu uros- ja naarasrotilla ihonalaisilla annoksilla 50 mcg/kg asti (noin 2 kertaa suurempi kuin aikuisten MRHDID mikrogrammaa/m²:n perusteella). Eturauhasen paino laski merkittävästi ihonalaisella annoksella 50 mikrogrammaa/kg.
Kliiniset tutkimukset
Monivuotinen ei-allerginen nuha
Kolme satunnaistettua, kaksoissokkoutettua, rinnakkaisten ryhmien, vehikkeleillä, lumekontrolloitua koetta suoritettiin 1 191 koehenkilöllä tutkiakseen FLONASE-nenäsumutteen 50 mikrogrammaa säännöllistä käyttöä potilailla, joilla oli monivuotinen ei-allerginen nuha. Näissä tutkimuksissa arvioitiin koehenkilöiden arvioimat nenäoireiden kokonaispistemäärät (TNSS), jotka sisälsivät nenätukoksen, nenän jälkeisen tippumisen, rinorrean koehenkilöillä, joita hoidettiin 28 päivää kaksoissokkohoitoa ja yhdessä kolmesta tutkimuksesta 6 kuukauden avoimella hoidolla. Kaksi näistä kokeista osoitti, että FLONASE-nenäsumutteella (100 mikrogrammaa kahdesti päivässä) hoidetuilla koehenkilöillä TNSS väheni tilastollisesti merkitsevästi vehikkelillä hoidettuihin henkilöihin verrattuna.
Käyttö tietyissä populaatioissa
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C. FLONASE-nenäsumuteella ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Kortikosteroidien on osoitettu olevan teratogeenisiä koe-eläimissä, kun niitä annetaan systeemisesti suhteellisen pieninä annoksina. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, FLONASE-nenäsumutetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle. Naisia tulee neuvoa ottamaan yhteyttä lääkäriin, jos he tulevat raskaaksi FLONASE-nenäsumutteen käytön aikana.
Hiiret ja rotat flutikasonipropionaattiannoksilla, jotka ovat noin 1 ja 4 kertaa suuremmat kuin aikuisille ihmisille suositeltu suurin vuorokausiannos (MRHDID) (mg/m², kun emon ihonalainen annos on 45 ja 100 mikrog/kg/vrk). osoitti voimakkaille kortikosteroidiyhdisteille ominaista sikiötoksisuutta, mukaan lukien alkion kasvun hidastuminen, omfaloseli, suulakihalkio ja hidastunut kallon luutuminen. Rotilla ei havaittu teratogeenisuutta annoksilla, jotka olivat enintään 3 kertaa MRHDID:tä suuremmilla annoksilla (mg/m² perusteella emon inhalaatioannoksilla 68,7 mcg/kg/vrk asti).
Kaneilla havaittiin sikiön painon laskua ja suulakihalkeamaa flutikasonipropionaattiannoksella, joka oli noin 0,3-kertainen aikuisten MRHDID-annokseen verrattuna (mg/m², kun emon ihonalainen annos oli 4 mikrog/kg/vrk). Teratogeenisia vaikutuksia ei kuitenkaan raportoitu flutikasonipropionaattiannoksilla, jotka olivat noin 20-kertaisia aikuisten MRHDID-annoksiin verrattuna (mg/m²:n perusteella äidin suun kautta annetulla annoksella 300 mikrog/kg/vrk). Flutikasonipropionaattia ei havaittu plasmassa tässä tutkimuksessa, mikä vastaa todettua alhaista hyötyosuutta oraalisen annon jälkeen [ks. KLIININEN FARMAKOLOGIA ].
Flutikasonipropionaatti läpäisi istukan ihonalaisen annon jälkeen hiirille ja rotille ja suun kautta kaneille.
Oraalisista kortikosteroideista saadut kokemukset niiden käyttöönoton jälkeen farmakologisissa annoksissa, toisin kuin fysiologisissa annoksissa, viittaavat siihen, että jyrsijät ovat alttiimpia kortikosteroidien teratogeenisille vaikutuksille kuin ihmiset. Lisäksi, koska kortikosteroidien tuotanto lisääntyy luonnollisesti raskauden aikana, useimmat naiset tarvitsevat pienemmän eksogeenisen kortikosteroidiannoksen ja monet eivät tarvitse kortikosteroidihoitoa raskauden aikana.
Ei-teratogeeniset vaikutukset
Hypoadrenalismia voi esiintyä imeväisillä, joiden äidit ovat saaneet kortikosteroideja raskauden aikana. Tällaisia vauvoja on seurattava huolellisesti.
Imettävät äidit
Ei tiedetä, erittyykö flutikasonipropionaatti äidinmaitoon. Muita kortikosteroideja on kuitenkin havaittu äidinmaidosta. Tritioidun flutikasonipropionaatin ihonalainen antaminen imettäville rotille annoksena, joka oli noin 0,4 kertaa aikuisten MRHDID-annoksena mg/m²:n perusteella, johti mitattavissa olevaan radioaktiivisuuteen maitoon.
Koska kontrolloiduista tutkimuksista ei ole saatavilla tietoja intranasaalisen FLONASE nenäsumutteen 50 mikrogrammaa käytöstä imettäville äideille, varovaisuutta tulee noudattaa, kun FLONASE nenäsumutetta 50 mikrogrammaa annetaan imettäville naisille.
Käyttö lapsille
FLONASE-nenäsumutteen turvallisuus ja tehokkuus 4-vuotiailla ja sitä vanhemmilla lapsilla on osoitettu [ks. HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA ]. Kuusisataaviisikymmentä (650) 4–11-vuotiasta henkilöä ja 440 12–17-vuotiasta henkilöä tutkittiin Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa flutikasonipropionaattinenäsumuteella. FLONASE nenäsumutteen 50 mikrogramman turvallisuutta ja tehokkuutta alle 4-vuotiailla lapsilla ei ole varmistettu.
Vaikutukset kasvuun
Kontrolloidut kliiniset tutkimukset ovat osoittaneet, että intranasaaliset kortikosteroidit voivat hidastaa kasvunopeutta, kun niitä annetaan lapsipotilaille. Tämä vaikutus havaittiin, koska hypotalamus-aivolisäke-lisämunuaisen (HPA) akselin suppressiosta ei saatu laboratoriotodisteita, mikä viittaa siihen, että kasvunopeus on herkempi indikaattori systeemiselle kortikosteroidialtistukselle lapsipotilailla kuin jotkut yleisesti käytetyt HPA-akselin toiminnan testit. Tämän intranasaalisiin kortikosteroideihin liittyvän kasvunopeuden hidastumisen pitkän aikavälin vaikutuksia, mukaan lukien vaikutusta aikuisen lopulliseen pituuteen, ei tunneta. Nenänsisäisten kortikosteroidien hoidon lopettamisen jälkeistä "kiihtymiskasvun" mahdollisuutta ei ole tutkittu riittävästi. Intranasaalista kortikosteroidia, mukaan lukien FLONASE-nenäsumutetta, saavien lapsipotilaiden kasvua tulee seurata rutiininomaisesti (esim. stadiometrisesti). Pitkäaikaisen hoidon mahdollisia kasvuvaikutuksia tulee punnita saavutettuihin kliinisiin hyötyihin ja vaihtoehtoisiin hoitoihin liittyviin riskeihin nähden. Intranasaalisten kortikosteroidien, mukaan lukien FLONASE-nenäsumute, systeemisten vaikutusten minimoimiseksi jokaisen potilaan annos tulee titrata pienimpään annokseen, joka hallitsee tehokkaasti hänen oireitaan.
Yhden vuoden plasebokontrolloitu tutkimus suoritettiin 150:llä lapsipotilaalla (3–9-vuotiaat) arvioimaan FLONASE-nenäsumutteen (200 mikrogramman kerta-annos) vaikutusta kasvunopeuteen. FLONASE-nenäsumutetta (n = 56) ja lumelääkettä (n = 52) saaneesta ensisijaisesta populaatiosta kasvunopeuden pistearvio FLONASE-nenäsumuteella 50 mikrogrammaa oli 0,14 cm/vuosi pienempi kuin lumelääkkeellä (95 % CI: -0,54, 0,27 cm). /vuosi). Siten ei havaittu tilastollisesti merkitsevää vaikutusta kasvuun verrattuna lumelääkkeeseen. Kliinisesti merkittäviä muutoksia HPA-akselin toiminnassa tai luun mineraalitiheydessä ei havaittu mitattuna 12 tunnin kortisolin virtsaan erittymisessä ja kaksoisenergiaröntgenabsorptiometrialla.
Ei voida sulkea pois mahdollisuutta, että FLONASE nenäsumute 50 mikrogrammaa aiheuttaa kasvun suppressiota herkillä potilailla tai suositeltua suurempina annoksina annettuna.
Geriatrinen käyttö
Rajoitettu määrä 65-vuotiaita ja vanhempia (n = 129) tai 75-vuotiaita ja vanhempia (n = 11) on hoidettu FLONASE-nenäsumutteella kliinisissä tutkimuksissa. Vaikka koehenkilöiden määrä on liian pieni tehon ja turvallisuuden erillisen analyysin mahdollistamiseksi, tässä populaatiossa raportoidut haittavaikutukset olivat samanlaisia kuin nuorempien potilaiden raportoimat haittavaikutukset. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
Maksan vajaatoiminta
Virallisia farmakokineettisiä tutkimuksia FLONASE-nenäsumuteella 50 mikrogrammaa ei ole tehty potilailla, joilla on maksan vajaatoiminta. Koska flutikasonipropionaatti eliminoituu pääasiassa maksametaboliassa, maksan toiminnan heikkeneminen voi johtaa flutikasonipropionaatin kertymiseen plasmaan. Siksi potilaita, joilla on maksasairaus, tulee seurata tarkasti.

Munuaisten vajaatoiminta
Virallisia farmakokineettisiä tutkimuksia FLONASE-nenäsumuteella ei ole tehty potilailla, joilla on munuaisten vajaatoiminta.
YLIANNOSTUS
Krooninen yliannostus voi aiheuttaa hyperkortismin merkkejä/oireita (ks VAROTOIMENPITEET ). Flutikasonipropionaatin 2 mg (10 kertaa suositeltu annos) nenänsisäinen antaminen kahdesti vuorokaudessa 7 päivän ajan terveille vapaaehtoisille ihmisille oli hyvin siedetty. Jopa 16 mg:n kerta-annoksia suun kautta on tutkittu vapaaehtoisilla ihmisillä, eikä akuutteja toksisia vaikutuksia ole raportoitu. Toistuvat suun kautta annetut annokset 80 mg:aan asti vuorokaudessa 10 päivän ajan vapaaehtoisilla ja toistuvat suun kautta annetut annokset 10 mg:aan asti vuorokaudessa 14 päivän ajan potilailla olivat hyvin siedettyjä. Haittavaikutukset olivat vaikeusasteeltaan lieviä tai kohtalaisia, ja ilmaantuvuus oli samanlainen aktiivisessa hoitoryhmässä ja lumelääkeryhmässä. Akuutti yliannostus tällä annosmuodolla on epätodennäköistä, koska 1 pullo FLONASE (flutikasonipropionaatti) -nenäsumutetta sisältää noin 8 mg flutikasonipropionaattia.
Suun kautta ja ihon alle annetut keskimääräiset tappavat annokset hiirillä ja rotilla olivat > 1 000 mg/kg (> 20 000 ja > 41 000 kertaa suurin suositeltu päivittäinen intranasaalinen annos aikuisilla ja vastaavasti > 10 000 ja > 20 000 kertaa suurin suositeltu päivittäinen intranasaalinen annos). annos lapsille mg/m2 perusteella).
VASTA-AIHEET
FLONASE (flutikasonipropionaatti) -nenäsumute on vasta-aiheinen potilaille, jotka ovat yliherkkiä jollekin sen aineosalle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Flutikasonipropionaatti on synteettinen trifluorattu kortikosteroidi, jolla on anti-inflammatorinen vaikutus. Flutikasonipropionaatin on osoitettu in vitro osoittavan sitoutumisaffiniteettia ihmisen glukokortikoidireseptoriin, joka on 18-kertainen deksametasoniin verrattuna, lähes kaksinkertainen beklometasonidipropionaatin aktiivisen metaboliitin beklometasoni-17-monopropionaatin (BMP) sitoutumisaffiniteettiin verrattuna ja yli 3 kertaa suurempi kuin deksametasonilla. budesonidista. Tiedot McKenzie-verisuonia supistavista määrityksistä ihmisillä ovat yhdenmukaisia näiden tulosten kanssa. Näiden löydösten kliinistä merkitystä ei tunneta.
Tarkkaa mekanismia, jolla flutikasonipropionaatti vaikuttaa nuhan oireisiin, ei tunneta. Kortikosteroideilla on osoitettu olevan laaja vaikutus useisiin solutyyppeihin (esim. syöttösolut, eosinofiilit, neutrofiilit, makrofagit, lymfosyytit) ja välittäjiin (esim. histamiini, eikosanoidit, leukotrieenit, sytokiinit), jotka osallistuvat tulehdukseen. Seitsemässä aikuisilla tehdyssä tutkimuksessa FLONASE-nenäsumute on vähentänyt nenän limakalvon eosinofiilejä 66 %:lla potilaista (35 % lumelääkkeestä) ja basofiilien määrää 39 %:lla potilaista (28 % lumelääkkeellä). Näiden löydösten suoraa yhteyttä pitkäaikaiseen oireiden lievitykseen ei tunneta.
Farmakodynamiikka
HPA Axis Effect
FLONASE-nenäsumutteen 50 mikrogramman mahdolliset systeemiset vaikutukset HPA-akseliin arvioitiin. FLONASE-nenäsumutetta 50 mikrogrammaa annettuna 200 mikrogrammaa kerran vuorokaudessa tai 400 mikrogrammaa kahdesti vuorokaudessa verrattiin plaseboon tai suun kautta annettavaan prednisoniannokseen 7,5 tai 15 mg aamulla. FLONASE-nenäsumute kummallakaan annoksella 4 viikon ajan ei vaikuttanut lisämunuaisen vasteeseen 6 tunnin kosyntropiinistimulaatioon, kun taas molemmat oraalisen prednisonin annokset vähensivät merkittävästi vastetta kosyntropiinille.
Sydämen elektrofysiologia
Tutkimusta, joka on erityisesti suunniteltu arvioimaan FLONASE:n vaikutusta QT-aikaan, ei ole tehty.
Farmakokinetiikka
FLONASE nenäsumutteen 50 mikrogramman aktiivisuus johtuu emolääkkeestä, flutikasonipropionaatista. Intranasaalisen reitin alhaisesta biologisesta hyötyosuudesta johtuen suurin osa farmakokineettisistä tiedoista saatiin muiden antoreittien kautta.
Imeytyminen
Epäsuorat laskelmat osoittavat, että nenänsisäisesti annettavan flutikasonipropionaatin absoluuttinen hyötyosuus on keskimäärin alle 2 %. Kokeet, joissa käytettiin leimatun ja leimaamattoman lääkkeen oraalista annostelua, ovat osoittaneet, että flutikasonipropionaatin oraalinen systeeminen hyötyosuus on mitätön (
Jakelu
Laskimonsisäisen annon jälkeen flutikasonipropionaatin alkuvaihe oli nopea ja yhdenmukainen sen korkean rasvaliukoisuuden ja kudossitoutumisen kanssa. Jakautumistilavuus oli keskimäärin 4,2 l/kg.
Ihmisen plasman proteiineihin sitoutuneen flutikasonipropionaatin prosenttiosuus oli keskimäärin 99 %. Flutikasonipropionaatti sitoutuu heikosti ja palautuvasti erytrosyytteihin, eikä se sitoutu merkittävästi ihmisen transkortiiniin.
Eliminointi
Laskimonsisäisen annostelun jälkeen flutikasonipropionaatilla oli polyeksponentiaalinen kinetiikka, ja sen terminaalinen eliminaation puoliintumisaika oli noin 7,8 tuntia. Flutikasonipropionaatin veren kokonaispuhdistuma on korkea (keskiarvo: 1 093 ml/min), ja munuaispuhdistuma on alle 0,02 % kokonaispuhdistumasta.
Aineenvaihdunta: Ainoa ihmisellä havaittu verenkierrossa oleva metaboliitti on flutikasonipropionaatin 17β-karboksyylihappojohdannainen, joka muodostuu CYP3A4-reitin kautta. Tällä metaboliitilla oli pienempi affiniteetti (noin 1/2 000) kuin emolääkkeellä ihmisen keuhkojen sytosolin glukokortikoidireseptoriin in vitro ja merkityksetön farmakologinen aktiivisuus eläinkokeissa. Muita metaboliitteja, jotka on havaittu in vitro viljellyillä ihmisen hepatoomasoluilla, ei ole havaittu ihmisellä.
Erittyminen: Alle 5 % radioaktiivisesti merkitystä oraalisesta annoksesta erittyi virtsaan metaboliitteina ja loput ulosteisiin lähtöaineena ja metaboliitteina.
Erikoispopulaatiot
Flutikasonipropionaatti-nenäsumutetta ei ole tutkittu missään erityisryhmässä, eikä sukupuolispesifisiä farmakokineettisiä tietoja ole saatu.
Huumeiden vuorovaikutukset
Sytokromi P450 3A4:n estäjät: Ritonaviiri: Flutikasonipropionaatti on CYP3A4:n substraatti. Flutikasonipropionaatin ja vahvan CYP3A4:n estäjän, ritonaviirin, samanaikaista käyttöä ei suositella 18 terveellä koehenkilöllä tehdyn usean annoksen ja yhteisvaikutustutkimuksen perusteella. Flutikasonipropionaatin vesipitoista nenäsumutetta (200 mikrogrammaa kerran päivässä) annettiin 7 päivän ajan ritonaviirin (100 mg kahdesti vuorokaudessa) kanssa. Plasman flutikasonipropionaattipitoisuudet pelkän vesipitoisen flutikasonipropionaatin nenäsumutteen jälkeen eivät olleet havaittavissa (
Ketokonatsoli: Suun kautta inhaloitavan flutikasonipropionaatin (1 000 mikrogrammaa) ja ketokonatsolin (200 mg kerran vuorokaudessa) samanaikainen anto johti 1,9-kertaiseen plasman flutikasonipropionaattialtistukseen ja 45 %:n laskuun plasman kortisolin AUC:ssa, mutta sillä ei ollut vaikutusta kortisolin erittymiseen virtsaan.
Erytromysiini: Useiden lääkkeiden yhteisvaikutustutkimuksessa suun kautta inhaloitavan flutikasonipropionaatin (500 mikrogrammaa kahdesti vuorokaudessa) ja erytromysiinin (333 mg 3 kertaa vuorokaudessa) samanaikainen anto ei vaikuttanut flutikasonipropionaatin farmakokinetiikkaan.
POTILASTIEDOT
FLONASE® [flow'naz] (flutikasonipropionaatti) nenäsumute, 50 mcg
Lue FLONASE-nenäsumutteen mukana tulevat potilastiedot ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä potilastiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on FLONASE-nenäsumute?
FLONASE Nenäsumute 50 mcg on reseptilääke, jota käytetään ei-allergisten nenäoireiden, kuten vuotavan nenän, tukkoisen nenän, aivastelua ja nenän kutinaa, hoitoon aikuisilla ja yli 4-vuotiailla lapsilla.
Ei tiedetä, onko FLONASE nenäsumute 50 mcg turvallinen ja tehokas alle 4-vuotiaille lapsille.
Kuka ei saa käyttää FLONASE nenäsumutetta 50mcg?
Älä käytä FLONASE-nenäsumutetta 50 mikrogrammaa, jos olet allerginen flutikasonipropionaatille tai jollekin FLONASE-nenäsuihkeen aineosalle. Katso "Mitkä ovat FLONASE nenäsumutteen 50mcg aineosat?" alla täydellinen luettelo ainesosista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen FLONASE nenäsumutteen 50 mcg käyttöä?
Kerro terveydenhuollon tarjoajallesi kaikista terveydentilastasi, mukaan lukien jos:
- sinulla on tai on ollut nenähaavoja, nenäleikkauksia tai nenävammoja.
- sinulla on silmäongelmia, kuten kaihi tai glaukooma.
- sinulla on immuunijärjestelmäongelma.
- olet allerginen jollekin FLONASE-nenäsumutteen aineosalle, muille lääkkeille tai elintarvikkeille. Katso "Mitä FLONASE-nenäsumutteen ainesosat ovat?" alla täydellinen luettelo ainesosista.
- sinulla on minkä tahansa virus-, bakteeri- tai sieni-infektio.
- ovat altistuneet vesirokolle tai tuhkarokkolle.
- sinulla on muita sairauksia.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, voiko FLONASE-nenäsumute vahingoittaa sikiötäsi.
- imetät tai aiot imettää. Ei tiedetä, erittyykö FLONASE nenäsumute 50 mikrogrammaa rintamaitoon ja voiko se vahingoittaa vauvaasi.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. FLONASE-nenäsumute ja tietyt muut lääkkeet voivat olla vuorovaikutuksessa keskenään. Tämä voi aiheuttaa vakavia sivuvaikutuksia. Kerro terveydenhuollon tarjoajallesi erityisesti, jos käytät sieni- tai HIV-lääkkeitä.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Kuinka minun pitäisi käyttää FLONASE-nenäsumutetta?
Lue vaiheittaiset ohjeet FLONASE-nenäsumutteen käytöstä tämän potilastietojen lopussa.
- FLONASE-nenäsumute on tarkoitettu käytettäväksi vain nenässäsi. Älä suihkuta sitä silmiin tai suuhusi.
- Lasten tulee käyttää FLONASE-nenäsumutetta aikuisen avustuksella lapsen terveydenhuollon tarjoajan ohjeiden mukaisesti.
- Käytä FLONASE nenäsumutetta 50 mcg juuri niin kuin terveydenhuollon tarjoajasi on neuvonut. Älä käytä FLONASE-nenäsumutetta useammin kuin on määrätty.
- FLONASE-nenäsumutteen säännöllinen käyttö voi kestää useita päiviä, ennen kuin nuha-oireesi paranevat. Jos oireesi eivät parane tai pahenevat, soita terveydenhuollon tarjoajalle.
- Saat parhaat tulokset, jos käytät FLONASE-nenäsumutetta säännöllisesti joka päivä ilman, että annosta jää väliin. Kun alat tuntea olosi paremmaksi, terveydenhuollon tarjoaja voi pienentää annostasi. Älä lopeta FLONASE nenäsumutteen 50 mcg käyttö, ellei terveydenhuollon tarjoaja kehota sinua tekemään niin.
Mitkä ovat FLONASE nenäsumutteen 50mcg mahdolliset sivuvaikutukset?
FLONASE nenäsumute 50mcg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nenäongelmia. Nenäongelmia voivat olla:
- nenästä vuotaa verta.
- haavaumia (haavoja) nenässäsi.
- tietty sieni-infektio nenässä, suussa ja/tai kurkussa (sammas).
- reikä nenän rustossa (nenän väliseinän perforaatio). Nenän väliseinän perforaation oireita voivat olla:
- kuoriutuminen nenässä
- nenästä vuotaa verta
- vuotava nenä
- viheltävä ääni kun hengität
- hidas haavan paraneminen. Älä käytä FLONASE-nenäsumutetta ennen kuin nenäsi on parantunut, jos nenässäsi on haavauma, nenäsi on leikattu tai jos nenäsi on vaurioitunut.
- silmäongelmat mukaan lukien glaukooma ja kaihi. Sinun tulee käydä säännöllisesti silmätutkimuksissa, kun käytät FLONASE-nenäsumutetta.
- vakavia allergisia reaktioita. Soita terveydenhuollon tarjoajallesi tai hakeudu ensiapuun, jos saat jonkin seuraavista vakavan allergisen reaktion oireista:
- ihottuma
- nokkosihottuma
- kasvojen, suun ja kielen turvotus
- hengitysongelmia
- heikentynyt immuunijärjestelmä ja lisääntynyt mahdollisuus saada infektioita (immunosuppressio). Immuunijärjestelmääsi heikentävien lääkkeiden käyttö lisää todennäköisyyttä saada infektioita ja voi pahentaa tiettyjä infektioita. Näitä infektioita voivat olla tuberkuloosi (TB), silmän herpes simplex -infektiot ja sienten, bakteerien, virusten ja loisten aiheuttamat infektiot. Vältä kosketusta ihmisten kanssa, joilla on tarttuva sairaus, kuten vesirokko tai tuhkarokko, kun käytät FLONASE-nenäsumutetta. Jos joudut kosketuksiin vesirokkoa tai tuhkarokkoa sairastavan kanssa, soita välittömästi terveydenhuollon tarjoajallesi. Infektion oireita voivat olla:
- kuume
- väsynyt olo
- kipu
- pahoinvointi
- kipuja
- oksentelua
- vilunväristykset
- alentuneet steroidihormonitasot (lisämunuaisen vajaatoiminta). Lisämunuaisten vajaatoiminta tapahtuu, kun lisämunuaiset eivät tuota tarpeeksi steroidihormoneja. Tämä voi tapahtua, kun lopetat suun kautta otettavien kortikosteroidilääkkeiden (kuten prednisonin) käytön ja aloitat inhaloitavaa steroidia sisältävän lääkkeen (kuten FLONASE-nenäsumute) käytön. Lisämunuaisen vajaatoiminnan oireita voivat olla:
- väsynyt olo
- energian puute
- heikkous
- pahoinvointia ja oksentelua
- alhainen verenpaine
- lasten kasvun hidastuminen. Lapsen kasvua tulee tarkkailla usein.
FLONASE nenäsumutteen 50mcg yleisimmät sivuvaikutukset ovat:
- päänsärky
- pahoinvointia ja oksentelua
- kipeä kurkku
- vaikeuksia hengittää
- nenästä vuotaa verta
- yskä
- nenän polttaminen tai kutina
Kerro terveydenhuollon tarjoajallesi kaikista sivuvaikutuksista, jotka häiritsevät sinua tai eivät mene pois.
Nämä eivät ole kaikki FLONASE-nenäsumutteen sivuvaikutuksia. Kysy lisätietoja terveydenhuollon tarjoajaltasi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka säilytän FLONASE nenäsumutetta 50mcg?
- Säilytä FLONASEa 4 °C - 30 °C:ssa (39–86 °F).
Pidä FLONASE nenäsumute 50mcg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa FLONASE-nenäsumutteen turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus tarkoituksiin, joita ei ole mainittu potilastiedotteessa. Älä käytä FLONASE-nenäsumutetta sairauteen, johon sitä ei ole määrätty. Älä anna FLONASE-nenäsumutetta muille ihmisille, vaikka heillä olisi sama sairaus kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen sisältää yhteenvedon tärkeimmistä tiedoista FLONASE-nenäsumutteesta. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja FLONASE-nenäsumutteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja FLONASE-nenäsumutteesta saat soittamalla numeroon 1-888-825-5249.
Mitkä ovat FLONASE nenäsumutteen 50mcg ainesosat?
Vaikuttava aine: flutikasonipropionaatti.
Inaktiiviset aineet: mikrokiteinen selluloosa, karboksimetyyliselluloosanatrium, dekstroosi, 0,02 % w/w bentsalkoniumkloridia, polysorbaatti 80 ja 0,25 % w/w fenyylietyylialkoholi.
Käyttöohjeet
FLONASE® [flow'naz] (flutikasonipropionaatti) nenäsumute, 50 mcg
FLONASE nenäsumute 50 mcg on tarkoitettu käytettäväksi vain nenässäsi.
Lue nämä tiedot ennen kuin alat käyttää FLONASE-nenäsumutetta.
Osia FLONASE-nenäsumuttimestasi (Katso kuva A)
Kuva A 
FLONASE-nenäsumute 50 mcg on pohjustettava ennen kuin käytät sitä ensimmäistä kertaa ja kun et ole käyttänyt sitä viikkoon tai pidempään.
FLONASE-nenäsuihkeen pohjustus
- Ravista pulloa varovasti ja poista sitten pölysuojus (katso kuva B).
Kuva B 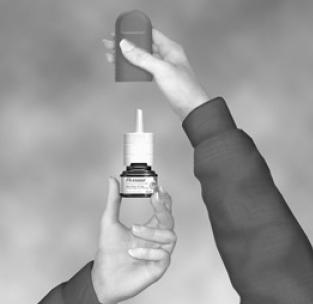
- Pidä pulloa kuvan osoittamalla tavalla (katso kuva C) niin, että nenäapplikaattori osoittaa sinusta poispäin ja etusormi ja keskisormi ovat nenäapplikaattorin kummallakin puolella ja peukalo pullon alla.
- Paina alas ja vapauta 6 kertaa, kunnes hienojakoinen suihke ilmestyy (katso kuva C). Pumppu on nyt käyttövalmis.
Kuva C 
FLONASE-nenäsumutteen käyttäminen:
Vaihe 1 . Puhalla nenääsi puhdistaaksesi sieraimet.
Vaihe 2 . Sulje 1 sieraimesi. Kallista päätäsi hieman eteenpäin ja pidä pullo pystyasennossa ja aseta nenäapplikaattori varovasti toiseen sieraimeen (katso kuva D).
Kuva D 
Vaihe 3 Aloita hengittäminen nenäsi kautta ja paina sisään hengittäessäsi tiukasti ja nopeasti 1 kerran applikaattoria vapauttaaksesi suihkeen. Saat täyden annoksen ruiskuttamalla etusormella ja keskisormella samalla kun tuet pullon pohjaa peukalolla. Vältä roiskumista silmiin. Hengitä kevyesti sisään sieraimen kautta (katso kuva E).
Kuva E 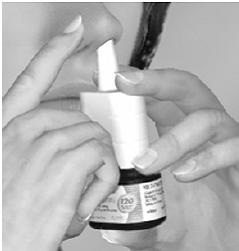
Vaihe 4 . Hengitä ulos suun kautta.
Vaihe 5 . Jos tarvitaan toinen suihke tähän sieraimeen, toista vaiheet 2–4.
Vaihe 6 . Toista vaiheet 2–5 toisessa sieraimessa.
Vaihe 7 . Pyyhi nenäapplikaattori puhtaalla liinalla ja aseta pölysuojus takaisin paikalleen (katso kuva F).
Kuva F 
Älä käytä tätä pulloa enempää kuin merkitty määrä suihkeita, vaikka pullo ei ole täysin tyhjä. Ennen kuin heität pullon pois, keskustele terveydenhuollon tarjoajan kanssa, onko täyttötarpeet. Älä ota ylimääräisiä annoksia tai lopeta FLONASE nenäsumutteen 50 mikrogrammaa ottamista keskustelematta terveydenhuollon tarjoajan kanssa.
FLONASE-nenäsuihkeen puhdistaminen:
Nenäsumute tulee puhdistaa vähintään kerran viikossa.
1. Irrota pölysuojus ja vedä sitten varovasti ylöspäin nenäapplikaattorin vapauttamiseksi.
2. Pese asetin ja pölysuoja lämpimän vesijohtoveden alla. Anna kuivua huoneenlämmössä.
3. Aseta applikaattori ja pölysuojus takaisin pulloon.
4. Jos nenäapplikaattori tukkeutuu, se voidaan poistaa ja antaa liota lämpimään veteen. Huuhtele nenäapplikaattori kylmällä vesijohtovedellä. Kuivaa nenäapplikaattori ja aseta se takaisin pulloon. Älä yritä avata nenäapplikaattoria työntämällä neulaa tai muuta terävää esinettä.
FLONASE-nenäsumutteen säilyttäminen:
- Säilytä FLONASE-nenäsumutetta 50 mikrogrammaa 4-30 °C:ssa (39 °F - 86 °F).
- Älä käytä FLONASE-nenäsumutetta etikettiin tai pakkaukseen merkityn päivämäärän "EXP" jälkeen.
