Clarinex 5mg Desloratadine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
CLARINEX® (desloratadiini) Tabletit
KUVAUS
CLARINEX (desloratadiini) -tabletit ovat vaaleansinisiä, pyöreitä, kalvopäällysteisiä tabletteja, jotka sisältävät 5 mg desloratadiinia, antihistamiinia, joka annetaan suun kautta. CLARINEX 5mg -tabletit sisältävät myös seuraavia apuaineita: kaksiemäksinen kalsiumfosfaattidihydraatti USP, mikrokiteinen selluloosa NF, maissitärkkelys NF, talkki USP, karnaubavaha NF, valkoinen vaha NF, laktoosimonohydraatista koostuva päällystysmateriaali, hypromelloosidioksidi, ti, polyglyetti ja glykoli FD&C Blue #2 Aluminium Lake.
CLARINEX Oral Solution on kirkas oranssi neste, joka sisältää 0,5 mg/1 ml desloratadiinia. Oraaliliuos sisältää seuraavat inaktiiviset aineosat: propyleeniglykoli USP, sorbitoliliuos USP, sitruunahappo (vedetön) USP, natriumsitraattidihydraatti USP, natriumbentsoaatti NF, dinatriumedetaatti USP, puhdistettu vesi USP. Se sisältää myös kidesokeria, luonnollista ja keinotekoista aromia purukumiin ja FDC Yellow #6 -väriainetta.
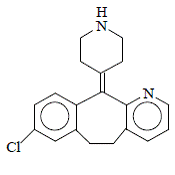
Desloratadiini on valkoinen tai luonnonvalkoinen jauhe, joka liukenee heikosti veteen, mutta liukenee hyvin etanoliin ja propyleeniglykoliin. Sillä on empiirinen kaava: C19H19ClN2 ja molekyylipaino 310,8. Kemiallinen nimi on 8-kloori-6,11-dihydro-11-(4-piperdinylideeni)-5H-bentso[5,6]syklohepta[1,2-b]pyridiini ja sillä on seuraava rakenne:
INDIKAATIOT
Kausiluonteinen allerginen nuha
CLARINEX® on tarkoitettu kausiluonteisen allergisen nuhan nasaalisten ja ei-nasaalisten oireiden lievittämiseen yli 2-vuotiailla potilailla.
Monivuotinen allerginen nuha
CLARINEX on tarkoitettu ympärivuotisen allergisen nuhan nasaalisten ja ei-nasaalisten oireiden lievittämiseen 6 kuukauden ikäisillä ja sitä vanhemmilla potilailla.
Krooninen idiopaattinen urtikaria
CLARINEX 5mg on tarkoitettu kutinan oireenmukaiseen lievitykseen, nokkosihottumakohtausten määrän ja nokkosihottumatilan vähentämiseen 6 kuukauden ikäisille ja sitä vanhemmille potilaille, joilla on krooninen idiopaattinen urtikaria.
ANNOSTELU JA HALLINNOINTI
Vaikka desloratadiinin suussa hajoava tablettiformulaatio saattaa olla saatavilla markkinoilla, CLARINEX® RediTabs® -tabletteja ei enää markkinoida.
CLARINEX 5 mg -tabletit, oraaliliuos tai RediTabs-tabletit voidaan ottaa ruokailusta riippumatta. Aseta CLARINEX (desloratadiini) RediTabs -tabletit kielelle ja anna hajota ennen nielemistä. Tabletin hajoaminen tapahtuu nopeasti. Annostele veden kanssa tai ilman. Ota tabletti heti läpipainopakkauksen avaamisen jälkeen.
Ikälle sopiva annos CLARINEX-oraaliliuosta tulee antaa kaupallisesti saatavalla mittatiputtimella tai -ruiskulla, joka on kalibroitu antamaan 2 ml ja 2,5 ml (½ tl).
Aikuiset ja 12-vuotiaat ja sitä vanhemmat nuoret
CLARINEX- tai CLARINEX RediTabs-tablettien suositeltu annos on yksi 5 mg:n tabletti kerran vuorokaudessa. Suositeltu annos CLARINEX-oraaliliuosta on 2 teelusikallista (5 mg 10 ml:ssa) kerran päivässä.
Lapset 6-11 vuotta
Suositeltu annos CLARINEX-oraaliliuosta on 1 teelusikallinen (2,5 mg 5 ml:ssa) kerran päivässä. CLARINEX RediTabs -tablettien suositeltu annos on yksi 2,5 mg:n tabletti kerran vuorokaudessa.
Lapset 12 kk - 5 vuoden ikäiset
Suositeltu annos CLARINEX 5 mg oraaliliuosta on ½ teelusikallista (1,25 mg 2,5 ml:ssa) kerran päivässä.
6-11 kuukauden ikäiset lapset
Suositeltu annos CLARINEX-oraaliliuosta on 2 ml (1 mg) kerran vuorokaudessa.
Aikuiset, joilla on maksan tai munuaisten vajaatoiminta
Aikuisille potilaille, joilla on maksan tai munuaisten vajaatoiminta, suositellaan aloitusannosta yhtä 5 mg:n tablettia joka toinen päivä farmakokineettisten tietojen perusteella. Annostussuositusta lapsille, joilla on maksan tai munuaisten vajaatoiminta, ei voida antaa tiedon puutteen vuoksi [katso KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
CLARINEX-tabletit ovat vaaleansinisiä, kalvopäällysteisiä tabletteja, joissa on merkintä ”C5”, ja jotka sisältävät 5 mg desloratadiinia. CLARINEX Oral Solution on kirkas oranssi neste, joka sisältää 0,5 mg desloratadiinia/1 ml.
Varastointi ja käsittely
CLARINEX 5 mg tabletit: Kohokuvioidut "C5", vaaleansiniset, kalvopäällysteiset tabletit, jotka on pakattu 100 kpl polyeteenimuovipulloihin NDC 0085-1264-01).
CLARINEX 5 mg oraaliliuos: Kirkas oranssinvärinen neste, joka sisältää 0,5 mg/1 ml desloratadiinia 16 unssin meripihkanvärisessä lasipullossa ( NDC 0085-1334-01) ja 4 unssin meripihkan lasipullo ( NDC 0085-1334-02).
Varastointi
CLARINEX-tabletit: Suojaa käyttöyksikköpakkauksia ja yksikköannossairaalapakkauksia liialliselta kosteudelta. Säilytä 25°C (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ]. Lämpöherkkä. Vältä altistumista 30°C:n (86°F) tai sitä korkeammalle lämpötilalle.
CLARINEX oraaliliuos: Säilytä 25°C (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ]. Suojaa valolta.
Valmistettu: Merck Sharp & Dohme Corp., MERCK & CO., INC.:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: maaliskuu 2019
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin etiketin muissa osissa:
- Yliherkkyysreaktiot. [Katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Aikuiset Ja Nuoret
Allerginen nuha
Useita annoksia saaneissa lumekontrolloiduissa tutkimuksissa 2834 vähintään 12-vuotiasta potilasta sai CLARINEX-tabletteja 2,5–20 mg päivässä, joista 1655 potilasta sai suositellun vuorokausiannoksen 5 mg. Potilailla, jotka saivat 5 mg vuorokaudessa, haittatapahtumien määrä oli samanlainen CLARINEX 5 mg:n ja lumelääkettä saaneiden potilaiden välillä. Haittavaikutusten vuoksi ennenaikaisesti lopettaneiden potilaiden prosenttiosuus oli 2,4 % CLARINEX 5 mg:n ryhmässä ja 2,6 % lumelääkeryhmässä. Näissä tutkimuksissa ei havaittu vakavia haittavaikutuksia potilailla, jotka saivat desloratadiinia. Kaikki haittatapahtumat, joita ilmoitti vähintään 2 % potilaista, jotka saivat suositeltua vuorokausiannosta CLARINEX 5 mg -tabletteja (5 mg kerran vuorokaudessa), ja jotka olivat yleisempiä CLARINEX-tablettien kuin lumelääkehoidon yhteydessä, on lueteltu taulukossa 1.
Laboratorio- ja elektrokardiografisten poikkeavuuksien esiintymistiheys ja suuruus olivat samanlaiset CLARINEX- ja lumelääkettä saaneilla potilailla.
Sukupuolen, iän tai rodun mukaan määritellyissä potilasalaryhmissä ei havaittu eroja haittatapahtumissa.
Krooninen idiopaattinen urtikaria
Kroonisen idiopaattisen nokkosihottuman toistuvia annoksia koskevissa lumekontrolloiduissa tutkimuksissa 211 vähintään 12-vuotiasta potilasta sai CLARINEX 5 mg -tabletteja ja 205 lumelääkettä. Haittatapahtumat, joita raportoi yli tai yhtä suuri kuin 2 % CLARINEX 5 mg tabletteja saaneista potilaista ja jotka olivat yleisempiä CLARINEX 5 mg:n kuin lumelääkehoidon yhteydessä, olivat (Clarinex 5 mg ja lumelääkettä vastaavasti): päänsärky (14 %, 13 %). , pahoinvointi (5%, 2%), väsymys (5%, 1%), huimaus (4%, 3%), nielutulehdus (3%, 2%), dyspepsia (3%, 1%) ja lihassärky (3) %, 1 %).
Pediatria
Kolmessa lumekontrolloidussa kliinisessä tutkimuksessa kaksisataaneljäkymmentäkuusi 6 kuukauden–11-vuotiaista lapsipotilasta sai CLARINEX-oraaliliuosta 15 päivän ajan. 6-11-vuotiaat lapsipotilaat saivat 2,5 mg kerran päivässä, 1-5-vuotiaat 1,25 mg kerran vuorokaudessa ja 6-11 kuukauden ikäiset 1,0 mg kerran päivässä.
6–11-vuotiailla koehenkilöistä 2 prosenttia tai enemmän ei raportoinut yksittäisiä haittavaikutuksia.
2–5-vuotiailla koehenkilöillä CLARINEXin ja lumelääkkeen käytön yhteydessä raportoituja haittavaikutuksia vähintään 2 prosentilla potilaista, jotka saivat CLARINEX 5 mg oraaliliuosta ja yleisemmin kuin lumelääkettä, olivat kuume (5,5 %, 5,4 %), virtsatietulehdus (3,6 %, 0 %) ja vesirokko (3,6 %, 0 %).
12 kuukauden - 23 kuukauden ikäisillä koehenkilöillä CLARINEX 5 mg -valmisteen ja lumelääkkeen käytön yhteydessä raportoituja haittavaikutuksia vähintään 2 prosentilla CLARINEX-oraaliliuosta saaneista potilaista, joiden esiintymistiheys oli suurempi kuin lumelääkettä, olivat kuume (16,9 %, 12,9 %), ripuli ( 15,4 %, 11,3 %), ylähengitystieinfektiot (10,8 %, 9,7 %), yskä (10,8 %, 6,5 %), ruokahalun lisääntyminen (3,1 %, 1,6 %), emotionaalinen labilisuus (3,1 %, 0 %), nenäverenvuoto ( 3,1 %, 0 %), loisinfektio (3,1 %, 0 %), nielutulehdus (3,1 %, 0 %), makulopapulaarinen ihottuma (3,1 %, 0 %).
kuukauden - 11 kuukauden ikäisillä koehenkilöillä CLARINEX 5 mg:n ja lumelääkkeen yhteydessä vähintään 2 prosentilla CLARINEX 5 mg oraaliliuosta saaneista potilaista raportoitiin ylempien hengitysteiden infektioita (21,2 %, 12,9 %) useammin kuin lumelääkettä. ripuli (19,7%, 8,1%), kuume (12,1%, 1,6%), ärtyneisyys (12,1%, 11,3%), yskä (10,6%, 9,7%), uneliaisuus (9,1%, 8,1%), keuhkoputkentulehdus (6,1%) 0 %), välikorvatulehdus (6,1 %, 1,6 %), oksentelu (6,1 %, 3,2 %), anoreksia (4,5 %, 1,6 %), nielutulehdus (4,5 %, 1,6 %), unettomuus (4,5 %, 0 %), rinorrea (4,5 %, 3,2 %), punoitus (3,0 %, 1,6 %) ja pahoinvointi (3,0 %, 0 %).
Missään EKG-parametrissa, mukaan lukien QTc-aika, ei havaittu kliinisesti merkittäviä muutoksia. Vain yksi 246:sta lapsipotilaista, jotka saivat CLARINEX 5 mg oraaliliuosta kliinisissä tutkimuksissa, keskeytti hoidon haittatapahtuman vuoksi.
Markkinoinnin jälkeinen kokemus
Koska haittatapahtumat raportoidaan vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Seuraavia spontaaneja haittavaikutuksia on raportoitu desloratadiinin markkinoinnin aikana:
Sydämen häiriöt: takykardia, sydämentykytys
Hengityselimet, rintakehä ja välikarsina: hengenahdistus
Ihon ja ihonalaisen kudoksen häiriöt: ihottuma, kutina
Hermoston häiriöt: psykomotorinen yliaktiivisuus, liikehäiriöt (mukaan lukien dystonia, tics ja ekstrapyramidaaliset oireet), kohtaukset (raportoitu potilailla, joilla on tai ei ole tunnettua kohtaushäiriötä)
Immuunijärjestelmän häiriöt: yliherkkyysreaktiot (kuten urtikaria, turvotus ja anafylaksia)
Tutkimukset: kohonneet maksaentsyymiarvot, mukaan lukien bilirubiini
Maksa-sappihäiriöt: hepatiitti
Aineenvaihdunta- ja ravitsemushäiriöt: lisääntynyt ruokahalu
HUUMEIDEN VUOROVAIKUTUKSET
Sytokromi P450 3A4:n estäjät
Kontrolloiduissa kliinisissä tutkimuksissa desloratadiinin samanaikainen anto ketokonatsolin, erytromysiinin tai atsitromysiinin kanssa johti plasman desloratadiinin ja hydroksidesloratadiinin pitoisuuksien nousuun, mutta desloratadiinin turvallisuusprofiilissa ei havaittu kliinisesti merkittäviä muutoksia. [Katso KLIININEN FARMAKOLOGIA ]
Fluoksetiini
Kontrolloiduissa kliinisissä tutkimuksissa desloratadiinin samanaikainen anto fluoksetiinin, selektiivisen serotoniinin takaisinoton estäjän (SSRI) kanssa johti plasman desloratadiinin ja 3 hydroksidesloratadiinin pitoisuuksien nousuun, mutta desloratadiinin turvallisuusprofiilissa ei havaittu kliinisesti merkittäviä muutoksia. [Katso KLIININEN FARMAKOLOGIA ]
Simetidiini
Kontrolloiduissa kliinisissä tutkimuksissa desloratadiinin ja simetidiinin, histamiini H2-reseptorin salpaajan, samanaikainen käyttö johti plasman desloratadiinin ja 3-hydroksidesloratadiinin pitoisuuksien nousuun, mutta desloratadiinin turvallisuusprofiilissa ei havaittu kliinisesti merkittäviä muutoksia. [Katso KLIININEN FARMAKOLOGIA ]
Huumeiden väärinkäyttö ja riippuvuus
Ei ole tietoa siitä, että CLARINEX-tablettien yhteydessä esiintyisi väärinkäyttöä tai riippuvuutta.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Yliherkkyysreaktiot
Desloratadiinin annon jälkeen on raportoitu yliherkkyysreaktioita, kuten ihottumaa, kutinaa, urtikariaa, turvotusta, hengenahdistusta ja anafylaksiaa. Jos tällainen reaktio ilmenee, CLARINEX 5 mg -hoito on lopetettava ja vaihtoehtoista hoitoa harkittava. [Katso HAITTAVAIKUTUKSET ]
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Tietoja potilaille
- Potilaita tulee neuvoa käyttämään CLARINEX 5 mg:aa ohjeiden mukaisesti.
- Koska ruoka ei vaikuta biologiseen hyötyosuuteen, potilaita voidaan neuvoa, että CLARINEX 5 mg -tabletit, oraaliliuos tai RediTabs-tabletit voidaan ottaa aterioista riippumatta.
- Potilaita tulee neuvoa olemaan suurentamatta annosta tai antotiheyttä, koska tutkimukset eivät ole osoittaneet tehon lisääntymistä suuremmilla annoksilla ja uneliaisuutta voi esiintyä.
- Fenyyliketonuurit: CLARINEX RediTabs -tabletit sisältävät fenyylialaniinia.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeenisuustutkimukset
Desloratadiinin karsinogeenisuus arvioitiin loratadiinitutkimuksella rotilla ja desloratadiinitutkimuksella hiirillä. Rotilla tehdyssä 2-vuotisessa tutkimuksessa loratadiinia annettiin ruokavalion yhteydessä annoksina 25 mg/kg/vrk (desloratadiinin ja desloratadiinimetaboliitin arvioidut altistukset olivat noin 30 kertaa suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella). Merkittävästi suurempi maksasolukasvainten (yhdistettyjen adenoomien ja karsinoomien) ilmaantuvuus havaittiin miehillä, joille annettiin 10 mg/kg/vrk loratadiinia ja miehillä ja naisilla, joille annettiin 25 mg/kg/vrk loratadiinia. Arvioidut desloratadiini- ja desloratadiinimetaboliitialtistukset rotilla, joille annettiin 10 mg/kg loratadiinia, olivat noin 7 kertaa suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella. Näiden löydösten kliinistä merkitystä desloratadiinin pitkäaikaisen käytön aikana ei tunneta.
Kaksivuotisessa ravitsemustutkimuksessa hiirillä, uroksilla ja naarailla, joille annettiin enintään 16 mg/kg/vrk ja 32 mg/kg/vrk desloratadiinia, ei havaittu merkitsevää lisääntymistä minkään kasvainten ilmaantumisessa. Arvioidut desloratadiini- ja desloratadiinimetaboliitialtistukset hiirillä näillä annoksilla olivat 12-kertaiset ja 27-kertaiset ihmisen AUC-arvoon suositellulla vuorokausiannoksella suun kautta.
Genotoksisuustutkimukset
Desloratadiinilla tehdyissä genotoksisuustutkimuksissa ei havaittu genotoksisuuspotentiaalia käänteismutaatiomäärityksessä (Salmonella/E. colin nisäkkäiden mikrosomibakteerien mutageenisuusmääritys) tai kahdessa kromosomipoikkeavuuksien määrityksessä (ihmisen perifeerisen veren lymfosyyttien klastogeenisuusmääritys ja hiiren luuytimen mikrotumamääritys). ).
Hedelmällisyyden heikkeneminen
Rotilla ei ollut vaikutusta naarasrottien hedelmällisyyteen desloratadiiniannoksilla 24 mg/kg/vrk asti (desloratadiinin ja desloratadiinin metaboliitin arvioidut altistukset olivat noin 130 kertaa suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella). Urosspesifistä hedelmällisyyden heikkenemistä, mikä osoitti naaraiden alentuneen hedelmöittymisen, vähentyneen siittiöiden lukumäärän ja liikkuvuuden sekä histopatologisten kivesten muutosten seurauksena rotilla desloratadiinin suun kautta annetulla annoksella 12 mg/kg (arvioitu desloratadiinin ja desloratadiinin metaboliitin altistus oli noin 45 kertaa suurempi kuin AUC ihmisillä suositellulla vuorokausiannoksella suun kautta). Desloratadiinilla ei ollut vaikutusta rottien hedelmällisyyteen oraalisella annoksella 3 mg/kg/vrk (arvioidut desloratadiini- ja desloratadiinimetaboliitialtistukset olivat noin 8 kertaa suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella).
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, desloratadiinia tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Desloratadiini ei ollut teratogeeninen rotilla ja kaniineilla noin 210-kertaisena ja 230-kertaisena pitoisuus-aika-käyrän alla oleva pinta-ala (AUC) ihmisillä suositellulla vuorokausiannoksella suun kautta. Erillisessä naarasrotilla tehdyssä tutkimuksessa havaittiin kuitenkin lisääntynyttä ennen implantaatiota tapahtuvaa menetystä ja vähentynyttä implantaatioiden ja sikiöiden määrää. Pienentynyttä ruumiinpainoa ja hidasta oikaisurefleksiä raportoitiin pennuilla, kun AUC oli noin 50-kertainen tai suurempi kuin ihmisten AUC suositellulla vuorokausiannoksella. Desloratadiinilla ei ollut vaikutusta poikasten kehitykseen, kun AUC oli noin 7 kertaa suurempi kuin ihmisten AUC suositellulla vuorokausiannoksella suun kautta. Vertailun AUC-arvot viittaavat desloratadiinialtistukseen kaneilla ja desloratadiinin ja sen metaboliittien altistumisen summaan rotilla. [Katso Ei-kliininen toksikologia ]
Imettävät äidit
Desloratadiini erittyy äidinmaitoon; siksi on tehtävä päätös, lopetetaanko imetys vai desloratadiini, ottaen huomioon lääkkeen hyöty imettävälle äidille ja mahdollinen riski lapselle.
Käyttö lapsille
CLARINEX 5 mg oraaliliuoksen suositeltu annos lapsiväestölle perustuu CLARINEX 5 mg:n plasmapitoisuuden vertailuun aikuisilla ja lapsipotilailla. CLARINEX-oraaliliuoksen turvallisuus on osoitettu 246:lla 6 kuukauden–11 vuoden ikäisellä lapsipotilaalla kolmessa lumekontrolloidussa kliinisessä tutkimuksessa. Koska kausittaisen ja ympärivuotisen allergisen nuhan ja kroonisen idiopaattisen urtikarian kulku ja CLARINEXin vaikutukset ovat riittävän samankaltaisia lapsi- ja aikuisväestössä, se mahdollistaa aikuisten tehoa koskevien tietojen ekstrapoloinnin lapsipotilaisiin. CLARINEX 5 mg oraaliliuoksen tehokkuutta näissä ikäryhmissä tukevat riittävät ja hyvin kontrolloidut CLARINEX 5 mg tablettien aikuisilla tehdyt tutkimukset. CLARINEX 5 mg tablettien tai CLARINEX 5 mg oraaliliuoksen turvallisuutta ja tehokkuutta ei ole osoitettu alle 6 kuukauden ikäisillä lapsipotilailla. [Katso KLIININEN FARMAKOLOGIA ]
CLARINEX RediTabs 2,5 mg:n tablettia ei ole arvioitu lapsipotilailla. CLARINEX 5 mg RediTabs -tabletin ja aiemmin markkinoille tulleen RediTabs-tabletin bioekvivalenssi on vahvistettu aikuisilla. CLARINEX 5 mg RediTabs -valmisteen farmakokineettiset tiedot tukevat 2,5 mg:n annosvahvuuden käyttöä 6–11-vuotiailla lapsipotilailla yhdessä kuvattujen pediatristen annostutkimusten kanssa.
Geriatrinen käyttö
Desloratadiinin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden välillä. Yleensä iäkkäille potilaille annosvalinnan tulee olla varovaista, koska maksan, munuaisten tai sydämen toiminta on heikentynyt sekä samanaikainen sairaus tai muu lääkehoito. [Katso KLIININEN FARMAKOLOGIA ]
Munuaisten vajaatoiminta
Annoksen muuttamista potilaille, joilla on munuaisten vajaatoiminta, suositellaan [ks ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Annoksen muuttamista potilaille, joilla on maksan vajaatoiminta, suositellaan [ks ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Yliannostustapauksissa harkitse tavanomaisia toimenpiteitä imeytymättömien lääkkeiden poistamiseksi. Oireellinen ja tukeva hoito on suositeltavaa. Desloratadiini ja 3-hydroksidesloratadiini eivät poistu hemodialyysillä.
Tiedot akuutista yliannostuksesta rajoittuvat markkinoille tulon jälkeisistä haittavaikutusraporteista ja CLARINEX 5 mg -valmisteen kehittämisen aikana tehdyistä kliinisistä tutkimuksista saatuihin kokemuksiin. Annosvaihtelututkimuksessa ilmoitettiin uneliaisuutta annoksilla 10 mg ja 20 mg/vrk.
Toisessa tutkimuksessa ei raportoitu kliinisesti merkittäviä haittavaikutuksia normaaleille mies- ja naispuolisille vapaaehtoisille, joille annettiin kerta-annoksia 45 mg CLARINEXia vuorokaudessa 10 päivän ajan [ks. KLIININEN FARMAKOLOGIA ].

Kuolleisuutta esiintyi rotilla suun kautta otetuilla annoksilla 250 mg/kg tai suurempia (arvioidut desloratadiini- ja desloratadiinimetaboliitialtistukset olivat noin 120 kertaa suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella). Suun kautta otettava mediaani tappava annos hiirillä oli 353 mg/kg (arvioitu desloratadiinialtistus oli noin 290 kertaa suurempi kuin ihmisen vuorokausiannos mg/m²:n perusteella). Apinoilla ei esiintynyt kuolemia suun kautta annetuilla annoksilla 250 mg/kg asti (arvioitu desloratadiinialtistus oli noin 810 kertaa ihmisen suun kautta otettavan vuorokausiannoksen mg/m² perusteella).
VASTA-AIHEET
CLARINEX 5mg -tabletit, RediTabs ja oraaliliuos ovat vasta-aiheisia potilaille, jotka ovat yliherkkiä tälle lääkkeelle tai jollekin sen aineosalle tai loratadiinille [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Desloratadiini on pitkävaikutteinen trisyklinen histamiiniantagonisti, jolla on selektiivinen H1-reseptorin histamiiniantagonistivaikutus. Reseptorisitoutumistiedot osoittavat, että desloratadiinilla on merkittävä vuorovaikutus ihmisen histamiini-H1-reseptorin kanssa pitoisuudessa 2-3 ng/ml (7 nanomolaarinen). Desloratadiini esti histamiinin vapautumista ihmisen syöttösoluista in vitro. Rotilla tehdyn radioaktiivisesti leimatun kudosten jakautumistutkimuksen ja marsuilla tehdyn radioligandin H1-reseptorin sitoutumistutkimuksen tulokset osoittivat, että desloratadiini ei läpäissyt helposti veri-aivoestettä. Tämän löydön kliinistä merkitystä ei tunneta.
Farmakodynamiikka
Wheal And Flare
Ihmisen histamiini-ihotutkimukset desloratadiinin kerta-annosten ja toistuvien 5 mg:n annosten jälkeen ovat osoittaneet, että lääkkeellä on antihistamiininen vaikutus 1 tunnin kuluttua. tämä toiminta voi jatkua jopa 24 tuntia. Desloratadiinin 5 mg:n ryhmässä ei ollut näyttöä histamiinin aiheuttamasta ihon takyfylaksiasta 28 päivän hoitojakson aikana. Histamiini-ihotestien kliinistä merkitystä ei tunneta.
Vaikutukset QTc:hen
Tavallisille vapaaehtoisille miehille ja naisille annettiin 45 mg:n kerta-annoksia 10 päivän ajan. Kardiologi luki kaikki tässä tutkimuksessa saadut EKG:t manuaalisesti sokkoineen. CLARINEX-hoitoa saaneilla potilailla keskimääräinen syke nousi 9,2 lyöntiä minuutissa lumelääkkeeseen verrattuna. QT-aika korjattiin sykkeen (QTc) suhteen sekä Bazett- että Fridericia-menetelmillä. QTc-aikaa (Bazett) käytettäessä CLARINEX-hoitoa saaneiden potilaiden keskimääräinen nousu oli 8,1 ms verrattuna lumelääkkeeseen. QTc-aikaa (Fridericia) käytettäessä CLARINEX-hoitoa saaneilla koehenkilöillä oli keskimäärin 0,4 ms:n lisäys lumelääkkeeseen verrattuna. Kliinisesti merkittäviä haittavaikutuksia ei raportoitu.
Farmakokinetiikka
Imeytyminen
Kun desloratadiinia 5 mg:n tablettia annettiin suun kautta kerran vuorokaudessa 10 päivän ajan normaaleille terveille vapaaehtoisille, keskimääräinen aika plasman huippupitoisuuksiin (Tmax) saavutettiin noin 3 tuntia annoksen ottamisen jälkeen ja keskimääräiset vakaan tilan huippupitoisuudet plasmassa (Cmax) ja AUC Havaittiin vastaavasti 4 ng/ml ja 56,9 ng.h/ml. Ruoalla tai greippimehulla ei ollut vaikutusta desloratadiinin hyötyosuuteen (Cmax ja AUC).
CLARINEX-oraaliliuoksen farmakokineettistä profiilia arvioitiin kolmivaiheisessa ristikkäistutkimuksessa, johon osallistui 30 aikuista vapaaehtoista. 10 ml:n kerta-annos CLARINEX-oraaliliuosta, joka sisälsi 5 mg desloratadiinia, oli bioekvivalentti 5 mg:n CLARINEX-tabletin kerta-annoksen kanssa. Ruoalla ei ollut vaikutusta CLARINEX 5 mg oraaliliuoksen hyötyosuuteen (AUC ja Cmax).
CLARINEX 5 mg RediTabs -tablettien farmakokineettistä profiilia arvioitiin kolmivaiheisessa risteyttävässä tutkimuksessa, johon osallistui 24 aikuista vapaaehtoista. Yksi CLARINEX RediTabs -tabletti, joka sisälsi 5 mg desloratadiinia, oli bioekvivalentti yhden 5 mg:n CLARINEX RediTabs -tabletin (alkuperäinen formulaatio) kanssa sekä desloratadiinille että 3-hydroksidesloratadiinille. Ruoalla ja vedellä ei ollut vaikutusta CLARINEX RediTabs -tablettien biologiseen hyötyosuuteen (AUC ja Cmax).
Jakelu
Desloratadiini sitoutuu plasman proteiineihin noin 82-87 % ja 3-hydroksidesloratadiini 85-89 %. Desloratadiinin ja 3-hydroksidesloratadiinin sitoutuminen proteiineihin ei muuttunut potilailla, joilla oli munuaisten vajaatoiminta.
Aineenvaihdunta
Desloratadiini (loratadiinin tärkein metaboliitti) metaboloituu laajalti 3-hydroksidesloratadiiniksi, aktiiviseksi metaboliitiksi, joka myöhemmin glukuronidoituu. Entsyymiä, jotka vastaavat 3-hydroksidesloratadiinin muodostumisesta, ei ole tunnistettu. Kliinisistä tutkimuksista saadut tiedot osoittavat, että osalla väestöstä on heikentynyt kyky muodostaa 3-hydroksidesloratadiinia ja että he metaboloivat desloratadiinia huonosti. Farmakokineettisissa tutkimuksissa (n = 3748) noin 6 % tutkittavista oli desloratadiinin heikkoja metaboloijia (määritelty henkilöksi, jonka 3-hydroksidesloratadiinin ja desloratadiinin AUC-suhde oli alle 0,1, tai henkilö, jonka desloratadiinin puoliintumisaika oli yli 50 tuntia ). Näihin farmakokineettisiin tutkimuksiin osallistui 2–70-vuotiaita henkilöitä, joista 977 oli 2–5-vuotiaita, 1575 6–11-vuotiasta henkilöä ja 1196 12–70-vuotiasta henkilöä. Hitaiden aineenvaihduntahoitajien esiintyvuudessa ei ollut eroa ikäryhmien välillä. Hitaiden metaboloijien esiintymistiheys oli suurempi mustilla (17 %, n = 988) kuin valkoihoisilla (2 %, n = 1 462) ja latinalaisamerikkalaisilla (2 %, n = 1 063). Mediaanialtistus (AUC) desloratadiinille oli hitailla metaboloijilla noin 6 kertaa suurempi kuin koehenkilöillä, jotka eivät ole hitaita. Koehenkilöitä, jotka metaboloivat desloratadiinia heikosti, ei voida tunnistaa prospektiivisesti, ja he altistuvat suuremmille desloratadiinipitoisuuksille suositellun desloratadiiniannoksen jälkeen. Kliinisissä usean annoksen turvallisuustutkimuksissa, joissa metaboloijan tila todettiin, otettiin mukaan yhteensä 94 hitaampaa metaboloijaa ja 123 normaalia metaboloijaa, joita hoidettiin CLARINEX-oraaliliuoksella 15-35 päivän ajan. Näissä tutkimuksissa ei havaittu yleisiä eroja turvallisuudessa hitaiden ja normaalien metaboloijien välillä. Vaikka tätä ei ole havaittu näissä tutkimuksissa, altistumiseen liittyvien haittatapahtumien riskiä ei voida sulkea pois potilailla, jotka ovat heikkoja metaboloivia.
Eliminointi
Desloratadiinin keskimääräinen eliminaation puoliintumisaika plasmassa oli noin 27 tuntia. Cmax- ja AUC-arvot nousivat suhteessa annokseen 5-20 mg:n kerta-annosten jälkeen. Akkumuloitumisaste 14 päivän annostelun jälkeen vastasi puoliintumisaikaa ja annostiheyttä. Ihmisen massatasapainotutkimuksessa dokumentoitiin noin 87 %:n talteenotto 14C-desloratadiiniannoksesta, joka jakautui tasaisesti virtsaan ja ulosteisiin aineenvaihduntatuotteina. Plasman 3hydroksidesloratadiinin analyysi osoitti samanlaisia Tmax- ja puoliintumisaikaarvoja kuin desloratadiinilla.
Erikoispopulaatiot
Geriatriset aiheet
Vanhemmilla henkilöillä (≥65-vuotiaat; n=17) CLARINEX 5 mg -tablettien toistuvan annon jälkeen desloratadiinin keskimääräiset Cmax- ja AUC-arvot olivat 20 % suuremmat kuin nuoremmilla (
Pediatriset aiheet
6–11-vuotiailla koehenkilöillä kerta-annos 5 ml CLARINEX-oraaliliuosta, joka sisälsi 2,5 mg desloratadiinia, johti samanlaisiin desloratadiinipitoisuuksiin plasmassa kuin aikuisilla, kun annettiin yhtä 5 mg:n CLARINEX-tablettia. 2–5-vuotiailla koehenkilöillä kerta-annos 2,5 ml CLARINEX-oraaliliuosta, joka sisälsi 1,25 mg desloratadiinia, johti plasman desloratadiinipitoisuuksiin, jotka olivat samanlaiset kuin aikuisilla, kun annettiin yhtä 5 mg:n CLARINEX-tablettia. Metaboliitin (3-hydroksidesloratadiini) Cmax ja AUC olivat kuitenkin 1,27 ja 1,61 kertaa suuremmat 5 mg:n oraaliliuoksen annoksella aikuisille verrattuna Cmax- ja AUC-arvoihin, jotka saatiin 2–11-vuotiailla lapsilla, jotka saivat 1,25- 2,5 mg CLARINEX-oraaliliuosta.
Yksittäinen annos 2,5 ml tai 1,25 ml CLARINEX 5 mg oraaliliuosta, joka sisälsi 1,25 mg tai 0,625 mg desloratadiinia, annettiin 6–11 kuukauden ikäisille ja 12–23 kuukauden ikäisille koehenkilöille. Populaatiofarmakokineettisen analyysin tulokset osoittivat, että 1 mg:n annos 6–11 kuukauden ikäisille ja 1,25 mg:n annos 12–23 kuukauden ikäisille koehenkilöille tarvitaan, jotta desloratadiinin plasmapitoisuudet ovat samanlaiset kuin aikuisilla, kun annettiin yksittäinen 5- mg CLARINEX-oraaliliuosta.
CLARINEX 5 mg RediTabs 2,5 mg tablettia ei ole arvioitu lapsipotilailla. CLARINEX 5 mg RediTabs -tabletin ja alkuperäisen CLARINEX 5 mg RediTabs -tabletin bioekvivalenssi on vahvistettu aikuisilla. CLARINEX 5 mg RediTabs -tablettien farmakokineettiset tiedot tukevat 2,5 mg:n annosvahvuuden käyttöä 6–11-vuotiailla lapsipotilailla yhdessä kuvattujen pediatristen annostutkimusten kanssa.
Munuaisten vajaatoiminta
Desloratadiinin farmakokinetiikka 7,5 mg:n kerta-annoksen jälkeen karakterisoitiin potilailla, joilla oli lievä (n=7; kreatiniinipuhdistuma 51-69 ml/min/1,73 m²), keskivaikea (n=6; kreatiniinipuhdistuma 34-43 ml/min/1,73 m²) ) ja vaikea (n=6; kreatiniinipuhdistuma 5-29 ml/min/1,73 m²) munuaisten vajaatoiminta tai hemodialyysistä riippuvainen (n=6) potilasta. Potilailla, joilla oli lievä ja kohtalainen munuaisten vajaatoiminta, mediaani Cmax- ja AUC-arvot suurenivat noin 1,2-kertaisesti ja AUC-arvot 1,9-kertaisiksi verrattuna potilaisiin, joiden munuaisten toiminta oli normaali. Potilailla, joilla oli vaikea munuaisten vajaatoiminta tai jotka olivat riippuvaisia hemodialyysistä, Cmax-arvo suureni noin 1,7-kertaiseksi ja AUC-arvo 2,5-kertaiseksi. 3-hydroksidesloratadiinin pitoisuuksissa havaittiin vähäisiä muutoksia. Desloratadiini ja 3-hydroksidesloratadiini poistuivat heikosti hemodialyysillä. Munuaisten vajaatoiminta ei muuttanut desloratadiinin ja 3-hydroksidesloratadiinin sitoutumista plasman proteiineihin. Annoksen muuttamista potilaille, joilla on munuaisten vajaatoiminta, suositellaan [ks ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Desloratadiinin farmakokinetiikka karakterisoitiin suun kautta otetun kerta-annoksen jälkeen potilailla, joilla oli lievä (n=4), keskivaikea (n=4) ja vaikea (n=4) maksan vajaatoiminta Child-Pugh-luokituksen mukaisesti ja 8 potilaalla, joilla oli maksan toimintahäiriö. normaali maksan toiminta. Maksan vajaatoimintaa sairastavilla potilailla AUC-arvo oli vakavuudesta riippumatta noin 2,4-kertainen verrattuna normaaleihin koehenkilöihin. Desloratadiinin näennäinen oraalinen puhdistuma potilailla, joilla oli lievä, keskivaikea ja vaikea maksan vajaatoiminta, oli 37 %, 36 % ja 28 % normaaleista koehenkilöistä. Maksan vajaatoimintaa sairastavilla potilailla havaittiin desloratadiinin keskimääräisen eliminaation puoliintumisajan pidentymistä. 3-hydroksidesloratadiinin keskimääräiset Cmax- ja AUC-arvot maksan vajaatoimintaa sairastavilla potilailla eivät eronneet tilastollisesti merkitsevästi potilaista, joilla oli normaali maksan toiminta. Annoksen muuttamista potilaille, joilla on maksan vajaatoiminta, suositellaan [ks ANNOSTELU JA HALLINNOINTI ].
Sukupuoli
Naishenkilöillä, joita hoidettiin 14 päivän ajan CLARINEX 5 mg -tableteilla, desloratadiinin Cmax- ja AUC-arvot olivat 10 % ja AUC-arvot 3 % korkeammat kuin miehillä. 3-hydroksidesloratadiinin Cmax- ja AUC-arvot kasvoivat myös naisilla 45 % ja 48 % miehiin verrattuna. Nämä ilmeiset erot eivät kuitenkaan todennäköisesti ole kliinisesti merkittäviä, joten annoksen muuttamista ei suositella.
Rotu
14 päivän CLARINEX-tablettien käytön jälkeen desloratadiinin Cmax-arvot olivat 18 % ja AUC-arvot 32 % korkeammat mustaihoisilla verrattuna valkoihoisiin. 3-hydroksidesloratadiinin Cmax- ja AUC-arvot pienenivät vastaavasti 10 % mustaihoisilla verrattuna valkoihoisiin. Nämä erot eivät todennäköisesti ole kliinisesti merkittäviä, joten annoksen muuttamista ei suositella.
Huumeiden vuorovaikutukset
Kahdessa kontrolloidussa ristikkäisessä kliinisen farmakologian tutkimuksessa terveillä miehillä (n=12 kussakin tutkimuksessa) ja naisella (n=12 kussakin tutkimuksessa) vapaaehtoisilla desloratadiinia 7,5 mg (1,5-kertainen vuorokausiannos) kerran vuorokaudessa annettiin yhdessä erytromysiinin kanssa 500 mg joka 8. tuntia tai ketokonatsolia 200 mg 12 tunnin välein 10 päivän ajan. Kolmessa erillisessä kontrolloidussa rinnakkaisryhmätutkimuksessa kliinisessä 5 mg:n annoksessa desloratadiinia annettiin samanaikaisesti atsitromysiinin 500 mg ja sen jälkeen 250 mg kerran vuorokaudessa 4 päivän ajan (n=18) tai fluoksetiinin 20 mg kerran vuorokaudessa kanssa 7 päivän ajan. 23 päivän esikäsittelyjakson jälkeen fluoksetiinilla (n = 18) tai simetidiinillä 600 mg 12 tunnin välein 14 päivän ajan (n = 18) vakaan tilan olosuhteissa normaaleille terveille vapaaehtoisille miehille ja naisille. Vaikka desloratadiinin ja 3hydroksidesloratadiinin plasmapitoisuuksia (Cmax ja AUC0-24 h) havaittiin (ks. taulukko 2), desloratadiinin turvallisuusprofiilissa ei havaittu kliinisesti merkittäviä muutoksia, jotka on arvioitu elektrokardiografisilla parametreilla (mukaan lukien korjattu QT-aika). kliiniset laboratoriotutkimukset, elintoiminnot ja haittatapahtumat.
Eläinten toksisuus ja/tai farmakologia Lisääntymistoksikologiset tutkimukset
Desloratadiini ei ollut teratogeeninen rotilla annoksilla 48 mg/kg/vrk asti (desloratadiinin ja desloratadiinin metaboliitin arvioidut altistukset olivat noin 210 kertaa suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella) eikä kaniineilla annoksilla 60 mg/kg/vrk asti. päivässä (arvioitu desloratadiinialtistus oli noin 230 kertaa suurempi kuin ihmisten AUC suositellulla vuorokausiannoksella). Erillisessä tutkimuksessa naarasrotilla havaittiin lisääntynyttä ennen implantaatiota tapahtuvaa menetystä sekä implantaatioiden ja sikiöiden määrän vähenemistä 24 mg/kg:lla (arvioitu desloratadiinin ja desloratadiinin metaboliitin altistus oli noin 120 kertaa suurempi kuin ihmisten AUC suositellulla päivittäisellä suun kautta). annos). Pienentynyttä ruumiinpainoa ja hidasta oikaisurefleksiä raportoitiin pennuilla 9 mg/kg/vrk tai suuremmilla annoksilla (arvioidut desloratadiini- ja desloratadiinimetaboliitialtistukset olivat noin 50-kertaiset tai suuremmat kuin ihmisten AUC suositellulla vuorokausiannoksella). Desloratadiinilla ei ollut vaikutusta poikasten kehitykseen suun kautta annetulla annoksella 3 mg/kg/vrk (arvioitu desloratadiini- ja desloratadiinimetaboliittialtistus oli noin 7 kertaa suurempi kuin ihmisten AUC suositellulla suun kautta otetulla vuorokausiannoksella).
Kliiniset tutkimukset
Kausiluonteinen allerginen nuha
CLARINEX-tablettien kliinistä tehoa ja turvallisuutta arvioitiin yli 2 300:lla 12–75-vuotiaalla potilaalla, joilla oli kausiluonteista allergista nuhaa. Yhteensä 1838 potilasta sai 2,5-20 mg/vrk CLARINEXia neljässä kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa kliinisessä tutkimuksessa, jotka kestivät 2-4 viikkoa Yhdysvalloissa. Näiden tutkimusten tulokset osoittivat CLARINEX 5 mg:n tehon ja turvallisuuden kausiluonteista allergista nuhaa sairastavien aikuisten ja nuorten potilaiden hoidossa. Annosvaihtelututkimuksessa tutkittiin CLARINEXia 2,5–20 mg/vrk. Annokset 5, 7,5, 10 ja 20 mg/vrk olivat parempia kuin lumelääke; eikä lisähyötyä havaittu yli 5,0 mg:n annoksilla. Samassa tutkimuksessa uneliaisuuden ilmaantuvuus lisääntyi annoksilla 10 mg/vrk ja 20 mg/vrk (5,2 % ja 7,6 %) verrattuna lumelääkkeeseen (2,3 %).
Kahdessa 4 viikkoa kestäneessä tutkimuksessa, joihin osallistui 924 potilasta (15-75 vuotta), joilla oli kausiluonteinen allerginen nuha ja samanaikainen astma, CLARINEX 5 mg tabletit 5 mg kerran vuorokaudessa paransivat nuhan oireita heikentämättä keuhkojen toimintaa. Tämä tukee CLARINEX 5 mg -tablettien turvallisuutta aikuispotilaille, joilla on kausiluonteinen allerginen nuha ja lievä tai kohtalainen astma.
CLARINEX-tabletit 5 mg kerran vuorokaudessa vähensivät merkitsevästi kokonaisoirepistemäärää (nenä- ja ei-nenäoireiden yksittäisten pisteiden summa) potilailla, joilla oli kausiluonteinen allerginen nuha. Katso taulukko 3.
CLARINEX 5 mg -tablettien 5 mg:n tehossa ei ollut merkittäviä eroja sukupuolen, iän tai rodun mukaan määritellyissä potilasalaryhmissä.
Monivuotinen allerginen nuha
CLARINEX 5 mg -tablettien kliinistä tehoa ja turvallisuutta arvioitiin yli 1 300:lla 12–80-vuotiaalla potilaalla, joilla oli ympärivuotinen allerginen nuha. Yhteensä 685 potilasta sai 5 mg/vrk CLARINEX 5 mg kahdessa kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa kliinisessä 4 viikon tutkimuksessa, jotka suoritettiin Yhdysvalloissa ja kansainvälisesti. Yhdessä näistä tutkimuksista CLARINEX 5 mg tablettien 5 mg kerran vuorokaudessa osoitettiin merkittävästi vähentävän kokonaisoireiden pistemäärää potilailla, joilla on monivuotinen allerginen nuha (taulukko 4).
Krooninen idiopaattinen urtikaria
CLARINEX 5 mg tablettien tehoa ja turvallisuutta 5 mg kerran vuorokaudessa tutkittiin 416:lla kroonista idiopaattista urtikariaa sairastavalla potilaalla iältään 12–84-vuotiailla, joista 211 sai CLARINEXia. Kahdessa kaksoissokkoutetussa, lumekontrolloidussa, satunnaistetussa kliinisessä tutkimuksessa, jotka kestivät kuusi viikkoa, ennalta määritellyssä viikon ensisijaisessa arvioinnissa, CLARINEX-tabletit vähensivät merkittävästi kutinan vakavuutta lumelääkkeeseen verrattuna (taulukko 5). Myös toissijaiset päätetapahtumat arvioitiin, ja ensimmäisen hoitoviikon aikana CLARINEX 5 mg -tabletit 5 mg vähensivät toissijaisia päätepisteitä, "nokkosihottumien lukumäärää" ja "suurimman nokkosihottuman kokoa" lumelääkkeeseen verrattuna.
CLARINEX-oraaliliuoksen kliininen turvallisuus dokumentoitiin kolmessa, 15 päivää kestäneessä kaksoissokkoutetussa, lumekontrolloidussa turvallisuustutkimuksessa lapsilla, joilla on dokumentoitu allerginen nuha, krooninen idiopaattinen nokkosihottuma tai henkilöt, jotka olivat ehdokkaita antihistamiinihoitoon. Ensimmäisessä tutkimuksessa 2,5 mg CLARINEX-oraaliliuosta annettiin 60:lle 6–11-vuotiaalle lapselle. Toisessa tutkimuksessa arvioitiin 1,25 mg CLARINEX-oraaliliuosta 55:lle 2–5-vuotiaalle lapselle. Kolmannessa tutkimuksessa 1,25 mg CLARINEX 5 mg oraaliliuosta annettiin 65 12-23 kuukauden ikäiselle lapsipotilaalle ja 1,0 mg CLARINEX-oraaliliuosta 66 6-11 kuukauden ikäiselle lapsipotilaalle. Näiden tutkimusten tulokset osoittivat CLARINEX 5 mg oraaliliuoksen turvallisuuden 6 kuukauden – 11 vuoden ikäisillä lapsilla.
POTILASTIEDOT
CLARINEX® (CLA-RI-NEX) (desloratadiini) -tabletit, RediTabs® ja oraaliliuos
Lue CLARINEX®-valmisteen mukana tulevat potilastiedot ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä pakkausseloste on tiivistelmä potilaille tarkoitetuista tiedoista. Lääkäri tai apteekki voi antaa sinulle lisätietoja. Tämä pakkausseloste ei korvaa sitä, että keskustelet lääkärisi kanssa sairaudesta tai hoidostasi.
Mikä on CLARINEX 5mg?
CLARINEX on reseptilääke, joka sisältää desloratadiinia (antihistamiinia).
CLARINEXia käytetään seuraavien oireiden hallintaan:
- kausiluonteinen allerginen nuha (aivastelu, nenän tukkoisuus, vuotava nenä ja nenän kutina) 2-vuotiailla ja sitä vanhemmilla.
- monivuotinen allerginen nuha (aivastelu, nenän tukkoisuus, vuotava nenä ja nenän kutina) 6 kuukauden ikäisillä ja sitä vanhemmilla.
- krooninen idiopaattinen nokkosihottuma (pitkäaikainen kutina) ja vähentää nokkosihottumaa 6 kuukauden ikäisillä ja sitä vanhemmilla.
CLARINEX ei ole tarkoitettu alle 6 kuukauden ikäisille lapsille.
Kuka ei saa ottaa CLARINEXia?
Älä ota CLARINEX 5 mg:aa, jos:
- olet allerginen desloratadiinille tai jollekin CLARINEX-tablettien, CLARINEX RediTabs®- tai CLARINEX-oraaliliuoksen aineosista. Katso tämän pakkausselosteen lopusta täydellinen luettelo ainesosista.
- ovat allergisia loratadiinille (Alavert, Claritin).
Keskustele lääkärisi kanssa ennen tämän lääkkeen ottamista, jos sinulla on kysyttävää siitä, otatko tätä lääkettä vai ei.
Mitä minun tulee kertoa lääkärilleni ennen kuin otat CLARINEX 5 mg -valmistetta?
Ennen kuin otat CLARINEX 5 mg -valmistetta, kerro lääkärillesi, jos:
- sinulla on maksa- tai munuaisongelmia.
- sinulla on muita sairauksia.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako CLARINEX 5 mg sikiötäsi. Keskustele lääkärisi kanssa, jos olet raskaana tai suunnittelet raskautta.
- imetät tai aiot imettää. CLARINEX 5 mg voi erittyä äidinmaitoon. Keskustele lääkärisi kanssa siitä, mikä on paras tapa ruokkia vauvasi, jos otat CLARINEXia.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. CLARINEX 5 mg voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa CLARINEX 5 mg:n tehoon. Kerro lääkärillesi erityisesti, jos otat:
- ketokonatsoli (Nizoral)
- erytromysiini (Ery-tab, Eryc, PCE)
- atsitromysiini (Zithromax, Zmax)
- antihistamiinit
- fluoksetiini (Prozac)
- simetidiini (Tagamet)
Tunne käyttämäsi lääkkeet. Pidä luetteloa lääkkeistäsi ja näytä se lääkärillesi ja apteekkiin, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa CLARINEX?
- Ota CLARINEX 5 mg juuri sen verran kuin lääkärisi on määrännyt.
- Älä muuta CLARINEX 5 mg -annostasi tai ota sitä useammin kuin on määrätty.
- CLARINEX 5 mg voidaan ottaa ruoan kanssa tai ilman.
- Aseta CLARINEX RediTabs -tabletti kielellesi ja anna sen liueta ennen nielemistä. CLARINEX 5 mg RediTabs voidaan ottaa veden kanssa tai ilman. Ota CLARINEX 5 mg RediTabs -tabletti heti läpipainopakkauksen avaamisen jälkeen.
- Ota CLARINEX-oraaliliuos mittatiputtimella tai suuruiskulla, jonka tilavuus on 2 ml tai 2,5 ml. Pyydä apteekista tiputin tai ruisku, jos sinulla ei ole sellaista.
- Jos otat liikaa CLARINEXia, ota välittömästi yhteyttä lääkäriin tai hakeudu lääkärin hoitoon.
Mitkä ovat CLARINEX-tablettien mahdolliset sivuvaikutukset?
CLARINEX 5mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Allergiset reaktiot. Lopeta CLARINEX 5 mg:n käyttö ja soita heti lääkärillesi tai hakeudu hätäapua, jos sinulla on jokin seuraavista oireista:
- ihottuma
- kutina
- nokkosihottuma
- huulten, kielen, kasvojen ja kurkun turvotus
- hengenahdistus tai hengitysvaikeudet
CLARINEXin yleisimmät sivuvaikutukset aikuisilla ja 12-vuotiailla ja sitä vanhemmilla lapsilla, joilla on allerginen nuha, ovat:
- kipeä kurkku
- kuiva suu
- lihaskipu
- väsymys
- uneliaisuus
- kuukautiskivut
Uneliaisuutta tai väsymystä voi esiintyä, jos otat enemmän CLARINEXia kuin lääkärisi on määrännyt.
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia CLARINEXin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Miten CLARINEX 5mg pitäisi säilyttää?
- Store CLARINEX-tabletit välillä 59°F - 86°F (15°C - 30°C).
- CLARINEX-tabletit ovat herkkiä lämmölle. Säilytä alle 86°F (30°C).
- Suojella CLARINEX 5 mg tabletit kosteudelta.
- Store CLARINEX 5 mg oraaliliuos välillä 59°F - 86°F (15°C - 30°C). Suojaa CLARINEX 5 mg oraaliliuosta valolta.
Pitää CLARINEX-tabletit, RediTabs-tabletit , ja Oraaliliuos ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa CLARINEXista
Lääkkeitä määrätään joskus muihin kuin potilasohjeessa mainittuihin tarkoituksiin. Älä käytä CLARINEX 5 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna CLARINEX 5 mg:aa muille ihmisille, vaikka heillä olisi sama sairaus kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen tiivistää tärkeimmät tiedot CLARINEXista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltä tietoja CLARINEXista, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta www.CLARINEX.com
Mitä ainesosia CLARINEX 5mg sisältää?
Aktiivinen ainesosa: desloratadiini
Potilaat, joilla on fenyyliketonuria: CLARINEX RediTabs -tabletit sisältävät fenyylialaniinia.
CLARINEX 5 mg tablettien inaktiiviset aineosat: kaksiemäksinen kalsiumfosfaattidihydraatti USP, mikrokiteinen selluloosa NF, maissitärkkelys NF, talkki USP, karnaubavaha NF, valkoinen vaha NF, pinnoitemateriaali, joka koostuu laktoosimonohydraatista, hypromelloosista, titaanidioksidista, polyetyleeniglykolista ja FD&C Aluminium Lake #2:sta.
CLARINEX 5 mg oraaliliuoksen inaktiiviset aineosat: propyleeniglykoli USP, sorbitoliliuos USP, sitruunahappo (vedetön) USP, natriumsitraattidihydraatti USP, natriumbentsoaatti NF, dinatriumedetaatti USP, puhdistettu vesi USP. Se sisältää myös kidesokeria, luonnollista ja keinotekoista aromia purukumiin ja FDC Yellow #6 -väriainetta.
