Zofran 4mg, 8mg Ondansetron Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zofran on ja miten sitä käytetään?
Zofran 4mg on reseptilääke, jota käytetään ennaltaehkäisyyn ja tiettyjen lääkkeiden aiheuttaman tai leikkauksen jälkeisen pahoinvoinnin ja oksentelun oireiden hoitoon. Zofran 8mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Zofran kuuluu lääkeryhmään, jota kutsutaan antiemeetiksi, selektiiviseksi 5-HT3-antagonistiksi.
Ei tiedetä, onko Zofran 4mg turvallinen ja tehokas alle 1 kuukauden ikäisille lapsille.
Mitkä ovat Zofranin mahdolliset sivuvaikutukset?
Zofran voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vaikea ummetus,
- vatsakipu,
- turvotus,
- päänsärky, johon liittyy rintakipua ja voimakasta huimausta,
- pyörtyminen,
- nopeat tai jyskyttävät sydämenlyönnit,
- ihon tai silmien keltaisuus (keltatauti)
- näön hämärtyminen,
- tilapäinen näönmenetys,
- agitaatio,
- hallusinaatiot,
- kuume,
- nopea syke,
- yliaktiiviset refleksit,
- pahoinvointi,
- oksentelua,
- ripuli,
- koordinaation menetys ja
- pyörtyminen
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zofranin yleisimpiä sivuvaikutuksia ovat:
- ripuli,
- ummetus,
- uneliaisuus ja
- väsynyt tunne
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Zofranin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
ZOFRAN 4 mg tablettien ja ZOFRAN oraaliliuoksen vaikuttava aine on ondansetronihydrokloridi dihydraattina, ondansetronin raseeminen muoto ja selektiivinen serotoniini-5-HT3-reseptorityypin salpaaja. Kemiallisesti se on (±) 1,2,3,9-tetrahydro-9-metyyli-3-[(2-metyyli-1 H-imidatsol-1-yyli)metyyli]-4H-karbatsol-4-oni, monohydrokloridi, dihydraatti . Sillä on seuraava rakennekaava:
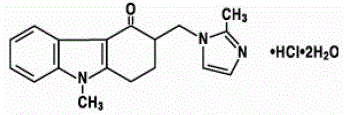
Empiirinen kaava on C18H19N3O·HCl·2H2O, joka edustaa molekyylipainoa 365,9.
Ondansetronihydroklorididihydraatti on valkoinen tai luonnonvalkoinen jauhe, joka liukenee veteen ja normaaliin suolaliuokseen.
Suun kautta hajoavien ZOFRAN 4 mg ODT -tablettien vaikuttava aine on ondansetroniemäs, ondanseronin raseeminen muoto ja selektiivinen serotoniini-5-HT3-reseptorin tyyppinen salpaaja. Kemiallisesti se on (±) 1,2,3,9tetrahydro-9-metyyli-3-[(2-metyyli-1 H-imidatsol-1-yyli)metyyli]-4H-karbatsol-4-oni. Sillä on seuraava rakennekaava:
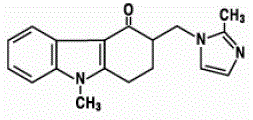
Empiirinen kaava on C18H19N3O, jonka molekyylipaino on 293,4.
Jokainen 4 mg:n ZOFRAN 8 mg tabletti oraaliseen käyttöön sisältää ondansetronihydroklorididihydraattia, joka vastaa 4 mg ondansetronia. Jokainen 8 mg:n ZOFRAN 8 mg:n tabletti oraaliseen käyttöön sisältää ondansetronihydroklorididihydraattia, joka vastaa 8 mg ondansetronia. Jokainen tabletti sisältää myös inaktiivisia aineita hypromelloosia, keltaista rautaoksidia (vain 8 mg:n tabletti), laktoosia, magnesiumstearaattia, mikrokiteistä selluloosaa, esigelatinoitua tärkkelystä, triasetiinia ja titaanidioksidia.
Jokainen 4 mg:n ZOFRAN 8 mg ODT suun kautta hajoava tabletti oraaliseen käyttöön sisältää 4 mg ondansetroniemästä. Jokainen 8 mg ZOFRAN 4 mg ODT suun kautta hajoava tabletti suun kautta annettavaksi sisältää 8 mg ondansetroniemästä. Jokainen ZOFRAN ODT -tabletti sisältää myös inaktiivisia aineosia aspartaamia, gelatiinia, mannitolia, metyyliparabeeninatriumia, propyyliparabeeninatriumia ja mansikkaaromia. ZOFRAN ODT -tabletit ovat pakastekuivattu, suun kautta annettava ondansetroniformulaatio, joka hajoaa kielellä eikä vaadi vettä liukenemisen tai nielemisen helpottamiseksi.
Jokainen 5 ml ZOFRAN-oraaliliuosta sisältää 5 mg ondansetronihydroklorididihydraattia, joka vastaa 4 mg ondansetronia. ZOFRAN 8 mg oraaliliuos sisältää inaktiivisia aineosia vedetöntä sitruunahappoa, puhdistettua vettä, natriumbentsoaattia, natriumsitraattia, sorbitolia ja mansikkaaromia.
INDIKAATIOT
ZOFRAN on tarkoitettu estämään pahoinvointia ja oksentelua, joka liittyy:
- erittäin emetogeeninen syövän kemoterapia, mukaan lukien sisplatiini, joka on suurempi tai yhtä suuri kuin 50 mg/m²
- kohtalaisen oksentelua aiheuttavan syövän kemoterapian alku- ja toistuvat kurssit
- sädehoito potilailla, jotka saavat joko koko kehon säteilytystä, yksittäistä suuren annoksen fraktiota vatsaan tai päivittäisiä fraktioita vatsaan
ZOFRAN on tarkoitettu myös leikkauksen jälkeisen pahoinvoinnin ja/tai oksentelun ehkäisyyn.
ANNOSTELU JA HALLINNOINTI
Annostus
Suositellut annostusohjelmat aikuisille ja lapsipotilaille on kuvattu taulukossa 1 ja taulukossa 2. Vastaavia annoksia ZOFRAN-tabletteja, ZOFRAN ODT® suussa hajoavia tabletteja ja ZOFRAN-oraaliliuosta voidaan käyttää vaihtokelpoisesti.
Annostus maksan vajaatoiminnassa
Potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-pistemäärä 10 tai enemmän), älä ylitä 8 mg:n päivittäistä kokonaisannosta [ks. Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ].
Suun kautta hajoavien ZOFRAN ODT -tablettien anto-ohjeet
Älä yritä työntää ZOFRAN ODT suussa hajoavia tabletteja kalvotaustan läpi. KUORI 1 läpipainopakkauksen foliopohja kuivin käsin ja poista tabletti VAROVASTI. Aseta ZOFRAN 4mg ODT suussa hajoava tabletti VÄLITTÖMÄSTI kielen päälle, jossa se liukenee sekunneissa, ja niele sitten syljen kanssa. Annostelu nesteen kanssa ei ole välttämätöntä.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
ZOFRAN tabletit ovat soikeita, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on kaiverrettu "Zofran", ja niitä on saatavana seuraavina vahvuuksina:
- 4 mg - valkoinen tabletti, jonka toiselle puolelle on kaiverrettu "4".
- 8 mg - keltainen tabletti, jonka toiselle puolelle on kaiverrettu "8".
ZOFRAN ODT suussa hajoavat tabletit ovat valkoisia, pyöreitä ja tasokuperia tabletteja, joita on saatavana seuraavina vahvuuksina:
- 4 mg - toisella puolella merkintä "Z4".
- 8 mg - toisella puolella merkintä "Z8".
ZOFRAN 4 mg oraaliliuos 4 mg/5 ml, on kirkas, väritön tai vaaleankeltainen neste, jolla on tyypillinen mansikan tuoksu, saatavana 50 ml:n pullossa.
Varastointi ja käsittely
ZOFRAN tabletit
4 mg (ondansetronihydroklorididihydraatti, joka vastaa 4 mg ondansetronia) ovat valkoisia, soikeita, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on kaiverrettu "Zofran" ja toiselle puolelle "4" 30 tabletin pulloissa (NDC 0078-0675-15). ).
Säilytä 2°C - 30°C (36°F - 86°F). Suojaa valolta. Annostele tiiviiseen, valonkestävään astiaan USP:n mukaisesti.
8 mg (ondansetronihydroklorididihydraatti, joka vastaa 8 mg ondansetronia) ovat keltaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on kaiverrettu "Zofran" ja toiselle puolelle "8" 30 tabletin pulloissa (NDC 0078-0676-15). ).
Säilytä 2°C - 30°C (36°F - 86°F). Suojaa valolta. Annostele tiiviiseen, valonkestävään astiaan USP:n mukaisesti.
ZOFRAN 8 mg ODT suussa hajoavat tabletit
4 mg (4 mg ondansetroniemäksenä) ovat valkoisia, pyöreitä ja tasokuperia tabletteja, joiden toiselle puolelle on kaiverrettu "Z4" 30 tabletin yksikköannospakkauksissa (NDC 0078-0679-19).
mg (8 mg ondansetroniemäksenä) ovat valkoisia, pyöreitä ja tasokuperia tabletteja, joiden toisella puolella on merkintä "Z8" 30 tabletin yksikköannospakkauksissa (NDC 0078-0680-19).
Säilytä 2°C - 30°C (36°F - 86°F).
ZOFRAN 4 mg oraaliliuos
kirkas, väritön tai vaaleankeltainen neste, jolla on ominainen mansikan tuoksu, sisältää 5 mg ondansetronihydroklorididihydraattia, joka vastaa 4 mg ondansetronia 5 ml:ssa ruskeissa 50 ml:n lasipulloissa, joissa on lapsiturvallinen korkki (NDC 0078-0677-22) .
Säilytä pystyasennossa 15°C - 30°C (59°F - 86°F). Suojaa valolta. Säilytä pullot pystyasennossa laatikoissa.
Jakelija: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Tarkistettu: huhtikuu 2021
SIVUVAIKUTUKSET
Seuraavat kliinisesti merkittävät haittavaikutukset on kuvattu muualla merkinnöissä:
- Yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen [katso VAROITUKSET JA VAROTOIMET ]
- Serotoniinioireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Progressiivisen ileuksen ja mahalaukun turvotuksen peittäminen [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Seuraavia haittavaikutuksia on raportoitu kliinisissä tutkimuksissa potilailla, joita on hoidettu ZOFRANin vaikuttavalla aineella ondansetronilla. Syy-yhteys ZOFRAN-hoitoon oli monissa tapauksissa epäselvä.
Kemoterapian aiheuttaman pahoinvoinnin ja oksentelun ehkäisy
Yleisimmät haittavaikutukset, joita raportoitiin vähintään 4 %:lla 300 aikuisesta, jotka saivat 24 mg:n kerta-annoksen ZOFRANia 4 mg suun kautta kahdessa tutkimuksessa, jotka koskivat voimakkaasti emetogeeniseen kemoterapiaan (sisplatiinia suurempi tai yhtä suuri kuin 50 mg) liittyvää pahoinvointia ja oksentelua /m²) olivat: päänsärky (11 %) ja ripuli (4 %).
Yleisimmät haittavaikutukset, jotka on raportoitu neljässä aikuisilla tehdyssä tutkimuksessa kohtalaisen emetogeeniseen kemoterapiaan (pääasiassa syklofosfamidiin perustuviin hoitoihin) liittyvän pahoinvoinnin ja oksentelun ehkäisyyn, on esitetty taulukossa 3.
Harvemmin yleiset haittavaikutukset
Keskushermosto
Ekstrapyramidaaliset reaktiot (alle 1 % potilaista).
Maksa
Aspartaattitransaminaasien (AST) ja/tai alaniinitransaminaasien (ALT) arvot ylittivät kaksi kertaa normaalin ylärajan noin 1–2 prosentilla 723 potilaasta, jotka saivat ZOFRANia 8 mg ja syklofosfamidipohjaista kemoterapiaa Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa. Lisäykset olivat ohimeneviä eivätkä näyttäneet liittyvän annokseen tai hoidon kestoon. Toistuvan altistuksen yhteydessä havaittiin samanlaisia ohimeneviä transaminaasiarvojen nousuja joillakin hoitojaksoilla, mutta oireista maksasairauksia ei esiintynyt. Syövän kemoterapian rooli näissä biokemiallisissa muutoksissa on epäselvä.
Maksan vajaatoimintaa ja kuolemaa on raportoitu syöpäpotilailla, jotka ovat saaneet samanaikaisesti lääkkeitä, mukaan lukien mahdollisesti maksatoksista sytotoksista kemoterapiaa ja antibiootteja. Maksan vajaatoiminnan etiologia on epäselvä.
Sisäinen
Ihottuma (noin 1 % potilaista).
Muut (alle 2 %)
Anafylaksia, bronkospasmi, takykardia, angina pectoris, hypokalemia, elektrokardiografiset muutokset, verisuonten tukkeutumistapahtumat ja grand mal -kohtaukset. Bronkospasmia ja anafylaksiaa lukuun ottamatta yhteys ZOFRAN 4 mg:aan on epäselvä.
Säteilyn aiheuttaman pahoinvoinnin ja oksentelun ehkäisy
Yleisimmät haittavaikutukset (suurempi tai yhtä suuri kuin 2 %), jotka raportoitiin ZOFRANia ja samanaikaista sädehoitoa saaneilla potilailla, olivat samanlaisia kuin ZOFRANia ja samanaikaista kemoterapiaa saaneilla potilailla, ja ne olivat päänsärky, ummetus ja ripuli.
Leikkauksen jälkeisen pahoinvoinnin ja oksentelun ehkäisy
Yleisimmät aikuisilla raportoidut haittavaikutukset leikkauksen jälkeisen pahoinvoinnin ja oksentelun ehkäisytutkimuksessa (tutkimuksissa) on esitetty taulukossa 4. Näissä tutkimuksissa potilaat saivat samanaikaisesti useita perioperatiivisia ja postoperatiivisia lääkkeitä molemmissa hoitoryhmissä.
Crossover-tutkimuksessa, jossa oli 25 henkilöä, päänsärkyä raportoitiin 6 potilaalla, joille annettiin ZOFRAN 8 mg ODT:tä suun kautta hajoavaa tablettia veden kanssa (24 %) verrattuna kahdelle henkilölle, jolle annettiin ZOFRAN 8 mg ODT suussa hajoava tabletti ilman vettä (8 %).
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu ondansetronin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Kardiovaskulaarinen
Rytmihäiriöt (mukaan lukien kammio- ja supraventrikulaarinen takykardia, ennenaikaiset kammioiden supistukset ja eteisvärinä), bradykardia, elektrokardiografiset muutokset (mukaan lukien toisen asteen sydänkatkos, QT/QTc-ajan pidentyminen ja ST-segmentin lama), sydämentykytys ja pyörtyminen. Harvoin ja pääasiassa suonensisäisen ondansetronin yhteydessä on raportoitu ohimeneviä EKG-muutoksia, mukaan lukien QT-ajan pidentyminen.
Kenraali
Huuhtelu
Harvinaisia yliherkkyysreaktioita, joskus vakavia (esim. anafylaktisia reaktioita, angioödeema, bronkospasmi, hengenahdistus, hypotensio, kurkunpään turvotus, stridor) on myös raportoitu. Laryngospasmia, sokkia ja sydänpysähdyksiä on esiintynyt allergisten reaktioiden aikana potilailla, jotka ovat saaneet ruiskeena ondansetronia.
Maksa-sappi
Maksaentsyymihäiriöt.
Alemmat hengityselimet
Hikka.
Neurologia
Okulogyrinen kriisi, joka esiintyy yksinään, samoin kuin muiden dystonisten reaktioiden yhteydessä.
Iho
Urtikaria, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi.
Silmäsairaudet
Ohimenevän sokeuden tapauksia, pääasiassa suonensisäisen annon aikana, on raportoitu. Näiden ohimenevän sokeuden tapausten raportoitiin hävinneen muutamassa minuutissa jopa 48 tunnissa.
HUUMEIDEN VUOROVAIKUTUKSET
Serotonergiset lääkkeet
Serotoniinioireyhtymä (mukaan lukien muuttunut henkinen tila, autonominen epävakaus ja hermolihasoireet) on kuvattu 5-HT3-reseptoriantagonistien ja muiden serotonergisten lääkkeiden, mukaan lukien SSRI- ja SNRI-lääkkeiden, samanaikaisen käytön jälkeen. Seuraa serotoniinioireyhtymän ilmaantumista. Jos oireita ilmaantuu, lopeta ZOFRAN 4mg -hoito ja aloita tukihoito [ks VAROITUKSET JA VAROTOIMET ].
Sytokromi P-450 -entsyymeihin vaikuttavat lääkkeet
Ondansetroni ei itse näytä indusoivan tai indusoivan maksan sytokromi P-450 lääkettä metaboloivaa entsyymijärjestelmää [ks. KLIININEN FARMAKOLOGIA ]. Koska ondansetroni metaboloituu maksan sytokromi P450:tä lääkettä metaboloivien entsyymien (CYP3A4, CYP2D6, CYP1A2) toimesta, näiden entsyymien induktorit tai estäjät voivat muuttaa ondansetroni puhdistumaa ja siten sen puoliintumisaikaa. Potilailla, joita hoidettiin voimakkailla CYP3A4:n indusoijilla (ts. fenytoiinilla, karbamatsepiinilla ja rifampiinilla), ondansetronin puhdistuma lisääntyi merkittävästi ja ondansetronipitoisuudet veressä pienenivät. Saatavilla olevien tietojen perusteella ZOFRAN 8 mg:n annoksen muuttamista ei kuitenkaan suositella potilaille, jotka käyttävät näitä lääkkeitä [ks. KLIININEN FARMAKOLOGIA ].
Tramadol
Vaikka ondansetronin ja tramadolin välillä ei ole havaittu farmakokineettisiä yhteisvaikutuksia, kahdesta pienestä tutkimuksesta saadut tiedot osoittavat, että yhdessä käytettynä ZOFRAN 8 mg voi lisätä potilaan kontrolloimaa tramadolin antamista. Seuraa potilaita varmistaaksesi riittävän kivun hallinnan, kun ondansetronia annetaan tramadolin kanssa.
Kemoterapia
Karmustiini, etoposidi ja sisplatiini eivät vaikuta ondansetronin farmakokinetiikkaan.
Crossover-tutkimuksessa, johon osallistui 76 lapsipotilasta, suonensisäinen ondansetroni ei lisännyt suuren annoksen metotreksaatin systeemisiä pitoisuuksia.
Alfentaniili ja Atrakurium
ZOFRAN 4 mg ei muuta alfentaniilin tuottamia hengitysteitä lamaavia vaikutuksia tai atrakuriumin tuottaman hermo-lihassalpauksen astetta. Yhteisvaikutuksia yleis- tai paikallispuudutteiden kanssa ei ole tutkittu.
Huumeiden väärinkäyttö ja riippuvuus
Eläintutkimukset ovat osoittaneet, että ondansetronia ei erotella bentsodiatsepiinina eikä se korvaa bentsodiatsepiineja suorissa riippuvuustutkimuksissa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Yliherkkyysreaktiot
Yliherkkyysreaktioita, mukaan lukien anafylaksia ja bronkospasmi, on raportoitu potilailla, jotka ovat olleet yliherkkiä muille selektiivisille 5-HT3-reseptorin antagonisteille. Jos yliherkkyysreaktioita ilmenee, lopeta ZOFRANin käyttö. hoitaa viipymättä hoidon standardin mukaisesti ja seurata, kunnes merkit ja oireet häviävät [katso VASTA-AIHEET ].
QT-ajan pidentyminen
Ondansetronia saavilla potilailla on havaittu muutoksia EKG:ssä, mukaan lukien QT-ajan pidentyminen. Lisäksi markkinoille tulon jälkeen on raportoitu Torsade de Pointes -tapauksia ZOFRANia käyttävillä potilailla. Vältä ZOFRAN 8 mg:n käyttöä potilailla, joilla on synnynnäinen pitkä QT-oireyhtymä. EKG-seurantaa suositellaan potilaille, joilla on elektrolyyttihäiriöitä (esim. hypokalemia tai hypomagnesemia), kongestiivista sydämen vajaatoimintaa, bradyarytmiaa tai potilaille, jotka käyttävät muita QT-ajan pidentymiseen johtavia lääkkeitä [ks. KLIININEN FARMAKOLOGIA ].
Serotoniinin oireyhtymä
Serotoniinioireyhtymän kehittymistä on raportoitu käytettäessä pelkästään 5-HT3-reseptorin antagonisteja. Useimmat raportit on liitetty serotonergisten lääkkeiden samanaikaiseen käyttöön (esim. selektiiviset serotoniinin takaisinoton estäjät (SSRI), serotoniinin ja norepinefriinin takaisinoton estäjät (SNRI), monoamiinioksidaasin estäjät, mirtatsapiini, fentanyyli, litium, tramadoli ja suonensisäinen metyleenisininen. Jotkut raportoiduista tapauksista olivat kuolemaan johtaneita. Serotoniinioireyhtymää, joka ilmenee pelkän ZOFRAN 4 mg:n yliannostuksen yhteydessä, on myös raportoitu. Suurin osa 5-HT3-reseptoriantagonistien käyttöön liittyvistä serotoniinioireyhtymistä tapahtui anestesian jälkeisessä hoitoyksikössä tai infuusiokeskuksessa.
Serotoniinioireyhtymään liittyviä oireita voivat olla seuraavat merkkien ja oireiden yhdistelmät: mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia) , neuromuskulaariset oireet (esim. vapina, jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt), kohtaukset, joihin voi liittyä maha-suolikanavan oireita (esim. pahoinvointi, oksentelu, ripuli). Potilaita tulee tarkkailla serotoniinioireyhtymän ilmaantumisen varalta, erityisesti käytettäessä samanaikaisesti ZOFRAN 4 mg:aa ja muita serotonergisia lääkkeitä. Jos serotoniinioireyhtymän oireita ilmenee, lopeta ZOFRAN-hoito ja aloita tukihoito. Potilaille on kerrottava lisääntyneestä serotoniinioireyhtymän riskistä, erityisesti jos ZOFRANia käytetään samanaikaisesti muiden serotonergisten lääkkeiden kanssa (ks. HUUMEIDEN VUOROVAIKUTUKSET , YLIANNOSTUS ].
Progressiivisen ileuksen ja mahalaukun turvotuksen peittäminen
ZOFRANin käyttö potilailla vatsaleikkauksen jälkeen tai potilailla, joilla on kemoterapian aiheuttama pahoinvointi ja oksentelu, voi peittää etenevän suolestuksen ja/tai mahalaukun turvotuksen. Tarkkaile suoliston toiminnan heikkenemistä, erityisesti potilailla, joilla on maha-suolikanavan tukkeutumisen riskitekijöitä.
ZOFRAN 8mg ei ole lääke, joka stimuloi mahalaukun tai suoliston peristaltiikkaa. Sitä ei tule käyttää nenä-maha-imun sijasta.
Fenyyliketonuria
Fenyyliketonuriapotilaille tulee kertoa, että ZOFRAN ODT suussa hajoavat tabletit sisältävät fenyylialaniinia (aspartaamin ainesosa). Jokainen 4 mg:n ja 8 mg:n suussa hajoava tabletti sisältää alle 0,03 mg fenyylialaniinia.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Syöpää aiheuttavia vaikutuksia ei havaittu 2 vuotta kestäneissä tutkimuksissa rotilla ja hiirillä oraalisilla ondansetroniannoksilla 10 mg/kg/vrk ja 30 mg/kg/vrk (noin 4 ja 6 kertaa suurempi suositeltu ihmiselle suun kautta otettava annos 24 mg). päivässä kehon pinta-alan perusteella).
Ondansetroni ei ollut mutageeninen tavanomaisissa mutageenisuustesteissä.
Ondansetronin anto suun kautta 15 mg/kg:aan vuorokaudessa (noin 6 kertaa suurin suositeltu suun kautta otettava annos ihmiselle 24 mg/vrk, kehon pinta-alan perusteella) ei vaikuttanut uros- ja naarasrottien hedelmällisyyteen tai yleiseen lisääntymiskykyyn.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Julkaistut epidemiologiset tutkimukset ondansetronin käytön ja vakavien synnynnäisten epämuodostumien välisestä yhteydestä ovat raportoineet epäjohdonmukaisista löydöksistä ja niillä on tärkeitä metodologisia rajoituksia, jotka estävät johtopäätösten tekemisen ondanseronin käytön turvallisuudesta raskauden aikana (ks. Data ). Saatavilla olevat markkinoille tulon jälkeiset tiedot eivät ole tunnistaneet lääkkeeseen liittyvää keskenmenon tai haitallisten äitiysvaikutusten riskiä. Rotilla ja kaneilla tehdyt lisääntymistutkimukset eivät osoittaneet sikiölle aiheutuvia haittoja, kun ondansetronia annettiin organogeneesin aikana noin 6-kertaisena ja 24-kertaisena ihmiselle suun kautta otettavaan enimmäisannokseen 24 mg/vrk, kehon pinta-alan perusteella (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon taustariskiä mainitulla väestöllä ei tunneta. Kaikilla raskauksilla on taustariski synnynnäisille epämuodostumille, keskenmenoille tai muille haitallisille seurauksille. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenojen arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Data
Ihmistiedot
Saatavilla olevat tiedot ondansetronin käytöstä raskaana oleville naisille useista julkaistuista epidemiologisista tutkimuksista estävät arvioinnin lääkkeeseen liittyvästä haitallisten sikiövaikutusten riskistä johtuen merkittävistä metodologisista rajoituksista, mukaan lukien epävarmuus siitä, ottivatko reseptin kirjoittaneet naiset todella lääkkeen, samanaikainen käyttö. muista lääkkeistä tai hoidoista, muistamisharhasta ja muista säätämättömistä sekaannuksista.
Ondansetronialtistus kohdussa ei ole yhdistetty yleisiin vakaviin synnynnäisiin epämuodostumisiin kokonaisanalyysissä. Eräässä suuressa retrospektiivisessä kohorttitutkimuksessa tutkittiin 1970 naista, jotka saivat ondansetronin reseptin raskauden aikana, eikä raportoitu mitään yhteyttä ondansetronille altistumisen ja vakavien synnynnäisten epämuodostumien, keskenmenon, kuolleena synnytyksen, ennenaikaisen synnytyksen, alhaisen syntymäpainon tai raskausikään nähden pienten vauvojen välillä.
Kahdessa suuressa retrospektiivisessä kohorttitutkimuksessa ja yhdessä tapauskontrollitutkimuksessa on arvioitu ondansetronialtistusta ensimmäisen raskauskolmanneksen aikana ja sydän- ja verisuonivaurioiden riskiä epäjohdonmukaisin tuloksin. Suhteelliset riskit (RR) vaihtelivat välillä 0,97 (95 % CI 0,86 - 1,10) - 1,62 (95 % CI 1,04, 2,54). Eräässä kohorttitutkimuksessa tehdyssä alaryhmäanalyysissä havaittiin, että ondansetroni liittyi erityisesti sydämen väliseinän vaurioihin (RR 2,05, 95 % CI 1,19, 3,28); tätä yhteyttä ei kuitenkaan vahvistettu muissa tutkimuksissa.
Useat tutkimukset ovat arvioineet ondansetronin ja suun halkeamien riskiä epäjohdonmukaisin tuloksin. Yhdysvaltain Medicaid-tietokannassa tehty retrospektiivinen kohorttitutkimus, jossa käsiteltiin 1,8 miljoonaa raskautta, osoitti lisääntyneen suun halkeamien riskin 88 467 raskaudessa, joissa ondansetronia määrättiin suun kautta ensimmäisen kolmanneksen aikana (RR 1,24, 95 % CI 1,03, 1,48), mutta tällaista yhteyttä ei ollut. raportoitu suonensisäisellä ondansetronilla 23 866 raskaudessa (RR 0,95, 95 % CI 0,63, 1,43). Molempia antomuotoja saaneiden naisten alaryhmässä RR oli 1,07 (95 % CI 0,59, 1,93). Kahdessa tapauskontrollitutkimuksessa, joissa käytettiin sikiövaurioiden seurantaohjelmista saatuja tietoja, raportoitiin ristiriitaisista yhteyksistä äidin ondansetronin käytön ja eristetyn suulakihalkion välillä (OR 1,6 [95 % CI 1,1, 2,3] ja 0,5 [95 % CI 0,3, 1,0]). Ei tiedetä, tapahtuiko ondansetronin altistuminen kohdussa kitalaen muodostumisen aikana (suulaki muodostuu 6. ja 9. raskausviikon välillä).
Eläinten tiedot
Alkion ja sikiön kehitystutkimuksissa rotilla ja kaniineilla tiineille eläimille annettiin oraalisia annoksia ondansetronia enintään 15 mg/kg/vrk ja 30 mg/kg/vrk organogeneesin aikana. Ondansetronilla ei ollut merkittäviä vaikutuksia emoeläimiin tai jälkeläisten kehitykseen lukuun ottamatta pientä vähentymistä emon painonnousussa kaneilla. Annoksilla 15 mg/kg/vrk rotilla ja 30 mg/kg/vrk kaniineilla emon altistusmarginaali oli noin 6 ja 24 kertaa suurempi kuin ihmiselle suositeltu suurin suun kautta otettava annos 24 mg/vrk, kehon pinta-alan perusteella. .
Pre- ja postnataalisessa kehitystoksisuustutkimuksessa raskaana olevat rotat saivat ondansetronia suun kautta 15 mg/kg/vrk 17. tiineyspäivästä pentueen päivään 21. Lukuun ottamatta emon painonnousun lievää laskua, havaittiin ei vaikuta tiineisiin rottiin eikä niiden jälkeläisten pre- ja postnataaliseen kehitykseen, mukaan lukien paritetun F1-sukupolven lisääntymiskyky. Annoksella 15 mg/kg/vrk rotilla emon altistusmarginaali oli noin 6 kertaa suurempi kuin ihmisen suurin suositeltu suun kautta otettava annos 24 mg/vrk, kehon pinta-alan perusteella.
Imetys
Riskien yhteenveto
Ei tiedetä, erittyykö ondansetronia äidinmaitoon. ZOFRAN 8 mg:n vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon ei ole tietoa. On kuitenkin osoitettu, että ondansetronia on rottien maidossa. Kun lääkettä on eläimen maidossa, on todennäköistä, että lääkettä on äidinmaidossa.
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon äidin 4 mg:n ZOFRAN-annoksen kliinisen tarpeen ja ZOFRANin mahdollisten haitallisten vaikutusten kanssa imetettävään lapseen tai äidin taustalla olevaan sairauteen.
Käyttö lapsille
Suun kautta annetun ZOFRANin turvallisuus ja tehokkuus on osoitettu 4-vuotiailla ja sitä vanhemmilla lapsipotilailla kohtalaisen emetogeeniseen syövän kemoterapiaan liittyvän pahoinvoinnin ja oksentelun ehkäisyssä. ZOFRANin 4 mg:n käyttöä näissä ikäryhmissä tukevat riittävät ja hyvin kontrolloidut ZOFRAN-tutkimukset aikuisilla ja lisätiedot kolmesta avoimesta, kontrolloimattomasta, ei-yhdysvaltalaisesta tutkimuksesta 182 syöpäpotilaalla iältään 4–18-vuotiailla lapsipotilailla. joille annettiin erilaisia sisplatiini- tai ei-sisplatiinihoitoja [ks ANNOSTELU JA HALLINNOINTI , Kliiniset tutkimukset ].
Lisätietoja ondansetronin käytöstä lapsipotilailla on ZOFRAN-injektiovalmisteen ohjetiedoissa.
Suun kautta annetun ZOFRAN 4 mg:n turvallisuutta ja tehokkuutta ei ole osoitettu lapsipotilailla seuraavissa tapauksissa:
- erittäin emetogeeniseen syövän kemoterapiaan liittyvän pahoinvoinnin ja oksentelun ehkäisy
- sädehoitoon liittyvän pahoinvoinnin ja oksentelun ehkäisy
- postoperatiivisen pahoinvoinnin ja/tai oksentelun ehkäisy
Geriatrinen käyttö
Syövän kemoterapian aiheuttamasta ja leikkauksen jälkeisestä pahoinvointia ja oksentelua sairastavien potilaiden kokonaismäärästä Yhdysvalloissa ja ulkomailla kontrolloiduissa kliinisissä tutkimuksissa, joista tehtiin alaryhmäanalyysit, 938 (19 %) oli 65-vuotiaita tai vanhempia.
Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu 65-vuotiaiden sekä vanhempien ja nuorempien koehenkilöiden välillä. Puhdistuksen pieneneminen ja eliminaation puoliintumisajan pidentyminen havaittiin yli 75-vuotiailla potilailla verrattuna nuorempiin koehenkilöihin [ks. KLIININEN FARMAKOLOGIA ]. Kliinisissä tutkimuksissa ei ollut riittävästi yli 75-vuotiaita ja vanhempia potilaita, jotta turvallisuudesta tai tehokkuudesta olisi tehty päätelmiä tässä ikäryhmässä. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois. Annosta ei tarvitse muuttaa iäkkäillä potilailla.
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta.
Vaikeaa maksan vajaatoimintaa sairastavilla potilailla puhdistuma pienenee ja näennäinen jakautumistilavuus kasvaa, mikä johtaa ondanseronin puoliintumisajan merkittävään pidentymiseen. Siksi älä ylitä 8 mg:n päivittäistä kokonaisannosta potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-pistemäärä 10 tai enemmän) [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Annoksen muuttamista ei suositella potilaille, joilla on minkään asteista munuaisten vajaatoimintaa (lievä, kohtalainen tai vaikea). Ei ole kokemusta muusta kuin ondansetronin ensimmäisen päivän annosta [ks KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Ondansetronin yliannostukseen ei ole spesifistä vastalääkettä. Potilaita tulee hoitaa asianmukaisella tukihoidolla.
Yllä lueteltujen haittavaikutusten lisäksi seuraavia haittavaikutuksia on kuvattu ondansetronin yliannostuksen yhteydessä: "Äkillinen sokeus" (amauroosi), jonka kesto oli 2–3 minuuttia plus vaikea ummetus, esiintyi yhdellä potilaalla, jolle annettiin 72 mg ondansetronia laskimoon kerta-annoksena. Hypotensiota (ja pyörtymistä) ilmeni potilaalla, joka otti 48 mg ZOFRAN-tabletteja. Vain 4 minuutin ajan 32 mg:n infuusion jälkeen havaittiin vasovagaalinen episodi, johon liittyi ohimenevä toisen asteen sydänkatkos. Kaikissa tapauksissa haittavaikutukset hävisivät kokonaan.
Serotoniinioireyhtymän mukaisia lapsitapauksia on raportoitu pienten lasten tahattomien ondansetronin oraalisten yliannostusten jälkeen (arvioitu suurempi kuin 5 mg/kg). Raportoituja oireita olivat uneliaisuus, kiihtyneisyys, takykardia, takypnea, kohonnut verenpaine, punoitus, mydriaasi, hikoilu, myokloniset liikkeet, horisontaalinen nystagmus, hyperrefleksia ja kohtaukset. Potilaat tarvitsivat tukihoitoa, mukaan lukien joissakin tapauksissa intubaatio, ja he toipuivat täydellisesti ilman jälkiseurauksia 1–2 päivässä.
VASTA-AIHEET
ZOFRAN on vasta-aiheinen potilailla:
- tiedetään olevan yliherkkä (esim. anafylaksia) ondansetronille tai jollekin valmisteen aineosista [ks. HAITTAVAIKUTUKSET ]
- samanaikaisesti apomorfiinia syvän hypotension ja tajunnan menetyksen riskin vuoksi
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Ondansetroni on selektiivinen 5-HT3-reseptorin antagonisti. Vaikka sen vaikutusmekanismia ei ole täysin karakterisoitu, ondansetroni ei ole dopamiinireseptorin antagonisti. 5-HT3-tyypin serotoniinireseptoreita on sekä perifeerisesti emättimen hermopäätteissä että keskeisesti postreman alueen kemoreseptorin laukaisuvyöhykkeellä. Ei ole varmaa, välittyykö ondansetronin antiemeettinen vaikutus sentraalisesti, perifeerisesti vai molemmissa kohdissa. Sytotoksinen kemoterapia näyttää kuitenkin liittyvän serotoniinin vapautumiseen ohutsuolen enterokromafiinisoluista. Ihmisillä 5-hydroksi-indolietikkahapon (5-HIAA) erittyminen virtsaan lisääntyy sisplatiinin annon jälkeen samanaikaisesti oksentelun alkamisen kanssa. Vapautunut serotoniini voi stimuloida vagusafferentteja 5-HT3-reseptorien kautta ja käynnistää oksentelurefleksin.
Farmakodynamiikka
Terveillä koehenkilöillä 0,15 mg/kg ondansetronin suonensisäisillä kerta-annoksilla ei ollut vaikutusta ruokatorven motiliteettiin, mahalaukun motiliteettiin, alempaan ruokatorven sulkijalihaksen paineeseen tai ohutsuolen läpikulkuaikaan. Ondansetronin usean päivän annon on osoitettu hidastavan läpikulkua paksusuolessa terveillä koehenkilöillä. Ondansetroni ei vaikuta plasman prolaktiinipitoisuuksiin.
Sydämen elektrofysiologia
QTc-ajan pidentymistä tutkittiin kaksoissokkoutetussa, kerta-laskimoannos-, lumelääke- ja positiivisesti kontrolloidussa ristikkäistutkimuksessa 58 terveellä koehenkilöllä. Suurin keskimääräinen (95 %:n ylempi luottamusraja) QTcF-ero lumelääkkeeseen verrattuna lähtötason korjauksen jälkeen oli 19,5 (21,8) millisekuntia ja 5,6 (7,4) millisekuntia 15 minuutin 32 mg:n ja 8 mg:n ondansetroni-injektion jälkeen. Ondansetronipitoisuuden ja ΔΔQTcF:n välillä havaittiin merkittävä altistus-vastesuhde. Vakiintunutta altistus-vastesuhdetta käytettäessä 24 mg:n annoksella, joka infusoitiin suonensisäisesti 15 minuutin aikana, keskimääräinen ennustettu (95 % ylempi ennusteväli) ΔΔQTcF oli 14,0 (16,3) millisekuntia. Sitä vastoin 16 mg:n annoksella, joka infusoitiin suonensisäisesti 15 minuutin aikana samaa mallia käyttäen, keskimääräinen ennustettu (95 % ylempi ennusteväli) ΔΔQTcF oli 9,1 (11,2) millisekuntia. Tässä tutkimuksessa 15 minuutin aikana infusoitu 8 mg:n annos ei pidentänyt QT-aikaa kliinisesti merkittävässä määrin.
Farmakokinetiikka
Imeytyminen
Ondansetroni imeytyy maha-suolikanavasta ja käy läpi jonkin verran ensikierron metaboliaa. Keskimääräinen hyötyosuus terveillä koehenkilöillä yhden 8 mg:n tabletin annon jälkeen on noin 56 %.
Ondansetronin systeeminen altistus ei kasva suhteessa annokseen. Käyrän alla oleva pinta-ala (AUC) 16 mg:n tabletilla oli 24 % suurempi kuin ennustettiin 8 mg:n tabletin annoksella. Tämä saattaa johtua siitä, että ensikierron metabolia on hidastunut suuremmilla oraalisilla annoksilla.
Ruoan vaikutukset
Biosaatavuutta lisää hieman myös ruoan läsnäolo.
Jakelu
Ondansetronin sitoutuminen plasman proteiineihin in vitro mitattuna oli 70-76 % konsentraatioalueella 10-500 ng/ml. Kierrettävä lääkeaine jakautuu myös punasoluihin.
Eliminointi
Aineenvaihdunta ja erittyminen
Ondansetroni metaboloituu laajalti ihmisissä, ja noin 5 % radioaktiivisesti leimatusta annoksesta erittyy lähtöaineena virtsasta. Metaboliitit havaitaan virtsassa. Ensisijainen aineenvaihduntareitti on indolirenkaan hydroksylaatio, jota seuraa glukuronidi- tai sulfaattikonjugaatio.
In vitro -metaboliatutkimukset ovat osoittaneet, että ondansetroni on substraatti ihmisen maksan sytokromi P-450 -entsyymeille, mukaan lukien CYP1A2, CYP2D6 ja CYP3A4. Ondansetronin kokonaisliikevaihdossa CYP3A4:llä oli hallitseva rooli. Ondansetronia metaboloivien metabolisten entsyymien moninkertaisuuden vuoksi on todennäköistä, että yhden entsyymin eston tai häviäminen (esim. CYP2D6:n geneettinen puutos) kompensoidaan toisilla ja saattaa johtaa vain vähäiseen muutoksiin ondanseronin eliminaation kokonaisnopeudessa.
Vaikka joillakin konjugoimattomilla metaboliiteilla on farmakologista aktiivisuutta, niitä ei löydy plasmasta pitoisuuksina, jotka todennäköisesti edistäisivät merkittävästi ondansetronien biologista aktiivisuutta.
Tietyt populaatiot
Ikä: Vanhempi väestö
Puhdistuksen pienenemistä ja eliminaation puoliintumisajan pidentymistä havaitaan yli 75-vuotiailla potilailla nuorempiin koehenkilöihin verrattuna [ks. Käyttö tietyissä populaatioissa ].
Seksiä
Sukupuolten välisiä eroja havaittiin kerta-annoksena annetun ondansetronin jakautumisessa. Imeytymisen laajuus ja nopeus ovat suurempia naisilla kuin miehillä. Naisten hitaampi puhdistuma, pienempi näennäinen jakautumistilavuus (painoon sovitettuna) ja korkeampi absoluuttinen hyötyosuus johtivat korkeampiin plasman ondansetronipitoisuuksiin. Nämä korkeammat plasmapitoisuudet voivat osittain selittyä miesten ja naisten ruumiinpainoeroilla. Ei tiedetä, olivatko nämä sukupuoleen liittyvät erot kliinisesti tärkeitä. Tarkemmat farmakokineettiset tiedot ovat taulukoissa 5 ja 6.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan ei odoteta vaikuttavan merkittävästi ondansetronin kokonaispuhdistumaan, koska munuaispuhdistuma on vain 5 % kokonaispuhdistumasta. Ondansetronin keskimääräinen plasmapuhdistuma pieneni kuitenkin noin 50 % potilailla, joilla oli vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 30 ml/min). Puhdistuksen pieneneminen oli vaihtelevaa, eikä se ollut yhdenmukainen puoliintumisajan pidentymisen kanssa [katso Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Potilailla, joilla on lievä tai keskivaikea maksan vajaatoiminta, puhdistuma pienenee kaksinkertaiseksi ja keskimääräinen puoliintumisaika pitenee 11,6 tuntiin verrattuna 5,7 tuntiin terveillä koehenkilöillä. Potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-pistemäärä 10 tai enemmän), puhdistuma pienenee 2-3-kertaiseksi ja näennäinen jakautumistilavuus kasvaa, minkä seurauksena puoliintumisaika pitenee 20 tuntiin [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
CYP 3A4:n indusoijat
Sytokromi P-450:n indusoijat voivat vaikuttaa ondansetroni eliminaatioon. Farmakokineettisessä tutkimuksessa, johon osallistui 16 epilepsiapotilasta, jotka saivat kroonisesti CYP3A4-induktoreita, karbamatsepiinia tai fenytoiinia, havaittiin ondansetronin AUC:n, Cmax:n ja t½:n pienenemistä. Tämä johti ondansetronin puhdistuman merkittävään lisääntymiseen. Tämän nousun ei kuitenkaan uskota olevan kliinisesti merkityksellistä [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Kemoterapeuttiset aineet
Karmustiini, etoposidi ja sisplatiini eivät vaikuta ondanseronin farmakokinetiikkaan [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Antasidit
Antasidien samanaikainen käyttö ei muuta ondansetronin imeytymistä.
Kliiniset tutkimukset
Kemoterapian aiheuttaman pahoinvoinnin ja oksentelun ehkäisy
Erittäin emetogeeninen kemoterapia
Kahdessa satunnaistetussa, kaksoissokkoutetussa, monoterapiatutkimuksessa kerta-annos ZOFRANia 24 mg:n oraalinen annos oli parempi kuin relevantti historiallinen lumelääkekontrolli pahoinvoinnin ja oksentelun ehkäisyssä, joka liittyi erittäin emetogeeniseen syövän kemoterapiaan, mukaan lukien sisplatiini, joka oli suurempi tai yhtä suuri kuin 50 mg/m². Steroidien antaminen suljettiin pois näistä kliinisistä tutkimuksista. Yli 90 % potilaista, jotka saivat 50 mg/m²:n tai suurempia sisplatiiniannoksia historiallisessa lumelääkkeessä, koki oksentelua ilman antiemeettistä hoitoa.
Ensimmäisessä tutkimuksessa verrattiin 24 mg:n ondansetronin oraalisia annoksia kerta-annoksena, 8 mg:n 8 tunnin välein 2 annosta ja 32 mg:n kerta-annoksena 357 aikuisella syöpäpotilaalla, jotka saivat kemoterapiahoitoja, jotka sisälsivät sisplatiinia vähintään 50 mg/m². . Ensimmäinen tai yksittäinen annos annettiin 30 minuuttia ennen kemoterapiaa. Yhteensä 66 % potilaista ryhmässä, joka sai ondansetronia 24 mg kerran vuorokaudessa, 55 % ondansetronia 8 mg kahdesti vuorokaudessa saaneiden ryhmässä ja 55 % ondansetronin 32 mg kerran vuorokaudessa saaneiden ryhmässä, valmistui. 24 tunnin koeaika, jossa 0 oksentelujaksoa ja ei pelastavia antiemeettisiä lääkkeitä, tehon ensisijainen päätetapahtuma. Jokaisen kolmesta hoitoryhmästä osoitettiin olevan tilastollisesti merkitsevästi parempi kuin historiallinen lumelääkekontrolli.
Samassa tutkimuksessa 56 %:lla potilaista, jotka saivat kerta-annoksen 24 mg ondansetronia suun kautta, ei esiintynyt pahoinvointia 24 tunnin tutkimusjakson aikana, kun taas 36 %:lla potilaista, jotka saivat suun kautta ondansetronia 8 mg kahdesti vuorokaudessa. P = 0,001) ja 50 % oraalisen ondansetronin 32 mg kerran päivässä -ryhmässä. Annostusohjelmia ZOFRAN 8 mg kahdesti vuorokaudessa ja 32 mg kerran vuorokaudessa ei suositella pahoinvoinnin ja oksentelun ehkäisyyn, joka liittyy voimakkaasti emetogeeniseen kemoterapiaan [ks. ANNOSTELU JA HALLINNOINTI ].
Toisessa tutkimuksessa vahvistettiin ZOFRANin 4 mg:n kerta-annoksen 24 mg:n oraalisen annoksen teho pahoinvoinnin ja oksentelun ehkäisyssä, joka liittyy erittäin emetogeeniseen syövän kemoterapiaan, mukaan lukien sisplatiini, joka on suurempi tai yhtä suuri kuin 50 mg/m².
Kohtalaisen emetogeeninen kemoterapia
Yhdysvalloissa suoritettiin satunnaistettu lumekontrolloitu kaksoissokkotutkimus 67 potilaalla, jotka saivat syklofosfamidipohjaista kemoterapiahoitoa, joka sisälsi doksorubisiinia. Ensimmäinen 8 mg:n ZOFRAN-annos 8 mg annettiin 30 minuuttia ennen solunsalpaajahoidon aloittamista, ja seuraava annos 8 tuntia ensimmäisen annoksen jälkeen, mitä seurasi 8 mg ZOFRANia 8 mg kahdesti päivässä 2 päivän ajan kemoterapian päättymisen jälkeen.ZOFRAN oli merkittävästi tehokkaampi kuin lumelääke oksentamisen estämisessä. Hoitovaste perustui oksentelujaksojen kokonaismäärään 3 päivän koejakson aikana. Tämän kokeen tulokset on yhteenveto taulukossa 7.
Yhdysvaltalaisessa kaksoissokkotutkimuksessa, johon osallistui 336 potilasta, jotka saivat joko metotreksaattia tai doksorubisiinia sisältävää syklofosfamidipohjaista kemoterapiahoitoa, ZOFRAN 8 mg kahdesti vuorokaudessa annettuna oli yhtä tehokas kuin ZOFRAN 8 mg annettuna 3 kertaa päivässä pahoinvoinnin ja oksentelun ehkäisemisessä. ZOFRAN 8 mg kolme kertaa vuorokaudessa ei ole suositeltava hoito-ohjelma kohtalaisen oksentelua aiheuttavan kemoterapian hoitoon [ks. ANNOSTELU JA HALLINNOINTI ].
Hoitovaste perustui oksentelujaksojen kokonaismäärään 3 päivän koejakson aikana. Katso taulukosta 8 tarkat tiedot tutkituista annostusohjelmista ja tämän kokeen tuloksista.
Uudelleenkäsittely
Yksihaaratutkimuksissa 148 potilasta, jotka saivat syklofosfamidipohjaista kemoterapiaa, saivat ZOFRANia uudelleen 8 mg:lla kolme kertaa vuorokaudessa seuraavan solunsalpaajahoidon aikana yhteensä 396 uusintahoitojakson ajan. Emeettisiä jaksoja ei esiintynyt 314:ssä (79 %) uusintahoitokunnissa, ja vain 1-2 oksentelua esiintyi 43:lla (11 %) uusintahoitokursseista.
Pediatriset kokeet
Kolme avointa, yksihaaraista, ei-USA-tutkimusta on suoritettu 182:lla 4–18-vuotiaalla syöpäpotilaalla, joille annettiin erilaisia sisplatiini- tai ei-sisplatiinihoito-ohjelmia. ZOFRANin 4 mg:n injektion aloitusannos vaihteli välillä 0,04–0,87 mg/kg (kokonaisannos 2,16–12 mg), minkä jälkeen annettiin ZOFRANin 4–24 mg:n suun kautta vuorokaudessa 3 päivän ajan. Näissä tutkimuksissa 58 %:lla 170 arvioidusta potilaasta oli täydellinen vaste (ei oksentelujaksoja) päivänä 1. Kahdessa tutkimuksessa vasteprosentti ZOFRANiin 4 mg kolme kertaa vuorokaudessa alle 12-vuotiailla potilailla oli samanlainen kuin ZOFRAN 8:lla. mg kolme kertaa päivässä 12–18-vuotiaille potilaille. Oksentamisen ehkäisy näillä lapsipotilailla oli olennaisesti sama kuin aikuisilla.
Säteilyn aiheuttama pahoinvointi ja oksentelu
Koko kehon säteilytys
Satunnaistetussa lumekontrolloidussa kaksoissokkotutkimuksessa 20 potilaalle 8 mg ZOFRANia annettuna 1,5 tuntia ennen jokaista sädehoidon fraktiota 4 päivän ajan oli merkitsevästi lumelääkettä tehokkaampi estämään koko kehon säteilytyksen aiheuttamaa oksentelua. Koko kehon säteilytys koostui 11 fraktiosta (120 cGy per fraktio) 4 päivän aikana, yhteensä 1 320 cGy. Potilaat saivat 3 fraktiota 3 päivän ajan, sitten 2 fraktiota päivänä 4.
Yhden suuren annoksen sädehoito
Aktiivisella kontrolloidussa kaksoissokkotutkimuksessa, johon osallistui 105 potilasta, jotka saivat kerta-annoksena suurannoksista sädehoitoa (800-1000 cGy) vatsan etu- tai takakentällä, joka oli suurempi tai yhtä suuri kuin 80 cm², ZOFRAN 4 mg oli merkittävästi tehokkaampi. kuin metoklopramidi oksentamisen täydellisessä hallinnassa (0 oksentelujaksoa). Potilaat saivat ensimmäisen annoksen ZOFRANia (8 mg) tai metoklopramidia (10 mg) 1–2 tuntia ennen sädehoitoa. Jos sädehoitoa annettiin aamulla, 8 mg ZOFRANia 8 mg tai 10 mg metoklopramidia annettiin myöhään iltapäivällä ja toistettiin ennen nukkumaanmenoa. Jos sädehoitoa annettiin iltapäivällä, potilaat ottivat 8 mg ZOFRAN 4 mg tai 10 mg metoklopramidia vain kerran ennen nukkumaanmenoa. Potilaat jatkoivat suun kautta otettavaa lääkitystä kolmesti päivässä 3 päivän ajan.
Päivittäinen fraktioitu sädehoito
Aktiivikontrolloidussa kaksoissokkotutkimuksessa, johon osallistui 135 potilasta, jotka saivat 1–4 viikon fraktioitua sädehoitoa (180 cGy:n annokset) vatsan alueella, joka oli suurempi tai yhtä suuri kuin 100 cm², ZOFRAN 4 mg oli merkitsevästi. tehokkaampi kuin proklooriperatsiini oksentamisen täydellisessä hallinnassa (0 oksentelua). Potilaat saivat ensimmäisen annoksen ZOFRANia (8 mg) tai proklooriperatsiinia (10 mg) 1–2 tuntia ennen ensimmäistä päivittäistä sädehoitofraktiota, minkä jälkeen 8 mg:n annokset noin 8 tunnin välein jokaisena sädehoitopäivänä.
Leikkauksen jälkeinen pahoinvointi ja oksentelu
Kahdessa lumekontrolloidussa kaksoissokkotutkimuksessa (toinen tehtiin Yhdysvalloissa ja toinen Yhdysvaltojen ulkopuolella) 865 naiselle, joille tehtiin sairaalakirurgisia toimenpiteitä, ZOFRANia annettiin 16 mg kerta-annoksena tai lumelääkettä tuntia ennen yleisen tasapainon induktiota. anestesia (barbituraatti, opioidi, typpioksiduuli, neuromuskulaarinen salpaus ja lisäisofluraani tai enfluraani), ZOFRAN-tabletit olivat merkittävästi tehokkaampia kuin lumelääke leikkauksen jälkeisen pahoinvoinnin ja oksentelun estämisessä.
Miehillä ei ole tehty kokeita.
POTILASTIEDOT
QT-ajan pidentyminen
Kerro potilaille, että ZOFRAN voi aiheuttaa vakavia sydämen rytmihäiriöitä, kuten QT-ajan pidentymistä. Neuvo potilaita kertomaan välittömästi terveydenhuollon tarjoajalleen, jos he havaitsevat muutoksen sydämessään, jos he tuntevat pyörrytystä tai jos heillä on pyörtymäkohtaus [ks. VAROITUKSET JA VAROTOIMET ].
Yliherkkyysreaktiot
Kerro potilaille, että ZOFRAN 4 mg voi aiheuttaa yliherkkyysreaktioita, joista jotkut ovat niinkin vakavia kuin anafylaksia ja bronkospasmi. Neuvo potilaita ilmoittamaan välittömästi terveydenhuollon tarjoajalleen kaikista yliherkkyysreaktioiden merkeistä ja oireista, mukaan lukien kuume, vilunväristykset, ihottuma tai hengitysvaikeudet [ks. VAROITUKSET JA VAROTOIMET ].
Progressiivisen ileuksen ja mahalaukun turvotuksen peittäminen
Kerro potilaille vatsaleikkauksen jälkeen tai potilaille, joilla on kemoterapian aiheuttamaa pahoinvointia ja oksentelua, että ZOFRAN 4mg voi peittää suolitukoksen merkit ja oireet. Neuvo potilaita ilmoittamaan välittömästi terveydenhuollon tarjoajalleen kaikista mahdollisista suolen tukkeumiin liittyvistä merkeistä tai oireista [katso VAROITUKSET JA VAROTOIMET ].
Huumeiden vuorovaikutukset
- Neuvo potilasta ilmoittamaan terveydenhuollon tarjoajalleen kaikkien lääkkeiden, erityisesti apomorfiinin, käytöstä. Apomorfiinin ja ZOFRANin samanaikainen käyttö voi aiheuttaa merkittävän verenpaineen laskun ja tajunnan menetyksen.
- Kerro potilaille serotoniinioireyhtymän mahdollisuudesta, kun ZOFRAN 8 mg:aa käytetään samanaikaisesti jonkin muun serotonergisen aineen, kuten masennuksen ja migreenin hoitoon tarkoitettujen lääkkeiden kanssa. Neuvo potilaita hakeutumaan välittömästi lääkärin hoitoon, jos seuraavia oireita ilmenee: mielentilan muutokset, autonominen epävakaus, hermo-lihasoireet ruoansulatuskanavan oireilla tai ilman [ks. VAROITUKSET JA VAROTOIMET ].
ZOFRAN 4 mg ODT suun kautta hajoavien tablettien anto
Pyydä potilaita olemaan poistamatta suussa hajoavia ZOFRAN 4 mg ODT -tabletteja läpipainopakkauksesta vasta juuri ennen annostelua.
- Älä yritä työntää ZOFRAN 8mg ODT suussa hajoavia tabletteja kalvotaustan läpi.
- Irrota kuivin käsin 1 läpipainopakkauksen foliotausta ja poista tabletti varovasti.
- Aseta ZOFRAN ODT suussa hajoava tabletti välittömästi kielen päälle, jossa se liukenee sekunneissa, ja niele sitten syljen kanssa.
- Annostelu nesteen kanssa ei ole välttämätöntä.
- Irrotettavat kuvitetut tarrat on kiinnitetty reseptin mukana toimitettavaan tuotepakkaukseen tuotteen asianmukaisen käytön ja käsittelyn varmistamiseksi.
