Xeloda 500mg Capecitabine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Xeloda 500mg on ja miten sitä käytetään?
Xeloda on reseptilääke, jota käytetään syöpien, kuten paksusuolensyövän, paksusuolensyövän ja rintasyövän, oireiden hoitoon. Xelodaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Xeloda kuuluu lääkeluokkaan, jota kutsutaan antineoplastiksi, antimetaboliitiksi.
Ei tiedetä, onko Xeloda 500 mg turvallinen ja tehokas lapsille.
Mitkä ovat Xeloda 500 mg:n mahdolliset sivuvaikutukset?
Xeloda voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kuume yli 100,5 astetta,
- pahoinvointi,
- ruokahalun menetys,
- syö paljon vähemmän kuin tavallisesti,
- oksentelu (useammin kuin kerran 24 tunnissa),
- vaikea ripuli (useammin kuin 4 kertaa päivässä tai yön aikana),
- rakkuloita tai haavaumia suussasi,
- punaiset tai turvonneet ikenet,
- nielemisvaikeuksia,
- kipu, arkuus, punoitus, turvotus, rakkuloita tai ihon hilseily käsissäsi tai jaloissasi,
- tuntuu kovasti janoiselta tai kuumalta,
- kyvyttömyys virtsata,
- voimakas hikoilu,
- kuuma ja kuiva iho,
- rintakipu tai paine,
- epätasaiset sydämenlyönnit,
- hengenahdistus,
- turvotus tai nopea painonnousu,
- kivulias tai vaikea virtsaaminen,
- turvotus jaloissasi tai nilkoissasi,
- väsynyt olo,
- hengenahdistus,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- kuumetta tai muita flunssan oireita,
- yskä,
- ihohaavat,
- kalpea iho,
- helppo mustelma,
- epätavallinen verenvuoto,
- huima olo,
- nopea syke,
- kipeä kurkku,
- turvotus kasvoissasi tai kielessäsi,
- polttaa silmissäsi ja
- ihokipu, jota seuraa punainen tai violetti ihottuma (erityisesti kasvoissa tai ylävartalossa) ja joka aiheuttaa rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Xeloda 500 mg:n yleisimmät sivuvaikutukset ovat:
- vatsakipu,
- ummetus,
- vatsavaivat,
- väsynyt tunne,
- lievä ihottuma ja
- tunnottomuutta tai pistelyä käsissäsi tai jaloissasi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Xelodan mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
XELODAN JA WARFARININ VUOROVAIKUTUS
XELODA 500 mg varfariini Yhteisvaikutukset: Potilaiden, jotka saavat samanaikaisesti kapesitabiinia ja oraalista kumariinijohdannaista antikoagulanttihoitoa, on seurattava antikoagulanttivastetta (INR tai protrombiiniaika) usein, jotta antikoagulanttiannosta voidaan muuttaa vastaavasti. Kliinisesti tärkeä XELODAn ja varfariinin lääkkeiden yhteisvaikutus osoitettiin kliinisessä farmakologisessa tutkimuksessa [ks. VAROITUKSET JA VAROTOIMET ja huumeiden vuorovaikutus]. Muuttuneita hyytymisparametreja ja/tai verenvuotoa, mukaan lukien kuolema, on raportoitu potilailla, jotka ovat saaneet XELODA 500 mg samanaikaisesti kumariinijohdannaisten antikoagulanttien, kuten varfariinin ja fenprokumonin, kanssa. Markkinoille tulon jälkeiset raportit ovat osoittaneet kliinisesti merkitsevää pidentymistä protrombiiniajassa (PT) ja INR:ssä potilailla, joiden antikoagulantit stabiloituivat XELODA 500 mg:n käyttöönoton yhteydessä. Nämä tapahtumat ilmenivät useiden päivien ja jopa useiden kuukausien kuluessa XELODA 500 mg -hoidon aloittamisesta ja joissakin tapauksissa kuukauden sisällä XELODA-hoidon lopettamisesta. Näitä tapahtumia esiintyi potilailla, joilla oli maksametastaasseja tai ei niitä. Yli 60-vuotias ikä ja syöpädiagnoosi altistavat potilaan kohonneen koagulopatian riskin.
KUVAUS
XELODA (kapesitabiini) on fluoripyrimidiinikarbamaatti, jolla on antineoplastista vaikutusta. Se on suun kautta annettava systeeminen 5'-deoksi-5-fluorouridiinin (5'-DFUR) aihiolääke, joka muunnetaan 5-fluorourasiiliksi.
Kapesitabiinin kemiallinen nimi on 5'-deoksi-5-fluori-N-[(pentyylioksi)karbonyyli]sytidiini ja sen molekyylipaino on 359,35. Kapesitabiinilla on seuraava rakennekaava:
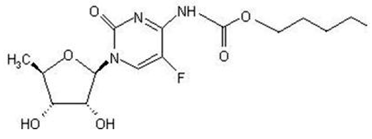
Kapesitabiini on valkoinen tai luonnonvalkoinen kiteinen jauhe, jonka vesiliukoisuus on 26 mg/ml 20 °C:ssa.
XELODA toimitetaan kaksoiskuperina, pitkänomaisina kalvopäällysteisinä tabletteina suun kautta annettaviksi. Jokainen vaalea persikanvärinen tabletti sisältää 150 mg kapesitabiinia ja yksi persikanvärinen tabletti sisältää 500 mg kapesitabiinia. XELODAn inaktiivisia aineosia ovat: vedetön laktoosi, kroskarmelloosinatrium, hydroksipropyylimetyyliselluloosa, mikrokiteinen selluloosa, magnesiumstearaatti ja puhdistettu vesi. Persikka- tai vaalea persikkakalvopinnoite sisältää hydroksipropyylimetyyliselluloosaa, talkkia, titaanidioksidia ja synteettisiä keltaisia ja punaisia rautaoksideja.
INDIKAATIOT
Peräsuolen syöpä
- XELODA on tarkoitettu yksittäiseksi lääkkeeksi adjuvanttihoitoon Dukesin C-koolonsyöpäpotilaille, joille on tehty täydellinen primaarisen kasvaimen resektio, kun pelkkä fluoripyrimidiinihoito on edullinen. XELODA 500 mg ei ollut huonompi kuin 5-fluorourasiili ja leukovoriini (5-FU/LV) taudista vapaan eloonjäämisen (DFS) suhteen. Lääkäreiden tulee ottaa huomioon yhdistelmäkemoterapiatutkimusten tulokset, jotka ovat osoittaneet parantumista DFS:ssä ja OS:ssä, kun he määräävät yksittäistä XELODA 500 mg:aa Dukesin C-koolonsyövän adjuvanttihoitoon.
- XELODA 500 mg on tarkoitettu ensilinjan hoitoon potilaille, joilla on metastasoitunut kolorektaalinen karsinooma, kun pelkkä fluoripyrimidiinihoito on parempi. Yhdistelmäkemoterapia on osoittanut eloonjäämishyötyä verrattuna pelkkään 5-FU/LV-hoitoon. XELODA 500 mg:n monoterapialla ei ole osoitettu eloonjäämishyötyä verrattuna 5-FU/LV-arvoon. XELODAn käyttöä 5FU/LV:n sijaan yhdistelmänä ei ole tutkittu riittävästi turvallisuuden tai eloonjäämisedun säilyttämisen varmistamiseksi.
Rintasyöpä
- XELODA yhdessä dosetakselin kanssa on tarkoitettu metastasoituneen rintasyövän hoitoon, kun aikaisempi antrasykliiniä sisältävä kemoterapia on epäonnistunut.
- XELODA 500 mg monoterapia on tarkoitettu myös sellaisten potilaiden hoitoon, joilla on metastaattinen rintasyöpä, joka on resistentti sekä paklitakselille että antrasykliiniä sisältävälle kemoterapia-ohjelmalle tai resistentti paklitakselille ja joille ei ole aiheellista jatkohoitoa antrasykliinille (esim. potilaille, jotka ovat saaneet kumulatiivisia annoksia 400 mg/m2 doksorubisiinia tai doksorubisiinin ekvivalentteja). Resistenssi määritellään eteneväksi sairaudeksi hoidon aikana, alkuvasteen kanssa tai ilman, tai uusiutumisena 6 kuukauden kuluessa antrasykliiniä sisältävän adjuvanttihoidon päättymisestä.
ANNOSTELU JA HALLINNOINTI
Tärkeät hallintaohjeet
XELODA-tabletit tulee niellä kokonaisina veden kera 30 minuutin kuluessa aterian jälkeen. XELODA 500mg on sytotoksinen lääke. Noudata soveltuvia erityisiä käsittely- ja hävittämismenettelyjä.1 Jos XELODA 500 mg -tabletit on leikattava tai murskattava, sen saa tehdä ammattihenkilö, joka on koulutettu sytotoksisten lääkkeiden turvalliseen käsittelyyn asianmukaisia laitteita ja turvatoimenpiteitä käyttäen. XELODA-annos lasketaan kehon pinta-alan mukaan.
Normaali aloitusannos
Monoterapia (metastaattinen paksusuolen syöpä, adjuvantti kolorektaalisyöpä, etäpesäkkeinen rintasyöpä)
Suositeltu XELODAn annos on 1250 mg/m2 suun kautta kahdesti vuorokaudessa (aamulla ja illalla; vastaa 2500 mg/m2 kokonaisvuorokausiannosta) 2 viikon ajan, jota seuraa 1 viikon tauko 3 viikon sykleinä (katso ).
Dukesin C paksusuolensyöpäpotilaiden liitännäishoitoa suositellaan yhteensä 6 kuukauden ajan [eli XELODA 1250 mg/m2 suun kautta kahdesti vuorokaudessa 2 viikon ajan, minkä jälkeen seuraa 1 viikon tauko, yhteensä 3 viikon jaksoina. 8 sykliä (24 viikkoa)].
Yhdessä doketakselin kanssa (metastaattinen rintasyöpä)
Yhdistettynä dosetakselin kanssa suositeltu XELODAn annos on 1250 mg/m2 kahdesti vuorokaudessa 2 viikon ajan, jota seuraa 1 viikon tauko, yhdistettynä dosetakselin annokseen 75 mg/m2 1 tunnin laskimonsisäisenä infuusiona kolmen viikon välein. Esilääkitys on dosetakselimerkinnän mukaan aloitettava ennen dosetakselin antamista potilaille, jotka saavat XELODAn ja dosetakselin yhdistelmää. näyttää XELODAn kokonaisvuorokausiannoksen kehon pinta-alan mukaan ja kullakin annoksella otettavien tablettien lukumäärän.
Annoksen hallintaohjeet
Kenraali
XELODAn annostus voi olla tarpeen yksilöidä potilaan hoidon optimoimiseksi. Potilaita on seurattava huolellisesti toksisuuden varalta, ja XELODA 500 mg:n annosta tulee muuttaa tarpeen mukaan potilaan yksilöllisen hoidon sietokyvyn mukaan [ks. Kliiniset tutkimukset ]. XELODA 500 mg:n antamisen aiheuttamaa toksisuutta voidaan hallita oireenmukaisella hoidolla, annoksen keskeytyksellä ja XELODAn annosta säätämällä. Kun annosta on pienennetty, sitä ei saa lisätä myöhemmin. Myrkyllisyyden vuoksi pois jätettyjä XELODA 500 mg -annoksia ei korvata tai palauteta; sen sijaan potilaan tulee jatkaa suunniteltujen hoitojaksojen mukaisesti.
Fenytoiinin annosta ja kumariinijohdannaisten antikoagulanttien annosta on ehkä pienennettävä, kun jompaakumpaa lääkettä annetaan samanaikaisesti XELODAn kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Monoterapia (metastaattinen paksusuolen syöpä, adjuvantti kolorektaalisyöpä, etäpesäkkeinen rintasyöpä)
Haittavaikutusten hallintaan suositellaan alla kuvattua XELODAn annosmuutosohjelmaa (katso ).
Yhdessä doketakselin kanssa (metastaattinen rintasyöpä)
XELODA 500 mg:n annosmuutoksia toksisuuden vuoksi tulee tehdä edellä olevan XELODAn mukaisesti. Jos hoitojakson alussa joko XELODA 500 mg:n tai dosetakselin hoidon viivästyminen on aiheellista, molempien lääkkeiden antoa tulee lykätä, kunnes molempien lääkkeiden uudelleen aloittamisen vaatimukset täyttyvät.
Doketakselin annoksen pienennysaikataulu, kun sitä käytetään yhdessä XELODAn kanssa metastaattisen rintasyövän hoitoon, on esitetty taulukossa 3.
Aloitusannoksen säätäminen erityisryhmissä
Munuaisten vajaatoiminta
XELODA 500 mg:n aloitusannosta ei suositella potilaille, joilla on lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma = 51-80 ml/min [Cockroft ja Gault, kuten alla on esitetty]). Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (peruskreatiniinipuhdistuma = 30-50 ml/min) annosta pienennetään 75 %:iin XELODAn aloitusannoksesta, kun sitä käytetään monoterapiana tai yhdessä dosetakselin kanssa (1250 mg/m2 - 950 mg/m2). kahdesti päivässä) suositellaan [katso Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ]. Myöhempää annoksen muuttamista suositellaan ohjeen mukaisesti ja (hoito-ohjelmasta riippuen), jos potilaalle kehittyy asteen 2–4 haittavaikutus [ks. VAROITUKSET JA VAROTOIMET ]. Aloitusannoksen säätösuositukset potilaille, joilla on kohtalainen munuaisten vajaatoiminta, koskevat sekä XELODA 500 mg monoterapiaa että XELODA 500 mg yhdistelmähoitoa dosetakselin kanssa.
Cockroftin ja Gaultin yhtälö:
Geriatria
Lääkäreiden tulee noudattaa varovaisuutta XELODA 500 mg:n vaikutusten seurannassa vanhuksilla. Tietoja ei ole riittävästi annossuosituksen antamiseksi.
MITEN TOIMITETAAN
Annostusmuodot Vahvuudet
XELODA toimitetaan kaksoiskuperina, pitkänomaisina kalvopäällysteisinä tabletteina suun kautta annettaviksi. Jokainen vaalea persikanvärinen tabletti sisältää 150 mg kapesitabiinia ja jokainen persikanvärinen tabletti sisältää 500 mg kapesitabiinia.
150 mg
Väri: Vaalea persikka Kaiverrus: XELODA toisella puolella ja 150 toisella 150 mg tabletit on pakattu 60 ( NDC 0004-1100-20), yksittäin pakattuna laatikkoon.
500 mg
Väri: Persikka Kaiverrus: XELODA 500mg toisella puolella ja 500mg toisella 500mg tabletit on pakattu 120 ( NDC 0004-1101-50), yksittäin pakattuna laatikkoon.
Varastointi ja käsittely
Säilytä 25°C (77°F); sallitaan 15° - 30°C (59° - 86°F). [Katso USP Controlled Room Temperature]. PIDÄ TIIVIN SULJETTUNA.
XELODA on sytotoksinen lääke. Noudata soveltuvia erityisiä käsittely- ja hävittämismenettelyjä.1 Käyttämätön tuote tulee hävittää paikallisten vaatimusten tai lääkkeiden takaisinotto-ohjelmien mukaisesti.
VIITTEET
1. "OSHA Hazardous Drugs." OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Jakelija: Genentech USA, Inc. Roche Groupin jäsen, 1 DNA Way, South San Francisco, CA 94080-4990. Tarkistettu: toukokuu 2021
SIVUVAIKUTUKSET
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Adjuvantti paksusuolensyöpä
osoittaa haittavaikutuksia, joita esiintyi ≥ 5 %:lla potilaista yhdestä vaiheen 3 tutkimuksesta Dukesin C paksusuolensyöpäpotilailla, jotka saivat vähintään yhden annoksen tutkimuslääkettä ja joilla oli vähintään yksi turvallisuusarviointi. Yhteensä 995 potilasta hoidettiin annoksella 1250 mg/m2 kahdesti vuorokaudessa 500 mg XELODAa 2 viikon ajan, jota seurasi 1 viikon tauko, ja 974 potilaalle annettiin 5-FU:ta ja leukovoriinia (20 mg/m2 leukovoriini IV ja sen jälkeen 425 mg/m2 IV bolus 5FU päivinä 1-5 28 päivän välein). Hoidon keston mediaani oli 164 päivää kapesitabiinilla hoidetuilla potilailla ja 145 päivää 5-FU/LV-hoidetuilla potilailla. Yhteensä 112 (11 %) ja 73 (7 %) kapesitabiinia ja 5-FU/LV-hoitoa saanutta potilasta keskeytti hoidon haittavaikutusten vuoksi. Yhteensä 18 kaikista syistä johtuvaa kuolemaa tapahtui joko tutkimuksessa tai 28 päivän kuluessa tutkimuslääkkeen saamisesta: 8 (0,8 %) potilasta satunnaistettiin saamaan XELODA 500 mg ja 10 (1,0 %) satunnaistettiin saamaan 5-FU/LV.
osoittaa asteen 3/4 laboratoriopoikkeavuuksia, joita esiintyi ≥ 1 %:lla potilaista yhdestä vaiheen 3 tutkimuksesta Dukesin C paksusuolensyöpäpotilailla, jotka saivat vähintään yhden annoksen tutkimuslääkettä ja joilla oli vähintään yksi turvallisuusarvio.
Metastaattinen paksusuolen syöpä
Monoterapia
osoittaa haittavaikutukset, joita esiintyi ≥ 5 %:lla potilaista, jotka yhdistettiin kahteen vaiheen 3 tutkimukseen ensimmäisen linjan metastaattisen paksusuolensyövän hoidossa. Yhteensä 596 potilasta, joilla oli metastasoitunut paksusuolen syöpä, hoidettiin 1250 mg/m2 kahdesti päivässä XELODAa 2 viikon ajan, jota seurasi 1 viikon tauko, ja 593 potilaalle annettiin 5-FU:ta ja leukovoriinia Mayo-hoidon yhteydessä (20 mg/m2 leukovoriini IV ja sen jälkeen 425 mg/m2 IV bolus 5-FU, päivinä 1-5, joka 28. päivä). Yhdistetyssä kolorektaalisessa tietokannassa hoidon keston mediaani oli 139 päivää kapesitabiinilla hoidetuilla potilailla ja 140 päivää 5-FU/LV-hoidetuilla potilailla. Yhteensä 78 (13 %) ja 63 (11 %) kapesitabiinia ja 5-FU/LV-hoitoa saaneita potilasta keskeytti hoidon haittavaikutusten/yhteisen sairauden vuoksi. Yhteensä 82 kuolemantapausta kaikista syistä tapahtui joko tutkimuksessa tai 28 päivän kuluessa tutkimuslääkkeen saamisesta: 50 (8,4 %) potilasta satunnaistettiin saamaan XELODA 500 mg ja 32 (5,4 %) satunnaistettiin saamaan 5-FU/LV.
Rintasyöpä
Yhdessä Docetaxelin kanssa
Seuraavat tiedot esitetään yhdistelmätutkimuksesta XELODA 500 mg:n ja dosetakselin kanssa potilailla, joilla on metastaattinen rintasyöpä vuonna ja . XELODAn ja dosetakselin yhdistelmähaarassa hoito oli XELODAa suun kautta 1250 mg/m2 kahdesti vuorokaudessa jaksoittaisena hoitona (2 viikkoa hoitoa, jota seurasi 1 viikko ilman hoitoa) vähintään 6 viikon ajan ja dosetakseli annettiin 1 tunnin laskimonsisäisenä infuusiona klo. 75 mg/m2 annoksella jokaisen 3 viikon syklin ensimmäisenä päivänä vähintään 6 viikon ajan. Monoterapiahaarassa dosetakselia annettiin 1 tunnin suonensisäisenä infuusiona annoksella 100 mg/m2 jokaisen 3 viikon syklin ensimmäisenä päivänä vähintään 6 viikon ajan. Keskimääräinen hoidon kesto oli 129 päivää yhdistelmäryhmässä ja 98 päivää monoterapiahaarassa. Yhteensä 66 potilasta (26 %) yhdistelmähaarassa ja 49 (19 %) monoterapiahaarassa vetäytyi tutkimuksesta haittavaikutusten vuoksi. Niiden potilaiden prosenttiosuus, jotka tarvitsivat annoksen pienentämistä haittavaikutusten vuoksi, oli 65 % yhdistelmähoitoryhmässä ja 36 % monoterapiahaarassa. Niiden potilaiden prosenttiosuus, jotka vaativat hoidon keskeyttämistä haittavaikutusten vuoksi yhdistelmähoitoryhmässä oli 79 %. Hoidon keskeytykset kuuluivat yhdistelmähoitoa saaneiden potilaiden annosmuutosohjelmaan, mutta eivät dosetakselia monoterapiaa saaneiden potilaiden kohdalla.
Monoterapia
Seuraavat tiedot esitetään tutkimuksesta vaiheen IV rintasyöpäpotilailla, jotka saivat 1250 mg/m2 annoksen kahdesti vuorokaudessa 2 viikon ajan, mitä seurasi 1 viikon tauko. Keskimääräinen hoidon kesto oli 114 päivää. Yhteensä 13 potilasta 162:sta (8 %) keskeytti hoidon haittavaikutusten/yhtenäisen sairauden vuoksi.
Kliinisesti merkitykselliset haittatapahtumat
Alla on esitetty kliinisesti merkitykselliset haittatapahtumat, jotka raportoitiin
Monoterapia (metastaattinen paksusuolen syöpä, adjuvantti kolorektaalisyöpä, etäpesäkkeinen rintasyöpä)
Ruoansulatuskanava: vatsan turvotus, dysfagia, proktalgia, askites (0,1 %), mahahaava (0,1 %), ileus (0,3 %), myrkyllinen suolen laajentuma, gastroenteriitti (0,1 %)
Iho ja ihonalainen: kynsisairaus (0,1 %), lisääntynyt hikoilu (0,1 %), valoherkkyysreaktio (0,1 %), ihon haavauma, kutina, säteilyn palautumisoireyhtymä (0,2 %)
Yleistä: rintakipu (0,2 %), influenssan kaltainen sairaus, kuumat aallot, kipu (0,1 %), käheys, ärtyneisyys, kävelyvaikeudet, jano, rintakipu, kollapsi, fibroosi (0,1 %), verenvuoto, turvotus, sedaatio
Neurologinen: unettomuus, ataksia (0,5 %), vapina, dysfasia, enkefalopatia (0,1 %), epänormaali koordinaatio, dysartria, tajunnan menetys (0,2 %), tasapainon heikkeneminen
Aineenvaihdunta: painonnousu, kakeksia (0,4 %), hypertriglyseridemia (0,1 %), hypokalemia, hypomagnesemia
Silmä: sidekalvotulehdus
Hengitys: yskä (0,1 %), nenäverenvuoto (0,1 %), astma (0,2 %), hemoptysis, hengitysvaikeudet (0,1 %), hengenahdistus
Sydämen: takykardia (0,1 %), bradykardia, eteisvärinä, kammion ekstrasystolat, ekstrasystolat, sydänlihastulehdus (0,1 %), sydänpussin effuusio
Infektiot: kurkunpäätulehdus (1,0 %), keuhkoputkentulehdus (0,2 %), keuhkokuume (0,2 %), bronkopneumonia (0,2 %), keratokonjunktiviitti, sepsis (0,3 %), sieni-infektiot (mukaan lukien kandidiaasi) (0,2 %)
Tuki- ja liikuntaelimistö: myalgia, luukipu (0,1 %), niveltulehdus (0,1 %), lihasheikkous
Veri ja lymfajärjestelmä: leukopenia (0,2 %), hyytymishäiriö (0,1 %), luuytimen lama (0,1 %), idiopaattinen trombosytopeniapurppura (1,0 %), pansytopenia (0,1 %)
Verisuoni: hypotensio (0,2 %), verenpainetauti (0,1 %), lymfoödeema (0,1 %), keuhkoembolia (0,2 %), aivoverenkiertohäiriö (0,1 %)
Psykiatrinen: masennus, sekavuus (0,1 %)
Munuaiset: munuaisten vajaatoiminta (0,6 %)
Korva: huimaus
Maksa-sappi: maksafibroosi (0,1 %), hepatiitti (0,1 %), kolestaattinen hepatiitti (0,1 %), poikkeavia maksan toimintakokeita
Immuunijärjestelmä: lääkeyliherkkyys (0,1 %)
XELODA 500 mg yhdistelmänä dosetakselin kanssa (metastaattinen rintasyöpä)
Ruoansulatuskanava: ileus (0,4 %), nekrotisoiva enterokoliitti (0,4 %), ruokatorven haava (0,4 %), hemorraginen ripuli (0,8 %)
Neurologinen: ataksia (0,4 %), pyörtyminen (1,2 %), makuaistin menetys (0,8 %), polyneuropatia (0,4 %), migreeni (0,4 %)
Sydämen: supraventrikulaarinen takykardia (0,4 %)
Infektio: neutropeeninen sepsis (2,4 %), sepsis (0,4 %), bronkopneumonia (0,4 %) Veri ja
Lymfaattinen: agranulosytoosi (0,4 %), protrombiinin lasku (0,4 %)
Verisuoni: hypotensio (1,2 %), laskimoflebiitti ja tromboflebiitti (0,4 %), posturaalinen hypotensio (0,8 %)
Munuaiset: munuaisten vajaatoiminta (0,4 %)
Maksa-sappi: keltaisuus (0,4 %), epänormaalit maksan toimintakokeet (0,4 %), maksan vajaatoiminta (0,4 %), maksakooma (0,4 %), hepatotoksisuus (0,4 %)
Immuunijärjestelmä: yliherkkyys (1,2 %)
Markkinoinnin jälkeinen kokemus
Seuraavia haittavaikutuksia on havaittu markkinoille tulon jälkeen: angioödeema, maksan vajaatoiminta, kyyneltiehyen ahtauma, kuivumisesta johtuva akuutti munuaisten vajaatoiminta, mukaan lukien kuolemaan johtava lopputulos [ks. VAROITUKSET JA VAROTOIMET ], lupus erythematosus, sarveiskalvon sairaudet, mukaan lukien keratiitti, toksinen leukoenkefalopatia, vakavat ihoreaktiot, kuten Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi (TEN) [ks. VAROITUKSET JA VAROTOIMET ], jatkuva tai vaikea käsi- ja jalkaoireyhtymä voi lopulta johtaa sormenjälkien menettämiseen [katso VAROITUKSET JA VAROTOIMET ]
Seuraavia haittavaikutuksia on raportoitu murskattujen XELODA 500 mg -tablettien yhteydessä: silmien ärsytys ja turvotus, ihottuma, ripuli, parestesia, päänsärky, mahalaukun ärsytys, oksentelu ja pahoinvointi.
HUUMEIDEN VUOROVAIKUTUKSET
Huumeiden väliset vuorovaikutukset
Antikoagulantit
Muuttuneita hyytymisparametreja ja/tai verenvuotoa on raportoitu potilailla, jotka ottavat XELODA 500 mg samanaikaisesti kumariinijohdannaisten antikoagulanttien, kuten varfariinin ja fenprokumonin kanssa [ks. LAATIKKO VAROITUS ]. Nämä tapahtumat ilmenivät useiden päivien ja jopa useiden kuukausien kuluessa XELODA 500 mg -hoidon aloittamisesta ja joissakin tapauksissa kuukauden sisällä XELODA-hoidon lopettamisesta. Näitä tapahtumia esiintyi potilailla, joilla oli maksametastaasseja tai ei niitä. Lääkkeiden yhteisvaikutustutkimuksessa varfariinin kerta-annoksella S-varfariinin keskimääräinen AUC nousi merkittävästi [ks. KLIININEN FARMAKOLOGIA ]. Suurin havaittu INR-arvo nousi 91 %. Tämä yhteisvaikutus johtuu todennäköisesti kapesitabiinin ja/tai sen metaboliittien aiheuttamasta sytokromi P450 2C9:n estämisestä.
Fenytoiini
Fenytoiinin tasoa tulee seurata huolellisesti potilailla, jotka käyttävät XELODA 500 mg, ja fenytoiiniannosta on ehkä pienennettävä [ks. ANNOSTELU JA HALLINNOINTI ]. Markkinoille tulon jälkeiset raportit osoittavat, että joillakin potilailla, jotka saivat XELODA 500 mg ja fenytoiinia, oli toksisuutta, joka liittyi kohonneisiin fenytoiinitasoihin. Muodollisia lääkeaineiden yhteisvaikutustutkimuksia fenytoiinin kanssa ei ole tehty, mutta yhteisvaikutusmekanismin oletetaan olevan CYP2C9-isoentsyymin esto kapesitabiinin ja/tai sen metaboliittien vaikutuksesta.
Leukovoriini
5-fluorourasiilin pitoisuus kasvaa ja leukovoriini voi lisätä sen toksisuutta. Kuolemia vakavasta enterokoliitista, ripulista ja nestehukasta on raportoitu iäkkäillä potilailla, jotka ovat saaneet viikoittain leukovoriinia ja fluorourasiilia.
CYP2C9-substraatit
Varfariinia lukuun ottamatta XELODAn ja muiden CYP2C9-substraattien välillä ei ole suoritettu virallisia lääkkeiden yhteisvaikutustutkimuksia. Varovaisuutta tulee noudattaa, kun XELODAA annetaan samanaikaisesti CYP2C9-substraattien kanssa.
Allopurinoli
Samanaikainen käyttö allopurinolin kanssa voi vähentää kapesitabiinin aktiivisten metaboliittien pitoisuutta [katso KLIININEN FARMAKOLOGIA ], mikä saattaa heikentää XELODAn tehoa. Vältä allopurinolin käyttöä XELODA-hoidon aikana.
Huumeiden ja ruoan vuorovaikutus
Ruoan osoitettiin vähentävän sekä kapesitabiinin imeytymisnopeutta että laajuutta [katso KLIININEN FARMAKOLOGIA ]. Kaikissa kliinisissä tutkimuksissa potilaita kehotettiin antamaan XELODA 500 mg 30 minuutin kuluessa aterian jälkeen. On suositeltavaa, että XELODA annetaan ruoan kanssa [katso ANNOSTELU JA HALLINNOINTI ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Koagulopatia
Potilaiden, jotka saavat samanaikaisesti kapesitabiinia ja oraalista kumariinijohdannaista antikoagulanttihoitoa, antikoagulanttivastetta (INR tai protrombiiniaika) on seurattava tarkasti usein ja antikoagulantin annosta on muutettava vastaavasti [ks. LAATIKKO VAROITUS ja HUUMEIDEN VUOROVAIKUTUKSET ].
Ripuli
XELODA 500 mg voi aiheuttaa ripulia, joskus vaikeaa. Potilaita, joilla on vaikea ripuli, on seurattava huolellisesti ja heille on annettava neste- ja elektrolyyttikorvaushoitoa, jos he kuivuvat. 875 potilaalla, joilla oli joko metastaattista rintasyöpää tai paksusuolensyöpää ja jotka saivat XELODA-monoterapiaa, mediaaniaika asteen 2–4 ripulin ensimmäiseen esiintymiseen oli 34 päivää (vaihteluväli 1–369 päivää). Asteiden 3-4 ripulin keston mediaani oli 5 päivää. National Cancer Institute of Canadan (NCIC) asteen 2 ripuli määritellään lisääntyneeksi ulostemääräksi 4–6 päivässä tai yöllisiksi ulosteiksi, asteen 3 ripuliksi ulosteiden lisääntymiseksi 7–9 päivässä tai inkontinenssiksi ja imeytymishäiriöksi ja asteen 4 ripuliksi ulosteiden lisääntyminen ≥ 10/vrk tai voimakkaasti verinen ripuli tai parenteraalisen tuen tarve. Jos asteen 2, 3 tai 4 ripulia ilmenee, XELODAn anto tulee keskeyttää välittömästi, kunnes ripuli häviää tai sen voimakkuus vähenee asteeseen 1 [ks. ANNOSTELU JA HALLINNOINTI ]. Tavallisia ripulia ehkäiseviä hoitoja (esim. loperamidia) suositellaan.
Nekrotisoivaa enterokoliittia (tyfliitti) on raportoitu.
Kardiotoksisuus
XELODA 500 mg:lla havaittu kardiotoksisuus sisältää sydäninfarktin/iskemian, angina pectoriksen, rytmihäiriöt, sydämenpysähdyksen, sydämen vajaatoiminnan, äkillisen kuoleman, elektrokardiografiset muutokset ja kardiomyopatian. Nämä haittavaikutukset voivat olla yleisempiä potilailla, joilla on aiemmin ollut sepelvaltimotauti.
Dihydropyrimidiinidehydrogenaasin puutos
Markkinoille tulon jälkeisten raporttien perusteella potilailla, joilla on tiettyjä homotsygoottisia tai tiettyjä yhdisteitä sisältäviä heterotsygoottisia mutaatioita DPD-geenissä, jotka johtavat täydelliseen tai lähes täydelliseen DPD-aktiivisuuden puuttumiseen, on lisääntynyt riski saada akuutti varhainen toksisuus ja vakava, henkeä uhkaava tai kuolemaan johtava haitta. XELODAn aiheuttamat reaktiot (esim. mukosiitti, ripuli, neutropenia ja neurotoksisuus). Potilailla, joilla on osittainen DPD-aktiivisuus, voi myös olla lisääntynyt XELODAn aiheuttamien vakavien, hengenvaarallisten tai kuolemaan johtavien haittavaikutusten riski.
Keskeytä tai lopeta XELODA 500 mg:n antaminen pysyvästi kliinisen arvioinnin perusteella havaittujen toksisuuksien alkamisesta, kestosta ja vakavuusasteesta potilailla, joilla on merkkejä akuutista varhain alkavasta tai epätavallisen vakavasta toksisuudesta, mikä saattaa viitata siihen, että DPD-aktiivisuus on lähes täydellinen tai puuttuu kokonaan. Mitään XELODA-annosta ei ole todistettu turvalliseksi potilaille, joilla ei ole DPD-aktiivisuutta. Ei ole riittävästi tietoa tietyn annoksen suosittelemiseksi potilaille, joilla on osittainen DPD-aktiivisuus millään erityisellä testillä mitattuna.
Kuivuminen ja munuaisten vajaatoiminta
Kuivumista on havaittu, ja se voi aiheuttaa akuutin munuaisten vajaatoiminnan, joka voi olla kohtalokas. Potilailla, joilla on aiempaa heikentynyt munuaisten toiminta tai jotka saavat samanaikaisesti XELODAa tunnettujen munuaistoksisten aineiden kanssa, on suurempi riski. Potilaat, joilla on anoreksia, astenia, pahoinvointi, oksentelu tai ripuli, voivat kuivua nopeasti. Seuraa potilaita, kun XELODA 500 mg annetaan dehydraation ehkäisemiseksi ja korjaamiseksi heti alussa. Jos asteen 2 (tai korkeampi) nestehukka ilmenee, XELODA-hoito tulee keskeyttää välittömästi ja kuivuminen korjata. Hoitoa ei saa aloittaa uudelleen, ennen kuin potilas on nesteytetty ja kaikki aiheuttavat syyt on korjattu tai hallinnassa. Annoksen muutoksia tulee soveltaa aiheuttavaan haittatapahtumaan tarvittaessa [katso ANNOSTELU JA HALLINNOINTI ].
Potilaat, joilla on kohtalainen munuaisten vajaatoiminta lähtötilanteessa, tarvitsevat annoksen pienentämistä [katso ANNOSTELU JA HALLINNOINTI ]. Potilaita, joilla on lievä tai kohtalainen munuaisten vajaatoiminta lähtötilanteessa, tulee seurata huolellisesti haittavaikutusten varalta. Hoidon välitöntä keskeyttämistä ja myöhempiä annoksen muutoksia suositellaan, jos potilaalle kehittyy asteen 2–4 haittavaikutus, kuten kohdassa [ks. ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa , ja KLIININEN FARMAKOLOGIA ].
Alkion ja sikiön myrkyllisyys
Eläinten lisääntymistutkimusten löydösten ja sen vaikutusmekanismin perusteella XELODA voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [ks. KLIININEN FARMAKOLOGIA ]. Rajallisesti saatavilla olevat tiedot eivät riitä XELODA 500 mg:n käyttöön raskaana oleville naisille. Eläinten lisääntymistutkimuksissa kapesitabiinin antaminen tiineille eläimille organogeneesin aikana aiheutti alkiokuolleisuutta ja teratogeenisuutta hiirillä ja alkiokuolleisuutta apinoilla 0,2-kertaisella ja 0,6-kertaisella altistuksella (AUC) potilailla, jotka saivat suositeltua annosta [ks. Käyttö tietyissä populaatioissa ]. Ilmoita raskaana oleville naisille mahdollisista riskeistä sikiölle. Neuvo lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä hoidon aikana ja 6 kuukauden ajan viimeisen XELODA-annoksen jälkeen [ks. Käyttö tietyissä populaatioissa ].
Muko-iho- ja ihotoksisuus
XELODA-hoitoa saavilla potilailla voi esiintyä vakavia limakalvoreaktioita, joista osa on kuolemaan johtavia, kuten Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi (TEN) [ks. HAITTAVAIKUTUKSET ]. XELODA 500 mg -hoito tulee lopettaa pysyvästi potilailla, joilla on vaikea ihon limakalvoreaktio, joka saattaa johtua XELODA-hoidosta.
Käsi-ja-jalka-oireyhtymä (kämmen-plantaarinen erytrodysestesia tai kemoterapian aiheuttama akral eryteema) on ihotoksisuus. Mediaaniaika taudin puhkeamiseen oli 79 päivää (vaihteluväli 11–360 päivää) ja vaikeusaste 1–3 potilailla, jotka saivat XELODA 500 mg:n monoterapiaa metastaattisissa olosuhteissa. Asteen 1 tunnusomaista on jokin seuraavista: puutuminen, dysestesia/parestesia, pistely, käsien ja/tai jalkojen kivuton turvotus tai punoitus ja/tai epämukavuus, joka ei häiritse normaalia toimintaa. Asteen 2 käsi- ja jalkaoireyhtymä määritellään käsien ja/tai jalkojen kivulias punoitus ja turvotus ja/tai epämukavuus, joka vaikuttaa potilaan päivittäiseen toimintaan. Asteen 3 käsi-ja-jalkaoireyhtymä määritellään kosteaksi hilseilyksi, haavaumiksi, rakkulaksi tai voimakkaaksi käsien ja/tai jalkojen kipuksi ja/tai vakavaksi epämukavuudeksi, joka aiheuttaa potilaan kyvyttömyyden työskennellä tai suorittaa päivittäisiä toimintoja. Pysyvä tai vaikea käsien ja jalkojen oireyhtymä (aste 2 ja korkeampi) voi lopulta johtaa sormenjälkien menettämiseen, mikä voi vaikuttaa potilaan tunnistamiseen. Jos asteen 2 tai 3 käsi- ja jalkaoireyhtymä ilmenee, XELODAn anto tulee keskeyttää, kunnes tapahtuma häviää tai sen voimakkuus vähenee asteeseen 1. Asteen 3 käsi- ja jalkaoireyhtymän jälkeen seuraavien XELODAn 500 mg annosta tulee pienentää. katso ANNOSTELU JA HALLINNOINTI ].
Hyperbilirubinemia
875 potilaalla, joilla oli joko metastasoitunut rintasyöpä tai paksusuolen syöpä ja jotka saivat vähintään yhden annoksen XELODAa 1250 mg/m2 kahdesti vuorokaudessa monoterapiana 2 viikon ajan, jota seurasi 1 viikon tauko, asteen 3 (1,5-3 x ULN) hyperbilirubinemia esiintyi 15,2 %:lla (n=133) potilaista ja asteen 4 (>3 x ULN) hyperbilirubinemiaa esiintyi 3,9 %:lla (n=34) potilaista. 566 potilaasta, joilla oli maksametastaaseja lähtötilanteessa ja 309 potilaasta, joilla ei ollut maksametastaaseja lähtötilanteessa, asteen 3 tai 4 hyperbilirubinemiaa esiintyi 22,8 %:lla ja 12,3 %:lla. Niistä 167 potilaasta, joilla oli asteen 3 tai 4 hyperbilirubinemia, 18,6 %:lla (n = 31) oli myös lähtötilanteen jälkeisiä alkalisen fosfataasin nousuja (asteet 1-4, ilman nousua lähtötilanteessa) ja 27,5 %:lla (n = 46) transaminaasiarvot kohosivat lähtötilanteen jälkeen. milloin tahansa (ei välttämättä samanaikaisesti). Suurimmalla osalla näistä potilaista, 64,5 %:lla (n = 20) ja 71,7 %:lla (n = 33), oli maksametastaaseja lähtötilanteessa. Lisäksi 57,5 %:lla (n = 96) ja 35,3 %:lla (n = 59) 167 potilaasta alkalisen fosfataasin tai transaminaasiarvojen kohoaminen (asteet 1–4) oli sekä lähtötasolla että sen jälkeen. Vain 7,8 %:lla (n=13) ja 3,0 %:lla (n=5) oli alkalisen fosfataasin tai transaminaasien asteen 3 tai 4 nousu.
Niillä 596 potilaalla, joita hoidettiin XELODA 500 mg:lla ensisijaisena hoitona metastasoituneen paksusuolensyövän hoitoon, asteen 3 tai 4 hyperbilirubinemian ilmaantuvuus oli samanlainen kuin XELODA 500 mg:n monoterapian kliinisten tutkimusten yleisessä turvallisuustietokannassa. Asteen 3 tai 4 hyperbilirubinemian ilmaantumiseen kulunut mediaani kolorektaalisyöpäpopulaatiossa oli 64 päivää ja kokonaisbilirubiinin mediaani nousi lähtötilanteen arvosta 8 μm/l arvoon 13 μm/l XELODA-hoidon aikana. Niistä 136 kolorektaalisyöpäpotilaasta, joilla oli asteen 3 tai 4 hyperbilirubinemia, 49 potilaalla oli asteen 3 tai 4 hyperbilirubinemia viimeinen mitattu arvo, joista 46:lla oli maksametastaaseja lähtötilanteessa.
251 potilaasta, joilla oli metastasoitunut rintasyöpä, jotka saivat 500 mg XELODA:n ja dosetakselin yhdistelmää, asteen 3 (1,5–3 x ULN) hyperbilirubinemiaa esiintyi 7 %:lla (n=17) ja asteen 4 (> 3 x ULN) hyperbilirubinemiaa 2 %:lla. (n = 5).
Jos lääkkeeseen liittyvää asteen 3–4 bilirubiinin nousua esiintyy, XELODA 500 mg:n anto tulee välittömästi keskeyttää, kunnes hyperbilirubinemia laskee arvoon ≤ 3,0 X ULN (ks. suositellut annoksen muutokset kohdasta ANNOSTELU JA HALLINNOINTI ].
Hematologinen
875 potilaasta, joilla oli joko metastasoitunut rintasyöpä tai paksusuolensyöpä ja jotka saivat 1250 mg/m2 annoksen kahdesti vuorokaudessa monoterapiana 2 viikon ajan, jota seurasi 1 viikon tauko, 3,2 %:lla, 1,7 %:lla ja 2,4 %:lla potilaista oli aste 3. tai 4 neutropeniaa, trombosytopeniaa tai hemoglobiinin laskua. 251 metastasoitunutta rintasyöpää sairastavasta potilaasta, jotka saivat annoksen XELODAa yhdessä dosetakselin kanssa, 68 %:lla oli asteen 3 tai 4 neutropenia, 2,8 %:lla asteen 3 tai 4 trombosytopenia ja 9,6 %:lla asteen 3 tai 4 anemia.
Potilaita, joiden lähtötilanteen neutrofiilien määrä on
Geriatriset potilaat
≥80-vuotiailla potilailla saattaa esiintyä useammin asteen 3 tai 4 haittavaikutuksia. 875 potilaasta, joilla oli joko metastasoitunut rintasyöpä tai paksusuolensyöpä ja jotka saivat XELODA 500 mg monoterapiaa, 62 % 21:stä ≥ 80-vuotiaasta potilaasta, joita hoidettiin XELODA 500 mg:lla, koki hoitoon liittyvän asteen 3 tai 4 haittatapahtuman: ripuli 6:lla (28,6 %). , pahoinvointia 3:lla (14,3 %), käsi- ja jalkaoireyhtymää 3:lla (14,3 %) ja oksentelua kahdella (9,5 %) potilaalla. Niistä 10 70-vuotiaasta ja sitä vanhemmasta potilaasta (yksikään potilas ei ollut yli 80-vuotias), joita hoidettiin XELODAn 500 mg:lla yhdessä dosetakselin kanssa, 30 %:lla (3/10) potilaista oli 3. tai 4. asteen ripulia ja suutulehdusta, ja 40 % (4/10) koki asteen 3 käsi-jalka-oireyhtymän.
Niiden 67 yli 60-vuotiaan potilaan joukossa, jotka saivat XELODAa yhdessä dosetakselin kanssa, asteen 3 tai 4 hoitoon liittyvien haittavaikutusten, hoitoon liittyvien vakavien haittavaikutusten, haittavaikutuksista johtuvien keskeytysten, hoidon keskeyttämisen haittavaikutusten ja hoidon vuoksi Kahden ensimmäisen hoitosyklin aikana keskeyttäneiden määrä oli suurempi kuin alle 60-vuotiaiden potilaiden ryhmässä.
995 potilaalla, jotka saivat XELODAa Dukesin C paksusuolensyövän adjuvanttihoitona primaarisen kasvaimen resektion jälkeen, 41 % 398:sta 65-vuotiaasta XELODA-hoitoa saaneesta potilaasta koki hoitoon liittyvän asteen 3 tai 4 haittatapahtuman: käsi- ja - jalkaoireyhtymä 75:llä (18,8 %), ripuli 52:lla (13,1 %), stomatiitti 12:lla (3,0 %), neutropenia/granulosytopenia 11:llä (2,8 %), oksentelu 6:lla (1,5 %) ja pahoinvointi 5:llä (1,3 %) %) potilaista. ≥ 65-vuotiailla potilailla (kaikki satunnaistettu populaatio; kapesitabiini 188 potilasta, 5-FU/LV 208 potilasta), joita hoidettiin Dukesin C paksusuolensyövän vuoksi primaarisen kasvaimen resektion jälkeen, riskisuhteet taudista vapaalle eloonjäämiselle ja kokonaiseloonjäämiselle XELODA verrattuna 5-FU/LV:hen olivat 1,01 (95 % CI 0,80 – 1,27) ja 1,04 (95 % CI 0,79 – 1,37).
Maksan vajaatoiminta
Potilaita, joilla on lievä tai keskivaikea maksan vajaatoiminta maksametastaasien vuoksi, on seurattava huolellisesti XELODA-hoidon aikana. Vaikean maksan vajaatoiminnan vaikutusta XELODAn dispositioon ei tunneta [katso Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Yhdistelmä muiden lääkkeiden kanssa
XELODAn käyttöä yhdessä irinotekaanin kanssa ei ole tutkittu riittävästi.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Ripuli
Kerro potilaille, joilla on asteen 2 ripulia (yli 4–6 ulostetta/päivä tai yöllinen uloste) tai enemmän tai joilla on vaikea verinen ripuli, johon liittyy voimakasta vatsakipua ja kuumetta, että he lopettavat XELODAn käytön. Neuvo potilaita ripulin hoitoon ripulihoitojen (esim. loperamidi) käytöstä [ks. VAROITUKSET JA VAROTOIMET ].
Kardiotoksisuus
Neuvo potilaita kardiotoksisuuden riskistä ja ottamaan välittömästi yhteyttä terveydenhuollon tarjoajaan tai hakeutumaan ensiapuun rintakivun, hengenahdistuksen, huimauksen tai huimauksen vuoksi [ks. VAROITUKSET JA VAROTOIMET ].
Dihydropyrimidiinidehydrogenaasin puutos
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos heillä on tiedossa DPD-puutos. Neuvo potilaita, jos heillä on täydellinen tai lähes täydellinen DPD-aktiivisuuden puuttuminen, heillä on lisääntynyt riski saada akuutti varhainen toksisuus ja XELODAn aiheuttamia vakavia, henkeä uhkaavia tai kuolemaan johtavia haittavaikutuksia (esim. mukosiitti, ripuli, neutropenia ja neurotoksisuus) [katso VAROITUKSET JA VAROTOIMET ].
Kuivuminen ja munuaisten vajaatoiminta
Neuvoa potilaita, jotka kokevat asteen 2 tai korkeamman nestehukan (injektiolaskimonesteet VAROITUKSET JA VAROTOIMET ].
Tärkeät hallintaohjeet
Neuvo potilaita nielemään XELODA 500 mg tabletit kokonaisina veden kera 30 minuutin kuluessa ateriasta. Neuvo potilaita ja hoitajia olemaan murskaamatta tai leikkaamatta XELODA-tabletteja. Neuvo potilaita, jos he eivät voi niellä XELODA-tabletteja kokonaisina, ilmoittamaan asiasta terveydenhuollon tarjoajalle [ks. ANNOSTELU JA HALLINNOINTI ].
Yliherkkyys ja angioödeema
Kerro potilaille, että XELODA voi aiheuttaa vakavia yliherkkyysreaktioita ja angioedeemaa. Neuvo potilaita, jotka ovat olleet yliherkkiä kapesitabiinille tai 5-fluorourasiilille, ilmoittamaan asiasta terveydenhuollon tarjoajalleen [ks. VASTA-AIHEET ]. Neuvo potilaita, joille kehittyy yliherkkyysreaktioita tai limakalvon oireita (esim. urtikaria, ihottuma, punoitus, kutina tai kasvojen, huulten, kielen tai kurkun turvotus, joka vaikeuttaa nielemistä tai hengitystä), lopettamaan XELODAn käyttö ja ottamaan välittömästi yhteyttä terveydenhuollon tarjoajaan tai mennä ensiapuun. [katso HAITTAVAIKUTUKSET ].
Pahoinvointi
Neuvo potilaita, jotka kokevat asteen 2 pahoinvointia (ruoan saanti on vähentynyt merkittävästi, mutta pystyvät syömään ajoittain) tai enemmän lopettamaan XELODA 500 mg:n ottaminen välittömästi ja ottamaan yhteyttä terveydenhuollon tarjoajaan pahoinvoinnin hoitamiseksi [ks. HAITTAVAIKUTUKSET ].

Oksentelu
Neuvo potilaita, jotka kokevat asteen 2 oksentelua (2–5 jaksoa 24 tunnin aikana) tai enemmän, lopettamaan XELODAn käyttö välittömästi ja ottamaan yhteyttä terveydenhuollon tarjoajaan oksentelun hoitamiseksi [ks. HAITTAVAIKUTUKSET ].
Käsi-ja-jalka-oireyhtymä
Neuvo potilaita, joilla on asteen 2 käsien ja jalkojen oireyhtymä (kivulias punoitus ja turvotus käsissä ja/tai jaloissa ja/tai epämukavuus, joka vaikuttaa potilaan päivittäiseen toimintaan) tai enemmän lopettamaan XELODA 500 mg:n käyttö välittömästi ja ottamaan yhteyttä terveydenhuollon tarjoajaan . Kerro potilaille, että oireenmukaisen hoidon aloittamista suositellaan, ja käsi-jalka-oireyhtymä voi johtaa sormenjälkien menettämiseen, mikä voi vaikuttaa henkilöllisyyteen [ks. HAITTAVAIKUTUKSET ].
Stomatiitti
Kerro potilaille, joilla on asteen 2 suutulehdus (kivulias punoitus, turvotus tai haavaumat suussa tai kielessä, mutta pystyvät syömään) tai enemmän lopettamaan XELODAn käyttö välittömästi ja ottamaan yhteyttä terveydenhuollon tarjoajaan [ks. HAITTAVAIKUTUKSET ].
Kuume ja Neutropenia
Ilmoita potilaille, joille nousee 100,5 °F tai korkeampi kuume tai muita todisteita mahdollisesta infektiosta, ottamaan yhteyttä terveydenhuollon tarjoajaan [katso HAITTAVAIKUTUKSET ].
Alkion ja sikiön myrkyllisyys
Kertokaa lisääntymispotentiaaliin kuuluvia naisia mahdollisesta riskistä sikiölle ja käyttämään tehokasta ehkäisyä XELODA 500 mg -hoidon aikana ja 6 kuukauden ajan viimeisen annoksen jälkeen. Neuvo naisia ilmoittamaan terveydenhuollon tarjoajalleen tunnetusta tai epäillystä raskaudesta [katso VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
Neuvo miespotilaita, joilla on lisääntymiskykyisiä naispartnereita, käyttämään tehokasta ehkäisyä XELODA 500 mg -hoidon aikana ja 3 kuukauden ajan viimeisen annoksen jälkeen [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo naisia olemaan imettämättä XELODA 500 mg -hoidon aikana ja 2 viikkoa viimeisen annoksen jälkeen [ks. Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kapesitabiinin karsinogeenisuutta ei ole tutkittu riittäviä tutkimuksia. Kapesitabiini ei ollut mutageeninen in vitro bakteereille (Ames-testi) tai nisäkässoluille (kiinanhamsterin V79/HPRT-geenimutaatiomääritys). Kapesitabiini oli klastogeeninen in vitro ihmisen ääreisveren lymfosyyteille, mutta ei klastogeeninen in vivo hiiren luuytimelle (mikronukleustesti). Fluorourasiili aiheuttaa mutaatioita bakteereissa ja hiivassa. Fluorourasiili aiheuttaa myös kromosomipoikkeavuuksia hiiren mikrotumatestissä in vivo.
Naarashiirten hedelmällisyyttä ja yleistä lisääntymiskykyä koskevissa tutkimuksissa oraaliset kapesitabiiniannokset 760 mg/kg/vrk (noin 2300 mg/m2/vrk) häiritsivät kiimaa ja aiheuttivat sen seurauksena hedelmällisyyden laskua. Hiirillä, jotka tulivat raskaaksi, yksikään sikiö ei selvinnyt tästä annoksesta. Kiiman häiriö oli palautuva. Miehillä tämä annos aiheutti rappeuttavia muutoksia kiveksissä, mukaan lukien spermatosyyttien ja siittiöiden määrän vähenemistä. Erillisissä farmakokineettisissä tutkimuksissa tämä annos tuotti hiirillä 5'-DFUR AUC -arvot noin 0,7 kertaa vastaavat arvot potilailla, joille annettiin suositeltu päiväannos.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Eläinten lisääntymistutkimuksissa tehtyjen löydösten ja sen vaikutusmekanismin perusteella XELODA 500 mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [ks. KLIININEN FARMAKOLOGIA ]. Rajallisesti saatavilla olevat ihmisistä saadut tiedot eivät riitä kertomaan lääkkeisiin liittyvästä riskistä raskauden aikana. Eläinten lisääntymistutkimuksissa kapesitabiinin antaminen tiineille eläimille organogeneesin aikana aiheutti alkioiden kuolleisuutta ja teratogeenisuutta hiirillä ja alkiokuolleisuutta apinoilla 0,2-kertaisella ja 0,6-kertaisella altistuksella (AUC) potilailla, jotka saivat suositeltua annosta [ks. Data ]. Ilmoita raskaana oleville naisille mahdollisista riskeistä sikiölle.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Eläinten tiedot
Kapesitabiinin oraalinen antaminen raskaana oleville hiirille organogeneesin aikana annoksella 198 mg/kg/vrk aiheutti epämuodostumia ja alkioiden kuolleisuutta. Erillisissä farmakokineettisissä tutkimuksissa tämä annos tuotti hiirillä 5'-DFUR AUC-arvot, jotka olivat noin 0,2 kertaa AUC-arvot potilailla, joille annettiin suositeltu päiväannos. Epämuodostumat hiirillä sisälsivät kitalakihalkeamaa, anoftalmiaa, mikroftalmiaa, oligodaktyylia, polydaktyylia, syndaktyylia, mutkaisia häntää ja aivokammioiden laajentumista. Kapesitabiinin oraalinen antaminen raskaana oleville apinoille organogeneesin aikana annoksella 90 mg/kg/vrk aiheutti sikiökuolleisuuden. Tämä annos tuotti 5'-DFUR AUC-arvot, jotka olivat noin 0,6 kertaa AUC-arvot potilailla, joille annettiin suositeltu päiväannos.
Imetys
Riskien yhteenveto
Ei ole tietoa kapesitabiinin esiintymisestä äidinmaidossa tai sen vaikutuksista maidontuotantoon tai imetettävään lapseen. Kapesitabiinin metaboliitteja oli imettävien hiirten maidossa [katso Data ]. Kapesitabiinialtistus voi aiheuttaa vakavia haittavaikutuksia rintaruokinnassa oleville vauvoille, joten kehota naisia olemaan imettämättä XELODA 500 mg -hoidon aikana ja 2 viikkoa viimeisen annoksen jälkeen.
Data
Imetävät hiiret, joille annettiin kerta-annos kapesitabiinia suun kautta, erittivät merkittäviä määriä kapesitabiinimetaboliitteja maitoon.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Raskaustestaus
Lisääntymiskykyisille naisille suositellaan raskaustestin tekemistä ennen XELODA-hoidon aloittamista.
Ehkäisy
Naaraat
XELODA 500mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [katso Raskaus ]. Kehota lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä hoidon aikana ja 6 kuukauden ajan viimeisen XELODAn annoksen jälkeen.
Miehet
Geneettisten toksisuuslöydösten perusteella kehota miespotilaita, joiden naispuoliset kumppanit ovat lisääntymiskykyisiä, käyttämään tehokasta ehkäisyä hoidon aikana ja 3 kuukauden ajan viimeisen XELODAn annoksen jälkeen [ks. Ei-kliininen toksikologia ].
Hedelmättömyys
Eläinkokeiden perusteella XELODA saattaa heikentää lisääntymiskykyisten naisten ja miesten hedelmällisyyttä [ks. Ei-kliininen toksikologia ].
Käyttö lapsille
XELODAn turvallisuutta ja tehokkuutta lapsipotilailla ei ole varmistettu. Kliinistä hyötyä ei osoitettu kahdessa yhden haaran tutkimuksessa lapsipotilailla, joilla oli äskettäin diagnosoitu aivorungon gliooma ja korkealaatuinen gliooma. Molemmissa tutkimuksissa lapsipotilaat saivat lapsipotilaille tutkittavaa kapesitabiiniformulaatiota samanaikaisesti sädehoidon kanssa ja sen jälkeen (kokonaisannos 5580 cGy 180 cGy-fraktioissa). Tutkittavan formulaation suhteellinen hyötyosuus XELODA 500 mg:n kanssa oli samanlainen.
Ensimmäinen tutkimus suoritettiin 22:lla lapsipotilaalla (mediaani-ikä 8 vuotta, vaihteluväli 5–17 vuotta), joilla oli äskettäin diagnosoitu ei-levitetty sisäinen diffuusi aivorungon gliooma ja korkealaatuinen glioomi. Tutkimuksen annosmääritysosassa potilaat saivat kapesitabiinia samanaikaisesti sädehoidon kanssa annoksina 500 mg/m2 - 850 mg/m2 12 tunnin välein enintään 9 viikon ajan. Kahden viikon tauon jälkeen potilaat saivat 1250 mg/m2 kapesitabiinia 12 tunnin välein 21 päivän syklin päivinä 1–14 enintään 3 syklin ajan. Kapesitabiinin suurin siedetty annos (MTD) annettiin samanaikaisesti sädehoidon kanssa 650 mg/m2 12 tunnin välein. Tärkeimmät annosta rajoittavat toksisuudet olivat kämmen-plantaarinen erytrodysestesia ja alaniiniaminotransferaasin (ALT) nousu.
Toinen tutkimus suoritettiin 34 muulla lapsipotilaalla, joilla oli äskettäin diagnosoitu ei-levitetty sisäinen diffuusi aivorungon gliooma (mediaani-ikä 7 vuotta, vaihteluväli 3–16 vuotta) ja 10 lapsipotilasta, jotka saivat kapesitabiinin MTD:n annosmääritystutkimuksessa ja täyttivät tämän kokeen kelpoisuuskriteerit. Kaikki potilaat saivat 650 mg/m2 kapesitabiinia 12 tunnin välein ja samanaikaisesti sädehoitoa enintään 9 viikon ajan. Kahden viikon tauon jälkeen potilaat saivat 1250 mg/m2 kapesitabiinia 12 tunnin välein 21 päivän syklin päivinä 1–14 enintään 3 syklin ajan.
Kapesitabiinia saaneilla lapsipotilailla, joilla oli äskettäin diagnosoitu sisäinen aivorungon gliooma, ei parantunut yhden vuoden taudin etenemisvapaa eloonjäämisaste ja yhden vuoden kokonaiseloonjäämisaste verrattuna samanlaiseen muihin kliinisiin tutkimuksiin osallistuneisiin lapsipotilaisiin.
Kapesitabiinin haittavaikutusprofiili oli yhdenmukainen aikuisilla tunnetun haittavaikutusprofiilin kanssa, lukuun ottamatta laboratorioarvojen poikkeavuuksia, joita esiintyi yleisemmin lapsipotilailla. Yleisimmin raportoidut laboratorioarvojen poikkeavuudet (potilasta kohden ≥40 %) olivat kohonneet ALAT (75 %), lymfosytopenia (73 %), leukopenia (73 %), hypokalemia (68 %), trombosytopenia (57 %), hypoalbuminemia (55 %). %), neutropenia (50 %), matala hematokriitti (50 %), hypokalsemia (48 %), hypofosfatemia (45 %) ja hyponatremia (45 %).
Geriatrinen käyttö
Lääkäreiden tulee kiinnittää erityistä huomiota XELODA 500 mg:n haittavaikutusten seurantaan vanhuksilla [ks. VAROITUKSET JA VAROTOIMET ].
Maksan vajaatoiminta
Noudata varovaisuutta, kun potilaita, joilla on lievä tai kohtalainen maksan toimintahäiriö maksametastaasien vuoksi, hoidetaan XELODAn kanssa. Vaikean maksan vajaatoiminnan vaikutusta XELODAan ei tunneta [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Potilailla, joilla oli kohtalainen (kreatiniinipuhdistuma = 30-50 ml/min) ja vaikea (kreatiniinipuhdistuma VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ANNOSTELU JA HALLINNOINTI , ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Akuutin yliannostuksen ilmenemismuotoja ovat pahoinvointi, oksentelu, ripuli, maha-suolikanavan ärsytys ja verenvuoto sekä luuytimen lama. Yliannostuksen lääketieteelliseen hoitoon tulee sisältyä tavanomaiset tukitoimenpiteet, joilla pyritään korjaamaan esiintyviä kliinisiä oireita. Vaikka kliinistä kokemusta dialyysin käytöstä XELODA 500 mg:n yliannostuksen hoitona ei ole raportoitu, dialyysistä voi olla hyötyä alentamalla emoyhdisteen pienimolekyylipainoisen metaboliitin 5'-DFUR:n pitoisuuksia verenkierrossa.
XELODA 500 mg:n kerta-annokset eivät olleet tappavia hiirille, rotille ja apinoille annoksilla 2 000 mg/kg asti (2,4, 4,8 ja 9,6 kertaa ihmisen suositeltu päiväannos mg/m2:n perusteella).
VASTA-AIHEET
Vaikea munuaisten vajaatoiminta
XELODA on vasta-aiheinen potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 30 ml/min [Cockroft ja Gault]) [ks. Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Yliherkkyys
XELODA 500 mg on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä kapesitabiinille tai jollekin sen aineosalle. XELODA on vasta-aiheinen potilailla, jotka ovat yliherkkiä 5-fluorourasiilille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Entsyymit muuttavat kapesitabiinin 5-fluorourasiiliksi (5-FU) in vivo. Sekä normaalit että kasvainsolut metaboloivat 5-FU:ta 5-fluori-2'-deoksiuridiinimonofosfaatiksi (FdUMP) ja 5-fluorouridiinitrifosfaatiksi (FUTP). Nämä metaboliitit aiheuttavat soluvaurioita kahdella eri mekanismilla. Ensinnäkin FdUMP ja folaattikofaktori, N5-10-metyleenitetrahydrofolaatti, sitoutuvat tymidylaattisyntaasiin (TS) muodostaen kovalenttisesti sitoutuneen kolmikomponentin. Tämä sitoutuminen estää tymidylaatin muodostumisen 2'-deoksiuridylaatista. Tymidylaatti on välttämätön tymidiinitrifosfaatin esiaste, joka on välttämätön DNA:n synteesille, joten tämän yhdisteen puute voi estää solujen jakautumista. Toiseksi ydintranskription entsyymit voivat virheellisesti sisällyttää FUTP:tä uridiinitrifosfaatin (UTP) tilalle RNA:n synteesin aikana. Tämä metabolinen virhe voi häiritä RNA:n prosessointia ja proteiinisynteesiä.
Farmakokinetiikka
Imeytyminen
Kun syöpäpotilaille annettiin suun kautta 1255 mg/m2 kahdesti vuorokaudessa, kapesitabiini saavutti huippupitoisuudet veressä noin 1,5 tunnissa (Tmax) ja 5-FU:n huipputasot hieman myöhemmin, 2 tunnin kuluttua. Ruoka vähensi sekä kapesitabiinin imeytymisnopeutta että -laajuutta, ja keskimääräinen Cmax pieneni 60 % ja AUC0-∞ 35 %. Ruoka laski myös 5-FU:n Cmax-arvoa 43 % ja AUC0-∞ 21 %. Ruoka viivästytti sekä vanhemman että 5-FU:n Tmax-arvoa 1,5 tunnilla [katso VAROITUKSET JA VAROTOIMET , ANNOSTELU JA HALLINNOINTI , ja Huumeiden ja ruoan vuorovaikutus ].
XELODA 500 mg:n ja sen metaboliittien farmakokinetiikkaa on arvioitu noin 200 syöpäpotilaalla annosalueella 500-3500 mg/m2/vrk. Tällä alueella XELODAn ja sen metaboliitin, 5'-DFCR:n, farmakokinetiikka oli suhteessa annokseen eivätkä muuttuneet ajan myötä. 5'-DFUR:n ja 5-FU:n AUC:n nousu oli kuitenkin suurempi kuin suhteessa annoksen nousuun, ja 5-FU:n AUC oli 34 % suurempi päivänä 14 kuin päivänä 1. Potilaiden välinen vaihtelu 5-FU:n Cmax ja AUC olivat yli 85 %.
Jakelu
Kapesitabiinin ja sen metaboliittien sitoutuminen plasman proteiineihin on alle 60 %, eikä se ole pitoisuudesta riippuvaista. Kapesitabiini sitoutui ensisijaisesti ihmisen albumiiniin (noin 35 %). XELODA 500 mg:lla on pieni mahdollisuus farmakokineettisiin yhteisvaikutuksiin, jotka liittyvät plasman proteiineihin sitoutumiseen.
Bioaktivaatio ja aineenvaihdunta
Kapesitabiini metaboloituu laajalti entsymaattisesti 5-FU:ksi. Maksassa 60 kDa:n karboksyyliesteraasi hydrolysoi suuren osan yhdisteestä 5'-deoksi-5-fluorosytidiiniksi (5'-DFCR). Sytidiinideaminaasi, entsyymi, jota esiintyy useimmissa kudoksissa, mukaan lukien kasvaimet, muuntaa myöhemmin 5'-DFCR:n 5'-DFUR:ksi. Entsyymi, tymidiinifosforylaasi (dThdPaasi), hydrolysoi sitten 5'DFUR:n aktiiviseksi lääkkeeksi 5-FU. Monet kudokset kaikkialla kehossa ilmentävät tymidiinifosforylaasia. Jotkut ihmisen karsinoomat ilmentävät tätä entsyymiä suurempina pitoisuuksina kuin ympäröivät normaalit kudokset. Kun XELODAa annettiin suun kautta 7 päivää ennen leikkausta kolorektaalisyöpää sairastaville potilaille, 5-FU:n pitoisuuden mediaanisuhde kolorektaalisissa kasvaimissa ja vierekkäisiin kudoksiin oli 2,9 (vaihteluväli 0,9-8,0). Näitä suhteita ei ole arvioitu rintasyöpäpotilailla eikä niitä ole verrattu 5-FU-infuusioon.
Kapesitabiinin aineenvaihduntareitti 5-FU:ksi
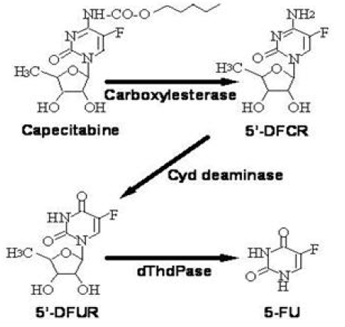
Dihydropyrimidiinidehydrogenaasientsyymi hydraa 5-FU:n, kapesitabiinin aineenvaihdunnan tuotteen, paljon vähemmän toksiseksi 5-fluori-5,6-dihydrofluorourasiiliksi (FUH2). Dihydropyrimidinaasi katkaisee pyrimidiinirenkaan, jolloin saadaan 5-fluoriureidopropionihappoa (FUPA). Lopuksi β-ureido-propionaasi pilkkoo FUPA:n α-fluori-β-alaniiniksi (FBAL), joka poistuu virtsassa.
In vitro -entsymaattiset tutkimukset ihmisen maksan mikrosomeilla osoittivat, että kapesitabiini ja sen metaboliitit (5'-DFUR, 5'-DFCR, 5-FU ja FBAL) eivät estäneet testisubstraattien metaboliaa sytokromi P450 isoentsyymien 1A2, 2A6, 3A4, 2C19, 2D6 ja 2E1.
Erittyminen
Kapesitabiini ja sen metaboliitit erittyvät pääasiassa virtsaan; 95,5 % annetusta kapesitabiiniannoksesta erittyy virtsaan. Ulosteiden erittyminen on vähäistä (2,6 %). Pääasiallinen virtsaan erittynyt metaboliitti on FBAL, joka on 57 % annetusta annoksesta. Noin 3 % annetusta annoksesta erittyy virtsaan muuttumattomana lääkkeenä. Sekä alkuperäisen kapesitabiinin että 5-FU:n eliminaation puoliintumisaika oli noin 0,75 tuntia.
Iän, sukupuolen ja rodun vaikutus kapesitabiinin farmakokinetiikkaan
Populaatioanalyysi kahdesta suuresta kontrolloidusta tutkimuksesta metastasoitunutta paksusuolensyöpää sairastavilla potilailla (n=505), joille annettiin XELODAa 500 mg annoksella 1250 mg/m2 kahdesti päivässä, osoitti, että sukupuoli (202 naista ja 303 miestä) ja rotu (455) valkoihoisilla/valkoihoisilla potilailla, 22 mustaihoisella potilaalla ja 28 muun rodun potilaalla) ei ole vaikutusta 5'DFUR:n, 5-FU:n ja FBAL:n farmakokinetiikkaan. Iällä ei ole merkittävää vaikutusta 5'-DFUR:n ja 5-FU:n farmakokinetiikkaan 27-86 vuoden välillä. Iän 20 prosentin nousu johtaa 15 prosentin nousuun FBAL:n AUC:ssa [katso VAROITUKSET JA VAROTOIMET ja ANNOSTELU JA HALLINNOINTI ].
Kun kapesitabiinia annettiin suun kautta 825 mg/m2 kahdesti vuorokaudessa 14 päivän ajan, japanilaisilla potilailla (n = 18) oli noin 36 % pienempi kapesitabiinin Cmax ja 24 % pienempi AUC kuin valkoihoisilla potilailla (n = 22). Japanilaisilla potilailla oli myös noin 25 % pienempi FBAL:n Cmax ja 34 % pienempi AUC kuin valkoihoisilla potilailla. Näiden erojen kliinistä merkitystä ei tunneta. Merkittäviä eroja ei esiintynyt altistumisessa muille metaboliiteille (5'-DFCR, 5'-DFUR ja 5FU).
Maksan vajaatoiminnan vaikutus
XELODAa on arvioitu 13 potilaalla, joilla oli lievä tai keskivaikea maksan toimintahäiriö, joka johtuu maksametastaasseista, jotka on määritelty bilirubiinin, ASAT/ALAT:n ja alkalisen fosfataasin yhdistelmäpistemäärällä kerta-annoksen 1255 mg/m2 XELODA jälkeen. Sekä kapesitabiinin AUC0-∞ että Cmax suurenivat 60 % potilailla, joilla oli maksan vajaatoiminta, verrattuna potilaisiin, joilla oli normaali maksan toiminta (n=14). 5-FU:n AUC0-∞ ja Cmax eivät muuttuneet. Varovaisuutta on noudatettava annettaessa XELODA 500 mg:aa potilailla, joilla on lievä tai kohtalainen maksan toimintahäiriö maksametastaasien vuoksi. Vaikean maksan vajaatoiminnan vaikutusta XELODA 500 mg:aan ei tunneta [katso VAROITUKSET JA VAROTOIMET ja Käyttö erityispopulaatioissa ].
Munuaisten vajaatoiminnan vaikutus
Kun kapesitabiinia annettiin suun kautta 1250 mg/m2 kahdesti vuorokaudessa eriasteista munuaisten vajaatoimintaa sairastaville syöpäpotilaille, potilailla, joilla oli kohtalainen (kreatiniinipuhdistuma = 30-50 ml/min) ja vaikea (kreatiniinipuhdistuma 80 ml/min). Systeeminen 5'-DFUR-altistus oli 42 % ja 71 % suurempi potilailla, joilla oli keskivaikea munuaisten vajaatoiminta, ja 71 % suurempi kuin normaalipotilailla. Systeeminen kapesitabiinialtistus oli noin 25 % suurempi sekä keskivaikeaa että vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla [ks. ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ja Käyttö erityispopulaatioissa ].
Kapesitabiinin vaikutus varfariinin farmakokinetiikkaan
Neljällä syöpäpotilaalla kapesitabiinin (1250 mg/m2 kahdesti) krooninen antaminen 20 mg:n varfariinin kerta-annoksen kanssa lisäsi S-varfariinin keskimääräistä AUC-arvoa 57 % ja vähensi sen puhdistumaa 37 %. Lähtötilanteen korjattu INR:n AUC nousi näillä neljällä potilaalla 2,8-kertaiseksi, ja suurin havaittu keskimääräinen INR-arvo nousi 91 % [ks. LAATIKKO VAROITUS ja HUUMEIDEN VUOROVAIKUTUKSET ].
Antasidien vaikutus kapesitabiinin farmakokinetiikkaan
Kun Maalox® (20 ml), alumiinihydroksidia ja magnesiumhydroksidia sisältävää antasidia, annettiin välittömästi XELODAn jälkeen (1250 mg/m2, n = 12 syöpäpotilasta), AUC nousi 16 % ja Cmax 35 %. kapesitabiinille ja 18 % ja 22 % vastaavasti 5'-DFCR:lle. XELODAn kolmeen muuhun päämetaboliittiin (5'-DFUR, 5-FU, FBAL) ei havaittu vaikutusta.
Allopurinolin vaikutus kapesitabiiniin
Julkaistussa kirjallisuudessa on raportoitu, että samanaikainen käyttö allopurinolin kanssa voi vähentää kapesitabiinin konversiota aktiivisiksi metaboliiteiksi, FdUMP:ksi ja FUTP:ksi; kliinistä merkitystä ei kuitenkaan täysin karakterisoitu.
Kapesitabiinin vaikutus dosetakselin farmakokinetiikkaan ja päinvastoin
Vaiheen 1 tutkimuksessa arvioitiin XELODAn vaikutusta dosetakselin (Taxotere®) farmakokinetiikkaan ja dosetakselin vaikutusta XELODAn farmakokinetiikkaan 26 potilaalla, joilla oli kiinteitä kasvaimia. XELODAn ei havaittu vaikuttavan dosetakselin farmakokinetiikkaan (Cmax ja AUC), eikä dosetakselilla ole vaikutusta kapesitabiinin ja 5-FU:n esiasteen 5'-DFUR:n farmakokinetiikkaan.
Kliiniset tutkimukset
Adjuvantti paksusuolensyöpä
Monikeskus satunnaistettu, kontrolloitu vaiheen 3 kliininen tutkimus Dukesin C paksusuolensyöpää (X-ACT) sairastavilla potilailla antoi tietoa XELODAn käytöstä paksusuolensyöpäpotilaiden adjuvanttihoidossa. Tutkimuksen ensisijaisena tavoitteena oli verrata XELODAa saaneiden potilaiden sairaudesta vapaata eloonjäämistä (DFS) potilaisiin, jotka saivat pelkän IV 5-FU/LV:n. Tässä tutkimuksessa 1987 potilasta satunnaistettiin joko hoitoon XELODAlla 1250 mg/m2 suun kautta kahdesti vuorokaudessa 2 viikon ajan, mitä seurasi 1 viikon tauko, joka annettiin 3 viikon sykleinä yhteensä 8 sykliä (24 viikkoa) tai IV. bolus 5-FU 425 mg/m2 ja 20 mg/m2 IV leukovoriini päivinä 1-5, annettuna 4 viikon sykleinä yhteensä 6 sykliä (24 viikkoa). Tutkimukseen osallistuneiden potilaiden edellytettiin olevan 18–75-vuotiaita, joilla oli histologisesti vahvistettu Dukesin C-vaiheen paksusuolensyöpä ja vähintään yksi positiivinen imusolmuke, ja heille oli suoritettu (8 viikon sisällä ennen satunnaistamista) täydellinen primaarisen kasvaimen resektio ilman makroskooppisia tai mikroskooppisia todisteita jäljellä olevasta kasvaimesta. Potilailta ei myöskään vaadittu aiempaa sytotoksista kemoterapiaa tai immunoterapiaa (paitsi steroideja), ja heidän ECOG-suorituskykynsä oli 0 tai 1 (KPS ≥ 70 %), ANC ≥ 1,5 x 109/l, verihiutaleet ≥ 100 x 109/l, seerumin kreatiniini ≤ kreatiniini 1,5 ULN, kokonaisbilirubiini ≤ 1,5 ULN, AST/ALT ≤ 2,5 ULN ja CEA normaaleissa rajoissa satunnaistamisen aikana.
XELODA- ja 5-FU/LV-potilaiden demografiset lähtötilanteet on esitetty taulukossa 10. Lähtötilanteen ominaisuudet olivat hyvin tasapainossa eri haarojen välillä.
Kaikki potilaat, joilla oli normaali munuaisten toiminta tai lievä munuaisten vajaatoiminta, aloittivat hoidon täydellä aloitusannoksella 1250 mg/m2 suun kautta kahdesti vuorokaudessa. Aloitusannosta pienennettiin potilailla, joilla oli kohtalainen munuaisten vajaatoiminta (laskettu kreatiniinipuhdistuma 30-50 ml/min) lähtötilanteessa [ks. ANNOSTELU JA HALLINNOINTI ]. Myöhemmin kaikkien potilaiden annoksia muutettiin tarvittaessa toksisuuden mukaan. XELODA 500 mg:n annoksen hallintaan sisältyi annoksen pienentämistä, syklin viivästymistä ja hoidon keskeytyksiä (ks. taulukko 11).
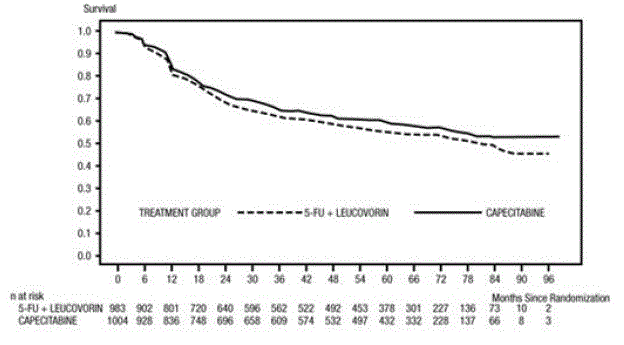
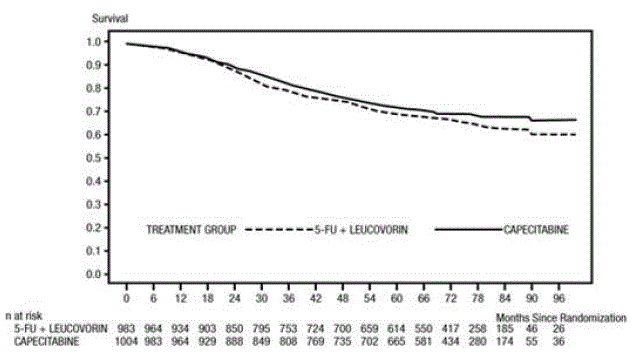
Mediaaniseuranta analyysin aikaan oli 83 kuukautta (6,9 vuotta). DFS:n vaarasuhde XELODA 500 mg:lle verrattuna 5-FU/LV:hen oli 0,88 (95 % CI 0,77 – 1,01) (katso ja Kuvio 1 ). Koska vaarasuhteen ylempi kaksipuolinen 95 %:n luottamusraja oli alle 1,20, XELODA ei ollut huonompi kuin 5-FU/LV. Non-inferiority margin 1,20:n valinta vastaa noin 75 %:n säilymistä 5-FU/LV:n vaikutuksesta DFS:ään. XELODAn riskisuhde 5-FU/LV:hen verrattuna kokonaiseloonjäämiseen oli 0,86 (95 % CI 0,74 – 1,01). Viiden vuoden kokonaiseloonjäämisaste oli 71,4 % XELODAn ja 68,4 % 5-FU/LV:n kohdalla (katso kuva 2).
Kuva 1 Kaplan-Meierin arviot taudista eloonjäämisestä (kaikki satunnaistettu populaatio)a
Kuva 2 Kaplan-Meierin arviot kokonaiseloonjäämisestä (kaikki satunnaistettu väestö)
Metastaattinen paksusuolen syöpä
Kenraali
XELODAn suositusannos 500 mg määritettiin avoimessa, satunnaistetussa kliinisessä tutkimuksessa, jossa selvitettiin jatkuvan kapesitabiinihoidon (1331 mg/m2/vrk kahteen jaettuun annokseen, n=39) ja kapesitabiinin jaksoittaisen hoidon tehoa ja turvallisuutta ( 2510 mg/m2/vrk kahteen annokseen jaettuna, n=34) ja jaksoittainen hoito kapesitabiinilla yhdessä oraalisen leukovoriinin (LV) kanssa (kapesitabiini 1657 mg/m2/vrk kahteen annokseen jaettuna, n=35; leukovoriini 60 mg/ päivä) potilailla, joilla on edennyt ja/tai metastaattinen kolorektaalinen karsinooma ensilinjan metastaattisissa olosuhteissa. Leukovoriinin lisäämisessä XELODAan ei ollut ilmeistä etua vastenopeudessa; myrkyllisyys kuitenkin lisääntyi. XELODA, 1250 mg/m2 kahdesti vuorokaudessa 14 päivän ajan, jota seurasi 1 viikon tauko, valittiin kliinistä jatkokehitystä varten kolmen tutkitun hoito-ohjelman yleisen turvallisuus- ja tehoprofiilin perusteella.
Monoterapia
Tiedot kahdesta avoimesta, monikeskuksesta, satunnaistetusta, kontrolloidusta kliinisestä tutkimuksesta, joihin osallistui 1207 potilasta, tukevat XELODAn käyttöä metastasoituneen kolorektaalikarsinooman ensilinjan hoidossa. Nämä kaksi kliinistä tutkimusta olivat suunnittelultaan identtisiä, ja ne suoritettiin 120 keskuksessa eri maissa. Tutkimus 1 suoritettiin Yhdysvalloissa, Kanadassa, Meksikossa ja Brasiliassa; Tutkimus 2 suoritettiin Euroopassa, Israelissa, Australiassa, Uudessa-Seelannissa ja Taiwanissa. Molemmissa tutkimuksissa yhteensä 603 potilasta satunnaistettiin saamaan hoitoa XELODA 500 mg:lla annoksella 1250 mg/m2 kahdesti vuorokaudessa 2 viikon ajan, minkä jälkeen seurasi 1 viikon tauko ja annettiin 3 viikon sykleinä. 604 potilasta satunnaistettiin saamaan hoitoa 5-FU:lla ja leukovoriinilla (20 mg/m2 leukovoriini IV ja sen jälkeen 425 mg/m2 IV bolus 5-FU, päivinä 1–5, joka 28. päivä).
Molemmissa tutkimuksissa arvioitiin kokonaiseloonjäämistä, etenemiseen kuluvaa aikaa ja vasteprosenttia (täydelliset ja osittaiset vasteet). Vastaukset määriteltiin Maailman terveysjärjestön kriteerien mukaan ja toimitettiin sokeutetulle riippumattomalle arviointikomitealle (IRC). Toimeksiantaja sovitti erot arvioiden välillä tutkijan ja IRC:n välillä määritellyn algoritmin mukaisesti. Eloonjäämistä arvioitiin non-inferiority-analyysin perusteella.
XELODA- ja 5-FU/LV-potilaiden demografiset perustiedot on esitetty taulukossa 13.
Kahden vaiheen 3 tutkimuksen tehon päätepisteet on esitetty kohdissa ja
Kuva 3 Kaplan-Meier-käyrä yhdistetyn datan kokonaisselviytymiselle (tutkimukset 1 ja 2)
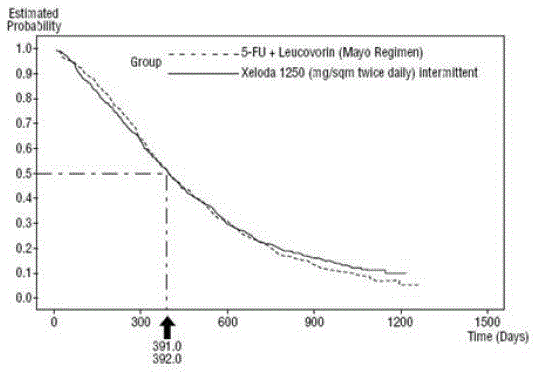
XELODA oli parempi kuin 5-FU/LV objektiivisen vasteen suhteen tutkimuksessa 1 ja tutkimuksessa 2. XELODA 500 mg:n ja 5-FU/LV:n samankaltaisuus näissä tutkimuksissa arvioitiin tutkimalla mahdollisia eroja näiden kahden hoidon välillä. Sen varmistamiseksi, että XELODA 500 mg:lla on kliinisesti merkityksellinen eloonjäämisvaikutus, suoritettiin tilastollisia analyyseja sen määrittämiseksi, kuinka suuri prosenttiosuus 5-FU/LV:n eloonjäämisvaikutuksesta XELODA säilytti. Arvio 5-FU/LV:n eloonjäämisvaikutuksesta johdettiin kymmenen satunnaistetun tutkimuksen meta-analyysistä julkaistusta kirjallisuudesta, joissa 5-FU:ta verrattiin 5-FU/LV-hoitoihin, jotka olivat samanlaisia kuin näissä tutkimuksissa käytetyt kontrolliryhmät. 1 ja 2. Menetelmä hoitojen vertailuun oli tutkia pahin tapaus (95 %:n luotettavuuden yläraja) 5-FU/LV:n ja XELODA 500 mg:n väliselle erolle ja osoittaa, että yli 50 %:n menetys 5- FU/LV-eloonjäämisvaikutus suljettiin pois. Osoitettiin, että ylläpidetyn 5-FU/LV:n eloonjäämisvaikutuksen prosenttiosuus oli vähintään 61 % tutkimuksessa 2 ja 10 % tutkimuksessa 1. Yhdistetty tulos vastaa vähintään 50 %:n säilymistä 5:n vaikutuksesta. -FU/LV. On huomattava, että nämä säilyneen vaikutuksen arvot perustuvat 5-FU/LV:n ja XELODAn 500 mg:n eron ylärajaan. Nämä tulokset eivät sulje pois mahdollisuutta, että XELODA 500 mg on todellista vastaavuutta 5-FU/LV:n kanssa (katso ja Kuva 3 ).
Rintasyöpä
XELODAa on arvioitu kliinisissä tutkimuksissa yhdessä dosetakselin (Taxotere®) kanssa ja monoterapiana.
Yhdessä Docetaxelin kanssa
Vaiheen 3 kliinisessä tutkimuksessa yhdessä dosetakselin kanssa käytetty XELODAn annos perustui faasin 1 tutkimuksen tuloksiin, jossa useita dosetakselin annoksia annettiin 3 viikon sykleissä yhdessä jaksoittaisen XELODAn (14 päivää) kanssa. hoidon kesto ja sen jälkeen 7 päivän tauko) arvioitiin. Yhdistelmäannostusohjelma valittiin 75 mg/m2:n siedettävyysprofiilin perusteella, kun dosetakselia annettiin 3 viikon sykleissä yhdessä 1250 mg/m2:n kanssa kahdesti vuorokaudessa 14 päivän ajan 500 mg:n XELODA-annoksella 3 viikon sykleissä. Hyväksytty annos 100 mg/m2 dosetakselia annettuna 3 viikon sykleissä oli faasin 3 tutkimuksen kontrollihaara.
XELODAa yhdessä dosetakselin kanssa arvioitiin avoimessa, monikeskustutkimuksessa, satunnaistetussa tutkimuksessa 75 keskuksessa Euroopassa, Pohjois-Amerikassa, Etelä-Amerikassa, Aasiassa ja Australiassa. Mukaan otettiin yhteensä 511 potilasta, joilla oli metastaattinen rintasyöpä, joka oli resistentti antrasykliiniä sisältävälle hoidolle tai uusiutui sen aikana tai sen jälkeen tai uusiutui 2 vuoden sisällä antrasykliiniä sisältävän adjuvanttihoidon päättymisestä. Kaksisataaviisikymmentäviisi (255) potilasta satunnaistettiin saamaan XELODAa 1250 mg/m2 kahdesti vuorokaudessa 14 päivän ajan, jota seurasi 1 viikko ilman hoitoa ja dosetakselia 75 mg/m2 1 tunnin laskimonsisäisenä infuusiona kolmen viikon jaksoissa. Monoterapiahaarassa 256 potilasta sai dosetakselia 100 mg/m2 1 tunnin laskimonsisäisenä infuusiona kolmen viikon jaksoissa. Potilaiden demografiset tiedot on esitetty taulukossa 16.
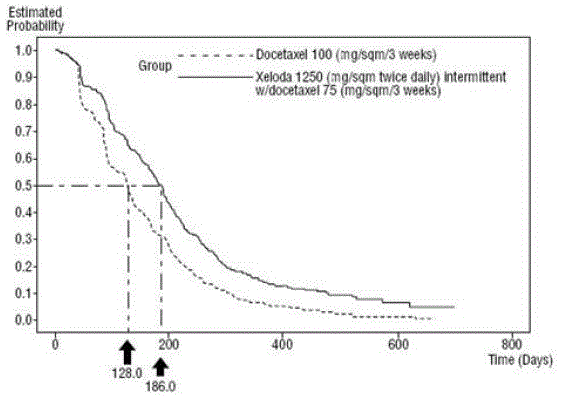
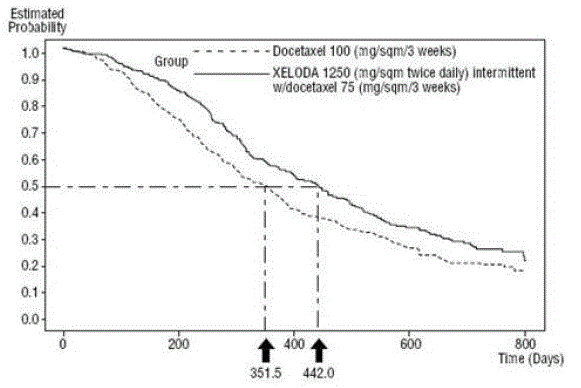
XELODA yhdessä dosetakselin kanssa paransi tilastollisesti merkitsevästi taudin etenemiseen kuluvaa aikaa, kokonaiseloonjäämistä ja objektiivista vasteprosenttia verrattuna dosetakselin monoterapiaan, kuten osoitetaan ja Kuva 5 .
Kuva 4 Kaplan-Meierin arviot taudin etenemiseen kuluvasta ajasta XELODA ja Docetaxel vs Docetaxel
Kuva 5 Kaplan-Meierin selviytymisarviot XELODA ja Docetaxel vs Docetaxel
Monoterapia
XELODAn kasvainten vastaista vaikutusta monoterapiana arvioitiin avoimessa yksihaaraisessa tutkimuksessa, joka suoritettiin 24 keskuksessa Yhdysvalloissa ja Kanadassa. Mukaan otettiin yhteensä 162 potilasta, joilla oli vaiheen IV rintasyöpä. Ensisijainen päätetapahtuma oli kasvainvaste potilailla, joilla oli mitattavissa oleva sairaus, ja vaste määriteltiin ≥ 50 %:n laskuksi kaksiulotteisesti mitattavissa olevan taudin kohtisuorassa olevien halkaisijoiden tulojen summassa vähintään yhden kuukauden ajan. XELODAa annettiin annoksella 1255 mg/m2 kahdesti vuorokaudessa 2 viikon ajan, minkä jälkeen seurasi 1 viikon tauko ja annettiin 3 viikon sykleinä. Perustason demografiset ja kliiniset ominaisuudet kaikille potilaille (n = 162) ja potilaille, joilla on mitattavissa oleva sairaus (n = 135), on esitetty kohdassa . Resistenssi määriteltiin eteneväksi sairaudeksi hoidon aikana, alkuvasteen kanssa tai ilman, tai uusiutumisena 6 kuukauden sisällä antrasykliiniä sisältävän adjuvanttikemoterapian hoidon päättymisestä.
Kasvainten vastaiset vasteet potilaille, joiden sairaus on resistentti sekä paklitakselille että antrasykliinille, on esitetty
Alaryhmässä 43 potilasta, jotka olivat kaksinkertaisesti resistenttejä, mediaaniaika etenemiseen oli 102 päivää ja mediaani eloonjäämisaika 255 päivää. Objektiivista vasteprosenttia tässä populaatiossa tuki 18,5 %:n vasteprosentti (1 CR, 24 PR:tä) 135 potilaan kokonaispopulaatiossa, joilla oli mitattavissa oleva sairaus ja jotka olivat vähemmän vastustuskykyisiä kemoterapialle (katso ). Mediaaniaika etenemiseen oli 90 päivää ja mediaani eloonjäämisaika oli 306 päivää.
POTILASTIEDOT
XELODA® (zeh-LOE-duh) (kapesitabiini) tabletit
Mikä on tärkein tieto, joka minun pitäisi tietää XELODA 500mg:sta?
XELODA 500mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- XELODA voi olla vuorovaikutuksessa verta ohentavien lääkkeiden, kuten varfariinin (COUMADIN®) kanssa. XELODA 500 mg:n ottaminen näiden lääkkeiden kanssa voi aiheuttaa muutoksia verihyytymien nopeudessa ja voi aiheuttaa verenvuotoa, joka voi johtaa kuolemaan. Tämä voi tapahtua heti muutaman päivän kuluttua XELODA 500 mg:n käytön aloittamisesta tai myöhemmin hoidon aikana ja mahdollisesti jopa kuukauden sisällä XELODAn käytön lopettamisesta. Riskisi voi olla suurempi, koska sinulla on syöpä ja jos olet yli 60-vuotias.
- Kerro terveydenhuollon tarjoajallesi ennen XELODAn ottamista, jos käytät varfariinia (COUMADIN) tai muuta verta ohentavaa lääkettä.
- Jos käytät varfariinia (COUMADIN) tai muuta verenohennusainetta, joka on varfariinin kaltaista (COUMADIN) XELODA-hoidon aikana, terveydenhuollon tarjoajan tulee tehdä verikokeita usein tarkistaakseen, kuinka nopeasti veri hyytyy XELODA-hoidon aikana ja sen jälkeen. Terveydenhuollon tarjoaja voi tarvittaessa muuttaa verenohennuslääkkeen annostasi.
Katso "Mitä ovat XELODA 500mg:n mahdolliset sivuvaikutukset?" lisätietoja sivuvaikutuksista.
Mikä on XELODA?
XELODA on reseptilääke, jota käytetään ihmisten hoitoon:
- paksusuolen syöpä, joka on levinnyt paksusuolen lähellä oleviin imusolmukkeisiin (Dukesin C-vaihe) leikkauksen jälkeen.
- paksusuolen tai peräsuolen syöpä (kolorektaalinen), joka on levinnyt muihin kehon osiin (metastaattinen), ensimmäisenä syöpäsi hoitona tässä vaiheessa.
- rintasyöpä, joka on levinnyt muihin kehon osiin (metastaattinen) yhdessä toisen dosetakseli-nimisen lääkkeen kanssa sen jälkeen, kun hoito tietyillä muilla syöpälääkkeillä ei ole tehonnut.
- rintasyöpä, joka on levinnyt muihin kehon osiin ja joka ei ole parantunut paklitakselihoidon ja tiettyjen muiden syöpälääkkeiden jälkeen tai joka ei voi enää saada hoitoa tietyillä syöpälääkkeillä.
Ei tiedetä, onko XELODA 500 mg turvallinen ja tehokas lapsille.
Älä ota XELODAA, jos:
- sinulla on vakavia munuaisongelmia
- olet allerginen kapesitabiinille, 5-fluorourasiilille tai jollekin sen XELODAn ainesosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo XELODAn ainesosista.
Keskustele terveydenhuollon tarjoajan kanssa ennen XELODAn ottamista, jos et ole varma, onko sinulla jokin yllä luetelluista tiloista.
Ennen kuin otat XELODAn, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää XELODAsta?"
- on ollut sydänongelmia
- sinulla on munuais- tai maksaongelmia
- sinulle on kerrottu, että sinulta puuttuu DPD-entsyymi (dihydropyrimidiinidehydrogenaasi).
- olet raskaana tai suunnittelet raskautta. XELODA 500mg voi vahingoittaa sikiötäsi. Terveydenhuollon tarjoajasi tulee tehdä raskaustesti ennen XELODA-hoidon aloittamista. Kerro heti terveydenhuollon tarjoajallesi, jos tulet raskaaksi tai epäilet olevasi raskaana XELODA-hoidon aikana.
- Naaraat jotka voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä hoidon aikana ja 6 kuukauden ajan viimeisen annoksen jälkeen. Keskustele terveydenhuollon tarjoajasi kanssa ehkäisyvaihtoehdoista, jotka voivat sopia sinulle XELODA-hoidon aikana.
- Miehet joiden naispuoliset kumppanit voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä hoidon aikana ja 3 kuukauden ajan viimeisen annoksen jälkeen.
- imetät tai aiot imettää. Ei tiedetä, erittyykö XELODA äidinmaitoon. Älä imetä XELODA 500 mg -hoidon aikana ja 2 viikkoa viimeisen annoksen jälkeen.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. XELODA voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa XELODAn vaikutustapaan.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa XELODA 500 mg?
- Ota XELODA juuri sen verran kuin terveydenhuollon tarjoajasi on määrännyt.
- Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon XELODAa sinun tulee ottaa ja milloin se tulee ottaa.
- Ota XELODA 2 kertaa päivässä, 1 kerta aamulla ja 1 kerta illalla.
- Ota XELODA 500 mg 30 minuutin kuluessa aterian lopettamisen jälkeen.
- Niele XELODA 500 mg tabletit kokonaisina veden kera. Älä murskaa tai leikkaa XELODA 500 mg tabletit. Jos et voi niellä XELODA-tabletteja kokonaisina, kerro siitä terveydenhuoltoon.
- Terveydenhuollon tarjoaja voi muuttaa annostasi, väliaikaisesti lopettaa tai lopettaa XELODA 500 mg -hoidon pysyvästi, jos sinulle ilmaantuu haittavaikutuksia.
- Jos otat liikaa XELODAa, soita heti terveydenhuollon tarjoajallesi tai mene lähimmän sairaalan ensiapuun.
Mitkä ovat XELODAn mahdolliset sivuvaikutukset?
XELODA voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Pahoinvointi ja oksentelu ovat yleisiä XELODAn kanssa. Jos menetät ruokahalusi, tunnet olosi heikoksi ja sinulla on pahoinvointia, oksentelua tai ripulia, voit nopeasti kuivua.
Lopeta XELODAn käyttö ja soita heti terveydenhuollon tarjoajallesi, jos:
Jos valkosolumääräsi on hyvin alhainen, sinulla on suurentunut riski saada infektio. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulle nousee 100,5 oF tai korkeampi kuume tai sinulla on muita infektion merkkejä ja oireita.
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää XELODAsta?"
- Ripuli. Ripuli on yleistä XELODAn kanssa ja voi joskus olla vaikeaa. Lopeta XELODAn käyttö ja soita heti terveydenhuollon tarjoajallesi, jos suolen liikkeet lisääntyvät vuorokaudessa neljällä tai useammalla suolen liikkeellä kuin sinulla on tavallista, tai suolen liikkeitä yöllä. Kysy terveydenhuollon tarjoajalta, mitä lääkkeitä voit käyttää ripulin hoitoon. Jos sinulla on vaikea verinen ripuli, johon liittyy voimakasta vatsakipua ja kuumetta, lopeta Xeloda 500 mg -valmisteen käyttö ja soita heti terveydenhuollon tarjoajalle tai mene lähimmän sairaalan ensiapuun.
- Sydänongelmat. XELODA voi aiheuttaa sydänongelmia, mukaan lukien: sydänkohtauksen ja sydämen verenkierron heikkenemisen, rintakipua, epäsäännöllisiä sydämenlyöntejä, muutoksia sydämesi sähköisessä toiminnassa EKG:ssä, sydänlihasongelmia, sydämen vajaatoimintaa ja äkillisiä kuolema. Lopeta XELODA 500 mg:n käyttö ja soita välittömästi terveydenhuollon tarjoajalle tai mene lähimmän sairaalan ensiapuun, jos saat uusia sydänongelman oireita, mukaan lukien:
- rintakipu
- huimaus
- hengenahdistus
- huimaus
- Liian runsaan nesteen menetys (dehydraatio) ja munuaisten vajaatoiminta. XELODA 500 mg:n käytön yhteydessä voi tapahtua nestehukkaa ja se voi aiheuttaa äkillisen munuaisten vajaatoiminnan, joka voi johtaa kuolemaan. Sinulla on suurempi riski, jos sinulla on munuaisongelmia ennen XELODA 500 mg:n ottamista ja käytät myös muita lääkkeitä, jotka voivat aiheuttaa munuaisongelmia.
- oksentaa vähintään 2 kertaa päivässä.
- pystyvät syömään tai juomaan vain vähän silloin tällöin tai eivät ollenkaan pahoinvoinnin vuoksi.
- on ripuli. Katso "ripuli" yllä.
- Vaikeat iho- ja suun reaktiot.
- XELODA 500 mg voi aiheuttaa vakavia ihoreaktioita, jotka voivat johtaa kuolemaan. Kerro välittömästi terveydenhuollon tarjoajalle, jos sinulle ilmaantuu ihottumaa, rakkuloita ja ihon hilseilyä. Terveydenhuollon tarjoaja voi kehottaa sinua lopettamaan XELODAn käytön, jos sinulla on vakava ihoreaktio. Älä ota XELODA 500 mg uudelleen, jos näin käy.
- XELODA 500 mg voi myös aiheuttaa "käsi ja jalka" -oireyhtymän. Käsien ja jalkojen oireyhtymä on yleinen XELODA 500 mg:n käytön yhteydessä, ja se voi aiheuttaa käsien ja jalkojen puutumista ja tunnemuutoksia tai punoitusta, kipua tai turvotusta käsissäsi ja jaloissasi. Lopeta XELODAn käyttö ja soita heti terveydenhuollon tarjoajallesi, jos sinulla on jokin näistä oireista etkä pysty suorittamaan tavallisia toimintojasi.
- Käsi- ja jalkaoireyhtymä voi johtaa sormenjälkien menettämiseen, mikä voi vaikuttaa henkilöllisyyteen.
- voit saada haavaumia suussasi tai kielessäsi XELODA-hoidon aikana. Lopeta XELODA 500 mg:n käyttö ja soita terveydenhuollon tarjoajalle, jos saat kivuliasta punoitusta, turvotusta tai haavaumia suussasi tai kielessäsi tai jos sinulla on syömisongelmia.
- Lisääntynyt bilirubiinitaso veressäsi ja maksaongelmia. Kohonnut bilirubiinipitoisuus veressäsi on yleistä XELODA 500 mg:n käytön yhteydessä, ja se voi joskus olla myös vaikeaa. Terveydenhuollon tarjoaja tarkistaa sinut näiden ongelmien varalta XELODA-hoidon aikana.
- Vähentynyt valkosolujen, verihiutaleiden ja punasolujen määrä. Terveydenhuollon tarjoaja tekee verikokeita XELODA-hoidon aikana tarkistaakseen verisolumääräsi.
80-vuotiailla tai sitä vanhemmilla ihmisillä saattaa olla todennäköisemmin vakavia tai vakavia sivuvaikutuksia XELODAn käytön yhteydessä.
XELODA 500mg:n yleisimmät sivuvaikutukset ovat:
- ripuli
- vatsan alueen (vatsan) kipu
- käsien ja jalkojen syndrooma
- heikkoutta ja väsymystä
- pahoinvointi
- oksentanut
- punasolujen hajoamistuotteiden (bilirubiinin) lisääntyminen veressäsi
XELODA voi aiheuttaa vakavia allergisia reaktioita. Kerro terveydenhuollon tarjoajallesi, jos sinulla on koskaan ollut allerginen reaktio kapesitabiinille tai 5-fluorourasiilille. Katso "Älä ota XELODAA, jos:". Lopeta XELODA 500 mg:n käyttö ja soita välittömästi terveydenhuollon tarjoajalle tai mene ensiapuun, jos sinulla on jokin seuraavista vakavan allergisen reaktion oireista:
- punaiset kutisevat näppylät iholla (nokkosihottuma)
- ihon punoitus
- kasvojen, huulten, kielen tai kurkun turvotus
- ihottuma
- kutina
- nielemis- tai hengitysvaikeuksia
XELODA 500mg voi aiheuttaa hedelmällisyysongelmia naisilla ja miehillä. Tämä voi vaikuttaa mahdollisuuteen saada lapsi. Keskustele terveydenhuollon tarjoajan kanssa, jos olet huolissasi hedelmällisyydestä.
Nämä eivät ole kaikkia XELODAn mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka XELODA tulee säilyttää?
- Säilytä XELODA 500 mg huoneenlämmössä 20 - 25 °C (68 °F - 77 °F).
- Säilytä XELODA 500 mg tiiviisti suljetussa astiassa.
- Kysy terveydenhuollon tarjoajalta tai apteekista, kuinka käyttämätön XELODA hävitetään turvallisesti.
Pidä XELODA ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa XELODAn turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä XELODAa sairauteen, johon sitä ei ole määrätty. Älä anna XELODA 500 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja XELODA 500 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia XELODA 500mg sisältää?
Aktiivinen ainesosa: kapesitabiini
Inaktiiviset ainesosat: vedetön laktoosi, kroskarmelloosinatrium, hydroksipropyylimetyyliselluloosa, mikrokiteinen selluloosa, magnesiumstearaatti ja puhdistettu vesi. Persikka- tai vaalea persikkakalvopäällyste sisältää hydroksipropyylimetyyliselluloosaa, talkkia, titaanidioksidia ja synteettisiä keltaisia ja punaisia rautaoksideja.
Lisätietoja on osoitteessa http://www.gene.com/patients/medicines/xeloda 500mg tai soittamalla numeroon 1-877-436-3683.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
