Casodex 50mg Bicalutamide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Casodex on ja miten sitä käytetään?
Casodex on reseptilääke, jota käytetään eturauhassyövän oireiden hoitoon. Casodex 50 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Casodex 50mg kuuluu lääkeluokkaan nimeltä Antineoplastics, Antiandrogen; CYP3A4:n estäjä, kohtalainen.
Ei tiedetä, onko Casodex turvallinen ja tehokas lapsille.
Mitkä ovat Casodexin mahdolliset sivuvaikutukset?
Casodex voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintojen kipu tai turvotus,
- verta virtsassasi,
- kuume,
- vilunväristykset,
- äkillinen rintakipu tai epämukavuus,
- hengityksen vinkuminen,
- kuiva yskä,
- hengenahdistus,
- kalpea iho,
- huimaus,
- nopea syke,
- keskittymisvaikeuksia,
- pahoinvointi,
- ylävatsakipu,
- väsynyt olo,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- nälkä,
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- uneliaisuus,
- kuiva iho,
- näön hämärtyminen ja
- painonpudotus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Casodex 50mg:n yleisimmät sivuvaikutukset ovat:
- kuumia aaltoja,
- kipu selässäsi,
- lantiokipu,
- vatsakipu,
- turvotus käsissäsi, nilkoissasi tai jaloissasi,
- lisääntynyt virtsaaminen yöllä,
- heikkous,
- huimaus,
- pahoinvointi,
- ripuli ja
- ummetus
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Casodexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
CASODEX® (bikalutamidi) -tabletit sisältävät 50 mg bikalutamidia, ei-steroidista androgeenireseptorin estäjää, jolla ei ole muuta tunnettua endokriinistä aktiivisuutta. Kemiallinen nimi on propaaniamidi, N [4-syaani-3-(trifluorimetyyli)fenyyli]-3-[(4-fluorifenyyli)sulfonyyli]-2-hydroksi-2-metyyli-,(+-). Rakenteelliset ja empiiriset kaavat ovat:
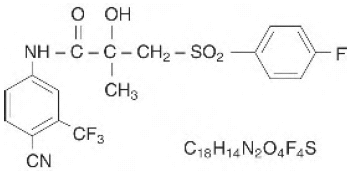
Bikalutamidin molekyylipaino on 430,37. pKa' on noin 12. Bikalutamidi on hieno valkoinen tai luonnonvalkoinen jauhe, joka on käytännössä liukenematon veteen 37 °C:ssa (5 mg/1000 ml), liukenee heikosti kloroformiin ja absoluuttiseen etanoliin, liukenee niukasti metanoliin ja liukenee asetoniin ja tetrahydrofuraani.
CASODEX on rasemaatti, jonka antiandrogeeninen aktiivisuus on lähes yksinomaan bikalutamidin R-enantiomeeri; S-enantiomeeri on olennaisesti inaktiivinen.
CASODEX 50 mg tablettien inaktiiviset aineet ovat laktoosi, magnesiumstearaatti, hypromelloosi, polyetyleeniglykoli, polyvidoni, natriumtärkkelysglykolaatti ja titaanidioksidi.
INDIKAATIOT
CASODEX 50 mg päivässä on tarkoitettu käytettäväksi yhdistelmähoidossa luteinisoivaa hormonia vapauttavan hormonin (LHRH) analogin kanssa D2-vaiheen metastaattisen eturauhaskarsinooman hoitoon.
CASODEX 150 mg päivässä ei ole hyväksytty käytettäväksi yksin tai muiden hoitojen kanssa [katso Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Suositeltu annos ja aikataulu
Suositeltu annos CASODEX 50 mg hoidolle yhdessä LHRH-analogin kanssa on yksi 50 mg:n tabletti kerran vuorokaudessa (aamulla tai illalla) ruoan kanssa tai ilman. On suositeltavaa, että CASODEX 50 mg otetaan samaan aikaan joka päivä. CASODEX-hoito tulee aloittaa samaan aikaan LHRH-analogin kanssa. Jos CASODEX 50 mg -annos unohtuu, ota seuraava annos sovittuun aikaan. Älä ota unohtunutta annosta äläkä kaksinkertaista seuraavaa annosta.
Annoksen säätö munuaisten vajaatoiminnassa
Annosta ei tarvitse muuttaa potilaille, joilla on munuaisten vajaatoiminta [katso Käyttö tietyissä populaatioissa ].
Annoksen säätö maksan vajaatoiminnassa
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa sairastavilla potilailla (n = 4) bikalutamidin aktiivisen enantiomeerin puoliintumisaika piteni 76 % (5,9 ja 10,4 vuorokautta normaalilla ja 10,4 vuorokautta), mutta annostusta ei tarvitse muuttaa. katso Käyttö tietyissä populaatioissa ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuus
CASODEX® (bikalutamidi) 50 mg tabletit suun kautta.
Valkoiset, kalvopäällysteiset tabletit (joiden toisella puolella on merkintä "CDX50" ja toisella puolella "CASODEX-logo") toimitetaan yksikköannospulloissa, joissa on 30 tablettia (0310-0705-30).
Varastointi ja käsittely
Säilytä valvotussa huoneenlämmössä, 20°-25°C (68°-77°F).
Valmistettu: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Tarkistettu: maaliskuu 2017.
SIVUVAIKUTUKSET
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kokemus kliinisistä kokeista
Potilailla, joilla oli pitkälle edennyt eturauhassyöpä, joita hoidettiin CASODEX 50 mg:lla yhdessä LHRH-analogin kanssa, yleisin haittavaikutus oli kuumat aallot (53 %).
Monikeskustutkimuksessa, kaksoissokkoutetussa, kontrolloidussa kliinisessä monikeskustutkimuksessa, jossa verrattiin CASODEX 50 mg kerran vuorokaudessa flutamidiin 250 mg kolmesti vuorokaudessa, kutakin yhdessä LHRH-analogin kanssa, seuraavat haittavaikutukset, joiden ilmaantuvuus oli vähintään 5 %, riippumatta syy-yhteydestä, on raportoitu.
Muut CASODEX-LHRH-analogihoitoryhmässä raportoidut haittavaikutukset (suurempi tai yhtä suuri kuin 2 %, mutta vähemmän kuin 5 %) on lueteltu alla kehokohtaisesti ja ne ovat esiintymistiheyden mukaisessa järjestyksessä kussakin kehon järjestelmässä syy-yhteydestä riippumatta.
Keho kokonaisuutena: kasvain; Niskakipu; Kuume; Vilunväristykset; Sepsis; Tyrä; Kysta
Sydän: Angina pectoris; Sydämen vajaatoiminta; Sydäninfarkti; Sydänpysähdys; Sepelvaltimon häiriö; Pyörtyminen
Ruoansulatus: Melena; Peräsuolen verenvuoto; Kuiva suu; Dysfagia; Ruoansulatuskanavan häiriö; Periodontal absessi; Ruoansulatuskanavan karsinooma
Aineenvaihdunta ja ravitsemus: turvotus; BUN lisääntynyt; Lisääntynyt kreatiniini; Kuivuminen; Kihti; Hyperkolesteremia
Tuki- ja liikuntaelimistö: myalgia; Jalkakrampit
Hermostunut: Hypertonia; Hämmennys; Uneliaisuus; Libido vähentynyt; neuropatia; Hermostuneisuus
Hengitys: keuhkosairaus; Astma; Nenäverenvuoto; Sinuiitti
Iho ja lisäkkeet: Kuiva iho; hiustenlähtö; Kutina; herpes zoster; ihokarsinooma; Ihosairaus
Erityiset aistit: Määritelty kaihi
Urogenitaaliset: Dysuria; Virtsan kiireellisyys; hydronefroosi; Virtsateiden häiriö
Epänormaalit laboratoriotestien arvot:
Laboratorioarvojen poikkeavuudet mukaan lukien: kohonnut AST, ALT, bilirubiini, BUN ja kreatiniini; ja hemoglobiinin ja valkosolujen määrän laskua on raportoitu sekä CASODEX-LHRH-analogilla hoidetuilla että flutamidi-LHRH-analogilla hoidetuilla potilailla.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu CASODEXin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Hengityselinten häiriöt: Interstitiaalinen keuhkosairaus (joissakin tapauksissa kuolemaan johtava), mukaan lukien interstitiaalinen pneumoniitti ja keuhkofibroosi, useimmiten yli 50 mg:n annoksilla.
Ihon ja ihonalaisen kudoksen häiriöt: Valoherkkyys
HUUMEIDEN VUOROVAIKUTUKSET
Kliiniset tutkimukset eivät ole osoittaneet lääkevuorovaikutuksia bikalutamidin ja LHRH-analogien (gosereliinin tai leuprolidin) välillä. Ei ole näyttöä siitä, että bikalutamidi indusoi maksaentsyymejä.
In vitro -tutkimukset ovat osoittaneet, että R-bikalutamidi on CYP 3A4:n estäjä, jolla on vähemmän CYP 2C9-, 2C19- ja 2D6-aktiivisuutta estäviä vaikutuksia. Kliiniset tutkimukset ovat osoittaneet, että CASODEXin samanaikainen anto keskimääräiset midatsolaamin (CYP 3A4:n substraatti) pitoisuudet voivat nousta 1,5-kertaisesti (Cmax) ja 1,9-kertaisesti (AUC). Tästä syystä on noudatettava varovaisuutta, kun CASODEX 50 mg annetaan samanaikaisesti CYP 3A4 -substraattien kanssa.
Proteiineihin sitoutumistutkimukset in vitro ovat osoittaneet, että bikalutamidi voi syrjäyttää kumariiniantikoagulantteja sitoutumiskohdista. Protrombiiniaikoja tulee seurata tarkasti potilailla, jotka jo saavat kumariiniantikoagulantteja ja jotka aloitetaan CASODEX 50 mg:n annoksella, ja antikoagulantin annosta voi olla tarpeen muuttaa.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Hepatiitti
Markkinoille tulon jälkeen CASODEXin käytön yhteydessä on raportoitu kuolemantapauksia tai sairaalahoitoa vakavan maksavaurion (maksan vajaatoiminnan) vuoksi. Maksatoksisuus ilmeni näissä raporteissa yleensä kolmen tai neljän ensimmäisen hoitokuukauden aikana. Kontrolloiduissa kliinisissä tutkimuksissa noin 1 %:lla CASODEX-potilaista esiintyi hepatiittia tai huomattavaa maksaentsyymiarvojen nousua, joka johti lääkkeen käytön lopettamiseen.
Seerumin transaminaasiarvot tulee mitata ennen CASODEX-hoidon aloittamista, säännöllisin väliajoin neljän ensimmäisen hoitokuukauden ajan ja ajoittain sen jälkeen. Jos kliinisiä oireita tai merkkejä, jotka viittaavat maksan toimintahäiriöön (esim. pahoinvointi, oksentelu, vatsakipu, väsymys, ruokahaluttomuus, "flunssan kaltaiset" oireet, tumma virtsa, keltaisuus tai oikean yläkvadrantin arkuus), seerumin transaminaasit, erityisesti seerumin ALAT, tulee mitata välittömästi. Jos potilaalla on milloin tahansa keltaisuus tai ALAT nousee yli kaksinkertaisen normaalin ylärajan, CASODEX-hoito tulee välittömästi lopettaa ja maksan toimintaa seurataan tarkasti.
Gynekomastia ja rintakipu
Kliinisissä tutkimuksissa, joissa CASODEX 150 mg ainoana lääkkeenä eturauhassyövän hoitoon, gynekomastiaa on raportoitu jopa 38 %:lla ja rintakipua 39 %:lla potilaista.
Glukoositoleranssi
LHRH-agonisteja saavilla miehillä on havaittu glukoositoleranssin vähenemistä. Tämä voi ilmetä diabeteksena tai sokeritasapainon menettämisenä niillä, joilla on jo diabetes. Siksi on harkittava verensokerin seurantaa potilailla, jotka saavat CASODEX 50 mg yhdessä LHRH-agonistien kanssa.
Laboratoriotestit
Seerumin eturauhasspesifisen antigeenin (PSA) säännöllinen arviointi voi olla hyödyllistä potilaan vasteen seurannassa. Jos PSA-tasot nousevat CASODEX 50 mg -hoidon aikana, potilaan kliininen eteneminen on arvioitava. Potilaille, joilla on objektiivinen sairauden eteneminen yhdessä kohonneen PSA:n kanssa, voidaan harkita antiandrogeenihoitoa ilman hoitoa samalla, kun LHRH-analogia jatketaan.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Annos ja aikataulu
Kerro potilaille, että hoito CASODEX 50 mg:lla ja LHRH-analogilla tulee aloittaa samaan aikaan ja että heidän ei tule keskeyttää tai lopettaa näiden lääkkeiden käyttöä neuvottelematta terveydenhuollon tarjoajansa kanssa [ks. ANNOSTELU JA HALLINNOINTI ].
Hepatiitti
Kerro potilaille, että CASODEX voi aiheuttaa hepatiittia, joka voi johtaa maksan vajaatoimintaan ja kuolemaan. Neuvo potilaita, että maksan toimintakokeita tulee seurata säännöllisesti hoidon aikana ja raportoida hepatiitin merkeistä ja oireista [ks. VAROITUKSET JA VAROTOIMET ].
Glukoositoleranssi
Kerro potilaille, että LHRH-agonistihoidon aikana on raportoitu diabetesta tai sokeritasapainon menetystä potilailla, joilla on diabetes. Siksi on harkittava verensokerin seurantaa potilailla, jotka saavat CASODEXia yhdessä LHRH-agonistien kanssa [ks. VAROITUKSET JA VAROTOIMET ].
Uneliaisuus
CASODEX-hoidon aikana on raportoitu uneliaisuutta. Neuvo potilaita, jotka kokevat tämän oireen, noudattamaan varovaisuutta ajaessaan tai käyttäessään koneita [katso HAITTAVAIKUTUKSET ].
Valoherkkyys
Kerro potilaille, että CASODEX-hoidon aikana on raportoitu valoherkkyystapauksia ja että heidän tulee välttää suoraa altistumista liialliselle auringonvalolle tai UV-valolle. Aurinkosuojan käyttöä tulee harkita [katso HAITTAVAIKUTUKSET ].
Ehkäisy ja hedelmällisyys
Neuvo miespotilaita, joilla on lisääntymiskykyisiä naispartnereita, käyttämään tehokasta ehkäisyä hoidon aikana ja 130 päivän ajan viimeisen CASODEX 50 mg -hoidon annoksen jälkeen. Kerro miespotilaille, että CASODEX voi heikentää hedelmällisyyttä [katso Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahden vuoden karsinogeenisuustutkimukset suun kautta suoritettiin sekä uros- että naarasrotilla ja hiirillä bikalutamidin annoksilla 5, 15 tai 75 mg/kg/vrk. Erilaisia kasvaimen kohde-elinten vaikutuksia tunnistettiin, ja niiden katsottiin johtuvan bikalutamidin antiandrogeenisuudesta, nimittäin kivesten hyvänlaatuiset interstitiaaliset (Leydig) solukasvaimet urosrotilla kaikilla annostasoilla (tasapainon plasmapitoisuus 5 mg/kg/vrk). annos on noin 0,7 kertaa ihmisen altistus suositellulla annoksella) ja kohdun adenokarsinooma naarasrotilla annoksella 75 mg/kg/vrk (noin 1,5 kertaa ihmisen altistus suositellulla annoksella). Ei ole näyttöä Leydig-solujen liikakasvusta potilailla; kohdun kasvaimet eivät ole merkityksellisiä osoitetulle potilaspopulaatiolle.
Pieni maksasolukarsinooman ilmaantuvuus uroshiirillä, joille annettiin 75 mg/kg/vrk bikalutamidia (noin 4 kertaa ihmisen altistus suositellulla annoksella) ja hyvänlaatuisten kilpirauhasen follikulaaristen solujen adenoomien ilmaantuvuus lisääntyi rotilla, joille annettiin 5 mg/kg /vrk (noin 0,7 kertaa ihmisen altistus suositellulla annoksella) ja enemmän. Nämä neoplastiset muutokset olivat eläintoksisuustutkimuksissa havaittujen ei-neoplastisten muutosten etenemistä, jotka liittyvät maksaentsyymien induktioon. Entsyymien induktiota ei ole havaittu bikalutamidin antamisen jälkeen ihmisellä. Genotoksiseen karsinogeneesiin viittaavia kasvaimia aiheuttavia vaikutuksia ei havaittu.
Kattava sarja sekä in vitro että in vivo genotoksisuustestejä (hiivan geenikonversio, Ames, E. coli, CHO/HGPRT, ihmisen lymfosyyttien sytogeneettiset testit, hiiren mikrotuman ja rotan luuytimen sytogeneettiset testit) on osoittanut, että bikalutamidilla ei ole genotoksista aktiivisuutta .
Toistuvan annoksen toksikologisissa tutkimuksissa kivesten siementiehyiden surkastumista on havaittu kaikilla tutkituilla lajilla, mikä on antiandrogeenien ennustettu luokkavaikutus. 6 ja 12 kuukautta kestäneessä rotalla tehdyssä tutkimuksessa kivesten surkastumista havaittiin noin kaksinkertaisella altistuksella ihmiselle suositellulla annoksella. 12 kuukautta kestäneessä koiratutkimuksessa kivesten surkastumisen ilmaantuvuus havaittiin noin 7-kertaisella altistuksella ihmiselle suositellulla annoksella. Urosrotilla, joille annettiin 250 mg/kg/vrk (noin 2 kertaa ihmisen altistus suositellulla annoksella), prekoitaalinen aikaväli ja onnistuneen parittelun aika pidentyivät ensimmäisessä parittelussa, mutta onnistuneen parittelun jälkeen ei havaittu vaikutuksia hedelmällisyyteen. Nämä vaikutukset hävisivät 7 viikon kuluttua 11 viikon annostelujakson päättymisestä.
Naarasrotilla, joille annettiin annoksia 1, 10 ja 250 mg/kg/vrk (alle 2-kertainen ihmisen altistus suositellulla annoksella), lisääntyi kiimakierron epäsäännöllisyys, mutta sillä ei ollut vaikutusta hedelmällisyyteen.
Perinataalisessa ja postnataalisessa kehitystutkimuksessa rottien naarasjälkeläisillä, jotka saivat annokset 10 mg/kg/vrk (noin 0,7 kertaa ihmisen altistus suositellulla kliinisellä annoksella) tai enemmän, tiineysaste väheni. Bikalutamidin antaminen raskaana oleville naaraille johti urospuolisten jälkeläisten feminisoitumiseen, mikä johti hypospadiaan annoksilla 10 mg/kg/vrk (noin 0,7 kertaa ihmisen altistus suositellulla annoksella) ja sitä suuremmilla annoksilla. Myös sairaat urosjälkeläiset olivat impotentteja.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
CASODEX on vasta-aiheinen raskaana oleville naisille, koska se voi vahingoittaa sikiötä. CASODEX 50 mg ei ole tarkoitettu käytettäväksi naisilla. CASODEX 50 mg:n käytöstä raskaana oleville naisille ei ole tietoja ihmisillä. Lisääntymistutkimuksissa eläinkokeissa bikalutamidin oraalinen antaminen tiineille rotille organogeneesin aikana aiheutti epänormaalia lisääntymiselimien kehitystä urospuolisten sikiöiden altistuksilla, jotka olivat noin 0,7-2 kertaa suuremmat kuin ihmisen altistus suositellulla annoksella (ks. Data ).
Data
Eläinten tiedot
Alkion ja sikiön kehitystutkimuksessa tiineillä rotilla, joille annosteltiin organogeneesin aikana tiineyspäivistä 6–15, urospuolisten sikiöiden anogenitaalinen etäisyys oli pienentynyt annoksilla 10 mg/kg/vrk ja sitä suuremmilla annoksilla (noin 0,7-2 kertaa ihmisen altistus suositeltu annos).
Pre- ja postnataalisessa kehitystutkimuksessa naarasrotille annettiin annosta tiineyspäivästä 7-16, ja niiden annettiin pentua ja kasvattaa jälkeläisiä vieroittamiseen asti. . Rottien urospuolisilla jälkeläisillä, jotka saivat annoksia 10 mg/kg/vrk (noin 0,7 kertaa ihmisen altistus suositellulla annoksella) tai enemmän, havaittiin pienentyneen anogenitaalisen etäisyyden.
Perinataalisessa ja postnataalisessa kehitystutkimuksessa naarasrotille annettiin annosta tiineyspäivästä 16. imetyspäivään 22, ja niiden annettiin peittää ja kasvattaa jälkeläisiä vieroittamiseen asti. Eloonjääminen ja jälkeläisten paino imetyksen aikana vähenivät emorottien pentueilla, jotka saivat 250 mg/kg/vrk annoksia (noin 2 kertaa ihmisen altistus suositellulla annoksella). Rottien urospuolisilla jälkeläisillä, jotka saivat annokset 10 mg/kg/vrk (noin 0,7 kertaa ihmisen altistus suositellulla annoksella) tai enemmän, havaittiin vähentyneen anogenitaalisen etäisyyden, pienemmät sekundaariset sukupuolielimet, kryptorkidia ja hypospadiat, jotka johtivat kyvyttömyyteen paritella. ja raskaaksi heidän naiskumppaninsa. Naaraspuolisten rottien jälkeläisillä, jotka saivat 10 mg/kg/vrk annoksia (noin 0,7 kertaa ihmisen altistus suositellulla annoksella) ja sitä suurempia, oli vähentynyt tiineysaste.
Imetys
Riskien yhteenveto
CASODEX 50 mg ei ole tarkoitettu käytettäväksi raskaana oleville naisille. Bikalutamidin erittymisestä äidinmaitoon tai vaikutuksista imetettävään lapseen tai maidontuotantoon ei ole tietoa. Bikalutamidia on havaittu rotan maidosta.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Ehkäisy
Miehet
Antiandrogeenihoito voi aiheuttaa morfologisia muutoksia siittiöissä [katso Ei-kliininen toksikologia ]. Eläinten lisääntymistutkimuksissa saatujen löydösten ja sen vaikutusmekanismin perusteella kehota miespotilaita, joilla on lisääntymiskykyisiä naispartnereita, käyttämään tehokasta ehkäisyä hoidon aikana ja 130 päivän ajan viimeisen CASODEX-annoksen jälkeen [ks. Raskaus ja KLIININEN FARMAKOLOGIA ].
Hedelmättömyys
Miehet

Eläinkokeiden perusteella CASODEX 50 mg voi estää spermatogeneesiä ja heikentää lisääntymiskykyisten miesten hedelmällisyyttä. CASODEX 50 mg:n pitkäaikaisia vaikutuksia miesten hedelmällisyyteen ei ole tutkittu [ks. Ei-kliininen toksikologia ].
Käyttö lapsille
CASODEX 50 mg:n turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
CASODEX (bikalutamidi) suussa hajoava tabletti tutkittiin yhdessä ARIMIDEXin (anastrotsoli) suussa hajoavan tabletin kanssa avoimessa, ei-vertailevassa, monikeskustutkimuksessa, jossa arvioitiin tämän yhdistelmähoidon tehoa ja turvallisuutta 12 kuukauden ajan gonadotropiinista riippumattoman hoidossa. varhaisvarhainen murrosikä pojilla, joilla on suvullinen miespuolinen varhaismurrosikä, joka tunnetaan myös nimellä testotoksikoosi. Potilaat otettiin mukaan tutkimukseen, jos heidän lähtötilanteensa oli ≥ 2 vuotta ja testotoksikoosidiagnoosi perustui etenevän varhaisvaiheen murrosiän, symmetrisen kivesten suurenemisen, pitkälle edenneen luuiän, murrosiän seerumin testosteronitasojen, ennen murrosiän tapahtuneen gonadotropiinin erityksen kliinisiin piirteisiin. GnRH-stimulaatiotesti ja muiden kliinisten ja biokemiallisten syiden puuttuminen testosteronin ylimäärästä. Kolmetoista 14:stä tutkimukseen osallistuneesta potilaasta suoritti 12 kuukauden yhdistelmähoidon (yksi potilas menetettiin seurantaan). Jos keskivarhainen murrosikä (CPP) kehittyi, LHRH-analogia piti lisätä. Neljällä potilaalla diagnosoitiin CPP 12 kuukauden tutkimuksen aikana, ja he saivat LHRH-analogiahoitoa ja 2 lisäpotilasta diagnosoitiin 12 kuukauden lopussa, ja he saivat hoitoa myöhemmin. Keskiarvo ± SD ominaisuudet lähtötilanteessa olivat seuraavat: kronologinen ikä: 3,9 ± 1,9 vuotta; luuston ikä 8,8±2,5; luun ikä/kronologinen ikäsuhde: 2,06±0,51; kasvunopeus (cm/v): 10,81 ± 4,22; kasvunopeuden keskihajontapisteet (SDS): 0,41±1,36.
CASODEX-aloitusannos oli 12,5 mg. CASODEXia titrattiin jokaisessa potilaassa, kunnes vakaan tilan R-bikalutamidin (bikalutamidin aktiivinen isomeeri) pienin plasmapitoisuus saavutti 5-15 mcg/ml, mikä on terapeuttisten pitoisuuksien vaihteluväli, joka saavutettiin eturauhassyöpää sairastavilla aikuisilla tämänhetkisen lääkkeen antamisen jälkeen. hyväksytty CASODEX-annos 50 mg. Anastrotsolin vuorokausiannos oli 0,5 mg. Anastrotsolia titrattiin itsenäisesti jokaisessa potilaassa, kunnes se saavutti vakaan tilan seerumin estradiolipitoisuuden
Tutkimuksen ensisijainen tehokkuusanalyysi oli kasvunopeuden muutos 12 kuukauden hoidon jälkeen suhteessa kasvunopeuteen vähintään 6 kuukauden aikana ennen tutkimukseen osallistumista. Tutkimusta edeltävät kasvuluvut saatiin takautuvasti. Ei ollut tilastollista näyttöä siitä, että kasvunopeus olisi hidastunut hoidon aikana. CASODEX/ARIMIDEX-hoidon aikana keskimääräinen kasvunopeus (cm/v) laski 1,6 cm/vuosi, 95 % luottamusväli (-4,7 - 1,5) p = 0,28; keskimääräinen kasvunopeus SDS laski 0,1 SD, 95 % CI (-1,2 - 1,0) p = 0,88. Taulukossa 2 esitetään kuvaavat tiedot kasvunopeuksista koko väestölle ja alaryhmille, jotka on määritelty aiemman testotoksikoosihoidon perusteella ketokonatsolilla, spironolaktonilla, anastrotsolilla tai muilla aromataasi-inhibiittoreilla.
Testosteronin kokonaispitoisuudet nousivat keskimäärin 5 mmol/l 12 kuukauden hoidon aikana lähtötason keskiarvosta 10 mmol/l. Estradiolipitoisuudet olivat kvantitatiivisella tasolla (9,81 pmol/l) tai sen alapuolella 11 potilaalla 12:sta 12 kuukauden hoidon jälkeen. Kuusi 12 potilaasta aloitti hoidon estradiolipitoisuudella, joka oli alle kvantifiointitason.
Tutkimuksen aikana ei ollut kuolemantapauksia, vakavia haittatapahtumia tai haittatapahtumien vuoksi keskeytyksiä. Tutkimushoidolle altistuneista 14 potilaasta 13 (92,9 %) koki vähintään yhden haittatapahtuman. Yleisimmin raportoidut (>3 potilasta) haittatapahtumat olivat gynekomastia (7/14, 50 %), keskeinen varhaismurrosikä (6/14, 43 %), oksentelu (5/14, 36 %), päänsärky (3/14, 21 %), kuumetta (3/14, 21 %) ja ylempien hengitysteiden infektioita (3/14, 21 %). Haittavaikutuksia, joita tutkijat katsoivat mahdollisesti liittyvän bikalutamidiin, olivat gynekomastia (6/14, 43 %), keskeinen varhainen murrosikä (2/14, 14 %), rintojen arkuus (2/14, 14 %), rintojen kipu (1/14, 7 %), voimattomuus (1/14, 7 %), lisääntynyt alaniiniaminotransferaasi [ALT] (1/14, 7 %), lisääntynyt aspartaattiaminotransferaasi [AST] (1/14, 7 %) ja tuki- ja liikuntaelimistön rintakipu (1 /14, 7 %). Päänsärky oli ainoa haittavaikutus, jonka tutkijat katsoivat mahdollisesti liittyvän anastrotsoliin. Potilaalla, jolle kehittyi kohonnut ALAT- ja ASAT-arvo, nousu oli
Geriatrinen käyttö
Kahdessa tutkimuksessa potilailla, joille annettiin 50 tai 150 mg vuorokaudessa, ei ole osoitettu merkitsevää yhteyttä iän ja vakaan tilan kokonaisbikalutamidin tai aktiivisen R-enantiomeerin välillä.
Maksan vajaatoiminta
CASODEXia tulee käyttää varoen potilailla, joilla on kohtalainen tai vaikea maksan vajaatoiminta. CASODEX metaboloituu laajalti maksassa. Rajoitetut tiedot potilaista, joilla on vaikea maksan vajaatoiminta, viittaavat siihen, että CASODEXin erittyminen voi viivästyä ja johtaa lisäkertymiseen. Säännöllisiä maksan toimintakokeita tulee harkita maksan vajaatoimintaa sairastaville potilaille, jotka saavat pitkäaikaista hoitoa [katso VAROITUKSET JA VAROTOIMET ].
Mitään kliinisesti merkitsevää eroa bikalutamidin kummankaan enantiomeerin farmakokinetiikassa ei havaittu potilailla, joilla oli lievä tai keskivaikea maksasairaus terveisiin verrokkeihin verrattuna. R-enantiomeerin puoliintumisaika piteni kuitenkin noin 76 % (5,9 ja 10,4 päivää normaalipotilailla ja 10,4 vuorokautta, vastaavasti) potilailla, joilla oli vaikea maksasairaus (n = 4).
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnalla (kreatiniinipuhdistumana mitattuna) ei ollut merkittävää vaikutusta bikalutamidin tai aktiivisen R-enantiomeerin eliminaatioon.
YLIANNOSTUS
Pitkäaikaisia kliinisiä tutkimuksia on suoritettu annoksilla 200 mg CASODEX 50 mg päivässä, ja nämä annokset ovat olleet hyvin siedettyjä. CASODEX 50 mg kerta-annosta, joka aiheuttaa hengenvaarallisena pidetyn yliannostuksen oireita, ei ole vahvistettu.
Spesifistä vastalääkettä ei ole; yliannostuksen hoidon tulee olla oireenmukaista.
CASODEX 50 mg:n yliannostusta hoidettaessa potilas voi oksentaa, jos potilas on hereillä. On muistettava, että tässä potilasryhmässä on saatettu ottaa useita lääkkeitä. Dialyysistä ei todennäköisesti ole apua, koska CASODEX sitoutuu voimakkaasti proteiineihin ja metaboloituu laajalti. Yleistä tukihoitoa, mukaan lukien säännöllinen elintoimintojen seuranta ja potilaan tarkka seuranta, on aiheellista.
VASTA-AIHEET
Casodex on vasta-aiheinen:
Yliherkkyys
CASODEX 50mg on vasta-aiheinen kaikille potilaille, jotka ovat osoittaneet yliherkkyysreaktion lääkkeelle tai jollekin tabletin aineosalle. Yliherkkyysreaktioita, mukaan lukien angioneuroottinen turvotus ja urtikaria, on raportoitu.
Naiset
CASODEX 50 mg:lla ei ole indikaatiota naisille, eikä sitä tule käyttää tässä potilasryhmässä.
Raskaus
CASODEX 50mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [katso Käyttö tietyissä populaatioissa ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
CASODEX 50mg on ei-steroidinen androgeenireseptorin estäjä. Se estää kilpailevasti androgeenien toimintaa sitoutumalla sytosolin androgeenireseptoreihin kohdekudoksessa. Eturauhassyövän tiedetään olevan androgeeniherkkä ja reagoi hoitoon, joka vastustaa androgeenin vaikutusta ja/tai poistaa androgeenin lähteen.
Kun CASODEX 50 mg yhdistetään LHRH-analogihoitoon, LHRH-analogin aiheuttamaan seerumin testosteronin suppressioon ei vaikuteta. Kliinisissä tutkimuksissa, joissa CASODEX oli ainoa eturauhassyövän hoitoon tarkoitettu lääke, on kuitenkin havaittu seerumin testosteronin ja estradiolin nousua.
Osalla potilaita, joita on hoidettu CASODEXilla ja LHRH-agonisteilla ja jotka lopettavat CASODEX 50 mg -hoidon etenevän edenneen eturauhassyövän vuoksi, eturauhasspesifisen antigeenin (PSA) väheneminen ja/tai kliininen paraneminen (antiandrogeenivieroitusilmiö) voivat olla havaittu.
Farmakokinetiikka
Imeytyminen
Bikalutamidi imeytyy hyvin oraalisen annon jälkeen, vaikka absoluuttista biologista hyötyosuutta ei tunneta. Bikalutamidin antamisella samanaikaisesti ruoan kanssa ei ole kliinisesti merkittävää vaikutusta imeytymisnopeuteen tai -asteeseen.
Jakelu
Bikalutamidi sitoutuu voimakkaasti proteiineihin (96 %) [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Aineenvaihdunta/eliminaatio
Bikalutamidi metaboloituu stereospesifisesti. S-isomeeri (inaktiivinen) metaboloituu pääasiassa glukuronidaation kautta. R-isomeeri (aktiivinen) myös glukuronidoituu, mutta se hapettuu pääasiassa inaktiiviseksi metaboliitiksi, jota seuraa glukuronidaatio. Sekä emo- että metaboliittiglukuronidit eliminoituvat virtsaan ja ulosteisiin. S-enantiomeeri poistuu nopeasti R-enantiomeeriin verrattuna, ja R-enantiomeerin osuus on noin 99 % plasman vakaan tilan kokonaistasoista.
CASODEX 50 mg:n aktiivisen enantiomeerin farmakokinetiikka normaaleilla miehillä ja potilailla, joilla on eturauhassyöpä, on esitetty taulukossa 3.
Kliiniset tutkimukset
CASODEX 50 mg päivittäin yhdessä LHRH-A:n kanssa
Monikeskustutkimuksessa, kaksoissokkoutetussa, kontrolloidussa kliinisessä tutkimuksessa 813 potilasta, joilla oli aiemmin hoitamaton pitkälle edennyt eturauhassyöpä, satunnaistettiin saamaan CASODEXia 50 mg kerran vuorokaudessa (404 potilasta) tai 250 mg flutamidia (409 potilasta) kolme kertaa vuorokaudessa. yhdistelmä LHRH-analogien kanssa (joko gosereliiniasetaatti-implantti tai leuprolidiasetaattivarasto).
Analyysissa, joka tehtiin sen jälkeen, kun mediaaniseuranta oli 160 viikkoa, 213 (52,7 %) CASODEX-LHRH-analogilla hoidettua potilasta ja 235 (57,5 %) flutamidi-LHRH-analogihoitoa saaneita potilasta oli kuollut. Eloonjäämisessä ei ollut merkittävää eroa hoitoryhmien välillä (katso kuvio 1). Ajan kuolemaan (eloonjäämisen) vaarasuhde oli 0,87 (95 %:n luottamusväli 0,72-1,05).
Kuvio 1 - Kaplan-Meier-kuoleman todennäköisyys molemmissa antiandrogeenihoitoryhmissä. 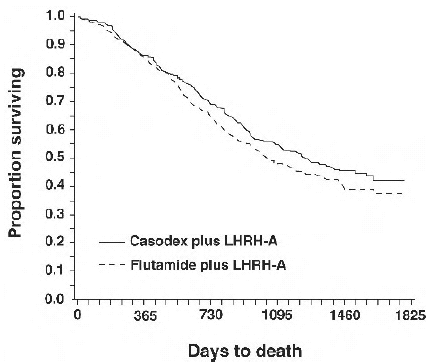
Hoitoryhmien välillä ei ollut merkittävää eroa objektiiviseen kasvaimen etenemiseen kuluvassa ajassa (katso kuvio 2). Objektiivinen kasvaimen eteneminen määriteltiin minkä tahansa luumetastaasien ilmaantumisena tai olemassa olevien luumetastaasien pahenemisena luukuvauksessa, joka johtui metastasoituneesta taudista, tai 25 %:lla tai enemmän kaikista olemassa olevista mitattavissa olevista luuston ulkopuolisista etäpesäkkeistä. CASODEX plus LHRH-analogin ja flutamidin ja LHRH-analogin etenemiseen kuluvan ajan riskisuhde oli 0,93 (95 %:n luottamusväli, 0,79-1,10).
Kuvio 2 - Kaplan-Meier-käyrä ajan etenemiseen molemmissa antiandrogeenihoitoryhmissä. 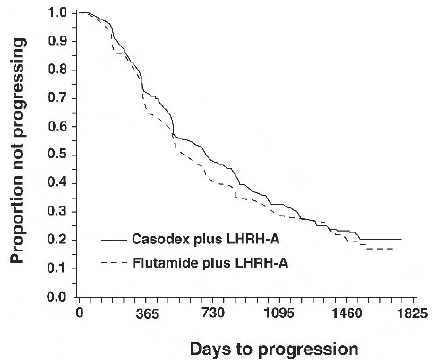
Elämänlaatua arvioitiin potilaskyselyillä, jotka koskivat kipua, sosiaalista toimintaa, emotionaalista hyvinvointia, elinvoimaa, aktiivisuusrajoituksia, vuodevammaa, yleistä terveyttä, fyysistä suorituskykyä, yleisoireita ja hoitoon liittyviä oireita. Elämänlaatukyselylomakkeiden arviointi ei osoittanut johdonmukaisia merkittäviä eroja kahden hoitoryhmän välillä.
Turvallisuustiedot CASODEX 150 mg:n kliinisistä tutkimuksista
CASODEX 150 mg ei ole hyväksytty käytettäväksi yksinään tai muiden hoitojen kanssa.
Kaksi identtistä monikeskustutkimusta, satunnaistettua avointa tutkimusta, joissa verrattiin CASODEX 150 mg päivittäistä monoterapiaa kastraatioon, suoritettiin potilailla, joilla oli paikallisesti edennyt (T3-4, NX, M0) tai metastaattinen (M1) eturauhassyöpä.
Monoterapia – M1-ryhmä
CASODEX 150 mg päivässä ei ole hyväksytty käytettäväksi potilailla, joilla on eturauhassyöpä M1. Kahden eloonjäämistutkimuksen välianalyysin perusteella Data Safety Monitoring Board suositteli CASODEX-hoidon lopettamista M1-potilailla, koska kuoleman riski oli 25 % (HR 1,25, 95 % CI 0,87 - 1,81) ja 31 % ( HR 1,31, 95 % CI 0,97 - 1,77) korkeampi CASODEX 50 mg:lla hoidetussa ryhmässä verrattuna kastroituun ryhmään.
Paikallisesti edistynyt (T3-4, NX, M0) ryhmä
CASODEX 150 mg päivässä ei ole hyväksytty käytettäväksi potilailla, joilla on paikallisesti edennyt (T3-4, NX, M0) eturauhassyöpä. Kun kaikki M1-potilaat lopetettiin, tutkimukset jatkuivat T3-4-, NX- ja M0-potilailla tutkimuksen loppuun asti. Suuremmassa tutkimuksessa (N=352) kuolinriski oli 25 % (HR 1,25, 95 % CI 0,92 - 1,71) suurempi CASODEX-ryhmässä ja pienemmässä tutkimuksessa (N=140) kuoleman riski oli 36 % (HR 0,64, 95 % CI, 0,39 - 1,03) pienempi CASODEX 50 mg -ryhmässä.
Edellä mainittujen kahden tutkimuksen lisäksi käynnissä on kolme muuta kliinistä tutkimusta, jotka tarjoavat lisätietoa CASODEX 150 mg:n turvallisuudesta, annoksesta, jota ei ole hyväksytty käytettäväksi. Nämä ovat kolme monikeskustutkimusta, satunnaistettua, kaksoissokkoutettua rinnakkaisryhmätutkimusta, joissa verrattiin CASODEX 150 mg vuorokaudessa annettua monoterapiaa (edellisen hoidon adjuvanttia tai tarkkaavaisena odotuksen alaisena) lumelääkkeeseen kuoleman tai taudin etenemiseen kuluvan ajan suhteen 8113 potilaan populaatiolla, joilla on paikallinen tai paikallisesti edennyt eturauhassyöpä.
CASODEX 150 mg päivässä ei ole hyväksytty käytettäväksi hoitona potilaille, joilla on paikallinen eturauhassyöpä ja jotka ovat ehdokkaita tarkkaavaiseen odotukseen. Tiedot kahdesta näistä tutkimuksista suunnitellun alaryhmäanalyysin perusteella 1627 potilaalla, joilla oli paikallinen eturauhassyöpä ja jotka olivat tarkkaavaisena odotuksena, osoittivat suuntauksen eloonjäämisen vähenemiseen CASODEX-haarassa 7,4 vuoden mediaaniseurannan jälkeen. CASODEX-hoitoa saaneilla potilailla kuoli 294 (37,7 %) verrattuna lumelääkettä saaneiden potilaiden 279 (32,9 %) (paikallinen tarkkaavainen odotusryhmä) riskisuhteen ollessa 1,16 (95 % CI 0,99-1,37).
POTILASTIEDOT
CASODEX® [cas–o–dex] (bikalutamidi) Tabletti
Lue nämä potilastiedot ennen kuin aloitat CASODEX 50 mg:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä pakkausseloste ei korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on CASODEX 50mg?
CASODEX on reseptilääke, jota kutsutaan androgeenireseptorin estäjäksi ja jota käytetään yhdessä luteinisoivaa hormonia vapauttavan hormonin (LHRH) kanssa D2-vaiheen metastaattisen eturauhassyövän hoitoon.
CASODEX ei ole tarkoitettu käytettäväksi naisilla.
Ei tiedetä, onko CASODEX turvallinen ja tehokas lapsille.
Kuka ei saa ottaa CASODEX 50 mg -valmistetta?
Älä ota CASODEX 50 mg:ta, jos:
- ovat nainen.
- ovat raskaana tai saattavat tulla raskaaksi. CASODEX voi vahingoittaa sikiötäsi.
- olet allerginen jollekin CASODEXin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo CASODEXin ainesosista. Hakeudu välittömästi lääkärin hoitoon, jos saat jonkin seuraavista allergisen reaktion oireista: kutina, nokkosihottuma (koholla olevat kuhmut), kasvojen, huulten tai kielen turvotus, hengitys- tai nielemisvaikeudet.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen CASODEXin ottamista?
Ennen kuin otat CASODEX 50 mg -valmistetta, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on maksaongelmia.
- ota verta ohentava lääke. Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, onko lääkkeesi verta ohentava.
- sinulla on diabetes (heikkoa verensokerin hallintaa on raportoitu ihmisillä, jotka käyttävät CASODEXia yhdessä LHRH-lääkkeiden kanssa).
- sinulla on kumppani, joka on raskaana tai voi tulla raskaaksi. Sinun tulee käyttää tehokkaita ehkäisymenetelmiä CASODEX 50 mg -hoidon aikana ja 130 päivän ajan CASODEX-hoidon lopettamisen jälkeen. Keskustele lääkärisi kanssa, jos sinulla on kysyttävää ehkäisystä.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. CASODEX 50mg ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen sivuvaikutuksia. CASODEX voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa CASODEX 50 mg:n tehoon.
Tunne käyttämäsi lääkkeet. Pidä luettelo lääkkeistäsi mukanasi, jotta voit näyttää terveydenhuollon tarjoajille, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa CASODEX 50mg?
- Ota CASODEX juuri sen verran kuin terveydenhuollon tarjoajasi on neuvonut sinua ottamaan sen.
- Ota CASODEX samaan aikaan joka päivä.
- CASODEX 50 mg -hoitosi tulee aloittaa samaan aikaan LHRH-hoidon kanssa.
- Jos unohdat ottaa annoksen, älä ota ylimääräistä annosta, vaan ota seuraava annos tavalliseen aikaan. Älä ota 2 annosta samanaikaisesti.
- CASODEX 50 mg voidaan ottaa ruoan kanssa tai ilman.
- Jos otat liikaa CASODEXia, soita välittömästi terveydenhuollon tarjoajallesi tai Myrkytystietokeskukseen tai mene lähimmän sairaalan ensiapuun.
- Älä lopeta CASODEXin käyttöä, ellei terveydenhuollon tarjoaja kerro sinulle.
- Terveydenhuollon tarjoaja voi tehdä verikokeita CASODEX-hoidon aikana.
- Eturauhassyöpäsi voi pahentua, kun käytät CASODEXia yhdessä LHRH-lääkkeiden kanssa.
Eturauhassyövän säännöllinen seuranta terveydenhuollon tarjoajan kanssa on tärkeää sen määrittämiseksi, onko sairautesi pahempi.
Mitä minun pitäisi välttää CASODEX 50 mg:n käytön aikana?
Älä aja, käytä koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka CASODEX vaikuttaa sinuun.
Jotkut ihmiset ovat olleet herkkiä auringonvalolle CASODEX-hoidon aikana. Sinun tulee välttää auringonvaloa tai aurinkolamppuja ja solariumeja ja harkita aurinkovoiteen käyttöä CASODEX-hoidon aikana.
Mitkä ovat CASODEX 50mg:n mahdolliset sivuvaikutukset?
CASODEX voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Maksaongelmat, mukaan lukien maksan vajaatoiminta, joka saattaa olla tarpeen hoitaa sairaalassa tai johtaa kuolemaan. Terveydenhuollon tarjoajasi tulee tehdä verikokeita maksasi toiminnan tarkistamiseksi ennen CASODEX-hoitoa ja sen aikana. Kerro heti terveydenhuollon tarjoajallesi, jos saat jonkin näistä maksaongelman oireista hoidon aikana:
- ihon ja silmien keltaisuus (keltatauti)
- tumma virtsa
- oikean ylävatsan kipu
- pahoinvointi
- oksentelua
- väsymys
- ruokahalun menetys
- vilunväristykset
- kuume
- Hengitysvaikeudet yskän tai kuumeen kanssa tai ilman. Jotkut CASODEX 50 mg -valmistetta käyttävät ihmiset saavat keuhkotulehduksen, jota kutsutaan interstitiaaliseksi keuhkosairaudeksi.
- Allerginen reaktio. Allergisen reaktion oireita ovat: ihon kutina, nokkosihottuma (koholla olevat kyhmyt), kasvojen, huulten, kielen, kurkun turvotus tai nielemisvaikeudet.
- Rintojen suureneminen (gynekomastia) ja rintojen kipu.
- Huono verensokeritasapaino voi tapahtua ihmisillä, jotka käyttävät CASODEX 50 mg yhdessä LHRH-lääkkeiden kanssa. Terveydenhuollon tarjoaja voi tarkistaa verensokerisi CASODEX 50 mg -hoidon aikana.
CASODEX 50mg:n yleisimmät sivuvaikutukset ovat:
- kuumia aaltoja tai lyhyitä lämpöä ja hikoilua
- koko kehon kipu selässä, lantiossa, vatsassa
- heikko olo
- ummetus
- infektio
- pahoinvointi
- nilkkojen, jalkojen tai jalkojen turvotus
- ripuli
- verta virtsassasi
- herääminen unesta virtsaamaan yöllä
- punasolujen väheneminen (anemia)
- huimata
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikkia CASODEXin mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää CASODEX?
Säilytä CASODEX huoneenlämmössä välillä 68 °F - 77 °F (20 °C - 25 °C).
Pidä CASODEX 50mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa CASODEXin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin potilasohjeessa mainittuihin tarkoituksiin. Älä käytä CASODEXia sairauksiin, joihin sitä ei ole määrätty. Älä anna CASODEX 50 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen sisältää yhteenvedon tärkeimmistä CASODEX-tiedoista. Jos haluat lisätietoja CASODEXista, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista CASODEX-tietoa, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja saat osoitteesta www.CASODEX.com tai soittamalla numeroon 1-800-236-9933.
Mitä ainesosia CASODEX 50mg sisältää?
Aktiivinen ainesosa: bikalutamidi.
Inaktiiviset ainesosat: laktoosi, magnesiumstearaatti, hypromelloosi, polyetyleeniglykoli, polyvidoni, natriumtärkkelysglykolaatti, titaanidioksidi.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
