Leukeran 2mg, 5mg Chlorambucil Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Leukeran 5mg on ja miten sitä käytetään?
Leukeran 5mg on reseptilääke, jota käytetään kroonisen lymfaattisen (lymfosyyttisen) leukemian ja Hodgkinin lymfooman oireiden hoitoon. Leukeran 5mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Leukeran 5mg kuuluu luokkaan antineoplastiset, alkyloivat lääkeaineet.
Ei tiedetä, onko Leukeran turvallinen ja tehokas lapsille.
Mitkä ovat Leukeranin mahdolliset sivuvaikutukset?
Leukeran voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- kohtaukset,
- epätavallinen massa tai pala,
- vaikea oksentelu tai ripuli,
- uusi tai paheneva yskä,
- helppo mustelma,
- epätavallinen verenvuoto (nenä, suu, emätin tai peräsuolen),
- violetit tai punaiset pisteet ihon alla,
- pahoinvointi,
- ylävatsakipu,
- kutina,
- väsymys,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- kuume,
- turvonneet ikenet,
- tuskalliset suun haavaumat,
- kipua nieltäessä,
- ihohaavat,
- vilustumisen tai flunssan oireet,
- yskä,
- vaikeuksia hengittää,
- kipeä kurkku,
- ihokipu ja
- punainen tai violetti ihottuma, joka leviää (etenkin kasvoille tai ylävartalolle) ja aiheuttaa rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Leukeranin yleisimpiä sivuvaikutuksia ovat:
- kuume,
- verenvuotoa ja
- flunssan oireita
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Leukeranin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
VAROITUS
LEUKERAN (klorambusiili) voi tukahduttaa vakavasti luuytimen toimintaa. Klorambusiili on ihmisille syöpää aiheuttava aine. Klorambusiili on todennäköisesti mutageeninen ja teratogeeninen ihmisille. Klorambusiili aiheuttaa ihmisen hedelmättömyyttä (ks VAROITUKSET JA VAROTOIMET ).
KUVAUS
LEUKERANin (klorambusiili) syntetisoivat ensin Everett et ai. Se on typpisinappityyppinen bifunktionaalinen alkyloiva aine, jonka on todettu vaikuttavan valittuihin ihmisen neoplastisiin sairauksiin. Klorambusiili tunnetaan kemiallisesti 4-[bis(2-kloorietyyli)amino]bentseenibutaanihappona ja sillä on seuraava rakennekaava:
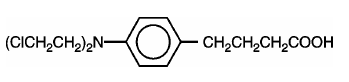
Klorambusiili hydrolysoituu vedessä ja sen pKa on 5,8.
LEUKERAN (klorambusiili) on saatavana tabletin muodossa suun kautta annettavaksi. Jokainen kalvopäällysteinen tabletti sisältää 2 mg klorambusiilia ja inaktiivisia aineita kolloidista piidioksidia, hypromelloosia, laktoosia (vedetöntä), makrogolia/PEG 400:a, mikrokiteistä selluloosaa, punaista rautaoksidia, steariinihappoa, titaanidioksidia ja keltaista rautaoksidia.
INDIKAATIOT
LEUKERAN (klorambusiili) on tarkoitettu kroonisen lymfaattisen (lymfosyyttisen) leukemian, pahanlaatuisten lymfoomien, mukaan lukien lymfosarkooman, jättimäisen follikulaarisen lymfooman ja Hodgkinin taudin hoitoon. Se ei ole parantava missään näistä häiriöistä, mutta voi tuottaa kliinisesti hyödyllistä lievitystä.
ANNOSTELU JA HALLINNOINTI
Tavallinen suun kautta otettava annos on 0,1–0,2 mg/kg vuorokaudessa tarpeen mukaan 3–6 viikon ajan. Tämä on tavallisesti 4-10 mg päivässä keskivertopotilaalle. Koko vuorokausiannos voidaan antaa kerralla. Nämä annokset on tarkoitettu hoidon aloittamiseen tai lyhyisiin hoitojaksoihin. Annostus on säädettävä huolellisesti potilaan vasteen mukaan ja sitä on pienennettävä heti, kun valkosolujen määrä laskee äkillisesti. Hodgkinin tautia sairastavat potilaat tarvitsevat yleensä 0,2 mg/kg päivässä, kun taas potilaat, joilla on muita lymfoomia tai kroonista lymfaattista leukemiaa, tarvitsevat yleensä vain 0,1 mg/kg päivässä. Kun luuytimessä on lymfosyyttinen infiltraatio tai luuydin on hypoplastinen, vuorokausiannos ei saa ylittää 0,1 mg/kg (noin 6 mg keskivertopotilaalla).
Kroonisen lymfaattisen leukemian hoitoon on raportoitu vaihtoehtoisia aikatauluja, joissa käytetään klorambusiilin pulssiannoksia jaksottaisesti, kahdesti viikossa tai kerran kuukaudessa. Jaksottaiset klorambusiiliohjelmat alkavat kerta-annoksella 0,4 mg/kg. Annoksia nostetaan yleensä 0,1 mg/kg, kunnes lymfosytoosi tai toksisuus havaitaan hallinnassa. Myöhemmät annokset muutetaan tuottamaan lievää hematologista toksisuutta. Vaikuttaa siltä, että kroonisen lymfaattisen leukemian vastenopeus klorambusiilin kahdesti viikossa tai kerran kuukaudessa annettavaan annosteluohjelmaan on samanlainen tai parempi kuin aiemmin raportoitu päivittäisen annon yhteydessä ja että hematologinen toksisuus oli pienempi tai yhtä suuri kuin tutkimuksissa, joissa käytettiin päivittäistä klorambusiilia. .
Säteily ja sytotoksiset lääkkeet tekevät luuytimen alttiimmaksi vaurioille, ja klorambusiilia tulee käyttää erityisen varoen 4 viikon kuluessa täydellisestä sädehoito- tai kemoterapiajaksosta. Pienet palliatiivisen säteilyn annokset yksittäisiin, kaukana luuytimestä oleviin pesäkkeisiin eivät kuitenkaan yleensä alenna neutrofiilien ja verihiutaleiden määrää. Näissä tapauksissa klorambusiilia voidaan antaa tavanomaisina annoksina.
Tällä hetkellä koetaan, että lyhyet hoitojaksot ovat turvallisempia kuin jatkuva ylläpitohoito, vaikka molemmat menetelmät ovat olleet tehokkaita. On tunnustettava, että jatkuva hoito voi antaa vaikutelman "ylläpitohoidosta" potilailla, jotka ovat todella remissiossa ja joilla ei ole välitöntä lisälääkkeiden tarvetta. Jos käytetään ylläpitoannosta, se ei saa ylittää 0,1 mg/kg päivässä ja voi hyvinkin olla niinkin alhainen kuin 0,03 mg/kg päivässä. Tyypillinen ylläpitoannos on 2–4 mg päivässä tai vähemmän veriarvojen tilasta riippuen. Tästä syystä saattaa olla toivottavaa lopettaa lääke, kun maksimaalinen hallinta on saavutettu, koska jaksoittainen hoito, joka aloitetaan uudelleen pahenemishetkellä, voi olla yhtä tehokas kuin jatkuva hoito.
Syöpälääkkeiden asianmukaisen käsittelyn ja hävittämisen menettelyjä tulee noudattaa. Tästä aiheesta on julkaistu useita ohjeita.1-4 Ei ole olemassa yleistä yksimielisyyttä siitä, että kaikki ohjeissa suositellut menettelyt ovat tarpeellisia tai asianmukaisia.
Erikoispopulaatiot
Maksan vajaatoiminta
Potilaita, joilla on maksan vajaatoiminta, tulee seurata tarkasti toksisuuden varalta. Koska klorambusiili metaboloituu ensisijaisesti maksassa, annoksen pienentämistä voidaan harkita LEUKERAN-hoitoa sairastavilla potilailla, joilla on maksan vajaatoiminta. Maksan vajaatoimintaa sairastavista potilaista ei kuitenkaan ole riittävästi tietoa antaakseen erityistä annossuositusta.
MITEN TOIMITETAAN
LEUKERAN toimitetaan ruskeina, kalvopäällysteisinä, pyöreinä, kaksoiskuperina tabletteina, jotka sisältävät 2 mg klorambusiilia kullanruskeissa lasipulloissa, joissa on lapsiturvallinen korkki. Toiselle puolelle on kaiverrettu "GX EG3" ja toiselle puolelle "L".
Pullo 25 ( NDC 76388-635-25)
Säilytä jääkaapissa, 2° - 8°C (36° - 46°F).
VIITTEET
1. NIOSH-varoitus: Ammatillisen altistumisen estäminen antineoplastisille ja muille vaarallisille lääkkeille terveydenhuollon ympäristöissä. 2004. Yhdysvaltain terveys- ja henkilöstöministeriö, kansanterveyspalvelu, sairauksien valvonta- ja ehkäisykeskukset, kansallinen työturvallisuus- ja työterveysinstituutti, DHHS (NIOSH), julkaisunro 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Osa VI: Luku 2. Työperäisen vaarallisille huumeille altistumisen hallinta. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Pharmacists. ASHP-ohjeet vaarallisten lääkkeiden käsittelystä. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM, & Kelleher, LO (toim.) 2005. Kemoterapian ja bioterapian suuntaviivat ja suositukset käytäntöön (2. painos) Pittsburgh, PA: Oncology Nursing Society.
Valmistaja: Excella GmbH & Co. KG, Feucht, Saksa. Tarkistettu: maaliskuu 2017
SIVUVAIKUTUKSET
Jos haluat ilmoittaa EPÄILLEISTÄ HAITTAVAIKUTUKSISTA, ota yhteyttä Aspen Global Inc. Toll-Freeen numeroon 1-855-800-8165 tai FDA:han numeroon 1-800-FDA-1088 tai www.fda.gov/medwatch.
Hematologinen
Yleisin sivuvaikutus on luuydinsuppressio, anemia, leukopenia, neutropenia, trombosytopenia tai pansytopenia. Vaikka luuydinsuppressiota esiintyy usein, se on yleensä palautuva, jos klorambusiili poistetaan riittävän aikaisin. Peruuttamatonta luuytimen vajaatoimintaa on kuitenkin raportoitu.
Ruoansulatuskanava
Ruoansulatuskanavan häiriöitä, kuten pahoinvointia ja oksentelua, ripulia ja suun haavaumia esiintyy harvoin.
CNS
Vapinaa, lihasnykitystä, myokloniaa, sekavuutta, kiihtyneisyyttä, ataksiaa, veltto pareesia ja hallusinaatioita on raportoitu klorambusiilin harvinaisina haittavaikutuksina, jotka häviävät lääkkeen käytön lopettamisen jälkeen. Harvinaisia, fokaalisia ja/tai yleistyneitä kohtauksia on raportoitu esiintyvän sekä lapsilla että aikuisilla sekä terapeuttisilla päivittäisillä annoksilla että pulssiannoksella sekä akuutissa yliannostuksessa (ks. VAROTOIMENPITEET : Kenraali ).
Ihotauti
Allergisia reaktioita, kuten nokkosihottumaa ja angioneuroottista turvotusta, on raportoitu ensimmäisen tai myöhemmän annostelun jälkeen. Ihon yliherkkyyttä (mukaan lukien harvinaiset raportit ihottumasta, joka etenee erythema multiformeksi, toksisesta epidermaalisesta nekrolyysistä ja Stevens-Johnsonin oireyhtymästä) on raportoitu (ks. VAROITUKSET ).
Sekalaista
Muita raportoituja haittavaikutuksia ovat: keuhkofibroosi, maksatoksisuus ja keltaisuus, lääkekuume, perifeerinen neuropatia, interstitiaalinen keuhkokuume, steriili kystiitti, hedelmättömyys, leukemia ja sekundaariset pahanlaatuiset kasvaimet (ks. VAROITUKSET ).

HUUMEIDEN VUOROVAIKUTUKSET
Klorambusiilin kanssa ei ole tunnettuja lääkkeiden ja lääkkeiden yhteisvaikutuksia.
VAROITUKSET
Karsinogeenisten ominaisuuksiensa vuoksi klorambusiilia ei tule antaa potilaille, joilla on muita sairauksia kuin krooninen lymfaattinen leukemia tai pahanlaatuiset lymfoomat. Kouristuksia, hedelmättömyyttä, leukemiaa ja sekundaarisia pahanlaatuisia kasvaimia on havaittu, kun klorambusiilia käytettiin pahanlaatuisten ja ei-pahanlaatuisten sairauksien hoidossa.
On monia raportteja akuutista leukemiasta potilailla, joilla on sekä pahanlaatuisia että ei-pahanlaatuisia sairauksia klorambusiilihoidon jälkeen. Monissa tapauksissa nämä potilaat saivat myös muita kemoterapeuttisia aineita tai jonkinlaista sädehoitoa. Klorambusiilin aiheuttaman leukemian tai karsinooman riskin kvantifiointi ihmisillä ei ole mahdollista. Klorambusiilia (ja muita alkyloivia aineita) saaneiden potilaiden leukemian kehittymisestä julkaistujen raporttien arviointi viittaa siihen, että leukemogeneesin riski kasvaa sekä hoidon kroonisuudessa että suurilla kumulatiivisilla annoksilla. On kuitenkin osoittautunut mahdottomaksi määritellä kumulatiivista annosta, jonka alapuolella ei ole riskiä sekundaarisen pahanlaatuisuuden induktiosta. Klorambusiilihoidon mahdollisia hyötyjä on punnittava yksilöllisesti mahdolliseen sekundaarisen pahanlaatuisen kasvaimen induktion riskiin nähden.
Klorambusiilin on osoitettu aiheuttavan kromatidi- tai kromosomivaurioita ihmisillä. Sekä palautuvaa että pysyvää hedelmällisyyttä on havaittu molemmilla klorambusiilia saaneilla sukupuolilla.
Suuri steriiliyden ilmaantuvuus on dokumentoitu, kun klorambusiilia annetaan prepubertaalisille ja murrosikäisille miehille. Pitkäkestoista tai pysyvää atsoospermiaa on havaittu myös aikuisilla miehillä. Vaikka useimmat raportit klorambusiilin aiheuttamista sukurauhasten toimintahäiriöistä ovat liittyneet miehiin, amenorrean induktio naisilla alkyloivilla aineilla on hyvin dokumentoitu ja klorambusiili pystyy aiheuttamaan kuukautisia. Ruumiinavaustutkimukset pahanlaatuista lymfoomaa sairastavien naisten munasarjoista, joita hoidettiin yhdistelmäkemoterapialla, mukaan lukien klorambusiililla, ovat osoittaneet vaihtelevan asteen fibroosia, vaskuliittia ja alkurakkuloiden ehtymistä.
Harvoissa tapauksissa on raportoitu ihottumaa, joka etenee erythema multiformeksi, toksiseksi epidermaaliseksi nekrolyysiksi tai Stevens-Johnsonin oireyhtymäksi. Klorambusiilihoito tulee lopettaa välittömästi potilailla, joille kehittyy ihoreaktioita.
Raskaus
Raskausluokka D
Klorambusiili voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Yksipuolista munuaisten ageneesia on havaittu kahdella jälkeläisellä, joiden äidit saivat klorambusiilia ensimmäisen raskauskolmanneksen aikana. Urogenitaalisia epämuodostumia, mukaan lukien munuaisen puuttuminen, havaittiin klorambusiilia saaneiden rottien sikiöillä. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta tulee informoida mahdollisesta vaarasta sikiölle. Hedelmällisessä iässä olevia naisia tulee neuvoa välttämään raskaaksi tulemista.
VAROTOIMENPITEET
Kenraali
Monille potilaille kehittyy hitaasti etenevä lymfopenia hoidon aikana. Lymfosyyttien määrä palautuu yleensä nopeasti normaalille tasolle lääkehoidon päätyttyä. Useimmilla potilailla on jonkin verran neutropeniaa kolmannen hoitoviikon jälkeen, ja tämä voi jatkua jopa 10 päivää viimeisen annoksen jälkeen. Tämän jälkeen neutrofiilien määrä palautuu yleensä nopeasti normaaliksi. Vaikea neutropenia näyttää liittyvän annokseen, ja sitä esiintyy yleensä vain potilailla, jotka ovat saaneet kokonaisannoksen 6,5 mg/kg tai enemmän yhtenä hoitojaksona jatkuvalla annostuksella. Noin neljäsosan kaikista jatkuvaa annostusta saavista potilaista ja kolmannekselle tämän annoksen saaneista 8 viikon sisällä tai vähemmän voidaan odottaa kehittyvän vaikeaa neutropeniaa.
Vaikka klorambusiilin käyttöä ei tarvitse keskeyttää ensimmäisten neutrofiilien määrän laskun ilmetessä, on muistettava, että lasku voi jatkua 10 päivää viimeisen annoksen jälkeen ja että kokonaisannoksen lähestyessä arvoa 6,5 mg/kg peruuttamattomien luuydinvaurioiden vaara. Klorambusiilin annosta tulee pienentää, jos leukosyyttien tai verihiutaleiden määrä laskee alle normaaliarvojen, ja se tulee lopettaa vakavamman masennuksen vuoksi.
Klorambusiili pitäisi ei annetaan täysillä annoksilla ennen kuin 4 viikkoa täyden sädehoidon tai kemoterapian jälkeen, koska luuydin on herkkä vaurioille näissä olosuhteissa. Jos leukosyytti- tai verihiutaleiden määrä on laskenut ennen hoitoa luuydinsairausprosessin vuoksi ennen hoidon aloittamista, hoito tulee aloittaa pienemmällä annoksella.
Jatkuvasti alhainen neutrofiilien ja verihiutaleiden määrä tai perifeerinen lymfosytoosi viittaavat luuytimen infiltraatioon. Jos luuydintutkimus vahvistaa, klorambusiilin päiväannos ei saa ylittää 0,1 mg/kg. Klorambusiili näyttää olevan suhteellisen vapaa maha-suolikanavan sivuvaikutuksista tai muista myrkyllisyyden todisteista, lukuun ottamatta luuydintä lamaavaa vaikutusta. Ihmisillä 20 mg:n tai suuremmat kerta-annokset suun kautta voivat aiheuttaa pahoinvointia ja oksentelua.
Lapsilla, joilla on nefroottinen oireyhtymä, ja potilailla, jotka saavat suuria sykeannoksia klorambusiilia, saattaa olla lisääntynyt kohtausten riski. Kuten kaikkia mahdollisesti epileptogeenisiä lääkkeitä käytettäessä, varovaisuutta on noudatettava annettaessa klorambusiilia potilaille, joilla on aiemmin ollut kohtaushäiriö tai päävamma tai jotka saavat muita mahdollisesti epileptogeenisiä lääkkeitä.
Elävien rokotteiden antamista immuunipuutteisille potilaille tulee välttää.
Laboratoriotestit
Potilaita on seurattava huolellisesti, jotta vältetään hengenvaaralliset luuytimen vauriot hoidon aikana. Veritutkimukset tulee tehdä viikoittain hemoglobiinitason, leukosyyttien kokonais- ja differentiaalimäärän sekä kvantitatiivisen verihiutaleiden määrän määrittämiseksi. Ensimmäisten 3–6 hoitoviikon aikana on myös suositeltavaa, että valkosolujen määrä mitataan 3 tai 4 päivää jokaisen viikoittaisen täydellisen verinäytteen jälkeen. Galton ym. ovat ehdottaneet, että seuraavilla potilailla on hyödyllistä piirtää veriarvot kaavioon samalla, kun ruumiinpaino, lämpötila, pernan koko jne. kirjataan. On vaarallista antaa potilaan olla yli 2 viikkoa ilman hematologista ja kliinistä tutkimusta hoidon aikana.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Katso VAROITUKSET osio, jossa on tietoa karsinogeneesistä, mutageneesistä ja hedelmällisyyden heikkenemisestä.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka D
Katso VAROITUKSET osio.
Imettävät äidit
Ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon ja koska klorambusiili voi aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imetys vai lopetetaanko lääke, ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
Klorambusiilia koskeviin kliinisiin tutkimuksiin ei sisältynyt riittävää määrää 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
Käyttö potilailla, joilla on munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta klorambusiilin eliminaatioon ei ole virallisesti tutkittu. Muuttumattoman klorambusiilin ja sen tärkeimpien aktiivisten metaboliittien, fenyylietikkahapposinapin, eliminaatio munuaisten kautta on alle 1 % annetusta annoksesta. Lisäksi annosta ei tarvinnut muuttaa kahdella klorambusiilia saaneella dialyysipotilaalla. Siksi munuaisten vajaatoiminnan ei odoteta vaikuttavan merkittävästi klorambusiilin eliminaatioon.
Käyttö potilailla, joilla on maksan vajaatoiminta
Muodollisia tutkimuksia potilailla, joilla on maksan vajaatoiminta, ei ole tehty. Koska klorambusiili metaboloituu ensisijaisesti maksassa, maksan vajaatoimintaa sairastavia potilaita tulee seurata tarkasti toksisuuden varalta ja annoksen pienentämistä voidaan harkita potilailla, joilla on maksan vajaatoiminta LEUKERAN-hoidon aikana (ks. ANNOSTELU JA HALLINNOINTI ).
YLIANNOSTUS
Palautuva pansytopenia oli pääasiallinen havainto tahattomista klorambusiilin yliannostuksista. Myös neurologista toksisuutta on esiintynyt kiihtyneestä käyttäytymisestä ja ataksiasta useisiin grand mal -kohtauksiin. Koska vastalääkettä ei tunneta, verikuvaa on seurattava tarkasti ja yleiset tukitoimenpiteet ja tarvittaessa verensiirrot tulee aloittaa. Klorambusiili ei ole dialysoitavissa.
Oraaliset LD50-kerta-annokset hiirillä ovat 123 mg/kg. Rotilla yksittäinen intraperitoneaalinen annos 12,5 mg/kg klorambusiilia tuottaa tyypillisiä typpi-sinappivaikutuksia; näitä ovat suolen limakalvon ja imukudosten surkastuminen, vaikea lymfopenia, joka on maksimaalinen 4 päivässä, anemia ja trombosytopenia. Tämän annoksen jälkeen eläimet alkavat toipua 3 päivän kuluessa ja näyttävät normaaleilta noin viikossa, vaikka luuydin ei ehkä muutu täysin normaaliksi noin 3 viikkoon. Intraperitoneaalinen annos 18,5 mg/kg tappaa noin 50 % rotista ja aiheuttaa kouristuksia. Rotille on annettu suun kautta kerta-annoksena jopa 50 mg/kg, ja se on toipunut. Tällainen annos aiheuttaa bradykardiaa, liiallista syljeneritystä, hematuriaa, kouristuksia ja hengityshäiriöitä.
VASTA-AIHEET
Klorambusiili pitäisi ei käytetään potilailla, joiden sairaus on osoittanut aiempaa resistenssiä aineelle. Potilaille, jotka ovat osoittaneet yliherkkyyttä klorambusiilille, ei tule antaa lääkettä. Klorambusiilin ja muiden alkyloivien aineiden välillä voi esiintyä yliherkkyyttä (ihottumaa).
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Klorambusiili, aromaattinen typpisinappijohdannainen, on alkyloiva aine. Klorambusiili häiritsee DNA:n replikaatiota ja indusoi solujen apoptoosia sytosolisen p53:n kerääntymisen ja sitä seuraavan apoptoosin promoottorin Baxin aktivoitumisen kautta.
Farmakokinetiikka
Tutkimuksessa, johon osallistui 12 potilasta, joille annettiin kerta-annoksia suun kautta 0,2 mg/kg LEUKERANia 5 mg, klorambusiilin keskimääräinen annossovitettu (±SD) Cmax plasmassa oli 492 ± 160 ng/ml, AUC oli 883 ± 329 ng.h/ml. Keskimääräinen eliminaation puoliintumisaika (t½) oli 1,3 ± 0,5 tuntia ja Tmax oli 0,83 ± 0,53 tuntia. Päämetaboliitin, fenyylietikkahapposinapin (PAAM) keskimääräinen annoksen mukaan sovitettu (± SD) plasman Cmax oli 306 ± 73 ng/ml, AUC oli 1204 ± 285 ng.h/ml, keskimääräinen t½ oli 1,8 ± 0,4 tuntia. ja Tmax oli 1,9 ± 0,7 tuntia.
0,6-1,2 mg/kg:n kerta-annosten jälkeen plasman klorambusiilin huippupitoisuus (Cmax) saavutetaan 1 tunnin kuluessa ja lähtölääkkeen terminaalinen eliminaation puoliintumisaika (t ) on arviolta 1,5 tuntia.
Imeytyminen
Klorambusiili imeytyy nopeasti ja täydellisesti (>70 %) maha-suolikanavasta. Klorambusiilin nopean ja ennustettavan imeytymisen mukaisesti yksilöiden välisen vaihtelun plasman farmakokinetiikassa on osoitettu olevan suhteellisen vähäistä 15-70 mg:n oraalisten annosten jälkeen (2-kertainen potilaan sisäinen vaihtelu ja 2-4-kertainen vaihtelu). potilaiden välinen AUC-vaihtelu). Klorambusiilin imeytyminen heikkenee, kun se otetaan ruokailun jälkeen. Kymmenellä potilaalla tehdyssä tutkimuksessa ruoan nauttiminen nosti mediaani Tmax -arvoa kaksinkertaiseksi ja pienensi annoksen mukaisia Cmax- ja AUC-arvoja 55 % ja AUC 20 %.
Jakelu
Näennäinen jakautumistilavuus oli keskimäärin 0,31 l/kg klorambusiilin oraalisen kerta-annoksen 0,2 mg/kg jälkeen 11 syöpäpotilaalla, joilla oli krooninen lymfaattinen leukemia.
Klorambusiili ja sen metaboliitit sitoutuvat laajalti plasman ja kudosten proteiineihin. In vitro klorambusiili sitoutuu 99-prosenttisesti plasman proteiineihin, erityisesti albumiiniin. Klorambusiilin aivo-selkäydinnesteen tasoja ei ole määritetty.
Aineenvaihdunta
Klorambusiili metaboloituu laajalti maksassa ensisijaisesti fenyylietikkahapposinappiksi, jolla on antineoplastista vaikutusta. Klorambusiili ja sen tärkein metaboliitti hajoavat oksidatiivisesti monohydroksi- ja dihydroksijohdannaisiksi.
Erittyminen
Radioaktiivisesti leimatun klorambusiilin (14C) kerta-annoksen jälkeen noin 20–60 % radioaktiivisuudesta näkyy virtsassa 24 tunnin kuluttua. Jälleen alle 1 % virtsan radioaktiivisuudesta on klorambusiilin tai fenyylietikkahapposinapin muodossa.
POTILASTIEDOT
Potilaille tulee kertoa, että klorambusiilin tärkeimmät toksisuudet liittyvät yliherkkyyteen, lääkekuumeeseen, myelosuppressioon, maksatoksisuuteen, hedelmättömyyteen, kohtauksiin, maha-suolikanavan toksisuuteen ja sekundäärisiin pahanlaatuisuuksiin. Potilaiden ei saa koskaan antaa ottaa lääkettä ilman lääkärin valvontaa, ja heidän tulee kääntyä lääkärin puoleen, jos heillä on ihottumaa, verenvuotoa, kuumetta, keltaisuutta, jatkuvaa yskää, kouristuskohtauksia, pahoinvointia, oksentelua, kuukautisia tai epätavallisia kyhmyjä/massaa. Hedelmällisessä iässä olevia naisia tulee neuvoa välttämään raskaaksi tulemista.
