Hydrea 500mg Hydroxyurea Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Hydrea 500mg on ja miten sitä käytetään?
Hydrea (hydroksiurea) on antineoplastinen (syövän vastainen) lääkeaine, jota käytetään melanooman, resistentin kroonisen myelosyyttisen leukemian ja toistuvan, metastaattisen tai leikkauskyvyttömän munasarjasyövän sekä pään ja kaulan primaaristen levyepidermoidisten karsinoomien hoitoon. Hydrea on saatavana yleisessä muodossa.
Mitkä ovat Hydrean sivuvaikutukset?
Hydrean yleisiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ärtynyt vatsa,
- ripuli,
- ummetus,
- ihomuutokset, kuten hilseily tai värimuutos,
- flunssan kaltaiset oireet,
- hiustenlähtö,
- ihottuma,
- päänsärky,
- huimaus,
- uneliaisuus tai
- painonnousu.
Hydrean vakavia sivuvaikutuksia ovat:
- anemia,
- myelosuppressio ja
- leukemia.
KUVAUS
HYDREA (hydroksiureakapselit, USP) on antimetaboliitti, joka on saatavana suun kautta käytettäväksi kapseleina, jotka sisältävät 500 mg hydroksiureaa. Inaktiivisia ainesosia ovat sitruunahappo, väriaineet (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 ja D&C Red No. 28), gelatiini, laktoosi, magnesiumstearaatti, natriumfosfaatti ja titaanidioksidi.
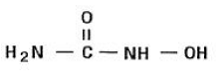
Hydroksiurea on valkoinen tai luonnonvalkoinen kiteinen jauhe. Se on hygroskooppinen ja liukenee vapaasti veteen, mutta käytännössä liukenematon alkoholiin. Empiirinen kaava on CH4N2O2 ja sen molekyylipaino on 76,05. Sen rakennekaava on:
INDIKAATIOT
HYDREA 500mg on tarkoitettu seuraavien sairauksien hoitoon:
- Resistentti krooninen myelooinen leukemia.
- Paikallisesti edenneet pään ja kaulan levyepiteelikarsinoomat (lukuun ottamatta huulia) yhdessä kemosäteilyhoidon kanssa.
ANNOSTELU JA HALLINNOINTI
Annostelutiedot
HYDREAa käytetään yksinään tai yhdessä muiden kasvainlääkkeiden tai sädehoidon kanssa kasvainsairauksien hoitoon. Yksilöllistä hoito kasvaimen tyypin, sairauden tilan, hoitovasteen, potilaan riskitekijöiden ja nykyisten kliinisen käytännön standardien perusteella.
Perusta kaikki annokset potilaan todelliseen tai ihannepainoon sen mukaan, kumpi on pienempi.
HYDREA on sytotoksinen lääke. Noudata soveltuvia erityisiä käsittely- ja hävitysmenettelyjä [katso VIITTEET ].
Niele HYDREA-kapselit kokonaisina. ÄLÄ avaa, riko tai pureskele kapseleita, koska HYDREA on sytotoksinen lääke.
Foolihapon profylaktista antoa suositellaan [katso VAROITUKSET JA VAROTOIMET ].
Seuraa verenkuvaa vähintään kerran viikossa HYDREA 500 mg -hoidon aikana. Vaikea anemia on korjattava ennen HYDREA-hoidon aloittamista.
Annosmuutokset toksisuuden vuoksi
Seuraa seuraavia asioita ja pienennä annosta tai lopeta HYDREA 500mg:n käyttö vastaavasti:
- Myelosuppressio [katso VAROITUKSET JA VAROTOIMET ]
- Ihon vaskuliitti [katso VAROITUKSET JA VAROTOIMET ]
Harkitse annoksen muuttamista muiden toksisten vaikutusten varalta.
Annoksen muutokset munuaisten vajaatoimintaa varten
Pienennä HYDREA-annosta 50 % potilailla, joiden mitattu kreatiniinipuhdistuma on alle 60 ml/min tai joilla on loppuvaiheen munuaissairaus (ESRD) [ks. Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Näiden potilaiden hematologisten parametrien tarkka seuranta on suositeltavaa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Kapselit
500 mg läpinäkymätön vihreä kansi ja läpinäkymätön vaaleanpunainen runko-osa, johon on painettu ”HYDREA” ja ”830”.
Varastointi ja käsittely
HYDREA® (hydroksiureakapselit, USP) toimitetaan 500 mg:n kapseleina HDPE-pulloissa, joissa on muovinen kierrekorkki. Jokainen pullo sisältää 100 kapselia.
Korkki on läpinäkymätön vihreä ja runko läpinäkymätön vaaleanpunainen. Kapseleiden molempiin osiin on painettu mustalla musteella "HYDREA" ja "830" ( NDC 0003-0830-50).
Varastointi
Säilytä 20-25°C (68-77°F); retket sallitaan 15°C-30°C (59°F-86°F) [katso USP Controlled RoomTemperature]. Säilytettävä tiiviisti suljettuna.
Käsittely ja hävittäminen
HYDREA 500mg on sytotoksinen lääke. Noudata soveltuvia erityisiä käsittely- ja hävitysmenettelyjä [katso VIITTEET ].
Vähentääksesi kosketusriskiä kehota hoitajia käyttämään kertakäyttökäsineitä käsitellessäsi HYDREAa tai HYDREAa sisältäviä pulloja. Pese kädet saippualla ja vedellä ennen ja jälkeen kosketuksen pullon tai kapseleiden kanssa, kun käsittelet HYDREAa. Älä avaa HYDREA 500 mg kapseleita. Vältä altistumista murskatuille tai avatuille kapseleille. Jos kosketusta murskattujen tai avattujen kapseleiden kanssa joutuu iholle, pese altistunut alue välittömästi ja perusteellisesti saippualla ja vedellä. Jos kosketusta murskattujen tai avattujen kapseleiden kanssa tapahtuu silmässä (silmissä), vaurioitunutta aluetta tulee huuhdella perusteellisesti vedellä tai isotonisella silmähuuhteluvedellä, joka on tarkoitettu tähän tarkoitukseen vähintään 15 minuutin ajan. Jos kapselista roiskuu jauhetta, pyyhi se välittömästi kostealla kertakäyttöpyyhkeellä ja hävitä suljettuun astiaan, kuten muovipussiin. kuten tyhjät kapselit. Roiskealueet tulee sitten puhdistaa kolme kertaa pesuaineliuoksella ja sen jälkeen puhtaalla vedellä. Pidä lääke poissa lasten ja lemmikkien ulottuvilta. Ota yhteyttä lääkäriisi saadaksesi ohjeita vanhentuneiden kapseleiden hävittämisestä.
VIITTEET
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Valmistettu: Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Tarkistettu: joulukuuta 2020
SIVUVAIKUTUKSET
Seuraavat kliinisesti merkittävät haittavaikutukset on kuvattu yksityiskohtaisesti muissa merkintäosissa:
- Myelosuppressio [katso VAROITUKSET JA VAROTOIMET ]
- Pahanlaatuiset kasvaimet [katso VAROITUKSET JA VAROTOIMET ]
- Vaskuliittiset toksisuudet [katso VAROITUKSET JA VAROTOIMET ]
- Antiretroviraalisten lääkkeiden samanaikaisen käytön riskit [katso VAROITUKSET JA VAROTOIMET ]
- Säteilymuisti [katso VAROITUKSET JA VAROTOIMET ]
- Makrosytoosi [katso VAROITUKSET JA VAROTOIMET ]
- Keuhkojen toksisuus [katso VAROITUKSET JA VAROTOIMET ]
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu HYDREAn hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, niiden esiintymistiheyttä ei aina ole mahdollista arvioida luotettavasti.
- Lisääntymisjärjestelmän ja rintojen häiriöt: atsoospermia ja oligospermia
- Ruoansulatuskanavan häiriöt: stomatiitti, pahoinvointi, oksentelu, ripuli ja ummetus
- Aineenvaihdunta- ja ravitsemushäiriöt: anoreksia, kasvainlyysioireyhtymä
- Ihon ja ihonalaisen kudoksen häiriöt: makulopapulaarinen ihottuma, ihon haavaumat, lupus erythematosus, dermatomyosiittia muistuttavat ihomuutokset, perifeerinen ja kasvojen punoitus, hyperpigmentaatio, kynsien hyperpigmentaatio, ihon ja kynsien surkastuminen, hilseily, violetit näppylät ja hiustenlähtö
- Munuaisten ja virtsateiden häiriöt: dysuria, seerumihapon, veren ureatypen (BUN) ja kreatiniinipitoisuuden nousu
- Hermoston häiriöt: päänsärky, huimaus, uneliaisuus, sekavuus, hallusinaatiot ja kouristukset
- Yleiset häiriöt: kuume, vilunväristykset, huonovointisuus, turvotus ja astenia
- Maksa-sappihäiriöt: maksaentsyymien nousu, kolestaasi ja hepatiitti
- Hengityselinten häiriöt: diffuusi keuhkoinfiltraatit, hengenahdistus ja keuhkofibroosi, interstitiaalinen keuhkosairaus, pneumoniitti, alveoliitti, allerginen alveoliitti ja yskä
- Immuunihäiriöt: systeeminen lupus erythematosus
- Yliherkkyys: Sairaalahoitoa vaativaa lääkkeiden aiheuttamaa kuumetta (pyreksiaa) (>39°C, >102°F) on raportoitu samanaikaisesti ruoansulatuskanavan, keuhkojen, tuki- ja liikuntaelinten, maksa-sappien, dermatologisten tai kardiovaskulaaristen oireiden kanssa. Tauti alkoi tyypillisesti 6 viikon kuluessa aloittamisesta ja hävisi hydroksiureahoidon lopettamisen jälkeen. Kuume ilmaantui uudelleen tyypillisesti 24 tunnin kuluessa.
Hydroksiurean ja sädehoidon yhdistelmässä havaitut haittavaikutukset ovat samanlaisia kuin ne, jotka on raportoitu käytettäessä hydroksiureaa tai sädehoitoa yksinään. Näitä vaikutuksia ovat pääasiassa luuytimen lama (anemia ja leukopenia), mahalaukun ärsytys ja mukosiitti. Melkein kaikilla potilailla, jotka saavat riittävää yhdistelmähoitoa hydroksiurea- ja sädehoitoa, ilmenee samanaikainen leukopenia. Verihiutaleiden vähentymistä (
HUUMEIDEN VUOROVAIKUTUKSET
Lisääntynyt myrkyllisyys antiretroviraalisten lääkkeiden samanaikaisen käytön yhteydessä
Haimatulehdus
Potilailla, joilla on HIV-infektio hydroksiurea- ja didanosiinihoidon aikana, joko stavudiinin kanssa tai ilman, on esiintynyt kuolemaan johtavaa ja ei-fataalista haimatulehdusta. Hydroksiureaa ei ole tarkoitettu HIV-infektion hoitoon; Jos HIV-infektiopotilaita kuitenkin hoidetaan hydroksiurealla ja erityisesti yhdessä didanosiinin ja/tai stavudiinin kanssa, haimatulehduksen merkkien ja oireiden tarkkaa seurantaa suositellaan. Hydroksiureahoito on lopetettava pysyvästi potilailla, joille kehittyy haimatulehduksen merkkejä ja oireita.
Maksatoksisuus
Markkinoille tulon jälkeisen seurannan aikana on raportoitu maksatoksisuutta ja maksan vajaatoimintaa, joka on johtanut kuolemaan HIV-infektiota sairastavilla potilailla, joita on hoidettu hydroksiurealla ja muilla antiretroviraalisilla lääkkeillä. Kuolemaan johtaneita maksatapahtumia raportoitiin useimmiten potilailla, joita hoidettiin hydroksiurean, didanosiinin ja stavudiinin yhdistelmällä. Vältä tätä yhdistelmää.
Perifeerinen neuropatia
Perifeeristä neuropatiaa, joka oli joissakin tapauksissa vaikeaa, on raportoitu HIV-potilailla, jotka ovat saaneet hydroksiureaa yhdessä antiretroviraalisten lääkkeiden kanssa, mukaan lukien didanosiini, stavudiinin kanssa tai ilman.
Laboratoriokokeiden häiriöt
Virtsahappo-, urea- tai maitohappomäärityksien häiriintyminen
Tutkimukset ovat osoittaneet, että hydroksiurealla on analyyttinen häiriö urean, virtsahapon ja maitohapon määrittämisessä käytettävien entsyymien (ureaasi, urikaasi ja laktaattidehydrogenaasi) kanssa, mikä tekee niistä virheellisesti kohonneita tuloksia potilailla, joita hoidetaan hydroksiurealla.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Myelosuppressio
Hydroksiurea aiheuttaa vakavaa myelosuppressiota. Hydroksiureahoitoa ei pidä aloittaa, jos luuytimen toiminta on selvästi heikentynyt. Luuydinsuppressiota saattaa esiintyä, ja leukopenia on yleensä sen ensimmäinen ja yleisin ilmentymä. Trombosytopeniaa ja anemiaa esiintyy harvemmin ja harvoin ilman edeltävää leukopeniaa. Luuydindepressio on todennäköisempää potilailla, jotka ovat aiemmin saaneet sädehoitoa tai sytotoksisia syövän kemoterapeuttisia aineita; Käytä hydroksiureaa varoen tällaisilla potilailla.
Arvioi hematologinen tila ennen HYDREA-hoitoa ja sen aikana. Anna tukihoitoa ja muuta annosta tai lopeta HYDREA tarpeen mukaan. Myelosuppressiosta toipuminen on yleensä nopeaa, kun hoito keskeytetään.
Pahanlaatuiset kasvaimet
Hydroksiurea on ihmiselle syöpää aiheuttava aine. Potilailla, jotka saavat pitkäaikaista hydroksiureaa myeloproliferatiivisten sairauksien hoitoon, on raportoitu sekundaarista leukemiaa. Ihosyöpää on myös raportoitu potilailla, jotka ovat saaneet pitkäaikaista hydroksiureaa. Suosittele suojaamista auringolta ja seuraa sekundaaristen pahanlaatuisten kasvainten kehittymistä.
Alkion ja sikiön myrkyllisyys
Vaikutusmekanismin ja eläimillä tehtyjen löydösten perusteella HYDREA 500 mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Hydroksiurea oli sikiötoksinen ja teratogeeninen rotilla ja kaniineilla annoksilla, jotka olivat 0,8-kertaisia ja 0,3-kertaisia ihmisille suositeltuihin enimmäisvuorokausiannoksiin verrattuna mg/m2:n perusteella. Kerro raskaana oleville naisille mahdollisesta riskistä sikiölle [katso Käyttö tietyissä populaatioissa ].
Kehota lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä HYDREA 500 mg -hoidon aikana ja sen jälkeen vähintään 6 kuukauden ajan hoidon jälkeen. Kehota lisääntymiskykyisiä miehiä käyttämään tehokasta ehkäisyä HYDREA 500 mg -hoidon aikana ja sen jälkeen vähintään vuoden ajan hoidon jälkeen [ks. Käyttö tietyissä populaatioissa ].
Vaskuliittiset toksisuudet
Ihon vaskuliittista toksisuutta, mukaan lukien vaskuliittiset haavaumat ja gangreeni, on esiintynyt potilailla, joilla on myeloproliferatiivisia häiriöitä hydroksiureahoidon aikana. Näitä vaskuliittisia toksisuuksia raportoitiin useimmiten potilailla, jotka ovat saaneet interferonihoitoa tai saavat parhaillaan interferonihoitoa. Jos ihon vaskuliittisia haavaumia ilmaantuu, aloita hoito ja keskeytä HYDREA.
Elävät rokotukset
Vältä elävän rokotteen käyttöä potilailla, jotka käyttävät HYDREAa. HYDREAn samanaikainen käyttö elävän virusrokotteen kanssa voi voimistaa viruksen replikaatiota ja/tai lisätä rokotteen haittavaikutuksia, koska HYDREA voi tukahduttaa normaalit puolustusmekanismit. Rokotus elävillä rokotteilla potilaalle, joka saa HYDREA 500 mg, voi johtaa vakavaan infektioon. Potilaan vasta-ainevaste rokotteisiin saattaa heikentyä. Harkitse asiantuntijan kuulemista.
Antiretroviraalisten lääkkeiden samanaikaisen käytön riskit
Haimatulehdusta, maksatoksisuutta ja perifeeristä neuropatiaa on esiintynyt, kun hydroksiureaa on annettu samanaikaisesti antiretroviraalisten lääkkeiden kanssa, mukaan lukien didanosiini ja stavudiini [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Säteilyn muistaminen
Potilailla, jotka ovat aiemmin saaneet sädehoitoa, saattaa pahentua säteilytyksen jälkeinen punoitus. Seuraa ihon punoitusta potilailla, jotka ovat aiemmin saaneet säteilyä, ja hoitaa oireenmukaisesti.
Makrosytoosi
HYDREA 500mg voi aiheuttaa makrosytoosia, joka on itsestään rajoittuva ja havaitaan usein hoidon alkuvaiheessa. Morfologinen muutos muistuttaa turmiollista anemiaa, mutta se ei liity B12-vitamiinin tai foolihapon puutteeseen. Tämä voi peittää tuhoisan anemian diagnoosin. Foolihapon profylaktista antoa suositellaan.
Keuhkojen toksisuus
Interstitiaalista keuhkosairautta, mukaan lukien keuhkofibroosi, keuhkojen infiltraatio, pneumoniitti ja alveoliitti/allerginen alveoliitti (mukaan lukien kuolemaan johtaneet tapaukset), on raportoitu potilailla, joita on hoidettu myeloproliferatiivisen kasvaimen vuoksi. Seuraa potilaita, joille kehittyy kuumetta, yskää, hengenahdistusta tai muita hengitystieoireita usein, tutki ja aloita hoito viipymättä. Lopeta HYDREA 500 mg:n käyttö ja hoida sitä kortikosteroideilla [katso HAITTAVAIKUTUKSET ].
Laboratoriokokeiden häiriöt
Virtsahappo-, urea- tai maitohappomääritysten häiriöt ovat mahdollisia, mikä tekee niistä virheellisesti kohonneita tuloksia potilailla, joita hoidetaan hydroksiurealla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Perinteisiä pitkän aikavälin tutkimuksia hydroksiurean karsinogeenisuuden arvioimiseksi ei ole tehty. Kuitenkin vatsaontelonsisäinen 125-250 mg/kg hydroksiurea (noin 0,6-1,2 kertaa ihmisen suurin suositeltu suun kautta otettava päiväannos mg/m2:n perusteella) kolmesti viikossa 6 kuukauden ajan naarasrotille lisäsi rintarauhaskasvaimien ilmaantuvuutta rotilla, jotka jäivät eloon 18:aan. kuukautta vertailuun verrattuna. Hydroksiurea on mutageeninen in vitro bakteereille, sienille, alkueläimille ja nisäkässoluille. Hydroksiurea on klastogeeninen in vitro (hamsterin solut, ihmisen lymfoblastit) ja in vivo (SCE-määritys jyrsijöillä, hiiren mikrotumamääritys). Hydroksiurea aiheuttaa jyrsijän alkiosolujen transformaation kasvaimia aiheuttavaksi fenotyypiksi.
Urosrotille annettu hydroksiurea annoksella 60 mg/kg/vrk (noin 0,3 kertaa ihmisen suurin suositeltu päiväannos mg/m2:n perusteella) aiheutti kivesten surkastumista, vähensi spermatogeneesiä ja heikensi merkittävästi niiden kykyä hedelmöittää naaraita.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
HYDREA voi aiheuttaa sikiövaurioita eläinkokeiden tulosten ja lääkkeen vaikutusmekanismin perusteella [katso KLIININEN FARMAKOLOGIA ]. HYDREAn käytöstä raskaana olevilla naisilla ei ole tietoa lääkkeisiin liittyvästä riskistä. Eläinten lisääntymistutkimuksissa hydroksiurean antaminen tiineille rotille ja kaneille organogeneesin aikana aiheutti alkiotoksisia ja teratogeenisia vaikutuksia annoksilla, jotka olivat vastaavasti 0,8-kertaisia ja 0,3-kertaisia ihmisille suositeltuihin enimmäisvuorokausiannoksiin mg/m2:n perusteella (ks. Data ). Kertokaa naisille mahdollisista riskeistä sikiölle ja välttämään raskaaksi tulemista HYDREA-hoidon aikana.
USA:n väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %.
Data
Eläinten tiedot
Hydroksiurean on osoitettu olevan voimakas teratogeeni monissa eläinmalleissa, mukaan lukien hiiret, hamsterit, kissat, minisiat, koirat ja apinat annoksilla, jotka ovat 1-kertaisia ihmisen annokseen verrattuna mg/m2-pohjaisesti. Hydroksiurea on alkiotoksinen ja aiheuttaa sikiön epämuodostumia (osittain luutuneita kallon luut, silmäkuopat puuttuminen, vesipää, kaksipuoliset sternebrae, puuttuvat lannenikamat) annoksella 180 mg/kg/vrk (noin 0,8 kertaa ihmisen suurin suositeltu vuorokausiannos mg/m2:n perusteella). rotilla ja 30 mg/kg/vrk (noin 0,3 kertaa ihmisen suurin suositeltu vuorokausiannos mg/m2 perusteella) kaniineilla. Alkiotoksisuus oli tunnusomaista sikiön elinkelpoisuuden heikkeneminen, elävien pentueiden koon pieneneminen ja kehityksen viivästyminen. Hydroksiurea läpäisee istukan. Rotille annetut kerta-annokset ≥ 375 mg/kg (noin 1,7 kertaa ihmisen suurin suositeltu päiväannos mg/m2:n perusteella) aiheuttivat kasvun hidastumista ja heikensivät oppimiskykyä.
Imetys
Riskien yhteenveto
Hydroksiurea erittyy äidinmaitoon. Imetys on lopetettava HYDREA-hoidon ajaksi, koska hydroksiureasta imetetylle lapselle voi aiheutua vakavia haittavaikutuksia, mukaan lukien karsinogeenisuus.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Raskaustestaus
Tarkista lisääntymiskykyisten naisten raskaustila ennen HYDREA-hoidon aloittamista.
Ehkäisy
Naaraat
HYDREA voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [katso Raskaus ]. Kehota lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä HYDREA-hoidon aikana ja sen jälkeen vähintään 6 kuukauden ajan hoidon jälkeen. Neuvo naisia ilmoittamaan välittömästi raskaudesta.
Miehet
HYDREA 500mg voi vaurioittaa siittiöitä ja kiveskudosta, mikä voi johtaa mahdollisiin geneettisiin poikkeavuksiin. Miesten, joilla on lisääntymiskykyisiä naispuolisia seksikumppaneita, tulee käyttää tehokasta ehkäisyä HYDREA 500 mg -hoidon aikana ja sen jälkeen vähintään vuoden ajan hoidon jälkeen [ks. Ei-kliininen toksikologia ].
Hedelmättömyys
Miehet
Eläimillä ja ihmisillä tehtyjen löydösten perusteella HYDREA-hoito voi heikentää miesten hedelmällisyyttä. Miehillä on havaittu atsoospermiaa tai oligospermiaa, joskus palautuvaa. Ilmoita miespotilaille sperman säilymisen mahdollisuudesta ennen hoidon aloittamista [katso HAITTAVAIKUTUKSET ja Ei-kliininen toksikologia ].
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Iäkkäät potilaat voivat olla herkempiä hydroksiurean vaikutuksille ja saattavat tarvita pienemmän annoksen. Hydroksiurea erittyy munuaisten kautta, ja tämän lääkkeen haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä [ks. ANNOSTELU JA HALLINNOINTI ].
Munuaisten vajaatoiminta
Altistuminen hydroksiurealle on suurempi potilailla, joiden kreatiniinipuhdistuma on alle 60 ml/min tai potilailla, joilla on loppuvaiheen munuaissairaus (ESRD). Pienennä annosta ja seuraa tarkasti hematologisia parametreja, kun HYDREA 500 mg on määrä antaa näille potilaille [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Ei ole olemassa tietoja, jotka tukevat erityisiä ohjeita annoksen muuttamiseksi potilailla, joilla on maksan vajaatoiminta. Näiden potilaiden hematologisten parametrien tarkka seuranta on suositeltavaa.
YLIANNOSTUS
Akuuttia limakalvon toksisuutta on raportoitu potilailla, jotka ovat saaneet hydroksiureaa annoksina, jotka ovat useita kertoja terapeuttiseen annokseen verrattuna. Arkuutta, violettia punoitusta, turvotusta kämmenissä ja jaloissa, jota seuraa käsien ja jalkojen hilseily, ihon vakavaa yleistynyttä hyperpigmentaatiota ja stomatiittia on myös havaittu.
VASTA-AIHEET
HYDREA 500 mg on vasta-aiheinen potilailla, jotka ovat aiemmin olleet yliherkkiä hydroksiurealle tai jollekin muulle valmisteen aineosalle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Tarkkaa mekanismia, jolla hydroksiurea tuottaa antineoplastisia vaikutuksia, ei tällä hetkellä voida kuvata. Erilaisten rottien ja ihmisten kudosviljelmien tutkimusten raportit tukevat kuitenkin hypoteesia, jonka mukaan hydroksiurea estää välittömästi DNA-synteesin toimimalla ribonukleotidireduktaasin estäjänä häiritsemättä ribonukleiinihapon tai proteiinin synteesiä. Tämä hypoteesi selittää, miksi hydroksiurea voi tietyissä olosuhteissa aiheuttaa teratogeenisia vaikutuksia.
Pään ja kaulan okasolusyöpien (epidermoidisolujen) karsinoomien samanaikaisen hydroksiureahoidon ja säteilytyksen tehokkuuden lisäämiseksi on oletettu kolme vaikutusmekanismia. Kiinalaisen hamsterin soluja käyttävät in vitro -tutkimukset viittaavat siihen, että hydroksiurea (1) on tappava normaalisti radioresistenteille S-vaiheen soluille ja (2) pitää muut solusyklin solut G1- tai esi-DNA-synteesivaiheessa, jossa ne ovat herkimpiä säteilyn vaikutuksia. Kolmas vaikutusmekanismi on teoretisoitu HeLa-solujen in vitro -tutkimusten perusteella. Näyttää siltä, että hydroksiurea estää DNA-synteesiä estämällä niiden solujen normaalia korjausprosessia, jotka ovat vaurioituneet, mutta eivät kuolleet säteilytyksen vaikutuksesta, mikä vähentää niiden eloonjäämisprosenttia; RNA- ja proteiinisynteesit eivät ole osoittaneet muutoksia.
Farmakokinetiikka
Imeytyminen
Suun kautta annetun HYDREAn jälkeen hydroksiurea saavuttaa huippupitoisuudet plasmassa 1–4 tunnissa. Keskimääräiset huippupitoisuudet plasmassa ja AUC suurenevat enemmän kuin suhteessa annoksen suurentamiseen.
Ruoan vaikutuksesta hydroksiurean imeytymiseen ei ole tietoa.
Jakelu
Hydroksiurea jakautuu koko kehoon jakautumistilavuudella, joka on suunnilleen koko kehon vesimäärä.
Hydroksiurea keskittyy leukosyytteihin ja punasoluihin.
Aineenvaihdunta
Jopa 60 % suun kautta annetusta annoksesta muuttuu kyllästyvän maksan metabolian kautta ja suoliston bakteereissa havaittu ureaasi hajoaa vähäisessä määrin.
Erittyminen
Sirppisoluanemiaa sairastavilla potilailla hydroksiurean keskimääräinen kumulatiivinen virtsaan erittyminen oli noin 40 % annetusta annoksesta.
Tietyt populaatiot
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta hydroksiurean farmakokinetiikkaan arvioitiin aikuisilla potilailla, joilla oli sirppisolusairaus ja munuaisten vajaatoiminta. Potilaat, joiden munuaisten toiminta on normaali (kreatiniinipuhdistuma [CrCl] >80 ml/min), lievä (CrCl 50-80 ml/min), keskivaikea (CrCl = 30- 60 ml/min). Pienennä HYDREA 500 mg annosta, kun sitä annetaan potilaille, joiden kreatiniinipuhdistuma on ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
POTILASTIEDOT
- On olemassa myelosuppression vaara. Veriarvojen seurantaa viikoittain koko hoidon ajan tulee korostaa potilailla, jotka käyttävät HYDREAa [katso VAROITUKSET JA VAROTOIMET ]. Neuvo potilaita ilmoittamaan välittömästi infektion tai verenvuodon merkeistä ja oireista.
- Kerro potilaille, että on olemassa ihon vaskuliittisten toksisuuksien ja sekundaaristen pahanlaatuisten kasvainten, mukaan lukien leukemia ja ihosyövät, riski [ks. VAROITUKSET JA VAROTOIMET ].
- Kerro lisääntymispotentiaalisille naisille mahdollisista riskeistä sikiölle ja ilmoittaa terveydenhuollon tarjoajalle tiedossa olevasta tai epäillystä raskaudesta. Neuvo lisääntymiskykyisiä naisia ja miehiä käyttämään ehkäisyä HYDREA-hoidon aikana ja sen jälkeen [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
- Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he ovat saaneet tai aikovat saada rokotuksia HYDREA 500 mg:n käytön aikana, koska tämä voi johtaa vakavaan infektioon [ks. VAROITUKSET JA VAROTOIMET ].
- Neuvo naisia lopettamaan imetys HYDREA-hoidon aikana [katso Käyttö tietyissä populaatioissa ].
- HIV-infektiopotilaiden tulee ottaa yhteyttä lääkäriin haimatulehduksen, maksatapahtumien ja perifeerisen neuropatian merkkien ja oireiden varalta [ks. VAROITUKSET JA VAROTOIMET ].
- Säteilytyksen jälkeistä punoitusta voi esiintyä potilailla, jotka ovat saaneet aikaisempaa sädehoitoa [katso VAROITUKSET JA VAROTOIMET ].
- Kerro potilaille mahdollisen keuhkomyrkytysoireista ja neuvo heitä hakeutumaan välittömästi lääkärin hoitoon kuumeen, yskän, hengenahdistuksen tai muiden hengitystieoireiden ilmetessä [ks. VAROITUKSET JA VAROTOIMET ].
