Suprax 100mg, 200mg Cefixime Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Suprax 200mg on ja miten sitä käytetään?
Suprax (kefiksiimi) oraalisuspensiolle on kefalosporiiniantibiootti, jota käytetään monien erityyppisten bakteerien aiheuttamien infektioiden hoitoon.
Mitä sivuvaikutuksia Supraxilla on?
Suprax 100mg:n yleisiä sivuvaikutuksia ovat:
- vatsavaivoja/kipuja,
- ripuli,
- pahoinvointi,
- ummetus,
- ruokahalun menetys,
- kaasu,
- päänsärky,
- huimaus,
- ahdistus,
- uneliaisuus,
- lisääntynyt virtsaaminen yöllä,
- vuotava nenä,
- kipeä kurkku,
- yskä, tai
- emättimen kutina tai vuoto.
Kerro lääkärillesi, jos havaitset Suprax 200 mg:n harvinaisia mutta erittäin vakavia sivuvaikutuksia, mukaan lukien:
- vaikea vatsakipu tai vatsakipu,
- jatkuva pahoinvointi tai oksentelu,
- keltaiset silmät tai iho,
- tumma virtsa,
- epätavallinen väsymys,
- uudet infektion merkit (esim. jatkuva kurkkukipu, kuume),
- helppo mustelma tai verenvuoto,
- virtsan määrän muutos tai
- henkiset/mielialan muutokset (kuten sekavuus).
KUVAUS
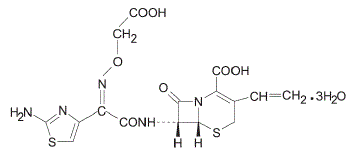
Cefixime on puolisynteettinen, kefalosporiinien antibakteerinen lääke, joka on tarkoitettu annettavaksi suun kautta. Kemiallisesti se on (6R,7R)-7-[2-(2-amino-4-tiatsolyyli)glyoksyyliamido]-8-okso-3-vinyyli-5-tia-1-atsabisyklo[4.2.0]okt-2 -eeni-2-karboksyylihappo, 72-(Z)-[O-(karboksimetyyli)oksiimi]trihydraatti.
Molekyylipaino = 507,50 trihydraattina. Kemiallinen kaava on C16H15N5O7S2.3H2O
Kefiksiimin rakennekaava on:
- SUPRAX® (kefiksiimi) 400 mg tablettien USP sisältämät inaktiiviset aineosat ovat: kaksiemäksinen kalsiumfosfaatti, hypromelloosi, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, esigelatinoitu tärkkelys, titaanidioksidi ja triasetiini.
- SUPRAX® (cefixime) 400 mg kapseleiden sisältämät inaktiiviset aineosat ovat: kolloidinen piidioksidi, krospovidoni, vähän substituoitu hydroksipropyyliselluloosa, magnesiumstearaatti ja mannitoli. Kapselin kuori sisältää seuraavat inaktiiviset aineosat: musta rautaoksidi, punainen rautaoksidi, gelatiini, kaliumhydroksidi, propyleeniglykoli, sellakka, natriumlauryylisulfaatti ja titaanidioksidi.
- SUPRAX® (kefiksiimi) 100 mg tai 150 mg tai 200 mg purutablettien sisältämät inaktiiviset ainesosat ovat: aspartaami, kolloidinen piidioksidi, krospovidoni, FD&C Red # 40 Aluminium Lake, vähän substituoitu hydroksipropyyliselluloosa, magnesiumstearaatti, mannitoli-makuaine, mannitoli. ja tutti frutti maku.
- SUPRAX® (kefiksiimi) -jauheen sisältämät inaktiiviset aineosat oraalisuspensiota varten USP ovat: kolloidinen piidioksidi, natriumbentsoaatti, mansikka-aromi, sukraloosi (vain 500 mg / 5 ml vahvuus), sakkaroosi ja ksantaanikumi.
INDIKAATIOT
Komplisoitumattomat virtsatieinfektiot
SUPRAX on tarkoitettu sellaisten aikuisten ja vähintään kuuden kuukauden ikäisten lapsipotilaiden hoitoon, joilla on komplisoitumattomia virtsatieinfektioita, jotka ovat aiheuttaneet Escherichia colin ja Proteus mirabilisin herkät isolaatit.
Välikorvatulehdus
SUPRAX on tarkoitettu yli kuuden kuukauden ikäisten aikuisten ja lapsipotilaiden hoitoon, joilla on Haemophilus influenzaen, Moraxella catarrhaliksen ja Streptococcus pyogenesin herkkien isolaattien aiheuttama välikorvatulehdus. (Streptococcus pyogenesin tehoa tässä elinjärjestelmässä tutkittiin alle 10 infektiossa.)
Merkintä
Potilailla, joilla oli Streptococcus pneumoniaen aiheuttama välikorvatulehdus, kokonaisvaste oli noin 10 % pienempi kefiksiimilla kuin vertailuvalmisteella [ks. Kliiniset tutkimukset ].
Nielutulehdus ja tonsilliitti
SUPRAX on tarkoitettu vähintään kuuden kuukauden ikäisten aikuisten ja lapsipotilaiden hoitoonnielutulehdus ja tonsilliitti, jonka aiheuttavat Streptococcus pyogenesin herkät isolaatit. (Huomautus: Penisilliini on tavallinen suosituslääke Streptococcus pyogenes -infektioiden hoidossa. SUPRAX on yleensä tehokas Streptococcus pyogenes -bakteerin hävittämisessä nenänielusta; tiedot, jotka osoittavat SUPRAX 100 mg:n tehokkuuden myöhemmässä reumakuumeen ehkäisyssä, eivät kuitenkaan ole saatavilla.)
Kroonisen keuhkoputkentulehduksen akuutit pahenemisvaiheet
SUPRAX 200mg on tarkoitettu aikuisille ja vähintään kuuden kuukauden ikäisille lapsipotilaille, joilla on kroonisen keuhkoputkentulehduksen akuutteja pahenemisvaiheita, jotka ovat aiheuttaneet Streptococcus pneumoniae- ja Haemophilus influenzae -bakteerin herkät isolaatit.
Komplisoitumaton tippuri (kohdunkaulan/virtsaputken)
SUPRAX 100mg on tarkoitettu aikuisten ja kuuden kuukauden ikäisten tai sitä vanhempien lapsipotilaiden hoitoon, joilla on komplisoitumaton gonorrea (kohdunkaulan/virtsaputken), jonka aiheuttavat herkät Neisseria gonorrhoeae -isolaatit (penisillinaasia ja ei-penisillinaasia tuottavat isolaatit).
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja SUPRAX 100mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi SUPRAX 100mg -valmistetta tulee käyttää vain sellaisten infektioiden hoitoon, joiden on todistettu tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystietoa on saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antimikrobista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
Aikuiset
Suositeltu kefiksiimin annos on 400 mg vuorokaudessa. Tämä voidaan antaa 400 mg:n tablettina tai kapselina päivittäin tai 400 mg:n tabletti voidaan jakaa ja antaa puolikkaana tablettina 12 tunnin välein. Komplisoitumattomien kohdunkaulan/virtsaputken gonokokki-infektioiden hoitoon suositellaan 400 mg:n kerta-annosta suun kautta. Kapseli ja tabletti voidaan antaa ruokailusta riippumatta.
Streptococcus pyogenes -bakteerin aiheuttamien infektioiden hoidossa kefiksiimin terapeuttinen annos tulee antaa vähintään 10 päivän ajan.
Pediatriset potilaat (6 kuukautta tai vanhemmat)
Suositeltu annos on 8 mg/kg/vrk suspensiota. Tämä voidaan antaa yhtenä vuorokautisena annoksena tai jaettuna kahteen annokseen, 4 mg/kg 12 tunnin välein.
Merkintä
Jokaiselle lasten painoalueelle on määritetty ehdotettu annos. Katso taulukko 1. Varmista, että kaikki määräykset, joissa määritellään annos millilitroina, sisältävät pitoisuuden, koska SUPRAX oraalisuspensiota on saatavana kolmessa eri pitoisuudessa (100 mg/5 ml, 200 mg/5 ml ja 500 mg/5 ml).
Yli 45 kg painavia tai yli 12-vuotiaita lapsia tulee hoitaa suositellulla aikuisen annoksella. SUPRAX (cefixime) -purutabletit on pureskeltava tai murskattava ennen nielemistä.
Välikorvantulehdus tulee hoitaa purutableteilla tai suspensiolla. Välikorvantulehduksen kliiniset tutkimukset suoritettiin purutableteilla tai suspensiolla, ja purutabletit tai suspensio johtavat korkeampiin veren huippupitoisuuksiin kuin tabletit, kun niitä annettiin samalla annoksella.
Siksi tablettia tai kapselia ei tule korvata purutabletteja tai suspensiota välikorvatulehduksen hoidossa [ks. KLIININEN FARMAKOLOGIA ].
Streptococcus pyogenes -bakteerin aiheuttamien infektioiden hoidossa kefiksiimin terapeuttinen annos tulee antaa vähintään 10 päivän ajan.
Munuaisten vajaatoiminta
SUPRAX 200 mg voidaan antaa munuaisten vajaatoiminnalle. Normaalia annosta ja aikataulua voidaan käyttää potilailla, joiden kreatiniinipuhdistuma on 60 ml/min tai suurempi. Katso taulukosta 2 annoksen muuttamisesta aikuisille, joilla on munuaisten vajaatoiminta. Hemodialyysi tai peritoneaalidialyysi eivät poista merkittäviä määriä lääkettä elimistöstä.
Käyttövalmiiksi saattamisen ohjeet oraalisuspensiota varten
Käyttövalmiiksi saattamisen jälkeen suspensiota voidaan säilyttää 14 päivän ajan joko huoneenlämmössä tai jääkaapissa ilman merkittävää tehon menetystä. Säilytettävä tiiviisti suljettuna. Ravista hyvin ennen käyttöä. Hävitä käyttämätön osa 14 päivän kuluttua.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
SUPRAX on saatavana suun kautta annettavaksi seuraavissa annosmuodoissa ja vahvuuksina:
- Kalvopäällysteiset tabletit sisältävät 400 mg kefiksiimiä trihydraattina. Nämä ovat valkoisia tai luonnonvalkoisia, kalvopäällysteisiä, kapselin muotoisia tabletteja, joissa on viistoreunainen ja jaettu jakouurre kummallakin puolella. Tabletin toisella puolella on kaiverrus "SUPRAX" ja toisella puolella "LUPIN".
- Kapselit sisältävät 400 mg kefiksiimiä trihydraattina. Nämä ovat "00EL"-kokoisia kapseleita, joissa on vaaleanpunainen läpinäkymätön kansi ja vaaleanpunainen läpinäkymätön runko-osa, jossa mustalla musteella "LU" ja "U43". Kapselit sisältävät valkoista tai kellertävän valkoista rakeista jauhetta.
- Purutabletit sisältävät joko 100 mg tai 150 mg tai 200 mg kefiksiimiä trihydraattina. 100 mg:n tabletti on vaaleanpunainen, pyöreä tabletti, jonka toiselle puolelle on kaiverrettu ”SUPRAX 100” ja toiselle puolelle ”LUPIN”. 150 mg:n tabletti on vaaleanpunainen, pyöreä tabletti, jonka toiselle puolelle on kaiverrettu ”SUPRAX 150” ja toiselle puolelle ”LUPIN”. 200 mg:n tabletti on vaaleanpunainen, pyöreä tabletti, jonka toiselle puolelle on kaiverrettu ”SUPRAX 200” ja toiselle puolelle ”LUPIN”.
- Jauhe oraalisuspensiota varten, kun se on valmistettu käyttövalmiiksi, sisältää joko 100 mg/5 ml tai 200 mg/5 ml tai 500 mg/5 ml kefiksiimiä trihydraattina. 100 mg/5 ml ja 200 mg/5 ml jauhe on väriltään luonnonvalkoisesta vaaleankeltaiseen ja se on mansikan makuinen. 500 mg/5 ml:n jauheessa on luonnonvalkoista kermanväristä väriä ja se on mansikanmakuinen.
Varastointi ja käsittely
SUPRAX® on saatavana suun kautta annettavaksi seuraavissa annosmuodoissa, vahvuuksissa ja pakkauksissa, jotka on lueteltu alla olevassa taulukossa:
Valmistaja: Lupin Limited Mandideep 462 046 Intia. Tarkistettu: maaliskuu 2018.
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yleisimmin havaitut haittavaikutukset Yhdysvalloissa tehdyissä tablettiformulaatiotutkimuksissa olivat maha-suolikanavan tapahtumat, joita raportoitiin 30 %:lla aikuispotilaista joko kahdesti vuorokaudessa tai kerran vuorokaudessa saaneilla. Viisi prosenttia (5 %) Yhdysvalloissa kliinisissä tutkimuksissa olevista potilaista keskeytti hoidon lääkkeisiin liittyvien haittavaikutusten vuoksi. Yksittäisiä haittavaikutuksia olivat ripuli 16 %, löysät tai tiheä ulosteet 6 %, vatsakipu 3 %, pahoinvointi 7 %, dyspepsia 3 % ja ilmavaivat 4 %. Ruoansulatuskanavan haittavaikutusten, mukaan lukien ripulin ja löysät ulosteet, ilmaantuvuus suspensiota saaneilla lapsipotilailla oli verrattavissa tabletteja saaneilla aikuispotilailla.
Markkinoinnin jälkeinen kokemus
Seuraavia haittavaikutuksia on raportoitu kefiksiimin käytön jälkeen. Ilmaantuvuus oli alle 1 50:stä (alle 2 %).
Ruoansulatuskanava
Kliinisissä tutkimuksissa havaittiin useita dokumentoituja pseudomembranoottisia paksusuolentulehdustapauksia. Pseudomembranoottisen paksusuolitulehduksen oireet voivat ilmaantua hoidon aikana tai sen jälkeen.
Yliherkkyysreaktiot
Anafylaktiset/anafylaktoidiset reaktiot (mukaan lukien sokki ja kuolemantapaukset), ihottumat, nokkosihottuma, lääkekuume, kutina, angioedeema ja kasvojen turvotus. Erythema multiforme, Stevens-Johnsonin oireyhtymä ja seerumitaudin kaltaisia reaktioita on raportoitu.
Maksa
karkea SGPT:n, SGOT:n, alkalisen fosfataasin, hepatiitti, keltaisuus.
Munuaiset
Ohimenevä BUN- tai kreatiniiniarvon nousu, akuutti munuaisten vajaatoiminta.
Keskushermosto
Päänsärkyä, huimausta, kohtauksia.
Hemic ja lymfaattinen järjestelmä
Ohimenevä trombosytopenia, leukopenia, neutropenia, protrombiiniajan pidentyminen, kohonnut LDH, pansytopenia, agranulosytoosi ja eosinofilia.
Epänormaalit laboratoriokokeet
Hyperbilirubinemia.
Muut haittavaikutukset
Sukuelinten kutina, vaginiitti, kandidiaasi, toksinen epidermaalinen nekrolyysi.
Kefalosporiiniluokan lääkkeiden raportoidut haittavaikutukset
Allergiset reaktiot, superinfektiot, munuaisten vajaatoiminta, toksinen nefropatia, maksan toimintahäiriö mukaan lukien kolestaasi, aplastinen anemia, hemolyyttinen anemia, verenvuoto ja koliitti.
Useat kefalosporiinit ovat saaneet aikaan kouristuskohtauksia, erityisesti potilailla, joilla on munuaisten vajaatoiminta, kun annosta ei ole pienennetty [ks. ANNOSTELU JA HALLINNOINTI katso YLIANNOSTUS ]. Jos lääkehoitoon liittyviä kouristuskohtauksia ilmenee, lääkkeen käyttö on lopetettava. Antikonvulsanttihoitoa voidaan antaa, jos se on kliinisesti aiheellista.
HUUMEIDEN VUOROVAIKUTUKSET
Karbamatsepiini
Markkinoille tulon jälkeen on raportoitu kohonneita karbamatsepiinipitoisuuksia, kun kefiksiimiä on annettu samanaikaisesti. Lääkkeiden seuranta voi auttaa havaitsemaan muutoksia plasman karbamatsepiinin pitoisuuksissa.
Varfariini ja antikoagulantit
Pidentynyttä protrombiiniaikaa kliinisen verenvuodon kanssa tai ilman sitä on raportoitu, kun kefiksiimiä on annettu samanaikaisesti.
Lääke/laboratoriotestien vuorovaikutukset
Väärä positiivinen reaktio virtsan ketoneille voi ilmetä nitroprussidia käyttävillä testeillä, mutta ei nitroferrisyanidia käyttävillä testeillä.
Kefiksiimin anto voi aiheuttaa väärän positiivisen reaktion virtsassa olevan glukoosin suhteen käyttämällä Clinitest®-, Benedict- tai Fehling-liuosta. On suositeltavaa käyttää entsymaattisiin glukoosioksidaasireaktioihin perustuvia glukoositestejä (kuten Clinistix® tai TesTape®). Väärä positiivinen suora Coombs-testi on raportoitu muiden kefalosporiinien käytön aikana; Tästä syystä on otettava huomioon, että positiivinen Coombsin testi voi johtua lääkkeestä.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.

VAROTOIMENPITEET
Yliherkkyysreaktiot
Anafylaktisia/anafylaktoidisia reaktioita (mukaan lukien sokki ja kuolemantapaukset) on raportoitu kefiksiimin käytön yhteydessä.
Ennen SUPRAX-hoidon aloittamista on tutkittava huolellisesti, onko potilaalla aiemmin ollut yliherkkyysreaktioita kefalosporiineille, penisilliineille tai muille lääkkeille. Jos tätä tuotetta annetaan penisilliiniherkille potilaille, on noudatettava varovaisuutta, koska ristiin yliherkkyys beetalaktaamiantibakteerilääkkeiden välillä on dokumentoitu selvästi ja sitä voi esiintyä jopa 10 %:lla potilaista, joilla on ollut penisilliiniallergia. Jos SUPRAX 100 mg:lle ilmenee allerginen reaktio, lopeta lääkkeen käyttö.
Clostridium Difficilen aiheuttama ripuli
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien SUPRAX 200 mg, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen isolaatit lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD:ta epäillään tai varmistetaan, jatkuva antibakteeristen lääkkeiden käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibakteerinen lääkehoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
Annoksen säätäminen munuaisten vajaatoiminnassa
SUPRAX 100 mg:n annosta tulee muuttaa potilailla, joilla on munuaisten vajaatoiminta sekä jatkuva ambulatorinen peritoneaalidialyysi (CAPD) ja hemodialyysi (HD). Dialyysipotilaita tulee seurata huolellisesti [katso ANNOSTELU JA HALLINNOINTI ].
Koagulaatiovaikutukset
Kefalosporiinit, mukaan lukien SUPRAX 200 mg, voivat liittyä protrombiiniaktiivisuuden laskuun. Riskiryhmään kuuluvat potilaat, joilla on munuaisten tai maksan vajaatoiminta tai huono ravitsemustila, sekä potilaat, jotka saavat pitkäaikaista antimikrobista hoitoa, ja potilaat, jotka ovat aiemmin stabiloituneet antikoagulanttihoidolla. Protrombiiniaikaa on seurattava riskipotilailla ja annettava eksogeenistä K-vitamiinia ohjeiden mukaisesti.
Lääkeresistenttien bakteerien kehittäminen
SUPRAXin (kefiksiimin) määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Riski potilailla, joilla on fenyyliketonuria
Fenyylialaniini voi olla haitallista potilaille, joilla on fenyyliketonuria (PKU). SUPRAX 200 mg purutabletit sisältävät aspartaamia, joka on fenyylialaniinin lähde. Jokainen 100 mg, 150 mg ja 200 mg vahvuus sisältää 3,3 mg, 5 mg ja 6,7 mg fenyylialaniinia. Ennen kuin määräät SUPRAX-purutabletteja PKU-potilaalle, harkitse fenyylialaniinin yhdistettyä päivittäistä määrää kaikista lähteistä, mukaan lukien SUPRAX 200 mg:n purutabletit.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Elinikäisiä tutkimuksia eläimillä karsinogeenisuuden arvioimiseksi ei ole tehty. Cefixime ei aiheuttanut pistemutaatioita bakteereissa tai nisäkässoluissa, DNA-vaurioita tai kromosomivaurioita in vitro, eikä sillä ollut klastogeenistä potentiaalia in vivo hiiren mikrotumatestissä. Rotilla kefiksiimi ei vaikuttanut hedelmällisyyteen ja lisääntymiskykyyn annoksilla, jotka olivat enintään 25 kertaa aikuisen terapeuttisia annosta suuremmat.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka B
Lisääntymistutkimuksia on suoritettu hiirillä ja rotilla annoksilla, jotka ovat jopa 40-kertaisia ihmisen annokseen verrattuna, eivätkä ne ole osoittaneet mitään merkkejä kefiksiimin aiheuttamasta haitasta sikiölle. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
Cefiximin käyttöä synnytyksen ja synnytyksen aikana ei ole tutkittu. Hoitoa tulee antaa vain, jos se on selvästi tarpeen.
Imettävät äidit
Ei tiedetä, erittyykö kefiksiimi äidinmaitoon. Imetyksen lopettamista tilapäisesti tämän lääkkeen ajaksi on harkittava.
Käyttö lapsille
Kefiksiimin turvallisuutta ja tehokkuutta alle kuuden kuukauden ikäisillä lapsilla ei ole osoitettu. Ruoansulatuskanavan haittavaikutusten, mukaan lukien ripulin ja löysät ulosteet, ilmaantuvuus suspensiota saaneilla lapsipotilailla oli verrattavissa tabletteja saaneilla aikuispotilailla.
Geriatrinen käyttö
Kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen selvittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Vanhuksilla tehdyssä farmakokineettisessä tutkimuksessa havaittiin eroja farmakokineettisissä parametreissa [katso KLIININEN FARMAKOLOGIA ]. Nämä erot olivat pieniä eivätkä osoita tarvetta muuttaa lääkkeen annostusta vanhuksilla.
Munuaisten vajaatoiminta
Kefiksiimin annosta tulee muuttaa potilailla, joilla on munuaisten vajaatoiminta sekä jatkuvaa ambulatorista peritoneaalidialyysiä (CAPD) ja hemodialyysia (HD). Dialyysipotilaita tulee seurata huolellisesti [katso ANNOSTELU JA HALLINNOINTI ].
YLIANNOSTUS
Mahahuuhtelu voi olla aiheellista; muuten ei ole olemassa spesifistä vastalääkettä. Kefiksiimiä ei poisteta merkittäviä määriä verenkierrosta hemodialyysillä tai peritoneaalidialyysillä. Haittavaikutukset pienellä määrällä terveitä aikuisia vapaaehtoisia, jotka saivat enintään 2 g:n kerta-annoksia kefiksiimia, eivät eronneet profiilista, joka havaittiin potilailla, joita hoidettiin suositelluilla annoksilla.
VASTA-AIHEET
Suprax (kefiksiimi) on vasta-aiheinen potilaille, jotka ovat allergisia kefiksiimille tai muille kefalosporiineille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Cefixime on puolisynteettinen kefalosporiinien antibakteerinen lääke [katso Mikrobiologia ].
Farmakokinetiikka
SUPRAX 200 mg purutabletit ovat biologisesti samanarvoisia oraalisuspension kanssa.
Suun kautta annetut SUPRAX 200 mg tabletit ja suspensio imeytyy noin 40-50 % riippumatta siitä, annettiin ruoan kanssa tai ilman; maksimaaliseen imeytymiseen kuluva aika pitenee kuitenkin noin 0,8 tuntia, kun se otetaan ruoan kanssa. Yksi 200 mg:n kefiksiimitabletti tuottaa seerumin keskimääräisen huippupitoisuuden, joka on noin 2 mcg/ml (vaihteluväli 1-4 mcg/ml); yksi 400 mg:n tabletti tuottaa keskimääräisen huippupitoisuuden, joka on noin 3,7 mcg/ml (vaihteluväli 1,3-7,7 mcg/ml). Oraalisuspensio tuottaa keskimääräisiä huippupitoisuuksia, jotka ovat noin 25–50 % korkeampia kuin tabletit, kun sitä testataan normaaleilla aikuisilla vapaaehtoisilla. Kahdensadan ja 400 mg:n annokset oraalisuspensiota tuottavat keskimääräiset huippupitoisuudet, jotka ovat 3 mcg/ml (vaihteluväli 1-4,5 mcg/ml) ja 4,6 mcg/ml (vaihteluväli 1,9-7,7 mcg/ml), kun testataan normaaleilla aikuisilla vapaaehtoisilla. . Aika-konsentraatiokäyrän alla oleva pinta-ala (AUC) on noin 10–25 % suurempi oraalisuspensiolla kuin tabletilla 100–400 mg:n annosten jälkeen, kun sitä testataan normaaleilla aikuisilla vapaaehtoisilla. Tämä lisääntynyt imeytyminen on otettava huomioon, jos tabletti korvataan oraalisuspensiolla. Bioekvivalenssin puutteen vuoksi tabletteja ei pidä korvata oraalisuspensiolla välikorvatulehduksen hoidossa [ks. ANNOSTELU JA HALLINNOINTI ]. Lapsilla ei ole tehty ristikkäisiä tutkimuksia tablettien ja suspensioiden välillä.
400 mg:n kapseli on bioekvivalentti 400 mg:n tabletin kanssa paasto-olosuhteissa. Ruoka kuitenkin vähentää kapselin annon jälkeen imeytymistä noin 15 % AUC:n perusteella ja 25 % Cmax:n perusteella.
Huippupitoisuudet seerumissa saavutetaan 2–6 tunnin kuluttua yhden 200 mg:n tabletin, yhden 400 mg:n tabletin tai 400 mg:n kefiksiimisuspension oraalisen annon jälkeen. Huippupitoisuudet seerumissa saavutetaan 2–5 tunnin kuluttua 200 mg:n suspension kerta-annoksesta. Huippupitoisuudet seerumissa saavutetaan 3–8 tunnin kuluttua yhden 400 mg:n kapselin oraalisen annon jälkeen.
Jakelu
Sitoutuminen seerumin proteiineihin on pitoisuudesta riippumatonta, ja sitoutunut osuus on noin 65 %. Moniannostutkimuksessa, joka tehtiin tutkimusformulaatiolla, jonka biologinen hyötyosuus on vähemmän kuin tabletti tai suspensio, lääkkeen kertyminen seerumiin tai virtsaan oli vähäistä 14 päivän annostelun jälkeen. Kefiksiimin CSF-tasoista ei ole saatavilla riittäviä tietoja.
Aineenvaihdunta ja erittyminen
Kefiksiimin metaboloitumisesta in vivo ei ole näyttöä. Noin 50 % imeytyneestä annoksesta erittyy muuttumattomana virtsaan 24 tunnissa. Eläinkokeissa havaittiin, että kefiksiimiä erittyy myös sappeen yli 10 % annetusta annoksesta. Kefiksiimin puoliintumisaika seerumissa terveillä koehenkilöillä on riippumaton annosmuodosta ja on keskimäärin 3–4 tuntia, mutta voi vaihdella jopa 9 tuntiin joillakin normaaleilla vapaaehtoisilla.
Erikoispopulaatiot
Geriatria
Keskimääräiset AUC-arvot vakaassa tilassa iäkkäillä potilailla ovat noin 40 % korkeammat kuin muiden terveiden aikuisten keskimääräiset AUC-arvot. Farmakokineettisten parametrien erot 12 nuoren ja 12 iäkkään henkilön välillä, jotka saivat 400 mg kefiksiimiä kerran päivässä 5 päivän ajan, on esitetty seuraavasti:
Nämä lisäykset eivät kuitenkaan olleet kliinisesti merkittäviä [katso ANNOSTELU JA HALLINNOINTI ].
Munuaisten vajaatoiminta
Potilailla, joilla on kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma 20-40 ml/min), kefiksiimin keskimääräinen puoliintumisaika seerumissa pitenee 6,4 tuntiin. Vaikeassa munuaisten vajaatoiminnassa (kreatiniinipuhdistuma 5-20 ml/min) puoliintumisaika piteni keskimäärin 11,5 tuntiin. Lääke ei poistu merkittävästi verestä hemodialyysillä tai peritoneaalidialyysillä. Tutkimus kuitenkin osoitti, että 400 mg:n annoksilla hemodialyysipotilailla on samanlainen veriprofiili kuin henkilöillä, joiden kreatiniinipuhdistuma on 21-60 ml/min.
Mikrobiologia
Toimintamekanismi
Kuten muidenkin kefalosporiinien, kefiksiimin bakterisidinen vaikutus johtuu soluseinän synteesin estämisestä. Kefiksiimi on stabiili tiettyjen beetalaktamaasientsyymien läsnä ollessa. Tämän seurauksena tietyt penisilliineille ja joillekin kefalosporiineille resistentit organismit voivat beetalaktamaasien vuoksi olla herkkiä kefiksiimille.
Resistanssi
Resistenssi kefiksiimille Haemophilus influenzae- ja Neisseria gonorrhoeae -isolaateissa liittyy useimmiten muutoksiin penisilliiniä sitovissa proteiineissa (PBP). Sefiksiimillä saattaa olla rajoitettu vaikutus Enterobacteriaceae-bakteeriin, joka tuottaa laajennetun spektrin beetalaktamaaseja (ESBL). Pseudomonas-lajit, Enterococcus-lajit, D-ryhmän streptokokkien kannat, Listeria monocytogenes, useimmat stafylokokkikannat (mukaan lukien metisilliiniresistentit kannat), useimmat Enterobacter-lajit, useimmat Bacteroides fragilis -kannat ja useimmat fixime C tolostridium -lajit ovat resistenttejä.
Antimikrobinen aktiivisuus
Sefiksiimin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. INDIKAATIOT ].
Gram-positiiviset bakteerit
Streptococcus pneumoniae Streptococcus pyogenes
Gram-negatiiviset bakteerit
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 prosentilla seuraavista bakteereista on in vitro -minimi estävä pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin kefiksiimin herkkä raja-arvo samanlaiseen sukuun tai organismiryhmään kuuluvia isolaatteja vastaan. Kefiksiimin tehoa näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Streptococcus agalactiae
Gram-negatiiviset bakteerit
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia lajit Salmonella lajit Serratia marcescens Shigella lajit
Herkkyystestaus
Tarkempia tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä ja laadunvalvontastandardeista, jotka FDA on tunnustanut tälle lääkkeelle, on osoitteessa https://www.fda.gov/STIC.
Kliiniset tutkimukset
Välikorvantulehduksen kliiniset vertailevat tutkimukset suoritettiin lähes 400 lapsella iältään 6 kuukauden ja 10 vuoden välillä. Streptococcus pneumoniae eristettiin 47 %:lta potilaista, Haemophilus influenzae 34 %:lta, Moraxella catarrhalis 15 %:lta ja S. pyogenes 4 %:lta.
Streptococcus pneumoniaen kokonaisvaste kefiksiimiin oli noin 10 % pienempi ja Haemophilus influenzaen tai Moraxella catarrhaliksen noin 7 % korkeampi (12 %, kun H. influenzaen beetalaktamaasipositiiviset isolaatit ovat mukana) kuin näiden organismien vasteaste aktiiviset kontrollilääkkeet.
Näissä tutkimuksissa potilaat satunnaistettiin ja heitä hoidettiin joko kefiksiimilla annoksilla 4 mg/kg kahdesti vuorokaudessa tai 8 mg/kg kerran vuorokaudessa tai vertailuvalmisteella. 69-70 %:lla potilaista kussakin ryhmässä välikorvantulehduksen merkit ja oireet hävisivät, kun niitä arvioitiin 2-4 viikkoa hoidon jälkeen, mutta jatkuva effuusio havaittiin 15 %:lla potilaista. Kun arvioitiin hoidon lopussa, 17 % potilaista, jotka saivat kefiksiimia, ja 14 % potilaista, jotka saivat tehokkaita vertailulääkkeitä (18 % mukaan lukien potilaat, joilla oli Haemophilus influenzae resistentti vertailulääkkeelle ja jotka saivat kontrolliantibakteerilääkettä) katsottiin hoidon epäonnistumisia. 2–4 viikon seurantaan mennessä yhteensä 30–31 %:lla potilaista oli näyttöä joko hoidon epäonnistumisesta tai taudin uusiutumisesta.
Välikorvatulehduksen bakteriologinen tulos kahdesta neljään viikkoa hoidon jälkeen toistuvan välikorvan perusteella
POTILASTIEDOT
Neuvo potilaita, että antibakteerisia lääkkeitä, mukaan lukien kefiksiimi, tulisi käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun kefiksiimia määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi: (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja joita ei voida hoitaa oraalisuspension kefiksiimilla tai kefiksiimipurutableteilla tai muilla antibakteerisia lääkkeitä tulevaisuudessa.
Neuvo fenyyliketonuriapotilaita, että SUPRAX 200 mg purutabletit sisältävät aspartaamia, fenyylialaniinin lähdettä seuraavasti: Jokainen SUPRAX-purutabletti sisältää 3,3 mg, 5 mg ja 6,7 mg fenyylialaniinia 100 mg:n, 150 mg:n ja 200 mg:n vahvuuksia kohti.
Kerro potilaille, että ripuli on yleinen antibakteeristen lääkkeiden aiheuttama ongelma, joka yleensä päättyy, kun antibakteerinen lääke lopetetaan. Joskus bakteerilääkehoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibakteerisen lääkkeen ottamisen jälkeen. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
