Asacol 400mg Mesalamine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Asacol 400mg on ja miten sitä käytetään?
Asacol on reseptilääke, jota käytetään haavaisen paksusuolitulehduksen oireiden hoitoon. Asacol 400 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Asacol kuuluu lääkeryhmään, jota kutsutaan 5-aminosalisyylihappojohdannaisiksi.
Ei tiedetä, onko Asacol 400 mg turvallinen ja tehokas alle 5-vuotiaille lapsille.
Mitkä ovat Asacol 400mg:n mahdolliset sivuvaikutukset?
Asacol voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- vatsakrampit,
- verinen ripuli,
- kuume,
- päänsärky,
- ihottuma,
- veriset tai tervamaiset ulosteet,
- yskii verta,
- oksennusta, joka näyttää kahvinporolta,
- vähän tai ei ollenkaan virtsaamista,
- kivulias tai vaikea virtsaaminen,
- turvotus jaloissasi tai nilkoissasi,
- väsynyt olo,
- hengenahdistus,
- ruokahalun menetys,
- ylävatsakipu,
- helppo mustelma tai verenvuoto,
- tumma virtsa,
- savenväriset ulosteet ja
- ihon tai silmien keltaisuus (keltatauti)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Asacolin yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- oksentelua,
- vatsakipu,
- ripuli,
- ruoansulatushäiriöt,
- kaasu,
- päänsärky,
- ihottuma ja
- epänormaalit maksan toimintakokeet
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Asacolin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
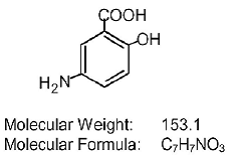
Jokainen Asacol (mesalamiini) viivästyneesti vapauttava tabletti suun kautta annettavaksi sisältää 400 mg mesalamiinia, aminosalisylaattia. Asacol (mesalamiini) viivästyneesti vapautuvat tabletit sisältävät akryylipohjaista hartsia, Eudragit S (metakryylihappokopolymeeri tyyppi B, NF), joka liukenee pH:ssa 7 tai sitä korkeammalla ja vapauttaa mesalamiinia terminaalisessa sykkyräsuolessa ja sen jälkeen paikallista tulehdusta estävää vaikutusta paksusuolessa. . Mesalamiinilla (kutsutaan myös nimellä 5-aminosalisyylihappo tai 5-ASA) on kemiallinen nimi 5-amino-2-hydroksibentsoehappo. Sen rakennekaava on:
Ei-aktiiviset ainesosat: Jokainen tabletti sisältää kolloidista piidioksidia, dibutyyliftalaattia, syötävää mustaa mustetta, rautaoksidin punaista, keltaista rautaoksidia, laktoosimonohydraattia, magnesiumstearaattia, metakryylihappokopolymeeriä B (Eudragit S), polyetyleeniglykolia, povidonia, natriumtärkkelysglykolaattia ja talkkiglykolaattia.
INDIKAATIOT
Lievästi tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoito
Asacol® (mesalamiini) viivästetysti vapautuvat tabletit on tarkoitettu lievästi tai kohtalaisesti aktiivisen haavaisen paksusuolitulehduksen hoitoon 5-vuotiaille ja sitä vanhemmille potilaille.
Haavaisen paksusuolitulehduksen remission ylläpito aikuisilla
Asacol (mesalamiini) viivästetysti vapauttavat tabletit on tarkoitettu haavaisen paksusuolitulehduksen remission ylläpitämiseen aikuisilla. Asacolin turvallisuutta ja tehokkuutta haavaisen paksusuolitulehduksen remission ylläpitämisessä lapsipotilailla ei ole osoitettu.
ANNOSTELU JA HALLINNOINTI
Annostus lievästi tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoitoon
Aikuiset
Aikuisille suositeltu Asacol 400 mg -annos on kaksi 400 mg:n tablettia, jotka otetaan kolme kertaa päivässä ruoan kanssa tai ilman ruokaa (kokonaisvuorokausiannos 2,4 grammaa) 6 viikon ajan [ks. Kliiniset tutkimukset ].
Pediatria
Lapsipotilaille suositeltu Asacol-vuorokausiannos perustuu painoon (enintään 2,4 grammaa/vrk) (katso taulukko 1). Asacol 400 mg tabletit otetaan kahdesti päivässä ruoan kanssa tai ilman ruokaa 6 viikon ajan [ks. Kliiniset tutkimukset ].
Annostus haavaisen paksusuolitulehduksen remission ylläpitämiseen aikuisilla
Aikuisille suositeltu Asacol-annos on 1,6 grammaa päivässä, jaettuna annoksina, ruoan kanssa tai ilman (ks. Kliiniset tutkimukset ].
Tärkeät hallintaohjeet
Niele Asacol-tabletit kokonaisina. Älä leikkaa, riko tai pureskele tabletteja.
Kahden Asacol 400 mg:n tabletin ei ole osoitettu olevan biologisesti samanarvoisia yhden Asacol® HD (mesalamiini) viivästetysti vapauttavan 800 mg:n tabletin kanssa, eikä niitä tule käyttää keskenään.
Testaus ennen Asacol 400 mg:n antamista
Arvioi munuaisten toiminta ennen Asacol-hoidon aloittamista [katso VAROITUKSET JA VAROTOIMET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Asacol (mesalamiini) viivästyneesti vapauttavat tabletit: 400 mg (punaruskea, kapselin muotoinen ja mustalla painettu "0752 DR").
Varastointi ja käsittely
Asacol (mesalamiini) viivästyneesti vapauttavat tabletit ovat saatavilla punaruskeina kapselin muotoisina tabletteina, jotka sisältävät 400 mg mesalamiinia ja joihin on painettu mustalla ”0752 DR”.
NDC 0430-0752-27 Pullo, jossa 180 tablettia
Säilytä 20° - 25° C (68° - 77° F); retket sallittu 15° - 30° C (59° - 86° F) [Katso USP-ohjattu huonelämpötila ].
Valmistaja: Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Saksa. Markkinoija: Warner Chilcott (US), LLC Rockaway, NJ 07866. Tarkistettu: lokakuu 2013
SIVUVAIKUTUKSET
Vakavimmat Asacol-kliinisissä tutkimuksissa tai muilla mesalamiinia sisältävillä tai mesalamiiniksi metaboloituvilla tuotteilla havaitut haittavaikutukset ovat:
- Munuaisten vajaatoiminta, mukaan lukien munuaisten vajaatoiminta [ks VAROITUKSET JA VAROTOIMET ]
- Akuutti intoleranssioireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
- Maksan vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yhteensä Asacol 400 mg tabletteja on arvioitu 2 690 potilaalla, joilla oli haavainen paksusuolitulehdus kontrolloiduissa ja avoimissa tutkimuksissa. Seuraavissa kohdissa esiteltyjä haittavaikutuksia voi esiintyä hoidon pituudesta riippumatta, ja vastaavia reaktioita on raportoitu lyhyt- ja pitkäaikaisissa tutkimuksissa sekä markkinoille tulon jälkeen.
Kliiniset tutkimukset, jotka tukivat Asacol 400 mg:n käyttöä lievästi tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoidossa, sisälsivät kaksi 6 viikon lumekontrolloitua, satunnaistettua kaksoissokkotutkimusta aikuisilla, joilla oli lievä tai kohtalainen haavainen paksusuolitulehdus (tutkimukset 1 ja 2), ja yksi 6 viikon satunnaistettu kaksoissokkotutkimus kahdella annostasolla lapsille, joilla on lievä tai kohtalainen haavainen paksusuolitulehdus. Kliiniset tutkimukset, jotka tukivat Asacol 400 mg tablettien käyttöä haavaisen paksusuolitulehduksen remission ylläpitämisessä, sisälsivät 6 kuukauden, satunnaistetun, kaksoissokkoutetun, lumekontrolloidun, monikeskustutkimuksen ja neljä aktiivikontrolloitua ylläpitotutkimusta, joissa verrattiin Asacol 400 mg tabletteja sulfasalatsiinin kanssa. . Asacol 400 mg on arvioitu näissä kontrolloiduissa tutkimuksissa 427 aikuisella ja 82 lapsella, joilla oli haavainen paksusuolitulehdus.
Lievästi tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoito aikuisilla
Kahdessa 6 viikkoa kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa (tutkimukset 1 ja 2), joihin osallistui 245 potilasta, joista 155 satunnaistettiin saamaan Asacol-hoitoa [ks. Kliiniset tutkimukset ], 3,2 prosenttia Asacolilla hoidetuista potilaista keskeytti hoidon haittavaikutusten vuoksi, kun taas lumelääkettä saaneista potilaista 2,2 prosenttia. Tutkimuksen 1 potilaiden keski-ikä oli 42 vuotta ja 48 prosenttia potilaista oli miehiä. Tutkimuksen 2 potilaiden keski-ikä oli 42 vuotta ja 59 prosenttia potilaista oli miehiä. Asacol-hoidon lopettamiseen johtaneita haittavaikutuksia olivat (jokainen yhdellä potilaalla): ripuli ja paksusuolentulehduksen paheneminen; huimaus, pahoinvointi, nivelkipu ja päänsärky; ihottuma, letargia ja ummetus; suun kuivuminen, huonovointisuus, alaselän epämukavuus, lievä desorientaatio, lievä ruoansulatushäiriöt ja kouristukset; päänsärky, pahoinvointi, särky, oksentelu, lihaskrampit, tukkoinen pää, tukkeutuneet korvat ja kuume.
Haittavaikutukset Asacolilla hoidetuilla potilailla, joiden esiintymistiheys on vähintään 2 prosenttia ja suurempi kuin lumelääke kuuden viikon kaksoissokkoutetuissa, lumekontrolloiduissa tutkimuksissa (tutkimukset 1 ja 2), on lueteltu alla olevassa taulukossa 2.
Lievän tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoito 5–17-vuotiailla lapsipotilailla
Satunnaistettu, kaksoissokkoutettu, 6 viikkoa kestänyt tutkimus kahdella Asacol-annoksella (tutkimus 3) suoritettiin 82:lla 5–17-vuotiaalla lapsipotilaalla, joilla oli lievä tai kohtalainen haavainen paksusuolitulehdus. Kaikki potilaat jaettiin painoluokittain (17 - alle 33 kg, 33 - alle 54 kg ja 54 - 90 kg) ja jaettiin satunnaisesti saamaan pieni annos (1,2, 2,0 ja 2,4 g/vrk). painoluokka) tai suuri annos (2,0, 3,6 ja 4,8 g/vrk).
Suuri annos ei ole hyväksytty annos, koska sen ei havaittu olevan tehokkaampi kuin hyväksytty annos [katso ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
Mesalamiinille altistumisen kesto tutkimukseen osallistuneiden 82 potilaan joukossa oli 12–50 päivää (keskiarvo 40 päivää kussakin annosryhmässä). Suurin osa (88 prosenttia) kunkin ryhmän potilaista sai hoitoa yli 5 viikkoa. Taulukossa 3 on yhteenveto erityisistä raportoiduista haittavaikutuksista (AR).
Vakavia haittavaikutuksia esiintyi 12 prosentilla pienen annoksen ryhmän potilaista ja 5 prosentilla suuren annoksen ryhmän potilaista. Haavainen paksusuolitulehdus raportoitiin vakavana AR:na yhdessä koehenkilössä kussakin ryhmässä. Muita vakavia haittavaikutuksia olivat poskiontelotulehdus, vatsakipu, alentunut painoindeksi, adenovirusinfektio, verinen ripuli, sklerosoiva kolangiitti ja haimatulehdus yhdellä koehenkilöllä pienen annoksen ryhmässä sekä anemia ja pyörtyminen yhdellä koehenkilöllä suuren annoksen ryhmässä.
Seitsemän potilasta poistettiin tutkimuksesta haitallisten haittavaikutusten vuoksi: 5 (12 prosenttia) pienen annoksen ryhmässä (haavainen paksusuolitulehdus, adenovirusinfektio, sklerosoiva kolangiitti, haimatulehdus) ja 2 (5 prosenttia) suuren annoksen ryhmässä (lisääntynyt amylaasi ja lisääntynyt lipaasi) , ylävatsakipu).
Yleisesti ottaen reaktioiden luonne ja vakavuus lapsiväestössä oli samankaltainen kuin haavaista paksusuolitulehdusta sairastavien aikuispopulaatioiden kohdalla.
Haavaisen paksusuolitulehduksen remission ylläpito aikuisilla
Kuusi kuukautta kestäneessä lumekontrolloidussa ylläpitotutkimuksessa, johon osallistui 264 potilasta (tutkimus 4), joista 177 satunnaistettiin Asacoliin, kuusi (3,4 prosenttia) Asacolia käyttävistä potilaista keskeytti hoidon haittavaikutusten vuoksi, kun taas neljä (4,6 prosenttia) lumelääkettä käyttävistä potilaista [ks Kliiniset tutkimukset ]. Tutkimuksen 4 potilaiden keski-ikä oli 42 vuotta ja 55 prosenttia potilaista oli miehiä. Asacolia käyttävillä potilailla tutkimuksen keskeyttämiseen johtaneita haittavaikutuksia olivat (jokainen yhdellä potilaalla): ahdistuneisuus; päänsärky; kutina; vähentynyt libido; nivelreuma; ja stomatiitti ja astenia.
Taulukossa 2 lueteltujen reaktioiden lisäksi seuraavia haittavaikutuksia esiintyi potilailla, jotka käyttivät Asacolia vähintään 2 prosentin esiintymistiheydellä tutkimuksessa 4: vatsan suureneminen, gastroenteriitti, maha-suolikanavan verenvuoto, infektio, nivelsairaus, migreeni, hermostuneisuus, parestesia, peräsuolen häiriö, peräsuolen verenvuoto, ulosteen poikkeavuudet, tenesmus, virtsaamistiheys, verisuonten laajentuminen ja näköhäiriöt.
342 potilaalla kontrolloimattomissa kliinisissä tutkimuksissa seuraavia haittavaikutuksia esiintyi vähintään 5 prosentin taajuudella ja näytti yleistyvän annoksen kasvaessa: voimattomuus, kuume, flunssaoireyhtymä, kipu, vatsakipu, selkäkipu, ilmavaivat, maha-suolikanavan verenvuoto , nivelkipu ja nuha.
Markkinoinnin jälkeinen kokemus
Edellä Asacolia koskevissa kliinisissä tutkimuksissa raportoitujen haittavaikutusten lisäksi alla luetellut haittavaikutukset on tunnistettu Asacol 400 mg:n ja muiden mesalamiinia sisältävien tuotteiden käytön jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keho kokonaisuutena: Niskakipu, kasvojen turvotus, turvotus, lupus-tyyppinen oireyhtymä, huumekuume.
Sydän: Perikardiitti, sydänlihastulehdus [katso VAROITUKSET JA VAROTOIMET ].
Ruoansulatuskanava: Anoreksia, haimatulehdus, gastriitti, lisääntynyt ruokahalu, kolekystiitti, suun kuivuminen, suun haavaumat, rei'itetty peptinen haava verinen ripuli.
Hematologinen: Agranulosytoosi aplastinen anemia, trombosytopenia, eosinofilia, leukopenia, anemia, lymfadenopatia.
Tuki- ja liikuntaelimistö: Kihti.
Hermostunut: Masennus, uneliaisuus, emotionaalinen labilisuus, hyperestesia, huimaus, sekavuus, vapina, perifeerinen neuropatia, transversaalinen myeliitti, Guillain-Barrén oireyhtymä.
Munuaiset: Munuaisten vajaatoiminta, interstitiaalinen nefriitti, minimaalisen muutoksen nefropatia [katso VAROITUKSET JA VAROTOIMET ].
Hengityselimet/keuhkot: Eosinofiilinen keuhkokuume, interstitiaalinen pneumoniitti, astman paheneminen, pleuriitti.
Iho: Hiustenlähtö, psoriasis, pyoderma gangrenosus, kuiva iho, erythema nodosum, urtikaria.
Erityiset aistit: Silmäkipu, makuaistin vääristyminen, näön hämärtyminen, tinnitus.
Urogenitaaliset: Dysuria, virtsaamistarve, hematuria, lisäkivestulehdus, menorragia, palautuva oligospermia.
Laboratoriohäiriöt: Kohonnut AST (SGOT) tai ALT (SGPT), kohonnut alkalinen fosfataasi, kohonnut GGT, kohonnut LDH, kohonnut bilirubiini, kohonnut seerumin kreatiniini ja BUN.

HUUMEIDEN VUOROVAIKUTUKSET
Asacol 400 mg:lla ei ole tehty virallisia yhteisvaikutustutkimuksia muiden lääkkeiden kanssa. Seuraavia yhteisvaikutuksia mesalamiinia sisältävien tuotteiden ja muiden lääkkeiden välillä on kuitenkin raportoitu.
Nefrotoksiset aineet, mukaan lukien ei-steroidiset tulehduskipulääkkeet
Mesalamiinin samanaikainen käyttö tunnettujen munuaistoksisten aineiden kanssa, mukaan lukien ei-steroidiset tulehduskipulääkkeet (NSAID), voi lisätä munuaisreaktioiden riskiä (ks. VAROITUKSET JA VAROTOIMET ].
Atsatiopriini tai 6-merkaptopuriini
Mesalamiinin samanaikainen käyttö atsatiopriinin tai 6-merkaptopuriinin kanssa voi lisätä verisairauksien riskiä.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa, mukaan lukien minimaalinen muutosnefropatia, akuutti ja krooninen interstitiaalinen nefriitti ja munuaisten vajaatoiminta, on raportoitu potilailla, jotka käyttävät tuotteita, kuten Asacol 400 mg, jotka sisältävät mesalamiinia tai muuttuvat mesalamiiniksi.
On suositeltavaa, että potilaiden munuaisten toiminta arvioidaan ennen Asacol 400 mg -hoidon aloittamista ja määräajoin hoidon aikana.
Lääkkeen määrääjien tulee arvioida huolellisesti riskit ja hyödyt käytettäessä Asacolia potilailla, joilla on tiedossa oleva munuaisten vajaatoiminta tai joilla on aiemmin ollut munuaissairaus [ks. HUUMEIDEN VUOROVAIKUTUKSET ja Ei-kliininen toksikologia ].
Mesalamiinin aiheuttama akuutti intoleranssioireyhtymä
Mesalamiini on yhdistetty akuuttiin intoleranssioireyhtymään, jota voi olla vaikea erottaa haavaisen paksusuolitulehduksen pahenemisesta. Vaikka tarkkaa esiintymistiheyttä ei ole määritetty, sitä on esiintynyt 3 prosentissa mesalamiinin tai sulfasalatsiinin kontrolloiduista kliinisistä tutkimuksista. Oireita ovat kouristukset, vatsakipu, verinen ripuli ja joskus kuume, päänsärky ja ihottuma. Seuraa potilaita tarkasti näiden oireiden pahenemisen varalta hoidon aikana. Jos epäillään akuuttia intoleranssioireyhtymää, lopeta Asacol-hoito välittömästi.
Yliherkkyysreaktiot
Joillakin potilailla, jotka ovat kokeneet yliherkkyysreaktion sulfasalatsiinille, voi olla samanlainen reaktio Asacol 400 mg:n tai muiden yhdisteiden kanssa, jotka sisältävät tai muuttuvat mesalamiiniksi.
Mesalamiinin aiheuttamia sydämen yliherkkyysreaktioita (sydänlihastulehdus ja perikardiitti) on raportoitu Asacolin ja muiden mesalamiinilääkkeiden käytön yhteydessä. Varovaisuutta on noudatettava määrättäessä tätä lääkettä potilaille, joilla on sairaus, joka altistaa sydänlihastulehduksen tai perikardiitin kehittymiselle.
Maksan vajaatoiminta
Maksan vajaatoimintaa on raportoitu potilailla, joilla on aiempi maksasairaus ja jotka ovat saaneet mesalamiinia. Varovaisuutta tulee noudattaa annettaessa Asacolia potilaille, joilla on maksasairaus.
Pitkittynyt mahalaukun retentio potilailla, joilla on maha-suolikanavan ylätukos
Orgaaninen tai toiminnallinen tukkeuma ylemmän maha-suolikanavan alueella voi aiheuttaa Asacol 400 mg:n pitkittyneen retention mahalaukussa, mikä hidastaisi mesalamiinin vapautumista paksusuolessa.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Mesalamiini ei ollut syöpää aiheuttava ravinnon annoksilla 480 mg/kg/vrk rotilla ja 2000 mg/kg/vrk hiirillä, jotka ovat noin 2,9 ja 6,1 kertaa Asacol 400 mg:n suurin suositeltu ylläpitoannos 1,6 g/vrk tai 26,7 kertaa. mg/kg/vrk laskettuna 60 kg ruumiinpainosta, vastaavasti kehon pinta-alan perusteella.
Mutageneesi
Mesalamiini oli negatiivinen Ames-määrityksessä mutageneesin suhteen, negatiivinen sisarkromatidivaihdon (SCE) ja kromosomipoikkeavuuksien induktiolle kiinanhamsterin munasarjasoluissa in vitro ja negatiivinen mikrotumien (MN) induktiolle hiiren luuytimen polykromaattisissa erytrosyyteissä.
Hedelmällisyyden heikkeneminen
Mesalamiinilla ei todettu olevan vaikutusta uros- ja naarasrottien hedelmällisyyteen tai lisääntymiskykyyn 480 mg/kg/vrk (noin 1,9 kertaa ihmisen suositeltu hoitoannos kehon pinta-alan perusteella laskettuna) suun kautta annetuilla annoksilla.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
Riskien yhteenveto
Asacol 400 mg:n käytöstä raskaana oleville naisille ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. Rajoitetut julkaistut ihmisillä tehdyt mesalamiinitiedot eivät osoita synnynnäisten epämuodostumien yleisen lisääntymistä. Jotkut tiedot osoittavat lisääntyneen ennenaikaisen synnytyksen, kuolleena syntymisen ja alhaisen syntymäpainon; nämä haitalliset raskauden tulokset liittyvät kuitenkin myös aktiiviseen tulehdukselliseen suolistosairauteen. Lisäksi kaikissa raskauksissa, riippumatta lääkkeiden altistumisesta, taustalla on 2–4 prosenttia suuria epämuodostumia ja 15–20 prosenttia raskauden katkeamista. Sikiövaurioita ei havaittu eläimillä tehdyissä lisääntymistutkimuksissa mesalamiinilla rotilla ja kaniineilla suun kautta annetuilla annoksilla, jotka olivat noin 1,9-kertaisia (rotta) ja 3,9-kertaisia (kaniini) ihmisille suositeltuihin annoksiin verrattuna. Dibutyyliftalaatti (DBP) on kuitenkin Asacolin enteropäällysteen inaktiivinen ainesosa, ja rotilla tehdyissä eläintutkimuksissa annoksilla, jotka ylittivät 190 kertaa ihmisen annoksen kehon pinta-alan perusteella, äidin DBP liittyi ulkoisiin ja luuston epämuodostumisiin ja haitallisiin vaikutuksiin. miehen lisääntymisjärjestelmä. Asacol 400 mg -valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Ihmistiedot
Mesalamiini läpäisee istukan. Prospektiivisissa ja retrospektiivisissä tutkimuksissa yli 600 raskauden aikana mesalamiinille altistuneessa naisessa havaittu synnynnäisten epämuodostumien määrä ei noussut taustatasoa korkeammaksi yleisväestössä. Jotkut tiedot osoittavat lisääntyneen ennenaikaisen synnytyksen, kuolleena syntymisen ja alhaisen syntymäpainon, mutta on epäselvää, johtuiko tämä äidin taustalla olevasta sairaudesta, lääkealtistumisesta vai molemmista, koska aktiivinen tulehduksellinen suolistosairaus liittyy myös haitallisiin raskauden tuloksiin.
Eläinten tiedot
Lisääntymistutkimuksia mesalamiinilla suoritettiin organogeneesin aikana rotilla ja kaniineilla oraalisilla annoksilla 480 mg/kg/vrk asti. Ei ollut näyttöä heikentyneestä hedelmällisyydestä tai haitasta sikiölle. Nämä mesalamiiniannokset olivat noin 1,9 kertaa (rotta) ja 3,9 kertaa (kani) suositeltuja ihmisannoksia kehon pinta-alan perusteella.
Dibutyyliftalaatti (DBP) on Asacolin enteropäällysteen inaktiivinen ainesosa. Ihmisen päivittäinen DBP:n saanti suositellusta Asacol-tablettien enimmäisannoksesta on noin 21 mg. Rotilla julkaistut raportit osoittavat, että urosrottien jälkeläisillä, jotka altistettiin kohdussa DBP:lle (suurempi tai yhtä suuri kuin 100 mg/kg/vrk, noin 39 kertaa ihmisen annos kehon pinta-alan perusteella), esiintyy lisääntymisjärjestelmän poikkeavuuksia, jotka ovat yhteensopivia androgeeniriippuvaisten häiriöiden kanssa. kehitystä. Tämän löydön kliinistä merkitystä rotilla ei tunneta. Suuremmilla annoksilla (suurempi tai yhtä suuri kuin 500 mg/kg/vrk, noin 194 kertaa ihmisen annos kehon pinta-alan perusteella) lisävaikutuksia, mukaan lukien kryptorkidiismi, hypospadiat, sukupuolielinten surkastuminen tai vanheneminen, kivesvauriot, vähennetään päivittäin. siittiöiden tuotantoa, pysyvää nännien pidättymistä ja vähentynyttä anogenitaalista etäisyyttä havaitaan. Naarasjälkeläiset eivät vaikuta. Raskaana oleville rotille annettuihin suuriin DBP-annoksiin liittyi lisääntynyt kehityshäiriöiden ilmaantuvuus, kuten suulakihalkeama (suurempi tai yhtä suuri kuin 630 mg/kg/vrk, noin 244 kertaa ihmisen annos, kehon pinta-alan perusteella) ja luusto. poikkeavuuksia (suurempi tai yhtä suuri kuin 750 mg/kg/vrk, noin 290 kertaa ihmisen annos kehon pinta-alan perusteella) jälkeläisissä.
Imettävät äidit
Mesalamiinia ja sen N-asetyylimetaboliittia on äidinmaidossa. Julkaistuissa imetystutkimuksissa äidin mesalamiiniannokset eri suun kautta ja peräsuolen kautta annettavista formulaatioista ja tuotteista vaihtelivat välillä 500 mg - 3 g päivässä. Mesalamiinin pitoisuus maidossa vaihteli havaitsemattomasta arvoon 0,11 mg/l. N-asetyyli-5-aminosalisyylihappometaboliitin pitoisuus vaihteli välillä 5-18,1 mg/l. Näiden pitoisuuksien perusteella arvioidut vauvan päivittäiset annokset yksinomaan imetetylle lapselle ovat 0-0,017 mg/kg/vrk mesalamiinia ja 0,75-2,72 mg/kg/vrk N-asetyyli-5-aminosalisyylihappoa.
Dibutyyliftalaatti (DBP), Asacol 400 mg -tablettien enteropäällysteen inaktiivinen ainesosa, ja sen ensisijainen metaboliitti monobutyyliftalaatti (MBP) erittyvät äidinmaitoon. Tämän kliinistä merkitystä ei ole määritetty.
Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä Asacol 400 mg:n tarvetta ja mahdollisia haitallisia vaikutuksia lääkkeestä tai äidin taustalla olevasta tilasta imetettävään lapseen. Noudata varovaisuutta, kun Asacol 400 mg -valmistetta annetaan imettäville naisille.
Käyttö lapsille
Asacol 400 mg:n turvallisuus ja tehokkuus 5–17-vuotiailla lapsipotilailla lievän tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoidossa on osoitettu kuuden viikon aikana. Asacolin käyttöä näissä ikäryhmissä tukevat todisteet riittävistä ja hyvin kontrolloiduista Asacol 400 mg:n tutkimuksista aikuisilla ja yhdestä tutkimuksesta lapsipotilailla [ks. HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ].
Asacol 400 mg tutkittiin satunnaistetussa, kaksoissokkoutetussa rinnakkaisryhmien 6 viikon hoitotutkimuksessa kahdella Asacol 400 mg:n annostasolla 82:lla 5–17-vuotiaalla lapsipotilaalla, joilla oli lievä tai kohtalainen haavainen paksusuolitulehdus. Kaikki potilaat jaettiin painoluokittain (17 - alle 33 kg, 33 - alle 54 kg ja 54 - 90 kg) ja jaettiin satunnaisesti saamaan pieni annos (1,2, 2,0 ja 2,4 g/vrk vastaavan painon mukaan) luokka) tai suuri annos (2,0, 3,6 ja 4,8 g/vrk). Lähtötilanne- ja seulontakäyntejä seurasi 6 viikon hoitojakso [katso ANNOSTELU JA HALLINNOINTI ]. Suuri annos ei ollut tehokkaampi kuin pieni annos, eikä se ole hyväksytty annos [katso Kliiniset tutkimukset ].
Asacolin turvallisuutta ja tehoa alle 5-vuotiailla lapsipotilailla ei ole varmistettu. Asacolin turvallisuutta ja tehokkuutta haavaisen paksusuolitulehduksen remission ylläpitämisessä lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Asacolin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteessa. Yleensä maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyys iäkkäillä potilailla tulee ottaa huomioon määrättäessä Asacol-valmistetta. Kontrolloimattomista kliinisistä tutkimuksista ja markkinoille tulon jälkeisistä raportointijärjestelmistä saadut raportit viittaavat veren dyskrasioiden, eli agranulosytoosin, neutropenian ja pansytopenian, yleisempään Asacol-hoitoa saavilla 65-vuotiailla tai vanhemmilla potilailla. Verisolujen määrää on seurattava tarkasti Asacol-hoidon aikana.
Munuaisten vajaatoiminta
Mesalamiinin tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, tätä lääkehoitoa määrättäessä tulee noudattaa varovaisuutta. On suositeltavaa, että kaikkien potilaiden munuaisten toiminta arvioidaan ennen Asacol-hoidon aloittamista ja määräajoin Asacol-hoidon aikana [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ].
YLIANNOSTUS
Mesalamiinin yliannostukselle ei ole spesifistä vastalääkettä, ja Asacol-hoidon epäillyn akuutin vakavan toksisuuden tulee olla oireenmukaista ja tukevaa. Tämä voi sisältää ruoansulatuskanavan imeytymisen ehkäisemisen, nesteen elektrolyyttitasapainon korjaamisen ja riittävän munuaistoiminnan ylläpitämisen. Asacol 400mg on pH-riippuvainen viivästetysti vapautuva tuote, ja tämä tekijä tulee ottaa huomioon hoidettaessa epäiltyä yliannostusta.
VASTA-AIHEET
Asacol on vasta-aiheinen potilailla, jotka ovat yliherkkiä salisylaateille tai aminosalisylaateille tai jollekin Asacol-valmisteen aineosalle [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET , ja KUVAUS ].
ASACOL (mesalamiini) viivästetysti vapauttavat tabletit, suun kautta käytettäväksi
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Mesalamiinin vaikutusmekanismia ei tunneta, mutta se näyttää olevan pikemminkin paikallinen kuin systeeminen. Arakidonihapon metaboliittien limakalvon tuotanto sekä syklo-oksigenaasireittien eli prostanoidien että lipoksigenaasireittien eli leukotrieenien ja hydroksi-ikosatetraeenihappojen kautta lisääntyy kroonista haavaista paksusuolitulehdusta sairastavilla potilailla, ja on mahdollista, että mesalamiini vähentää tulehdusta estävät syklo-oksigenaasin ja estävät prostaglandiinin tuotantoa paksusuolessa.
Farmakokinetiikka
Imeytyminen
Noin 28 prosenttia Asacol 400 mg -tablettien mesalamiinista imeytyy suun kautta ottamisen jälkeen. Mesalamiinin imeytyminen on samanlaista paastonneilla ja syödyillä koehenkilöillä. Mesalamiinin ja sen metaboliitin T max on yleensä viivästynyt, mikä kuvastaa viivästynyttä vapautumista, ja vaihtelee 4–16 tunnin välillä.
Aineenvaihdunta
Imeytynyt mesalamiini asetyloituu nopeasti suolen limakalvon seinämässä ja maksassa N-asetyyli-5-aminosalisyylihapoksi.
Erittyminen
Imeytynyt mesalamiini erittyy pääasiassa munuaisten kautta N-asetyyli-5-aminosalisyylihappona. Imeytymätön mesalamiini erittyy ulosteeseen.
Suonensisäisen annon jälkeen mesalamiinin eliminaation puoliintumisajan on raportoitu olevan noin 40 minuuttia. Oraalisen annostelun jälkeen mesalamiinin ja N-asetyyli-5-aminosalisyylihapon terminaaliset t½-arvot ovat yleensä noin 12 tuntia, mutta ne vaihtelevat 2-15 tunnin välillä. Mesalamiinin ja N-asetyyli-5-aminosalisyylihapon plasmapitoisuuksissa ja niiden eliminaation puoliintumisajoissa Asacol-valmisteen annon jälkeen esiintyy suurta yksilöiden ja yksilöiden välistä vaihtelua.
Tietyt populaatiot
Pediatriset potilaat
Annosvaihteluissa PK-tutkimuksessa, jossa arvioitiin 30, 60 ja 90 mg/kg/vrk Asacol-annoksia 400 mg kahdesti vuorokaudessa neljän viikon ajan, mesalamiinin keskimääräiset Cavg-arvot lapsilla, joilla oli haavainen paksusuolitulehdus, vaihtelivat noin 400 ng/ml - 2100 ng. /mL kaikkien annostasojen tietojen perusteella.
Lapsilla tehdyssä haavaista paksusuolitulehdusta sairastavilla potilailla tehdyssä tutkimuksessa (tutkimus 3) mesalamiinin keskimääräiset plasmapitoisuudet (perustuen harvaan näytteenottoon) olivat 820-988 ng/ml alhaisella annoksella (eli 1,2, 2,0 tai 2,4 g/vrk annoksen perusteella. ruumiinpainot 17 - yli 33 kg, 33 - alle 54 kg ja 54 - alle 90 kg).
Eläinten toksikologia ja/tai farmakologia
Eläinkokeissa (rotat, hiiret, koirat) munuaiset olivat pääasiallinen toksisuuden aiheuttaja. (Seuraavassa eläinten annostuksen vertailut suositeltuihin ihmisannostuksiin perustuvat kehon pinta-alaan ja 2,4 g/vrk annokseen 60 kg painoiselle henkilölle.)
Mesalamiini aiheuttaa munuaisten papillaarinekroosia rotilla kerta-annoksina noin 750 mg/kg - 1000 mg/kg (noin 3-4 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella). Rotille kuuden kuukauden ajan annetut annokset 170 ja 360 mg/kg/vrk (noin 0,7 ja 1,5 kertaa suositeltu annos ihmiselle kehon pinta-alan perusteella) aiheuttivat papillaarisen nekroosin, papillaarisen turvotuksen, tubulusten rappeutumisen, tubulusten mineralisaatiota ja uroteelin liikakasvua.
Hiirillä oraaliset annokset 4000 mg/kg/vrk mesalamiinia (noin 8 kertaa suositeltu annos ihmiselle kehon pinta-alan perusteella) kolmen kuukauden ajan aiheuttivat tubulusnefroosia, multifokaalista/hajoavaa tubulo-interstitiaalista tulehdusta ja multifokaalista/hajautunutta papillaarinekroosia.
Koirilla 6 000 mg:n kerta-annokset (noin 8 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella) viivästyneesti vapauttavia mesalamiinitabletteja aiheuttivat munuaisten papillaarinekroosin, mutta ne eivät olleet kuolemaan johtavia. Munuaismuutoksia on ilmennyt koirilla, joille on annettu jatkuvaa mesalamiinia annoksina 80 mg/kg/vrk (1,1 kertaa ihmiselle suositeltu annos kehon pinta-alan perusteella).
Kliiniset tutkimukset
Lievästi tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoito
Aikuiset
Kaksi lumekontrolloitua tutkimusta (tutkimukset 1 ja 2) ovat osoittaneet Asacol-tablettien tehon potilailla, joilla on lievä tai kohtalainen haavainen paksusuolitulehdus.
Yhdessä satunnaistetussa kaksoissokkoutetussa monikeskustutkimuksessa, johon osallistui 158 potilasta (tutkimus 1), Asacol-annoksia 1,6 g/vrk ja 2,4 g/vrk 6 viikon ajan verrattiin lumelääkkeeseen. Pisteytysjärjestelmään hoidon tehokkuuden määrittämiseksi sisältyi ulosteiden tiheyden, peräsuolen verenvuodon, sigmoidoskooppisten löydösten, potilaan toiminnan arvioinnin ja lääkärin kokonaisarvioinnin arvioinnin. Annoksella 2,4 g/vrk 21 potilaalla 43:sta (49 prosenttia) Asacol-tabletteja käyttävästä potilaasta paransi suolen sigmoidoskooppista ulkonäköä verrattuna 12:een 44:stä (27 prosenttia) lumelääkettä saaneesta potilaasta (p = 0,048). Lisäksi huomattavasti useammilla potilailla Asacol-tabletteja 2,4 g/vrk saaneessa ryhmässä peräsuolen verenvuoto ja ulosteiden tiheys paranivat. Annos 1,6 g/vrk ei tuottanut johdonmukaisia todisteita tehokkuudesta.
Toisessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa, joka kesti 6 viikkoa 87 potilaalla (tutkimus 2), Asacol-tabletit annoksella 4,8 g/vrk 6 viikon ajan johtivat sigmoidoskooppiseen paranemiseen 28 potilaalla 38:sta. (74 prosenttia) verrattuna lumelääkepotilaan 10:een 38:sta (26 prosenttia) (p alle 0,001). Lisäksi useammilla potilailla Asacol 400 mg tabletteja 4,8 g/vrk saaneessa ryhmässä kuin lumeryhmässä yleisoireet paranivat.
Annos 4,8 g/vrk ei ole hyväksytty annos lievän tai kohtalaisen aktiivisen haavaisen paksusuolitulehduksen hoitoon.
Pediatria
Asacol 400 mg:n turvallisuutta ja tehokkuutta 5–17-vuotiailla lapsipotilailla lievästi tai kohtalaisesti aktiivisen haavaisen paksusuolitulehduksen hoidossa tukevat riittävät ja hyvin kontrolloidut Asacol 400 mg:n tutkimukset aikuisilla ja yksi lapsipotilailla tehty tutkimus.
Satunnaistettu, kaksoissokkoutettu, 6 viikkoa kestänyt tutkimus kahdella Asacol-annoksella (tutkimus 3) suoritettiin 82:lla 5–17-vuotiaalla lapsipotilaalla, joilla oli lievä tai kohtalainen haavainen paksusuolitulehdus. Kaikki potilaat jaettiin painoluokittain (17 - alle 33 kg, 33 - alle 54 kg ja 54 - 90 kg) ja jaettiin satunnaisesti saamaan pieni annos (1,2, 2,0 ja 2,4 g/vrk vastaavan painon mukaan) luokka) tai suuri annos (2,0, 3,6 ja 4,8 g/vrk). Annokset annettiin 12 tunnin välein.
Niiden potilaiden osuus, jotka saavuttivat menestystä typistetyn Mayo-pisteen (TM-Mayo) perusteella (perustuu Mayo-pisteen ulostetiheyden ja peräsuolen verenvuodon alapisteisiin) ja lasten haavaisen paksusuolitulehduksen aktiivisuusindeksin (PUCAI) perusteella (johon sisältyi mm. vatsakipu, peräsuolen verenvuoto, ulosteen konsistenssi ja tiheys, yöllinen ulostaminen ja aktiivisuus) mitattiin 6 viikon hoidon jälkeen. TM-Mayoon perustuva menestys määriteltiin joko osittaiseksi vasteeksi (parantuminen lähtötasosta ulosteiden tiheydessä tai peräsuolen verenvuodon alapisteissä ilman pahenemista toisessa) tai täydelliseksi vasteeksi (sekä ulosteen tiheyden että peräsuolen verenvuodon alapisteet ovat 0). PUCAI:hen perustuva menestys määriteltiin joko osittaiseksi vasteeksi (PUCAI:n lasku vähintään 20 pistettä lähtötasosta viikolle 6 ja viikon 6 pisteet suurempi tai yhtä suuri kuin 10) tai täydelliseksi vasteeksi (PUCAI alle 10 viikolla 6).
Pienen annoksen ryhmässä oli 41 potilasta ja suuren annoksen ryhmässä 41 potilasta, jotka saivat vähintään yhden annoksen Asacolia; 36 potilasta kustakin annosryhmästä suoritti tutkimuksen. Potilaat katsottiin hoidon epäonnistuneiksi, jos he eivät saavuttaneet menestystä tai keskeyttivät hoidon haittavaikutuksen tai tehon puutteen vuoksi.
Viikolla 6 73,2 prosenttia pienen annoksen ryhmän potilaista ja 70,0 prosenttia suuren annoksen ryhmän potilaista onnistui TM-Mayon perusteella; 34,1 prosenttia potilaista pienen annoksen ryhmässä ja 42,5 prosenttia potilaista suuren annoksen ryhmässä saavutti täydellisen vasteen. Viikolla 6 56,1 prosenttia potilaista pienen annoksen ryhmässä ja 55,0 prosenttia potilaista suuren annoksen ryhmässä onnistui PUCAI:n perusteella; 46,3 prosenttia potilaista pienen annoksen ryhmässä ja 42,5 prosenttia potilaista suuren annoksen ryhmässä saavutti täydellisen vasteen.
Suuri annos ei ollut tehokkaampi kuin pieni annos, eikä se ole hyväksytty annos [katso ANNOSTELU JA HALLINNOINTI ].
Haavaisen paksusuolitulehduksen remission ylläpito aikuisilla
Kuuden kuukauden satunnaistetussa kaksoissokkoutetussa, lumekontrolloidussa, monikeskustutkimuksessa (tutkimus 4) oli mukana 264 potilasta, joita hoidettiin Asacol 400 mg tableteilla 0,8 g/vrk (n = 90), 1,6 g/vrk (n = 87). tai lumelääkettä (n = 87). 0,8 g/vrk ryhmässä potilaille annettiin annos kahdesti päivässä; 1,6 g/vrk ryhmässä potilaita annettiin neljä kertaa päivässä. Niiden potilaiden osuus, joita hoidettiin annoksella 0,8 g/vrk ja jotka säilyttivät endoskooppisen remission, ei ollut tilastollisesti merkitsevä plaseboon verrattuna. Niiden potilaiden osuus, jotka käyttivät 1,6 g/vrk Asacol-tabletteja, joilla haavaisen paksusuolitulehduksen endoskooppinen remissio säilyi, oli 61:llä 87:stä (70,1 prosenttia) verrattuna 42:een 87:stä (48,3 prosenttia) lumelääkepotilaista (p = 0,005).
Neljän ylläpitotutkimuksen yhdistetyssä tehokkuusanalyysissä verrattiin Asacol 400 mg tabletteja annoksilla 0,8 g/vrk ja 2,8 g/vrk, jaettuna annoksina kahdesta vuorokaudesta neljään kertaan vuorokaudessa, sulfasalatsiinin kanssa annoksilla 2 g/vrk 4 g/päivä. Hoidon onnistuminen havaittiin 59:llä 98:sta (59 prosenttia) Asacol-tabletteja käyttävästä potilaasta ja 70:llä 102:sta (69 prosenttia) sulfasalatsiinia käyttävistä potilaista, mikä ei ole merkittävä ero.
POTILASTIEDOT
- Neuvo potilaita nielemään Asacol-tabletit kokonaisina varoen rikkomasta, leikkaamasta tai pureskelemasta tabletteja, koska päällyste on tärkeä osa viivästetysti vapauttavaa formulaatiota.
- Kerro potilaille, että jos he ovat siirtymässä aiemmasta oraalisesta mesalamiinihoidosta Asacoliin, heidän tulee keskeyttää aiempi oraalinen mesalamiinihoitonsa ja noudattaa Asacol-annostusohjeita. Kerro potilaille, että he eivät saa korvata kahta Asacol 400 mg tablettia yhdellä Asacol 400 mg HD 800 mg tabletilla [ks. ANNOSTELU JA HALLINNOINTI ].
- Kerro potilaille, että ulosteessa on raportoitu ehjiä, osittain ehjiä ja/tai tabletin kuoria. Neuvo potilaita ottamaan yhteyttä lääkäriin, jos tämä toistuu.
- Neuvo potilaita suojaamaan Asacol 400 mg tabletteja kosteudelta. Neuvo potilaita sulkemaan säiliö tiukasti ja jättämään kaikki kuivausainepussit pulloon tablettien mukana.
- Kertokaa raskaana oleville, imettäville tai hedelmällisessä iässä oleville naisille, että Asacol 400mg sisältää dibutyyliftalaattia, joka on yhdistetty epämuodostumiin ja haitallisiin vaikutuksiin miesten lisääntymisjärjestelmään eläinkokeissa. Dibutyyliftalaatti erittyy äidinmaitoon.
