Ceftin 250mg, 500mg, 125mg Cefuroxime Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Ceftin 500mg on ja miten sitä käytetään?
Ceftin 500mg on reseptilääke, jota käytetään bakteeri-infektioiden oireiden hoitoon. Ceftiniä voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Ceftin 250mg on kefalosporiiniantibiootti.
Ei tiedetä, onko Ceftin turvallinen ja tehokas alle 3 kuukauden ikäisille lapsille.
Mitkä ovat Ceftinin mahdolliset sivuvaikutukset?
Ceftin 250 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- ripuli (veren kanssa tai ilman),
- ihon tai silmien keltaisuus,
- ihottuma,
- mustelmat,
- vaikea pistely tai puutuminen,
- kohtaukset (kouristukset),
- vaikea tai kivulias virtsaaminen,
- turvotus jaloissa, nilkoissa, kasvoissa tai kielessä,
- väsymys,
- hengenahdistus,
- kuume,
- kipeä kurkku,
- polttaa silmissäsi,
- ihokipu, johon liittyy punainen tai violetti ihottuma,
- ihon rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Ceftinin yleisimpiä sivuvaikutuksia ovat:
- ripuli,
- pahoinvointi,
- oksentelua,
- epätavallinen tai epämiellyttävä maku suussa,
- vaippaihottuma lapsella,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Ceftinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
CEFTIN 500 mg tabletit ja CEFTIN oraalisuspensiota varten sisältävät kefuroksiimia kefuroksiimiaksetiilina. CEFTIN on puolisynteettinen, kefalosporiinien antibakteerinen lääke, joka on tarkoitettu annettavaksi suun kautta.
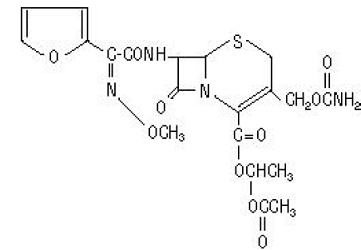
Kefuroksiimiaksetiilin (kefuroksiimin 1-(asetyylioksi)etyyliesteri) kemiallinen nimi on (RS)-1-hydroksietyyli (6R,7R)-7-[2-(2-furyyli)glyoksyyliamido]-3-(hydroksimetyyli) )-8-okso-5-tia-1-atsabisyklo[4.2.0]okt-2-eeni-2-karboksylaatti, 72-(Z)-(O-metyylioksiimi), 1-asetaatti-3-karbamaatti. Sen molekyylikaava on C20H22N4O10S ja sen molekyylipaino on 510,48.
Kefuroksiimiaksetiili on amorfisessa muodossa ja sillä on seuraava rakennekaava:
Tabletit ovat kalvopäällysteisiä ja sisältävät 250 tai 500 mg kefuroksiimia kefuroksiimiaksetiilinä. Tabletit sisältävät inaktiivisia aineosia kolloidista piidioksidia, kroskarmelloosinatriumia, hydrattua kasviöljyä, hypromelloosia, metyyliparabeenia, mikrokiteistä selluloosaa, propyleeniglykolia, propyyliparabeenia, natriumbentsoaattia, natriumlauryylisulfaattia ja titaanidioksidia.
Oraalisuspensio, kun se liuotetaan veteen, vastaa 125 mg tai 250 mg kefuroksiimia (kefuroksiimiaksetiilinä) 5 ml:ssa. Oraalisuspensio sisältää inaktiivisia aineosia asesulfaamikaliumia, aspartaamia, povidoni K30:tä, steariinihappoa, sakkaroosia, tutti-frutti-aromia ja ksantaanikumia.
INDIKAATIOT
Nielutulehdus/tonsilliitti
CEFTIN 125 mg tabletit on tarkoitettu aikuispotilaille ja lapsipotilaille (13-vuotiaat ja sitä vanhemmat), joilla on lievä tai keskivaikea nielutulehdus/tonsilliitti, jonka aiheuttavat Streptococcus pyogenes -herkät kannat.
CEFTIN 500 mg oraalisuspensiota varten on tarkoitettu 3 kuukaudesta 12-vuotiaisiin lapsipotilaiden lievän tai keskivaikean nielutulehdus/tonsilliitti hoitoon, jonka ovat aiheuttaneet herkät Streptococcus pyogenes -kannat.
Käyttörajoitukset
- CEFTINin tehoa reumakuumeen ehkäisyssä ei ole osoitettu kliinisissä tutkimuksissa.
- CEFTIN 125 mg:n tehoa penisilliiniresistenttien Streptococcus pyogenes -kantojen hoidossa ei ole osoitettu kliinisissä tutkimuksissa.
Akuutti bakteeriperäinen välikorvatulehdus
CEFTIN 125 mg tabletit on tarkoitettu lapsipotilaiden (jotka voivat niellä tabletit kokonaisina) hoitoon, joilla on akuutti bakteeriperäinen välikorvatulehdus, jonka aiheuttavat Streptococcus pneumoniae, Haemophilus influenzae (mukaan lukien β-laktamaasia tuottavat kannat), Moraxella lactamase (mukaan lukien catarhalissase) -tuottavat kannat) tai Streptococcus pyogenes.
CEFTIN oraalisuspensiota varten on tarkoitettu 3 kuukaudesta 12-vuotiaisiin lapsipotilaiden hoitoon, joilla on akuutti bakteeriperäinen välikorvatulehdus, jonka aiheuttavat Streptococcus pneumoniae-, Haemophilus influenzae- (mukaan lukien β-laktamaasia tuottavat kannat), Moraxella-katarraalinen (mukaan lukien katarraalinen) -kanta. -tuottavat kannat) tai Streptococcus pyogenes.
Akuutti bakteeriperäinen poskiontelotulehdus
CEFTIN-tabletit on tarkoitettu aikuis- ja lapsipotilaille (vähintään 13-vuotiaille), joilla on lievä tai keskivaikea akuutti bakteeriperäinen poskiontelotulehdus, jonka aiheuttavat herkät Streptococcus pneumoniae- tai Haemophilus influenzae -kannat (vain β-laktamaasia tuottamattomat kannat).
CEFTIN 250 mg oraalisuspensiota varten on tarkoitettu 3 kuukauden - 12-vuotiaiden lapsipotilaiden hoitoon, joilla on lievä tai keskivaikea akuutti bakteeriperäinen poskiontelotulehdus, jonka aiheuttavat Streptococcus pneumoniae- tai Haemophilus influenzae-herkät kannat (ainoastaan ei-beeta-laktamaasia tuottava stratamaasia). .
Käyttörajoitukset
CEFTINin tehoa β-laktamaasia tuottavan Haemophilus influenzaen tai Moraxella catarrhaliksen aiheuttamiin poskiontelotulehduksiin potilailla, joilla on akuutti bakteeriperäinen poskiontelotulehdus, ei ole osoitettu, koska näitä isolaatteja ei ollut riittävästi kliinisissä tutkimuksissa [ks. Kliiniset tutkimukset ].
Kroonisen keuhkoputkentulehduksen akuutit bakteerien pahenemisvaiheet
CEFTIN-tabletit on tarkoitettu aikuispotilaille ja lapsipotilaille (13-vuotiaat ja sitä vanhemmat), joilla on lieviä tai keskivaikeita akuutteja kroonisen keuhkoputkentulehduksen pahenemisvaiheita, jotka aiheutuvat Streptococcus pneumoniae-, Haemophilus influenzae- (β-laktamaasinegatiiviset kannat) herkästi. tai Haemophilus para influenzae (β-laktamaasinegatiiviset kannat).
Komplisoitumattomat iho- ja ihorakenteen infektiot
CEFTIN 250 mg tabletit on tarkoitettu aikuispotilaille ja lapsipotilaille (13-vuotiaat ja sitä vanhemmat), joilla on komplisoitumattomia iho- ja ihorakenteen infektioita, jotka ovat aiheuttaneet herkät Staphylococcus aureus -kannat (mukaan lukien β-laktamaasia tuottavat kannat) tai Streptococcus pyogenes.
Komplisoitumattomat virtsatieinfektiot
CEFTIN 500 mg tabletit on tarkoitettu aikuispotilaille ja lapsipotilaille (13-vuotiaat ja sitä vanhemmat), joilla on komplisoitumattomia virtsatieinfektioita, jotka ovat aiheuttaneet herkät Escherichia coli- tai Klebsiella pneumoniae -kannat.
Komplisoitumaton tippuri
CEFTIN-tabletit on tarkoitettu hoitoon aikuispotilaille ja lapsipotilaille (13-vuotiaat ja sitä vanhemmat), joilla on komplisoitumaton tippuri, virtsaputken ja endoservikaaliset penisillinaasia tuottavat ja ei-penisillinaasia tuottavat herkät Neisseria gonorrhoeae -kannat sekä naaraspuoliset, peräsuolen ja infektoimattomat gonorrhea -kannat. , jonka aiheuttavat penisillinaasia tuottamattomat Neisseria gonorrhoeae -herkät kannat.
Varhainen Lymen tauti (erythema migrans)
CEFTIN-tabletit on tarkoitettu Borrelia burgdorferi -bakteerin herkkien kantojen aiheuttaman varhaisen Lymen taudin (erythema migrans) hoitoon aikuispotilaille ja lapsipotilaille (13-vuotiaat ja sitä vanhemmat).
Impetigo
CEFTIN 250 mg oraalisuspensiota varten on tarkoitettu 3 kuukauden–12-vuotiaiden lapsipotilaiden hoitoon, joilla on Staphylococcus aureus (mukaan lukien Plaktamaasia tuottavat kannat) tai Streptococcus pyogenes -bakteerin herkkien kantojen aiheuttama impetigo.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja CEFTINin ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi CEFTIN 500 mg:aa tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetusti tai vahvasti epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
Tärkeät hallintaohjeet
- CEFTIN-tabletit ja CEFTIN oraalisuspensiota varten eivät ole bioekvivalentteja, eivätkä ne siksi ole korvattavissa milligrammaa per milligrammaa (ks. KLIININEN FARMAKOLOGIA ].
- Anna CEFTIN-tabletteja tai oraalisuspensiota asianmukaisissa annostusohjeissa kuvatulla tavalla [katso Annostus CEFTIN 500 mg tableteille, Annostus CEFTIN 250 mg oraalisuspensiolle ja CEFTIN 125 mg oraalisuspension valmistus ja anto ].
- Anna CEFTIN 500 mg tabletit ruoan kanssa tai ilman.
- Anna CEFTIN 500 mg oraalisuspensiota ruoan kanssa.
- Lapsipotilaat (13-vuotiaat ja sitä vanhemmat), jotka eivät voi niellä CEFTIN 125 mg tabletteja kokonaisina, tulee saada CEFTIN oraalisuspensiota varten, koska tabletilla on vahva, pysyvä katkera maku murskattuna [ks. Annostus CEFTIN-tableteille ].
Annostus CEFTIN 500 mg tableteille
Anna CEFTIN 250 mg tabletit alla olevan annostusohjetaulukon mukaisesti ruoan kanssa tai ilman.
Annostus CEFTINille oraalisuspensiolle
Anna CEFTIN oraalisuspensiota varten alla olevan annostusohjetaulukon mukaisesti ruoan kanssa.
CEFTINin valmistaminen ja anto oraalisuspensiota varten
Valmistele suspensio annostelun yhteydessä seuraavasti:
- Ravista oraalisuspensiota hyvin ennen jokaista käyttöä.
- Kiinnitä korkki tiukasti jokaisen avaamisen jälkeen.
- Säilytä käyttövalmiiksi valmistettu suspensio jääkaapissa 2–8 °C:ssa (36–46 °F).
- Hävitä käyttövalmiiksi valmistettu suspensio 10 päivän kuluttua.
Annostus potilaille, joilla on heikentynyt munuaisten toiminta
Annosteluväliä on muutettava potilailla, joiden kreatiniinipuhdistuma on alle 30 ml/min alla olevan taulukon 4 mukaisesti, koska kefuroksiimi eliminoituu pääasiassa munuaisten kautta [ks. KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
CEFTIN-tabletit ovat valkoisia, kapselin muotoisia, kalvopäällysteisiä tabletteja, joita on saatavana seuraavina vahvuuksina:
- 250 mg kefuroksiimia (kefuroksiimiaksetiilinä), jonka toiselle puolelle on kaiverrettu "GX ES7" ja toiselle puolelle tyhjä.
- 500 mg kefuroksiimia (kefuroksiimiaksetiilinä), jonka toiselle puolelle on kaiverrettu "GX EG2" ja toiselle puolelle tyhjä.
CEFTIN oraalisuspensiota varten toimitetaan kuivana, valkoisena tai luonnonvalkoisena tutti-frutti-makuisena jauheena. Kun suspensio valmistetaan ohjeiden mukaisesti, se vastaa 125 mg tai 250 mg kefuroksiimia (kefuroksiimiaksetiilinä) 5 ml:ssa.
Varastointi ja käsittely
CEFTIN-tabletit, 250 mg kefuroksiimia (kefuroksiimiaksetiilina), ovat valkoisia, kapselin muotoisia, kalvopäällysteisiä tabletteja, joiden toiselle puolelle on kaiverrettu "GX ES7" ja toiselle puolelle tyhjät tabletit seuraavasti: 20 tablettia/pullo NDC 0173-0387-00
CEFTIN-tabletit, 500 mg kefuroksiimia (kefuroksiimiaksetiilina), ovat valkoisia, kapselin muotoisia, kalvopäällysteisiä tabletteja, joissa on kaiverrus "GX EG2" toisella puolella ja tyhjä toisella puolella seuraavasti: 20 tablettia/pullo NDC 0173-0394-00
Säilytä tabletit 15–30 °C:ssa (59–86 °F). Kiinnitä korkki tiukasti jokaisen avaamisen jälkeen.
CEFTIN 500 mg oraalisuspensiota varten toimitetaan kuivana, valkoisena tai luonnonvalkoisena, tutti-fruttimakuisena jauheena. Kun suspensio valmistetaan ohjeiden mukaisesti, se vastaa 125 mg tai 250 mg kefuroksiimia (kefuroksiimiaksetiilinä) 5 ml:ssa. Se toimitetaan ruskeissa lasipulloissa seuraavasti:
125 mg/5 ml
100 ml suspensio NDC 0173-0740-00
250 mg/5 ml
50 ml suspensio NDC 0173-0741-10 100 ml suspensio NDC 0173-0741-00
Säilytä kuivajauhe ennen käyttökuntoon saattamista 2–30 °C (36–86 °F).
Säilytä suspensio välittömästi käyttövalmiiksi saattamisen jälkeen jääkaapissa 2–8 °C:ssa (36–46 °F). HÄITÄ 10 PÄIVÄN JÄLKEEN.
GlaxoSmithKline, Research Triangle Park, NC 27709. Tarkistettu: lokakuu 2017
SIVUVAIKUTUKSET
Seuraavat vakavat ja muutoin tärkeät haittavaikutukset on kuvattu tarkemmin etiketin Varoitukset ja varotoimet -osiossa:
Anafylaktiset reaktiot [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Tabletit
Usean annoksen annostusohjelmat, joiden kesto on 7–10 päivää
Useita annoksia koskevissa kliinisissä tutkimuksissa 912 henkilöä hoidettiin CEFTINillä (125-500 mg kahdesti päivässä). On huomattava, että 125 mg kahdesti päivässä ei ole hyväksytty annos. Kaksikymmentä (2,2 %) koehenkilöä keskeytti lääkityksen haittavaikutusten vuoksi. Seitsemäntoista (85 %) 20:stä hoidon keskeyttäneestä koehenkilöstä teki sen maha-suolikanavan häiriöiden, mukaan lukien ripulin, pahoinvoinnin, oksentelun ja vatsakipujen, vuoksi. Niiden CEFTINillä hoidettujen potilaiden prosenttiosuus, jotka keskeyttivät tutkimuslääkkeen hoidon haittavaikutusten vuoksi, oli samanlainen vuorokausiannoksilla 1 000, 500 ja 250 mg (2,3 %, 2,1 % ja 2,2 %). Ruoansulatuskanavan haittavaikutusten ilmaantuvuus kuitenkin lisääntyi suositeltujen suurempien annosten myötä.
Haittavaikutukset taulukossa 5 koskevat koehenkilöitä (n = 912), joita hoidettiin CEFTINillä 250 mg useissa kliinisissä tutkimuksissa.
Seuraavia haittavaikutuksia esiintyi alle 1 %:lla mutta yli 0,1 %:lla potilaista (n = 912), joita hoidettiin CEFTINillä moniannosten kliinisissä tutkimuksissa.
Immuunijärjestelmän häiriöt Nokkosihottuma, turvonnut kieli.
Aineenvaihdunta- ja ravitsemushäiriöt : Anoreksia.
Hermoston häiriöt : Päänsärky.
Sydämen häiriöt : Rintakipu.
Hengityselinten häiriöt : Hengenahdistus.
Ruoansulatuskanavan häiriöt : Vatsakipu, vatsakrampit, ilmavaivat, ruoansulatushäiriöt, suun haavaumat.
Ihon ja ihonalaisten kudosten häiriöt : Ihottuma, kutina.
Munuais- ja virtsatiehäiriöt : Dysuria.
Lisääntymisjärjestelmän ja rintojen häiriöt : Emätintulehdus, vulvan kutina.
Yleiset häiriöt ja hallintopaikan ehdot : Vilunväristykset, uneliaisuus, jano.
Tutkimukset : Positiivinen Coombsin testi.
Varhainen Lymen tauti 20 päivän hoito-ohjelmalla
Kahdessa monikeskustutkimuksessa arvioitiin CEFTIN 500 mg kahdesti vuorokaudessa 20 päivän ajan. Yleisimmät lääkkeeseen liittyvät haittavaikutukset olivat ripuli (10,6 %), Jarisch-Herxheimer-reaktio (5,6 %) ja vaginiitti (5,4 %). Muita haitallisia kokemuksia esiintyi tiheydellä, joka oli verrattavissa 7–10 päivän annostelussa raportoituihin.
Yksinkertainen hoito-ohjelma komplisoitumattomaan tippuriin
Kliinisissä tutkimuksissa, joissa käytettiin 1 000 mg:n kerta-annosta 250 mg CEFTINiä, 1 061 koehenkilöä hoidettiin komplisoitumattoman gonorrean vuoksi. Taulukon 6 haittavaikutukset koskivat koehenkilöitä, joita hoidettiin kerta-annoksella 1 000 mg CEFTINiä Yhdysvaltain kliinisissä tutkimuksissa.
Seuraavia haittavaikutuksia esiintyi alle 1 %:lla mutta yli 0,1 %:lla potilaista (n = 1 061), joita hoidettiin kerta-annoksella 1 000 mg CEFTINiä komplisoitumattomaan tippuriin Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa.
Infektiot ja infektiot : Emättimen kandidoosi.
Hermoston häiriöt : Päänsärky, huimaus, uneliaisuus.
Sydämen häiriöt : Puristava tunne/kipu rinnassa, takykardia.
Ruoansulatuskanavan häiriöt : Vatsakipu, dyspepsia.
Ihon ja ihonalaisten kudosten häiriöt : Punoitus, ihottuma, kutina.
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt : Lihaskouristukset, lihasjäykkyys, niskan lihaskouristukset, locklew-tyyppinen reaktio.
Munuais- ja virtsatiehäiriöt : Verenvuoto/kipu virtsaputkessa, munuaiskipu.
Lisääntymisjärjestelmän ja rintojen häiriöt : Emättimen kutina, emätinvuoto.
Oraalinen suspensio
Kliinisissä tutkimuksissa, joissa käytettiin useita CEFTIN-annoksia 250 mg, lapsipotilaita (96,7 % oli alle 12-vuotiaita) hoidettiin CEFTINillä (20-30 mg/kg/vrk jaettuna kahdesti päivässä maksimiannokseen 500 tai 1 000 mg/vrk). vastaavasti). Yksitoista (1,2 %) yhdysvaltalaista keskeytti lääkityksen haittavaikutusten vuoksi. Hoito keskeytettiin pääasiassa ruoansulatuskanavan häiriöiden, yleensä ripulin tai oksentelun vuoksi. Kolmetoista (1,4 %) yhdysvaltalaista lapsipotilasta keskeytti hoidon maun ja/tai lääkkeen antoongelmien vuoksi.
Taulukon 7 haittavaikutukset koskevat yhdysvaltalaisia koehenkilöitä (n = 931), joita hoidettiin CEFTINillä moniannosten kliinisissä tutkimuksissa.
Seuraavia haittavaikutuksia esiintyi alle 1 %:lla mutta yli 0,1 %:lla yhdysvaltalaisista koehenkilöistä (n = 931), joita hoidettiin CEFTINillä oraalisuspensiota varten moniannosten kliinisissä tutkimuksissa.
Infektiot ja infektiot : Ruoansulatuskanavan tulehdus, kandidiaasi, virussairaus, ylempien hengitysteiden tulehdus, sinuiitti, virtsatietulehdus.
Veri- ja imukudosjärjestelmän häiriöt : Eosinofilia.
Psykiatriset häiriöt : Yliaktiivisuus, ärtyisä käyttäytyminen.
Ruoansulatuskanavan häiriöt : Vatsakipu, ilmavaivat, ptyalismi.
Ihon ja ihonalaisten kudosten häiriöt : Ihottuma.
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt : Nivelten turvotus, nivelsärky.
Lisääntymisjärjestelmän ja rintojen häiriöt : Emättimen ärsytys.

Yleiset häiriöt ja hallintopaikan ehdot : Yskä, kuume.
Tutkimukset : Kohonneet maksaentsyymiarvot, positiivinen Coombsin testi.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu CEFTINin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imukudosjärjestelmän häiriöt
Hemolyyttinen anemia, leukopenia, pansytopenia, trombosytopenia.
Ruoansulatuskanavan häiriöt
Pseudomembranoottinen koliitti [katso VAROITUKSET JA VAROTOIMET ].
Maksan ja sappien häiriöt
Maksan vajaatoiminta mukaan lukien hepatiitti ja kolestaasi, keltaisuus.
Immuunijärjestelmän häiriöt
Anafylaksia, seerumitautia muistuttava reaktio.
Tutkimukset
Lisääntynyt protrombiiniaika.
Hermoston häiriöt
Kouristukset, enkefalopatia.
Munuais- ja virtsatiehäiriöt
Munuaisten toimintahäiriö.
Ihon ja ihonalaisten kudosten häiriöt
Angioedeema, erythema multiforme, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, urtikaria.
HUUMEIDEN VUOROVAIKUTUKSET
Ehkäisypillerit
Kefuroksiimiaksetiili voi vaikuttaa suolistoflooraan, mikä heikentää estrogeenin reabsorptiota ja heikentää oraalisten estrogeeni/progesteroni-yhdistelmäehkäisyvalmisteiden tehoa. Neuvo potilaita harkitsemaan vaihtoehtoisia täydentäviä (ei-hormonaalisia) ehkäisymenetelmiä hoidon aikana.
Lääkkeet, jotka vähentävät mahahapon happamuutta
Lääkkeet, jotka vähentävät mahalaukun happamuutta, voivat heikentää CEFTINin biologista hyötyosuutta kuin paastotilassa. Mahalaukun happamuutta vähentävien lääkkeiden antaminen voi tehdä tyhjäksi CEFTIN 250 mg:n lisääntyneen imeytymisen aiheuttaman ravinnon vaikutuksen, kun se annetaan aterian jälkeisessä tilassa. Anna CEFTIN vähintään 1 tunti ennen lyhytvaikutteisten antasidien antoa tai 2 tuntia sen jälkeen. Histamiini-2 (H2) -antagonisteja ja protonipumpun estäjiä tulee välttää.
Probenesidi
Probenesidin samanaikainen anto kefuroksiimiaksetiilitablettien kanssa lisää kefuroksiimin pitoisuutta seerumissa [ks. KLIININEN FARMAKOLOGIA ]. Probenesidin ja kefuroksiimiaksetiilin samanaikaista käyttöä ei suositella.
Lääke/laboratoriotestien vuorovaikutukset
Väärin positiivinen reaktio virtsan glukoosille voi ilmetä kuparin pelkistystesteissä (esim. Benedictin tai Fehlingin liuos), mutta ei entsyymipohjaisissa glykosuriatesteissä. Koska ferrisyaniditestissä voi saada väärän negatiivisen tuloksen, on suositeltavaa käyttää joko glukoosioksidaasi- tai heksokinaasimenetelmää veren/plasman glukoosipitoisuuden määrittämiseen potilailla, jotka saavat kefuroksiimiaksetiilia. Kefuroksiimin läsnäolo ei häiritse seerumin ja virtsan kreatiniinin määritystä alkalisella pikraattimenetelmällä.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Anafylaktiset reaktiot
Vakavia ja joskus kuolemaan johtaneita yliherkkyysreaktioita (anafylaktisia) on raportoitu potilailla, jotka ovat saaneet beetalaktaamilääkkeitä. Näitä reaktioita esiintyy todennäköisemmin henkilöillä, joilla on aiemmin ollut yliherkkyys beetalaktaamille ja/tai herkkyys useille allergeeneille. On raportoitu henkilöitä, joilla on ollut penisilliiniyliherkkyyttä ja jotka ovat kokeneet vakavia reaktioita kefalosporiinihoidon aikana. CEFTIN 500 mg on vasta-aiheinen potilailla, jotka ovat yliherkkiä CEFTINille tai muille β-laktaamiantibakteerilääkkeille [ks. VASTA-AIHEET ]. Ennen kuin aloitat CEFTIN-hoidon, tiedustele aiempia yliherkkyysreaktioita penisilliineille, kefalosporiineille tai muille allergeeneille. Jos allerginen reaktio ilmenee, keskeytä CEFTIN-hoito ja aloita asianmukainen hoito.
Clostridium Difficilen aiheuttama ripuli
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien CEFTIN, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja voivat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli 2 kuukauden kuluttua antibakteeristen aineiden annosta.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen aiheen mukaan.
Mikrobien liikakasvun mahdollisuus
Sieni- tai bakteeripatogeenien superinfektioiden mahdollisuus tulee ottaa huomioon hoidon aikana.
Lääkeresistenttien bakteerien kehittäminen
CEFTINin määrääminen joko ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Fenyyliketonuria
CEFTIN 125 mg oraalisuspensiota varten 125 mg/5 ml sisältää fenyylialaniinia 11,8 mg 5 ml:ssa (1 teelusikallinen) käyttövalmiiksi saatettua suspensiota. CEFTIN 250 mg oraalisuspensiota varten 250 mg/5 ml sisältää 25,2 mg fenyylialaniinia 5 ml:ssa (1 teelusikallinen) käyttövalmiiksi saatettua suspensiota.
Glukoositestien häiriöt
Väärä positiivinen tulos virtsan glukoosille voi ilmaantua kuparin pelkistystesteissä, ja väärän negatiivinen tulos veren/plasman glukoosipitoisuudelle voi esiintyä ferrisyaniditesteissä CEFTIN-hoitoa saavilla koehenkilöillä [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Vaikka eläimillä ei ole tehty elinikäisiä tutkimuksia karsinogeenisuuden arvioimiseksi, kefuroksiimiaksetiilille ei havaittu mutageenista aktiivisuutta bakteerimutaatiotesteissä. Positiivisia tuloksia saatiin in vitro kromosomipoikkeamamäärityksessä; kuitenkin negatiiviset tulokset havaittiin in vivo mikrotumatestissä annoksilla 1,5 g/kg asti. Rotilla tehdyt lisääntymistutkimukset annoksilla 1 000 mg/kg/vrk asti (9 kertaa ihmisen suositeltu enimmäisannos kehon pinta-alan perusteella) eivät ole osoittaneet hedelmällisyyden heikkenemistä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka B. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, CEFTINiä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Lisääntymistutkimuksia on tehty hiirillä annoksilla 3 200 mg/kg/vrk (14 kertaa suositeltu enimmäisannos ihmiselle kehon pinta-alan perusteella) ja rotilla annoksilla 1 000 mg/kg/vrk (9 kertaa suositeltu enimmäisannos). ihmisannos perustuu kehon pinta-alaan), eivätkä ne ole paljastaneet merkkejä hedelmällisyyden heikkenemisestä tai kefuroksiimiaksetiilin aiheuttamasta vahingosta sikiölle.
Imettävät äidit
Koska kefuroksiimi erittyy äidinmaitoon, varovaisuutta on noudatettava, kun CEFTIN 500 mg -valmistetta annetaan imettäville naisille.
Käyttö lapsille
CEFTIN 250 mg:n turvallisuus ja tehokkuus on osoitettu 3 kuukauden–12-vuotiaille lapsipotilaille akuutin bakteeriperäisen poskiontelotulehduksen vuoksi sen hyväksynnän perusteella aikuisilla. CEFTINin käyttöä lapsipotilailla tukevat farmakokineettiset ja turvallisuustiedot aikuisilla ja lapsipotilailla sekä kliiniset ja mikrobiologiset tiedot, jotka on saatu riittävistä ja hyvin kontrolloiduista tutkimuksista aikuisten akuutin bakteeriperäisen poskiontelotulehduksen ja akuutin välikorvantulehduksen hoidossa, johon liittyy effuusiota. lapsipotilaat. Sitä tukee myös markkinoille tulon jälkeisten haittatapahtumien seuranta. [Katso KÄYTTÖAIHEET JA KÄYTTÖ , ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA ]
Geriatrinen käyttö
Kaikista potilaista, jotka saivat 250 mg CEFTINiä 20 kliinisessä tutkimuksessa, 375 oli 65-vuotiaita tai vanhempia ja 151 oli 75-vuotiaita tai vanhempia. Näiden koehenkilöiden ja nuorempien aikuisten välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa. Raportoitu kliininen kokemus ei ole osoittanut eroja iäkkäiden ja nuorempien aikuisten potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Kefuroksiimi erittyy pääosin munuaisten kautta, ja haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä.
Munuaisten vajaatoiminta
CEFTIN 125 mg:n annoksen pienentämistä suositellaan aikuispotilaille, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Kefalosporiinien yliannostus voi aiheuttaa aivoärsytystä, joka johtaa kouristukseen tai enkefalopatiaan. Seerumin kefuroksiimipitoisuuksia voidaan alentaa hemodialyysillä ja peritoneaalidialyysillä.
VASTA-AIHEET
CEFTIN on vasta-aiheinen potilailla, joiden tiedetään olevan yliherkkiä (esim. anafylaksia) CEFTINille tai muille β-laktaamiantibakteerilääkkeille (esim. penisilliineille ja kefalosporiineille).
KLIININEN FARMAKOLOGIA
Toimintamekanismi
CEFTIN 250mg on antibakteerinen lääke [katso Mikrobiologia ].
Farmakokinetiikka
Imeytyminen
Oraalisen annon jälkeen kefuroksiimiaksetiili imeytyy ruoansulatuskanavasta ja hydrolysoituu nopeasti kefuroksiimiksi epäspesifisten esteraasien vaikutuksesta suolen limakalvolla ja veressä. Kefuroksiimin seerumin farmakokineettiset parametrit sen jälkeen, kun CEFTIN 250 mg tabletteja on annettu aikuisille, on esitetty taulukossa 8.
Ruoan vaikutus
Tabletin imeytyminen on suurempi, kun se otetaan ruokailun jälkeen (absoluuttinen hyötyosuus kasvaa 37 %:sta 52 %:iin). Tästä imeytymiserosta huolimatta koehenkilöiden kliiniset ja bakteriologiset vasteet olivat riippumattomia ravinnosta tabletin antohetkellä kahdessa tutkimuksessa, joissa tätä arvioitiin.
Kaikki farmakokineettiset ja kliiniset tehokkuus- ja turvallisuustutkimukset lapsilla, joissa käytettiin suspensioformulaatiota, suoritettiin ruokailun jälkeen. Tietoja ei ole saatavilla suspension imeytymiskinetiikasta, kun sitä annetaan paastopotilaille.
Bioekvivalenssin puute
Oraalisuspensio ei ollut bioekvivalentti tablettien kanssa, kun sitä testattiin terveillä aikuisilla. Tabletti- ja oraalisuspensioformulaatiot EIVÄT ole korvattavissa milligramma-permilligramma-perusmäärällä. Suspension käyrän alla oleva pinta-ala oli keskimäärin 91 % tabletin vastaavasta, ja suspension huippupitoisuus plasmassa oli keskimäärin 71 % tablettien huippupitoisuudesta plasmassa. Siksi sekä tablettien että oraalisuspensioiden turvallisuus ja tehokkuus vahvistettiin erillisissä kliinisissä tutkimuksissa.
Jakelu
Kefuroksiimi jakautuu solunulkoisiin nesteisiin. Noin 50 % seerumin kefuroksiimista sitoutuu proteiineihin.
Aineenvaihdunta
Aksetiiliosa metaboloituu asetaldehydiksi ja etikkahapoksi.
Erittyminen
Kefuroksiimi erittyy muuttumattomana virtsaan; aikuisilla noin 50 % annetusta annoksesta erittyy virtsaan 12 tunnin kuluessa. Kefuroksiimin farmakokinetiikkaa lapsipotilailla ei ole tutkittu. Ennen kuin lisätietoja on saatavilla, kefuroksiimiaksetiilin eliminaatiota munuaisten kautta aikuisilla ei pitäisi ekstrapoloida lapsiin.
Tietyt populaatiot
Munuaisten vajaatoiminta
Tutkimuksessa, johon osallistui 28 aikuista, joilla oli normaali munuaisten toiminta tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI ].
Pediatriset potilaat
Kefuroksiimin seerumin farmakokineettiset parametrit lapsipotilailla, joille annettiin CEFTINiä oraalisuspensiota varten, on esitetty taulukossa 9.
Geriatriset potilaat
Tutkimuksessa, johon osallistui 20 iäkkää henkilöä (keski-ikä = 83,9 vuotta), joiden keskimääräinen kreatiniinipuhdistuma oli 34,9 ml/min, keskimääräinen eliminaation puoliintumisaika seerumissa pidennettiin 3,5 tuntiin; huolimatta kefuroksiimin vähäisemmästä eliminaatiosta iäkkäillä potilailla, annostuksen muuttaminen iän perusteella ei ole tarpeen [ks. Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutukset
Probenesidin ja kefuroksiimiaksetiilitablettien samanaikainen anto lisää kefuroksiimin aluetta seerumin pitoisuuden ja aikakäyrän alla ja seerumin maksimipitoisuutta 50 % ja 21 %.
Mikrobiologia
Toimintamekanismi
Kefuroksiimiaksetiili on bakterisidinen aine, joka estää bakteerin soluseinän synteesiä. Kefuroksiimiaksetiili vaikuttaa joidenkin gramnegatiivisten ja grampositiivisten bakteerien β-laktamaaseihin, sekä penisillinaaseihin että kefalosporinaaseihin.
Vastustusmekanismi
Resistenssi kefuroksiimiaksetiilille johtuu pääasiassa β-laktamaasin aiheuttamasta hydrolyysistä, penisilliiniä sitovien proteiinien (PBP) muutoksista, heikentyneestä läpäisevyydestä ja bakteerien ulosvirtauspumppujen läsnäolosta.
Herkkyys kefuroksiimiaksetiilille vaihtelee maantieteellisen sijainnin ja ajan mukaan; Paikallisia herkkyystietoja tulee tarkastella, jos niitä on saatavilla. H. influenzaen beetalaktamaasinegatiivisia, ampisilliiniresistenttejä (BLNAR) isolaatteja tulee pitää kefuroksiimiaksetilille resistentteinä.
Kefuroksiimiaksetiilin on osoitettu olevan aktiivinen useimpia seuraavien bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ]:
Gram-positiiviset bakteerit
Staphylococcus aureus (vain metisilliinille herkät isolaatit) Streptococcus pneumoniae Streptococcus pyogenes
Gram-negatiiviset bakteerit
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a Laajemman spektrin β-laktamaasia (ESBL) ja karbapenemaasia tuottavat isolaatit ovat resistenttejä aksetiilifuroksiimille. Spirochetes Borrelia Burgdorferi
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 prosentilla seuraavista mikro-organismeista on in vitro -minimi estävä pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin kefuroksiimiaksetiilin herkkä raja-arvo 1 mcg/ml. Kefuroksiimiaksetiilin tehoa näiden mikro-organismien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Staphylococcus epidermidis (vain metisilliinille herkät isolaatit) Staphylococcus saprophyticus (vain metisilliinille herkät isolaatit) Streptococcus agalactiae
Gram-negatiiviset bakteerit
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaerobiset bakteerit Peptococcus niger
Herkkyystestimenetelmät
Kliinisen mikrobiologian laboratorion tulee mahdollisuuksien mukaan toimittaa lääkärille paikallisissa sairaaloissa ja vastaanottoalueilla käytettävien mikrobilääkkeiden in vitro -herkkyystestien tulokset määräaikaisraportteina, jotka kuvaavat sairaalasta ja yhteisöstä hankittujen patogeenien herkkyysprofiilia. Näiden raporttien pitäisi auttaa lääkäriä valitsemaan antibakteerinen lääkevalmiste hoitoa varten.
Laimennustekniikat
Antimikrobisten MIC-arvojen määrittämiseen käytetään kvantitatiivisia menetelmiä. Nämä MIC-arvot tarjoavat toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC-arvot tulee määrittää käyttämällä standardisoitua testimenetelmää (liemi tai agar).1, 2 MIC-arvot on tulkittava taulukossa 10.2,3 annettujen kriteerien mukaisesti.
Diffuusiotekniikat
Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, tarjoavat myös toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko antaa arvion bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko on määritettävä käyttämällä standardisoitua testimenetelmää.4 Tässä menetelmässä käytetään paperilevyjä, jotka on kyllästetty 30 mikrogrammalla kefuroksiimiaksetiilia mikro-organismien herkkyyden testaamiseen kefuroksiimiaksetilille. Levyn diffuusion tulkintakriteerit on esitetty taulukossa 10.3
Stafylokokkien herkkyys kefuroksiimille voidaan päätellä testaamalla vain penisilliiniä ja joko kefoksitiinia tai oksasilliinia.
Streptococcus pyogenes -bakteerin herkkyys voidaan päätellä penisilliinitestauksesta.
"Herkkä"-raportti osoittaa, että mikrobilääke todennäköisesti estää patogeenin kasvua, jos mikrobilääke saavuttaa pitoisuuden, joka on yleensä saavutettavissa infektiopaikassa. "Keskitaso"-raportti osoittaa, että tulosta on pidettävä epäselvänä, ja jos mikro-organismi ei ole täysin herkkä vaihtoehtoisille, kliinisesti toteuttamiskelpoisille lääkkeille, testi on toistettava. Tämä kategoria tarkoittaa mahdollista kliinistä soveltuvuutta kehon kohteisiin, joissa lääke on fysiologisesti keskittynyt tai tilanteissa, joissa voidaan käyttää suuria lääkeannoksia. Tämä kategoria tarjoaa myös puskurivyöhykkeen, joka estää pieniä hallitsemattomia teknisiä tekijöitä aiheuttamasta suuria tulkintaeroja. "Resistant"-raportti osoittaa, että mikrobilääke ei todennäköisesti estä patogeenin kasvua, jos antimikrobinen lääke saavuttaa pitoisuudet, jotka tavallisesti saavutetaan infektiokohdassa; tulee valita muu hoitomuoto.
Laadunvalvonta
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollien käyttöä määrityksessä käytettyjen tarvikkeiden ja reagenssien tarkkuuden ja tarkkuuden sekä testin suorittavan henkilön tekniikoiden valvomiseksi ja varmistamiseksi.1,2,4 Laadunvalvonta-alueet MIC:lle ja levydiffuusiolle testaus 30 mikrogramman levyllä on esitetty taulukossa 11.3
Kliiniset tutkimukset
Akuutti bakteeriperäinen poskiontelotulehdus
Yksi riittävä ja hyvin kontrolloitu tutkimus suoritettiin koehenkilöillä, joilla oli akuutti bakteeriperäinen poskiontelotulehdus. Tässä tutkimuksessa jokaisesta koehenkilöstä otettiin poskionteloaspiraatti poskiontelonpunktiolla ennen kuin hoito aloitettiin oletetun akuutin bakteeriperäisen poskiontelotulehduksen vuoksi. Kaikilla koehenkilöillä oli radiografisia ja kliinisiä todisteita akuutista poskiontelotulehduksesta. Kokeessa CEFTINin kliininen tehokkuus akuutin poskiontelotulehduksen hoidossa oli verrattavissa oraaliseen antimikrobiseen aineeseen, joka sisälsi spesifistä β-laktamaasi-inhibiittoria. Mikrobiologiset tiedot osoittivat kuitenkin CEFTINin olevan tehokas akuutin bakteeriperäisen poskiontelotulehduksen hoidossa, joka johtuu vain Streptococcus pneumoniaesta tai ei-beetalaktamaasia tuottavasta Haemophilus influenzaesta. Tässä tutkimuksessa saatiin riittämätön määrä β-laktamaasia tuottavia Haemophilus influenzae- ja Moraxella catarrhalis -isolaatteja CEFTINin tehokkuuden arvioimiseksi riittävästi näiden kahden organismin aiheuttaman akuutin bakteeriperäisen poskiontelotulehduksen hoidossa.
Tässä tutkimuksessa satunnaistettiin 317 aikuista henkilöä, 132 koehenkilöä Yhdysvalloissa ja 185 henkilöä Etelä-Amerikassa. Taulukko 12 esittää hoitoaikeusanalyysin tulokset.
Tässä tutkimuksessa ja sitä tukevassa yläleuanpunktiotutkimuksessa 15 arvioitavalla koehenkilöllä oli tunnistettu patogeeni, joka ei tuottanut β-laktamaasia Haemophilus influenzae. Näistä 67 %:lla (10/15) tämä patogeeni oli hävitetty. Kahdeksantoista (18) arvioitavasta koehenkilöstä oli Streptococcus pneumoniae tunnistettu patogeeni. Näistä 83 %:lla (15/18) tämä patogeeni oli hävitetty.
Varhainen Lymen tauti
Kaksi riittävää ja hyvin kontrolloitua tutkimusta suoritettiin koehenkilöillä, joilla oli varhainen Lymen tauti. Kaikilla koehenkilöillä oli lääkärin dokumentoima erythema migrans, johon liittyi tai ei ollut infektion systeemisiä ilmentymiä. Koehenkilöt arvioitiin 1 kuukauden kuluttua hoidon onnistumisesta varhaisen Lymen taudin hoidossa (osa I) ja 1 vuoden kuluttua hoidon onnistumisesta myöhäisen Lymen taudin jälkiseurausten estämisessä (osa II).
Yhteensä 355 aikuista henkilöä (181 hoidettiin kefuroksiimiaksetililla ja 174 doksisykliinillä) satunnaistettiin kahdessa tutkimuksessa, ja varhaisen Lymen taudin diagnoosi vahvistettiin 79 %:lla (281/355). Varhaisen Lymen taudin kliininen diagnoosi näillä koehenkilöillä vahvistettiin 1) soketulla asiantuntijalukemalla valokuvia ennen hoitoa erythema migrans -ihovauriosta, jos niitä oli saatavilla, ja 2) serologisella vahvistuksella (käyttämällä entsyymikytkentäistä immunosorbenttimääritystä [ELISA] ja immunoblot-määritystä ["Western" blot]) Borrelia burgdorferille, Lymen taudin etiologiselle tekijälle, spesifisten vasta-aineiden esiintymisestä. Taulukon 13 tehokkuustiedot koskevat tätä "validoitua" potilasryhmää, kun taas alla olevat turvallisuustiedot koskevat koko potilaspopulaatiota kahdessa tutkimuksessa. Kliiniset tiedot arvioitavista koehenkilöistä "validoidun" potilaiden alajoukossa on esitetty taulukossa 13.
CEFTIN ja doksisykliini estivät tehokkaasti myöhäisen Lymen taudin seurausten kehittymistä.
Vaikka lääkkeisiin liittyvien maha-suolikanavan haittavaikutusten ilmaantuvuus oli samanlainen kahdessa hoitoryhmässä (kefuroksiimiaksetiili - 13 %; doksisykliini - 11 %), lääkkeeseen liittyvän ripulin ilmaantuvuus oli suurempi kefuroksiimiaksetiiliryhmässä kuin doksisykliiniryhmässä (11). % vs. 3 %).
VIITTEET
1. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardi – kymmenes painos. 2015. CLSI-dokumentti M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Menetelmät mikrobien laimennusta ja levyherkkyystestausta varten harvoin eristetyille tai epävakaille bakteereille: Hyväksytyt ohjeet – Toinen painos. 2010. CLSI-dokumentti M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Suorituskykystandardit antimikrobiaaliselle herkkyystestaukselle; Kahdeskymmenesviides tiedote. 2015. CLSI-dokumentti M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Clinical and Laboratory Standards Institute (CLSI). Antimikrobisten levyjen diffuusioherkkyystestien suorituskykystandardit; Hyväksytty standardi – kahdestoista painos. 2015. CLSI-dokumentti M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
POTILASTIEDOT
Allergiset reaktiot
Kerro potilaille, että CEFTIN on kefalosporiini, joka voi aiheuttaa allergisia reaktioita joillekin henkilöille [katso VAROITUKSET JA VAROTOIMET ].
Clostridium Difficilen aiheuttama ripuli
Kerro potilaille, että ripuli on yleinen antibakteeristen lääkkeiden aiheuttama ongelma, ja se yleensä loppuu, kun antibakteerinen lääke lopetetaan. Joskus bakteerilääkehoidon aloittamisen jälkeen potilaille voi kehittyä vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa 2 kuukautta tai enemmän sen jälkeen, kun he ovat ottaneet viimeisen antibakteerisen annoksen. Jos näin tapahtuu, kehota potilaita ottamaan yhteyttä lääkäriin mahdollisimman pian.
Fenyyliketonuria
Kerro potilaille ja hoitajille, että CEFTIN 125 mg oraalisuspensiota varten sisältää fenyylialaniinia (aspartaamin komponentti) [ks. VAROITUKSET JA VAROTOIMET ].
Murskaavat tabletit
Neuvo potilaita nielemään tabletti kokonaisena murskaamatta tablettia. Potilaiden, jotka eivät voi niellä tablettia kokonaisena, tulee saada oraalisuspensio.
Oraalinen suspensio
Neuvo potilaita ravistelemaan oraalisuspensiota hyvin ennen jokaista käyttöä, säilyttämään jääkaapissa ja hävittämään 10 päivän kuluttua. Oraalisuspensio tulee ottaa ruoan kanssa.
Huumeiden vastustuskyky
Kerro potilaille, että antibakteerisia lääkkeitä, mukaan lukien CEFTIN, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun CEFTIN 250 mg määrätään bakteeri-infektion hoitoon, kerro potilaille, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi: (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa CEFTIN 500 mg:lla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa. .
