Syövän hoito: Nolvadex 10mg, 20mg Tamoxifen Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Nolvadex on ja miten sitä käytetään?
Nolvadex 10mg on reseptilääke, jota käytetään rintasyövän oireiden hoitoon. Nolvadexia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Nolvadex 20mg kuuluu lääkeluokkaan, jota kutsutaan antineoplastiksi, estrogeenireseptorin antagonistiksi.
Ei tiedetä, onko Nolvadex 20mg turvallinen ja tehokas lapsille.
Mitkä ovat Nolvadex 20mg:n mahdolliset sivuvaikutukset?
Nolvadex voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- näkö muuttuu,
- silmäkipu,
- helppo mustelma tai verenvuoto,
- mielialan muutoksia,
- nilkkojen tai jalkojen turvotus ja
- epätavallinen väsymys
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Nolvadexin yleisimmät sivuvaikutukset ovat:
- kuumia aaltoja,
- punoitus,
- kuukautisten muutokset,
- pahoinvointi,
- jalkakrampit,
- vatsakouristukset,
- luukipu,
- lihaskipu,
- yskä,
- turvotus,
- väsymys,
- hiusten oheneminen,
- päänsärky,
- masennus ja
- seksuaalisen kyvyn/kiinnostuksen menetys (miehillä)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Nolvadexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
VAROITUS
Naisille, joilla on ductal carcinoma in situ (DCIS) ja naisille, joilla on korkea rintasyövän riski: Vakavia ja hengenvaarallisia tapahtumia, jotka liittyvät NOLVADEXiin (tamoksifeenisitraatti) riskin vähentämisympäristössä (naiset, joilla on suuri riski saada syöpä, ja naiset, joilla on DCIS), ovat kohdun pahanlaatuiset kasvaimet, aivohalvaus ja keuhkoembolia. Näiden tapahtumien ilmaantuvuus on arvioitu NSABP P-1 -tutkimuksesta (ks KLIININEN FARMAKOLOGIA-Kliiniset tutkimukset - Rintasyövän ilmaantuvuuden vähentäminen korkean riskin naisilla ). Kohdun pahanlaatuiset kasvaimet koostuvat sekä kohdun limakalvon adenokarsinoomasta (esiintyvyys 1 000 naisvuotta kohden NOLVADEXilla (tamoksifeenisitraatti) 2,20 vs. lumelääkettä 0,71) ja kohdun sarkoomasta (esiintyvyys 1 000 naisvuotta kohden 0,17 NOLV0-citraattia NOLV0ADEX4 (tamoksifeenisitraatti) plasebo)*. Aivohalvauksen ilmaantuvuus 1 000 naisvuotta kohden oli 1,43 NOLVADEXilla (tamoksifeenisitraatti) verrattuna 1,00 lumelääkkeeseen**. Keuhkoembolian ilmaantuvuus 1 000 naisvuotta kohden oli 0,75 NOLVADEXilla (tamoksifeenisitraatti) verrattuna 0,25 lumelääkkeeseen**.
Jotkut aivohalvauksista, keuhkoemboleista ja kohdun pahanlaatuisista kasvaimista olivat kohtalokkaita.
Terveydenhuollon tarjoajien tulisi keskustella näiden vakavien tapahtumien mahdollisista hyödyistä verrattuna mahdollisiin riskeihin naisten kanssa, joilla on korkea rintasyövän riski, ja naisten, joilla on DCIS, harkitsevien NOLVADEX:ia (tamoksifeenisitraattia) vähentääkseen rintasyövän kehittymisriskiään.
NOLVADEXin (tamoksifeenisitraatin) hyödyt ovat suuremmat kuin sen riskit naisilla, joilla on jo diagnosoitu rintasyöpä.
VIITTEET
* Päivitetyt pitkän aikavälin seurantatiedot (seurannan mediaanipituus on 6,9 vuotta) NSABP P-1 -tutkimuksesta. Katso VAROITUKSET: Vaikutukset kohdun endometriumin syöpään ja kohdun sarkoomaan .
**Katso taulukko 3 alla KLIININEN FARMAKOLOGIA-Kliiniset tutkimukset .
KUVAUS
NOLVADEX® (tamoksifeenisitraatti) -tabletit, ei-steroidinen antiestrogeeni, on tarkoitettu annettavaksi suun kautta. NOLVADEX (tamoksifeenisitraatti) -tabletit ovat saatavilla seuraavasti:
10 mg tabletit
Yksi tabletti sisältää 15,2 mg tamoksifeenisitraattia, mikä vastaa 10 mg tamoksifeenia.
20 mg tabletit
Yksi tabletti sisältää 30,4 mg tamoksifeenisitraattia, mikä vastaa 20 mg tamoksifeenia.
Inaktiiviset ainesosat: karboksimetyyliselluloosakalsium, magnesiumstearaatti, mannitoli ja tärkkelys.
Kemiallisesti NOLVADEX (tamoksifeenisitraatti) on trifenyylietyleenijohdannaisen trans-isomeeri. Kemiallinen nimi on (Z)2-[4-(1,2-difenyyli-1-butenyyli)fenoksi]-N,N-dimetyylietaaniamiini-2-hydroksi-1,2,3-propaanitrikarboksylaatti (1:1). Rakenteelliset ja empiiriset kaavat ovat:
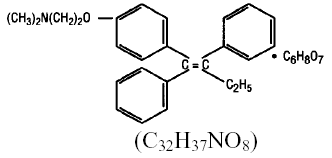
Tamoksifeenisitraatin molekyylipaino on 563,62, pKa' on 8,85, tasapainoliukoisuus veteen 37 °C:ssa on 0,5 mg/ml ja 0,02 N HCl:ssa 37 °C:ssa, se on 0,2 mg/ml.
INDIKAATIOT
Metastaattinen rintasyöpä
NOLVADEX (tamoksifeenisitraatti) on tehokas metastaattisen rintasyövän hoidossa naisilla ja miehillä. Premenopausaalisilla naisilla, joilla on metastaattinen rintasyöpä, NOLVADEX (tamoksifeenisitraatti) on vaihtoehto munasarjan poistoleikkaukselle tai munasarjojen säteilytykselle. Saatavilla olevat todisteet osoittavat, että potilaat, joiden kasvaimet ovat estrogeenireseptoripositiivisia, hyötyvät todennäköisemmin NOLVADEX-hoidosta (tamoksifeenisitraatti).
Rintasyövän adjuvanttihoito
NOLVADEX (tamoksifeenisitraatti) on tarkoitettu solmukohtaisen rintasyövän hoitoon naisilla täydellisen rinnanpoiston tai segmentaalisen mastektomian, kainaloiden dissektion ja rintojen säteilytyksen jälkeen. Joissakin NOLVADEX- (tamoksifeenisitraatti) -adjuvanttitutkimuksissa suurin osa tähän mennessä saadusta hyödystä on ollut alaryhmässä, jossa on neljä tai useampia positiivisia kainalosolmukkeita.
NOLVADEX (tamoksifeenisitraatti) on tarkoitettu kainalosolmuke-negatiivisen rintasyövän hoitoon naisilla täydellisen rinnanpoiston tai segmentaalisen mastektomian, kainaloiden dissektion ja rintojen säteilytyksen jälkeen.
Estrogeeni- ja progesteronireseptoriarvot voivat auttaa ennustamaan, onko adjuvantti NOLVADEX (tamoksifeenisitraatti) -hoidosta todennäköisesti hyötyä.
NOLVADEX (tamoksifeenisitraatti) vähentää kontralateraalisen rintasyövän esiintymistä potilailla, jotka saavat adjuvanttia NOLVADEX (tamoksifeenisitraatti) -hoitoa rintasyövän hoitoon.
Ductal Carcinoma in Situ (DCIS)
Naisilla, joilla on DCIS, rintaleikkauksen ja säteilyn jälkeen NOLVADEX (tamoksifeenisitraatti) on tarkoitettu vähentämään invasiivisen rintasyövän riskiä (ks. LAATIKKO VAROITUS etiketin alussa). Päätöksen NOLVADEX-hoidosta (tamoksifeenisitraatti) rintasyövän ilmaantuvuuden vähentämiseksi tulee perustua NOLVADEX-hoidon (tamoksifeenisitraatti) hyötyjen ja riskien yksilölliseen arviointiin.
Nykyiset kliinisistä tutkimuksista saadut tiedot tukevat viiden vuoden adjuvanttia NOLVADEX-hoitoa (tamoksifeenisitraattia) potilailla, joilla on rintasyöpä.
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla
NOLVADEX (tamoksifeenisitraatti) on tarkoitettu vähentämään rintasyövän ilmaantuvuutta naisilla, joilla on suuri riski saada rintasyöpä. Tämä vaikutus osoitettiin 5 vuotta kestäneessä tutkimuksessa, jonka seurannan mediaani oli 4,2 vuotta. 25 prosenttia osallistujista sai huumeita 5 vuoden ajan. Pidemmän aikavälin vaikutuksia ei tunneta. Tässä tutkimuksessa tamoksifeenilla ei ollut vaikutusta yleiseen tai rintasyöpään liittyvään kuolleisuuteen (ks LAATIKKO VAROITUS etiketin alussa).
NOLVADEX (tamoksifeenisitraatti) on tarkoitettu vain suuren riskin naisille. "Suuri riski" määritellään vähintään 35-vuotiaiksi naisiksi, joiden 5 vuoden ennustettu rintasyövän riski on ≥ 1,67 % Gail-mallin mukaan laskettuna.
Esimerkkejä tekijöiden yhdistelmistä, jotka ennustavat 5 vuoden riskin ≥ 1,67 %:
Ikä 35 tai vanhempi ja jokin seuraavista tekijöistä:
- Yksi ensimmäisen asteen sukulainen, jolla on ollut rintasyöpä, 2 tai useampi hyvänlaatuinen biopsia ja rintabiopsia, joka osoittaa epätyypillistä hyperplasiaa; tai
- Vähintään 2 ensimmäisen asteen sukulaista, joilla on ollut rintasyöpä ja henkilökohtainen rintabiopsia; tai
- LCIS
Ikä 40 tai vanhempi ja jokin seuraavista tekijöistä:
- Yksi ensimmäisen asteen sukulainen, jolla on ollut rintasyöpä, 2 tai useampi hyvänlaatuinen biopsia, ikä ensimmäisessä elävänä syntymässä 25 vuotta tai vanhempi ja ikä kuukautisten alkaessa 11 vuotta tai nuorempi; tai
- Vähintään 2 ensimmäisen asteen sukulaista, joilla on ollut rintasyöpä ja joiden ikä ensimmäisenä elävänä syntymässä on 19 vuotta tai nuorempi; tai
- Yksi ensimmäisen asteen sukulainen, jolla on ollut rintasyöpä, ja henkilökohtainen rintabiopsia, joka osoittaa epätyypillistä hyperplasiaa.
Ikä 45 tai vanhempi ja jokin seuraavista tekijöistä:
- Vähintään 2 ensimmäisen asteen sukulaista, joilla on ollut rintasyöpä ja ikää ensimmäisenä elävänä syntymässä 24 vuotta tai nuorempia; tai
- Yksi ensimmäisen asteen sukulainen, jolla on ollut rintasyöpä ja jolla on ollut hyvänlaatuinen rintabiopsia, ikä kuukautisten alkaessa 11 vuotta tai alle ja ikä ensisyntyneenä 20 vuotta tai enemmän.
Ikä 50 tai vanhempi ja jokin seuraavista tekijöistä:
- vähintään 2 ensimmäisen asteen sukulaista, joilla on ollut rintasyöpä; tai
- Aiempi rintabiopsia, jossa on epätyypillistä hyperplasiaa ja ikä ensimmäisenä elävänä syntymässä 30 vuotta tai vanhempi ja ikä kuukautisten alkaessa 11 vuotta tai vähemmän; tai
- Aiemmin vähintään kaksi rintabiopsiaa, joilla on ollut epätyypillistä hyperplasiaa, ja ikä ensimmäisenä elävänä syntymässä 30 tai vanhempi.
Ikä 55 tai vanhempi ja jokin seuraavista tekijöistä:
- Yksi ensimmäisen asteen sukulainen, jolla on ollut rintasyöpä ja jolla on henkilökohtainen hyvänlaatuinen rintabiopsia, ja ikä kuukautisten alkaessa 11 vuotta tai vähemmän; tai
- Aiemmin vähintään 2 rintabiopsiaa, joilla on ollut epätyypillistä hyperplasiaa, ja ikä ensimmäisenä elävänä syntymässä 20 vuotta tai vanhempi.
60 vuotta tai vanhempi ja:
- Viiden vuoden ennustettu rintasyövän riski ≥ 1,67 % Gail-mallilla laskettuna.
Naisille, joiden riskitekijöitä ei ole kuvattu yllä olevissa esimerkeissä, Gail-malli on välttämätön absoluuttisen rintasyövän riskin arvioimiseksi. Terveydenhuollon ammattilaiset voivat hankkia Gail-mallin riskinarviointityökalun soittamalla numeroon 1-800-544-2007.
NOLVADEXin (tamoksifeenisitraatti) vaikutuksesta rintasyövän ilmaantuvuuteen naisilla, joilla on perinnöllisiä mutaatioita (BRCA1, BRCA2) ei ole saatavilla riittävästi tietoa, jotta voitaisiin antaa erityisiä suosituksia NOLVADEXin (tamoksifeenisitraatti) tehokkuudesta näillä potilailla.
Rintasyövän kehittymisriskin arvioinnin jälkeen päätöksen NOLVADEX-hoidosta (tamoksifeenisitraatti) rintasyövän ilmaantuvuuden vähentämiseksi tulee perustua yksilölliseen NOLVADEX-hoidon (tamoksifeenisitraatti) hyötyjen ja riskien arviointiin. NSABP P-1 -tutkimuksessa NOLVADEX (tamoksifeenisitraatti) -hoito alensi rintasyövän kehittymisen riskiä tutkimuksen seurantajakson aikana, mutta ei poistanut rintasyövän riskiä (katso taulukko 3 KLIININEN FARMAKOLOGIA ).
ANNOSTELU JA HALLINNOINTI
Rintasyöpäpotilaille suositeltu vuorokausiannos on 20-40 mg. Yli 20 mg:n vuorokausiannokset tulee antaa jaettuna annoksiin (aamulla ja illalla).
Kolmessa yhden aineen adjuvanttitutkimuksessa naisilla annettiin yksi 10 mg:n NOLVADEX-tabletti (tamoksifeenisitraatti) kaksi (ECOG ja NATO) tai kolme (Toronto) kertaa päivässä kahden vuoden ajan. NSABP B-14 -adjuvanttitutkimuksessa naisilla, joilla oli solmukohtanegatiivinen rintasyöpä, yksi 10 mg:n NOLVADEX-tabletti (tamoksifeenisitraatti) annettiin kahdesti päivässä vähintään 5 vuoden ajan. B-14-tutkimuksen tulokset viittaavat siihen, että hoidon jatkaminen yli viiden vuoden ajan ei tuota lisähyötyä (ks. KLIININEN FARMAKOLOGIA ). Vuoden 1995 EBCTCG-katsauksessa uusiutumisen ja kuolleisuuden väheneminen oli suurempi niissä tutkimuksissa, joissa tamoksifeenia käytettiin noin 5 vuotta, kuin niissä, joissa tamoksifeenia käytettiin lyhyemmän hoitojakson ajan. Ei ollut viitteitä siitä, että yli 20 mg:n vuorokausiannokset olisivat tehokkaampia. Nykyiset kliinisistä tutkimuksista saadut tiedot tukevat 5 vuoden adjuvantti NOLVADEX (tamoksifeenisitraatti) -hoitoa potilailla, joilla on rintasyöpä.
Ductal Carcinoma in Situ (DCIS)
Suositeltu annos on NOLVADEX (tamoksifeenisitraatti) 20 mg päivässä 5 vuoden ajan.
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla
Suositeltu annos on NOLVADEX (tamoksifeenisitraatti) 20 mg päivässä 5 vuoden ajan. NOLVADEXin (tamoksifeenisitraatin) käytön tueksi ei ole olemassa muita tietoja kuin 5 vuoden ajan (katso KLIININEN FARMAKOLOGIA-Kliiniset tutkimukset - Rintasyövän ilmaantuvuuden vähentäminen korkean riskin naisilla ).
MITEN TOIMITETAAN
10 mg tabletit sisältää tamoksifeenia sitraattina määränä, joka vastaa 10 mg tamoksifeenia (pyöreä, kaksoiskupera, päällystämätön, valkoinen tabletti, jossa on NOLVADEX (tamoksifeenisitraatti) 600, jossa toisella puolella ja cameo toisella puolella), toimitetaan 60 pulloissa. tabletteja. NDC 0310-0600-60.
20 mg tabletit sisältää tamoksifeenia sitraattina määränä, joka vastaa 20 mg tamoksifeenia (pyöreä, kaksoiskupera, päällystämätön, valkoinen tabletti, jossa on NOLVADEX (tamoksifeenisitraatti) 604, jossa toisella puolella ja cameo toisella puolella, toimitetaan 30 pulloissa. tabletteja. NDC 0310-0604-30.
Säilytä kontrolloidussa huoneenlämmössä, 20-25 °C (68-77 °F) [katso USP]. Annostele hyvin suljetussa, valonkestävässä astiassa.
*Coumadin® on Bristol-Myers Squibb Pharmaceuticalsin rekisteröity tavaramerkki. Kaikki muut tavaramerkit ovat AstraZeneca-konsernin, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437, omaisuutta. Rev 09-27-05. FDA:n tarkistuspäivämäärä: 9.3.2006
SIVUVAIKUTUKSET
NOLVADEXin (tamoksifeenisitraatti) haittavaikutukset ovat suhteellisen lieviä ja harvoin tarpeeksi vakavia vaatimaan hoidon lopettamista rintasyöpäpotilailla.
Jatkuvat kliiniset tutkimukset ovat johtaneet lisätietoihin, jotka osoittavat paremmin NOLVADEXin (tamoksifeenisitraatti) haittavaikutusten esiintyvyyden lumelääkkeeseen verrattuna.
Metastaattinen rintasyöpä
Lisääntynyttä luu- ja kasvainkipua ja myös paikallista taudin leimahdusta on esiintynyt, mikä joskus liittyy hyvään kasvainvasteeseen. Potilaat, joilla on lisääntynyt luukipu, saattavat tarvita lisää kipulääkkeitä. Potilailla, joilla on pehmytkudossairaus, voi äkillisesti kasvaa olemassa olevien leesioiden koko, johon joskus liittyy huomattavaa punoitusta leesioiden sisällä ja ympärillä ja/tai uusien leesioiden kehittymistä. Kun niitä esiintyy, luukipu tai sairauden paheneminen havaitaan pian NOLVADEXin (tamoksifeenisitraatti) aloittamisen jälkeen ja yleensä häviävät nopeasti.
Potilailla, joita hoidetaan NOLVADEXilla (tamoksifeenisitraatti) metastasoituneen rintasyövän vuoksi, yleisin NOLVADEXin (tamoksifeenisitraatti) haittavaikutus on kuumat aallot.
Muita harvoin esiintyviä haittavaikutuksia ovat hyperkalsemia, perifeerinen turvotus, ruokahalu, kutina, masennus, huimaus, huimaus, päänsärky, hiusten oheneminen ja/tai osittainen hiustenlähtö ja emättimen kuivuus.
Premenopausaaliset naiset
Seuraavassa taulukossa on yhteenveto haittavaikutuksista, joita raportoitiin vähintään 2 %:lla kliinisistä tutkimuksista (Ingle, Pritchard, Buchanan), joissa verrattiin NOLVADEX-hoitoa (tamoksifeenisitraatti) munasarjojen ablaatioon premenopausaalisilla potilailla, joilla on metastaattinen rintasyöpä.
Miehen rintasyöpä
NOLVADEX (tamoksifeenisitraatti) on hyvin siedetty miehillä, joilla on rintasyöpä. Kirjallisuuden raportit ja tapausraportit viittaavat siihen, että NOLVADEXin (tamoksifeenisitraatti) turvallisuusprofiili miehillä on samanlainen kuin naisilla. Libidon menetys ja impotenssi ovat johtaneet tamoksifeenihoidon lopettamiseen miespotilailla. Myös tamoksifeenilla hoidetuilla oligospermisillä miehillä LH-, FSH-, testosteroni- ja estrogeenitasot olivat koholla. Merkittäviä kliinisiä muutoksia ei raportoitu.
Adjuvantti rintasyöpä
NSABP B-14 -tutkimuksessa naiset, joilla oli kainalosolmuke-negatiivinen rintasyöpä, satunnaistettiin saamaan 5 vuoden NOLVADEXia (tamoksifeenisitraattia) 20 mg/vrk tai lumelääkettä primaarisen leikkauksen jälkeen. Raportoidut haittavaikutukset on taulukoitu alla (keskimääräinen seuranta noin 6,8 vuotta), ja ne osoittavat, että haittatapahtumat ovat yleisempiä NOLVADEXilla (tamoksifeenisitraatti) kuin lumelääkkeellä. Kuumien aaltojen (64 % vs. 48 %), emätinvuotojen (30 % vs. 15 %) ja epäsäännöllisten kuukautisten (25 % vs. 19 %) esiintyvyys oli suurempi NOLVADEXilla (tamoksifeenisitraatti) verrattuna lumelääkkeeseen. Kaikki muut haittavaikutukset ilmenivät yhtä usein kahdessa hoitoryhmässä tromboottisia tapahtumia lukuun ottamatta; suurempi ilmaantuvuus havaittiin NOLVADEXilla (tamoksifeenisitraatti) hoidetuilla potilailla (5 vuoden ajan, 1,7 % vs. 0,4 %). Kaksi potilaista, joita hoidettiin NOLVADEXilla (tamoksifeenisitraatti), joilla oli tromboottisia tapahtumia, kuoli.
Eastern Cooperative Oncology Groupin (ECOG) adjuvanttirintasyöpätutkimuksessa NOLVADEXia (tamoksifeenisitraattia) tai lumelääkettä annettiin 2 vuoden ajan naisille rinnanpoiston jälkeen. Verrattuna lumelääkkeeseen NOLVADEX (tamoksifeenisitraatti) osoitti merkittävästi korkeampaa kuuman aaltojen ilmaantuvuutta (19 % vs. 8 % lumelääkkeessä). Kaikkien muiden haittavaikutusten ilmaantuvuus oli samanlainen kahdessa hoitoryhmässä, lukuun ottamatta trombosytopeniaa, jossa NOLVADEXin (tamoksifeenisitraatti) ilmaantuvuus oli 10 % vs. 3 % lumelääkettä saaneessa, mikä on tilastollisen merkitsevyyden rajahavainto.
Muissa adjuvanttitutkimuksissa Toronton ja NOLVADEXin (tamoksifeenisitraatti) Adjuvant Trial Organizationin (NATO) naiset saivat joko NOLVADEXia (tamoksifeenisitraattia) tai ei lainkaan hoitoa. Toronton tutkimuksessa kuumia aaltoja havaittiin 29 %:lla NOLVADEX-potilaista (tamoksifeenisitraatti) verrattuna 1 %:iin hoitamattomassa ryhmässä. NATO-tutkimuksessa kuumia aaltoja ja emättimen verenvuotoa raportoitiin 2,8 %:lla ja 2,0 %:lla NOLVADEXin (tamoksifeenisitraatti) naisista verrattuna 0,2 %:iin kummallakin hoitamattomassa ryhmässä.
Anastrotsolin adjuvanttitutkimus – Anastrotsolin tutkimus verrattuna NOLVADEXiin (tamoksifeenisitraatti) varhaisen rintasyövän adjuvanttihoidossa (katso KLIININEN FARMAKOLOGIA - Kliiniset tutkimukset).
Keskimääräisellä 33 kuukauden seurannalla anastrotsolin ja NOLVADEXin (tamoksifeenisitraatti) yhdistelmä ei osoittanut mitään tehokkuusetua verrattuna NOLVADEX-hoitoon (tamoksifeenisitraatti), joka annettiin yksinään kaikille potilaille sekä hormonireseptoripositiivisessa alapopulaatiossa. Tämä hoitohaara keskeytettiin tutkimuksesta. Adjuvanttihoidon keston mediaani turvallisuusarvioinnissa oli 59,8 kuukautta ja 59,6 kuukautta potilailla, jotka saivat anastrotsolia 1 mg ja NOLVADEXia (tamoksifeenisitraattia) 20 mg.
Seuraavassa taulukossa on esitetty haittatapahtumat, joiden ilmaantuvuus on vähintään 5 % kummassakin hoitoryhmässä hoidon aikana tai 14 päivän sisällä hoidon päättymisestä.
Haittatapahtumat, joiden ilmaantuvuus on vähintään 5 % kummassakin hoitoryhmässä hoidon aikana tai 14 päivän sisällä hoidon päättymisestä
Tietyt haittatapahtumat ja haittatapahtumien yhdistelmät määriteltiin ennakoivasti analysoitavaksi perustuen näiden kahden lääkkeen tunnettuihin farmakologisiin ominaisuuksiin ja sivuvaikutusprofiileihin (katso seuraava taulukko).
Niiden potilaiden lukumäärä (%), joilla on ennalta määritetty haittavaikutus anastrotsoliadjuvanttitutkimuksessa1
Anastrotsolia saaneilla potilailla nivelsairaudet (mukaan lukien niveltulehdus, niveltulehdus ja nivelsärky) lisääntyivät verrattuna potilaisiin, jotka saivat NOLVADEXia (tamoksifeenisitraatti). Anastrotsolia saaneilla potilailla oli lisääntynyt kaikkien murtumien (erityisesti selkärangan, lonkan ja ranteen murtumien) ilmaantuvuus [315 (10 %)] verrattuna potilaisiin, jotka saivat NOLVADEXia (tamoksifeenisitraatti) [209 (7 %)]. Anastrotsolia saaneilla potilailla oli vähemmän kuumia aaltoja, emättimen verenvuotoa, emätinvuotoa, kohdun limakalvon syöpää, laskimotromboembolisia tapahtumia ja iskeemisiä aivoverisuonitapahtumia verrattuna potilaisiin, jotka saivat NOLVADEXia (tamoksifeenisitraatti).
NOLVADEXia (tamoksifeenisitraattia) saaneiden potilaiden hyperkolesterolemia väheni (108 [3,5 %) verrattuna anastrotsolia saaneisiin potilaisiin (278 [9 %). Angina pectorista raportoitiin 71 [2,3 %] potilaalla anastrotsolihaarassa ja 51 [1,6 %] potilaalla NOLVADEX (tamoksifeenisitraatti) -haarassa; sydäninfarkti raportoitiin 37 [1,2 %] potilaalla anastrotsolihaarassa ja 34 [1,1 %] potilaalla NOLVADEX (tamoksifeenisitraatti) -haarassa.
Adjuvanttitutkimuksen luun alatutkimuksen tulokset 12 ja 24 kuukauden kohdalla osoittivat, että anastrotsolia saaneiden potilaiden sekä lannerangan että lonkan luun mineraalitiheyden (BMD) keskimääräinen lasku lähtötasoon verrattuna. NOLVADEXia (tamoksifeenisitraattia) saaneilla potilailla sekä lannerangan että lonkan luun mineraalitiheys lisääntyi keskimäärin lähtötasoon verrattuna.
Ductal Carcinoma in Situ (DCIS)
Haittavaikutusten tyyppi ja esiintymistiheys NSABP B-24 -tutkimuksessa olivat yhdenmukaisia muiden NOLVADEX-valmisteella (tamoksifeenisitraatti) tehdyissä adjuvanttitutkimuksissa havaittujen kanssa.
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla
NSABP P-1 -tutkimuksessa NOLVADEX-ryhmässä (tamoksifeenisitraatti) lisääntyi viisi vakavaa haittavaikutusta: kohdun limakalvosyöpä (33 tapausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) vs. 14 lumeryhmässä); keuhkoembolia (18 tapausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) vs. 6 plaseboryhmässä); syvä laskimotukos (30 tapausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) vs. 19 plaseboryhmässä); aivohalvaus (34 tapausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) vs. 24 lumeryhmässä); kaihi muodostuminen (540 tapausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) vs. 483 lumelääkeryhmässä) ja kaihileikkaus (101 tapausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) vs. 63 lumeryhmässä) (katso VAROITUKSET ja Taulukko 3 KLIININEN FARMAKOLOGIA ).
Seuraavassa taulukossa on esitetty NSABP P-1:ssä havaitut haittatapahtumat hoitoryhmittäin. Vain haittatapahtumat, jotka ovat yleisempiä NOLVADEXissa (tamoksifeenisitraatti) kuin lumelääkkeessä, näytetään.
NSABP P-1 -tutkimuksessa 15,0 % ja 9,7 % NOLVADEX-hoitoa (tamoksifeenisitraattia) ja lumelääkehoitoa saaneista osallistujista vetäytyi lääketieteellisistä syistä. Seuraavat ovat lääketieteelliset syyt lopettaa NOLVADEX (tamoksifeenisitraatti) ja lumelääke, vastaavasti: Kuumat aallot (3,1 % vs. 1,5 %) ja emättimen vuoto (0,5 % vs. 0,1 %).
NSABP P-1 -tutkimuksessa 8,7 % NOLVADEXia (tamoksifeenisitraattia) ja lumelääkehoitoa saaneista osallistujista 9,6 % vetäytyi ei-lääketieteellisistä syistä.
NSABP P-1 -tutkimuksessa minkä tahansa vaikeusasteen kuumia aaltoja esiintyi 68 %:lla lumelääkettä saaneista naisista ja 80 %:lla NOLVADEXia (tamoksifeenisitraattia) saaneista naisista. Vakavia kuumia aaltoja esiintyi 28 %:lla lumelääkettä saaneista naisista ja 45 %:lla NOLVADEXia (tamoksifeenisitraattia) saaneista naisista. Emätinvuotoa esiintyi 35 %:lla lumelääkettä saaneista naisista ja 55 %:lla NOLVADEXia (tamoksifeenisitraattia) saaneista naisista. ja oli vakava 4,5 %:lla ja 12,3 %:lla. Emättimen verenvuodon ilmaantuvuudessa ei ollut eroa hoitoryhmien välillä.
Lapsipotilaat - McCune-Albrightin oireyhtymä
Keskimääräinen kohdun tilavuus kasvoi 6 kuukauden hoidon jälkeen ja kaksinkertaistui vuoden kestäneen tutkimuksen lopussa. Syy-yhteyttä ei ole vahvistettu; kuitenkin, koska endometriumin adenokarsinooman ja kohdun sarkooman ilmaantuvuuden on havaittu lisääntyneen NOLVADEX-hoitoa saaneilla aikuisilla (ks. LAATIKKO VAROITUS ), suositellaan jatkuvaa seurantaa McCune-Albright-potilailla, joita hoidetaan NOLVADEXilla (tamoksifeenisitraatti) pitkäaikaisten vaikutusten varalta. NOLVADEXin (tamoksifeenisitraatti) turvallisuutta ja tehoa 2–10-vuotiaille tytöille, joilla on McCune-Albrightin oireyhtymä ja varhainen murrosikä, ei ole tutkittu yli vuoden hoidon. NOLVADEX-hoidon (tamoksifeenisitraatti) pitkäaikaisia vaikutuksia tytöillä ei ole varmistettu.
Markkinoinnin jälkeistä kokemusta
Harvemmin raportoituja haittavaikutuksia ovat verenvuoto emättimestä, vuoto emättimestä, kuukautiskierron epäsäännöllisyys, ihottuma ja päänsärky. Yleensä nämä eivät ole olleet niin vakavia, että ne vaatisivat annoksen pienentämistä tai hoidon lopettamista. NOLVADEX (tamoksifeenisitraatti) -hoidon yhteydessä on raportoitu erittäin harvoin erythema multiforme, Stevens-Johnsonin oireyhtymä, bullous pemfigoid, interstitiaalinen keuhkotulehdus ja harvinaisia raportteja yliherkkyysreaktioista, mukaan lukien angioödeema. Joissakin näistä tapauksista alkamisaika oli yli vuosi. Harvoin seerumin triglyseridipitoisuuden nousu, joissakin tapauksissa haimatulehdus, voi liittyä NOLVADEXin (tamoksifeenisitraatti) käyttöön (ks. VAROTOIMET- Lääke/laboratoriotestien yhteisvaikutukset jakso).
HUUMEIDEN VUOROVAIKUTUKSET
Kun NOLVADEXia (tamoksifeenisitraattia) käytetään yhdessä kumariinityyppisten antikoagulanttien kanssa, antikoagulanttivaikutus voi lisääntyä merkittävästi. Jos tällaista yhteiskäyttöä on olemassa, potilaan protrombiiniajan huolellista seurantaa suositellaan.
NSABP P-1 -tutkimuksessa naiset, jotka tarvitsivat kumariinityyppisiä antikoagulantteja mistä tahansa syystä, eivät olleet oikeutettuja osallistumaan tutkimukseen (katso VASTA-AIHEET ).
Tromboembolisten tapahtumien riski on lisääntynyt, kun sytotoksisia aineita käytetään yhdessä NOLVADEXin (tamoksifeenisitraatti) kanssa.
Tamoksifeeni alensi letrotsolin pitoisuutta plasmassa 37 %. Tamoksifeenin vaikutusta muiden antineoplastisten lääkkeiden, kuten syklofosfamidin ja muiden sellaisten lääkkeiden metaboliaan ja erittymiseen, jotka vaativat aktivoituakseen sekatoimintoisia oksidaaseja, ei tunneta. Tamoksifeenin ja N-desmetyylitamoksifeenin plasmapitoisuuksien on osoitettu pienenevän, kun niitä annetaan samanaikaisesti rifampiinin tai aminoglutetimidin kanssa. CYP3A4-välitteisen metabolian induktion katsotaan olevan mekanismi, jolla nämä vähentymiset tapahtuvat; muita CYP3A4:ää indusoivia aineita ei ole tutkittu tämän vaikutuksen vahvistamiseksi.
Yhdellä potilaalla, joka sai NOLVADEXia (tamoksifeenisitraattia) samanaikaisesti fenobarbitaalin kanssa, tamoksifeenin vakaan tilan seerumitaso oli alhaisempi kuin muilla potilailla (eli 26 ng/ml vs. keskiarvo 122 ng/ml). Tämän löydön kliinistä merkitystä ei kuitenkaan tunneta. Rifampiini indusoi tamoksifeenin metaboliaa ja pienensi merkittävästi tamoksifeenin pitoisuutta plasmassa 10 potilaalla. Aminoglutetimidi alentaa tamoksifeenin ja N-desmetyylitamoksifeenin pitoisuuksia plasmassa. Medroksiprogesteroni alentaa plasman N-desmetyylin, mutta ei tamoksifeenin, pitoisuuksia.
Samanaikaisen bromokriptiinihoidon on osoitettu nostavan seerumin tamoksifeeni- ja N-desmetyylitamoksifeenipitoisuutta.
Anastrotsolin adjuvanttitutkimuksen kliinisten ja farmakokineettisten tulosten perusteella NOLVADEXia (tamoksifeenisitraattia) ei pidä antaa anastrotsolin kanssa (ks. KLIININEN FARMAKOLOGIA - Lääkkeiden väliset vuorovaikutukset jakso).
Lääke/laboratoriotestien vuorovaikutukset
Markkinoille tulon jälkeisen seurannan aikana T4-arvon kohoamista raportoitiin muutamilla postmenopausaalisilla potilailla, mikä saattaa johtua kilpirauhasta sitovan globuliinin lisääntymisestä. Näihin nousuihin ei liittynyt kliinistä kilpirauhasen liikatoimintaa.
Vaihtelua emätinnäytteiden karyopyknoottisessa indeksissä ja eriasteista estrogeenivaikutusta Pap-kokeissa on havaittu harvoin postmenopausaalisilla potilailla, joille on annettu NOLVADEXia (tamoksifeenisitraatti).
NOLVADEXin (tamoksifeenisitraatti) markkinoille tulon jälkeisessä kokemuksessa on raportoitu harvoin esiintyviä hyperlipidemiatapauksia. Plasman triglyseridien ja kolesterolin määräajoin seuranta saattaa olla aiheellista potilaille, joilla on jo hyperlipidemia (ks. HAITTAVAIKUTUKSET - Markkinoinnin jälkeinen kokemus jakso).
VAROITUKSET
Vaikutukset metastaattisille rintasyöpäpotilaille
Kuten muunkin lisähormonihoidon (estrogeenit ja androgeenit) yhteydessä, hyperkalsemiaa on raportoitu joillakin rintasyöpäpotilailla, joilla on luumetastaaseja muutaman viikon kuluessa NOLVADEX-hoidon (tamoksifeenisitraatti) aloittamisesta. Jos hyperkalsemiaa esiintyy, on ryhdyttävä asianmukaisiin toimenpiteisiin ja, jos se on vakava, NOLVADEX (tamoksifeenisitraatti) on lopetettava.
Vaikutukset kohdun endometriumin syöpään ja kohdun sarkoomaan
Kohdun pahanlaatuisten kasvainten ilmaantuvuuden on raportoitu lisääntyneen NOLVADEX-hoidon (tamoksifeenisitraatti) yhteydessä. Taustalla olevaa mekanismia ei tunneta, mutta se voi liittyä NOLVADEXin (tamoksifeenisitraatti) estrogeenin kaltaiseen vaikutukseen. Useimmat NOLVADEXin (tamoksifeenisitraatti) yhteydessä havaitut kohdun pahanlaatuiset kasvaimet luokitellaan kohdun limakalvon adenokarsinoomaksi. Harvinaisia kohdun sarkoomeja, mukaan lukien pahanlaatuiset sekakuumorit (MMMT) mukaan lukien, on kuitenkin raportoitu. Kohdun sarkooma liittyy yleensä korkeampaan FIGO-vaiheeseen (III/IV) diagnoosin yhteydessä, huonompaan ennusteeseen ja lyhyempään eloonjäämiseen. Kohdun sarkooman on raportoitu esiintyvän useammin NOLVADEXin (tamoksifeenisitraatti) pitkäaikaisilla käyttäjillä (≥ 2 vuotta) kuin ei-käyttäjillä. Jotkut kohdun pahanlaatuisista kasvaimista (endometriumin karsinooma tai kohdun sarkooma) ovat olleet kohtalokkaita.
NSABP P-1 -tutkimuksessa NOLVADEXiin (tamoksifeenisitraatti) satunnaistettujen osallistujien joukossa kohdun limakalvosyövän ilmaantuvuus lisääntyi tilastollisesti merkitsevästi (33 invasiivista kohdun limakalvosyöpää verrattuna 14 tapaukseen lumelääkkeeseen satunnaistetuissa osallistujissa (RR=2,48). , 95 % CI: 1,27-4,92). NOLVADEXia (tamoksifeenisitraattia) saaneiden osallistujien 33 tapausta olivat FIGO-vaiheen I, mukaan lukien 20 IA, 12 IB ja 1 IC kohdun limakalvon adenokarsinooma. Lumeryhmään satunnaistetuista osallistujista 13 oli FIGO-vaiheen I (8 IA ja 5 IB) ja 1 oli FIGO Stage IV. Viisi naista, jotka saivat NOLVADEXia (tamoksifeenisitraatti) ja 1 lumelääkettä, sai leikkauksen lisäksi leikkauksen jälkeistä sädehoitoa. Tämä kasvu havaittiin pääasiassa vähintään 50-vuotiailla naisilla. satunnaistamisen aika (26 invasiivista kohdun limakalvon syöpää, verrattuna 6 tapaukseen lumelääkettä saaneiden osallistujien keskuudessa (RR=4,50, 95 % CI: 1,78-13,16). Satunnaistamisen aikaan ≤ 49-vuotiailla naisilla oli 7 tapausta i nvasiivinen kohdun limakalvosyöpä verrattuna 8 tapaukseen lumelääkettä saaneiden osallistujien keskuudessa (RR = 0,94, 95 % CI: 0,28-2,89). Jos ikä diagnoosihetkellä otetaan huomioon, 4 kohdun limakalvon syöpätapausta oli 49-vuotiaiden osallistujien joukossa, jotka satunnaistettiin NOLVADEXiin (tamoksifeenisitraatti), kun taas lumelääkettä saaneiden joukossa 2 (RR=2,21, 95 %:n luottamusväli: 0,4–12,0). Diagnoosihetkellä ≥ 50-vuotiaista naisista NOLVADEXiin (tamoksifeenisitraatti) satunnaistettujen osallistujien joukossa oli 29 tapausta verrattuna lumelääkettä saaneiden naisten 12 tapaukseen (RR = 2,5, 95 % CI: 1,3-4,9). Riskisuhteet olivat samanlaiset kahdessa ryhmässä, vaikka nuoremmilla naisilla tapahtui vähemmän tapahtumia. Suurin osa (29 tapauksesta 33 tapauksesta NOLVADEX-ryhmässä (tamoksifeenisitraatti)) kohdun limakalvon syövistä diagnosoitiin oireellisilla naisilla, vaikka 5 tapauksesta 33 NOLVADEX-ryhmässä (tamoksifeenisitraatti) esiintyi oireettomilla naisilla. NOLVADEXia (tamoksifeenisitraattia) saaneilla naisilla tapahtumat ilmenivät 1–61 kuukauden (keskiarvo = 32 kuukautta) hoidon alusta.
Päivitetyssä pitkän aikavälin tietojen katsauksessa (kokonaisseurannan mediaanipituus on 6,9 vuotta, mukaan lukien sokkoutettu seuranta) 8 306 naisella, joilla oli ehjä kohtu satunnaistuksessa NSABP P-1 -riskinvähennystutkimuksessa, molempien ilmaantuvuus adenokarsinoomat ja harvinaiset kohdun sarkoomit lisääntyivät NOLVADEXia (tamoksifeenisitraattia) käyttävillä naisilla. Sokkoutetun seurannan aikana todettiin 36 FIGO-vaiheen I kohdun limakalvon adenokarsinooman tapausta (22 oli FIGO-vaiheen IA, 13 IB ja 1 IC) NOLVADEXia (tamoksifeenisitraattia) saaneilla naisilla ja 15 tapausta lumelääkettä saaneilla naisilla [14 oli FIGO-vaiheen I (9 IA ja 5 IB) ja 1 tapaus oli FIGO-vaihe IV]. NOLVADEXia (tamoksifeenisitraattia) saaneista potilaista, joille kehittyi kohdun limakalvon syöpä, yksi, jolla oli vaiheen IA syöpä ja neljä IB-vaiheen syöpää, sai sädehoitoa. Lumeryhmässä yksi potilas, jolla oli FIGO-vaiheen 1B syöpä, sai sädehoitoa ja potilas, jolla oli FIGO-vaiheen IVB syöpä, kemoterapiaa ja hormonihoitoa. Kokonaisseurannan aikana kohdun limakalvon adenokarsinooma raportoitiin 53 naisella, jotka satunnaistettiin NOLVADEXiin (tamoksifeenisitraatti) (30 FIGO-tapausta IA, 20 oli vaihe IB, 1 oli vaihe IC ja 2 oli vaihe IIIC) ja 17 naista satunnaistettiin lumelääkettä (9 tapausta oli FIGO-vaihe IA, 6 tapausta vaihe IB, 1 vaihe IIIC ja 1 vaihe IVB) (esiintyvyys 1 000 naisvuotta kohden 2,20 ja 0,71). Jotkut potilaat saivat leikkauksen lisäksi sädehoitoa leikkauksen jälkeen. Kohdun sarkoomia raportoitiin 4 naisella, jotka satunnaistettiin NOLVADEXiin (tamoksifeenisitraatti) (1 oli FIGO IA, 1 oli FIGO IB, 1 oli FIGO IIA ja 1 oli FIGO IIIC) ja yksi potilas satunnaistettiin lumelääkkeeseen (KUVA 1A); ilmaantuvuus 1 000 naisvuotta kohden 0,17 ja 0,04. NOLVADEXiin (tamoksifeenisitraatti) satunnaistetuista potilaista FIGO IA- ja IB-tapaukset olivat MMMT ja sarkooma, vastaavasti; FIGO II oli MMMT; ja FIGO III oli sarkooma; ja yhdellä lumelääkkeeseen satunnaistetulla potilaalla oli MMMT. Samanlainen lisääntynyt endometriumin adenokarsinooman ja kohdun sarkooman ilmaantuvuus havaittiin naisilla, jotka saivat NOLVADEXia (tamoksifeenisitraattia) viidessä muussa NSABP-kliinisessä tutkimuksessa.
Jokainen potilas, joka saa tai on aiemmin saanut NOLVADEXia (tamoksifeenisitraattia), joka ilmoittaa epänormaalista emättimen verenvuodosta, on arvioitava välittömästi. Potilaiden, jotka saavat tai ovat aiemmin saaneet NOLVADEXia (tamoksifeenisitraattia), tulee käydä vuosittain gynekologisissa tutkimuksissa ja heidän tulee välittömästi ilmoittaa lääkärilleen, jos heillä on epänormaaleja gynekologisia oireita, kuten kuukautiskierron epäsäännöllisyyttä, epänormaalia emättimen verenvuotoa, muutoksia emättimessä tai lantion kipua tai paine.
P-1-tutkimuksessa kohdun limakalvon näytteenotto ei muuttanut kohdun limakalvosyövän havaitsemisastetta verrattuna naisiin, joille ei otettu kohdun limakalvonäytteitä (0,6 % näytteenoton kanssa, 0,5 % ilman näytteenottoa) naisilla, joilla oli ehjä kohtu. Ei ole olemassa tietoja, jotka viittaavat siihen, että rutiininomainen kohdun limakalvon näytteenotto oireettomilla naisilla, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) rintasyövän esiintyvyyden vähentämiseksi, olisi hyödyllistä.
Ei-pahanlaatuiset vaikutukset kohtuun
NOLVADEX-hoidon (tamoksifeenisitraatti) yhteydessä on raportoitu lisääntyneen kohdun limakalvon muutosten, mukaan lukien hyperplasia ja polyypit, ilmaantuvuus. Tämän kasvun esiintyvyys ja kuvio viittaavat siihen, että taustalla oleva mekanismi liittyy NOLVADEXin (tamoksifeenisitraatti) estrogeenisiin ominaisuuksiin.
NOLVADEXia (tamoksifeenisitraattia) saaneilla naisilla on raportoitu muutamia endometrioosia ja kohdun fibroideja. Taustalla oleva mekanismi voi johtua NOLVADEXin (tamoksifeenisitraatti) osittaisesta estrogeenisesta vaikutuksesta. Munasarjakystat on havaittu myös pienellä määrällä premenopausaalisilla potilailla, joilla on edennyt rintasyöpä ja joita on hoidettu NOLVADEXilla (tamoksifeenisitraatti).
NOLVADEXin (tamoksifeenisitraatti) on raportoitu aiheuttavan kuukautiskierron epäsäännöllisyyttä tai kuukautisia.
NOLVADEXin (tamoksifeenisitraatin) tromboemboliset vaikutukset
On näyttöä tromboembolisten tapahtumien, mukaan lukien syvän laskimotukoksen ja keuhkoembolian, lisääntymisestä NOLVADEX-hoidon (tamoksifeenisitraatti) aikana. Kun NOLVADEXia (tamoksifeenisitraattia) annetaan samanaikaisesti kemoterapian kanssa, tromboembolisten vaikutusten esiintyvyys voi lisääntyä edelleen. Rintasyövän hoidossa NOLVADEXin (tamoksifeenisitraatti) riskejä ja etuja on harkittava huolellisesti naisilla, joilla on ollut tromboembolisia tapahtumia. Pienessä NSABP P-1 -tutkimuksen alatutkimuksessa (N=81) ei näyttänyt olevan mitään hyötyä naisten seulonnasta tekijä V Leiden- ja protrombiinimutaatioiden G20210A varalta keinona tunnistaa ne, jotka eivät ehkä ole sopivia ehdokkaita NOLVADEXiin (tamoksifeeni). sitraatti) hoitoon.
NSABP P-1 -tutkimuksen tiedot osoittavat, että osallistujilla, jotka saivat NOLVADEXia (tamoksifeenisitraattia) ilman keuhkoembolia (PE), keuhkoemboliat lisääntyivät tilastollisesti merkitsevästi (18-NOLVADEX (tamoksifeenisitraatti), 6-plasebo, RR=3,01 , 95 % CI: 1,15-9,27). Kolme keuhkoembolista, kaikki NOLVADEX (tamoksifeenisitraatti) -haarassa, olivat kohtalokkaita. Kahdeksankymmentäseitsemän prosenttia keuhkoemboliatapauksista esiintyi vähintään 50-vuotiailla naisilla satunnaistuksen yhteydessä. NOLVADEXia (tamoksifeenisitraattia) saaneilla naisilla tapahtumat ilmenivät 2-60 kuukauden (keskiarvo = 27 kuukautta) hoidon alusta.
Tässä samassa populaatiossa ei tilastollisesti merkitsevä lisääntyminen syvälaskimotromboosissa (DVT) NOLVADEX (tamoksifeenisitraatti) -ryhmässä (30-NOLVADEX (tamoksifeenisitraatti), 19- lumelääke; RR = 1,59, 95 % CI: 0,86 -2,98). Suhteellisen riskin lisääntyminen oli sama ≤ 49-vuotiailla ja ≥ 50-vuotiailla naisilla, vaikka tapahtumia esiintyi vähemmän nuoremmilla naisilla. Naisilla, joilla oli tromboembolisia tapahtumia, oli riski saada toinen asiaan liittyvä tapahtuma (7 25:stä lumelääkettä saaneesta naisesta, 5 naisella 48:sta NOLVADEXia (tamoksifeenisitraattia) saaneesta) ja heillä oli riski saada tapahtuman ja sen hoidon komplikaatioita (0/25 lumelääke, 4/48 NOLVADEXilla (tamoksifeenisitraatti)). NOLVADEXia (tamoksifeenisitraattia) saaneilla naisilla syvä laskimotukostapahtumia esiintyi 2-57 kuukauden (keskiarvo = 19 kuukautta) hoidon alusta.
Aivohalvauksen lisääntyminen ei ollut tilastollisesti merkitsevää potilailla, jotka oli satunnaistettu NOLVADEXiin (tamoksifeenisitraatti) (24-Placebo; 34-NOLVADEX (tamoksifeenisitraatti); RR = 1,42; 95 % CI 0,82-2,51). Kuusi lumelääkeryhmän 24 aivohalvauksesta katsottiin alkuperältään verenvuotoiseksi ja 10 34 aivohalvauksesta NOLVADEX-ryhmässä (tamoksifeenisitraatti) luokiteltiin hemorragiseksi. Seitsemäntoista 34 aivohalvauksesta NOLVADEX-ryhmässä (tamoksifeenisitraatti) katsottiin okklusiivisiksi ja 7:ää pidettiin tuntemattoman etiologian vuoksi. Neljätoista lumelääkettä saaneen haaran 24 aivohalvauksesta ilmoitettiin olevan okkluusio ja 4 tuntematon etiologia. Näistä aivohalvauksista 3 aivohalvausta lumeryhmässä ja 4 aivohalvausta NOLVADEX-ryhmässä (tamoksifeenisitraatti) olivat kohtalokkaita. Kahdeksankymmentäkahdeksan prosenttia aivohalvauksista tapahtui naisilla, jotka olivat vähintään 50-vuotiaita satunnaistamisen aikaan. NOLVADEXia (tamoksifeenisitraattia) saaneilla naisilla tapahtumat ilmenivät 1 - 63 kuukauden välillä (keskiarvo = 30 kuukautta) hoidon aloittamisesta.
Vaikutukset maksaan: Maksasyöpä
Ruotsalaisessa tutkimuksessa, jossa käytettiin adjuvanttia NOLVADEXia (tamoksifeenisitraatti) 40 mg/vrk 2-5 vuoden ajan, NOLVADEXilla (tamoksifeenisitraatti) hoidetussa ryhmässä on raportoitu 3 maksasyövän tapausta verrattuna 1 tapaukseen havainnointiryhmässä (katso VAROTOIMET- Karsinogeneesi ). Muissa kliinisissä tutkimuksissa, joissa arvioitiin NOLVADEXia (tamoksifeenisitraattia), maksasyöpätapauksia ei ole raportoitu tähän mennessä.
Yksi maksasyövän tapaus raportoitiin NSABP P-1:ssä osallistujalla, joka oli satunnaistettu NOLVADEXiin (tamoksifeenisitraatti).
Vaikutukset maksaan: Ei-pahanlaatuiset vaikutukset
NOLVADEX (tamoksifeenisitraatti) on yhdistetty muutoksiin maksaentsyymitasoissa ja harvoissa tapauksissa useisiin vaikeampiin maksahäiriöihin, mukaan lukien rasvamaksa, kolestaasi, hepatiitti ja maksanekroosi. Muutamat näistä vakavista tapauksista sisälsivät kuolemantapauksia. Useimmissa raportoiduissa tapauksissa suhde NOLVADEXiin (tamoksifeenisitraatti) on epävarma. Joitakin positiivisia uudelleenhaasteita ja haasteita on kuitenkin raportoitu.
NSABP P-1 -tutkimuksessa havaittiin muutamia asteen 3-4 muutoksia maksan toiminnassa (SGOT, SGPT, bilirubiini, alkalinen fosfataasi) (10 lumelääkkeellä ja 6 NOLVADEXilla (tamoksifeenisitraatti)). Seerumin lipidejä ei kerätty systemaattisesti.
Muut syövät
Useita toisia primaarisia kasvaimia, joita esiintyy muissa paikoissa kuin endometriumissa, on raportoitu rintasyövän NOLVADEX-hoidon (tamoksifeenisitraatti) jälkeen kliinisissä tutkimuksissa. NSABP B-14- ja P-1-tutkimuksista saadut tiedot eivät osoita muiden (muiden kuin kohdun) syöpien lisääntymistä potilailla, jotka saavat NOLVADEXia (tamoksifeenisitraatti). Se, liittyykö NOLVADEXiin (tamoksifeenisitraatti) muiden (muiden kuin kohdun) syöpien riski, on edelleen epävarmaa, ja sitä arvioidaan edelleen.
Vaikutukset silmiin
Silmähäiriöitä, mukaan lukien sarveiskalvon muutokset, värinäön heikkeneminen, verkkokalvon laskimotromboosi ja retinopatia, on raportoitu potilailla, jotka ovat saaneet NOLVADEXia (tamoksifeenisitraatti). Kaihien esiintyvyyden lisääntymistä ja kaihileikkauksen tarvetta on raportoitu potilailla, jotka saavat NOLVADEXia (tamoksifeenisitraatti).
NSABP P-1 -tutkimuksessa kaihien kehittymisen rajamerkityksen riski oli lisääntynyt niillä naisilla, joilla ei ollut kaihia lähtötilanteessa (540-NOLVADEX (tamoksifeenisitraatti); 483- lumelääke; RR = 1,13, 95 % CI: 1,00-1,28). havaittu. Näillä samoilla naisilla NOLVADEX (tamoksifeenisitraatti) liittyi lisääntyneeseen kaihileikkauksen riskiin (101-NOLVADEX (tamoksifeenisitraatti) ; 63- lumelääke; RR = 1,62, 95 % CI 1,18-2,22) (katso taulukko 3 KLIININEN FARMAKOLOGIA ). Kaikilla tutkimuksessa osallistuneilla naisilla (kaihia tai ilman lähtötasoa) NOLVADEX (tamoksifeenisitraatti) liittyi lisääntyneeseen kaihileikkauksen riskiin (201-NOLVADEX (tamoksifeenisitraatti); 129-plasebo; RR = 1,58, 95 % luottamusväli 1,26-1,97). Näöntarkastusta ei vaadittu tutkimuksen aikana. Muita johtopäätöksiä ei-kaihiin liittyvistä oftalmistisista tapahtumista ei voida tehdä.
Raskausluokka D
NOLVADEX (tamoksifeenisitraatti) voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Naisia tulee neuvoa olemaan raskaaksi NOLVADEXin (tamoksifeenisitraatti) käytön aikana tai 2 kuukauden kuluessa NOLVADEXin (tamoksifeenisitraatti) lopettamisesta, ja heidän tulee käyttää este- tai ei-hormonaalisia ehkäisymenetelmiä, jos he ovat seksuaalisesti aktiivisia. Tamoksifeeni ei aiheuta hedelmättömyyttä edes kuukautiskierron epäsäännöllisyydessä. Lääkkeen antiestrogeenisten ominaisuuksien odotetaan vaikuttavan lisääntymistoimintoihin. Rotilla tehdyissä lisääntymistutkimuksissa annoksilla, jotka olivat yhtä suuria tai pienempiä kuin ihmisannos, havaittiin ei-teratogeenisiä luuston kehitysmuutoksia, jotka havaittiin palautuviksi. Lisäksi rotilla tehdyissä hedelmällisyystutkimuksissa ja kaniineilla tehdyissä teratologisissa tutkimuksissa, joissa käytettiin ihmisillä käytettyjä annoksia tai pienempiä annoksia, havaittiin pienempi alkion istuttamisen ilmaantuvuus ja suurempi sikiökuoleman ilmaantuvuus tai hidastuneen kohdun kasvun ilmaantuvuus ja hitaampi oppimiskäyttäytyminen joitakin rotanpentuja verrattuna historiallisiin kontrolleihin. Useille tiineille marmosetteille annettiin 10 mg/kg/vrk (noin 2-kertainen ihmiselle suositeltuun vuorokausiannokseen mg/m²:n perusteella) organogeneesin aikana tai raskauden viimeisellä puoliskolla. Epämuodostumia ei havaittu, ja vaikka annos oli riittävän suuri raskauden keskeyttämiseen joillakin eläimillä, ne, jotka säilyttivät tiineyden, eivät osoittaneet merkkejä teratogeenisista epämuodostumista.
Sikiön lisääntymiskanavan kehityksen jyrsijämalleissa tamoksifeeni (annoksilla 0,002–2,4-kertainen ihmisen suurin suositeltu päivittäinen annos mg/m²:n perusteella) aiheutti molemmissa sukupuolissa samanlaisia muutoksia kuin estradiolin, etynyyliestradiolin ja dietyylistilbestrolin aiheuttamat muutokset. Vaikka näiden muutosten kliinistä merkitystä ei tunneta, jotkin näistä muutoksista, erityisesti emättimen adenoosi, ovat samanlaisia kuin nuorilla naisilla, jotka ovat altistuneet dietyylistilbestrolille kohdussa ja joilla on 1:1000:n riski saada kirkassoluinen adenokarsinooma. vagina tai kohdunkaula. Tähän mennessä kohdussa altistumisen tamoksifeenille ei ole osoitettu aiheuttavan emättimen adenooosia tai emättimen tai kohdunkaulan kirkassoluista adenokarsinoomaa nuorilla naisilla. Kuitenkin vain pieni määrä nuoria naisia on altistunut tamoksifeenille kohdussa, ja pienempää määrää on seurattu riittävän kauan (15–20-vuotiaaksi asti) sen määrittämiseksi, voiko tämä altistuminen aiheuttaa emättimen tai kohdunkaulan neoplasiaa.
Tamoksifeenista ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Pieni määrä raportteja on raportoitu emättimen verenvuodosta, spontaaneista aborteista, synnynnäisistä epämuodostumista ja sikiökuoleista raskaana olevilla naisilla. Jos tätä lääkettä käytetään raskauden aikana tai potilas tulee raskaaksi tämän lääkkeen käytön aikana tai noin kahden kuukauden kuluessa hoidon lopettamisesta, potilas tulee olla tietoinen sikiölle mahdollisesti aiheutuvista riskeistä, mukaan lukien mahdollinen pitkäaikainen DES- kuten syndrooma.
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla – raskausluokka D
Seksuaalisesti aktiivisille hedelmällisessä iässä oleville naisille NOLVADEX (tamoksifeenisitraatti) -hoito tulee aloittaa kuukautisten aikana. Naisilla, joilla on epäsäännöllinen kuukautiskierto, riittää negatiivinen B-HCG juuri ennen hoidon aloittamista (ks. VAROTOIMENPITEET - TIETOA POTILAATILLE - Rintasyövän ilmaantuvuuden vähentäminen korkean riskin naisilla ).
VAROTOIMENPITEET
Kenraali
Verihiutaleiden määrän laskua, yleensä arvoon 50 000-100 000/mm³, harvoin pienempi, on raportoitu satunnaisesti potilailla, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) rintasyöpään. Potilailla, joilla on merkittävä trombosytopenia, on esiintynyt harvinaisia verenvuotojaksoja, mutta on epävarmaa, johtuvatko nämä jaksot NOLVADEX-hoidosta (tamoksifeenisitraatti). Leukopeniaa on havaittu, joskus yhdistettynä anemiaan ja/tai trombosytopeniaan. Neutropeniasta ja pansytopeniasta on raportoitu harvoin NOLVADEXia (tamoksifeenisitraattia) saaneilla potilailla; tämä voi joskus olla vakavaa.
NSABP P-1 -tutkimuksessa 6 NOLVADEXia (tamoksifeenisitraattia) saaneella naisella ja 2 lumelääkettä saaneella naisella verihiutaleiden määrä laski asteittain 3–4 (≤ 50 000/mm³).
Tietoa potilaille
Potilaita tulee neuvoa lukemaan Lääkitysopas toimitetaan lain edellyttämällä tavalla, kun NOLVADEX 10 mg annostellaan. Koko teksti Lääkitysopas on painettu uudelleen tämän asiakirjan lopussa.
Invasiivisen rintasyövän ja DCIS:n väheneminen naisilla, joilla on DCIS
Naisten, joilla on DCIS, joita hoidetaan lumpektomialla ja sädehoidolla ja jotka harkitsevat NOLVADEXin (tamoksifeenisitraatti) käyttöä pienentääkseen toisen rintasyöpätapahtuman esiintyvyyttä, tulee arvioida hoidon riskit ja hyödyt, koska NOLVADEX-hoito (tamoksifeenisitraatti) vähensi invasiivisten rintojen ilmaantuvuutta syöpä, mutta sen ei ole osoitettu vaikuttavan eloonjäämiseen (katso taulukko 1 KLIININEN FARMAKOLOGIA ).
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla
Naiset, joilla on korkea riski sairastua rintasyöpään, voivat harkita NOLVADEX-hoidon (tamoksifeenisitraatti) ottamista vähentääkseen rintasyövän ilmaantuvuutta. Se, katsotaanko hoidon hyötyjen olevan riskejä suurempi, riippuu naisen henkilökohtaisesta terveyshistoriasta ja siitä, kuinka hän punnii hyödyt ja riskit. NOLVADEX (tamoksifeenisitraatti) -hoito rintasyövän esiintyvyyden vähentämiseksi ei siksi välttämättä sovi kaikille naisille, joilla on korkea rintasyövän riski. Naisten, jotka harkitsevat NOLVADEX- (tamoksifeenisitraatti) -hoitoa, tulee neuvotella terveydenhuollon ammattilaisen kanssa mahdollisten hyötyjen ja riskien arvioimiseksi ennen rintasyövän ilmaantuvuuden vähentämistä koskevan hoidon aloittamista (katso taulukko 3 KLIININEN FARMAKOLOGIA ). Naisten tulisi ymmärtää, että NOLVADEX (tamoksifeenisitraatti) vähentää rintasyövän ilmaantuvuutta, mutta ei välttämättä poista riskiä. NOLVADEX (tamoksifeenisitraatti) vähensi pienten estrogeenireseptoripositiivisten kasvainten ilmaantuvuutta, mutta ei muuttanut estrogeenireseptorinegatiivisten kasvainten tai suurempien kasvainten ilmaantuvuutta. Rintasyöpää sairastavilla naisilla, joilla on suuri riski sairastua toiseen rintasyöpään, noin 5 vuoden NOLVADEX-hoito (tamoksifeenisitraatti) vähensi toisen rintasyövän vuotuista ilmaantuvuutta noin 50 %.
Naiset, jotka ovat raskaana tai suunnittelevat raskautta, eivät saa ottaa NOLVADEXia (tamoksifeenisitraattia) vähentääkseen rintasyövän riskiä. Tehokas ei-hormonaalinen ehkäisy on kaikkien NOLVADEXia (tamoksifeenisitraattia) käyttävien premenopausaalisten naisten ja noin kahden kuukauden ajan hoidon lopettamisen jälkeen käytettävä, jos he ovat seksuaalisesti aktiivisia. Tamoksifeeni ei aiheuta hedelmättömyyttä edes kuukautiskierron epäsäännöllisyydessä. Seksuaalisesti aktiivisille hedelmällisessä iässä oleville naisille NOLVADEX (tamoksifeenisitraatti) -hoito tulee aloittaa kuukautisten aikana. Naisilla, joilla on epäsäännöllinen kuukautiskierto, riittää negatiivinen B-HCG juuri ennen hoidon aloittamista (ks. VAROITUKSET - Raskausluokka D ).
Kaksi eurooppalaista tamoksifeenin tutkimusta rintasyövän riskin vähentämiseksi suoritettiin, ja niissä ei havaittu eroa rintasyöpätapausten määrässä tamoksifeeni- ja lumeryhmien välillä. Näissä tutkimuksissa oli koesuunnitelmia, jotka poikkesivat NSABP P-1:stä, olivat pienempiä kuin NSABP P-1, ja tutkimukseen otettiin naisia, joilla oli pienempi riski sairastua rintasyöpään kuin P-1:ssä.
Seuranta NOLVADEX (tamoksifeenisitraatti) -hoidon aikana
Naisia, jotka käyttävät tai ovat aiemmin käyttäneet NOLVADEXia (tamoksifeenisitraattia), tulee neuvoa hakeutumaan nopeasti lääkärin hoitoon uusien rintojen kyhmyjen, emättimen verenvuodon, gynekologisten oireiden (kuukautiskierron epäsäännöllisyydet, muutokset emättimen erityksessä tai lantion kipu tai paine), jalkojen turvotuksen tai arkuus, selittämätön hengenahdistus tai näkömuutokset. Naisten tulee kertoa kaikille hoidontarjoajille arvioinnin syystä riippumatta, että he ottavat NOLVADEXia (tamoksifeenisitraattia).
Naisten, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) rintasyövän esiintyvyyden vähentämiseksi, tulee suorittaa rintojen tutkimus, mammografia ja gynekologinen tutkimus ennen hoidon aloittamista. Nämä tutkimukset tulee toistaa säännöllisin väliajoin hoidon aikana hyvän lääketieteellisen käytännön mukaisesti. Naisten, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) rintasyövän adjuvanttihoitona, tulee noudattaa samoja seurantamenettelyjä kuin NOLVADEXia (tamoksifeenisitraattia) käyttävien naisten rintasyövän ilmaantuvuuden vähentämiseksi. Naisten, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) metastasoituneen rintasyövän hoitoon, tulee tarkistaa tämä seurantasuunnitelma hoitajansa kanssa ja valita sopivat menetelmät ja arviointiaikataulu.
Laboratoriotestit
Säännöllinen täydellinen verenkuva, mukaan lukien verihiutaleiden määrä, ja määräajoin maksan toimintakokeet tulee ottaa.
ATAC-tutkimuksen aikana useammilla anastrotsolia saaneilla potilailla ilmoitettiin kohonneen seerumin kolesterolipitoisuus verrattuna potilaisiin, jotka saivat NOLVADEXia (tamoksifeenisitraatti) (9 % vs. 3,5 %).
Karsinogeneesi
Perinteinen karsinogeneesitutkimus rotilla annoksilla 5, 20 ja 35 mg/kg/vrk (noin yksi, kolme ja seitsemän kertaa suurempi suositeltu päivittäinen suurin annos mg/m²-perusteella mitattuna) annettaessa suun kautta letkulla enintään 2 vuoden ajan. ) paljasti hepatosellulaarisen karsinooman merkittävän lisääntymisen kaikilla annoksilla. Näiden kasvainten ilmaantuvuus oli merkittävästi suurempi rotilla, joille annettiin 20 tai 35 mg/kg/vrk (69 %) verrattuna rotilla, joille annettiin 5 mg/kg/vrk (14 %). Erillisessä tutkimuksessa rotille annettiin tamoksifeenia 45 mg/kg/vrk (noin yhdeksänkertainen ihmiselle suositeltuun päivittäiseen enimmäisannokseen mg/m²:n perusteella); hepatosellulaarinen neoplasia ilmeni 3-6 kuukauden iässä.
Granulosasoluisia munasarjakasvaimia ja interstitiaalisten solujen kivesten kasvaimia havaittiin kahdessa erillisessä hiiritutkimuksessa. Hiirille annettiin tamoksifeenin trans- ja raseemista muotoa 13-15 kuukauden ajan annoksina 5, 20 ja 50 mg/kg/vrk (noin puolet, kaksi ja viisinkertainen ihmiselle suositeltuun päivittäiseen annokseen mg/m² perusta).
Mutageneesi
Perinteisissä in vivo- ja in vitro -testeissä pro- ja eukaryoottisilla testijärjestelmillä ja lääkeaineenvaihduntajärjestelmillä ei havaittu genotoksisuutta. Kuitenkin lisääntyneet DNA-adduktien tasot havaittiin 32P-jälkileimauksella rotan maksasta ja viljellyistä ihmisen lymfosyyteistä. Tamoksifeenin on myös havaittu lisäävän mikrotuman muodostumista in vitro ihmisen lymfoblastoidisolulinjassa (MCL-5). Näiden löydösten perusteella tamoksifeeni on genotoksinen jyrsijän ja ihmisen MCL-5-soluissa.
Hedelmällisyyden heikkeneminen
Tamoksifeeni aiheutti hedelmällisyyden ja hedelmöittymisen heikkenemistä naarasrotilla annoksilla 0,04 mg/kg/vrk (noin 0,01-kertainen ihmiselle suositeltuun vuorokausiannostukseen mg/m²:n perusteella laskettuna), kun sitä annettiin kahden viikon ajan ennen parittelua tiineyspäivään 7 asti. . Tällä annoksella hedelmällisyys- ja lisääntymisindeksit vähenivät huomattavasti sikiön kokonaiskuolleisuuden myötä. Sikiökuolleisuus lisääntyi myös annoksilla 0,16 mg/kg/vrk (noin 0,03 kertaa ihmiselle suositeltu vuorokausiannos mg/m²:n perusteella laskettuna), kun naarasrotille annettiin annostusta 7-17 raskauspäivänä. Tamoksifeeni aiheutti abortin, ennenaikaisen synnytyksen ja sikiökuoleman kaneissa, kun niitä annettiin annoksina, jotka olivat yhtä suuria tai suurempia kuin 0,125 mg/kg/vrk (noin 0,05 kertaa ihmiselle suositeltu vuorokausiannos mg/m²:n perusteella laskettuna). Rotilla tai kaneilla ei havaittu teratogeenisiä muutoksia.
Raskausluokka D
Katso VAROITUKSET .
Imettävät äidit
Tamoksifeenin on raportoitu estävän imetystä. Kaksi lumekontrolloitua tutkimusta yli 150 naisella ovat osoittaneet, että tamoksifeeni estää merkittävästi varhaista synnytyksen jälkeistä maidontuotantoa. Molemmissa tutkimuksissa tamoksifeenia annettiin 24 tunnin sisällä synnytyksestä 5–18 päivän ajan. Tamoksifeenin vaikutusta vakiintuneeseen maidontuotantoon ei tunneta.
Ei ole tietoa siitä, erittyykö tamoksifeeni äidinmaitoon. Jos se erittyy, tamoksifeenin vaikutuksista rintamaitoon ei ole tietoa imetetylle lapselle tai rintaruokitetulle eläimille. Kuitenkin vastasyntyneiden suora altistuminen tamoksifeenille hiirille ja rotille (ei rintamaidon kautta) aiheutti 1) lisääntymiselinten vaurioita naarasjyrsijöillä (samankaltaisia kuin ihmisillä dietyylistilbestrolille kohdunsisäisen altistuksen jälkeen) ja 2) urosten lisääntymiselinten toimintahäiriöitä. jyrsijät, kuten kivesten atrofia ja spermatogeneesin pysähtyminen.
Ei tiedetä, erittyykö NOLVADEX (tamoksifeenisitraatti) äidinmaitoon. Koska NOLVADEXin (tamoksifeenisitraatti) imeväisillä voi olla vakavia haittavaikutuksia, NOLVADEXia (tamoksifeenisitraattia) käyttävien naisten ei tule imettää.
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla, joilla on DCIS
Ei tiedetä, erittyykö NOLVADEX (tamoksifeenisitraatti) äidinmaitoon. Koska NOLVADEXin (tamoksifeenisitraatti) imeväisillä voi olla vakavia haittavaikutuksia, NOLVADEXia (tamoksifeenisitraattia) käyttävien naisten ei tule imettää.
Käyttö lapsille
NOLVADEXin (tamoksifeenisitraatti) turvallisuutta ja tehoa 2–10-vuotiaille tytöille, joilla on McCune-Albrightin oireyhtymä ja varhainen murrosikä, ei ole tutkittu yli vuoden hoidon. NOLVADEX-hoidon (tamoksifeenisitraatti) pitkäaikaisia vaikutuksia tytöille ei ole osoitettu. NOLVADEXilla (tamoksifeenisitraatti) hoidetuilla aikuisilla on havaittu kohdun pahanlaatuisten kasvainten, aivohalvauksen ja keuhkoembolian ilmaantuvuuden lisääntymistä (ks. LAATIKKO VAROITUS , ja KLIININEN FARMAKOLOGIA - Kliiniset tutkimukset - McCune-Albrightin oireyhtymä alakohta).
Geriatrinen käyttö
NSABP P-1 -tutkimuksessa vähintään 65-vuotiaiden naisten osuus oli 16 %. Vähintään 70-vuotiaita naisia oli 6 % osallistujista. Rintasyövän ilmaantuvuus väheni osallistujilla kussakin alaryhmässä: Yhteensä 28 ja 10 invasiivista rintasyöpää havaittiin 65-vuotiailla ja sitä vanhemmilla osallistujilla lumelääkeryhmässä ja NOLVADEX (tamoksifeenisitraatti) -ryhmissä. Kaikkien muiden tulosten osalta tämän alajoukon tulokset heijastavat tuloksia, jotka havaittiin vähintään 50-vuotiaiden naisten alajoukossa. Vanhempien ja nuorempien potilaiden välillä ei havaittu yleisiä eroja siedettävyydessä (ks KLIININEN FARMAKOLOGIA - Kliiniset tutkimukset - Rintasyövän ilmaantuvuuden vähentäminen korkean riskin naisilla jakso).
NSABP B-24 -tutkimuksessa vähintään 65-vuotiaiden naisten osuus oli 23 %. Osallistujista 10 % oli vähintään 70-vuotiaita naisia. Yhteensä 14 ja 12 invasiivista rintasyöpää havaittiin 65-vuotiailla ja sitä vanhemmilla plasebo- ja NOLVADEX- (tamoksifeenisitraatti) -ryhmissä. Tämä osajoukko on liian pieni, jotta sen tehosta voitaisiin tehdä johtopäätöksiä. Kaikissa muissa päätepisteissä tämän alajoukon tulokset olivat verrattavissa tähän tutkimukseen osallistuneiden nuorempien naisten tuloksiin. Vanhempien ja nuorempien potilaiden välillä ei havaittu yleisiä eroja siedettävyydessä.
YLIANNOSTUS
Suurimmilla annoksilla havaitut merkit LD50:n määrittämiseksi eläimillä tehdyissä tutkimuksissa olivat hengitysvaikeudet ja kouristukset.
Akuuttia yliannostusta ihmisillä ei ole raportoitu. Edistyneen metastaattisen syöpäpotilaiden tutkimuksessa, jossa määritettiin erityisesti NOLVADEXin (tamoksifeenisitraatti) suurin siedetty annos arvioitaessa erittäin suurten annosten käyttöä monilääkeresistenssin kumoamiseen, havaittiin akuuttia neurotoksisuutta, joka ilmeni vapinana, hyperrefleksiana, epävakaana kävelynä ja huimauksena. Nämä oireet ilmenivät 3-5 päivän kuluessa NOLVADEXin (tamoksifeenisitraatti) aloittamisesta ja poistuivat 2-5 päivän kuluessa hoidon lopettamisesta. Pysyvää neurologista toksisuutta ei havaittu. Yksi potilas koki kohtauksen useita päiviä NOLVADEXin (tamoksifeenisitraatti) lopettamisen jälkeen ja neurotoksiset oireet olivat hävinneet. Kohtauksen syy-yhteys NOLVADEX-hoitoon (tamoksifeenisitraatti) ei ole tiedossa. Näille potilaille annetut annokset olivat kaikki suurempia kuin 400 mg/m² kyllästysannos, jota seurasivat 150 mg/m² NOLVADEXin (tamoksifeenisitraatti) ylläpitoannokset kahdesti päivässä.
Samassa tutkimuksessa havaittiin QT-ajan pidentymistä EKG:ssa, kun potilaille annettiin yli 250 mg/m² kyllästysannoksia, mitä seurasi 80 mg/m² NOLVADEXin (tamoksifeenisitraatti) ylläpitoannoksia kahdesti päivässä. Naiselle, jonka kehon pinta-ala on 1,5 m², pienin kyllästysannos ja ylläpitoannokset, joilla esiintyi neurologisia oireita ja QT-muutoksia, olivat vähintään 6 kertaa suuremmat kuin suurin suositeltu annos.
Yliannostukseen ei tunneta erityistä hoitoa; hoidon tulee olla oireenmukaista.
VASTA-AIHEET
NOLVADEX (tamoksifeenisitraatti) on vasta-aiheinen potilailla, joilla on tunnettu yliherkkyys lääkkeelle tai jollekin sen aineosalle.
Rintasyövän ilmaantuvuuden väheneminen korkean riskin naisilla ja naisilla, joilla on DCIS
NOLVADEX (tamoksifeenisitraatti) on vasta-aiheinen naisille, jotka tarvitsevat samanaikaista kumariinityyppistä antikoagulanttihoitoa tai naisille, joilla on ollut syvä laskimotukos tai keuhkoembolia.
KLIININEN FARMAKOLOGIA
NOLVADEX (tamoksifeenisitraatti) on ei-steroidinen aine, joka on osoittanut tehokkaita estrogeenisia ominaisuuksia eläinkoejärjestelmissä. Antiestrogeeniset vaikutukset voivat liittyä sen kykyyn kilpailla estrogeenin kanssa sitoutumiskohdista kohdekudoksissa, kuten rinnassa. Tamoksifeeni estää dimetyylibentsantraseenin (DMBA) indusoiman rotan rintasyövän induktiota ja aiheuttaa jo vakiintuneiden DMBA-indusoitujen kasvainten regression. Tässä rottamallissa tamoksifeeni näyttää saavan aikaan kasvainten vastaisia vaikutuksia sitoutumalla estrogeenireseptoreihin.
Ihmisen rintojen adenokarsinoomista johdetuissa sytosoleissa tamoksifeeni kilpailee estradiolin kanssa estrogeenireseptoriproteiinista.
Imeytyminen ja jakautuminen
Kun tamoksifeenia otettiin suun kautta 20 mg:n kerta-annoksen jälkeen, plasman keskimääräinen huippupitoisuus 40 ng/ml (vaihteluväli 35-45 ng/ml) saavutettiin noin 5 tunnin kuluttua annoksesta. Tamoksifeenin plasmapitoisuuksien lasku on kaksivaiheista, ja terminaalinen eliminaation puoliintumisaika on noin 5-7 päivää. N-desmetyylitamoksifeenin keskimääräinen huippupitoisuus plasmassa on 15 ng/ml (vaihteluväli 10-20 ng/ml). Krooninen 10 mg tamoksifeenin antaminen kahdesti vuorokaudessa 3 kuukauden ajan potilaille johtaa tamoksifeenin keskimääräisiin vakaan tilan pitoisuuksiin plasmassa 120 ng/ml (vaihteluväli 67-183 ng/ml) ja 336 ng/ml (vaihteluväli 148-654 ng/ml). ml) N-desmetyylitamoksifeenille. Tamoksifeenin ja N-desmetyylitamoksifeenin keskimääräiset vakaan tilan pitoisuudet plasmassa, kun tamoksifeenia on annettu 20 mg kerran päivässä 3 kuukauden ajan, ovat 122 ng/ml (vaihteluväli 71-183 ng/ml) ja 353 ng/ml (vaihteluväli 152-706 ng). /ml), vastaavasti. Hoidon aloittamisen jälkeen tamoksifeenin vakaan tilan pitoisuudet saavutetaan noin 4 viikossa ja N-desmetyylitamoksifeenin vakaan tilan pitoisuudet noin 8 viikossa, mikä viittaa tämän metaboliitin puoliintumisajaksi noin 14 päivää. Vakaan tilan risteyttävässä tutkimuksessa, jossa 10 mg NOLVADEX (tamoksifeenisitraatti) tabletteja annettiin kahdesti päivässä vs. 20 mg NOLVADEX (tamoksifeenisitraatti) tabletti kerran vuorokaudessa, 20 mg NOLVADEX (tamoksifeenisitraatti) tabletti oli bioekvivalentti 10 tabletin kanssa. mg NOLVADEX (tamoksifeenisitraatti) -tabletit.
Aineenvaihdunta
Tamoksifeeni metaboloituu laajalti suun kautta antamisen jälkeen. N-desmetyylitamoksifeeni on tärkein potilaiden plasmasta löydetty metaboliitti. N-desmetyylitamoksifeenin biologinen aktiivisuus näyttää olevan samanlainen kuin tamoksifeenin. 4-hydroksitamoksifeeni ja tamoksifeenin sivuketjun primaarinen alkoholijohdannainen on tunnistettu vähäisiksi metaboliiteiksi plasmassa. Tamoksifeeni on sytokromi P-450 3A, 2C9 ja 2D6 substraatti ja P-glykoproteiinin estäjä.
Erittyminen
Naisilla tehdyt tutkimukset, jotka saivat 20 mg 14C-tamoksifeenia, ovat osoittaneet, että noin 65 % annetusta annoksesta erittyi elimistöstä 2 viikon aikana ja pääasiallinen eliminaatioreitti oli ulosteen erittyminen. Lääke erittyy pääasiassa polaarisina konjugaatteina, ja muuttumattomana lääkeaineen ja konjugoimattomien metaboliittien osuus ulosteen kokonaisradioaktiivisuudesta on alle 30 %.
Erikoispopulaatiot
Iän, sukupuolen ja rodun vaikutuksia tamoksifeenin farmakokinetiikkaan ei ole määritetty. Maksan toiminnan heikkenemisen vaikutuksia tamoksifeenin metaboliaan ja farmakokinetiikkaan ei ole määritetty.
Pediatriset potilaat
Tamoksifeenin ja N-desmetyylitamoksifeenin farmakokinetiikka karakterisoitiin populaatiofarmakokineettisellä analyysillä, jossa potilasta kohden oli harvoja näytteitä, jotka saatiin 27:ltä 2–10-vuotiaalta lapsipotilaalta, jotka osallistuivat tutkimukseen, jonka tarkoituksena oli arvioida NOLVADEXin (tamoksifeeni) turvallisuutta, tehoa ja farmakokinetiikkaa. sitraatti) McCune-Albrightin oireyhtymän hoidossa. Analyyseihin sisällytettiin runsaasti tietoa kahdesta tamoksifeenisitraatin farmakokineettisestä tutkimuksesta, joissa 59 postmenopausaalista naista, joilla oli rintasyöpä, otettiin päätökseen tamoksifeenin rakenteellisen farmakokineettisen mallin määrittämiseksi. Yksiosastoinen malli sopi parhaiten tietoihin.
Lapsipotilailla keskimääräinen vakaan tilan huippupitoisuus plasmassa (Css, max) ja AUC olivat 187 ng/ml ja 4110 ng h/ml, ja Css, max saavutettiin noin 8 tunnin kuluttua annostelusta. Puhdistus (CL/F) painon mukaan laskettuna naispuolisilla lapsipotilailla oli noin 2,3 kertaa suurempi kuin naispuolisilla rintasyöpäpotilailla. Nuorimmassa naispuolisten lapsipotilaiden kohortissa (2–6-vuotiaat) CL/F oli 2,6 kertaa korkeampi; vanhimmassa kohortissa (7-10,9-vuotiaat) CL/F oli noin 1,9-kertainen. Altistuminen N-desmetyylitamoksifeenille oli verrattavissa lapsi- ja aikuispotilaiden välillä. NOLVADEXin (tamoksifeenisitraatti) turvallisuutta ja tehoa 2–10-vuotiaille tytöille, joilla on McCune-Albrightin oireyhtymä ja varhainen murrosikä, ei ole tutkittu yli vuoden hoidon. NOLVADEX-hoidon (tamoksifeenisitraatti) pitkäaikaisia vaikutuksia tytöillä ei ole varmistettu. NOLVADEXilla (tamoksifeenisitraatti) hoidetuilla aikuisilla on havaittu kohdun pahanlaatuisten kasvainten, aivohalvauksen ja keuhkoembolian ilmaantuvuuden lisääntymistä (ks. LAATIKKO VAROITUS ).
Huumeiden väliset vuorovaikutukset
In vitro -tutkimukset osoittivat, että erytromysiini, syklosporiini, nifedipiini ja diltiatseemi estivät kilpailevasti N-desmetyylitamoksifeenin muodostumista näennäisen K1:n ollessa vastaavasti 20, 1, 45 ja 30 µM. Näiden in vitro -tutkimusten kliinistä merkitystä ei tunneta.
Tamoksifeeni alensi letrotsolin pitoisuutta plasmassa 37 %, kun näitä lääkkeitä annettiin samanaikaisesti. Rifampiini, sytokromi P-450 3A4:n indusoija, alensi tamoksifeenin AUC-arvoa 86 % ja Cmax 55 %. Aminoglutetimidi alentaa tamoksifeenin ja N-desmetyylitamoksifeenin pitoisuuksia plasmassa. Medroksiprogesteroni alentaa plasman N-desmetyylin, mutta ei tamoksifeenin, pitoisuuksia.
Anastrotsolin adjuvanttitutkimuksessa anastrotsolin ja NOLVADEXin (tamoksifeenisitraatti) samanaikainen anto rintasyöpäpotilailla vähensi plasman anastrotsolin pitoisuutta 27 % verrattuna anastrotsolipitoisuuksiin yksinään; Samanaikainen käyttö ei kuitenkaan vaikuttanut tamoksifeenin tai N-desmetyylitamoksifeenin farmakokinetiikkaan (ks. VAROTOIMENPITEET - LÄÄKEMUOTOTIEDOT ). NOLVADEXia (tamoksifeenisitraattia) ei pidä antaa samanaikaisesti anastrotsolin kanssa.
Kliiniset tutkimukset
Metastaattinen rintasyöpä
Premenopausaaliset naiset (NOLVADEX (tamoksifeenisitraatti) vs. ablaatio)
Kolmessa prospektiivisessa, satunnaistetussa tutkimuksessa (Ingle, Pritchard, Buchanan) verrattiin NOLVADEXia (tamoksifeenisitraatti) munasarjojen ablaatioon (ooforektomia tai munasarjojen säteilytys) premenopausaalisilla naisilla, joilla oli pitkälle edennyt rintasyöpä. Vaikka objektiivinen vasteprosentti, aika hoidon epäonnistumiseen ja eloonjääminen olivat samanlaiset molemmilla hoidoilla, rajoitettu potilaskertymä esti vastaavuuden osoittamisen. Kolmen tutkimuksen eloonjäämistietojen yleisanalyysissä kuoleman riskisuhde (NOLVADEX (tamoksifeenisitraatti) / munasarjojen ablaatio) oli 1,00 ja kaksipuolinen 95 %:n luottamusväli 0,73-1,37. Kohonneita seerumin ja plasman estrogeenipitoisuuksia on havaittu premenopausaalisilla naisilla, jotka saavat NOLVADEXia (tamoksifeenisitraatti), mutta satunnaistettujen tutkimusten tiedot eivät viittaa tämän nousun haittavaikutukseen. Rajoitettu määrä premenopausaalisia potilaita, joiden sairaus eteni NOLVADEX-hoidon (tamoksifeenisitraatti) aikana, reagoi myöhempään munasarjojen ablaatioon.
Miehen rintasyöpä
Julkaistut tulokset 122 potilaasta (119 arvioitavissa) ja tapausraportit 16 potilaasta (13 arvioitavissa), joita hoidettiin NOLVADEXilla (tamoksifeenisitraatti), ovat osoittaneet, että NOLVADEX (tamoksifeenisitraatti) on tehokas miesten rintasyövän lievittävässä hoidossa. Kuusikymmentäkuusi näistä 132 arvioitavasta potilaasta reagoi NOLVADEXiin (tamoksifeenisitraatti), mikä muodostaa 50 %:n objektiivisen vasteen.
Adjuvantti rintasyöpä
Yleiskatsaus
Early Breast Cancer Trialists' Collaborative Group (EBCTCG) teki maailmanlaajuisia katsauksia varhaisen rintasyövän systeemisestä adjuvanttihoidosta vuosina 1985, 1990 ja uudelleen vuonna 1995. Vuonna 1998 raportoitiin 10 vuoden tulostiedot 36 689 naisesta 55 satunnaistetussa kokeessa. adjuvantti NOLVADEX (tamoksifeenisitraatti) käyttäen annoksia 20-40 mg/vrk 1-5+ vuoden ajan. 25 prosenttia potilaista sai yhden vuoden tai vähemmän koehoitoa, 52 prosenttia sai 2 vuotta ja 23 prosenttia noin 5 vuotta. 48 prosenttia kasvaimista oli estrogeenireseptori (ER) positiivisia (> 10 fmol/mg), 21 % oli ER-heikkoja (
Naisilla, joilla oli ER-positiivinen tai tuntematon rintasyöpä ja positiivisia solmukkeita, jotka saivat noin 5 vuoden hoitoa, kokonaiseloonjääminen 10 vuoden kohdalla oli 61,4 % NOLVADEXilla (tamoksifeenisitraatti) ja 50,5 % kontrollilla (logrank 2p
Tamoksifeenin suunnitellun keston vaikutus voidaan kuvata seuraavasti. Naisilla, joilla on ER-positiivinen tai tuntematon rintasyöpä ja jotka saivat 1 vuoden tai vähemmän, 2 vuotta tai noin 5 vuotta NOLVADEXia (tamoksifeenisitraattia), kuolleisuuden suhteellinen väheneminen oli 12 %, 17 % ja 26 % (trendi merkitsevä 2 p
Hyöty on vähemmän selvä naisilla, joilla on huono ER-rintasyöpä ja joilla uusiutumisen suhteellinen väheneminen oli 10 % (2p = 0,007) kaikkien kestojen aikana yhteensä tai 9 % (2p = 0,02), jos kontralateraaliset rintasyövät jätetään pois. Vastaava kuolleisuuden lasku oli 6 % (NS). Noin 5 vuoden NOLVADEXin (tamoksifeenisitraatti) vaikutukset uusiutumiseen ja kuolleisuuteen olivat samanlaiset iästä ja samanaikaisesta kemoterapiasta riippumatta. Ei ollut viitteitä siitä, että yli 20 mg:n vuorokausiannokset olisivat tehokkaampia.
Anastrotsoliadjuvantti ATAC -tutkimus - Anastrotsolin tutkimus verrattuna NOLVADEXiin (tamoksifeenisitraatti) varhaisen rintasyövän adjuvanttihoidossa - Anastrotsoliadjuvanttitutkimus suoritettiin 9 366 postmenopausaalisella naisella, joilla oli leikattavissa oleva rintasyöpä ja jotka satunnaistettiin saamaan adjuvanttihoitoa joko anastrotsolia 1 mg päivässä, NOLVADEXia (tamoksifeenisitraattia) 20 mg päivässä tai näiden kahden hoidon yhdistelmää viiden vuoden ajan tai uusiutumiseen saakka. taudista. Keskimääräisellä 33 kuukauden seurannalla anastrotsolin ja NOLVADEXin (tamoksifeenisitraatti) yhdistelmä ei osoittanut mitään tehokkuusetua verrattuna pelkkään NOLVADEX-hoitoon (tamoksifeenisitraatti) kaikilla potilailla eikä hormonireseptoripositiivisessa alapopulaatiossa. Tämä hoitohaara keskeytettiin tutkimuksesta. Katso KLIININEN FARMAKOLOGIA-Erityispopulaatiot-Lääke-Lääkevuorovaikutukset , VAROTOIMET - Laboratoriokokeet , VAROTOIMET - Lääkevuorovaikutukset ja HAITTAVAIKUTUKSET tämän kokeilun turvallisuustietoja koskevat osiot. Katso ARIMIDEX® (anastrotsoli) 1 mg -tablettien täydelliset reseptitiedot saadaksesi lisätietoja tästä tutkimuksesta.
ATAC-tutkimuksen kahdessa monoterapiahaarassa olevia potilaita hoidettiin keskimäärin 60 kuukautta (5 vuotta), ja niitä seurattiin keskimäärin 68 kuukauden ajan. Taudista vapaa eloonjääminen intent-to-treat -populaatiossa parani tilastollisesti merkitsevästi [hazard Ratio (HR) = 0,87, 95 % CI: 0,78, 0,97, p = 0,0127] anastratsolihaarassa verrattuna NOLVADEX-ryhmään (tamoksifeenisitraatti) .
Solmu positiivinen - Yksilölliset opinnot
Kaksi tutkimusta (Hubay ja NSABP B-09) osoittivat parantuneen sairaudesta vapaan eloonjäämisen radikaalin tai modifioidun radikaalin mastektomian jälkeen postmenopausaalisilla naisilla tai vähintään 50-vuotiailla naisilla, joilla oli kirurgisesti parannettava rintasyöpä ja positiivisia kainalosolmukkeita, kun NOLVADEX (tamoksifeenisitraatti) oli lisätty adjuvanttisytotoksiseen kemoterapiaan. Hubay-tutkimuksessa NOLVADEX (tamoksifeenisitraatti) lisättiin "pieniannoksen" CMF:ään (syklofosfamidi, metotreksaatti ja fluorourasiili). NSABP B-09 -tutkimuksessa NOLVADEXia (tamoksifeenisitraattia) lisättiin melfalaaniin [L-fenyylialaniinisinappi (P)] ja fluorourasiiliin (F).
Hubay-tutkimuksessa potilaat, joilla oli positiivinen (yli 3 fmol) estrogeenireseptori, hyötyivät todennäköisemmin. NSABP B-09 -tutkimuksessa 50–59-vuotiailla naisilla vain naiset, joiden sekä estrogeeni- että progesteronireseptoritasot olivat 10 fmol tai enemmän, hyötyivät selvästi, kun taas ei-statistisesti merkittävä suuntaus haitallisiin vaikutuksiin oli naisilla, joilla oli sekä estrogeeni- että progesteronireseptoritaso. alle 10 fmol. 60–70-vuotiailla naisilla oli suuntaus kohti NOLVADEXin (tamoksifeenisitraatti) suotuisaa vaikutusta ilman selvää yhteyttä estrogeeni- tai progesteronireseptorin tilaan.
Kolme prospektiivista tutkimusta (ECOG-1178, Toronto, NATO), joissa käytettiin NOLVADEXia (tamoksifeenisitraattia) adjuvanttina yksittäisenä aineena, osoitti parantuneen taudista vapaan eloonjäämisen täydellisen mastektomian ja kainaloleikkauksen jälkeen postmenopausaalisilla naisilla, joilla oli positiiviset kainalosolmukkeet verrattuna lumelääkkeeseen/ei hoitoa saaneisiin kontrolleihin. . Naton tutkimus osoitti myös yleisen selviytymishyödyn.
Solmu negatiivinen - Yksilölliset tutkimukset
NSABP B-14, prospektiivinen, kaksoissokkoutettu, satunnaistettu tutkimus, jossa verrattiin NOLVADEXia (tamoksifeenisitraattia) lumelääkkeeseen naisilla, joilla oli kainalosolmuke-negatiivinen, estrogeenireseptoripositiivinen (≥ 10 fmol/mg sytosoliproteiinia) rintasyöpä (adjuvanttihoitona) , täydellisen mastektomian ja kainaloleikkauksen tai segmentaalisen resektion jälkeen
POTILASTIEDOT
LÄÄKKEEN OPAS
NOLVADEX (tamoksifeenisitraatti) ® (NOLE-vah-dex) Tabletit Yleinen nimi: tamoksifeeni (ta-MOX-I-fen)
Kirjoitettu naisille, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) pienentämään suurta mahdollisuuttaan saada rintasyöpää tai joilla on ductal carcinoma in situ (DCIS)
Tämä lääkitysopas käsittelee vain NOLVADEXin (tamoksifeenisitraatin) käyttöä rintasyövän riskin pienentämiseksi korkean riskin naisilla ja naisilla, joita hoidetaan DCIS:n vuoksi.
Ihmiset, jotka käyttävät NOLVADEXia (tamoksifeenisitraatti) tarjota rintasyövillä on erilaisia etuja ja erilaisia päätöksiä kuin korkean riskin naisilla tai naisilla, joilla on ductal carcinoma in situ (DCIS), jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) rintasyövän riskin vähentämiseksi. Jos sinulla on jo rintasyöpä, keskustele lääkärisi kanssa siitä, kuinka NOLVADEXin (tamoksifeenisitraatti) rintasyövän hoidon hyödyt verrataan tässä asiakirjassa kuvattuihin riskeihin.
Miksi minun pitäisi lukea tämä lääkitysopas?
Tässä oppaassa on tietoja, jotka auttavat sinua päättämään, käytätkö NOLVADEXia (tamoksifeenisitraattia) rintasyövän riskin pienentämiseksi.
Sinun ja lääkärisi tulee keskustella siitä, onko NOLVADEXin (tamoksifeenisitraatin) mahdollinen hyöty pienentämällä rintasyövän riskiä suurempi kuin sen mahdolliset riskit. Lääkärilläsi on erityinen tietokoneohjelma tai kädessä pidettävä laskin, joka kertoo, kuulutko riskiryhmään. Jos sinulla on DCIS ja sinua on hoidettu leikkauksella ja sädehoidolla, lääkärisi voi määrätä NOLVADEXia (tamoksifeenisitraattia) vähentääksesi mahdollisuuttasi saada invasiivinen (leviävä) rintasyöpä.
Lue tämä opas huolellisesti ennen kuin aloitat NOLVADEXin (tamoksifeenisitraatti). On tärkeää lukea saamasi tiedot aina, kun saat lisää lääkettä. Voi olla jotain uutta. Tämä opas ei kerro kaikkea NOLVADEXista (tamoksifeenisitraatista) ja kertoo ei ota yhteys lääkäriin.
Vain sinä ja lääkärisi voit määrittää, onko NOLVADEX (tamoksifeenisitraatti) oikea sinulle.
Mikä on tärkein tieto, joka minun pitäisi tietää NOLVADEXin (tamoksifeenisitraatti) käytöstä rintasyövän riskin vähentämiseksi?
NOLVADEX (tamoksifeenisitraatti) on reseptilääke, joka on jollain tapaa kuin estrogeeni (naishormoni) ja jollain tavalla erilainen. Rinnassa NOLVADEX (tamoksifeenisitraatti) voi estää estrogeenin vaikutukset. Koska se tekee tämän, NOLVADEX (tamoksifeenisitraatti) voi estää rintasyöpien kasvun, jotka tarvitsevat estrogeenia kasvaakseen (syövät, jotka ovat estrogeeni- tai progesteronireseptoripositiivisia).
NOLVADEX (tamoksifeenisitraatti) voi alentaa rintasyöpäriskiä naisilla, joilla on normaalia suurempi mahdollisuus saada rintasyöpä seuraavien viiden vuoden aikana (korkean riskin naiset) ja naisilla, joilla on DCIS.
Koska korkean riskin naisilla ei vielä ole syöpää, on tärkeää harkita huolellisesti, onko NOLVADEXin (tamoksifeenisitraatin) mahdollinen hyöty rintasyövän riskin pienentämisessä suurempi kuin sen mahdolliset riskit.
Tässä lääkitysoppaassa tarkastellaan NOLVADEXin (tamoksifeenisitraatti) käytön riskejä ja etuja rintasyövän riskin vähentämiseksi naisilla, joilla on suuri riski ja DCIS. Tämä opas tekee ei keskustella erityiseduista ja päätöksistä ihmisille, joilla on jo rintasyöpä.
Miksi naiset ja miehet käyttävät NOLVADEXia (tamoksifeenisitraatti)?
NOLVADEXilla (tamoksifeenisitraatti) on useampi kuin yksi käyttötarkoitus. NOLVADEXia (tamoksifeenisitraattia) käytetään:
pienentämään mahdollisuutta rintasyövän saaminen naisilla, joilla on normaalia suurempi mahdollisuus saada rintasyöpä seuraavan viiden vuoden aikana (korkean riskin naiset)
pienentämään mahdollisuutta invasiivisen (leviävän) rintasyövän saaminen naisille, joille on tehty leikkaus ja säteily ductal carcinoma in situ (DCIS) vuoksi. DCIS tarkoittaa, että syöpä on vain maitokanavien sisällä.
tarjota rintasyöpä naisilla varhaisen hoidon päätyttyä. Varhainen hoito voi sisältää leikkausta, sädehoitoa ja kemoterapiaa. NOLVADEX (tamoksifeenisitraatti) voi estää syöpää leviämästä muihin kehon osiin. Se voi myös vähentää naisen mahdollisuutta saada uusi rintasyöpä. naisilla ja miehillä,
tarjota rintasyöpä, joka on levinnyt muihin kehon osiin (metastaattinen rintasyöpä).
Tässä oppaassa puhutaan vain NOLVADEXin (tamoksifeenisitraatin) käyttämisestä rintasyövän riskin pienentämiseksi (#1 ja #2 yllä).
Mitkä ovat NOLVADEXin (tamoksifeenisitraatin) edut rintasyövän riskin pienentämiseksi korkean riskin naisilla ja naisilla, joita hoidetaan DCIS:n vuoksi?
Iso yhdysvaltalainen tutkimus tarkasteltiin riskialttiita naisia ja verrattiin niitä, jotka ottivat NOLVADEXia (tamoksifeenisitraattia) 5 vuoden ajan muihin, jotka ottivat pilleriä ilman NOLVADEXia (tamoksifeenisitraatti) (plasebo). Korkean riskin naiset määriteltiin erityisen tietokoneohjelman perusteella naisiksi, joilla on 1,7 % tai suurempi mahdollisuus saada rintasyöpä seuraavan viiden vuoden aikana. Tässä tutkimuksessa:
- Jokaista 1000 riskialttiista naisesta joka otti lumelääkettä , joka vuosi noin 7 sairastui rintasyöpään.
- Jokaista 1000 riskialttiista naisesta joka otti NOLVADEXia (tamoksifeenisitraattia) , joka vuosi noin 4 sairastui rintasyöpään.
Tutkimus osoitti, että keskimäärin korkean riskin naiset, jotka käyttivät NOLVADEXia (tamoksifeenisitraattia), pienensivät mahdollisuuksiaan saada rintasyöpää 44 %:lla 7:stä 1000:sta 4:een 1000:sta.
Toinen yhdysvaltalainen tutkimus tarkasteltiin naiset, joilla on DCIS ja vertaili niitä, jotka ottivat NOLVADEXia (tamoksifeenisitraattia) 5 vuoden ajan muihin lumelääkettä käyttäviin. Tässä tutkimuksessa:
- Jokaisesta 1000 DCIS-sairaan naisesta jotka ottivat lumelääkettä joka vuosi noin 17 sairastui rintasyöpään.
- Jokaisesta 1000 DCIS-sairaan naisesta joka otti NOLVADEXia (tamoksifeenisitraattia) , joka vuosi noin 10 sairastui rintasyöpään.
Tutkimus osoitti, että NOLVADEXia (tamoksifeenisitraattia) käyttäneet DCIS-potilaat vähensivät keskimäärin 43 prosentilla mahdollisuuksiaan saada invasiivinen (leviävä) rintasyöpä 17:stä 1000:sta 10:een 1000:sta.
Nämä tutkimukset eivät tarkoita, että NOLVADEXin (tamoksifeenisitraatti) ottaminen alentaa henkilökohtaista mahdollisuuttasi saada rintasyöpä. Emme tiedä, mitä hyötyä on kenellekään naiselle, joka käyttää NOLVADEXia (tamoksifeenisitraattia) vähentääkseen mahdollisuuttaan saada rintasyöpä.
Mitkä ovat NOLVADEXin (tamoksifeenisitraatti) riskit?
Kohdassa "Mitä hyötyä NOLVADEXista (tamoksifeenisitraatti) on?" kuvatuissa tutkimuksissa NOLVADEXia (tamoksifeenisitraattia) käyttäneet suuren riskin naiset saivat tiettyjä sivuvaikutuksia enemmän kuin lumelääkettä käyttäneet.
Jotkut näistä sivuvaikutuksista voivat aiheuttaa kuoleman.
Yhdessä tutkimuksessa naisilla, joilla oli vielä kohtu
- Jokaisesta tuhannesta lumelääkettä käyttäneestä naisesta yksi sai vuosittain kohdun limakalvon syövän, eikä kukaan sairastu kohdun sarkoomaan (kohdun kehon syöpä).
- Jokaisesta 1 000:sta NOLVADEXia (tamoksifeenisitraattia) käyttäneestä naisesta joka vuosi 2 sai kohdun limakalvon syövän ja alle 1 sairastui kohdun sarkoomaan.
Nämä tulokset osoittavat, että keskimäärin korkean riskin naisilla joilla oli vielä kohtu , NOLVADEX (tamoksifeenisitraatti) kaksinkertaisti mahdollisuuden saada kohdun limakalvon syöpä 1:1000:sta 2:1000:een, ja se lisäsi mahdollisuutta saada kohdun sarkooma. Tämä ei tarkoita, että NOLVADEXin (tamoksifeenisitraatti) ottaminen kaksinkertaistaa henkilökohtaisen mahdollisuutesi saada kohdun limakalvosyöpä tai lisää mahdollisuuttasi saada kohdun sarkooma. Emme tiedä, mikä tämä riski on kenellekään naiselle. Riski on erilainen naisilla, joilla ei enää ole kohtua.
Kaikilla tässä tutkimuksessa osallistuneilla naisilla NOLVADEXin (tamoksifeenisitraatti) käyttö lisäsi veritulpan riskiä keuhkoissa tai suonissa tai aivohalvauksen riskiä. Joissakin tapauksissa naiset kuolivat näihin vaikutuksiin.
NOLVADEX (tamoksifeenisitraatti) lisäsi riskiä saada kaihi (silmän linssin sameus) tai joutua kaihileikkaukseen. (Katso "Mitkä ovat NOLVADEXin (tamoksifeenisitraatin) mahdolliset sivuvaikutukset?" saadaksesi lisätietoja sivuvaikutuksista.)
Mitä emme tiedä NOLVADEXin (tamoksifeenisitraatti) ottamisesta rintasyövän riskin vähentämiseksi?
Emme tiedä
- jos NOLVADEX (tamoksifeenisitraatti) alentaa mahdollisuutta saada rintasyöpä naisilla, joilla on epänormaalit rintasyöpägeenit (BRCA1 ja BRCA2)
- jos NOLVADEXin (tamoksifeenisitraatti) ottaminen 5 vuoden ajan vähentää rintasyöpien määrää, jonka nainen saa elämänsä aikana, tai jos se vain viivästyttää joidenkin rintasyöpien kehittymistä
- jos NOLVADEX (tamoksifeenisitraatti) auttaa naista elämään pidempään
- NOLVADEXin (tamoksifeenisitraatti) käytön vaikutukset hormonikorvaushoidon (HRT), ehkäisypillereiden tai androgeenien (mieshormonien) kanssa
- NOLVADEXin (tamoksifeenisitraatti) käytön edut, jos olet alle 35-vuotias
Tutkimuksia tehdään saadakseen lisää tietoa NOLVADEXin (tamoksifeenisitraatti) käytön pitkäaikaisista eduista ja riskeistä rintasyövän riskin vähentämiseksi.
Mitkä ovat NOLVADEXin (tamoksifeenisitraatin) mahdolliset sivuvaikutukset?
NOLVADEXin (tamoksifeenisitraatti) yleisin sivuvaikutus on kuumat aallot. Tämä ei ole merkki vakavasta ongelmasta.
Seuraavaksi yleisin sivuvaikutus on emätinvuoto. Jos vuoto on veristä, se voi olla merkki vakavasta ongelmasta. [Katso "Muutokset kohdun limakalvossa (endometriumissa) tai rungossa" alla.]
NOLVADEXin (tamoksifeenisitraatti) vähemmän yleiset mutta vakavat sivuvaikutukset on lueteltu alla. Näitä voi esiintyä milloin tahansa. Soita lääkärillesi välittömästi, jos sinulla on merkkejä alla luetelluista sivuvaikutuksista:
- Muutokset kohdun limakalvossa (endometriumissa) tai rungossa. Nämä muutokset voivat tarkoittaa vakavien ongelmien alkamista, mukaan lukien kohtusyöpä. Kohdun muutosten merkit ovat:
- Emättimen verenvuoto tai verinen vuoto, joka voi olla ruosteista tai ruskeaa. Sinun tulee soittaa lääkärillesi, vaikka verenvuotoa esiintyisi vain vähän.
- Muutos kuukausittaisessa verenvuodossasi, kuten verenvuodon määrässä tai ajoituksessa tai lisääntynyt hyytymisaste.
- Kipu tai painetta lantiossa (nabasi alapuolella).
- Verihyytymiä suonissasi tai keuhkoissasi. Nämä voivat aiheuttaa vakavia ongelmia, mukaan lukien kuoleman. Saatat saada hyytymiä jopa 2-3 kuukauden kuluttua NOLVADEXin (tamoksifeenisitraatti) käytön lopettamisesta. Veritulppien merkit ovat:
- äkillinen rintakipu, hengenahdistus, veren yskiminen
- kipu, arkuus tai turvotus toisessa tai molemmissa jaloissasi
- Aivohalvaus. Aivohalvaus voi aiheuttaa vakavia lääketieteellisiä ongelmia, mukaan lukien kuoleman. Aivohalvauksen merkit ovat:
- äkillinen heikkous, pistely tai tunnottomuus kasvoissasi, käsivarsissasi tai jaloissasi, erityisesti vartalon toisella puolella
- äkillinen hämmennys, puhe- tai ymmärtämisvaikeudet
- äkillinen näkemishäiriö toisessa tai molemmissa silmissä
- äkilliset kävelyvaikeudet, huimaus, tasapainon tai koordinaation menetys
- äkillinen voimakas päänsärky ilman tunnettua syytä
- Kaihi tai lisääntynyt mahdollisuus kaihileikkauksen tarpeeseen. Merkki näistä ongelmista on hidas näön hämärtyminen.
- Maksaongelmat, mukaan lukien keltaisuus. Maksaongelmien merkkejä ovat ruokahaluttomuus ja ihosi tai silmänvalkuaisten kellastuminen.
Nämä eivät ole kaikkia NOLVADEXin (tamoksifeenisitraatti) mahdollisia sivuvaikutuksia. Täydellisen luettelon saat lääkäriltä tai apteekista.
Kuka ei saa ottaa NOLVADEXia (tamoksifeenisitraatti)?
Älä ota NOLVADEXia (tamoksifeenisitraattia) mistään syystä, jos
- Oletko raskaana tai suunnittelet raskautta NOLVADEXin (tamoksifeenisitraatti) käytön aikana tai 2 kuukauden aikana NOLVADEXin (tamoksifeenisitraatti) käytön lopettamisen jälkeen. NOLVADEX (tamoksifeenisitraatti) voi vahingoittaa sikiötäsi. NOLVADEXin (tamoksifeenisitraatti) poistaminen kehosta kestää noin 2 kuukautta. Varmistaaksesi, että et ole raskaana, voit aloittaa NOLVADEXin (tamoksifeenisitraatti) käytön kuukautisten aikana. Tai voit tehdä raskaustestin varmistaaksesi, ettet ole raskaana, ennen kuin aloitat.
- Imettävät. Emme tiedä, voiko NOLVADEX (tamoksifeenisitraatti) kulkeutua maidon läpi ja vahingoittaa vauvaasi.
- Sinulla on ollut allerginen reaktio NOLVADEXille (tamoksifeenisitraatti) tai tamoksifeenille (NOLVADEXin (tamoksifeenisitraatti) toinen nimi) tai jollekin sen inaktiivisista aineosista.
Jos tulet raskaaksi NOLVADEXin (tamoksifeenisitraatti) käytön aikana, lopeta sen käyttö heti ja ota yhteyttä lääkäriisi. NOLVADEX (tamoksifeenisitraatti) voi vahingoittaa sikiötäsi. Älä käytä NOLVADEXia (tamoksifeenisitraattia) vähentääksesi mahdollisuuttasi saada rintasyöpä, jos
- Sinulla on koskaan ollut veritulppa, joka tarvitsi lääketieteellistä hoitoa.
- Käytät verta ohentavia lääkkeitä, kuten varfariinia (kutsutaan myös Coumadin®*).
- Liikkumiskykysi on rajoitettu suurimman osan hereilläolotunneistasi.
- Olet vaarassa saada veritulppia. Lääkärisi voi kertoa sinulle, jos sinulla on suuri riski saada veritulppia.
- Sinulla ei ole normaalia suurempi mahdollisuus saada rintasyöpä. Lääkärisi voi kertoa sinulle, oletko suuren riskin nainen.
Kuinka minun pitäisi ottaa NOLVADEX (tamoksifeenisitraatti)?
- Niele tabletti(t) kokonaisina veden tai muun alkoholittoman nesteen kera. Voit ottaa NOLVADEXin (tamoksifeenisitraatti) ruoan kanssa tai ilman. Ota lääkkeesi joka päivä. Se voi olla helpompi muistaa, jos otat sen samaan aikaan joka päivä.
- Jos unohdat ottaa annoksen, ota se, kun muistat, ja ota sitten seuraava annos tavalliseen tapaan. Jos on melkein aika ottaa seuraava annos tai muistat seuraavan annoksen, älä ota ylimääräisiä tabletteja korvataksesi unohtamasi annoksen.
- Ota NOLVADEX (tamoksifeenisitraatti) 5 vuoden ajan, ellei lääkärisi toisin määrää.
Mitä minun pitäisi välttää NOLVADEXin (tamoksifeenisitraatti) käytön aikana?
- Älä tule raskaaksi NOLVADEXin (tamoksifeenisitraatti) käytön aikana tai 2 kuukauden ajan lopettamisen jälkeen. NOLVADEX (tamoksifeenisitraatti) voi estää hormonaalisten ehkäisymenetelmien toiminnan. Hormonaalisia menetelmiä ovat ehkäisypillerit, laastarit, injektiot, renkaat ja implantit. Siksi, kun käytät NOLVADEXia (tamoksifeenisitraattia), käytä ehkäisymenetelmiä, jotka eivät käytä hormoneja, kuten kondomit, spermisidillä varustetut palleat tai tavalliset IUD:t. Jos tulet raskaaksi, lopeta NOLVADEXin (tamoksifeenisitraatti) käyttö heti ja soita lääkärillesi.
- Älä imetä. Emme tiedä, voiko NOLVADEX (tamoksifeenisitraatti) kulkeutua maidon läpi ja voiko se vahingoittaa vauvaa.
Mitä minun pitäisi tehdä, kun käytän NOLVADEXia (tamoksifeenisitraatti)?
- Käy säännöllisesti gynekologisissa tarkastuksissa ("naisten tarkastukset"), rintojen tarkastuksessa ja mammografiassa. Lääkärisi kertoo sinulle kuinka usein. Nämä tarkistavat rintasyövän ja kohdun limakalvon syövän merkkejä. Koska NOLVADEX (tamoksifeenisitraatti) ei estä kaikkia rintasyöpiä ja saatat saada muun tyyppisiä syöpiä, tarvitset näitä kokeita löytääksesi syövät mahdollisimman aikaisin.
- Koska NOLVADEX (tamoksifeenisitraatti) voi aiheuttaa vakavia sivuvaikutuksia, kiinnitä erityistä huomiota kehoosi. Merkit, joita sinun tulee etsiä, on lueteltu kohdassa "Mitä ovat NOLVADEXin (tamoksifeenisitraatin) mahdolliset sivuvaikutukset?"
- Kerro kaikille lääkäreille, että käytät NOLVADEXia (tamoksifeenisitraattia).
- Kerro heti lääkärillesi, jos sinulla on uusia kyhmyjä rinnassa.
Yleistä tietoa NOLVADEXin (tamoksifeenisitraatin) turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Lääkärisi on määrännyt NOLVADEXia (tamoksifeenisitraattia) vain sinulle. Älä anna sitä muille ihmisille, vaikka heillä olisi samanlainen sairaus, koska se voi vahingoittaa heitä. Älä käytä sitä sairauteen, johon sitä ei ole määrätty.
Tämä lääkitysopas on tiivistelmä tiedoista NOLVADEXista (tamoksifeenisitraatti) naisille, jotka käyttävät NOLVADEXia (tamoksifeenisitraattia) pienentääkseen suurta mahdollisuuttaan saada rintasyöpä tai joilla on DCIS. Jos haluat lisätietoja NOLVADEXista (tamoksifeenisitraatti), kysy lääkäriltäsi tai apteekista. He voivat antaa sinulle tietoa NOLVADEXista (tamoksifeenisitraatista), joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja NOLVADEXista (tamoksifeenisitraatti) tai rintasyövästä on osoitteessa www.NOLVADEX (tamoksifeenisitraatti) .com tai soittamalla numeroon 1-800-236-9933.
Ainesosat: tamoksifeenisitraatti, karboksimetyyliselluloosakalsium, magnesiumstearaatti, mannitoli ja tärkkelys.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto
