Mobic 7.5mg, 15mg Meloxicam Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Mobic 15mg on ja miten sitä käytetään?
Mobic 7,5 mg on reseptillä määrätty ei-steroidinen tulehduskipulääke, jota käytetään nivelrikon, nivelreuman ja kohtalaisen tai vaikean kivun oireiden hoitoon. Mobic 7,5 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Mobic on ei-steroidinen tulehduskipulääke (NSAID).
Ei tiedetä, onko Mobic turvallinen ja tehokas lapsille, jotka painavat alle 60 kg.
Mitkä ovat Mobic 7,5 mg:n mahdolliset sivuvaikutukset?
- kaikenlainen ihottuma,
- hengenahdistus,
- turvotus,
- nopea painonnousu,
- veriset tai tervamaiset ulosteet,
- veren yskiminen tai oksennus, joka näyttää kahvinporolta,
- pahoinvointi,
- ylävatsakipu,
- kutina,
- väsynyt olo,
- flunssan kaltaiset oireet,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- silmien tai ihon kellastuminen (keltatauti),
- kalpea iho,
- väsymys,
- huimaus,
- kylmät kädet tai jalat,
- vähän tai ei ollenkaan virtsaamista ja
- turvotus jaloissa tai nilkoissa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Mobic 15mg:n yleisimmät sivuvaikutukset ovat:
- vatsakipu,
- pahoinvointi,
- oksentelua,
- närästys,
- ripuli,
- ummetus,
- kaasu,
- huimaus ja
- vilustumisen tai flunssan oireita
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Mobicin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VAKAVIEN SYDÄN-VERENSUUNION JA MAA-SUOLTOTAPAHTUMIEN RISKI
Kardiovaskulaariset tromboottiset tapahtumat
- Ei-steroidiset tulehduskipulääkkeet (NSAID) lisäävät vakavien kardiovaskulaaristen tromboottisten tapahtumien riskiä, mukaan lukien sydäninfarkti ja aivohalvaus, jotka voivat olla hengenvaarallisia. Tämä riski voi ilmetä hoidon varhaisessa vaiheessa ja voi lisääntyä käytön keston myötä [ks. VAROITUKSET JA VAROTOIMET].
- MOBIC 7,5 mg on vasta-aiheinen sepelvaltimon ohitusleikkauksen (CABG) yhteydessä [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET].
Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatiot
- Tulehduskipulääkkeet lisäävät vakavien maha-suolikanavan (GI) haittatapahtumien riskiä, mukaan lukien verenvuoto, haavaumat ja mahalaukun tai suoliston perforaatiot, jotka voivat olla kohtalokkaita. Nämä tapahtumat voivat tapahtua milloin tahansa käytön aikana ja ilman varoittavia oireita. Iäkkäät potilaat ja potilaat, joilla on aiemmin ollut peptinen haavasairaus ja/tai GI-verenvuoto, ovat suurempi riski saada vakavia GI-tapahtumia (ks. VAROITUKSET JA VAROTOIMET).
KUVAUS
MOBIC (meloksikaami) on ei-steroidinen tulehduskipulääke (NSAID). Yksi pastellinkeltainen MOBIC 15 mg tabletti sisältää 7,5 mg tai 15 mg meloksikaamia suun kautta annettavaksi. Meloksikaami on kemiallisesti nimetty 4-hydroksi-2-metyyli-N-(5-metyyli-2-tiatsolyyli)-2H-1,2-bentsotiatsiini-3-karboksamidi-1,1-dioksidiksi. Molekyylipaino on 351,4. Sen empiirinen kaava on C14H13N3O4S2 ja sillä on seuraava rakennekaava:
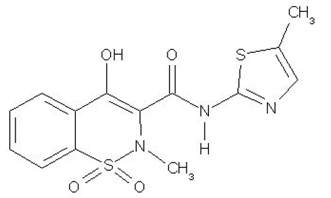
Meloksikaami on pastellinkeltainen kiinteä aine, joka on käytännöllisesti katsoen veteen liukenematon, ja vahvempi liukoisuus vahvoihin happoihin ja emäksiin. Se liukenee hyvin heikosti metanoliin. Meloksikaamin näennäinen jakautumiskerroin (log P)app = 0,1 n-oktanoli/puskurissa pH 7,4. Meloksikaamin pKa-arvot ovat 1,1 ja 4,2.
MOBIC 15 mg on saatavana tabletteina suun kautta annettavaksi, joka sisältää 7,5 mg tai 15 mg meloksikaamia.
MOBIC 15 mg tablettien inaktiivisia aineosia ovat kolloidinen piidioksidi, krospovidoni, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa, povidoni ja natriumsitraattidihydraatti.
INDIKAATIOT
Nivelrikko (OA)
MOBIC on tarkoitettu nivelrikon merkkien ja oireiden lievittämiseen [katso Kliiniset tutkimukset
Nivelreuma (RA)
MOBIC on tarkoitettu nivelreuman merkkien ja oireiden lievittämiseen [katso Kliiniset tutkimukset ].
Nuorten nivelreuma (JRA) pauciarticular ja polyarticular Course
MOBIC 7,5 mg on tarkoitettu lievittämään nivelreuman tai moninivelisen taudin merkkejä ja oireita potilailla, jotka painavat ≥ 60 kg [ks. ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Yleiset annosteluohjeet
Harkitse huolellisesti MOBICin ja muiden hoitovaihtoehtojen mahdollisia hyötyjä ja riskejä ennen kuin päätät käyttää MOBICia. Käytä pienintä tehokasta annosta lyhimmän keston ajan yksittäisten potilaan hoitotavoitteiden mukaisesti [katso VAROITUKSET JA VAROTOIMET ].
Kun olet tarkkailenut vastetta alkuperäiseen MOBIC-hoitoon, säädä annosta yksilöllisen potilaan tarpeiden mukaan.
Aikuisilla suurin suositeltu päivittäinen suun kautta otettava MOBIC-annos on 15 mg formulaatiosta riippumatta. Hemodialyysipotilaille suositellaan 7,5 mg:n päivittäistä enimmäisannostusta [katso Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA
MOBIC voidaan ottaa ruokailuajasta riippumatta.
Nivelrikko
Nivelrikon merkkien ja oireiden lievittämiseksi MOBICin suositeltu aloitus- ja ylläpitoannos suun kautta on 7,5 mg kerran vuorokaudessa. Jotkut potilaat voivat saada lisähyötyä nostamalla annosta 15 mg:aan kerran vuorokaudessa.
Nivelreuma
Nivelreuman merkkien ja oireiden lievittämiseksi MOBIC 7,5 mg:n suositeltu aloitus- ja ylläpitoannos suun kautta on 7,5 mg kerran vuorokaudessa. Jotkut potilaat voivat saada lisähyötyä nostamalla annosta 15 mg:aan kerran vuorokaudessa.
Nuorten nivelreuma (JRA) pauciarticular ja polyarticular Course
Nuorten nivelreuman hoidossa suositeltu MOBIC 7,5 mg -annos suun kautta on 7,5 mg kerran vuorokaudessa lapsille, jotka painavat ≥ 60 kg. Kliinisissä tutkimuksissa annoksen suurentamisesta yli 7,5 mg:aan ei osoitettu lisähyötyä.
MOBIC-tabletteja ei tule käyttää lapsille, jotka painavat alle 60 kg.
Munuaisten vajaatoiminta
MOBIC 15 mg:n käyttöä potilaille, joilla on vaikea munuaisten vajaatoiminta, ei suositella.
Hemodialyysipotilailla MOBICin enimmäisannos on 7,5 mg päivässä [katso KLIININEN FARMAKOLOGIA ].
Ei vaihdettavissa muiden meloksikaamin formulaatioiden kanssa
MOBIC-tabletit eivät ole osoittaneet vastaavaa systeemistä altistusta muille hyväksytyille suun kautta otettavan meloksikaamin muodoille. Siksi MOBIC 7,5 mg -tabletit eivät ole vaihdettavissa muiden oraalisen meloksikaamivalmisteen kanssa, vaikka kokonaismilligrammavahvuus olisi sama. Älä korvaa samanlaisia annosvahvuuksia MOBIC 7,5 mg -tabletteja muilla suun kautta otettavalla meloksikaamivalmisteella.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
MOBIC (meloksikaami) -tabletit:
- 7,5 mg: pastellinkeltainen, pyöreä, kaksoiskupera, päällystämätön tabletti, joka sisältää 7,5 mg meloksikaamia. Toisella puolella on Boehringer Ingelheim -logo ja toisella puolella M-kirjain.
- 15 mg: pastellinkeltainen, pitkänomainen, kaksoiskupera, päällystämätön tabletti, joka sisältää 15 mg meloksikaamia. Tabletin toisella puolella on merkintä "15" ja toisella kirjain "M".
Varastointi ja käsittely
MOBIC on saatavana pastellinkeltaisena, pyöreänä, kaksoiskupera, päällystämätön tabletti, joka sisältää 7,5 mg meloksikaamia, tai pastellinkeltainen, pitkänomainen, kaksoiskupera, päällystämätön tabletti, joka sisältää 15 mg meloksikaamia. 7,5 mg:n tabletin toisella puolella on Boehringer Ingelheim -logo ja toisella puolella M-kirjain. 15 mg:n tabletin toiselle puolelle on painettu tabletin koodi "15" ja toiselle puolelle kirjain "M".
MOBIC (meloksikaami) tabletit 7,5 mg: NDC 0597-0029-01; Pullot 100
MOBIC (meloksikaami) tabletit 15 mg: NDC 0597-0030-01; Pullot 100
Varastointi
Säilytä 20°C - 25°C (68°F - 77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ]. Säilytä MOBIC-tabletit kuivassa paikassa.
Annostele tabletit tiiviiseen astiaan.
Pidä tämä ja kaikki lääkkeet poissa lasten ulottuvilta.
Jakelija: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Tarkistettu: huhtikuu 2021
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Kardiovaskulaariset tromboottiset tapahtumat [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- GI-verenvuoto, haavaumat ja perforaatio [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Hypertensio [katso VAROITUKSET JA VAROTOIMET ]
- Sydämen vajaatoiminta ja turvotus [katso VAROITUKSET JA VAROTOIMET ]
- Munuaisten toksisuus ja hyperkalemia [katso VAROITUKSET JA VAROTOIMET ]
- Anafylaktiset reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihoreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS) [katso VAROITUKSET JA VAROTOIMET ]
- Sikiön toksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Hematologinen toksisuus [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset
Nivelrikko ja nivelreuma
MOBIC-vaiheen 2/3 kliinisten tutkimusten tietokanta sisältää 10 122 nivelreumapotilasta ja 1012 nivelreumapotilasta, joita hoidettiin MOBICilla 7,5 mg/vrk, 3505 nivelreumapotilasta ja 1351 nivelreumapotilasta, joita hoidettiin MOBICilla 15 mg/vrk. MOBICia annettiin näillä annoksilla 661 potilaalle vähintään 6 kuukauden ajan ja 312 potilaalle vähintään vuoden ajan. Noin 10 500 näistä potilaista hoidettiin kymmenessä lumelääke- ja/tai aktiivikontrolloidussa nivelrikkotutkimuksessa, ja 2 363 näistä potilaista hoidettiin kymmenessä lumelääke- ja/tai aktiivikontrolloidussa nivelreumatutkimuksessa. Ruoansulatuskanavan (GI) haittatapahtumat olivat useimmin raportoituja haittavaikutuksia kaikissa hoitoryhmissä MOBIC 15 mg -tutkimuksissa.
Potilailla, joilla oli polven tai lonkan nivelrikko, suoritettiin 12 viikkoa kestänyt monikeskustutkimus, kaksoissokkoutettu, MOBIC 7,5 mg:n tehon ja turvallisuuden vertaamiseksi lumelääkkeeseen ja aktiiviseen kontrolliin. Kaksi 12 viikkoa kestänyt monikeskus, kaksoissokkoutettu, satunnaistettu tutkimus suoritettiin nivelreumapotilailla MOBICin tehon ja turvallisuuden vertaamiseksi lumelääkkeeseen.
Taulukko 1a kuvaa haittatapahtumia, joita esiintyi ≥ 2 %:lla MOBIC-hoitoryhmistä 12 viikon lumelääke- ja aktiivisesti kontrolloidussa nivelrikkotutkimuksessa.
Taulukko 1b kuvaa haittatapahtumia, joita esiintyi ≥ 2 %:lla MOBIC 7,5 mg -hoitoryhmistä kahdessa 12 viikkoa kestäneessä lumekontrolloidussa nivelreumatutkimuksessa.
Haittatapahtumat, joita esiintyi MOBIC 15 mg:lla ≥ 2 %:lla potilaista, joita hoidettiin lyhytaikaisesti (4–6 viikkoa) ja pitkäaikaisesti (6 kuukautta) aktiivisesti kontrolloiduissa nivelrikkotutkimuksissa, on esitetty taulukossa 2.
Suurempiin MOBIC-annoksiin (22,5 mg ja enemmän) on liitetty vakavien maha-tautitapahtumien riskin lisääntyminen; siksi MOBIC 15 mg:n vuorokausiannos ei saa ylittää 15 mg:aa.
Pediatria
Nuorten nivelreuma (JRA)
Kolmesataakahdeksankymmentäseitsemän potilasta, joilla oli pauciaartikulaarinen ja moninivelinen JRA, altistettiin MOBIC 15 mg:lle annoksilla 0,125–0,375 mg/kg päivässä kolmessa kliinisessä tutkimuksessa. Nämä tutkimukset koostuivat kahdesta 12 viikkoa kestäneestä monikeskustutkimuksesta, kaksoissokkoutetusta, satunnaistetusta tutkimuksesta (toisessa 12 viikon avoimessa jatkotutkimuksessa ja toisessa 40 viikon jatkotutkimuksessa) ja yhdestä 1 vuoden avoimesta farmakokineettisestä tutkimuksesta. Näissä MOBIC 15 mg:n lapsitutkimuksissa havaitut haittatapahtumat olivat luonteeltaan samanlaisia kuin aikuisten kliinisissä tutkimuksissa, vaikka esiintymistiheydessä oli eroja. Erityisesti seuraavat yleisimmät haittatapahtumat, vatsakipu, oksentelu, ripuli, päänsärky ja kuume, olivat yleisempiä lapsipotilailla kuin aikuisilla tehdyissä tutkimuksissa. Ihottumaa raportoitiin seitsemällä (
Seuraavassa on luettelo haittavaikutuksista, joita esiintyi
Keho kokonaisuutena: allerginen reaktio, kasvojen turvotus, väsymys, kuume, kuumat aallot, huonovointisuus, pyörtyminen, painon lasku, painon nousu
Sydän ja verisuoni: angina pectoris, sydämen vajaatoiminta, kohonnut verenpaine, hypotensio, sydäninfarkti, vaskuliitti
Keskus- ja ääreishermosto: kouristukset, parestesia, vapina, huimaus
Ruoansulatuskanava : paksusuolitulehdus, suun kuivuminen, pohjukaissuolihaava, punoitus, ruokatorven tulehdus, mahahaava, gastriitti, gastroesofageaalinen refluksi, maha-suolikanavan verenvuoto, hematemesis, verenvuoto, pohjukaissuolihaava, verenvuoto pohjukaissuolihaava, pohjukaissuolihaava, perforaatio, suolen perforaatio, haimahaava, melena, haavainen
Syke ja rytmi: rytmihäiriö, sydämentykytys, takykardia
Hematologinen: leukopenia, purppura, trombosytopenia
Maksa ja sappijärjestelmä: ALAT lisääntynyt, ASAT lisääntynyt, bilirubinemia, GGT lisääntynyt, hepatiitti
Metabolinen ja ravitsemus : kuivuminen
Psykiatrinen : epänormaalit unet, ahdistus, lisääntynyt ruokahalu, sekavuus, masennus, hermostuneisuus, uneliaisuus
Hengitys : astma, bronkospasmi, hengenahdistus
Iho ja lisäkkeet: hiustenlähtö, angioedeema, rakkuloiden eruptio, valoherkkyysreaktio, kutina, lisääntynyt hikoilu, nokkosihottuma
Erityiset aistit: epänormaali näkö, sidekalvotulehdus, makuaistin vääristyminen, tinnitus
Virtsajärjestelmä : albuminuria, lisääntynyt BUN, kohonnut kreatiniini, hematuria, munuaisten vajaatoiminta
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu MOBICin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Päätökset siitä, sisällytetäänkö spontaaneista ilmoituksista haitallinen tapahtuma merkintään, perustuvat yleensä yhteen tai useampaan seuraavista tekijöistä: (1) tapahtuman vakavuus, (2) ilmoitusten määrä tai (3) syy-yhteyden vahvuus huume. Maailmanlaajuisessa markkinoille tulon jälkeisessä kokemuksessa tai kirjallisuudessa raportoituja haittavaikutuksia ovat: akuutti virtsanpidätys; agranulosytoosi; mielialan muutokset (kuten mielialan kohoaminen); anafylaktoidiset reaktiot mukaan lukien sokki; erythema multiforme; exfoliatiivinen dermatiitti; interstitiaalinen nefriitti; keltaisuus; maksan vajaatoiminta; Stevens Johnsonin oireyhtymä; toksinen epidermaalinen nekrolyysi ja naisten hedelmättömyys.
HUUMEIDEN VUOROVAIKUTUKSET
Katso taulukosta 3 kliinisesti merkittäviä yhteisvaikutuksia meloksikaamin kanssa. Katso myös VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA .
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Kardiovaskulaariset tromboottiset tapahtumat
Useiden COX-2-selektiivisten ja ei-selektiivisten tulehduskipulääkkeiden kliiniset tutkimukset, jotka kestivät enintään kolme vuotta, ovat osoittaneet lisääntyneen vakavien kardiovaskulaaristen (CV) tromboottisten tapahtumien, mukaan lukien sydäninfarktin (MI) ja aivohalvauksen, riskin, jotka voivat johtaa kuolemaan. Saatavilla olevien tietojen perusteella on epäselvää, että sydän- ja verisuonitautien tromboottisten tapahtumien riski on samanlainen kaikilla tulehduskipulääkkeillä. NSAID-lääkkeiden käytön aiheuttama vakavien CV-tromboottisten tapahtumien suhteellinen lisääntyminen lähtötasoon verrattuna näyttää olevan samanlainen niillä, joilla on tunnettu sydänsairaus tai sydän- ja verisuonitautien riskitekijöitä. Potilailla, joilla oli tunnettu sydän- ja verisuonitukosairaus tai riskitekijöitä, oli kuitenkin suurempi ylimääräisten vakavien sydän- ja verisuonitautitapahtumien absoluuttinen ilmaantuvuus, mikä johtui heidän kohonneesta lähtötasosta. Joissakin havainnointitutkimuksissa havaittiin, että tämä lisääntynyt vakavien sydän- ja verisuonitautien tromboottisten tapahtumien riski alkoi jo ensimmäisten hoitoviikkojen aikana. CV-tromboottisen riskin lisääntyminen on havaittu johdonmukaisimmin suuremmilla annoksilla.
Minimoidaksesi haitallisten sydän- ja verisuonitapahtumien riski NSAID-hoitoa saavilla potilailla, käytä pienintä tehokasta annosta mahdollisimman lyhyen ajan. Lääkäreiden ja potilaiden tulee pysyä valppaina tällaisten tapahtumien kehittymisen suhteen koko hoitojakson ajan, vaikka aiempia CV-oireita ei olisikaan ollut. Potilaille tulee kertoa vakavien CV-tapahtumien oireista ja toimenpiteistä, joihin on ryhdyttävä, jos niitä ilmenee.
Ei ole olemassa johdonmukaista näyttöä siitä, että aspiriinin samanaikainen käyttö pienentäisi NSAID-lääkkeiden käyttöön liittyvien vakavien sydän- ja verisuonitautitapahtumien riskiä. Aspiriinin ja tulehduskipulääkkeen, kuten meloksikaamin, samanaikainen käyttö lisää vakavien maha-suolikanavan (GI) tapahtumien riskiä [ks. VAROITUKSET JA VAROTOIMET ].
Tila Sepelvaltimon ohitussiirteen (CABG) jälkeisen leikkauksen jälkeen
Kahdessa suuressa, kontrolloidussa kliinisessä tutkimuksessa COX-2-selektiivisillä tulehduskipulääkkeillä kivun hoitoon ensimmäisten 10–14 päivän aikana CABG-leikkauksen jälkeen havaittiin lisääntyneen sydäninfarktin ja aivohalvauksen ilmaantuvuus. Tulehduskipulääkkeet ovat vasta-aiheisia CABG:n asetuksissa [katso VASTA-AIHEET ].
MI-potilaat
Tanskan kansallisessa rekisterissä tehdyt havainnointitutkimukset ovat osoittaneet, että potilailla, joita hoidettiin tulehduskipulääkkeillä MI:n jälkeisenä aikana, oli lisääntynyt riski saada uusinta infarktia, sydän- ja verisuonisairauksiin liittyvää kuolemaa ja yleiskuolleisuutta ensimmäisestä hoitoviikosta alkaen. Tässä samassa kohortissa kuoleman ilmaantuvuus ensimmäisenä vuonna MI:n jälkeisenä vuonna oli 20 tapausta 100 henkilövuotta kohden NSAID-hoitoa saaneilla potilailla, kun taas 12 tapausta 100 henkilövuotta kohden ei-NSAID-potilailla. Vaikka absoluuttinen kuolleisuus laski jonkin verran ensimmäisen vuoden MI:n jälkeen, lisääntynyt suhteellinen kuolemanriski NSAID-käyttäjien keskuudessa säilyi ainakin neljän seuraavan seurantavuoden ajan.
Vältä MOBIC 15 mg:n käyttöä potilailla, joilla on äskettäin sydäninfarkti, ellei hyödyn odoteta ylittävän toistuvien sydän- ja verisuonitukosten riskiä. Jos MOBIC 15 mg:aa käytetään potilailla, joilla on äskettäin sydäninfarkti, tarkkaile potilaita sydämen iskemian merkkien varalta.
Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatio
Tulehduskipulääkkeet, mukaan lukien meloksikaami, voivat aiheuttaa vakavia maha-suolikanavan (GI) haittavaikutuksia, kuten tulehdusta, verenvuotoa, haavaumia ja ruokatorven, mahan, ohutsuolen tai paksusuolen perforaatiota, jotka voivat olla kohtalokkaita. Näitä vakavia haittavaikutuksia voi esiintyä milloin tahansa varoittavien oireiden kanssa tai ilman niitä potilailla, joita hoidetaan tulehduskipulääkkeillä. Vain joka viides potilas, jolle kehittyy vakava ylemmän maha-suolikanavan haittatapahtuma NSAID-hoidon aikana, on oireellinen. NSAID-lääkkeiden aiheuttamia mahahaavoja, voimakasta verenvuotoa tai perforaatiota esiintyi noin 1 %:lla potilaista, joita hoidettiin 3–6 kuukautta, ja noin 2–4 %:lla vuoden ajan hoidetuista potilaista. Edes lyhytaikainen NSAID-hoito ei kuitenkaan ole vaaratonta.
GI-verenvuodon, haavauman ja perforaation riskitekijät
Potilailla, joilla oli aiemmin ollut mahahaava ja/tai maha-suolikanavan verenvuotoa ja jotka käyttivät tulehduskipulääkkeitä, oli yli 10-kertainen riski saada maha-suolikanavan verenvuoto verrattuna potilaisiin, joilla ei ollut näitä riskitekijöitä. Muita tekijöitä, jotka lisäävät ruoansulatuskanavan verenvuodon riskiä tulehduskipulääkkeillä hoidetuilla potilailla, ovat NSAID-hoidon pidempi kesto; suun kautta otettavien kortikosteroidien, aspiriinin, antikoagulanttien tai selektiivisten serotoniinin takaisinoton estäjien (SSRI) samanaikainen käyttö; tupakointi; alkoholin käyttö; vanhempi ikä; ja huono yleinen terveydentila. Useimmat markkinoille tulon jälkeisistä kuolemaan johtaneista GI-tapahtumista tapahtuneista raporteista tapahtuivat iäkkäillä tai heikkokuntoisilla potilailla. Lisäksi potilailla, joilla on pitkälle edennyt maksasairaus ja/tai koagulopatia, on suurentunut ruoansulatuskanavan verenvuodon riski.
Strategiat GI-riskien minimoimiseksi NSAID-hoidetuilla potilailla
- Käytä pienintä tehokasta annosta mahdollisimman lyhyen ajan.
- Vältä useamman kuin yhden tulehduskipulääkkeen antamista kerrallaan.
- Vältä käyttöä potilailla, joilla on suurempi riski, ellei hyödyn odoteta olevan suurempi kuin lisääntynyt verenvuotoriski. Tällaisille potilaille sekä potilaille, joilla on aktiivinen maha-suolikanavan verenvuoto, harkitse muita vaihtoehtoisia hoitoja kuin tulehduskipulääkkeitä.
- Pysy valppaana GI-haavan ja verenvuodon merkkien ja oireiden varalta NSAID-hoidon aikana.
- Jos epäillään vakavaa GI-haittatapahtumaa, aloita viipymättä arviointi ja hoito ja keskeytä MOBIC 15mg, kunnes vakava GI-haittatapahtuma on suljettu pois.
- Jos käytät samanaikaisesti pieniannoksista aspiriinia sydämen ennaltaehkäisyyn, seuraa potilaita tarkemmin GI-verenvuodon varalta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Maksatoksisuus
Kliinisissä tutkimuksissa noin 1 %:lla NSAID-hoitoa saaneista potilaista on raportoitu ALAT- tai ASAT-arvon kohoamista (kolme tai useampi kertaa normaalin ylärajan [ULN]). Lisäksi on raportoitu harvoin, joskus kuolemaan johtaneita, vakavia maksavaurioita, mukaan lukien fulminantti hepatiitti, maksanekroosi ja maksan vajaatoiminta.
ALAT- tai ASAT-arvojen nousua (alle kolme kertaa ULN) voi esiintyä jopa 15 %:lla potilaista, joita hoidetaan tulehduskipulääkkeillä, mukaan lukien meloksikaamilla.
Kerro potilaille maksatoksisuuden varoitusmerkeistä ja oireista (esim. pahoinvointi, väsymys, letargia, ripuli, kutina, keltaisuus, oikean yläneljänneksen arkuus ja "flunssan kaltaiset" oireet). Jos kehittyy maksasairauteen vastaavia kliinisiä oireita tai oireita (esim. eosinofilia, ihottuma jne.), keskeytä MOBIC välittömästi ja suorita kliininen arvio potilaalle [ks. Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Hypertensio
Tulehduskipulääkkeet, mukaan lukien MOBIC, voivat johtaa olemassa olevan verenpainetaudin uuteen puhkeamiseen tai pahenemiseen, mikä voi lisätä sydän- ja verisuonitapahtumien ilmaantuvuutta. Angiotensiinia konvertoivan entsyymin (ACE) estäjiä, tiatsididiureetteja tai loop-diureetteja käyttävillä potilailla voi olla heikentynyt vaste näihin hoitoihin, kun he käyttävät tulehduskipulääkkeitä (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Seuraa verenpainetta (BP) NSAID-hoidon aloittamisen aikana ja koko hoidon ajan.
Sydämen vajaatoiminta ja turvotus
Coxib ja perinteisten NSAID Trialists’ Collaboration -meta-analyysi satunnaistetuista kontrolloiduista tutkimuksista osoitti noin kaksinkertaisen sydämen vajaatoiminnan vuoksi sairaalahoitoihin joutumisen COX-2-selektiivisesti hoidetuilla potilailla ja ei-selektiivisillä NSAID-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin. Tanskan kansallisen rekisterin tutkimuksessa sydämen vajaatoimintapotilailla NSAID-lääkkeiden käyttö lisäsi sydäninfarktin, sydämen vajaatoiminnan vuoksi sairaalahoidon ja kuoleman riskiä.
Lisäksi joillakin tulehduskipulääkkeillä hoidetuilla potilailla on havaittu nesteen kertymistä ja turvotusta. Meloksikaamin käyttö voi heikentää useiden näiden sairauksien hoitoon käytettyjen terapeuttisten aineiden (esim. diureetit, ACE:n estäjät tai angiotensiinireseptorin salpaajat [ARB:t]) CV-vaikutuksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vältä MOBIC 15 mg:n käyttöä potilailla, joilla on vaikea sydämen vajaatoiminta, ellei hyödyn odoteta ylittävän sydämen vajaatoiminnan pahenemisen riskiä. Jos MOBICia käytetään potilailla, joilla on vaikea sydämen vajaatoiminta, seuraa potilaita sydämen vajaatoiminnan pahenemisen varalta.
Munuaisten toksisuus ja hyperkalemia
Munuaisten toksisuus
Tulehduskipulääkkeiden, mukaan lukien MOBIC, pitkäaikainen käyttö on johtanut munuaisten papillaarinekroosiin, munuaisten vajaatoimintaan, akuuttiin munuaisten vajaatoimintaan ja muihin munuaisvaurioihin.
Munuaistoksisuutta on havaittu myös potilailla, joilla munuaisten prostaglandiineilla on kompensoiva rooli munuaisten perfuusion ylläpitämisessä. Näillä potilailla tulehduskipulääkkeiden antaminen voi vähentää annoksesta riippuvaa prostaglandiinien muodostumista ja toissijaisesti munuaisten verenkiertoa, mikä voi aiheuttaa ilmeistä munuaisten vajaatoimintaa. Suurin tämän reaktion riski on potilailla, joilla on munuaisten vajaatoiminta, nestehukka, hypovolemia, sydämen vajaatoiminta, maksan toimintahäiriö, diureetteja ja ACE:n estäjiä tai ARB-lääkkeitä käyttävillä ja vanhuksilla. NSAID-hoidon lopettamista seuraa yleensä palautuminen hoitoa edeltävään tilaan.
MOBICin munuaisvaikutukset voivat nopeuttaa munuaisten vajaatoiminnan etenemistä potilailla, joilla on aiempi munuaissairaus. Koska jotkin MOBIC-metaboliitit erittyvät munuaisten kautta, tarkkaile potilaita munuaisten toiminnan heikkenemisen varalta.
Korjaa tilavuustila kuivuneilla tai hypovoleemisilla potilailla ennen MOBIC-hoidon aloittamista. Seuraa munuaisten toimintaa potilailla, joilla on munuaisten tai maksan vajaatoiminta, sydämen vajaatoiminta, nestehukka tai hypovolemia MOBICin käytön aikana [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Kontrolloiduista kliinisistä tutkimuksista ei ole saatavilla tietoa MOBIC 15 mg:n käytöstä potilailla, joilla on pitkälle edennyt munuaissairaus. Vältä MOBIC 7,5 mg:n käyttöä potilailla, joilla on pitkälle edennyt munuaissairaus, ellei hyödyn odoteta ylittävän munuaisten toiminnan huononemisen riskiä. Jos MOBICia käytetään potilailla, joilla on pitkälle edennyt munuaissairaus, seuraa potilaita munuaisten toiminnan heikkenemisen merkkien varalta [ks. KLIININEN FARMAKOLOGIA ].
Hyperkalemia
Seerumin kaliumpitoisuuden nousua, mukaan lukien hyperkalemiaa, on raportoitu NSAID-lääkkeiden käytön yhteydessä, jopa joillakin potilailla, joilla ei ole munuaisten vajaatoimintaa. Potilailla, joilla on normaali munuaisten toiminta, näiden vaikutusten on katsottu johtuvan hyporeneemis-hypoaldosteronismista.
Anafylaktiset reaktiot
Meloksikaamiin on liittynyt anafylaktisia reaktioita potilailla, joilla on tai ei ole tunnettua yliherkkyyttä meloksikaamille sekä potilailla, joilla on aspiriinille herkkä astma [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Hakeudu hätäapua, jos anafylaktinen reaktio ilmenee.
Aspiriiniherkkyyteen liittyvä astman paheneminen
Astmaa sairastavien potilaiden alaryhmällä voi olla aspiriinille herkkä astma, johon voi sisältyä krooninen rinosinusiitti, joka on komplisoitunut nenäpolyyppien vuoksi; vakava, mahdollisesti kuolemaan johtava bronkospasmi; ja/tai intoleranssi aspiriinille ja muille tulehduskipulääkkeille. Koska aspiriinin ja muiden tulehduskipulääkkeiden välistä ristireaktiivisuutta on raportoitu tällaisilla aspiriinille herkillä potilailla, MOBIC on vasta-aiheinen potilailla, joilla on tällainen aspiriiniherkkyys [ks. VASTA-AIHEET ]. Kun MOBIC 15 mg:aa käytetään potilailla, joilla on aiemmin ollut astma (ilman tunnettua aspiriiniherkkyyttä), seuraa potilaita astman oireiden ja merkkien muutosten varalta.
Vakavat ihoreaktiot
Tulehduskipulääkkeet, mukaan lukien meloksikaami, voivat aiheuttaa vakavia ihohaittavaikutuksia, kuten eksfoliatiivisen ihottuman, Stevens-Johnsonin oireyhtymän (SJS) ja toksisen epidermaalisen nekrolyysin (TEN), jotka voivat olla hengenvaarallisia. Nämä vakavat tapahtumat voivat tapahtua ilman varoitusta. Kerro potilaille vakavien ihoreaktioiden merkeistä ja oireista ja MOBICin käytön lopettamisesta heti, kun ihottumaa tai jokin muu yliherkkyysmerkki ilmaantuu. MOBIC on vasta-aiheinen potilailla, joilla on aiemmin ollut vakavia ihoreaktioita tulehduskipulääkkeille [katso VASTA-AIHEET ].
Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS)
Eosinofilian ja systeemisten oireiden aiheuttamaa lääkereaktiota (DRESS) on raportoitu potilailla, jotka käyttävät tulehduskipulääkkeitä, kuten MOBICia. Jotkut näistä tapahtumista ovat olleet kohtalokkaita tai hengenvaarallisia. DRESS sisältää tyypillisesti, vaikkakaan ei yksinomaan, kuumetta, ihottumaa, lymfadenopatiaa ja/tai kasvojen turvotusta. Muita kliinisiä oireita voivat olla hepatiitti, nefriitti, hematologiset poikkeavuudet, sydänlihastulehdus tai myosiitti. Joskus DRESSin oireet voivat muistuttaa akuuttia virusinfektiota. Eosinofiliaa esiintyy usein. Koska tämän häiriön esiintyminen vaihtelee, muut elinjärjestelmät, joita ei ole mainittu tässä, voivat olla mukana. On tärkeää huomata, että yliherkkyyden varhaisia ilmenemismuotoja, kuten kuumetta tai lymfadenopatiaa, voi esiintyä, vaikka ihottumaa ei olisikaan ilmeistä. Jos tällaisia merkkejä tai oireita ilmenee, lopeta MOBIC-hoito ja arvioi potilas välittömästi.
Sikiön toksisuus
Sikiön valtimotiehyen ennenaikainen sulkeminen
Vältä tulehduskipulääkkeiden, mukaan lukien MOBIC, käyttöä raskaana oleville naisille noin 30. raskausviikolla ja myöhemmin. Tulehduskipulääkkeet, mukaan lukien MOBIC, lisäävät sikiön valtimotiehyen ennenaikaisen sulkeutumisen riskiä suunnilleen tässä raskausiässä.
Oligohydramnion / vastasyntyneen munuaisten vajaatoiminta
Tulehduskipulääkkeiden, mukaan lukien MOBIC 15 mg, käyttö noin 20. raskausviikolla tai myöhemmin raskauden aikana voi aiheuttaa sikiön munuaisten vajaatoimintaa, joka johtaa oligohydramnioniin ja joissakin tapauksissa vastasyntyneen munuaisten vajaatoimintaan. Näitä haittavaikutuksia havaitaan keskimäärin päivien tai viikkojen hoidon jälkeen, vaikka oligohydramnionista on raportoitu harvoin jo 48 tunnin kuluttua NSAID-lääkkeiden käytön aloittamisesta. Oligohydramnion parantuu usein, mutta ei aina, kun hoito lopetetaan. Pitkittyneen oligohydramnionin komplikaatioita voivat olla esimerkiksi raajojen supistukset ja viivästynyt keuhkojen kypsyminen. Joissakin markkinoille tulon jälkeisissä tapauksissa, joissa vastasyntyneen munuaisten toiminta on heikentynyt, vaadittiin invasiivisia toimenpiteitä, kuten verensiirtoa tai dialyysiä.
Jos NSAID-hoito on tarpeen noin 20 viikon ja 30 raskausviikon välillä, rajoita MOBICin käyttö pienimpään tehokkaaseen annokseen ja lyhimpään mahdolliseen kestoon. Harkitse lapsivesien ultraäänitutkimusta, jos MOBIC 15 mg -hoito kestää yli 48 tuntia. Lopeta MOBIC 15 mg:n käyttö, jos ilmenee oligohydramnionia ja seuraa kliinisen käytännön mukaisesti [ks. Käyttö tietyissä populaatioissa ].
Hematologinen myrkyllisyys
NSAID-hoitoa saaneilla potilailla on esiintynyt anemiaa. Tämä voi johtua piilevasta tai suuresta verenhukasta, nesteen kertymisestä tai epätäydellisesti kuvatusta vaikutuksesta erytropoieesiin. Jos MOBIC-hoidolla hoidetulla potilaalla on anemian merkkejä tai oireita, tarkkaile hemoglobiinia tai hematokriittiä.
Tulehduskipulääkkeet, mukaan lukien MOBIC 7,5 mg, voivat lisätä verenvuototapahtumien riskiä. Samanaikaiset sairaudet, kuten hyytymishäiriöt tai varfariinin, muiden antikoagulanttien, verihiutaleiden estämiseen tarkoitettujen aineiden (esim. aspiriini), serotoniinin takaisinoton estäjien (SSRI) ja serotoniinin norepinefriinin takaisinoton estäjien (SNRI) samanaikainen käyttö voivat lisätä tätä riskiä. Seuraa näitä potilaita verenvuodon merkkien varalta [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Tulehduksen ja kuumeen peittäminen
MOBIC 15 mg:n farmakologinen aktiivisuus tulehdusta ja mahdollisesti kuumetta vähentävänä voi heikentää diagnostisten merkkien käyttöä infektioiden havaitsemisessa.
Laboratoriovalvonta
Koska vakavaa ruoansulatuskanavan verenvuotoa, maksatoksisuutta ja munuaisvaurioita voi esiintyä ilman varoittavia oireita tai merkkejä, harkitse pitkäaikaista NSAID-hoitoa saavien potilaiden seurantaa CBC:llä ja kemiallisella profiililla säännöllisesti [ks. VAROITUKSET JA VAROTOIMET ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ), joka tulee jokaisen jaetun reseptin mukana.
Kerro potilaille, perheille tai heidän omaishoitajilleen seuraavista tiedoista ennen kuin aloitat NSAID-hoidon ja ajoittain meneillään olevan hoidon aikana.
Kardiovaskulaariset tromboottiset tapahtumat
Neuvo potilaita olemaan valppaana sydän- ja verisuonitromboottisten tapahtumien oireiden suhteen, mukaan lukien rintakipu, hengenahdistus, heikkous tai puheen epäselvyys, ja ilmoittamaan kaikista näistä oireista välittömästi terveydenhuollon tarjoajalleen [ks. VAROITUKSET JA VAROTOIMET ].
Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatio
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalle haavaumien ja verenvuodon oireista, mukaan lukien ylävatsan kipu, dyspepsia, melena ja hematemesis. Jos käytät samanaikaisesti pieniannoksista aspiriinia sydämen ennaltaehkäisyyn, kerro potilaille lisääntyneestä ruoansulatuskanavan verenvuodon merkkien ja oireiden riskistä [ks. VAROITUKSET JA VAROTOIMET ].
Maksatoksisuus
Kerro potilaille maksatoksisuuden varoitusmerkeistä ja oireista (esim. pahoinvointi, väsymys, letargia, ripuli, kutina, keltaisuus, oikean yläneljänneksen arkuus ja "flunssan kaltaiset" oireet). Jos näitä esiintyy, neuvo potilaita lopettamaan MOBIC 7,5 mg:n anto ja hakemaan välitöntä lääketieteellistä hoitoa [katso VAROITUKSET JA VAROTOIMET ].
Sydämen vajaatoiminta ja turvotus
Neuvo potilaita olemaan valppaana sydämen vajaatoiminnan oireista, mukaan lukien hengenahdistus, selittämätön painonnousu tai turvotus, ja ottamaan yhteyttä terveydenhuollon tarjoajaan, jos tällaisia oireita ilmenee [ks. VAROITUKSET JA VAROTOIMET ].
Anafylaktiset reaktiot
Kerro potilaille anafylaktisen reaktion oireista (esim. hengitysvaikeudet, kasvojen tai kurkun turvotus). Neuvo potilaita hakemaan välitöntä hätäapua, jos näitä ilmenee [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Vakavat ihoreaktiot, mukaan lukien DRESS
Neuvo potilaita lopettamaan MOBICin käyttö välittömästi, jos heille ilmaantuu minkäänlainen ihottuma tai kuume, ja ottamaan yhteyttä terveydenhuollon tarjoajaan mahdollisimman pian [ks. VAROITUKSET JA VAROTOIMET ].
Naisen hedelmällisyys
Kertokaa lisääntymiskykyisille naisille, jotka haluavat tulla raskaaksi, että tulehduskipulääkkeet, mukaan lukien MOBIC 7,5 mg, voivat liittyä palautuvaan ovulaation viivästymiseen [ks. Käyttö tietyissä populaatioissa ].
Sikiön toksisuus
Kerro raskaana oleville naisille, että he välttävät MOBIC 15 mg:n ja muiden tulehduskipulääkkeiden käyttöä 30. raskausviikolla, koska sikiön valtimotiehyen ennenaikainen sulkeutuminen on vaarassa. Jos MOBIC 15 mg -hoitoa tarvitaan raskaana olevalle naiselle noin 20–30 raskausviikon välillä, kerro hänelle, että häntä on ehkä seurattava oligohydramnionin varalta, jos hoito jatkuu yli 48 tuntia [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Vältä tulehduskipulääkkeiden samanaikaista käyttöä
Kerro potilaille, että MOBIC 15 mg:n samanaikainen käyttö muiden tulehduskipulääkkeiden tai salisylaattien (esim. diflunisaali, salsalaatti) kanssa ei ole suositeltavaa ruoansulatuskanavan toksisuuden lisääntyneen riskin ja tehon vähäisen tai ei ollenkaan [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Varoita potilaita, että tulehduskipulääkkeitä voi olla "reseptivapaa" lääkkeissä vilustumisen, kuumeen tai unettomuuden hoitoon.
Tulehduskipulääkkeiden ja pieniannoksisten aspiriinin käyttö
Kerro potilaille, etteivät he käytä pieniannoksisia aspiriinia samanaikaisesti MOBIC 7,5 mg:n kanssa, ennen kuin he keskustelevat terveydenhuollon tarjoajansa kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Saat nykyiset reseptitiedot skannaamalla koodin tai soittamalla Boehringer Ingelheim Pharmaceuticals, Inc:lle numeroon 1-800-542-6257.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Pitkäaikaisissa karsinogeenisuustutkimuksissa rotilla (104 viikkoa) ja hiirillä (99 viikkoa) kasvainten ilmaantuvuus ei lisääntynyt, kun meloksikaamia annettiin suun kautta annoksina 0,8 mg/kg/vrk asti ja enintään 8,0 mg/kg/vrk. hiiret (jopa 0,5-kertainen ja vastaavasti 2,6-kertainen ihmisen enimmäisannos [MRHD] 15 mg/vrk MOBIC 7,5 mg perustuen kehon pinta-alan [BSA] vertailuun).
Mutageneesi
Meloksikaami ei ollut mutageeninen Ames-määrityksessä eikä klastogeeninen kromosomipoikkeavuusmäärityksessä ihmisen lymfosyyteillä eikä hiiren luuytimessä tehdyssä in vivo -mikronukleustestissä.
Hedelmällisyyden heikkeneminen
Meloksikaami ei heikentänyt uros- ja naarasrottien hedelmällisyyttä oraalisilla annoksilla 9 mg/kg/vrk uroksilla ja 5 mg/kg/vrk naarailla (jopa 5,8 ja 3,2 kertaa suurempi kuin MRHD:n perusteella). BSA-vertailu).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Tulehduskipulääkkeiden, mukaan lukien MOBIC, käyttö voi aiheuttaa sikiön valtimotiehyen ennenaikaisen sulkeutumisen ja sikiön munuaisten vajaatoiminnan, mikä johtaa oligohydramnioniin ja joissakin tapauksissa vastasyntyneen munuaisten vajaatoimintaan. Näiden riskien vuoksi rajoita MOBICin annosta ja kestoa noin 20-30 raskausviikolla ja vältä MOBICin käyttöä noin 30 raskausviikolla ja myöhemmin raskauden aikana (ks. Kliiniset näkökohdat , Data ).
Sikiön valtimotiehyen ennenaikainen sulkeminen
Tulehduskipulääkkeiden, mukaan lukien MOBIC 15 mg, käyttö noin 30. raskausviikolla tai myöhemmin raskauden aikana lisää sikiön valtimotiehyen ennenaikaisen sulkeutumisen riskiä.
Oligohydramnion / vastasyntyneen munuaisten vajaatoiminta
Tulehduskipulääkkeiden käyttöön noin 20. raskausviikolla tai myöhemmin raskauden aikana on liittynyt tapauksia, joissa sikiön munuaisten toimintahäiriö on johtanut oligohydramnioniin ja joissakin tapauksissa vastasyntyneen munuaisten vajaatoimintaan.
Havaintotutkimuksista saadut tiedot NSAID-lääkkeiden käytön mahdollisista sikiö- ja sikiöriskeistä raskauden ensimmäisen tai toisen kolmanneksen aikana eivät ole vakuuttavia.
Eläinten lisääntymistutkimuksissa havaittiin alkion ja sikiön kuolemaa rotilla ja kaniineilla, joita hoidettiin organogeneesin aikana meloksikaamilla suun kautta otetuilla annoksilla, jotka vastaavat 0,65- ja 6,5-kertaisia MOBICin suositeltuja enimmäisannoksia (MRHD). Väliseinän sydänvaurioiden ilmaantuvuus havaittiin kaneilla, joita hoidettiin koko alkion synnyn ajan meloksikaamilla suun kautta otettavalla annoksella, joka vastasi 78-kertaista MRHD:tä. Pre- ja postnataalisissa lisääntymistutkimuksissa havaittiin lisääntynyttä dystokian, viivästyneen synnytyksen ja jälkeläisten eloonjäämisen vähentymistä meloksikaamin 0,08-kertaisella MRHD:llä. Teratogeenisia vaikutuksia ei havaittu rotilla ja kaneilla, joita hoidettiin meloksikaamilla organogeneesin aikana suun kautta annetulla annoksella, joka vastasi 2,6-kertaista ja 26-kertaista MRHD:tä [ks. Data ].
Eläintietojen perusteella prostaglandiinien on osoitettu olevan tärkeä rooli kohdun limakalvon verisuonten läpäisevyydessä, blastokystien implantaatiossa ja dedikualaatiossa. Eläinkokeissa prostaglandiinin synteesin estäjien, kuten meloksikaamin, antaminen johti lisääntyneeseen ennen ja jälkeen implantaation menetykseen. Prostaglandiinien on myös osoitettu olevan tärkeä rooli sikiön munuaisten kehityksessä. Julkaistuissa eläintutkimuksissa prostaglandiinin synteesin estäjien on raportoitu heikentävän munuaisten kehitystä, kun niitä on annettu kliinisesti merkittävinä annoksina.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Sikiön/vastasyntyneen haittavaikutukset
Sikiön valtimotiehyen ennenaikainen sulkeminen
Vältä tulehduskipulääkkeiden käyttöä naisilla noin 30. raskausviikolla ja myöhemmin raskauden aikana, koska tulehduskipulääkkeet, mukaan lukien MOBIC 7,5 mg, voivat aiheuttaa sikiön valtimotiehyen ennenaikaisen sulkeutumisen (ks. Data ).
Oligohydramnion / vastasyntyneen munuaisten vajaatoiminta
Jos tulehduskipulääkkeitä tarvitaan noin 20 raskausviikolla tai myöhemmin raskauden aikana, rajoita käyttö pienimpään tehokkaaseen annokseen ja lyhimpään mahdolliseen kestoon. Jos MOBIC 15 mg -hoito kestää yli 48 tuntia, harkitse oligohydramnionin tarkkailua ultraäänellä. Jos oligohydramnionin ilmaantuu, lopeta MOBIC 7,5 mg:n käyttö ja seuraa kliinisen käytännön mukaisesti (ks. Data ).
Työ tai toimitus
MOBIC 7,5 mg:n vaikutuksista synnytyksen tai synnytyksen aikana ei ole tutkimuksia. Eläinkokeissa tulehduskipulääkkeet, mukaan lukien meloksikaami, estävät prostaglandiinien synteesiä, viivästävät synnytystä ja lisäävät kuolleena syntymän ilmaantuvuutta.
Data
Ihmistiedot
Sikiön valtimotiehyen ennenaikainen sulkeminen
Julkaistun kirjallisuuden mukaan tulehduskipulääkkeiden käyttö noin 30 raskausviikolla ja myöhemmin raskauden aikana voi aiheuttaa sikiön valtimotiehyen ennenaikaisen sulkeutumisen.
Oligohydramnion / vastasyntyneen munuaisten vajaatoiminta
Julkaistut tutkimukset ja markkinoille tulon jälkeiset raportit kuvaavat äidin tulehduskipulääkkeiden käyttöä noin 20. raskausviikolla tai myöhemmin raskauden aikana, mikä liittyy sikiön munuaisten vajaatoimintaan, joka johtaa oligohydramnioniin ja joissakin tapauksissa vastasyntyneen munuaisten vajaatoimintaan. Näitä haittavaikutuksia havaitaan keskimäärin päivien tai viikkojen hoidon jälkeen, vaikka oligohydramnionista on raportoitu harvoin jo 48 tunnin kuluttua NSAID-lääkkeiden käytön aloittamisesta. Monissa tapauksissa, mutta ei kaikissa, lapsivesien väheneminen oli ohimenevää ja korjaantui lääkkeen käytön lopettamisen jälkeen. Äidin tulehduskipulääkkeiden käytöstä ja vastasyntyneen munuaisten vajaatoiminnasta ilman oligohydramnionia on raportoitu rajoitetusti, joista osa on ollut peruuttamattomia. Jotkut vastasyntyneen munuaisten vajaatoiminnan tapaukset vaativat hoitoa invasiivisilla toimenpiteillä, kuten vaihtosiirrolla tai dialyysillä.
Näiden markkinoille tulon jälkeisten tutkimusten ja raporttien metodologiset rajoitukset sisältävät kontrolliryhmän puuttumisen; rajalliset tiedot annoksesta, lääkkeelle altistumisen kestosta ja ajoituksesta; ja muiden lääkkeiden samanaikainen käyttö. Nämä rajoitukset estävät luotettavan arvion laatimisen haitallisten sikiön ja vastasyntyneiden seurausten riskistä äidin tulehduskipulääkkeiden käytön yhteydessä. Koska julkaistut turvallisuustiedot vastasyntyneiden tuloksista koskivat enimmäkseen keskosia, tiettyjen raportoitujen riskien yleistettävyys äidin käytön kautta tulehduskipulääkkeille altistuneelle täysiaikaiselle lapselle on epävarmaa.
Eläinten tiedot
Meloksikaami ei ollut teratogeeninen, kun sitä annettiin tiineille rotille sikiön organogeneesin aikana suun kautta annetuilla annoksilla aina 4 mg/kg/vrk asti (2,6 kertaa suurempi kuin MOBIC:n 15 mg:n MRHD BSA-vertailun perusteella). Meloksikaamin antaminen raskaana oleville kaniineille koko alkion synnyn aikana lisäsi sydämen väliseinävaurioiden ilmaantuvuutta oraalisella annoksella 60 mg/kg/vrk (78 kertaa suurempi kuin MRHD BSA-vertailun perusteella). Ei-vaikutustaso oli 20 mg/kg/vrk (26 kertaa suurempi kuin MRHD BSA-konversion perusteella). Rotilla ja kaniineilla sikiökuolleisuutta esiintyi suun kautta otetuilla meloksikaamin annoksilla 1 mg/kg/vrk ja 5 mg/kg/vrk (vastaavasti 0,65 ja 6,5 kertaa suurempi kuin MRHD BSA-vertailun perusteella), kun sitä annettiin koko organogeneesin ajan. .
Meloksikaamin oraalinen antaminen tiineille rotille myöhään tiineyden aikana imetyksen aikana lisäsi dystokian, viivästyneen synnytyksen ilmaantuvuutta ja vähensi jälkeläisten eloonjäämistä meloksikaamin annoksilla 0,125 mg/kg/vrk tai suuremmilla (0,08-kertainen MRHD BSA-vertailun perusteella).
Imetys
Riskien yhteenveto
Ihmisillä ei ole tietoa siitä, erittyykö meloksikaamia äidinmaitoon tai vaikutuksista imeväisiin tai maidontuotantoon. Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä MOBIC-tarvetta ja MOBIC 15mg:n mahdollisia haittavaikutuksia imetettävään lapseen tai äidin taustalla olevaa tilaa.
Data
Eläinten tiedot
Meloksikaamia oli imettävien rottien maidossa suurempina pitoisuuksina kuin plasmassa.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Naaraat
Vaikutusmekanismin perusteella prostaglandiinivälitteisten tulehduskipulääkkeiden, mukaan lukien MOBIC, käyttö voi viivästyttää tai estää munasarjojen follikkelien repeytymistä, mikä on liittynyt palautuvaan hedelmättömyyteen joillakin naisilla. Julkaistut eläintutkimukset ovat osoittaneet, että prostaglandiinin synteesin estäjien antaminen voi häiritä ovulaation edellyttämää prostaglandiinivälitteistä follikkelien repeämistä. Pienet tutkimukset naisilla, joita hoidettiin tulehduskipulääkkeillä, ovat myös osoittaneet palautuvan ovulaation viivästymisen. Harkitse tulehduskipulääkkeiden, mukaan lukien MOBIC-hoidon, lopettamista naisilla, joilla on vaikeuksia tulla raskaaksi tai jotka ovat parhaillaan lapsettomuustutkimuksissa.
Käyttö lapsille
Meloksikaamin turvallisuutta ja tehokkuutta JRA-lapsipotilailla 2–17-vuotiailla on arvioitu kolmessa kliinisessä tutkimuksessa [ks. ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET ja Kliiniset tutkimukset ].
Geriatrinen käyttö
Iäkkäillä potilailla on suurempi riski saada tulehduskipulääkkeisiin liittyviä vakavia kardiovaskulaarisia, maha-suolikanavan ja/tai munuaisten haittavaikutuksia kuin nuoremmilla potilailla. Jos iäkkäälle potilaalle odotettu hyöty on suurempi kuin nämä mahdolliset riskit, aloita annostelu annosalueen alimmasta päästä ja seuraa potilaita haittavaikutusten varalta [ks. VAROITUKSET JA VAROTOIMET ].
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. Potilaita, joilla on vaikea maksan vajaatoiminta, ei ole tutkittu riittävästi. Koska meloksikaami metaboloituu merkittävästi maksassa ja hepatotoksisuutta voi esiintyä, käytä meloksikaamia varoen potilailla, joilla on maksan vajaatoiminta (ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Potilaita, joilla on vaikea munuaisten vajaatoiminta, ei ole tutkittu. MOBIC 7,5 mg:n käyttöä potilaille, joilla on vaikea munuaisten vajaatoiminta, ei suositella. Hemodialyysipotilailla meloksikaamia ei saa ylittää 7,5 mg päivässä. Meloksikaami ei ole dialysoitavissa [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Akuutin NSAID-yliannostuksen jälkeiset oireet ovat tyypillisesti rajoittuneet letargiaan, uneliaisuuteen, pahoinvointiin, oksenteluun ja ylävatsakipuun, jotka ovat yleensä korjaantuneet tukihoidolla. Ruoansulatuskanavan verenvuotoa on esiintynyt. Hypertensiota, akuuttia munuaisten vajaatoimintaa, hengityslamaa ja koomaa on esiintynyt, mutta ne olivat harvinaisia [katso VAROITUKSET JA VAROTOIMET ].
Hoida potilaita oireenmukaisella ja tukevalla hoidolla NSAID-yliannostuksen jälkeen. Spesifisiä vastalääkkeitä ei ole. Harkitse oksentamista ja/tai aktiivihiiltä (60-100 grammaa aikuisilla, 1-2 grammaa painokiloa kohden lapsipotilailla) ja/tai osmoottista katarssia oireellisilla potilailla, jotka havaitaan neljän tunnin kuluessa lääkkeen ottamisesta tai potilailla, joilla on suuri yliannostus ( 5-10 kertaa suositeltu annos). Pakotettu diureesi, virtsan alkalisointi, hemodialyysi tai hemoperfuusio eivät ehkä ole hyödyllisiä korkean proteiinisitoutumisen vuoksi.
Meloksikaamin yliannostuksesta on vain vähän kokemusta. Kolestyramiinin tiedetään nopeuttavan meloksikaamin puhdistumaa. Kliinisessä tutkimuksessa osoitettiin, että meloksikaamin poistuminen nopeutui 4 g:n oraalisilla kolestyramiiniannoksilla kolmesti päivässä. Kolestyramiinin antaminen voi olla hyödyllistä yliannostuksen jälkeen.
Saat lisätietoja yliannostushoidosta soittamalla myrkytystietokeskukseen (1-800-222-1222).
VASTA-AIHEET
MOBIC 15 mg on vasta-aiheinen seuraaville potilaille:
- Tunnettu yliherkkyys (esim. anafylaktiset reaktiot ja vakavat ihoreaktiot) meloksikaamille tai jollekin lääkevalmisteen aineosalle [ks. VAROITUKSET JA VAROTOIMET ]
- Astma, urtikaria tai muut allergisen tyyppiset reaktiot aspiriinin tai muiden tulehduskipulääkkeiden ottamisen jälkeen. Tällaisilla potilailla on raportoitu vakavia, joskus kuolemaan johtaneita, anafylaktisia reaktioita tulehduskipulääkkeisiin [katso VAROITUKSET JA VAROTOIMET ]
- Sepelvaltimon ohitusleikkauksen (CABG) yhteydessä [katso VAROITUKSET JA VAROTOIMET ]
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Meloksikaamilla on kipua lievittävä, anti-inflammatorinen ja kuumetta alentava vaikutus.
MOBICin, kuten muiden tulehduskipulääkkeiden, vaikutusmekanismia ei täysin ymmärretä, mutta se sisältää syklo-oksigenaasin (COX-1 ja COX-2) eston.
Meloksikaami on voimakas prostaglandiinisynteesin estäjä in vitro. Hoidon aikana saavutetut meloksikaamipitoisuudet ovat saaneet aikaan in vivo -vaikutuksia. Prostaglandiinit herkistävät afferentteja hermoja ja tehostavat bradykiniinin vaikutusta kivun aiheuttamiseen eläinmalleissa. Prostaglandiinit ovat tulehduksen välittäjiä. Koska meloksikaami on prostaglandiinisynteesin estäjä, sen vaikutustapa voi johtua prostaglandiinien vähenemisestä ääreiskudoksissa.
Farmakokinetiikka
Imeytyminen
Meloksikaamikapseleiden absoluuttinen biologinen hyötyosuus oli 89 % oraalisen 30 mg:n kerta-annoksen jälkeen verrattuna 30 mg:n IV bolusinjektioon. Suonensisäisten kerta-annosten jälkeen annokseen suhteutettu farmakokinetiikka oli 5–60 mg. Toistuvien oraalisten annosten jälkeen meloksikaamikapseleiden farmakokinetiikka oli suhteessa annokseen 7,5–15 mg:n välillä. Keskimääräinen C saavutettiin 4–5 tunnin kuluessa 7,5 mg:n meloksikaamitabletin ottamisen jälkeen paasto-olosuhteissa, mikä osoittaa lääkkeen pitkittyneen imeytymisen. Useita annoksia käytettäessä vakaan tilan pitoisuudet saavutettiin päivään 5 mennessä. Toinen meloksikaamin pitoisuushuippu esiintyy noin 12-14 tuntia annoksen jälkeen, mikä viittaa sapen kierrätykseen.
Meloksikaamin oraalisuspension 7,5 mg/5 ml ja 15 mg/10 ml annosten on todettu olevan bioekvivalentteja meloksikaamin 7,5 mg:n ja 15 mg:n kapseleiden kanssa. Meloksikaamikapseleiden on osoitettu olevan biologisesti samanarvoisia MOBIC 7,5 mg -tablettien kanssa.
Ruoka ja antasidivaikutukset
Meloksikaamikapseleiden antaminen runsasrasvaisen aamiaisen (75 g rasvaa) jälkeen johti lääkkeen keskimääräisiin huippupitoisuuksiin (eli Cmax) noin 22 %:lla, kun taas imeytymisaste (AUC) pysyi muuttumattomana. Aika huippupitoisuuteen (Tmax) saavutettiin 5–6 tunnin kuluessa. Vertailun vuoksi, meloksikaamisuspension AUC- tai Cmax-arvoihin ei vaikuttanut samankaltaisen rasvaisen aterian jälkeen, kun taas keskimääräiset Tmax-arvot nousivat noin 7 tuntiin. Farmakokineettisiä yhteisvaikutuksia ei havaittu antasidien samanaikaisen käytön yhteydessä. Näiden tulosten perusteella MOBIC 15 mg voidaan antaa riippumatta aterioiden ajoituksesta tai antasidien samanaikaisesta antamisesta.
Jakelu
Meloksikaamin keskimääräinen jakautumistilavuus (Vss) on noin 10 l. Meloksikaami sitoutuu ~99,4 % ihmisen plasman proteiineihin (pääasiassa albumiiniin) terapeuttisella annosalueella. Proteiiniin sitoutumisen osuus on riippumaton lääkeainepitoisuudesta kliinisesti merkittävällä pitoisuusalueella, mutta se pienenee ~99 %:iin potilailla, joilla on munuaissairaus. Suun kautta annetun meloksikaamin tunkeutuminen ihmisen punasoluihin on alle 10 %. Radioaktiivisesti leimatun annoksen jälkeen yli 90 % plasmassa havaitusta radioaktiivisuudesta oli muuttumattomana meloksikaamina.
Meloksikaamin pitoisuudet nivelnesteessä ovat suun kautta otetun kerta-annoksen jälkeen 40–50 % plasman pitoisuuksista. Nivelnesteen vapaa fraktio on 2,5 kertaa suurempi kuin plasmassa, koska nivelnesteen albumiinipitoisuus on pienempi kuin plasmassa. Tämän tunkeutumisen merkitystä ei tunneta.
Eliminointi
Aineenvaihdunta
Meloksikaami metaboloituu laajalti maksassa. Meloksikaamin metaboliitteja ovat 5'-karboksimeloksikaami (60 % annoksesta), joka on peräisin P-450-välitteisestä aineenvaihdunnasta, joka muodostuu väliaineenvaihduntatuotteen 5'-hydroksimetyylimeloksikaamin hapettumisesta, joka myös erittyy pienemmässä määrin (9 % annoksesta) ). In vitro -tutkimukset osoittavat, että CYP2C9:llä (sytokromi P450:tä metaboloiva entsyymi) on tärkeä rooli tässä aineenvaihduntareitissä, ja CYP3A4-isotsyymin osuus on vähäinen. Potilaiden peroksidaasiaktiivisuus on todennäköisesti vastuussa kahdesta muusta metaboliitista, joiden osuus on 16 % ja 4 % annetusta annoksesta. Kaikilla neljällä metaboliitilla ei tiedetä olevan in vivo farmakologista aktiivisuutta.
Erittyminen
Meloksikaami erittyy pääasiassa metaboliittien muodossa, ja sitä esiintyy yhtä suuressa määrin virtsaan ja ulosteisiin. Vain jäänteitä muuttumattomasta lähtöaineesta erittyy virtsaan (0,2 %) ja ulosteisiin (1,6 %). Virtsan erittymisen laajuus vahvistettiin leimaamattomilla useilla 7,5 mg:n annoksilla: 0,5 %, 6 % ja 13 % annoksesta löydettiin virtsasta meloksikaamin muodossa ja 5'-hydroksimetyyli- ja 5'- -karboksi-metaboliitit, vastaavasti. Lääkettä erittyy merkittävästi sapessa ja/tai enteraalisesti. Tämä osoitettiin, kun kolestyramiinin oraalinen anto meloksikaamin kerta-annoksen jälkeen laski meloksikaamin AUC-arvoa 50 %.
Keskimääräinen eliminaation puoliintumisaika (t1/2) vaihtelee 15 tunnista 20 tuntiin. Eliminaation puoliintumisaika on vakio eri annostasoilla, mikä osoittaa lineaarista metaboliaa terapeuttisella annosalueella. Plasman puhdistuma on 7-9 ml/min.
Tietyt populaatiot
Pediatriset
Kerta-annoksen (0,25 mg/kg) jälkeen ja vakaan tilan (0,375 mg/kg/vrk) saavuttamisen jälkeen nuoremmilla potilailla (2–6-vuotiailla) oli yleinen suuntaus, että altistuminen oli noin 30 % pienempi kuin vanhemmilla potilailla. potilaat (7–16-vuotiaat). Vanhemmilla potilailla meloksikaamialtistus oli samanlainen (kerta-annos) tai hieman pienempi (vakaa tila) kuin aikuisilla potilailla, kun AUC-arvot normalisoitiin 0,25 mg/kg annokseen [ks. ANNOSTELU JA HALLINNOINTI ]. Meloksikaamin keskimääräinen eliminaation puoliintumisaika (SD) oli 15,2 (10,1) ja 13,0 tuntia (3,0) 2–6-vuotiailla potilailla ja 7–16-vuotiailla potilailla.
Kovariaattianalyysissä populaation farmakokinetiikan hyödyntäminen ruumiinpainossa, mutta ei iässä, oli ainoa ennustava kovariaatti meloksikaamin näennäisen oraalisen plasmapuhdistuman eroille. Ruumiinpainon mukaan normalisoidut näennäiset suun kautta otettavat puhdistumaarvot olivat riittävät meloksikaamialtistuksen ennustajat lapsipotilailla.
MOBICin farmakokinetiikkaa alle 2-vuotiailla lapsipotilailla ei ole tutkittu.
Geriatric
Iäkkäillä miehillä (≥65-vuotiaat) plasman meloksikaamin pitoisuudet ja vakaan tilan farmakokinetiikka olivat samanlaisia kuin nuorilla miehillä. Iäkkäillä naisilla (≥65-vuotiaat) AUCss oli 47 % korkeampi ja Cmax,ss 32 % korkeampi kuin nuoremmilla naisilla (≤55-vuotiaat) painon normalisoinnin jälkeen. Huolimatta kohonneista kokonaispitoisuuksista iäkkäillä naisilla, haittatapahtumaprofiili oli vertailukelpoinen molemmilla iäkkäillä potilaspopulaatioilla. Iäkkäillä naispotilailla havaittiin pienempi vapaa fraktio verrattuna iäkkäisiin miespotilaisiin.
Seksiä
Nuorten naisten plasmapitoisuudet olivat hieman pienemmät kuin nuorilla miehillä. 7,5 mg MOBIC:n kerta-annosten jälkeen keskimääräinen eliminaation puoliintumisaika oli 19,5 tuntia naisten ryhmässä verrattuna 23,4 tuntiin miesten ryhmässä. Vakaassa tilassa tiedot olivat samanlaiset (17,9 tuntia vs 21,4 tuntia). Tällä sukupuolesta johtuvalla farmakokineettisellä erolla ei todennäköisesti ole juurikaan kliinistä merkitystä. Farmakokinetiikka oli lineaarinen, eikä Cmax- tai Tmax-arvoissa ollut merkittävää eroa sukupuolten välillä.
Maksan vajaatoiminta
Meloksikaamin 15 mg:n kerta-annoksen jälkeen ei havaittu merkittäviä eroja plasman pitoisuuksissa potilailla, joilla oli lievä (Child-Pugh luokka I) tai kohtalainen (Child-Pugh luokka II) maksan vajaatoiminta terveisiin vapaaehtoisiin verrattuna. Maksan vajaatoiminta ei vaikuttanut meloksikaamin sitoutumiseen proteiineihin. Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. Potilaita, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka III), ei ole tutkittu riittävästi [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Munuaisten vajaatoiminta
Meloksikaamin farmakokinetiikkaa on tutkittu potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Meloksikaamin plasman kokonaispitoisuus pieneni ja meloksikaamin kokonaispuhdistuma lisääntyi munuaisten vajaatoiminnan asteen myötä, kun taas vapaat AUC-arvot olivat samanlaiset kaikissa ryhmissä. Meloksikaamin korkeampi puhdistuma potilailla, joilla on munuaisten vajaatoiminta, saattaa johtua sitoutumattoman meloksikaamin suurentuneesta fraktiosta, joka on käytettävissä maksan metaboliaan ja myöhempään erittymiseen. Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Potilaita, joilla on vaikea munuaisten vajaatoiminta, ei ole tutkittu riittävästi. MOBICin käyttöä potilailla, joilla on vaikea munuaisten vajaatoiminta, ei suositella [ks ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Hemodialyysi
Meloksikaamin kerta-annoksen jälkeen plasman vapaan Cmax-pitoisuudet olivat korkeammat kroonista hemodialyysihoitoa saavilla munuaisten vajaatoimintaa sairastavilla potilailla (1 % vapaa fraktio) verrattuna terveisiin vapaaehtoisiin (0,3 % vapaa fraktio). Hemodialyysi ei alentanut lääkkeen kokonaispitoisuutta plasmassa; siksi lisäannoksia ei tarvita hemodialyysin jälkeen. Meloksikaami ei ole dialysoitavissa [katso ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
Aspiriini
Kun tulehduskipulääkkeitä annettiin aspiriinin kanssa, NSAID-lääkkeiden sitoutuminen proteiineihin väheni, vaikka vapaan NSAID:n puhdistuma ei muuttunut. Kun MOBIC 15 mg annettiin aspiriinin kanssa (1 000 mg kolmesti vuorokaudessa) terveille vapaaehtoisille, sillä oli taipumus suurentaa meloksikaamin AUC-arvoa (10 %) ja C-arvoa (24 %). Tämän yhteisvaikutuksen kliinistä merkitystä ei tunneta. Katso taulukosta 3 kliinisesti merkittäviä NSAID-lääkkeiden yhteisvaikutuksia aspiriinin kanssa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Kolestyramiini
Neljän päivän esikäsittely kolestyramiinilla lisäsi meloksikaamin puhdistumaa merkittävästi 50 %. Tämä johti t1/2:n laskuun 19,2 tunnista 12,5 tuntiin ja AUC:n pienenemiseen 35 %. Tämä viittaa siihen, että meloksikaamilla on kierrätysreitti maha-suolikanavassa. Tämän yhteisvaikutuksen kliinistä merkitystä ei ole varmistettu.
Simetidiini
Samanaikainen 200 mg:n simetidiinin antaminen neljästi vuorokaudessa ei muuttanut 30 mg:n meloksikaamin kerta-annoksen farmakokinetiikkaa.
Digoksiini
Meloksikaami 15 mg kerran vuorokaudessa 7 päivän ajan ei muuttanut digoksiinin plasmapitoisuusprofiilia, kun β-asetyylidigoksiinia oli annettu 7 päivän ajan kliinisillä annoksilla. In vitro -testeissä ei havaittu proteiinia sitovien lääkkeiden yhteisvaikutuksia digoksiinin ja meloksikaamin välillä.
Litium
Terveillä koehenkilöillä tehdyssä tutkimuksessa litiumin keskimääräinen annosta edeltävä pitoisuus ja AUC nousivat 21 % potilailla, jotka saivat litiumia 804-1072 mg kahdesti vuorokaudessa ja meloksikaamia 15 mg QD joka päivä verrattuna koehenkilöihin, jotka saivat pelkkää litiumia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Metotreksaatti
13 nivelreumapotilaalla tehdyssä tutkimuksessa arvioitiin toistuvien meloksikaamiannosten vaikutuksia kerran viikossa otetun metotreksaatin farmakokinetiikkaan. Meloksikaamilla ei ollut merkittävää vaikutusta metotreksaatin kerta-annosten farmakokinetiikkaan. In vitro metotreksaatti ei syrjäyttänyt meloksikaamia ihmisen seerumin sitoutumiskohdista [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Varfariini
Meloksikaamin vaikutusta varfariinin antikoagulanttivaikutukseen tutkittiin terveillä koehenkilöillä, jotka saivat päivittäisiä varfariiniannoksia, jotka tuottivat INR-arvon (International Normalised Ratio) välillä 1,2–1,8. Näillä koehenkilöillä meloksikaami ei muuttanut varfariinin farmakokinetiikkaa eikä varfariinin keskimääräistä antikoagulanttivaikutusta protrombiiniajalla määritettynä. Kuitenkin yhdellä koehenkilöllä INR nousi 1,5:stä 2,1:een. Varovaisuutta tulee noudattaa annettaessa MOBIC 15 mg varfariinin kanssa, koska varfariinia saavilla potilailla saattaa ilmetä muutoksia INR-arvossa ja verenvuotokomplikaatioiden riski kasvaa, kun uusi lääke otetaan käyttöön [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Kliiniset tutkimukset
Nivelrikko ja nivelreuma
MOBIC 15 mg:n käyttöä polven ja lonkan nivelrikon merkkien ja oireiden hoitoon arvioitiin 12 viikkoa kestäneessä kaksoissokkoutetussa kontrolloidussa tutkimuksessa. MOBICia (3,75 mg, 7,5 mg ja 15 mg päivässä) verrattiin lumelääkkeeseen. Neljä ensisijaista päätetapahtumaa olivat tutkijan kokonaisarvio, potilaan kokonaisarviointi, potilaan kivun arviointi ja WOMAC-kokonaispistemäärä (itse laadittava kyselylomake, jossa käsitellään kipua, toimintaa ja jäykkyyttä). Potilaat, jotka saivat MOBIC 7,5 mg vuorokaudessa ja MOBIC 15 mg vuorokaudessa, paranivat merkittävästi kussakin näistä päätepisteistä lumelääkkeeseen verrattuna.
MOBICin käyttöä nivelrikon merkkien ja oireiden hallintaan arvioitiin kuudessa kaksoissokkoutetussa, aktiivisesti kontrolloidussa tutkimuksessa Yhdysvaltojen ulkopuolella, ja ne kestivät 4 viikosta 6 kuukauteen. Näissä tutkimuksissa MOBICin teho annoksina 7,5 mg/vrk ja 15 mg/vrk oli verrattavissa piroksikaamiin 20 mg/vrk ja diklofenaakki SR:ään 100 mg/vrk, ja se vastasi USA:n tutkimuksessa havaittua tehoa.
MOBIC 7,5 mg:n käyttöä nivelreuman merkkien ja oireiden hoitoon arvioitiin 12 viikon, kaksoissokkoutetussa, kontrolloidussa monikansallisessa tutkimuksessa. MOBICia (7,5 mg, 15 mg ja 22,5 mg päivässä) verrattiin lumelääkkeeseen. Tämän tutkimuksen ensisijainen päätetapahtuma oli ACR20-vaste, nivelreuman kliinisen, laboratorio- ja toiminnallisten mittareiden yhdistetty mitta. Potilaat, jotka saivat MOBICia 7,5 mg ja 15 mg päivässä, paransivat merkittävästi ensisijaisessa päätetapahtumassa lumelääkkeeseen verrattuna. 22,5 mg:n annoksella ei havaittu lisääntyvää hyötyä verrattuna 15 mg:n annokseen.
Nuorten nivelreuma (JRA) pauciarticular ja polyarticular Course
MOBIC 7,5 mg:n käyttöä poukiaarisen tai moninivelisen taudin merkkien ja oireiden hoitoon 2-vuotiailla ja sitä vanhemmilla potilailla arvioitiin kahdessa 12 viikon kaksoissokkoutetussa rinnakkaishaarisessa, aktiivisesti kontrolloidussa tutkimuksessa. .
Molemmissa tutkimuksissa oli kolme haaraa: naprokseeni ja kaksi annosta meloksikaamia. Molemmissa tutkimuksissa meloksikaamin annostelu aloitettiin annoksella 0,125 mg/kg/vrk (maksimi 7,5 mg) tai 0,25 mg/kg/vrk (maksimi 15 mg) ja naprokseenin annostelu aloitettiin annoksella 10 mg/kg/vrk. Yhdessä tutkimuksessa käytettiin näitä annoksia koko 12 viikon annostelujakson ajan, kun taas toisessa titrattiin 4 viikon kuluttua annoksiksi 0,25 mg/kg/vrk ja 0,375 mg/kg/vrk (maksimi 22,5 mg) ja 15 mg/kg. / päivä naprokseenia.
Tehokkuusanalyysissä käytettiin ACR Paediatric 30 -vastaajan määritelmää, yhdistelmää vanhemman ja tutkijan arvioista, aktiivisten nivelten ja nivelten, joilla on rajoitettu liikerata, ja erytrosyyttien sedimentaationopeutta. Vastaajien osuus oli samanlainen kaikissa kolmessa ryhmässä molemmissa tutkimuksissa, eikä eroa havaittu meloksikaamin annosryhmien välillä.
POTILASTIEDOT
Ei-steroidisten tulehduskipulääkkeiden (NSAID) lääkitysopas
Mikä on tärkein tieto, joka minun pitäisi tietää lääkkeistä, joita kutsutaan steroideihin kuulumattomiksi tulehduskipulääkkeiksi (NSAID)?
Tulehduskipulääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Lisääntynyt sydänkohtauksen tai aivohalvauksen riski, joka voi johtaa kuolemaan. Tämä riski voi ilmetä hoidon alkuvaiheessa ja voi lisääntyä:
- NSAID-lääkkeiden kasvavilla annoksilla
- tulehduskipulääkkeiden pidempään käyttöön
Älä ota tulehduskipulääkkeitä juuri ennen tai jälkeen sydänleikkauksen, jota kutsutaan "sepelvaltimon ohitusleikkaukseksi (CABG)."
Vältä tulehduskipulääkkeiden ottamista äskettäisen sydänkohtauksen jälkeen, ellei terveydenhuollon tarjoaja kehota sinua tekemään niin. Sinulla saattaa olla suurentunut riski saada toinen sydänkohtaus, jos käytät tulehduskipulääkkeitä äskettäisen sydänkohtauksen jälkeen.
- Lisääntynyt ruokatorven (suusta mahaan johtava putki), mahan ja suoliston verenvuodon, haavaumien ja repeytymien (rei'itysten) riski:
- milloin tahansa käytön aikana
- ilman varoittavia oireita
- joka voi aiheuttaa kuoleman
Haavan tai verenvuodon riski kasvaa:
- aiempi mahahaava tai maha- tai suolistoverenvuoto NSAID-lääkkeiden käytön yhteydessä
- "kortikosteroideiksi", "antikoagulantteiksi", "SSRI-lääkkeiksi" tai "SNRI-lääkkeiksi" kutsuttujen lääkkeiden ottaminen nostamalla tulehduskipulääkkeiden annoksia
- tulehduskipulääkkeiden pidempi käyttö
- tupakointi-
- juoda alkoholia
- vanhempi ikä
- huono terveys
- pitkälle edennyt maksasairaus
- verenvuoto-ongelmia
Tulehduskipulääkkeitä tulee käyttää vain:
- juuri niin kuin määrätään
- pienimmällä mahdollisella annoksella hoitoasi
- lyhimmän tarvittavan ajan
Mitä tulehduskipulääkkeet ovat?
Tulehduskipulääkkeitä käytetään kivun ja punoituksen, turvotuksen ja lämmön (tulehduksen) hoitoon sairauksista, kuten erilaisista niveltulehduksista, kuukautiskipuista ja muista lyhytaikaisista kivuista.
Kuka ei saa käyttää tulehduskipulääkkeitä?
Älä käytä tulehduskipulääkkeitä:
- jos sinulla on ollut astmakohtaus, nokkosihottuma tai muu allerginen reaktio aspiriinin tai muiden tulehduskipulääkkeiden kanssa.
- juuri ennen tai jälkeen sydämen ohitusleikkauksen.
Ennen kuin otat tulehduskipulääkkeitä, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on maksa- tai munuaisongelmia
- on korkea verenpaine
- on astma
- olet raskaana tai suunnittelet raskautta. Tulehduskipulääkkeiden ottaminen noin 20 raskausviikolla tai myöhemmin voi vahingoittaa sikiötäsi. Jos joudut käyttämään tulehduskipulääkkeitä yli 2 päivää raskausviikon 20–30 välillä, terveydenhuollon tarjoajasi saattaa joutua seuraamaan nesteen määrää kohdussasi vauvan ympärillä. Älä käytä tulehduskipulääkkeitä noin 30 raskausviikon jälkeen.
- imetät tai suunnittelet imettämistä.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- tai käsikauppalääkkeet, vitamiinit tai yrttilisät. Tulehduskipulääkkeet ja jotkut muut lääkkeet voivat olla vuorovaikutuksessa keskenään ja aiheuttaa vakavia sivuvaikutuksia. Älä aloita uuden lääkkeen käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa.
Mitkä ovat tulehduskipulääkkeiden mahdolliset sivuvaikutukset?
Tulehduskipulääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää lääkkeistä, joita kutsutaan steroideihin kuulumattomiksi tulehduskipulääkkeiksi (NSAID)?"
- uusi tai pahempi korkea verenpaine
- sydämen vajaatoiminta
- maksaongelmia, mukaan lukien maksan vajaatoiminta
- munuaisongelmat mukaan lukien munuaisten vajaatoiminta
- alhainen punasolujen määrä (anemia)
- hengenvaarallisia ihoreaktioita
- hengenvaarallisia allergisia reaktioita
Muita tulehduskipulääkkeiden sivuvaikutuksia ovat: vatsakipu, ummetus, ripuli, kaasut, närästys, pahoinvointi, oksentelu ja huimaus.
Hae heti hätäapua, jos saat jonkin seuraavista oireista:
- hengenahdistus tai hengitysvaikeudet
- rintakipu
- heikkous jossakin kehon osassa tai puolella
- sammaltava puhe
- kasvojen tai kurkun turvotus
Lopeta tulehduskipulääkkeiden käyttö ja soita heti terveydenhuollon tarjoajallesi, jos saat jonkin seuraavista oireista:
- pahoinvointi
- tavallista väsyneempi tai heikompi
- ripuli
- kutina
- ihosi tai silmäsi näyttävät keltaisilta
- ruoansulatushäiriöt tai vatsakipu
- flunssan kaltaiset oireet
- oksentaa verta
- suolistossasi on verta tai se on mustaa ja tahmeaa kuin terva
- epätavallinen painonnousu
- ihottuma tai rakkuloita ja kuumetta
- käsivarsien, jalkojen, käsien ja jalkojen turvotus
Jos otat liikaa tulehduskipulääkkeitäsi, soita terveydenhuollon tarjoajalle tai hakeudu välittömästi lääkärin hoitoon.
Nämä eivät ole kaikkia tulehduskipulääkkeiden mahdollisia sivuvaikutuksia. Kysy lisää tulehduskipulääkkeistä terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Muita tietoja tulehduskipulääkkeistä:
- Aspiriini on NSAID, mutta se ei lisää sydänkohtauksen mahdollisuutta. Aspiriini voi aiheuttaa verenvuotoa aivoissa, mahassa ja suolistossa. Aspiriini voi myös aiheuttaa haavaumia mahassa ja suolistossa.
- Joitakin tulehduskipulääkkeitä myydään pienempinä annoksina ilman reseptiä (reseptivapaa). Keskustele terveydenhuollon tarjoajan kanssa ennen kuin käytät reseptivapaa tulehduskipulääkkeitä yli 10 päivää.
Yleistä tietoa tulehduskipulääkkeiden turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä tulehduskipulääkkeitä sairauteen, johon niitä ei ole määrätty. Älä anna tulehduskipulääkkeitä muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Jos haluat lisätietoja tulehduskipulääkkeistä, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja tulehduskipulääkkeistä, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
