Feldene 10mg, 20mg Piroxicam Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Feldene 20mg on ja miten sitä käytetään?
Piroksikaami on reseptilääke, jota käytetään nivelreuman (mukaan lukien nuorten niveltulehduksen) tai niveltulehduksen kivun tai tulehduksen hoitoon. Piroksikaamia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Piroksikaami on ei-steroidinen tulehduskipulääke (NSAID).
Ei tiedetä, onko Piroxicam turvallinen ja tehokas alle 12-vuotiaille lapsille.
Mitkä ovat Feldenen mahdolliset sivuvaikutukset?
Feldene 10mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hakkaa niskassa tai korvissa,
- uneliaisuus,
- näön hämärtyminen,
- turvotus,
- nopea painonnousu,
- hengenahdistus,
- ruokahalun menetys,
- vatsakipu,
- väsymys,
- kutina,
- tumma virtsa,
- savenväriset jakkarat,
- ihon tai silmien keltaisuus (keltaisuus),
- veriset tai tervamaiset ulosteet,
- veren yskiminen tai oksennus, joka näyttää kahvinporolta,
- vähän tai ei ollenkaan virtsaamista,
- turvotus jaloissasi tai nilkoissasi,
- huima olo,
- kylmät kädet tai jalat,
- vaalea iho ja
- kova päänsärky,
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Feldenen yleisimpiä sivuvaikutuksia ovat:
- epänormaalit maksan toimintakokeet,
- virtsaamisvaikeudet,
- ärtynyt vatsa,
- närästys,
- ruokahalun menetys,
- vatsakipu,
- pahoinvointi,
- oksentelua,
- kaasu,
- ripuli,
- ummetus,
- huimaus,
- päänsärky,
- kutina tai ihottuma ja
- soi korvissa,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Feldenen mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VAKAVIEN SYDÄN-VERENSUUNION JA MAA-SUOLTOTAPAHTUMIEN RISKI
Kardiovaskulaariset tromboottiset tapahtumat
- Ei-steroidiset tulehduskipulääkkeet (NSAID) lisäävät vakavien kardiovaskulaaristen tromboottisten tapahtumien riskiä, mukaan lukien sydäninfarkti ja aivohalvaus, jotka voivat olla hengenvaarallisia. Tämä riski voi ilmetä hoidon alkuvaiheessa ja voi kasvaa käytön keston myötä. [katso VAROITUKSET JA VAROTOIMET ].
- FELDENE 20 mg on vasta-aiheinen sepelvaltimon ohitusleikkauksen (CABG) yhteydessä [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatiot
- Tulehduskipulääkkeet lisäävät vakavien maha-suolikanavan (GI) haittatapahtumien riskiä, mukaan lukien verenvuoto, haavaumat ja mahalaukun tai suoliston perforaatiot, jotka voivat olla kohtalokkaita. Nämä tapahtumat voivat tapahtua milloin tahansa käytön aikana ja ilman varoittavia oireita. Iäkkäät potilaat ja potilaat, joilla on aiemmin ollut peptinen haavasairaus ja/tai maha-suolikanavan verenvuoto, ovat suurempi riski saada vakavia GI-tapahtumia [ks. VAROITUKSET JA VAROTOIMET ].
KUVAUS
FELDENE (piroksikaami) kapseli on steroideihin kuulumaton tulehduskipulääke, saatavilla kastanjanruskeina ja sinisinä #322 10 mg kapseleina ja kastanjanruskeina #323 20 mg kapseleina suun kautta. Kemiallinen nimi on 4-hydroksyyli-2-metyyli-N-2-pyridinyyli-2H-1,2-bentsotiatsiini-3-karboksamidi-1,1-dioksidi. Molekyylipaino on 331,35. Sen molekyylikaava on C15H13N3O4S, ja sillä on seuraava kemiallinen rakenne.
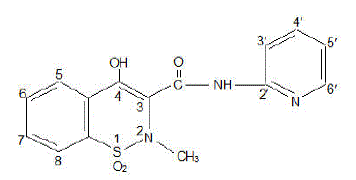
Piroksikaami esiintyy valkoisena kiteisenä kiinteänä aineena, joka liukenee niukasti veteen, laimeaan happoon ja useimpiin orgaanisiin liuottimiin. Se liukenee heikosti alkoholiin ja vesiliuoksiin. Siinä on heikosti hapan 4-hydroksiprotoni (pKa 5,1) ja heikosti emäksinen pyridyylityppi (pKa 1,8).
FELDENE 10 mg:n inaktiivisia aineosia ovat: Sininen 1, Punainen 3, laktoosi, magnesiumstearaatti, natriumlauryylisulfaatti, tärkkelys.
INDIKAATIOT
FELDENE on merkitty:
- Nivelrikon merkkien ja oireiden lievitykseen.
- Nivelreuman merkkien ja oireiden lievitykseen.
ANNOSTELU JA HALLINNOINTI
Harkitse huolellisesti FELDENE 20 mg:n ja muiden hoitovaihtoehtojen mahdollisia hyötyjä ja riskejä ennen kuin päätät käyttää FELDENEa. Käytä pienintä tehokasta annosta lyhimmän keston ajan yksittäisten potilaan hoitotavoitteiden mukaisesti [katso VAROITUKSET JA VAROTOIMET ].
Kun FELDENE 20 mg:n aloitushoitovaste on tarkkailtava, annos ja tiheys tulee säätää kunkin potilaan tarpeiden mukaan.
Nivelreuman ja nivelrikon lievittämiseksi annos on 20 mg suun kautta kerran vuorokaudessa. Haluttaessa vuorokausiannos voidaan jakaa. FELDENEN pitkän puoliintumisajan vuoksi vakaan tilan pitoisuudet veressä saavutetaan vasta 7–12 päivään. Tästä syystä, vaikka FELDENEN terapeuttiset vaikutukset ovat ilmeisiä hoidon alkuvaiheessa, vaste lisääntyy progressiivisesti useiden viikkojen aikana, eikä hoidon vaikutusta tule arvioida kahteen viikkoon.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
FELDENE (piroksikaami) kapselit
10 mg kastanjanruskeaa ja sinistä #322 20 mg kastanjanruskeaa #323
Varastointi ja käsittely
FELDENE® (piroksikaami) 10 mg kapselit ovat kastanjanruskeita ja sinisiä #322, toimitetaan seuraavasti:
FELDENE® (piroksikaami) 20 mg kapselit ovat kastanjanruskeat #323, toimitetaan seuraavasti:
Varastointi
Säilytä huoneenlämmössä 20°C - 25°C (68°F - 77°F); retket sallitaan 15 °C - 30 °C (59 °F - 86 °F) [katso USP:n ohjaama huonelämpötila].
Jakelija: Pfizer Labs, Division of Pfizer Inc., 235 East 42nd Street, New York, NY 10017. Tarkistettu: huhtikuu 2017.
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Kardiovaskulaariset tromboottiset tapahtumat [katso VAROITUKSET JA VAROTOIMET ]
- GI-verenvuoto, haavaumat ja perforaatiot [katso VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Hypertensio [katso VAROITUKSET JA VAROTOIMET ]
- Sydämen vajaatoiminta ja turvotus [katso VAROITUKSET JA VAROTOIMET ]
- Munuaisten toksisuus ja hyperkalemia [katso VAROITUKSET JA VAROTOIMET ]
- Anafylaktiset reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihoreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Hematologinen toksisuus [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
FELDENE 10 mg tai muita tulehduskipulääkkeitä käyttävillä potilailla yleisimmin raportoidut haittavaikutukset, joita esiintyy noin 1–10 %:lla potilaista, ovat:
Sydän- ja verisuonijärjestelmä: Turvotus
Ruoansulatuselimistö: Anoreksia, vatsakipu, ummetus, ripuli, ilmavaivat, pahoinvointi, oksentelu
Hermosto : Huimaus, päänsärky, huimaus
Iho ja lisäkkeet: Kutina, ihottuma
Erityiset aistit: Tinnitus
Muita satunnaisesti raportoituja haitallisia kokemuksia ovat:
Sydän- ja verisuonijärjestelmä: Sydämentykytys
Ruoansulatuselimistö: Stomatiitti
Hermosto: Uneliaisuus
Erityiset aistit: Näön hämärtyminen
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu FELDENEN hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keho kokonaisuutena: Kuume, infektio, sepsis, anafylaktiset reaktiot, ruokahalun muutokset, kuolema, flunssan kaltainen oireyhtymä, kipu (koliikki), seerumitauti
Sydän- ja verisuonijärjestelmä: Kongestiivinen sydämen vajaatoiminta, kohonnut verenpaine, takykardia, pyörtyminen, rytmihäiriöt, angina pectoriksen paheneminen, hypotensio, sydäninfarkti, vaskuliitti
Ruoansulatuselimistö: Dyspepsia, kohonneet maksaentsyymiarvot, runsas verenvuoto/perforaatio, närästys, haavat (maha-/pohjukaissuolihaava), suun kuivuminen, ruokatorven tulehdus, gastriitti, glossiitti, hematemesis, hepatiitti, keltaisuus, melena, peräsuolen verenvuoto, eruktaatio, maksan vajaatoiminta, haimatulehdus
Hemic ja lymfaattinen järjestelmä: Anemia, lisääntynyt verenvuotoaika, e kymoosi, eosinofilia, nenäverenvuoto, leukopenia, purppura, petekiaalinen ihottuma, trombosytopenia, agranulosytoosi, hemolyyttinen anemia, aplastinen anemia, lymfadenopatia, pansytopenia
Yliherkkyys: Positiivinen ANA
Aineenvaihdunta ja ravitsemus: Painon muutokset, nesteen kertyminen, hyperglykemia, hypoglykemia
Hermosto: Ahdistus, voimattomuus, sekavuus, masennus, unen poikkeavuudet, unettomuus, huonovointisuus, hermostuneisuus, parestesia, uneliaisuus, vapina, akatisia, kouristukset, kooma, hallusinaatiot, aivokalvontulehdus, mielialan muutokset
Hengitysjärjestelmä: Astma, hengenahdistus, hengityslama, keuhkokuume
Iho ja lisäkkeet: Hiustenlähtö, mustelmat, hilseily, punoitus, valoherkkyys, hiki, angioödeema, toksinen epidermaalinen nekroosi, erythema multiforme, eksfoliatiivinen ihotulehdus, onykolyysi, Stevens Johnsonin oireyhtymä, nokkosihottuma, vesiculobulloous reaktio
Erityiset aistit: Sidekalvotulehdus, kuulon heikkeneminen, turvonneet silmät
Urogenitaaljärjestelmä: Epänormaali munuaisten toiminta, c ystiitti, dysuria, hematuria, hyperkalemia, interstitiaalinen nefriitti, nefroottinen oireyhtymä, oliguria/polyuria, proteinuria, munuaisten vajaatoiminta, glomerulonefriitti
Sukuelinten ja rintojen häiriöt: Naisten hedelmällisyys heikkeni
HUUMEIDEN VUOROVAIKUTUKSET
Katso taulukosta 1 kliinisesti merkittäviä lääkeinteraktioita piroksikaamin kanssa.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Kardiovaskulaariset tromboottiset tapahtumat
Useiden COX-2-selektiivisten ja ei-selektiivisten tulehduskipulääkkeiden kliiniset tutkimukset, jotka kestivät enintään kolme vuotta, ovat osoittaneet lisääntyneen vakavien kardiovaskulaaristen (CV) tromboottisten tapahtumien, mukaan lukien sydäninfarktin (MI) ja aivohalvauksen riskin, jotka voivat olla kohtalokkaita. Saatavilla olevien tietojen perusteella on epäselvää, että sydän- ja verisuonitautien tromboottisten tapahtumien riski on samanlainen kaikilla tulehduskipulääkkeillä. NSAID-lääkkeiden käytön aiheuttama vakavien CV-tromboottisten tapahtumien suhteellinen lisääntyminen lähtötasoon verrattuna näyttää olevan samanlainen niillä, joilla on tunnettu sydänsairaus tai sydän- ja verisuonitautien riskitekijöitä. Potilailla, joilla oli tunnettu sydän- ja verisuonitukosairaus tai riskitekijöitä, oli kuitenkin suurempi ylimääräisten vakavien sydän- ja verisuonitautitapahtumien absoluuttinen ilmaantuvuus, mikä johtui heidän kohonneesta lähtötasosta. Joissakin havainnointitutkimuksissa havaittiin, että tämä lisääntynyt vakavien sydän- ja verisuonitautien tromboottisten tapahtumien riski alkoi jo ensimmäisten hoitoviikkojen aikana. CV-tromboottisen riskin lisääntyminen on havaittu johdonmukaisimmin suuremmilla annoksilla.
Minimoidaksesi haitallisten sydän- ja verisuonitapahtumien riski NSAID-hoitoa saavilla potilailla, käytä pienintä tehokasta annosta mahdollisimman lyhyen ajan. Lääkäreiden ja potilaiden tulee pysyä valppaina tällaisten tapahtumien kehittymisen suhteen koko hoitojakson ajan, vaikka aiempia CV-oireita ei olisikaan ollut. Potilaille tulee kertoa vakavien CV-tapahtumien oireista ja toimenpiteistä, joihin on ryhdyttävä, jos niitä ilmenee.
Ei ole olemassa johdonmukaista näyttöä siitä, että aspiriinin samanaikainen käyttö pienentäisi NSAID-lääkkeiden käyttöön liittyvien vakavien sydän- ja verisuonitautitapahtumien riskiä. Aspiriinin ja tulehduskipulääkkeen, kuten piroksikaamin, samanaikainen käyttö lisää vakavien maha-suolikanavan (GI) tapahtumien riskiä [ks. Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatio ].
Tila Sepelvaltimon ohitussiirteen (CABG) jälkeisen leikkauksen jälkeen
Kahdessa suuressa, kontrolloidussa kliinisessä tutkimuksessa COX-2-selektiivisillä tulehduskipulääkkeillä kivun hoitoon ensimmäisten 10–14 päivän aikana CABG-leikkauksen jälkeen havaittiin lisääntynyt sydäninfarktin ja aivohalvauksen ilmaantuvuus. Tulehduskipulääkkeet ovat vasta-aiheisia CABG:n asetuksissa [katso VASTA-AIHEET ].
MI-potilaat
Tanskan kansallisessa rekisterissä tehdyt havainnointitutkimukset ovat osoittaneet, että potilailla, joita hoidettiin tulehduskipulääkkeillä MI:n jälkeisenä aikana, oli lisääntynyt riski saada uusinta infarktia, sydän- ja verisuonisairauksiin liittyvää kuolemaa ja yleiskuolleisuutta ensimmäisestä hoitoviikosta alkaen. Tässä samassa kohortissa kuoleman ilmaantuvuus ensimmäisenä vuonna MI:n jälkeisenä vuonna oli 20 tapausta 100 henkilövuotta kohden NSAID-hoitoa saaneilla potilailla, kun taas 12 tapausta 100 henkilövuotta kohden ei-NSAID-potilailla. Vaikka absoluuttinen kuolleisuus laski jonkin verran ensimmäisen vuoden MI:n jälkeen, lisääntynyt suhteellinen kuolemanriski NSAID-käyttäjien keskuudessa säilyi ainakin neljän seuraavan seurantavuoden ajan.
Vältä FELDENE 10 mg:n käyttöä potilailla, joilla on äskettäin sydäninfarkti, ellei hyödyn odoteta ylittävän toistuvien sydän- ja verisuonitukosten riskiä. Jos FELDENEä käytetään potilailla, joilla on äskettäin sydäninfarkti, seuraa potilaita sydämen iskemian oireiden varalta.
Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatio
Tulehduskipulääkkeet, mukaan lukien FELDENE, aiheuttavat vakavia maha-suolikanavan (GI) haittavaikutuksia, kuten tulehdusta, verenvuotoa, haavaumia ja ruokatorven, mahan, ohutsuolen tai paksusuolen perforaatiota, jotka voivat olla kohtalokkaita. Näitä vakavia haittavaikutuksia voi esiintyä milloin tahansa varoittavien oireiden kanssa tai ilman niitä potilailla, joita hoidetaan tulehduskipulääkkeillä. Vain joka viides potilas, jolle kehittyy vakava ylemmän maha-suolikanavan haittatapahtuma NSAID-hoidon aikana, on oireellinen. NSAID-lääkkeiden aiheuttamia mahahaavoja, voimakasta verenvuotoa tai perforaatiota esiintyi noin 1 %:lla 3–6 kuukauden ajan hoidetuista potilaista ja noin 2–4 %:lla vuoden ajan hoidetuista potilaista. Edes lyhytaikainen NSAID-hoito ei kuitenkaan ole vaaratonta.
GI-verenvuodon, haavauman ja perforaation riskitekijät
Potilailla, joilla oli aiemmin ollut mahahaava ja/tai maha-suolikanavan verenvuotoa ja jotka käyttivät tulehduskipulääkkeitä, oli yli 10 kertaa suurempi riski saada maha-suolikanavan verenvuoto verrattuna potilaisiin, joilla ei ollut näitä riskitekijöitä. Muita tekijöitä, jotka lisäävät ruoansulatuskanavan verenvuodon riskiä tulehduskipulääkkeillä hoidetuilla potilailla, ovat NSAID-hoidon pidempi kesto; suun kautta otettavien kortikosteroidien, aspiriinin, antikoagulanttien tai selektiivisten serotoniinin takaisinoton estäjien (SSRI) samanaikainen käyttö; tupakointi; alkoholin käyttö; vanhempi ikä; ja huono yleinen terveydentila. Useimmat markkinoille tulon jälkeisistä kuolemaan johtaneista GI-tapahtumista tapahtuneista raporteista tapahtuivat iäkkäillä tai heikkokuntoisilla potilailla. Lisäksi potilailla, joilla on pitkälle edennyt maksasairaus ja/tai koagulopatia, on suurentunut ruoansulatuskanavan verenvuodon riski.
Strategiat GI-riskien minimoimiseksi NSAID-hoidetuilla potilailla
- Käytä pienintä tehokasta annosta mahdollisimman lyhyen ajan.
- Vältä useamman kuin yhden tulehduskipulääkkeen antamista kerrallaan.
- Vältä käyttöä potilailla, joilla on suurempi riski, ellei hyödyn odoteta olevan suurempi kuin lisääntynyt verenvuotoriski. Tällaisille potilaille sekä potilaille, joilla on aktiivinen maha-suolikanavan verenvuoto, harkitse muita vaihtoehtoisia hoitoja kuin tulehduskipulääkkeitä.
- Pysy valppaana GI-haavan ja verenvuodon merkkien ja oireiden varalta NSAID-hoidon aikana.
- Jos epäillään vakavaa GI-haittatapahtumaa, aloita viipymättä arviointi ja hoito ja lopeta FELDENE-hoito, kunnes vakava GI-haittatapahtuma on suljettu pois.
- Jos käytät samanaikaisesti pieniannoksista aspiriinia sydämen ennaltaehkäisyyn, seuraa potilaita tarkemmin GI-verenvuodon varalta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Maksatoksisuus
Kliinisissä tutkimuksissa noin 1 %:lla NSAID-hoitoa saaneista potilaista on raportoitu ALAT- tai ASAT-arvon kohoamista (kolme tai useampi kertaa normaalin ylärajan [ULN]). Lisäksi on raportoitu harvoin, joskus kuolemaan johtaneita, vakavia maksavaurioita, mukaan lukien fulminantti hepatiitti, maksanekroosi ja maksan vajaatoiminta.
ALAT- tai ASAT-arvojen nousua (alle kolme kertaa ULN) voi esiintyä jopa 15 %:lla potilaista, joita hoidetaan tulehduskipulääkkeillä, mukaan lukien piroksikaamilla.
Kerro potilaille maksatoksisuuden varoitusmerkeistä ja oireista (esim. pahoinvointi, väsymys, uneliaisuus, ripuli, kutina, keltaisuus, oikean yläkvadrantin arkuus ja "flunssan kaltaiset" oireet). Jos kliinisiä merkkejä ja oireita, jotka vastaavat maksasairautta, ilmaantuu tai jos systeemisiä oireita (esim. eosinofilia, ihottuma jne.) ilmenee, FELDENE-hoito on lopetettava välittömästi ja potilaan kliininen arviointi.
Hypertensio
Tulehduskipulääkkeet, mukaan lukien FELDENE, voivat johtaa verenpainetaudin uuteen puhkeamiseen tai olemassa olevan verenpainetaudin pahenemiseen, mikä voi lisätä sydän- ja verisuonitapahtumien ilmaantuvuutta. Angiotensiinia konvertoivan entsyymin (ACE) estäjiä, tiatsididiureetteja tai loop-diureetteja käyttävillä potilailla voi olla heikentynyt vaste näihin hoitoihin, kun he käyttävät tulehduskipulääkkeitä (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Seuraa verenpainetta (BP) NSAID-hoidon aloittamisen aikana ja koko hoidon ajan.
Sydämen vajaatoiminta ja turvotus
Coxib ja perinteinen NSAID Trialists' Collaboration -meta-analyysi satunnaistetuista kontrolloiduista tutkimuksista osoitti noin kaksinkertaisen sydämen vajaatoimintaan liittyvien sairaalahoitojen määrän COX-2-selektiivisesti hoidetuilla potilailla ja ei-selektiivisillä NSAID-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin. Tanskan kansallisen rekisterin tutkimuksessa sydämen vajaatoimintapotilailla NSAID-lääkkeiden käyttö lisäsi sydäninfarktin, sydämen vajaatoiminnan vuoksi sairaalahoidon ja kuoleman riskiä.
Lisäksi joillakin tulehduskipulääkkeillä hoidetuilla potilailla on havaittu nesteen kertymistä ja turvotusta. Piroksikaamin käyttö voi heikentää useiden näiden sairauksien hoitoon käytettyjen terapeuttisten aineiden (esim. diureetit, ACE:n estäjät tai angiotensiinireseptorin salpaajat [ARB:t]) CV-vaikutuksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vältä FELDENE 10 mg:n käyttöä potilailla, joilla on vaikea sydämen vajaatoiminta, ellei hyödyn odoteta ylittävän sydämen vajaatoiminnan pahenemisen riskiä. Jos FELDENEä käytetään potilaille, joilla on vaikea sydämen vajaatoiminta, seuraa potilaita sydämen vajaatoiminnan pahenemisen varalta.
Munuaisten toksisuus ja hyperkalemia
Munuaisten toksisuus
Tulehduskipulääkkeiden pitkäaikainen käyttö on johtanut munuaisten papillaarinekroosiin ja muihin munuaisvaurioihin.
Munuaistoksisuutta on havaittu myös potilailla, joilla munuaisten prostaglandiineilla on kompensoiva rooli munuaisten perfuusion ylläpitämisessä. Näillä potilailla tulehduskipulääkkeiden antaminen voi vähentää annoksesta riippuvaa prostaglandiinien muodostumista ja toissijaisesti munuaisten verenkiertoa, mikä voi aiheuttaa ilmeistä munuaisten vajaatoimintaa. Suurin tämän reaktion riski on potilailla, joilla on munuaisten vajaatoiminta, nestehukka, hypovolemia, sydämen vajaatoiminta, maksan toimintahäiriö, diureetteja ja ACE:n estäjiä tai ARB-lääkkeitä käyttävillä ja vanhuksilla. NSAID-hoidon lopettamista seuraa yleensä palautuminen hoitoa edeltävään tilaan.
Kontrolloiduista kliinisistä tutkimuksista ei ole saatavilla tietoa FELDENE 20 mg:n käytöstä potilailla, joilla on pitkälle edennyt munuaissairaus. FELDENE 20 mg:n munuaisvaikutukset voivat nopeuttaa munuaisten vajaatoiminnan etenemistä potilailla, joilla on ennestään munuaissairaus.
Korjaa tilavuustila kuivuneilla tai hypovoleemisilla potilailla ennen FELDENE-hoidon aloittamista. Seuraa munuaisten toimintaa potilailla, joilla on munuaisten tai maksan vajaatoiminta, sydämen vajaatoiminta, nestehukka tai hypovolemia FELDENE-hoidon aikana [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Vältä FELDENEN käyttöä potilailla, joilla on pitkälle edennyt munuaissairaus, ellei hyödyn odoteta ylittävän munuaisten toiminnan huononemisen riskiä. Jos FELDENEä käytetään potilaille, joilla on pitkälle edennyt munuaissairaus, seuraa potilaita munuaisten toiminnan heikkenemisen varalta.
Hyperkalemia
Seerumin kaliumpitoisuuden nousua, mukaan lukien hyperkalemiaa, on raportoitu NSAID-lääkkeiden käytön yhteydessä, jopa joillakin potilailla, joilla ei ole munuaisten vajaatoimintaa. Potilailla, joilla on normaali munuaisten toiminta, näiden vaikutusten on katsottu johtuvan hyporeneemis-hypoaldosteronismista.
Anafylaktiset reaktiot
Piroksikaamiin on liittynyt anafylaktisia reaktioita potilailla, joilla on tai ei tiedetä olevan yliherkkä piroksikaamille, sekä potilailla, joilla on aspiriinille herkkä astma [ks. VASTA-AIHEET ja Aspiriiniherkkyyteen liittyvä astman paheneminen ].
Hakeudu hätäapua, jos anafylaktinen reaktio ilmenee.
Aspiriiniherkkyyteen liittyvä astman paheneminen
Astmaa sairastavien potilaiden alaryhmällä voi olla aspiriinille herkkä astma, johon voi sisältyä krooninen rinosinusiitti, joka on komplisoitunut nenäpolyyppien vuoksi; vakava, mahdollisesti kuolemaan johtava bronkospasmi; ja/tai intoleranssi aspiriinille ja muille tulehduskipulääkkeille. Koska aspiriinin ja muiden tulehduskipulääkkeiden välistä ristireaktiivisuutta on raportoitu tällaisilla aspiriinille herkillä potilailla, FELDENE 20 mg on vasta-aiheinen potilaille, joilla on tällainen aspiriiniherkkyys [ks. VASTA-AIHEET ]. Kun FELDENEä käytetään potilailla, joilla on aiemmin ollut astma (ilman tunnettua aspiriiniherkkyyttä), seuraa potilaita astman oireiden ja merkkien muutosten varalta.
Vakavat ihoreaktiot
Tulehduskipulääkkeet, mukaan lukien piroksikaami, voivat aiheuttaa vakavia ihohaittavaikutuksia, kuten eksfoliatiivisen ihotulehduksen, Stevens-Johnsonin oireyhtymän (SJS) ja toksisen epidermaalisen nekrolyysin (TEN), jotka voivat olla hengenvaarallisia. Nämä vakavat tapahtumat voivat tapahtua ilman varoitusta. Kerro potilaille vakavien ihoreaktioiden merkeistä ja oireista ja lopeta FELDENE 10 mg:n käyttö heti, kun ihottumaa tai jokin muu yliherkkyysmerkki ilmaantuu ensimmäisen kerran. FELDENE 20 mg on vasta-aiheinen potilailla, joilla on aiemmin ollut vakavia ihoreaktioita tulehduskipulääkkeistä [ks. VASTA-AIHEET ].
Sikiön valtimotiehyen ennenaikainen sulkeminen
Piroksikaami voi aiheuttaa sikiön valtimotiehyen ennenaikaisen sulkeutumisen. Vältä tulehduskipulääkkeiden, mukaan lukien FELDENE 20 mg, käyttöä raskaana oleville naisille 30. raskausviikolla (kolmas raskauskolmanneksesta) alkaen [ks. Käyttö tietyissä populaatioissa ].
Hematologinen myrkyllisyys
NSAID-hoitoa saaneilla potilailla on esiintynyt anemiaa. Tämä voi johtua piilevasta tai suuresta verenhukasta, nesteen kertymisestä tai epätäydellisesti kuvatusta vaikutuksesta erytropoieesiin. Jos FELDENE-hoitoa saavalla potilaalla on anemian merkkejä tai oireita, seuraa hemoglobiinia tai hematokriittiä.
Tulehduskipulääkkeet, mukaan lukien FELDENE, voivat lisätä verenvuototapahtumien riskiä. Samanaikaiset sairaudet, kuten hyytymishäiriöt, varfariinin, muiden antikoagulanttien, verihiutaleiden estämiseen tarkoitettujen aineiden (esim. aspiriini), serotoniinin takaisinoton estäjien (SSRI) ja serotoniinin norepinefriinin takaisinoton estäjien (SNRI) samanaikainen käyttö voivat lisätä tätä riskiä. Seuraa näitä potilaita verenvuodon merkkien varalta [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Tulehduksen ja kuumeen peittäminen
FELDENE 10 mg:n farmakologinen aktiivisuus tulehdusta ja mahdollisesti kuumetta vähentävänä voi heikentää diagnostisten merkkien käyttöä infektioiden havaitsemisessa.
Laboratoriovalvonta
Koska vakavaa ruoansulatuskanavan verenvuotoa, maksatoksisuutta ja munuaisvaurioita voi esiintyä ilman varoittavia oireita tai merkkejä, harkitse pitkäaikaista NSAID-hoitoa saavien potilaiden seurantaa CBC:llä ja kemiallisella profiililla säännöllisesti [ks. Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatiot, maksatoksisuus, munuaistoksisuus ja hyperkalemia ] .
Oftalmologiset vaikutukset
Koska ei-steroidisilla tulehduskipulääkkeillä on raportoitu haittavaikutuksia silmässä, on suositeltavaa, että potilaille, joille kehittyy näköhäiriöitä FELDENE-hoidon aikana, tehdään silmätutkimus.

Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ), joka tulee jokaisen jaetun reseptin mukana. Kerro potilaille, perheille tai heidän omaishoitajilleen seuraavista tiedoista ennen FELDENE-hoidon aloittamista ja ajoittain jatkuvan hoidon aikana.
Kardiovaskulaariset tromboottiset tapahtumat
Neuvo potilaita olemaan valppaana sydän- ja verisuonitromboottisten tapahtumien oireiden suhteen, mukaan lukien rintakipu, hengenahdistus, heikkous tai puheen epäselvyys, ja ilmoittamaan kaikista näistä oireista välittömästi terveydenhuollon tarjoajalleen [ks. VAROITUKSET JA VAROTOIMET ].
Ruoansulatuskanavan verenvuoto, haavaumat ja perforaatio
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen haavaumien ja verenvuodon oireista, mukaan lukien ylävatsan kipu, dyspepsia, melena ja hematemesis. Jos käytät samanaikaisesti pieniannoksista aspiriinia sydämen profylaksiaan, kerro potilaille lisääntyneestä ruoansulatuskanavan verenvuodon riskistä ja merkeistä ja oireista [ks. VAROITUKSET JA VAROTOIMET ].
Maksatoksisuus
Kerro potilaille maksatoksisuuden varoitusmerkeistä ja oireista (esim. pahoinvointi, väsymys, letargia, kutina, ripuli, keltaisuus, oikean yläneljänneksen arkuus ja "flunssan kaltaiset" oireet). Jos näitä ilmenee, neuvo potilaita lopettamaan FELDENE ja hakemaan välitöntä lääketieteellistä hoitoa [katso VAROITUKSET JA VAROTOIMET ].
Sydämen vajaatoiminta ja turvotus
Neuvo potilaita olemaan valppaana sydämen vajaatoiminnan oireista, mukaan lukien hengenahdistus, selittämätön painonnousu tai turvotus, ja ottamaan yhteyttä terveydenhuollon tarjoajaan, jos tällaisia oireita ilmenee [ks. VAROITUKSET JA VAROTOIMET ].
Anafylaktiset reaktiot
Kerro potilaille anafylaktisen reaktion oireista (esim. hengitysvaikeudet, kasvojen tai kurkun turvotus). Neuvo potilaita hakemaan välitöntä hätäapua, jos näitä ilmenee [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Vakavat ihoreaktiot
Neuvo potilaita lopettamaan FELDENE-hoito välittömästi, jos heille kehittyy minkäänlainen ihottuma, ja ottamaan yhteyttä terveydenhuollon tarjoajaan mahdollisimman pian [ks. VAROITUKSET JA VAROTOIMET ].
Naisen hedelmällisyys
Kerro lisääntymiskykyisille naisille, jotka haluavat tulla raskaaksi, että tulehduskipulääkkeet, mukaan lukien FELDENE 20 mg, voivat liittyä palautuvaan ovulaation viivästymiseen [ks. Käyttö tietyissä populaatioissa ].
Sikiön toksisuus
Kerro raskaana oleville naisille, että he välttävät FELDENEN ja muiden tulehduskipulääkkeiden käyttöä 30. raskausviikolla, koska on olemassa riski sikiön valtimotiehyen ennenaikaisesta sulkeutumisesta [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Vältä tulehduskipulääkkeiden samanaikaista käyttöä
Kerro potilaille, että FELDENEN samanaikaista käyttöä muiden tulehduskipulääkkeiden tai salisylaattien (esim. diflunisaalin, salsalaatin) kanssa ei suositella, koska maha-suolikanavan toksisuuden riski on lisääntynyt ja tehokkuus lisääntyy vain vähän tai ei ollenkaan [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Varoita potilaita, että tulehduskipulääkkeitä voi olla "reseptivapaa" lääkkeissä vilustumisen, kuumeen tai unettomuuden hoitoon.
Tulehduskipulääkkeiden ja pieniannoksisten aspiriinin käyttö
Kerro potilaille, etteivät he käytä pieniannoksisia aspiriinia samanaikaisesti FELDENEN kanssa, ennen kuin he keskustelevat terveydenhuollon tarjoajansa kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Pitkäaikaisia eläinkokeita ei ole tehty piroksikaamin karsinogeenisen potentiaalin karakterisoimiseksi.
Mutageneesi
Piroksikaami ei ollut mutageeninen Amesin bakteerien käänteismutaatiomäärityksessä tai dominantin letaalimutaatiomäärityksessä hiirillä, eikä se ollut klastogeeninen in vivo -kromosomipoikkeavuusmäärityksessä hiirillä.
Hedelmällisyyden heikkeneminen
Lisääntymistutkimukset, joissa rotille annettiin piroksikaamia annoksina 2, 5 tai 10 mg/kg/vrk (jopa 5 kertaa suurin suositeltu ihmisannos [MRHD] 20 mg perustuen mg/m2 kehon pinta-alaan [BSA]) ei paljastanut miehen tai naisen hedelmällisyyden heikkenemistä.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Tulehduskipulääkkeiden, mukaan lukien FELDENE 20 mg, käyttö raskauden kolmannen kolmanneksen aikana lisää sikiön valtimotiehyen ennenaikaisen sulkeutumisen riskiä. Vältä tulehduskipulääkkeiden, mukaan lukien FELDENE 10 mg, käyttöä raskaana oleville naisille 30. raskausviikolla (kolmas raskauskolmanneksesta alkaen).
FELDENE 20 mg:n käytöstä raskaana oleville naisille ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia.
Havaintotutkimuksista saadut tiedot NSAID-lääkkeiden käytön mahdollisista sikiö- ja sikiöriskeistä raskauden ensimmäisen tai toisen kolmanneksen aikana eivät ole vakuuttavia. Yleisessä yhdysvaltalaisessa väestössä kaikissa kliinisesti tunnistetuissa raskauksissa, lääkealtistuksesta riippumatta, taustalla on 2–4 % vakavia epämuodostumia ja 15–20 % raskauden katkeamista.
Rotilla ja kaneilla tehdyissä lisääntymistutkimuksissa ei havaittu teratogeenisuutta altistuksilla, jotka olivat 5-kertaisia ja kaniineilla 10 kertaa MRHD. Piroksikaamilla tehdyissä rotilla tehdyissä tutkimuksissa sikiötoksisuutta (istutuksen jälkeinen menetys) havaittiin altistuksilla, jotka olivat 2 kertaa MRHD:tä, ja viivästynyttä synnytystä ja lisääntynyt kuolleena synnytyksen ilmaantuvuus todettiin piroksikaamin MRHD:tä vastaavilla annoksilla. Eläintietojen perusteella prostaglandiinien on osoitettu olevan tärkeä rooli kohdun limakalvon verisuonten läpäisevyydessä, blastokystien implantaatiossa ja dedikualaatiossa. Eläinkokeissa prostaglandiinin synteesin estäjien, kuten piroksikaamin, antaminen johti lisääntyneeseen ennen ja jälkeen implantaation menetykseen.
Kliiniset näkökohdat
Työ tai toimitus
FELDENEN vaikutuksista synnytyksen aikana ei ole tutkimuksia. Eläintutkimuksissa tulehduskipulääkkeet, mukaan lukien piroksikaami, estävät prostaglandiinien synteesiä, viivästävät synnytystä ja lisäävät kuolleena syntymän ilmaantuvuutta.
Data
Eläinten tiedot
Raskaana olevat rotat, joille annettiin piroksikaamia 2, 5 tai 10 mg/kg/vrk organogeneesin aikana (raskauspäivät 6-15), osoittivat lisääntyneitä implantaation jälkeisiä menetyksiä, kun piroksikaamia annettiin 5 ja 10 mg/kg/vrk (vastaa 2 ja 10 mg/kg/vrk) 5 kertaa ihmiselle suositeltu enimmäisannos [MRHD], 20 mg, laskettuna mg/m2 kehon pinta-alasta [BSA]). Jälkeläisillä ei havaittu lääkkeisiin liittyviä kehityspoikkeavuuksia. Ruoansulatuskanavan toksisuus lisääntyi raskaana olevilla rotilla tiineyden viimeisen kolmanneksen aikana verrattuna ei-tiineisiin tai aiemmilla raskauskolmanneksilla oleviin rottiin. Tiineillä kaniineilla, joille annettiin piroksikaamia 2, 5 tai 10 mg/kg/vrk organogeneesin aikana (raskauspäivät 7–18), ei havaittu jälkeläisillä lääkkeeseen liittyviä kehityshäiriöitä (jopa 10 kertaa MRHD, joka perustuu mg/m2:een. BSA).
Pre- ja postnataalisessa kehitystutkimuksessa, jossa tiineille rotille annettiin piroksikaamia 2, 5 tai 10 mg/kg/vrk tiineyspäivänä 15 synnytyksen ja jälkeläisten vieroituksen jälkeen, painonnousua ja kuolemaa havaittiin emoilla 10 mg/kg/vrk (5 kertaa MRHD perustuen mg/m2 BSA-arvoon) alkaen raskauspäivästä 20. Hoidetut emot paljastivat vatsakalvontulehduksen, adheesiot, mahaverenvuotoa, verenvuotoa aiheuttavan suolitulehduksen ja kuolleita sikiöitä kohdussa. Synnytys viivästyi ja kuolleena syntyneiden ilmaantuvuus lisääntyi kaikissa piroksikaamilla hoidetuissa ryhmissä (annoksilla, jotka vastaavat MRHD:tä). Synnytyksen jälkeistä kehitystä ei voitu arvioida luotettavasti, koska äidille ei annettu hoitoa vakavan äidin toksisuuden vuoksi.
Imetys
Riskien yhteenveto
Rajoitetut tiedot kahdesta julkaistusta raportista, joihin sisältyi yhteensä 6 imettävää naista ja 2 vauvaa, osoittivat, että piroksikaamia erittyy äidinmaitoon noin 1–3 % äidin pitoisuudesta. Piroksikaamia ei kertynyt maitoon verrattuna äidin plasmaan hoidon aikana. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen FELDENE 20 mg:n tarve ja kaikki FELDENE-valmisteen tai äidin taustalla olevan sairauden mahdolliset haitalliset vaikutukset imetettävään lapseen.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Naaraat
Vaikutusmekanismin perusteella prostaglandiinivälitteisten tulehduskipulääkkeiden, mukaan lukien FELDENE, käyttö voi viivästyttää tai estää munasarjojen follikkelien repeytymistä, mikä on liittynyt palautuvaan hedelmättömyyteen joillakin naisilla. Julkaistut eläintutkimukset ovat osoittaneet, että prostaglandiinin synteesin estäjien antaminen voi häiritä ovulaation edellyttämää prostaglandiinivälitteistä follikkelien repeämistä. Pienet tutkimukset naisilla, joita hoidettiin tulehduskipulääkkeillä, ovat myös osoittaneet palautuvan ovulaation viivästymisen. Harkitse tulehduskipulääkkeiden, mukaan lukien FELDENE-hoidon, lopettamista naisilla, joilla on vaikeuksia tulla raskaaksi tai jotka ovat menossa lapsettomuustutkimuksiin.
Käyttö lapsille
FELDENE 20 mg:n käyttöä ei ole tutkittu lapsipotilailla. FELDENE 10 mg:n turvallisuutta ja tehoa ei ole varmistettu.
Geriatrinen käyttö
Iäkkäillä potilailla on suurempi riski saada tulehduskipulääkkeisiin liittyviä vakavia kardiovaskulaarisia, maha-suolikanavan ja/tai munuaisten haittavaikutuksia kuin nuoremmilla potilailla. Jos iäkkäälle potilaalle odotettu hyöty on suurempi kuin nämä mahdolliset riskit, aloita annostelu annosalueen alimmasta päästä ja seuraa potilaita haittavaikutusten varalta [ks. VAROITUKSET JA VAROTOIMET ].
YLIANNOSTUS
Akuutin NSAID-yliannostuksen jälkeiset oireet ovat tyypillisesti rajoittuneet letargiaan, uneliaisuuteen, pahoinvointiin, oksenteluun ja ylävatsakipuun, jotka yleensä korjaantuvat tukihoidolla. Ruoansulatuskanavan verenvuotoa on esiintynyt. Hypertensiota, akuuttia munuaisten vajaatoimintaa, hengityslamaa ja koomaa on esiintynyt, mutta ne olivat harvinaisia [katso VAROITUKSET JA VAROTOIMET ].
Hoida potilaita oireenmukaisella ja tukihoidolla NSAID-yliannostuksen jälkeen. Spesifisiä vastalääkkeitä ei ole. Harkitse oksentamista ja/tai aktiivihiiltä (60–100 grammaa aikuisilla, 1–2 grammaa painokiloa kohden lapsipotilailla) ja/tai osmoottista katarssia oireellisilla potilailla, jotka havaitaan neljän tunnin kuluessa lääkkeen ottamisesta tai potilailla, joilla on suuri yliannostus ( 5-10 kertaa suositeltu annos).
Piroksikaamin pitkä puoliintumisaika plasmassa tulee ottaa huomioon hoidettaessa piroksikaamin yliannostusta. Pakotettu diureesi, virtsan alkalisointi, hemodialyysi tai hemoperfuusio eivät ehkä ole hyödyllisiä korkean proteiinisitoutumisen vuoksi.
Lisätietoja yliannostushoidosta saat myrkytystietokeskuksesta (1-800-222-1222).
VASTA-AIHEET
FELDENE 10 mg on vasta-aiheinen seuraaville potilaille:
- Tunnettu yliherkkyys (esim. anafylaktiset reaktiot ja vakavat ihoreaktiot) piroksikaamille tai jollekin lääkevalmisteen aineosalle [ks. VAROITUKSET JA VAROTOIMET ]
- Astma, urtikaria tai muut allergisen tyyppiset reaktiot aspiriinin tai muiden tulehduskipulääkkeiden ottamisen jälkeen. Tällaisilla potilailla on raportoitu vakavia, joskus kuolemaan johtaneita, anafylaktisia reaktioita tulehduskipulääkkeisiin [katso VAROITUKSET JA VAROTOIMET ]
- Sepelvaltimon ohitusleikkauksen (CABG) yhteydessä [katso VAROITUKSET JA VAROTOIMET ]
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Piroksikaamilla on kipua lievittävä, anti-inflammatorinen ja kuumetta alentava vaikutus.
FELDENE 20 mg:n, kuten muiden tulehduskipulääkkeiden, vaikutusmekanismia ei täysin tunneta, mutta se sisältää syklo-oksigenaasin (COX-1 ja COX-2) eston.
Piroksikaami on voimakas prostaglandiinien (PG) synteesin estäjä in vitro. Hoidon aikana saavutetut piroksikaamipitoisuudet ovat saaneet aikaan in vivo -vaikutuksia. Prostaglandiinit herkistävät afferentteja hermoja ja tehostavat bradykiniinin vaikutusta kivun aiheuttamiseen eläinmalleissa. Prostaglandiinit ovat tulehduksen välittäjiä. Koska piroksikaami on prostaglandiinisynteesin estäjä, sen vaikutustapa voi johtua prostaglandiinien vähenemisestä ääreiskudoksissa.
Farmakokinetiikka
Yleiset farmakokineettiset ominaisuudet
Piroksikaamin farmakokinetiikkaa on karakterisoitu terveillä henkilöillä, erityisryhmillä ja potilailla. Piroksikaamin farmakokinetiikka on lineaarinen. Altistuminen lisääntyy suhteellisesti annosten kasvaessa. Pidentynyt puoliintumisaika (50 tuntia) johtaa suhteellisen vakaiden plasmapitoisuuksien säilymiseen koko päivän ajan kerran vuorokaudessa annettavilla annoksilla ja merkittävään kumuloitumiseen toistuvan annoksen jälkeen. Useimmat potilaat saavuttavat vakaan tilan plasman 7–12 päivän kuluessa. Korkeampia pitoisuuksia, jotka ovat suunnilleen vakaan tilan 2-3 viikon kohdalla, on havaittu potilailla, joilla piroksikaamin puoliintumisaika plasmassa oli pidempi.
Imeytyminen
Piroksikaami imeytyy hyvin oraalisen annon jälkeen. Lääkeainepitoisuudet plasmassa ovat verrannollisia 10 ja 20 mg:n annoksille ja saavuttavat yleensä huippunsa 3–5 tunnin kuluessa annosta. Yksi 20 mg:n kerta-annos tuottaa yleensä piroksikaamin huippupitoisuuksia plasmassa 1,5–2 mcg/ml, kun taas lääkkeen enimmäispitoisuudet plasmassa stabiloituvat toistuvan 20 mg:n päivittäisen piroksikaamin annon jälkeen arvoon 3–8 mikrog/ml.
Ruoan yhteydessä imeytymisnopeus hidastuu hieman, mutta ei sen laajuus oraalisen annon jälkeen. Antasidien (alumiinihydroksidin tai alumiinihydroksidin ja magnesiumhydroksidin) samanaikaisella antamisella ei ole osoitettu olevan vaikutusta suun kautta annetun piroksikaamin pitoisuuksiin plasmassa.
Jakelu
Piroksikaamin näennäinen jakautumistilavuus on noin 0,14 l/kg. Yhdeksänkymmentäyhdeksän prosenttia plasman piroksikaamista sitoutuu plasman proteiineihin. Piroksikaami erittyy äidinmaitoon. Sen esiintyminen rintamaidossa on määritetty alku- ja pitkäaikaisolosuhteissa (52 päivää). Piroksikaamia erittyi äidinmaitoon noin 1–3 % äidin pitoisuudesta. Piroksikaamia ei kertynyt maitoon verrattuna plasmaan hoidon aikana.
Eliminointi
Aineenvaihdunta
Piroksikaamin metabolia tapahtuu hydroksylaatiolla pyridyylisivuketjun 5-asemassa ja tämän tuotteen konjugoimalla; syklodehydraation avulla; ja reaktiosarjalla, joka sisältää amidisidoksen hydrolyysin, dekarboksyloinnin, renkaan supistumisen ja N-demetyloinnin. In vitro -tutkimukset osoittavat, että sytokromi P4502C9 (CYP2C9) on pääasiallinen entsyymi, joka osallistuu 5'-hydroksipiroksikaamin, päämetaboliitin, muodostumiseen [ks. Farmakogenomiikka ]. Piroksikaamin aineenvaihdunnan biotransformaatiotuotteilla ei ole raportoitu olevan minkäänlaista anti-inflammatorista vaikutusta.
Suurempi systeeminen piroksikaamin altistus on havaittu potilailla, joilla on CYP2C9-polymorfismia verrattuna normaaleihin metaboloijatyyppisiin henkilöihin [ks. Farmakogenomiikka ].
Erittyminen
Piroksikaami ja sen biotransformaatiotuotteet erittyvät virtsaan ja ulosteeseen, ja virtsaan on noin kaksi kertaa enemmän kuin ulosteessa. Noin 5 % FELDENE 10 mg:n annoksesta erittyy muuttumattomana. Piroksikaamin puoliintumisaika plasmassa (t½ ) on noin 50 tuntia.
Tietyt populaatiot
Pediatriset
Piroksikaamia ei ole tutkittu lapsipotilailla.
Rotu
Rotuun johtuvia farmakokineettisiä eroja ei ole tunnistettu.
Maksan vajaatoiminta
Maksasairauden vaikutuksia piroksikaamin farmakokinetiikkaan ei ole osoitettu. Merkittävä osa piroksikaamista eliminoituu kuitenkin maksametaboliassa. Tämän seurauksena potilaat, joilla on maksasairaus, saattavat tarvita pienempiä piroksikaamin annoksia verrattuna potilaisiin, joilla on normaali maksan toiminta.
Munuaisten vajaatoiminta
Piroksikaamin farmakokinetiikkaa on tutkittu potilailla, joilla on munuaisten vajaatoiminta. Tutkimukset osoittavat, että potilaat, joilla on lievä tai kohtalainen munuaisten vajaatoiminta, eivät välttämättä tarvitse annostuksen muuttamista. Piroksikaamin farmakokineettisiä ominaisuuksia ei kuitenkaan tunneta potilailla, joilla on vaikea munuaisten vajaatoiminta tai jotka saavat hemodialyysihoitoa.
Huumeiden vuorovaikutustutkimukset
Antasidit
Antasidien samanaikainen antaminen ei vaikuttanut piroksikaamin pitoisuuksiin plasmassa.
Aspiriini
Kun piroksikaamia annettiin aspiriinin kanssa, sen sitoutuminen proteiineihin väheni, vaikka vapaan FELDENE 20 mg:n puhdistuma ei muuttunut. Piroksikaamin pitoisuudet plasmassa laskivat noin 80 %:iin normaaliarvoistaan, kun FELDENEä (20 mg/vrk) annettiin yhdessä aspiriinin (3900 mg/vrk) kanssa. Tämän yhteisvaikutuksen kliinistä merkitystä ei tunneta [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Farmakogenomiikka
CYP2C9-aktiivisuus on vähentynyt yksilöillä, joilla on geneettisiä polymorfismeja, kuten CYP2C9*2- ja CYP2C9*3-polymorfismeja. Rajoitetut tiedot kahdesta julkaistusta raportista osoittivat, että henkilöillä, joilla oli heterotsygoottinen CYP2C9*1/*2 (n=9), heterotsygoottinen CYP2C9*1/*3 (n=9) ja homotsygoottinen CYP2C9*3/*3 (n=1) genotyyppi 1,7-, 1,7- ja 5,3-kertaiset systeemiset piroksikaamipitoisuudet, vastaavasti, kuin koehenkilöillä, joilla oli CYP2C9*1/*1 (n=17, normaali metaboloijagenotyyppi) kerta-annoksen oraalisen annon jälkeen. Piroksikaamin eliminaation puoliintumisajan keskiarvot koehenkilöillä, joilla oli CYP2C9*1/*3 (n=9) ja CYP2C9*3/*3 (n=1) genotyyppi, olivat 1,7 ja 8,8 kertaa korkeammat kuin koehenkilöillä, joilla oli CYP2C9*1. /*1 (n = 17). On arvioitu, että homotsygoottisen*3/*3-genotyypin esiintymistiheys on 0-1 % koko populaatiossa; Kuitenkin jopa 5,7 %:n esiintymistiheys on raportoitu tietyissä etnisissä ryhmissä.
CYP2C9-substraattien huonot metaboloijat
Potilaiden, joiden tiedetään tai epäillään olevan heikkoja CYP2C9-metaboloijia genotyypin tai aiemman muiden CYP2C9-substraattien (kuten varfariinin ja fenytoiinin) käytöstä/kokemuksen perusteella, harkitse annoksen pienentämistä, koska heillä saattaa olla epätavallisen korkeat plasmapitoisuudet heikentyneen metabolisen puhdistuman vuoksi.
Kliiniset tutkimukset
Kontrolloiduissa kliinisissä tutkimuksissa FELDENEN tehokkuus on osoitettu sekä nivelreuman ja nivelrikon akuuteissa pahenemisvaiheissa että pitkäaikaisessa hoidossa.
FELDENE 20 mg:n terapeuttiset vaikutukset näkyvät molempien sairauksien hoidon alussa, ja vaste lisääntyy asteittain useiden (8–12) viikkojen aikana. Teho nähdään kivun lievityksenä ja mahdollisena tulehduksen hiljentymisenä.
20 mg/vrk FELDENE 20 mg:n terapeuttinen vaikutus on verrattavissa aspiriinin terapeuttisiin annoksiin, ja vähäisten maha-suolikanavan vaikutusten ja tinnituksen ilmaantuvuus on pienempi.
FELDENE 10 mg on annettu samanaikaisesti kiinteiden kulta- ja kortikosteroidiannosten kanssa. "Steroideja säästävän" vaikutuksen olemassaoloa ei ole tähän mennessä tutkittu riittävästi.
POTILASTIEDOT
Mikä on tärkein tieto, joka minun pitäisi tietää lääkkeistä, joita kutsutaan steroideihin kuulumattomiksi tulehduskipulääkkeiksi (NSAID)?
Tulehduskipulääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Lisääntynyt sydänkohtauksen tai aivohalvauksen riski, joka voi johtaa kuolemaan. Tämä riski voi ilmetä hoidon alkuvaiheessa ja voi lisääntyä:
- NSAID-lääkkeiden kasvavilla annoksilla
- tulehduskipulääkkeiden pidempään käyttöön
- Lisääntynyt ruokatorven (suusta mahaan johtava putki), mahan ja suoliston verenvuodon, haavaumien ja repeytymien (rei'itysten) riski:
- milloin tahansa käytön aikana
- ilman varoittavia oireita
- joka voi aiheuttaa kuoleman
Haavan tai verenvuodon riski kasvaa:
- aiempi mahahaava tai maha- tai suolistoverenvuoto NSAID-lääkkeiden käytön yhteydessä
- "kortikosteroideiksi", "antikoagulantteiksi", "SSRI-lääkkeiksi" tai "SNRI-lääkkeiksi" kutsuttujen lääkkeiden ottaminen
- tulehduskipulääkkeiden annoksia
- tulehduskipulääkkeiden pidempi käyttö
- tupakointi-
- juoda alkoholia
- vanhempi ikä
- huono terveys
- pitkälle edennyt maksasairaus
- verenvuoto-ongelmia
Tulehduskipulääkkeitä tulee käyttää vain:
- juuri niin kuin määrätään
- pienimmällä mahdollisella annoksella hoitoasi
- lyhimmän tarvittavan ajan
Älä ota tulehduskipulääkkeitä juuri ennen tai jälkeen sydänleikkauksen, jota kutsutaan "sepelvaltimon ohitusleikkaukseksi (CABG)."
Vältä tulehduskipulääkkeiden ottamista äskettäisen sydänkohtauksen jälkeen, ellei terveydenhuollon tarjoaja kehota sinua tekemään niin. Sinulla saattaa olla suurentunut riski saada toinen sydänkohtaus, jos käytät tulehduskipulääkkeitä äskettäisen sydänkohtauksen jälkeen
Mitä tulehduskipulääkkeet ovat?
Tulehduskipulääkkeitä käytetään kivun ja punoituksen, turvotuksen ja lämmön (tulehduksen) hoitoon sairauksista, kuten erilaisista niveltulehduksista, kuukautiskipuista ja muista lyhytaikaisista kivuista.
Kuka ei saa käyttää tulehduskipulääkkeitä?
Älä käytä tulehduskipulääkkeitä:
- jos sinulla on ollut astmakohtaus, nokkosihottuma tai muu allerginen reaktio aspiriinin tai muiden tulehduskipulääkkeiden kanssa.
- juuri ennen tai jälkeen sydämen ohitusleikkauksen.
Ennen kuin otat tulehduskipulääkkeitä, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on maksa- tai munuaisongelmia
- on korkea verenpaine
- on astma
- olet raskaana tai suunnittelet raskautta. Keskustele terveydenhuollon tarjoajan kanssa, jos harkitset tulehduskipulääkkeiden käyttöä raskauden aikana. Älä käytä tulehduskipulääkkeitä 29 raskausviikon jälkeen
- imetät tai suunnittelet imettämistä.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- tai käsikauppalääkkeet, vitamiinit tai yrttilisät. Tulehduskipulääkkeet ja jotkut muut lääkkeet voivat olla vuorovaikutuksessa keskenään ja aiheuttaa vakavia sivuvaikutuksia. Älä aloita uuden lääkkeen käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa.
Mitkä ovat tulehduskipulääkkeiden mahdolliset sivuvaikutukset?
Tulehduskipulääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää lääkkeistä, joita kutsutaan steroideihin kuulumattomiksi tulehduskipulääkkeiksi (NSAID)?"
- uusi tai pahempi korkea verenpaine
- sydämen vajaatoiminta
- maksaongelmia, mukaan lukien maksan vajaatoiminta
- munuaisongelmat mukaan lukien munuaisten vajaatoiminta
- alhainen punasolujen määrä (anemia)
- hengenvaarallisia ihoreaktioita
- hengenvaarallisia allergisia reaktioita
- Muita NSAID-lääkkeiden sivuvaikutuksia ovat: vatsakipu, ummetus, ripuli, kaasut, närästys, pahoinvointi, oksentelu ja huimaus.
Hae heti hätäapua, jos saat jonkin seuraavista oireista:
- hengenahdistus tai hengitysvaikeudet
- rintakipu
- heikkous jossakin kehon osassa tai puolella
- sammaltava puhe
- kasvojen tai kurkun turvotus
Lopeta tulehduskipulääkkeiden käyttö ja soita heti terveydenhuollon tarjoajallesi, jos saat jonkin seuraavista oireista:
- pahoinvointi
- tavallista väsyneempi tai heikompi
- ripuli
- kutina
- ihosi tai silmäsi näyttävät keltaisilta
- ruoansulatushäiriöt tai vatsakipu
- flunssan kaltaiset oireet
- oksentaa verta
- suolistossasi on verta tai se on mustaa ja tahmeaa kuin terva
- epätavallinen painonnousu
- ihottuma tai rakkuloita ja kuumetta
- käsivarsien, jalkojen, käsien ja jalkojen turvotus
Jos otat liikaa tulehduskipulääkkeitäsi, soita terveydenhuollon tarjoajalle tai hakeudu välittömästi lääkärin hoitoon.
Nämä eivät ole kaikkia tulehduskipulääkkeiden mahdollisia sivuvaikutuksia. Kysy lisää tulehduskipulääkkeistä terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Muita tietoja tulehduskipulääkkeistä
- Aspiriini on NSAID, mutta se ei lisää sydänkohtauksen mahdollisuutta. Aspiriini voi aiheuttaa verenvuotoa aivoissa, mahassa ja suolistossa. Aspiriini voi myös aiheuttaa haavaumia mahassa ja suolistossa.
- Joitakin tulehduskipulääkkeitä myydään pienempinä annoksina ilman reseptiä (reseptivapaa). Keskustele terveydenhuollon tarjoajan kanssa ennen kuin käytät reseptivapaa tulehduskipulääkkeitä yli 10 päivää.
Yleistä tietoa tulehduskipulääkkeiden turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä tulehduskipulääkkeitä sairauteen, johon niitä ei ole määrätty. Älä anna tulehduskipulääkkeitä muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Jos haluat lisätietoja tulehduskipulääkkeistä, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja tulehduskipulääkkeistä, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
