Bakteerilääkkeet: Bactrim 400/80mg, 800/160mg Trimethoprim Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Tuotemerkki: Bactrim
Yleisnimi: Sulfametoksatsoli ja trimetopriimi-injektio suonensisäistä infuusiota varten
Mikä on Bactrim 800mg?
Bactrim (sulfametoksatsoli ja trimetopriimi) DS on kahden antibiootin yhdistelmä, joita käytetään virtsatieinfektioiden, akuutin välikorvatulehduksen, keuhkoputkentulehduksen, Shigelloosin, Pneumocystis-keuhkokuumeen, matkaripulin, metisilliiniresistentin Staphylococcus aureuksen (MRSA) ja muiden bakteerien hoitoon. tälle antibiootille herkkiä infektioita.
Mitkä ovat Bactrimin sivuvaikutukset?
Bactrimin yleisiä sivuvaikutuksia ovat:
- ruokahalun menetys,
- pahoinvointi,
- oksentelua,
- kivulias tai turvonnut kieli,
- huimaus,
- pyörivä tunne,
- soi korvissasi,
- väsymys tai
- unihäiriöt (unettomuus).
Kerro lääkärillesi, jos sinulla on vakavia Bactrim 800 mg:n sivuvaikutuksia, mukaan lukien:
- mustelmat tai verenvuoto,
- aplastinen anemia,
- keltaisuus,
- maksanekroosi,
- suun haavaumat,
- nivelkivut,
- vakavat ihottumat,
- kutinaa ja
- kipeä kurkku.
KUVAUS
BACTRIM™ (trimetopriimi ja sulfametoksatsoli) -injektio, steriili liuos vain suonensisäistä infuusiota varten, on yhdistelmä sulfametoksatsolia, sulfonamidiantimikrobista ainetta, ja trimetopriimiä, dihydrofolaattireduktaasi-inhibiittoria. Jokainen 5 ml sisältää 80 mg trimetopriimiä (16 mg/ml) ja 400 mg sulfametoksatsolia (80 mg/ml) sekoitettuna 40 % propyleeniglykoliin, 10 % etyylialkoholiin ja 0,3 % dietanoliamiiniin; 1 % bentsyylialkoholia ja 0,1 % natriummetabisulfiittia lisätty säilöntäaineina, injektionesteisiin käytettävä vesi ja pH säädetty noin arvoon 10 natriumhydroksidilla.
Trimetopriimi on 2,4-diamino-5-(3,4,5-trimetoksibentsyyli)pyrimidiini. Se on valkoisesta vaaleankeltaiseen, hajuton, karvas yhdiste, jonka molekyylipaino on 290,3 ja jolla on seuraava rakennekaava:
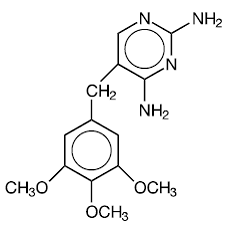
C14H18N4O3 MW 290,3
Sulfametoksatsoli on N1-(5-metyyli-3-isoksatsolyyli)sulfanilamidi. Se on melkein valkoinen, hajuton, mauton yhdiste, jonka molekyylipaino on 253,28 ja jolla on seuraava rakennekaava:
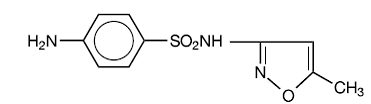
C10H11N3O3S MW 253,28
INDIKAATIOT
Pneumocystis jirovecii Keuhkokuume
BACTRIM on tarkoitettu Pneumocystis jirovecii -keuhkokuumeen hoitoon aikuisille ja yli kahden kuukauden ikäisille lapsipotilaille.
Shigelloosi
BACTRIM 400mg on tarkoitettu herkkien Shigella flexneri- ja Shigella sonnei -kantojen aiheuttaman enteriitin hoitoon aikuisille ja yli kahden kuukauden ikäisille lapsipotilaille.
Virtsatieinfektiot
BACTRIM on tarkoitettu vaikeiden tai monimutkaisten virtsatieinfektioiden hoitoon aikuisilla ja kahden kuukauden ikäisillä ja sitä vanhemmilla lapsipotilailla, jotka johtuvat herkistä Escherichia coli-, Klebsiella-, Enterobacter-, Morganella morganii-, Proteus mirabilis- ja Proteus vulgaris -kannoista, kun BACTRIM ei ole käyttökelpoinen ja kun organismi ei ole herkkä virtsateissä tehokkaille yksittäisille antibakteerisille aineille.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja BACTRIMin ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi BACTRIM-valmistetta tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään aiheuttavan herkkiä bakteereja. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
Vaikka asianmukaiset viljely- ja herkkyystutkimukset tulisi suorittaa, hoito voidaan aloittaa näiden tutkimusten tuloksia odotellessa.
ANNOSTELU JA HALLINNOINTI
Annostus aikuisille ja lapsipotilaille (kahden kuukauden ikäisille ja sitä vanhemmille)
Suurin suositeltu vuorokausiannos on 60 ml (960 mg trimetopriimiä) päivässä.
Annoksen muuttaminen potilailla, joilla on heikentynyt munuaisten toiminta
Kun munuaisten toiminta on heikentynyt, annosta tulee käyttää pienempään annokseen taulukon 2 mukaisesti.
Tärkeät hallintaohjeet
Anna liuos suonensisäisenä infuusiona 60–90 minuutin aikana. Vältä antamasta nopeaa infuusiota tai bolusinjektiota. ÄLÄ anna BACTRIM 400 mg lihakseen.
Tarkista silmämääräisesti parenteraaliset lääkevalmisteet hiukkasten ja värimuutosten varalta ennen antoa aina, kun liuos ja säiliö sen sallivat.
Valmistusmenetelmä
Yksi- ja usean annoksen injektiopullojen laimennus
BACTRIM on laimennettava. Jokainen 5 ml tulee lisätä 125 ml:aan 5 % dekstroosia vedessä. Kun liuosta on laimennettu 5-prosenttisella dekstroosilla vedessä, sitä ei saa säilyttää jääkaapissa, vaan se tulee käyttää 6 tunnin kuluessa.
Jos halutaan laimennus 5 ml/100 ml 5 % dekstroosia vedessä, se tulee käyttää 4 tunnin kuluessa. Niissä tapauksissa, joissa nesteen rajoittaminen on toivottavaa, kukin 5 ml voidaan lisätä 75 ml:aan 5 % dekstroosia vedessä. Näissä olosuhteissa liuos on sekoitettava juuri ennen käyttöä ja annettava 2 tunnin kuluessa.
Jos visuaalisessa tarkastelussa on sameutta tai merkkejä kiteytymisestä sekoittamisen jälkeen, liuos on hävitettävä ja valmistettava uusi liuos.
Tehdä EI sekoita Bactrim 5-prosenttisessa dekstroosissa vedessä lääkkeiden tai liuosten kanssa samassa astiassa.
Useita annoksia sisältävät injektiopullot (käsittely)
Ensimmäisen injektiopulloon syöttämisen jälkeen jäljellä oleva sisältö on käytettävä 48 tunnin kuluessa.
Infuusiojärjestelmät laskimonsisäiseen antamiseen
Seuraavat infuusiojärjestelmät on testattu ja todettu tyydyttäviksi: yksikköannoslasisäiliöt; yksikköannos polyvinyylikloridi- ja polyolefiinisäiliöt. Muita järjestelmiä ei ole testattu, joten muita ei voida suositella.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
BACTRIM on saatavana injektiona, joka sisältää 80 mg/ml sulfametoksatsolia ja 16 mg/ml trimetopriimiä 10 ml:n kerta-annoksen ja 30 ml:n usean annoksen injektiopulloissa.
Varastointi ja käsittely
BACTRIM™ (sulfametoksatsoli ja trimetopriimi) -injektio toimitetaan seuraavasti:
10 ml:n pullot joka sisältää 160 mg trimetopriimiä (16 mg/ml) ja 800 mg sulfametoksatsolia (80 mg/ml) infuusiota varten 5 % dekstroosia vedessä.
10 ml injektiopullo: NDC 49708-001-4210 ml:n injektiopullo (10 kpl:n laatikko): NDC 49708-001-45
30 ml:n usean annoksen injektiopullot , jokainen 5 ml sisältää 80 mg trimetopriimiä (16 mg/ml) ja 400 mg sulfametoksatsolia (80 mg/ml) infuusiota varten 5 % dekstroosia vedessä.
30 ml:n injektiopullo (1 laatikko): NDC 49708-002-47
Säilytä huoneenlämmössä (15°C – 30°C tai 59°F – 86°F). ÄLÄ SÄILYTÄ JÄÄHDYKSI.
VIITTEET
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimetopriimi-sulfametoksatsoli Pneumocystis carinii -keuhkokuumeen hoitoon. Ann Intern Med. kesäkuu 1980; 92:762-769.
Jakelija: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Tarkistettu: heinäkuu 2020
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu muualla merkinnöissä:
- Alkion ja sikiön toksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyys ja muut kohtalokkaat reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Trombosytopenia [katso VAROITUKSET JA VAROTOIMET ]
- Clostridioides difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Sulfiittiherkkyys [katso VAROITUKSET JA VAROTOIMET ]
- Leucovorinin samanaikaiseen käyttöön Pneumocystis jirovecii -keuhkokuumeen liittyvä riski [ks. VAROITUKSET JA VAROTOIMET ]
- Propyleeniglykolin myrkyllisyys [katso VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ]
- Infuusioreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Hypoglykemia [katso VAROITUKSET JA VAROTOIMET ]
- Elektrolyyttihäiriöt [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yleisimmät haittavaikutukset ovat ruoansulatuskanavan häiriöt (pahoinvointi, oksentelu ja ruokahaluttomuus) ja allergiset ihoreaktiot (kuten ihottuma ja urtikaria).
Paikallinen reaktio, kipu ja lievä ärsytys suonensisäisen (IV) annon yhteydessä ovat harvinaisia. Tromboflebiittiä on havaittu.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu BACTRIM-valmisteen hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
- Tromboottinen trombosytopenia purppura
- Idiopaattinen trombosytopeeninen purppura
- QT-ajan pidentyminen, mikä johtaa kammiotakykardiaan ja torsade de pointes -kohtaan
- Metabolinen asidoosi
HUUMEIDEN VUOROVAIKUTUKSET
BACTRIM 400 mg:n mahdollisuus vaikuttaa muihin lääkkeisiin
Trimetopriimi on CYP2C8:n ja OCT2-kuljettajan estäjä. Sulfametoksatsoli on CYP2C9:n estäjä. Vältä BACTRIM 80 mg:n samanaikaista antamista lääkkeiden kanssa, jotka ovat CYP2C8:n ja 2C9:n tai OCT2:n substraatteja.
Vuorovaikutus laboratorio- tai diagnostisten testausten kanssa
BACTRIM, erityisesti trimetopriimikomponentti, voi häiritä seerumin metotreksaattimääritystä kompetitiivisella sitomisproteiinitekniikalla (CBPA) määritettynä, kun sitovana proteiinina käytetään bakteerien dihydrofolaattireduktaasia. Häiriöitä ei kuitenkaan esiinny, jos metotreksaatti mitataan radioimmunomäärityksellä (RIA).
BACTRIM:n läsnäolo voi myös häiritä Jaffen alkalisen pikraattireaktion kreatiniinimääritystä, mikä johtaa noin 10 %:n yliarviointiin normaaliarvojen alueella.
VIITTEET
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Mitä kliinikon tulisi tietää QT-välistä. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Katsaus: Dofetilidin farmakologia ja toksikologia. Int J Med Toxicol. 2001; 4(2):16.
5. London NJ, Garg SJ, Moorthy RS, Cunningham ET. Lääkkeiden aiheuttama uveiitti. J Oftalminen tulehdus Infect. 2013; 3:43.
6. Marinella MA. Trimetopriimin aiheuttama hyperkalemia: raportoitujen tapausten analyysi. Gerontol. 1999;45:209-212.
7. Margassery S, Bastani B. Henkeä uhkaava hyperkalemia ja asidoosi trimetoprimisulfametoksatsolihoidon seurauksena. J. Nephrol. 2001;14(5):410-414.
8. Moh R, et ai. Hematologiset muutokset aikuisilla, jotka saavat tsidovudiinia sisältävää HAART-hoitoa yhdessä kotrimoksatsolin kanssa Norsunluurannikolla. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr, Vlasses PH. Trimetopriimi muuttaa prokaiiniamidin ja nasetyyliprokaiiniamidin jakautumista. Clin Pharmacol Ther. lokakuu 1988; 44(4):467-77.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Alkion ja sikiön myrkyllisyys
Jotkut epidemiologiset tutkimukset viittaavat siihen, että altistuminen BACTRIM-valmisteelle raskauden aikana voi liittyä lisääntyneeseen synnynnäisten epämuodostumien, erityisesti hermoputkivaurioiden, kardiovaskulaaristen epämuodostumien, virtsatievaurioiden, suun halkeamien ja mailanjalan riskiin. Jos BACTRIM 400 mg:aa käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on kerrottava mahdollisista sikiölle aiheutuvista vaaroista (ks. Käyttö tietyissä populaatioissa ].
Yliherkkyys ja muut kohtalokkaat reaktiot
Sulfonamidien antamiseen liittyviä kuolemantapauksia on ilmennyt vakavista reaktioista, mukaan lukien Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, fulminantti maksanekroosi, agranulosytoosi, aplastinen anemia ja muut veren dyskrasiat.
Sulfonamidit, mukaan lukien sulfonamidia sisältävät tuotteet, kuten BACTRIM, on lopetettava heti, kun ihottumaa tai haittavaikutuksia ilmenee ensimmäisen kerran. Kliiniset oireet, kuten ihottuma, kurkkukipu, kuume, nivelsärky, yskä, hengenahdistus, kalpeus, purppura tai keltaisuus, voivat olla varhaisia merkkejä vakavista reaktioista. Ihottumaa voi seurata vakavampia reaktioita, kuten Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, maksanekroosi tai vakava verihäiriö. Täydelliset verenkuvat tulee tehdä usein potilailta, jotka saavat sulfonamideja. Yskä, hengenahdistus ja keuhkoinfiltraatit ovat hengitysteiden yliherkkyysreaktioita, joita on raportoitu sulfonamidihoidon yhteydessä.
Trombosytopenia
BACTRIM-indusoitu trombosytopenia voi olla immuunivälitteinen häiriö. Vakavia trombosytopeniatapauksia, jotka ovat kuolemaan johtavia tai hengenvaarallisia, on raportoitu. Tarkkaile potilaita hematologisen toksisuuden varalta. Trombosytopenia paranee yleensä viikossa BACTRIM-hoidon lopettamisen jälkeen.
Streptokokki-infektiot ja reumakuume
Vältä BACTRIM-valmisteen käyttöä streptokokkien aiheuttaman nielutulehduksen hoidossa. Kliiniset tutkimukset ovat dokumentoineet, että potilailla, joilla on A-ryhmän β-hemolyyttinen streptokokkitonsillofaryngiitti, on suurempi esiintyvyys bakteriologisen epäonnistumisen aikana BACTRIM 800 mg:lla hoidettuna kuin niillä potilailla, joita hoidettiin penisilliinillä, mikä on osoituksena siitä, että tätä organismia ei ole saatu hävitettyä nielurisojen alueelta. Siksi BACTRIM ei estä jälkitauteja, kuten reumaattista kuumetta.
Clostridioides Difficile -bakteeriin liittyvä ripuli
Clostridioides difficile -bakteeriin liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien BACTRIM 80 mg, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripulia antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibakteerinen käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, antibakteerinen hoito
C. difficile, ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
Sulfiittiherkkyys
BACTRIM 400 mg sisältää natriummetabisulfiittia, sulfiittia, joka voi aiheuttaa allergisen tyyppisiä reaktioita, mukaan lukien anafylaktisia oireita ja hengenvaarallisia tai lievempiä astmakohtauksia tietyillä herkillä ihmisillä. Sulfiittiherkkyyden yleistä esiintyvyyttä väestössä ei tunneta. Sulfiittiherkkyyttä havaitaan useammin astmaatikoilla kuin ei-astmaisilla.
Bentsyylialkoholin toksisuus lapsipotilailla ("hengitysoireyhtymä")
BACTRIM 160mg sisältää bentsyylialkoholia säilöntäaineena. Vakavia ja kuolemaan johtavia haittavaikutuksia, mukaan lukien "hengitysoireyhtymä", voi esiintyä vastasyntyneillä ja pienipainoisilla imeväisillä, joita hoidetaan bentsyylialkoholilla säilöttyillä infuusioliuoksilla, mukaan lukien BACTRIM. "Huokkaava oireyhtymä" on tunnusomaista keskushermoston lamaantumisesta, metabolisesta asidoosista ja hengityksestä. BACTRIM 160mg on vasta-aiheinen alle kahden kuukauden ikäisille lapsipotilaille [ks. VASTA-AIHEET ].
Kun määräät BACTRIM 400 mg:aa lapsipotilaille (2 kuukauden ikäisille ja vanhemmille), ota huomioon bentsyylialkoholin yhdistetty päivittäinen metabolinen kuormitus kaikista lähteistä, mukaan lukien BACTRIM (sisältää 10 mg bentsyylialkoholia/ml) ja muut bentsyylialkoholia sisältävät lääkkeet. Bentsyylialkoholin vähimmäismäärää, jolla voi esiintyä vakavia haittavaikutuksia, ei tunneta [katso Käyttö tietyissä populaatioissa ].
Leukovoriinin samanaikaiseen käyttöön Pneumocystis jirovecii -keuhkokuumeen liittyvä riski
Hoidon epäonnistuminen ja liiallinen kuolleisuus havaittiin, kun BACTRIM-valmistetta käytettiin samanaikaisesti leukovoriinin kanssa HIV-positiivisten potilaiden, joilla oli Pneumocystis jirovecii -keuhkokuume, hoitoon satunnaistetussa lumekontrolloidussa tutkimuksessa.4 Vältä BACTRIM:n ja leukovoriinin yhteiskäyttöä Pneumocystis jirovecii -keuhkokuumeen hoidon aikana.
Propyleeniglykolin myrkyllisyys
BACTRIM sisältää propyleeniglykolia liuottimena (40 % v/v). Käytettäessä suuria annoksia, kuten P. jirovecii -keuhkokuumeen hoidossa ja samanaikaisesti muiden propyleeniglykolia sisältävien valmisteiden kanssa, voi esiintyä hyperosmolaarisuutta ja anionivälin metabolista asidoosia, mukaan lukien maitohappoasidoosi. Propyleeniglykolin toksisuus voi johtaa akuuttiin munuaisvaurioon, keskushermostotoksisuuteen ja usean elimen vajaatoimintaan. Tarkkaile propyleeniglykolin päivittäistä kokonaissaantia kaikista lähteistä ja happo-emäshäiriöitä. Lopeta BACTRIM 400 mg:n käyttö, jos epäillään propyleeniglykolin toksisuutta [ks. HAITTAVAIKUTUKSET ].
Folaatin puute
Vältä BACTRIM 160 mg:n käyttöä potilailla, joiden munuaisten tai maksan toiminta on heikentynyt, joilla on mahdollinen folaatin puutos (esim. vanhukset, krooniset alkoholistit, potilaat, jotka saavat antikonvulsanttihoitoa, potilaat, joilla on imeytymishäiriö ja potilaat, joilla on aliravitsemustila) ja potilailla, joilla on vaikea allergiat tai keuhkoastma.
Foolihapon puutteeseen viittaavia hematologisia muutoksia voi esiintyä iäkkäillä potilailla tai potilailla, joilla on aiemmin ollut foolihapon puutos tai munuaisten vajaatoiminta. Nämä vaikutukset ovat palautuvia foliinihappohoidolla [katso Käyttö tietyissä populaatioissa ].
Hemolyysi
Glukoosi-6-fosfaattidehydrogenaasin puutteesta kärsivillä henkilöillä voi esiintyä hemolyysiä. Tämä reaktio on usein annoksesta riippuvainen.
Infuusioreaktiot
Infuusion ekstravaskulaarisesta infiltraatiosta johtuvaa paikallista ärsytystä ja tulehdusta on havaittu BACTRIM-hoidon yhteydessä. Jos näitä ilmenee, infuusio on keskeytettävä ja aloitettava uudelleen toisesta kohdasta.
Hypoglykemia
Hypoglykemiatapauksia ei-diabeettisilla potilailla, joita on hoidettu BACTRIM 400 mg:lla, on havaittu, yleensä muutaman päivän hoidon jälkeen. Potilaat, joilla on munuaisten vajaatoiminta, maksasairaus, aliravitsemus tai jotka saavat suuria BACTRIM 800 mg -annoksia, ovat erityisen vaarassa.
Fenyylialaniinin heikentynyt aineenvaihdunta
Trimetopriimin, BACTRIM-valmisteen komponentin, on todettu heikentävän fenyylialaniinin aineenvaihduntaa, mutta tällä ei ole merkitystä fenyyliketonuriapotilailla, joilla on asianmukainen ruokavalion rajoitus.

Porfyria ja kilpirauhasen vajaatoiminta
Kuten muutkin sulfonamideja sisältävät lääkkeet, BACTRIM voi laukaista porfyriakriisin ja kilpirauhasen vajaatoiminnan. Vältä BACTRIM-valmisteen käyttöä potilailla, joilla on porfyria tai kilpirauhasen toimintahäiriö.
Mahdollinen riski Pneumocystis jirovecii -keuhkokuumeen hoidossa potilailla, joilla on hankittu immuunikatooireyhtymä (AIDS)
AIDS-potilaat eivät ehkä siedä tai reagoi BACTRIM-hoitoon samalla tavalla kuin muut kuin AIDS-potilaat. BACTRIM-hoidon haittavaikutusten, erityisesti ihottuman, kuumeen, leukopenian ja kohonneiden aminotransferaasiarvojen (transaminaasiarvojen) esiintyvyyden AIDS-potilailla, joita hoidetaan Pneumocystis jirovecii -keuhkokuumeeseen, on raportoitu olevan huomattavasti lisääntynyt verrattuna ilmaantumiseen, joka tavallisesti liittyy BACTRIM 800 mg:n käyttö ei-aids-potilailla. Jos potilaalle kehittyy ihottumaa tai jokin haittavaikutuksesta, arvioi BACTRIM-hoito uudelleen [ks. VAROITUKSET JA VAROTOIMET ].
Vältä BACTRIM 80 mg:n ja leukovoriinin samanaikaista antamista Pneumocystis jirovecii -keuhkokuumeen hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ].
Elektrolyyttihäiriöt
Suuri trimetopriimiannos, jota käytetään P. jirovecii -keuhkokuumepotilailla, aiheuttaa seerumin kaliumpitoisuuden progressiivisen mutta palautuvan nousun huomattavalla määrällä potilaita. Jopa hoito suositelluilla annoksilla voi aiheuttaa hyperkalemiaa, kun trimetopriimia annetaan potilaille, joilla on kaliumaineenvaihdunnan häiriö, munuaisten vajaatoiminta tai jos lääkkeitä, joiden tiedetään aiheuttavan hyperkalemiaa, annetaan samanaikaisesti. Näillä potilailla seerumin kaliumpitoisuuden tarkka seuranta on perusteltua.
Vaikeaa ja oireenmukaista hyponatremiaa voi esiintyä potilailla, jotka saavat BACTRIM 800 mg, erityisesti P. jirovecii -keuhkokuumeen hoidossa. Hyponatremian arviointi ja asianmukainen korjaus on tarpeen oireellisilla potilailla hengenvaarallisten komplikaatioiden estämiseksi.
Hoidon aikana on varmistettava riittävä nesteen saanti ja virtsan eritys kristallurian estämiseksi. Potilaat, jotka ovat "hitaita asetyloijia", voivat olla alttiimpia omituisille sulfonamideille.
Laboratoriokokeiden seuranta
BACTRIM-hoitoa saavien potilaiden täydelliset verenkuvat tulee tehdä usein. Lopeta BACTRIM 800 mg:n käyttö, jos jonkin muodostuneen verielementin määrä laskee merkittävästi. Suorita virtsaanalyysit huolellisesti mikroskooppisella tutkimuksella ja munuaisten toimintakokeilla hoidon aikana, erityisesti niille potilaille, joiden munuaisten toiminta on heikentynyt.
Lääkeresistenttien bakteerien kehittäminen
BACTRIM:n määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Sulfametoksatsoli ei ollut karsinogeeninen, kun se arvioitiin 26 viikkoa kestäneessä kasvaimia aiheuttavassa hiiritutkimuksessa (Tg-rasH2) sulfametoksatsolin annoksilla 400 mg/kg/vrk asti; 2-kertainen ihmisen systeemiseen altistukseen verrattuna (vuorokausiannoksella 800 mg sulfametoksatsolia kahdesti kahdesti päivässä).
Mutageneesi
Standardin mukaisia käänteismutaatiobakteeritestejä in vitro ei ole tehty sulfametoksatsolin ja trimetopriimin yhdistelmällä. Ihmisen lymfosyyteillä tehty in vitro kromosomipoikkeamatesti sulfametoksatsolilla/trimetopriimillä oli negatiivinen. Eläinlajeissa tehdyissä in vitro- ja in vivo -kokeissa sulfametoksatsoli/trimetopriimi ei vaurioittanut kromosomeja. Mikrotumatestit in vivo olivat positiivisia sulfametoksatsolin/trimetopriimin oraalisen annon jälkeen. Sulfametoksatsolilla ja trimetopriimilla hoidetuilta potilailta saadut leukosyyttien havainnot eivät paljastaneet kromosomipoikkeavuuksia.
Sulfametoksatsoli yksin oli positiivinen in vitro käänteismutaatiobakteerimäärityksessä ja in vitro mikrotumamäärityksissä, joissa käytettiin viljeltyjä ihmisen lymfosyyttejä.
Trimetopriimi yksinään oli negatiivinen in vitro käänteismutaatiobakteerimäärityksissä ja in vitro kromosomipoikkeavuusmäärityksissä kiinanhamsterin munasarja- tai keuhkosoluilla S9-aktivaation kanssa tai ilman sitä. In vitro komeetta-, mikrotuma- ja kromosomivauriomäärityksissä, joissa käytettiin viljeltyjä ihmisen lymfosyyttejä, trimetopriimi oli positiivinen. Hiirillä trimetopriimin oraalisen antamisen jälkeen ei havaittu DNA-vaurioita maksan, munuaisten, keuhkojen, pernan tai luuytimen Comet-määrityksissä.
Hedelmällisyyden heikkeneminen
Mitään haitallisia vaikutuksia hedelmällisyyteen tai yleiseen lisääntymiskykyyn ei havaittu rotilla, joille annettiin suun kautta jopa 350 mg/kg/vrk sulfametoksatsolia plus 70 mg/kg/vrk trimetopriimia, annoksia, jotka olivat suunnilleen kaksi kertaa ihmisen suositeltu päiväannos kehon pinta-alasta laskettuna. .
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
BACTRIM voi vahingoittaa sikiötä, jos sitä annetaan raskaana olevalle naiselle. Jotkin epidemiologiset tutkimukset viittaavat siihen, että altistuminen BACTRIM 400 mg:lle raskauden aikana saattaa liittyä lisääntyneeseen synnynnäisten epämuodostumien, erityisesti hermoputkivaurioiden, sydän- ja verisuonihäiriöiden, virtsatievaurioiden, suun halkeamien ja nuijajalan riskiin (ks. Ihmistiedot ).
Yksi kolmesta rotalla tehdystä tutkimuksesta osoitti suulakihalkeamaa annoksilla, jotka olivat noin 5 kertaa suositeltuja ihmisannoksia kehon pinta-alan perusteella laskettuna; kaksi muuta tutkimusta eivät osoittaneet teratogeenisuutta vastaavilla annoksilla. Raskaana olevilla kaniineilla tehdyt tutkimukset osoittivat lisääntynyttä sikiön menetystä noin 6 kertaa ihmisen annokseen verrattuna kehon pinta-alan perusteella (ks. Eläinten tiedot ).
Vakavien synnynnäisten epämuodostumien ja keskenmenojen arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia. Kerro raskaana oleville naisille BACTRIM 400 mg:n mahdollisista haitoista sikiölle (ks Kliiniset näkökohdat ).
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Virtsatieinfektio raskauden aikana liittyy haitallisiin perinataalisiin tuloksiin, kuten ennenaikaiseen synnytykseen, alhaiseen syntymäpainoon ja preeklampsiaan sekä raskaana olevan naisen lisääntyneeseen kuolleisuuteen. P. jirovecii -keuhkokuume raskauden aikana liittyy ennenaikaiseen synnytykseen ja raskaana olevan naisen lisääntyneeseen sairastumiseen ja kuolleisuuteen. BACTRIM-valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Data
Ihmistiedot
Vaikka suuria, prospektiivisia, hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla ja heidän vauvoillaan ei ole, jotkin retrospektiiviset epidemiologiset tutkimukset viittaavat siihen, että ensimmäisen raskauskolmanneksen BACTRIM 80 mg:lle altistumisen ja synnynnäisten epämuodostumien, erityisesti hermoputkivaurioiden, sydän- ja verisuonihäiriöiden, virtsateiden riskin välillä on yhteys. vaurioita, suuhalkeamia ja nukkajalkaa. Näitä tutkimuksia rajoitti kuitenkin paljastuneiden tapausten pieni määrä ja lukuisten tilastollisten vertailujen ja sekaannusten mukauttamisen puute. Näitä tutkimuksia rajoittavat edelleen muistaminen, valinta ja tietoharha sekä niiden löydösten rajoitettu yleistettävyys. Lopuksi tulosmittaukset vaihtelivat tutkimusten välillä, mikä rajoitti tutkimusten välisiä vertailuja. Vaihtoehtoisesti muissa epidemiologisissa tutkimuksissa ei havaittu tilastollisesti merkitsevää yhteyttä BACTRIM 160 mg -altistuksen ja tiettyjen epämuodostumien välillä. Brumfitt ja Pursell,10 retrospektiivisessä tutkimuksessa, raportoivat tuloksesta 186 raskaudesta, joiden aikana äiti sai joko lumelääkettä tai suun kautta trimetopriimiä ja sulfametoksatsolia. Synnynnäisten epämuodostumien ilmaantuvuus oli 4,5 % (3/66) lumelääkettä saaneilla ja 3,3 % (4/120) trimetopriimia ja sulfametoksatsolia saaneilla. Ei havaittu poikkeavuuksia 10 lapsella, joiden äidit saivat lääkettä ensimmäisen raskauskolmanneksen aikana. Erillisessä tutkimuksessa Brumfitt ja Pursell eivät myöskään löytäneet synnynnäisiä poikkeavuuksia 35 lapsella, joiden äidit olivat saaneet suun kautta trimetopriimia ja sulfametoksatsolia hedelmöittymishetkellä tai pian sen jälkeen.
Eläinten tiedot
Rotilla joko 533 mg/kg sulfametoksatsolia tai 200 mg/kg trimetopriimia suun kautta annetut annokset aiheuttivat teratologisia vaikutuksia, jotka ilmenivät pääasiassa suulakihalkeiluna. Nämä annokset ovat noin 5 ja 6 kertaa suositeltuja ihmisen päivittäisiä kokonaisannoksia kehon pinta-alalla laskettuna. Kahdessa rotilla tehdyssä tutkimuksessa teratologiaa ei havaittu, kun 512 mg/kg sulfametoksatsolia käytettiin yhdessä 128 mg/kg trimetopriimin kanssa. Joissakin kanitutkimuksissa sikiön katoamisen (kuolleiden ja imeytyneiden hedelmöitysten) yleinen lisääntyminen liittyi trimetopriimiannoksiin, jotka olivat kuusi kertaa ihmisen terapeuttinen annos kehon pinta-alan perusteella.
Imetys
Riskien yhteenveto
BACTRIM-pitoisuudet äidinmaidossa ovat noin 2–5 % suositellusta vuorokausiannoksesta yli kahden kuukauden ikäisille lapsipotilaille. BACTRIM-valmisteen vaikutuksesta imetettävään lapseen tai maidontuotantoon ei ole tietoa. Bilirubiinin siirtymän ja kernicteruksen mahdollisen riskin vuoksi imetettävällä lapsella [katso VASTA-AIHEET ], neuvoo naisia välttämään imetystä BACTRIM-hoidon aikana.
Käyttö lapsille
BACTRIM on vasta-aiheinen alle kahden kuukauden ikäisille lapsipotilaille bilirubiinin siirtymisen ja kernicteruksen mahdollisen riskin vuoksi [ks. VASTA-AIHEET ].
Vakavia haittavaikutuksia, mukaan lukien kuolemaan johtaneet reaktiot ja "hengästymisoireyhtymä", esiintyi keskosilla ja pienipainoisilla vastasyntyneiden tehohoitoyksiköllä, jotka saivat bentsyylialkoholia säilöntäaineena infuusioliuoksissa. Näissä tapauksissa bentsyylialkoholin annokset 99-234 mg/kg/vrk tuottivat korkeita pitoisuuksia bentsyylialkoholia ja sen metaboliitteja veressä ja virtsassa (bentsyylialkoholin pitoisuus veressä oli 0,61-1,378 mmol/l). Muita haittavaikutuksia olivat asteittainen neurologinen heikkeneminen, kohtaukset, kallonsisäinen verenvuoto, hematologiset poikkeavuudet, ihon hajoaminen, maksan ja munuaisten vajaatoiminta, hypotensio, bradykardia ja kardiovaskulaarinen kollapsi. Keskosilla, pienipainoisilla vauvoilla saattaa olla todennäköisempää kehittää näitä reaktioita, koska he eivät ehkä pysty metaboloimaan bentsyylialkoholia.
Kun määrätät BACTRIM 800 mg:aa lapsipotilaille, ota huomioon bentsyylialkoholin yhdistetty päivittäinen metabolinen kuormitus kaikista lähteistä, mukaan lukien BACTRIM (BACTRIM 160 mg sisältää 10 mg bentsyylialkoholia/ml) ja muut bentsyylialkoholia sisältävät lääkkeet. Bentsyylialkoholin vähimmäismäärää, jolla voi esiintyä vakavia haittavaikutuksia, ei tunneta [katso VAROITUKSET JA VAROTOIMET ].
Geriatrinen käyttö
BACTRIMin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat.
Vakavien haittavaikutusten riski voi olla suurentunut iäkkäillä potilailla, varsinkin jos on komplisoituvia tiloja, esim. munuaisten ja/tai maksan vajaatoiminta tai muiden lääkkeiden samanaikainen käyttö. Vaikeat ihoreaktiot, yleinen luuytimen suppressio [ks VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ], verihiutaleiden spesifinen väheneminen (purppuran kanssa tai ilman) ja hyperkalemia ovat yleisimmin raportoituja vakavia haittavaikutuksia iäkkäillä potilailla.
Niillä, jotka saavat samanaikaisesti tiettyjä diureetteja, pääasiassa tiatsideja, on raportoitu lisääntynyttä trombosytopenian ja purppuran ilmaantuvuutta. BACTRIM 80 mg -hoidon samanaikainen käyttö voi nostaa veren digoksiinipitoisuutta erityisesti iäkkäillä potilailla. Seerumin digoksiinitasoja tulee seurata [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Iäkkäillä potilailla voi esiintyä foolihapon puutteeseen viittaavia hematologisia muutoksia. Nämä vaikutukset ovat palautuvia foliinihappohoidolla. Annostusta on mukautettava asianmukaisesti potilaille, joilla on munuaisten vajaatoiminta, ja käytön keston tulee olla mahdollisimman lyhyt ei-toivottujen reaktioiden riskin minimoimiseksi [ks. ANNOSTELU JA HALLINNOINTI ].
BACTRIM-valmisteen trimetopriimikomponentti voi aiheuttaa hyperkalemiaa, kun sitä annetaan potilaille, joilla on kaliumaineenvaihdunnan häiriö, munuaisten vajaatoiminta tai kun sitä annetaan samanaikaisesti sellaisten lääkkeiden kanssa, joiden tiedetään aiheuttavan hyperkalemiaa, kuten angiotensiinikonvertaasin estäjät. Näillä potilailla seerumin kaliumpitoisuuden tarkka seuranta on perusteltua. BACTRIM 160 mg -hoidon lopettamista suositellaan seerumin kaliumpitoisuuden alentamiseksi.
Sulfametoksatsolin farmakokineettiset parametrit olivat samankaltaisia vanhuksilla ja nuoremmilla aikuisilla. Seerumin trimetopriimin keskimääräinen maksimipitoisuus oli korkeampi ja trimetopriimin keskimääräinen munuaispuhdistuma oli pienempi iäkkäillä henkilöillä verrattuna nuorempiin koehenkilöihin [ks. KLIININEN FARMAKOLOGIA ].
VIITTEET
4. Safrin S, Lee BL, Sande MA. Foolihapon lisähoito trimetopriimi-sulfametoksatsolin kanssa Pneumocystis carinii -keuhkokuumeessa AIDS-potilailla liittyy lisääntyneeseen hoidon epäonnistumisen ja kuoleman riskiin. J Infect Dis. lokakuu 1994; 170(4):912-7.
10. Brumfitt W, Pursell R. Trimetoprimi/sulfametoksatsoli naisten bakteerurian hoidossa. J Infect Dis. marraskuu 1973; 128 (Suppl): S657-S663.
YLIANNOSTUS
Akuutti
Koska ihmisillä ei ole laajaa kokemusta BACTRIM 160 mg:n kerta-annoksista, jotka ylittävät 25 ml (400 mg trimetopriimiä ja 2 000 mg sulfametoksatsolia), suurinta siedettyä annosta ihmisillä ei tunneta.
Sulfonamidien yliannostuksen merkkejä ja oireita ovat anoreksia, koliikki, pahoinvointi, oksentelu, huimaus, päänsärky, uneliaisuus ja tajuttomuus. Pyreksiaa, hematuriaa ja kristalluriaa voidaan havaita. Veren dyskrasiat ja keltaisuus ovat mahdollisia yliannostuksen myöhäisiä ilmentymiä.
Trimetopriimin akuutin yliannostuksen merkkejä ovat pahoinvointi, oksentelu, huimaus, päänsärky, henkinen masennus, sekavuus ja luuytimen lama.
Hoidon yleisiä periaatteita ovat suonensisäisten nesteiden antaminen, jos virtsaneritystä on vähän ja munuaisten toiminta on normaali. Virtsan happamoittaminen lisää trimetopriimin eliminaatiota munuaisten kautta. Potilasta tulee seurata veriarvoilla ja asianmukaisilla veren kemiallisilla mittauksilla, mukaan lukien elektrolyytit. Jos ilmenee merkittävää veren dyskrasiaa tai keltaisuutta, näihin komplikaatioihin on aloitettava spesifinen hoito. Peritoneaalidialyysi ei ole tehokas ja hemodialyysi on vain kohtalaisen tehokas trimetopriimin ja sulfametoksatsolin eliminoinnissa.
Krooninen
BACTRIM 800 mg:n käyttö suurina annoksina ja/tai pitkiä aikoja voi aiheuttaa luuytimen lamaa, joka ilmenee trombosytopeniana, leukopeniana ja/tai megaloblastisena anemiana. Jos merkkejä luuydinlamauksesta ilmenee, potilaalle tulee antaa leukovoriinia 5–15 mg päivässä, kunnes normaali hematopoieesi palautuu.
VASTA-AIHEET
BACTRIM on vasta-aiheinen seuraavissa tapauksissa:
- Tunnettu yliherkkyys trimetopriimille tai sulfonamideille [ks VAROITUKSET JA VAROTOIMET ]
- Aiempi lääkkeiden aiheuttama immuunitrombosytopenia trimetopriimin ja/tai sulfonamidien käytön yhteydessä [ks. VAROITUKSET JA VAROTOIMET ]
- Potilaat, joilla on dokumentoitu megaloblastinen anemia folaatin puutteesta johtuvan [katso VAROITUKSET JA VAROTOIMET ]
- Alle kahden kuukauden ikäiset lapsipotilaat [katso Käyttö tietyissä populaatioissa ]
- Merkittävä maksavaurio [katso VAROITUKSET JA VAROTOIMET ]
- Vaikea munuaisten vajaatoiminta, kun munuaisten toiminnan tilaa ei voida seurata [katso VAROITUKSET JA VAROTOIMET ]
- Samanaikainen anto dofetilidi2,3:n kanssa [katso HUUMEIDEN VUOROVAIKUTUKSET ]
VIITTEET
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Mitä kliinikon tulisi tietää QT-välistä. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Katsaus: Dofetilidin farmakologia ja toksikologia. Int J Med Toxicol. 2001; 4(2):16.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
BACTRIM on antimikrobinen lääke [katso Mikrobiologia ].
Farmakokinetiikka
Kun 11 potilaalle, joiden paino vaihteli välillä 105-165 lbs (keskiarvo, 143 lbs), annettiin 160 mg trimetopriimia ja 800 mg sulfametoksatsolia kerta-annoksena 1 tunnin suonensisäinen infuusio, trimetopriimin ja sulfaamioksatsolin huippupitoisuudet plasmassa olivat ±3. μg/ml ja 46,3 ± 2,7 μg/ml, vastaavasti. Saman annoksen toistuvan laskimonsisäisen annon jälkeen 8 tunnin välein keskimääräiset plasmapitoisuudet juuri ennen kutakin infuusiota ja välittömästi sen jälkeen vakaassa tilassa olivat 5,6 ± 0,6 μg/ml ja 8,8 ± 0,9 μg/ml trimetopriimilla ja 70,6 ± 7,3 μg. /ml ja 105,6 ± 10,9 μg/ml sulfametoksatsolille. Keskimääräinen puoliintumisaika plasmassa oli 11,3 ± 0,7 tuntia trimetopriimilla ja 12,8 ± 1,8 tuntia sulfametoksatsolilla. Kaikilla näillä 11 potilaalla oli normaali munuaisten toiminta, ja heidän ikänsä vaihteli 17-78 vuoden välillä (mediaani, 60 vuotta).11
Lapsilla ja aikuisilla tehdyt farmakokineettiset tutkimukset viittaavat iästä riippuvaiseen trimetopriimin puoliintumisaikaan, kuten taulukossa 5.12 on esitetty.
Potilailla, joilla on vaikea munuaisten vajaatoiminta, molempien komponenttien puoliintumisajat pidentyvät, mikä vaatii annostusohjelman muuttamista [ks. ANNOSTELU JA HALLINNOINTI ].
Jakelu
Sekä trimetopriimi että sulfametoksatsoli esiintyvät veressä sitoutumattomina, proteiineihin sitoutuneina ja metaboloituneina muodoina; sulfametoksatsoli esiintyy myös konjugoituneena muodossa.
Noin 44 % trimetopriimista ja 70 % sulfametoksatsolista sitoutuu plasman proteiineihin. 10 mg prosentin sulfametoksatsolipitoisuus plasmassa vähentää trimetopriimin sitoutumista proteiineihin merkityksettömästi; trimetopriimi ei vaikuta sulfametoksatsolin sitoutumiseen proteiineihin.
Sekä trimetopriimi että sulfametoksatsoli jakautuvat yskökseen ja emätinnesteeseen; trimetopriimi jakautuu myös keuhkoputkien eritteisiin, ja molemmat läpäisevät istukan ja erittyvät äidinmaitoon.
Eliminointi
Aineenvaihdunta
Sulfametoksatsoli metaboloituu ihmisessä vähintään viideksi metaboliitiksi: N4-asetyyli-, N4-hydroksi-, 5-metyylihydroksi-, N4-asetyyli-5-metyylihydroksisulfametoksatsoli-metaboliitiksi ja N-glukuronidikonjugaatiksi. N4-hydroksimetaboliitin muodostuminen välittyy CYP2C9:n välityksellä.
Trimetopriimi metaboloituu in vitro 11 erilaiseksi metaboliitiksi, joista viisi on glutationiaddukteja ja kuusi oksidatiivisia metaboliitteja, mukaan lukien tärkeimmät metaboliitit, 1- ja 3-oksidit sekä 3- ja 4-hydroksijohdannaiset.
Trimetopriimin ja sulfametoksatsolin vapaita muotoja pidetään terapeuttisesti aktiivisina muotoina. In vitro -tutkimukset viittaavat siihen, että trimetopriimi on P-glykoproteiinin, OCT1:n ja OCT2:n substraatti ja että sulfametoksatsoli ei ole P-glykoproteiinin substraatti.
Erittyminen
Trimetopriimi ja sulfametoksatsoli erittyvät pääasiassa munuaisten kautta sekä glomerulussuodatuksen että tubuluserityksen kautta. Sekä trimetopriimin että sulfametoksatsolin pitoisuudet virtsassa ovat huomattavasti korkeammat kuin pitoisuudet veressä. Virtsaan erittyneen annoksen prosenttiosuus 12 tunnin aikana ensimmäisen 240 mg trimetopriimiannoksen ja 1 200 mg sulfametoksatsolin suonensisäisen annon jälkeen päivänä 1 vaihteli 17 % - 42,4 % vapaana trimetopriimina; 7 - 12,7 % vapaana sulfametoksatsolina; ja 36,7–56 % kokonaissulfametoksatsolia (vapaa plus N4-asetyloitu metaboliitti). Kun trimetopriimi ja sulfametoksatsoli annetaan yhdessä BACTRIM 400 mg:na, ne eivät vaikuta toisen virtsaan erittymiseen.
Tietyt populaatiot
Geriatriset potilaat
Sulfametoksatsolin 800 mg ja trimetopriimin 160 mg farmakokinetiikkaa tutkittiin kuudessa vanhemmassa koehenkilössä (keski-ikä: 78,6 vuotta) ja kuudessa nuoressa terveessä koehenkilössä (keski-ikä: 29,3 vuotta) käyttäen muuta kuin USA:n hyväksymää formulaatiota. Sulfametoksatsolin farmakokineettiset arvot vanhemmilla koehenkilöillä olivat samanlaiset kuin nuorilla aikuisilla. Trimetopriimin keskimääräinen munuaispuhdistuma oli merkittävästi pienempi iäkkäillä koehenkilöillä verrattuna nuoriin aikuisiin (19 ml/h/kg vs. 55 ml/h/kg). Painon mukaan normalisoinnin jälkeen trimetopriimin näennäinen kokonaispuhdistuma oli kuitenkin keskimäärin 19 % pienempi geriatrisilla koehenkilöillä verrattuna nuoriin aikuisiin.
Mikrobiologia
Toimintamekanismi
Sulfametoksatsoli estää dihydrofoolihapon bakteerisynteesiä kilpailemalla para-aminobentsoehapon (PABA) kanssa. Trimetopriimi estää tetrahydrofoolihapon tuotantoa dihydrofoolihaposta sitoutumalla tarvittavaan entsyymiin, dihydrofolaattireduktaasiin, ja estämällä sitä palautuvasti. Siten sulfametoksatsoli ja trimetopriimi estävät kaksi peräkkäistä vaihetta monille bakteereille välttämättömien nukleiinihappojen ja proteiinien biosynteesissä.
Resistanssi
In vitro -tutkimukset ovat osoittaneet, että bakteerien vastustuskyky kehittyy hitaammin käytettäessä sekä sulfametoksatsolia että trimetopriimia yhdessä kuin sulfametoksatsolia tai trimetopriimia yksinään käytettäessä.
Antimikrobinen aktiivisuus
BACTRIM on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Aerobiset gramnegatiiviset bakteerit
Escherichia coliKlebsiella-lajit Enterobacter-lajitMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Muut mikro-organismit
Pneumocystis jirovecii
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 prosentilla seuraavista bakteereista on in vitro -minimi estävä pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin BACTRIM 160 mg:n herkkä raja-arvo saman suvun tai organismiryhmän isolaatteja vastaan. BACTRIM 400 mg:n tehoa näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Aerobiset grampositiiviset bakteerit
Streptococcus pneumoniae
Aerobiset gramnegatiiviset bakteerit
Haemophilus influenzae
Herkkyystestaus
Tarkempia tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä ja laadunvalvontastandardeista, jotka FDA on tunnustanut tälle lääkkeelle, on osoitteessa https://www.fda.gov/STIC.
VIITTEET
11. Grose WE, Bodey GP, Loo TL. Laskimonsisäisesti annettavan trimetopriimi-sulfametoksatsolin kliininen farmakologia. Antimikrobiset aineet Chemother. maaliskuu 1979; 15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Laskimonsisäisen trimetopriimi-sulfametoksatsolin farmakologia lapsille ja aikuisille. Nykyinen kemoterapia ja infektiotaudit. American Society for Microbiology, Washington, DC 1980; Voi. 1, s. 691-692.
POTILASTIEDOT
Alkion sikiön toksisuus
Kerro lisääntymispotentiaalisille naispotilaille siitä, että BACTRIM voi aiheuttaa sikiövaurioita, ja ilmoittaa terveydenhuollon tarjoajalle tunnetusta tai epäillystä raskaudesta [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo imettäviä naisia välttämään imetystä BACTRIM-hoidon aikana.
Antibakteerinen vastustuskyky
Neuvo potilaita, että antibakteerisia lääkkeitä, mukaan lukien BACTRIM, tulisi käyttää vain bakteeri-infektioiden hoitoon. Se ei hoida virusinfektioita (esim. flunssaa).
Neuvo potilaita ylläpitämään riittävää nesteen saantia, jotta estetään kristalluria ja kivien muodostuminen.
Ripuli
Kerro potilaille, että ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibiootin käyttö lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
