Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zocor on ja miten sitä käytetään?
Zocor (simvastatiini) on reseptilääke, jota käytetään alentamaan "pahan" kolesterolin (pienitiheyksinen lipoproteiini tai LDL) tasoa ja lisäämään "hyvän" kolesterolin (suuritiheyksinen lipoproteiini tai HDL) tasoa ja alentamaan triglyseriiniä sekä vähentää aivohalvauksen ja sydänkohtauksen riskiä. Zocoria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Zocor kuuluu lääkeluokkaan, jota kutsutaan lipidejä alentaviksi aineiksi, statiineiksi, HMG-CoA-reduktaasin estäjiksi.
Ei tiedetä, onko Zocor turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitkä ovat Zocorin mahdolliset sivuvaikutukset?
Zocor 20mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- ruokahalun menetys,
- vatsakipu oikealla yläpuolella,
- väsymys,
- kutina,
- tumma virtsa,
- savenvärinen jakkara ja
- ihon tai silmien keltaisuus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zocorin yleisimpiä sivuvaikutuksia ovat:
- päänsärky,
- pahoinvointi,
- vatsakipu,
- ummetus ja
- vilustumisoireet (nenän tukkoisuus, aivastelu tai kurkkukipu)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Zocorin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
ZOCOR (simvastatiini) on lipidejä alentava aine, joka on johdettu synteettisesti Aspergillus terreuksen fermentaatiotuotteesta. Suun kautta ottamisen jälkeen simvastatiini, joka on inaktiivinen laktoni, hydrolysoituu vastaavaksi β-hydroksihappomuodoksi. Tämä on 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n (HMG-CoA) reduktaasin estäjä. Tämä entsyymi katalysoi HMG-CoA:n muuttumista mevalonaatiksi, mikä on varhainen ja nopeutta rajoittava vaihe kolesterolin biosynteesissä.
Simvastatiini on butaanihappo, 2,2-dimetyyli-,1,2,3,7,8,8a-heksahydro-3,7-dimetyyli-8-[2-(tetrahydro-4hydroksi-6-okso-2H-pyraani- 2-yyli)etyyli]-1-naftalenyyliesteri, [1S-[1a,3a,7p,8p(2S*,4S*),-8aβ]]. Simvastatiinin empiirinen kaava on C25H38O5 ja sen molekyylipaino on 418,57. Sen rakennekaava on:
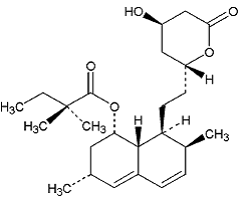
Simvastatiini on valkoinen tai luonnonvalkoinen, ei-hygroskooppinen, kiteinen jauhe, joka on käytännössä liukenematon veteen ja liukenee vapaasti kloroformiin, metanoliin ja etanoliin.
Suun kautta annettavat ZOCOR-tabletit sisältävät joko 5 mg, 10 mg, 20 mg, 40 mg tai 80 mg simvastatiinia ja seuraavia inaktiivisia aineosia: askorbiinihappo, sitruunahappo, hydroksipropyyliselluloosa, hypromelloosi, rautaoksidit, laktoosi, magnesiumstearaatti, mikrokiteinen selluloosa , tärkkelys, talkki ja titaanidioksidi. Butyloitua hydroksianisolia lisätään säilöntäaineena.
INDIKAATIOT
Hoidon lipidejä muuttavilla aineilla tulisi olla vain yksi osa useiden riskitekijöiden interventiota henkilöillä, joilla on merkittävästi lisääntynyt riski sairastua hyperkolesterolemian vuoksi ateroskleroottiseen verisuonisairauteen. Lääkehoitoa suositellaan ruokavalion lisänä, kun tyydyttyneitä rasvoja ja kolesterolia sisältävän ruokavalion ja muiden ei-farmakologisten toimenpiteiden vaste yksinään on ollut riittämätön. Potilaille, joilla on sepelvaltimotauti (CHD) tai suuri sepelvaltimotautiriski, ZOCOR® voidaan aloittaa samanaikaisesti ruokavalion kanssa.
Sepelvaltimotautikuolleisuuden ja sydän- ja verisuonitapahtumien riskin väheneminen
Potilaille, joilla on suuri sepelvaltimotapahtumien riski olemassa olevan sepelvaltimotaudin, diabeteksen, perifeerisen verisuonisairauden, aivohalvauksen tai muun aivoverenkierron sairauden vuoksi, ZOCOR 5 mg on tarkoitettu seuraaviin:
- Vähennä kokonaiskuolleisuuden riskiä vähentämällä sepelvaltimotautikuolemia.
- Vähennä ei-kuolemaan johtavan sydäninfarktin ja aivohalvauksen riskiä.
- Vähennä sepelvaltimoiden ja ei-sepelvaltimoiden revaskularisaatiotoimenpiteiden tarvetta.
Hyperlipidemia
ZOCOR on tarkoitettu seuraaville:
- Vähennä kohonnutta kokonaiskolesterolia (kokonaiskolesterolia), matalatiheyksisten lipoproteiinikolesterolia (LDL-C), apolipoproteiini B:tä (Apo B) ja triglyseridejä (TG) ja lisää korkeatiheyksisten lipoproteiinikolesterolin (HDL-C) määrää potilailla, joilla on primaarinen hyperlipidemia (Fredricksonin tyyppi IIa, heterotsygoottinen familiaalinen ja ei-perhe) tai sekoitettu dyslipidemia (Fredricksonin tyyppi IIb).
- Vähennä kohonnutta TG:tä potilailla, joilla on hypertriglyseridemia (Fredricksonin tyypin lV hyperlipidemia).
- Vähennä kohonnutta TG- ja VLDL-kolesteroliarvoja potilailla, joilla on primaarinen dysbetalipoproteinemia (Fredrickson-tyypin lll-hyperlipidemia).
- Vähennä kokonaiskolesterolia ja LDL-kolesterolia potilailla, joilla on homotsygoottinen familiaalinen hyperkolesterolemia (HoFH) muiden lipidejä alentavien hoitojen (esim. LDL-afereesin) lisänä tai jos tällaisia hoitoja ei ole saatavilla.
Nuoret potilaat, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia (HeFH)
ZOCOR on tarkoitettu ruokavalion lisäaineeksi kokonaiskolesteroli-, LDL-kolesteroli- ja Apo B -tasojen alentamiseen nuorilla pojilla ja tytöillä, jotka ovat ylittäneet kuukautisten alkamisen vähintään vuoden iässä, 10–17-vuotiaat ja joilla on HeFH, jos Riittävän ruokavaliohoidon kokeen jälkeen on olemassa seuraavat löydökset:
- Suvussa on positiivinen ennenaikainen sydän- ja verisuonitauti (CVD) tai
- Nuorilla potilaalla on kaksi tai useampia muuta sydän- ja verisuonisairauksien riskitekijää.
Lapsi- ja nuorisopotilaiden hoidon vähimmäistavoite on saavuttaa keskimääräinen LDL-kolesteroli
Käyttörajoitukset
ZOCOR 20 mg:aa ei ole tutkittu olosuhteissa, joissa suurin poikkeavuus on kylomikronien nousu (eli Fredrickson-tyypin I ja V hyperlipidemia).
ANNOSTELU JA HALLINNOINTI
Suositeltu annostus
Tavallinen annosalue on 5-40 mg/vrk. Potilailla, joilla on sepelvaltimotauti tai suuri sepelvaltimotautiriski, ZOCOR voidaan aloittaa samanaikaisesti ruokavalion kanssa. Suositeltu tavallinen aloitusannos on 10 tai 20 mg kerran vuorokaudessa illalla. Suositeltu aloitusannos on 40 mg/vrk potilaille, joilla on suuri sepelvaltimotautitapahtuman riski olemassa olevan sepelvaltimotaudin, diabeteksen, ääreissuonitaudin, aivohalvauksen tai muun aivoverisuonisairauden vuoksi. Lipidimääritykset on tehtävä 4 viikon hoidon jälkeen ja ajoittain sen jälkeen.
Rajoitettu annostus 80 mg:lle
Myopatian, mukaan lukien rabdomyolyysin, lisääntyneen riskin vuoksi erityisesti ensimmäisen hoitovuoden aikana, ZOCORin 80 mg:n annoksen käyttö on rajoitettava potilaisiin, jotka ovat käyttäneet simvastatiinia 80 mg kroonisesti (esim. 12 kuukauden ajan tai kauemmin). ilman todisteita lihastoksisuudesta [katso VAROITUKSET JA VAROTOIMET ].
Potilaat, jotka sietävät tällä hetkellä 80 mg:n ZOCOR-annosta ja jotka on aloitettava yhteisvaikutteisella lääkkeellä, joka on vasta-aiheinen tai johon liittyy simvastatiinin annoskatto, tulee vaihtaa vaihtoehtoiseen statiiniin, jolla on vähemmän potentiaalia lääkeaineiden yhteisvaikutuksille.
Koska ZOCOR 40 mg:n 80 mg:n annokseen liittyy lisääntynyt myopatian, mukaan lukien rabdomyolyysin, riski, potilaita, jotka eivät pysty saavuttamaan LDL-kolesterolitavoitetta käyttämällä 40 mg:n ZOCOR 5 mg:n annosta, ei tule titrata 80 mg:n annokseen. , mutta se tulee asettaa vaihtoehtoiselle LDL-kolesterolia alentavalle hoidolle, joka alentaa LDL-kolesterolia enemmän.
Yhteiskäyttö muiden lääkkeiden kanssa
Potilaat, jotka käyttävät verapamiilia, diltiazemia tai dronedaronia
- ZOCOR-annos ei saa ylittää 10 mg / vrk [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
Potilaat, jotka käyttävät amiodaronia, amlodipiinia tai ranolatsiinia
- ZOCOR 10 mg:n annos ei saa ylittää 20 mg/vrk [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
Potilaat, joilla on homotsygoottinen familiaalinen hyperkolesterolemia
Suositeltu annos on 40 mg/vrk iltaisin [katso ANNOSTELU JA HALLINNOINTI , Rajoitettu annostus 80 mg:lle ]. ZOCOR 5 mg:aa tulee käyttää näille potilaille muiden lipidejä alentavien hoitojen (esim. LDL-afereesin) lisänä tai jos tällaisia hoitoja ei ole saatavilla.
Simvastatiinialtistus noin kaksinkertaistuu käytettäessä samanaikaisesti lomitapidia; siksi ZOCOR-annosta tulee pienentää 50 %, jos lomitapide aloitetaan. ZOCOR 5 mg:n annos ei saa ylittää 20 mg/vrk (tai 40 mg/vrk potilailla, jotka ovat aiemmin ottaneet ZOCORia 80 mg/vrk kroonisesti, esim. 12 kuukauden ajan tai kauemmin, ilman todisteita lihastoksisuudesta) lomitapidin käytön aikana.
Nuoret (10–17-vuotiaat), joilla on heterotsygoottinen familiaalinen hyperkolesterolemia
Suositeltu tavallinen aloitusannos on 10 mg kerran vuorokaudessa iltaisin. Suositeltu annostusalue on 10-40 mg/vrk; suurin suositeltu annos on 40 mg/vrk. Annokset tulee yksilöidä suositellun hoidon tavoitteen mukaan [katso NCEP Pediatric Panel Guidelines1 ja Kliiniset tutkimukset ]. Säätö tulee tehdä vähintään 4 viikon välein.
Potilaat, joilla on munuaisten vajaatoiminta
Koska ZOCOR 5 mg ei erity merkittävästi munuaisten kautta, annoksen muuttaminen ei ole tarpeen potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Varovaisuutta on kuitenkin noudatettava, kun ZOCOR 20 mg:aa annetaan potilaille, joilla on vaikea munuaisten vajaatoiminta. tällaisten potilaiden hoito tulee aloittaa annoksella 5 mg/vrk, ja heitä on seurattava tarkasti [ks VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- Tabletit ZOCOR 5 mg ovat vaaleanpunaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 726 ja toisella puolella ZOCOR 5.
- Tabletit ZOCOR 10 mg ovat persikanvärisiä, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 735 ja toinen puoli sileä.
- Tabletit ZOCOR 20 mg ovat kullanruskeita, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 740 ja toinen puoli sileä.
- Tabletit ZOCOR 40 mg ovat tiilenpunaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 749 ja toinen puoli sileä.
- Tabletit ZOCOR 80 mg ovat tiilenpunaisia, kapselin muotoisia, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 543 ja toisella puolella 80.
Varastointi ja käsittely
Nro 8146 - Tabletit ZOCOR 10 mg ovat persikanvärisiä, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 735 ja toinen puoli sileä. Ne toimitetaan seuraavasti:
NDC 0006-0735-31 käyttöyksikköä 30 kpl pulloja NDC 0006-0735-54 käyttöyksikköä 90 kpl pulloja.
Nro 8147 - Tabletit ZOCOR 20 mg ovat kellanruskeita, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 740 ja toiselta puolelta sileä. Ne toimitetaan seuraavasti:
NDC 0006-0740-31 käyttöyksikköä 30 kpl pulloja NDC 0006-0740-54 käyttöyksikköä 90 kpl pulloja.
Nro 8148 - Tabletit ZOCOR 40 mg ovat tiilenpunaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 749 ja toinen puoli sileä. Ne toimitetaan seuraavasti:
NDC 0006-0749-31 käyttöyksikköä 30 kpl pulloja NDC 0006-0749-54 käyttöyksikköä 90 kpl pulloja.
Nro 6577 - Tabletit ZOCOR 80 mg ovat tiilenpunaisia, kapselin muotoisia kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 543 ja toisella puolella 80. Ne toimitetaan seuraavasti:
NDC 0006-0543-31 käyttöyksikköä 30 kpl pulloja NDC 0006-0543-54 käyttöyksikköä 90 kpl pulloja.
Varastointi
Säilytä 5-30°C (41-86°F).
1Kansallinen kolesterolikasvatusohjelma (NCEP): Lasten ja nuorten veren kolesterolitasoja käsittelevän asiantuntijapaneelin raportin kohokohdat. Pediatria. 89(3):495-501. 1992.
Valmistaja: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, UK NE23 3JU. Tarkistettu: syyskuussa 2020
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Markkinoille tuloa edeltävissä kontrolloiduissa kliinisissä tutkimuksissa ja niiden avoimissa jatkotutkimuksissa (2 423 potilasta seurannan mediaanikestolla noin 18 kuukautta) 1,4 % potilaista keskeytettiin haittavaikutusten vuoksi. Yleisimmät hoidon lopettamiseen johtaneet haittavaikutukset olivat ruoansulatuskanavan häiriöt (0,5 %), lihaskipu (0,1 %) ja nivelsärky (0,1 %). Simvastatiinikontrolloiduissa kliinisissä tutkimuksissa yleisimmin raportoidut haittavaikutukset (esiintyvyys ≥ 5 %) olivat: ylempien hengitysteiden infektiot (9,0 %), päänsärky (7,4 %), vatsakipu (7,3 %), ummetus (6,6 %) ja pahoinvointi (5,4 %). %).
Skandinavian Simvastatin Survival Study
4S:ssä, johon osallistui 4 444 henkilöä (ikähaarukka 35-71 vuotta, 19 % naisia, 100 % valkoihoisia), joita hoidettiin 20-40 mg/vrk ZOCORilla (n = 2 221) tai lumelääke (n = 2 223) keskimäärin 5,4 vuoden ajan, haittavaikutuksia Taulukossa 2 on raportoitu ≥ 2 %:lla potilaista ja enemmän kuin lumelääkettä.
Sydänsuojatutkimus
Sydänsuojatutkimuksessa (HPS), johon osallistui 20 536 potilasta (ikähaarukka 40-80 vuotta, 25 % naisia, 97 % valkoihoisia, 3 % muita rotuja), joita hoidettiin ZOCORilla 40 mg/vrk (n = 10 269) tai lumelääkevalmisteella (n = 10 267) keskimäärin viiden vuoden aikana kirjattiin vain vakavia haittavaikutuksia ja mahdollisista haittavaikutuksista johtuvia keskeytyksiä. Haittavaikutuksista johtuvia keskeyttämisprosentti oli 4,8 % ZOCOR 10 mg:lla hoidetuista potilaista, kun taas lumelääkettä saaneiden potilaiden osuus oli 5,1 %. Myopatian/rabdomyolyysin ilmaantuvuus oli
Muut kliiniset tutkimukset
Kliinisessä tutkimuksessa, jossa 12 064 potilasta, joilla on ollut sydäninfarkti, hoidettiin ZOCORilla (keskimääräinen seuranta-aika 6,7 vuotta), myopatian ilmaantuvuus (määritelty selittämättömäksi lihasheikkoudeksi tai -kivuksi seerumin kreatiinikinaasin [CK] ollessa yli 10 kertaa normaalin yläraja [ULN]) potilailla, jotka saivat 80 mg/vrk, oli noin 0,9 % verrattuna 0,02 %:iin potilailla, jotka saivat 20 mg/vrk. Rabdomyolyysin (määritelty myopatiaksi, jonka CK > 40 kertaa ULN) ilmaantuvuus potilailla, jotka saivat 80 mg/vrk, oli noin 0,4 % verrattuna 0 %:iin potilailla, jotka saivat 20 mg/vrk. Myopatian, mukaan lukien rabdomyolyysin, ilmaantuvuus oli suurin ensimmäisen vuoden aikana ja väheni sen jälkeen huomattavasti seuraavien hoitovuosien aikana. Tässä tutkimuksessa potilaita seurattiin huolellisesti, ja jotkin yhteisvaikuttavat lääkevalmisteet suljettiin pois.
Muita kliinisissä tutkimuksissa raportoituja haittavaikutuksia olivat ripuli, ihottuma, dyspepsia, ilmavaivat ja voimattomuus.
Laboratoriotestit
Merkittäviä ja pysyviä maksan transaminaasiarvojen nousuja on havaittu [katso VAROITUKSET JA VAROTOIMET ]. Kohonneita alkalisen fosfataasin ja y-glutamyylitranspeptidaasin on myös raportoitu. Noin 5 %:lla potilaista CK-tasot kohosivat vähintään kolme kertaa normaaliarvoon verrattuna yhden tai useamman kerran. Tämä johtui CK:n ei-kardiaalisesta fraktiosta. [katso VAROITUKSET JA VAROTOIMET ]
Nuoret potilaat (10-17-vuotiaat)
48 viikkoa kestäneessä kontrolloidussa tutkimuksessa nuorilla pojilla ja tytöillä, joilla oli vähintään 1 vuosi kuukautisten jälkeen, 10–17-vuotiaat (43,4 % naisia, 97,7 % valkoihoisia, 1,7 % latinalaisamerikkalaisia, 0,6 % monirotuisia), joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia (n=175), joita hoidettiin lumelääkkeellä tai ZOCORilla (10-40 mg päivässä), molemmissa ryhmissä havaitut yleisimmät haittavaikutukset olivat ylähengitystieinfektio, päänsärky, vatsakipu ja pahoinvointi [ks. Käyttö tietyissä populaatioissa ja Kliiniset tutkimukset ].
Markkinoinnin jälkeinen kokemus
Koska alla olevat reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei yleensä ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Seuraavat lisähaittavaikutukset on tunnistettu simvastatiinin hyväksymisen jälkeisen käytön aikana: kutina, hiustenlähtö, erilaiset ihomuutokset (esim. kyhmyt, värimuutos, ihon/limakalvojen kuivuminen, muutokset hiuksissa/kynsissä), huimaus, lihaskrampit, myalgia , haimatulehdus, parestesia, perifeerinen neuropatia, oksentelu, anemia, erektiohäiriö, interstitiaalinen keuhkosairaus, rabdomyolyysi, hepatiitti/keltatauti, kuolemaan johtava ja ei-kuolema maksan vajaatoiminta ja masennus.
Immuunivälitteisestä nekrotisoivasta myopatiasta, joka liittyy statiinien käyttöön, on raportoitu harvoin [katso VAROITUKSET JA VAROTOIMET ].
Ilmeistä yliherkkyysoireyhtymää on raportoitu harvoin, johon on sisältynyt joitain seuraavista oireista: anafylaksia, angioedeema, lupus erythematous-kaltainen oireyhtymä, polymyalgia rheumatica, dermatomyosiitti, vaskuliitti, purppura, trombosytopenia, leukopenia, hemolyyttinen anemia, positiivinen ANA, ESR:n nousu, eosinofilia , niveltulehdus, nivelkipu, urtikaria, voimattomuus, valoherkkyys, kuume, vilunväristykset, punoitus, huonovointisuus, hengenahdistus, toksinen epidermaalinen nekrolyysi, erythema multiforme, mukaan lukien Stevens-Johnsonin oireyhtymä.
Markkinoille tulon jälkeen on raportoitu harvoin statiinien käyttöön liittyviä kognitiivisia toimintahäiriöitä (esim. muistin menetys, unohtaminen, muistinmenetys, muistin heikkeneminen, sekavuus). Näitä kognitiivisia ongelmia on raportoitu kaikkien statiinien kohdalla. Raportit ovat yleensä ei-vakavia ja palautuvat statiinihoidon lopettamisen jälkeen, ja oireiden alkamisajat vaihtelevat (yhdestä päivästä vuosiin) ja oireiden häviämiseen (mediaani 3 viikkoa).
HUUMEIDEN VUOROVAIKUTUKSET
Vahvat CYP3A4:n estäjät, syklosporiini tai danatsoli
Vahvat CYP3A4:n estäjät: Simvastatiini, kuten monet muut HMG-CoA-reduktaasin estäjät, on CYP3A4:n substraatti. Simvastatiini metaboloituu CYP3A4:n kautta, mutta sillä ei ole CYP3A4:ää estävää vaikutusta. siksi sen ei odoteta vaikuttavan muiden CYP3A4:n kautta metaboloituvien lääkkeiden pitoisuuksiin plasmassa.
Kohonneet plasman HMG-CoA-reduktaasia inhiboivat pitoisuudet lisäävät myopatian ja rabdomyolyysin riskiä, erityisesti käytettäessä suurempia simvastatiiniannoksia. [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ] Sellaisten lääkkeiden samanaikainen käyttö, joilla on vahva CYP3A4:ää estävä vaikutus, on vasta-aiheista [ks. VASTA-AIHEET ]. Jos itrakonatsoli-, ketokonatsoli-, posakonatsoli-, vorikonatsoli-, erytromysiin-, klaritromysiini- tai telitromysiiniä ei voida välttää, simvastatiinihoito on keskeytettävä hoidon ajaksi.
Siklosporiini tai danatsoli: Myopatian, mukaan lukien rabdomyolyysin, riski kasvaa, jos siklosporiinia tai danatsolia annetaan samanaikaisesti. Siksi näiden lääkkeiden samanaikainen käyttö on vasta-aiheista [katso VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Lipidejä alentavat lääkkeet, jotka voivat aiheuttaa myopatiaa, kun niitä annetaan yksinään
Gemfibrotsiili
Vasta-aiheinen simvastatiinin kanssa [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Muut fibraatit
Varovaisuutta tulee noudattaa määrättäessä simvastatiinia [ks VAROITUKSET JA VAROTOIMET ].
Amiodaroni, dronedaroni, ranolatsiini tai kalsiumkanavasalpaajat
Myopatian, mukaan lukien rabdomyolyysin, riski kasvaa, jos samanaikaisesti annetaan amiodaronia, dronedaronia, ranolatsiinia tai kalsiumkanavasalpaajia, kuten verapamiilia, diltiatseemia tai amlodipiinia [ks. ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ja Taulukko 3 KLIININEN FARMAKOLOGIA ].
Niasiini
Myopatia-/rabdomyolyysitapauksia on havaittu, kun simvastatiinia on annettu samanaikaisesti lipidejä modifioivilla annoksilla (≥1 g/vrk niasiinia) niasiinia sisältäviä valmisteita. Myopatian riski on suurempi kiinalaisilla potilailla. Kliinisessä tutkimuksessa (seurantamediaani 3,9 vuotta), johon osallistui potilaita, joilla oli suuri sydän- ja verisuonitautien riski ja joiden LDL-kolesterolitaso oli hyvin hallinnassa ja sai simvastatiinia 40 mg/vrk yhdessä etsetimibin 10 mg/vrk kanssa tai ilman etsetimibin annoksella 10 mg/vrk. sydän- ja verisuonitauteihin lisättynä lipidejä modifioivia annoksia (≥1 g/vrk) niasiinia. ZOCORin samanaikaista käyttöä lipidejä modifioivien niasiiniannosten (≥1 g/vrk) kanssa ei suositella kiinalaisille potilaille. Ei tiedetä, koskeeko tämä riski muita aasialaisia potilaita [ks VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Digoksiini
Yhdessä tutkimuksessa digoksiinin samanaikainen anto simvastatiinin kanssa johti lievään digoksiinipitoisuuden nousuun plasmassa. Digoksiinia käyttäviä potilaita tulee seurata asianmukaisesti, kun simvastatiinihoito aloitetaan [ks KLIININEN FARMAKOLOGIA ].
Kumariiniantikoagulantit
Kahdessa kliinisessä tutkimuksessa, joista toisessa tehtiin normaaleja vapaaehtoisia ja toisessa hyperkolesteroleemiapotilaita, simvastatiini 20-40 mg/vrk vahvisti hieman kumariiniantikoagulanttien vaikutusta: protrombiiniaika, joka on raportoitu kansainvälisenä normalisoituna suhteena (INR), nousi lähtötasosta 1,7 1,8:sta ja 2,6:sta 3,4:ään potilastutkimuksissa. Muiden statiinien käytön yhteydessä on raportoitu kliinisesti ilmeistä verenvuotoa ja/tai pidentynyttä protrombiiniaikaa muutamilla potilailla, jotka ovat käyttäneet samanaikaisesti kumariiniantikoagulantteja. Tällaisilla potilailla protrombiiniaika tulee määrittää ennen simvastatiinihoidon aloittamista ja riittävän usein hoidon alkuvaiheessa sen varmistamiseksi, ettei protrombiiniajassa tapahdu merkittäviä muutoksia. Kun vakaa protrombiiniaika on dokumentoitu, protrombiiniaikoja voidaan tarkkailla sellaisin väliajoin, joita yleensä suositellaan kumariiniantikoagulantteja käyttäville potilaille. Jos simvastatiiniannosta muutetaan tai se lopetetaan, sama toimenpide on toistettava. Simvastatiinihoitoon ei ole liittynyt verenvuotoa tai muutoksia protrombiiniajassa potilailla, jotka eivät käytä antikoagulantteja.
Kolkisiini
Myopatiatapauksia, mukaan lukien rabdomyolyysi, on raportoitu, kun simvastatiinia on annettu samanaikaisesti kolkisiinin kanssa, ja varovaisuutta on noudatettava määrättäessä simvastatiinia kolkisiinin kanssa.
Daptomysiini
Rabdomyolyysitapauksia on raportoitu, kun simvastatiinia on annettu daptomysiinin kanssa. Sekä simvastatiini että daptomysiini voivat aiheuttaa myopatiaa ja rabdomyolyysiä yksinään annettuina, ja myopatian ja rabdomyolyysin riski voi lisääntyä, jos niitä käytetään samanaikaisesti. Keskeytä tilapäisesti ZOCOR potilailla, jotka käyttävät daptomysiiniä [katso VAROITUKSET JA VAROTOIMET ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Myopatia/rabdomyolyysi
Simvastatiini aiheuttaa toisinaan myopatiaa, joka ilmenee lihaskivuna, -arkuudena tai -heikkoutena, jolloin kreatiinikinaasi (CK) ylittää kymmenen kertaa normaalin ylärajan (ULN). Myopatia ilmenee joskus rabdomyolyysina, johon liittyy myoglobinuriaan liittyvä akuutti munuaisten vajaatoiminta tai ei sitä, ja harvinaisia kuolemantapauksia on esiintynyt. Myopatian riskiä lisää simvastatiinin ja simvastatiinihapon kohonneet plasmapitoisuudet. Myopatialle altistavia tekijöitä ovat korkea ikä (≥65 vuotta), naissukupuoli, hallitsematon kilpirauhasen vajaatoiminta ja munuaisten vajaatoiminta. Kiinalaispotilailla voi olla lisääntynyt myopatian riski [katso Käyttö tietyissä populaatioissa ].
Myopatian riski, mukaan lukien rabdomyolyysi, on annoksesta riippuvainen. Kliinisten tutkimusten tietokannassa, jossa 41 413 potilasta hoidettiin ZOCOR 10 mg:lla ja joista 24 747 (noin 60 %) osallistui tutkimuksiin, joiden mediaaniseuranta oli vähintään 4 vuotta, myopatian ilmaantuvuus oli noin 0,03 % ja 0,08 %. 20 ja 40 mg/vrk, vastaavasti. Myopatian ilmaantuvuus 80 mg:lla (0,61 %) oli suhteettoman korkeampi kuin pienemmillä annoksilla. Näissä tutkimuksissa potilaita seurattiin huolellisesti, ja jotkin yhteisvaikuttavat lääkevalmisteet suljettiin pois.
Kliinisessä tutkimuksessa, jossa 12 064 potilasta, joilla on ollut sydäninfarkti, hoidettiin ZOCORilla (keskimääräinen seuranta-aika 6,7 vuotta), myopatian ilmaantuvuus (määritelty selittämättömäksi lihasheikkoudeksi tai -kivuksi seerumin kreatiinikinaasin [CK] ollessa yli 10 kertaa normaalin yläraja [ULN]) potilailla, jotka saivat 80 mg/vrk, oli noin 0,9 % verrattuna 0,02 %:iin potilailla, jotka saivat 20 mg/vrk. Rabdomyolyysin (määritelty myopatiaksi, jonka CK > 40 kertaa ULN) ilmaantuvuus potilailla, jotka saivat 80 mg/vrk, oli noin 0,4 % verrattuna 0 %:iin potilailla, jotka saivat 20 mg/vrk. Myopatian, mukaan lukien rabdomyolyysin, ilmaantuvuus oli suurin ensimmäisen vuoden aikana ja väheni sen jälkeen huomattavasti seuraavien hoitovuosien aikana. Tässä tutkimuksessa potilaita seurattiin huolellisesti, ja jotkin yhteisvaikuttavat lääkevalmisteet suljettiin pois.
Myopatian, mukaan lukien rabdomyolyysin, riski on suurempi potilailla, jotka saavat 80 mg simvastatiinia, verrattuna muihin statiinihoitoihin, joilla on samanlainen tai suurempi LDL-kolesterolia alentava teho, ja verrattuna pienempiin simvastatiiniannoksiin. Siksi ZOCORin 80 mg:n annosta tulee käyttää vain sairaalapotilailla, jotka ovat käyttäneet simvastatiinia 80 mg kroonisesti (esim. 12 kuukauden ajan tai kauemmin) ilman näyttöä lihastoksisuudesta. [Katso ANNOSTELU JA HALLINNOINTI , Rajoitettu annostus 80 mg:lle ]. Jos kuitenkin potilas, joka sietää parhaillaan 80 mg:n ZOCOR-annosta, on aloitettava vuorovaikutteisella lääkkeellä, joka on vasta-aiheinen tai johon liittyy simvastatiinin annoskatto, potilas tulee vaihtaa vaihtoehtoiseen statiiniin, jolla on vähemmän potentiaalia huumeiden välinen vuorovaikutus. Potilaita tulee kertoa lisääntyneestä myopatian, mukaan lukien rabdomyolyysin, riskistä, ja heidän tulee ilmoittaa viipymättä kaikista selittämättömistä lihaskivuista, arkuudesta tai heikkoudesta. Jos oireita ilmaantuu, hoito on lopetettava välittömästi. [katso Immuunivälitteinen nekrotisoiva myopatia ]
Kaikille potilaille, jotka aloittavat hoidon ZOCOR 20 mg:lla tai joiden ZOCOR-annosta nostetaan, on kerrottava myopatian, mukaan lukien rabdomyolyysin, riskistä ja kehotettava ilmoittamaan viipymättä kaikista selittämättömistä lihaskivuista, -arkuudesta tai -heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta, jos lihasoireita ilmenee. ja oireet jatkuvat ZOCORin lopettamisen jälkeen. ZOCOR-hoito tulee lopettaa välittömästi, jos myopatiaa diagnosoidaan tai sitä epäillään. Useimmissa tapauksissa lihasoireet ja CK:n lisääntyminen hävisivät, kun hoito lopetettiin välittömästi. Säännöllisiä CK-määrityksiä voidaan harkita potilailla, jotka aloittavat hoidon ZOCOR 5 mg:lla tai joiden annosta nostetaan, mutta ei ole takeita siitä, että tällainen seuranta estää myopatian.
Monilla potilailla, joille on kehittynyt rabdomyolyysi simvastatiinihoidon aikana, on ollut monimutkainen sairaus, mukaan lukien munuaisten vajaatoiminta, joka on yleensä seurausta pitkäaikaisesta diabeteksesta. Tällaisia potilaita on seurattava tarkemmin. ZOCOR-hoito tulee lopettaa, jos CPK-arvot kohoavat huomattavasti tai jos myopatiaa diagnosoidaan tai sitä epäillään. ZOCOR-hoito tulee myös väliaikaisesti keskeyttää potilailta, joilla on akuutti tai vakava tila, joka altistaa rabdomyolyysin aiheuttaman munuaisten vajaatoiminnan kehittymiselle, esim. sepsis; hypotensio; iso leikkaus; trauma; vakavat metaboliset, endokriiniset tai elektrolyyttihäiriöt; tai hallitsematon epilepsia.
Huumeiden vuorovaikutukset
Myopatian ja rabdomyolyysin riskiä lisää simvastatiinin ja simvastatiinihapon kohonnut plasmapitoisuus. Simvastatiini metaboloituu sytokromi P450:n isoformin 3A4 avulla. Tietyt lääkkeet, jotka estävät tätä metaboliareittiä, voivat nostaa simvastatiinin pitoisuutta plasmassa ja lisätä myopatian riskiä. Näitä ovat itrakonatsoli, ketokonatsoli, posakonatsoli, vorikonatsoli, makrolidiantibiootit erytromysiini ja klaritromysiini sekä ketolidiantibiootti telitromysiini, HIV-proteaasin estäjät, bosepreviiri, telapreviiri, masennuslääke nefatsodoni, kobisistaattia tai mehua sisältävät tuotteet KLIININEN FARMAKOLOGIA ]. Näiden lääkkeiden yhdistelmä simvastatiinin kanssa on vasta-aiheista. Jos lyhytaikaista hoitoa vahvoilla CYP3A4-estäjillä ei voida välttää, simvastatiinihoito on keskeytettävä hoidon ajaksi [ks. VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Simvastatiinin yhteiskäyttö gemfibrotsiilin, syklosporiinin tai danatsolin kanssa on vasta-aiheista [ks. VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Varovaisuutta tulee noudattaa määrättäessä muita fibraatteja simvastatiinin kanssa, koska nämä aineet voivat aiheuttaa myopatiaa yksinään annettuna ja riski kasvaa, kun niitä annetaan samanaikaisesti [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Myopatiatapauksia, mukaan lukien rabdomyolyysi, on raportoitu, kun simvastatiinia on annettu samanaikaisesti kolkisiinin kanssa, ja varovaisuutta on noudatettava määrättäessä simvastatiinia kolkisiinin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Simvastatiinin ja seuraavien lääkkeiden yhteiskäytön hyötyjä tulee punnita huolellisesti ja mahdollisia yhdistelmien riskejä vastaan: muut lipidejä alentavat lääkkeet (fibraatit tai HoFH-potilailla lomitapidi), amiodaroni, dronedaroni, verapamiili, diltiatseemi, amlodipiini, tai ranolatsiini [katso ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET ].
Myopatiatapauksia, mukaan lukien rabdomyolyysi, on havaittu, kun simvastatiinia on annettu samanaikaisesti lipidejä modifioivien niasiinia sisältävien tuotteiden annoksilla (≥1 g/vrk niasiinia) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Rabdomyolyysitapauksia on raportoitu, kun simvastatiinia on annettu daptomysiinin kanssa. Keskeytä tilapäisesti ZOCOR potilailla, jotka käyttävät daptomysiiniä [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Taulukossa 1 on yhteenveto vuorovaikutteisten aineiden määräämissuosituksista [katso myös ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
Immuunivälitteinen nekrotisoiva myopatia
Immuunivälitteisestä nekrotisoivasta myopatiasta (IMNM), autoimmuunimyopatiasta, on raportoitu harvoin statiinien käyttöön liittyen. IMNM:lle on tunnusomaista: proksimaalinen lihasheikkous ja kohonnut seerumin kreatiinikinaasi, jotka jatkuvat statiinihoidon lopettamisesta huolimatta; positiivinen anti-HMG-CoA-reduktaasivasta-aine; lihasbiopsia, joka osoittaa nekrotisoivaa myopatiaa; ja parantaminen immunosuppressiivisilla aineilla. Neuromuskulaariset ja serologiset lisätutkimukset voivat olla tarpeen. Hoito immunosuppressiivisilla aineilla saattaa olla tarpeen. Harkitse IMNM:n riskiä huolellisesti ennen toisen statiinin aloittamista. Jos hoito aloitetaan toisella statiinilla, tarkkaile IMNM:n merkkejä ja oireita.
Maksan toimintahäiriö
Seerumin transaminaasiarvojen jatkuvaa nousua (yli 3x ULN) on esiintynyt noin 1 %:lla potilaista, jotka ovat saaneet simvastatiinia kliinisissä tutkimuksissa. Kun lääkehoito keskeytettiin tai lopetettiin näillä potilailla, transaminaasitasot putosivat yleensä hitaasti hoitoa edeltäville tasoille. Lisääntymiseen ei liittynyt keltaisuutta tai muita kliinisiä merkkejä tai oireita. Ei ollut näyttöä yliherkkyydestä.
Scandinavian Simvastatin Survival Study (4S) -tutkimuksessa [katso Kliiniset tutkimukset ], potilaiden lukumäärä, joilla oli enemmän kuin yksi transaminaasiarvojen nousu > 3X ULN, tutkimuksen aikana ei eronnut merkitsevästi simvastatiini- ja lumeryhmien välillä (14 [0,7 %] vs. 12 [0,6 %]). Kohonneet transaminaasiarvot johtivat hoidon keskeyttämiseen 8 potilaalta simvastatiiniryhmässä (n=2221) ja 5 plaseboryhmässä (n=2223). Niistä 1 986 simvastatiinilla hoidetuista 4S-potilaasta, joiden maksan toimintatestit (LFT) olivat lähtötilanteessa normaalit, kahdeksalle (0,4 %) kehittyi peräkkäinen LFT-arvon nousu >3X ULN:iin ja/tai hoito keskeytettiin transaminaasien nousun vuoksi 5,4 vuoden aikana (seurantamediaani). ) tutkimuksen. Näistä kahdeksasta potilaasta 5:lle kehittyi nämä poikkeavuudet ensimmäisen vuoden aikana. Kaikki tämän tutkimuksen potilaat saivat 20 mg:n aloitusannoksen simvastatiinia; 37 % titrattiin 40 mg:aan.
Kahdessa kontrolloidussa kliinisessä tutkimuksessa 1 105 potilaalla pysyvän maksan transaminaasitason nousun 12 kuukauden ilmaantuvuus lääkesuhteesta riippumatta oli 0,9 % ja 2,1 % 40 ja 80 mg:n annoksilla. Yhdellekään potilaalle ei kehittynyt pysyviä maksan toimintahäiriöitä ensimmäisten 6 kuukauden hoidon jälkeen tietyllä annoksella.
Maksan toimintakokeet suositellaan tehtäväksi ennen hoidon aloittamista ja sen jälkeen, kun se on kliinisesti aiheellista. Markkinoille tulon jälkeen on raportoitu harvoin kuolemaan johtaneesta ja ei-fataalista maksan vajaatoimintaa potilailla, jotka ovat käyttäneet statiineja, mukaan lukien simvastatiinia. Jos ZOCOR 5 mg -hoidon aikana ilmenee vakava maksavaurio, johon liittyy kliinisiä oireita ja/tai hyperbilirubinemiaa tai keltaisuutta, keskeytä hoito välittömästi. Jos muuta etiologiaa ei löydy, älä käynnistä ZOCORia uudelleen. Huomaa, että ALAT voi virrata lihaksesta, joten ALAT:n nousu CK:n kanssa voi viitata myopatiaan [ks. Myopatia/rabdomyolyysi ].
Lääkettä tulee käyttää varoen potilailla, jotka käyttävät suuria määriä alkoholia ja/tai joilla on aiemmin ollut maksasairaus. Aktiiviset maksasairaudet tai selittämättömät transaminaasitason nousut ovat vasta-aiheita simvastatiinin käytölle.
Kohtalaista (alle 3X ULN) seerumin transaminaasiarvojen nousua on raportoitu simvastatiinihoidon jälkeen. Nämä muutokset ilmenivät pian simvastatiinihoidon aloittamisen jälkeen, olivat usein ohimeneviä, niihin ei liittynyt oireita eivätkä ne vaatineet hoidon keskeyttämistä.
Endokriininen toiminta
HbA1c-arvon nousua ja seerumin paastoglukoosipitoisuutta on raportoitu käytettäessä HMG-CoA-reduktaasin estäjiä, mukaan lukien ZOCOR.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
72 viikkoa kestäneessä karsinogeenisuustutkimuksessa hiirille annettiin simvastatiinin päivittäisiä annoksia 25, 100 ja 400 mg/kg ruumiinpainoa, mikä johti plasman keskimääräisiin lääkeainepitoisuuksiin, jotka olivat noin 1, 4 ja 8 kertaa korkeammat kuin ihmisen plasmalääke. 80 mg:n oraalisen annoksen jälkeen. Maksakarsinoomat lisääntyivät merkittävästi suuria annoksia saaneilla naisilla ja keski- ja suuria annoksia saaneilla miehillä, ja miehillä esiintyvyys oli enintään 90 %. Maksan adenoomien ilmaantuvuus lisääntyi merkittävästi naisilla, jotka saivat keski- ja suuria annoksia. Lääkehoito lisäsi myös merkittävästi keuhkojen adenoomien ilmaantuvuutta keski- ja suuriannoksilla miehillä ja naisilla. Harderian rauhasen (jyrsijöiden silmän rauhanen) adenoomat olivat merkittävästi korkeampia suuriannoksisilla hiirillä kuin kontrolleilla. Tuumorigeenisestä vaikutuksesta ei havaittu näyttöä annoksella 25 mg/kg/vrk.
Erillisessä 92 viikkoa kestäneessä karsinogeenisuustutkimuksessa hiirillä annoksilla 25 mg/kg/vrk asti ei havaittu todisteita kasvaimia aiheuttavasta vaikutuksesta (keskimääräiset plasman lääkepitoisuudet olivat 1 kertaa korkeammat kuin ihmisillä, joille annettiin 80 mg simvastatiinia AUC:lla mitattuna).
Kaksivuotisessa tutkimuksessa rotilla annoksella 25 mg/kg/vrk, kilpirauhasen follikulaaristen adenoomien ilmaantuvuus lisääntyi tilastollisesti merkitsevästi naarasrotilla, jotka altistettiin noin 11 kertaa suuremmille simvastatiinitasoille kuin ihmisillä, joille annettiin 80 mg simvastatiinia (esim. mitattuna AUC:lla).
Toinen kaksivuotinen rottien karsinogeenisuustutkimus annoksilla 50 ja 100 mg/kg/vrk tuotti hepatosellulaarisia adenoomat ja karsinoomat (naarasrotilla molemmilla annoksilla ja uroksilla annoksella 100 mg/kg/vrk). Kilpirauhasen follikulaaristen solujen adenoomat lisääntyivät miehillä ja naisilla molemmilla annoksilla; kilpirauhasen follikkelisolukarsinoomat lisääntyivät naisilla annoksella 100 mg/kg/vrk. Kilpirauhasen kasvaimien lisääntynyt ilmaantuvuus näyttää olevan yhdenmukainen muiden statiinien tulosten kanssa. Nämä hoitotasot edustivat plasman lääkeainepitoisuuksia (AUC) noin 7- ja 15-kertaisia (miehet) ja 22- ja 25-kertaisia (naiset) verrattuna ihmisen plasman keskimääräiseen lääkealtistukseen 80 milligramman vuorokausiannoksen jälkeen.
Mutageenisuutta ei havaittu mikrobiaalisessa mutageenisuustestissä (Ames) rotan tai hiiren maksan metabolisen aktivaation kanssa tai ilman sitä. Lisäksi mitään todisteita geneettisen materiaalin vaurioista ei havaittu in vitro emäksisessä eluutiomäärityksessä, jossa käytettiin rotan hepatosyyttejä, V-79-nisäkässolujen eteenpäin suuntautuvassa mutaatiotutkimuksessa, in vitro kromosomipoikkeavuustutkimuksessa CHO-soluissa tai in vivo kromosomipoikkeamamäärityksessä. hiiren luuytimessä.
Hedelmällisyys heikkeni urosrotilla, joita hoidettiin simvastatiinilla 34 viikon ajan annoksella 25 mg/kg ruumiinpainoa (4 kertaa ihmisen enimmäisaltistustaso AUC:n perusteella potilailla, jotka saivat 80 mg/vrk); tätä vaikutusta ei kuitenkaan havaittu myöhemmissä hedelmällisyystutkimuksessa, jossa simvastatiinia annettiin samalla annostasolla urosrotille 11 viikon ajan (koko spermatogeneesisykli, mukaan lukien lisäkiveksen kypsyminen). Kummassakaan tutkimuksessa ei havaittu mikroskooppisia muutoksia rottien kiveksissä. Annoksella 180 mg/kg/vrk (joka tuottaa 22 kertaa korkeammat altistustasot kuin ihmisillä, jotka ottivat 80 mg/vrk pinta-alan, mg/m2 perusteella), havaittiin siementiehyiden rappeutumista (nekroosia ja siittiöiden epiteelin häviämistä). Koirilla esiintyi lääkkeeseen liittyvää kivesten surkastumista, vähentynyttä spermatogeneesiä, siittiöiden rappeutumista ja jättimäisten solujen muodostumista annoksella 10 mg/kg/vrk (noin 2 kertaa ihmisen altistus AUC:n perusteella annoksella 80 mg/vrk). Näiden löydösten kliininen merkitys on epäselvä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka X [Katso VASTA-AIHEET ]
ZOCOR on vasta-aiheinen naisille, jotka ovat tai voivat tulla raskaaksi. Lipidejä alentavista lääkkeistä ei ole hyötyä raskauden aikana, koska kolesterolia ja kolesterolijohdannaisia tarvitaan normaaliin sikiön kehitykseen. Ateroskleroosi on krooninen prosessi, ja lipidejä alentavien lääkkeiden käytön lopettamisella raskauden aikana pitäisi olla vain vähän vaikutusta primaarisen hyperkolesterolemiahoidon pitkäaikaisiin tuloksiin. ZOCORin käytöstä raskauden aikana ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. on kuitenkin harvinaisia raportteja synnynnäisistä poikkeavuuksista vauvoilla, jotka ovat altistuneet statiineille kohdussa. Simvastatiinin lisääntymistutkimukset eläimillä rotilla ja kaniineilla eivät osoittaneet näyttöä teratogeenisuudesta. Seerumin kolesteroli ja triglyseridit lisääntyvät normaalin raskauden aikana, ja kolesteroli tai kolesterolijohdannaiset ovat välttämättömiä sikiön kehitykselle. Koska statiinit vähentävät kolesterolin synteesiä ja mahdollisesti muiden kolesterolista peräisin olevien biologisesti aktiivisten aineiden synteesiä, ZOCOR voi aiheuttaa sikiövaurioita, kun niitä annetaan raskaana olevalle naiselle. Jos ZOCOR 5mg -valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle.
Synnynnäisistä epämuodostumista on raportoitu harvoin kohdunsisäisen statiinialtistuksen jälkeen. Katsauksessa2, joka käsitti noin 100 prospektiivisesti seurattua raskautta naisilla, jotka olivat altistuneet simvastatiinille tai muulle rakenteellisesti samankaltaiselle statiinille, synnynnäisten epämuodostumien, spontaanien aborttien ja sikiökuolemien/kuolemansyntyneiden ilmaantuvuus ei ylittänyt yleisväestössä odotettua. Tutkimus kykeni kuitenkin sulkemaan pois vain 3-4-kertaisen lisääntyneen synnynnäisten epämuodostumien riskin taustatasoon verrattuna. 89 %:ssa näistä tapauksista lääkehoito aloitettiin ennen raskautta ja lopetettiin ensimmäisen raskauskolmanneksen aikana, kun raskaus todettiin.
Simvastatiini ei ollut teratogeeninen rotilla tai kaniineilla annoksilla (25 ja 10 mg/kg/vrk), jotka johtivat 3 kertaa ihmisen altistukseen verrattuna mg/m2 pinta-alasta. Toisella rakenteellisesti samankaltaisella statiinilla tehdyissä tutkimuksissa havaittiin kuitenkin luuston epämuodostumia rotilla ja hiirillä.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing Surveillance of Lovastatin and Simvastatin Exposure during Pregnancy, Reproductive Toxicology, 10(6):439-446, 1996.
Hedelmällisessä iässä olevia naisia, jotka tarvitsevat ZOCOR 5 mg -hoitoa lipidihäiriön vuoksi, tulee neuvoa käyttämään tehokasta ehkäisyä. Jos nainen yrittää tulla raskaaksi, ZOCOR-hoidon lopettamista tulee harkita. Jos raskaus tulee, ZOCOR-hoito on lopetettava välittömästi.
Imettävät äidit
Ei tiedetä, erittyykö simvastatiini äidinmaitoon. Koska pieni määrä toista tämän luokan lääkettä erittyy äidinmaitoon ja koska imeväisille voi aiheutua vakavia haittavaikutuksia, simvastatiinia käyttävien naisten ei tule imettää lapsiaan. On tehtävä päätös, lopetetaanko imetys vai lopetetaanko lääkkeiden käyttö, ottaen huomioon lääkkeen merkitys äidille [ks. VASTA-AIHEET ].
Käyttö lapsille
Simvastatiinin turvallisuutta ja tehokkuutta 10–17-vuotiailla potilailla, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia, on arvioitu kontrolloidussa kliinisessä tutkimuksessa nuorilla pojilla ja tytöillä, joilla oli vähintään 1 vuosi kuukautisten alkamisen jälkeen. Simvastatiinilla hoidetuilla potilailla oli samanlainen haittavaikutusprofiili kuin lumelääkettä saaneilla potilailla. Yli 40 mg:n annoksia ei ole tutkittu tässä populaatiossa. Tässä rajoitetussa kontrolloidussa tutkimuksessa ei ollut merkittävää vaikutusta nuorten poikien tai tyttöjen kasvuun tai seksuaaliseen kypsymiseen eikä tyttöjen kuukautiskierron pituuteen. [Katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , Kliiniset tutkimukset ] Nuoria naisia tulee neuvoa asianmukaisista ehkäisymenetelmistä simvastatiinihoidon aikana [ks. VASTA-AIHEET ja Raskaus ]. Simvastatiinia ei ole tutkittu alle 10-vuotiailla potilailla eikä premenarkaalisilla tytöillä.
Geriatrinen käyttö
Niistä 2 423 potilaasta, jotka saivat ZOCOR 5 mg faasin III kliinisissä tutkimuksissa ja 10 269 potilaasta Heart Protection Study -tutkimuksessa, jotka saivat ZOCOR 40 mg, 363 (15 %) ja 5 366 (52 %) olivat ≥ 65-vuotiaita. HPS:ssä 615 (6 %) oli ≥75-vuotiaita. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois. Koska korkea ikä (≥65 vuotta) on myopatialle altistava tekijä, ZOCORia tulee määrätä varoen iäkkäille. [Katso KLIININEN FARMAKOLOGIA ]
Simvastatiinilla tehty farmakokineettinen tutkimus osoitti statiinien keskimääräisen aktiivisuuden plasmassa olevan noin 45 % korkeampi iäkkäillä 70-78-vuotiailla potilailla verrattuna 18-30-vuotiaisiin potilaisiin. 4S:ssä 1 021 (23 %) 4 444 potilaasta oli 65-vuotiaita tai vanhempia. Lipidejä alentava teho oli vähintään yhtä hyvä iäkkäillä potilailla kuin nuoremmilla potilailla, ja ZOCOR vähensi merkittävästi kokonaiskuolleisuutta ja sepelvaltimotautikuolleisuutta iäkkäillä potilailla, joilla on ollut sepelvaltimotauti. HPS-potilaista 52 % oli iäkkäitä (4 891 potilasta 65-69-vuotiaita ja 5 806 potilasta 70-vuotiaita tai vanhempia). Sepelvaltimotautikuoleman, ei-kuolemaan johtavan sydäninfarktin, sepelvaltimon ja ei-sepelvaltimon revaskularisaatiotoimenpiteiden ja aivohalvauksen suhteellinen riskin pieneneminen oli samanlaista vanhemmilla ja nuoremmilla potilailla [ks. Kliiniset tutkimukset ]. HPS:ssä 32 145 aktiivisen sisäänajojakson aloittaneen potilaan joukossa oli 2 myopatia-/rabdomyolyysitapausta; nämä potilaat olivat iältään 67 ja 73. Niistä seitsemästä myopatia-/rabdomyolyysitapauksesta 10 269 simvastatiinia saaneen potilaan joukossa 4 oli vähintään 65-vuotiaita (lähtötilanteessa), joista yksi oli yli 75-vuotias. ja nuoremmat potilaat joko 4S:ssä tai HPS:ssä.
Koska korkea ikä (≥ 65 vuotta) on myopatialle, rabdomyolyysille mukaan lukien, altistava tekijä, ZOCOR 40 mg:aa tulee määrätä varoen vanhuksille. Kliinisessä tutkimuksessa potilailla, joita hoidettiin simvastatiinilla 80 mg/vrk, ≥65-vuotiailla potilailla myopatian, mukaan lukien rabdomyolyysin, riski oli suurempi kuin alle 65-vuotiailla potilailla. [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ]
Munuaisten vajaatoiminta
Varovaisuutta on noudatettava, kun ZOCOR 20 mg:aa annetaan potilaille, joilla on vaikea munuaisten vajaatoiminta.[Katso kohta ANNOSTELU JA HALLINNOINTI ]
Maksan vajaatoiminta
ZOCOR 10mg on vasta-aiheinen potilailla, joilla on aktiivinen maksasairaus, johon voi sisältyä selittämätöntä jatkuvaa maksan transaminaasiarvojen nousua [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Kiinalaiset potilaat
Kliinisessä tutkimuksessa, jossa potilaita, joilla oli korkea sydän- ja verisuonitautien riski, hoidettiin simvastatiinilla 40 mg/vrk (seurantamediaani 3,9 vuotta), myopatian ilmaantuvuus oli noin 0,05 % ei-kiinalaispotilailla (n=7367) verrattuna 0,24 % kiinalaisilla potilailla (n=5468). Myopatian ilmaantuvuus kiinalaisilla potilailla, jotka saivat simvastatiinia 40 mg/vrk tai etsetimibi/simvastatiinia 10/40 mg/vrk yhdessä pitkittyvästi vapautuvan niasiinin 2 g/vrk kanssa, oli 1,24 %.
Kiinalaispotilailla voi olla suurempi myopatian riski. Seuraa potilaita asianmukaisesti. ZOCOR 10 mg:n samanaikainen anto niasiinia sisältävien tuotteiden lipidejä modifioivien annosten (≥1 g/vrk niasiini) kanssa ei ole suositeltavaa kiinalaisille potilaille [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
YLIANNOSTUS
Merkittävä kuolleisuus havaittiin hiirillä 9 g/m2:n kerta-annoksen jälkeen. Kuolleisuutta ei havaittu rotilla ja koirilla, joita hoidettiin annoksilla 30 ja 100 g/m2. Jyrsijöillä ei havaittu erityisiä diagnostisia oireita. Näillä annoksilla ainoat koirilla havaitut merkit olivat oksentelu ja limaiset ulosteet.
Muutamia ZOCORin yliannostustapauksia on raportoitu; suurin otettu annos oli 3,6 g. Kaikki potilaat toipuivat ilman jälkioireita. Yliannostustapauksissa tulee ryhtyä tukitoimenpiteisiin. Simvastatiinin ja sen metaboliittien dialysoituvuutta ihmisellä ei tällä hetkellä tunneta.
VASTA-AIHEET
ZOCOR 40mg on vasta-aiheinen seuraavissa olosuhteissa:
- Samanaikainen voimakkaiden CYP3A4-estäjien (esim. itrakonatsoli, ketokonatsoli, posakonatsoli, vorikonatsoli, HIV-proteaasin estäjät, bosepreviiri, telapreviiri, erytromysiini, klaritromysiini, telitromysiini, nefatsodoni ja kobisistaattia sisältävät tuotteet) samanaikainen anto. VAROITUKSET JA VAROTOIMET ].
- Gemfibrotsiilin, syklosporiinin tai danatsolin samanaikainen anto [katso VAROITUKSET JA VAROTOIMET ].
- Yliherkkyys tämän lääkkeen jollekin komponentille [katso HAITTAVAIKUTUKSET ].
- Aktiivinen maksasairaus, johon voi sisältyä selittämätöntä jatkuvaa maksan transaminaasiarvojen nousua [katso VAROITUKSET JA VAROTOIMET ].
- Naiset, jotka ovat raskaana tai voivat tulla raskaaksi. Seerumin kolesteroli ja triglyseridit lisääntyvät normaalin raskauden aikana, ja kolesteroli tai kolesterolijohdannaiset ovat välttämättömiä sikiön kehitykselle. Koska HMG-CoA-reduktaasin estäjät (statiinit) vähentävät kolesterolin synteesiä ja mahdollisesti muiden kolesterolista peräisin olevien biologisesti aktiivisten aineiden synteesiä, ZOCOR 40 mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Ateroskleroosi on krooninen prosessi, ja lipidejä alentavien lääkkeiden käytön lopettamisella raskauden aikana ei pitäisi olla juurikaan vaikutusta primaarisen hyperkolesterolemian pitkäaikaishoidon tulokseen. ZOCORin käytöstä raskauden aikana ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. kuitenkin harvinaisissa raporteissa havaittiin synnynnäisiä epämuodostumia kohdunsisäisen statiinialtistuksen jälkeen. Rotilla ja kaniineilla tehdyissä lisääntymistutkimuksissa simvastatiinilla ei havaittu näyttöä teratogeenisuudesta. ZOCORia tulee antaa hedelmällisessä iässä oleville naisille vain, jos tällaisten potilaiden raskaaksi tuleminen on erittäin epätodennäköistä. Jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, ZOCOR-hoito on lopetettava välittömästi ja potilaalle on kerrottava mahdollisesta vaarasta sikiölle (ks. Käyttö tietyissä populaatioissa ].
- Imettävät äidit. Ei tiedetä, erittyykö simvastatiini äidinmaitoon. kuitenkin pieni määrä toista tämän luokan lääkettä erittyy äidinmaitoon. Koska statiinit voivat aiheuttaa vakavia haittavaikutuksia imeväisille, ZOCOR-hoitoa tarvitsevien naisten ei tule imettää lapsiaan [ks. Käyttö tietyissä populaatioissa ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Simvastatiini on aihiolääke ja hydrolysoituu annon jälkeen aktiiviseksi β-hydroksihappomuotokseen, simvastatiinihapoksi. Simvastatiini on 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n (HMG-CoA) reduktaasin spesifinen estäjä, entsyymi, joka katalysoi HMG-CoA:n muuttumista mevalonaatiksi, mikä on varhainen ja nopeutta rajoittava vaihe kolesterolin biosynteesireitissä. Lisäksi simvastatiini alentaa VLDL:ää ja TG:tä ja lisää HDL-kolesterolia.
Farmakodynamiikka
Epidemiologiset tutkimukset ovat osoittaneet, että kohonneet kokonaiskolesteroli-, LDL-kolesteroli- ja alentuneet HDL-kolesterolitasot liittyvät ateroskleroosin kehittymiseen ja lisääntyneeseen kardiovaskulaariseen riskiin. LDL-kolesterolin alentaminen vähentää tätä riskiä. HDL-kolesterolin nousun tai TG:n laskun riippumatonta vaikutusta sepelvaltimoiden ja sydän- ja verisuonisairauksien sekä kuolleisuuden riskiin ei kuitenkaan ole määritetty.
Farmakokinetiikka
Simvastatiini on laktoni, joka hydrolysoituu helposti in vivo vastaavaksi β-hydroksihapoksi, joka on voimakas HMG-CoA-reduktaasin estäjä. HMG-CoA-reduktaasin esto on perusta simvastatiinin annon jälkeen plasmassa olevien β-hydroksihappometaboliittien (aktiiviset estäjät) ja emäshydrolyysin jälkeen aktiivisten plus piilevien estäjien (kokonaisestäjät) farmakokineettisissä tutkimuksissa.
14C-leimatun simvastatiinin oraalisen annoksen jälkeen ihmiselle 13 % annoksesta erittyi virtsaan ja 60 % ulosteeseen. Plasman kokonaisradioaktiivisuuden pitoisuudet (simvastatiini plus 14C-metaboliitit) saavuttivat huippunsa 4 tunnin kuluttua ja laskivat nopeasti noin 10 %:iin huipusta 12 tunnin kuluttua annoksesta. Koska simvastatiini erittyy laajasti ensikierron maksassa, lääkkeen saatavuus yleiseen verenkiertoon on alhainen (
Sekä simvastatiini että sen β-hydroksihappometaboliitit sitoutuvat voimakkaasti (noin 95 %) ihmisen plasman proteiineihin. Rottatutkimukset osoittavat, että kun radioaktiivisesti merkittyä simvastatiinia annettiin, simvastatiinista peräisin oleva radioaktiivisuus ylitti veri-aivoesteen.
Simvastatiinin tärkeimmät aktiiviset metaboliitit, joita esiintyy ihmisen plasmassa, ovat simvastatiinin β-hydroksihappo ja sen 6′-hydroksi-, 6′-hydroksimetyyli- ja 6′-eksometyleenijohdannaiset. Sekä aktiivisten että kokonaisinhibiittoreiden huippupitoisuudet plasmassa saavutettiin 1,3–2,4 tunnin kuluessa annoksesta. Vaikka suositeltu terapeuttinen annosalue on 5–40 mg/vrk, yleisen verenkierron estäjien AUC:n lineaarisuudesta ei havaittu merkittävää poikkeamaa, kun annos nostettiin jopa 120 mg:aan. Suhteessa paastotilaan inhibiittorien plasmaprofiiliin ei vaikuttanut, kun simvastatiinia annettiin juuri ennen kuin American Heart Association suositteli vähärasvaista ateriaa.
Tutkimuksessa, johon osallistui 16 iäkkää 70–78-vuotiasta potilasta, jotka saivat ZOCORia 40 mg/vrk, HMG-CoA-reduktaasia estävän vaikutuksen keskimääräinen plasmataso nousi noin 45 % verrattuna 18 potilaaseen, jotka olivat 18–30-vuotiaita. Kliiniset tutkimuskokemukset vanhuksilla (n=1522) viittaavat siihen, että turvallisuudessa ei ollut yleisiä eroja iäkkäiden ja nuorempien potilaiden välillä [ks. Käyttö tietyissä populaatioissa ].
Kineettiset tutkimukset toisella statiinilla, jolla on samanlainen pääasiallinen eliminaatioreitti, ovat ehdottaneet, että tietyllä annostasolla voidaan saavuttaa suurempi systeeminen altistus potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistumalla mitattuna).
Simvastatiinihappo on kuljetusproteiinin OATP1B1 substraatti. Kuljetusproteiinia OATP1B1 estävien lääkevalmisteiden samanaikainen käyttö saattaa suurentaa plasman simvastatiinihapon pitoisuuksia ja lisätä myopatian riskiä. Esimerkiksi syklosporiinin on osoitettu lisäävän statiinien AUC-arvoa; vaikka mekanismia ei täysin ymmärretä, simvastatiinihapon AUC:n nousu johtuu oletettavasti osittain CYP3A4:n ja/tai OATP1B1:n estämisestä.
Myopatian riskiä lisää plasman korkea HMG-CoA-reduktaasia estävä aktiivisuus. CYP3A4:n estäjät voivat nostaa plasman HMG-CoA-reduktaasin estoaktiivisuutta ja lisätä myopatian riskiä [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Tutkimuksessa, johon osallistui 12 tervettä vapaaehtoista, simvastatiinilla ei 80 mg:n annoksella ollut vaikutusta koettimen sytokromi P450 isoformin 3A4 (CYP3A4) substraattien, midatsolaamin ja erytromysiinin, metaboliaan. Tämä viittaa siihen, että simvastatiini ei ole CYP3A4:n estäjä, ja siksi sen ei odoteta vaikuttavan muiden CYP3A4:n kautta metaboloituvien lääkkeiden pitoisuuksiin plasmassa.
Simvastatiinin (40 mg QD 10 päivän ajan) samanaikainen anto johti kardioaktiivisen digoksiinin maksimikeskimääräisten pitoisuuksien nousuun (annettiin 0,4 mg:n kerta-annoksena päivänä 10) noin 0,3 ng/ml.
Eläinten toksikologia ja/tai farmakologia
Keskushermostotoksisuus
Näköhermon rappeutumista havaittiin kliinisesti normaaleilla koirilla, joita hoidettiin simvastatiinilla 14 viikon ajan annoksella 180 mg/kg/vrk. Annos, joka tuotti plasman keskimääräiset lääkeainepitoisuudet noin 12 kertaa korkeammat kuin plasman keskimääräinen lääketaso ihmisillä, jotka saivat 80 mg/vrk.
Kemiallisesti samanlainen tähän luokkaan kuuluva lääke aiheutti myös näköhermon rappeutumista (retinogeniculaattikuitujen Wallerin degeneraatiota) kliinisesti normaaleissa koirissa annoksesta riippuvaisella tavalla alkaen annoksesta 60 mg/kg/vrk, annoksella, joka sai aikaan noin 30 kertaa korkeammat plasman lääkeainepitoisuudet. kuin keskimääräinen plasman lääketaso ihmisillä, jotka käyttävät suurinta suositeltua annosta (mitattuna kokonaisentsyymien estoaktiivisuudella). Tämä sama lääke aiheutti myös vestibulokokleaarista Wallerian kaltaista rappeutumista ja verkkokalvon gangliosolukromatolyysiä koirilla, joita hoidettiin 14 viikon ajan annoksella 180 mg/kg/vrk. Annos, joka johti plasman keskimääräiseen lääkeainetasoon, joka oli samanlainen kuin 60 mg/kg/vrk. päivän annos.
Keskushermoston verisuonivaurioita, joille on tunnusomaista perivaskulaarinen verenvuoto ja turvotus, perivaskulaaristen tilojen mononukleaaristen solujen infiltraatio, perivaskulaarinen fibriinikertymä ja pienten verisuonten nekroosi, havaittiin koirilla, joita hoidettiin simvastatiinilla annoksella 360 mg/kg/vrk, joka annos tuotti keskimääräistä plasmaa lääketasot, jotka olivat noin 14 kertaa korkeammat kuin keskimääräiset plasman lääketasot ihmisillä, jotka ottivat 80 mg/vrk. Samanlaisia keskushermoston verisuonivaurioita on havaittu useiden muiden tämän luokan lääkkeiden yhteydessä.
Kaihia esiintyi naarasrotilla kahden vuoden hoidon jälkeen annoksella 50 ja 100 mg/kg/vrk (22 ja 25 kertaa ihmisen AUC annoksella 80 mg/vrk) ja koirilla kolmen kuukauden kuluttua annoksella 90 mg/kg/vrk. 19 kertaa) ja kahden vuoden kuluttua annoksella 50 mg/kg/vrk (5 kertaa).
Kliiniset tutkimukset
Kliiniset tutkimukset aikuisilla
Sepelvaltimotautikuolleisuuden ja sydän- ja verisuonitapahtumien riskin väheneminen
4S:ssä ZOCOR 20 mg:n hoidon vaikutus kokonaiskuolleisuuteen arvioitiin 4 444 potilaalla, joilla oli sepelvaltimotauti ja lähtötilanteen kokonaiskolesteroli 212-309 mg/dl (5,5-8,0 mmol/l). Tässä monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa potilaita hoidettiin tavanomaisella hoidolla, mukaan lukien ruokavalio, ja joko ZOCOR 20-40 mg/vrk (n=2221) tai lumelääke (n=2223) mediaanikeston ajan. 5,4 vuotta. Tutkimuksen aikana ZOCOR-hoito johti keskimääräiseen kokonaiskolesteroli-, LDL-kolesteroli- ja TG-arvon alenemiseen 25 %, 35 %:iin ja 10 %:iin, ja HDL-kolesterolin keskimääräiseen nousuun 8 %. ZOCOR vähensi merkittävästi kuolleisuusriskiä 30 % (p = 0,0003, 182 kuolemaa ZOCOR 40 mg ryhmässä vs 256 kuolemaa lumeryhmässä). Sepelvaltimotautikuolleisuuden riski pieneni merkittävästi 42 % (p=0,00001, 111 vs. 189 kuolemaa). Ryhmien välillä ei ollut tilastollisesti merkitsevää eroa ei-sydän- ja verisuoniperäisissä kuolleissa. ZOCOR vähensi merkittävästi suurten sepelvaltimotapahtumien riskiä (sepelvaltimotautikuolleisuus sekä sairaalassa todettu ja hiljainen ei-kuolemaan johtava sydäninfarkti [MI]) 34 % (p
Sydänsuojatutkimus (HPS) oli laaja, monikeskus, lumekontrolloitu kaksoissokkotutkimus, jonka keskimääräinen kesto oli 5 vuotta. Tutkimus suoritettiin 20 536 potilaalla (10 269 ZOCOR 40 mg:lla ja 10 267 lumelääkkeellä). Potilaat jaettiin hoitoon käyttämällä kovariaattista adaptiivista menetelmää3, joka otti huomioon jo ilmoittautuneiden potilaiden 10 tärkeän perustason ominaisuuden jakautumisen ja minimoi näiden ominaisuuksien epätasapainon ryhmien välillä. Potilaiden keski-ikä oli 64 vuotta (vaihteluväli 40-80 vuotta), 97 % oli valkoihoisia ja heillä oli suuri riski saada vakava sepelvaltimotapahtuma olemassa olevan sepelvaltimotaudin (65 %), diabeteksen (tyyppi 2, 26 %; tyyppi 1) vuoksi. , 3 %), aivohalvaus tai muu aivoverisuonisairaus (16 %), perifeerinen verisuonisairaus (33 %) tai hypertensio miehillä ≥ 65 vuotta (6 %). Lähtötilanteessa 3 421 potilaalla (17 %) LDL-kolesterolitasot olivat alle 100 mg/dl, joista 953:lla (5 %) LDL-kolesterolitasot olivat alle 80 mg/dl; 7 068 potilaalla (34 %) tasot olivat 100 - 130 mg/dl; ja 10 047 potilaalla (49 %) tasot olivat yli 130 mg/dl.
DR Taves, Minimization: uusi menetelmä potilaiden jakamiseksi hoito- ja kontrolliryhmiin. Clin. Pharmacol. Siellä. 15 (1974), s. 443-453
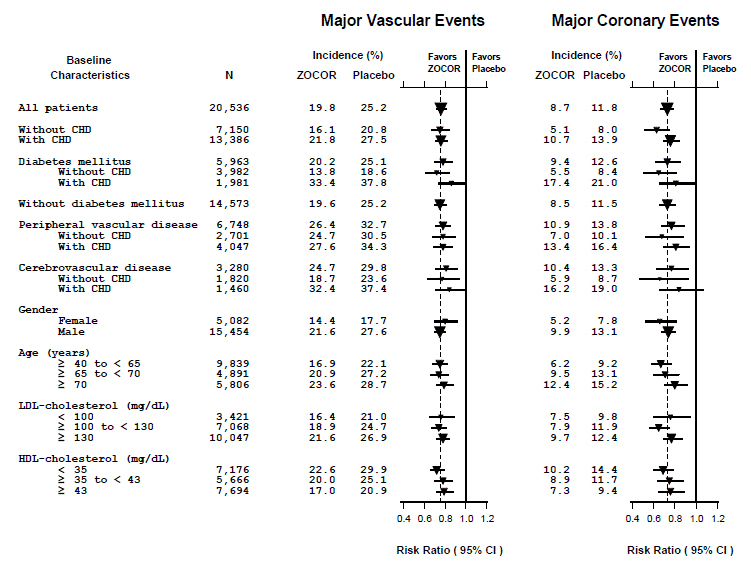
HPS-tulokset osoittivat, että ZOCOR 40 mg/vrk vähensi merkittävästi: kokonais- ja sepelvaltimotautikuolleisuutta; ei-fataalin sydäninfarktin, aivohalvauksen ja revaskularisaatiotoimenpiteet (sepelvaltimotaudit ja ei-sepelvaltimotaudit) (katso taulukko 4).
Kaksi yhdistettyä päätepistettä määriteltiin, jotta tapahtumia olisi riittävästi suhteellisten riskien pienenemisen arvioimiseksi eri lähtötilanteen ominaisuuksilla (katso kuva 1). Suurten sepelvaltimotapahtumien (MCE) yhdistelmä koostui sepelvaltimotautikuolleisuudesta ja ei-fataalista MI:stä (analysoitu aika ensimmäiseen tapahtumaan; 898 potilaalla, joita hoidettiin ZOCOR 5 mg:lla, oli tapahtumia ja 1 212 potilaalla lumelääkettä saaneella). Suurten verisuonitapahtumien (MVE) yhdistelmä koostui MCE-, aivohalvaus- ja revaskularisaatiotoimenpiteistä, mukaan lukien sepelvaltimon, perifeeriset ja muut ei-sepelvaltimotoimenpiteet (analysoitu aika ensimmäiseen tapahtumaan; 2 033 potilaalla, joita hoidettiin ZOCOR 10 mg:lla, oli tapahtumia ja 2 585 potilaalla plasebolla oli tapahtumia). Merkittäviä suhteellisen riskin pienenemistä havaittiin molemmissa yhdistetyissä päätepisteissä (27 % MCE ja 24 % MVE, p
Kuva 1 ZOCOR 5mg -hoidon vaikutukset merkittäviin verisuonitapahtumiin ja merkittäviin sepelvaltimotapahtumiin HPS:ssä
Angiografiset tutkimukset
Multicenter Anti-Atheroma Study -tutkimuksessa simvastatiinin vaikutus ateroskleroosiin arvioitiin kvantitatiivisella sepelvaltimon angiografialla hyperkolesteroleemisilla potilailla, joilla oli sepelvaltimotauti. Tässä satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa tutkimuksessa potilaita hoidettiin simvastatiinilla 20 mg/vrk tai lumelääkkeellä. Angiogrammit arvioitiin lähtötilanteessa, kahden ja neljän vuoden aikana. Tutkimuksen yhteiset päätetapahtumat olivat keskimääräinen muutos potilasta kohden minimi- ja keskimääräisissä onteloiden halkaisijassa, mikä osoitti fokaalista ja diffuusia sairautta. ZOCOR hidasti merkittävästi leesioiden etenemistä vuoden 4 angiogrammissa mitattuna molemmilla parametreilla sekä halkaisijan ahtauman prosentuaalisen muutoksen perusteella. Lisäksi simvastatiini vähensi merkittävästi niiden potilaiden osuutta, joilla oli uusia vaurioita ja uusia kokonaistukoksia.
Lipidiprofiilien muutokset
Primaarinen hyperlipidemia (Fredricksonin tyyppi lla ja llb)
ZOCORin on osoitettu olevan tehokas kokonaiskolesterolin ja LDL-kolesterolin vähentämisessä heterotsygoottisissa familiaalisissa ja ei-perheperäisissä hyperlipidemian muodoissa ja sekahyperlipidemiassa. Maksimaalinen tai lähes maksimivaste saavutetaan yleensä 4-6 viikossa ja se säilyy kroonisen hoidon aikana. ZOCOR vähensi merkittävästi kokonaiskolesteroli-, LDL-kolesteroli-, kokonaiskolesteroli-/HDL-kolesterolisuhdetta ja LDL-C/HDL-C-suhdetta; ZOCOR alensi myös TG:tä ja nosti HDL-kolesterolia (katso taulukko 5).
Hypertriglyseridemia (Fredrickson-tyyppi IV)
Alaryhmäanalyysin tulokset 74 potilaalla, joilla oli tyypin IV hyperlipidemia, 130 potilaan, kaksoissokkoutetusta, lumekontrolloidusta, 3-jaksoisesta risteytystutkimuksesta, on esitetty taulukossa 6.
Dysbetalipoproteinemia (Fredricksonin tyyppi III)
Alaryhmäanalyysin tulokset 7 potilaalla, joilla oli tyypin III hyperlipidemia (dysbetalipoproteinemia) (apo E2/2) (VLDL-C/TG>0,25) 130 potilaan kaksoissokkoutetusta, lumekontrolloidusta, 3-jaksoisesta risteytystutkimuksesta on esitetty taulukossa 7.
Homotsygoottinen familiaalinen hyperkolesterolemia
Kontrolloidussa kliinisessä tutkimuksessa 12 15–39-vuotiasta potilasta, joilla oli homotsygoottinen familiaalinen hyperkolesterolemia, sai simvastatiinia 40 mg/vrk yhtenä annoksena tai kolmeen annokseen jaettuna tai 80 mg/vrk jaettuna 3 annokseen. 11 potilaalla, joilla LDL-kolesteroli laski, LDL-kolesterolin keskimääräiset muutokset 40 ja 80 mg:n annoksilla olivat 14 % (vaihteluväli 8–23 %, mediaani 12 %) ja 30 % (vaihteluväli 14–46 % , mediaani 29 %). Yhdellä potilaalla LDL-kolesteroli nousi 15 %. Toisella potilaalla, jolla ei ollut LDL-C-reseptoritoimintaa, LDL-kolesteroli väheni 41 % 80 mg:n annoksella.
Endokriininen toiminta
Kliinisissä tutkimuksissa simvastatiini ei heikentänyt lisämunuaisten varausta tai vähentänyt merkittävästi plasman kortisolin peruspitoisuutta. Simvastatiinilla tehdyissä kliinisissä tutkimuksissa havaittiin miehillä vähäistä laskua lähtötasosta perusplasman testosteronissa. Sama vaikutus havaittiin myös muilla statiineilla ja sappihappoja sitovalla kolestyramiinilla. Plasman gonadotropiinitasoihin ei ollut vaikutusta. Plasebokontrolloidussa 12 viikkoa kestäneessä tutkimuksessa simvastatiinin 80 mg:lla ei ollut merkittävää vaikutusta plasman testosteronivasteeseen ihmisen koriongonadotropiinille. Toisessa 24 viikkoa kestäneessä tutkimuksessa simvastatiinilla 20-40 mg ei ollut havaittavissa olevaa vaikutusta spermatogeneesiin. 4S-tutkimuksessa, jossa 4 444 potilasta satunnaistettiin saamaan simvastatiinia 20-40 mg/vrk tai lumelääkettä keskimäärin 5,4 vuoden ajan, miesten seksuaalisten haittatapahtumien ilmaantuvuus ei ollut merkitsevästi erilainen kahdessa hoitoryhmässä. Näistä tekijöistä johtuen plasman testosteronin pienet muutokset eivät todennäköisesti ole kliinisesti merkittäviä. Mahdollisia vaikutuksia aivolisäkkeen ja sukurauhasten akseliin premenopausaalisilla naisilla ei tunneta.
Kliiniset tutkimukset nuorilla
Kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 175 potilasta (99 teini-ikäistä poikaa ja 76 postmenarkaalista tyttöä), jotka olivat iältään 10-17 vuotta (keski-ikä 14,1 vuotta), joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia (HeFH), satunnaistettiin saamaan simvastatiinia (n = 106) tai lumelääkettä (n=67) 24 viikon ajan (perustutkimus). Tutkimukseen osallistuminen edellytti lähtötason LDL-kolesterolitasoa 160-400 mg/dl ja vähintään yhden vanhemman LDL-kolesterolitaso >189 mg/dl. Simvastatiinin annos (kerran vuorokaudessa illalla) oli 10 mg ensimmäisten 8 viikon ajan, 20 mg toisen 8 viikon ajan ja 40 mg sen jälkeen. 24 viikon jatkossa 144 potilasta päätti jatkaa hoitoa simvastatiinilla 40 mg tai lumelääkettä.
ZOCOR 20 mg alensi merkittävästi plasman kokonaiskolesteroli-, LDL-kolesteroli- ja Apo B -tasoja (katso taulukko 8). Pidennyksen tulokset 48 viikon kohdalla olivat verrattavissa perustutkimuksessa havaittuihin.
24 viikon hoidon jälkeen saavutettu keskimääräinen LDL-kolesteroliarvo oli 124,9 mg/dl (vaihteluväli: 64,0289,0 mg/dl) ZOCOR 40 mg -ryhmässä verrattuna 207,8 mg/dl:iin (vaihteluväli: 128,0-334,0 mg/dl). lumelääkeryhmässä.
Yli 40 mg:n vuorokausiannosten turvallisuutta ja tehoa ei ole tutkittu lapsilla, joilla on HeFH. Lapsuuden simvastatiinihoidon pitkäaikaista tehoa aikuisiän sairastuvuuden ja kuolleisuuden vähentämiseen ei ole osoitettu.
POTILASTIEDOT
Potilaita tulee neuvoa noudattamaan kansallisen kolesterolikasvatusohjelman (NCEP) suosittelemaa ruokavaliota, säännöllistä liikuntaohjelmaa ja säännöllistä paastolipidipaneelin testausta.
Potilaita tulee neuvoa aineista, joita heidän ei tule käyttää samanaikaisesti simvastatiinin kanssa [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ]. Potilaita tulee myös neuvoa ilmoittamaan muille terveydenhuollon ammattilaisille, jotka määräävät uutta lääkettä tai lisäävät olemassa olevan lääkkeen annosta, että he käyttävät ZOCORia.
Lihaskipu
Kaikille ZOCOR-hoitoa aloittaville potilaille tulee kertoa myopatian, mukaan lukien rabdomyolyysin, riskistä, ja heitä tulee kertoa viipymättä kaikista selittämättömistä lihaskivuista, arkuudesta tai heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta tai jos nämä lihasoireet jatkuvat ZOCOR-hoidon lopettamisen jälkeen. Potilaille, jotka käyttävät 80 mg:n annosta, tulee kertoa, että myopatian, mukaan lukien rabdomyolyysin, riski kasvaa käytettäessä 80 mg:n annosta. Myopatian, mukaan lukien rabdomyolyysin, riski ZOCOR 40 mg:n käytön yhteydessä lisääntyy, kun otetaan tietyntyyppisiä lääkkeitä tai nautitaan greippimehua. Potilaiden tulee keskustella kaikista lääkkeistä, sekä reseptilääkkeistä että reseptivapaista, terveydenhuollon ammattilaisten kanssa.
Maksan entsyymit
Maksan toimintakokeet suositellaan tehtäväksi ennen ZOCOR 20 mg -hoidon aloittamista ja sen jälkeen, kun se on kliinisesti aiheellista. Kaikkia ZOCORilla hoidettuja potilaita tulee neuvoa ilmoittamaan viipymättä kaikista oireista, jotka voivat viitata maksavaurioon, mukaan lukien väsymys, anoreksia, epämukavuus oikealla ylävatsassa, tumma virtsa tai keltaisuus.
Raskaus
Hedelmällisessä iässä olevia naisia tulee neuvoa käyttämään tehokasta ehkäisymenetelmää raskauden ehkäisemiseksi ZOCORin käytön aikana. Keskustele tulevista raskaussuunnitelmista potilaiden kanssa ja keskustele siitä, milloin ZOCOR 40 mg:n käyttö lopetetaan, jos he yrittävät tulla raskaaksi. Potilaita tulee neuvoa, että jos he tulevat raskaaksi, heidän tulee lopettaa ZOCORin käyttö ja soittaa terveydenhuollon ammattilaiselle.
Imetys
Imettävät naiset eivät saa käyttää ZOCORia. Potilaita, joilla on lipidihäiriö ja jotka imettävät, tulee neuvoa keskustelemaan vaihtoehdoista terveydenhuollon ammattilaisen kanssa.
