Lopid 300mg Gemfibrozil Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Lopid 300mg on ja miten sitä käytetään?
Lopid (gemfibrotsiili) on lipidejä säätelevä aine, jota käytetään erittäin korkeiden kolesteroli- ja triglyseriditasojen hoitoon haimatulehdusta sairastavilla ihmisillä, ja sitä käytetään myös alentamaan aivohalvauksen, sydänkohtauksen tai muiden sydänkomplikaatioiden riskiä ihmisillä, joilla on korkea kolesteroli ja triglyseridit. muut hoidot eivät ole auttaneet. Lopid on saatavana yleisessä muodossa.
Mitkä ovat Lopid 300mg:n sivuvaikutukset?
Lopid 300mg:n yleisiä sivuvaikutuksia ovat:
- vatsavaivat,
- vatsakipu/vatsakipu,
- pahoinvointi,
- oksentelua,
- ripuli,
- päänsärky,
- huimaus,
- uneliaisuus,
- nivel- tai lihaskipu,
- kiinnostuksen menetys seksiin,
- impotenssi,
- vaikeuksia saada orgasmi,
- tunnottomuus tai pistely tunne,
- epätavallinen maku tai
- vilustumisoireet, kuten nenän tukkoisuus, aivastelu, kurkkukipu.
Lopid 300mg voi harvoin aiheuttaa sappikiviä ja maksaongelmia.
Kerro lääkärillesi, jos huomaat jonkin seuraavista epätodennäköisistä, mutta vakavista Lopid 300 mg:n sivuvaikutuksista, mukaan lukien:
- vaikea maha-/vatsakipu,
- jatkuva pahoinvointi tai oksentelu,
- keltaiset silmät tai iho ja
- tumma virtsa.
KUVAUS
LOPID® (gemfibrotsiilitabletit, USP) on lipidejä säätelevä aine. Sitä on saatavana tabletteina suun kautta annettavaksi. Yksi tabletti sisältää 600 mg gemfibrotsiilia. Jokainen tabletti sisältää myös kalsiumstearaattia, NF; candelilla vaha, FCC; mikrokiteinen selluloosa, NF; hydroksipropyyliselluloosa, NF; hypromelloosi, USP; metyyliparabeeni, NF; Opaspray valkoinen; polyetyleeniglykoli, NF; polysorbaatti 80, NF; propyyliparabeeni, NF; kolloidinen piidioksidi, NF; esigelatinoitu tärkkelys, NF. Kemiallinen nimi on 5-(2,5-dimetyylifenoksi)-2,2-dimetyylipentaanihappo, jolla on seuraava rakennekaava:
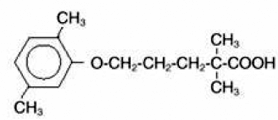
Empiirinen kaava on C15H22O3 ja molekyylipaino on 250,35; liukoisuus veteen ja happoon on 0,0019 % ja laimeaan emäkseen yli 1 %. Sulamispiste on 58–61 °C. Gemfibrotsiili on valkoinen kiinteä aine, joka on stabiili tavallisissa olosuhteissa.
INDIKAATIOT
LOPID (gemfibrotsiilitabletit, USP) on tarkoitettu ruokavalion lisähoitoon:
Alaryhmäanalyysissä Helsingin sydäntutkimuksen potilaista, joiden HDL-kolesteroliarvot olivat mediaaniarvoja suuremmat (yli 46,4 mg/dl), vakavien sepelvaltimotapahtumien ilmaantuvuus oli samanlainen gemfibrotsiili- ja lumelääkealaryhmissä (katso taulukko I).
Dyslipidemian alkuhoito on lipoproteiinipoikkeavuuden tyypille spesifinen ruokavaliohoito. Ylipaino ja liiallinen alkoholinkäyttö voivat olla tärkeitä hypertriglyseridemian tekijöitä, ja niitä tulee hoitaa ennen lääkehoitoa. Fyysinen harjoittelu voi olla tärkeä apuväline, ja se on yhdistetty HDL-kolesterolin nousuun. Hyperlipidemiaa aiheuttavat sairaudet, kuten kilpirauhasen vajaatoiminta tai diabetes mellitus, tulee etsiä ja hoitaa asianmukaisesti. Estrogeenihoitoon liittyy joskus plasman triglyseridien massiivisia nousuja, erityisesti potilailla, joilla on familiaalinen hypertriglyseridemia. Tällaisissa tapauksissa estrogeenihoidon keskeyttäminen voi poistaa hypertriglyseridemian spesifisen lääkehoidon tarpeen. Lääkkeiden käyttöä tulee harkita vain, kun on yritetty kohtuullisesti saada tyydyttäviä tuloksia ei-lääkemenetelmillä. Jos päätetään käyttää lääkkeitä, potilaalle tulee kertoa, ettei se vähennä ruokavalion noudattamisen merkitystä.
ANNOSTELU JA HALLINNOINTI
Suositeltu annos aikuisille on 1200 mg jaettuna kahteen annokseen 30 minuuttia ennen aamu- ja ilta-ateriaa (ks. KLIININEN FARMAKOLOGIA ).
MITEN TOIMITETAAN
LOPID (Tabletti 737), valkoisia, elliptisiä, kalvopäällysteisiä, jakouurteisia tabletteja, joista jokainen sisältää 600 mg gemfibrotsiilia, on saatavana seuraavasti:
NDC 0071-0737-20: 60 pullot NDC 0071-0737-30: 500 pullot
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F) [katso USP]. Suojaa valolta ja kosteudelta.
Jakelija Pfizer Inc:n Parke-Davis Division, NY, NY 10017. Tarkistettu: joulukuu 2020
SIVUVAIKUTUKSET
Helsinki Heart Study -tutkimuksen primaarisen ennaltaehkäisyn kaksoissokkokontrolloidussa vaiheessa 2046 potilasta sai LOPID-lääkitystä enintään viiden vuoden ajan. Tässä tutkimuksessa seuraavat haittavaikutukset olivat tilastollisesti yleisempiä LOPID-ryhmän koehenkilöillä:
Sappirakon leikkaus suoritettiin 0,9 %:lle LOPID 300 mg:n saaneista ja 0,5 %:lle lumelääkepotilaista primaarisessa ehkäisykomponentissa, mikä on 64 % ylimäärä, mikä ei eroa tilastollisesti klofibraattiryhmässä havaitusta sappirakkoleikkauksen ylimäärästä verrattuna WHO-tutkimuksen plaseboryhmään. . Sappirakon leikkaus tehtiin myös useammin LOPID-ryhmässä kuin lumeryhmässä (1,9 % vs. 0,3 %, p = 0,07) sekundaarisessa ehkäisykomponentissa. Tilastollisesti merkitsevä lisäys umpilisäkkeen poistossa gemfibrotsiiliryhmässä havaittiin myös sekundaarisessa ehkäisykomponentissa (6 gemfibrotsiililla vs. 0 lumelääkkeellä, p=0,014).
Hermostoon ja erityisiin aisteihin liittyvät haittavaikutukset olivat yleisempiä LOPID 300 mg -ryhmässä. Näitä olivat hypestesia, parestesiat ja makuhäiriöt. Muita haittavaikutuksia, jotka olivat yleisempiä LOPID 300 mg -hoitoryhmän koehenkilöillä, mutta joiden syy-yhteyttä ei voitu osoittaa, ovat kaihi, perifeerinen verisuonisairaus ja aivoverenvuoto.
Muiden tutkimusten perusteella näyttää todennäköiseltä, että LOPID 300mg liittyy syy-seuraus-yhteyteen LUSKI- JA LUUSTON OIREIDEN ilmaantumiseen (ks. VAROITUKSET ) sekä Epänormaalit maksan toimintatestit ja HEMATOLOGiset MUUTOKSET (katso VAROTOIMENPITEET ).
Muissa kontrolloiduissa kliinisissä 805 potilaan tutkimuksissa raportoituja virus- ja bakteeri-infektioita (flunssa, yskä, virtsatietulehdukset) oli yleisempi gemfibrotsiilihoitoa saaneilla potilailla. Muut gemfibrotsiilin yhteydessä raportoidut haittavaikutukset on lueteltu alla järjestelmäkohtaisesti. Nämä luokitellaan sen mukaan, onko syy-yhteys LOPID-hoitoon todennäköinen vai ei:
Muita raportoituja haittavaikutuksia ovat kolekystiitti ja sappikivitauti (katso VAROITUKSET ).
HUUMEIDEN VUOROVAIKUTUKSET
HMG-CoA-reduktaasin estäjät
LOPID 300 mg:n samanaikainen anto simvastatiinin kanssa on vasta-aiheista (ks. VASTA-AIHEET ja VAROITUKSET ). Vältä LOPIDin samanaikaista käyttöä rosuvastatiinin kanssa. Jos samanaikaista käyttöä ei voida välttää, rosuvastatiini aloitetaan annoksella 5 mg kerran vuorokaudessa. Rosuvastatiinin annos ei saa ylittää 10 mg kerran vuorokaudessa. Myopatian ja rabdomyolyysin riski kasvaa gemfibrotsiilin ja HMG-CoA-reduktaasin estäjän yhdistelmähoidolla. Myopatiaa tai rabdomyolyysiä akuutin munuaisten vajaatoiminnan kanssa tai ilman sitä on raportoitu jo kolmen viikon kuluttua yhdistelmähoidon aloittamisesta tai useiden kuukausien jälkeen (ks. VAROITUKSET ). Ei ole takeita siitä, että kreatiinikinaasin säännöllinen seuranta estää vakavan myopatian ja munuaisvaurion esiintymisen.
Antikoagulantit
VAROVAISUUTTA ON NOUDATTAA, KUN WARFARINIA ANNETAAN YHDESSÄ LOPIDIN KANSSA. VARFARIININ ANNOSTUSTA PITÄISI VÄHENTÄÄ, ETTÄ PROTROMBINIAIKA SÄILYTETÄÄN HALUTULLA TASOLLA VERENTOJEN KOMPLIKATIOIDEN ESTÄMISEKSI. TOIMIEN PROTROMBIIININ MÄÄRITTÄMINEN ON SUOSITELTAVAA, KUN ON LOPULLISESTI MÄÄRITTY, ETTÄ PROTROMBIINITASO ON VAKAUTUNUT.
CYP2C8-substraatit
Gemfibrotsiili on voimakas CYP2C8:n estäjä ja saattaa lisätä altistusta pääasiassa CYP2C8:n kautta metaboloituville lääkkeille (esim. dabrafenibi, entsalutamidi, loperamidi, montelukasti, paklitakseli, pioglitatsoni, rosiglitatsoni). Siksi pääasiassa CYP2C8-entsyymin kautta metaboloituvien lääkkeiden annosta voidaan joutua pienentämään, kun gemfibrotsiilia käytetään samanaikaisesti (ks. VAROITUKSET ).
Repaglinidi
Terveillä vapaaehtoisilla samanaikainen anto gemfibrotsiilin kanssa (600 mg kahdesti vuorokaudessa 3 päivän ajan) johti 8,1-kertaiseen (5,5-15,0-kertaiseen) korkeampaan repaglinidin AUC-arvoon ja 28,6-kertaiseen (vaihteluväli 18,5-80,1-kertaiseen) korkeampi repaglinidipitoisuus plasmassa 7 tuntia annoksen jälkeen. Samassa tutkimuksessa gemfibrotsiili (600 mg kahdesti päivässä 3 päivän ajan) + itrakonatsoli (200 mg aamulla ja 100 mg illalla päivänä 1, sitten 100 mg kahdesti päivässä päivänä 2-3) johti 19,4-( 12,9-24,7-kertainen) suurempi repaglinidin AUC ja 70,4-kertainen (vaihteluväli 42,9-119,2-kertainen) suurempi repaglinidin pitoisuus plasmassa 7 tuntia annoksen jälkeen. Lisäksi gemfibrotsiili yksinään tai gemfibrotsiili + itrakonatsoli pitkitti repaglinidin hypoglykeemisiä vaikutuksia. Gemfibrotsiilin ja repaglinidin samanaikainen käyttö lisää vakavan hypoglykemian riskiä ja on vasta-aiheinen (ks. VASTA-AIHEET ).
Dasabuvir
Gemfibrotsiilin ja dasabuvirin samanaikainen käyttö suurensi dasabuviirin AUC- ja Cmax-arvoja (suhteet: 11,3 ja 2,01) CYP2C8-estämisen vuoksi. Lisääntynyt dasabuviirialtistus voi lisätä QT-ajan pidentymisen riskiä, joten gemfibrotsiilin ja dasabuviirin samanaikainen käyttö on vasta-aiheista (ks. VASTA-AIHEET ).
Selexipag
Gemfibrotsiilin ja seleksipagin samanaikainen käyttö kaksinkertaisti altistuksen seleksipagille ja suurensi altistuksen aktiiviselle metaboliitille noin 11-kertaiseksi. Gemfibrotsiilin ja seleksipagin samanaikainen käyttö on vasta-aiheista (ks VASTA-AIHEET ).
Enzalutamidi
Terveillä vapaaehtoisilla, joille annettiin 160 mg:n kerta-annos entsalutamidia sen jälkeen, kun gemfibrotsiili oli 600 mg kahdesti vuorokaudessa, entsalutamidin ja aktiivisen metaboliitin (N-desmetyylientsalutamidi) AUC nousi 2,2-kertaiseksi ja vastaava Cmax pieneni 16 %. Entsalutamidille altistuminen voi lisätä kohtausten riskiä. Jos samanaikainen käyttö katsotaan tarpeelliseksi, enzalutamidin annosta tulee pienentää (ks VAROITUKSET ).
OATP1B1 Substraatit
Gemfibrotsiili on OATP1B1-kuljettajan estäjä ja saattaa lisätä altistusta lääkkeille, jotka ovat OATP1B1:n substraatteja (esim. atrasentaani, atorvastatiini, bosentaani, etsetimibi, fluvastatiini, glyburidi, SN-38 [irinotekaanin aktiivinen metaboliitti], rosuvastatiini, pitavastatiini, rifampinvastatiini , valsartaani, olmesartaani). Siksi OATP1B1:n substraattien lääkkeiden annostusta saatetaan joutua pienentämään, kun gemfibrotsiilia käytetään samanaikaisesti (ks. VAROITUKSET ). Gemfibrotsiilin yhdistelmähoito simvastatiinin tai repaglinidin kanssa, jotka ovat OATP1B1-substraatteja, on vasta-aiheista (ks. VASTA-AIHEET ).
CYP-entsyymien, UGTA-entsyymien ja OATP1B1-kuljettajan in vitro -tutkimukset
In vitro -tutkimukset ovat osoittaneet, että gemfibrotsiili on CYP1A2:n, CYP2C8:n, CYP2C9:n, CYP2C19:n, OATP1B1:n ja UDP-glukuronosyylitransferaasin (UGT) 1A1 ja 1A3 estäjä (ks. VAROITUKSET ).
Sappihappoa sitovat hartsit
Gemfibrotsiilin AUC pieneni 30 %, kun gemfibrotsiilia (600 mg) annettiin samanaikaisesti hartsiraelääkkeiden, kuten kolestipolin (5 g) kanssa. Lääkkeiden antamista vähintään kahden tunnin välein suositellaan, koska gemfibrotsiilialtistus ei vaikuttanut merkittävästi, kun se annettiin kahden tunnin erolla kolestipolista.
Kolkisiini
Myopatiaa, mukaan lukien rabdomyolyysi, on raportoitu, kun kolkisiinia on annettu kroonisesti terapeuttisina annoksina. LOPIDin samanaikainen käyttö voi voimistaa myopatian kehittymistä. Potilaat, joilla on munuaisten vajaatoiminta ja iäkkäät potilaat, ovat suurentunut riski. Varovaisuutta on noudatettava määrättäessä LOPIDia kolkisiinin kanssa, erityisesti iäkkäille potilaille tai potilaille, joilla on munuaisten vajaatoiminta.
VAROITUKSET
Helsinki Heart Study -tutkimuksen rajoitetumman koon vuoksi havaittu ero mistä tahansa syystä johtuvassa kuolleisuudessa LOPID 300 mg:n ja lumelääkeryhmän välillä ei eroa tilastollisesti merkitsevästi klofibraattiryhmän 29 prosentin ylikuolleisuudesta erillisessä WHO-tutkimuksessa yhdeksän vuoden seuranta (ks KLIININEN FARMAKOLOGIA ). Ei-sepelvaltimotautiin liittyvä kuolleisuus osoitti ylimääräistä ryhmässä, joka alun perin satunnaistettiin LOPID-ryhmään, johtuen ensisijaisesti avoimen laajennuksen aikana havaittuista syöpäkuolemista.
Helsinki Heart Study -tutkimuksen viisivuotisen primaarisen ehkäisyn osan aikana kuolleisuus mistä tahansa syystä oli 44 (2,2 %) LOPID 300 mg -ryhmässä ja 43 (2,1 %) lumeryhmässä; mukaan lukien 3,5 vuoden seurantajakso kokeen päättymisestä, kumulatiivinen kuolleisuus mistä tahansa syystä oli 101 (4,9 %) LOPID-ryhmässä ja 83 (4,1 %) ryhmässä, joka alun perin satunnaistettiin lumelääkkeeseen (riskisuhde 1:20 puolesta lumelääkkeestä). Helsinki Heart Study -tutkimuksen rajoitetumman koon vuoksi havaittu ero mistä tahansa syystä johtuvassa kuolleisuudesta LOPID 300 mg:n ja lumelääkeryhmän välillä vuonna 5 tai vuonna 8,5 ei eroa tilastollisesti merkitsevästi tutkimuksessa raportoidusta 29 prosentin ylikuolleisuudesta. klofibraattiryhmässä erillisessä WHO-tutkimuksessa yhdeksän vuoden seurannassa. Ei-sepelvaltimotautiin liittyvä kuolleisuus osoitti ylimääräistä ryhmässä, joka alun perin satunnaistettiin LOPID 300 mg:aan 8,5 vuoden seurannassa (65 LOPID 300 mg vs. 45 lumelääkettä ei-sepelvaltimotautikuolemaa).
Tutkimuksen aikana ja 3,5 vuoden aikana tutkimuksen päättymisen jälkeen havaitun syövän (pois lukien tyvisolusyöpä) ilmaantuvuus oli 51 (2,5 %) molemmissa alun perin satunnaistetuissa ryhmissä. Lisäksi alun perin LOPID 300 mg:aan satunnaistetussa ryhmässä oli 16 tyvisolusyöpää ja alun perin lumelääkkeeseen satunnaistetussa ryhmässä 9 (p=0,22). Alun perin LOPID 300 mg:aan satunnaistetussa ryhmässä oli 30 (1,5 %) syöpää aiheuttavaa kuolemaa ja 18 (0,9 %) ryhmässä, joka alun perin satunnaistettiin lumelääkkeeseen (p = 0,11). Haittatulokset, mukaan lukien sepelvaltimotapahtumat, olivat korkeampia gemfibrotsiilipotilailla vastaavassa tutkimuksessa miehillä, joilla on ollut tai epäillään sepelvaltimotautia Helsingin sydäntutkimuksen sekundaarisen ehkäisyn osa-alueella (ks. KLIININEN FARMAKOLOGIA ).
Rotilla tehtiin myös vertaileva karsinogeenisuustutkimus, jossa verrattiin kolmea tämän luokan lääkettä: fenofibraattia (10 ja 60 mg/kg; 0,3 ja 1,6 kertaa ihmisen annos), klofibraattia (400 mg/kg; 1,6 kertaa ihmisen annos). ja gemfibrotsiili (250 mg/kg; 1,7 kertaa ihmisen annos). Haiman akinaarien adenoomat lisääntyivät miehillä ja naisilla, jotka saivat fenofibraattia; hepatosellulaarinen karsinooma ja haiman akinaarinen adenoomat lisääntyivät miehillä ja maksan neoplastiset kyhmyt naisilla, joita hoidettiin klofibraatilla; maksan neoplastiset kyhmyt lisääntyivät klofibraatilla hoidetuilla miehillä ja naisilla; maksan neoplastiset kyhmyt lisääntyivät gemfibrotsiililla hoidetuilla miehillä ja naisilla, kun taas kivesten interstitiaalisolukasvaimet (Leydig-solut) lisääntyivät miehillä kaikilla kolmella lääkkeellä.

VAROTOIMENPITEET
Alkuhoito
Laboratoriotutkimuksia tulisi tehdä sen varmistamiseksi, että lipiditasot ovat jatkuvasti epänormaaleja. Ennen LOPID-hoidon aloittamista seerumin lipidejä on pyrittävä kontrolloimaan asianmukaisella ruokavaliolla, liikunnalla, painonpudotuksella liikalihavilla potilailla ja kaikkien lääketieteellisten ongelmien, kuten diabeteksen ja kilpirauhasen vajaatoiminnan, hallintaan, jotka vaikuttavat lipidien poikkeavuuksiin.
Jatkuu terapiaa
Seerumin lipidit on määritettävä säännöllisesti ja lääke on lopetettava, jos lipidivaste on riittämätön kolmen kuukauden hoidon jälkeen.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikaisia tutkimuksia on tehty rotilla 0,2- ja 1,3-kertaisella altistuksella ihmisen altistukseen verrattuna (AUC:n perusteella). Hyvänlaatuisten maksakyhmyjen ja maksakarsinoomien ilmaantuvuus lisääntyi merkittävästi suuriannoksisilla urosrotilla. Maksasyöpien ilmaantuvuus lisääntyi myös pieniannoksisilla miehillä, mutta kasvu ei ollut tilastollisesti merkitsevä (p=0,1). Urosrotilla esiintyi annoksesta riippuvaa ja tilastollisesti merkitsevää hyvänlaatuisten Leydig-solukasvainten lisääntymistä. Suurempia annoksia saaneilla naarasrotilla oli merkittävä lisääntynyt hyvänlaatuisten ja pahanlaatuisten maksakasvaimien yhdistetty ilmaantuvuus.
Pitkäaikaisia tutkimuksia on tehty hiirillä 0,1- ja 0,7-kertaisella altistuksella ihmisen altistukseen verrattuna (AUC:n perusteella). Maksakasvainten esiintyvyyden osalta ei ollut tilastollisesti merkitseviä eroja verrokkeista, mutta testatut annokset olivat pienempiä kuin ne, jotka osoitettiin syöpää aiheuttaviksi muiden fibraattien kanssa.
Elektronimikroskopiatutkimukset ovat osoittaneet maksan peroksisomien proliferaatiota LOPID-annon jälkeen urosrotille. Ihmisillä ei ole tehty riittävää tutkimusta peroksisomien lisääntymisen testaamiseksi, mutta muutoksia peroksisomien morfologiassa on havaittu. Peroksisomien proliferaatiota on osoitettu tapahtuvan ihmisillä jommallakummalla kahdesta muusta fibraattiluokkaan kuuluvasta lääkkeestä, kun maksabiopsioita verrattiin ennen hoitoa ja sen jälkeen samalla yksilöllä.
Noin kaksinkertainen ihmisannos (pinta-alan perusteella) annettuna urosrotille 10 viikon ajan johti annoksesta riippuvaiseen hedelmällisyyden laskuun. Myöhemmät tutkimukset osoittivat, että tämä vaikutus kääntyi noin kahdeksan viikon lääkkeettömän jakson jälkeen, eikä se välintynyt jälkeläisiin.
Raskaus
LOPID 300 mg:n on osoitettu aiheuttavan haittavaikutuksia rotilla ja kaniineilla annoksilla, jotka ovat 0,5–3 kertaa ihmisen annos (pinta-alan perusteella). Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. LOPID 300 mg:aa tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
LOPID 300 mg:n antaminen naarasrotille kaksinkertaisena ihmisen annoksena (pinta-alan perusteella) ennen raskautta ja sen aikana aiheutti annoksesta riippuvan hedelmöittymisnopeuden laskun, kuolleena syntyneiden lasten määrän lisääntymisen ja pienten poikasten painon laskun imetyksen aikana. Myös annoksesta riippuvaisia lisääntyneitä luuston vaihteluita esiintyi. Anoftalmiaa esiintyi, mutta harvoin.
0,6- ja 2-kertainen ihmisannos (pinta-alan perusteella) LOPID-annoksen antaminen naarasrotille tiineyspäivästä 15 vieroittamiseen aiheutti annoksesta riippuvaisen syntymäpainon laskun ja poikasten kasvun hidastumisen imetyksen aikana.
300 mg:n LOPID 300 mg:n ihmisannos 1- ja 3-kertainen (pinta-alaan perustuen) antaminen naaraskaneille organogeneesin aikana aiheutti annoksesta riippuvan pentueen koon pienenemisen ja suurella annoksella parietaalisen luuston vaihteluiden esiintyvyyden lisääntymistä.
Imettävät äidit
Ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon ja koska LOPID:lle on eläinkokeissa todettu tuumorigeenisyyttä, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkehoito ottaen huomioon lääkkeen merkitys äidille.
Hematologiset muutokset
Lievää hemoglobiinin, hematokriitin ja valkosolujen laskua on havaittu satunnaisilla potilailla LOPID-hoidon aloittamisen jälkeen. Nämä tasot kuitenkin vakiintuvat pitkäaikaisen annon aikana. Harvoin on raportoitu vaikeaa anemiaa, leukopeniaa, trombosytopeniaa ja luuytimen hypoplasiaa.
Siksi säännöllistä verenkuvaa suositellaan LOPID 300 mg:n annon ensimmäisten 12 kuukauden aikana.
Maksan toiminta
Maksan toimintakokeiden poikkeavuuksia on havaittu ajoittain LOPID-hoidon aikana, mukaan lukien ASAT-, ALAT-, LDH-, bilirubiini- ja alkalisen fosfataasin kohoaminen. Nämä ovat yleensä palautuvia, kun LOPID 300 mg -hoito lopetetaan. Siksi säännöllisiä maksan toimintatutkimuksia suositellaan ja LOPID 300 mg -hoito tulee lopettaa, jos poikkeavuudet jatkuvat.
Munuaisten toiminta
Munuaisten vajaatoiminnan pahenemista on raportoitu LOPID-hoidon lisäämisen jälkeen potilailla, joiden plasman kreatiniinin lähtötaso on > 2,0 mg/dl. Tällaisilla potilailla vaihtoehtoisen hoidon käyttöä tulee harkita pienemmän LOPID-annoksen haittojen ja hyötyjen suhteen.
Käyttö lapsille
Turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
YLIANNOSTUS
LOPIDin yliannostustapauksia on raportoitu. Yhdessä tapauksessa 7-vuotias lapsi toipui nauttiessaan jopa 9 grammaa LOPIDia. Yliannostuksen yhteydessä raportoituja oireita olivat vatsakrampit, epänormaalit maksan toimintakokeet, ripuli, kohonnut CPK, nivel- ja lihaskipu, pahoinvointi ja oksentelu. Yliannostuksen ilmetessä tulee ryhtyä oireenmukaisiin tukitoimenpiteisiin.
VASTA-AIHEET
KLIININEN FARMAKOLOGIA
LOPID on lipidejä säätelevä aine, joka alentaa seerumin triglyseridejä ja erittäin alhaisen tiheyden lipoproteiinin (VLDL) kolesterolia sekä lisää HDL-kolesterolia. Vaikka kokonais- ja matalatiheyksisten lipoproteiinien (LDL) kolesterolin vähäistä laskua voidaan havaita LOPID 300 mg -hoidolla, potilaiden, joilla on tyypin IV hyperlipoproteinemiasta johtuva kohonnut triglyseridipitoisuus, hoito johtaa usein LDL-kolesterolin nousuun. LOPID 300 mg -hoito vaikuttaa yleensä minimaalisesti LDL-kolesterolitasoihin tyypin IIb potilailla, joilla on kohonnut sekä seerumin LDL-kolesteroli että triglyseridit; kuitenkin LOPID 300mg yleensä nostaa HDL-kolesterolia merkittävästi tässä ryhmässä. LOPID 300mg lisää HDL-alafraktioiden HDL2- ja HDL3-alafraktioiden sekä apolipoproteiinien AI- ja AII-tasoja. Epidemiologiset tutkimukset ovat osoittaneet, että sekä alhainen HDL-kolesteroli että korkea LDL-kolesteroli ovat riippumattomia sepelvaltimotaudin riskitekijöitä.
Helsinki Heart Study -tutkimuksen primaarisessa ehkäisyosassa, jossa tutkittiin 4081 40–55-vuotiasta miespotilasta satunnaistetulla, kaksoissokkoutetulla, lumekontrolloidulla tavalla, LOPID 300 mg -hoitoon liittyi plasman kokonaistriglyseridien merkittävää laskua. ja suuren tiheyden lipoproteiinikolesterolin merkittävä nousu. Kohtalaista plasman kokonaiskolesterolin ja matalatiheyksisen lipoproteiinikolesterolin alenemista havaittiin LOPID-hoitoryhmässä kokonaisuudessaan, mutta lipidivaste oli heterogeeninen, erityisesti eri Fredrickson-tyyppien välillä. Tutkimukseen osallistui henkilöitä, joiden seerumin ei-HDL-kolesteroli oli yli 200 mg/dl ja joilla ei ollut aikaisempaa sepelvaltimotautia. Viiden vuoden tutkimusjakson aikana LOPID 300 mg -ryhmässä vakavien sepelvaltimotapahtumien (äkilliset sydänkuolemat sekä kuolemaan johtaneet ja muut kuin kuolemaan johtaneet sydäninfarktit) määrä väheni 1,4 % absoluuttisesti (34 % suhteellisesti) lumelääkkeeseen verrattuna, p = 0,04 (ks. Taulukko I). Ei-kuolemaan johtaneiden sydäninfarktien suhteellinen määrä väheni 37 % lumelääkkeeseen verrattuna, mikä vastaa hoitoon liittyvää eroa, joka on 13,1 tapahtumaa tuhatta henkilöä kohden. Mistä tahansa syystä kuolleita oli tutkimuksen kaksoissokkoutetussa osassa 44 (2,2 %) LOPID 300 mg:n satunnaistusryhmässä ja 43 (2,1 %) lumeryhmässä.
Fredrickson-tyypeistä Helsinki Heart Study -tutkimuksen primaarisen ehkäisykomponentin 5-vuotisen kaksoissokkotutkimuksen aikana vakavien sepelvaltimotapahtumien ilmaantuvuus väheni eniten tyypin IIb potilailla, joilla oli sekä LDL-kolesteroli- että kokonaisplasman koholla. triglyseridit. Tällä tyypin IIb gemfibrotsiiliryhmän potilaiden alaryhmällä oli alhaisempi keskimääräinen HDL-kolesterolitaso lähtötasolla kuin tyypin IIa alaryhmässä, jossa LDL-kolesteroli ja normaalit plasman triglyseridiarvot kohosivat. HDL-kolesterolin keskimääräinen nousu tyypin IIb potilailla tässä tutkimuksessa oli 12,6 % lumelääkkeeseen verrattuna. LDL-kolesterolin keskimääräinen muutos tyypin IIb potilailla oli –4,1 % LOPID-potilailla verrattuna 3,9 prosentin nousuun lumelääkealaryhmässä. Helsingin sydäntutkimuksen tyypin IIb koehenkilöillä oli gemfibrotsiiliryhmässä viiden vuoden aikana 26 vähemmän sepelvaltimotapahtumaa tuhatta henkilöä kohden lumelääkkeeseen verrattuna. Ero sepelvaltimotapahtumissa oli huomattavasti suurempi LOPID 300 mg:n ja lumelääkkeen välillä potilaiden alaryhmässä, joiden triadi LDL-kolesteroli > 175 mg/dl (> 4,5 mmol), triglyseridit > 200 mg/dl (> 2,2 mmol) ja HDL -kolesteroli
Lisätietoja on saatavilla 3,5 vuoden (8,5 vuotta kumulatiivisesti) seurannasta kaikista Helsinki Heart Study -tutkimukseen osallistuneista koehenkilöistä. Helsinki Heart Study -tutkimuksen päätyttyä koehenkilöt saattoivat valita LOPID-hoidon aloittamisen, lopettamisen tai jatkamisen; tietämättä omia lipidiarvojaan tai kaksoissokkohoitoa, 60 % alun perin lumelääkkeeseen satunnaistetuista potilaista aloitti LOPID 300 mg:n hoidon ja 60 % alun perin satunnaistetuista potilaista jatkoi lääkitystä. Noin 6,5 vuoden kuluttua satunnaistamisen jälkeen kaikille potilaille ilmoitettiin heidän alkuperäisestä hoitoryhmästään ja lipidiarvoistaan viiden vuoden kaksoissokkohoidon aikana. LOPID-hoidon tilassa tehtyjen lisämuutosten jälkeen 61 % potilaista alun perin satunnaistettiin LOPID-ryhmään, joka käytti lääkettä; alun perin lumelääkkeeseen satunnaistetussa ryhmässä 65 % käytti LOPIDia. Taulukossa II on esitetty yksityiskohtaisesti avoimen seurantajakson aikana esiintyvien tapahtumien määrä tuhatta kohden.
Kumulatiivinen kuolleisuus 8,5 vuoden ajalta osoitti 20 %:n suhteellista enemmän kuolemia ryhmässä, joka oli alun perin satunnaistettu LOPID 300 mg:n plaseboryhmään verrattuna, ja sydäntapahtumien suhteellinen lasku 20 %:lla alun perin satunnaistettuun LOPID 300 mg:n plaseboryhmään verrattuna. (katso taulukko III). Tämä alun perin satunnaistetun "hoitoaikeisen" populaation analyysi jättää huomiotta hoidon vaihtamisen mahdolliset monimutkaiset vaikutukset avoimen vaiheen aikana. Vaarasuhteiden säätäminen, kun otetaan huomioon avoimen hoidon tila 6,5 - 8,5, voisi muuttaa raportoituja kuolleisuuden vaarasuhteita kohti yhtenäisyyttä.
Ei ole selvää, missä määrin Helsinki Heart Study -tutkimuksen primaarisen ehkäisykomponentin löydöksiä voidaan ekstrapoloida muihin dyslipideemisen väestöryhmiin, joita ei ole tutkittu (kuten naisiin, nuorempiin tai vanhempiin miehiin tai niihin, joilla on vain HDL:ään rajoittuvia lipidipoikkeavuuksia -kolesteroli) tai muihin lipidejä muuttaviin lääkkeisiin.
Helsinki Heart Study -tutkimuksen sekundaarinen ehkäisyosa suoritettiin viiden vuoden ajan rinnakkain ja samoissa keskuksissa Suomessa 628:lla keski-ikäisellä miehellä, jotka jäivät Helsingin sydäntutkimuksen primaariprevention osa-alueen ulkopuolelle angina pectoriksen, sydäninfarktin, tai selittämättömiä EKG-muutoksia. Tutkimuksen ensisijainen tehokkuuspäätetapahtuma oli sydäntapahtumat (kuolemaan johtaneiden ja ei-kuolemaan johtaneiden sydäninfarktien ja äkillisten sydänkuolemien summa). Sydäntapahtumien riskisuhde (LOPID:plasebo) oli 1,47 (95 %:n luottamusrajat 0,88–2,48, p=0,14). LOPID 300 mg -ryhmän 35 potilaasta, joilla oli sydänkohtauksia, 12 potilasta kärsi tapahtumista tutkimuksen lopettamisen jälkeen. Plaseboryhmän 24 potilaasta, joilla oli sydäntapahtumia, 4 potilasta kärsi tapahtumista tutkimuksen lopettamisen jälkeen. LOPID-ryhmässä todettiin 17 sydänkuolemaa ja lumeryhmässä 8 (riskisuhde 2,18; 95 %:n luottamusrajat 0,94–5,05, p=0,06). Kymmenen näistä kuolemista LOPID-ryhmässä ja 3 lumeryhmässä tapahtui hoidon lopettamisen jälkeen. Tässä tutkimuksessa potilailla, joilla tiedetään tai epäillään sepelvaltimotautia, LOPID 300 mg -hoidosta ei havaittu mitään hyötyä sydäntapahtumien tai sydänkuolemien vähentämisessä. Näin ollen LOPID 300 mg:sta on ollut hyötyä vain valikoiduilla dyslipideemisilla potilailla, joilla ei ole epäilty tai todettu sepelvaltimotauti. Jopa potilailla, joilla on sepelvaltimotauti ja kohonnut LDL-kolesteroli, kohonneet triglyseridit ja alhainen HDL-kolesteroli, LOPIDin mahdollista vaikutusta sepelvaltimotapahtumiin ei ole tutkittu riittävästi.
Sepelvaltimotautiprojektin aikana ei havaittu tehoa potilailla, joilla oli todettu sepelvaltimotauti kemiallisesti ja farmakologisesti samankaltaisella lääkkeellä, klofibraatilla. Coronary Drug Project oli kuusi vuotta kestänyt satunnaistettu kaksoissokkotutkimus, johon osallistui 1 000 klofibraattia, 1 000 nikotiinihappoa ja 3 000 lumepotilasta, joilla oli tunnettu sepelvaltimotauti. Kliinisesti ja tilastollisesti merkitsevä väheneminen sydäninfarktien määrässä havaittiin samanaikaisesti nikotiinihappoa saaneessa ryhmässä lumelääkkeeseen verrattuna; klofibraatilla ei havaittu vähenemistä.
Gemfibrotsiilin vaikutusmekanismia ei ole tarkasti selvitetty. Ihmisillä LOPID 300mg:n on osoitettu estävän perifeeristä lipolyysiä ja vähentävän vapaiden rasvahappojen erittymistä maksasta, mikä vähentää maksan triglyseridien tuotantoa. LOPID 300mg estää synteesiä ja lisää VLDL-kantaja-apolipoproteiini B:n puhdistumaa, mikä johtaa VLDL-tuotannon vähenemiseen.
Eläintutkimukset viittaavat siihen, että gemfibrotsiili saattaa HDL-kolesterolin nostamisen lisäksi vähentää pitkäketjuisten rasvahappojen sitoutumista vasta muodostuneisiin triglyserideihin, nopeuttaa kiertoa ja kolesterolin poistumista maksasta sekä lisätä kolesterolin erittymistä ulosteeseen. LOPID 300 mg imeytyy hyvin ruoansulatuskanavasta suun kautta otetun annon jälkeen. Plasman huippupitoisuudet saavutetaan 1–2 tunnissa ja puoliintumisaika plasmassa on 1,5 tuntia toistuvien annosten jälkeen.
Gemfibrotsiili imeytyy täysin oraalisen LOPID 300 mg -tablettien jälkeen ja saavuttaa huippupitoisuudet plasmassa 1-2 tunnin kuluttua annostelusta. Gemfibrotsiilin farmakokinetiikkaan vaikuttaa aterioiden ajoitus suhteessa annostusaikaan. Yhdessä tutkimuksessa (viite 4) sekä lääkkeen imeytymisnopeus että laajuus lisääntyivät merkittävästi, kun se annettiin 0,5 tuntia ennen ateriaa. Keskimääräinen AUC pieneni 14–44 %, kun LOPID annettiin aterioiden jälkeen verrattuna 0,5 tuntiin ennen ateriaa. Myöhemmässä tutkimuksessa LOPID 300 mg:n imeytymisnopeus oli suurin, kun se annettiin 0,5 tuntia ennen ateriaa ja Cmax oli 50–60 % suurempi kuin aterioiden tai paaston yhteydessä. Tässä tutkimuksessa ei ollut merkittäviä vaikutuksia annoksen ajoituksen AUC-arvoon suhteessa aterioihin (ks ANNOSTELU JA HALLINNOINTI ).
LOPID hapettuu pääasiassa renkaan metyyliryhmässä muodostaen peräkkäin hydroksimetyylin ja karboksyylimetaboliitin. Noin 70 prosenttia ihmiselle annetusta annoksesta erittyy virtsaan, enimmäkseen glukuronidikonjugaattina, ja alle 2 % erittyy muuttumattomana gemfibrotsiilina. Kuusi prosenttia annoksesta erittyy ulosteisiin. Gemfibrotsiili sitoutuu voimakkaasti plasman proteiineihin ja on mahdollista syrjäyttää yhteisvaikutuksia muiden lääkkeiden kanssa (ks. VAROTOIMENPITEET ).
POTILASTIEDOT
Tietoja ei ole annettu. Katso VAROITUKSET ja VAROTOIMENPITEET osiot.
