Zetia 10mg Ezetimibe Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zetia on ja miten sitä käytetään?
Zetia on reseptilääke, jota käytetään korkean kolesterolin oireiden hoitoon ja kolesterolin alentamiseen. Zetiaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Zetia kuuluu lääkeluokkaan, jota kutsutaan lipidejä alentaviksi aineiksi, 2-atsetidinoniksi.
Ei tiedetä, onko Zetia 10mg turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitkä ovat Zetian mahdolliset sivuvaikutukset?
Zetia voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- lihaskipu,
- lihasten arkuus tai heikkous,
- kuume,
- epätavallinen väsymys ja
- tumma virtsa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zetia 10mg:n yleisimmät sivuvaikutukset ovat:
- lihas- tai nivelkipu,
- tukkoinen nenä,
- poskiontelokipu,
- kipeä kurkku,
- ripuli ja
- kipu kädessä tai jalassa
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikki Zetian mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
ZETIA (etetimibi) kuuluu lipidejä alentavien yhdisteiden luokkaan, joka estää selektiivisesti kolesterolin ja vastaavien fytosterolien imeytymistä suolistosta. Etsetimibin kemiallinen nimi on 1-(4-fluorifenyyli)-3(R)-[3-(4-fluorifenyyli)-3(S)-hydroksipropyyli]-4(S)-(4-hydroksifenyyli)-2-atsetidinoni . Empiirinen kaava on C24H21F2NO3. Sen molekyylipaino on 409,4 ja sen rakennekaava on:
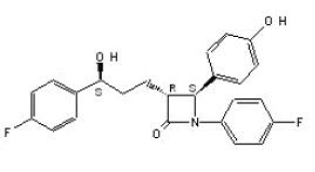
Etsetimibi on valkoinen, kiteinen jauhe, joka liukenee vapaasti tai hyvin etanoliin, metanoliin ja asetoniin ja on käytännössä liukenematon veteen. Etsetimibin sulamispiste on noin 163 °C ja se on stabiili ympäristön lämpötilassa. ZETIA 10mg on saatavana tablettina suun kautta annettavaksi, joka sisältää 10 mg etsetimibia ja seuraavia inaktiivisia aineosia: kroskarmelloosinatrium NF, laktoosimonohydraatti NF, magnesiumstearaatti NF, mikrokiteinen selluloosa NF, povidoni USP ja natriumlauryylisulfaatti NF.
INDIKAATIOT
Hoidon lipidejä muuttavilla aineilla tulisi olla vain yksi osa useiden riskitekijöiden interventiota henkilöillä, joilla on merkittävästi lisääntynyt riski sairastua hyperkolesterolemian vuoksi ateroskleroottiseen verisuonisairauteen. Lääkehoitoa suositellaan ruokavalion lisänä, kun tyydyttyneitä rasvoja ja kolesterolia sisältävän ruokavalion ja muiden ei-farmakologisten toimenpiteiden vaste yksinään on ollut riittämätön.
Primaarinen hyperlipidemia
Monoterapia
Pelkästään annettu ZETIA® on tarkoitettu ruokavalion lisähoitona kohonneen kokonaiskolesterolin (kokonaiskolesterolin), matalatiheyksisen lipoproteiinikolesterolin (LDL-C), apolipoproteiini B:n (Apo B) ja ei-korkean tiheyden lipoproteiinikolesterolin alentamiseksi. (ei-HDL-C) potilailla, joilla on primaarinen (heterotsygoottinen familiaalinen ja ei-familiaalinen) hyperlipidemia.
Yhdistelmähoito HMG-CoA-reduktaasin estäjillä (statiineilla)
ZETIA 10 mg, annettuna yhdessä 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n (HMG-CoA) reduktaasin estäjän (statiinin) kanssa, on tarkoitettu ruokavalion lisähoitona kohonneen kokonaiskolesterolin, LDL-kolesterolin ja Apo-arvon alentamiseksi. B ja ei-HDL-C potilailla, joilla on primaarinen (heterotsygoottinen familiaalinen ja ei-familiaalinen) hyperlipidemia.
Yhdistelmähoito fenofibraatilla
ZETIA 10 mg, annettuna yhdessä fenofibraatin kanssa, on tarkoitettu ruokavalion lisähoitona alentamaan kohonnutta kokonaiskolesteroli-, LDL-kolesteroli-, Apo B- ja ei-HDL-kolesteroliarvoja aikuispotilailla, joilla on sekahyperlipidemia.
Homotsygoottinen familiaalinen hyperkolesterolemia (HoFH)
ZETIA 10 mg:n ja atorvastatiinin tai simvastatiinin yhdistelmä on tarkoitettu kohonneiden kokonaiskolesteroli- ja LDL-kolesteroliarvojen alentamiseen HoFH-potilailla, lisänä muihin lipidejä alentaviin hoitoihin (esim. LDL-afereesi) tai jos tällaisia hoitoja ei ole saatavilla. .
Homotsygoottinen Sitosterolemia
ZETIA 10mg on tarkoitettu ruokavalion lisähoitona kohonneiden sitosteroli- ja kampesterolipitoisuuksien vähentämiseen potilailla, joilla on homotsygoottinen familiaalinen sitosterolemia.
Käyttörajoitukset
ZETIA:n vaikutusta sydän- ja verisuonisairauksiin ja kuolleisuuteen ei ole määritetty.
ZETIAa ei ole tutkittu Fredricksonin tyypin I, III, IV ja V dyslipidemioissa.
ANNOSTELU JA HALLINNOINTI
Yleiset annostelutiedot
Suositeltu ZETIA-annos on 10 mg kerran vuorokaudessa.
ZETIA 10 mg voidaan ottaa ruoan kanssa tai ilman.
Samanaikainen lipidejä alentava hoito
ZETIA 10 mg voidaan antaa statiinin (potilaille, joilla on primaarinen hyperlipidemia) tai fenofibraatin kanssa (potilaille, joilla on sekamuotoinen hyperlipidemia) lisävaikutuksen lisäämiseksi. Mukavuussyistä ZETIAn vuorokausiannos voidaan ottaa samaan aikaan statiinin tai fenofibraatin kanssa kunkin lääkkeen annostussuositusten mukaisesti.
Coadminis sappihappoa sitovien aineiden kanssa
ZETIA-annos tulee tapahtua joko ≥ 2 tuntia ennen tai ≥ 4 tuntia sappihappoa sitovan aineen annon jälkeen [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Potilaat, joilla on maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen potilailla, joilla on lievä maksan vajaatoiminta [ks VAROITUKSET JA VAROTOIMET ].
Potilaat, joilla on munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta [katso KLIININEN FARMAKOLOGIA ]. Kun simvastatiinia annetaan potilaille, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta (arvioitu glomerulussuodatusnopeus Käyttö tietyissä populaatioissa ].
Geriatriset potilaat
Annoksen muuttaminen ei ole tarpeen geriatrisilla potilailla [katso KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
10 mg:n tabletit ovat valkoisia tai luonnonvalkoisia, kapselin muotoisia tabletteja, joiden toisella puolella on merkintä "414".
Varastointi ja käsittely
Nro 3861 - Tabletit ZETIA, 10 mg , ovat valkoisia tai luonnonvalkoisia, kapselin muotoisia tabletteja, joiden toisella puolella on merkintä "414". Ne toimitetaan seuraavasti:
NDC 66582-414-31 pulloa 30 kappaletta NDC 66582-414-54 90 pulloa NDC 66582-414-74 500 pulloa NDC 66582-414-76 pulloa 5000 NDC 66582-414-28 100 yksikköannospakkauksia.
Varastointi
Säilytä 25°C (77°F); sallitaan 15-30°C (59-86°F). [Katso USP-ohjattu huonelämpötila .] Suojaa kosteudelta.
Merck Sharp & Dohme Corp., MERCK & CO., INC:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: elokuu 2013
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään tarkemmin etiketin muissa osissa:
- Maksaentsyymihäiriöt [katso VAROITUKSET JA VAROTOIMET ]
- Rabdomyolyysi ja myopatia [katso VAROITUKSET JA VAROTOIMET ]
Monoterapiatutkimukset
ZETIA 10 mg kontrolloitujen kliinisten tutkimusten tietokannassa (plasebokontrolloitu) 2 396 potilaasta, joiden hoidon kesto oli mediaani 12 viikkoa (vaihteluväli 0–39 viikkoa), 3,3 % ZETIA 10 mg:n potilaista ja 2,9 % lumelääkettä saaneista potilaista keskeytti haittavaikutusten vuoksi. reaktiot. Yleisimmät haittavaikutukset potilaiden ryhmässä, joita hoidettiin ZETIA 10 mg:lla, jotka johtivat hoidon keskeyttämiseen ja joita esiintyi lumelääkettä enemmän:
- Nivelkipu (0,3 %)
- Huimaus (0,2 %)
- Gamma-glutamyylitransferaasi lisääntyi (0,2 %)
Yleisimmin raportoidut haittavaikutukset (esiintyvyys ≥ 2 % ja suurempi kuin lumelääke) ZETIA-monoterapiakontrolloidussa kliinisessä 2396 potilaan tutkimustietokannassa olivat: ylempien hengitysteiden infektio (4,3 %), ripuli (4,1 %), nivelkipu (3,0 %), poskiontelotulehdus (2,8 %) ja raajojen kipu (2,7 %).
Statiinin yhteiskäyttötutkimukset
ZETIA + statiinikontrolloitujen kliinisten tutkimusten tietokannassa, johon sisältyi 11 308 potilasta, joiden keskimääräinen hoidon kesto oli 8 viikkoa (vaihteluväli 0–112 viikkoa), 4,0 % ZETIA + statiinia saaneista potilaista ja 3,3 % pelkkää statiinia saaneista potilaista keskeytti hoidon haittavaikutusten vuoksi. Yleisimmät haittavaikutukset ZETIA + statiinihoitoa saaneiden potilaiden ryhmässä, jotka johtivat hoidon keskeyttämiseen ja joita esiintyi useammin kuin statiinia yksinään, olivat:
- Alaniiniaminotransferaasi lisääntynyt (0,6 %)
- Myalgia (0,5 %)
- Väsymys, aspartaattiaminotransferaasin lisääntyminen, päänsärky ja raajojen kipu (kumpikin 0,2 %)
Yleisimmin raportoidut haittavaikutukset (esiintyvyys ≥ 2 % ja suurempi kuin pelkkä statiini) ZETIA + statiinikontrolloiduissa kliinisissä 11 308 potilaan tutkimustietokannassa olivat: nenänielutulehdus (3,7 %), lihaskipu (3,2 %), ylempien hengitysteiden infektio (2,9 %). nivelkipu (2,6 %) ja ripuli (2,5 %).
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
Monoterapia
10 kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa 2 396 potilasta, joilla oli primaarinen hyperlipidemia (ikähaarukka 9-86 vuotta, 50 % naisia, 90 % valkoihoisia, 5 % mustia, 3 % latinalaisamerikkalaisia, 2 % aasialaisia) ja kohonnut LDL-kolesteroli. hoidettiin ZETIAlla 10 mg/vrk hoidon keston mediaani oli 12 viikkoa (vaihteluväli 0-39 viikkoa).
Haittavaikutukset, joita raportoitiin ≥ 2 %:lla ZETIA:lla hoidetuista potilaista ja joiden ilmaantuvuus oli suurempi kuin lumelääkettä lumekontrolloiduissa ZETIA 10 mg:n tutkimuksissa, syy-yhteyden arvioinnista riippumatta, on esitetty taulukossa 1.
TAULUKKO 1: Kliiniset haittavaikutukset, joita esiintyy ≥ 2 %:lla potilaista, joita hoidettiin ZETIA 10 mg:lla ja joiden ilmaantuvuus on suurempi kuin lumelääke, syy-yhteydestä riippumatta
Harvempien haittavaikutusten esiintyvyys oli verrattavissa ZETIA 10 mg:n ja lumelääkkeen välillä.
Yhdistelmä statiinin kanssa
28 kaksoissokkoutetussa, kontrolloidussa (plasebo- tai aktiivikontrolloidussa) kliinisessä tutkimuksessa 11 308 potilasta, joilla oli primaarinen hyperlipidemia (ikähaarukka 10–93 vuotta, 48 % naisia, 85 % valkoihoisia, 7 % mustia, 4 % latinalaisamerikkalaisia, 3 % aasialaisia) ja kohonneita LDL-kolesterolia hoidettiin ZETIAlla 10 mg/vrk samanaikaisesti käynnissä olevan statiinihoidon kanssa tai lisättynä siihen hoidon keston mediaani oli 8 viikkoa (vaihteluväli 0-112 viikkoa).
Peräkkäisten kohonneiden transaminaasiarvojen (≥ 3 × ULN) ilmaantuvuus oli suurempi potilailla, jotka saivat ZETIAa 10 mg yhdessä statiinien kanssa (1,3 %) kuin potilailla, joita hoidettiin pelkästään statiineilla (0,4 %). [Katso VAROITUKSET JA VAROTOIMET ]
Taulukossa 2 on esitetty kliiniset haittavaikutukset, jotka raportoitiin ≥ 2 %:lla ZETIA + statiinilla hoidetuista potilaista ja joiden ilmaantuvuus on suurempi kuin statiini, riippumatta syy-yhteyteen.
TAULUKKO 2: Kliiniset haittavaikutukset, joita esiintyy ≥ 2 %:lla potilaista, joita hoidettiin ZETIA 10 mg:lla yhdessä statiinin kanssa ja joiden ilmaantuvuus on suurempi kuin statiini, syy-yhteydestä riippumatta
Yhdistelmä fenofibraatin kanssa
Tähän kliiniseen tutkimukseen osallistui 625 potilasta, joilla oli sekamuotoinen dyslipidemia (ikähaarukka 20-76 vuotta, 44 % naisia, 79 % valkoihoisia, 0,1 % mustia, 11 % latinalaisamerikkalaisia, 5 % aasialaisia), joita hoidettiin enintään 12 viikon ajan ja 576 potilasta hoidettiin enintään 48 lisäviikkoa arvioitiin ZETIA:n ja fenofibraatin yhteiskäyttöä. Tätä tutkimusta ei suunniteltu vertailemaan hoitoryhmiä harvinaisten tapahtumien suhteen. Kliinisesti merkittävien maksan transaminaasiarvojen nousujen (≥3 – ULN, peräkkäinen) ilmaantuvuus (95 % CI) oli 4,5 % (1,9, 8,8) ja 2,7 % (1,2, 5,4) fenofibraattimonoterapian (n=188) ja ZETIA-hoidon yhteydessä. fenofibraatilla (n=183), vastaavasti hoitoaltistusta mukautettuna. Vastaavat kolekystektomian ilmaantuvuusluvut olivat 0,6 % (95 % CI: 0,0 %, 3,1 %) ja 1,7 % (95 % CI: 0,6 %, 4,0 %) monoterapiassa fenofibraatilla ja ZETIA 10 mg:lla yhdessä fenofibraatin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Samanaikaiselle hoidolle sekä fenofibraatti- ja etsetimibimonoterapialle altistuneiden potilaiden määrä ei riittänyt arvioimaan sappirakon sairauden riskiä. CPK-arvon nousua > 10 – ULN ei havaittu missään hoitoryhmässä.
Markkinoinnin jälkeinen kokemus
Koska alla olevat reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei yleensä ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Seuraavat lisähaittavaikutukset on tunnistettu ZETIA:n hyväksymisen jälkeisen käytön aikana:
Yliherkkyysreaktiot, mukaan lukien anafylaksia, angioödeema, ihottuma ja urtikaria; erythema multiforme; nivelkipu; myalgia; kohonnut kreatiinifosfokinaasi; myopatia/rabdomyolyysi [katso VAROITUKSET JA VAROTOIMET ]; maksan transaminaasiarvojen nousu; hepatiitti; vatsakipu; trombosytopenia; haimatulehdus; pahoinvointi; huimaus; parestesia; masennus; päänsärky; sappikivitauti; kolekystiitti.
HUUMEIDEN VUOROVAIKUTUKSET
[Katso KLIININEN FARMAKOLOGIA ]
Syklosporiini
Varovaisuutta tulee noudattaa käytettäessä ZETIA 10 mg:aa ja siklosporiinia samanaikaisesti, koska altistuminen sekä etsetimibille että siklosporiinille lisääntyy. Siklosporiinipitoisuuksia tulee seurata potilailla, jotka saavat ZETIAa ja siklosporiinia.
Etsetimibialtistus voi lisääntyä enemmän potilailla, joilla on vaikea munuaisten vajaatoiminta. Potilailla, joita hoidetaan siklosporiinilla, yhteiskäytön aiheuttaman lisääntyneen etsetimibialtistuksen mahdollisia vaikutuksia on punnittava huolellisesti etsetimibin aiheuttamien lipiditasojen muutosten hyötyihin nähden.
Fibraatit
Etsetimibin samanaikaisen annon tehoa ja turvallisuutta muiden fibraattien kuin fenofibraatin kanssa ei ole tutkittu.
Fibraatit voivat lisätä kolesterolin erittymistä sappeen, mikä johtaa sappikivitautiin. Prekliinisessä koirilla tehdyssä tutkimuksessa etsetimibi lisäsi kolesterolia sappirakon sapessa [ks. Ei-kliininen toksikologia ]. ZETIA:n samanaikaista käyttöä muiden fibraattien kuin fenofibraatin kanssa ei suositella, ennen kuin käyttöä potilailla on tutkittu riittävästi.
Fenofibraatti
Jos sappikivitautia epäillään potilaalla, joka saa ZETIA 10 mg ja fenofibraattia, sappirakkotutkimukset ovat aiheellisia ja vaihtoehtoista lipidejä alentavaa hoitoa tulee harkita [ks. HAITTAVAIKUTUKSET ja fenofibraatin tuotemerkinnät].
Kolestyramiini
Samanaikainen kolestyramiinin anto pienensi etsetimibin kokonaismäärän keskimääräistä käyrän alla olevaa pinta-alaa (AUC) noin 55 %. Tämä yhteisvaikutus saattaa vähentää etsetimibin lisäämisestä kolestyramiiniin johtuvaa LDL-kolesterolin asteittaista laskua.
Kumariiniantikoagulantit
Jos etsetimibiä lisätään varfariiniin, kumariiniantikoagulanttiin, kansainvälistä normalisoitua suhdetta (INR) on seurattava asianmukaisesti.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Käytä statiinien tai fenofibraatin kanssa
ZETIAn ja tietyn statiinin tai fenofibraatin samanaikaisen annon tulee tapahtua kyseisen lääkkeen tuoteselosteen mukaisesti.
Maksan entsyymit
Kontrolloiduissa kliinisissä monoterapiatutkimuksissa maksan transaminaasiarvojen peräkkäisten nousujen (≥ 3 x normaalin yläraja [ULN]) ilmaantuvuus oli samanlainen ZETIA:n (0,5 %) ja lumelääkkeen (0,3 %) välillä.
Kontrolloiduissa kliinisissä yhdistelmätutkimuksissa, joissa ZETIA 10 mg aloitettiin samanaikaisesti statiinin kanssa, maksan transaminaasiarvojen peräkkäisten nousujen (≥ 3 x ULN) ilmaantuvuus oli 1,3 % potilailla, joita hoidettiin ZETIAlla ja statiineilla, ja 0,4 % potilailla, joita hoidettiin pelkästään statiineilla. Nämä transaminaasiarvojen nousut olivat yleensä oireettomia, eivät liittyneet kolestaasiin ja palasivat lähtötasolle hoidon lopettamisen tai hoidon jatkamisen jälkeen. Kun ZETIAa annetaan samanaikaisesti statiinin kanssa, maksakokeet tulee tehdä hoidon alussa ja statiinin suositusten mukaisesti. Jos ALAT- tai ASAT-arvon nousu ≥ 3 x ULN jatkuu, harkitse ZETIA 10 mg:n ja/tai statiinin lopettamista.
Myopatia/rabdomyolyysi
Kliinisissä tutkimuksissa ZETIA 10 mg:n annokseen ei liittynyt ylimääräistä myopatiaa tai rabdomyolyysiä verrattuna vastaavaan kontrolliryhmään (plasebo tai statiini yksin). Myopatia ja rabdomyolyysi ovat kuitenkin tunnettuja statiinien ja muiden lipidejä alentavien lääkkeiden haittavaikutuksia. Kliinisissä tutkimuksissa kreatiinifosfokinaasin (CPK) > 10 x ULN ilmaantuvuus oli 0,2 % ZETIA:lla vs. 0,1 % lumelääkettä saaneilla ja 0,1 % ZETIA:lla, kun sitä annettiin yhdessä statiinin kanssa, verrattuna 0,4 % pelkästään statiinien käyttöön. Luustolihastoksisuuden riski kasvaa suuremmilla statiiniannoksilla, korkealla iällä (> 65), kilpirauhasen vajaatoiminnalla, munuaisten vajaatoiminnalla ja käytetystä statiinista riippuen muiden lääkkeiden samanaikaisella käytöllä.
Markkinoille tulon jälkeen ZETIAsta on raportoitu myopatiaa ja rabdomyolyysiä. Useimmat potilaat, joille kehittyi rabdomyolyysi, käyttivät statiineja ennen ZETIA-hoidon aloittamista. Rabdomyolyysiä on kuitenkin raportoitu käytettäessä ZETIA 10 mg monoterapiaa ja lisättynä ZETIA 10 mg lääkeaineisiin, joiden tiedetään liittyvän lisääntyneeseen rabdomyolyysiriskiin, kuten fibraatteihin. ZETIA ja kaikki statiinit tai fibraatti, joita potilas käyttää samanaikaisesti, on lopetettava välittömästi, jos myopatiaa diagnosoidaan tai sitä epäillään. Lihasoireiden esiintyminen ja CPK-taso > 10 x ULN viittaa myopatiaan.
Maksan vajaatoiminta
Koska etsetimibialtistuksen lisääntymisen vaikutuksia ei tunneta potilailla, joilla on kohtalainen tai vaikea maksan vajaatoiminta, ZETIAa ei suositella näille potilaille. [Katso KLIININEN FARMAKOLOGIA ]
Potilasneuvontatiedot
Katso FDA:n hyväksymä potilasmerkintä (POTILASTIEDOT).
Potilaita tulee neuvoa noudattamaan kansallisen kolesterolikasvatusohjelman (NCEP) suosittelemaa ruokavaliota, säännöllistä liikuntaohjelmaa ja säännöllistä paasto-lipidipaneelin testausta.
Lihaskipu
Kaikille etsetimibihoidon aloittaville potilaille tulee kertoa myopatian vaarasta ja heitä tulee kertoa viipymättä kaikista selittämättömistä lihaskivuista, -arkuudesta tai -heikkoudesta. Tämän esiintymisen riski kasvaa tietyntyyppisten lääkkeiden käytön yhteydessä. Potilaiden tulee keskustella kaikista lääkkeistä, sekä reseptilääkkeistä että reseptivapaista, lääkärinsä kanssa.
Maksan entsyymit
Maksakokeet tulee tehdä, kun ZETIA 10 mg lisätään statiinihoitoon ja statiinisuositusten mukaisesti.
Raskaus
Hedelmällisessä iässä olevia naisia tulee neuvoa käyttämään tehokasta ehkäisymenetelmää raskauden ehkäisemiseksi, kun he käyttävät ZETIAa lisättynä statiinihoitoon. Keskustele tulevista raskaussuunnitelmista potilaiden kanssa ja keskustele siitä, milloin ZETIA 10 mg:n ja statiinin yhdistelmähoito lopetetaan, jos he yrittävät tulla raskaaksi. Potilaita tulee neuvoa, että jos he tulevat raskaaksi, heidän tulee lopettaa ZETIA 10 mg:n ja statiinihoidon yhdistelmähoito ja soittaa terveydenhuollon ammattilaiselle.
Imetys
Imettäviä naisia tulee neuvoa olemaan käyttämättä ZETIAa lisättynä statiinihoitoon. Potilaita, joilla on lipidihäiriö ja jotka imettävät, tulee neuvoa keskustelemaan vaihtoehdoista terveydenhuollon ammattilaisten kanssa.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Etsetimibillä suoritettiin 104 viikkoa kestänyt ravinnon karsinogeenisuustutkimus rotilla annoksilla 1500 mg/kg/vrk (urokset) ja 500 mg/kg/vrk (naaraat) (noin 20 x ihmisen altistus 10 mg vuorokaudessa AUC0:n perusteella. -24 tuntia etsetimibin kokonaismäärälle). Etsetimibillä suoritettiin myös 104 viikkoa kestänyt ravinnon karsinogeenisuustutkimus hiirillä annoksilla 500 mg/kg/vrk (> 150 x ihmisen altistus 10 mg:lla vuorokaudessa etsetimibin kokonaismäärän AUC0-24 tunnin perusteella). Lääkehoidetuilla rotilla tai hiirillä ei havaittu tilastollisesti merkitsevää lisääntymistä kasvainten ilmaantuvuuksissa.
Mutageenisuutta ei havaittu in vitro mikrobien mutageenisuustestissä (Ames) Salmonella typhimuriumilla ja Escherichia colilla metabolisen aktivaation kanssa tai ilman sitä. Mitään näyttöä klastogeenisuudesta ei havaittu in vitro kromosomipoikkeavuusmäärityksessä ihmisen perifeerisen veren lymfosyyteissä metabolisen aktivaation kanssa tai ilman sitä. Lisäksi in vivo hiiren mikrotumatestissä ei ollut näyttöä genotoksisuudesta.
Rotilla tehdyissä etsetimibin hedelmällisyystutkimuksissa suun kautta (letkuletkulla) ei havaittu lisääntymistoksisuutta uros- tai naarasrotilla annoksilla 1000 mg/kg/vrk (~7 x ihmisen altistus 10 mg:lla vuorokaudessa AUC0-arvon perusteella). 24 tuntia etsetimibin kokonaismäärälle).
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
Etsetimibistä ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Etsetimibia tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle aiheutuvan riskin.
Etsetimibin oraalisen (leukurunko) alkion ja sikiön kehitystutkimuksissa, jotka suoritettiin rotilla ja kaniineilla organogeneesin aikana, ei havaittu alkiokuolevia vaikutuksia testatuilla annoksilla (250, 500, 1000 mg/kg/vrk). Rotilla havaittiin tavallisten sikiön luustolöydösten (ylimääräinen pari rintakehän kylkiluita, luutumaton kaulanikamakeskus, lyhennetyt kylkiluut) ilmaantuvuus annoksella 1000 mg/kg/vrk (noin 10 x ihmisen altistus 10 mg:lla vuorokaudessa AUC0-24 tunnin perusteella. kokonaisetsetimibin osalta). Etsetimibillä hoidetuilla kaniineilla havaittiin rintakehän ulkopuolisten kylkiluiden ilmaantuvuuden lisääntyminen annoksella 1000 mg/kg/vrk (150 x ihmisen altistus annoksella 10 mg vuorokaudessa etsetimibin kokonaismäärän AUC0-24 tunnin perusteella). Etsetimibi läpäisi istukan, kun tiineille rotille ja kaneille annettiin useita suun kautta annettuja annoksia.
Etsetimibin ja statiinien yhdistelmänä tehdyt usean annoksen tutkimukset rotilla ja kaniineilla organogeneesin aikana johtavat korkeampiin etsetimibi- ja statiinialtistukseen. Lisääntymishavaintoja esiintyy pienemmillä annoksilla yhdistelmähoidossa kuin monoterapiassa.
Kaikki statiinit ovat vasta-aiheisia raskaana oleville ja imettäville naisille. Kun ZETIA 10 mg annetaan statiinin kanssa hedelmällisessä iässä olevalle naiselle, katso statiinin raskausluokka ja tuotemerkinnät. [Katso VASTA-AIHEET]
Imettävät äidit
Ei tiedetä, erittyykö etsetimibi äidinmaitoon. Rottatutkimuksissa etsetimibin kokonaisaltistus imettävillä pennuilla oli jopa puolet emon plasmassa havaitusta altistumisesta. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, kun ZETIA 10 mg -valmistetta annetaan imettäville naisille. ZETIAa ei tule käyttää imettäville äideille, ellei mahdollinen hyöty ole suurempi kuin mahdollinen riski lapselle.
Käyttö lapsille
Simvastatiinin (n=126) ja simvastatiinin kanssa samanaikaisesti annetun ZETIAn vaikutuksia verrattuna simvastatiinimonoterapiaan (n=122) on arvioitu nuorilla pojilla ja tytöillä, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia (HeFH). Monikeskustutkimuksessa, kaksoissokkoutetussa, kontrolloidussa tutkimuksessa, jota seurasi avoin vaihe, 142 poikaa ja 106 postmenarkaalista tyttöä, 10–17-vuotiaita (keski-ikä 14,2 vuotta, 43 % naisia, 82 % valkoihoisia, 4 % aasialaisia, 2 % mustia). HeFH-potilaat satunnaistettiin saamaan joko ZETIA 10 mg yhdessä simvastatiinin kanssa tai simvastatiinin monoterapiaa. Osallistuminen tutkimukseen edellytti 1) LDL-kolesterolin lähtötasoa 160 - 400 mg/dl ja 2) HeFH:n mukaista sairaushistoriaa ja kliinistä esitystä. Keskimääräinen lähtötason LDL-kolesteroliarvo oli 225 mg/dl (vaihteluväli: 161-351 mg/dl) ZETIA 10 mg:n ja simvastatiinin kanssa annetussa ryhmässä verrattuna 219 mg/dl (vaihteluväli: 149-336 mg/dl) simvastatiinin monoterapiaan. ryhmä. Potilaat saivat ZETIAa ja simvastatiinia (10 mg, 20 mg tai 40 mg) tai simvastatiinin monoterapiaa (10 mg, 20 mg tai 40 mg) 6 viikon ajan, ZETIAa ja 40 mg simvastatiinia tai 40 mg simvastatiinia. seuraavat 27 viikkoa ja avoimesti annettiin samanaikaisesti ZETIAa ja simvastatiinia (10 mg, 20 mg tai 40 mg) 20 viikon ajan sen jälkeen.
Viikon 6 tutkimuksen tulokset on koottu taulukkoon 3. Viikon 33 tulokset olivat yhdenmukaisia viikon 6 tulosten kanssa.
TAULUKKO 3: Keskimääräinen prosentuaalinen ero viikolla 6 simvastatiiniryhmän kanssa annetun ZETIA 10 mg:n yhdistetyn annoksen ja yhdistetyn simvastatiinimonoterapiaryhmän välillä nuorilla potilailla, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia
Tutkimuksen alusta viikon 33 loppuun haittavaikutuksen vuoksi keskeytyi 7 (6 %) potilaalla ZETIA-ryhmässä, jossa annettiin samanaikaisesti simvastatiinia, ja 2 (2 %) potilaalla simvastatiinin monoterapiaryhmässä.
Tutkimuksen aikana maksan transaminaasiarvojen nousua (kaksi peräkkäistä ALAT- ja/tai ASAT-mittausta ≥3 x ULN) esiintyi neljällä (3 %) ZETIA 10 mg:n ja simvastatiinin kanssa yhdessä annetussa ryhmässä ja kahdella (2 %) yksilöllä simvastatiinin monoterapiassa. ryhmä. CPK-arvon nousua (≥ 10 x ULN) esiintyi kahdella (2 %) yksilöllä ZETIA-ryhmässä, jossa annettiin samanaikaisesti simvastatiinia, ja nollalla yksilöllä simvastatiinin monoterapiaryhmässä.
Tässä rajoitetussa kontrolloidussa tutkimuksessa ei ollut merkittävää vaikutusta nuorten poikien tai tyttöjen kasvuun tai seksuaaliseen kypsymiseen eikä tyttöjen kuukautiskierron pituuteen.
ZETIA 10 mg:n yhteiskäyttöä simvastatiinin kanssa yli 40 mg/vrk annoksilla ei ole tutkittu nuorilla. ZETIA 10 mg:n käyttöä ei myöskään ole tutkittu alle 10-vuotiailla potilailla tai premenarkaalisilla tytöillä.
Etsetimibin kokonaismäärään (etsetimibi + etsetimibe-glukuronidi) perustuen farmakokineettisiä eroja ei ole nuorten ja aikuisten välillä. Farmakokineettisiä tietoja alle 10-vuotiaista lapsista ei ole saatavilla.
Geriatrinen käyttö
Monoterapiatutkimukset
Niistä 2396 potilaasta, jotka saivat ZETIA 10 mg kliinisissä tutkimuksissa, 669 (28 %) oli 65-vuotiaita tai vanhempia ja 111 (5 %) 75-vuotiaita tai vanhempia.
Statiinin yhteiskäyttötutkimukset
Niistä 11 308 potilaasta, jotka saivat ZETIAa + statiinia kliinisissä tutkimuksissa, 3587 (32 %) oli 65-vuotiaita tai vanhempia ja 924 (8 %) 75-vuotiaita tai vanhempia.
Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa ja tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois [ks. KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Kun ZETIA 10 mg -valmistetta käytetään monoterapiana, annosta ei tarvitse muuttaa.
Study of Heart and Renal Protection (SHARP) -tutkimuksessa, johon osallistui 9 270 potilasta, joilla oli kohtalainen tai vaikea munuaisten vajaatoiminta (6 247 ei-dialyysipotilasta, joiden seerumin kreatiniinin mediaani oli 2,5 mg/dl ja arvioitu glomerulusten suodatusnopeuden mediaani 25,6 ml/min/1,73 m², ja 3023 dialyysipotilasta), vakavien haittatapahtumien, tutkimushoidon keskeyttämiseen johtaneiden haittatapahtumien tai erityisen kiinnostavien haittatapahtumien (lihas- ja luuston haittatapahtumat, maksaentsyymihäiriöt, tapaussyöpä) esiintyvyys oli samanlainen potilailla, joille oli koskaan annettu etsetimibi 10 mg plus simvastatiinia 20 mg (n=4650) tai lumelääkettä (n=4620) seurannan mediaanien ollessa 4,9 vuotta. Koska munuaisten vajaatoiminta on kuitenkin statiiniin liittyvän myopatian riskitekijä, yli 20 mg:n simvastatiiniannoksia tulee käyttää varoen ja tarkkaan seurannassa, kun niitä annetaan samanaikaisesti ZETIAn kanssa potilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta.
Maksan vajaatoiminta
ZETIAa ei suositella potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta [ks VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
ZETIA 10 mg annettuna samanaikaisesti statiinin kanssa on vasta-aiheinen potilaille, joilla on aktiivinen maksasairaus tai selittämätön jatkuva maksan transaminaasiarvojen nousu (ks. VASTA-AIHEET ; VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Kliinisissä tutkimuksissa etsetimibia annettiin 50 mg/vrk 15 terveelle henkilölle enintään 14 päivän ajan, 40 mg/vrk 18 potilaalle, joilla oli primaarinen hyperlipidemia enintään 56 päivän ajan ja 40 mg/vrk 27 potilaalle, joilla oli homotsygoottinen sitosterolemia. 26 viikkoa oli yleensä hyvin siedetty. Yksi naispotilas, jolla oli homotsygoottinen sitosterolemia, otti vahingossa etsetimibin yliannostuksen 120 mg/vrk 28 päivän ajan ilman raportoituja kliinisiä tai laboratoriotutkimuksia haittavaikutuksia.
Yliannostustapauksissa on käytettävä oireenmukaisia ja tukitoimenpiteitä.
VASTA-AIHEET
ZETIA on vasta-aiheinen seuraavissa olosuhteissa:
- ZETIA 10 mg:n yhdistelmä statiinin kanssa on vasta-aiheinen potilailla, joilla on aktiivinen maksasairaus tai selittämätön jatkuva maksan transaminaasiarvojen nousu.
- Naiset, jotka ovat raskaana tai voivat tulla raskaaksi. Koska statiinit vähentävät kolesterolin synteesiä ja mahdollisesti muiden kolesterolista peräisin olevien biologisesti aktiivisten aineiden synteesiä, ZETIA yhdessä statiinin kanssa voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana oleville naisille. Lisäksi raskaudenaikaisesta hoidosta ei ole ilmeistä hyötyä, eikä turvallisuutta raskaana oleville naisille ole osoitettu. Jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta tulee kertoa mahdollisesta vaarasta sikiölle ja kliinisen hyödyn puutteesta, jos käyttöä jatketaan raskauden aikana. [Katso Käyttö tietyissä populaatioissa ]
- Imettävät äidit. Koska statiinit voivat erittyä äidinmaitoon ja koska statiinit voivat aiheuttaa vakavia haittavaikutuksia imettäville imeväisille, naisia, jotka tarvitsevat ZETIA-hoitoa yhdessä statiinin kanssa, tulee neuvoa olemaan imettämättä lapsiaan [ks. Käyttö tietyissä populaatioissa ].
- Potilaat, joiden tiedetään olevan yliherkkiä jollekin tämän tuotteen aineosalle. ZETIA:n yhteydessä on raportoitu yliherkkyysreaktioita, mukaan lukien anafylaksia, angioedeeema, ihottuma ja nokkosihottuma [ks. HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Etsetimibi alentaa veren kolesterolia estämällä kolesterolin imeytymistä ohutsuolesta. 2 viikkoa kestäneessä kliinisessä tutkimuksessa, johon osallistui 18 hyperkolesteroleemista potilasta, ZETIA 10 mg esti kolesterolin imeytymistä suolistosta 54 % lumelääkkeeseen verrattuna. ZETIAlla ei ollut kliinisesti merkittävää vaikutusta rasvaliukoisten A-, D- ja E-vitamiinien plasmapitoisuuksiin (113 potilaan tutkimuksessa), eikä se heikentänyt lisämunuaiskuoren steroidihormonin tuotantoa (118 potilaan tutkimuksessa).
Maksan kolesterolipitoisuus on peräisin pääasiassa kolmesta lähteestä. Maksa voi syntetisoida kolesterolia, ottaa kolesterolia verestä kiertävistä lipoproteiineista tai ottaa kolesterolia, joka imeytyy ohutsuoleen. Suoliston kolesteroli on peräisin pääasiassa sapen erittymisestä ja ravinnon kolesterolista.
Etsetimibin vaikutusmekanismi eroaa muiden kolesterolia alentavien yhdisteiden luokkien (statiinit, sappihappoja sitovat aineet [hartsit], fibriinihappojohdannaiset ja kasvistanolit) vaikutusmekanismista. Etsetimibin molekyylikohteen on osoitettu olevan sterolien kuljettaja, Niemann-Pick C1-Like 1 (NPC1L1), joka osallistuu kolesterolin ja fytosterolien imeytymiseen suolistossa.
Etsetimibi ei estä kolesterolin synteesiä maksassa tai lisää sappihapon erittymistä. Sen sijaan etsetimibi lokalisoituu ohutsuolen harjan rajalle ja estää kolesterolin imeytymistä, mikä vähentää kolesterolin kulkeutumista suolistosta maksaan. Tämä vähentää maksan kolesterolivarastoja ja lisää kolesterolin poistumista verestä; tämä erillinen mekanismi täydentää statiinien ja fenofibraatin mekanismia [katso Kliiniset tutkimukset ].
Farmakodynamiikka
Kliiniset tutkimukset ovat osoittaneet, että kohonneet kokonaiskolesterolin, LDL-kolesterolin ja Apo B:n, LDL:n tärkeimmän proteiinin, tasot edistävät ihmisen ateroskleroosia. Lisäksi alentuneet HDL-kolesterolitasot liittyvät ateroskleroosin kehittymiseen. Epidemiologiset tutkimukset ovat osoittaneet, että sydän- ja verisuonisairauksien sairastavuus ja kuolleisuus vaihtelevat suoraan kokonaiskolesterolin ja LDL-kolesterolin tason mukaan ja käänteisesti HDL-kolesterolin tason mukaan. Kuten LDL, kolesterolirikastetut triglyseridit sisältävät lipoproteiinit, mukaan lukien erittäin matalatiheyksiset lipoproteiinit (VLDL), keskitiheyksiset lipoproteiinit (IDL) ja jäännökset, voivat myös edistää ateroskleroosia. HDL-kolesterolin nousun tai TG:n laskun riippumatonta vaikutusta sepelvaltimoiden ja sydän- ja verisuonisairauksien riskiin ja kuolleisuuteen ei ole määritetty.
ZETIA alentaa kokonaiskolesterolia, LDL-kolesterolia, Apo B:tä, ei-HDL-kolesterolia ja TG:tä ja lisää HDL-kolesterolia potilailla, joilla on hyperlipidemia. ZETIA 10 mg:n antaminen statiinin kanssa parantaa tehokkaasti seerumin kokonaiskolesteroli-, LDL-kolesteroli-, ApoB-, ei-HDL-kolesteroli-, TG- ja HDL-kolesteroliarvoja kummankaan hoidon lisäksi. ZETIA 10 mg:n antaminen fenofibraatin kanssa parantaa tehokkaasti seerumin kokonaiskolesteroli-, LDL-kolesteroli-, ApoB- ja ei-HDL-kolesteroliarvoja potilailla, joilla on sekahyperlipidemia, verrattuna kumpaankaan hoitoon yksinään. Etsetimibin joko yksinään tai statiinin tai fenofibraatin lisäksi annettuna vaikutusta sydän- ja verisuonisairauksiin ja kuolleisuuteen ei ole osoitettu.
Farmakokinetiikka
Imeytyminen
Oraalisen annon jälkeen etsetimibi imeytyy ja konjugoituu laajalti farmakologisesti aktiiviseksi fenoliseksi glukuronidiksi (etsetimibe-glukuronidi). Kun paastonneelle aikuiselle oli annettu 10 mg ZETIA 10 mg:n kerta-annos, etsetimibin keskimääräiset huippupitoisuudet plasmassa (Cmax) 3,4–5,5 ng/ml saavutettiin 4–12 tunnissa (Tmax). Etsetimibe-glukuronidin keskimääräinen Cmax-arvo 45-71 ng/ml saavutettiin 1-2 tunnin välillä (Tmax). Annossuhteesta ei havaittu olennaista poikkeamaa 5–20 mg:n välillä. Etsetimibin absoluuttista biologista hyötyosuutta ei voida määrittää, koska yhdiste on käytännöllisesti katsoen liukenematon vesipitoiseen väliaineeseen, joka soveltuu injektioon.
Ruoan vaikutus suun kautta imeytymiseen
Samanaikainen ruuan antaminen (ruoanrasvaiset tai rasvattomat ateriat) ei vaikuttanut etsetimibin imeytymisasteeseen, kun se annettiin ZETIA 10 mg tabletteina. Etsetimibin C-arvo nousi 38 % runsasrasvaisten aterioiden nauttimisen myötä. ZETIA voidaan antaa ruoan kanssa tai ilman.
Jakelu
Etsetimibi ja etsetimibeglukuronidi sitoutuvat voimakkaasti (> 90 %) ihmisen plasman proteiineihin.
Aineenvaihdunta ja erittyminen
Etsetimibi metaboloituu ensisijaisesti ohutsuolessa ja maksassa glukuronidikonjugaation kautta (faasi II reaktio), minkä jälkeen se erittyy sappeen ja munuaisten kautta. Minimaalinen oksidatiivinen aineenvaihdunta (vaihe I reaktio) on havaittu kaikissa arvioiduissa lajeissa.
Ihmisillä etsetimibi metaboloituu nopeasti etsetimibiglukuronidiksi. Etsetimibi ja etsetimibeglukuronidi ovat tärkeimmät plasmassa havaitut lääkeaineperäiset yhdisteet, jotka muodostavat noin 10-20 % ja 80-90 % plasman kokonaislääkkeestä. Sekä etsetimibi että etsetimibeglukuronidi eliminoituvat plasmasta noin 22 tunnin puoliintumisajalla sekä etsetimibin että etsetimibeglukuronidin osalta. Plasman pitoisuus-aikaprofiileissa on useita huippuja, mikä viittaa enterohepaattiseen kierrätykseen.
14C-etsetimibin (20 mg) oraalisen antamisen jälkeen ihmisille etsetimibin kokonaismäärä (etsetimibi + etsetimibeglukuronidi) vastasi noin 93 % plasman kokonaisradioaktiivisuudesta. 48 tunnin kuluttua plasmassa ei ollut havaittavia radioaktiivisuustasoja.
Noin 78 % ja 11 % annetusta radioaktiivisuudesta havaittiin ulosteessa ja virtsassa 10 päivän keräysjakson aikana. Etsetimibi oli pääasiallinen ulosteen ainesosa ja sen osuus oli 69 % annetusta annoksesta, kun taas etsetimibeglukuronidi oli pääasiallinen aineosa virtsassa ja sen osuus oli 9 % annetusta annoksesta.
Tietyt populaatiot
Geriatriset potilaat: Toistuvassa etsetimibin annoksessa 10 mg kerran vuorokaudessa 10 päivän ajan tehdyssä tutkimuksessa etsetimibin kokonaispitoisuudet plasmassa olivat noin 2 kertaa suuremmat vanhemmilla (≥65-vuotiailla) terveillä koehenkilöillä kuin nuoremmilla.
Lapsipotilaat: [Katso Käyttö tietyissä populaatioissa ]
Sukupuoli: Toistuvassa tutkimuksessa etsetimibiä annettiin 10 mg kerran vuorokaudessa 10 päivän ajan, etsetimibin kokonaispitoisuudet plasmassa olivat hieman korkeammat (
Rotu: Moniannosten farmakokineettisten tutkimusten meta-analyysin perusteella mustaihoisten ja valkoihoisten koehenkilöiden välillä ei ollut farmakokineettisiä eroja. Aasialaisilla koehenkilöillä tehdyt tutkimukset osoittivat, että etsetimibin farmakokinetiikka oli samanlainen kuin valkoihoisilla koehenkilöillä.
Maksan vajaatoiminta: Etsetimibin kerta-annoksen 10 mg:n jälkeen etsetimibin kokonaisannoksen keskimääräinen AUC suureni noin 1,7-kertaiseksi potilailla, joilla oli lievä maksan vajaatoiminta (Child-Pugh-pisteet 5–6) terveisiin koehenkilöihin verrattuna. Etsetimibin kokonaismäärän AUC-arvot nousivat noin 3-4-kertaisiksi ja etsetimibin 5-6-kertaisiksi potilailla, joilla oli keskivaikea (Child-Pugh-pistemäärä 7-9) tai vaikea maksan vajaatoiminta (Child-Pugh-pisteet). 10-15). Keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla tehdyssä 14 päivää kestäneessä toistuvassa tutkimuksessa (10 mg vuorokaudessa) etsetimibin ja etsetimibin kokonaismäärän AUC-arvot nousivat noin 4-kertaisiksi päivinä 1 ja 14 terveisiin koehenkilöihin verrattuna. Koska etsetimibialtistuksen lisääntymisen vaikutuksia ei tunneta potilailla, joilla on kohtalainen tai vaikea maksan vajaatoiminta, ZETIAa ei suositella näille potilaille (ks. VAROITUKSET JA VAROTOIMET ].
Munuaisten vajaatoiminta: Etsetimibin 10 mg:n kerta-annoksen jälkeen potilailla, joilla oli vaikea munuaissairaus (n=8; keskimääräinen CrCl ≥ 30 ml/min/1,73 m²), etsetimibin, etsetimibeglukuronidin ja etsetimibin kokonaismäärän AUC-arvot nousivat noin 1,5. -kertaisesti verrattuna terveisiin koehenkilöihin (n=9).
Huumeiden vuorovaikutukset
[Katso myös HUUMEIDEN VUOROVAIKUTUKSET ]
ZETIA 10 mg:lla ei ollut merkittävää vaikutusta sarjaan koetinlääkkeitä (kofeiini, dekstrometorfaani, tolbutamidi ja IV midatsolaami), joiden tiedettiin metaboloituvan sytokromi P450:n vaikutuksesta (1A2, 2D6, 2C8/9 ja 3A4) 12 terveen hengellisen cocktailtutkimuksessa. aikuisia miehiä. Tämä osoittaa, että etsetimibi ei ole näiden sytokromi P450-isotsyymien estäjä eikä indusoija, ja on epätodennäköistä, että etsetimibi vaikuttaa näiden entsyymien metaboloimien lääkkeiden metaboliaan.
TAULUKKO 4: Samanaikaisesti annettujen lääkkeiden vaikutus etsetimibin kokonaismäärään
TAULUKKO 5: Etsetimibin samanaikaisen annon vaikutus systeemiseen altistumiseen muille lääkkeille
Eläinten toksikologia ja/tai farmakologia
Etsetimibin hypokolesteroleemista vaikutusta arvioitiin kolesterolia saaneilla reesusapinoilla, koirilla, rotilla ja ihmisen kolesteroliaineenvaihdunnan hiirimalleilla. Etsetimibin ED50-arvon todettiin olevan 0,5 μg/kg/vrk, koska se estää apinoiden plasman kolesterolipitoisuuden nousun. ED50-arvot koirilla, rotilla ja hiirillä olivat 7, 30 ja 700 µg/kg/vrk. Nämä tulokset ovat yhdenmukaisia sen kanssa, että ZETIA on voimakas kolesterolin imeytymisen estäjä.
Rottamallissa, jossa etsetimibin glukuronidimetaboliitia (SCH 60663) annettiin pohjukaissuolensisäisesti, metaboliitti esti kolesterolin imeytymistä yhtä tehokkaasti kuin emoyhdiste (SCH 58235), mikä viittaa siihen, että glukuronidimetaboliitilla oli samanlainen aktiivisuus kuin lähtöaineena. huume.
Yhden kuukauden tutkimuksissa koirilla, joille annettiin etsetimibia (0,03-300 mg/kg/vrk), sappirakon sapen kolesterolipitoisuus nousi ~2-4-kertaiseksi. Kuitenkaan koirille vuoden ajan annettu 300 mg/kg/vrk annos ei aiheuttanut sappikivien muodostumista tai muita haitallisia maksa-sappivaikutuksia. 14 päivää kestäneessä tutkimuksessa hiirillä, joille annettiin etsetimibia (0,3-5 mg/kg/vrk) ja jotka ruokittiin vähärasvaisella tai runsaasti kolesterolia sisältävällä ruokavaliolla, sappirakon sapen kolesterolipitoisuus joko ei muuttunut tai alentunut normaalille tasolle.
Suoritettiin sarja akuutteja prekliinisiä tutkimuksia ZETIA:n selektiivisyyden määrittämiseksi kolesterolin imeytymisen estämiseksi. Etsetimibi esti 14C-kolesterolin imeytymistä, mutta se ei vaikuttanut triglyseridien, rasvahappojen, sappihappojen, progesteronin, etinyyliestradiolin tai rasvaliukoisten A- ja D-vitamiinien imeytymiseen.
Hiirillä tehdyissä 4–12 viikkoa kestäneissä toksisuustutkimuksissa etsetimibi ei indusoinut sytokromi P450:tä lääkettä metaboloivia entsyymejä. Toksisuustutkimuksissa etsetimibin farmakokineettinen yhteisvaikutus statiinien (vanhempien tai niiden aktiivisten hydroksihappometaboliittien) kanssa havaittiin rotilla, koirilla ja kaniineilla.
Kliiniset tutkimukset
Primaarinen hyperlipidemia
ZETIA 10 mg alentaa kokonaiskolesterolia, LDL-kolesterolia, Apo B:tä, ei-HDL-kolesterolia ja TG:tä ja lisää HDL-kolesterolia potilailla, joilla on hyperlipidemia. Maksimaalinen tai lähes maksimivaste saavutetaan yleensä 2 viikossa ja se säilyy kroonisen hoidon aikana.
Monoterapia
Kahdessa monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, 12 viikkoa kestäneessä tutkimuksessa 1719 potilaalla, joilla oli primaarinen hyperlipidemia, ZETIA alensi merkittävästi kokonaiskolesteroli-, LDL-kolesteroli-, Apo B-, ei-HDL-kolesteroli- ja TG-arvoja ja lisäsi HDL-arvoja. C verrattuna lumelääkkeeseen (katso taulukko 6). LDL-kolesterolin lasku oli johdonmukaista iän, sukupuolen ja lähtötason LDL-kolesterolin välillä.
TAULUKKO 6: Vaste ZETIA 10 mg:lle potilailla, joilla on primaarinen hyperlipidemia (keskimääräinen % muutos hoitamattomasta lähtötilanteesta†)
Yhdistelmä statiinien kanssa
ZETIA 10mg Lisätty jatkuvaan statiinihoitoon
Monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, 8 viikon tutkimuksessa, 769 potilasta, joilla oli primaarinen hyperlipidemia, tunnettu sepelvaltimotauti tai useita kardiovaskulaarisia riskitekijöitä, jotka saivat jo statiinimonoterapiaa, mutta jotka eivät olleet saavuttaneet NCEP ATP II -tavoitettaan LDL:ää -C tavoite satunnaistettiin saamaan joko ZETIA 10 mg tai lumelääke meneillään olevan statiinin lisäksi.
Jatkuvaan statiinihoitoon lisätty ZETIA 10 mg alensi merkittävästi kokonaiskolesteroli-, LDL-kolesteroli-, Apo B-, ei-HDL-kolesteroli- ja TG-arvoja ja nosti HDL-kolesterolia verrattuna yksinään annettuun statiiniin (katso taulukko 7). ZETIA 10 mg:n aiheuttama LDL-kolesterolin aleneminen oli yleensä johdonmukaista kaikissa statiineissa.
TAULUKKO 7: Reaktio ZETIA 10 mg:n lisäämiseen meneillään olevaan statiinihoitoon potilailla, joilla on hyperlipidemia (keskimääräinen % muutos hoidetusta lähtötilanteesta‡)
ZETIA aloitettiin samanaikaisesti statiinin kanssa
Neljässä monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, 12 viikkoa kestäneessä tutkimuksessa 2382 hyperlipidemiapotilaalle annettiin ZETIAa tai lumelääkettä yksinään tai eri annoksilla atorvastatiinia, simvastatiinia, pravastatiinia tai lovastatiinia.
Kun kaikkia potilaita, jotka saivat ZETIAa statiinin kanssa, verrattiin kaikkiin potilaisiin, jotka saivat vastaavaa statiinia yksinään, ZETIA 10 mg alensi merkittävästi kokonaiskolesterolia, LDL-kolesterolia, Apo B:tä, ei-HDL-kolesterolia ja TG:tä sekä pravastatiinia lukuun ottamatta. , nosti HDL-kolesterolia verrattuna statiiniin yksinään. ZETIA 10 mg:n aiheuttama LDL-kolesterolin aleneminen oli yleensä johdonmukaista kaikissa statiineissa. (Katso alaviite , taulukot 8-11.)
TAULUKKO 8: Vaste ZETIA 10 mg:lle ja atorvastatiinille, jotka aloitettiin samanaikaisesti potilailla, joilla on primaarinen hyperlipidemia (keskimääräinen % muutos hoitamattomasta lähtötilanteesta†)
TAULUKKO 9: Vaste ZETIA 10 mg:lle ja simvastatiinille samanaikaisesti aloitettuna potilailla, joilla on primaarinen hyperlipidemia (keskimääräinen % muutos hoitamattomasta lähtötilanteesta†)
TAULUKKO 10: ZETIA- ja pravastatiinivaste, joka aloitettiin samanaikaisesti potilailla, joilla on primaarinen hyperlipidemia (keskimääräinen % muutos hoitamattomasta lähtötilanteesta†)
TAULUKKO 11: ZETIA- ja lovastatiinivaste, joka aloitettiin samanaikaisesti potilailla, joilla on primaarinen hyperlipidemia (keskimääräinen % muutos hoitamattomasta lähtötilanteesta†)
Yhdistelmä fenofibraatin kanssa
Monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa potilailla, joilla oli sekamuotoista hyperlipidemiaa, 625 potilasta hoidettiin enintään 12 viikon ajan ja 576 potilasta vielä 48 viikon ajan. Potilaat satunnaistettiin saamaan lumelääkettä, pelkkää ZETIAa, pelkkä 160 mg fenofibraattia tai ZETIA 10 mg ja 160 mg fenofibraattia 12 viikkoa kestäneessä tutkimuksessa. Kun 12 viikkoa kestänyt tutkimus oli saatu päätökseen, kelpoiset potilaat määrättiin ZETIA-hoitoon, jota annettiin samanaikaisesti fenofibraatin tai fenofibraattimonoterapian kanssa vielä 48 viikon ajaksi.
ZETIA 10 mg yhdessä fenofibraatin kanssa alensi merkittävästi kokonaiskolesteroli-, LDL-kolesteroli-, Apo B- ja ei-HDL-kolesteroliarvoja verrattuna pelkkään fenofibraattiin. TG:n prosentuaalinen lasku ja HDLC:n prosentuaalinen nousu ZETIA:lla, jota annettiin yhdessä fenofibraatin kanssa, olivat verrattavissa pelkän fenofibraatin annokseen (katso taulukko 12).
TAULUKKO 12: Vaste ZETIA 10mg:lle ja fenofibraatille samanaikaisesti aloitettuna potilailla, joilla on sekahyperlipidemia (keskimääräinen % muutos hoitamattomasta lähtötilanteesta† 12 viikon kohdalla†)
Muutokset lipidipäätepisteissä 48 lisäviikkoa jatkuneen ZETIA-hoidon jälkeen, jota annettiin samanaikaisesti fenofibraatin kanssa tai pelkän fenofibraatin kanssa, olivat yhdenmukaisia yllä esitettyjen 12 viikon tietojen kanssa.
Homotsygoottinen familiaalinen hyperkolesterolemia (HoFH)
ZETIAn tehon arvioimiseksi HoFH:n hoidossa suoritettiin tutkimus. Tähän kaksoissokkoutettuun, satunnaistettuun, 12 viikkoa kestäneeseen tutkimukseen otettiin mukaan 50 potilasta, joilla oli kliininen ja/tai genotyyppinen HoFH-diagnoosi, samanaikaisesti LDL-afereesin kanssa tai ilman, ja jotka jo saivat atorvastatiinia tai simvastatiinia (40 mg). Potilaat satunnaistettiin johonkin kolmesta hoitoryhmästä: atorvastatiini tai simvastatiini (80 mg), ZETIA 10 mg atorvastatiinin tai simvastatiinin (40 mg) kanssa tai ZETIA, johon annettiin atorvastatiinia tai simvastatiinia (80 mg). Koska etsetimibin biologinen hyötyosuus on heikentynyt potilailla, jotka saavat samanaikaisesti kolestyramiinia [ks. HUUMEIDEN VUOROVAIKUTUKSET ], etsetimibi annettiin vähintään 4 tuntia ennen tai jälkeen hartsien annon. Keskimääräinen lähtötason LDL-kolesteroli oli 341 mg/dl potilailla, jotka oli satunnaistettu saamaan 80 mg atorvastatiinia tai 80 mg simvastatiinia, ja 316 mg/dl ryhmässä, joka oli satunnaistettu saamaan ZETIA 10 mg plus atorvastatiinia 40 tai 80 mg tai simvastatiinia 40 tai 80 mg. ZETIA 10 mg, annettuna yhdessä atorvastatiinin tai simvastatiinin kanssa (40 ja 80 mg statiiniryhmät, yhdistetty), alensi merkitsevästi LDL-kolesterolia (21 %) verrattuna simvastatiinin tai atorvastatiinin monoterapian annoksen suurentamiseen 40 mg:sta 80 mg:aan (7 %). Niillä, joita hoidettiin ZETIA 10 mg plus 80 mg atorvastatiinilla tai ZETIA 10 mg plus 80 mg simvastatiinilla, LDL-kolesteroli väheni 27 %.
Homotsygoottinen sitosterolemia (fytosterolemia)
ZETIA:n tehokkuuden arvioimiseksi homotsygoottisen sitosterolemian hoidossa suoritettiin tutkimus. Tässä monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, 8 viikkoa kestäneessä tutkimuksessa, 37 potilasta, joilla oli homotsygoottinen sitosterolemia ja kohonneet plasman sitosterolipitoisuudet (> 5 mg/dl) nykyisellä hoito-ohjelmallaan (ruokavalio, sappihappoa sitovat hartsit, statiinit, sykkyräsuolen ohitusleikkaus ja/tai LDL-afereesi), satunnaistettiin saamaan ZETIAa (n=30) tai lumelääkettä (n=7). Koska etsetimibin biologinen hyötyosuus on heikentynyt potilailla, jotka saavat samanaikaisesti kolestyramiinia [ks. HUUMEIDEN VUOROVAIKUTUKSET ], etsetimibi annettiin vähintään 2 tuntia ennen tai 4 tuntia hartsien annon jälkeen. Lukuun ottamatta yhtä LDL-afereesia saavaa henkilöä, ZETIA alensi plasman sitosterolia merkittävästi, 21 % ja 24 % lähtötasosta. Sitä vastoin lumelääkettä saaneilla potilailla sitosteroli ja kampesteroli lisääntyivät 4 % ja 3 % lähtötasosta. Potilailla, joita hoidettiin ZETIA 10 mg:lla, kasvisterolien keskimääräiset plasmapitoisuudet laskivat asteittain tutkimuksen aikana. Plasman sitosterolin ja kampesterolin vähentämisen vaikutuksia sydän- ja verisuonisairauksien ja kuolleisuuden vähentämiseen ei ole osoitettu.
Sitosterolin ja kampesterolin aleneminen oli johdonmukaista potilailla, jotka ottivat ZETIA 10 mg samanaikaisesti sappihappoja sitovien aineiden kanssa (n = 8) ja potilailla, jotka eivät saaneet samanaikaista sappihappoja sitovia aineita (n = 21).
Käyttörajoitukset
ZETIA 10 mg:n vaikutusta sydän- ja verisuonisairauksiin ja kuolleisuuteen ei ole määritetty.
POTILASTIEDOT
ZETIA® (etsetimibi) Tabletit
Potilastiedot ZETIAsta (zet´-ea)
Yleinen nimi: etsetimibe (e-zet´-e-mib)
Lue nämä tiedot huolellisesti ennen kuin aloitat ZETIA®-hoidon ja aina, kun saat lisää ZETIAa. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi. Jos sinulla on kysyttävää ZETIAsta, käänny lääkärisi puoleen. Vain lääkärisi voi päättää, sopiiko ZETIA sinulle.
Mikä on ZETIA?
ZETIA on lääke, jota käytetään alentamaan veren kokonaiskolesterolin ja LDL-kolesterolin (huono) tasoa. ZETIA on tarkoitettu potilaille, jotka eivät pysty hallitsemaan kolesterolitasoaan pelkällä ruokavaliolla ja liikunnalla. Sitä voidaan käyttää sellaisenaan tai muiden lääkkeiden kanssa korkean kolesterolin hoitoon. Sinun tulee noudattaa kolesterolia alentavaa ruokavaliota tämän lääkkeen käytön aikana.
ZETIA vähentää elimistösi absorboiman kolesterolin määrää. ZETIA 10mg ei auta sinua laihduttamaan. ZETIA 10 mg:n ei ole osoitettu estävän sydänsairauksia tai sydänkohtauksia.
Lisätietoja kolesterolista on kohdassa "Mitä minun pitäisi tietää korkeasta kolesterolista?" seuraava osio.
Kuka ei saa ottaa ZETIA 10mg -valmistetta?
- Älä ota ZETIA 10 mg -valmistetta, jos olet allerginen etsetimibille, ZETIA:n vaikuttavalle aineelle tai inaktiivisille aineosille. Katso luettelo ei-aktiivisista ainesosista seuraavasta "Epäaktiiviset ainesosat" -osiosta.
- Jos sinulla on aktiivinen maksasairaus, älä käytä ZETIA 10 mg -valmistetta, kun käytät kolesterolia alentavia lääkkeitä, joita kutsutaan statiineiksi.
- Jos olet raskaana tai imetät, älä ota ZETIAa statiinin käytön aikana.
- Jos olet hedelmällisessä iässä oleva nainen, sinun tulee käyttää tehokasta ehkäisymenetelmää raskauden ehkäisemiseksi käyttäessäsi ZETIAa lisättynä statiinihoitoon.
ZETIAa ei ole tutkittu alle 10-vuotiailla lapsilla.
Mitä minun tulee kertoa lääkärilleni ennen ZETIA 10mg -valmisteen käyttöä ja sen aikana?
Kerro lääkärillesi kaikista reseptilääkkeistä ja ilman reseptiä saatavista lääkkeistä, joita käytät tai aiot ottaa, mukaan lukien luonnolliset tai rohdosvalmisteet.
Kerro lääkärillesi kaikista sairauksistasi, mukaan lukien allergiat.
Kerro lääkärillesi, jos:
- ollut koskaan maksaongelmia. ZETIA 10mg ei ehkä sovi sinulle.
- olet raskaana tai suunnittelet raskautta. Lääkärisi keskustelee kanssasi, sopiiko ZETIA 10 mg sinulle.
- imettävät. Emme tiedä, voiko ZETIA 10mg kulkeutua vauvaasi maidon kautta. Lääkärisi keskustelee kanssasi, sopiiko ZETIA 10 mg sinulle.
- kokea selittämätöntä lihaskipua, arkuutta tai heikkoutta.
Kuinka minun pitäisi ottaa ZETIA 10mg?
- Ota ZETIA kerran päivässä ruoan kanssa tai ilman. Saattaa olla helpompi muistaa ottaa annos, jos teet sen samaan aikaan joka päivä, kuten aamiaisen, päivällisen tai nukkumaan mennessä. Jos käytät myös toista kolesterolia alentavaa lääkettä, kysy lääkäriltäsi, voitko ottaa niitä samanaikaisesti.
- Jos unohdat ottaa ZETIAn, ota se heti kun muistat. Älä kuitenkaan ota enempää kuin yhtä ZETIA-annosta päivässä.
- Jatka kolesterolia alentavan ruokavalion noudattamista ZETIA-hoidon aikana. Kysy lääkäriltäsi, jos tarvitset tietoa ruokavaliosta.
- Jatka ZETIA 10 mg:n ottamista, ellei lääkärisi kehota sinua lopettamaan. On tärkeää, että jatkat ZETIA 10 mg:n käyttöä, vaikka et tuntisi olosi pahoin.
- Käy säännöllisesti lääkärissäsi tarkistaaksesi kolesterolitasosi ja tarkistaaksesi sivuvaikutukset. Lääkärisi voi tehdä verikokeita maksan tarkistamiseksi ennen kuin aloitat ZETIA-hoidon statiinin kanssa ja hoidon aikana.
Mitkä ovat ZETIA:n mahdolliset sivuvaikutukset?
Kliinisissä tutkimuksissa potilaat ilmoittivat harvoista sivuvaikutuksista ZETIA-hoidon aikana. Näitä olivat ripuli, nivelkivut ja väsymys.
Potilailla on ollut vakavia lihasongelmia ZETIA 10 mg:n käytön aikana, yleensä kun ZETIA 10 mg lisättiin statiinilääkkeeseen. Jos tunnet selittämätöntä lihaskipua, arkuutta tai heikkoutta ZETIA-hoidon aikana, ota välittömästi yhteyttä lääkäriisi. Sinun on tehtävä tämä viipymättä, koska harvoin nämä lihasongelmat voivat olla vakavia, ja lihasten hajoaminen voi johtaa munuaisvaurioihin.
Lisäksi yleiskäytössä on raportoitu seuraavia sivuvaikutuksia: allergiset reaktiot (jotka saattavat vaatia hoitoa välittömästi), mukaan lukien kasvojen, huulten, kielen ja/tai kurkun turvotus, joka voi aiheuttaa hengitys- tai nielemisvaikeuksia, ihottuma ja nokkosihottuma ; kohonnut punainen ihottuma, jossa joskus kohteen muotoisia vaurioita; nivelkipu; lihassäryt; muutokset joissakin laboratorioverikokeissa; maksaongelmat; vatsakipu; haiman tulehdus; pahoinvointi; huimaus; kihelmöintiä; masennus; päänsärky; sappikivet; sappirakon tulehdus.
Kerro lääkärillesi, jos sinulla on näitä tai muita lääketieteellisiä ongelmia ZETIA-hoidon aikana. Täydellisen luettelon sivuvaikutuksista kysy lääkäriltäsi tai apteekista.
Mitä minun pitäisi tietää korkeasta kolesterolista?
Kolesteroli on eräänlainen rasva, jota löytyy verestäsi. Kokonaiskolesterolisi koostuu LDL- ja HDL-kolesterolista.
LDL-kolesterolia kutsutaan "pahaksi" kolesteroliksi, koska se voi kertyä valtimoiden seinämiin ja muodostaa plakkia. Ajan myötä plakin kerääntyminen voi aiheuttaa valtimoiden kapenemista. Tämä kapeneminen voi hidastaa tai estää veren virtausta sydämeen, aivoihin ja muihin elimiin. Korkea LDL-kolesteroli on yksi sydänsairauksien ja yksi aivohalvauksen syistä.
HDL-kolesterolia kutsutaan "hyväksi" kolesteroliksi, koska se estää huonon kolesterolin kerääntymisen valtimoihin.
Triglyseridit ovat myös veressäsi olevia rasvoja.
Yleistä ZETIAsta
Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa. Älä käytä ZETIA 10 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna ZETIAa muille ihmisille, vaikka heillä olisi sama sairaus kuin sinulla. Se voi vahingoittaa heitä.
Tämä tiivistää tärkeimmät tiedot ZETIAsta. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltä tietoja ZETIA 10mg -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Inaktiiviset ainesosat:
Kroskarmelloosinatrium, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa, povidoni ja natriumlauryylisulfaatti.
