Tricor 160mg, 200mg Fenofibrate Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Tricor on ja miten sitä käytetään?
Tricor on reseptilääke, jota käytetään vähentämään kolesterolin ja triglyseridien (rasvahappojen) oireita veressä. Tricoria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Tricor kuuluu lääkeaineluokkaan, jota kutsutaan kuituhappoaineiksi.
- Ei tiedetä, onko Tricor 200mg turvallinen ja tehokas lapsille
Mitkä ovat Tricorin mahdolliset sivuvaikutukset?
Tricor 200mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- terävä vatsakipu, joka leviää selkään tai lapaluun,
- ruokahalun menetys,
- vatsakipu juuri aterian jälkeen,
- ihon tai silmien keltaisuus (keltatauti),
- kuume,
- vilunväristykset,
- heikkous,
- kipeä kurkku,
- suun haavaumat,
- epätavalliset mustelmat tai verenvuoto,
- rintakipu,
- äkillinen yskä,
- hengityksen vinkuminen,
- nopea hengitys,
- veren yskiminen ja
- turvotus, lämpö tai punoitus kädessä tai jalassa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Tricorin yleisimpiä sivuvaikutuksia ovat:
- vuotava nenä,
- aivastelu ja
- epänormaalit laboratoriotutkimukset
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Tricorin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
TRICOR (fenofibraattitabletit) on lipidejä säätelevä aine, joka on saatavana tabletteina suun kautta annettavaksi. Yksi tabletti sisältää 54 mg tai 160 mg fenofibraattia. Fenofibraatin kemiallinen nimi on 2-[4-(4-klooribentsoyyli)fenoksi]-2-metyylipropaanihappo, 1-metyylietyyliesteri, jolla on seuraava rakennekaava:
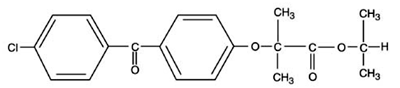
Empiirinen kaava on C20H21O4Cl ja molekyylipaino on 360,83; fenofibraatti on veteen liukenematon. Sulamispiste on 79-82 °C. Fenofibraatti on valkoinen kiinteä aine, joka on stabiili tavallisissa olosuhteissa.
Inaktiiviset ainesosat
Jokainen tabletti sisältää kolloidista piidioksidia, krospovidonia, laktoosimonohydraattia, lesitiiniä, mikrokiteistä selluloosaa, polyvinyylialkoholia, povidonia, natriumlauryylisulfaattia, natriumstearyylifumaraattia, talkkia, titaanidioksidia ja ksantaanikumia. Lisäksi yksittäiset 54 mg:n tabletit sisältävät D&C Yellow No. 10:tä, FD&C Yellow No. 6:ta, FD&C Blue No. 2:ta.
INDIKAATIOT
Primaarinen hyperkolesterolemia tai sekamuotoinen dyslipidemia
TRICOR on tarkoitettu ruokavalion lisähoitona alentamaan kohonnutta matalatiheyksisen lipoproteiinikolesterolin (LDL-C), kokonaiskolesterolin (kokonaiskolesterolin), triglyseridien ja apolipoproteiini B:n (Apo B) pitoisuutta sekä lisäämään korkeatiheyksisten lipoproteiinikolesterolin (HDL-) määrää. C) aikuispotilailla, joilla on primaarinen hyperkolesterolemia tai sekamuotoinen dyslipidemia.
Vaikea hypertriglyseridemia
TRICOR 200mg on tarkoitettu myös ruokavalion lisähoitona aikuispotilaille, joilla on vaikea hypertriglyseridemia. Glykeemisen hallinnan parantaminen diabeetikoilla, joilla on paastokylomikronemia, yleensä poistaa farmakologisten toimenpiteiden tarpeen.
Selvästi kohonneet seerumin triglyseridipitoisuudet (esim. > 2000 mg/dl) voivat lisätä haimatulehduksen riskiä. Fenofibraattihoidon vaikutusta tämän riskin vähentämiseen ei ole tutkittu riittävästi.
Tärkeitä käytön rajoituksia
Fenofibraatin annoksella, joka vastaa 145 mg TRICORia, ei osoitettu vähentävän sepelvaltimotautien sairastuvuutta ja kuolleisuutta suuressa, satunnaistetussa kontrolloidussa tutkimuksessa potilailla, joilla oli tyypin 2 diabetes [ks. VAROITUKSET JA VAROTOIMET ].
ANNOSTELU JA HALLINNOINTI
Yleisiä huomioita
Potilaat tulee asettaa asianmukaiselle lipidejä alentavalle ruokavaliolle ennen TRICOR 160 mg:n saamista, ja heidän tulee jatkaa tätä ruokavaliota TRICOR-hoidon aikana. TRICOR-tabletit voidaan antaa ruokailusta riippumatta.
Dyslipidemian alkuhoito on lipoproteiinipoikkeavuuden tyypille spesifinen ruokavaliohoito. Ylipaino ja liiallinen alkoholin nauttiminen voivat olla tärkeitä tekijöitä hypertriglyseridemiassa, ja niihin tulee kiinnittää huomiota ennen lääkehoitoa. Liikunta voi olla tärkeä apuväline. Hyperlipidemiaa aiheuttavat sairaudet, kuten kilpirauhasen vajaatoiminta tai diabetes mellitus, tulee etsiä ja hoitaa asianmukaisesti. Estrogeenihoitoon, tiatsididiureetteihin ja beetasalpaajiin liittyy joskus plasman triglyseridien massiivista nousua, erityisesti potilailla, joilla on familiaalinen hypertriglyseridemia. Tällaisissa tapauksissa spesifisen etiologisen aineen käytön lopettaminen voi poistaa hypertriglyseridemian spesifisen lääkehoidon tarpeen.
Lipiditasoja tulee seurata säännöllisesti ja harkita TRICOR-annoksen pienentämistä, jos lipiditasot laskevat merkittävästi tavoitealueen alapuolelle.
Hoito tulee keskeyttää potilailla, joilla ei ole riittävää vastetta kahden kuukauden hoidon jälkeen suositellulla enimmäisannoksella 145 mg kerran vuorokaudessa.
Primaarinen hyperkolesterolemia tai sekamuotoinen dyslipidemia
TRICOR 200 mg:n aloitusannos on 145 mg kerran vuorokaudessa.
Vaikea hypertriglyseridemia
Aloitusannos on 48-145 mg päivässä. Annostus tulee määrittää yksilöllisesti potilaan vasteen mukaan, ja sitä tulee tarvittaessa muuttaa toistuvien lipidimääritysten jälkeen 4–8 viikon välein. Suurin annos on 145 mg kerran vuorokaudessa.
Munuaisten vajaatoiminta
Hoito TRICOR 200 mg:lla tulee aloittaa 48 mg:n vuorokausiannoksella potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta, ja annosta lisätään vasta, kun tämän annoksen vaikutukset munuaisten toimintaan ja lipiditasoihin on arvioitu. TRICORin käyttöä tulee välttää potilailla, joilla on vaikea munuaisten vajaatoiminta [ks Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Geriatriset potilaat
Vanhusten annosvalinta tulee tehdä munuaisten toiminnan perusteella [katso Käyttö tietyissä populaatioissa ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 48 mg keltaisia tabletteja, joihin on painettu tunnuskoodikirjaimet "FI".
- 48 mg keltaisia tabletteja, joihin on painettu "a"-logo ja tunnuskirjaimet "FI".
- 145 mg:n valkoiset tabletit, joihin on painettu tunnuskoodi "FO".
- 145 mg:n valkoiset tabletit, joihin on painettu "a"-logo ja tunnuskirjaimet "FO".
Varastointi ja käsittely
TRICOR® (fenofibraattitabletit) on saatavana kahdessa vahvuudessa:
48 mg
Keltaiset tabletit, joihin on painettu tunnuskoodi ”FI”, saatavilla 90 ( NDC 0074-3173-90).
Keltaiset tabletit, joihin on painettu “a”-logo ja tunnuskirjaimet “FI”, saatavilla 90 ( NDC 0074-6122-90).
145 mg
Valkoisia tabletteja, joihin on painettu tunnuskoodi "FO", saatavana 90 ( NDC 0074-3189-90).
Valkoisia tabletteja, joihin on painettu "a"-logo ja tunnuskirjaimet "FO", saatavilla 90 ( NDC 0074-6123-90).
Varastointi
Säilytä 25°C (77°F); sallitaan 15-30°C (59-86°F).
[Katso USP Controlled Room Temperature]. Pidä poissa lasten ulottuvilta. Suojaa kosteudelta.
Valmistaja AbbVie Inc., North Chicago, IL 60064, USA, Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irlanti. Tarkistettu: maaliskuu 2021
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Kuolleisuus ja sepelvaltimotaudin sairastavuus [katso VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Haimatulehdus [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
- Venotromboembolinen sairaus [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Haittatapahtumat, joita raportoi vähintään 2 % fenofibraatilla hoidetuista potilaista (ja enemmän kuin lumelääkettä) kaksoissokkoutettujen, lumekontrolloitujen tutkimusten aikana, kausaalisuudesta riippumatta, on lueteltu alla olevassa taulukossa 1. Haittatapahtumat johtivat hoidon keskeyttämiseen 5,0 %:lla fenofibraatilla hoidetuista potilaista ja 3,0 %:lla lumelääkettä saaneista potilaista. Maksan toimintakokeiden kohoaminen oli yleisin tapahtuma, joka aiheutti fenofibraattihoidon keskeyttämisen 1,6 %:lla kaksoissokkotutkimuksien potilaista.
Kontrolloiduissa tutkimuksissa urtikariaa havaittiin 1,1 %:lla vs. 0 % ja ihottumaa 1,4 %:lla vs. 0,8 %:lla plasebopotilaista.
Maksaentsyymien lisääntyminen
Kymmenen lumekontrolloidun tutkimuksen yhdistetyssä analyysissä ALAT-arvo nousi > 3-kertaiseksi normaalin ylärajaan verrattuna 5,3 %:lla potilaista, jotka saivat fenofibraattia annoksilla, jotka vastaavat 96-145 mg TRICORia päivässä, ja 1,1 %:lla lumelääkettä saaneista potilaista. [katso VAROITUKSET JA VAROTOIMET ]. Kahdeksan viikkoa kestäneessä tutkimuksessa ALAT- tai ASAT-arvojen nousu ≥ 3 kertaa normaalin ylärajan yläpuolella oli 13 % potilailla, jotka saivat 96–145 mg TRICORia päivässä, ja 0 % potilailla, jotka saivat 48 mg:n annoksia. tai vähemmän TRICORia päivittäin tai lumelääkettä.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on havaittu fenofibraatin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei aina ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen: myalgia, rabdomyolyysi, haimatulehdus, akuutti munuaisten vajaatoiminta, lihasspasmit, hepatiitti, kirroosi, lisääntynyt kokonaisbilirubiini, anemia, nivelsärky, hemoglobiinin lasku, hematokriitin lasku, valkosolujen väheneminen, voimattomuus, vakavasti alentunut HDL-kolesterolitaso ja interstitiaalinen keuhkosairaus. Valoherkkyysreaktioita on esiintynyt päivistä kuukausiin aloittamisen jälkeen; joissakin näistä tapauksista potilaat ilmoittivat aiemmasta valoherkkyysreaktiosta ketoprofeenille.
HUUMEIDEN VUOROVAIKUTUKSET
Kumariiniantikoagulantit
Kumariinityyppisten antikoagulanttien vaikutusten on havaittu voimistuvan PT/INR-arvon pidentyessä.
Varovaisuutta tulee noudattaa, kun kumariiniantikoagulantteja annetaan yhdessä TRICORin kanssa. Antikoagulanttien annosta tulee pienentää, jotta PT/INR pysyy halutulla tasolla verenvuotokomplikaatioiden estämiseksi. Toistuvia PT/INR-määrityksiä suositellaan, kunnes on varmasti todettu, että PT/INR on vakiintunut [ks. VAROITUKSET JA VAROTOIMET ].
Immunosuppressantit
Immunosuppressiiviset aineet, kuten siklosporiini ja takrolimuusi, voivat aiheuttaa munuaistoksisuutta, jolloin kreatiniinipuhdistuma laskee ja seerumin kreatiniinipitoisuus nousee, ja koska munuaisten erittyminen on fibraattilääkkeiden, mukaan lukien TRICOR, ensisijainen eliminaatioreitti, on olemassa riski, että yhteisvaikutus johtaa munuaisten toiminnan heikkenemiseen. TRICORin (fenofibraattitablettien) käytön hyödyt ja riskit immunosuppressanttien ja muiden mahdollisesti munuaistoksisten aineiden kanssa tulee harkita huolellisesti ja pienintä käytettyä tehokasta annosta ja munuaisten toimintaa seurata.
Sappihappoa sitovat hartsit
Koska sappihappoa sitovat hartsit voivat sitoa muita samanaikaisesti annettuja lääkkeitä, potilaiden tulee ottaa TRICOR 200 mg vähintään 1 tunti ennen sappihappoa sitovaa hartsia tai 4–6 tuntia sen jälkeen, jotta vältetään sen imeytymisen estäminen.
Kolkisiini
Myopatiatapauksia, mukaan lukien rabdomyolyysi, on raportoitu, kun fenofibraatteja on annettu samanaikaisesti kolkisiinin kanssa, ja varovaisuutta on noudatettava määrättäessä fenofibraattia kolkisiinin kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Kuolleisuus ja sepelvaltimotauti Sairastuvuus
TRICOR 160 mg:n vaikutusta sepelvaltimotautiin ja -kuolleisuuteen sekä ei-sydän- ja verisuoniperäiseen kuolleisuuteen ei ole osoitettu.
Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid) -tutkimus oli satunnaistettu lumekontrolloitu tutkimus, johon osallistui 5518 tyypin 2 diabetesta sairastavaa potilasta, jotka saivat taustalla fenofibraatilla hoidettua statiinihoitoa. Keskimääräinen seuranta-aika oli 4,7 vuotta. Fenofibraatin ja statiinin yhdistelmähoito osoitti merkityksettömän 8 %:n suhteellisen riskin pienenemisen vakavien haitallisten kardiovaskulaaristen tapahtumien (MACE) ensisijaisessa lopputuloksessa, joka koostuu ei-kuolemaan johtaneesta sydäninfarktista, ei-kuolemaan johtaneesta aivohalvauksesta ja sydän- ja verisuonisairauksien kuolemasta (riskisuhde [ HR] 0,92, 95 % CI 0,79-1,08) (p = 0,32) verrattuna statiinimonoterapiaan. Sukupuolialaryhmäanalyysissä MACE:n riskisuhde yhdistelmähoitoa saavilla miehillä verrattuna statiinimonoterapiaan oli 0,82 (95 % CI 0,69-0,99), ja MACE:n riskisuhde yhdistelmähoitoa saavilla naisilla verrattuna statiinimonoterapiaan oli 1,38 (95 % CI 0,98-1,94) (vuorovaikutus p = 0,01). Tämän alaryhmän löydön kliininen merkitys on epäselvä.
Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) -tutkimus oli 5 vuotta kestänyt satunnaistettu, lumekontrolloitu tutkimus, johon osallistui 9795 tyypin 2 diabetesta sairastavaa potilasta, joita hoidettiin fenofibraatilla. Fenofibraatti osoitti sepelvaltimotautitapahtumien primaarisen lopputuloksen ei-merkittävän 11 %:n suhteellista vähenemistä (riskisuhde [HR] 0,89, 95 %:n luottamusväli 0,75-1,05, p = 0,16) ja merkitsevän 11 %:n pienenemisen kokonaistuloksissa. sydän- ja verisuonitautitapahtumat (HR 0,89 [0,80-0,99], p = 0,04). Kokonaiskuolleisuus sepelvaltimotautiin lisääntyi fenofibraatilla ei-merkittävästi 11 % (HR 1,11 [0,95, 1,29], p=0,18) ja 19 % (HR 1,19 [0,90, 1,57], p = 0,22). verrattuna lumelääkkeeseen.
Koska TRICORin (fenofibraattitabletit), klofibraatin ja gemfibrotsiilin välillä on kemiallisia, farmakologisia ja kliinisiä yhtäläisyyksiä, haittahavainnot neljässä suuressa satunnaistetussa, lumekontrolloidussa kliinisessä tutkimuksessa näillä muilla fibraattilääkkeillä voivat koskea myös TRICORia.
Sepelvaltimotautiprojektissa, laajassa tutkimuksessa sydäninfarktin jälkeisistä potilaista, joita hoidettiin 5 vuotta klofibraatilla, ei havaittu eroa kuolleisuudessa klofibraattiryhmän ja lumelääkeryhmän välillä. Leikkausta vaativien sappikivitautien ja kolekystiitin määrässä oli kuitenkin ero näiden kahden ryhmän välillä (3,0 % vs. 1,8 %).
Maailman terveysjärjestön (WHO) tekemässä tutkimuksessa 5 000 tutkittavaa, joilla ei ollut tiedossa olevaa sepelvaltimotautia, sai lumelääkettä tai klofibraattia viiden vuoden ajan, ja niitä seurattiin vielä yhden vuoden ajan. Klofibraattiryhmässä oli tilastollisesti merkitsevä, korkeampi iän mukaan korjattu kaikista syistä johtuva kuolleisuus verrattuna plaseboryhmään (5,70 % vs. 3,96 %, p =
Helsinki Heart Study oli laaja (n=4081) tutkimus keski-ikäisille miehille, joilla ei ole ollut sepelvaltimotautia. Koehenkilöt saivat joko lumelääkettä tai gemfibrotsiilia 5 vuoden ajan, minkä jälkeen jatkoaika oli 3,5 vuotta. Kokonaiskuolleisuus oli numeerisesti korkeampi gemfibrotsiilin satunnaistusryhmässä, mutta se ei saavuttanut tilastollista merkitsevyyttä (p = 0,19, suhteellisen riskin 95 %:n luottamusväli G:P = 0,91-1,64). Vaikka syöpäkuolemien suuntaus oli korkeampi gemfibrotsiiliryhmässä (p = 0,11), syöpiä (pois lukien tyvisolusyöpä) diagnosoitiin yhtä usein molemmissa tutkimusryhmissä. Tutkimuksen rajallisesta koosta johtuen suhteellinen kuolemanriski mistään syystä ei ollut erilainen kuin Maailman terveysjärjestön tutkimuksen 9 vuoden seurantatiedoissa (RR=1,29).
Helsinki Heart Study -tutkimuksen sekundaariprevention osa-alueeseen otettiin keski-ikäisiä miehiä, jotka suljettiin pois primaarisen ehkäisyn tutkimuksesta tunnetun tai epäillyn sepelvaltimotaudin vuoksi. Koehenkilöt saivat gemfibrotsiilia tai lumelääkettä 5 vuoden ajan. Vaikka sydänkuolemien trendi oli suurempi gemfibrotsiiliryhmässä, tämä ei ollut tilastollisesti merkitsevä (riskisuhde 2,2, 95 %:n luottamusväli: 0,94-5,05). Sappirakkoleikkausten määrä ei ollut tilastollisesti merkitsevä tutkimusryhmien välillä, mutta suuntaus oli korkeampi gemfibrotsiiliryhmässä (1,9 % vs. 0,3 %, p = 0,07).
Maksatoksisuus
TRICORin markkinoille tulon jälkeen on raportoitu vakavaa lääkkeiden aiheuttamaa maksavauriota (DILI), mukaan lukien maksansiirto ja kuolema. DILI-tautia on raportoitu hoidon ensimmäisten viikkojen aikana tai useiden hoitokuukausien jälkeen, ja joissakin tapauksissa se on hävinnyt, kun TRICOR 200 mg -hoito on lopetettu. DILI-potilailla on ollut merkkejä ja oireita, mukaan lukien tumma virtsa, epänormaali uloste, keltaisuus, huonovointisuus, vatsakipu, lihaskipu, painonpudotus, kutina ja pahoinvointi. Monilla potilailla oli samanaikaisesti kohonnut kokonaisbilirubiini, seerumin alaniinitransaminaasi (ALT) ja aspartaattitransaminaasi (AST). DILI on luonnehdittu hepatosellulaariseksi, krooniseksi aktiiviseksi ja kolestaattiseksi hepatiitiksi, ja kirroosia on esiintynyt kroonisen aktiivisen hepatiitin yhteydessä.
Kliinisissä tutkimuksissa fenofibraatti annoksina, jotka vastaavat 96–145 mg TRICOR 160 mg päivässä, on yhdistetty seerumin ASAT- tai ALAT-arvojen nousuun. Transaminaasien nousun ilmaantuvuus voi olla annoksesta riippuvaa [katso HAITTAVAIKUTUKSET ].
TRICOR 160 mg on vasta-aiheinen potilailla, joilla on aktiivinen maksasairaus, mukaan lukien ne, joilla on primaarinen sappikirroosi ja selittämättömiä pysyviä maksan toimintahäiriöitä [ks. VASTA-AIHEET ]. Seuraa potilaan maksan toimintaa, mukaan lukien seerumin ALAT, ASAT ja kokonaisbilirubiini, lähtötilanteessa ja säännöllisesti TRICOR-hoidon ajan. Lopeta TRICOR 200 mg:n käyttö, jos maksavaurion merkkejä tai oireita ilmaantuu tai jos entsyymiarvot jatkuvat (ALAT tai ASAT > 3 kertaa normaalin yläraja tai jos siihen liittyy bilirubiinin nousu). Älä aloita TRICOR 160 mg:n käyttöä uudelleen näille potilaille, jos maksavauriolle ei ole muuta selitystä.
Myopatia ja rabdomyolyysi
Fibraatit lisäävät myopatian riskiä, ja ne on yhdistetty rabdomyolyysiin. Vakavan lihastoksisuuden riski näyttää olevan suurentunut iäkkäillä potilailla ja potilailla, joilla on diabetes, munuaisten vajaatoiminta tai kilpirauhasen vajaatoiminta.
Myopatiaa tulee harkita jokaisella potilaalla, jolla on diffuusia myalgiaa, lihasten arkuutta tai heikkoutta ja/tai kreatiinifosfokinaasi (CPK) -arvojen huomattavaa nousua.
Potilaita tulee neuvoa ilmoittamaan viipymättä selittämättömästä lihaskivusta, -arkuudesta tai -heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta. CPK-tasot tulee arvioida potilailla, jotka raportoivat näistä oireista, ja TRICOR 200 mg -hoito tulee lopettaa, jos CPK-tasot ovat huomattavasti kohonneet tai myopatiaa/myosiittia epäillään tai diagnosoidaan.
Havaintotutkimuksista saadut tiedot osoittavat, että rabdomyolyysin riski kasvaa, kun fibraatteja, erityisesti gemfibrotsiilia, annetaan samanaikaisesti statiinin kanssa. Yhdistelmää tulee välttää, ellei lipiditasojen lisämuutosten hyöty todennäköisesti ole suurempi kuin tämän lääkeyhdistelmän lisääntynyt riski [ks. KLIININEN FARMAKOLOGIA ].
Myopatiatapauksia, mukaan lukien rabdomyolyysi, on raportoitu, kun fenofibraatteja on annettu samanaikaisesti kolkisiinin kanssa, ja varovaisuutta on noudatettava määrättäessä fenofibraattia kolkisiinin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Seerumin kreatiniini
Seerumin kreatiniinipitoisuuden nousua on raportoitu fenofibraattipotilailla. Näillä nousuilla on taipumus palata lähtötasolle fenofibraattihoidon lopettamisen jälkeen. Näiden havaintojen kliinistä merkitystä ei tunneta. Seuraa munuaisten toimintaa potilailla, joilla on munuaisten vajaatoiminta ja jotka käyttävät TRICORia. Munuaisten seurantaa tulee harkita myös TRICOR-hoitoa saavilla potilailla, joilla on munuaisten vajaatoiminnan riski, kuten vanhukset ja diabetespotilaat.
Sappikivitauti
Fenofibraatti, kuten klofibraatti ja gemfibrotsiili, voivat lisätä kolesterolin erittymistä sappeen, mikä johtaa sappikivitautiin. Jos sappikivitautia epäillään, sappirakkotutkimukset ovat aiheellisia. TRICOR 160 mg -hoito tulee lopettaa, jos sappikiviä löytyy.

Kumariiniantikoagulantit
Varovaisuutta on noudatettava, kun kumariiniantikoagulantteja annetaan yhdessä TRICOR 160 mg:n kanssa, koska kumariinityyppiset antikoagulanttivaikutukset voivat pidentää protrombiiniaikaa/kansainvälistä normalisoitua suhdetta (PT/INR). Verenvuotokomplikaatioiden estämiseksi suositellaan PT/INR:n säännöllistä seurantaa ja antikoagulantin annoksen säätämistä, kunnes PT/INR on vakiintunut [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Haimatulehdus
Pankreatiittia on raportoitu potilailla, jotka ovat käyttäneet fenofibraattia, gemfibrotsiilia ja klofibraattia. Tämä esiintyminen voi edustaa tehon epäonnistumista potilailla, joilla on vaikea hypertriglyseridemia, suora lääkevaikutus tai sekundaarinen ilmiö, joka välittyy sappitiekivien tai lietteen muodostumisen kautta yhteisen sappitiehyen tukkeutumiseen.
Hematologiset muutokset
Lievää tai kohtalaista hemoglobiinin, hematokriitin ja valkosolujen laskua on havaittu potilailla fenofibraattihoidon aloittamisen jälkeen. Nämä tasot kuitenkin vakiintuvat pitkäaikaisen annon aikana. Trombosytopeniaa ja agranulosytoosia on raportoitu fenofibraatilla hoidetuilla henkilöillä. Puna- ja valkosolumäärän säännöllistä seurantaa suositellaan TRICOR-hoidon ensimmäisten 12 kuukauden aikana.
Yliherkkyysreaktiot
Akuutti yliherkkyys
Fenofibraatin markkinoille tulon jälkeen on raportoitu anafylaksiaa ja angioedeemaa. Joissakin tapauksissa reaktiot olivat hengenvaarallisia ja vaativat kiireellistä hoitoa. Jos potilaalle kehittyy merkkejä tai oireita akuutista yliherkkyysreaktiosta, neuvokaa häntä hakeutumaan välittömästi lääkärin hoitoon ja lopettamaan fenofibraattihoito.
Viivästynyt yliherkkyys
Markkinoille tulon jälkeen on raportoitu vakavia ihon haittavaikutuksia (SCAR), mukaan lukien Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi ja lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS), joita esiintyy päivistä viikkoihin fenofibraatin käytön aloittamisen jälkeen. DRESS-tapaukset liittyivät ihoreaktioihin (kuten ihottumaan tai hilseilevään ihottumaan) ja eosinofilian, kuumeen ja systeemisten elinten (munuaisten, maksan tai hengitysteiden) yhdistelmään. Lopeta fenofibraatin käyttö ja hoitaa potilaita asianmukaisesti, jos epäillään SCAR:ia.
Venotromboembolinen sairaus
FIELD-tutkimuksessa keuhkoembolia (PE) ja syvä laskimotromboosi (DVT) havaittiin useammin fenofibraattiryhmässä kuin lumelääkettä saaneessa ryhmässä. FIELD-tutkimukseen osallistuneista 9 795 potilaasta 4 900 oli lumelääkeryhmässä ja 4 895 fenofibraattiryhmässä. DVT:n osalta lumelääkeryhmässä esiintyi 48 tapahtumaa (1 %) ja fenofibraattiryhmässä 67 (1 %) (p = 0,074); ja PE:n tapauksessa lumelääkeryhmässä oli 32 (0,7 %) ja fenofibraattiryhmässä 53 (1 %) (p = 0,022).
Sepelvaltimotautiprojektissa suurempi osa klofibraattiryhmästä koki selvän tai epäillyn kuolemaan johtavan tai ei-kuolemaan johtavan keuhkoembolian tai tromboflebiitin kuin lumeryhmässä (5,2 % vs. 3,3 % viiden vuoden kohdalla; p
Paradoksaalinen HDL-kolesterolitason lasku
Markkinoille tulon jälkeen ja kliinisissä tutkimuksissa on raportoitu vakavasta HDL-kolesterolitason laskusta (niinkin alhainen kuin 2 mg/dl) diabeetikoilla ja ei-diabeettisilla potilailla, joille on aloitettu fibraattihoito. HDL-kolesterolin lasku heijastuu apolipoproteiini A1:n vähenemisenä. Tämän laskun on raportoitu tapahtuvan 2 viikon tai vuoden kuluessa fibraattihoidon aloittamisesta. HDL-kolesterolitasot pysyvät alhaisina, kunnes fibraattihoito on lopetettu; vaste fibraattihoidon lopettamiseen on nopea ja jatkuva. Tämän HDL-kolesterolin laskun kliinistä merkitystä ei tunneta. On suositeltavaa tarkistaa HDL-kolesteroliarvot ensimmäisten kuukausien aikana fibraattihoidon aloittamisen jälkeen. Jos havaitaan vakavasti alentunut HDL-kolesterolitaso, fibraattihoito tulee keskeyttää ja HDL-kolesterolitasoa seurata, kunnes se on palannut lähtötasolle, eikä fibraattihoitoa pidä aloittaa uudelleen.
Ei-kliininen toksikologia
Karsinogeneesi ja mutageneesi ja hedelmällisyyden heikkeneminen
Rotilla on tehty fenofibraatilla kaksi ravinnon karsinogeenisuustutkimusta. Ensimmäisessä 24 kuukauden tutkimuksessa Wistar-rotille annettiin fenofibraattia 10, 45 ja 200 mg/kg/vrk, joka on noin 0,3, 1 ja 6 kertaa suurin suositeltu ihmisannos (MRHD) 300 mg fenofibraattia päivässä, mikä vastaa 145 mg TRICOR 160 mg päivässä kehon pinta-alan vertailujen perusteella. Annoksella 200 mg/kg/vrk (6 kertaa MRHD) maksakarsinoomien ilmaantuvuus lisääntyi merkittävästi molemmilla sukupuolilla. Miehillä havaittiin tilastollisesti merkitsevä haimakarsinoomien lisääntyminen 1- ja 6-kertaisilla MRHD:llä; Miehillä havaittiin haiman adenoomien ja hyvänlaatuisten kivesten interstitiaalisolukasvainten lisääntymistä 6-kertaisella MRHD:llä. Toisessa 24 kuukautta kestäneessä rotilla karsinogeenisuustutkimuksessa eri rottikannalla (Sprague-Dawley) annokset 10 ja 60 mg/kg/vrk (0,3 ja 2 kertaa MRHD) lisäsivät merkittävästi haiman akinaarien adenoomien ilmaantuvuutta molemmilla sukupuolilla ja lisääntyy kivesten interstitiaalisolukasvaimet miehillä kaksinkertaisella MRHD:llä.
Rotilla suoritettiin 117 viikkoa kestänyt karsinogeenisuustutkimus, jossa verrattiin kolmea lääkettä: fenofibraatti 10 ja 60 mg/kg/vrk (0,3 ja 2 kertaa MRHD, kehon pinta-alavertailujen perusteella), klofibraatti (400 mg/kg/vrk; 2 kertaa). ihmisen annos) ja gemfibrotsiilia (250 mg/kg/vrk; 2 kertaa ihmisen annos, perustuen mg/m² pinta-alaan). Fenofibraatti lisäsi haiman akinaarien adenoomaa molemmilla sukupuolilla. Klofibraatti lisäsi hepatosellulaarista karsinoomaa ja haiman akinaarista adenoomaa miehillä ja maksan neoplastisia kyhmyjä naisilla. Gemfibrotsiili lisäsi maksan neoplastisia kyhmyjä miehillä ja naisilla, kun taas kaikki kolme lääkettä lisäsivät kivesten interstitiaalisolukasvaimia miehillä.
21 kuukautta kestäneessä CF-1-hiirillä tehdyssä tutkimuksessa fenofibraatti 10, 45 ja 200 mg/kg/vrk (noin 0,2, 1 ja 3 kertaa MRHD, kehon pinta-alavertailujen perusteella) lisäsi merkittävästi maksakarsinoomia molemmissa. sukupuolten 3 kertaa MRHD. Toisessa 18 kuukautta kestäneessä tutkimuksessa annoksilla 10, 60 ja 200 mg/kg/vrk fenofibraatti lisäsi merkitsevästi maksakarsinoomia uroshiirillä ja maksaadenoomia naarashiirillä 3-kertaisella MRHD:llä.
Elektronimikroskopiatutkimukset ovat osoittaneet peroksisomaalista proliferaatiota fenofibraatin antamisen jälkeen rotalle. Asianmukaista tutkimusta peroksisomien proliferaation testaamiseksi ihmisillä ei ole tehty, mutta muutoksia peroksisomien morfologiassa ja lukumäärässä on havaittu ihmisillä sen jälkeen, kun niitä oli hoidettu muilla fibraattiluokan jäsenillä, kun saman henkilön maksabiopsiaa verrattiin ennen hoitoa ja sen jälkeen.
Fenofibraatilla ei ole osoitettu olevan mutageenisia vaikutuksia seuraavissa testeissä: Ames, hiiren lymfooma, kromosomipoikkeavuus ja suunnittelematon DNA-synteesi rotan primaarisissa maksasoluissa.
Hedelmällisyystutkimuksissa rotille annettiin suun kautta fenofibraattiannoksia, urokset saivat 61 päivää ennen parittelua ja naaraat 15 päivää ennen parittelua vieroituksen kautta, mikä ei aiheuttanut haitallista vaikutusta hedelmällisyyteen annoksilla 300 mg/kg/vrk asti (10 kertaa MRHD, joka perustuu kehon pinta-alan vertailuihin).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Rajallisesti saatavilla olevat tiedot fenofibraatin käytöstä raskaana oleville naisille eivät riitä määrittämään lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien, keskenmenon tai haitallisten äitien tai sikiöiden riskiä. Eläinten lisääntymistutkimuksissa ei havaittu merkkejä alkio-sikiötoksisuudesta, kun fenofibraattia annettiin oraalisesti rotille ja kaniineille organogeneesin aikana annoksina, jotka olivat pienempiä tai vastaavia kuin suurin suositeltu kliininen annos 145 mg vuorokaudessa, perustuen kehon pinta-alaan (mg/ m²). Lisääntymiselle haitallisia vaikutuksia esiintyi suuremmilla annoksilla emolle toksisuuden ollessa läsnä (ks Data ). TRICOR 200 mg -valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Eläinten tiedot
Tiineillä rotilla, joille annettiin oraalisia annoksia 14, 127 ja 361 mg/kg/vrk raskauspäivästä 6-15 organogeneesin aikana, ei havaittu haitallisia kehityshavaintoja annoksella 14 mg/kg/vrk (vähemmän kuin kliininen altistus). suurimmalla suositellulla ihmisen annoksella [MRHD] 300 mg fenofibraattia vuorokaudessa, mikä vastaa 145 mg TRICORia päivässä kehon pinta-alavertailujen perusteella). Lisääntynyttä sikiön luuston epämuodostumia havaittiin emolle toksisilla annoksilla (361 mg/kg/vrk, mikä vastaa 12 kertaa kliinistä altistusta MRHD:llä), jotka hillitsivät merkittävästi äidin painonnousua.
Tiineillä kaniineilla, joille annettiin oraalisesti 15, 150 ja 300 mg/kg/vrk tiineyspäivästä 618 alkaen organogeneesin aikana ja joiden annettiin synnyttää, ei havaittu haitallisia kehityshavaintoja annoksella 15 mg/kg/vrk (annos, joka likimääräinen kliininen altistus MRHD:llä kehon pinta-alan vertailujen perusteella). Keskeytettyjä pentueita havaittiin emolle toksisilla annoksilla (≥ 150 mg/kg/vrk, mikä vastaa ≥ 10 kertaa kliinistä altistusta MRHD:llä), jotka estivät emon painonnousua.
Tiineillä rotilla, joille annettiin suun kautta ravinnon annoksia 15, 75 ja 300 mg/kg/vrk raskauspäivästä 15 imetyspäivään 21 (vieroitus), ei havaittu haitallisia kehitysvaikutuksia annoksella 15 mg/kg/vrk (vähemmän kuin kliininen altistus). MRHD:ssä, kehon pinta-alavertailujen perusteella, huolimatta äidin toksisuudesta (painon nousun lasku). Implantaation jälkeinen menetys havaittiin annoksella ≥ 75 mg/kg/vrk (≥ 2 kertaa kliininen altistus MRHD:llä) emolle toksisuuden (vähentynyt painonnousu) läsnä ollessa. Pentujen eloonjäämisen todettiin vähentyneen annoksella 300 mg/kg/vrk (10 kertaa kliininen altistus MRHD:llä), mikä liittyi äidin painonnousun vähentymiseen/emon laiminlyöntiin.
Imetys
Riskien yhteenveto
Ei ole saatavilla tietoa fenofibraatin esiintymisestä äidinmaidossa, lääkkeen vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon. Fenofibraattia erittyy rottien maidossa, ja siksi se todennäköisesti kulkeutuu äidinmaitoon. Vakavien haittavaikutusten, kuten imeväisten lipidiaineenvaihdunnan häiriön, vuoksi naiset eivät saa imettää TRICOR 200 mg -hoidon aikana ja 5 päivää viimeisen annoksen jälkeen [ks. VASTA-AIHEET ].
Käyttö lapsille
Turvallisuutta ja tehoa ei ole osoitettu lapsipotilailla.
Geriatrinen käyttö
Fenofibriinihapon tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Ikä ei vaikuta fenofibriinihapon altistumiseen. Koska iäkkäillä potilailla on suurempi munuaisten vajaatoiminnan ilmaantuvuus, iäkkäiden potilaiden annos tulee valita munuaisten toiminnan perusteella [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ]. Iäkkäiden potilaiden, joiden munuaisten toiminta on normaali, ei pitäisi tarvita annosmuutoksia. Harkitse munuaisten toiminnan seurantaa TRICORia käyttävillä iäkkäillä potilailla.
Munuaisten vajaatoiminta
TRICOR 160 mg:n käyttöä tulee välttää potilailla, joilla on vaikea munuaisten vajaatoiminta (ks. VASTA-AIHEET ]. Annosta on pienennettävä potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta [ks ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ]. Munuaisten toiminnan seurantaa suositellaan potilaille, joilla on munuaisten vajaatoiminta.
Maksan vajaatoiminta
TRICOR 200 mg:n käyttöä ei ole arvioitu potilailla, joilla on maksan vajaatoiminta [ks. VASTA-AIHEET ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
TRICORin yliannostukseen ei ole erityistä hoitoa. Yliannostuksen ilmetessä on aiheellista potilaan yleistä tukihoitoa, mukaan lukien elintoimintojen seuranta ja kliinisen tilan tarkkailu. Imeytymätön lääke on tarvittaessa eliminoitava oksentamalla tai mahahuuhtelulla. tavallisia varotoimia tulee noudattaa hengitysteiden ylläpitämiseksi. Koska fenofibriinihappo sitoutuu voimakkaasti plasman proteiineihin, hemodialyysiä ei tule harkita.
VASTA-AIHEET
TRICOR 200mg on vasta-aiheinen:
- potilaat, joilla on vaikea munuaisten vajaatoiminta, mukaan lukien dialyysihoitoa saavat potilaat [ks KLIININEN FARMAKOLOGIA ].
- potilaat, joilla on aktiivinen maksasairaus, mukaan lukien potilaat, joilla on primaarinen sappikirroosi ja selittämättömiä pysyviä maksan toimintahäiriöitä [ks. VAROITUKSET JA VAROTOIMET ].
- potilaat, joilla on aiempi sappirakon sairaus [katso VAROITUKSET JA VAROTOIMET ].
- imettävät äidit [katso Käyttö tietyissä populaatioissa ].
- potilaat, joiden tiedetään olevan yliherkkiä fenofibraatille tai fenofibriinihapolle [ks VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
TRICORin aktiivinen osa on fenofibriinihappo. Fenofibriinihapon farmakologisia vaikutuksia sekä eläimillä että ihmisillä on tutkittu laajasti fenofibraattia suun kautta annettaessa.
Kliinisessä käytännössä havaitut fenofibriinihapon lipidejä modifioivat vaikutukset on selitetty in vivo siirtogeenisissä hiirissä ja in vitro ihmisen maksasoluviljelmissä peroksisomiproliferaattorin aktivoiman reseptorin α (PPARa) aktivaatiolla. Tämän mekanismin kautta fenofibraatti lisää lipolyysiä ja triglyseridipitoisten hiukkasten eliminaatiota plasmasta aktivoimalla lipoproteiinilipaasia ja vähentämällä apoproteiini C-III:n tuotantoa (lipoproteiinilipaasiaktiivisuuden estäjä).
Tuloksena oleva TG:n lasku aiheuttaa LDL:n koon ja koostumuksen muutoksen pienistä tiheistä hiukkasista (jotka ovat aterogeenisiä niiden hapetusalttiuden vuoksi) suuriin kelluviin hiukkasiin. Näillä suuremmilla hiukkasilla on suurempi affiniteetti kolesterolireseptoreihin ja ne hajoavat nopeasti. PPARa:n aktivaatio indusoi myös apolipoproteiinien AI, A-II ja HDL-kolesterolin synteesiä.
Fenofibraatti alentaa myös seerumin virtsahappopitoisuutta hyperurikeemisillä ja normaaleilla yksilöillä lisäämällä virtsahapon erittymistä virtsaan.
Farmakodynamiikka
Useat kliiniset tutkimukset ovat osoittaneet, että kohonneet kokonaiskolesterolin, LDL-kolesterolin ja apo B:n, LDL-kalvokompleksin, tasot liittyvät ihmisen ateroskleroosiin. Samoin HDL-kolesterolin ja sen kuljetuskompleksin, apolipoproteiini A:n (apo AI ja apo AII) alentuneet tasot liittyvät ateroskleroosin kehittymiseen. Epidemiologiset tutkimukset ovat osoittaneet, että sydän- ja verisuonisairauksien sairastuvuus ja kuolleisuus vaihtelevat suoraan kokonaiskolesteroli-, LDL-kolesteroli- ja TG-tason sekä käänteisesti HDL-kolesterolin tason mukaan. HDL-kolesterolin nousun tai triglyseridien (TG) alentamisen riippumatonta vaikutusta sydän- ja verisuonisairauksien ja kuolleisuuden riskiin ei ole määritetty.
Fenofibriinihappo, fenofibraatin aktiivinen metaboliitti, vähentää kokonaiskolesterolin, LDL-kolesterolin, apolipoproteiini B:n, kokonaistriglyseridien ja triglyseridipitoisen lipoproteiinin (VLDL) määrää hoidetuilla potilailla. Lisäksi fenofibraattihoito lisää korkeatiheyksisten lipoproteiinien (HDL) ja apolipoproteiinien apoAI- ja apoAII-pitoisuutta.
Farmakokinetiikka
Fenofibriinihapon plasmapitoisuudet kolmen 48 mg:n tai yhden 145 mg:n tabletin antamisen jälkeen vastaavat yhtä 200 mg:n mikronisoitua fenofibraattikapselia ruokailuolosuhteissa.
Fenofibraatti on fenofibriinihapon aktiivisen kemiallisen osan aihiolääke. Fenofibraatti muuttuu esterihydrolyysissä kehossa fenofibriinihapoksi, joka on verenkierrossa mitattavissa oleva aktiivinen ainesosa.
Imeytyminen
Fenofibraatin absoluuttista biologista hyötyosuutta ei voida määrittää, koska yhdiste on käytännöllisesti katsoen liukenematon vesipitoiseen väliaineeseen, joka soveltuu injektioon. Fenofibraatti imeytyy kuitenkin hyvin maha-suolikanavasta. Kun terveille vapaaehtoisille annettiin suun kautta, noin 60 % radioaktiivisesti leimatun fenofibraatin kerta-annoksesta erittyi virtsaan, pääasiassa fenofibriinihappona ja sen glukuronaattikonjugaattina, ja 25 % erittyi ulosteisiin. Fenofibriinihapon huippupitoisuus plasmassa saavutetaan 6-8 tunnin kuluessa annosta.
Altistuminen fenofibriinihapolle plasmassa Cmax- ja AUC-arvoilla mitattuna ei eroa merkitsevästi, kun 145 mg:n kerta-annos fenofibraattia annetaan paasto- tai ei-paasto-olosuhteissa.
Jakelu
Kun fenofibraattia annetaan toistuvasti, fenofibriinihapon vakaa tila saavutetaan 9 päivässä. Fenofibriinihapon pitoisuudet plasmassa vakaassa tilassa ovat noin kaksinkertaiset kerta-annoksen jälkeen. Seerumin proteiineihin sitoutuminen oli noin 99 % normaaleilla ja hyperlipideemisilla henkilöillä.
Aineenvaihdunta
Oraalisen annon jälkeen fenofibraatti hydrolysoituu nopeasti esteraasien vaikutuksesta aktiiviseksi metaboliitiksi, fenofibriinihapoksi. muuttumatonta fenofibraattia ei havaita plasmassa.
Fenofibriinihappo konjugoituu pääasiassa glukuronihapon kanssa ja erittyy sitten virtsaan. Pieni määrä fenofibriinihappoa pelkistyy karbonyyliosassa bentshydrolimetaboliitiksi, joka puolestaan konjugoituu glukuronihapon kanssa ja erittyy virtsaan.
In vivo -aineenvaihduntatiedot osoittavat, että fenofibraatti tai fenofibriinihappo eivät käy läpi oksidatiivista metaboliaa (esim. sytokromi P450) merkittävässä määrin.
Eliminointi
Imeytymisen jälkeen fenofibraatti erittyy pääasiassa virtsaan metaboliitteina, pääasiassa fenofibriinihapona ja fenofibriinihappoglukuronidina. Radioaktiivisesti leimatun fenofibraatin annon jälkeen noin 60 % annoksesta erittyi virtsaan ja 25 % erittyi ulosteisiin.
Fenofibriinihappo eliminoituu 20 tunnin puoliintumisajalla, mikä mahdollistaa annoksen kerran vuorokaudessa.
Erikoispopulaatiot
Geriatria
Iäkkäillä 77–87-vuotiailla vapaaehtoisilla fenofibriinihapon oraalinen puhdistuma fenofibraattikerta-annoksen jälkeen oli 1,2 l/h, kun se on 1,1 l/h nuorilla aikuisilla. Tämä osoittaa, että samanlaista annostusohjelmaa voidaan käyttää vanhuksilla, joiden munuaisten toiminta on normaali, lisäämättä lääkkeen tai metaboliittien kertymistä [ks. ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Pediatria
TRICOR 160 mg:n farmakokinetiikkaa ei ole tutkittu lapsipotilailla.
Sukupuoli
Fenofibraatilla ei ole havaittu farmakokineettisiä eroja miesten ja naisten välillä.
Rotu
Rodun vaikutusta fenofibraatin farmakokinetiikkaan ei ole tutkittu, mutta fenofibraatti ei metaboloidu entsyymien toimesta, joiden tiedetään osoittavan etnisten ryhmien välistä vaihtelua.
Munuaisten vajaatoiminta
Fenofibriinihapon farmakokinetiikkaa tutkittiin potilailla, joilla oli lievä, keskivaikea ja vaikea munuaisten vajaatoiminta. Potilailla, joilla oli vaikea munuaisten vajaatoiminta (arvioitu glomerulusten suodatusnopeus [eGFR] ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla ei ole tehty farmakokineettisiä tutkimuksia.
Huumeiden väliset vuorovaikutukset
Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittavat, että fenofibraatti ja fenofibriinihappo eivät ole sytokromi (CYP) P450 -isoformien CYP3A4, CYP2D6, CYP2E1 tai CYP1A2 estäjiä. Ne ovat heikkoja CYP2C8:n, CYP2C19:n ja CYP2A6:n estäjiä ja lieviä tai kohtalaisia CYP2C9:n estäjiä terapeuttisilla pitoisuuksilla.
Taulukossa 2 kuvataan samanaikaisesti annettujen lääkkeiden vaikutukset fenofibriinihapon systeemiseen altistukseen. Taulukossa 3 kuvataan samanaikaisesti annetun fenofibraatin tai fenofibriinihapon vaikutukset muihin lääkkeisiin.
Kliiniset tutkimukset
Primaarinen hyperkolesterolemia (heterotsygoottinen familiaalinen ja ei-perhe) ja sekamuotoinen dyslipidemia
Fenofibraatin vaikutukset annoksella, joka vastaa 145 mg TRICORia (fenofibraattitabletit) päivässä, arvioitiin neljässä satunnaistetussa, lumekontrolloidussa, kaksoissokkoutetussa rinnakkaisryhmätutkimuksessa, joihin osallistui potilaita, joilla oli seuraavat keskimääräiset lipidiarvot lähtötilanteessa: kokonais-C 306,9 mg/dl; LDL-C 213,8 mg/dl; HDL-C 52,3 mg/dl; ja triglyseridit 191,0 mg/dl. TRICOR 200 mg -hoito alensi LDL-kolesterolia, kokonaiskolesterolia ja LDL-kolesterolin/HDL-kolesterolin suhdetta. TRICOR-hoito alensi myös triglyseridejä ja nosti HDL-kolesterolia (katso taulukko 4).
Koehenkilöiden osajoukossa suoritettiin apo B:n mittaukset. TRICOR 200 mg -hoito vähensi merkitsevästi apo B:tä lähtötilanteesta päätepisteeseen verrattuna lumelääkkeeseen (-25,1 % vs. 2,4 %, p
Vaikea hypertriglyseridemia
Fenofibraatin vaikutuksia seerumin triglyserideihin tutkittiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa, johon osallistui 147 hypertriglyseridemista potilasta. Potilaita hoidettiin kahdeksan viikon ajan protokollien mukaisesti, jotka erosivat vain siinä, että yksi potilaista, joiden lähtötason TG-tasot olivat 500-1500 mg/dl, ja muut TG-tasot 350-500 mg/dl. Potilailla, joilla oli hypertriglyseridemia ja normaali kolesterolikemia, johon liittyy tai ei hyperkylomikronemiaa, fenofibraattihoito annoksilla, jotka vastaavat TRICORia 145 mg päivässä, vähensi ensisijaisesti erittäin matalatiheyksisten lipoproteiinien (VLDL) triglyseridejä ja VLDL-kolesterolia. Potilaiden, joilla on kohonneet triglyseridit, hoito johtaa usein LDL-kolesterolin nousuun (katso taulukko 5).
TRICOR 160 mg:n vaikutusta sydän- ja verisuonisairauksiin ja kuolleisuuteen ei ole määritetty.
POTILASTIEDOT
Potilaita tulee neuvoa:
- TRICORin mahdollisista eduista ja riskeistä.
- Älä käytä TRICORia, jos tiedetään yliherkkyys fenofibraatille tai fenofibriinihapolle.
- lääkkeitä, joita ei tule ottaa yhdessä TRICORin kanssa.
- että jos he käyttävät kumariiniantikoagulantteja, TRICOR 160mg voi lisätä niiden antikoagulanttivaikutusta, ja seuranta saattaa olla tarpeen.
- jatkaa asianmukaista lipidejä muuntavaa ruokavaliota TRICORin käytön aikana.
- ottaa TRICOR 160 mg kerran vuorokaudessa ruoasta riippumatta määrätyllä annoksella nieleen jokainen tabletti kokonaisena.
- palata lääkärin vastaanotolle rutiinitarkkailua varten.
- ilmoittamaan lääkärilleen kaikista käyttämistään lääkkeistä, ravintolisistä ja kasviperäisistä valmisteista sekä mahdollisista muutoksista terveydentilassaan. Potilaita tulee myös neuvoa ilmoittamaan uutta lääkettä määrääville lääkäreilleen, että he käyttävät TRICORia.
- ilmoittamaan lääkärilleen maksavaurion oireista (esim. keltaisuus, vatsakipu, pahoinvointi, huonovointisuus, tumma virtsa, epänormaali uloste, kutina); mikä tahansa lihaskipu, arkuus tai heikkous; tai muita uusia oireita.
- ei saa imettää TRICOR-hoidon aikana ja 5 päivää viimeisen annoksen jälkeen.
